Композиции и способ контроля инфекций у млекопитающих, не относящихся к человеку, с применением белков острой фазы - RU2725841C2
Код документа: RU2725841C2
Чертежи







Описание
Настоящее изобретение относится к композициям и способам контроля инфекций у млекопитающих, не относящихся к человеку, в частности, контроля интрамаммарных инфекций (IMI). Изобретение, в частности, подходит для контроля инфекций и повышения благополучия млекопитающих, не относящихся к человеку, предпочтительно, бычьих, путем улучшения инволюции молочной железы во время периода запуска. Изобретение базируется на применении белков острой фазы, более предпочтительно, сывороточного амилоида A (SAA), еще более предпочтительно, изоформы 3 (SAA-3).
Введение
Выработка молока максимизирована, когда млекопитающие, не относящиеся к человеку, являются беременным в течение 70% времени каждой лактации. Между лактациями период сухостоя необходим для обновления стареющих эпителиальных клеток молочной железы и для гарантии оптимальной выработки молока в следующую лактацию. Из-за гормонального уровня, связанного с состоянием беременности у млекопитающего, не относящегося к человеку, и особенно у жвачных, таких как бычьи, инволюция молочной железы происходит медленнее, чем у других видов, где инволюция не происходит одновременно с беременностью. Это требует продолжительных периодов сухостоя около 60 дней, которые значительно уменьшают продолжительность продуктивного периода. Период сухостоя отличается двумя основными фазами обновления клеточной популяции: инволюция молочной железы, отличающаяся острым апоптозом, и регенерация клеток перед следующей лактацией. Пик апоптоза наблюдается во время первых 72 часов после прекращения лактации, продолжаясь в течение оставшегося периода сухостоя и объединяясь с повышением клеточной пролиферации. Физиологически, застой молока, который образуется при отлучении от кормления млекопитающего, не относящегося к человеку, наряду с белковыми и гормональными факторами, такими как снижение уровня пролактина, индуцирует инволюцию молочной железы и, в свою очередь, стимулирует сокращение паренхимы и останавливает секрецию молока.
Ткань молочной железы состоит из эпителиальных секреторных клеток и стромальной ткани с различными типами клеток, такими как фибробласты и иммунные клетки. Оба типа ткани разделены базальной мембраной, это тип внеклеточного матрикса (ЕСМ), который влияет на развитие и биологию молочной железы. ЕСМ непосредственно создает и поддерживает дифференцированное состояние молочной железы и предотвращает апоптоз. Протеолитическое разрушение базальной мембраны индуцирует апоптоз и инволюцию молочной железы. Существует несколько протеаз, вовлеченных в деградацию внеклеточного матрикса, но в основном ключевыми ферментами в данном процессе являются матриксные металлопротеиназы (ММР). Кроме того, оценивались другие функции в отношении ММР, такие как факторы высвобождения и факторы роста и цитокины, которые, в свою очередь, модулируют другие ключевые аспекты периода сухостоя, такие как активация иммунной системы и клеточный рост.
Молочная железа у указанных млекопитающих, не относящихся к человеку, претерпевает драматические изменения по части чувствительности к инфекциям в течение цикла лактации, что схематично проиллюстрировано на фигуре 1, а на ранней стадии периода сухостоя наблюдается более 60% новых интрамаммарных инфекций (IMI). Действительно, застой молока повышает давление внутри молочной железы, стимулируя протекание и чувствительность к бактериальной инфекции. Кроме того, молоко представляет собой богатую среду для бактериального роста. Кроме того, животные с высоким выходом молока более уязвимы в отношении приобретения интрамаммарных инфекций, поскольку у них замедленное образование кератинового макромолекулярного комплекса ферментов, формирующего поры в клеточной мембране, и повышенное закупоривания сосковых каналов. IMI, приобретенные в течение периода сухостоя, ассоциированы с повышением преобладания инфекций в следующей лактации, которое вызывает потерю молочной продуктивности и снижение качества молока.
Ранняя стадия периода сухостоя, таким образом, предлагает идеальную возможность для терапии IMI посредством использования целесообразных обработок. Действительно, во избежание высокого риска IMI на протяжении данного периода и во время последующей лактации, антибиотики стандартно вводят посредством инфузии в молочную железу. Однако данная практика ассоциирована с риском развития устойчивостей к противомикробным агентам, которые идентичны у людей и животных. Стимулирование иммунитета млекопитающего, не относящегося к человеку, в начале периода сухостоя может относиться не только к улучшению эффективности антибиотиков в случаях инфекции бактериями, ускользающими от ряда антибиотиков, но также может фактически заменить использование антибиотиков в качестве превентивных агентов в период сухостоя.
Сущность изобретения
Настоящее изобретение относится к новым композициям и к способам контроля интрамаммарных инфекций (IMI) у млекопитающих, не относящихся к человеку. Более конкретно, изобретение базируется на применении белков острой фазы, более предпочтительно, сывороточного амилоида A (SAA), еще более предпочтительно, изоформы 3 (SAA-3), для контроля IMI у млекопитающих, не относящихся к человеку.
Таким образом, цель изобретения относится к белку острой фазы, предпочтительно, к белку SAA-3 или к композиции, содержащей белок острой фазы, предпочтительно, белок SAA-3 для применения для контроля IMI у млекопитающих, не относящихся к человеку. Следующей целью изобретения является способ контроля IMI у млекопитающего, не относящегося к человеку, включающий введения млекопитающему, не относящемуся к человеку, эффективного количества белка острой фазы, предпочтительно, белка SAA-3. Следующая цель изобретения относится к применению белка острой фазы для контроля IMI у млекопитающего, не относящегося к человеку. Композиции, способы или применения по изобретению могут использоваться индивидуально (т.е. в качестве замены текущих лечений) или в комбинации с текущими лечениями (например, с антибиотиками, антиоксидантами, антипролактином, антигенами или с герметиками сосков молочной железы), для улучшения их эффективности. Кроме того, изобретения может использовать один белок острой фазы (например, белок SAA-3) или несколько различных белков острой фазы в комбинации.
Более конкретно, в изобретении предлагаются композиции на основе белков острой фазы и способы для контроля IMI у млекопитающих, не относящихся к человеку, путем улучшения эффективности стандартных интрамаммарных терапий, предпочтительно антибиотиков, антипролактина и/или герметиков сосков молочных желез.
Еще более предпочтительно, в изобретении предлагаются композиции на основе SAA-3 и способы контроля IMI у млекопитающих, не относящихся к человеку, путем замены использования антибиотиков.
Изобретение конкретно адаптировано и является эффективным для лечения млекопитающих, не относящихся к человеку, во время периода сухостоя, контролируя таким образом IMI во время периода сухостоя и/или в последующие периоды лактации. Конкретная цель изобретения относится к новым композициям на основе белков острой фазы и к способам контроля IMI во время периода сухостоя и/или в последующей лактации. Предпочтительно, композицию белка острой фазы вводят в течение периода сухостоя, более предпочтительно, в начале периода сухостоя.
Следующая более конкретная цель изобретения относится к новым композициям и к способам, включающим белок острой фазы, предпочтительно, белок SAA-3, для применения для контроля мастита.
Другая цель изобретения относится к новым композициям и к способам, включающим белок острой фазы, более предпочтительно, сывороточный амилоид А (SAA), еще более предпочтительно, изоформу 3 (SAA-3), для повышения благополучия млекопитающих, не относящихся к человеку, путем усиления инволюции молочной железы.
Более конкретно, в изобретении предлагаются композиции на основе белка острой фазы и способы для улучшения состояния вымени путем усиления инволюции молочной железы.
Еще более предпочтительно, в изобретении предлагаются композиции на основе белков острой фазы и способы для улучшения состояния вымени при воспалении путем усиления инволюции молочной железы.
Белки острой фазы для применения в настоящем изобретении предпочтительно представлены в чистой форме или в ассоциации с одним или с несколькими фармацевтически приемлемыми наполнителями или носителями.
Следующая цель изобретения относится к способу введения (вместе или отдельно, одновременно или последовательно) млекопитающему, не относящемуся к человеку, композиции, содержащей белок острой фазы, либо индивидуально, либо в комбинации ч другим белком острой фазы, с антибиотиками, антиоксидантами, герметиками сосков молочной железы, с антигенами или с антипролактиновым соединением, предпочтительно, с агонистом допаминовых рецепторов, более предпочтительно, с допамином, выделенным из эрголина, и еще более предпочтительно, с каберголином. Изобретение также относится к комбинированному лечению для бычьих, включающему белок SAA-3 и антипролактиновое соединение.
Изобретение может использоваться для млекопитающих, не относящихся к человеку, предпочтительно, для любого копытного или жвачного, такого как бычьи, овечьи, лошадиные, овцы или козы.
Композиции и способ по изобретению конкретно эффективны для контроля интрамаммарных инфекций (IMI), улучшения состояния вымени и усиления системы естественного иммунитета у млекопитающих, не относящихся к человеку. Данное изобретение конкретно эффективно для защиты от интрамаммарной инфекции, вызванной S. aureus, или для предотвращения интрамаммарной инфекции, вызванной S. aureus. Более конкретно, изобретение эффективно во время периода сухостоя, конкретно, во время ранней стадии периода сухостоя. Конкретно, изобретение эффективно для контроля IMI и/или коинфекции или улучшения состояния путем введения SAA-3 индивидуально или в комбинации со стандартным лечением, таким как, например, антибиотики или герметики сосков молочной железы.
Подписи к чертежам
Фиг. 1 - схематическая иллюстрация частоты интрамаммарных инфекций во время цикла лактации.
Фиг. 2 - активность металлопротеиназ (ММР) во время ранней стадии периода сухостоя. Активность металлопротеиназ представлена с помощью корня из INT*мм2 ± SEM (стандартная ошибка среднего). Данные получали на основе количественной оценки полос гелей зимографического анализа с использованием программного обеспечения «Quantity One» в течение 3 дней после запуска, для ММР-9 (а) и ММР-2 (b). Обработки, помеченные звездочкой, отличаются (Р<0,05).
Фиг. 3 - количество соматических клеток (SCC), содержание жира и белка во время ранней стадии периода сухостоя. SCC (а) представлен в виде SCC/мл ± SEM (трансформированные данные). Концентрация жира (b) и белка (с) (данные представлены в виде процентов ± SEM) в течение 3 дней после запуска). Обработки, помеченные звездочкой, отличаются (Р<0,05) и t(Р<0,1).
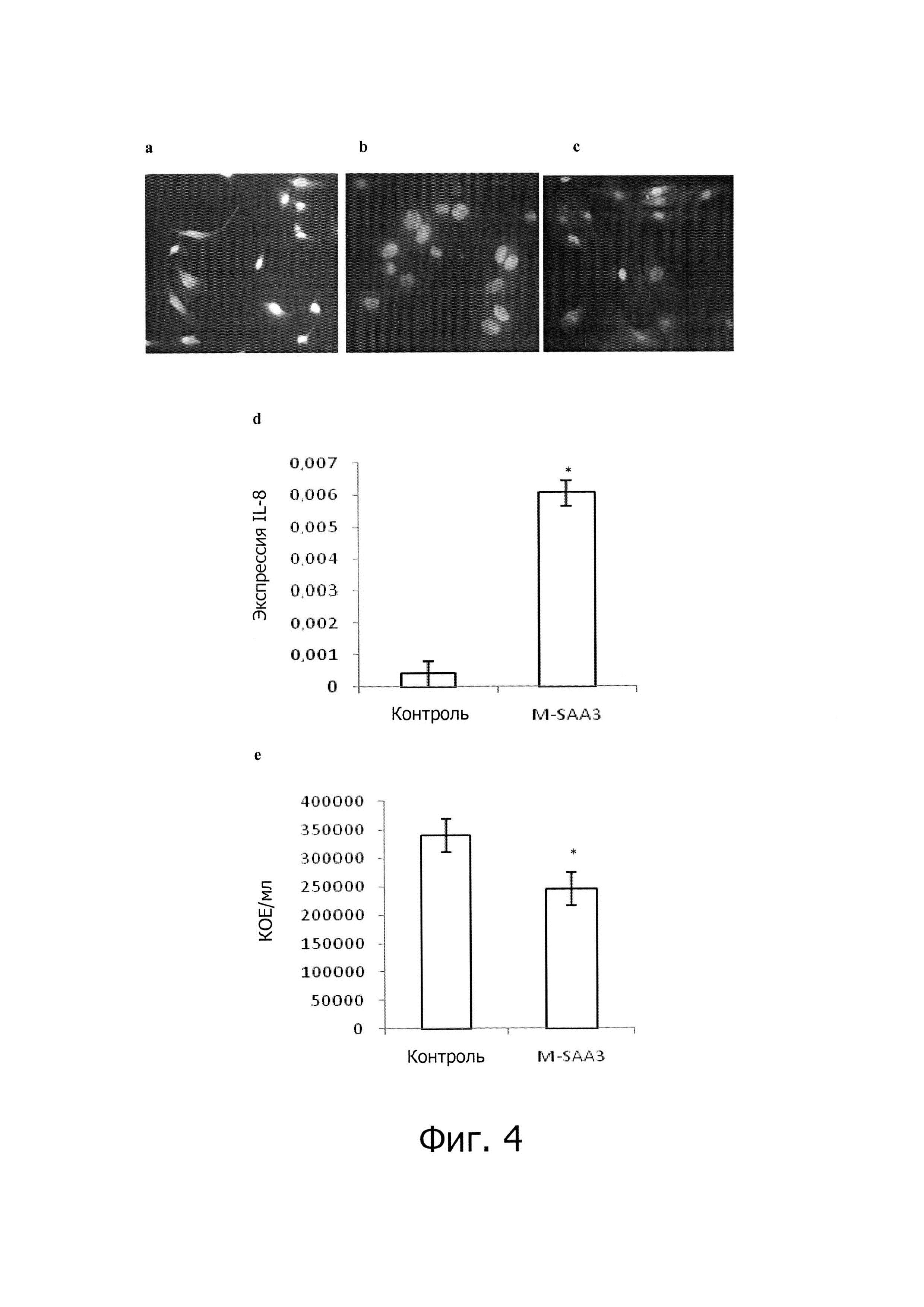
Фиг. 4 - первичные культуры клеток молочной железы. Иммунофлуоресценция первичных культур клеток молочной железы с использованием панцитокератина. Клетки HeLa (а) в качестве положительного контроля, ТНР-1 макрофаги (b) в качестве отрицательного контроля и культуры клеток молочной железы (с). Графики представляют генную экспрессию IL-8 (а) и количество жизнеспособных клеток интернализованных S. aureus (b). Столбики представляют средние значения ± SEM. Столбики со звездочкой значительно отличаются (Р<0,05).
Фиг. 5 - эффект SAA3 молочной железы в отношении генной экспрессии в дендритных клетках. Генная экспрессия IL-8 (a), INFγ (b), TNFα (с), CCR7 (d), CD80 (е) и iNOS (f). Столбики представляют средние значения ± SEM для различных обработок. Столбики, помеченные звездочкой, значительно отличаются (Р<0,05) и t (Р<0,1).
Фиг. 6 - рестрикционная карта плазмиды pNZ8148.
Фиг. 7 - результаты ПЦР амплификации гена saa3 в pNZ8148.
Фиг. 8 - вестерн-блот с M-SAA3, продуцированным в Lactococcus lactis (А). Количественная оценка полос вестерн-блота с использованием программного обеспечения «Quantity One» (В).
Подробное описание изобретения
Настоящее изобретение заключается в применении белков острой фазы, более предпочтительно, сывороточного амилоида A (SAA), еще более предпочтительно, изоформы 3 (SAA-3) в качестве активного ингредиента для контроля интрамаммарных инфекций (IMI) и/или для улучшения состояния и/или для бустинга или стимуляции естественного иммунитета у млекопитающих, не относящихся к человеку, предпочтительно, у бычьих.
В изобретении предлагается, прежде всего, применение таких белков, конкретно, белка SAA-3, в качестве иммунного агента у млекопитающих, не относящихся к человеку, а также для активации инволюции молочной железы.
Настоящее изобретение неожиданно продемонстрировало, что белки острой фазы, конкретно, белок SAA-3, обладают способностью усиливать привлечение иммунных клеток (выделение моноцитов, дифференцировка в дендритные клетки и профиль экспрессии интерлейкина 8), стимулировать инволюцию молочной железы путем повышения активности металлопротеиназ, модифицируя Количество Соматических Клеток, а также содержание молочного жира и белка, и способностью ингибировать бактериальную транслокацию, такую как например, Staphylococcus aureus, в первичных культурах клеток молочной железы.
Белки острой фазы
Млекопитающие отвечают на повреждение ткани, травму или инфекцию путем выполнения комплексных серий биологических реакций с целью предотвращения дальнейшего повреждения ткани, для инициации репарации поврежденной ткани, и для выделения и разрушения инфицированных организмов. Данный способ обозначается как противовоспалительный ответ. Ранняя и промежуточная стадии воспалительного ответа обозначаются как ответ острой фазы и включают в себя широкий спектр белковых медиаторов, включающих цитокины, интерлейкины и фактор некроза опухоли, которые рассмотрены в Steel & Whitehead (Immunology Today 15: 81-87, 1994).
Термин «белки острой фазы» обозначают в контексте данного изобретения группу плазматических белков, чья концентрация в плазме повышается или снижается в ответ на повреждение ткани, острые инфекции, ожоги или хроническое воспаление у млекопитающего, не относящегося к человеку. Данная группа включает, более конкретно, белки сывороточного амилоида A (SAA), кислого гликопротеина альфа-1, антитрипсина альфа-1, гаптоглобинов, фибриногена, С-реактивного белка, ферритина, церулоплазмина и факторов комплемента. Наиболее предпочтительный белок острой фазы для применения в изобретении представляет собой белок SAA.
Белки сывороточного амилоида A (SAA) представляют собой низкомолекулярные белки острой фазы, которые аккумулируются и быстро ассоциируют с липопротеином 3 высокой плотности (HDL3) во время острой фазы воспалительного ответа. Данное семейство белков острой фазы вырабатывается во всех позвоночных, исследованных к настоящему моменту, и в зависимости от вида, было идентифицировано три или четыре генетических локуса, которые кодируют SAA. Эти гены SAA, кодирующие изоформы SAA, дифференциально экспрессируются в печени и/или вне печени. Были охарактеризованы три основные изоформы, SAA-1, SAA-2 и SAA-3. SAA-3 представляет собой наиболее предпочтительный белок SAA для применении в настоящем изобретении.
Выделенный и очищенный бычий, ассоциированный с колострумом белок SAA-3 описан в US 7214512. Согласно данному патенту было представлено, что белок SAA-3 и, более конкретно, его высоко консервативный участок TFLK, присутствующий в N-концевой области, стимулирует продуцирование муцина в кишечнике, более конкретно, MUC3.
Изоформа белка SAA-3 (M-SAA-3) молочной железы бычьих, имеющего 97% гомологии с ассоциированным с колострумом белком SAA-3, была очищена из молока, которая, как сообщалось, обладает различными активностями, такими как хемотаксис иммунных клеток или модуляция цитокинов.
Однако, до сих пор не было сообщений или предположений о наличии эффекта белков острой фазы, таких как, белок SAA-3, в отношении привлечения иммунных клеток (выделение моноцитов, дифференцировка в дендритные клетки и профиль экспрессии интерлейкина 8), или в отношении инволюции молочной железы (например, повышение активности металлопротеиназ, модификация Количества Соматических Клеток, а также содержание молочного жира и белка) и в отношении ингибирования бактериальной транслокации (такой как например, Staphylococcus aureus) в молочной железе.
В контексте настоящего изобретения, термин «SAA-3» или «M-SAA3» обозначает белок или пептид, содержащий (i) полную аминокислотную последовательность SEQ ID NO: 2, или (ii) фрагмент SEQ ID NO: 2, содержащий, по меньшей мере, 20 последовательно расположенных аминокислот SEQ ID NO: 2, предпочтительно, по меньшей мере, 25, 30, 35, 40 или, по меньшей мере, 50 последовательно расположенных аминокислот SEQ ID NO: 2, или (iii) последовательность, имеющую, по меньшей мере, 80% идентичности с SEQ ID NO: 2, предпочтительно, по меньшей мере, 85%, 90%, 95% или 97% идентичности последовательности с SEQ ID NO: 2. Термины применяются взаимозаменяемо и включают, в частности, последовательности, раскрытые в данном документе, их консервативно модифицированные варианты, независимо от источника и любые другие варианты, которые сохраняют биологические свойства SAA-3 или M-SAA3.
Предпочтительно, термин SAA-3 обозначает белок или пептид, определенный выше, обладающий способностью стимулировать выработку интерлейкина-8 (IL-8) в клетках молочной железы, или для повышения количества соматических клеток в молочной железе, или для уменьшения in vitro инфекции эпителиальных клеток молочной железы бактериями S. aureus, по меньшей мере, на 15%.
Предпочтительно использовать белок острой фазы, выделенный из видов, в отношении которых предназначено лечение.
Термин «идентичность последовательности», применяемый к последовательностям нуклеиновой кислоты или белка, относится к количеству (обычно в процентах) совпадений последовательностей нуклеиновых кислот или белков между, по меньшей мере, двумя последовательностями, выравненными с использованием стандартизованного алгоритма, такого как выравнивание Смита-Ватермана (Smith and Waterman (1981) J Mol Biol 147: 195-197), CLUSTALW (Thompson et al. (1994) Nucleic Acids Res 22: 4673-4680), или BLAST2 (Altschul et al. (1997) Nucleic Acids Res 25: 3389-3402). BLAST2 может использоваться в качестве стандартизованного и воспроизводимого способа для вставки пробелов в одну из последовательностей с целью оптимизации выравнивания и для достижения более значимого сравнения между ними.
Белок острой фазы может представлять собой выделенный белок натурального происхождения или синтетический белок, или рекомбинантный белок.
Термины «белки» или «пептид» используются в данном документе взаимозаменяемо для обозначения полимера из аминокислотных остатков. Термины применяют к аминокислотным полимерам, в которых один или несколько аминокислотных остатков являются искусственным химическим аналогом соответствующей естественной аминокислоты, а также термины применяют к естественным аминокислотным полимерам. Существенная природа таких аналогов естественных аминокислот заключается в том, что при их включении в белок, такой белок будет специфично реактивен с антителами, вырабатываемыми к этому же белку, но состоящему полностью из естественных аминокислот.
Белок может быть модифицирован, как например, он может быть гликозилирован и/или может содержать модифицированные и/или искусственные аминокислоты. Термин «модифицированный» также включает модификации, включающие, в частности, фосфорилирование, гликозилирование, присоединение липида, сульфатирование, гамма-карбоксилирование остатков глутаминовой кислоты, гилроксилирование и ADP-рибозилирование. Понятно, что, как известно и как отмечено выше, эти белки не являются полностью линейными. Например, белки могут быть разветвленными в результате убиквитинилирования, и они могут быть циклическими с разветвлением или без него, как правило, в результате посттрансляционных модификаций, включающих естественное процессирование и события, привнесенные манипуляциями человека, которые не существуют в естественной среде. Циклический, разветвленный и разветвленный циклический белок может быть синтезирован с помощью не трансляционного естественного процесса, а также с помощью полностью синтетических методов.
Термин «рекомбинантный» включает ссылку на клетку или вектор, которые были модифицированы путем введения гетерологичной нуклеиновой кислоты, или эта клетка выделена из модифицированной таким образом клетки. Таким образом, рекомбинантные клетки экспрессируют гены, которые не обнаружены в идентичных формах в нативной (не рекомбинантной) форме клетки, или экспрессируют нативные гены, которые по-другому аномально экспрессируются, экспрессируются на низком уровне или совсем не экспрессируются в результате преднамеренного вмешательства человека. Термин «рекомбинантный» при использовании в данном документе не охватывает изменения клетки или вектора с помощью естественных событий (например, с помощью спонтанной мутации, естественной трансформации/трансдукции/транспозиции), как например, такие, которые случаются без преднамеренного вмешательства человека. Рекомбинантный белок или пептид представляет собой белок или пептид, получаемый из рекомбинантной клетки.
Термин «вектор» включает репликон, такой как плазмида, фаг, космида или вирус, в который может быть функционально вставлен другой сегмент нуклеиновой кислоты так, чтобы осуществлялась репликация или экспрессия сегмента.
Белок или пептид для применения в изобретении (например, белок SAA-3 или пептид) может быть представлен в выделенной или очищенной форме, предпочтительно лишенной других белков, предпочтительно в форме, чистой, по меньшей мере, на 90%, 95%, 96%, 97%, 98% или в более чистой форме. В конкретном воплощении, белок или пептид или композиция для применения в изобретении не содержат липополисахариды (LPS), т.е., не содержат некоторые количества или следы LPS. В изобретении предлагаются новые способы, дающие возможность рекомбинантного получения SAA3-белка, полностью лишенного LPS. Такой белок при использовании в настоящем изобретении минимизирует или избегает эндотоксической реакции.
В этом отношении, в конкретном воплощении в изобретении также предлагается способ получения белка SAA-3, включающий культивирование клетки, содержащей рекомбинантную нуклеиновую кислоту, кодирующую указанный белок SAA-3, при условиях, дающих возможность экспрессии указанной нуклеиновой кислоты, и извлечение SAA-3, где клетка лишена функционального пути получения LPS. В конкретном воплощении, клетка представляет собой бактериальную клетку lactococcus, предпочтительно, lactococcus lactis (например, штамм NZ900). Такая бактерия не вырабатывает LPS. В альтернативном воплощении клетка представляет собой бактерию с модифицированным LPS-путем, которая вырабатывает не LPS, а модифицированный метаболит, который не запускает эндотоксическую реакцию. Известно, что ацильные цепи LPS представляют собой пусковой механизм, который вызывает активацию NF-kB и выработку провоспалительных цитокинов. Делеция двух вторичных ацильных цепей приводит к получению модифицированного липида (обозначаемого липид IVА), который не запускает эндотоксичной реакции. Примером таких бактерий являются, например, ClearColi™ BL21 (DE3). Кроме того, с целью дополнительного улучшения уровня продуцирования в изобретении также описана оптимизированная SAA3-кодирующая нуклеиновая кислота с оптимизацией кодонов для экспрессии в Lactococcus. Последовательность представлена в SEQ ID NO: 3, и характеризует следующую цель настоящего изобретения. Более конкретно, изобретение также относится к нуклеиновой кислоте, содержащей нуклеотиды 3-467 SEQ ID NO: 3, или к ее комплементарной последовательности, а также к любому вектору или клетке, содержащем их, и к их применению.
Режим введения
Фармацевтические композиции или белки согласно настоящему изобретению могут вводиться многими путями, которые хорошо известны в данной области и адаптированы для лечения заболеваний млекопитающего, не относящегося к человеку. Они предпочтительно вводятся чрескожно, перорально, парентерально или путем инфузии. Они представлены в формах, подходящих для выбранного способа введения. Таким образом, они могут быть представлены в форме раствора или в форме пероральной или инъецируемой жидкой суспензии или в виде твердой или полутвердой формы, в порошкообразной форме, в виде капсул, таблеток с сахарным покрытием, мягких капсул, спреев, каплет, пилюлей, таблеток или паст.
Преимущественно, белки острой фазы или фармацевтические композиции, содержащие белок острой фазы, вводят с помощью интрамаммарной инфузии.
В следующем воплощении композиция представлена в форме вязкой пасты.
Композиции и способы по изобретению обычно содержат или используют «эффективное количество» белка острой фазы, предпочтительно, белка SAA-3, например, количество указанного белка, достаточное для того, чтобы вызывать статистический эффект in vivo и/или in vitro в отношении привлечения иммунных клеток (например, выделение моноцитов, дифференцировка в дендритные клетки и профиль экспрессии интерлейкина 8), для стимулирования инволюции молочной железы путем повышения активности металлопротеиназ, модифицируя Количество Соматических Клеток, а также содержание молочного жира и белка, и для ингибирования бактериальной транслокации, такой как например, Staphylococcus aureus в первичных культурах клеток молочной железы.
В зависимости от составов и белка, фармацевтические композиции могут дополнительно содержать подходящие фармацевтически приемлемые ингредиенты для получения жидких или твердых составов для чрескожного, перорального введения или введения путем инфузии. Кроме того, в случае пероральных составов, они могут вводиться непосредственно млекопитающим, не относящимся к человеку, или могут примешиваться в пищу.
Более того, в зависимости от типа, составы композиции по изобретению могут содержать растворитель, антислеживающий агент, смазывающий агент и любой подходящий наполнитель, такой как лактоза, целлюлоза или крахмал. В качестве смазывающего агента можно использовать стеариновую кислоту, стеарат магния, L-лейцин или, например, трибехенат глицерина. В качестве дезинтегрирующего агента могут использоваться карбоксиметил крахмал натрия или сетчатый карбоксиметил крахмал натрия. В качестве антислеживающего агента может использоваться чистый кремний или коллоидный диоксид кремния. Пероральные твердые формы могут быть представлены в форме таблеток с покрытием.
Подходящие композиции по изобретению получают путем смешивания эффективных терапевтических количеств, по меньшей мере, одного пролактинового соединения, как писано ранее, вместе с растворителем, регулятором рН, буферным агентом, суспендирующим агентом, солюбилизирующим агентом, стабилизатором, агентом тоничности и/или консервантом и путем трансформации смеси с использованием традиционного способа для инъекции или инфузии. Примеры растворителей представляют собой масляные растворители, такие как среднецепочечные триглицериды С8-С10, или смесь каприновой кислоты, каприловой кислоты и триглицеридов, таких как триглицериды с торговым названием Mygliol812. Инъецируемые препараты могут быть лиофилизированными согласно традиционным способам.
Примеры суспендирующих агентов включают метилцеллюлозу, полисорбат 80, гидроксиэтилцеллюлозу, ксантановую камедь, карбоксиметилцеллюлозу натрия, полиэтилен монолаурат сорбитана. Примеры солюбилизирующих агентов включают рициновое масло, отверждаемое с помощью полиоксиэтилена, полисорбат 80, никотинамид, полиоксиэтилированный монолаурат сорбитана, маркогол и этиловый эфир рицинолевой кислоты. Кроме того, стабилизирующий агент включает сульфат натрия, метасульфат натрия и эфир, в то время как консерванты включают метил р-гидроксибензоат, этил р-гидроксибензоат, сорбиновую кислоту, бензиловый спирт, фенол, крезол и холестерин. Один из примеров агентов тоничности представляет собой маннит. Во время получения растворов и инъецируемых суспензий лучше гарантировать, что они изотоничны по отношению к крови.
Преимущественно, фармацевтические композиции по настоящему изобретению могут вводиться вместе со стандартными терапиями IMI. Примеры стандартных терапий или профилактических композиций IMI представляют собой местные дезинфицирующие вещества для вымени, герметики сосков, антибиотики, такие как пенициллин группы М, цефалоспорин или колистин или даже ферменты, такие как лизоцимы или мурамидаза, антипролактиновое соединение, такое как выделенный из спорыньи агонист допаминового рецептора и, более конкретно, каберголин.
Контроль интрамаммарных инфекций (IMI)
Композиции и способы по изобретению конкретно подходят и являются эффективными для контроля IMI у млекопитающих, не относящихся к человеку. Как представлено в разделе экспериментов, композиции и способы эффективно блокируют или уменьшают бактериальную инфекцию в молочной железе, как in vitro, так и in vivo. Неожиданно в настоящем изобретении продемонстрировали, что белок SAA-3 обладает способностью ингибировать бактериальную транслокацию, такую как, например, Staphylococcus aureus, в молочной железе.
Композиции и способы конкретно эффективны для лечения во время или сразу перед периодом сухостоя.
Экспонирование с патогенами окружающей среды, вероятно, продолжается на протяжении периода сухостоя. Эти организмы первоначально приобретаются в результате контаминации вымени навозом и подстилкой. Существуют различные степени интрамаммарных инфекций (IMI), вызванных различными агентами окружающей среды, по мере прогрессирования периода сухостоя, и профили этих патогенов будут варьироваться между фермами и в зависимости от части света. Однако, как правило, можно ожидать, что грамположительные бактерии представляют собой контагиозные IMI-патогены, которые играют более важную роль у млекопитающих, не относящихся к человеку, особенно у бычьих, содержащих в молоке суммарно более высокое количество соматических клеток (SCC), в то время как при низком суммарном SCC в молоке патогены окружающей среды и, конкретно, грамотрицательные бактерии более существенны. Например, инфекции Streptococci, Klebsiella, и Enterobacter из окружающей среды более часто встречаются на ранней стадии периода сухостоя. С другой стороны, инфекции Е. coli имеют тенденцию встречаться до и после отела, Как правило, превалирующие патогенные организмы для бычьих IMI представляют собой Staphylococcus aureus, Escherichia coli, Streptococcus uberis, Streptococcus dysgalactiae и отрицательные по коагулазе Staphylococcus spp.
Интрамаммарные инфекции, имеющие место при отеле, могут возникать как в результате стойкости инфекций из предыдущей лактации, так и в результате новых инфекций, приобретенных во время периода сухостоя. Огромное большинство инфекций, присутствующих на поздней стадии периода сухостоя, представляют собой вновь приобретенные, а не сохранившиеся после запуска. Хотя такое сохранение, как правило, бывает редким, грамположительные бактерии с большей вероятностью сохраняются на протяжении периода сухостоя, чем грамотрицательные бактерии.
Новые инфекции, приобретенные во время периода сухостоя, особенно важны, и было продемонстрировано, что они встречаются до 10 раз чаще, чем новые инфекции, приобретенные во время лактации. В стадах с низким количеством соматическим клеток в молоке (<250000 клеток/на мл), Escherichia Coli и Streptococcus uberis обычно являются наиболее частыми причинами новых инфекций, и исследователи предполагают, что около 60% новых инфекций вызвано этими организмами. Приблизительно 60% всех случаев клинического мастита, проявляющихся в первые 100 дней лактации, могут способствовать IMI, приобретаемым во время периода сухостоя, ясно демонстрируя важность и влияние периода сухостоя в инфекции IMI при последующей лактации.
Несомненно, контроль развития IMI во время периода сухостоя является ключевым моментом для эффективного лечения мастита, который появляется в данный период и в последующей лактации. Кроме того, контроль IMI также участвует в оздоровлении млекопитающих, не относящихся к человеку, путем уменьшения, например, боли в молочной железе.
Конкретной целью изобретения, таким образом, является композиция или способ контроля IMI во время периода сухостоя у млекопитающего, не относящегося к человеку, с пользованием белка острой фазы, предпочтительно, белка SAA, более предпочтительно, белка SAA3. Другой конкретной целью изобретения является композиция или способ контроля новых бактериальных инфекций во время периода сухостоя с пользованием белка острой фазы, предпочтительно, белка SAA, более предпочтительно, белка SAA3.
В контексте данного изобретения, термин «контролирование» или «контроль» в отношении инфекции обозначает уменьшение проявлений или тяжести указанной инфекции или инфекционного заболевания и/или, по меньшей мере, уменьшения вероятности, риска, предрасположенности, тяжести, прогрессии или последствий инфекции.
Контроль IMI конкретно обозначает предотвращение IMI, например, любое уменьшение инфекции или инвазии или транслокации патогена (например, бактерии), предпочтительно, любое уменьшение, по меньшей мере, на 15%, 20% или более %.
Контроль инфекции у млекопитающего, не относящегося к человеку, которое экспонировалось инфекционным агентам, обозначает, по меньшей мере, уменьшение развития инфекционного агента и/или любого заболевания или симптома или последствия инфекционного агента.
Бустинг естественного иммунитета
В контексте данного изобретения, «бустинг естественного иммунитета» относится к любому улучшению или стимулированию иммунной системы млекопитающего, не относящегося к человеку, как правило, с целью улучшения сопротивляемости или защиты указанного млекопитающего против заболеваний.
Предпочтительно, термин «бустинг естественного иммунитета» обозначает способность увеличивать привлечение иммунных клеток, таких как моноциты, или дифференцировку дендритных клеток или секрецию интерлейкина 8. В настоящем изобретении неожиданно продемонстрировано, что белок SAA-3 обладает способностью повышать привлечение иммунных клеток (выделение моноциты, дифференцировка дендритных клеток и профиль экспрессии интерлейкина 8) и, таким образом, стимулировать естественный иммунитет млекопитающих, не относящихся к человеку.
Благосостояние млекопитающих, не относящихся к человеку
Интенсивная выработка молока ставит особые требования по уходу за здоровым состоянием вымени, так как хорошее состояние вымени помогает, например, молочным фермерам экономить расходы, достигая больше в плане качества молока, выработки и рентабельности. Только здоровые млекопитающие, не относящиеся к человеку, со здоровым выменем могут вырабатывать гарантированно свободное от патогенов и загрязнений молоко и гарантировать безопасность пищи для потребителя. Таким образом, контроль здорового состояния вымени может быть экономически выгодным способом, который также способствует уменьшению боли млекопитающих, не относящихся к человеку, и таким образом, способствует их благополучию. Количество и типы лекарственных средств, доступных сельскохозяйственным животным для лечения боли и воспаления, и информация об их эффективности ограничены.
В настоящем изобретении неожиданно продемонстрировано, что белок SAA-3 обладает способностью стимулировать инволюцию молочной железы путем усиления активности металлопротеиназы, модификации SCC, а также содержания молочного жира и белка и, таким образом, имеет полезный эффект в отношении здорового состояния вымени.
Дополнительные аспекты и преимущества изобретения будут раскрыты в следующем экспериментальном разделе, который иллюстрирует изобретение.
Примеры
Пример 1: Получение белка SAA-3
1.1. Продуцирование в Е. coli
Штамм EcUR206 (Е. coli BL21 Star (DE3)-pET101/D-TOPO вектор, содержащий последовательность козьего M-SAA3) использовали в продуцировании рекомбинантного белка. Процесс объясняется во множестве источников (Domènech et al., 2012). Вкратце, BL21/pURAD1 растили в 400 мл среды LB-Amp с исходной OD600 0,05 до достижения log-фазы. Рекомбинантную экспрессию индуцировали с помощью IPTG 0,1 мМ в течение 1 ч и 20 мин. Клеточный осадок получали путем центрифугирования при 6000g в течение 10 мин, и замораживали при -80°С до момента применения. Клеточные осадки ресупендировали до OD600=100 в 20 мМ буфера Na2HPO4 /NaH2PO4, 0,5М NaCl, рН 7,4, содержащего лизоцим (0,2 мг/мл), ДНК-аза I и РНК-аза А (20 μг/мл), ингибиторный коктейль протеаз (1 мМ) и MgCl2 (1 мМ) в течение 30 мин при комнатной температуре. Суспензию смешивали с предварительно взвешенными 0,1 мм-стеклянными гранулами (в интервале 26-36 мг на 1 мл образца) (Biospec Product, Inc, Бартлесвиль, США). Три цикла биения 45 сек каждая, по одной минуте на льду в течение циклов, проводили во взбивателе MiniBead (Biospec Product, Inc, Бартлесвиль, США). Разрушенную клеточную суспензию центрифугировали в течение 15 мин при 20000g при 4°С, и надосадочную жидкость рассматривали как растворимую фракцию, содержащую рекомбинантный белок. Рекомбинантный белок очищали с использованием коммерческих колонок His Spin Trap (GE Healthcare, Упсала, Швеция), следуя инструкциям производителей. Очищенный белок диализовали при 4°С против PBS и дополнительно количественно оценивали с использованием спектрофотометрии ((А280 × Молекулярная масса)/коэффициент поглощения; мг/мл). Следы липополисахаридов (LPS) в элюированной фракции количественно оценивали в элюированной фракции с помощью анализа эндотоксина endoLISA (Hyglos). Конечный уровень LPS соответствовал 0,08 нг LPS/μг рекомбинантного белка. Уровень был аналогичен следовым количествам, наблюдаемым в рекомбинантном коммерческом Apo-SAA (ProSci-включенный, уровень эндотоксина менее чем 0,1 нг/μг белка).
1.2. Способ получения без LPS
Этот пример раскрывает способ получения SAA-3 без LPS. Способ использует L. lactis в качестве бактериального хозяина с оптимизированной SAA-3 - кодирующей последовательностью. Конкретно, кодирующую последовательность белка SAA-3 оптимизировали с использованием кода частоты использования кодонов Lactococcus lactis и получали в качестве синтетического гена. Оптимизированный ген saa3 представлен ниже в виде SEQ ID NO: 3. Кодирующий домен располагается в области нуклеотидов 3-467.
Экспрессирующая плазмида, выбранная для экспрессии SAA-3 в Lactococcus lactis, представляет собой pNZ8148 (фиг. 6).
После клонирования гена saa3 в плазмиду pNZ8148, его электропорировали в Lactococcus lactis NZ900 следующим образом: Сто микролитров компетентных клеток электропорировали при 2500 V/ 200 Ω/ 2,5uF и выдерживали 2 ч при 30°С вместе с питательной средой M17 + 0,5% глюкозы. Всю совокупность трансформантов высевали на питательный агар M17 + 0,5% глюкозы вместе с 5 мкг/мл Хлорамфеникола. Девять положительных колоний тестировали с помощью ПЦР в качестве возможных положительных клонов. Клоны 1, 6, 7 и 8 секвенировали, и результат выявил, что клон 1 был положительным для оптимизированной последовательност M-SAA3 (фиг. 7).
Ночную культуру Lactococcus Lactis NZ900-pNZ8148-SAA3 процессировали в среде M17, содержащей 5% Глюкозу и 5 мкг/мл Хлорамфеникола. Свежий ре-инокулят обрабатывали при OD600нм=0,1, а индукцию проводили при OD600нм=0,97, 1,5 или 1,7 с содержанием 1, 5, 50 или 500 нг/мл Низина в течение 3 часов. После индукции 1 мл каждой культуры центрифугировали при 6000g, 15 мин, 4°С, и надосадочную жидкость сбрасывали. Осадок разрушали в течение 4 циклов 45'' FastPrep с использованием 100 мг стеклянных гранул (0,1 мм) и 1 мл Лизирующего буфера [NaH2PO4/Na2HPO4 20 мМ, NaCl 0,5М, рН 7,4 с содержанием Лизоцима (0,2 мг/мл), ДНК-аза I (20 μг/мл), РНК-аза А (20 μг/мл), MgCl2 1 мМ и 2 мкл/мл ингибиторного коктейля Протеаз (Sigma)]. Через 10 минут центрифугирования при 20000 xg, 20 μл каждой надосадочной жидкости (растворимая фракция) загружали на SDS-Page/вестерн-блот и проводили иммунную детекцию с использованием моноклонального анти-his антитела (Sigma Aldrich) в качестве первичного антитела и козьего вторичного антитела к мышиному IgG, конъюгированного со щелочной фосфатазой (Sigma). Полученные полосы (фиг 8) количественно оценивали с использованием программного обеспечения QuantityONE (BioRad).
Результаты демонстрируют, что белок M-SAA3 может эффективно продуцироваться в Lactococcus lactis в качестве растворимого белка. Получение свободно от LPS.
Пример 2: Исследование эффективности белка SAA-3 в отношении благосостояния бычьих путем измерения эффекта в отношении Количества Соматических Клеток (SCC), активности металлопротеиназ и содержания жира и белка после инфузии молочной железы
Две четверти у девяти коров были интрамаммарно инфузированы с помощью канюли для молочной железы с использованием 1 мг M-SAA3 и 80 нг Е. coli LPS (Sigma) (=контроль) для воспроизведения возможного эффекта следовых количеств LPS в очищенной рекомбинантной SAA-3-фракции. Тот же объем (10 мл) солевого раствора инфузировали в соответствующие контрольные четверти (фронтальные или задние четверти). Сразу после обработки все четверти были обработаны интрамаммарно с использованием обычного антибиотика (Орбенин экстра-сухостойная корова, Pfizer). Фронтальные и задние четверти обрабатывали статистически независимо. Образцы молока отбирали в первый день в 8 утра перед интрамаммарной инфузией (Т=0) и каждый день в 8 утра в течение 3 последовательных дней (Т=1, Т=2 и Т=3). Десять мл молока замораживали для анализа металлопротеиназ, и свежее молоко анализировали на предмет количества соматических клеток (SCC), жира и белка. Образцы свежего молока процессировали в ALLIC (Laboratori interprofessional lleter de Catalunya, Камбрилс, Испания).
Статистические анализы: Данные, касающиеся SCC, жира, белка, активности металлопротеиназ и экспрессии гена, анализировали в модели смешанных эффектов. Данные, полученные ранее, трансформировали при необходимости. Результаты выражены в виде средних значений не трансфрмированных данных ± SEM (если не установлено другое).
А. Активность металлопротеиназ
Замороженное молоко оттаивали и центрифугировали при 2700g в течение 10 мин для получения обезжиренного молока. Разведенное 1:20 обезжиренное молоко смешивали 1:1 с буфером загрузки (0,125М Tris рН=6,8 вместе с 0,005% бромфенолового синего, 20% глицерина, 4% SDS) и прогоняли в 10%-полиакриламидном геле, содержащем 1 мг/мл свиного желатина. Образцы прогоняли в течение 1 часа при 150V в рабочем буфере (192 мМ Gly, 25 мМ Tris, 0,1% SDS). После прогона гель промывали с использованием 2,5% раствора Triton Х-100 при комнатной температуре (RT) с мягким перемешиванием в течение 30 мин. Затем, гель инкубировали с проявляющим буфером (50 мМ Tris рН 7,6 с содержанием 0,2М NaCl, 5 мМ СаСl2, 0,02% Brij) в течение 30 мин, и реинкубировали в свежем проявляющем буфере в течение 48 часов при 37°С без перемешивания. Гели окрашивали с использованием Кумасси Синего R-250 (Bio-Rad) в течение 30 мин. Обесцвечивающий буфер (50% метанол, 10% уксусная кислота) использовали для визуализации полос, соответствующих металлопротеиназам. Гели гидролизовали, и размер полос и их интенсивность анализировали с помощью программного обеспечения Quantity One.
Активность молочных протеиназ оценивали посредством количественного анализа зимографии на геле. Ферменты ММР-9 и ММР-2 наблюдали в качестве отчетливых полос, соответствующих 92 кДа и 72 кДа. Наблюдали значительный эффект от обработки М-SAA3 (Р<0,0001) (фиг. 2). M-SAA3 повышал активность (Р<0,0001) ММР-9 в течение трех дней эксперимента по сравнению с солевым раствором. M-SAA3 также повышал (Р<0,001) уровень активности ММР-9 по сравнению с LPS (фиг.2а). Напротив, не было различий между LPS и их отрицательным контролем. С другой стороны, активность ММР-2 сохранялась неизменной после обработки как с использованием M-SAA3, так и LPS (фиг. 2b).
M-SAA3 отчетливо повышал активность ММР-9 в отношении молока на ранней стадии запуска. Уровень активности ММР-9 (фиг. 2а) был выше через 24 часа после инфузии и оставался выше базового уровня на протяжении всего эксперимента. LPS или эндотоксин представляет собой основную составляющую клеточной стенки грамотрицательной бактерии, и существенно активирует иммунный ответ. Во время продуцирования M-SAA3, остаточные следовые количества LPS детектировали в конечном элюированном белке. Таким образом, следовые количества LPS следует оценить, поскольку молочная железа бычьих высоко чувствительна к низким дозам LPS. Следовые количества LPS не повышали активности ММР-9, наблюдая аналогичные уровни по отношению к отрицательному контролю. С другой стороны, активность ММР-2 оставалась неизменной в течение всего эксперимента (фиг. 2b).
Известно, что металлопротеиназы обладают ключевой ролью во время проявления ранней стадии инволюции, поскольку стимулируют деградацию базальной мембраны молочной железы и, таким образом, могут рассматриваться как ключевые маркеры для активности инволюции молочной железы. Фактически, ММР-9 была описана как наиболее активная металлопротеиназа в процессе инволюции молочной железы коровы, и основной источник ММР-9, как считается, представляет собой нейтрофильную фракцию. Было описано, что ММР-2 повышает свой уровень во время маммогенеза, а также на поздней стадии инволюции, причем эндотелиальные клетки являются основными продуцентами ММР-2 у бычьих.
В. Количество соматических клеток (SCC)
Существенное повышение в числе SCC наблюдали в M-SAA3 (фиг. 3а) в наполненных четвертях в течение второго дня эксперимента.
Напротив, эффект следовых количеств LPS в SCC было различным. Менее существенное повышение наблюдали только в первый день эксперимента. Количество соматических клеток представляет количественную оценку иммунного ответа клеток, которые присутствуют в молоке, в основном обозначаются как нейтрофилы, макрофаги и другие типы клеток, такие как эпителиальные клетки. Как описано в научной литературе, SCC обычно повышается в течение процесса инволюции, поскольку медиаторы иммунного ответа привлекаются из кровеносных сосудов. Повышение уровня медиаторов иммунного ответа помогло бы защите молочной железы против инфекций, а также повышению активности ММР-9.
С. Содержание молочного жира и белка
Обе концентрации жира и белка (фиг. 3b, с) повышались при обработке M-SAA3 на ранней стадии периода сухостоя. Фактически, эффект обработки наблюдали (Р<0,05) для содержания жира (фиг. 3b). M-SAA3 повышал (Р<0,01) уровень жира по сравнению с соответствующим отрицательным контролем. Кроме того, содержание жира не повышалось при обработке LPS по сравнению с их соответствующим отрицательным контролем. Тенденцию (Р=0,051) в эффекте обработки наблюдали для содержания белка (фиг. 3с). M-SAA3 повышал (Р<0,01) концентрацию белка в молоке в течение первых трех дней эксперимента по сравнению с отрицательным контролем.
Содержание белка в четвертях, обработанных M-SAA3, имело тенденцию (Р=0,06) к тому, что оно было выше, чем в четвертях LPS, в то время как содержание белка с LPS не отличалось от своего отрицательного контроля.
Обе концентрации жира и белка (фиг. 3b, с) повышались при обработке M-SAA3 на ранней стадии периода сухостоя. Суммарная концентрация белка на ранней стадии инволюции частично из-за реабсорбции воды в результате секреции и частично благодаря повышенной концентрации лактоферрина, сывороточного альбумина и иммуноглобулинов, хотя экспрессия специфичных для молока белков, таких как казеин, уменьшалась. Концентрации молочного жира медленно снижалась в течение первых 2-3 недель периода сухостоя, но возможно, что на ранней стадии периода сухостоя образцы все еще детектировали накопление жира, который мог быть выше в M-SAA3-четвертях из-за усиленной реабсорбции воды.
Эти исследования Количества Соматических Клеток (SCC), активности металлопротеиназы и содержания жира и белка после инфузии молочной железы выявляют роль M-SAA3 в ходе инволюции молочной железы.
Пример 3: Исследование эффективности белка SAA-3 в отношении IMI путем измерения ингибирования транслокации S. aureus и экспрессии IL-8 в первичных культурах клеток молочной железы
Первичная культура клеток молочной железы
Ткань молочной железы получали на скотобойне и транспортировали в охлажденном PBS с содержанием 100 μг/мл стрептомицина, 100 Ед/мл пенициллина и 2,5 μг/мл амфотерицина В. В лаборатории ткань разрезали на маленькие кусочки и инкубировали в сбалансированном растворе солей Хэнкса с содержанием 0,1 мМ EDTA и 0,1 мМ DTT в течение 30 мин при 37°С в 10% СО2 при 150 об./мин. Затем, надосадочную жидкость удаляли и добавляли среду RPMI 1640, содержащую 0,05% коллагеназы, и инкубировали 30 мин. Среда содержала эпителиальные клетки, которые центрифугировали при 800g в течение 5 мин. Данный процесс повторяли 3 раза. Конечный осадок клеток ресуспендировали в среде F-12 с содержанием 8 μг/мл бычьего инсулина, 10 μг/мл жентамицина, 50 μг/мл гидрокортизона, 100 μг/мл стрептомицина, 100 Ед/мл пенициллина и 2,5 μг/мл амфотерицина. Клетки оценивали количественно с помощью подсчета с использованием гемоцитометра и инкубировали в количестве 80000 клеток/см2 во флаконах до момента дифференцировки. Фенотип эпителиальных клеток подтверждали с помощью иммунофлуоресцентного окрашивания против антител к цитокератину (Sigma), как описано ранее в статье (Hashim et al, 2004). Первичные клетки молочной железы растили на покровных стеклах и фиксировали с использованием 4% параформальдегида (разведенного в PBS). SK-BR3 использовали в качестве положительного контроля, и дифференцированные макрофагальные клетки ТНР-1 использовали в качестве отрицательного контроля. Покровные стекла блокировали с использованием 150 μл PBS, содержащего козью сыворотку (0,05% об./об.) и тритон 0,2%, в течение 30 мин при комнатной температуре (RT). Первичное антитело (моноклональное антитело к пан-цитокератину, продуцированное в мыши, Sigma, разведение 1:500) инкубировали в блокирующем буфере в течение 2 часов при RT. После 3 промывок с помощью PBS, вторичное антитело (антимышиное-FITC, Sigma, 1:1000) инкубировали в течение 1 часа при RT. Наконец, клетки промывали, и высушенные покровные стекла помещали на предметные стекла с использованием Fluoroprep и наблюдали на флуоресцентном микроскопе.
А. Транслокация S. aureus
Выделение Staphylococcus aureus
Патогенные Staphylococcus aureus, выделенные из молока маститной коровы, любезно предоставлены ALLIC (Laboratori interprofessional lleter de Catalunya, Cabrils, Spain). S. aureus растили в питательной среде и высевали на солевой агар с маннитом. Одиночные колонии растили в 10 мл Питательной среды в течение ночи при 37°С в статичных условиях. Клеточный осадок получали путем центрифугирования при 6000g в течение 10 мин при 4°С. Бактериальную концентрацию рассчитывали с помощью спектрофотометрической оценки (DO600=0,4 соответствует 10Е7 КОЕ/мл). Бактериальные дозы получали путем ресуспендирования и разведения клеточного осадка с использованием соответствующей среды без антибиотиков.
Инфекция Staphylococcus aureus первичных культур клеток молочной железы
Эпителиальные клетки молочной железы высевали в 24-луночные планшеты в концентрации 440000 клеток/на лунку. Клетки предварительно инкубировали вместе с 30 мкг/мл рекомбинантного M-SAA3 в течение 1 часа. После предварительной инкубации, клетки молочной железы инфицировали с помощью S. aureus в количестве 10Е6 КОЕ/мл в течение 2 часов. Клетки тщательно промывали с помощью Фосфатно-Солевого Буфера (PBS), и интернализированные S. aureus высвобождали из клеток с помощью Triton 0,1%. Делали серийные разведения бактерий и высевали их на солевой агар с маннитом. Колонии подсчитывали после роста в течение ночи при 37°С.
Эпителиальное происхождение культивируемых клеток демонстрировали с помощью иммунофлуоресцентного окрашивания с помощью моноклонального антитела к панцитокератину (Sigma) (фигура 4 а-с). Первичные культуры клеток молочной железы, преинкубированные вместе или без M-SAA3, заражали патогенным штаммом S. aureus, выделенным из молока маститной коровы. M-SAA3 уменьшал (Р<0,05) бактериальную транслокацию до 25% (данные представляли в виде КОЕ/мл) (фиг. 4е).
M-SAA3 уменьшал на 25% бактериальную инфекцию первичный культур клеток молочной железы, зараженных S. aureus, патогенным штаммом, выделенным из маститного молока.
IMI и особенно мастит представляет собой главную причину экономических потерь в молочных хозяйствах, около $2 биллионов в год в Соединенных Штатах. Кроме того, инфекция S. aureus представляет собой одну из главных причин мастита, и одну из наиболее трудных для контроля с помощью обработки антибиотиками.
В. Экспрессия IL-8
Эффект M-SAA3 в отношении экспрессии IL-8, как основного цитокина, привлекающего нейтрофилы, оценивали на эпителиальных первичных культурах из молочной железы коровы. Эпителиальное происхождение культивируемых клеток демонстрировали с помощью иммунофлуоресцентного окрашивания с помощью моноклонального антитела к панцитокератину (Sigma) (фигура 4 а-с). Наблюдали 15- 22 кратно увеличенную экспрессию (Р<0,0001) IL-8 после 3 часов инкубации вместе с М-SAA3 (фиг. 4d).
Существенное повышение SCC в течение дня 2 эксперимента (фиг. 3а) предполагало, что M-SAA3 может стимулировать клеточный хемотаксис. Это согласуется с предыдущими данными, которые выявили, что формы SAA печени активировали миграцию моноцитов и полиморфноядерных клеток к месту воспаления. Это хемотаксическое привлечение может быть опосредовано IL-8, чья основная функция относится к привлечению медиаторов иммунного ответа. Для подтверждения данной гипотезы первичные культуры из молочной железы коров получали и инкубировали вместе с белком SSA-3. Эпителиальные клетки молочной железы существенно повышали экспрессию IL-8, выявляя, что эпителиальные клетки молочной железы способны высвобождать хемотаксический цитокин после экспонирования с M-SAA3. Также в публикациях было описано, что другие типы клеток, такие как моноциты и нейтрофилы, продуцируют IL-8 в ответ на члены семейства SAA.
Эти исследования транслокации S. aureus и экспрессии IL-8 в первичных культурах молочной железы выявляют ключевую роль M-SAA3 для контроля IMI и особенно мастита.
Пример 4: Исследование эффективности белка SAA-3 в отношении повышения иммунного ответа путем измерения активации экспрессии IL-8 и созревания Дендритных Клеток (DC)
Выделение бычьих дендритных клеток
Бычью кровь вместе с гепарином натрия 50 МЕ/мл в качестве антикоагулянта получали на скотобойне. Кровь разводили 1:1 с помощью PBS-2% Фетальная Телячья Сыворотка (FCS) при комнатной температуре (RT). Разведенную кровь наслаивали на Histopaque-1077 (Sigma) в соотношении 1:2 (histopaque/разведенная кровь) и центрифугировали при 600g (режим на выбеге (brakes off)) в течение 30 минут при RT. Мононуклеары периферической крови (РВМС) выделяли из интерфазы, промывали средой и центрифугировали 10 минут при 200g. Клеточный осадок ресуспендировали и инкубировали вместе с 10 мл лизирующего буфера «Red Blood Lysis» (Sigma) и инкубировали в течение 10 минут при RT. После центрифугирования при 250g в течение 5 мин, процесс повторяли до момента получения осадка, свободного от эритроцитов. РВМС ресуспендировали в дополненной среде (RPMI-10% FCS, 50 μM β-меркаптоэтанола, 1% пенициллин/стрептомицин) и количественно оценивали с использованием гемоцитометра. Клетки РВМС инкубировали в 75 см2 флаконах Falcon в соотношении 10Е6 клеток/см2, и инкубировали в течение 1,5 часов в 5% СO2 при 37°С. После инкубации прикрепленные моноциты промывали один раз с помощью PBS и инкубировали со средой с добавлением цитокинов Интерлейкина 4 (IL-4) и гранулоцит макрофаг колониестимулирующего фактора (GM-CSF) (набор реагентов «Bovine Dendritic Cell Growth», Bionova, 1:20 разведение). Среду меняли на 3 день и наблюдали суммарную дифференцировку клеток с помощью микроскопии на 6 день. В день эксперимента клетки соскребали и считали. Дендритные клетки в количестве 4×105 клеток/на лунку высевали в 24-луночные планшеты и инкубировали в дополненной RPMI без антибиотиков.
Обработка бычьих дендритных клеток с использованием M-SAA3
Эпителиальные клетки молочной железы из первичных культур (44000 клеток/на лунку) и дендритные клетки (4×10Е5 клеток/на лунку) высевали в 24-луночные планшеты. Клетки инкубировали вместе с соответствующей средой без антибиотиков, вместе и без 30 μг/мл рекомбинантного M-SAA3 в течение 3 часов. После промывания с помощью PBS клетки ресуспендировали с использованием 0,5 мл Тризола (invitrogen) и замораживали на -80°С до осуществления анализа генной экспрессии с помощью количественного ОТ-ПЦР.
Количественный анализ ОТ-ПЦР
Суммарную РНК экстрагировали из эпителиальных клеток молочной железы и из дендритных клеток с использованием Тризола (Invitrogen), следуя инструкциям производителя. Один микрограмм РНК обратно транскрибировали для получения кДНК с использованием набора синтеза кДНК «IScript» (Bio-Rad, Калифорния, США). Количественный ОТ-ПЦР анализ осуществляли с использованием специфичных праймеров (таблица 1). Каждый набор праймеров индивидуально оптимизировали. Специфичность амплификации оценивали с помощью идентификации одиночной полосы с ожидаемой молекулярной массой и одиночного пика на кривой плавления. Эффективность рассчитывали путем амплификации серийных разведений 1/10 ампликона каждого гена. Строили стандартную кривую Ct против концентрации с получением эффективности, которую рассчитывали с использованием формулы 101//slope, с приемлемым интервалом 1,8-2,2. Использовали суммарный реакционный объем 20 μл, содержащий 50 нг кДНК, 10 μл зеленого флуоресцентного SYBER (Bio-Rad), и оптимизированную концентрацию праймеров для каждого гена (таблица 1). Реакции кПЦР осуществляли циклически: исходная стадия денатурации 10 мин при 95°С, с последующими 40 циклами 10с при 95°С, 15с при оптимизированной температуре отжига для каждого гена, 30с при 72°С и конечная протяжка 10 мин при 72°С.Относительную экспрессию гена рассчитывали с использованием метода 2ΔCt с АСТВ в качестве эталонного контроля генов.
Дендритные клетки инкубировали вместе или без M-SAA3. Оценивали набор генов, относящихся к активации и созреванию (фиг. 5a-f).
Уровень IL-8 повышался (Р<0,0001) 2-кратно после обработки с помощью М-SAA3. INFγ подвергался существенной положительной регуляции (Р<0,0001) с получением уровня в 28 раз выше после обработки с помощью M-SAA3. Уровень TNFα повышался (Р<0,0001) в 7 раз после обработки с помощью M-SAA3. Маркер CCR7 повышался (Р<0,01) в 2,5 раза (после обработки с помощью M-SAA3). Маркер CD80 имел тенденцию (Р=0,053) к повышению в 3 раза после обработки с помощью M-SAA3. Наконец, экспрессия iNOS имела тенденцию к повышению (Р=0,054) в 3 раза после обработки с помощью M-SAA3. Дендритные клетки (DC) представляют собой специальные антиген-презентирующие клетки с ключевой ролью в проявлении адаптивного иммунного ответа. DC может представлять собой единственный тип клеток, способных к активации наивных Т-клеток. Циркулирующие незрелые DC в кровотоке попадают к тканям, где они становятся резидентными клетками. В молочной железе популяции DC были идентифицированы среди альвеолярной, эпителиальной и межальвеолярной ткани. Незрелые DC демонстрирую высокую фагоцитарную активность и отвечают за поглощение антигена. Созревание достигается среди прочих стимулов с помощью бактериального распознавания. Зрелые DC уменьшают фагоцитарную активность и усиливают другие свойства, такие как антигенное презентирование и способность к миграции к вторичным лимфатическим узлам. Созревание может детектироваться путем повышения уровня связанных молекул, таких как CD80 и CCR7. CD80 представляет собой важную костимулирующую молекулу, которая участвует в антигенном презентировании наряду с комплексом II гистосовместимости (МНСII). CCR7 представляет собой рецептор, который помогает миграции зрелых DC. Инфузированный M-SAA3 повышал уровень некоторых маркеров созревания, связанных с активацией DC, миграцией и антигенным презентированием (фиг. 5a-f).
Провоспалительные цитокины, такие как IL-8, INFγ и TNFα, подвергались положительной регуляции. Уровень маркеров CCR7 и CD80 также повышался. Наконец, экспрессия фермента синтазы оксида азота (iNOS) также повышалась при обработке М-SAA3.
Эти результаты иллюстрируют, что обработка SAA-3 повышала Оксид Азота в макрофагах, медиатор, который участвует в борьбе против патогенов и вырабатывается с помощью iNOS.
Эти исследования созревания DC выявили ключевую роль M-SAA3 как медиатора, который участвует в борьбе против патогенов путем усиления стимулирования иммунного ответа.

Последовательности
SEQ ID NO: 1: последовательность мРНК M-SAA3
CACCAGGAGCCTCAGCAGGAGGGCACGGCCACAGGATGAACCTTTCCACGGGCATCATTTTCTGCTTCCTGATCCTGGGCGTCAGCAGCCAGAGATGGGGGACATTCCTCAAGGAAGCTGGTCAAGGGGCTAAAGACATGTGGAGAGCTTACCAAGACATGAAAGAAGCCAACTACAGGGGTGCAGACAAATACTTCCACGCCCGTGGAAACTATGACGCTGCCCGAAGGGGACCTGGGGGTGCCTGGGCTGCTAAAGTGATCAGTAACGCCAGAGAGACTATTCAGGGAATCACAGACCCTCTGTTTAAGGGTATGACCAGGGACCAGGTACGGGAGGATTCGAAGGCCGACCAGTTTGCCAACGAATGGGGCCGGAGCGGCAAAGACCCCAACCACTTCAGACCTGCTGGCCTGCCTGACAAGTACTGAGCTGCCTCTCTCTCTGCTCAGGAGATGGGCTGTGAGTCCCTAAGGGCAGAGACACTGACCTAGAGAGTTCTCTGTCCTCAGAAGGCAGCAGATCTAATAAATGCTCAAGAGATGG
SEQ ID NO: 2: последовательность белка M-SSA3
MNLSTGIIFCFLILGVSSQRWGTFLKEAGQGAKDMWRAYQDMKEANYRGADKYFHARGNYDAARRGPGGAWAAKVISNARETIQGITDPLFKGMTRDQVREDSKADQFANEWGRSGKDPNHFRPAGLPDKY
SEQ ID NO: 3: оптимизированная последовательность гена M-SSA3 для экспрессии в Lactococcus lactis
CCATGGCAAATCTTTCAACAGGTATTATTTTTTGTTTTCTTATTTTAGGTGTTTCATCACAAGGTTGGGGTACATTTTTACGTGAAGCTGGTCAAGGTGCTAAAGATATGTGGCGTGCTTATCGTGATATGAAAGAAGCTAATTATAAAGGGGCTGATAAATATTTTCATGCTCGTGGTAATTATGATGCTGCTCAACGTGGTCCAGGTGGTGTTTGGGCTGCTGAAGTTATTCGTGAAGCTTTACAAGGTATTACAGATCCACTTTTTAAAGGTATGACACGTCCACAAGTTCGTGAAGATACAAAAGCTGATCAATTTGCTAATGAATGGGGTCAATCAGGTAAAGATCCAAATCATTTTGGTCCAGCTGCTTTACCAGATAAATATAAAGGTGAATTGAATTCAAAATTAGAAGGTAAACCAATTCCAAATCCATTATTAGGTTTAGATTCAACACGTACAGGACACCACCATCATCATCATTAATCTAGA
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CEVA SANTE ANIMALE SA
<120> Compositions and Method for controlling infections in non-human
mammals using acute phase proteins
<130> B1621PC00
<160> 19
<170> PatentIn version 3.3
<210> 1
<211> 546
<212> DNA
<213> bovine SAA-3
<400> 1
caccaggagc ctcagcagga gggcacggcc acaggatgaa cctttccacg ggcatcattt 60
tctgcttcct gatcctgggc gtcagcagcc agagatgggg gacattcctc aaggaagctg 120
gtcaaggggc taaagacatg tggagagctt accaagacat gaaagaagcc aactacaggg 180
gtgcagacaa atacttccac gcccgtggaa actatgacgc tgcccgaagg ggacctgggg 240
gtgcctgggc tgctaaagtg atcagtaacg ccagagagac tattcaggga atcacagacc 300
ctctgtttaa gggtatgacc agggaccagg tacgggagga ttcgaaggcc gaccagtttg 360
ccaacgaatg gggccggagc ggcaaagacc ccaaccactt cagacctgct ggcctgcctg 420
acaagtactg agctgcctct ctctctgctc aggagatggg ctgtgagtcc ctaagggcag 480
agacactgac ctagagagtt ctctgtcctc agaaggcagc agatctaata aatgctcaag 540
agatgg 546
<210> 2
<211> 131
<212> PRT
<213> bovine SAA-3
<400> 2
Met Asn Leu Ser Thr Gly Ile Ile Phe Cys Phe Leu Ile Leu Gly Val
1 5 10 15
Ser Ser Gln Arg Trp Gly Thr Phe Leu Lys Glu Ala Gly Gln Gly Ala
20 25 30
Lys Asp Met Trp Arg Ala Tyr Gln Asp Met Lys Glu Ala Asn Tyr Arg
35 40 45
Gly Ala Asp Lys Tyr Phe His Ala Arg Gly Asn Tyr Asp Ala Ala Arg
50 55 60
Arg Gly Pro Gly Gly Ala Trp Ala Ala Lys Val Ile Ser Asn Ala Arg
65 70 75 80
Glu Thr Ile Gln Gly Ile Thr Asp Pro Leu Phe Lys Gly Met Thr Arg
85 90 95
Asp Gln Val Arg Glu Asp Ser Lys Ala Asp Gln Phe Ala Asn Glu Trp
100 105 110
Gly Arg Ser Gly Lys Asp Pro Asn His Phe Arg Pro Ala Gly Leu Pro
115 120 125
Asp Lys Tyr
130
<210> 3
<211> 494
<212> DNA
<213> Artificial
<220>
<223> artificial optimized saa3 gene
<400> 3
ccatggcaaa tctttcaaca ggtattattt tttgttttct tattttaggt gtttcatcac 60
aaggttgggg tacattttta cgtgaagctg gtcaaggtgc taaagatatg tggcgtgctt 120
atcgtgatat gaaagaagct aattataaag gggctgataa atattttcat gctcgtggta 180
attatgatgc tgctcaacgt ggtccaggtg gtgtttgggc tgctgaagtt attcgtgaag 240
ctttacaagg tattacagat ccacttttta aaggtatgac acgtccacaa gttcgtgaag 300
atacaaaagc tgatcaattt gctaatgaat ggggtcaatc aggtaaagat ccaaatcatt 360
ttggtccagc tgctttacca gataaatata aaggtgaatt gaattcaaaa ttagaaggta 420
aaccaattcc aaatccatta ttaggtttag attcaacacg tacaggacac caccatcatc 480
atcattaatc taga 494
<210> 4
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 4
ctggacttcg agcaggagat 20
<210> 5
<211> 19
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 5
cccgtcagga agctcgtag 19
<210> 6
<211> 21
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 6
ttgagagtgg gccacactgt g 21
<210> 7
<211> 19
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 7
tgcacccact tttccttgg 19
<210> 8
<211> 19
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 8
ataaccaggt cattcaagg 19
<210> 9
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 9
attctgactt ctcttccgct 20
<210> 10
<211> 19
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 10
agcacgtgga ggccttgat 19
<210> 11
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 11
gcggatgatg acgaggtagc 20
<210> 12
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 12
gaaccgcacc atcactgaca 20
<210> 13
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 13
taatggtcca ggtcaggtgc 20
<210> 14
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 14
gaggcctgtt taccactgga 20
<210> 15
<211> 24
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 15
ctcatagata cttctaaggc acag 24
<210> 16
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 16
aacagccctc tggttcaaac 20
<210> 17
<211> 20
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 17
tcttgatggc agacaggatg 20
<210> 18
<211> 18
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 18
cacaacggca acatcagg 18
<210> 19
<211> 21
<212> DNA
<213> Artificial
<220>
<223> primer
<400> 19
taagcaggac tagaggcaac a 21
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к использованию белков острой фазы для терапии мастита, вызванного S. Aureus, у крупного рогатого скота. Применяют изоформу 3 сывороточного амилоида A (SAA-3) путем интрамаммарной инфузии в период сухостоя. Изобретение позволяет эффективно контролировать инфекцию и улучшать инволюцию молочной железы КРС во время периода запуска. 4 н. и 8 з.п. ф-лы, 8 ил., 1 табл., 4 пр.

Комментарии