Терапевтические композиции и способы применения для лечения рака - RU2720984C2
Код документа: RU2720984C2
Чертежи





Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям и способам лечения рака. Более конкретно, настоящее изобретение относится к композициям сконструированных онколитических вирусов для введения пациенту, страдающему раком, которые специфически лизируют опухолевые клетки и активно выделяют опухолевые клетки и клеточный детрит для антигенпрезентирующих клеток, с целью создания противоопухолевого иммунитета.
УРОВЕНЬ ТЕХНИКИ
Опухоли могут развиваться у раковых пациентов, поскольку иммунная система не способна выявлять опухолевые клетки как клетки, которые должны быть уничтожены. У большой части раковых пациентов опухолевые клетки экспрессируют аутологичные опухолевые антигены. Эти аутологичные опухолевые антигены, также называемые «неоантигены», могут вызывать защитный противоопухолевый иммунный ответ. Опухолевые клетки, или мембраны опухолевых клеток, подлежат интернализации антигенпрезентирующими клетками с целью индуцирования развития противоопухолевого иммунного ответа. Однако иммунная система у многих раковых пациентов демонстрирует «неосведомленность» в отношении опухолевых антигенов, которые ассоциированы с ранним развитием опухоли «скрытым» путем, так что опухоль является фактически «невидимой» для антигенпрезентирующих клеток (Pardoll, 2000; Clin Immunol. 95:S44-49, и Dunn et al., 2002; Nat Immunol; 3: 991-8).
Кроме того, микроокружение опухоли и местное цитокиновое окружение часто являются подавляющими в отношении иммунной функции и могут активно индуцировать анергию и гибель иммунных клеток (Malmberg, Cancer Immunol Immunother., 53: 879-92; Lugade et al.; J Immunol. 2005; 174: 7516-23 (2004); Schreiber et al., Science (New York, N.Y.), 331(6024), 1565-70 (2011)). Эффективное лечение опухолевых поражений требует два компонента: 1. Деструкцию поражений, которые являются достаточно большими, чтобы выявить их визуально посредством метода лучевой диагностики, и 2. Индуцирование защитного, системного противоопухолевого иммунного ответа против опухолевых антигенов. Такой иммунный ответ будет уничтожать любые не подлежащие лечению поражения (например, поражения, которые могут быть не доступны лечению, не удаляемы посредством операции) и приводит к иммунно опосредованному выявлению, регрессии и/или деструкции микрометастазов, которые не могут быть определены визуально и не определяются посредством методов лучевой диагностики. Часто размер опухоли тормозит эффективность системного противоопухолевого иммунного ответа в установленный срок. В дополнение к использованию активного противоопухолевого иммунитета для уменьшения размера опухоли часто необходимы хирургическое удаление или другие средства, такие как внутриопухолевая инъекция композиций.
В последнее время были разработаны онколитические вирусы, которые пригодны для селективного уничтожения опухолевых клеток посредством литической репликации и тем самым для уменьшения размера опухоли (Liu et al., World J Gastroenterol. 2013 Aug 21; 19(31):5138-43). Пригодные вирусы деактивируют, так чтобы они больше не являлись патогенными, т.е. не реплицировались в неопухолевых клетках и не убивали их, но так чтобы они могли тем не менее проникать и убивать опухолевые клетки. Один иллюстративный вирус, вирус простого герпеса (HSV), был предложен для применения с целью онколитического лечения рака. Был идентифицирован ряд мутаций HSV, которые тем не менее позволяют вирусу реплицироваться в культуре или в активно делящихся клетках in vivo (например, в опухолях), но которые предотвращают значительную репликацию в нормальной ткани.
В дополнение к HSV, для онколитического лечения рака была продемонстрирована перспектива для различных дополнительных вирусов. Комбинированное использование онколитического HSV с доставкой гена, кодирующего иммуномодулирующий белок, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), закодированный в геноме деактивированного вируса, как было продемонстрировано, обладает иммуностимулирующими свойствами против опухоли, подлежащей лечению, в частности после инактивации вирусных функций, которые обычно уменьшают иммунные ответы на HSV. Таким образом, при таком применении мутант онколитического HSV следовало бы инокулировать в первичную или вторичную опухоль, в которой возникала бы репликация и онколитическая деструкция опухоли. Проблема данного подхода состоит в том, что GM-CSF используется для мобилизации антигенпрезентирующих клеток в область поражения, но поглощение опухолевого материала этими клетками после этого является случайным. Антигенпрезентирующие клетки довольно эффективны в поглощении материала в виде небольших частиц и растворимых антигенов, но не работают при интернализированных клетках или более крупных фрагментах клеток.
Индуцирование защитного противоопухолевого иммунного ответа требует поглощения опухолевых клеток и клеточных компонентов антигенпрезентирующими клетками, затем процессинга опухолевых антигенов и их транспортировки антигенпрезентирующими клетками в дренирующие лимфатические узлы. В лимфатических узлах иммуногенные опухолевые антигенные пептиды презентируются антигенпрезентирующими клетками в ассоциации с молекулами МНС класса I или класса II для активации опухолеспецифических CD8+ и CD4+ T-клеток, соответственно. Только после того, как Т-клетки активируются процессированными и презентированными опухолевыми антигенными пептидами, эти лимфоциты пролиферируют, покидают лимфатические узлы и циркулируют в организме для поиска и уничтожения метастатических опухолевых клеток, экспрессирующих рассматриваемые опухолевые антигены. Вследствие этого, получение эффективного противоопухолевого иммунного ответа требует эффективного и активного выделения опухолевых клеток для антигенпрезентирующих клеток.
Вследствие этого, требуются композиции и способы нехирургического уменьшения размера опухоли посредством лизиса клеток и активного выделения опухолевых клеток, клеточного детрита и фрагментов мембран для рекрутинга антигенпрезентирующих клеток и обеспечения иммунного ответа. Также необходимы пути повышения эффективности интернализации антигенпрезентирующими клетками опухолевых клеток и фрагментов клеток в пределах микроокружения опухоли.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с первым аспектом, изобретение относится к онколитическому вирусу, содержащему нуклеиновую кислоту, кодирующую фермент гексозилтрансферазу.
В соответствии с дополнительным аспектом изобретение относится к фармацевтической композиции, содержащей онколитический вирус, как определено здесь, в комбинации с фармацевтически приемлемым носителем.
В соответствии с дополнительным аспектом изобретение относится к способу лечения индивида с новообразованием, который включает стадии:
i) экспрессии эндогенного фермента, доставляемого онколитическим вирусом, как определено здесь, по меньшей мере в одну раковую клетку для модифицирования гликозилирования клеточной мембраны; и
ii) индуцирования лизиса по меньшей мере одной раковой клетки, возникающего в результате введения онколитического вируса.
В соответствии с дополнительным аспектом изобретение относится к способу лечения рака, включающему введение терапевтически эффективного количества онколитического вируса, как определено здесь, нуждающемуся в лечении пациенту, страдающему раком или имеющему новообразование или опухоль.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
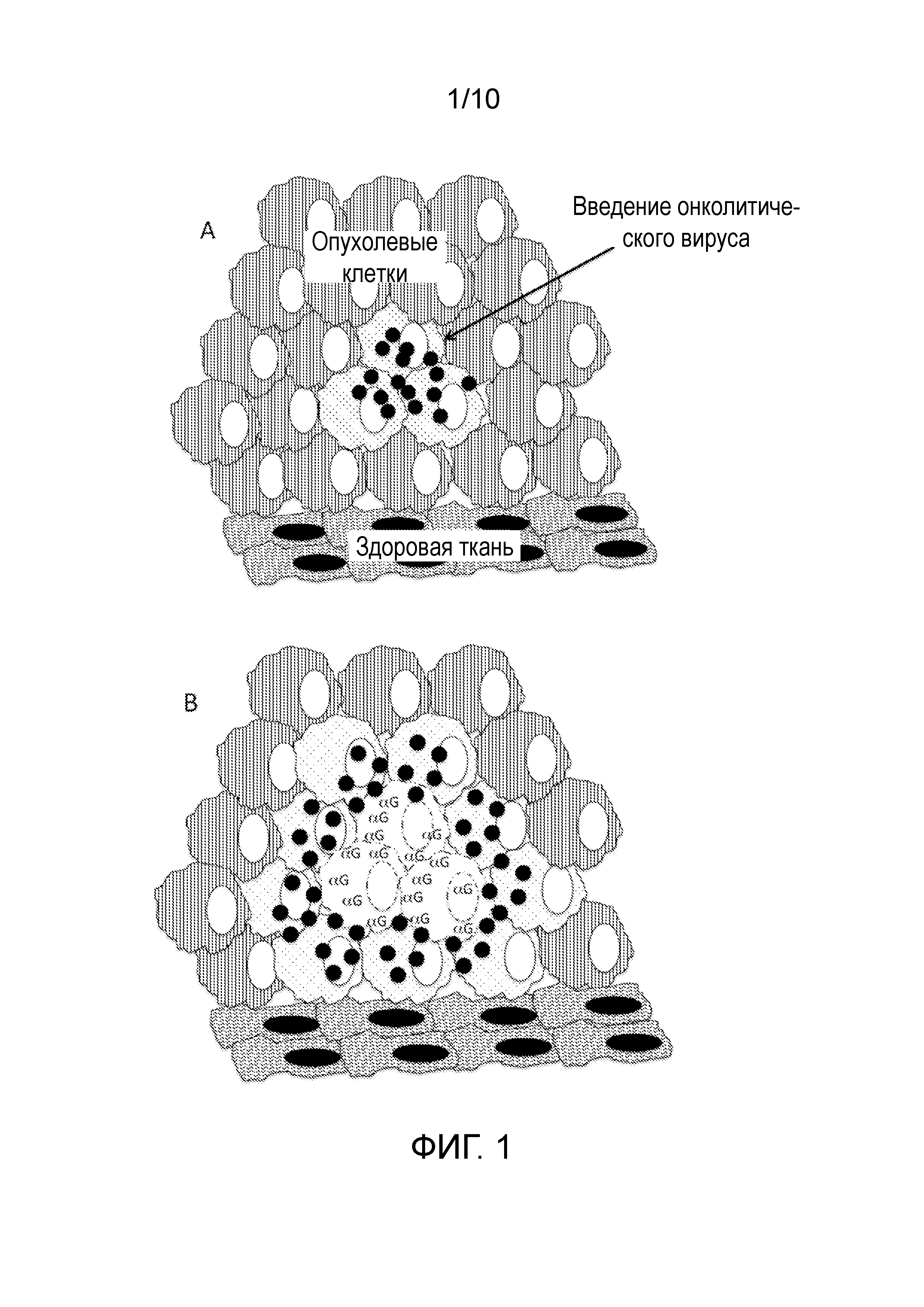
ФИГУРА 1: Представляет собой схематическое изображение серии клеточных событий, имеющих отношение к настоящим способам. Эти события включают A) введение сконструированных вирусных композиций, B) инфицирование, репликацию, экспрессию альфа 1,3-галактозилтрансферазы и альфа-gal эпитопов, и C) онколизис и рекрутинг антигенпрезентирующих клеток в область опухоли.
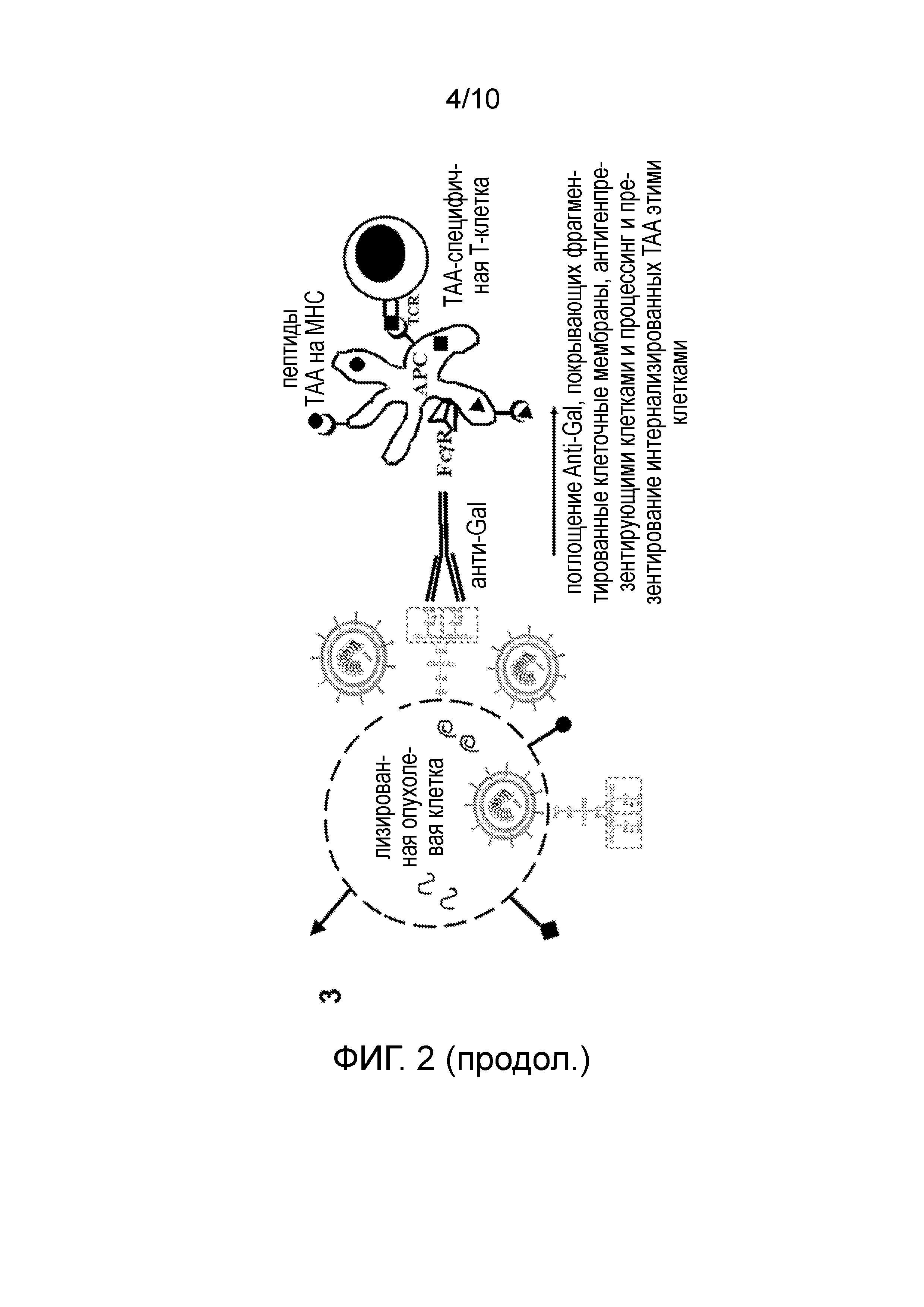
ФИГУРА 2: Представляет собой схематическое изображение опухолевой клетки, инфицированной онколитическим вирусом, содержащим альфа 1,3-галактозилтрансферазу, и экспрессирующей альфа-gal эпитопы на своей клеточной поверхности до лизиса. Альфа-gal-меченные фрагменты мембран интернализированы антигенпрезентирующими клетками. (1) Опухолевые клетки содержат опухолеассоциированные антигены (TAA) в цитоплазме и на клеточной мембране, которые являются уникальными для опухоли и для каждого отдельного пациента. Эти TAА представлены на клеточной мембране в виде (•,


ФИГУРА 3: Представляет собой схематическую хронологию для появления альфа-1,3 галактозилтрансферазы (α1,3GT) и альфа-gal эпитопов в клетках HeLa, трансдуцированных аденовирусом, содержащим ген α1,3GT (AdαGT).
ФИГУРА 4: Представляет собой график, демонстрирующий экспрессию альфа-gal эпитопов на клетках мышиной меланомы B16, трансдуцированных AdαGT, как показано посредством связывания IB4 (BS) лектина (A) Bandeiraea simplicifolia и мышиного анти-Gal IgG (B). A. Экспрессия альфа-gal эпитопов на клетках B16AdαGТ, (т.е. клетках B16, трансдуцированных AdαGT [1×1010 инфекционных единиц (ИЕ)/мл]), как измерено посредством проточной цитометрии клеток, окрашенных BS-лектином. Лектин спарен с флуоресцеином (FITC). Тонкая линейная гистограмма с заполненной точками областью клеток B16Adcont(т.е. клеток меланомы, трансдуцированных аденовирусом, не содержащим вставленные гены); Толстая линейная гистограмма - клетки B16AdαGТ. B. Связывание анти-Gal в сыворотке мыши, нокаутированной по альфа 1,3-галактозилтрансферазе с альфа-gal эпитопами на клетках BL6AdαGТ (


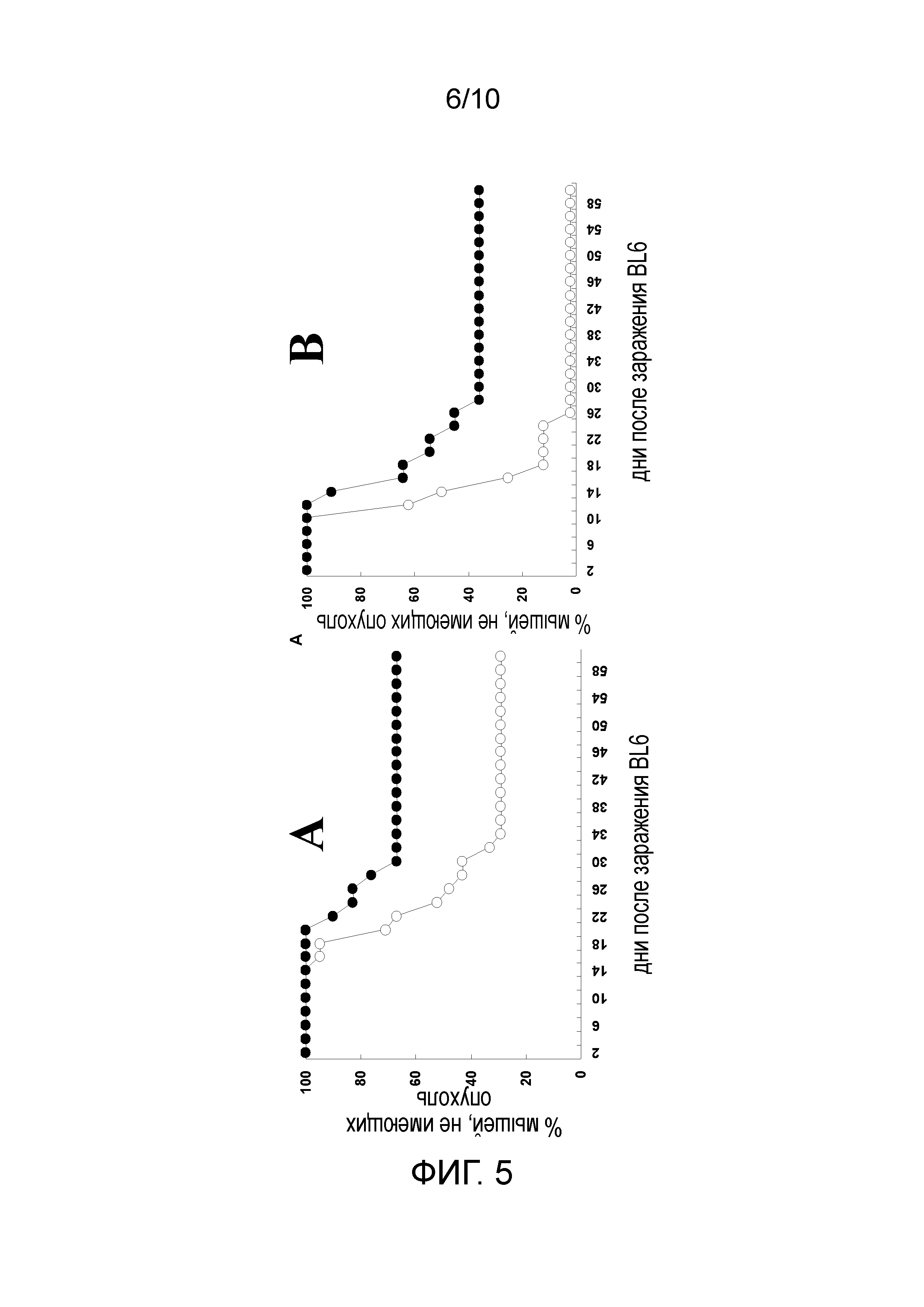
ФИГУРА 5: Представляет собой график, демонстрирующий защиту нокаутированных по альфа 1,3-галактозилтрансферазе мышей от заражения опухолью B16 с использованием вакцины B16AdαGT. Нокаутированных по альфа 1,3-галактозилтрансферазе мышей, продуцирующих анти-Gal, вакцинировали 2×106 облученных клеток B16, экспрессирующих альфа-gal эпитопы (B16AdαGT)(


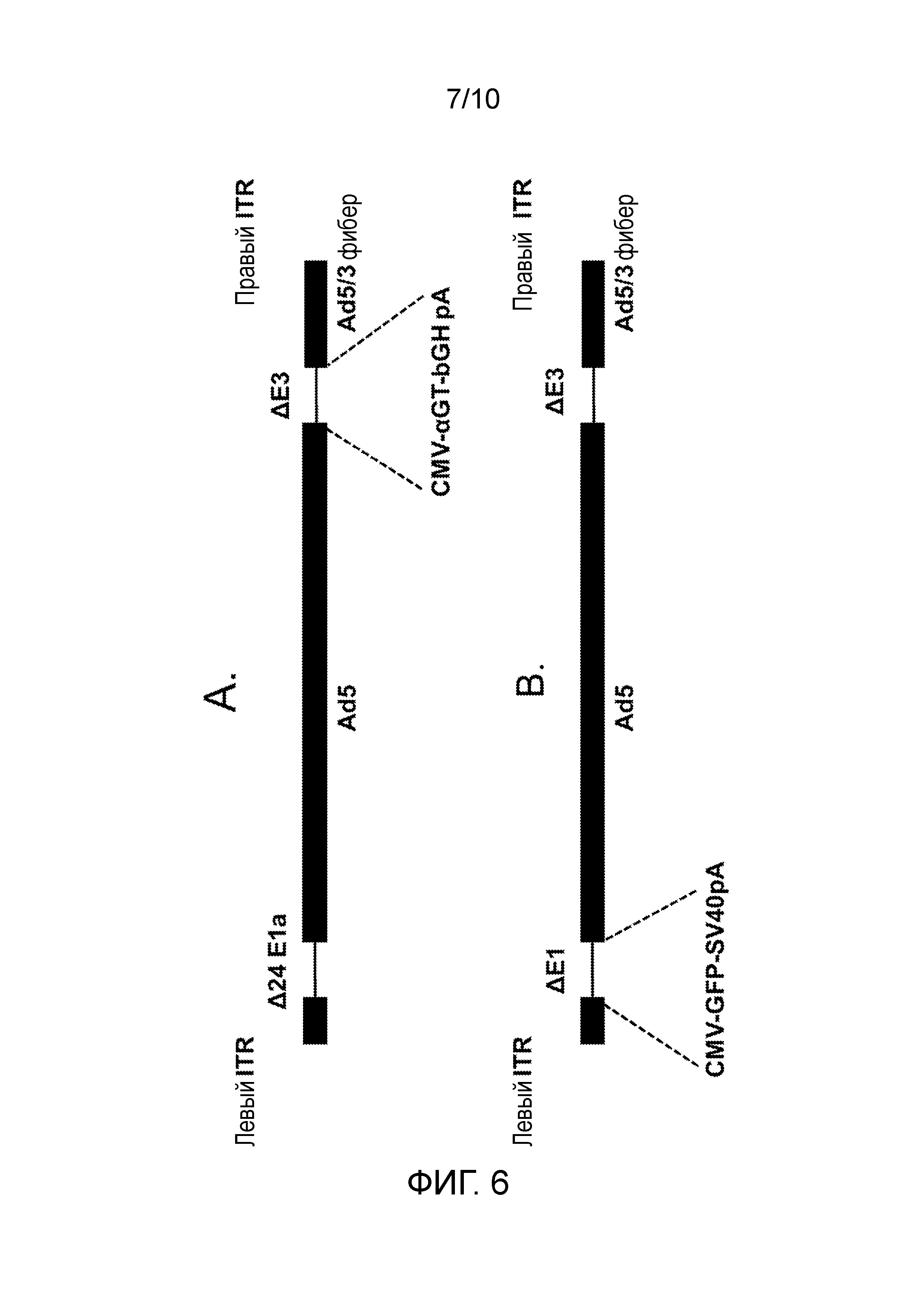
ФИГУРА 6: Представляет собой геномные структуры CRAd-αGT (A) и CRAd-GFP (B). Геномная последовательность Ad5 была модифицирована для экспрессии knob фибера Ad3. Последовательности E3 или E1 были модифицированы посредством делеции или замещения нуклеотидными последовательностями генов α1,3GT или GFP, соответственно.
ФИГУРА 7: Количественная оценка жизнеспособности раковых клеток человека после инфицирования CRAd-αGT. Клетки A549 и A375 засеяли в 96-луночные планшеты, инфицированные серийным титрованием вируса, начиная с 1,2×1011 вирусных частиц (VP)/мл CRAd-αGT или 9,7×1010 ВЧ/мл контрольного вируса CRAd-GFP, и инкубировали в течение 72 часов. Жизнеспособность клеток определяли количественно, используя люминисцентный анализ жизнеспособности клеток Cell Titre Glo (Promega).
ФИГУРА 8: Визуализация жизнеспособности раковых клеток человека после инфицирования CRAd-αGT. Клетки A549 (рака легкого) и A375 (меланомы) засеяли в 24-луночные планшеты, инфицированные 3,6×107 вирусных частиц (ВЧ)/мл CRAd-αGT или 1,9×1010 ВЧ/мл контрольного вируса CRAd-GFP, и инкубировали в течение 72 часов. Визуализацию проводили с применением световой микроскопии при 10-кратном увеличении.
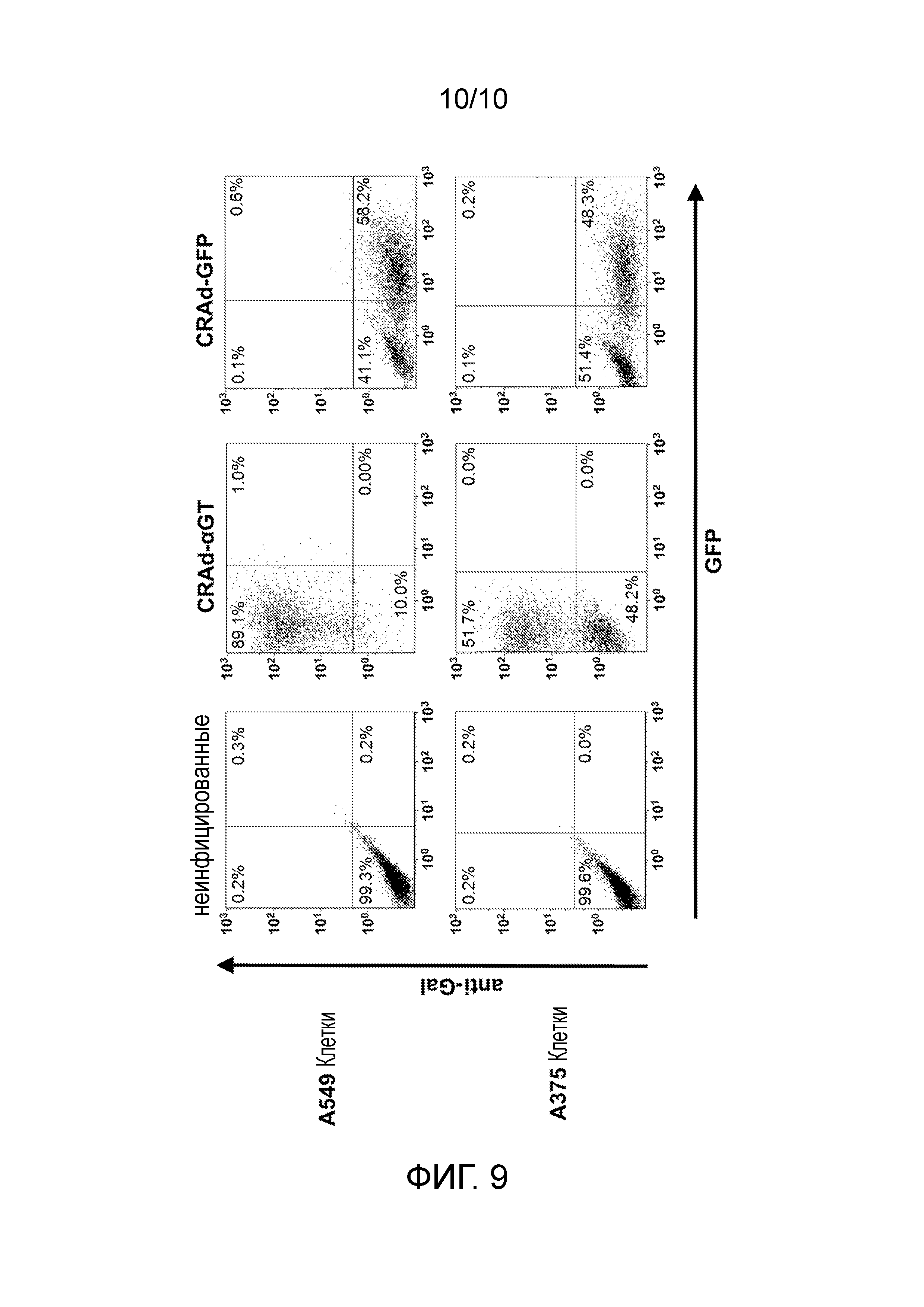
ФИГУРА 9: Анализ связывания анти-Gal с раковыми клетками человека после инфицирования CRAd-αGT. Клетки A549 и A375 инфицировали либо 1,44×106 вирусных частиц (ВЧ)/мл CRAd-αGT, либо 1,16×106 ВЧ/мл контрольного вируса CRAd-GFP. Клетки анализировали на связывание анти-Gal и экспрессию GFP посредством проточной цитометрии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с первым аспектом изобретение относится к онколитическому вирусу, содержащему нуклеиновую кислоту, кодирующую фермент гексозилтрансферазу.
Настоящее изобретение относится к композициям и способам для комбинирования лизиса опухолевых клеток, индуцированного онколитическим вирусом, с активным иммуноопосредованным выделением и рекрутингом антигенпрезентирующих клеток (APC) в область опухоли. Сконструированные онколитические вирусы, которые экспрессируют гексозилтрансферазу, такую как альфа 1,3-галактозилтрансфераза, будут модифицировать гликозилирование инфицированных клеток, так чтобы они экспрессировали альфа-gal эпитопы на клеточных мембранах перед вирусиндуцированным лизисом. Когда опухолевые клетки впоследствии лизируются вирусом, фрагменты клеточных мембран будут опсонизироваться натуральными анти-Gal антителами, которые связывают альфа-gal эпитопы для формирования иммунных комплексов. Анти-Gal антитела будут усиливать фагоцитоз фрагментов клеток опухоли с помощью APC через взаимодействие между Fc-участком анти-Gal антител и Fcγ-рецепторами (FcγR) на APC. Подобным образом, интактные опухолевые клетки, которые экспрессируют альфа-gal эпитопы после инфицирования вирусом, также будут опсонизироваться анти-Gal и поглощаться APC через FcγR. Поглощение антигена через FcγR приводит к активации и созреванию APC, которые процессируют опухолевые антигены для презентирования на молекулах MHC и мигрируют в дренирующие лимфатические узлы, где они презентируют опухолевые антигены Т-клеткам. Путем этого процесса генерируется защитный иммунный ответ против личных опухолевых антигенов пациента.
В дополнение к вышесказанному, экспрессия альфа-gal эпитопов на поверхности клеток и последующее образование их комплекса с анти-Gal антителами приведут к активации комплемента. Активация комплемента приводит к: высвобождению хемотаксических пептидов, которые мобилизуют APC в опухоль; опсонизации интактных опухолевых клеток и фрагментов мембран опухолевых клеток молекулами C3b комплемента; опосредованному комплементом лизису интактных опухолевых клеток. Интактные опухолевые клетки и фрагменты опухолевых клеток, опсонизированные молекулами C3b комплемента, связываются и интернализируются APC через взаимодействие между C3b и рецепторами комплемента на APC.
Вследствие этого, в дополнение к онколитическому вирусиндуцированному лизису инфицированных опухолевых клеток, опсонизация опухолевых клеток и фрагментов клеток анти-Gal антителами и последующая активация комплемента и образование иммунных комплексов, которые фагоцитируются APC, приводит к защитному противоопухолевому иммунному ответу. Вследствие этого, разрушение опухолевой массы посредством комбинации вирусиндуцированного онколизиса и иммунной активации улучшается, чем при отдельном введении либо нерепликативного вируса, экспрессирующего альфа 1,3-галактозилтрансферазу, либо одного репликационно-компетентного онколитического вируса, не экспрессирующего альфа 1,3-галактозилтрансферазу.
Таким образом, настоящее изобретение относится к улучшенному лечению различных типов рака и даже лечению таких типов, которые до сих пор считались неизлечимыми.
Настоящее изобретение направлено на композиции и способы применения онколитических вирусов, которые были модифицированы для доставки гетерологичной последовательности нуклеиновых кислот, кодирующей ген гликозилтрансферазы, такой как альфа 1,3-галактозилтрансфераза. Предпосылка заключается в том, что вирус специфически инфицирует опухолевые клетки, которые затем продуцируют и экспрессируют функциональный фермент альфа 1,3-галактозилтрансферазу. Фермент альфа 1,3-галактозилтрансфераза в последующем продуцирует и интегрирует альфа-gal эпитопы на поверхности опухолевых клеток. Интеграция альфа-gal эпитопов на мембране опухолевой клетки возникает перед лизисом клеток, индуцированным онколитическим вирусом, так что полученные впоследствии остатки клеточных мембран метятся альфа-gal эпитопами. Не желая быть связанными каким-либо конкретным механизмом, предполагается, что связывание меченных альфа-gal фрагментов опухолевых клеток природными анти-Gal антителами активирует систему комплемента (как делает большинство взаимодействий антиген/антитело) и генерирует расщепляющие комплемент хемотаксические факторы, которые мобилизуют APC в подлежащую лечению опухоль. Опухолевые клетки и фрагменты мембран опухолевых клеток, которые экспрессируют альфа-gal эпитопы, опсонизируются анти-Gal и активно выделяются для фагоцитоза APC, мобилизованными в опухоль. Предполагается, что подход, описанный в данной заявке, механистически отличается от предыдущих подходов к онколитическому вирусу, который экспрессирует GM-CSF, где APC произвольным образом интернализируют растворимые молекулы, которые находятся по соседству, посредством пиноцитоза с минимальным фагоцитозом материала в виде частиц. При настоящем подходе мембраны опухолевых клеток более эффективно фагоцитируются APC, поскольку фрагменты опухолевых клеток или интактные опухолевые клетки экспрессируют альфа-gal эпитопы, которые в последующем связываются с анти-Gal антителами. Взаимодействие между Fc-фрагментом анти-Gal антител, покрывающих фрагменты опухолевых клеток/интактные опухолевые клетки, и FcγR на APC стимулируют APC к интернализации, процессингу и презентации антигенов Т-клеткам. Дополнительно, активация комплемента и последующая опсонизация фрагментов опухолевых клеток и интактных опухолевых клеток белком C3b комплемента делает способными APC связывать комплемент с рецепторами для эффективной интернализации, процессинга и презентации опухолевых антигенов Т-клеткам.
Способы по изобретению парадоксальны, поскольку они, по-видимому, не направлены на модификацию гликозилирования поверхности клетки опухоли репликацией компетентного онколитического вируса для выделения фрагментов клеточных мембран и интактных клеток для поглощения APC.
Экспрессия и интеграция клеточных мембран альфа-gal эпитопов перед вирусиндуцированным лизисом клеток предоставляет способ мечения фрагментов мембран опухолевых клеток для рекрутинга APC и активного поглощения APC, индуцирующий защитный противоопухолевый иммунный ответ по сравнению с менее эффективными способами, описанными ранее. Не ограничиваясь каким-либо конкретным механизмом, на Фигурах 1 и 2 предоставлены принципиальные схемы, которые показывают один возможный механизм, посредством которого, как предполагается, заявленные композиции и способы обладают терапевтическим действием.
В вариантах осуществления настоящего раскрытия будут задействованы, если не указано иное, методики медицины, органической химии, биохимии, молекулярной биологии, фармакологии и т.п., которые находятся в рамках специальных знаний предшествующего уровня техники. Такие методики полностью объяснены в литературе.
Следует заметить, что в описании и прилагаемой формуле изобретения, формы единственного числа включают формы множественного числа, если контекст явно не определяет иное. В настоящем описании и последующей формуле изобретения будет сделана ссылка на ряд терминов, которые, как будет определено, имеют следующие значения, если не будет очевидным противоположное намерение.
Перед описанием ряда вариантов осуществления предоставлены и должны использоваться следующие определения, если не указано иное.
В одном варианте осуществления фермент представляет собой фермент галактозилтрансферазу. В дополнительном варианте осуществления фермент представляет собой фермент альфа 1,3-галактозилтрансферазу.
I. Композиции
Композиции, используемые в настоящем описании, содержат онколитический вирус и последовательность нуклеиновых кислот, кодирующую галактозилтрансферазу, и необязательно фармацевтически приемлемый носитель, пригодный для введения. Таким образом, в соответствии с дополнительным аспектом изобретение относится к фармацевтической композиции, содержащей онколитический вирус, как определено здесь, в комбинации с фармацевтически приемлемым носителем.
A. Вирусы
В одном варианте осуществления вирус сконструирован, чтобы быть онколитическим. В альтернативном варианте осуществления вирус является природным онколитическим.
В одном варианте осуществления онколитический вирус содержит рекомбинантный связывающий домен, специфичный для маркера стволовой опухолевой клетки.
В одном варианте осуществления вирус является репликационно-ограниченным и лизирует только раковые клетки, не затрагивая нераковые клетки.
Онколитические вирусы с ограниченной репликацией являются особенно пригодными для композиций и способов, описанных в настоящем описании. Такие вирусы реплицируются в раковых клетках и убивают них. Они могут дополнительно кодировать гетерологичный ген (или гены), который кодирует белок, который обладает дополнительными противоопухолевыми свойствами. Термин онколитический вирус обозначает, что он включает любой вирус, который инфицирует/проникает и лизирует раковые клетки. Идеальный онколитический вирус эффективно убивает клинически значимую фракцию раковых клеток пациента путем прямого цитолиза с минимальной деструкцией ткани, не являющейся неопластической.
Онколитические вирусы являются предпочтительными (из перспективы безопасности), если они по своей природе не являются патогенными (например, по своей природе не инфицируют людей) или вызывают только легкое заболевание у людей (например, аденовирусы вызывают гриппоподобные симптомы). Вирусы, которые успешно используют в одобренных вакцинах и вводят тысячам или миллионам человек (например, вакцина от натуральной оспы), по этой причине также являются предпочтительными. Если вирус является патогенным у людей и связан с серьезным заболеванием (например, нейротоксичность, ассоциированная с некоторыми штаммами вируса герпеса), то является предпочтительным создание множественных делеций или мутаций в вирусном геноме, чтобы сделать их специфичными для раковых клеток и снизить риск того, что одно событие генетической рекомбинации с эндогенным вирусом приведет к полностью патогенному штамму. Желательными являются проникновение в выделенную опухолевую клетку и специфичность репликации. Более того, при использовании у пациентов вирус должен быть безопасным и непатогенным. Онколитические вирусы, полученные от многих различных типов вирусов, описаны Liu etal. (Liu et al., Nature Clinical Practice Oncology 4: (2) 101-117, 2007). Среди этих оболочечных вирусов наиболее значимыми являются такие как, но не ограничиваясь, вирус простого герпеса (HSV), вирус коровьей оспы (VV) и парамиксовирусы, такие как вирус кори (MeV), вирус болезни Ньюкасла (NDV) или рабдовирусы, такие как вирус везикулярного стоматита (VSV). Помимо применения немодифицированного вируса дикого типа, генная инженерия может дополнительно повысить безопасность и эффективность онколитических вирусов.
Отличительная особенность векторов онколитических вирусов, ограничивающих репликацию, которые кодируют гетерологичный ген, состоит в том, что начальная доза гетерологичного гена может многократно быть увеличена in vivo посредством репликации в раковых клетках и высвобождения из раковых клеток в пределах инъецированного поражения (поражений). На это указывает, например, Liu et al. (Liuetal., 2003), который описывает свойства вектора мутантного вируса простого герпеса-1 (HSV-1), который кодирует гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). В совокупности данные виды терапии рака называются «усиленные терапевтические вакцины» (Bauzon&Hermiston, 2014). Инженерия оболочечных белков может ограничивать инфицирование вирусом опухолевыми клетками, и введение «суицидальных» генов может усилить терапевтические эффекты (Nakamura et al., Expert Opin. Bio. Ther. 4: (10): 1685-1692, 2004); Liu et al., Nature Clinical Practice Oncology 4: (2) 101-117, 2007; Liu et al., Gene Therapy, 10(4), 292-303, 2003).
Вирусы могут быть получены от хорошо изученных лабораторно-адаптированных штаммов, которые поддерживались несколькими последовательными пассажами через иммортализованные клеточные линии в культуре тканей. Однако опухоли человека у пациентов растут более медленно, чем иммортализованные клеточные линии в оптимизированных условиях культивирования, и могут иметь другие факторы окружающей среды и развития, которые ограничивают скорость метаболизма и деления клеток (такие как гипоксическая окружающая среда, которая может существовать в центре крупной опухолевой массы, результат недостаточной нутритивной поддержки). Вследствие этого предпочтительно выбирать вирус для оптимального роста in vivo (in situ), а не исходя из характеристик его роста в культуре тканей. Например, штамм HSV-1, полученный из клинического изолята JS1 (полученный от пациента и подвергшийся только короткому времени размножения в культуре тканей) использовали для создания онколитических вирусов для лечения раковых пациентов (Liu, 2003). Важным соображением при выборе клинического изолята является то, что оптимальные условия могут быть идентифицированы так, чтобы его можно было размножать in vitro, что необходимо для увеличения и получения клинического материала. Предполагается, что мутации в геноме улучшают репликацию вируса в культуре тканей, не ухудшая его рост в опухолях in vivo.
В дополнение к выбору вирусного вектора, основанного на его способности реплицироваться и лизировать опухолевую ткань у пациентов, предусмотрены дополнительные мутации в геноме, которые дополнительно улучшают его способность к репликации in vivo. Например, из клинического штамма HSV-1, JS1, удалены два гена (Liu, 2003). Первая делеция, ICP34.5, ограничивает репликацию вируса раковыми клетками; вторая, ICP47, приводит к ранней экспрессии US11, который кодирует вирусный белок, блокирующий фосфорилирование белка хозяина, PKR. PKR является ключевым компонентом врожденного иммунного ответа на инфицирование вирусом - при фосфорилировании он останавливает трансляцию белка в инфицированных клетках и ограничивает репликацию вируса. Вследствие этого, репликация in vivo мутантного штамма JS1 ICP34.5-/ICP47 усиливается по сравнению с штаммом дикого типа (без мутаций).
В ряде вариантов осуществления онколитический вирус представляет собой онколитический репликационно-компетентный аденовирус, вирус коровьей оспы, вирус герпеса, реовирус, вирус кори или вирус болезни Ньюкасла.
В другом варианте осуществления вирус представляет собой РНК- или ДНК-вирус человеческого или нечеловеческого происхождения, такой как аденовирус, герпесвирус, вирус коровьей оспы, вирус кори, вирус болезни Ньюкасла, автономные парвовирусы, вирус везикулярного стоматита (VSV) или реовирус.
Иллюстративные онколитические вирусы, показанные в таблице 1, в настоящее время находятся в клинических испытаниях и могут быть модифицированы, как описано в настоящем описании, для использования в предлагаемых терапевтических методах. В различных вариантах осуществления онколитический вирус представляет собой оболочечный вирус, полученный из вирусных семейств герпесвирид, поксвирид, рабдовирид или парамиксовирид, предпочтительно из семейства парамиксовирид, рода морбилливирус.

Некоторые онколитические вирусы генетически модифицированы для приобретения опухолеспецифической репликации (аденовирус, герпесвирус, вирус коровьей оспы), тогда как другие являются опухолеспецифическими вирусами по своей природе (реовирус, вирус болезни Ньюкасла, автономный парвовирус, определенные штаммы кори и вирус везикулярного стоматита (VSV)).
i) Аденовирус
В одном варианте осуществления онколитический вирус представляет собой аденовирус. Данные представлены в настоящем описании в примерах 1-3 и 8 и Фигурах 4-9, которые демонстрируют положительные результаты, достигнутые с применением аденовирусов, содержащих альфа 1,3-галактозилтрансферазу. Аденовирусы человека являются безоболочечными, двухнитевыми ДНК-вирусами приблизительно 30-38 kB. Отличительной особенностью аденовирусов является то, что они кодируют ряд вирусных белков, которые ингибируют наиболее важные регуляторные белки хозяина. Некоторые из этих регуляторных белков хозяина (такие как p53) являются дефектными при многих видах рака. Вследствие этого, делеция вирусного гена делает мутантные вирусы селективными для репликации при видах рака с дефектным регуляторным белком хозяина.
Таким образом, мутация гена E1B-55kD аденовируса, ингибирующего белок р-53, (например, в вирусе dl1520), является селективной для опухолей, которые имеют ограниченную или отсутствующую функцию p53. Функция p53 утрачена у большинства видов рака человека через различные механизмы, включая генную мутацию, сверхэкспрессию p53-связывающих ингибиторов (например, mdm2, папилломавируса E6 человека), и утрата p53-ингибирующего пути модулируется p14ARF.
Подобным образом, делеции в консервативной области 2 E1a имеют дефектное связывание белка ретинобластомы (RB), и эти мутанты исследуют для использования против опухолей с нарушениями пути RB (например, в вирусе dl922/947).
Другой подход к получению селективной репликации аденовирусов в раковых клетках состоит в регулировании экспрессии продукта вирусного гена E1a, используя промотор, специфичный для исследуемой ткани или рака. Например, его используют для нацеливания онколитических аденовирусов на рак простаты (посредством генетической модификации генома для введения промотора/энхансера простатспецифического антигена (PSA) перед геном E1a.
В одном варианте осуществления вирус представляет собой условно реплицирующийся аденовирус (CRAd), в котором репликация ограничивается опухолевыми клетками. Было продемонстрировано, что CRAd избирательно реплицируются в раковых клетках, вызывая их лизис и смерть (Fueyo et al., 2000; Kanno et al., 2012; Bramante et al., 2015). CRAd были образованы с использованием аденовируса 5 (Ad5), который был генетически модифицирован для экспрессии регулятора волокна аденовируса 3 (Ad3) для создания химерного вируса Ad5/3 (Kanerva et al., 2003; Kim et al., 2013).
Таким образом, в одном варианте осуществления CRAd представляет собой химерный вирус Ad5/3. Химерный вирус Ad5/3 способен связываться и проникать в клетки, используя CD46, Ad3-рецептор, а не коксаки-аденовирусный рецептор (CAR), который связывается Ad5. Это является преимуществом, поскольку многие опухоли имеют вариабельную экспрессию CAR, при том, что все ядерные клетки экспрессируют CD46 (Ulasov et al., 2006). Вирус становится условно-репликативным посредством введения делеции 24 пар оснований (Δ24) в константной области 2 (CR2) вирусного гена немедленного раннего ответа (E1a) (Kanerva et al., 2003). Таким образом, в одном варианте осуществления химерный вирус Ad5/3 дополнительно содержит делецию 24 пар оснований (Δ24) в константной области 2 (CR2) вирусного гена немедленного раннего ответа (E1a), в настоящем описании известного как Ad5/3-Δ24 CRAd. Эта мутация приводит к вирусному белку E1, который неспособен связывать белок ретинобластомы (Rb) для индуцирования S-фазы в пределах клетки (Fueyo et al., 2000). Вследствие этого, вирус неспособен реплицироваться в неделящихся нормальных клетках, но эффективно реплицируется в клетках, которые имеют неактивный путь Rb/p16, фенотип, обозначенный как общий для всех видов рака (Sherr, 1996). Химерный, условно-реплицирующийся Ad5/3-Δ24 CRAd может быть дополнительно модифицирован посредством замещения гена (E3) ранней области аденовируса трансгеном, что приводит к Ad5/3-Δ24 CRAd, который специфически продуцирует трансген во время репликации (Koski et al., 2010; Kanerva et al., 2013; Bramante et al., 2015). Химерный, условно-реплицирующийся Ad5/3-Δ24 CRAd дополнительно модифицирован путем замещения гена ранней области (E3) аденовируса трансгеном альфа 1,3-галактозилтрансферазы, что приводит к Ad5/3-Δ24 CRAd, который специфически продуцирует альфа 1,3-галактозилтрансферазу во время репликации. Таким образом, в одном варианте осуществления Ad5/3-Δ24 CRAd дополнительно содержит трансгенную альфа 1,3-галактозилтрансферазу, в настоящем описании известную как CRAd-αGT. Данные представлены в настоящем описании в примере 8 и Фигурах 6-9, которые демонстрируют, что человеческий рак легкого и клетки меланомы, инфицированные CRAd-αGT, экспрессируют альфа-gal эпитопы на поверхности клеток и связываются анти-Gal антителами перед вирусиндуцированным лизисом.
ii) Вирус герпеса
В одном варианте осуществления онколитический вирус представляет собой вирус герпеса. Методология представлена в настоящем описании в примерах 4-7, которые демонстрируют, как можно достичь положительных результатов с применением вируса герпеса, содержащего альфа-1,3 галактозилтрансферазу. Вирус герпеса (HSV) представляет собой оболочечный, двухнитевой ДНК-вирус приблизительно 152 kbp, и имеет природную тропность к нейронных и слизистых клеток. Как предполагается, HSV может быть полезным как в качестве вектора доставки генов в нервную систему и какую-либо другую область и для онколитического лечения рака. При обоих применениях вирус, однако, должен быть деактивирован, так чтобы он больше не был патогенным, но так, чтобы он все еще мог проникать в клетки и выполнять желаемую функцию. Таким образом, для доставки нетоксичных генов в намеченные клетки с применением HSV становится понятно, что в большинстве случаев экспрессия генов немедленного раннего ответа из вируса должна быть предотвращена/минимизирована. Для онколитического лечения рака, которое может также включать доставку гена (генов), улучшающих терапевтический эффект, был идентифицирован ряд мутаций HSV, которые все-таки позволяют вирусу реплицироваться в культуре или в активно делящихся клетках in vivo (например, в опухолях), но которые предотвращают значительную репликацию в нормальной ткани. Такие мутации включают разрушение генов, кодирующих ICP34.5, ICP6 и тимидинкиназу. Среди них, вирусы с мутациями ICP34.5 или ICP34.5 вместе с мутациями, например, ICP6, до сих пор показывали наиболее благоприятный профиль безопасности. Вирусы с делецией только ICP34.5, как было показано, реплицируются во многих типах опухолевых клеток in vitro и селективно реплицируются в искусственно индуцированных опухолях головного мозга у мышей, щадя при этом окружающие ткани. Ранние клинические испытания также показали свою безопасность у человека. Примеры таких вирусов и использования описаны в публикациях PCT WO 2001/053506, WO 98/004726, WO 98/051809 и WO 99/060145.
В одном варианте осуществления онколитический вирус представляет собой вирус HSV1. Один иллюстративный штамм онколитического вируса представляет собой штамм HSV1 JS 1, размещенный в Европейской коллекции культивируемых клеток (ECACC), CAMR, Sailsbury, Wiltshire SP4 0JG, United Kingdom, 2 января 2001 года под номером доступа 01010209. Штаммы онколитического вируса, такие как этот, могут быть модифицированы, как описано в настоящем описании, для экспрессии ферментов галактозилтрансфераз для использования в предоставленных способах.
iii) Вирус коровьей оспы
В одном варианте осуществления онколитический вирус представляет собой вирус коровьей оспы. Вирус коровьей оспы представляет собой оболочечный, двухнитевой ДНК-вирус приблизительно 200 kB. Этот вирус реплицируется в цитоплазме, перенося со своей инфекционной частицей ферменты, необходимые для репликации ДНК и транскрипции ее генов. Вирус коровьей оспы обладает многими качествами, которые делают его хорошим онколитическим вирусом. Он имеет большой геном со способностью принимать множественные чужеродные гены, он имеет широкий круг хозяев, он быстро реплицируется, и его можно легко рекомбинировать для изготовления вирусных мутантов. Были установлены хорошие показатели безопасности посредством использования вируса коровьей оспы в качестве противооспенной вакцины.
iv) Вирус кори
В одном варианте осуществления вирус представляет собой вирус кори (MeV) или вакцинный штамм MeV, такой как штамм Edmonston (MeVEdm). MeV использует два оболочечных гликопротеина (белок слияния (F) и белок гемагглютинин (H)) для проникновения в выделенную клетку. Белок F представляет собой трансмембранный белок I типа, тогда как белок H представляет собой трансмембранный домен II типа, т.е. его амино-конец выходит непосредственно в области цитоплазмы. Таким образом, оба белка содержат трансмембранную и цитоплазматическую область. Одной известной функцией белка F является опосредование слияния вирусных мембран с клеточными мембранами клетки хозяина. Функции, характерные для белка H, включают распознавание рецептора на намеченной мембране и поддержку белка F в его функции слияния с мембраной. Прямое и высокоэффективное слияние мембран на поверхности клеточной мембраны является особым свойством вируса кори и морбилливирусов, тем самым отличая их от многих других оболочечных вирусов, которые становятся эндоцитозированными и будут сливаться только при падении рН при эндоцитозе. Оба белка организованы на вирусной поверхности в правильной структуре плотно упакованных спайков, H-тетрамеров и F-тримеров (Russell et al., Virology 199:160-168, 1994).
Штамм Edmonston MeV (MeVEdm) использует единственный белок в качестве основного рецептора, а именно белок, который, как известно, является регулятором фактора активации комплемента, CD46 (Gerlier et al., Trends Microbiol. 3:338-345, 1995). CD46 экспрессируется на всех ядерных клетках человека. Большинство клинических изолятов вируса кори, однако, не может эффективно использовать CD46 в качестве рецептора. Человеческий SLAM (сигнальная лимфоцит-активирующая молекула, также известная как CDw150) представляет собой недавно обнаруженный мембранный гликопротеин, который экспрессируется на некоторых Т- и В-клетках, а также обнаруживается, что он действует как клеточный рецептор для MeV, включая штамм Edmonston (Tatsuo et al., Nature 406(6798):893-7, 2000). Точные биологические функции и взаимодействия белков H и F MeV остаются в значительной степени неясными.
В клиническом развитии рака существует ряд онколитических вирусов, которые могут быть модифицированы с включением кодирующей последовательность нуклеиновой кислоты, кодирующей гексозилтрансферазу, такую как альфа1,3-галактозилтрансфераза. Примеры таких онколитических вирусов включают Ad-mda7 (p53 Inc), Ad-p53 (p53 Inc.), CG-0070 (Cold Genesys, Inc.), DNX-2401 (DNAtrix, Inc.), DWP-418 (Daewoong Pharmaceutical), HSV, экспрессирующий huIL-12 (Univ. Alabama Birmingham), G-47 Delta (Univ. Tokyo Hospital), ганцикловир/ADV-TK (Shenzhen Tiandakang), GLONC-1 (Genelux Corp.), GLONC-2 (Genelux Corp.), GLONC-3 (Genelux Corp.), HF-10 (Takara Holdings), HSV-1716 (Virttu Biologics), JX-929 (Jennerex Bioterapeutics), KH-901 (Chengdu Kanghong Pharmaceuticals), вакцину MV-NIS (Mayo Clinic), Онколитический NDV-HUJ (Hadassah medical), OBP-301 (Oncolys BioPharma), Онколитический AdV (Erasmus MC), ONCOS-102 (Oncos Therapeutics), ORCA-010 (Orca Therapeutics), парвовирус H-1 (Oryx GmbH), пексастимоген девацирепвек (Jennerex Bioterapeutics), PV-701 (Wellstat Biologics), талимоген лахерпарепвек (Amgen), TG-1042 (Ascend Biopharmaceuticals), VCN-01 (VCN Biosciences) и VirRx-007 (p53 Inc.).
Вирусы по изобретению инфицируют и реплицируются в опухолевых клетках, в последующем убивая опухолевые клетки. Таким образом, такие вирусы являются репликационно-компетентными. Предпочтительно, они селективно репликационно-компетентны в опухолевых клетках. Это означает, что они либо реплицируются в опухолевых клетках, а не в неопухолевых клетках, либо что они более эффективно реплицируются в опухолевых клетках, чем в неопухолевых клетках. Клетки, в которых вирус способен реплицироваться, являются пермиссивными клетками.
Измерение способности к селективной репликации может быть проведено с помощью описанных в настоящем описании тестов для измерения способности к репликации и уничтожения опухолевых клеток, а также, при необходимости, проанализировано посредством статистических методов, упомянутых в настоящем описании.
Вирус изобретения предпочтительно обладает большей способностью, чем немодифицированный родительский штамм, инфицировать или реплицироваться в опухолевой клетке, уничтожать опухолевые клетки или распространяться между клетками в тканях. Предпочтительно эта способность является статистически значимо большей способностью. Например, вирус в соответствии с изобретением может иметь в 1,1 раза, 1,2 раза, 1,5 раза, 2 раз, 5 раз, 10 раз, 20 раз, 50 раз или 100 раз большую, чем способность немодифицированного родительского штамма в отношении тестируемого свойства.
Свойства вирусного штамма в отношении опухолевых клеток можно измерить любым способом, известным в данной области. Например, способность вируса инфицировать опухолевую клетку может быть определена количественно путем измерения дозы вируса, необходимой для заражения определенного процента клеток, например, 50% или 80% клеток. Способность реплицироваться в опухолевой клетке можно измерять с помощью измерений роста, как это выполнено в Примерах, например, посредством измерения роста вируса в клетках в течение 6, 12, 24, 36, 48 или 72 часов или дольше. Подобным образом, способность вируса лизировать опухолевые клетки может быть определена количественно посредством измерения соотношения живых (по сравнению с мертвыми) клеток в культурах, инкубированных с заданной дозой вируса в течение периода, составляющего 6, 12, 24, 36, 48 или 72 часов или дольше.
B) Последовательности и Промоторы Гетерологичных нуклеиновых кислот
Вирусы по изобретению могут быть модифицированы, чтобы они несли последовательности гетерологичных нуклеиновых кислот. В одном варианте осуществления гетерологичная нуклеиновая кислота кодирует гексозилтрансферазу. В одном варианте осуществления последовательность нуклеиновых кислот кодирует галактозилтрансферазу. В одном конкретном варианте осуществления последовательность нуклеиновых кислот кодирует альфа 1,3-галактозилтрансферазу. Термины «α1,3-галактозилтрансфераза», «альфа-1,3-галактозилтрансфераза», «альфа1,3GT», «α1,3GT», «гликопротеин альфа-галактозилтрансфераза 1» и «GGTA1», как используется в настоящем описании, относится к любому ферменту, способного синтезировать альфа-gal эпитопы. Фермент продуцируется у большинства млекопитающих, за исключением людей, приматов и мартышкообразных. Углеводная структура, продуцируемая ферментом, является иммуногенной у человека, а большинство здоровых людей имеют высокие титры природных анти-альфа-gal антител, также называемых «анти-Gal» антителами. В некоторых вариантах осуществления термин «альфа 1,3GT» относится к мышиному альфа1,3GT (например, Mus musculus - нуклеотиды от 460 до 1680 GenBank Номер доступа NM_010283) и к продукту его гена, а также к его функциональным аналогам у млекопитающих (например, других мартышкообразных, полуобезьян и неприматных млекопитающих, но не мартышкообразных, обезьян и людей). В некоторых вариантах осуществления термин «альфа1,3GT» относится к общему гену мармозеток (например, Callithrix jacchus - GenBank Номер доступа S71333), бычьему альфа 1,3GT (например, Bos taurus - GenBank Номер доступа NM_177511), кошачьему альфа1,3GT (например, Felis catus - GenBank Номер доступа NM_001009308), овечьему альфа1,3GT (например, Ovis aries - GenBank Номер доступа NM_001009764), крысиному альфа1,3GT (например, Rattus norvegicus - GenBank Номер доступа NM_145674) и свиному альфа1,3GT (например, Sus scrofa - GenBank Номер доступа NM_213810). Некоторые варианты осуществления содержат функциональный вариант альфа1,3GT млекопитающих, который отличается от последовательностей альфа1,3GT дикого типа млекопитающих, например, в менее чем 1-5% остатков. В частности, варианты альфа1,3GT включают, но без ограничения, встречающиеся в природе функциональные варианты альфа1,3GT млекопитающих, а также чтобы найти применение в композициях и способах настоящего изобретения предусматриваются не встречающиеся в природе варианты, созданные посредством рекомбинантных или других средств (например, замещения, делеции или добавления 1, 2, 3, 4 или 5 аминокислот, предпочтительно соответствующих остатку от функционального гомолога альфа1,3GT млекопитающих). В других вариантах осуществления используют процессированные формы альфа1,3GT млекопитающих, которые сохраняют каталитическую активность (например, GGTA1 не содержащий 90 аминокислотной N-концевой стеблевой области). Однако делеция 3 аминокислот из C-конца этого фермент приводит к его полной инактивации (Henion, T.R., B.A. Macher, F. Anaraki и U. Galili, Glycobiology 4:193-201, 1994).
Альфа1,3-галактозилтрансфераза была ранее сконструирована в аденовирусе и использована для клеточного переноса (Deriy et al. Glycobiology, 12(2), 135-44 2002; Deriy et al. Cancer Gene Therapy, 12(6), 528-39, 2005). Альфа 1,3-галактозилтрансферазу никогда не конструировали для экспрессии онколитическими вирусами для комбинированного способа лизиса/иммунизации, описанного в настоящем описании.
В вариантах осуществления, описанных в настоящем описании, гетерологичная последовательность нуклеиновых кислот предпочтительно функционально связана с контрольной последовательностью, обеспечивающей возможность экспрессии указанного гена в клетке in vivo. Вирусы по изобретению могут, таким образом, использоваться для доставки гетерологичных последовательностей нуклеиновых кислот в клетку in vivo, когда они будут экспрессироваться.
В соответствии с дополнительным аспектом изобретение относится к способу получения онколитического вируса, как определено здесь, который включает стадию включения нуклеиновой кислоты, кодирующей фермент гексозилтрансферазу, в геном указанного онколитического вируса.
Гетерологичная последовательность нуклеиновых кислот может быть вставлена в вирусный геном посредством любой пригодной методики, такой как гомологическая рекомбинация штаммов HSV, например, плазмидными векторами, несущими ген, окруженный последовательностями HSV.
Гетерологичная последовательность нуклеиновых кислот может быть вставлена в пригодный плазмидный вектор, содержащий последовательности вируса герпес, с применением методик клонирования, хорошо известных в данной области. Таким образом, в одном варианте осуществления указанная стадия включения содержит клонирование. Гетерологичная последовательность нуклеиновых кислот может быть вставлена в любую локализацию вирусного генома, предоставленная, чтобы онколитические свойства еще сохранялись. Гетерологичная последовательность нуклеиновых кислот может быть вставлена во множественные сайты в пределах вирусного генома. Например, в геном может быть вставлено от 2 до 5 генов.
Транскрибированная последовательность гетерологичной последовательности нуклеиновых кислот предпочтительно функционально связана с контрольной последовательностью, обеспечивающей возможность экспрессии гена в опухолевой клетке. Термин «функционально связана» относится к непосредственной близости, в которой описанные компоненты находятся во взаимосвязи, обеспечивающей им возможность функционировать надлежащим для них образом. Контрольная последовательность, «функционально связанная» с кодирующей последовательностью, лигируется таким образом, что в условиях, сравнимых с контрольной последовательностью, достигается экспрессия кодирующей последовательности.
Контрольная последовательность содержит промотор, позволяющий экспрессию гетерологичной последовательности нуклеиновых кислот и сигнал для окончания транскрипции. Промотор выбирают из промоторов, которые функциональны у млекопитающих, предпочтительно в опухолевых клетках человека. Промотор может быть получен из промоторных последовательностей генов эукариот. Например, промотор может быть получен из генома клетки, в которой должна происходить экспрессия гетерологичного гена, предпочтительно млекопитающего, предпочтительно опухолевой клетки человека. Что касается эукариотических промоторов, они могут быть промоторами, которые функционируют универсальным образом (такие как промоторы бета-актина, тубулина) или, в качестве альтернативы, способом, специфическим для опухоли. Могут также быть промоторы, которые реагируют на конкретные стимулы, например, промоторы, которые связывают рецепторы к стероидными гормонами. Могут также использоваться вирусные промоторы, например, промотор длинного концевого повтора вируса лейкоза мыши Moloney (MMLV LTR) или другие ретровирусные промоторы, промотор IE или человеческого цитомегаловируса (CMV) или промоторы генов вируса герпеса, включая те, которые стимулируют экспрессию транскриптов, связанных с латентностью.
Кассеты экспрессии и другие пригодные конструкты, содержащие гетерологичную последовательность нуклеиновых кислот и контрольные последовательности, могут быть изготовлены с применением обычных методик клонирования, известных квалифицированным специалистам в данной области (см., например, Sambrook et al., 1989, Molecular Cloning--A laboratory manual; Cold Spring Harbor Press).
Также может быть выгодным, чтобы промоторы были индуцируемыми, так чтобы уровни экспрессии последовательности гетерологичной нуклеиновой кислоты можно было регулировать во время жизни опухолевой клетки. Индуцируемый означает, что уровни экспрессии, полученные с использованием промотора, можно регулировать. Например, вирус изобретения может дополнительно содержать гетерологичную последовательность нуклеиновых кислот, кодирующую слитый белок активатора транскрипции tet-репрессора/VP16 под контролем сильного промотора (например, промотора CMV IE), а гетерологичная последовательность нуклеиновых кислот может быть под контролем промотора, реагирующего на слитый белок активатора транскрипции tet репрессора/VP16, описанный ранее (Gossen и Bujard, 1992, Gossen et al., 1995). Таким образом, в этом примере экспрессия гетерологичной последовательности нуклеиновых кислот может зависеть от присутствия или отсутствия тетрациклина.
В геноме вируса герпеса могут быть размещены множественные гетерологичные гены. Вследствие этого вирус изобретения может содержать две или более гетерологичные последовательности нуклеиновых кислот, например, от 2 до 3, 4 или 5 гетерологичных последовательностей нуклеиновых кислот. Можно вводить более одного гена и ассоциированных контрольных последовательностей в специфический штамм онколитического вируса либо на одном сайте, либо на нескольких сайтах в геноме вируса. В качестве альтернативы могут быть использованы пары промоторов (одинаковых или различных промоторов, обращенных в противоположных направлениях друг от друга, причем каждый из них может влиять на экспрессию гетерологичной последовательности нуклеиновой кислоты.
В другом варианте осуществления иммуномодулирующий белок коэкспрессируется с ферментом галактозилтрансферазой. Предпочтительно иммуномодулирующий белок будет усиливать противоопухолевую активность вируса. Более предпочтительно, белок представляет собой GM-CSF или другой цитокин, хемокин, такой как RANTES, или другую иммуномодулирующую молекулу, такую как B7.1, B7.2 или CD40L. Наиболее предпочтительной иммуномодулирующей молекулой является GM-CSF. Таким образом, в одном варианте осуществления онколитический вирус содержит последовательность нуклеиновых кислот, кодирующую GM-CSF. Иммуномодулирующий ген может представлять собой любой аллельный вариант гена дикого типа, или он может представлять собой мутантный ген. Иммуномодулирующий ген будет получен от млекопитающего, предпочтительно грызуна или примата, более предпочтительно от человека.
C) Фармацевтические Композиции
Фармацевтические композиции онколитических вирусов настоящего изобретения могут быть составлены любым общепринятым способом с использованием одного или нескольких физиологически приемлемых носителей или эксципиентов. Фармацевтические композиции настоящего изобретения могут быть составлены для ряда способов введения, включая системное, местное или локальное введение. Методики и готовые формы можно найти, например, в Remington's Pharmaceutical Sciences, Meade Publishing Co., Easton, Pa.
В одном варианте осуществления композиция онколитического вируса составлена для внутривенного введения, внутримышечного введения, интраперитонеального введения, интратуморального введения, подкожного введения, перорального введения, ректального введения, интравагинального введения, интраназального введения, чресслизистого введения или чрескожного введения.
В дополнительном варианте осуществления композиция онколитического вируса составлена для внутривенного введения, внутримышечного введения, интраперитонеального введения, подкожного введения, перорального введения, ректального введения, интравагинального введения, интраназального введения, чресслизистого введения или чрескожного введения.
Доставка подходящего онколитического вируса в раковые клетки, подлежащие лечению, может выполняться с использованием «раздетого» вируса или путем инкапсуляции вируса в носитель, например, в наночастицы, липосомы или другие везикулы.
Введение осуществляется предпочтительно в «терапевтически эффективном количестве», что является достаточным для того, чтобы проявить пользу для индивида. Фактическое вводимое количество, а также скорость и период действия будут зависеть от природы и тяжести опухоли, подлежащей лечению. Назначение лечения, например, решения о дозировке и т. д., входят в компетенцию врачей общей практики и других врачей и, как правило, учитывают расстройство, подлежащее лечению, состояние отдельного пациента, место доставки, способ введения и другие факторы, известные специалистам-практикам. Примеры методик и протоколов, упомянутых выше, можно найти в Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins.
Онколитический вирус можно вводить в любой терапевтически эффективной дозе. Терапевтически эффективные дозы могут составлять приблизительно, но не ограничиваясь, 103, приблизительно 104, приблизительно 105, приблизительно 106, приблизительно 107, приблизительно 108 или приблизительно 109бляшкообразующих единиц (БОЕ).
Для системного введения предпочтительной является инъекция, включая интратуморальную, внутримышечную, внутривенную, интраперитонеальную и подкожную. С целью инъекции фармацевтические композиции настоящего изобретения могут быть приготовлены в жидких растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса или раствор Рингера. В дополнение, фармацевтические композиции могут быть приготовлены в твердой форме и повторно растворены или суспендированы непосредственно перед использованием. Также пригодны лиофилизированные формы фармацевтической композиции.
Системное введение может также осуществляться через чресслизистые или чрескожные средства. Для чресслизистого или чрескожного введения в составе используют пенетранты, соответствующие проницаемому барьеру. Такие пенетранты обычно известны в данной области и включают, например, для чресслизистого введения, желчные соли и производные фузидовой кислоты. В дополнение, для облегчения проникновения могут использоваться детергенты. Чресслизистое введение может происходить с использованием назальных спреев или суппозиториев. Для местного введения векторные частицы изобретения могут быть в составе мазей, бальзамов, гелей или кремов, как в целом известно в данной области. Раствор для промывания также можно использовать местно для лечения повреждения или воспаления, чтобы ускорить заживление.
Фармацевтические композиции могут быть приготовлены для парентерального введения посредством инъекции, например, посредством болюсной инъекции или непрерывной инфузии. Препараты для инъекций могут быть представлены в виде стандартной лекарственной формы, например, в ампулах или в мультидозовых контейнерах, с необязательно добавленным консервантом. Фармацевтические композиции могут быть дополнительно приготовлены в виде суспензий, растворов или эмульсий в масляных или водных основах, и могут содержать другие агенты, включая суспендирующие, стабилизирующие и/или диспергирующие агенты.
Изобретение также включает набор, содержащий фармацевтическую композицию изобретения и устройство доставки для доставки композиции субъекту. В качестве примера устройством доставки может быть сжимаемая распылительная бутылка, распылительная бутылка с отмеренной дозой, аэрозольное распылительное устройство, атомайзер, устройство подачи сухого порошка, самовыталкивающее устройство для нанесения растворителя/порошка, шприц, иглу, тампон или контейнер, отмеряющий дозу. Набор может дополнительно содержать обучающий материал, как описано в настоящем описании.
II) Способы
Композиции вируса по изобретению могут использоваться в способах терапии рака человека или животного организма. В частности, вирусы по изобретению могут использоваться в онколитическом лечении рака, либо с дополнительной пролекарственной терапией или стимуляцией противоопухолевого иммунного ответа, либо без них. Композиции вируса по изобретению могут использоваться в терапевтическом лечении любой солидной опухоли у млекопитающего, предпочтительно у человека.
Таким образом, в соответствии с дополнительным аспектом, изобретение относится к способу лечения индивида с новообразованием, который включает стадии:
i) экспрессии эндогенного фермента, доставляемого онколитическим вирусом, как определено здесь, по меньшей мере в одну раковую клетку для модифицирования гликозилирования клеточной мембраны; и
ii) индуцирования лизиса по меньшей мере одной раковой клетки, возникающего в результате введения онколитического вируса.
В одном варианте осуществления способ направлен на лечение индивида с раком посредством введения эффективного количества композиции онколитического вируса, в котором инфицирование вирусом вызывает экспрессию гексозилтрансферазы перед лизисом.
В одном варианте осуществления онколитический вирус вводят в эффективном количестве, чтобы инфицировать по меньшей мере одну раковую клетку индивида.
В другом варианте осуществления альфа-gal эпитопы вставляют в мембрану инфицированной клетки в течение 10 часов после инфицирования.
В другом варианте осуществления альфа-gal эпитопы вставляют в мембрану инфицированной клетки до лизиса инфицированной клетки.
В одном варианте осуществления способ направлен на лечение индивида с раком.
В другом варианте осуществления способ направлен на лечение индивида с опухолью.
В другом варианте осуществления способ направлен на лечение индивида с раком.
В одном варианте осуществления мембрана модифицированной клетки активно выделяет фрагменты мембраны для рекрутинга антигенпрезентирующих клеток.
В другом варианте осуществления фермента достаточно для экспрессии альфа-gal эпитопов на мембране инфицированной клетки перед лизисом.
В другом варианте осуществления экспрессии альфа1,3-галактозилтрансферазы достаточно для индуцирования эффективного иммунного ответа на инфицированную клетку после лизиса.
В другом варианте осуществления альфа-gal эпитопов достаточно для привлечения антигенпрезентирующих клеток в область опухоли.
В другом варианте осуществления фермент экспрессируется в течение 4 часов после инфицирования.
В другом варианте осуществления альфа-gal эпитопов достаточно для связывания анти-gal антител в области опухоли.
Опосредованная анти-Gal деструкция опухолей, описанная в этом способе, может быть достигнута посредством инъекции геннотерапевтических векторов, содержащих ген альфа1,3-галактозилтрансферазы. В одном варианте осуществления настоящее изобретение рассматривает способ лечения пациентов с меланомой с множественными метастазами, включающий внутриопухолевые инъекции репликационно-компетентного онколитического вируса, содержащего ген альфа1,3-галактозилтрансферазы. В одном варианте осуществления внутриопухолевая инъекция композиций вируса приводит к трансдуцированным опухолевым клеткам, экспрессирующим альфа-gal эпитопы, в котором эти опухолевые клетки индуцируют интратуморальное воспаление до лизиса. Интратуморальное воспаление мобилизует антигенпрезентирующие клетки, такие как дендритные клетки, макрофаги и определенные B-клетки. Инфицированные клетки могут быть либо лизированы сконструированными репликационно-компетентными вирусами композиций, описанных в настоящем описании, либо в качестве альтернативы уничтожены природным анти-Gal антителом, связанным с альфа-gal эпитопами на трансдуцированных клетках через механизмы комплементзависимого цитолиза (CDC) или антителозависимого клеточноопосредованного цитолиза (ADCC). Хотя понимать механизм изобретения не является необходимым, предполагается, что опсонизированные анти-Gal опухолевые мембраны будут активно выделять фрагменты мембран опухолевых клеток или интактных опухолевых клеток для антигенпрезентирующих клеток и таким образом, способствовать защитному противоопухолевому иммунитету.
В другом варианте осуществления в настоящем изобретении рассматривается способ лечения пациентов с колоректальным раком, имеющих множественные метастазы в ободочной кишке и в печени, включающий внутриопухолевые инъекции онколитического вируса, содержащего ген альфа 1,3-галактозилтрансферазы. В одном варианте осуществления инъекция включает колоноскопию или лапароскопию как средство доставки вирусного вектора в опухолевые поражения.
В другом варианте осуществления в настоящем изобретении рассматривается способ лечения пациентов с раком легкого, имеющих множественные метастазы в легких, включающий внутриопухолевые инъекции онколитического вируса, содержащего ген альфа 1,3-галактозилтрансферазы. В одном варианте осуществления инъекция включает бронхоскопию.
В другом варианте осуществления в настоящем изобретении рассматривается способ лечения пациентов с раком мочевого пузыря, включающий онколитический вирус, содержащий вектор вирусного гена альфа 1,3-галактозилтрансферазы. В одном варианте осуществления вектор вводят посредством цистоскопии.
В другом варианте осуществления в настоящем изобретении рассматривается способ лечения пациентов с аденокарциномой поджелудочной железы, включающий онколитический вирус, содержащий вектор вирусного гена альфа 1,3-галактозилтрансферазы. В одном варианте осуществления вектор вводят посредством эндоскопии или лапароскопии.
В другом варианте осуществления в настоящем изобретении рассматривается способ лечения пациентов с раком молочной железы, содержащий вектор вирусного гена альфа 1,3-галактозилтрансферазы. В одном варианте осуществления вектор вводят посредством инъекции непосредственно в опухоль.
Введение онколитического вируса, содержащего вектор вирусного гена альфа 1,3-галактозилтрансферазы, может быть выполнено в любую солидную опухоль или лимфому, которая достижима для интратуморальной доставки гена альфа 1,3галактозилтрансферазы. Например, интратуморальная доставка описана в US 7820628.
Альтернативные способы доставки гена альфа 1,3-галактозилтрансферазы могут быть выполнены также с любым типом вирусного и невирусного вектора, который может доставлять гены. Например, эти способы включают, но без ограничения, аденовирусный вектор, аденовирусный вирус-хелпер, ретровирусный вектор, лентивирусный вектор, векторы депротеинизированной ДНК, вирус герпеса или векторы депротеинизированной РНК или ДНК-векторы.
В другом варианте осуществления в настоящем изобретении рассматривается способ введения векторов, содержащих ген альфа 1,3-галактозилтрансферазы, посредством инъекции в меланомные поражения или любое другое опухолевое поражение, в результате чего эпитопы вставляются в мембраны опухолевых клеток. Как и в случае опухолевых клеток, трансдуцированных онколитическим вирусом, содержащим ген альфа 1,3-галактозилтрансферазы, анти-Gal IgG будет связываться с мембранами опухолевых клеток, экспрессирующих альфа-gal эпитопы, и будет нацеливать их для антигенпрезентирующих клеток для получения системного иммунного ответа также против нелеченных опухолевых поражений, которые экспрессируют опухолевые антигены. Квалифицированный специалист в данной области должен признать, что в настоящем изобретении рассматривается создание адаптивного противоопухолевого иммунитета, обусловленного нацеливанием анти-Gal антителом для антигенпрезентирующих клеток посредством любой композиции, вводимой в опухолевую массу, что приводит к связыванию in situ этого природного антитела с опухолевыми клетками.
A) Введение
Вирусы по изобретению можно использовать у пациента, предпочтительно пациента человека, нуждающегося в лечении. Пациентом, нуждающемся в лечении, является индивид, страдающий раком, предпочтительно индивид с солидной опухолью. Целью терапевтического лечения является улучшение состояния пациента. Как правило, терапевтическое лечение, использующее вирус изобретения, облегчает симптомы рака.
В соответствии с дополнительным аспектом изобретение относится к способу лечения рака, включающему введение терапевтически эффективного количества вируса по изобретению пациенту, страдающему раком или имеющему новообразование или опухоль, нуждающемуся в лечении.
В соответствии с дополнительным аспектом изобретение относится к онколитическому вирусу, как определено здесь, или к фармацевтической композиции, как определено здесь, для применения в лечении рака.
Введение онколитического вируса по изобретению индивиду, страдающему опухолью, будет, как правило, убивать клетки опухоли, таким образом уменьшая размер опухоли и/или предотвращая распространение злокачественных клеток из опухоли, при этом также мобилизуя антигенпрезентирующие клетки (APC) в область опухоли и индуцируя защитный противоопухолевый иммунный ответ.
Для получения фармацевтической композиции один способ введения терапии включает комбинировние вируса с фармацевтически приемлемым носителем или разбавителем.
Пригодные носители и разбавители включают изотонические солевые растворы, например, фосфатно-буферный солевой раствор. Композиции, описанные в настоящем описании, можно вводить с использованием обычных путей введения, чтобы способствовать инфицированию вирусом области опухоли.
В одном варианте осуществления композиции вводят посредством инъекции (например, интраперитонеальной, внутримышечной, внутривенной, подкожной), ингаляции или инсуффляции (например, либо через рот, либо через нос чресслизистым или интраназальным способом) или посредством перорального, буккального, парентерального или ректального путей введения.
В одном варианте осуществления композицию вводят посредством инъекции непосредственно в намеченную ткань, которой может быть опухоль или кровеносный сосуд, кровоснабжающий опухоль. Количество вводимого вируса в случае HSV находится в диапазоне, составляющем от 104 до 1010 бляшкообразующих единиц (БОЕ), предпочтительно от 105 до 108 БОЕ, более предпочтительно приблизительно от 106 до 108 БОЕ. Как правило, для инъекции следует использовать вплоть до 500 мкл, как правило, от 1 до 200 мкл, предпочтительно от 1 до 10 мкл фармацевтической композиции вируса и фармацевтически приемлемого пригодного носителя или разбавителя. Однако для некоторых видов использования онколитической терапии также можно использовать более крупные объемы вплоть до, но не ограничиваясь, 10 мл, в зависимости от опухоли и участка инокуляции.
Описанные пути введения и дозы предназначены только в качестве руководства, поскольку квалифицированный специалист может легко определить оптимальный путь введения и дозировки. Дозировку можно определить в соответствии с различными параметрами, особенно в соответствии с локализацией опухоли, размером опухоли, возрастом, массой и состоянием пациента, подлежащего лечению, и пути введения. Дозировку и частоту дозирования можно сначала оптимизировать преклинически посредством изучения свойств вируса в культуре тканей и в пригодной животной модели.
Для получения фармацевтической композиции вирус можно скомбинировать с фармацевтически приемлемым носителем или разбавителем. Пригодным носителем для большинства вирусов будет забуференный физиологический раствор, такой как фосфатно-буферный солевой раствор (PBS). Фармацевтическая композиция будет идеально составлена, чтобы сделать возможным введение соответствующей дозы вируса в объеме вплоть до 1 мл, хотя могут быть случаи, когда вводят объем вплоть до 10 мл. В случаях, когда объемы опухолевого поражения индивида считаются слишком маленькими для лечения оптимальной дозой, возможно, что оптимальную дозу вводят в виде лечения множественных поражений, и каждую вводят в виде части общей оптимальной дозы. Также предусматривается, что для получения эффективного противоопухолевого ответа может потребоваться несколько доз. Интервал между дозами может быть определен на основе данных эффективности, полученных на доклинических моделях, или из клинического опыта, полученного с аналогичным штаммом вируса.
Предпочтительно вирус вводят посредством инъекции непосредственно в опухоль. Вирус также можно вводить системно или посредством инъекции в кровеносный сосуд, кровоснабжающий опухоль. Вирус также можно вводить в виде интравезикальной обработки; как можно было бы использовать для лечения рака мочевого пузыря. Оптимальный путь введения будет зависеть от размера опухоли.
В одном варианте осуществления способ представляет собой способ лечения индивида, имеющего новообразование, включающий введение эффективного количества модифицированного онколитического вируса, содержащего нуклеиновую кислоту, кодирующую фермент галактозилтрансферазу.
Таким образом, онколитические вирусы настоящего изобретения могут быть составлены для введения, например, посредством инъекции, ингаляции или инсуффляции (через рот либо через нос) или посредством перорального, буккального, парентерального или ректального введения.
B) Показания
В конкретных вариантах осуществления онколитические вирусы, пригодные для настоящих способов, можно вводить больному с раком простаты, молочной железы, легкого, печени, эндометрия, мочевого пузыря, ободочной кишки или шейки матки; аденокарциномой; меланомой; лимфомой; глиомой или саркомами, такими как саркомы мягких тканей и костей.
В дополнительном варианте осуществления изобретение направлено на сконструированный онколитический вирус изобретения для лечения или предотвращения рака, включая, но не ограничиваясь, новообразования, опухоли, метастазы или любое заболевание или расстройство, характеризующиеся неконтролируемым ростом клеток, и в частности его полирезистентные формы. Рак может представлять собой полифокальную опухоль. Примеры типов рака и расстройств пролиферации, подлежащих лечению лекарственными средствами изобретения включают, но без ограничения, лейкоз (например, миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный, эритролейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз и хронический лимфоцитарный лейкоз), лимфому (например, ходжкинскую лимфому и неходжкинскую лимфому), фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, ангиосаркому, эндотелиосаркому, саркому Юинга, рак ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак простаты, плоскоклеточный рак, базальноклеточный рак, аденокарциному, почечно-клеточный рак, гепатому, опухоль Вильмса, рак шейки матки, рак матки, опухоль яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиому, астроцитому, олигодендроглиому, меланому, нейробластому, ретинобластому, дисплазию и гиперплазию. В конкретном варианте осуществления терапевтические соединения изобретения вводят пациентам с раком простаты (например, простатит, доброкачественная гипертрофия простаты, доброкачественная гиперплазия простаты (BPH), параганглиома простаты, аденокарцинома простаты, внутриэпителиальная неоплазия предстательной железы, простато-ректальные свищи и атипичные стромальные поражения простаты). В особенно предпочтительном варианте осуществления лекарственные средства настоящего изобретения используют для лечения рака, глиомы, рака печени и/или рака ободочной кишки. Лечение и/или предотвращение рака включает, но без ограничения, облегчение симптомов, ассоциированных с раком, замедление прогрессирования рака, способствование регрессии рака и способствование иммунному ответу.
В рамках изобретения, термин новообразование относится к аномальному росту ткани. Новообразование может быть доброкачественным или злокачественным. Обычно злокачественное новообразование называют раком. Виды рака отличаются от доброкачественных новообразований способностью злокачественных клеток внедряться в другие ткани либо путем прямого роста в прилежащую ткань посредством инвазии, либо посредством имплантации в отдаленные участки путем метастазирования (т.е., переносом по кровеносной или лимфатической системе).
Способы настоящего изобретения пригодны для лечения доброкачественных и злокачественных новообразований (рака).
Как определено здесь, поверхностное новообразование представляет собой новообразование, расположенное на наружной поверхности тела, которое ограничено и не распространяется на окружающие ткани или другие части тела. Внутренние новообразования расположены во внутренних органах или других внутренних частях тела. Инвазивное новообразование представляет собой новообразование, которое начинает прорастать сквозь барьеры нормальных тканей и инвазирует окружающие зоны, например, инвазивный рак молочной железы, который распространился за пределы протоков и долек.
Неисключающий список типов новообразований, рассматриваемых для лечения способом, раскрытым в настоящем описании, включает следующие категории: (a) абдоминальные новообразования, включающие перитонеальные новообразования и ретропперитонеальные новообразования; (b) новообразования костей, включающие новообразования бедра, новообразования черепа, новообразования нижней челюсти, новообразования верхней челюсти, новообразования нижней челюсти, новообразования неба, новообразования носа, новообразования глазницы, новообразования основания черепа и новообразования позвоночника; c) новообразования молочной железы, включающие новообразования грудной железы у мужчин, карцинома протоков молочной железы и филлоидную опухоль; (d) новообразования пищеварительной системы, включающие новообразования желчевыводящих путей, новообразования желчных протоков, новообразования общего желчного протока, новообразования желчного пузыря, новообразования желудка и кишечника, новообразования пищевода, новообразования тонкой кишки, новообразования слепой кишки, новообразования червеобразного отростка, колоректальные новообразования, аденоматозный полипоз толстой кишки, колоректальный синдром Гарднера, новообразования толстой кишки, аденоматозный полипоз толстой кишки, синдром Гарднера толстой кишки, новообразования сигмовидной кишки, врожденные неполипозные колоректальные новообразования, новообразования прямой кишки, новообразования ануса, новообразования двенадцатиперстной кишки, новообразования подвздошной кишки, новообразования тощей кишки, новообразования желудка, новообразования печени, гепатоцеллюлярную аденому, гепатоцеллюлярную карциному, новообразования поджелудочной железы, аденому островковых клеток, инсулиному, карциному островковых клеток, гастриному, глюкагоному, соматостатиному, випому, карциному панкреатического протока, и перитонеальные новообразования; (e) новообразования эндокринных желез, включающие новообразования надпочечников, новообразования коры надпочечников, адренокортикальную аденому, адренокортикальную карциному, множественные эндокринные неоплазии, множественные эндокринные неоплазии типа 1, множественные эндокринные неоплазии типа 2a, множественные эндокринные неоплазии типа 2b, новообразования яичников, гранулезоклеточную опухоль, лютеому, синдром Мейгса, опухоль яичников из клеток Сертоли-Лейдига, текому, новообразования поджелудочной железы, паранеопластические эндокринные синдромы, новообразования паращитовидных желез, новообразования гипофиза, синдром Нельсона, новообразования яичек, опухоль яичек из клеток Сертоли-Лейдига и новообразования щитовидной железы (f) новообразования глаза, включая новообразования конъюнктивы, новообразования глазницы, новообразования сетчатки, ретинобластому, новообразования сосудистой оболочки глазного яблока, новообразования собственно сосудистой оболочке глаза и новообразования радужной оболочки; (g) новообразования головного мозга, головы и шеи, включающие новообразования пищевода, новообразования лица, новообразования века, новообразования рта, новообразования десен, пероральную лейкоплакию, волосистую лейкоплакию, новообразования губ, новообразования неба, новообразования слюнных желез, новообразования околоушной слюнной железы, новообразования подъязычной слюнной железы, новообразования подчелюстной слюнной железы, новообразования языка, оториноларингологические новообразования, новообразования уха, новообразования гортани, новообразования носа, новообразования околоносовых синусов, новообразования верхнечелюстных синусов, новообразования глотки, гипофарингеальные новообразования, новообразования носоглотки, новообразования ротоглотки, новообразования миндалин, новообразования паращитовидных желез, новообразования щитовидной железы и новообразования трахеи; (h) гематологические новообразования, включающие новообразования костного мозга; (i) новообразования нервной системы, включающие новообразования центральной нервной системы, новообразования головного мозга, новообразования желудочков мозга, новообразования сосудистого сплетения, папиллому сосудистого сплетения, субтенториальные новообразования, новообразования ствола мозга, новообразования желудочка, нейроцитому, пинеоцитому, супратенториальные новообразования, новообразования гипоталамуса, новообразования гипофиза, синдром Нельсона, новообразования черепно-мозговых нервов, новообразования зрительного нерва, глиому зрительного нерва, невриному слухового нерва, нейрофиброматоз 2, паранеопластические синдромы нервной системы, миастенический синдром Ламберта-Итона, энцефалит с поражением лимбической системы, поперечный миелит, паранеопластическую мозжечковую дегенерацию, паранеопластическую полинейропатию, новообразования периферической нервной системы, новообразования черепно-мозговых нервов, невриному слухового нерва и новообразования зрительного нерва; (j) новообразования таза; (k) новообразования кожи, включающие акантому, новообразования сальных желез, новообразования потовых желез и базальноклеточный рак; (l) новообразования мягких тканей, включающие новообразования мышц и сосудистые новообразования; (m) новообразования селезенки; (n) новообразования грудной полости, включающие новообразования сердца, новообразования средостения, новообразования дыхательной системы, новообразования бронхов, новообразования легкого, бронхогенную карциному, немелкоклеточный рак легкого, солитарные бессимптомные округлые тени в легких, синдром Панкоста, бластому легкого, склерозирующую гемангиому легкого, новообразования плевры, злокачественный экссудат в плевральной полости, новообразования трахеи, новообразования вилочковой железы, и тимому; (o) урогенитальные новообразования, включающие новообразования женских половых органов, новообразования фаллопиевых труб, новообразования матки, новообразования шейки матки, новообразования эндометрия, эндометриоидную карциному, эндометриальные стромальные опухоли, эндометриальную стромальную саркому, новообразования влагалища, новообразования вульвы, новообразования мужских половых органов, новообразования полового члена, новообразования простаты, новообразования яичек, урологические новообразования, новообразования мочевого пузыря, новообразования почек, почечно-клеточный рак, нефробластому, синдром Дениса-Драша, синдром WAGR, мезобластную нефрому, новообразования мочеточников и новообразования мочеиспускательного канала; (p) и дополнительные виды рака, включающие карциному почки, рак легкого, меланому, лейкоз, пищевод Барретта, метаплазия предраковых клеток.
Фармацевтические композиции настоящего изобретения можно вводить отдельно или в комбинации с другими типами стратегий лечения рака (например, лучевая терапия, химиотерапия, гормональная терапия, иммунотерапия и противоопухолевые агенты). Примеры противоопухолевых агентов включают, но без ограничения, цисплатин, ифосфамид, паклитаксел, таксаны, ингибиторы топоизомеразы I (e. g., CPT-11, топотекан, 9-AC и GG-211), гемцитабин, винорелбин, оксалиплатин, 5-фторурацил (5-FU), лейковорин, винорелбин, темодал и таксо.
Чтобы дополнительно проиллюстрировать изобретение, предоставлены следующие неограничивающие примеры.
Пример 1: Описание предварительных исследований экспрессии альфа-gal-эпитопов на опухолевых клетках путем трансдукции аденовирусным вектором, содержащим ген α1,3GT
Индуцирование экспрессии альфа-gal эпитопов (Gal-альфа1-3Gal-beta1-4GlcNAc-R) на опухолевых клетках человека была ранее изучено посредством трансдукции репликативно-дефектного аденовирусного вектора, который содержит ген α1,3GT, как подробно описано у Deriy et al. Glycobiology 2002, 12: 135-144. С этой целью открытую рамку считывания (ORF) мышиной кДНК альфа-1,3GT вставили в репликационно-дефектный аденовирусный вектор, в котором были удалены ранние гены E1 и E3. Это было достигнуто посредством использования челночной плазмиды pAd, содержащей альфа кДНК 1,3GT, которая допускает гомологичную рекомбинацию кДНК в репликационно-дефектный аденовирусный вектор. В этой плазмиде ген α1,3GT вставляли после промотора цитомегаловируса (CMV), который является весьма эффективным промотором в клетках млекопитающих. Полученный аденовирусный вектор, содержащий вставленный мышиный ген α1,3GT под промотором CMV, был передан в клеточную линию почки человека 293 (ATCC), которая содержит комплементирующий вирусный ген E1. Выделенный вирусный клон оценили на наличие кДНК α1,3GT, которая продуцирует каталитически активный фермент, посредством трансдукции клеток 293 и анализа экспрессии альфа-gal эпитопа спустя 24 ч посредством проточной цитометрии после связыванияIB4 Bandeiraea simplicifolia (BS-лектин). BS-лектин специфически связывается с альфа-gal эпитопами.
Репликативно дефектный аденовирус, контактирующий с геном α1,3GT, был обозначен AdαGT и дополнительно передан клеточной линии 293, которая содержит комплементирующий вирусный ген E1. Концентрацию AdαGT определяли в виде единиц множественности заражения (MOI) и определяли как наибольшее разбавление аденовирусного вектора, который демонстрирует цитопатическое действие в клетках 293 через 6 дней после инфицирования. Способность AdαGT индуцировать синтез и экспрессию альфа-gal эпитопов на опухолевых клетках человека исследовали на клеточной линии HeLa карциномы шейки матки человека, в которой, подобно другим злокачественным или нормальным клеткам человека, отсутствуют альфа-gal эпитопы.
Трансдукция клеток HeLa привела к немедленному проникновению в каждую клетку ~20 копий AdαGT. Появление мРНК α1,3GT, происходящей из AdαGT, определяли посредством полимеразной цепной реакции с обратной транскриптазой (RT-PCR) с применением прямых и обратных праймеров, специфичных для мышиного гена α1,3GT (5'-ATGAATGTCAAGGGAAAAG-3' (SEQ ID NO: 1) и 3'-TCAGACATTATTTCTAACCA-5' (SEQ ID NO: 2)). На основании данного анализа мРНК α1,3GT была обнаружена в цитоплазме клеток HeLa через 4 ч после трансдукции. Фактическое появление фермента α1,3GT в цитоплазме определяли посредством каталитической активности данного фермента. α1,3GT переносит галактозу от донора сахара UDP-Gal к девяти терминальным остаткам N-ацетиллактозамина на N-связанных углеводных цепях белка асиалофетуина, покрывающего лунки для ELISA. Синтезированные de novo альфа-gal эпитопы идентифицировали посредством ELISA с моноклональным анти-Gal антителом M86 (Galili et al. Transplantation, 65:1129-1132, 1998). Посредством применения данного анализа каталитическую активность α1,3GT сначала определили в трансдуцированных клетках HeLa через 6 ч (см. хронологию на Фигуре 3). Первоначальное появление α-gal эпитопов определяли посредством чувствительного анализа связывания моноклонального анти-Gal M86 антитела, называемого анализ ингибирования ELISA, который измеряет число альфа-gal эпитопов на клетку (Galili et al., supra). Посредством применения данного анализа экспрессии альфа-gal эпитопов на поверхности клетки HeLa определили гликоконъюгаты через 10 ч после трансдукции на уровне 6×104/клетка. В течение 48 ч после трансдукции число экспрессированных альфа-gal эпитопов повысилось до 2×106 эпитопов/клетка. (Фигура 3).
Поскольку AdαGT является репликативно-дефектным и не может пролиферировать в делящихся клетках, каждое клеточное деление трансдуцированных клеткок HeLa приводит к снижению числа копий α1,3GT на 50%. Соответственно, уменьшается экспрессия альфа-gal эпитопов на поверхности клеток, так что в течение 2 недель после трансдукции альфа-gal эпитопы на клетках не выявляются, и ген α1,3GT в клетках не определяется.
Пример 2: Экспрессия альфа-gal эпитопов на клетках меланомы B16-BL6, трансдуцированных аденовирусным вектором, содержащим ген альфа 1,3-галактозилтрансферазы
С целью достижения введения гена альфа 1,3-галактозилтрансферазы в клетки, данный ген вставляли в репликационно-некомпетентный аденовирусный вектор, как описано ранее (Deriy et al. Glycobiology 2002, 12: 135). Полученный в результате вектор обозначили AdαGT, и он является весьма эффективным в индукции экспрессии альфа-gal эпитопов на опухолевых клетках человека (Deriy L et al., supra). Экспрессию альфа-gal эпитопов определяли на трансдуцированных AdαGT клетках меланомы B16-BL6. Эти клетки являются субклоном меланомы B16 и называются клетки BL6. Трансдукция клеток BL6 AdαGT приводит к внутриклеточной выработке альфа1,3-галактозилтрансферазы, которую кодирует ген альфа 1,3-галактозилтрансферазы в трансдуцирующем AdαGT. Экспрессию альфа-gal эпитопов de novo на глюкоконъюгатах клеточной поверхности после синтеза этого эпитопа альфа 1,3-галактозилтрансферазой оценивали через 48 часов после трансдукции. Альфа-gal эпитопы определяли посредством связывания лектина IB4 Bandeiraea (Griffonia) simplicifolia (BS-лектин - лектин, специфичный для α-gal эпитопов), что измеряли посредством проточной цитометрии и посредством связывания анти-Gal антитела с трансдуцированными клетками, что измеряли посредством ELISA. Клетки BL6, трансдуцированные AdαGT (называемые клетки BL6AdαGТ) демонстрировали значительное изменение после связывания BS-лектина, что измерено посредством проточной цитометрии, по сравнению с клетками B16, трансдуцированными контрольным «пустым» аденовирусом, в котором отсутствует вставка гена альфа1,3-галактозилтрансферазы (называемых клетками BL6Adcont) (Фигура 4A). В дополнение, ~15% клеток BL6AdαGТ демонстрировали гораздо более высокую степень связывания лектина, чем остальная часть популяции, указывая на то, что эти клетки экспрессируют альфа-gal эпитопы в большом количестве эпитопов на клетку.
Способность мышиного анти-Gal IgG связываться с альфа-gal эпитопами на клетках BL6AdαGТ была продемонстрирована посредством ELISA (Фигура 4B). клетки BL6cont или клетки BL6AdαGТ прикрепляли к лункам для ELISA посредством высушивания. В дальнейшем в лунки добавляли сыворотку, содержащую анти-Gal IgG, в серийных двукратных разведениях, и связывание анти-Gal IgG определяли посредством связывания пероксидазы хрена (HRP), конъюгированной с козьим антимышиным IgG антителом. Значения неспецифического связывания IgG были вычтены путем параллельного измерения связывания IgG с лунками, покрытыми нетрансдуцированных клетками BL6. Анти-Gal легко связывались с клетками BL6AdαGТ даже при серийном разведении 1:128, тогда как в лунках, покрытых клетками BL6Adcont, связывание не наблюдалось при любом серийном разведении (Фигура 4B).
Пример 3: Эффективность клеток BL6AdαGТ в получении защитного противоопухолевого иммунного ответа
Эффективность трансдуцированных AdaGT опухолевых клеток в качестве вакцин исследовали на мышах, нокаутированных по альфа 1,3-галактозилтрансферазе, как подробно описано у Deriy et al. Cancer Gene Therapy 12: 528-539, 2005). В качестве модели опухоли служили клетки B16-BL6. Мышей, продуцирующих анти-Gal, вакцинировали 2×106 облученных клеток BL6AdaGТ или 2×106 облученных клеток BL6, которые были трансдуцированы контрольным родительским аденовирусным вектором с отсутствием гена альфа 1,3-галактозилтрансферазы. Последние клетки, называемые BL6Adcont, не экспрессировали альфа-gal эпитопы и служили для иммунизации контрольных мышей. Через одну неделю иммунизацию повторили. Через одну неделю после второй иммунизации мышей заражали подкожно 0,2×106 или 0,5×106 живых клеток BL6. В течение 2 месяцев проводили мониторинг развития опухоли. Две трети мышей, иммунизированных клетками BL6AdαGТ и зараженных 0,2×106 нетрансдуцированных родительских клеток BL6, были защищены от заражения, тогда как в контрольной группе опухоль не развивалась только у 20% (Фигура 5A). Когда мышей заражали более высмокими дозами, составляющими 0,5×106 живых клеток BL6, у одной трети мышей, иммунизированных клетками BL6AdaGТ, развивалась защита от заражения опухолью, тогда как у всех контрольных мышей, вакцинированных клетками BL6, трансдуцированными контрольным вирусом Adcont, опухоль развивалась в течение 25 дней после заражения клетками BL6 (Фигура 5B). Эти результаты означают, что трансдуцированные AdaGT опухолевые клетки, экспрессирующие альфа-gal эпитопы, могут служить в качестве противоопухолевых вакцин, которые эффективно определяют мишень для антигенпрезентирующих клеток и таким образом, могут индуцировать иммунный ответ против таких же опухолевых клеток, у которых отсутствуют альфа-gal эпитопы.
Пример 4: Кинетика экспрессии альфа-gal эпитопа по сравнению с цитолизом в опухолевых клетках, инфицированных вирусом герпеса, содержащим ген α1,3GT (HSVαGT)
Цель этого эксперимента состоит в определении in vitro хронологии экспрессии альфа-gal эпитопов на опухолевых клетках человека и мыши после инфицирования клеток онколитическим вирусом герпеса, содержащим ген α1,3GT (HSVαGT). Этот анализ потребовался с целью с целью подтверждения того, что экспрессия альфа-gal эпитопов на инфицированных клетках возникает перед цитолизом клеток этим онколитическим вирусом. Предполагается, что после того, как альфа-gal эпитопы экспрессируются на клеточных мембранах, они будут связываться с натуральным анти-Gal антителом даже после того, как клетки лизируются онколитическим вирусом HSVαGT. Иммунные комплексы, образованные между анти-Gal и фрагментированными мембранами опухолевых клеток (из-за лизиса клеток), будут эффективно выделяться для поглощения APC, такими как дендритные клетки и макрофаги, как результат взаимодействия между Fc-фрагментом анти-Gal антитела иммунокомплекса и Fcγ-рецепторами (FcγR) на APC (см. Фигуры 1 и 2). Для получения HSVαGT ген α1,3GT ниже промотора CMV амплифицируется ПЦР из репликативно-дефектного вируса AdαGT, описанного выше и у Deriy et al. 2002, supra. Ген ниже промотора CMV вставляется в онколитический HSV, и суспензию полученных в итоге HSVαGT получают посредством передачи в клетки HeLa в соответствии со способами, известными квалифицированными специалистами в данной области.
Экспрессию альфа-gal эпитопов определяют на HSVαGT инфицированных клетках меланомы B16F10 (B16) мышей и на клетках HeLa карциномы шейки матки человека. Исследование с мышиными клетками меланомы требуется для определения последующей выполнимости исследования in vivo с этими клетками у мышей. Меланома B16 является единственной известной клеточной линией опухолевых клеток мыши, которая не имеет альфа-gal-эпитопов и, таким образом, имитирует опухолевые клетки человека в отсутствие этого углеводного эпитопа. Исследование с клетками HeLa требуется для подтверждения предположения, что экспрессия альфа-gal эпитопа в опухолевых клетках человека, инфицированных HSVαGT, возникает перед цитолизом клеток этим вирусом. Исследование описано для клеток B16, но также является идентичным для клеток HeLa.
Суспензию вируса HSVαGT добавили к монослою клеток B16 в концентрации 1×106-2×107 БОЕ (бляшкообразующих единиц)/мл. Инфицированные клетки отделяли каждые 2 часа и определяли экспрессию гена α1,3GT вируса посредством обнаружения мРНК α1,3GT. Эту мРНК определяли посредством полимеразной цепной реакции с обратной транскриптазой (RT-PCR) с применением прямых и обратных праймеров, специфичных для мышиного гена α1,3GT (5'-ATGAATGTCAAGGGAAAAG-3' (SEQ ID NO: 1) и 3′-TCAGACATTATTTCTAACCA-5' (SEQ ID NO: 2)), как описано для AdαGT выше. Первоначальное появление фермента α1,3GT в цитоплазме инфицированных клеток определяли посредством каталитической активности этого фермента при ELISA с использованием асиалофетуина в качестве акцептора для фермента, а UDP-Gal использовали в качестве донора сахара. Асиалофетуин дополнительно функционирует в качестве твердофазного антигенного покрытия лунок для ELISA. Синтезированные de novo альфа-gal эпитопы идентифицировали посредством ELISA с моноклональным анти-Gal антителом M86 (Galili, 1998, supra). Последующее появление альфа-gal эпитопов определяли посредством связывания лектина IB4 Bandeiraea (Griffonia) simplicifolia (BS-лектин - лектин, специфичный для альфа-gal эпитопов), которое измеряют посредством проточной цитометрии и посредством связывания анти-Gal с инфицированными клетками, обработанными с покрытием ELISA высушенными клетками в лунках для ELISA. Экспрессию альфа-gal эпитопа дополнительно определяли количественно посредством чувствительного анализа связывания моноклонального анти-Gal M86 антитела, называемого анализ ингибирования ELISA, который измеряет число альфа-gal эпитопов на клетку (Galili et al. 1998, supra). В качестве контроля для инфицирования вирусом использовали «пустой» HSV (т.е. вирус с отсутствующим геном α1,3GT).
Продолжали проводить мониторинг культур клеток микроскопически на цитолиз с целью определить период после инфицирования, при котором клетки подвергаются цитолизу.
Пример 5: Эффективность HSVαGT в качестве онколитического вируса in situ
Эффективность HSVαGT в качестве онколитического вирусаи в качестве средства для создания защитного противоопухолевого иммунитета против ряда опухолеассоциированных антигенов (TAA) определяли в соответствии с исследованиями (Galili et al. J Immunol.; 178: 4676-87, 2007; Abdel-Motal et al. Cancer Immunol Immunother.;58: 1545-55, 2009.). Данные исследования выполнены на мышах, нокаутированных по альфа 1,3-галактозилтрансферазе, продуцирующих анти-Gal антитела. В качестве модели опухоли служили клетки B16. Продуцирующим анти-Gal мышам, нокаутированным по альфа 1,3-галактозилтрансферазе, в правую боковую область живота подкожно вводили 1×106 клеток B16. В результате этой инъекции клетки B16 за 5-6 дней развивались в меланомное опухолевое поражение диаметром 4-5 мм. HSVαGT в количестве, варьирующем между 103 и 106 БОЕ в объеме 0,1 мл вводили в опухоли посредством инъекции. Онколитический HSV с отсутствующим геном α1,3GT («пустой» HSV) использовали в качестве контрольного вируса, неспособного индуцировать экспрессию α-gal эпитопов. Динамическое наблюдение за мышами на исчезновение опухолевого поражения проводили в течение 2 месяцев. Мышей с опухолями, достигшими диаметра 20 мм, умервщляли. Количество HSVαGT, которое в два раза превышало количество, указывающее на полное устранение опухоли (т.е. 100% онколизис) определяли и использовали для дальнейших исследований, оценивающих защитный противоопухолевый иммунный ответ, вызванный этим лечением. Сравнение с контрольным HSV, не имеющим ген α1,3GT, определяло, является ли HSVαGT более или менее эффективным в индуцировании онколизиса, чем контрольный вирус.
Пример 6: Эффективность инфицированных HSVαGT поражений в получении защитного противоопухолевого иммунного ответа против отдаленных метастазов
Продуцирующим анти-Gal мышам, нокаутированным по альфа 1,3-галактозилтрансферазе, в правую боковую область живота подкожно вводили 1×106 клеток B16, а в левую боковую область вводили 1×104, 1×105 или 1×106 клеток B16. Развитие опухоли в левой боковой области представляет отдаленный метастаз, который может не развиваться в опухолевое поражение, если инъекция HSVαGT в правую боковую область превращает ее в вакцину, которая вызывает системный защитный противоопухолевый ответ. Когда опухоль в правой боковой области достигала размера (диаметра) 4-5 мм (в пределах 5-6 дней), в нее вводили посредством инъекции 0,1 мл суспензии HSVαGT в количестве, которое дважды превышало количество, которое индуцирует 100% цитолиз меланомного поражения. Онколитический HSV, не имеющий вставленного гена α1,3GT, использовали в качестве контрольного вируса, неспособного индуцировать экспрессию альфа-gal эпитопов. Динамическое наблюдение за ростом опухоли в левой боковой области проводили в течение 2 месяцев. Преобразование опухоли, в которую инъецировали HSVαGT, в вакцину, приводит к предотвращению роста отдаленных метастазов в левой боковой области в обнаруживамое поражение, когда в левую боковую область инъекционно вводят 1×104, 1×105 или 1×106 клеток B16. Предполагается, что предотвращение опухолевого роста является более эффективным (т.е. предотвращение развития большего количества опухолевых клеток в поражение в левой боковой области), когда в опухоль в правой боковой области инъекционно вводили HSVαGT, а не HSV, не имеющий гена α1,3GT.
Пример 7: Эффективность инфицированных HSVαGT поражений в получении защитного противоопухолевого иммунного ответа против заражения опухолевыми клетками
Продуцирующим анти-Gal мышам, нокаутированным по альфа 1,3-галактозилтрансферазе, в правую боковую область живота подкожно вводили 1×106 клеток B16. Когда опухоль в правой боковой области достигала размера (диаметра) 4-5 мм (в пределах 5-6 дней), в нее вводили посредством инъекции 0,1 мл суспензии HSVαGT в количестве, которое дважды превышало количество, которое индуцирует 100% цитолиз меланомного поражения. В качестве контрольного вируса, не способного индуцировать экспрессию альфа-gal эпитопов, использовали онколитический HSV, не имеющий вставленного гена α1,3GT. Через три недели после инъекции онколитического вируса в поражение в правой боковой области в левую боковую область инъекционно вводили 0,3×106, 1×106, 3×106 или 10×106 клеток B16 в качестве опухолевого заражения. Индуцирование защитного противоопухолевого иммунного ответа как результат инъекции HSVαGT в область в правой боковой области (которая преобразует опухоль в вакцину) приводит к предотвращению развития заражающих опухолевых клеток в левой боковой области в опухолевое поражение. Предотвращение опухолевого роста является более эффективным (т.е. предотвращение развития большего количества заражающих опухолевых клеток в поражение), когда в опухоль в правой боковой области инъекционно вводят HSVαGT, а не HSV, не имеющий ген α1,3GT.
Пример 8: Выработка и Эффективность репликационно-компетентного онколитического аденовируса, который кодирует функциональный ген альфа 1,3-галактозилтрансферазы
Настоящее исследование описывает выработку Ad5/3-Δ24-αGT CRAd (CRAd-αGT), в котором ген E3 был замещен мышиным геном альфа 1,3-галактозилтрансферазы (α1,3GT). α1,3GT синтезирует углеводный антиген галактоза-альфа-1,3-галактозил-бета-1,4-N-ацетил-глюкозамин-R (альфа-gal). Когда вирус реплицируется, белок α1,3GT продуцируется наряду с вирусными белками, белок αGT в последующем катализирует продукцию альфа-gal. Анти-Gal антитела образуют комплекс с альфа-gal клеточной поверхности, способствуя иммунной активации и поглощению иммунных комплексов антигенпрезентирующими клетками.
Материалы и Способы
Клеточные линии
Клеточные линии A549 (рака легкого человека) и A375 (меланомы человека) были куплены у Европейской коллекции клеточных культур (ECCAC). Клетки A549 сохраняли в F-12K+10% фетальной бычьей сыворотки (FBS). Клетки A375 сохраняли в среде Игла, модифицированной по способу Дульбекко (DMEM)+10% фетальной бычьей сыворотки. Обе клеточные линии инкубировали при 37°C и 5% CO2.
Получение вируса
Получение вируса осуществлялось по контракту Imanis Life Sciences (Rochester, Minneapolis, US). Конструирование вируса проводили с применением общепринятых челночных и больших аденовирусных плазмид и способов рекомбинантной ДНК, точно как подробно описано (Danthinne and Werth, 2000; Danthinne, 2001). С целью создания CRAd-αGT, 1,1 Kb мышиного гена α1,3GT (GenBank учетный номер M85153) синтезировали посредством методик интегрированной ДНК (IDT) и клонировали в челночный вектор Ad5 E3 с промотором CMV 5' последовательности α1,3GT. В космиде, кодирующей геном Ad5, с последовательностью knob фибера, замещенной последовательностью Ad3, последовательность 24-bp, кодирующая аминокислотную последовательность LTCHEAGF (SEQ ID NO: 3), была удалена из области E1a. Последовательность E3 была удалена из космиды Ad5/3 и заменена на последовательность CMV-αGT, субклонированную из челночного вектора. Для создания контроля, CRAd, последовательность, кодирующую зеленого флуоресцентного белка (GFP), синтезировали с помощью IDT и клонировали в челночный вектор Ad5 E1 с промотором CMV 5' последовательности GFP. E1 последовательность была удалена из космиды Ad5/3 и заменена на последовательность CMV-GFP последовательность, субклонированную из челночного вектора. Область E3 была удалена. Структуры химерного вируса показаны на Фигуре 6.
Клетки HEK 293 трансфицировали химерными вирусными космидами и после 48 часов инкубации готовили необработанные лизаты. Для амплификации вируса клетки HEK 293 засеяли в 15 см планшеты и инкубировали в течение ночи при 37°C, 5% CO2. На следующий день клетки инфицировали необработанным лизатом из инфицированных вирусом клеток и инкубировали в течение 48 часов при 37°C, 5% CO2, после чего собирали клетки и супернатант.
Вирусные частицы высвобождали из инфицированных клеток посредством трех циклов замораживания-оттаивания и освобождали от клеточного супернатанта посредством осаждения сульфатом аммония (Schagenetal., 2000). Очищение вируса выполняли посредством центрифугирования в градиенте плотности хлористого цезия (CsCl). Кратко, препарат необработанного вируса загружали в двухэтапный градиент CsCl в пробирку центрифуги Бекмана SW28 и центрифугировали в течение 2 часов при 20000 об/мин. Полосу вируса собирали и загружали в непрерывный градиент CsCl и снова центрифугировали. Полученную полосу вируса собирали и тотчас диализировали в 4×0,5 л буфера GTS (2,5% глицерин, 25 мМ NaCl, 20 мМ трис-HCl pH 8,0) в течение 18 часов при 4°C. Приблизительно 1 мл диализированной суспензии вируса собирали и фильтровали через 0,22 мкм мембрану Supor (Pall), затем замораживали при -70°C.
Концентрацию вируса определяли, используя способ OD260-SDS и коэффициент экстинкции, составляющий 1,1×1012 вирусных частиц (ВЧ) на поглощение 260 единиц в присутствии SDS. Было обнаружено, что концентрации вируса составляют 3,6×1012 ВЧ/мл для CRAd-αGT и 2,9×1012 ВЧ/мл для CRAd-GFP. Чистоту препаратов вируса определяли посредством соотношений A260/A280 и A320/A260 и, как было обнаружено, они находятся в диапазоне, ассоциированном с чистым вирусом (1,2-1,4 и 0,22-0,27, соответственно) для обоих вирусов.
Титр вируса определяли посредством анализа титрования в конечной точке (TCID50) с применением общепризнанного способа Рида-Менча (ReedandMuench, 1938). Кратко, клетки HEK293 засеяли в 24-луночные планшеты и инкубировали в течение ночи при 37°C. На следующий день 10-кратно разбавленную серию очищенного CsCl вирусного маточного раствора добавили к засеянным клеткам HEK293 и клетки инкубировали при 37°C, 5% CO2 в течение 14 дней. Лунки оценивали на наличие цитопатического действия (CPE) посредством визуальной оценки под микроскопом и подсчитывали TCID50, используя уравнение Рида-Менча (ReedandMuench,1938). Определили, что титр вируса составил 6,8×1011 TCID50/мл для CRAd-αGT и 2,7×1011 TCID50/мл для CRAd-GFP.
Определение уничтожения клеток CRAd-αGT
Субконфлюентные монослои клеток A549 и A375 собрали из флаконов с тканевой культурой с использованием раствора для диссоциации клеток (CDS, Sigma-Aldrich). Клетки подсчитали, используя гемоцитометр, и живые клетки отличали от мертвых посредством вытеснения трипанового синего. Клетки разбавили в среде и добавили в стерильные 96-луночные белые планшеты для тканевых культур с 90 мкл/лунку, чтобы предоставить либо 5×103, либо 1×104 клеток/лунку.
Каждый вирус разбавили 1:3 в фосфатно-буферном солевом растворе (PBS)+10% FBS для предоставления рабочих маточных растворов, составляющих 1,2×1012 ВЧ/мл для CRAd-αGT и 9,67×1011 ВЧ/мл для CRAd-GFP. Рабочие маточные растворы серийно разбавляли 1 в 5 в PBS+10% FBS для получения серий титрования 1,2×1012-1,2×105 ВЧ/мл для CRAd-αGT и 9,67×1011-9,9×104 для CRAd-GFP. Серии титрования разбавляли 1:10 в планшетах для анализа (10 мкл на лунку вируса к 90 мкл посеянных клеток) и планшеты инкубировали в течение 72 часов при 37°C/5% CO2. Жизнеспособность клеток определяли с применением люминисцентного реагента для определения жизнеспособности клеток Cell Titre Glo (Promega), в соответствии с инструкциями изготовителя, и планшеты считывали на планшетном ридере EnVision 2102 (Perkin Elmer). Относительные единицы люминисценции (RLU) наносили на график против log вирусных частиц/мл.
Для визуализации цитолитического действия вируса CRAd-αGT клетки A549 и A375 засеивали в чистые 96-луночные или 24-луночные планшеты, как подробно описано выше и ниже, и инфицировали различными разбавлениями CRAd-αGT и CRAd-GFP, вновь подробно описанными выше и ниже, оценивали под световым микроскопом. Изображения клеток были сделаны с YenCam 10 (Yenway) и поддерживающим программным обеспечением.
Определение связывания анти-Gal с раковыми клетками человека, инфицированными CRAd Ad5/3-Δ24-αGT
Клетки A549 и A375 собрали из флаконов с культурами тканей, как описано выше. После подсчета клетки разбавляли в культуральной среде и добавляли в 24-луночные планшеты с тканевой культурой в объеме 540 мкл/лунку, каждая равнялась 3×104 клеток/лунку.
Каждый вирус разбавляли 1:10000 в PBS+10% FBS (1:100 и затем 1:100) для предоставления растворов 3,6×108 ВЧ/мл для CRAd-αGT и 2,9×108 для CRAd-GFP. Эти растворы дважды разбавляли 1:25 в PBS+10% FBS для получения концентраций вируса, составляющих 1,44×107 и 5,8×105 ВЧ/мл для CRAd-αGT и 1,16×107 и 4,6×105 ВЧ/мл для CRAd-GFP. Три разведения вируса дополнительно разбавляли 1:10 на засеянные клетки (60 мкм вируса на 540 мкм клеток на лунку). Равный объем PBS+только 10% FBS добавили в лунки, служившие в качестве контроля без вирусов.
Планшеты инкубировали в течение 72 часов. В конце инкубации наличие альфа-gal антигена на поверхности инфицированных клеток определяли посредством проточной цитометрии. Инфицированные и неинфицированные (контроль без вирусов) клетки собирали из 24-луночных планшетов с использованием CDS, промывали в PBS+0,5% BSA и инкубировали с 40 мкг/мл моноклонального человеческого анти-Gal антитела M86 IgG1 (Absolute Antibody), разбавленного PBS+0,5% BSA, при 4°C в течение 1 часа. Клетки вновь промывали в PBS+0,5% BSA и инкубировали с конъюгированным с аллофикоцианином (APC) античеловеческим IgG (Biolegend), разбавляли PBS+0,5% BSA при 4°C в течение 30 минут в темноте. Клетки промывали PBS+0,5% BSA и анализировали на проточном цитометре Beckman Coulter FC500. Неокрашенные клетки использовали для установки напряжений для прямого рассеяния, бокового рассеяния и флуоресцентных каналов 1 и 4. Для испытываемых образцов регистрировали сигналы GFP (канал 1) и APC (канал 4). Для определения компенсации использовали одноцветные контроли.
Результаты
CRAd-αGT лизирует раковые клетки человека
Цитолитическое действие CRAd-αGT и контрольного CRAd-GFP на клетки A549 и A375 определяли количественно, используя анализ жизнеспособности клеток на основе планшетов (Фигура 7). Снижение жизнеспособности клеток наблюдали в лунках, в которых клетки, инфицированные либо CRAd-αGT, либо CRAd-GFP, зависели от концентрации вируса. Количество вирусных частиц CRAd-αGT, требуемое для снижения жизнеспособности клеток на 50%, было ниже, чем для контрольного вируса CRAd-GFP. Это соответствует титру вируса, измеренному посредством анализа TCID50 (см. раздел Материалы и Способы выше).
Цитолитическое действие CRAd-αGT у раковых клеток A549 и A375 человека визуализировали посредством световой микроскопии и сравнивали с CRAd-GFP (Фигура 8). Клетки, которые инфицировали либо CRAd-αGT, либо CRAd-GFP, и затем инкубировали в течение 72 часов, были уничтожены обоими вирусами. Неинфицированные клетки были здоровыми, без очевидного лизиса.
Клетки, инфицированные CRAd-αGT, связывают анти-Gal антитела
Для исследования, приводит ли инфицирование клеток CRAd-αGT к экспрессии каталитически активного белка α1,3GT и последующей экспрессии альфа-gal на поверхности клеток, связывание альфа-gal-специфических анти-Gal антител с клетками, инфицированными CRAd-αGT, определяли и сравнивали со связыванием анти-Gal антител с CRAd-GFP и неинфицированными клетками с применением проточной цитометрии (Фигура 9). Клетки, которые инфицировали CRAd-αGT, были прочно связаны с анти-Gal, но были отрицательными для экспрессии GFP. Наоборот, клетки, которые инфицировали CRAd-GFP, были отрицательными для связывания анти-Gal, но были положительными для экспрессии GFP. Неинфицированные клетки были отрицательными на анти-Gal связывание и экспрессию GFP.
Заключение
Инфицирование клеток человеческого немелкоклеточного рака легкого (A549) и меланомы (A375) CRAd-αGT привело к лизису и смерти клеток. Лизис клеток возникает как следствие репликации CRAd-αGT, который является селективным для раковых клеток вследствие делеции участка 24-bp из вирусного гена E1a (Fueyoetal.,2000).
В дополнение к лизису клеток, инфицирование раковых клеток CRAd-αGT привело к специфическому связыванию анти-Gal антител с поверхностью клеток, тогда как анти-Gal не связывается с неинфицированными или инфицированными CRAd-GFP клетками. Поскольку анти-Gal специфически связываются с альфа-gal эпитопом, авторы изобретения могут заключить, что репликация CRAd-αGT в раковых клетках приводит к экспрессии каталитически активного фермента α1,3GT, который в последующем катализирует синтез альфа-gal.
Связывание анти-Gal Антител с экспрессирующими альфа-gal погибающими опухолевыми клетками и детритом опухолевых клеток, созданных онколитическим действием вируса, будет усиливать адаптивный иммунный ответ на опухолевые неоантигены. Антигенпрезентирующие клетки (APC), несущие активирующие Fcγ-рецепторы, поглощают опухолевый клеточный детрит и мертвые клетки, образующие комплекс с анти-Gal IgG, посредством активации Fcγ-рецепторов. Активация Fcγ-рецепторов на APC приводит к активации APC, созреванию и улучшению презентирования антиген Т-клеткам (Regnaultetal., 1999; Rafiqetal., 2002; Platzeretal., 2014).
References
Bramante et al. (2015). Int.J. Cancer 137:1775-1783. Danthinne (2001). Biotechniques 30:612-6, 618-9. Danthinne and Werth (2000). Gene Ther. 7:80-7. Fueyo et al. (2000). Oncogene 19:2-12. Kanerva et al. (2013). Clin. Cancer Res. 19:2734-2744. Kanerva et al. (2003). Mol. Ther. 8:449-458. Kannoetal. (2012). Anticancer Res. 32:4891-5. Kim et al. (2013). Gynecol. Oncol. 130:518-24. Koski et al. (2010). Mol. Ther. 18:1874-84. Platzer (2014). Front. Immuno l.5:140. Rafiq et al. (2002). J. Clin. Invest. 110:71-9. Reed and Muench (1938). Am. J. Epidemiol. 27:493-497. Regnault et al. (1999). J. Exp. Med. 189:371-80. Schagen et al. (2000). Gene Ther. 7:1570-4. Sherr (1996). Science 274:1672-7. Ulasov et al. (2006). Hum. Gene Ther. 17:556-64.
--->
список последовательностей
<110> AGALIMMUNE LIMITED
<120> ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА
<130> AGA-C-P1835PCT
<150> 1505860.5
<151> 2015-04-07
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> ДНК
<213> искуственная
<220>
<223> Синтетический праймер
<400> 1
atgaatgtca agggaaaag 19
<210> 2
<211> 20
<212> ДНК
<213> искуственная
<220>
<223> Синтетический праймер
<400> 2
tcagacatta tttctaacca 20
<210> 3
<211> 8
<212> PRT
<213> мышиный
<400> 3
Leu Thr Cys His Glu Ala Gly Phe
1 5
<---
Реферат
Изобретение относится к биохимии. Описан онколитический вирус, содержащий нуклеиновую кислоту, кодирующую фермент гексозилтрансферазу, в котором фермент представляет собой фермент альфа 1,3-галактозилтрансферазу. Также описана фармацевтическая композиция, содержащая описанный онколитический вирус. Также описаны способы лечения индивида с новообразованием или рака, использующие описанный онколитический вирус. Изобретение позволяет лечить новообразования или рак, специфически лизируя опухолевые клетки. 6 н. и 14 з.п. ф-лы, 9 ил., 8 пр.
Формула
Документы, цитированные в отчёте о поиске
Онколитический аденовирус для лечения рака, его применение и фармацевтическая композиция, содержащая его

Комментарии