Композиции на основе наночастиц с улучшенным проникновением через слизистые оболочки - RU2598627C2
Код документа: RU2598627C2
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области композиций на основе наночастиц, в частности к гипотоническим композициям на основе наночастиц, которые быстро доставляют наночастицы, проникающие через слизь, к эпителиальным поверхностям, покрытым слизью, и способам их получения и применения.
ПРАВА ПРАВИТЕЛЬСТВА
Правительство США имеет определенные права на настоящее изобретение. Настоящая работа поддержана грантами национального института здоровья (R01HD062844, R33AI079740, R01CA140746) (J.H. and R.C.), национальной научной организацией (L.M.E.) и национальным институтом здоровья (бактерицидная инновационная программа 5R21AI079740).
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
U.S.S.N. 61/588350, поданная 19 января 2012 г.
PCT/US 2012/024344, поданная 8 февраля 2012 г.
PCT/US 2012/069882, поданная 14 декабря 2012 г.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Локализованная доставка терапевтических средств с помощью биоразлагаемых наночастиц часто обеспечивает преимущества по сравнению с системным введением лекарственного средства, включая ослабленные системные побочные эффекты и контролируемые концентрации лекарственного средства в сайтах-мишенях. Однако контролируемая доставка лекарственного средства к мукозальным поверхностям ограничена присутствием защитного слоя слизи.
Слизь представляет собой вязкоупругий гель, который покрывает все внешние эпителиальные поверхности, непокрытые кожей, такие как респираторный, желудочно-кишечный, носоглоточный и женский репродуктивный тракты, и поверхность глаз. Слизь эффективно задерживает общепринятые системы доставки лекарственных средств на основе частиц за счет пространственных и/или адгезионных взаимодействий. Как результат обновления слизи, большинство терапевтических средств, доставляемых местно на мукозальные поверхности, страдают от плохого проникновения и распределения, которые ограничивают их эффективность.
Наночастицы, содержащие лекарственные средства или гены, осуществляющие доставку в клетки, покрытые слизью, глаз, носа, легких, желудочно-кишечного тракта и женского репродуктивного тракта, должны достигать однородного распределения для того, чтобы максимально лечить или защищать данные поверхности. Однако чрезвычайно вязкоэластичный (т.е. вязкий и твердообразный по свойствам) и адгезионный слой слизи может замедлять или полностью связывать частицы, и, посредством этого, препятствовать их распределению по мукозальной поверхности. Кроме того, некоторые мукозальные поверхности, такие как мукозальные поверхности рта, желудка, кишечника, толстой кишки и влагалища, имеют сильноскладчатые эпителиальные поверхности, которые являются недоступными для общепринятых мукоадгезивных частиц и также для многих низкомолекулярных лекарственных и терапевтических средств. Без максимального распределения с проникновением в данные углубления, большая часть эпителия остается восприимчивой и/или необработанной. Кроме того, проникновение в складки, вероятно содержащие гораздо медленнее очищаемый слой слизи, допускает продленное время пребывания на эпителиальной поверхности.
Что касается применений по доставке лекарственных средств или генов, терапевтические частицы должны быть способны 1) достигать равномерного распределения по соответствующей мукозальной поверхности, а также 2) эффективно проходить слизистый барьер, избегая быстрого выведения со слизью, и обеспечивать эффективную доставку их терапевтического содержимого в лежащие глубже клетки (das Neves J & Bahia MF Int J Pharm 318, 1-14 (2006); Lai et al. Adv Drug Deliver Rev 61, 158-171 (2009); Ensign et al. Sci Transl Med 4, 138ral79 (2012); Eyles et al. J Pharm Pharmacol 47, 561-565 (1995)).
Биоразлагаемые наночастицы, которые проникают глубоко в слизистый барьер, могут давать улучшенное распределение, удерживание и эффективность лекарственного средства на мукозальных поверхностях. Плотные поверхностные слои из низкомолекулярного полиэтиленгликоля (ПЭГ) позволяют наночастицам быстро проникать через сильно вязкоэластичные слизистые секреции людей и животных. Гидрофильное и биоинертное покрытие ПЭГ эффективно снижает до минимума адгезионные взаимодействия между наночастицами и компонентами слизи. Биоразлагаемые частицы, проникающие через слизь (MPP), получают физической адсорбцией определенных плюроников, таких как F127, на готовых мукоадгезивных наночастицах.
Поверхность влагалища является сильноскладчатой, приспосабливаясь к расширению при половом сношении и родах; данные складки или "руги" обычно стянуты внутрибрюшным давлением, затрудняя доставку лекарственного средства к складчатым поверхностям. Для действительно эффективного предотвращения и лечения, постоянные концентрации лекарственного средства должны доставляться и сохраняться на всей доступной поверхности. Неспособность достигать подходящего распределения на всем эпителии влагалища представляет собой документально зафиксированный вид неудовлетворительных результатов для влагалищных микробицидов.
Другое значительное препятствие для эффективной доставки лекарственных средств во влагалище представляет собой вязкоэластичный слой слизи, секретируемый эндоцервиксом, который покрывает эпителий влагалища. Слизь эффективно захватывает чужеродные частицы и взвеси как пространственным, так и адгезионным механизмами, способствуя быстрому выведению. Хотя применение мукоадгезивных лекарственных форм предложено для увеличения времени пребывания во влагалище, мукоцилиарный клиренс протекает быстро (порядка от минут до часов), ограничивая время пребывания мукоадгезивных систем.
Мукозальный эпителий применяет осмотические градиенты для того, чтобы вызвать поглощение и выделение жидкости. Продукты для применения во влагалище традиционно получают с гипертоническими композициями, включая лечение молочницы влагалища, большинство смазок половых органов, таких как разогревающий гель KY®, и гели, разработанные для предотвращения передачи инфекции, передающейся половым путем, такой как ВИЧ. Гипертонические композиции вызывают быстрое, вызванное осмотически выделение жидкости во влагалище и, таким образом, вызывает немедленное повышение утечки жидкости из влагалища со скоростью, пропорциональной гипертоничности композиции. Более того, недавние исследования возможных влагалищных и ректальных микробицидов и в моделях животных, и на людях показали, что гипертонические композиции вызывают токсические эффекты, которые могут увеличивать восприимчивость к инфекциям. Первое успешное микробицидное испытание на предотвращение ВИЧ обнаружило, что антиретровирусное лекарственное средство, тенофовир, доставляемое в геле для влагалища, обеспечивает частичную защиту. К сожалению, гелевая композиция была сильно гипертонической, заставляя исследователей в новейшем клиническом исследовании тенофовира снижать концентрацию глицерина, снижая токсичность. Однако концентрацию не снижали, и композиция была все еще в значительной степени гипертонической. По-видимому, нет оснований признавать приемлемыми гипертонические композиции для доставки лекарственного средства во влагалище, поскольку в добавление к документально зафиксированным токсичным эффектам, гипертонические композиции вызывают быстрое вызываемое осмотически выделение влагалищного отделяемого, поток жидкости, который препятствует доставке лекарственных средств к эпителию. Данное отсутствие обоснованности игнорировалось и исследователями, и производителями продуктов для применения во влагалище, причем единственным очевидным исключением являются смазки половых органов, предназначенные для того, чтобы способствовать оплодотворению. Данные продукты формулируют так, чтобы они были изотоническими (осмоляльность является эквивалентной осмоляльности плазмы), способствуя поддержанию жизнеспособности сперматозоидов.
Следовательно, цель настоящего изобретения заключается в обеспечении композиций для быстрой и равномерной доставки дисперсий широкого диапазона лекарственных средств к эпителиальным поверхностям, покрытым слизью, с минимальной токсичностью для эпителия.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Осмос можно применять для того, чтобы вызвать быстрое проникновение частиц, проникающих через слизь, в глубокие полости в сильноскладчатых тканях слизистой оболочки. Поглощение и проникающая способность в глубокие полости тканей слизистой оболочки улучшают распределение по мукозальной поверхности, иначе плохо распределяемых молекул. Быстрое поглощение и проникающая способность в глубокие полости тканей слизистой оболочки приводят к продленному времени пребывания частиц, проникающих через слизь. Быстрое поглощение улучшает переносимость потребителем в добавление к увеличению эффективности лечения и снижению до минимума промежутка времени между применением и мукозальной защитой.
Гипотонические композиции оценивали на доставку растворимых в воде лекарственных средств и на доставку лекарственных средств с помощью мукоинертных (то есть, неадгезивных) наночастиц, проникающих через слизь (MPP). Гипотонические композиции заметно увеличивают скорость, с которой лекарственные средства и MPP достигают эпителиальной поверхности. Кроме того, гипотонические композиции значительно улучшают доставку лекарственных средств и MPP ко всей эпителиальной поверхности, включая проникновение глубоко в складки влагалища (руги), в которые не проникают изотонические композиции. Гипотонические композиции могут вызывать высвобождение лекарственных средств не только для поглощения эпителием, но также для проникновения через эпителий, снижая удерживания во влагалище. Напротив, гипотонические композиции вызывают быстрое и равномерное накопление MPP на поверхностях влагалища, но они не проникают через эпителий и, таким образом, сохраняют идеальную позицию для длительной мукозальной доставки лекарственных средств. Минимально гипотонические композиции, предпочтительно в диапазоне 20-220 мосмоль/кг, обеспечивают быструю и равномерную доставку MPP по всей поверхности влагалища, с минимальным риском токсичности для эпителия. Гипотонические композиции для доставки лекарственных средств во влагалище с помощью MPP должны заметно улучшать предотвращение и лечение заболеваний и расстройств репродуктивного тракта.
Данные также показывают, что имеется большая осмоляльность в толстой кишке, так что среды с осмоляльностью, большей чем осмоляльность плазмы крови (обычно считают изотонической при ~300 мосмоль/кг), все же приводят к улучшением распределения в толстой кишке, благодаря быстрому, вызванному осмотически поглощению жидкости. Диапазон для улучшенного распределения в толстой кишке с помощью гипотонической среды в толстой кишке составляет ~20 мосмоль/кг - 450 мосмоль/кг. В предпочтительном варианте осуществления композиция для применения в толстой или прямой кишке имеет осмоляльность приблизительно 20 мосмоль/кг - 450 мосмоль/кг, где ионы натрия (Na+) составляют по меньшей мере 30% осмоляльности свыше 220 мосмоль/кг. (т.е., если осмоляльность композиции составляет 450 мосмоль/кг, Na+ ионы должны составлять по меньшей мере 30% от 450-220=230 мосмоль/кг, или 69 мосмоль/кг). Улучшенное распределение гипотонически вводимых MPP (по сравнению с CP) в ткани прямой кишки с вызванным язвенным колитом, включая поглощение MPP язвенной тканью, также не демонстрировалось. Гипотоническое введение также приводит к улучшенному распределению свободного лекарственного средства (тенофовир, меченный FITC) в толстой кишке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
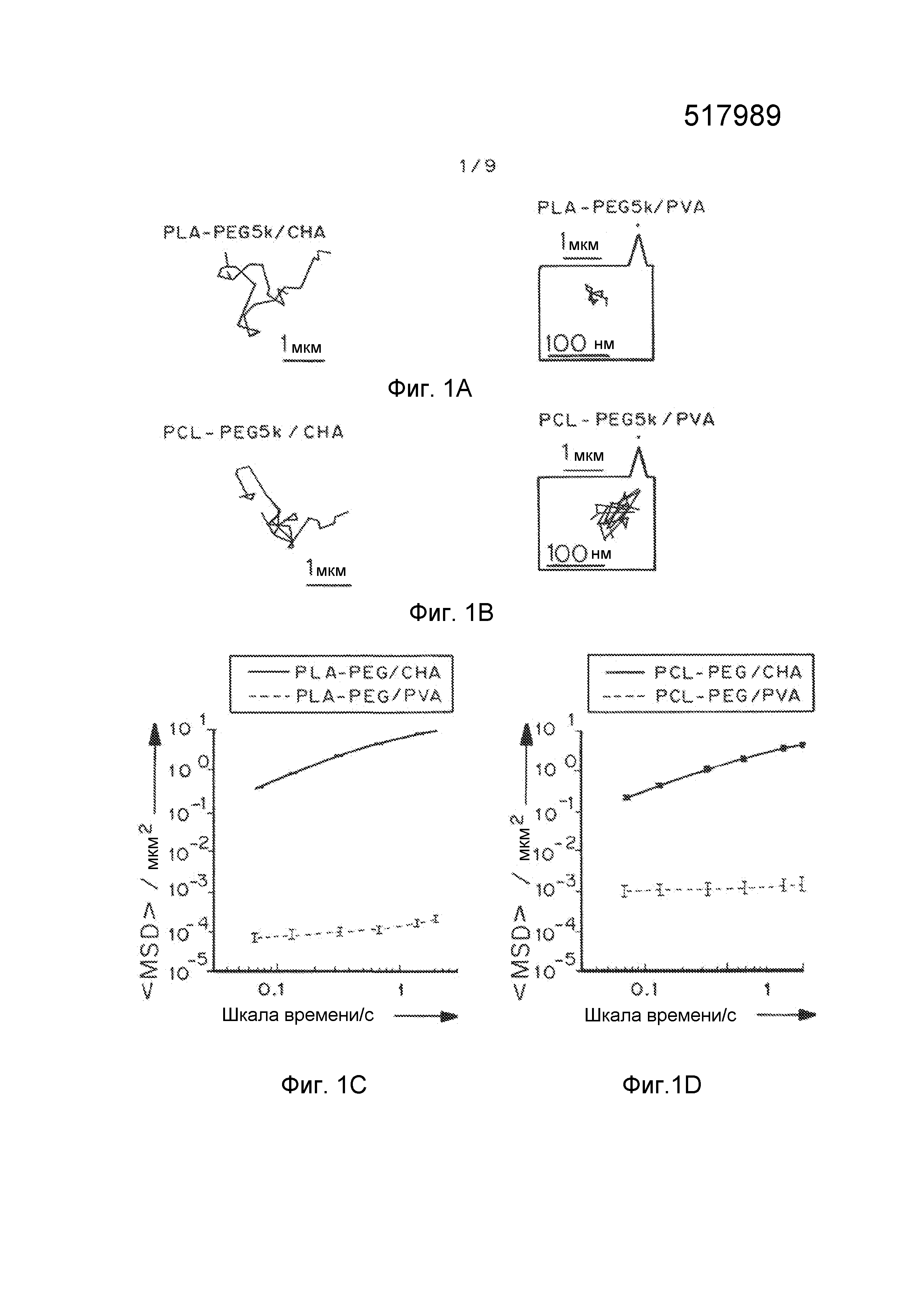
Фигуры 1A и 1B представляют собой репрезентативные кривые наночастиц PLA-PEG и PCL-PEG, содержащих CHA и PVA, полученных способом эмульсификации. Фигуры 1C и 1D представляют собой графики, показывающие усредненные по множеству геометрические среднеквадратичные отклонения (
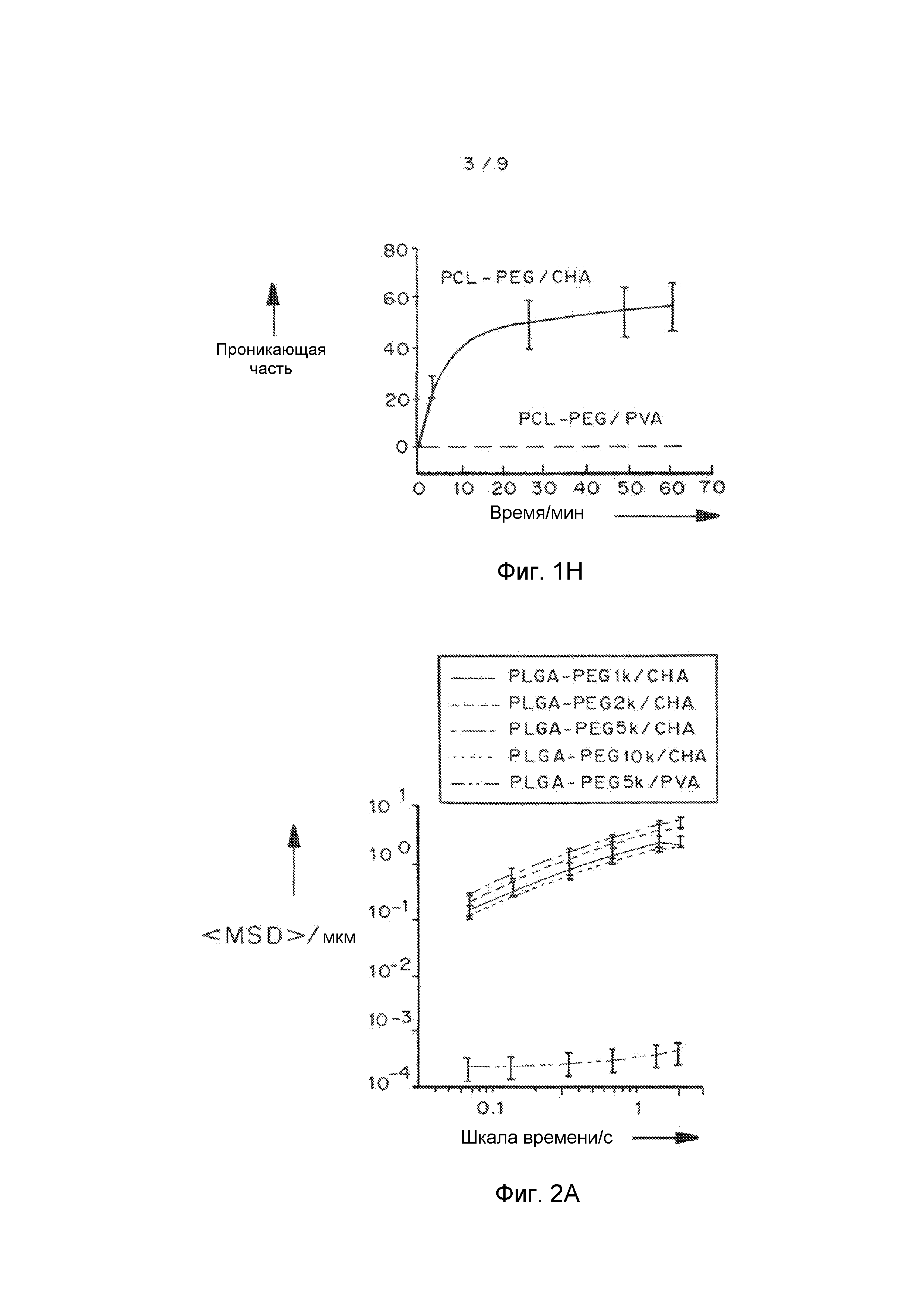
Фигуры 2A и 2B показывают эффект молекулярного веса ПЭГ на скорость переноса MPP в шеечно-влагалищной слизи: фигура 2A представляет собой график, показывающий усредненное по множеству геометрическое среднеквадратичное отклонение
Фигура 3A представляет собой график, показывающий усредненное по множеству геометрическое среднеквадратичное отклонение
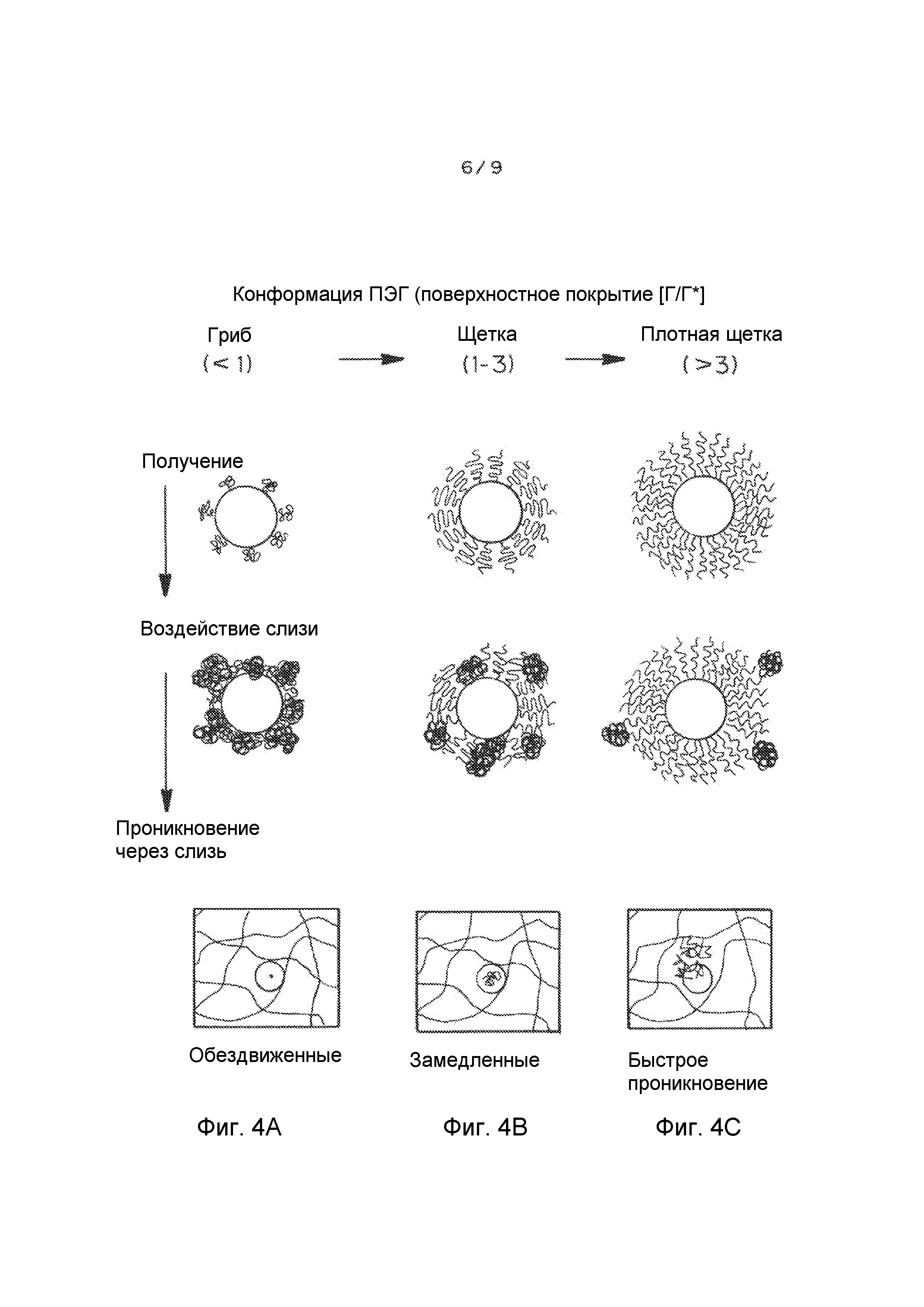
Фигуры 4A-C представляют собой схемы, иллюстрирующие влияния покрытия поверхности ПЭГ ([Γ/Γ*]) на проникновение через слизь наночастиц. Фигуры 4A-C показывают получение наночастиц PLGA-PEG с покрытием поверхности ПЭГ при повышении покрытия. По мере увеличения покрытия поверхности ПЭГ, режим ПЭГ сменяется с режима типа «гриб» (соседние цепи ПЭГ не перекрываются, [Γ/Γ*]<1, фигура 4A), на режим типа «щетка» (соседние цепи ПЭГ перекрываются, 1<[Γ/Γ*]<3, фигура 4B), на режим типа «плотная щетка» ([Γ/Γ*]>3, фигура 4C). При низком покрытии ПЭГ ([Γ/Γ*] <1, фигура 4A) муциновые волокна сильно сцепляются с ядрами наночастиц. При среднем покрытии ПЭГ (1<[Γ/Γ*]<3, фигура 4B), муциновые волокна все еще частично абсорбируются на ядрах наночастиц. При высоком ([Γ/Γ*]>3, фигура 4C) покрытии ПЭГ ядра наночастиц полностью экранированы биоинертным кольцом ПЭГ, приводя в результате к отсутствию адсорбции муцина на наночастицах. Фигура 4C показывает, что наночастицы с низким покрытием ПЭГ связываются в слизи, наночастицы со средним покрытием ПЭГ замедляются или даже связываются в слизи, и наночастицы с высоким и очень высоким покрытием ПЭГ способны быстро проникать через слизь.
Фигуры 5A и 5B показывают покрытие влагалища доксорубицином (Dox), введенным или в гипотоническом (hypo), или изотоническом (iso) растворе. Мышей (A) оставляли лежать на спине в течение 1 часа перед сбором ткани (неамбулаторные) или (B) они свободно перемещались в течение 10 минут перед сбором ткани (амбулаторные). Изображения показывают среднее покрытие поверхности влагалища для амбулаторных мышей, которым вводили Dox в (C) изотоническом (iso) и (D) гипотоническом (hypo) растворе. Данные представляют собой средние ± SEM (n=5). *P<0,05 по сравнению с изотоническим, критерий суммы рангов Уилкоксона.
Фигура 6 показывает удерживание во влагалище доксорубицина, введенного или в изотоническом (iso), или гипотоническом (hypo) растворе. Мышей оставляли лежать на спине в течение 10 минут перед сбором ткани. Наложение интенсивности флуоресценции доксорубицина и светлопольных изображений для изотонического раствора и гипотонического раствора в цельной ткани шеечно-влагалищного тракта. Относительный сигнал доксорубицина, основанный на количественном измерении сигнала флуоресценции, скорректированный для флуоресценции в растворе, является репрезентативным для средних, рассчитанных для n=4 мышей, и его количественно определяли в виде относительного сигнала ± SEM. *P<0,05 по сравнению с изотоническим, критерий суммы рангов Уилкоксона.
Фигура 7 показывает HSV-2 инфекцию во влагалище после обработки монофосфатом ацикловира (ACVp) или в гипотоническом (hypo), или в изотоническом (iso) растворе. ACVp (10 мг/мл) вводили за 1 минуту или 60 минут до вирусного инокулята. n≥45 мышей испытывали в каждой группе, и скорости заражения в контрольной группе составляли ~90%. *P<0,05 по сравнению с изотоническим, точный критерий Фишера.
Фигуры 8A и 8B показывает удерживание во влагалище MPP, введенных или в гипотоническом (hypo), или изотоническом (iso) растворе. Фигура 8A, мышей оставляли лежать на спине в течение 1 часа перед сбором ткани (неамбулаторные). Фигура 8B, мыши свободно передвигались в течение 10 минут перед сбором ткани (амбулаторные). Удерживание частиц рассчитывали как среднее ± SEM (n≥5). *P<0,05 по сравнению с изотоническим, критерий суммы рангов Уилкоксона.
Фигура 9 показывает распределение во влагалище флуоресцентных 100 нм MPP, введенных в растворах с изменяющейся осмолярностью в поперечных срезах, полученных из замороженной ткани влагалища, и в цельной разглаженной ткани влагалища. Все ткани собирали в пределах 10 минут введения частиц. Все величины представлены в единицах мосмоль/кг. Осмолярность для мукоадгезивных CP частиц составляла 20 мосмоль/кг. Изображения являются репрезентативными для n≥5 мышей. Данные рассчитывали как среднее ± SEM (n≥3).# - перепечатано из (4). * - P<0,05 по сравнению с гипотоническими растворами (20-220), критерий суммы рангов Уилкоксона
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Многие мукозальные поверхности, такие как поверхности рта, желудка, кишечника, толстой кишки и влагалища, содержат большое количество глубоких эпителиальных складок, обеспечивая расширение эпителия и поглощение жидкостей и питательных веществ. По этим причинам значительная доля эпителиальной поверхности содержится в данных труднодоступных складках. Способность создать частицы, которые равномерно распределяются на мукозальной поверхности ткани, имеет много важных следствий для терапевтической доставки, получения изображений и диагностических применений. Например, частицы, которые не достигают равномерного распределения и не проникают в глубокие полости, не способны полностью вылечивать или защищать мукозальную поверхность (Rajapaksa et al. J Biol Chem 285, 23739-23746 (2010).
В области доставки лекарственных средств во влагалище, достижение приемлемого распределения во всех целевых поверхностях представляет собой часто цитируемую проблему. Поверхность влагалища является сильноскладчатой, обеспечивая расширение при половом сношении и родовом акте, приводя в результате к сложенным складкам или "ругам". Плохое распределение в складках, даже после имитированного полового сношения, приводится в качестве решающего фактора в неспособности микробицидных продуктов защищать влагалище от инфекций. В других микробицидных исследованиях на мышах применяли большие объемы испытуемого продукта (вплоть до 40 мкл), способствуя более полному распределению во влагалище. Влагалище мышей может удерживать объем ~50 мкл; данный сравнительно большой объем испытуемого агента растягивает и развертывает эпителий влагалища. Напротив, человеческое влагалище может удерживать в диапазоне 50 мл, тогда как стандартные продукты для влагалища доставляют только 2-5 мл. Для исследования распределения во влагалище у мышей in vivo применяли небольшой объем (5 мкл), который будет более подходящим образом имитировать объемы, применяемые для людей. Способ, который доставляет лекарственные средства к поверхностям глубоких складок без растягивания влагалища, может приводить к более эффективной доставке лекарственных средств во влагалище.
Эпителий влагалища является проницаемым для небольших молекул и способен поглощать различные лекарственные средства. Поверхностный слой эпителия влагалища содержит плотно упакованные омертвевшие и умирающие клетки (роговой слой), которые защищают более глубокие слои живых клеток, обеспечивая выделение и поглощение жидкости через эпителий. Влагалище обладает естественной способностью вызванного осмотически поглощения жидкости, которую применяют для доставки лекарственных средств. Доксорубицин, вводимый в гипотоническом растворе, покрывает более 85% поверхности влагалища амбулаторных мышей, тогда как только 25% поверхности ткани влагалища покрывается доксорубицином, вводимом в изотоническом растворе. Изотоническая жидкость не проникает в руги, оставляя испещренный полосами рисунок при распрямлении ткани влагалища. Предположено, что гипотоническая доставка может увеличивать контрацептивную эффективность детергентного ноноксинола-9 (N9), увеличивая подвижность N9 через слизь (Dunmire EN & Katz DF Contraception 55, 209-217 (1997); Owen et al. J Control Release 60, 23-34 (1999)). Улучшенное проникновение гипотонического раствора N9 через слизь показано в выделенной слизи in vitro, причем цель заключалась в достижении более быстрого контакта между детергентом и сперматозоидами в слизи.
Доставка в шеечно-влагалищный тракт и толстую кишку в особенности может быть проблематичной, не только из-за проблемы распределения, но также из-за "утечки". Большинство влагалищных и ректальных композиций являются чрезвычайно гиперосмолярными, что вызывает осмотическое выделение жидкости из мукозального эпителия. Данное выделение жидкости приводит к разбавлению и утечке композиции, вместе с токсичностью, связанной с гиперосмолярностью (Rudolph et al. Mol Ther 12, 493-501 (2005); Bertschinger et al. Journal of Controlled Release 116, 96-104 (2006); Pihl et al Acta Physiol 193, 67-78 (2008); Noach J Pharmacol Exp Ther 270, 1373-1380 (1994)). Абсорбция лекарственного средства, применяя гипотонические растворы лекарственных средств, является известной, но не эффекты абсорбции на распределение и удерживание. См., например, Eyles et al. J Pharm Pharmacol 47, 561-565 (1995); Rajapaksa et al. J Biol Chem 285, 23739-23746 (2010); Rudolph et al. Mol Ther 12, 493-501 (2005); Bertschinger et al. Journal of Controlled Release 116, 96-104 (2006); Pihl et al. Acta Physiol 193, 67-78 (2008); Noach et al. J Pharmacol Exp Ther 270, 1373-1380 (1994); Lennernas H Pharmaceut Res 12, 1573-1582 (1995).
Тоничность композиции зависит от свойств проницаемости ткани (например, толстой кишки относительно влагалища) и существует критический слегка гипотонический диапазон для улучшенного поглощения и однородности распределения без токсичности. Слегка гипотонические композиции должны вызывать поглощение жидкости, которое будет снижать "утечку", часто приводимую пациентами в клинических исследованиях как вредное побочное действие. Данная утечка продукта ведет и к ухудшенной приемлемости для потребителя, а также быстрому удалению терапевтического агента. Например, снижение осмоляльности с 294 мосмоль/кг до 220 мосмоль/кг выполняло функцию слегка гипотонической жидкости, которая увеличивала покрытие поверхности влагалища с 60% до 76%, и по существу все гипотонически доставляемые MPP получали из катетера, достигая эпителиальной поверхности, глубоко в складчатых поверхностях в пределах 10 минут введения.
Композиции в виде частиц, которые быстро достигают равномерного распределения, а также проходят через слизь, можно применять для эффективной доставки в эпителий, покрытый слизью, в теле для широкого спектра применений, включая лечение лекарственными средствами (в диапазоне от низкомолекулярных терапевтических средств, подобных химиотерапевтическим лекарственным средствам, до пептидов, белков, олигонуклеотидов, ДНК и т.д.), получение изображений и диагностику. Для терапевтических целей, молекулы, захваченные в частицы, затем могут высвобождаться в течение длительного времени при заранее определенных скоростях. В общем, терапевтические применения для данной технологии включают доставку любого лекарственного средства, в случае, когда стандартная композиция не является пригодной, не является эффективной на 100%, или приводит к нежелательным побочным эффектам из-за неэффективного распределения, токсичности или "утечки". Данный способ должен также улучшать проникновение и равномерное распределение стандартных композиций лекарственных средств (т.е. без частиц для доставки лекарственных средств), в частности для доставки генов/олигонуклеотидов; направленной и в высшей степени локализованной химиотерапевтической доставки для лечения рака; направленной доставки противовоспалительных лекарственных средств; лечения или предотвращения ЗППП; проникновения в биопленки и другие биологические покрытия/барьеры; и направленной доставки антибиотиков для лечения бактериальной инфекции.
Большинство вагинальных гелей формулируют с эксципиентами, такими как глицерин или пропиленгликоль, которые придают гелю изотоничность. К сожалению, недавние исследования показывают, что данные гипертонические композиции обладают токсичностью в вагинальном тракте мышей, которая увеличивает восприимчивость к HSV-2 инфекции (Moench et al. BMC Infect Dis 10, 331 (2010)), которая, по всей вероятности, является гипертонической (Fuchs et al. J Infect Dis 195, 703-710 (2007); Clark MR & Friend DR. (2012) Pharmacokinetics and Topical Vaginal Effects of Two Tenofovir Gels in Rabbits. AIDS Res Hum Retroviruses.). Кроме того, было обнаружено, что гипертоническая гелевая композиция нарушает целостность эпителия в толстой кишке человека, и было обнаружено, что гипертоническая гелевая композиция тенофовира вызывает разрушение эпителия в эктоцервикальных и колоректальных эксплантатах по сравнению с тканями, подверженными воздействию только среды (Rohan PLoS One 5, e9310 (2010)). Было предположено, что основной влияющий фактор в экспериментальной модели мышей с заболеванием раздраженного кишечника, вызванным декстраном сульфата натрия (DSS), представляет собой гипертоничность раствора DSS. Высвобождение воспалительных цитокинов в промываемой жидкости влагалища мышей увеличивалось после 7 одноразовых доз среды для гипертонического геля, но увеличение отсутствовало после 7 одноразовых доз гипотонической композиции.
I. Определения
"Наночастица", как применяют в настоящем изобретении, обычно относится к частице любой формы, имеющей диаметр от приблизительно 1 нм вплоть до, но не ограничиваясь, приблизительно 1 микрона, более предпочтительно от приблизительно 5 нм до приблизительно 500 нм, самое предпочтительное от приблизительно 5 нм до приблизительно 100 нм. Наночастицы, имеющие сферическую форму, обычно называют "наносферами".
"Средний размер частиц", как применяют в настоящем изобретении, обычно относится к статистически среднему размеру частиц (диаметру) частиц в группе частиц. Диаметр по существу сферической частицы можно называть физическим или гидродинамическим диаметром. Диаметр несферической частицы может предпочтительно относиться к гидродинамическому диаметру. Как применяют в настоящем изобретении, диаметр несферической частицы может относиться к наибольшему линейному расстоянию между двумя точками на поверхности частицы. Средний размер частиц можно измерить, применяя способы, известные в данной области техники, такие как динамическое рассеяние света.
"Монодисперсное" и "однородное по размеру распределение" применяют взаимозаменяемо в настоящем изобретении, и они описывают множество наночастиц или микрочастиц, где частицы имеют одинаковый или практически одинаковый диаметр или аэродинамический диаметр. Как применяют в настоящем изобретении, монодисперсное распределение относится к распределениям частиц, в которых 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95% или более распределения лежит в пределах 5% масс-медианного диаметра или аэродинамического диаметра.
"Гидрофильное", как применяют в настоящем изобретении, относится к веществам, которые содержат сильно полярные группы, которые легко взаимодействуют с водой.
"Липофильное" относится к соединениям, обладающим сродством к липидам.
"Амфифильное" относится к молекуле, комбинирующей гидрофильные и липофильные (гидрофобные) свойства.
"Гидрофобное", как применяют в настоящем изобретении, относится к веществам, которые не обладают сродством к воде; стремящиеся отталкивать и не поглощать воду, а также не растворяться в или не смешиваться с водой.
"Фармацевтически приемлемое", как применяют в настоящем изобретении, относится к соединениям, веществам, композициям и/или лекарственным формам, которые, по результатам тщательной медицинской оценки, являются пригодными для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, с соразмерным соотношением риск/польза, согласно руководству государственных учреждений, таких как управление по продовольствию и лекарствам.
"Биосовместимый" и "биологически совместимый", как применяют в настоящем изобретении, обычно относятся к материалам, которые, вместе с любыми их метаболитами или продуктами разложения, обычно являются нетоксичными для реципиента и не вызывают любые заметные вредные эффекты у реципиента. В целом, биосовместимые материалы представляют собой материалы, которые не вызывают значительного воспаления или иммунной реакции при введении пациенту.
"Молекулярный вес", как применяют в настоящем изобретении, обычно относится к относительной средней длине цепи блочного полимера, если не указано иначе. На практике, молекулярный вес можно оценить или охарактеризовать, применяя различные способы, включая гельпроникающую хроматографию (ГПХ) или капиллярную вискозиметрию. ГПХ молекулярные веса приводят в виде средневесового молекулярного веса (Mw), в противоположность среднечисловому молекулярному весу (Mn). Капиллярная вискозиметрия дает оценку молекулярного веса в виде характеристической вязкости, определенной для разбавленного раствора полимера, применяя конкретный набор концентраций, температур и растворителей.
"Гидрофильный", как применяют в настоящем изобретении, относится к свойству обладать сродством к воде. Например, гидрофильные полимеры (или гидрофильные сегменты полимерной цепи) представляют собой полимеры (или сегменты полимерной цепи), которые в основном являются растворимыми в водных растворах и/или имеют тенденцию поглощать воду. В общем, чем более гидрофильным является полимер, тем большую склонность растворятся в, смешиваться с или смачиваться водой имеет данный полимер.
"Гидрофобный", как применяют в настоящем изобретении, относится к свойству отсутствия сродства к воде или даже способности отталкивать воду. Например, чем более гидрофобным является полимер (или сегмент полимерной цепи), тем меньшую склонность растворяться в, смешиваться с или смачиваться водой имеет данный полимер.
"Слизь", как применяют в настоящем изобретении, относится к вязкоэластичному природному веществу, содержащему в основном муциновые гликопротеины и другие вещества, которые защищают эпителиальную поверхность различных органов/тканей, включая респираторную, назальную, шеечно-влагалищную, желудочно-кишечную, ректальную, зрительную и слуховую системы. "Мокрота", как применяют в настоящем изобретении, относится к крайне вязкоэластичным секрециям слизи, состоящим из ряда макромолекул, таких как ДНК, актины и другого клеточного детрита, высвобождающихся из мертвых клеток в добавление к муциновым гликопротеинам. "Мокрота" обычно присутствует в болезненных дыхательных путях пациентов, пораженных обструктивными заболеваниями легких, включая, но не ограничиваясь, астму, ХОБЛ и КФ. "Слизь при КФ" и "мокрота при КФ", как применяют в настоящем изобретении, относятся к слизи и мокроте, соответственно, у пациента, страдающего от кистозного фиброза.
"Агент, уменьшающий количество слизи", как применяют в настоящем изобретении, относится к веществу, которое увеличивает скорость мукоцилиарного клиренса при введении пациенту. Агенты, уменьшающие количество слизи, являются известными в данной области техники. См., например, Hanes, J. et al. Gene Delivery to the Lung, в Pharmaceutical Inhalation Aerosol Technology. Marcel Dekker. Inc., New York; 489-539 (2003). Примеры агентов, уменьшающих количество слизи, включают N-ацетилцистеин (NAC), который расщепляет дисульфидные и сульфгидрильные связи, присутствующие в слизи. Другие агенты, уменьшающие количество слизи, включают полынь, бромелайн, папаин, клеродендрум, ацетилцистеин, бромгексин, карбоцистеин, эпразинон, мезну, амброксол, собрерол, домиодол, денуфозол, летостеин, стэпронин, тиопронин, гелзолин, тимозин β4, нелтенексин, эрдостеин и различные ДНКазы, включая РНКазы.
Термин "поверхностно-активное вещество", как применяют в настоящем изобретении, относится к агенту, который снижает поверхностное натяжение жидкости.
Термин "терапевтический агент" относится к агенту, который можно вводить для предотвращения или лечения заболевания или расстройства. Терапевтические агенты могут представлять собой нуклеиновую кислоту, аналог нуклеиновой кислоты, небольшую молекулу, пептидомиметик, белок, пептид, углевод или сахар, липид или поверхностно-активное вещество, или их комбинацию.
Термин "лечение" или предотвращение заболевания, расстройства или состояния от возникновения у животного, которое может быть предрасположено к заболеванию, расстройству и/или состоянию, но которому еще не поставлен диагноз его наличия; ингибирование заболевания, расстройства или состояния, например, задерживание его развития; и облечение заболевания, расстройства или состояния, например, вызов ремиссии заболевания, расстройства и/или состояния. Лечение заболевания или состояния включает облегчение по меньшей мере одного симптома конкретного заболевания или состояния, даже если не воздействуют на лежащую в основе патофизиологию, такое как лечение боли у субъекта введением анальгезирующего агента, даже если данный агент не излечивает причину боли.
Термин "молекула, осуществляющая направленную доставку", как применяют в настоящем изобретении, относится к молекуле, которая локализуется в или далеко от конкретной области. Молекула может представлять собой, например, белок, нуклеиновую кислоту, аналог нуклеиновой кислоты, углевод или небольшую молекулу. Молекула может представлять собой, например, терапевтическое соединение, такое как небольшая молекула, или молекулу для диагностики, такую как детектируемая метка. Область может представлять собой ткань, в частности тип клеток, или внутриклеточный компартмент. В одном варианте осуществления группа, осуществляющая направленную доставку, управляет локализацией активной молекулы. Активная молекула может представлять собой небольшую молекулу, белок, полимер или метал. Активная молекула может быть пригодной для терапевтических, профилактических или диагностических целей.
Термин "терапевтически эффективное количество" относится к количеству терапевтического агента, который, при введении в и/или на частицах, описанных в настоящем изобретении, дает некоторый требуемый эффект при приемлемом соотношении риск/польза, применимом в любом терапевтическом лечении. Эффективное количество может изменяться в зависимости от таких факторов, как заболевание или состояние, которые лечат, конкретные направленные конструкты, которые вводят, размер субъекта, или тяжесть заболевания или состояния. Специалист в данной области техники может эмпирически определить эффективное количество конкретного соединения без необходимости чрезмерного экспериментирования.
Термины "включенный" и "инкапсулированный" относится к включению, формулированию или другому включению активного агента в и/или на композиции, которое обеспечивает высвобождение, такое как замедленное высвобождение, данного агента при требуемом применении. Термины предполагают любой способ, которым терапевтический агент или другой материал включают в полимерный матрикс, включая, например: присоединение к мономеру данного полимера (ковалентным, ионным или другим связывающим взаимодействием), физическое смешение, включение агента в покрывающий слой полимера, включение в полимер, распределение по полимерному матриксу, прикрепление к поверхности полимерного матрикса (ковалентным или другими связывающими взаимодействиями), инкапсулирование внутри полимерного матрикса и т.д. Термин "совместное включение" или "совместное инкапсулирование" относится к включению терапевтического агента или другого материала, и по меньшей мере одного другого терапевтического агента или другого материала в заявленную композицию.
Общепринятое применение термина "изотонический" относится к жидкостям, которые не вызывают расширение или уменьшение клеток, которое обычно протекает, когда суммарная концентрация растворенных веществ (осмоляльность) является равной осмоляльности крови (~300 мосмоль/кг). Изотонической определяют в настоящем изобретении как композицию, которая не вызывает проникновение или утечку воды через полость или которая регулируется осмотически через эпителий. Гипотоническая композиция, определенная в настоящем изобретении, относится к композициям, которые вызывают ток воды внутрь, в направлении эпителия от мукозальной поверхности, и гипертонические композиции определяют как композиции, которые вызывают ток воды наружу, в направлении поверхности, покрытой слизью.
"Частица, проникающая через слизь" или "MPP", как применяют в настоящем изобретении, обычно относится к частицам, которые содержат покрытие, улучшающее проникновение через слизь. В некоторых вариантах осуществления частицы представляют собой частицы активного агента, такого как терапевтический, диагностический, профилактический и/или нутрицевтический агент (т.е. частица лекарственного средства), которые содержат покрытие, улучшающее проникновение через слизь, как описано ниже. В других вариантах осуществления частицы образованы матриксным материалом, таким как полимерный материал, в котором инкапсулирован, диспергирован и/или к которому присоединен терапевтический, диагностический, профилактический и/или нутрицевтический агент. Материал покрытия может быть ковалетно или нековалентно соединен с частицей лекарственного средства или полимерной частицей.
II. Наночастицы, проникающие через слизь (MPP)
A. Полимерные частицы
1. Полимерное ядро
Любое количество биосовместимых полимеров можно применять для получения наночастиц. В одном варианте осуществления биосовместимый полимер(ры) является биоразлагаемым. В другом варианте осуществления частицы не являются биоразлагаемыми. В других вариантах осуществления частицы представляют собой смесь разлагаемых и неразлагаемых частиц.
Примеры полимеров включают, но не ограничиваются, полимеры, содержащие циклодекстрин, в частности катионные полимеры, содержащие циклодекстрин, такие как полимеры, описанные в патенте США №6509323; полимеры, полученные из лактонов, такие как поли(капролактон) (PCL); полигидроксикислоты и их сополимеры, такие как поли(молочная кислота) (PLA), поли(L-молочная кислота) (PLLA), поли(гликолевая кислота) (PGA), поли(молочная кислота-со-гликолевая кислота) (PLGA), поли(L-молочная кислота-со-гликолевая кислота) (PLLGA), поли(D,L-лактид) (PDLA), поли(D,L-лактид-со-капролактон), поли(D,L-лактид-со-капролактон-со-гликолид), поли(D,L-лактид-со-PEO-со-D,L-лактид), поли(D,L-лактид-со-PPO-со-D,L-лактид), и их смеси, полиалкилцианоакрилаты, полиуретаны, полиаминокислоты, такие как поли-L-лизин (PLL), поли(валериановая кислота), и поли-L-глютаминовая кислота; гидроксипропилметакрилат (HPMA); полиангидриды; полиэфиры; полиортоэфиры; поли(эфирные амиды); полиамиды; поли(эфиры алкоксикислот); поликарбонаты; полиалкилены, такие как полиэтилен и полипропилен; полиалкиленгликоли, такие как полиэтиленгликоль (ПЭГ) и полиалкиленоксиды (PEO), и их блочные сополимеры, такие как полиоксиалкиленоксид ("PLURONICS®"); полиалкилентерефталаты, такие как поли(этилентерефталат); этиленвинилацетатный полимер (EVA); поливиниловые спирты (PVA); поливиниловые эфиры; поливиниловые эфиры, такие как поли(винилацетат); поливинилгалогениды, такие как поли(винилхлорид) (PVC), поливинилпирролидон; полисилоксаны; полистиролы (PS); целлюлозы, включая модифицированные целлюлозы, такие как алкилцеллюлозы, гидроксиалкилцеллюлозы, эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, гидроксипропилцеллюлоза и карбоксиметилцеллюлоза; полимеры акриловых кислот, такие как поли(метил(мет)акрилат) (PMMA), поли(этил(мет)акрилат), поли(бутил(мет)акрилат), поли(изобутил(мет)акрилат), поли(гексил(мет)акрилат), поли(изодецил(мет)акрилат), поли(лаурил(мет)акрилат), поли(фенил(мет)акрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат), поли(октадецилакрилат) (вместе называемые в настоящем изобретении "полиакриловыми кислотами"); полидиоксанон и его сополимеры; полигидроксиалканоаты; полипропиленфумараты; полиоксиметилен; полоксамеры; поли(масляную кислоту); триметиленкарбонат; и полифосфазены. Примеры предпочтительных природных полимеров включают белки, такие как альбумин, коллаген, желатин и проламины, например, зеин, и полисахариды, такие как альгинат. Также можно применять сополимеры приведенных выше соединений, такие как статистические, блочные или привитые сополимеры, или смеси полимеров, приведенных выше.
Функциональные группы в полимере можно блокировать для изменения свойств полимера и/или изменения (например, снижения или увеличения) реакционной способности функциональной группы. Например, карбоксильный конец полимеров, содержащих карбоновые кислоты, таких как полимеры, содержащие лактид и гликолид, можно необязательно блокировать, например, этерификацией, и гидроксильный конец можно необязательно блокировать, например, эфиризацией или этерификацией.
Сополимеры ПЭГ или его производных с любым из полимеров, описанных выше, можно применять для получения полимерных частиц. В определенных вариантах осуществления ПЭГ или производные можно помещать во внутренние положения сополимера. Альтернативно, ПЭГ или производные можно помещать вблизи или в концевых положениях сополимера. Например, один или более из полимеров, описанных выше, можно терминировать блоком полиэтиленгликоля. В некоторых вариантах осуществления полимерное ядро представляет собой смесь пегилированного полимера и непегилированного полимера, где полимерное ядро является тем же самым (например, PLGA и PLGA-PEG) или отличным (например, PLGA-PEG и PLA). В определенных вариантах осуществления микрочастицы или наночастицы получают в условиях, которые позволяют областям ПЭГ образовывать отдельную фазу или иначе располагаться на поверхности частиц. Расположенные на поверхности области ПЭГ отдельно могут выполнять функцию или содержать агент, изменяющий свойства поверхности. В конкретных вариантах осуществления частицы получают из одного или более полимеров, терминированных блоками полиэтиленгликоля в качестве материала, изменяющего свойства поверхности.
Средневесовой молекулярный вес может изменяться для указанного полимера, но обычно составляет от приблизительно 1000 дальтон до 1000000 дальтон, 1000 дальтон - 500000 дальтон, 1000 дальтон - 250000 дальтон, 1000 дальтон - 100000 дальтон, 5000 дальтон - 100000 дальтон, 5000 дальтон - 75000 дальтон, 5000 дальтон - 50000 дальтон или 5000 дальтон - 25000 дальтон.
В некоторых вариантах осуществления частицы можно применять в качестве переносчиков генов на основе наночастиц. В данных вариантах осуществления частицы могут быть образованы одним или более поликатионными полимерами, которые закомплексованы с одной или более нуклеиновыми кислотами, которые являются отрицательно заряженными. Катионный полимер может представлять собой любой синтетический или природный полимер, несущий по меньшей мере два положительных заряда на молекулу и имеющий достаточную плотность заряда и молекулярный вес для связывания с нуклеиновой кислотой в физиологических условиях (т.е. pH и солевые условия, встречающиеся в организме или клетках). В определенных вариантах осуществления поликатионный полимер содержит один или более аминовых остатков.
B. Частицы лекарственных средств с покрытием
В некоторых вариантах осуществления частицы терапевтического, диагностического, профилактического и/или нутрицевтического агента содержат покрытие, улучшающее проникновение через слизь. Частица может представлять собой микрочастицы или наночастицы. Примеры терапевтических, диагностических, профилактических и/или нутрицевтических агентов описаны более подробно ниже. Частицы лекарственного средства можно покрывать покрывающими веществами, улучшающими проникновение через слизь, применяя способы, известные в данной области техники. Плотность и структуру покрытия можно оценить, как описано ниже. Покрытие, улучшающее проникновение через слизь, может быть ковалентно или нековалентно соединено с агентом. В некоторых вариантах осуществления оно присоединено нековалентно. В других вариантах осуществления активный агент содержит реакционноспособную функциональную группу, или введена функциональная группа, с которой можно ковалентно соединять покрытие, улучшающее проникновение через слизь.
C. Материалы, которые способствуют диффузии через слизь
Микро- и/или наночастицы предпочтительно покрывают или включают в них один или более агентов или материалов, изменяющих свойства поверхности. "Агенты, изменяющие свойства поверхности", как применяют в настоящем изобретении, относится к агенту или материалу, который изменяет одно или более из свойств поверхности частиц, включая, но не ограничиваясь, гидрофильность (например, делает частицы более или менее гидрофильными), поверхностный заряд (например, делает поверхность нейтральной или практически нейтральной или более отрицательной или положительной), и/или улучшает перенос в или через жидкости и/или ткани организма, такие как слизь. В некоторых вариантах осуществления материал, изменяющий свойства поверхности, обеспечивает непосредственный терапевтический эффект, такой как ослабление воспаления.
Примеры агентов, изменяющих свойства поверхности, включают, но не ограничиваются, белки, включая анионные белки (например, альбумин), поверхностно-активные вещества, сахара или производные сахаров (например, циклодекстрин), терапевтические агенты и полимеры. Предпочтительные полимеры включают гепарин, полиэтиленгликоль ("PEG") и полоксомеры (полиэтиленоксидные блочные сополимеры). Самым предпочтительным материалом является ПЭГ или PLURONIC F127®, полиэтиленоксидный блочный сополимер, имеющийся в наличии у BASF.
Примеры поверхностно-активных веществ включают, но не ограничиваются, L-α-фосфатидилхолин (PC), 1,2-пальмитоилфосфатидилхолин (DPPC), олеиновую кислоту, триолеат сорбитана, моноолеат сорбитана, монолаурат сорбитана, монолаурат полиоксиэтилен (20) сорбитана, моноолеат полиоксиэтилен (20) сорбитана, природный лецитин, олеилполиоксиэтиленовый (2) эфир, стеарилполиоксиэтиленовый (2) эфир, лаурилполиоксиэтиленовый (4) эфир, блочные сополимеры оксиэтилена и оксипропилена, синтетический лецитин, диолеат диэтиленгликоля, тетрагидрофурфурилолеат, этилолеат, изопропилмиристат, глицерилмоноолеат, глицерилмоностеарат, глицерилмонорицинолеат, цетиловый спирт, стеариловый спирт, полиэтиленгликоль 400, хлорид цетилпиридиния, хлорид бензалкония, оливковое масло, глицерилмонолаурат, кукурузное масло, хлопковое масло и подсолнечное масло, лецитин, олеиновую кислоту и триолеат сорбитана.
В одном варианте осуществления частицы покрывают или включают в них полиэтиленгликоль (ПЭГ) или F127. Альтернативно, ПЭГ или F127 может быть в виде блоков, ковалентно соединенных (например, внутри цепи или по одному или обоим концам) с полимерным ядром, применяемым для получения частиц. В конкретных вариантах осуществления частицы получают из блочных сополимеров, содержащих ПЭГ. В более конкретных вариантах осуществления частицы получают из блочных сополимеров, содержащих ПЭГ, где ПЭГ ковалентно соединен с концом полимера ядра. Примеры молекулярных весов ПЭГ включают 300 Да, 600 Да, 1 кДа, 2 кДа, 3 кДа, 4 кДа, 6 кДа, 8 кДа, 10 кДа, 15 кДа, 20 кДа, 30 кДа, 50 кДа, 100 кДа, 200 кДа, 500 кДа и 1 МДа, и все величины в диапазоне 300 дальтон - 1 МДа. В предпочтительных вариантах осуществления ПЭГ имеет молекулярный вес приблизительно 5 кДа. ПЭГ любого указанного молекулярного веса может изменяться по характеристикам, таким как длина, плотность и разветвленность.
1. Оценка поверхностной плотности
Поверхностная плотность поли(этиленгликоля) (ПЭГ) на микрочастицах и/или наночастицах представляет собой ключевой параметр для определения их успешного применения in vivo. (Как применяют в настоящем изобретении, общие ссылки на ПЭГ на поверхности можно экстраполировать на PLURONIC® F127.) Контролируемая доставка лекарственных средств к мукозальным поверхностям является проблематичной из-за присутствия защитного слоя слизи, и частицы, проникающие через слизь, являются перспективными относительно улучшенного распределения, удерживания и эффективности лекарственных средств на мукозальных поверхностях. Плотное покрытие ПЭГ на биоразлагаемых наночастицах может обеспечивать быстрое проникновение через слизь из-за сильно ослабленного адгезионного взаимодействия между компонентами слизи и наночастицами.
В предпочтительном варианте осуществления ядерный магнитный резонанс (ЯМР) применяют для оценки поверхностной плотности ПЭГ на полимерных наночастицах, содержащих ПЭГ, описанных в настоящем изобретении, и качественно, и количественно (пик ПЭГ обычно наблюдают при ~3,65 ppm). Когда наночастицы диспергируют в ЯМР растворителе D2O, только поверхностный ПЭГ, а не ПЭГ, включенный в ядро, можно непосредственно обнаружить ЯМР. Следовательно, ЯМР обеспечивает способ прямого измерения поверхностной плотности ПЭГ.
В некоторых вариантах осуществления поверхностную плотность ПЭГ можно контролировать получением частиц из смеси пегилированных и непегилированных частиц. Например, поверхностную плотность ПЭГ на наночастицах PLGA можно точно контролировать получением частиц из смеси поли(молочной-со-гликолевой кислоты) и поли(этиленгликоля) (PLGA-PEG). Количественный1H ядерный магнитный резонанс (ЯМР) можно применять для измерения поверхностной плотности ПЭГ на наночастицах. Отслеживание множества частиц в человеческой слизи и исследование связывания муцина и распределения в ткани во влагалище мышей показали, что существует пороговая величина плотности ПЭГ, которая приблизительно составляет 10-16 ПЭГ цепей/100 нм2, для того чтобы наночастицы PLGA-PEG эффективно проникали через слизь. Пороговая величина плотности может изменяться в зависимости от ряда факторов, включая полимерное ядро, применяемое для получения частиц, размер частиц и/или молекулярный вес ПЭГ.
Плотность покрытия может изменяться в зависимости от ряда факторов, включая материал, изменяющий свойства поверхности, и состав частиц. В одном варианте осуществления плотность материала, изменяющего свойства поверхности, такого как ПЭГ, как измерено1H ЯМР, составляет по меньшей мере 0,1, 0,2, 0,5, 0,8, 1, 2, 5, 8, 10, 15, 20, 25, 40, 50, 60, 75, 80, 90 или 100 цепей на нм2. Данный объем, указанный выше, включает все величины от 0,1 до 100 единиц на нм2. В конкретных вариантах осуществления плотность материала, изменяющего свойства поверхности, такого как ПЭГ, составляет от приблизительно 1 до приблизительно 25 цепей/нм2, от приблизительно 1 до приблизительно 20 цепей/нм2, от приблизительно 5 до приблизительно 20 цепей/нм2, от приблизительно 5 до приблизительно 18 цепей/нм2, от приблизительно 5 до приблизительно 15 цепей/нм2 или от приблизительно 10 до приблизительно 15 цепей/нм2. В других конкретных вариантах осуществления плотность составляет от приблизительно 0,05 до приблизительно 0,5 ПЭГ цепей/нм2.
Концентрацию материала, изменяющего свойства поверхности, такого как ПЭГ, можно также изменять. В конкретных вариантах осуществления плотность материала, изменяющего свойства поверхности (например, PEG), является такой, что материал, изменяющий свойства поверхности (например, PEG), принимает конфигурацию вытянутой щетки. В других вариантах осуществления масса материала, изменяющего свойства поверхности, составляет по меньшей мере 1/10000, 1/7500, 1/5000, 1/4000, 1/3400, 1/2500, 1/2000, 1/1500, 1/1000, 1/750, 1/500, 1/250, 1/200, 1/150, 1/100, 1/75, 1/50, 1/25, 1/20, 1/5, 1/2 или 9/10 массы частиц. Диапазон, указанный выше, включает все величины от 1/10000 до 9/10.
D. Эмульгатор
Частицы, описанные в настоящем изобретении, могут содержать эмульгатор, в частности низкомолекулярный эмульгатор. Эмульгатор вводят в частицу в процессе получения частиц и, следовательно, он представляет собой компонент конечной частицы. Эмульгатор можно инкапсулировать в частицу, диспергировать во всем или части полимерного матрикса (например, часть эмульгатора простирается наружу из полимерного матрикса), и/или соединять (например, ковалентно или нековалентно) с поверхностью частиц.
"Низкомолекулярный", как применяют в настоящем изобретении, обычно относится к эмульгатору, имеющему молекулярный вес, меньший чем 1500, 1400, 1300, 1200, 1100, 1000, 900, 800, 700, 600, 500, 400 или 300 а.е.м. В некоторых вариантах осуществления молекулярный вес является меньшим чем 1300 а.е.м. В некоторых вариантах осуществления молекулярный вес составляет от приблизительно 300 а.е.м. до приблизительно 1200 а.е.м.
Эмульгатор может быть положительно заряженным, отрицательно заряженным или нейтральным. Примеры отрицательно заряженных эмульгаторов включают, но не ограничиваются, натриевую соль холевой кислоты (CHA, MW=430) и диоктилсульфосукцинат натрия (DSS, MW=455). Примеры положительно заряженных эмульгаторов включают, но не ограничиваются, бромид гексадецилтриметиламмония (CTAB, MW=364). Примеры нейтральных эмульгаторов включают, но не ограничиваются, сапон (MW=1191), TWEEN 20 (MW=1225), TWEEN 80 (MW=1310) и эфир сахара D1216 (лаурат сахарозы, SE, MW=524). В добавление к низкомолекулярному весу, эмульгатор должен быть способен подходящим способом стабилизировать капли эмульсии при образовании частиц для того, чтобы предотвратить агрегацию частиц. В добавление к подходящей стабилизации капель эмульсии для предотвращения образования агрегатов, стабилизатор должен быть достаточно маленьким для того, чтобы полностью экранировать поверхность частиц кольцом материала, изменяющего свойства поверхности (например, PEG), обеспечивая нейтральный или практически нейтральный поверхностный заряд. Перенос заряженных частиц замедлятся из-за взаимодействия заряженных частиц с противоположно заряженными молекулами in vivo. Например, способность частицы быстро проникать через слизь зависит, по меньшей мере частично, от поверхностного заряда частиц. Для облегчения их диффузии через слизь, наночастицы, описанные в настоящем изобретении, обычно имеют практически нейтральный поверхностный заряд. В определенных вариантах осуществления наночастица обладает ζ-потенциалом от приблизительно 10 мВ до приблизительно -10 мВ, предпочтительно от приблизительно 5 мВ до приблизительно -5 мВ, предпочтительно от приблизительно 3 мВ до приблизительно -3 мВ, более предпочтительно от приблизительно 2 мВ до приблизительно -2 мВ.
Когда на частицы, описанные в настоящем изобретении, ссылаются как на наночастицы, они, таким образом, обычно имеют средний диаметр в диапазоне от 1 нм вплоть до, но не ограничиваясь, приблизительно 1 микрона, более предпочтительно от приблизительно 5 нм до приблизительно 500 нм, самое предпочтительное от приблизительно 5 нм до приблизительно 100 нм. В определенных вариантах осуществления средний диаметр частиц составляет от приблизительно 100 нм до приблизительно 150 нм. Однако можно получить частицы, которые имеют размер в микронном диапазоне. Условия и/или материалы, применяемые для получения частиц, могут изменяться с изменением размера частиц.
В определенных вариантах осуществления наночастицы сохраняют свой размер и ζ-потенциал после распыления или хранения в течение по меньшей мере 1 месяца, более предпочтительно по меньшей мере 2 месяцев, самое предпочтительное по меньшей мере 3 месяцев при 4°C.
2. Влияние эмульгатора на способность переноса
В некоторых вариантах осуществления частицы вводят для проникновения в слизь для доставки лекарственного средства в слизистую оболочку. Частицы, описанные в настоящем изобретении, содержат материал, изменяющий свойства поверхности, который может улучшать перенос через слизь. Например, блочные сополимеры, содержащие ПЭГ, могут осуществлять самосборку, образуя плотное, мукоинертное покрытие ПЭГ на поверхности капель эмульсии, образованных способом эмульсификации.
E. Терапевтический, профилактический, нутрицевтический и/или диагностический агент
1. Терапевтические агенты
В некоторых вариантах осуществления в частицы инкапсулирован, диспергирован и/или с их поверхностью ковалентно или нековалентно соединен один или более терапевтических агентов. Терапевтический агент может представлять собой небольшую молекулу, белок, полисахарид или сахарид, молекулу нуклеиновой кислоты и/или липид.
i. Низкомолекулярные терапевтические агенты
Примеры классов низкомолекулярных терапевтических агентов включают, но не ограничиваются, анальгетики, противовоспалительные лекарственные средства, жаропонижающие лекарственные средства, антидепрессанты, противосудорожные лекарственные средства, антипсихотические лекарственные средства, нейропротективные лекарственные средства, антипролиферативные лекарственные средства, такие как противораковое лекарственное средство, антиинфекционные лекарственные средства, такие как антибактериальные лекарственные средства и противогрибковые лекарственные средства, антигистаминные лекарственные средства, противомигренозные лекарственные средства, антимускариновые лекарственные средства, анксиолитики, седативные лекарственные средства, снотворные лекарственные средства, нейролептики, бронхолитические лекарственные средства, лекарственные средства против астмы, сердечно-сосудистые лекарственные средства, кортикостероиды, дофаминергические лекарственные средства, электролиты, желудочно-кишечные лекарственные средства, миорелаксанты, питательные вещества, витамины, парасимпатомиметики, стимуляторы, анорексигенные лекарственные средства и антинарколептические лекарственные средства. Можно также включать нутрицевтики. Они могут представлять собой витамины, добавки, такие как кальций или биотин, или природные ингредиенты, такие как растительные экстракты или фитогормоны.
ii. Нуклеиновые кислоты
В некоторых вариантах осуществления агент представляет собой одну или более нуклеиновых кислот. Нуклеиновая кислота может изменять, корректировать или заменять последовательность эндогенной нуклеиновой кислоты. Нуклеиновую кислоту применяют для лечения рака, коррекции дефектов в генах при других легочных заболеваниях и метаболических заболеваниях, воздействующих на функционирование легких, гены, такие как гены для лечения болезни Паркинсона и БАС, где гены попадают в мозг посредством назальной доставки.
Генотерапия представляет собой способ коррекции дефектных генов, ответственных за развитие заболевания. Исследователи могут применять один из нескольких подходов для коррекции дефектных генов: нормальный ген можно вставлять в неспецифическое место в геноме, замещая нефункциональный ген. Дефектный ген можно заменять нормальным геном посредством гомологичной рекомбинации. Дефектный ген можно исправлять посредством селективной обратной мутации, которая возвращает ген к его нормальному функционированию. Можно изменять регуляцию (степень, с которой ген включен или выключен) конкретного гена.
Нуклеиновая кислота может представлять собой ДНК, РНК, химически модифицированную нуклеиновую кислоту или их комбинации. Например, способы увеличения стабильности нуклеиновой кислоты и устойчивости к ферментативному расщеплению являются известными в данной области техники, и они могут включать одну или более модификаций или замещений гетероциклических оснований, сахаров или связей полинуклеотидов. Можно обычно получить нуклеиновую кислоту, имеющую свойства, которые подобраны с учетом требуемого применения. Стандартные модификации включают, но не ограничиваются, применение запертых нуклеиновых кислот (LNA), незапертых нуклеиновых кислот (UNA), морфолинов, пептидных нуклеиновых кислот (ПНК), фосфотиоатных связей, фосфоноацетатных связей, пропиновых аналогов, 2′-O-метил РНК, 5-Me-dC, 2-5′ соединенной фосфодиэфирной связи, химерных связей (смешанных фосфотиоатных и фосфодиэфирных связей и модификаций), конъюгацию с липидом и пептидами, и их комбинации.
В некоторых вариантах осуществления нуклеиновая кислота содержит модификации межнуклеотидных связей, такие как фосфатные аналоги, содержащие ахиральные и незаряженные межсубъединичные связи (например, Sterchak, E. P. et al., Organic Chem., 52:4202, (1987)), или незаряженные полимеры, на основе морфолина, содержащие ахиральные межсубъединичные связи (см., например, патент США №5034506). Некоторые аналоги межсубъединичных связей включают морфолидат, ацеталь и гетероциклы, соединенные полиамидной цепью. Другие остовы и модифицированные связи включают, но не ограничиваются, фосфотиоаты, пептидо-нуклеиновые кислоты, трицикло-ДНК, ложные олигонуклеотиды, рибозимы, шпигельмеры (содержащие L-нуклеиновые кислоты, аптамер с высоким связывающим сродством), или CpG олигомеры.
Фосфотиоаты (или S-олигонуклеотиды) представляют собой вариант нормальной ДНК, в которой один из немостиковых атомов кислорода заменен на серу. Замещение на серу межнуклеотидной связи резко ослабляет действие эндо- и экзонуклеаз, включая 5′-3′ и 3′-5′ ДНК POL 1 экзонуклеазу, нуклеазу S1 и P1, РНКазы, сывороточную нуклеазу и фосфодиэстеразу змеиного яда. Кроме того, способность пересечения липидного бислоя улучшается. Благодаря данным важным улучшениям, фосфотиоаты находят все возрастающее применение в клеточной регуляции. Фосфотиоаты получают двумя основными путями: действием раствора элементарной серы в дисульфиде углерода на гидрофосфонат, или более современным подходом введения серы в триэфир фосфита, или действием дисульфида тетраэтилтиурама (TETD), или 1,1-диоксидом 3H-1,2-бензодитиол-3-она (BDTD). Последний способ позволяет избежать проблемы нерастворимости элементарной серы в большинстве органических растворителей и токсичности дисульфида углерода. TETD и BDTD способы также дают фосфотиоаты с высокой чистотой.
Пептидо-нуклеиновые кислоты (ПНК) представляют собой молекулы, в которых фосфатный остов олигонуклеотидов полностью заменен повторяющимися N-(2-аминоэтил)глициновыми звеньями, и фосфодиэфирные связи заменены пептидными связями. Различные гетероциклические основания соединены с остовом метиленкарбонильными связями. ПНК сохраняют расстояния между гетероциклическими основаниями, которые являются аналогичными расстояниям в олигонуклеотидах, но являются ахиральными и нейтрально заряженными молекулами. Пептидо-нуклеиновые кислоты обычно состоят из мономеров пептидо-нуклеиновых кислот. Гетероциклические основания могут представлять собой любое из стандартных оснований (урацил, тимин, цитозин, аденин и гуанин) или любое из модифицированных гетероциклических оснований, описанных ниже. ПНК могут также содержать одну или более пептидных или аминокислотных вариантов и модификаций. Таким образом, компоненты остова ПНК могут представлять собой пептидные связи, или альтернативно, они могут представлять собой непептидные связи. Примеры включают ацетильные кэпы, аминоспейсеры, такие как 8-амино-3,6-диоксаоктановая кислота (называемая в настоящем изобретении O-линкерами), и подобные. Способы химической сборки ПНК являются хорошо известными.
В некоторых вариантах осуществления нуклеиновая кислота содержит одно или более химически модифицированных гетероциклических оснований, включая, но не ограничиваясь, инозин, 5-(1-пропинил)урацил (pU), 5-(1-пропинил)цитозин (pC), 5-метилцитозин, 8-оксоаденин, псевдоцитозин, псевдоизоцитозин, 5- и 2-амино-5-(2′-дезокси-β-D-рибофуранозил)пиридин (2-аминопиридин), и различные пирроло- и пиразолопиримидиновые производные, 4-ацетилцитозин, 8-гидрокси-N-6-метиладенозин, азиридинилцитозин, 5-(карбоксигидроксилметил)урацил, 5-бромурацил, 5-карбоксиметиламинометил-2-тиоурацил, 5-карбоксиметиламинометилурацил, дигидроурацил, N6-изопентениладенин, 1-метиладенин, 1-метилпсевдоурацил, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, N6-метиладенин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеуозин, 5′-метоксикарбонилметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту, оксибутоксозин, псевдоурацил, квеуозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, метиловый эфир N-урацил-5-оксиуксусной кислоты, 2,6-диаминопурин и 2′-модифицированные аналоги, такие как, но не ограничиваясь, O-метил, амино- и фтор-модифицированные аналоги. Ингибирующие РНК, модифицированные 2-фтор (2′-F) пиримидинами, по-видимому, обладают подходящими свойствами in vitro.
В некоторых вариантах осуществления нуклеиновая кислота содержит одну или более модификаций сахарного остатка, включая, но не ограничиваясь, 2′-O-аминоэтокси, 2′-O-аминоэтил (2′-OAE), 2′-O-метокси, 2′-O-метил, 2-гуанидоэтил (2′-OGE), 2′-O,4′-C-метилен (LNA), 2′-O-(метоксиэтил) (2′-OME) и 2′-О-(N-(метил)ацетамидо) (2′-OMA).
Способы генотерапии обычно основаны на введении в клетку молекулы нуклеиновой кислоты, которая изменяет генотип клетки. Введение молекула нуклеиновой кислоты может корректировать, заменять или иначе изменять эндогенный ген посредством генетической рекомбинации. Способы могут включать введение полной замещающей копии дефектного гена, гетерологического гена или небольшой молекулы нуклеиновой кислоты, такой как олигонуклеотид. Данный подход обычно требует систем доставки для введения замещающего гена в клетку, таких как вирусные векторы, созданные методами генетической инженерии.
Способы получения экспрессирующих векторов, содержащих генетические последовательности и подходящие транскрипционные и трансляционные регуляторные элементы, являются хорошо известными в данной области техники. Данные способы включают in vitro способы рекомбинантной ДНК, синтетические способы и in vivo генетическую рекомбинацию. Экспрессирующие векторы обычно содержат регуляторные последовательности, необходимые элементы для трансляции и/или транскрипции встроенной кодирующей последовательности. Например, кодирующая последовательность предпочтительно операбельно соединена с промотором и/или энхансером, способствующим контролю экспрессии требуемого генного продукта. Промоторы, применяемые в биотехнологии, могут быть разного типа, согласно предполагаемому типу контроля генной экспрессии. Их можно обычно разделить на конститутивные промоторы, промоторы, специфические для ткани или стадии развития, индуцируемые промоторы и синтетические промоторы.
Вирусные векторы включают аденовирусы, аденоассоциированный вирус, вирус герпеса, вирус коровьей оспы, вирус полиомиелита, вирус СПИД, нейронный трофический вирус, Синдбис и другие вирусы РНК, включая вирусы с основой ВИЧ. Также пригодными являются любые вирусные семейства, которые обладают свойствами данных вирусов, которые делают их пригодными для применения в качестве векторов. Обычно вирусные векторы содержат неструктурные ранние гены, структурные поздние гены, транскрипт РНК полимеразы III, инвертированные концевые повторы, необходимые для репликации и инкапсулирования, и промоторы для контроля транскрипции и репликации вирусного генома. При получении в качестве векторов, в вирусах обычно удален один или более ранних генов, и генная кассета или генная/промоторная кассета встроена в вирусный геном вместо удаленной вирусной ДНК.
Направленное воздействие на гены посредством направленной рекомбинации, такой как гомологичная рекомбинация (HR), представляет собой другую стратегию для коррекции генов. Генную коррекцию в целевом участке можно осуществлять ДНК фрагментами, гомологичными гену-мишени (Hu, et al., Mol. Biotech., 29:197-210 (2005); Olsen, et al., J. Gene Med., 7:1534-1544 (2005)). Один способ направленной рекомбинации включает применение олигонуклеотидов, образующих триплекс (TFO), которые связываются в виде трех цепей с гомопуриновыми/гомопиримидиновыми участками в дуплексной ДНК специфическим по последовательности способом. Олигонуклеотиды, образующие триплекс, могут взаимодействовать или с двухцепочечными или одноцепочечными нуклеиновыми кислотами. Когда триплексные молекулы взаимодействуют с областью-мишенью, образуется структура, называемая триплексом, в которой присутствуют три цепочки ДНК, образующие комплекс, зависящий и от спаривания оснований по Уотсону-Крику, и от хугстиновского спаривания оснований. Триплексные молекулы являются предпочтительными, поскольку они связываются с областями-мишенями с высоким сродством и специфичностью. Предпочтительно, чтобы молекулы, образующие триплекс, связывались с молекулой-мишенью с Kd, меньшей чем 10-6, 10-8, 10-10 или 10-12. Способы направленной генотерапии, применяя олигонуклеотиды, образующие триплекс (TFO), и пептидо-нуклеиновые кислоты (ПНК), описаны в опубликованной заявке США №20070219122, и их применение для лечения инфекционных заболеваний, таких как ВИЧ, описано в опубликованной заявке США №2008050920. Молекулы, образующие триплекс, могут также представлять собой пептидо-нуклеиновые кислоты с «зажатыми концами» (tcPNA), такие как пептидо-нуклеиновые кислоты, описанные в опубликованной заявке США №2011/0262406.
Молекулы, образующие двойные дуплексы, такие как пара псевдокомплементарных олигонуклеотидов, могут также вызывать рекомбинацию с донорным олигонуклеотидом в некотором участке хромосомы. Применение псевдокомплементарных олигонуклеотидов в направленной генотерапии описано в опубликованной заявке США №2011/0262406.
2. Диагностические агенты
Примеры диагностических материалов включают парамагнитные молекулы, флуоресцентные соединения, магнитные молекулы и радионуклиды. Подходящие диагностические агенты включают, но не ограничиваются, агенты для формирования рентгеновских изображений и контрастную среду. Радионуклиды также можно применять в качестве агентов для формирования изображений. Примеры других подходящих контрастных агентов включают газы или соединения, выделяющие газ, которые являются непроницаемыми для ионизирующей радиации. Наночастицы могут дополнительно содержать агенты, пригодные для определения места введенных частиц. Агенты, пригодные для данной цели, включают флуоресцентные метки, радионуклиды и контрастные агенты.
III. Фармацевтические композиции
Для вариантов осуществления, в которых один или более терапевтических, профилактических и/или диагностических агентов инкапсулируют в полимерных наночастицах и/или соединяют с поверхностью наночастицы, содержание лекарственного вещества в процентах составляет от приблизительно 1% до приблизительно 80%, от приблизительно 1% до приблизительно 50%, предпочтительно от приблизительно 1% до приблизительно 40% по весу, более предпочтительно от приблизительно 1% до приблизительно 20% по весу, самое предпочтительное от приблизительно 1% до приблизительно 10% по весу. Диапазоны, указанные выше, включают все величины от 1% до 80%. Для вариантов осуществления, в которых агент присоединяют к поверхности частицы, содержание в процентах может быть большим, поскольку количество лекарственного средства не ограничено способами инкапсулирования. В некоторых вариантах осуществления агент, который будут доставлять, можно инкапсулировать в наночастицу и присоединять к поверхности частицы.
Композиции, описанные в настоящем изобретении, содержат эффективное количество наночастиц ("MPP") в фармацевтическом носителе, подходящем для введения в мукозальную поверхность, где фармацевтический носитель отрегулирован так, чтобы он был гипотоническим. Специалист в данной области техники может легко регулировать тоничность фармацевтических носителей, когда определена требуемая ткань, которую будут подвергать лечению, на основе предпочтительных диапазонов тоничности, описанных в настоящем изобретении.
Тоничность представляет собой ′эффективную осмолярность′ и равна сумме концентраций растворенных веществ, которые обладают способностью проявлять осмотическую силу через мембрану. Ряд различных материалов можно применять для регулирования тоничности. Например, в USP 29-NF 24 перечислено пять эксципиентов, классифицированных как агенты, регулирующие тоничность, включая декстрозу, глицерин; хлорид калия; маннит; и хлорид натрия. См., например, United States Pharmacopeial Convention, Inc. United States Pharmacopeia 29-National Formulary 24. Rockville MD: U.S. Pharmacopeial Convention, Inc.; 2005: 3261; Day, A. Dextrose. в: Rowe RC, Sheskey PJ and Owen SC, eds. Handbook of Pharmaceutical Excipients. 5th ed. Washington DC: American Pharmaceutical Association; 2005: 231-233; Price JC. Glycerin. в: Rowe RC, Sheskey PJ and Owen SC, eds. Handbook of Pharmaceutical Excipients. 5th ed. Washington DC: American Pharmaceutical Association 2005: 301-303; Price JC. Glycerin. в: Rowe RC, Sheskey PJ and Owen SC, eds. Handbook of Pharmaceutical Excipients. 5th ed. Washington DC: American Pharmaceutical Association; 2005: 301-303; Armstrong NA. Mannitol. в: Rowe RC, Sheskey PJ and Owen SC, eds. Handbook of Pharmaceutical Excipients. 5th ed. Washington DC: American Pharmaceutical Association; 2005: 449-453; Owen SC. Sodium Chloride. в: Rowe RC, Sheskey PJ and Owen SC, eds. Handbook of Pharmaceutical Excipients. 5th ed. Washington DC: American Pharmaceutical Association; 2005: 671-674. Маннит представляет собой пример перечисленного в GRAS ингредиента, одобренного для применения в качестве пищевой добавки в Европе, включенный в базу данных неактивных ингредиентов управления по контролю качества пищевых продуктов и лекарственных средств (внутрибрюшинная, внутримышечная, внутрижелудочная и подкожная инъекции; вливание; буккальные, пероральные и сублингвальные таблетки, порошки и капсулы; офтальмические препараты; растворы для местного применения), включенный в непарентеральные и парентеральные лекарственные средства, имеющие разрешение в Великобритании, и включенный в базу данных лекарственных средств природного происхождения Канады. 5,07% масс./об. водный раствор является изоосмотическим сыворотке крови.
Минимально гипотонические композиции, предпочтительно в диапазоне 20-220 мосмоль/кг, обеспечивают быструю и равномерную доставку MPP ко всей поверхности влагалища, с минимальным риском эпителиальной токсичности. Имеется более высокая осмолярность в толстой кишке, так что среды с осмолярностью выше осмолярности плазмы крови (обычно считают изотонической при ~300 мосмоль/кг) приводят к улучшениям распределения в толстой кишке. Диапазон для улучшения распределения в толстой кишке с помощью гипотонической среды в толстой кишке составляет ~20 мосмоль/кг - 450 мосмоль/кг, если основная доля растворенных веществ в композиции состоит из Na+ ионов, поскольку они будут активно поглощаться (абсорбироваться) эпителием, таким образом, делая композицию эффективно гипотонической, даже если она является гиперосмоляльной относительно крови.
A. Ингаляционные композиции
Фармацевтические композиции и способы ингаляционного введения активных агентов пациентам являются известными в данной области техники.
Дыхательные пути представляют собой структуру, участвующую в обмене газами между атмосферой и кровотоком. Дыхательные пути включают верхние дыхательные пути, включая ротовую часть глотки и дыхательное горло, с последующими нижними дыхательными путями, которые включают трахею, с последующими разветвлениями на бронхи и бронхиолы. Верхние и нижние дыхательные пути называют дыхательными путями, в которых не происходит газообмен. Затем терминальные бронхиолы разделяются на дыхательные бронхиолы, которые затем переходят в конечную дыхательную зону, альвеолы или глубинные легкие, в которых протекает обмен газами.
Композиции можно разделить на порошковые композиции и жидкие композиции. И порошковые, и жидкие композиции можно применять для получения аэрозольных композиций. Термин аэрозоль, как применяют в настоящем изобретении, относится к любому препарату мелкодисперсных частиц, которые могут быть в растворе или суспензии, получены ли они, применяя пропеллент, или нет.
1. Порошковые композиции
Порошковые композиции представляют собой мелкодисперсные твердые композиции, содержащие носители для наночастиц, которые являются пригодными для легочного введения. Порошковые композиции содержат, как минимум, один или более носителей для наночастиц, которые являются пригодными для легочного введения. Данные порошковые композиции можно вводить посредством легочной ингаляции пациенту, не используя любой носитель, отличный от воздуха или подходящего пропеллента.
В других вариантах осуществления порошковые композиции содержат один или более генных носителей для наночастиц в комбинации с фармацевтически приемлемым носителем. В данных вариантах осуществления генные носители для наночастиц и фармацевтический носитель можно формулировать в виде нано- или микрочастиц для доставки в легкие.
Фармацевтический носитель может включать наполнитель или липид, или поверхностно-активное вещество. Природные поверхностно-активные вещества, такие как дипальмитоилфосфатидилхолин (DPPC), являются самыми предпочтительными. Синтетические и животные ингаляционные поверхностно-активные вещества включают экзосульф - смесь DPPC с гексадеканолом и тилоксаполом, добавленными в качестве агентов, усиливающих растекание, пумактант (соединение для расширения аппарата искусственного дыхания или ALEC) - смесь DPPC и PG, KL-4 - состоящий из DPPC, пальмитоилолеоилфосфатидилглицерина и пальмитиновой кислоты в комбинации с 21 аминокислотным пептидом, который имитирует структурные характеристики SP-B, вентикут - DPPC, PG, пальмитиновая кислота и рекомбинантный SP-C, альвеофакт - экстрагированный из жидкости лаважа легких коровы, куросурф - экстрагированный из материала, полученного из молотого легкого свиньи, инфасурф - экстрагированный из жидкости лаважа легких теленка, и сурванта - экстрагированный из молотого легкого коровы с добавлением DPPC, пальмитиновой кислоты и трипалмитина. Экзосурф, куросурф, инфасурф и сурванта представляют собой поверхностно-активные вещества, одобренные в настоящее время FDA для применения в США.
Фармацевтический носитель может также включать один или более стабилизирующих агентов или диспергаторов. Фармацевтический носитель может также включать один или более регуляторов pH или буферов. Подходящие буферы включают органические соли, полученные из органических кислот и оснований, такие как цитрат натрия или аскорбат натрия. Фармацевтический носитель может также включать одну или более солей, таких как хлорид натрия или хлорид калия.
Порошковые композиции обычно получают смешением одного или более носителей для наночастиц с одним или более фармацевтически приемлемыми носителями. Необязательно, дополнительные активные агенты можно вводить в смесь, как обсуждается ниже. Затем смесь формуют до частиц, подходящих для ингаляционного введения, применяя способы, известные в данной области техники, такие как лиофилизация, распылительная сушка, агломерация, покрытие напылением, коацервация, низкотемпературное литье, измельчение (например, мельница, работающая воздушным истиранием (струйная мельница), шаровая мельница), гомогенизация высокого давления и/или кристаллизация в сверхкритической жидкости.
Подходящий способ получения частиц можно выбрать на основе требуемого размера частиц, распределения размера частиц и структуры частиц, требуемой для композиции. В некоторых случаях способ получения частиц выбирают так, чтобы получить набор частиц с требуемым размером частиц, распределением размеров частиц для ингаляционного введения. Альтернативно, способ получения частиц может давать набор частиц, из которого выбирают набор частиц с требуемым размером частиц, распределением размеров частиц для ингаляционного введения, например, просеиванием.
В данной области техники известно, что структура частиц влияет на глубину проникновения частицы в легкое. Соответственно, порошковые композиции перерабатывают в частицы, имеющие подходящий масс-медианный аэродинамический диаметр (MMAD), насыпную плотность и поверхностную шероховатость для достижения доставки одного или более активных агентов в требуемую область(и) легкого. Например, предпочтительные структуры частиц для доставки в глубокое легкое являются известными в данной области техники, и описаны, например, в патенте США №7052678 Vanbever, et al.
Частицы, имеющие масс-медианный аэродинамический диаметр (MMAD), больший чем приблизительно 5 микрон, обычно не достигают легких; вместо этого они, как правило, оседают на задней части горла и проглатываются. Частицы, имеющие диаметры от приблизительно 3 до приблизительно 5 микрон, являются достаточно маленькими для достижения верхних и средних областей дыхательной системы (дыхательные пути, в которых не происходит газообмен), но могут быть слишком большими для достижения альвиол. Меньшие частицы, (т.е. от приблизительно 0,5 до приблизительно 3 микрон) способны эффективно достигать области альвеол. Частицы, имеющие диаметры, меньшие чем приблизительно 0,5 микрон, могут также откладываться в области альвеол осаждением.
Точный диапазон размера частиц, эффективный для достижения доставки в альвеолярную область, будет зависеть от нескольких факторов, включая насыпную плотность доставляемых частиц. В общем, по мере снижения насыпной плотности MMAD частиц, способных эффективно достигать альвеолярной области легких, будет возрастать. Следовательно, в случае частиц с низкими насыпными плотностями, частицы, имеющие диаметры от приблизительно 3 до приблизительно 5 микрон, от приблизительно 5 до приблизительно 7 микрон, или от приблизительно 7 до приблизительно 9,5 микрон, можно эффективно доставлять в легкие. Предпочтительный аэродинамический диаметр для максимального отложения в легких можно рассчитать. См., например, патент США №7052678 Vanbever, et al.
Микрочастицы не могут диффундировать через слизь, даже если их поверхность является мукоинертной. Однако частицы, проникающие через слизь, можно инкапсулировать в микрочастицы для осаждения в верхней части легких и последующего высвобождения наночастиц. В некоторых случаях частицы имеют сферическую или овальную форму. Частицы могут иметь гладкую или шероховатую структуру поверхности. Частицы можно также покрывать полимером или другим подходящим материалом для контролирования доставки одного или более активных агентов в легкие.
Порошковые композиции можно вводить в виде сухого порошка, применяя подходящие способы, известные в данной области техники. Альтернативно, порошковые композиции можно суспендировать в жидких композициях, описанных ниже, и вводить в легкое, применяя способы, известные в данной области техники для доставки жидких композиций.
2. Жидкие композиции
Жидкие композиции содержат один или более носителей для наночастиц, суспендированные в жидком фармацевтическом носителе. Подходящие жидкие носители включают, но не ограничиваются, воду, соляной раствор и другие физиологически приемлемые водные растворы, содержащие соли и/или буферы, такие как физиологический раствор с фосфатным буфером (PBS), раствор Рингера и изотонический хлорид натрия, или любой другой водный раствор, пригодный для введения животному или человеку, который доведен до требуемой гипотоничности, как показано осмотически обусловленным током воды через эпителий от люминальной (мукозальной) поверхности к серозной поверхности. У определенных мукозальных поверхностей, таких как толстая кишка, "гиперосмоляльные жидкие носители (определенные в общепринятом смысле относительно осмоляльности крови) могут действительно быть гипотоническими в толстой кишке и вызывать поглощение жидкости эпителием. Действительно, изотонические композиции до сих пор нельзя было описать в легком, и при определенных болезненных состояних, таких как кистозный фиброз, осмоляльность бронхоальвеолярного секрета является гиперосмоляльной (большей, чем осмоляльность крови).
Предпочтительно, жидкие композиции являются слегка гипотоническими относительно физиологических жидкостей и приблизительно того же pH, в диапазоне, например, от приблизительно pH 4,0 до приблизительно pH 7,4, более предпочтительно от приблизительно pH 6,0 до pH 7,0. Жидкий фармацевтический носитель может содержать один или более физиологически совместимых буферов, таких как фосфатные буферы. Специалист в данной области техники может легко определить подходящее солевое содержание и pH для водного раствора для ингаляционного введения.
Жидкие композиции могут содержать один или более суспендирующих агентов, таких как производные целлюлозы, альгинат натрия, поливинилпирролидон, трагакантовая камедь или лецитин. Жидкие композиции могут также содержать один или более консервантов, таких как этил или н-пропил п-пропилгидроксибензоат.
В некоторых случаях жидкая композиция может содержать один или более растворителей, которые представляют собой низкотоксичные органические (т.е. неводные) остаточные растворители 3 класса, такие как этанол, ацетон, этилацетат, тетрагидрофуран, этиловый эфир и пропанол. Данные растворители можно выбрать, исходя из их способности легко переводить композицию в аэрозольное состояние. Любой данный растворитель, включенный в жидкую композицию, не должен с ущербом реагировать с одним или более активными агентами, присутствующими в жидкой композиции. Растворитель должен быть достаточно летучим для того, чтобы обеспечить образование аэрозоля раствора или суспензии. Дополнительные растворители или агенты, приводящие к образованию аэрозоля, такие как фреон, спирт, гликоль, полигликоль или жирная кислота, можно также включать в жидкую композицию, как требуется для увеличения летучести и/или изменения способности раствора или суспензии переходить в аэрозольное состояние.
Жидкие композиции могут также содержать небольшие количества полимеров, поверхностно-активных веществ или других эксципиентов, хорошо известных специалисту в данной области техники. В данном контексте "небольшие количества" означает то, что отсутствуют эксципиенты, которые могли бы неблагоприятно влиять на поглощение одного или более активных агентов в легких.
3. Аэрозольные композиции
Порошковые и жидкие композиции, описанные выше, можно применять для получения аэрозольных композиций для ингаляционного введения. Аэрозоли для доставки терапевтических агентов в дыхательные пути являются известными в данной области техники. Термин аэрозоль, как применяют в настоящем изобретении, относится к любому препарату мелкой дисперсии твердых или жидких частиц, суспендированных в газе. В некоторых случаях газ может представлять собой пропеллент; однако это не обязательно. Аэрозоли можно получить, применяя ряд стандартных способов, включая ультразвуковую обработку или обработку под высоким давлением.
В некоторых случаях для введения композиции в легкие применяют устройство. Подходящие устройства включают, но не ограничиваются, порошковые ингаляторы, дозирующие ингаляторы под давлением, распылители и электрогидродинамические аэрозольные устройства. Ингаляцию можно осуществлять через нос и/или рот пациента. Введение можно осуществлять самовведением композиции при ингаляции или введением композиции через респиратор пациенту с респиратором.
B. Местные и офтальмические композиции
Местные или энтеральные композиции можно получить в виде водных композиций, применяя способы, известные в данной области техники. Обычно данные композиции можно получить в виде растворов или суспензий; твердых форм, подходящих для применения в получении растворов или суспензий после добавления среды для растворения перед введением; эмульсий, таких как эмульсии воды в масле (w/o), эмульсии масла в воде (o/w) и их микроэмульсии, липосом, эмульсом, спреев, гелей, кремов или мазей.
Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, один или более полиолов (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), масла, такие как растительные масла (например, арахисовое масло, кукурузное масло, кунжутное масло и т.д.) и их комбинации. Подходящую текучесть можно поддерживать, например, применяя покрытие, такое как лецитин, поддержанием требуемого размера частиц в случае дисперсии и/или применением поверхностно-активных веществ. Во многих случаях предпочтительно включать агенты, например, сахара или хлорид натрия, регулируя тоничность.
Растворы и дисперсии активных соединений в виде свободной кислоты или основания или их фармакологически приемлемых солей можно получить в водном или другом растворителе или диспергирующей среде, подходящим способом смешанными с одним или более фармацевтически приемлемыми эксципиентами, включая, но не ограничиваясь, поверхностно-активные вещества, диспергаторы, эмульгаторы, агенты, регулирующие pH, и их комбинацию.
Подходящие поверхностно-активные вещества могут представлять собой анионные, катионные, амфотерные или неионные поверхностно-активные агенты. Подходящие анионные поверхностно-активные вещества включают, но не ограничиваются, вещества, содержащие карбоксилатный, сульфонатный и сульфатный ионы. Примеры анионных поверхностно-активных веществ включают длинноцепочечные алкилсульфонаты и алкиларилсульфонаты натрия, калия, аммония, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как бис(2-этилтиоксил)сульфосукцинат натрия; и алкилсульфаты, такие как лаурилсульфат натрия. Катионные поверхностно-активные вещества включают, но не ограничиваются, соединения четвертичного аммония, такие как хлорид бензалкония, хлорид бензетония, бромид цетримония, хлорид стеарилдиметилбензиламмония, полиоксиэтилен и кокосовый амин. Примеры неионных поверхностно-активных веществ включают моностеарат этиленгликоля, миристат пропиленгликоля, глицерилмоностеарат, глицерилстеарат, полиглицерил-4-олеат, ацилат сорбитана, ацилат сахарозы, лаурат ПЭГ-150, монолаурат ПЭГ-400, полиоксиэтиленмонолаурат, полисорбаты, полиоксиэтиленоктилфениловый эфир, цетиловый эфир ПЭГ-1000, полиоксиэтилентридециловый эфир, полипропиленгликольбутиловый эфир, полоксамер® 401, стеароилмоноизопропаноламид и полиоксиэтиленамид гидрогенизированного твердого животного жира. Примеры амфотерных поверхностно-активных веществ включают N-додецил-бета-аланин натрия, N-лаурил-бета-иминодипропионат натрия, миристоамфоацетат, лаурилбетаин и лаурилсульфобетаин.
Композиция может содержать консервант для предотвращения роста микроорганизмов. Подходящие консерванты включают, но не ограничиваются, парабены, хлорбутанол, фенол, сорбиновую кислоту и тимеросал. Композиция может также содержать антиоксидант для предотвращения разрушения активного агента(ов).
Композицию обычно доводят буфером до pH 3-8 для введения после растворения. Подходящие буферы включают, но не ограничиваются, фосфатные буферы, ацетатные буферы и цитратные буферы.
Растворимые в воде полимеры часто применяют в фармацевтических композициях. Подходящие растворимые в воде полимеры включают, но не ограничиваются, поливинилпирролидон, декстран, карбоксиметилцеллюлозу и полиэтиленгликоль.
Стерильные растворы можно получить введением активных соединений в требуемом количестве в подходящий растворитель или дисперсионную среду с одним или более из эксципиентов, перечисленных выше, при необходимости, с последующей стерилизующей фильтрацией. Обычно дисперсии получают введением различных стерилизованных активных ингредиентов в стерильную среду, которая содержит основную дисперсионную среду и другие требуемые ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, предпочтительные способы получения представляют собой способы вакуумной сушки и лиофилизации, которые дают порошок активного ингредиента плюс любой дополнительный требуемый ингредиент из их заранее стерилизованного фильтрованием раствора. Порошки можно получить таким способом, что частицы будут пористыми, что может улучшить растворение частиц. Способы получения пористых частиц являются хорошо известными в данной области техники.
Фармацевтические композиции для глазного введения предпочтительно представляют собой стерильный водный раствор или суспензию частиц, полученных из одного или более конъюгатов полимера и лекарственного средства. Подходящие растворители включают, например, воду, раствор Рингера, осмолярный (PBS) и изоосмолярный раствор хлорида натрия, которые доведены до требуемой гипотоничности для глаза, как определено, применяя MPP для наблюдения вызванного осмотически тока воды (слезная жидкость). Композиция может также представлять собой стерильный раствор, суспензию или эмульсию в нетоксичном, парентерально приемлемом разбавителе или растворителе, таком как 1,3-бутандиол.
В некоторых случаях композицию распределяют или упаковывают в жидкой или полутвердой форме, такой как раствор (глазные капли), суспензия, гель, крем или мазь. Альтернативно, композиции для глазного введения можно упаковывать в твердом виде, полученном, например, лиофилизацией подходящей жидкой композиции. Твердое вещество можно растворять в подходящем носителе или разбавителе перед введением.
Растворы, суспензии или эмульсии для глазного введения можно забуферить эффективным количеством буфера, необходимого для поддержания pH, подходящего для глазного введения. Подходящие буферы являются хорошо известными специалисту в данной области техники, и некоторые примеры подходящих буферов представляют собой ацетатные, боратные, карбонатные, цитратные и фосфатные буферы. Растворы, суспензии или эмульсии для глазного введения могут также содержать один или более агентов, регулирующих тоничности, регулируя тоничность композиции до умеренно гипотоничного диапазона. Подходящие агенты, регулирующие тоничность, являются хорошо известными в данной области техники, и некоторые примеры включают глицерин, маннит, сорбит, хлорид натрия и другие электролиты.
Растворы, суспензии или эмульсии для глазного введения могут также содержать один или более консервантов для предотвращения бактериального загрязнения офтальмических препаратов. Подходящие консерванты являются известными в данной области техники и включают полигексаметиленбигуанидин (PHMB), хлорид бензалкония (BAK), стабилизированные оксихлорные комплексы (иначе известные как Purite®), ацетат фенилртути, хлорбутанол, сорбиновую кислоту, хлоргексидин, бензиловый спирт, парабены, тимеросал и их смеси.
Растворы, суспензии или эмульсии для глазного введения могут также содержать один или более эксципиентов, известных в данной области техники, таких как диспергаторы, смачивающие агенты и суспендирующие агенты.
В еще других вариантах осуществления наночастицы формулируют для местного введения на слизистую оболочку. Подходящие лекарственные формы для местного введения включают крема, мази, бальзамы, спреи, гели, лосьоны и эмульсии. Композиции могут содержать один или более химических усилителей проникновения, агентов, улучшающих мембранную проницаемость, агентов, улучшающих мембранный транспорт, смягчающие средства, поверхностно-активные вещества, стабилизаторы и их комбинацию. В некоторых вариантах осуществления наночастицы можно вводить в виде жидкой композиции, такой как раствор или суспензия, полутвердой композиции, такой как гель, лосьон или мазь, или твердой композиции. "Гель" представляет собой коллоид, в котором диспергированная фаза смешана с непрерывной фазой, давая полутвердый материал, такой как желе.
В некоторых вариантах осуществления наночастицы формулируют в виде жидкостей, включая растворы и суспензии, такие как глазные капли, или полутвердой композиции, такой как мазь или лосьон для местного нанесения на слизистую оболочку, такую как глаз, или вагинально, или ректально.
Композиция может содержать один или более эксципиентов, таких как смягчающие средства, поверхностно-активные вещества и эмульгаторы.
"Смягчающие средства" представляют собой агент, наносимый наружно, который смягчает или «успокаивает» кожу, и они обычно являются известными в данной области техники и перечислены в справочнике, таком как "Handbook of Pharmaceutical Excipients", 4th Ed., Pharmaceutical Press, 2003. Они включают, без ограничения, миндальное масло, касторовое масло, экстракт рожкового дерева, цетостеароиловый спирт, цетиловый спирт, воск цетиловых эфиров, холестерин, хлопковое масло, циклометикон, пальмитостеарат этиленгликоля, глицерин, моностеарат глицерина, глицерилмоноолеат, изопропилмиристат, изопропилпальмитат, ланолин, лецитин, легкое минеральное масло, триглицериды со средней длиной цепи, минеральное масло и ланолиновые спирты, вазелин, вазелин и ланолиновые спирты, соевое масло, крахмал, стеариловый спирт, подсолнечное масло, ксилит и их комбинации. В одном варианте осуществления смягчающие средства представляют собой этилгексилстеарат и этилгексилпальмитат.
"Поверхностно-активные вещества" представляют собой поверхностно-активные агенты, которые снижают поверхностное натяжение и, посредством этого, улучшают эмульгирующие, пенообразующие, диспергирующие, смачивающие свойства и свойства распределения продукта. Подходящие неионные поверхностно-активные вещества включают эмульгирующий воск, глицерилмоноолеат, полиоксиэтиленалкильные эфиры, производные полиоксиэтиленкасторового масла, полисорбат, эфиры сорбитана, бензиловый спирт, бензилбензоат, циклодекстрины, моностеарат глицерина, полоксамер, повидон и их комбинации. В одном варианте осуществления неионное поверхностно-активное вещество представляет собой стеариловый спирт.
"Эмульгаторы" представляют собой поверхностно-активные вещества, которые содействуют формированию суспензии одной жидкости в другой и способствуют образованию стабильной смеси или эмульсии масла и воды. Стандартные эмульгаторы представляют собой: содержащие металл мыла, определенные животные и растительные масла и различные полярные соединения. Подходящие эмульгаторы включают камедь, анионный эмульгирующий воск, стеарат кальция, карбомеры, цетостеариловый спирт, цетиловый спирт, холестерин, диэтаноламин, пальмитостеарат этиленгликоля, моностеарат глицерина, глицерилмоноолеат, гидроксипропилцеллюлозу, гипромеллозу, ланолин, водный, ланолиновые спирты, лецитин, триглицериды со средней длиной цепи, метилцеллюлозу, минеральное масло и ланолиновые спирты, одноосновный фосфат натрия, моноэтаноламин, неионный эмульгирующий воск, олеиновую кислоту, полоксамер, полоксамеры, полиоксиэтиленалкильные эфиры, производные полиоксиэтиленкасторового масла, эфиры жирных кислот и полиоксиэтиленсорбитана, полиоксиэтиленстеараты, альгинат пропиленгликоля, самоэмульгирующийся глицерилмоностеарат, дигидрат цитрата натрия, лаурилсульфат натрия, эфиры сорбитана, стеариновую кислоту, подсолнечное масло, трагакант, триэтаноламин, ксантановую камедь и их комбинации. В одном варианте осуществления эмульгатор представляет собой стеарат глицерина.
Подходящие классы агентов, улучшающих проникновение, являются известными в данной области техники и включают, но не ограничиваются, жирные спирты, эфиры жирных кислот, жирные кислоты, простые эфиры жирных спиртов, аминокислоты, фосфолипиды, лецитины, холатные соли, ферменты, амины и амиды, комплексообразующие агенты (липосомы, циклодекстрины, модифицированные целлюлозы и диимиды), макроциклы, такие как макроциклические лактоны, кетоны и ангидриды и циклические мочевины, поверхностно-активные вещества, N-метилпирролидоны и их производные, ДМСО и родственные соединения, ионные соединения, азон и родственные соединения, и растворители, такие как спирты, кетоны, амиды, полиолы (например, гликоли). Примеры данных классов являются известными в данной области техники.
"Масло" представляет собой композицию, содержащую по меньшей мере 95% по весу липофильного вещества. Примеры липофильных веществ включают, но не ограничиваются, природные и синтетические масла, жиры, жирные кислоты, лецитины, триглицериды и их комбинации.
"Непрерывная фаза" относится к жидкости, в которой суспедированы твердые вещества или диспергированы капли другой жидкости, и ее иногда называют внешней фазой. Это также относится к жидкой фазе коллоида, в которой распределены твердые или жидкие частицы. Если непрерывная фаза представляет собой воду (или другой гидрофильный растворитель), растворимые в воде или гидрофильные лекарственные средства будут растворяться в непрерывной фазе (в противоположность диспергированию). В многофазной композиции (например, эмульсии), дискретную фазу суспендируют или диспергируют в непрерывной фазе.
"Эмульсия" представляет собой композицию, содержащую смесь несмешивающихся компонентов, гомогенно смешанных вместе. В конкретных вариантах осуществления несмешивающиеся компоненты включают липофильный компонент и водный компонент. Эмульсия представляет собой препарат одной жидкости, распределенной в виде небольших капель по всей второй жидкости. Диспергированная жидкость представляет собой прерывистую фазу, и диспергирующая среда представляет собой непрерывную фазу. Когда масло представляет собой диспергируемую жидкость, и водный раствор представляет собой непрерывную фазу, она известна как эмульсия масла в воде, тогда как когда вода или водный раствор представляет собой диспергируемую фазу, и масло или маслянистое вещество представляет собой непрерывную фазу, она известна как эмульсия воды в масле. Обе или любая из масляной фазы и водной фазы может содержать один или более поверхностно-активных веществ, эмульгаторов, стабилизаторов эмульсии, буферов и других эксципиентов. Предпочтительные эксципиенты включают поверхностно-активные вещества, особенно неионные поверхностно-активные вещества; эмульгаторы, особенно эмульгирующие воски; и жидкие нелетучие неводные материалы, в частности гликоли, такие как пропиленгликоль. Масляная фаза может содержать другие масляные фармацевтически одобренные эксципиенты. Например, материалы, такие как гидроксилированное касторовое масло или кунжутное масло, можно применять в масляной фазе в качестве поверхностно-активных веществ или эмульгаторов.
Эмульсия представляет собой препарат одной жидкости, распределенной в виде маленьких капель по всей второй жидкости. Диспергированная жидкость представляет собой прерывную фазу, и диспергирующая среда представляет собой непрерывную фазу. Когда масло представляет собой диспергированную жидкость и водный раствор представляет собой непрерывную фазу, она известна как эмульсия масла в воде, тогда как когда вода или водный раствор представляет собой диспергированную фазу и масло или маслянистое вещество представляет собой непрерывную фазу, она известна как эмульсия воды в масле. Масляная фаза может состоять, по меньшей мере частично, из пропеллента, такого как пропеллент HFA. Любая или обе из масляной фазы и водной фазы могут содержать один или более поверхностно-активных веществ, эмульгаторов, стабилизаторов эмульсии, буферов и других эксципиентов. Предпочтительные эксципиенты включают поверхностно-активные вещества, особенно неионные поверхностно-активные вещества; эмульгаторы, особенно эмульгирующие фоски; и жидкие нелетучие неводные материалы, в частности гликоли, такие как пропиленгликоль. Масляная фаза может содержать маслянистые фармацевтически одобренные эксципиенты. Например, материалы, такие как гидроксилированное касторовое масло или кунжутное масло, можно применять в масляной фазе в качестве поверхностно-активных веществ или эмульгаторов.
Поднабор эмульсий представляют собой самоэмульгирующиеся системы. Данные системы для доставки лекарственного средства обычно представляют собой капсулы (с твердой или мягкой оболочкой), состоящие из лекарственного средства, диспергированного или растворенного в смеси поверхностно-активных веществ и липофильных липидов, таких как масла или другие несмешивающиеся с водой жидкости. Когда на капсулу воздействует водное окружение и внешняя желатиновая оболочка растворяется, контакт между водной средой и содержимым капсулы мгновенно генерирует очень маленькие капли эмульсии. Они обычно имеют диапазон размеров мицелл или наночастиц. Не требуется смешение для получения эмульсии, как это обычно требуется в способах получения эмульсий.
"Лосьон" представляет собой жидкую композицию низкой или средней вязкости. Лосьон может содержать тонкоизмельченные вещества, которые можно растворить в диспергирующей среде за счет применения суспендирующих агентов и диспергаторов. Альтернативно, лосьоны могут содержать в качестве диспергированной фазы жидкие вещества, которые являются несмешиваемыми со средой, и их обычно диспергируют посредством эмульгаторов или других подходящих стабилизаторов. В одном варианте осуществления лосьон находится в виде эмульсии, имеющей вязкость 100-1000 сантистокс. Текучесть лосьонов обеспечивает быстрое и однородное нанесение по широкой площади поверхности. Обычно предполагается, что лосьоны сохнут на коже, оставляя тонкий слой их медицинских компонентов на поверхности кожи.
"Крем" представляет собой вязкую жидкую или полутвердую эмульсию типа или "масло в воде", или "вода в масле". Крема могут содержать эмульгаторы и/или другие стабилизирующие агенты. В одном варианте осуществления композиция находится в виде крема, имеющего вязкость, большую чем 1000 сантистокс, обычно в диапазоне 20000-50000 сантистокс. Крема часто являются предпочтительнее мазей, поскольку их обычно легче намазывать и удалять.
Разница между кремом и лосьоном заключается в вязкости, которая зависит от количества/применения различных масел и процента воды, применяемого для получения композиций. Крема обычно являются более густыми, чем лосьоны, могут иметь различное применение, и часто применяют более разнообразные масла, в зависимости от требуемого эффекта на кожу. В кремовой композиции процент водной основы составляет приблизительно 60-75%, и процент масляной основы составляет приблизительно 20-30% суммы, причем оставшиеся проценты составляют эмульгаторы, консерванты и добавки, давая в сумме 100%.
"Мазь" представляет собой полутвердый препарат, состоящий из мазевой основы и необязательно одного или более активных агентов. Примеры подходящих мазевых основ включают углеводородные основы (например, вазелин, белый вазелин, желтая мазь и минеральное масло); абсорбирующие мазевые основы (гидрофильный вазелин, безводный ланолин, ланолин и кольдкрем); основы, удаляемые водой (например, гидрофильная мазь), и растворимые в воде основания (например, полиэтиленгликольные мази). Пасты обычно отличаются от мазей тем, что они содержат больший процент твердых веществ. Пасты обычно являются более абсорбирующими и менее жирными, чем мази, полученные с теми же компонентами.
"Гель" представляет собой полутвердую систему, состоящую из дисперсии небольших или больших молекул в жидкой среде, которую делают полутвердой действием загустителя или полимерного материала, растворенного или суспендированного в жидкой среде. Жидкость может содержать липофильный компонент, водный компонент или оба компонента. Некоторые эмульсии могут представлять собой гели или иначе содержать гелевый компонент. Однако некоторые гели не являются эмульсиями, поскольку они не содержат гомогенизированной смеси несмешиваемых компонентов. Подходящие желатинирующие агенты включают, но не ограничиваются, модифицированные целлюлозы, такие как гидроксипропилцеллюлоза и гидроксиэтилцеллюлоза; карбопольные гомополимеры и сополимеры; и их комбинации. Подходящие растворители в жидкой среде включают, но не ограничиваются, дигликольмоноэтиловый эфир; алкенгликоли, такие как пропиленгликоль; диметилизосорбид; спирты, такие как изопропиловый спирт и этанол. Растворители обычно выбирают по их способности растворять лекарственное средство. Можно также вводить другие добавки, которые улучшают кожные ощущения и/или смягчают композицию. Примеры данных добавок включают, но не ограничиваются, изопропилмиристат, этилацетат, C12-C15 алкилбензоаты, минеральное масло, сквален, циклометикон, триглицериды каприновой/каприловой кислоты, и их комбинации.
Пены состоят из эмульсии в комбинации с газообразным пропеллентом или компонентом, выделяющим газ.
Буферы применяют для контроля pH композиции. Предпочтительно, буферы доводят pH композиции до от приблизительно 4 до приблизительно 7,5, более предпочтительно от приблизительно 4 до приблизительно 7, и самое предпочтительное от приблизительно 5 до приблизительно 7.
D. Энтеральные композиции
Подходящие пероральные лекарственные формы включают таблетки, капсулы, растворы, суспензии, сиропы и пастилки. Таблетки можно получить, применяя способы прессования или формования, хорошо известные в данной области техники. Желатиновые или нежелатиновые капсулы получают в виде твердых или мягких оболочек капсулы, в которую может быть инкапсулирован жидкий, твердый и полутвердый материал заливки, применяя способы, хорошо известные в данной области техники. Композиции можно получить, применяя один или более из фармацевтически приемлемых эксципиентов, включая разбавители, консерванты, связующие, смазывающие агенты, разрыхлители, агенты, вызывающие набухание, наполнители, стабилизаторы и их комбинации.
Эксципиенты, включая пластификаторы, пигменты, красители, стабилизирующие агенты и регуляторы сыпучести, можно также применять, получая композиции с покрытием для энтерального введения. Лекарственные композиции с замедленным высвобождением можно получить, как описано в стандартных источниках информации, таких как "Pharmaceutical dosage form tablets", eds. Liberman et al. (New York, Marcel Dekker, Inc., 1989), "Remington - The science and practice of pharmacy", 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, и "Pharmaceutical dosage forms and drug delivery systems", 6th Edition, Ansel et al., (Media, PA: Williams and Wilkins, 1995). Данные источники дают информацию об эксципиентах, материалах, оборудовании и способе получения таблеток и капсул и лекарственных форм таблеток, капсул и гранул с замедленным высвобождением.
Наночастицы можно покрывать, например, для замедления высвобождения, после того как частицы прошли через кислую среду желудка. Примеры подходящих материалов для нанесения покрытия включают, но не ограничиваются, целлюлозные полимеры, такие как ацетатфталат целлюлозы, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы и ацетатсукцинат гидроксипропилметилцеллюлозы; поливинилацетатфталат, полимеры и сополимеры акриловой кислоты, и метакриловые смолы, которые имеются в продаже под торговым названием EUDRAGIT® (Roth Pharma, Westerstadt, Germany), зеин, шеллак и полисахариды.
Разбавители, также называемые "наполнителями", обычно необходимы для увеличения объема твердой лекарственной формы так, чтобы обеспечить размер частиц для прессования таблеток или получения зерен и гранул. Подходящие разбавители включают, но не ограничиваются, дигидрат фосфата дикальция, сульфат кальция, лактозу, сахарозу, маннит, сорбит, целлюлозу, микрокристаллическую целлюлозу, каолин, хлорид натрия, сухой крахмал, гидролизованные крахмалы, предварительно желатинизированный крахмал, диоксид кремния, оксид титана, силикат магния алюминия и порошковый сахар.
Связующие вещества применяют для придания когезивных свойств твердой лекарственной композиции и, таким образом, обеспечивая, чтобы таблетка или зерно, или гранула оставались интактными после получения лекарственных форм. Подходящие связующие материалы включают, но не ограничиваются, крахмал, предварительно желатинизированный крахмал, желатин, сахара (включая сахарозу, глюкозу, декстрозу, лактозу и сорбит), полиэтиленгликоль, воски, природные и синтетические смолы, такие как камедь, трагакант, альгинат натрия, целлюлоза, включая гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, этилцеллюлозу, и вигум, и синтетические полимеры, такие как сополимеры акриловой и метакриловой кислоты, сополимеры метакриловой кислоты, метилметакрилатные сополимеры, аминоалкилметакрилатные сополимеры, полиакриловая кислота/полиметакриловая кислота и поливинилпирролидон.
Смазывающие агенты применяют для облегчения получения таблеток. Примеры подходящих смазывающих агентов включают, но не ограничиваются, стеарат магния, стеарат кальция, стеариновую кислоту, бегенат глицерина, полиэтиленгликоль, тальк и минеральное масло.
Разрыхлители применяют для облегчения распада лекарственной формы или "разделения" после введения, и они обычно включают, но не ограничиваются, крахмал, крахмалгликолят натрия, карбоксиметилкрахмал натрия, карбоксиметилцеллюлозу натрия, гидроксипропилцеллюлозу, предварительно желатинизированный крахмал, глины, целлюлозу, альгинин, камеди или поперечно-сшитые полимеры, такие как поперечно-сшитый ПВП (Polyplasdone® XL от GAF Chemical Corp).
Стабилизаторы применяют для подавления или замедления реакций разложения лекарственного средства, которые включают, в качестве примера, окислительные реакции. Подходящие стабилизаторы включают, но не ограничиваются, антиоксиданты, бутилированный гидрокситолуол (BHT); аскорбиновую кислоту, ее соли и эфиры; витамин E, токоферол и его соли; сульфиты, такие как метабисульфит натрия; цистеин и его производные; лимонную кислоту; пропилгаллат и бутилированный гидроксианизол (BHA).
IV. Способы получения MPP
Способы получения наночастиц являются известными в данной области техники и включают, но не ограничиваются, упаривание растворителя, удаление растворителя, распылительную сушку, обращение фазы, низкотемпературное формование и наноосаждение. Подходящие способы получения частиц вкратце описаны ниже. Фармацевтически приемлемые эксципиенты, включая агенты, регулирующие pH, разрыхлители, консерванты и антиоксиданты, можно необязательно вводить в частицы в процессе получения частиц. Как описано выше, один или более дополнительных активных агентов можно также вводить в наночастицу в процессе получения частиц.
V. Способы применения MPP-гипотонических композиций
Композиции, содержащие частицы, вводят на мукозальную поверхность в эффективном количестве терапевтического агента для облегчения одного или более симптомов, где композиция является гипотонической, улучшая поглощение частиц слизистой оболочкой без того, чтобы вызывать токсичность. Для этого можно применять стерильную упаковку для одного введения, содержащую раствор или суспензию, такую как глазные капли, или аппликатор для сухого порошка, геля, мази, крема или лосьона для местного введения на глазную поверхность, в области рта (буккальный, сублингвальный), влагалища, прямой кишки, или аэрозоль, или ее можно формулировать для перорального введения.
Настоящее изобретение будет более понятно со ссылкой на следующие неограничивающие примеры.
Примеры
Примеры 1-6 показывают получение и охарактеризацию частиц, проникающих через слизь ("MPP"). Примеры 7-9 показывают влияние гипотонических композиций на поглощение и токсичность MPP, введенных в ткани слизистой оболочки.
Материалы и способы
Натриевая соль холевой кислоты, TWEEN® 20, TWEEN® 80, бромид гексадецилтриметиламмония (CTAB), диоктилсульфосукцинат натрия (DSS), полиоксил 35 гидрогенизированное касторовое масло (Cremophor EL) и D-α-токоферолполиэтиленгликоль 1000 (Vitamin E-TPGS) получали у Sigma (St. Louis, MO).
Поли(виниловый спирт) (Mw=25 кДа с 88% гидролизом и 6 кДа с 80% гидролизом), и поли(этиленмалеиновый ангидрид, 1:1 молярное соотношение) с Mw ~400 кДа получали у PolySciences (Warrington, PA).
Сахарный эфир D1216 (SE) был подарком Mitsubishi-Kagaku Foods Co. (Tokyo, Japan).
Alexa Fluor 555 кадаверин получали у Invitrogen (Grand Island, NY).
Поли(молочная-со-гликолевая кислота) (PLGA; LA:GA 50:50) с характеристической вязкостью 0,15-0,25 дл/г (MW приблизительно 15 кДа) получали у Lakeshore Biomaterials (Birmingham, AL). PLGA(LA:GA 50:50)-PEG сополимеры с молекулярным весом ПЭГ 10, 5, 2 и 1 кДа, PLA-PEG5k и PCL-PEG5k были получены на заказ у Jinan Daigang Biomaterial Co., Ltd, (Jinan, China) и охарактеризованы1H ЯМР и гельпроникающей хроматографией (ГПХ). Применяли аппарат Шимадзу, снабженный рефрактометрическим детектором и двумя Waters Styragel® HR4 и HR5 колонками. Анализ проводили при 35°C, применяя тетрагидрофуран (THF) в качестве элюента при скорости потока 0,5 мл/мин. ГПХ калибровали полистирольными стандартами (Sigma, St. Louis, MO).
Химический состав и молекулярный вес (MW) блочного сополимера PLGA-PEG были охарактеризованы1H ЯМР. Полимеры растворяли в CDCl3, и1H ЯМР спектры регистрировали, применяя Bruker 400 REM прибор при 400 МГц.1H ЯМР спектры для сополимеров в CDCl3 показаны на фигуре 3. Пики CH (5,22 ppm) из LA звена, CH2 (4,83 ppm) из GA звена и CH2CH2 (3,65 ppm) из этиленоксидного звена интегрировали, где I5,22, I4,83, I3,65 представляют собой интегральные интенсивности пиков при 5,22, 4,83 и 3,65 ppm, соответственно. Отношение LA:GA оценивали как I5,22: (I4,83/2).
MW PLGA-PEG оценивали следующим образом:
(I3,65/4)/(I4,83/2)=(MWPEG/44)/(MWGA/58)
(I3,65/4)/(I5,22/1)=(MWPEG/44)/(MWLA/72)
MWPLGA-PEG=MWPEG+(MWGA+MWLA), где MWPEG равна 1, 2, 5 и 10 кДа.
Аналогично, молекулярный вес PLA-PEG и PCL-PEG оценивали следующим образом:
(I3,65/4)/(I5,22/1)=(MWPEG/44)/(MWLA/72)
MWPLA-PEG=MWPEG+MWLA;
(I3,65/4)/((I4,06+ I2,31)/4)=(MWPEG/44)/(MWCL/114)
MWPCL-PEG= MWPEG+ MWCL),
где MWPEG равна 5 кДа, I4,06 и I2,31 представляют собой интегральные интенсивности пиков из PCL при 4,06 и 2,31 ppm, соответственно.
Характеристики различных блочных сополимеров, содержащих ПЭГ, показаны в таблице 1.

Суммарное содержание ПЭГ в наночастицах определяли1H ЯМР, применяя Bruker 400 REM прибор при 400 МГц. Лиофилизированные наночастицы взвешивали с высокой степенью точности и растворяли в CDCl3, содержащем 1% по весу гексадейтеродиметилсульфоксида (TMS) в качестве внутреннего стандарта. Содержание ПЭГ определяли сравнением с калибровочной кривой ПЭГ 5 кДа, полученной из1H ЯМР спектра, применяя TMS в качестве внутреннего стандарта.
Проводили отслеживание флуоресцентномеченных наночастиц в свежей человеческой шейно-влагалищной слизи (CVM). Вкратце, 0,6 мкл наночастиц при подходящем разбавлении смешивали с 20 мкл слизи и выдерживали в течение 1 часа перед наблюдениями под микроскопом. Перемещение фиксировали при временном разрешении 66,7 мс, применяя фотокамеру с кремниевой усилительной мишенью (VE-1000, Dage-MTI), установленную на инвертационный эпилюминисцентный микроскоп, снабженный 100× линзами объектива для масляной иммерсии. Траектории для n>150 частиц для одного эксперимента получали, применяя MetaMorph программное обеспечение (Universal Imaging). Результаты наблюдения перемещения (20 с) анализировали, применяя MetaMorph программное обеспечение (Universal Imaging, Glendale, WI). Среднеквадратичное смещение (MSD), усредненное по времени, и эффективную диффузионную способность для каждой частицы рассчитывали в виде функции промежутка времени. Для каждого из условий проводили три эксперимента. Односторонний t-критерий Стьюдента с неодинаковой дисперсией применяли для оценки статистической значимости (P<0,05).
ITC эксперименты проводили при 25°C, применяя VP-ITC микрокалориметр (MicroCal Inc., USA). Эксперименты проводили введением 2 мг/мл раствора муцина в DI воде в 2-мл кюветы для образца, содержащие наночастицы с различной поверхностной плотностью ПЭГ при концентрации 1 мг/мл в воде со скоростью перемешивания 481 об/мин. Суммарно осуществляли 28 введений с интервалом в секунду и исходным уровнем мощности мккал/с. За первым введением 2 мкл раствора муцина следовало 27 введений 10 мкл раствора муцина. Изотермы связывания строили и анализировали, применяя Origin программное обеспечение, где ITC измерения подгоняли к моделе связывания с одним центром. Стехиометрию применяли для расчета степени связывания муцина с поверхностью наночастиц, представленной в виде мг муцина на м2.
Пример 1. Получение наночастиц
Материалы и способы
Биоразлагаемые наночастицы получали или способом односторонней эмульсии масла в воде, или способом двухсторонней эмульсии воды в масле в воде, как описано в R.C. Mundargi et al, J. Control. Release 125, 193 (2008), M. Li et al., Int. J. Pharm. 363, 26 (2008), C.E. Astete and C.M. Sabliov, J. Biomater. Set Polymer Ed. 17, 247 (2006), и R.A. Jain, Biomaterials, 21, 2475 (2000).
Наночастицы охарактеризовывали по размеру, свойствам поверхности и содержанию лекарственного вещества (для наночастиц с инкапсулированным лекарственным средством). Перемещение наночастиц отслеживали в свежей, неразбавленной человеческой CVM, применяя слежение за множеством частиц.
Наночастицы, полученные с различными количествами ПЭГ
PLGA-PEG наночастицы получали с изменяющимся целевым содержанием ПЭГ (0, 2, 3, 5, 8, 10 и 25% по весу, называемые PLGA, PLGA-PEG2%, PLGA-PEG3%, PLGA-PEG5%, PLGA-PEG8%, PLGA-PEG10% и PLGA-PEG25%), применяя эмульсификацию. Молекулярный вес ПЭГ 5 кДа выбирали, потому что все PLGA-PEG наночастицы с тем же содержание ПЭГ 6% по весу с ПЭГ в диапазоне от 1 кДа до 10 кДа легко проникают через слизь. Целевое содержание ПЭГ контролировали изменением соотношения PLGA и PLGA-PEG в процессе получения наночастиц. Размеры наночастиц контролировали так, чтобы они были в районе 100 нм регулированием концентрации полимера и способа эмульсификации, и все наночастицы имели монодисперсный диаметр с небольшим коэффициентом полидисперсности (меньше чем 0,1) при динамическом рассеянии света. Наночастицы имели сферическую форму на основе TEM исследования, и PLGA-PEG25% наночастицы с наибольшим целевым содержание ПЭГ показали меньший контраст на границе частиц, что, вероятно, является результатом большого содержания ПЭГ с меньшей электронной плотностью, расположенного на поверхности.
Результаты
Таблица 2 показывает характеристики частиц, полученных, как описано выше.
Данные представляют собой среднее ±SD.
Повышение целевого содержания ПЭГ приводило в результате к существенному снижению поверхностного заряда наночастиц (таблица 2), и практически нейтральный поверхностный заряд (приблизительно 4 мВ) получали, когда содержание ПЭГ достигало 8% по весу и выше. Сниженный поверхностный заряд отражает повышенное покрытие поверхности ПЭГ, поскольку плотные покрытия ПЭГ могут эффективно экранировать поверхностный заряд наночастиц. Однако измерение поверхностного заряда (зета-потенциал) не позволяет получить количественную информацию для оценки поверхностной плотности ПЭГ относительно числа цепей ПЭГ на поверхности частиц. Кроме того, на измерение поверхностного заряда могут влиять основные материалы и среда для измерения.
1H ЯМР применяли для прямого количественного определения поверхностной плотности ПЭГ на наночастицах. Как показано в таблице 3, поверхностное содержание ПЭГ на наночастицах увеличивается с увеличением целевого содержания ПЭГ. Таблица 3 показывает поверхностную плотность ПЭГ PLGA-PEG наночастиц с различными содержаниями ПЭГ. Поверхностное содержание ПЭГ обнаруживали1H ЯМР в D2O по сравнению со стандартом DSS (1% по весу). Суммарное содержание ПЭГ в наночастицах измеряли1H ЯМР в CDCl3 по сравнению со стандартом TMS (1% по весу). N/A, данные отсутствуют.
Данные (среднее ±SD) представляют собой среднее по меньшей мере трех различных партий образцов.
Пример 2. Наночастицы, полученные с различными эмульгаторами
Материалы и способы
Alexa Fluor 555 кадаверин (AF555) химически конъюгировали с полимерами. Наночастицы получали, применяя эмульсификацию. Обычно смесь (в сумме 50 мг) PLGA-PEG5k и AF555-меченного PLGA-PEG5k растворяли в 1 мл дихлорметана (DCM). Масляную фазу выливали в 5 мл водного раствора, содержащего 1% эмульгатора, при обработке ультразвуком (VibraCell, Sonics & Materials Inc., Newtown, CT) при 30% амплитуде в течение 2 минут в бане со льдом, получая эмульсию масла в воде.
Эмульсию выливали в другие 40 мл водной фазы раствора эмульгатора при магнитном перемешивании при 700 об/мин в течение по меньшей мере 3 часов, обеспечивая испарение растворителя. Растворитель дополнительно упаривали помещением раствора в вакуумную камеру на 30 минут. Конечные суспензии наночастиц фильтровали через 1 мкм шприцевой фильтр, центрифугировали при 20000 g в течение 25 минут и тщательно промывали водой.
Эмульгаторы, включая натриевую соль холевой кислоты (CHA), диоктилсульфосукцинат натрия (DSS), бромид гексадецилтриметиламмония (CTAB), поливиниловый спирт (PVA), поли(этилен-малеиновый ангидрид) (PEMA), сапонин, TWEEN20, TWEEN80 и сахарный эфир D1216 (SE), испытывали при концентрации 1% масс./об. CHA растворы при 0,01%-0,5% масс./об. также были способны результативно давать наночастицы. Также испытывали PLURONIC® F127, F68 растворы и другие низкомолекулярные эмульгаторы, подобные кремофору EL и витамину-E TPGS, но нестабильные эмульсии приводили в результате к большим агрегированным частицам.
Таблица 4 показывает характеристики наночастиц, полученных, применяя PLGA-PEG (Mn ~83 кДа) и PLGA (Mn ~15 кДа) и различные эмульгаторы (1% масс./об.).
Для оценки влияния молекулярного веса полиэтиленгликоля (MW ПЭГ) на способность наночастиц, полученных эмульсификацией, проникать через слизь, CHA выбирали в качестве репрезентативного низкомолекулярного сильного эмульгатора. PLGA-PEG наночастицы с различными MW ПЭГ при содержании ПЭГ приблизительно 6% по весу получали в 0,5% растворе CHA. Для того чтобы получить суммарное содержание ПЭГ 6% по весу для PLGA-PEG10k наночастиц, применяли смеси PLGA-PEG10k (21,6% по весу) и PLGA15k.
Результаты
Свойства наночастиц, полученных из ПЭГ различных молекулярных весов (~6% по весу содержание ПЭГ), показаны в таблице 5.
Свойства наночастиц, полученных для различных концентраций CHA и PLGA-PEG5k, содержащих 6% по весу ПЭГ, показаны в таблице 6.
Пример 3. Получение наночастиц с инкапсулированным лекарственным средством
Материалы и способы
Куркумин выбирали в качестве модельного гидрофобного лекарственного средства, который растворяли с полимером в DCM. Способ был аналогичным способу получения незагруженных наночастиц. Полученные наночастицы, содержащие куркумин, можно проявлять в слизи благодаря собственной флуоресценции куркумина.
BSA применяли в качестве модельного гидрофильного лекарственного средства, поскольку она является представителем высокомолекулярной биологии. BSA-FITC и BSA (10% отношение BSA-FITC) растворяли в 0,2 мл 16% масс./об. водного раствора при 37°C. Данный раствор добавляли к 1 мл 100 мг/мл PLGA-PEG5k в растворе DCM в процессе обработки образца ультразвуком (30% амплитуда, 1 минуту с 1 секундным импульсом) в бане со льдом. Полученную в результате W/O первичную эмульсию сразу же добавляли ко второй водной фазе (5 мл 1% раствора сапонина) при обработке ультразвуком (20% амплитуда в течение 2 минут). Двойную эмульсию переносили в другие 40 мл 1% раствора сапонина при магнитном перемешивании в течение 3 часов. Наночастицы фильтровали через 1 мкм шприцевой фильтр, промывали и собирали центрифугированием. BSA-FITC давал возможность отслеживать наночастицы с загрузкой BSA в слизи.
Результаты
Целевое содержание лекарственного вещества для наночастиц, содержащих куркумин, и наночастиц, содержащих BSA, составляло 9,1% и 16,7%, соответственно.
Пример 4. Оценка эмульгирующей способности
Материалы и способы
PLGA-PEG5k (MW приблизительно 83 кДа) применяли в качестве модельного полимера и растворяли в DCM при 50 мг/мл. 0,5 мл раствора PLGA-PEG5k в DCM добавляли к 5 мл водной фазы, содержащей 1% (масс./об.) эмульгаторов, при обработке ультразвуком с 30% амплитудой, получая эмульсию, применяя тот же способ, описанный выше. Образовавшуюся эмульсию добавляли к дополнительным 20 мл 1% раствора эмульгатора при магнитном перемешивании при 700 об/мин в течение 3 часов. Эмульгирующую способность каждого эмульгатора оценивали его способностью предотвращать образование агрегированных частиц. Агрегированные частицы собирали центрифугированием при 500g в течение 20 минут, и оставшиеся наночастицы в надосадочной жидкости собирали центрифугированием при 30000g в течение 25 минут. Весовое отношение наночастиц к агрегированным частицам рассчитывали и применяли в качестве коэффициента для оценки эмульгирующей способности эмульгатора.
Диаметр и поверхностный заряд
Диаметр и ζ-потенциал (поверхностный заряд) наночастиц измеряли, применяя Zetasizer Nano ZS90. Наночастицы суспендировали в 10 мМ растворе NaCl. Образцы TEM получали прикапыванием разбавленной суспензии наночастиц на TEM сетку и сушкой на воздухе. Структуру частиц характеризовали, применяя H7600 трансмиссионный электронный микроскоп (Hitachi, Japan).
Эффективность инкапсулирования
Эффективность инкапсулирования куркумина в наночастицах измеряли растворением лиофилизированных наночастиц в DMSO и измерением поглощения при 430 нм, применяя Biotek Synergy MX планшетный ридер. Содержание лекарственного средства определяли сравнением с калибровочной кривой для куркумина (диапазон концентраций 0-50 мкг/мл). Поглощение «пустых» наночастиц в DMSO при той же концентрации полимера вычитали. Эффективность инкапсулирования BSA-FITC анализировали после щелочной обработки. Известное количество лиофилизированных наночастиц подвергали полному гидролизу в 1M гидроксиде натрия. Полученный в результате раствор анализировали, применяя Biotek Synergy MX планшетный ридер при длине волны возбуждения 490 нм и длине волны излучения 525 нм. Получали стандартные растворы, содержащие такое же количество полимера и увеличивающиеся количества BSA-FITC в тех же условиях обработки. Количество BSA в наночастицах определяли сравнением с калибровочной кривой для BSA-FITC.
Содержание лекарственного вещества (DL) и эффективность инкапсулирования (EE) рассчитывали следующим образом:


Результаты
Результаты для различных эмульгаторов показаны в таблице 7.
Количественная оценка поверхностной плотности полиэтиленгликоля (ПЭГ)
Поверхностную плотность ПЭГ на наночастицах определяли1H ЯМР, применяя Bruker 400 REM прибор при 400 МГц. Время релаксации устанавливали на 10 с, и ZG при 90°. Наночастицы с различным содержанием ПЭГ получали непосредственно в 0,5% D2O растворе CHA и суспендировали в D2O с 1% по весу натриевой солью 3-(триметилсилил)-1-пропансульфокислоты в качестве внутреннего стандарта для1H ЯМР анализа.
Известный вес гомополимера ПЭГ 5 кДа (Sigma, St Louis, MO) в D2O с 1% натриевой солью 3-(триметилсилил)-1-пропансульфокислоты последовательно разбавляли до различных концентраций для построения калибровочной кривой для сигнала ПЭГ в1H ЯМР, и данную калибровочную кривую применяли для расчета поверхностного содержания ПЭГ на наночастицах.
0,2 мл раствора наночастиц в D2O лиофилизовали и взвешивали. Принимая, что все поверхностные цепи ПЭГ имели полную длину ПЭГ 5 kДа, поверхностную плотность ПЭГ рассчитывали в виде количества молекул ПЭГ на 100 нм2 площадь поверхности на наночастицах. Контрольные1H ЯМР эксперименты также проводили с PLGA наночастицами, полученными тем же способом, и не было обнаружено CHA пиков для PLGA наночастиц. Плотность ПЭГ, [Γ], представляет собой количество молекул ПЭГ на поверхности наночастицы на 100 нм2. Ее можно рассчитать делением суммарного содержания ПЭГ (MPEG, в молях), определенного1H ЯМР, на суммарную площадь поверхности всех наночастиц следующим способом:

где WNP представляет собой суммарную массу наночастиц, dNP представляет собой плотность наночастиц (плотность наночастиц принимают равной плотности полимера, 1,21 г/мл для PLGA), и D представляет собой диаметр частиц, как измерено динамическим рассеянием света.
Полное поверхностное покрытие типа «гриб» [Γ*] представляет собой количество свободных молекул ПЭГ, занимающих 100 нм2 площади поверхности частиц. Для определения [Γ*] оценивали поверхностную плотность, занимаемую одной цепью ПЭГ. Применяя способ случайного блуждания, единичная цепь ПЭГ занимает площадь поверхности, заданную сферой диаметра ξ:

где m представляет собой молекулярный вес цепи ПЭГ. Площадь поверхности, занимаемую одной молекулой ПЭГ, можно определить из (ξ/2)2. Таким образом, PEG5kДа имеет свободную молекулярную сферу с диаметром 5,4 нм, и занимает площадь поверхности 22,7 нм2. Следовательно, количество молекул ПЭГ для полного покрытия площади поверхности 100 нм2, [Γ*], составляет 4,4.
[Γ/Γ*] можно применять в качестве коэффициента для измерения плотности ПЭГ на поверхности наночастиц, где величины <1 показывают низкую плотность ПЭГ, где молекулы ПЭГ имеют конфигурацию типа «гриб»; тогда как величины >1 показывают высокую плотность ПЭГ, где молекулы ПЭГ имеют конфигурацию типа «щетка». Аналогично, [Γ*] для ПЭГ 10 kДа, 2 кДа и 1 kДа составляет 2,2, 11 и 22, соответственно. Результаты показаны в таблице 2 выше.
Таблица 8 показывает поверхностную плотность ПЭГ PLGA-PEG наночастиц с различными содержаниями ПЭГ. Поверхностную концентрацию ПЭГ определяли посредством1H ЯМР в D2O относительно стандарта, DSS (1% по весу). Суммарное содержание ПЭГ в наночастицах измеряли1H ЯМР в CDCl3 относительно стандарта, TMS (1% по весу). N/A, данные отсутствуют.
Поверхностная плотность ПЭГ PLGA-PEG наночастиц с различными содержаниями ПЭГ
Поверхностную плотность ПЭГ ([Γ], количество цепей ПЭГ на 100 нм2) рассчитывали и сравнивали с полным поверхностным покрытием типа «гриб» ([Γ*], количество свободных молекул ПЭГ на 100 нм2). PLGA-PEG3% наночастицы показали поверхностное содержание ПЭГ 2,6% по весу с плотностью 6,5 PEG/100 нм2, равной [Γ]/[Γ*]=1,5, которое придавало PLGA-PEG3% структуру типа «щетка» поверхностного покрытия ПЭГ. Структуру типа «щетка» с высокой плотностью покрытия ПЭГ ([Γ]/[Γ*]>3) получали при поверхностной плотности ПЭГ, большей чем 10 PEG/100 нм2 (PLGA-PEG5%).
Растворив лиофилизированные PLGA-PEG наночастицы в ЯМР растворителе CDCl3, измеряли суммарное содержание ПЭГ в наночастицах посредством1H ЯМР и обнаруживали, что суммарное содержание ПЭГ в наночастицах (и поверхностного ПЭГ, и ПЭГ, включенного в наполнитель наночастиц) было очень близким к поверхностному содержанию ПЭГ, как показано в таблице 5. Почти все цепи ПЭГ в PLGA-PEG наночастицах, полученных способом эмульсификации, обнаруживали на поверхности частиц. Способ эмульсификации включал упаривание органического растворителя (дихлорметана) из капель эмульсии и последующее затвердевание полимерного заполнителя. Медленное упаривание органического растворителя обеспечивает достаточное время для того, чтобы гидрофильные цепи ПЭГ диффундировали и накапливались на поверхности наночастиц, что приводило в результате к большому коэффициенту распределения ПЭГ на поверхности. Однако имеется существенная потеря ПЭГ в процессе получения наночастиц способом эмульсификации, и коэффициент потерь ПЭГ может составлять вплоть до 50% для PLGA-PEG25% наночастиц.
Аналогично предыдущим сообщениям, потеря ПЭГ может быть результатом образования мицелл низкомолекулярной частью PLGA-PEG в сополимере, который имеет большее содержание ПЭГ и большую гидрофильность. Данную часть очень небольших по размеру частиц, содержащих полимеры с большим содержанием ПЭГ, нельзя контролировать после стадий центрифугирования и промывки, что можно подтвердить повышенным средним молекулярным весом полимера после образования наночастиц, по сравнению с необработанным полимером, измеренным гельпроникающей хроматографией. PLGA-PEG10% наночастицы (117 нм), полученные способом наноосаждения (способ диффузии растворителя) в контрольном эксперименте показали суммарное содержание ПЭГ 6,5% по весу в наночастицах, и только 89% цепей ПЭГ обнаруживали на поверхности (равно поверхностному содержанию ПЭГ 5,8% по весу).
Пример 5. Отслеживание проникновения наночастиц через слизь
Материалы и способы
Собирали человеческую шейно-влагалищную слизь (CVM). Вкратце, неразбавленные шеечно-влагалищные выделения женщин с нормальной влагалищной флорой получали, применяя устройство с автоматическим отбором менструальных проб, следуя протоколу, одобренному экспертным советом университета Джонса Хопкинса. Устройство вставляли во влагалище на 60 секунд, удаляли и помещали в 50 мл центрифужные пробирки и центрифугировали при 1000 об/мин в течение 2 минут, собирая выделения.
Осуществляли отслеживание флуоресцентно-меченных наночастиц в свежей человеческой шейно-влагалищной слизи (CVM). Вкратце, 0,6 мкл наночастиц при подходящем разбавлением добавляли к 20 мкл слизи на изготовленным на заказ предметном стекле и выдерживали при комнатной температуре в течение 1 часа перед микроскопией. Траектории наночастиц в CVM регистрировали, применяя отслеживание множества частиц (MPT), 20-секундные перемещения регистрировали при временном разрешении 66,7 мс, применяя фотокамеру с кремниевой усилительной мишенью (VE-1000, Dage-MTI), установленную на инвертационный эпифлуоресцентный микроскоп, снабженный 100× объективом для масляной иммерсии (N.A., 1.3). Отслеженные перемещения (20 с) анализировали, применяя MetaMorph программное обеспечение (Universal Imaging, Glendale, WI).
Усредненное по времени среднеквадратичное смещение (MSD) и эффективную диффузионную способность для каждой частицы рассчитывали в виде функции промежутка времени:

где x и y представляют собой координаты наночастиц в виде функции времени, и τ представляет собой отставание во времени.
Наночастицы, содержащие куркумин, и наночастицы, содержащие FITC-BSA, отслеживали в человеческой CVM тем же способом, применяя флуоресценцию инкапсулированного куркумина или BSA-FITC. Проникновение частиц в слой слизи моделировали, применяя второй закон Фика и коэффициенты диффузии, полученные из экспериментов по отслеживанию.
Результаты
Сравнение переноса в человеческой CVM PLA-PEG и PCL-PEG наночастиц, содержащих CHA и PVA, полученных эмульсификацией, показано на фигурах 1A-H. Фигуры 1A и 1B показывают репрезентативные траектории PLA-PEG и PCL-PEG наночастиц, содержащих CHA и PVA. Фигуры 1C и 1D представляют собой графики, показывающие усредненное по ансамблю геометрическое среднеквадратичное отклонение (
Эффект молекулярного веса ПЭГ на скорость переноса MPP в CVM показан на фигурах 2A и 2B. Фигуры 2A и 2B показывают эффект молекулярного веса ПЭГ на скорость переноса MPP в человеческой шеечно-влагалищной слизи. Фигура 2A представляет собой график, показывающий усредненное по множеству геометрическое среднеквадратичное отклонение
Поверхностный заряд наночастиц был обратно пропорционален молекулярному весу ПЭГ и изменялся от -18 мВ (1 кДа) до -2,3 мВ (10 кДа). Поверхностная плотность ПЭГ [Γ] (количество ПЭГ на 100 нм2), измеренная1H ЯМР, снижалась по мере увеличения молекулярного веса ПЭГ. Однако отношение [Γ/Γ*][11] поверхностной плотности ПЭГ к теоретической плотности ПЭГ, требуемое для образования покрытия ПЭГ типа «щетка» [Γ*], было большим чем 2 (таблица 5), независимо от молекулярного веса ПЭГ, показывая наличие покрытия типа «плотная щетка» ПЭГ на поверхности PLGA-PEG(1-10 кДа)/CHA наночастиц.
Фигуры 3A-3C показывают скорости переноса MPP, содержащих куркумин и BSA, и обычных частиц (CP). Фигура 3A представляет собой график, показывающий усредненное по множеству геометрическое среднеквадратичное отклонение
PLGA наночастицы без покрытия ПЭГ полностью обездвиживались в слизи с диффузионной способностью в 38000 раз меньшей, чем диффузионная способность наночастиц с тем же размером частиц в воде. Наличие поверхностного покрытия ПЭГ на наночастицах значительно улучшало их диффузию через крайне вязкоэластичную слизь, PLGA-PEG3% с поверхностной плотностью ПЭГ 6,5 PEG/100 нм2 показали повышенную величину Dw/Dm вплоть до 142. Дополнительно повышая поверхностную плотность ПЭГ вплоть до 10,4 PEG/100 нм2, PLGA-PEG5% наночастицы были только в 17 раз более медленными, чем их диффузия в воде. Более чем 90% наночастиц были диффузными, когда поверхностная плотность ПЭГ была большей, чем 16,4 PEG/100 нм2 (PLGA-PEG8%). Дополнительное увеличение поверхностной плотности ПЭГ, вероятно, незначительно улучшает диффузионную способность частиц в слизи, поскольку поверхностная плотность 16,4 PEG/100 нм2 уже способна эффективно экранировать связывание с компонентами слизи. Приблизительно 50-70% наночастиц PLGA-PEG8%, 10% и 25% были способны проникать через физиологический слой слизи толщиной 30 мкм в течение 60 минут, имели значительно большие скорости, чем PLGA-PEG5%, PLGA-PEG3% (плотное покрытие), PLGA-PEG2% (слабое покрытие) и PLGA (без покрытия).
Пример 6. стабильность наночастиц в слизи
Материалы и способы
Стабильность наночастиц в слизи снижением до минимума адгезионного взаимодействия между частицами и компонентами слизи представляет собой важный критерий для их применения в качестве носителей, проникающих через слизь, лекарственных средств in vivo. Изменение размера наночастиц в присутствии муцина в качестве индикатора связывания муцина исследовали для определения стабильности наночастиц с различной поверхностной плотностью ПЭГ в присутствии муцина. Муцин, экстрагированный из бычьей поднижнечелюстной железы, выбирали в качестве модельного муцина, поскольку муцин представляет собой основной компонент слизи, и муцин из бычьей поднижнечелюстной железы имеет сходство с человеческой CVM и по структуре, и по физиологическим свойствам.
Наночастицы выдерживали с раствором муцина (10 мг/мл), и отслеживали изменение размера частиц в зависимости от времени.
Результаты
PLGA-PEG наночастицы с поверхностной плотностью ПЭГ ≥16,4 PEG/100 нм2 были стабильными в растворе муцина, сохраняя свой гидродинамический диаметр в процессе всех 3 часов выдерживания, и при данных поверхностных плотностях ПЭГ покрытия ПЭГ имели структуру типа «очень плотная щетка» ([Γ]/[Γ*]>3). Напротив, PLGA-PEG5% наночастицы с поверхностной плотностью 6,5 PEG/100 нм2 показали приблизительно 5% увеличение диаметра частиц после выдерживания с раствором муцина даже только в течение 5 минут, и поверхностная плотность ПЭГ на данных PLGA-PEG5% наночастицах уже давала в результате покрытие ПЭГ типа «щетка» ([Γ]/[Γ*]>1). Следовательно, только покрытия ПЭГ типа «щетка» недостаточно для полного экранирования муцинового связывания. Имелось постепенное увеличение размера частиц по мере понижения поверхностной плотности ПЭГ от структуры типа «щетка» до структуры типа «гриб». Без покрытия ПЭГ, PLGA наночастицы показывали резкое увеличение размера от 109±2 нм до 207±9 нм в течение 5 минут выдерживания в муцине.
Фигура 4A представляет собой схему, иллюстрирующую влияние покрытия поверхности ПЭГ ([Γ/Γ*]) на проникновение через слизь наночастиц. Верхняя панель показывает получение PLGA-PEG наночастиц с поверхностным покрытием ПЭГ при повышении степени покрытия. По мере увеличения покрытия поверхности ПЭГ, ПЭГ режим изменяется с режима типа «гриб» (соседние цепи ПЭГ не перекрываются, [Γ/Γ*]<1, фигура 4A), на режим типа «щетка» (соседние цепи ПЭГ перекрываются, 1<[Γ/Γ*]<3, фигура 4B), на режим типа «плотная щетка» ([Γ/Γ*]>3, фигура 4C). Средняя панель показывает, как покрытие ПЭГ определяет мукоадгезивное взаимодействие после воздействия слизи. При низком покрытии ПЭГ ([Γ/Γ*]<1), муциновые волокна крепко связываются с ядром наночастиц. При среднем покрытии ПЭГ (1<[Γ/Γ*]<3), муциновые волокна все еще могут частично связываться с ядром наночастиц. При высоком покрытии ПЭГ ([Γ/Γ*]>3), ядра наночастиц полностью экранированы биоинертным кольцом PEG, приводя в результате к отсутствию связывания муцина с наночастицами. Нижняя панель показывает, что наночастицы с низким покрытием ПЭГ обездвиживаются в слизи, наночастицы со средним покрытием ПЭГ задерживаются или даже обездвиживаются в слизи, наночастицы с высоким и очень высоким покрытием ПЭГ способны быстро проникать через слизь.
Пример 7. Влияние осмолярности раствора частиц на распределение и удерживание наночастиц в ткани слизистой оболочки влагалища и толстой кишки
Наночастицы, проникающие через слизь (MPP), которые избегают адгезивного захвата слоями слизи, присутствующими на мукозальных поверхностях, применяли для исследования их влияния на мукозальных поверхностях. Очень плотное покрытие низкомолекулярного (5 кДа) полиэтиленгликоля (ПЭГ) ковалентно соединяли с покрытием флуоресцентных 100 нм модифицированных по карбоксильной группе полистирольных (PS) частиц, получая PS-PEG наночастицы, проникающие через слизь. Наночастицы без покрытия ("обычные частицы" или "CP") связывались с муцином. CP плохо проникали через слои слизи и, вместо этого, агрегировали в полости свежезамороженной ткани мышиной толстой кишки и влагалища. Однако MPP проникали через барьер слизи вплоть до лежащего под ним эпителия, давая непрерывный "слой" частиц и в ткани прямой кишки, и в ткани влагалища мыши. Высокая абсорбционная способность мукозальных поверхностей могла приводить к быстрому "просасыванию" MPP, но не CP, через слои слизи, если частицы вводили в гипоосмолярном растворителе, подобном чистой воде. Введение частиц в гипоосмолярном растворе, таком как ультрачистая вода (UP), вызывает поглощение жидкости тканью, лежащей под слоями слизи, достигая осмотического равновесия, таким образом, втягивая MPP конвекцией.
Имеются недавние сообщения, подробно описывающие негативные побочные эффекты введения высокогиперосмолярных композиций, применяемых для доставки во влагалище и прямую кишку, которые могут вызывать существенную токсичность и разрушение эпителия (Fuchs et al. J Infect Dis 195, 703-710 (2007); Lacey et al. Int J STD AIDS 21, 714-717 (2007)). Однако не показано, что слегка гипоосмолярные жидкости имеют тот же профиль токсичности.
Материалы и способы
Исследовали распределение флуоресцентных 100 нм пегилированных полистирольных частиц, проникающих через слизь, на поперечных сечениях быстрозамороженной цельной ткани толстой кишки, вводимых или в (A) 1× PBS, или в (B) ультрачистой воде. Ткань вырезали сразу после введения и окрашивали DAPI для проявления ядер клеток.
Также исследовали распределение флуоресцентных 100 нм пегилированных полистирольных частиц, проникающих через слизь, на поперечных сечениях быстрозамороженной цельной ткани влагалища, введенных или в (A) 1× PBS, или в (B) ультрачистой воде. Ткань вырезали сразу после введения и окрашивали DAPI для проявления ядер клеток.
Затем оценивали флуоресценцию цельных мышиных вагинальных трактов и колоректальной ткани после первоначального введения флуоресцентных наночастиц или в UP воде (гипоосмолярная), или в PBS (изоосмолярная).
Для оценки удерживания наночастиц, 5 мкл красные флуоресцентные CP или MPP вводили интравагинально. Цельные шеечно-влагалищные тракты получали через 0, 2, 4 и 6 часов и помещали в стандартную чашку Петри. Для каждого условия и момента времени применяли n>7 мышей. Флуоресцентные изображения тканей получали, применяя устройство для формирования изображения Xenogen IVIS Spectrum (Caliper Life Sciences). Количественное определение флуоресцентных единиц на единицу площади рассчитывали, применяя программное обеспечение Xenogen Living Image 2.5.
Результаты
MPP быстро начинали покрывать влагалищный и колоректальный эпителий при введении в гипоосмолярном растворе.
Измеряли процент MPP (PSPEG) и CP (PS), удерживаемых в мышином вагинальном тракте в зависимости от времени после введение в UP воде. Через 6 часов 57% MPP и 7% CP оставались в CV тракте.
MPP удерживались во влагалищах мышей в значительно больших количествах в течение по меньшей мере 6 часов.
Биоразлагаемые MPP, содержащие FITC, вводили интравагинально в UP воде. Для сравнения вводили FITC в стандартном изоосмолярном геле-плацебо, гидроксиэтилцеллюлозе (HEC). Через 24 часа ткань влагалища вырезали и разглаживали между двумя предметными стеклами. Гипотонически добавляемые MPP, по-видимому, полностью покрывают эпителий, тогда как FITC распределялся разряжено. MPP резко улучшали эпителиальное распределение иначе плохо распределяемых молекул.
Пример 8. Распределение MPP в ткани влагалища в виде функции осмолярности
Исследования в примере 7 показывают, что MPP, которые не связываются со слизью, способны быстро диффундировать через человеческую и мышиную шеечно-влагалищную слизь (CVM), приводя в результате к проникновению глубоко в более медленно очищаемые слои слизи в складках, покрывая всю поверхность влагалища и находясь во влагалище дольше, чем обычные мукоадгезивные наночастицы (CP), описанные Ensign, et al. Sci Transl Med 4, 138ral79 (2012).
Один ключевой способ улучшения распределения и удерживания во влагалище MPP заключается во введении наночастиц в гипотоническом растворе. При доставке в гипотоническом растворе MPP быстро накапливаются на всей поверхности влагалища, попадая туда гораздо быстрее, чем ожидалось на основании только диффузии. Когда поток жидкости через слизевый гель вызван давлением, MPP проходят через слизь вместе с текущим потоком (т.е. растворным привлечением). Проводили исследования для определения, будет ли подобный эффект наблюдаться, если лекарственные средства и MPP доставлять во влагалище в гипотонических композициях. В данном исследовании изучали гипотоническую доставку во влагалище свободного лекарственного средства, а также MPP, определяя, может ли гипотоническая доставка давать улучшенное распределение, удерживание и защиту.
Материалы и способы
Животная модель
Женские особи 6-8 недельных CF-1 мышей получали у Harlan (Indianapolis, IN). Мышей содержали в виварии с обращенным световым циклом (12 часов день/12 часов ночь), обеспечивая выбор мышей в состоянии нормального эстрального цикла. Влагалище мышей в течение фазы эструса эстрального цикла наиболее напоминает влагалище человека. Барьерные свойства для наночастиц в слизи мышей в фазе эструса близко имитируют барьерные свойства для наночастиц в человеческой CVM. Таким образом, мышей в фазе эструса, как определено зрительно по внешнему виду отверстия влагалища, применяли для всех исследований на распределение и удерживание. Мышам, применяемым для исследований влагалищной защиты и подверженности HSV-2, вводили подкожную инъекцию в пах 2,5 мг Depo-Provera (Pharmacia & Upjohn Company, New York, NY) в 100 мкл физиологического раствора с фосфатным буфером (PBS) за 7 дней до экспериментов. Данную обработку обычно применяют для усиления подверженности к влагалищной инфекции HSV-2. Протоколы всех экспериментов были одобрены комитетом по содержанию и использованию животных университета Джонса Хопкинса.
Получение и характеристики наночастиц
Флуоресцентные модифицированные по карбоксильной группе (COOH) полистирольные (PS) наночастицы 100 нм в диаметре получали у Molecular Probes (Eugene, OR). Для получения MPP, PS частицы ковалентно модифицировали 5 кДа ПЭГ, модифицированным по аминогруппе (Creative PEGworks, Winston Salem, NC), как описано ранее Nance et al Sci Transl Med 4, 149ral19 (2012). Размер частиц и ζ-потенциал определяли динамическим рассеянием света и лазерной доплеровской анемометрией, соответственно, применяя Zetasizer Nano ZS90 (Malvern Instruments, Southborough, MA). Измерение размеров проводили при 25°C при угле рассеяния 90°. Образцы разбавляли в 10 мМ растворе NaCl (pH 7), и измерения проводили согласно документации прибора. Приблизительно нейтральный ζ-потенциал применяли для подтверждения конъюгирования с ПЭГ, и частицы испытывали на способность проникать через слизь в человеческой CVM, как описано ранее Lai et al. Proc Natl Acad Sci USA 104, 1482-1487 (2007) и Wang et al. Angew Chem Int Ed Engl 47, 9726-9729 (2008). Ранее было показано, что данные частицы быстро проникают через слизь влагалища мыши в фазе эструса. Осмоляльность растворов измеряли, применяя Wescor Vapro паронаполненный осмометр.
Распределение лекарственного средства и наночастиц во влагалище
Доксорубицин (NetQem, Durham, NC) растворяли при 1 мг/мл концентрации или в PBS (изоосмолярная относительно крови), или в ультрачистой воде (гипоосмолярная). Для 1 литра 1X PBS, 800 мл дистиллированной воды, 8 г NaCl; 0,2 г KCl; 1,44 г Na2HPO4;0,24 г KH2PO4;доводили pH до 7,4 HCl, добавляли дистиллированную воду до суммарного объема 1 литр.
Доксорубицин вводили вагинально и изоосмотически и гипоосмотически мышам при двух различных условиях. "Неамбулаторную" группу анестезировали внутрибрюшинной инъекцией рабочим раствором авертина (полученным согласно ACUC руководству комитета по содержанию и использованию животных университета Джонса Хопкинса) и оставляли лежать на спине в течение 1 часа перед сбором ткани. "Амбулаторную" группу анестезировали быстродействующим, ингалируемым изофлураном так, чтобы мыши немедленно просыпались и могли перемещаться в течение 10 минут перед сбором ткани. Затем собирали ткани влагалища, разрезали открыто продольно, разглаживали и зажимали между двумя предметными стеклами, герметично соединенными суперклеем. Данный способ полностью выравнивал ткань, обнажая поверхности, которые были спрятаны в полости. Изображения тканей получали на эпифлуоресцентном микроскопе (Nikon E6100) при 2 увеличении. Доксорубицин является флуоресцентным (ex/em 470/590). Получали изображения необработанных контрольных тканей, для того чтобы убедиться в том, что флуоресцентный сигнал доксорубицина был значительно большим, чем автофлуоресценция ткани. Небольшое увеличение захватывало большие части ткани, так что было необходимо только 2-3 изображения для наблюдения всей поверхности ткани. Изображения ′ограничивали′, выделяя область соответствующих границ вокруг флуоресцентного сигнала, и затем покрытую площадь количественно измеряли, применяя ImageJ программное обеспечение. Среднее покрытие в процентах определяли для каждой мыши, и данные величины усредняли по группам n=5 мышей.
Для получения распределения MPP в результате движущих сил немедленного поглощения жидкости, 20 мкл или изоосмолярного (PBS), или гипоосмолярного (ультрачистая вода) MPP раствора вводили вагинально. Большие объемы раствора помогали удостовериться, что полость будет заполнена жидкостью, и частицы разбавляли (0,01% масс./об.) так, чтобы градиенты концентрации были видны зрительно. Мышей анестезировали изофлураном и умерщвляли непосредственно после введения частиц. Ткань влагалища быстро отделяли и быстро замораживали в Tissue-Tek O.C.T. Compound. Поперечные срезы получали в различных точках по длине ткани, применяя Leica CM-3050-S криостат. Толщину срезов устанавливали равной 6 мкм, получая толщину одного слоя клеток. Затем срезы окрашивали агентом ProLong Gold, препятствующим выцветанию, с DAPI, визуализируя ядра клеток и сохраняя флуоресценцию частиц. Флуоресцентные изображения срезов получали инвертационным эпифлуоресцентным микроскопом (Zeiss Axio Observer). Что касается MPP распределения в зависимости от различной осмоляльности раствора, растворы частиц (0,08% масс./об.) получали изменением соотношений PBS и ультрачистой воды. Мышей анестезировали изофлураном, и 5 мкл раствора частиц вводили вагинально. Через 10 минут ткани собирали, быстро замораживали, разрезали и окрашивали, следуя способам, изложенным для наблюдения динамики поглощения жидкости. Для того чтобы количественно оценить покрытие ткани влагалища MPP, мышей анестезировали изофлураном, и 5 мкл раствора наночастиц вводили вагинально. В пределах 10 минут ткани отделяли, нарезали открыто продольно, и затем разглаживали, как описано для экспериментов на распределение лекарственных средств. Получали изображения контрольных тканей для того, чтобы удостовериться, что флуоресцентный сигнал был значительно большим, чем аутофлуоресценция ткани. Изображения ткани получали при 10 увеличении, применяя инвертационный эпифлуоресцентный микроскоп (Zeiss Axio Observer), и получали 8 изображений для каждой ткани. Покрытие количественно определяли, как изложено ранее для экспериментов на распределение лекарственных средств.
Удерживание лекарственного средства и наночастиц во влагалище
Доксорубицин растворяли при концентрации 1 мг/мл или в физиологическом растворе с фосфатным буфером ("PBS") (изоосмолярный относительно крови), или в ультрачистой воде (гипоосмолярная). Мышей анестезировали внутрибрюшинной инъекцией авертина перед интравагинальным введением 5 мкл раствора доксорубицина. Мышей оставляли лежать на спине в течение 10 минут для того, чтобы удостовериться, что "вытекший" раствор не будет влиять на измерение удерживания. Затем цельные шеечно-влагалищные тракты отделяли и помещали в стандартные чашки Петри. Флуоресцентные изображения тканей получали, применяя устройство для формирования изображения Xenogen IVIS Spectrum (Caliper Life Sciences). Для подсчета потенциальных различий флуоресценции растворов доксорубицина, пробирки и с изоосмолярными, и с гипоосмолярными растворами доксорубицина включали в изображение. Отношение интенсивности двух растворов применяли для нормализации флуоресценции ткани для каждой группы. Количество единиц флуоресценции на единицу площади рассчитывали, применяя программное обеспечение Xenogen Living Image 2.5. Среднее значение для изоосмолярной и гипоосмолярной групп нормализовали относительно изоосмолярной группы.
Красные флуоресцентные MPP суспендировали или в PBS (изоосмолярная), или в ультрачистой воде (гипоосмолярная) при 0,2% (масс./об.). Мышей анестезировали или внутрибрюшинной инъекцией авертина ("неамбулаторная" группа), или ингаляцией изофлурана ("амбулаторная" группа), как описано ранее для экспериментов по распределению лекарственного средства. Пять мкл или изоосмолярного, или гипоосмолярного раствора MPP вводили интравагинально. Через 1 час для неамбулаторных мышей, или через 10 минут для амбулаторных мышей, цельные шеечно-влагалищные тракты отделяли и помещали в стандартные чашки Петри. Получали флуоресцентные изображения и количественно оценивали их, как описано для удерживания лекарственного средства. В качестве контроля для удерживания MPP, 5 мкл раствора MPP аккуратно прикапывали пипеткой во влагалище после того, как цельный шеечно-влагалищный тракт уже был удален, и его помещали в чашку Петри. Данный подход применяли для MPP (но не для доксорубицина), поскольку наночастицы не проникают через ткань; следовательно, отсутствует потенциальное влияние различной способности проникать через ткань на флуоресцентный сигнал. Затем удерживание рассчитывали в виде процента среднего сигнала для ткани, являющейся контрольной.
Модель инфицирования мышей HSV-2
Мышам вводили 20 мкл 10 мг/мл монофосфата ацикловира, растворенного или в PBS (изоосмолярная), или в ультрачистой воде (гипоосмолярная) непосредственно перед применением. Было показано, что данное лекарственное средство обеспечивает частичную защиту в мышиной модели влагалищной инфекции HSV-2. Мышам вводили дозы или за 1 минуту, или за 60 минут перед вирусным инокулятом. Затем мышам вводили 10 мкл инокулята, содержащего штамм G HSV-2 (ATCC #VR-724, 2,8×107 TCID50на мл). Для исследований на защиту HSV-2 10-кратно разбавляли средой Бартела для доставки 10 ID50, дозу, которая обычно заражает 85-90% контрольных мышей. Что касается испытаний на вызванную осмотически чувствительность, вирус 10-кратно разбавляли средой Бартела и дополнительно 10-кратно разбавляли или средой Бартела (изоосмолярная), или деионизированной водой (гипоосмолярная) до ID50, дозы, которая заражает половину мышей. Мышей оценивали на заражение через три дня после инокуляции выращиванием PBS влагалищного лаважа на фибробластах крайней плоти человека (Diagnostic Hybrids, MRHF Lot #440318 W). В данной модели введенный (загруженный) вирус больше не обнаруживали в промывной жидкости, если ее собирали более чем через 12 часов после загрузки.
Статистические данные
Критерий суммы рангов Уилкоксона применяли для сравнения наборов данных. Данный тест является непараметрическим, и более подходящим в ситуациях, когда нельзя допустить распределение Гаусса. Что касается исследований на заражение HSV-2, статистическую значимость определяли, применяя точный критерий Фишера, двухстороннее распределение.
Результаты
Влияние тоничности на распределение лекарственного средства во влагалище
Когда мыши были неамбулаторными (лежащими на спине в течение 1 часа), только 15% площади ткани влагалища покрывалось доксорубицином, введенным в изоосмолярном растворе, тогда как 88% покрывалось при введении в гипоосмолярном растворе (фигура 5A). Когда мыши свободно перемещались в течение 10 минут перед сбором ткани, изоосмолярный раствор доставлял доксорубицин к 25% площади поверхности влагалища, тогда как гипоосмолярный раствор доставлял его к 86% площади (фигура 5B). Изоосмолярный раствор доставлял лекарственное средство только к поверхностям влагалища, находящимся снаружи полости, а не к поверхностям, содержащимся в скрытых складках влагалища, таким образом, давая картину "полосок" с неэкспонированной тканью, проявляющейся черным цветом. Напротив, гипоосмолярный раствор распределял доксорубицин по всей поверхности влагалища.
Влияние тоничности на удерживание лекарственного средства во влагалище
Изоосмолярные и гипоосмолярные растворы доксорубицина вводили интравагинально анестезированным мышам, избегая любого влияния утечки раствора. Через 10 минут после выдерживания на спине цельный репродуктивный тракт отделяли и анализировали количественно проявлением флуоресценции. Только через 10 минут относительный флуоресцентный сигнал доксорубицина, введенного в гипоосмолярном растворе, составлял половину сигнала доксорубицина, введенного в изоосмолярном растворе (фигура 6).
Влияние тоничности на предотвращение влагалищного заражения HSV-2
Улучшенное распределение гипотонически введенного лекарственного средства испытывали через короткие интервалы времени, и как сокращенное удерживание через более длинные промежутки времени будет влиять на эффективность лекарственного средства, введенного вагинально. Применяли монофосфат ацикловира (ACVp), умеренно защитное лекарственное средство, которое обеспечивает частичную защиту при введении за 30 минут перед вирусным инокулятом в мышиной модели влагалищного заражения HSV-2, поскольку он, вероятно, будет показывать любой благоприятный эффект улучшенного распределения. Аналогично доксорубицину, ACVp является растворимым в воде и действует внутриклеточно. Во-первых, убеждались в том, что гипотоническая жидкость не увеличивает подверженность к заражению введением ID50 дозы вируса (обычно заражает ~50% мышей), суспендированного или в изотоническом, или в гипотонической растворе. Когда вирус вводили или в изотоническом, или в гипотоническом растворе, заражалось 60% (9/15) мышей. Данный контрольный эксперимент показывал, что изменения скорости заражения были результатом присутствия лекарственного средства, а не гипотонических эффектов на вирус или подверженность ткани заражению. Для исследования защитных свойств применяли 10ID50, дозу, которая обычно заражает ~90% мышей.
Когда 1% ACVp вводили за 1 минуту до вируса, заражалось 49% (22/45) мышей, когда ACVp вводили изотонически, и заражался 31% (14/45) мышей, когда ACVp вводили гипотонически (фигура 7). Хотя данный результат приводит к выводу, что гипотонический раствор мог улучшить защиту влагалища, данное отличие не было статистически значимым (p=0,1). Когда 1% ACVp вводили за 1 час до вируса, заражалось 45% (27/60) мышей, когда ACVp вводили изотонически, и заражалось 73% (33/45) мышей, когда ACVp вводили гипотонически (фигура 7). Данное отличие было статистически значимым, приводя к выводу, что гипотоническая доставка могла улучшить немедленную защиту, осмотический поток через эпителий, по-видимому, удалял ACVp из влагалища, приводя в результате к ослабленной защите.
Влияние переноса, обусловленного осмотически, на распределение наночастиц во влагалище
Гипотоническая доставка свободного лекарственного средства приводит к улучшенному распределению в вагинальном тракте, но поглощение жидкости, вызванное осмотически, может вызывать удаление лекарственных средств, для которых эпителий влагалища является проницаемым, растворным привлечением. Напротив, эпителий влагалища по существу является непроницаемым для наночастиц, и, если они являются проникающими через слизь, осмотический поток доставляет их к эпителиальной поверхности. MPP, способные проникать через слизь влагалища, покрывают всю поверхность влагалища в пределах 10 минут после доставки в гипотоническом растворе. Даже при доставке в гипотонической жидкости, мукоадгезивные наночастицы (CP) агрегируют в полостных слоях слизи и не переносятся через слизь влагалища к эпителию влагалища переносом, вызванным осмотически. Определяли зависимость от тоничности распределения MPP, обусловленного осмотически, непосредственно после введения. Замораживая ткани влагалища непосредственно после введения MPP, можно было получить "моментальный снимок" первоначальной динамики распределения частиц.
Когда MPP вводят в изотоническом растворе, наночастицы обнаруживали распределенными по всей полости, но при доставке в гипотонических растворах был очевидным градиент концентрации частиц, причем MPP концентрировались на поверхности эпителия влагалища. Из поверхностного распределения MPP очевидно, что вызванный гипотонически поток жидкости приводил в результате к тому, что MPP быстро притягивались к поверхности влагалища, без поглощения через эпителий.
Влияние тоничности на удерживание наночастиц во влагалище
Была выдвинута гипотеза, что в отличие от свободного лекарственного средства, вводимого в гипотоническом растворе, удерживание во влагалище MPP будет улучшать гипотоническую доставку. Поскольку было предположено, что утечка жидкости будет играть некоторую роль в удерживании наночастиц, сравнивали и неамбулаторные, и амбулаторные условия. В случае неамбулаторных мышей (лежащих на спине в течение 1 часа) сохранялось 69% MPP, введенных в изотоническом растворе, и 83% MPP, введенных в гипотоническом растворе (фигура 8A). По-видимому, 1-часовой период обеспечивал поглощение жидкости и устранял гравитационные эффекты, снижая утечку. Хотя больший процент MPP сохранялся при введении в гипотоническом растворе, различие не было статистически значимым.
Однако когда мышам позволяли свободно перемещаться, наблюдали значительное снижение удерживания MPP, введенных в изотоническом растворе. После 10 минут свободного перемещения сохранялось только 22% MPP, введенных в изотоническом растворе, по сравнению с 75% MPP, введенными в гипотоническом растворе (фигура 8B). По-видимому, быстрая доставка MPP к поверхности влагалища приводила к продленному удерживанию, поскольку большая часть жидкости во влагалище быстро удалялась при свободном перемещении.
Влияние осмоляльности на распределение наночастиц во влагалище
Хорошо известно, что тоничность может сильно воздействовать на клетки, и новейшие данные отмечают токсичность сильно гипертонических гелей и для эпителия влагалища, и для эпителия прямой кишки, особенно при повторяющемся воздействии. Гипотонические растворы могут также вызывать токсичность. Для избегания потенциальных токсических эффектов было исследовано, могут ли умеренные степени гипотоничность все же улучшать распределение частиц во влагалище. В пределах 10 минут введения, MPP в гипотонических растворах, включающих 10-кратный диапазон (20-220 мосмоль/кг), доставляют MPP к поверхности влагалища. В противоположность изотоническому раствору (294 мосмоль/кг), который оставляет MPP частицы распределенными по всей полости влагалище с небольшим количеством, нанесенным на эпителиальную поверхность, умеренно гипотонический раствор (220 мосмоль/кг) вызывал быстрый перенос к эпителиальной поверхности. Кроме того, была тенденция к увеличению покрытия влагалища по мере повышения гипотоничности: В самом гипотоническом растворе (20 мосмоль/кг) MPP покрывали 88% эпителия влагалища через 10 минут, тогда как только 60% поверхности влагалища было покрыто MPP, введенными в растворе 294 мосмоль/кг (фигура 9). При всех испытуемых тоничностях, MPP достигали большей части эпителиальной поверхности, чем мукоадгезивные (CP) частицы, и минимально гипотонический раствор (220 мосмоль/кг) доставлял частицы к 76% поверхности влагалища, значительное увеличение по сравнению с 60% покрытием изотоническим раствором (294 мосмоль/кг).
В заключение, исследования, изучающие применение гипотонических растворов для доставки лекарственных средств с улучшенным переносом во влагалище показали, что хотя гипотоническая доставка доксорубицина улучшала распределение во влагалище, лекарственное средство поглощалось в эпителии, уменьшая удерживание во влагалище. Напротив, было обнаружено, что гипотоническая доставка мукоинертных наночастиц, проникающих через слизь (MPP), улучшала и распределение, и удерживание. Кроме того, было обнаружено, что даже минимально гипотоническая доставка значительно улучшала распределение во влагалище. Результаты показывают, что гипотонические композиции являются более эффективными для доставки лекарственных средств во влагалище, чем традиционные гипертонические композиции, и что MPP, доставленные гипотонически, являются особенно перспективными для нетоксичной замедленной доставки лекарственного средства по всей поверхности влагалища.
Хотя имелось улучшенное распределение лекарственного средства в гипотоническом растворе, поглощение жидкости могло потенциально приводить к быстрому удалению лекарственного средства флюидным переносом через эпителий влагалища. Применяя монофосфат ацикловира (ACVp), была продемонстрирована тенденция к улучшенной защите ACVp в гипотоническом растворе, введенным вагинально сразу же после HSV-2 вируса. Улучшенная защита, вероятно, является результатом увеличение покрытия влагалища лекарственным средством, введенным в гипотоническом растворе. Напротив, когда HSV-2 вводили через 1 час после лекарственного средства, защита ACVp, введенным в гипотоническом растворе, была значительно снижена по сравнению с ACVp в изотоническом растворе. Абсорбция лекарственного средства вдоль эпителия потоком жидкости, вызванным осмотически, приводила к выведению лекарственного средства и снижению защиты через 1 час. MPP обеспечивают способ для достижения улучшенного распределения лекарственного средства гипотонической доставкой, поскольку наночастицы накапливаются на поверхности эпителия влагалища, и MPP, содержащие ACVp, показали лучшую защиту, чем в 10 раз большая концентрация свободного лекарственного средства при введении вагинально за 30 минут перед HSV-2 вирусом. MPP сразу же притягивались эпителием влагалища при введении в минимально гипотоническом растворе.
Поглощение и выделение жидкости могут также влиять на удерживание во влагалище. Ранее было продемонстрировано, что у людей скорость утечки вагинальных гелей увеличивалась линейно по мере увеличения гипертоничности (Zeitlin et al. Contraception 68, 139-155 (2003)). В данном случае удерживание ослаблялось выделением жидкости, вызванным осмотически, приводящим к утечке продукта. Это показывает, что гипотонические продукты могут вызывать поглощение жидкости и снижение утечки, и могут, посредством этого, улучшать удерживание во влагалище. Было обнаружено, что это необязательно является верным для лекарственных средств, отличных от MPP, которые могут поглощаться эпителием влагалища. MPP, проникая в более медленно очищаемые слои слизи в глубоких складках влагалища, удерживаются дольше, чем CP. Как показано в данном исследовании, MPP лучше удерживаются в вагинальном тракте амбулаторных мышей при введении в гипотоническом растворе, по сравнению с введением в изотоническом растворе, снижением утечки во влагалище. Данные результаты показывают, что гипотоническая гелевая композиция, содержащая MPP, будет, вероятно, улучшать и распределение, и удерживание лекарственного средства во влагалище человека.
Пример 9. Сравнение влияния осмолярности на поглощение частиц в толстой кишке
Материалы и способы
Исследования проводили, как описано в примерах 7 и 9, сравнивая распределение MPP в толстой кишке мыши в растворе с изменяющейся тоничностью. В исследованиях сравнивали поглощение в толстой кишке с 20 мосмоль, 260 мосмоль, 350 мосмоль, 450 мосмоль, 860 мосмоль и 2200 мосмоль растворы. Единственным основанием для получения конвективного переноса к эпителию с помощью гиперосмолярных растворов является то, что они будут гиперосмолярными с помощью Na.
Также определяли распределение различных размеров CP и MPP после ректального совместного введения мышам с колитом, вызванным TNBS. Анализировали флуоресцентные изображения разглаженной ткани прямой кишки после гипотонического ректального введения растворов, содержащих смесь CP (красный) и MPP (зеленый) различных размеров (100 нм, 200 нм, 500 нм). Также получали поперечные срезы из замороженной ткани прямой кишки 200 нм CP и MPP (ядра клеток окрашивали синим DAPI).
Результаты
Эффективная осмоляльность толстой кишки, по-видимому, составляет 400-530 мосмоль/кг, выше осмолярности плазмы крови (~300 мосмоль/кг). Данный больший диапазон подтверждается Billich and Levitan, J Clinical Invest, (1969). Среды с осмоляльностью 400 мосмоль/кг и ниже обеспечивают улучшенное распределение MPP на поверхности ткани толстой кишки.
Пример 10. определение токсичности гипоосмотической композиции MPP
Недавние исследования показывают, что в ответ на определенные вагинальные продукты, эпителий влагалища может секретировать иммуномедиаторы, которые могут увеличивать подверженность к инфекциям, передающимся половым путем. Также было установлено, что другие состояния, такие как досрочные роды, связаны с воспалением репродуктивного тракта. Таким образом, важно, чтобы вагинальный продукт не вызывал данной иммунной реакции, особенно после повторяющегося дозирования. Гиперосмоляльные композиции ранее были продемонстрированы как токсичные для эпителия влагалища и прямой кишки, что может сводить на нет защитные или терапевтические полезные эффекты введенных лекарственных средств. Соответственно, данное исследование проводили для того, чтобы удостовериться, что гипоосмоляльные композиции не вызывают токсичности при введении в мукозальный эпителий.
Материалы и способы
Семидневные обработки чистыми гипотоническими (~20 мосмоль/кг) жидкостями (содержащими Pluronic F127 или MPP) и стандартной изоосмолярной гидроксиэтилцеллюлозой сравнивали с вариантами без обработки. Гипертонический гель (среда, содержащая 20% глицерин, применяемая в клинических исследованиях). Гипотоническую гелевую композицию (гель HEC с 20% повышенным содержанием воды для компенсации поглощения воды), содержащую MPP, сравнивали со стандартной гипертонической гелевой композицией (HEC, содержащей 20% глицерин, стандартная концентрация глицерина, применяемая для вагинальных гелевых композиций) на основе изображений поперечного сечения влагалища.
Двадцать мкл каждого испытуемого агента вводили интравагинально в мышиной модели DP один раз в день в течение семи дней. Гель HEC и N9 были предоставлены T. Moench (Reprotect), и гель с тенофовиром был любезно предоставлен C. Dezzutti (Питтсбургский университет). На восьмой день каждую мышь промывали дважды 50 мкл PBS. Каждый промывочный образец разбавляли дополнительными 200 мкл PBS и центрифугировали, удаляя слизистую пробку. Надосадочную жидкость (200 мкл) удаляли и разделяли по 50 мкл, для каждого из четырех (IL-1β, IL-1α, TNF-α, и IL-6) наборов для иммуноферментного анализа Quantikine (R&D Systems). Иммуноферментный анализ проводили согласно инструкциям производителя.
Результаты
Семидневная обработка чистыми гипотоническими (~20 мосмоль/кг) жидкостями (содержащими Pluronic F127 или MPP) и стандартной изоосмолярной гидроксиэтилцеллюлозой не вызывает увеличения количества цитокинов во влагалище (IL-1 альфа/бета), по сравнению с вариантом без обработки. Гипертонический гель (среда, содержащая 20% глицерин, применяемая в клинических испытаниях) вызывал значительное увеличения количества данных цитокинов во влагалище. Гипотоническую гелевую композицию, содержащую MPP, сравнивали со стандартной гипертонической гелевой композицией на основе изображений поперечного сечения влагалища. По-видимому, распределение и удерживание во влагалище MPP через 6 часов улучшалось в случае гипотонического (через 6 часов удерживался 81%) геля (гель HEC с 20% повышенным содержанием воды для компенсации поглощения воды) по сравнению с гипертонической (через 6 часов удерживалось ~20%) гелевой композицией (HEC, содержащая 20% глицерин, стандартная концентрация глицерина, применяемая для вагинальных гелевых композиций).
Реферат
Группа изобретений относится к области фармацевтической промышленности, а именно к гипотонической композиции для быстрого и равномерного распределения терапевтического, профилактического, диагностического или нутрицевтического агента по мукозальной поверхности, содержащей частицы, проникающие через слизь, которые содержат терапевтический, профилактический, диагностический или нутрицевтический агент и полиалкиленоксидное покрытие, улучшающее проникновение через слизь, которое улучшает диффузию частиц через слизь, где покрытие имеет коэффициент плотности [Г]/[Г*]>3, где Г - это плотность полиэтиленгликоля, характеризующая число молекул полиэтиленгликоля на 100 нмповерхности частицы, а Г* - это полное покрытие поверхности частицы, характеризующее теоретическое число свободных молекул полиэтиленгликоля, требуемое для полного покрытия 100 нмповерхности частицы, а также к способу введения одного или более терапевтических, профилактических и/или диагностических агентов человеку или животному с помощью указанных композиций. Группа изобретений обеспечивает получение частиц, проникающих через слизь, полностью защищенных от адсорбции слизи. 2 н. и 19 з.п. ф-лы, 23 ил., 8 табл., 10 пр.

Комментарии