Хинолил-содержащее соединение гидроксамовой кислоты, способ его получения, а также применение при лечении заболеваний, вызванных аномальной активностью протеинкиназы и/или гистондеацетилазы - RU2573633C2
Код документа: RU2573633C2
Чертежи

Описание
Область изобретения
Настоящее изобретение относится к областям органической химии и медицинской химии, в частности к хинолил-содержащему соединению гидроксамовой кислоты, способу его получения, фармацевтической композиции, содержащей это соединение, и его применению.
Предшествующий уровень техники
Протеинкиназы представляют один из видов фосфотрансфераз и осуществляют функцию переноса гамма-фосфатной группы АТФ на специфический аминокислотный остаток субстрата для фосфорилирования белка, тем самым проявляя свои физиологические и биохимические функции. Протеинкиназы представляют важный класс киназ. При передаче сигнала их главные функции лежат в двух аспектах: один состоит в том, чтобы регулировать активность белка посредством фосфорилирования; другой состоит в том, чтобы постепенно усиливать сигнал путем последовательного фосфорилирования белка, тем самым вызывая клеточный ответ.
Аномальная активность протеинкиназ не только тесно связана с аномальным состоянием на определенных этапах в последовательности внутриклеточных путей передачи сигнала, таких как пролиферация опухолевых клеток, апоптоз и метастазирование, но также является основной причиной возникновения ряда других заболеваний человека, связанных с воспалительным или пролиферативным ответом, например ревматоидного артрита, заболеваний сердечно-сосудистой и нервной системы, астмы, псориаза. На данный момент известно о существовании свыше 400 видов заболеваний человека, непосредственно или опосредованно связанных с протеинкиназой, что делает протеинкиназу еще одной важной мишенью для лекарственных средств после сопряженных с G-белком рецепторов.
Большое семейство протеинкиназ состоит из более чем 500 членов, которое обычно подразделяют на два класса, а именно протеинтирозинкиназы (РТК) и серин-треонинкиназы. По расположению киназ в клетках их классифицируют на рецепторные киназы и нерецепторные киназы, также называемые внутриклеточными киназами. Рецепторные киназы главным образом принадлежат к тирозинкиназам, также называемым рецепторными тирозинкиназами (RTK). Такие рецепторные киназы состоят из внеклеточной части, трансмембранной области и внутриклеточной части. Часть киназы, обладающая каталитической активностью, находится в цитоплазме. Подавляющее большинство серин-треонинкиназ находится внутри клетки и принадлежит к нерецепторным киназам, также называемым цитоплазматическими киназами.
Типичными представителями семейства RTK являются рецепторы факторов роста, которые могут быть разделены на по меньшей мере 19 подсемейств. Главными подсемействами являются следующие:
(а) рецепторные тирозинкиназы семейства HER, включая EGFR (рецептор эпителиального фактора роста), HER2, HER3 и HER4. EGFR является мишенью синтетических низкомолекулярных лекарственных средств Tarceva®, Tykerb® и моноклонального антитела Erbitux® для лечения немелкоклеточного рака легких;
(б) подсемейство, состоящее из рецептора инсулина (IR), рецептора инсулиноподобного фактора роста 1 (IGF-1R) и рецептора, родственного инсулиновому рецептору (IRR), где IGF-1R является хорошо известной мишенью противораковой терапии, однако поскольку он чрезвычайно похож на IR, особенно во внутриклеточной части киназы, в которой аминокислотная последовательность на 100% идентична соответствующей аминокислотной последовательности IR, также может ингибироваться активность IGF-1R, в то время как обычно ингибируется активность IR. Доказано, что IR также является эффективной мишенью противораковой терапии. Однако необходимо найти баланс между эффективностью и допускаемым риском при использовании ингибиторов IR против рака из-за того, что ингибирование IR ведет к появлению риска повышения уровня сахара в крови;
(в) семейство рецепторов фактора роста тромбоцитов (PDGFR), включая PDGFR-α, PDGFR-β, CSF1R, c-KIT и c-fms, где с-Kit также служит молекулярной мишенью лекарственного средства Gleevec® для лечения лейкоза, а также для лечения стромальных опухолей желудочно-кишечного тракта;
(г) семейство рецепторов фактора роста эндотелия сосудов (VEGFR), включая FLT1 (Fms-подобная тирозинкиназа 1 или VEGFR1), KDR (или VEGFR-2) и FLT4 (или VEGFR3), члены этого семейства являются молекулярными мишенями для Sutent® и Naxavar®;
(д) семейство рецепторов фактора роста фибробластов (FGFR), включая FGFR1, FGFR2, FGFR3 и FGFR4, а также 7 лигандов FGF1, FGF2, FGF3, FGF4, FGF5, FGF6 и FGF7, члены этого семейства являются молекулярными мишенями для лекарственных средств, в настоящее время проходящих клинические испытания;
(е) семейство МЕТ, включая c-Met, также называемый рецептором фактора роста гепатоцитов человека (hHGFR), и RON, где c-Met играет важную роль в росте и метастазировании первичной опухоли. Лекарственные средства, нацеленные на членов семейства МЕТ, в настоящее время все еще проходят клинические испытания;
(ж) семейство RET. RET представляет собой рецептор членов семейства GDNF, имеющих изоформы RET51, RET43 и RET9. Лекарственные средства, нацеленные на членов семейства RET, в настоящее время все еще проходят клинические испытания;
(з) семейство Eph, которое является самым большим семейством рецепторных тирозинкиназ и состоит из 16 рецепторов (ЕРНА1, ЕРНА2, ЕРНА3, ЕРНА4, ЕРНА5, ЕРНА6, ЕРНА7, ЕРНА8, ЕРНА9, ЕРНА10, ЕРНВ1, ЕРНВ2, ЕРНВ3, ЕРНВ4, ЕРНВ5, ЕРНВ6) и 9 лигандов (EFNA1, EFNA2, EFNA3, EFNA4, EFNA5, EFNB1, EFNB2, EFNB3). Члены этого семейства играют важную роль в развитии животных, и некоторые из них играют роль в опухолевых процессах.
AXL представляет собой еще одну важную рецепторную тирозинкиназу. AXL также известна как UFO/ARK/Tyro, а ее лиганд представляет собой витамин K-зависимый ростовой стимулирующий фактор GAS6. AXL впервые обнаружена как трансформирующий ген при хроническом миелогенном лейкозе (CML). AXL сверхэкспрессируется при метастатическом раке толстой кишки, раке щитовидной железы, раке молочной железы, раке предстательной железы и меланоме. Ингибирование активности AXL может играть роль в ингибировании клеточного роста, пролиферации и метастазах.
Нерецепторные киназы не имеют внеклеточной части и трансмембранной области, а вся киназа находится в цитоплазме. На настоящий момент известно, что существует по меньшей мере 24 вида нерецепторных киназ, которые подразделяют на 11 подсемейств, а именно подсемейства Src, Frk, Btk, CsK, Abl, Zap70, Fes, Fps, Fak, Jak и AcK. Подсемейство Src является самым большим и включает киназы Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr, AUR1, AUR2 и Yrk. Для более подробной информации см. Neet, К.; Hunter, Т. Genes to Cells 1996, 1, 147-169, и документы, упомянутые там. Хотя некоторые нерецепторные киназы принадлежат тирозинкиназам, большинство нерецепторных киназ являются серин-треонинкиназами. Некоторые их члены являются молекулярными мишенями лекарственных средств Gleevec® и Sprycel® для лечения лейкоза.
Как указано выше, при клиническом и практическом применении было доказано, что рецепторные киназы и нерецепторные киназы являются мишенями противоопухолевой терапии, и некоторые противоопухолевые лекарственные средства разрешены к продаже на рынке для лечения пациентов. Кроме лечения опухолей ингибирование аномальной активности рецепторных киназ и нерецепторных киназ также может быть использовано для лечения следующих заболеваний, которые включают: псориаз, или serpedo, цирроз, диабет, заболевания, связанные с ангиогенезом, заболевания, связанные с рестенозом, заболевания глаз, возрастную дегенерацию желтого пятна, ревматоидный артрит и другие воспалительные заболевания, заболевания иммунной системы, такие как аутоиммунные заболевания, сердечно-сосудистые заболевания, такие как атеросклероз, или заболевание почек, но не ограничиваются ими. Таким образом, необходимо продолжать разработки ингибиторов этих киназ.
Гистондеацетилаза (HDAC) представляет класс ферментов, повсеместно обнаруживаемых в бактериях, грибах, растениях и животных, роль которой заключается в удалении ацетила из аминогрупп N-концевых лизиновых остатков гистонового ядра, что усиливает объединение N-концевого положительно заряженного гистонового ядра с отрицательно заряженной ДНК и тем самым предотвращает транскрипционный алгоритм от контактирования с ДНК-матрицей. Согласно их гомологии с белками грибов гистондеацетилазы (HDAC) подразделяют на четыре класса: класс I включает HDAC1, HDAC2, HDAC3 и HDAC8, которые гомологичны белку грибов RPD3; класс II включает HDAC4, HDAC5, HDAC7 и HDAC9, которые гомологичны белку грибов HDA1; класс IIа включает HDAC6 и HDAC10, содержащие две каталитические точки; класс IV включает HDAC11, каталитический центр которого содержит аминокислотные остатки, относящиеся к классу I и II HDAC. Каталитические сайты 11HDAC изоформ имеют ионы цинка и могут ингибироваться соединениями гидроксамовых кислот, такими как SAHA (Vorinostat), трихостатин A (TSA). Ингибиторы HDAC в качестве стабилизаторов настроения и противоэпилептических лекарственных средств имеют длинную историю применения в психиатрии и неврологии. Ингибиторы HDAC изучаются для применения в лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона. Еще один большой класс применений ингибиторов HDAC используется в качестве противораковых лекарственных средств, репрезентативный пример которого представляет собой Vorinostat, разработанный фирмой Merck, который одобрен FDA для лечения метастатической кожной T-клеточной лимфомы (CTCL) в 2006 году. Лечение других опухолей, включающих солидные опухоли и лейкоз, ингибиторами HDAC находится в стадии клинических испытаний.
Краткое изложение сущности изобретения
Задача настоящего изобретения состоит в том, чтобы предложить хинолил-содержащее соединение гидроксамовой кислоты, обладающее ингибирующей активностью в отношении протеинкиназы и/или гистондеацетилазы, и также способ его получения.
Также в задачу настоящего изобретения входит применение вышеуказанного хинолил-содержащего соединения гидроксамовой кислоты для изготовления фармацевтической композиции для лечения заболеваний, связанных с аномальной активностью протеинкиназы и/или гистондеацетилазы.
Также в задачу настоящего изобретения входит предложение фармацевтической композиции, включающей указанную хинолил-содержащую гидроксамовую кислоту, способную лечить заболевания, связанные с аномальной активностью протеинкиназы и/или гистондеацетилазы.
Подробное описание изобретения
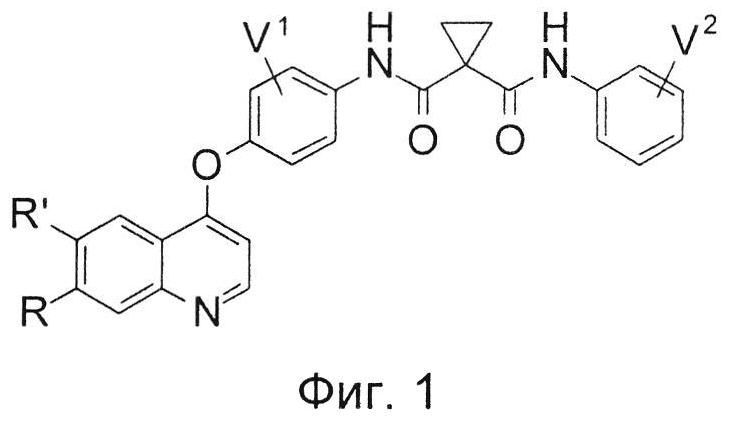
Предложено хинолил-содержащее соединение гидроксамовой кислоты, имеющее молекулярную структуру, представленную следующей ниже формулой (I):
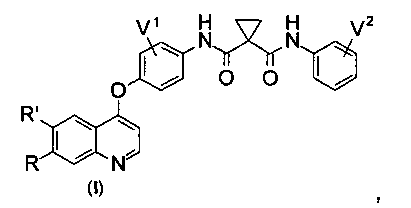
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -NO2, -CN, -ОН, -NH2, -NMe2, С1-6алкил, С2-6алкенил, С2-6алкинил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
один из R и R′ представляет собой группу Q, содержащую гидроксамовую кислоту, а другой представляет собой водород, метокси, метоксиэтокси или группу Q, содержащую гидроксамовую кислоту,
где группа Q, содержащая гидроксамовую кислоту, представлена формулой
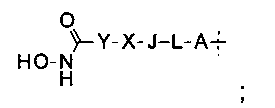
А представляет собой О, NH, S(=O)m, С1-6алкил, или А отсутствует, и водород в А может быть замещен G1;
L представляет собой С1-6алкил, С2-6алкенил, С2-6алкинил, С3-6циклоалкил, С6арил, С5-6гетероарил, С3-12гетероалициклил, или L отсутствует, и водород в L может быть замещен G2;
J представляет собой О, NH, S(=O)m, С1-6алкил, С2-6алкенил, С2-6алкинил, С3-6циклоалкил, С6арил, С5-6гетероарил, С3-12гетероалициклил, или J отсутствует, и водород в J может быть замещен G3;
X представляет собой -С(=O)-, -S(O)m, С1-6алкил, С2-6алкенил, С2-6алкинил, С3-6циклоалкил, С6арил, С5-6гетероарил, С3-12гетероалициклил, или X отсутствует, и водород в X может быть замещен G4;
Y представляет собой С1-6алкил, С2-6алкенил, С2-6алкинил, С3-6циклоалкил, С6арил, С5-6гетероарил, С3-12гетероалициклил, или Y отсутствует, и водород в Y может быть замещен G5;
где
каждый из G1, G2, G3, G4 и G5 независимо представляет собой Н, -CN, - CF3, -СО2Н, галоген, С1-6алкил, С3-6циклоалкил, С2-6алкенил, С2-6алкинил, С6арил, С5-6гетероарил, С3-12гетероалициклил, R1O-, R1R2N-, R1S(=O)m-, R1R2NS(=O)m-, R3C(=O)-, R1R2NC(=O)-, R1OC(=O)-, R3C(=O)O-, R1R2NC(=O)O-, R3C(=O)NR1-, R1R2NC(=O)NR4-, R1OC(=O)NR4-, R1S(=O)mNR4-, R1R2NS(=O)mNR4-, R1R2NC(=NR5)NR4-, R1R2NC(=CHNO2)NR4-, R1R2NC(=N-CN)NR4-, R1R2NC(=NR5)-, R1S(=O)(=NR5)NR4- или R1R2NS(=O)(=NR5)-;
каждый из R1, R2, R3, R4 и R5 независимо представляет собой Н, С1-6алкил, С2-6алкенил, С2-6алкинил, С3-6циклоалкил, С6арил, С5-6гетероарил или С3-12гетероалициклил; когда R1 и R2 связаны с одним и тем же атомом азота, они могут образовывать С3-12гетероалициклильное кольцо вместе с атомом азота, к которому они присоединены, и это С3-12гетероалициклильное кольцо может дополнительно содержать один или более гетероатомов, выбранных из О, N, или S(=O)m; водород в R1, R2, R3, R4 и R5 может быть замещен галогеном, CN, С1-6алкилом или С3-6циклоалкилом;
m равен от 0 до 2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ia) ниже:
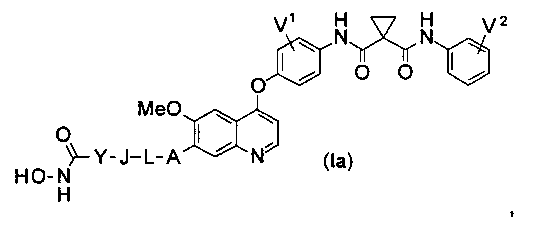
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
А представляет собой О, NH или S(=O)m, и водород в А может быть замещен G1;
L представляет собой С1-6алкил или С3-6циклоалкил, и водород в L может быть замещен G2;
J представляет собой О, NH или S(=O)m, и водород в J может быть замещен G3;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5;
m равен от 0 до 2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ib) ниже:
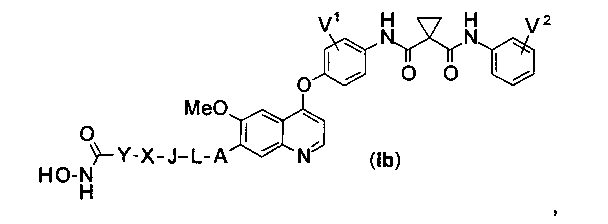
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
А представляет собой О, NH или S(=O)m, и водород в А может быть замещен G1;
L представляет собой С1-6алкил, и водород в L может быть замещен G2;
J представляет собой С3-6циклоалкил или С3-12гетероалициклил, и водород в J может быть замещен G3;
X представляет собой -С(=O)-, S(=O)m, или X отсутствует;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5;
m равен от 0 до 2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ic) ниже:
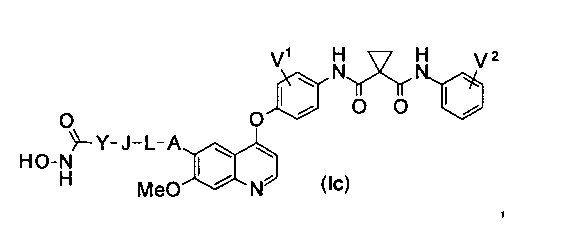
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
А представляет собой О, NH или S(=O)m, и водород в А может быть замещен G1;
L представляет собой С1-6алкил или С3-6циклоалкил, и водород в L может быть замещен G2;
J представляет собой О, NH или S(=O)m, и водород в J может быть замещен G3;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5;
m равен от 0 до 2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Id) ниже:
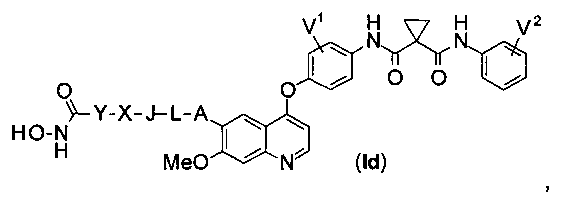
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
А представляет собой О, NH или S(=O)m, и водород в А может быть замещен G1;
L представляет собой С1-6алкил, и водород в L может быть замещен G2;
J представляет собой С3-6циклоалкил или С3-12гетероалициклил, и водород в J может быть замещен G3;
X представляет собой -С(=O)-, S(=O)m, или X отсутствует;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5;
m равен от 0 до 2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ie) ниже:
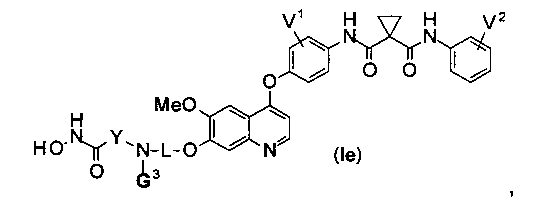
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
L представляет собой С1-6алкил или С3-6циклоалкил, и водород в L может быть замещен G2;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (If) ниже:
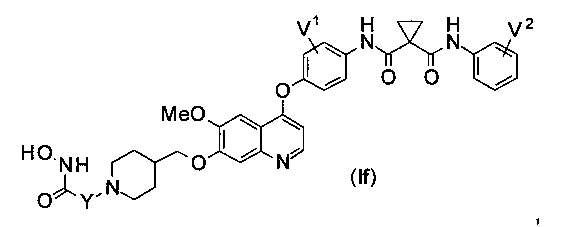
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, G3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ig) ниже:
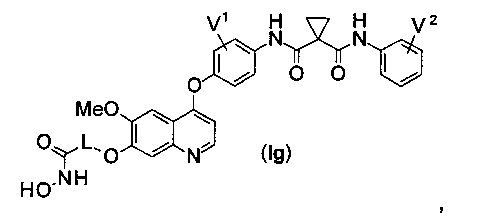
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
L представляет собой С1-6алкил или С3-6циклоалкил, и водород в L может быть замещен G2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ih) ниже:
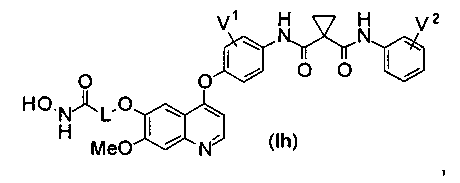
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
L представляет собой С1-6алкил или С3-6циклоалкил, и водород в L может быть замещен G2.
Структура хинолил-содержащего соединения гидроксамовой кислоты представлена формулой (Ii) ниже:
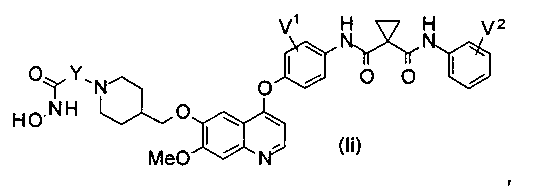
где
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
Y представляет собой С1-6алкил или С3-6циклоалкил, и водород в Y может быть замещен G5.
Хинолил-содержащее соединение гидроксамовой кислоты представляет собой любое из следующих соединений:
N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-(гидроксиамино)-3-оксопропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[2-(гидроксиамино)-2-оксоэтокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[3-(гидроксиамино)-3-оксопропокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[4-(гидроксиамино)-4-оксобутокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[5-(гидроксиамино)-5-оксопентилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[6-(гидроксиамино)-6-оксогексилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[7-(гидроксиамино)-7-оксогептилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]метокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]-пропокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]-пропокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[3-(гидроксиамино)-3-оксопропокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]метокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]-пропокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[3-[[3-(гидроксиамино)-3-оксопропил]амино]-пропокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[2-(гидроксиамино)-2-оксоэтокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[3-(гидроксиамино)-3-оксопропокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[4-(гидроксиамино)-4-оксобутокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[5-(гидроксиамино)-5-оксопентилокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[6-(гидроксиамино)-6-оксогексилокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[6-[7-(гидроксиамино)-7-оксогептилокси]-7-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид.
Хинолил-содержащее соединение гидроксамовой кислоты предпочтительно представляет собой любое из следующих соединений:
N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-(гидроксиамино)-3-оксопропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]метокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]-пропокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]-пропокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[3-(гидроксиамино)-3-оксопропокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид.
Хинолил-содержащее соединение гидроксамовой кислоты более предпочтительно представляет собой любое из следующих соединений:
N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]метокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид;
N1′-(4-фторфенил)-N1-[4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]циклопропан-1,1-дикарбоксамид.
Рацематы или энантиомеры любого из вышеупомянутых хинолил-содержащих соединений гидроксамовой кислоты охватываются настоящим изобретением.
Один из способов получения хинолил-содержащего соединения гидроксамовой кислоты заключается в осуществлении стадий, показанных на Схеме 1:
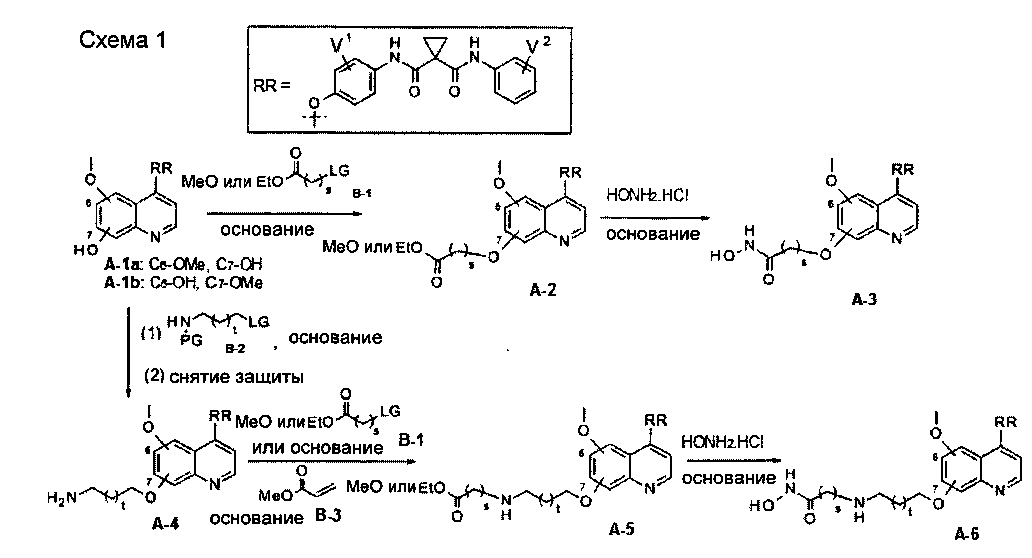
где
t равен от 0 до 6;
s равен от 1 до 10;
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
LG представляет собой общепринятую в области органической химии уходящую группу и представляет собой любую из F, Cl, Br, I, MsO, TsO или TfO;
PG представляет собой общепринятую в области органической химии защитную группу и представляет собой Boc или CBZ.
Один из способов получения хинолил-содержащего соединения гидроксамовой кислоты заключается в осуществлении стадий, показанных на Схеме 2:
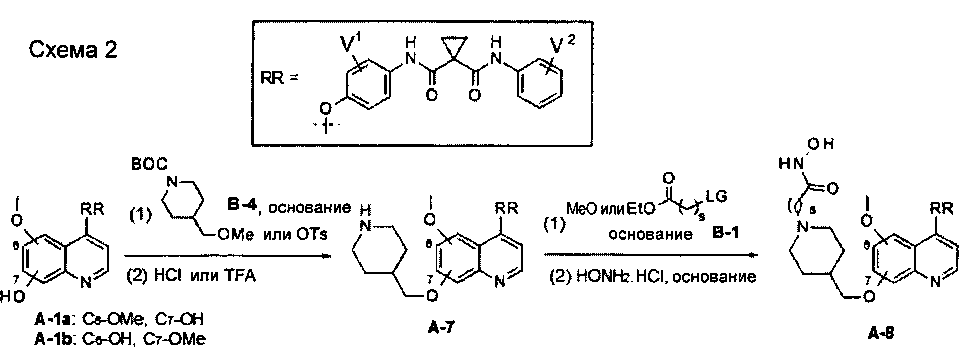
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
s равен от 1 до 10.
Один из способов получения хинолил-содержащего соединения гидроксамовой кислоты заключается в осуществлении стадий, показанных на Схеме 3:
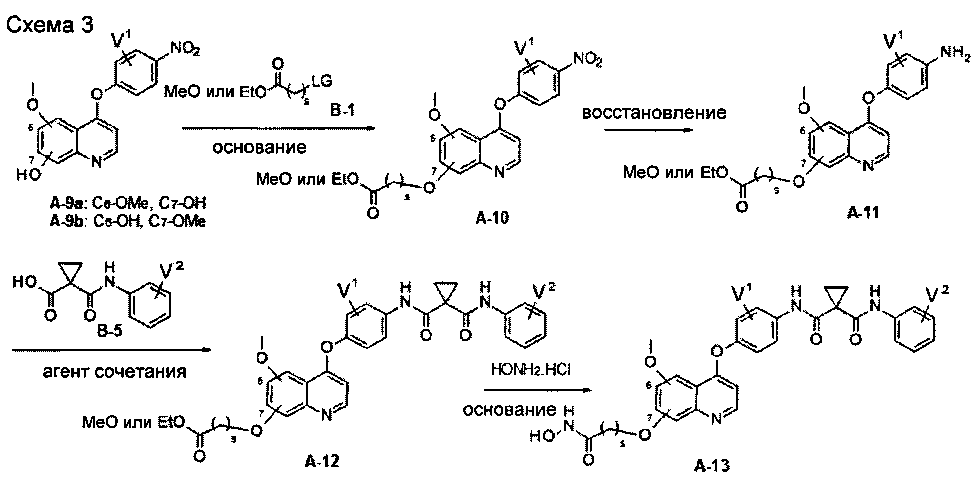
каждый из V1 и V2 независимо представляет собой водород, галоген, группу -OCF3, -CF3, -CN, -NMe2, С1-6алкил, С3-6циклоалкил, С3-12гетероалициклил, С1-6алкокси, С3-6циклоалкилокси или С3-12гетероалициклилокси;
s равен от 1 до 10.
В данной заявке предложено применение фармацевтической композиции, включающей хинолил-содержащее соединение гидроксамовой кислоты, для лечения заболеваний, вызванных аномальной активностью протеинкиназы и/или гистондеацетилазы.
В применении фармацевтической композиции, содержащей соединение по настоящему изобретению, протеинкиназа представляет собой ALK, AXL, ВТК, CDK11, c-Met, KDR, VEGFR2, RET, PDGFR-α, PDGFR-β, c-KIT, Flt3, MEK1, MEK2, CSF1R, EPHA2, MKNK2, TIE2, TRKA, SRC, PLK4, RON, EGF1R, HER2, HER3, HER4, PDGFR-α, c-fms, FLT1, Src, Frk, Btk, CsK, Abl, Fes, Fps, Fak, AcK, Yes, Fyn, Lyn, Lck, Hck, Fgr, Yrk, PDK1, TAK1, Tie-1, YSK4, TRK B, TRK C, SLK, PKN2, MST1R, MAP4K или DDR2.
Предпочтительно в применении фармацевтической композиции, содержащей соединение по настоящему изобретению, протеинкиназа представляет собой ALK, AXL, ВТК, CDK11, c-Met, KDR, VEGFR2, RET, PDGFR-α, PDGFR-β, c-KIT, Flt3, MEK1, MEK2, CSF1R, EPHA2, MKNK2, TIE2, TRKA, SRC или PLK4.
В применении фармацевтической композиции, содержащей соединение по настоящему изобретению, гистондеацетилаза представляет собой HDAC2, HDAC6, HDAC1, HDAC3, HDAC4, HDAC5, HDAC7, HDAC8, HDAC9, HDAC10 или HDAC11.
Предпочтительно в применении фармацевтической композиции, содержащей соединение по настоящему изобретению, гистондеацетилаза представляет собой HDAC2 и/или HDAC6.
В применении фармацевтической композиции, содержащей соединение по настоящему изобретению, заболевание представляет собой псориаз, цирроз, диабет, опосредованное ангиогенезом заболевание, заболевания глаза, заболевание иммунной системы, сердечно-сосудистое заболевание, эпилепсию, нейродегенеративное заболевание, болезнь Альцгеймера, болезнь Гентингтона или болезнь Паркинсона.
В применении фармацевтической композиции, содержащей соединение по настоящему изобретению, заболевание представляет собой опухоль, включая солидные опухоли и жидкие опухоли.
В применении фармацевтической композиции, содержащей соединение по настоящему изобретению, опухоль, в частности, включает одну из следующих опухолей или любую их комбинацию: рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы и шеи, меланому кожи или внутриглазную меланому, рак матки, рак яичника, рак прямой кишки, рак анальной области, рак желудка, рак ободочной кишки, рак молочной железы, рак фаллопиевой трубы, рак эндометрия, рак шейки матки, рак влагалища, рак вульвы, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, саркому мягкой ткани, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, рак мочевого пузыря, рак почки или мочеточника, почечный рак, опухоли центральной нервной системы (ЦНС), опухоли спинного мозга, аденомы гипофиза, желудочно-кишечные стромальные опухоли, колоректальный рак, немелкоклеточный рак легкого, мелкоклеточный рак легкого, мастоцитоз, глиому, саркому и лимфому.
В настоящей заявке предложена фармацевтическая композиция для лечения заболеваний, вызванных аномальной активностью протеинкиназы и/или гистондеацетилазы, содержащая любое одно или комбинацию из указанных выше соединений по настоящему изобретению или их фармацевтически приемлемые соли, сольваты или пролекарства, либо рацематы или энантиомеры любого одного или комбинации из указанных выше соединений или их фармацевтически приемлемых солей, сольватов или пролекарств.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать один или более фармацевтически приемлемых носителей.
Лекарственная форма любой из фармацевтических композиций по настоящему изобретению является следующей:
(1) пероральная форма; (2) инъекционная форма; (3) форма ректального суппозитория; (4) форма для назальной ингаляции; (5) форма глазных капель и (6) форма кожного пластыря.
Ряд экспериментов подтверждает, что хинолил-содержащее соединение гидроксамовой кислоты по настоящему изобретению обладает следующими преимуществами: (1) скрининговые тесты ингибирования активности киназы и/или гистондеацетилазы показывают, что соединения по настоящему изобретению оказывают сильное ингибирующее действие на ряд протеинкиназ и их мутантов и гистондеацетилазу; (2) тесты по ингибированию опухоли на животных моделях показывают, что такое хинолил-содержащее соединение гидроксамовой кислоты значительно ингибирует рост опухолей без видимой токсичности; (3) соединения по настоящему изобретению могут быть использованы в комбинации с другими противоопухолевыми лекарственными средствами таким образом, чтобы оказывать синергетический или аддитивный эффект; (4) соединения по настоящему изобретению могут быть использованы совместно с другими видами терапии опухолей, например радиотерапией, интервенционной терапией. Таким образом, хинолил-содержащее соединение гидроксамовой кислоты по изобретению может быть использовано в качестве эффективного лекарственного средства для лечения заболеваний, вызванных аномальной активностью протеинкиназы и/или гистондеацетилазы.
В применении соединений по изобретению для лечения заболеваний, вызванных аномальной активностью протеинкиназы и/или гистондеацетилазы, почечный рак представляет собой рак надпочечника, почечно-клеточную карциному или карциному почечной лоханки; и глиома представляет собой нейроглиому ствола головного мозга, нейроэндокринную глиому и нейроспонгиобластому.
В применении соединений по изобретению для лечения заболеваний, вызванных аномальной активностью протеинкиназы и/или гистондеацетилазы, помимо опухолей заболевания могут представлять собой псориаз, цирроз, диабет, связанные с ангиогенезом заболевания, связанные с рестенозом заболевания, заболевания глаза, такие как AMD (возрастная макулярная дегенерация), ревматоидный артрит и другие воспалительные заболевания, заболевания иммунной системы, такие как аутоиммунное заболевание (например СПИД и тому подобное), сердечно-сосудистые заболевания, такие как атеросклероз, почечные заболевания, эпилепсию, нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона и тому подобное.
Фармацевтическая композиция, содержащая соединение по настоящему изобретению, может быть использована для лечения заболеваний, вызванных аномальной активностью протеинкиназ и/или гистондеацетилазы у млекопитающего, такого как человек.
Посредством способа изготовления соединение по изобретению (включая рацематы, энантиомеры и другие стереоизомеры) или его фармацевтически приемлемые соли, гидраты, сольваты или пролекарства совместно с подходящими фармацевтически приемлемыми носителями и обычно используемыми в медицине вспомогательными веществами может быть приготовлено в виде фармацевтической композиции, которая является благоприятной для введения.
Пути введения фармацевтической композиции, содержащей соединение по изобретению, могут представлять собой: (1) пероральное введение, например таблетки, капсулы и так далее; (2) инъекция, например внутривенная инъекция, подкожная инъекция, внутримышечная инъекция, глазная инъекция, внутрибрюшинная инъекция и так далее; (3) ректальная свеча, например суппозиторий, гели и тому подобное; (4) назальная ингаляция, например спреи, аэрозоли и так далее; (5) глазные капли; (6) кожный пластырь. Система доставки лекарственного средства, например липосома, или технология замедленного высвобождения также могут быть использованы там, где предпочтительно применять пероральное введение и инъекцию, в частности более предпочтительно пероральное введение.
Разные лекарственные формы фармацевтических композиций, содержащих соединение по настоящему изобретению, могут быть приготовлены обычными в медицинской промышленности способами, например, смешивания, растворения, гранулирования, измельчения, эмульгирования, инкапсулирования, нанесения сахарного покрытия, сублимационной сушки, лиофильной сушки и так далее.
Содержание соединения по настоящему изобретению в фармацевтической композиции находится в диапазоне 0,001-100%. Фармацевтическую композицию вводят млекопитающему, включая человека, в эффективной ежесуточной дозе от 0,1 до 500 мг на килограмм массы тела, предпочтительно от 1 до 100 мг на килограмм массы тела. В таком диапазоне эффективных доз соединение по изобретению проявляет свое фармацевтическое действие по ингибированию активности протеинкиназы и/или активности гистондеацетилазы и лечению заболеваний, ассоциированных с аномальной активностью протеинкиназы и/или активностью гистондеацетилазы (например, рака).
Частота введения соединения по изобретению варьирует в зависимости от используемого соединения или его фармацевтической композиции и заболеваний, которые нужно лечить. Фармацевтическую композицию обычно вводят 1-6 раз в сутки, и предпочтительная частота введения составляет 1-3 раза в сутки.
Упаковка и хранение фармацевтической композиции по настоящему изобретению сходны с упаковкой и хранением обычных западных лекарственных средств. Например, лекарственное средство в форме твердого препарата может быть непосредственно помещено во флакон из стекла, пластика, бумаги или металла; во флаконе предпочтительно содержится осушитель и тому подобное для поддержания качества лекарственного средства; обычно лекарственное средство в жидкой лекарственной форме помещают во флакон из стекла, пластика или металла или пробирку; а лекарственное средство в форме аэрозоля обычно помещают в устойчивый к повышенному давлению контейнер из пластика или металла, оснащенный клапаном, регулирующим давление.
Определения
Ниже представлены определения терминов, упомянутых в настоящем изобретении. Переменные группы, такие как Ra, Rb, m, применимы только к этому разделу (то есть к разделу "Определения").
В соответствии с общими знаниями специалиста в данной области большинство химических реакций необходимо проводить в растворителе. Обычно используемые растворители для получения соединения по настоящему изобретению включают воду, метанол, этанол, изопропанол, н-пропанол, н-бутанол, изобутанол, трет-бутанол, 2-метоксиэтанол, 2,2,2-трифторэтанол, дихлорметан, 1,2-дихлорэтан, хлороформ, ТГФ, диоксан, DME, этилацетат, диэтиловый эфир, метил-трет-бутиловый эфир, гексан, циклогексан, толуол, ацетонитрил, ДМФА (диметилформамид), ДМСО или смесь любых двух или более перечисленных выше растворителей или им подобных, но не ограничиваются ими.
В некоторых случаях химические взаимодействия необходимо проводить в присутствии кислоты или основания. Обычно используемые основания для получения соединения по настоящему изобретению включают Et3N, Μe3Ν, i-Pr2NEt, пиридин, DBU (1,8-диазабицикло[5.4.0]ундец-7-ен), DABCO (1,4-диазабицикло[2.2.2]октан), тетраметилгуанидин, NaOH, KOH, Cs2CO3, Na2CO3, K2CO3, NaHCO3, KF, CsF, K3PO3, K2HPO4, KH2PO4, NaH, н-BuLi, втор-BuLi, трет-BuLi, NaN(SiMe3)2, LiN(SiMe3)2, KN(SiMe3)2 или смесь любых двух или более перечисленных выше оснований, но не ограничиваются ими. Обычно используемые кислоты для получения соединения по настоящему изобретению включают HCO2H, АсОН, ТФУ (трифторуксусная кислота), HCl (соляная кислота), H2SO4, HNO3, Н3РО4, п-TsOH (пара-толуолсульфоновая кислота), PhSO3H, CSA (камфорсульфокислота), MsOH (метансульфоновая кислота) и им подобные или кислоту Льюиса, такую как ZnCl2, AlCl3, BF3·OEt2 и им подобные, но не ограничиваются ими.
В некоторых случаях химические реакции необходимо проводить в присутствии агента сочетания. Обычно используемые агенты сочетания для получения соединения по настоящему изобретению включают DCC (Ν,Ν′-дициклогексилкарбодиимид), EDC, HATU, TBTU (тетрафторборат О-бензотриазол-1-ил-Ν,Ν,Ν′,Ν′-тетраметилурония), РуВОР (гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония), HCTU (гексафторфосфат O-(1Н-6-хлорбензотриазол-1-ил)-Ν,Ν,Ν′,Ν′-тетраметилурония), ВОР (гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония), DIC N,N′-диизопропилкарбодиимид, HOBt (1-гидроксибензотриазол), HOAt (1-гидроксиазабензотриазол), CDI (1,1-карбонилдиимидазол), DEPBT (3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3Н)-он) и им подобные, но не ограничиваются ими.
На некоторых стадиях получения соединения по изобретению необходимы восстановительная реакция и восстановители; восстановители включают H2+Pd/C, H2+Pd(OH)2, Н2+PtO2, H2+Ni Ренея, H2NNH2+Ni Ренея, Mg+MeOH, Fe+AcOH, Fe+HCl, Zn+AcOH, Zn+HCl, Zn+NH4OAc, SnCl2, LiAlH4, NaBH4, NaBH3(CN), NaB(OAc)3H, ВН3 и им подобные, но не ограничиваются ими.
На некоторых стадиях получения соединения по изобретению необходимо снятие защиты. Когда защитная группа представляет собой Вое (трет-бутоксикарбонил), обычно используемые реагенты для снятия защиты включают HCl, ТФУ, H2SO4 и им подобные, но не ограничиваются ими. Когда защитная группа представляет собой CBZ (бензилоксикарбонил), обычно используемые реагенты для снятия защиты включают Н2+Pd/C, Н2+Pd(ОН)2, Н2+Pd/C+HCl и им подобные, но не ограничиваются ими.
Реакцию получения соединения по настоящему изобретению обычно проводят при комнатной температуре, однако иногда температуру необходимо понизить до -78°С или повысить до 200°С. Как правило, реакцию проводят в условиях указанных выше растворителей и температур обычно при перемешивании, однако иногда ее необходимо проводить в микроволновой печи. Когда основания, реагенты или катализаторы являются чувствительными к воде или кислороду, реакцию необходимо проводить в безводных и бескислородных условиях. В таком случае не может быть использован протонный растворитель.
Термин "фармацевтически приемлемые соли" относится к солям, образованным посредством химического взаимодействия соединения по настоящему изобретению с неорганической кислотой, органической кислотой, неорганическим основанием или органическим основанием; причем такие соли сохраняют биологическую активность и эффективность соединения по настоящему изобретению. Неорганическая кислота или органическая кислота может представлять собой соляную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, угольную кислоту, фосфорную кислоту, хлорную кислоту, уксусную кислоту, лимонную кислоту, щавелевую кислоту, молочную кислоту, яблочную кислоту, салициловую кислоту, винную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, замещенную бензолсульфоновую кислоту (например, пара-толуолсульфоновую кислоту), изоникотиновую кислоту, олеиновую кислоту, дубильную кислоту, пантотеновую кислоту, аскорбиновую кислоту, янтарную кислоту, малеиновую кислоту, гентизиновую кислоту, фумаровую кислоту, глюконовую кислоту, уроновую кислоту, глюкаровую кислоту или сахарную кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, памовую кислоту, сорбиновую кислоту и им подобные; неорганическое основание или органическое основание может представлять собой гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид железа, гидроксид кальция, гидроксид бария, гидроксид магния, гидроксид цинка, аммиак, гидроксид органического четвертичного аммония, карбонат натрия, карбонат калия, карбонат лития, карбонат кальция, карбонат бария, карбонат магния, карбонатные четвертичные органические аммониевые соли, гидрокарбонат натрия, гидрокарбонат калия, гидрокарбонат лития, гидрокарбонат кальция, гидрокарбонат бария, гидрокарбонат магния, гидрокарбонатную четвертичную органическую аммониевую соль.
Термин "сольваты", как он использован здесь, означает стабильные вещества, образованные соединением по настоящему изобретению и обычно используемыми в химических реакциях растворителями посредством ковалентной связи, водородной связи, ионной связи, ван-дер-ваальсовых сил, комплексообразования, включения и так далее. Растворители могут представлять собой метанол, этанол, пропанол, бутанол, этиленгликоль, пропиленгликоль, полиэтиленгликоль, ацетон, ацетонитрил, диэтиловый эфир, метил-трет-бутиловый эфир и так далее.
Термин "гидрат" означает сольват, в котором растворитель представляет собой воду.
Термин "пролекарство" означает соединение по настоящему изобретению, превращаемое в другое соединение, которое может быть преобразовано в соединение по настоящему изобретению in vivo после его введения млекопитающему с помощью химического синтеза или физическими методами. Обычно методику "пролекарства" используют, чтобы преодолеть неблагоприятное или неподходящее физико-химическое свойство или способность проявлять лекарственные свойства самого лекарственного соединения.
Термин "рацематы, энантиомеры и другие стереоизомеры" означает соединения, имеющие такую же молекулярную формулу и молекулярную массу, но отличающиеся вследствие различных типов связывания между атомами и различных пространственных расположений, и поэтому такие соединения называют изомерами или стереоизомерами. Когда эти стереоизомеры являются зеркальным отражением друг друга, то есть выглядят сходно, но не могут быть полностью наложены друг на друга, как левая рука и правая рука, эти соединения называют энантиомерами. Абсолютные конфигурации энантиомеров обычно выражают как (R)- и (S)- или R- и S-. Подробно правила для определения абсолютных конфигураций описаны в главе 4 "Advanced Organic Chemistry", издание 4-е (J. March, John Wiley и Sons, New York, 1992). (R)- и (S)-энантиомеры вращают плоскость поляризованного света в противоположные стороны, то есть вращение влево и вращение вправо. Когда (R)- и (S)-энантиомеры смешаны или находятся в соотношении 1:1, смесь не обладает вращающим действием на поляризованный свет, и такую смесь называют рацематом.
Соединение по настоящему изобретению может быть представлено в виде таутомеров, ротамеров, цис-транс-изомеров и так далее. Эти понятия можно найти и изучить в "Advanced Organic Chemistry", издание 4-е, J. March. Поскольку эти изомеры обладают такой же/аналогичной функцией ингибирования активности протеинкиназы, что и соединения по настоящему изобретению, они также охватываются настоящим изобретением.
После введения соединений по настоящему изобретению млекопитающему (такому как человек), они, вероятно, метаболизируются in vivo в различные метаболиты при помощи различных ферментов, в соответствии с общими знаниями в данной области техники. Поскольку эти метаболиты обладают функцией ингибирования активности протеинкиназы, сходной с функцией соединений по настоящему изобретению, они также охватываются настоящим изобретением.
Термин "фармацевтическая композиция" означает смесь одного или более соединений по настоящему изобретению, его фармацевтически приемлемых солей, сольватов, гидратов или пролекарств и других химических ингредиентов (таких как фармацевтически приемлемый носитель). Фармацевтическую композицию используют для облегчения процесса введения соединений по настоящему изобретению животным. Помимо фармацевтически приемлемого носителя фармацевтические композиции могут дополнительно содержать обычно используемые фармацевтические вспомогательные вещества, например антибактериальный агент, противогрибковый агент, антимикробный агент, консервант, тонирующее вещество, солюбилизатор, загуститель, поверхностно-активное вещество, комплексообразующий агент, белок, аминокислоту, жир, углевод, витамин, минеральное вещество, микроэлемент, подсластитель, краситель, ароматизатор или их комбинации.
Термин "фармацевтически приемлемый носитель" относится к неактивному ингредиенту в фармацевтической композиции, который может представлять собой: карбонат кальция, фосфат кальция, различные сахара (такие как лактоза, маннит и так далее), крахмал, циклодекстрин, стеарат магния, целлюлозу, карбонат магния, полиакрилат, полиметилакрилат, желатин, воду, полиэтиленгликоль, пропиленгликоль, этиленгликоль, касторовое масло, гидрогенизированное касторовое масло, полиэтоксилированное гидрогенизированное касторовое масло, кунжутное масло, кукурузное масло, арахисовое масло и так далее.
Термин "алкил" означает линейную или разветвленную насыщенную углеводородную группу, имеющую определенное число атомов углерода. Например, С1-12алкил означает линейную или разветвленную группу, имеющую 1-12 атомов углерода. С0алкил означает одинарную ковалентную связь. Алкильные группы по настоящему изобретению включают метил, этил, пропил, бутил, изопропил, неопентил, 2-метил-1-гексил и так далее, но не ограничиваются ими. Алкил по настоящему изобретению иногда также относится к алкилену, то есть группе, образованной из алкила в результате потери одного атома водорода. Один или все атомы водорода алкила или алкилена могут быть замещены следующими группами: циклоалкил, арил, гетероарил, гетероалициклил, галоген, амино, гидроксил, циано, нитро, карбоксил, меркапто, оксо, алкокси, арилокси, алкилмеркапто, арилмеркапто, карбонил, тиокарбонил, С-амидо, N-амидо, О-аминокарбонилокси, N-аминокарбонилокси, О-аминотиокарбонилокси, N-аминотиокарбонилокси, С-сложный эфир, О-сложный эфир и -NRaRb, где Ra и Rb независимо выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила и трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероалициклильное кольцо.
Термин "циклоалкил" или "циклоалкан" означает моноциклическую, бициклическую или полициклическую углеводородную группу, имеющую определенное число атомов углерода. В случае бициклической или полициклической группы они могут быть соединены вместе до конденсированной (два смежных атома углерода являются общими для двух или более колец) или спирогруппы (один атом углерода является общим для двух или более колец). Например, С1-12циклоалкил означает моноциклическую, бициклическую или полициклическую углеводородную группу, содержащую 1-12 атомов углерода. С0циклоалкил означает одинарную ковалентную связь. Циклоалкил может содержать ненасыщенную двойную или тройную связь, но не имеет полностью сопряженной пи-электронной системы (π-электронной системы). Циклоалкил по настоящему изобретению иногда относится к циклоалкилену, то есть группе, образованной из циклоалкила в результате потери одного атома водорода. Циклоалкильные группы по настоящему изобретению включают: циклопропил, циклобутил, циклогексил, циклопентенил, циклогептатриенил, адамантил и так далее, но не ограничиваются ими (примеры показаны в Таблице 1):
Один или все атомы водорода циклоалкила или циклоалкана могут быть замещены следующими группами: алкил, арил, гетероарил, гетероалициклил, галоген, амино, гидроксил, циано, нитро, карбоксил, меркапто, оксо, алкокси, арилокси, алкилмеркапто, арилмеркапто, карбонил, тиокарбонил, С-амидо, 14-амидо, О-аминокарбонилокси, N-аминокарбонилокси, О-аминотиокарбонилокси, N-аминотиокарбонилокси, С-сложный эфир, О-сложный эфир и -NRaRb, где Ra и Rb независимо выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероалициклильное кольцо.
Термин "галоген" означает фтор, хлор, бром или йод.
Термин "алкокси" означает, что алкильная группа, имеющая определенное число атомов углерода, присоединена к другой группе через атом кислорода. Алкоксигруппы по настоящему изобретению включают метокси, этокси, пропокси, бутокси, циклопентилокси, циклогексилокси, изопропокси, неопентокси, 2-метил-1-гексилокси, но не ограничиваются ими.
Термин "циклоалкокси" означает, что циклоалкильная группа, имеющая определенное число атомов углерода, присоединена к другой группе через атом кислорода. Циклоалкилоксигруппы по настоящему изобретению включают циклопропокси, циклопентокси, циклогексилокси, но не ограничиваются ими.
Термин "арил" означает моноциклическую, бициклическую или полициклическую группу, состоящую из 6-12 атомов углерода, где по меньшей мере одно кольцо имеет полностью сопряженную π-электронную систему и отвечает правилу n+2, то есть эта группа обладает ароматичностью, но вся группа не обязательно должна быть полностью сопряженной. Арильная группа может находиться в форме ариленовой группы, то есть в структуре арила присутствуют два или более чем два сайта связывания с другими группами. Арильные группы по настоящему изобретению включают фенил, нафтил, инденил, инданил, тетрагидронафталин и так далее, но не ограничиваются ими. Один или все атомы водорода арильной группы могут быть замещены следующими группами: алкил, циклоалкил, гетероарил, гетероалицикил, галоген, амино, гидроксил, циано, нитро, карбоксил, меркапто, оксо, алкокси, арилокси, алкилмеркапто, арилмеркапто, карбонил, тиокарбонил, С-амидо, N-амидо, О-аминокарбонилокси, N-аминокарбонилокси, О-аминотиокарбонилокси, N-аминотиокарбонилокси, С-сложный эфир, О-сложный эфир и -NRaRb, где Ra и Rb независимо выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила и так далее, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероалициклильное кольцо.
Термин "гетероарил" означает моноциклическую, бициклическую или полициклическую группу, состоящую из 5-12 кольцевых атомов, отличных от атомов водорода, где по меньшей мере один атом представляет собой О, N или S(=O)m (где m равен 0-2) и где по меньшей мере одно кольцо имеет полностью сопряженную π-электронную систему и отвечает правилу n+2, то есть группа обладает ароматичностью; но вся группа не обязательно должна быть полностью сопряженной. Например, С5гетероарил означает ароматическую кольцевую группу, состоящую из 5 кольцевых атомов, где по меньшей мере один кольцевой атом выбран из О, N или S(=O)m (где m равен 0-2). Гетероарильная группа может также находиться в форме гетероарилена, то есть в структуре гетероарила присутствуют два или более чем два сайта связывания с другими группами. Гетероарильные группы по настоящему изобретению включают пиридинил, пиридонил, тетрагидропиридонил, пиримидинил, пиразинил, пиридазинил, имидазолил, тиазолил, тиофенил, фуранил, индолил, азаиндолил, бензимидазолил, индолинил, индолинонил, хинолинил и так далее, но не ограничиваются ими (примеры показаны в Таблице 2):
Один или все атомы водорода гетероарила могут быть замещены следующими группами: алкил, циклоалкил, арил, гетероалицикил, галоген, амино, гидроксил, циано, нитро, карбоксил, меркапто, оксо, алкокси, арилокси, алкилмеркапто, арилмеркапто, карбонил, тиокарбонил, С-амидо, N-амидо, О-аминокарбонилокси, N-аминокарбонилокси, О-аминотиокарбонилокси, 14-аминотиокарбонилокси, С-сложный эфир, О-сложный эфир и -NRaRb, где Ra и Rb независимо выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила и так далее, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероалициклильное кольцо.
Термин "гетероалициклил" или "гетероалицикл" означает моноциклическую, бициклическую или полициклическую группу или алкан, состоящие из 3-12 кольцевых атомов, отличных от атомов водорода, где по меньшей мере один атом представляет собой О, N или S(=O)m (где m равен 0-2). Например, С6гетероалициклил означает моноциклическую группу, состоящую из 6 кольцевых атомов, где по меньшей мере один кольцевой атом выбран из О, N или S(=O)m (где m равен 0-2). Помимо простых связей такое кольцо может дополнительно содержать двойные или тройные связи, но эти двойные или тройные связи не образуют полностью конъюгированную ароматическую структуру. Такие моноциклические, бициклические или полициклические гетероалициклилы могут находиться в форме конденсированного кольца, мостикового кольца или спирокольца. Гетероалициклильная группа по настоящему изобретению иногда относится к гетероалициклилену, то есть группе, образованной из гетероалициклильной группы после потери атома водорода. Гетероалициклильные группы или гетероалициклилы по настоящему изобретению включают пиперидинил, морфолинил, пиперазинил, пирролидинил, индолинил, тетрагидропиридинил, тетрагидрофуранил, тропиновый спирт, но не ограничиваются ими (примеры показаны в Таблице 3):
Один или все атомы водорода гетероалициклила или гетероалицикла могут быть замещены следующими группами: алкил, циклоалкил, арил, гетероарил, гетероалицикил, галоген, амино, гидроксил, циано, нитро, карбоксил, меркапто, оксо, алкокси, арилокси, алкилмеркапто, арилмеркапто, карбонил, тиокарбонил, С-амидо, 14-амидо, О-аминокарбонилокси, 14-аминокарбонилокси, О-аминотиокарбонилокси, N-аминотиокарбонилокси, С-сложный эфир, О-сложный эфир и -NRaRb, где Ra и Rb независимо выбраны из водорода, алкила, циклоалкила, арила, ацетила, карбонила, сульфонила, трифторметилсульфонила и так далее, и Ra и Rb вместе с атомом азота, к которому они присоединены, могут образовывать 5- или 6-членное гетероалициклильное кольцо.
Термин "арилокси" относится к арильной группе, присоединенной к другой группе через атом кислорода. Арилоксигруппы по настоящему изобретению включают фенокси, нафтокси, но не ограничиваются ими.
Термин "гетероарилокси" относится к гетероарильной группе, присоединенной к другой группе через атом кислорода. Гетероарилоксигруппы по настоящему изобретению включают 4-пиридилокси, 2-тиенилокси и так далее, но не ограничиваются ими.
Термин "амино" означает H2N- или H2N-, в котором атомы водорода могут быть замещены, то есть RaHN- и RaRbN-.
Термин "оксо" означает =O, то есть атому кислорода, присоединенному к атому углерода или гетероатому, выбранному из группы, включающей N, S или Р, посредством двойной связи. Примеры групп, замещенных оксо, включают примеры, показанные в Таблице 4, но не ограничиваются ими:
"гидрокси" относится к -ОН; "нитро" относится к -NO2;
"карбокси" относится к -СО2Н; "меркапто" относится к -SH;
"алкилмеркапто" означает алкил-S-; "арилмеркапто" означает арил-S-;
"карбонил" относится к -С(=O)-; "тиокарбонил" относится к -С(=S)-;
"С-амидо" относится к -С(=O)NRaRb; "N-амидо" относится к С(=O)NRa-;
"О-аминокарбонилокси" относится к -O-С(=O)NRaRb;
"N-аминокарбонилокси" относится к O-С(=O)NRa-;
"О-аминотиокарбонилокси" относится к -O-С(=S)NRaRb;
"N-аминотиокарбонилокси" относится к O-С(=S)NRa-;
"С-сложный эфир" означает -С(=O)ORa;
"N-сложный эфир" означает С(=O)O-;
"ацетил" относится к СН3С(=O)-;
"сульфонил" относится к -SO2Ra;
"трифторметилсульфонил" относится к CF3SO2-.
Краткое описание графических материалов
На Фиг. 1 показана молекулярная структура соединения по настоящему изобретению.
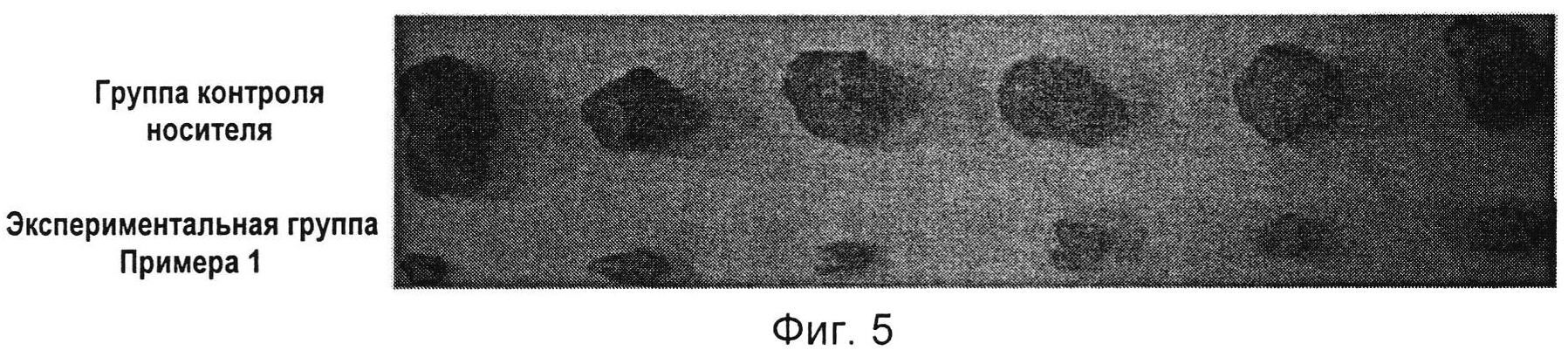
На Фиг. 2 показано сравнение изображений опухолей в мышином противоопухолевом эксперименте с соединением по настоящему изобретению по Примеру 1.
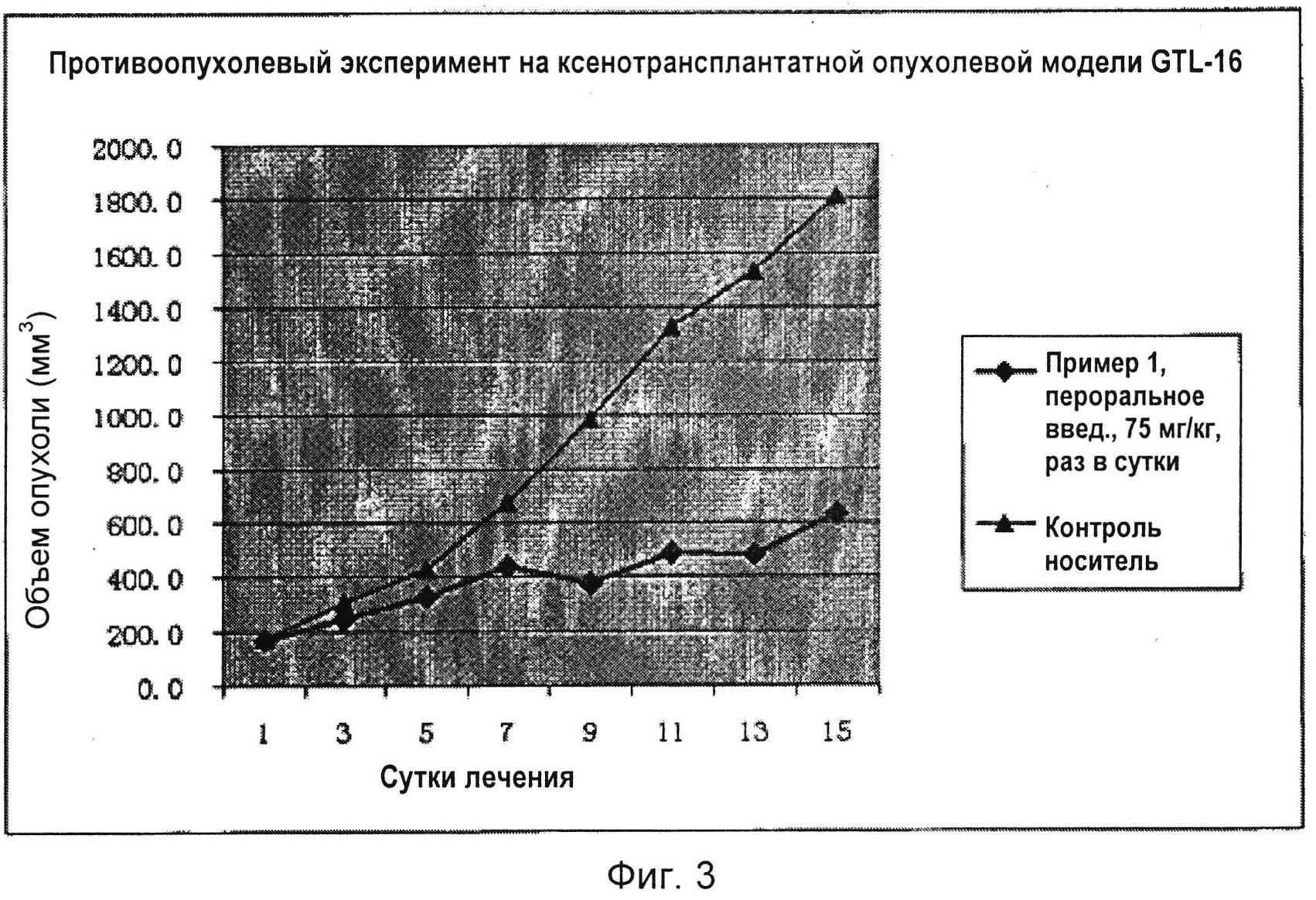
На Фиг. 3 показано сравнение кривых объемов опухолей в мышином противоопухолевом эксперименте с соединением по настоящему изобретению по Примеру 1.
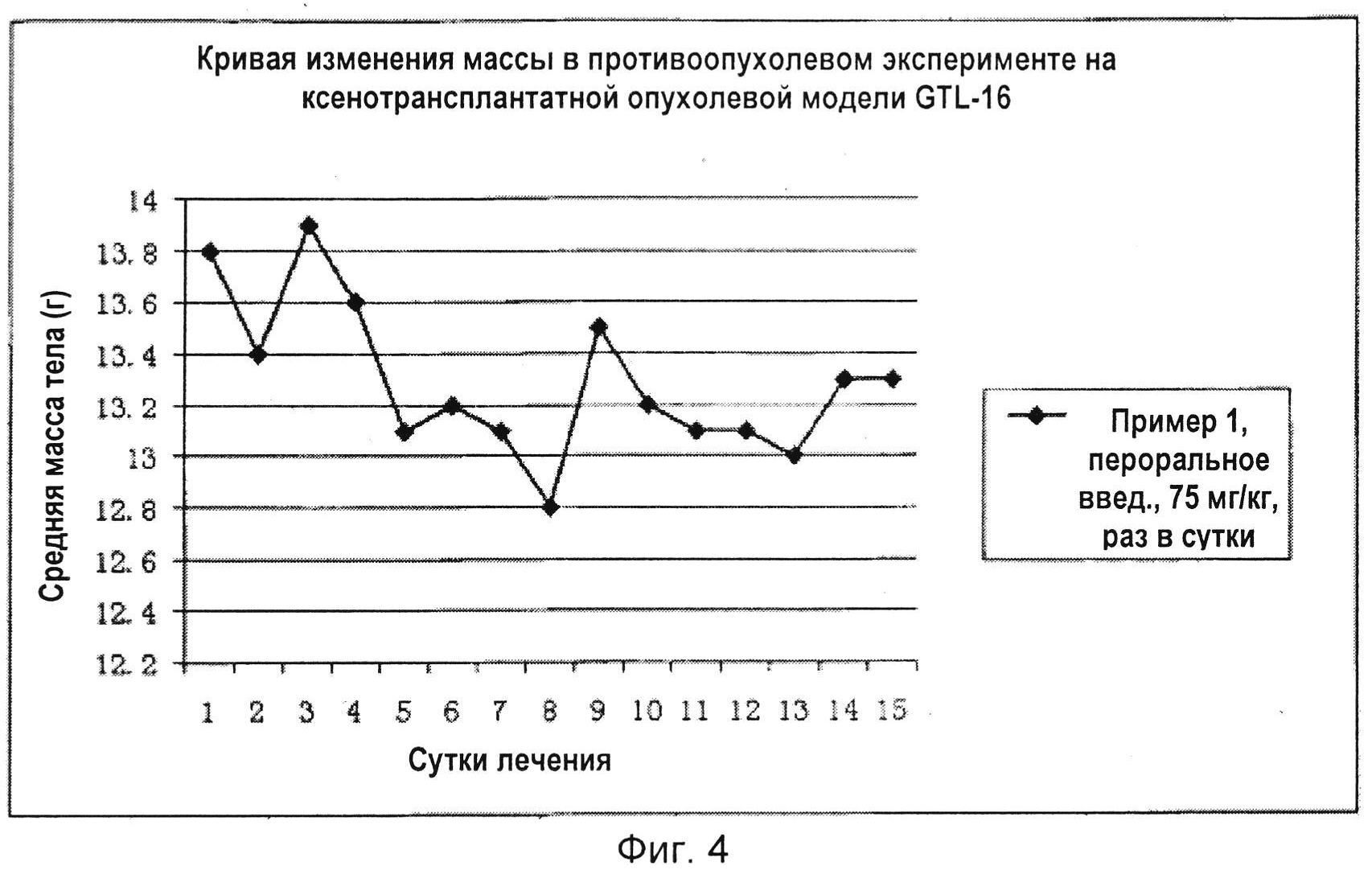
На Фиг. 4 показано сравнение масс тела мышей в мышином противоопухолевом эксперименте, которых лечили носителем или соединением по настоящему изобретению по Примеру 1.
На Фиг. 5 показано сравнение изображений опухолей в мышином противоопухолевом эксперименте с соединением по настоящему изобретению по Примеру 9.
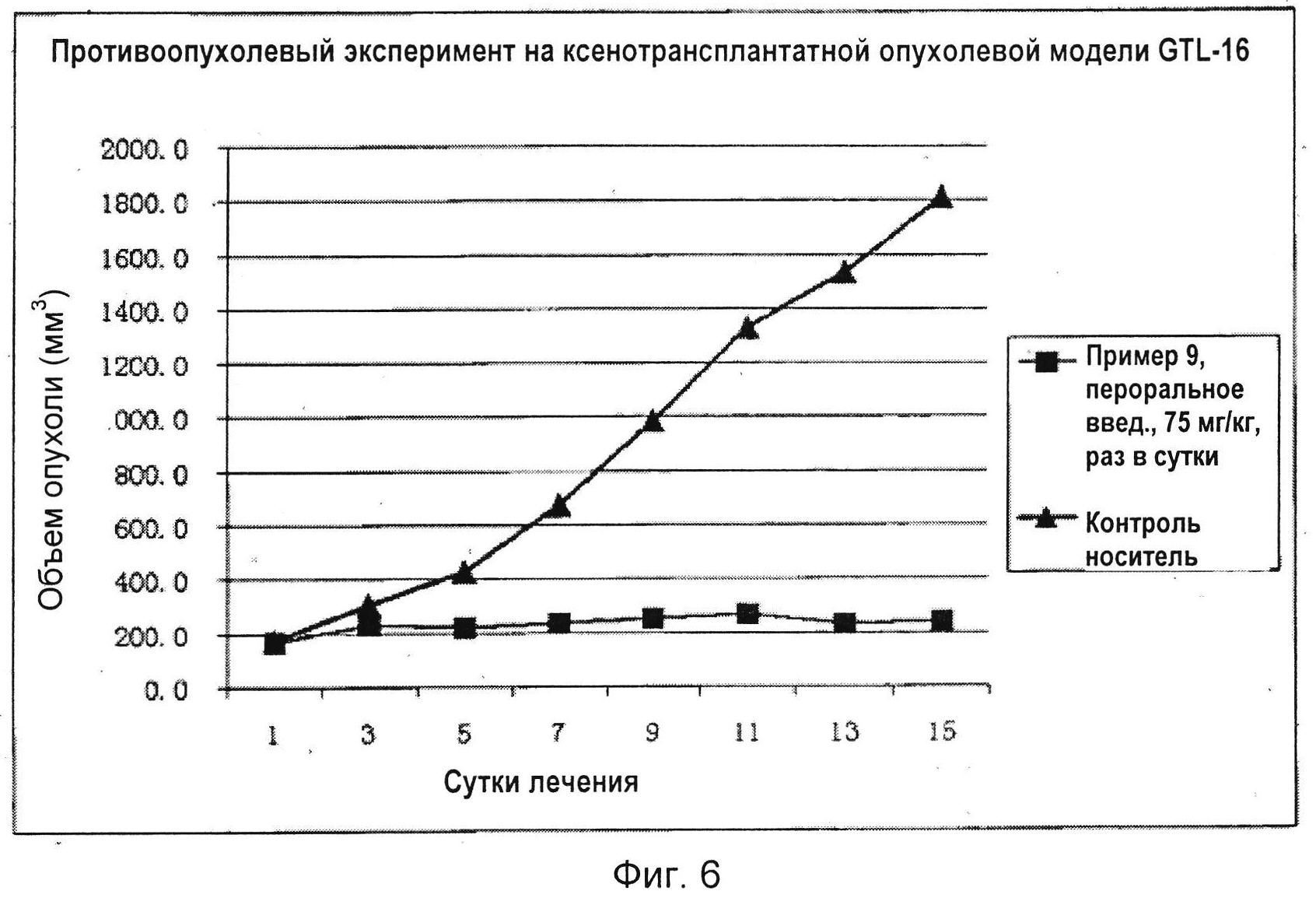
На Фиг. 6 показано сравнение кривых объемов опухолей в мышином противоопухолевом эксперименте с соединением по настоящему изобретению по Примеру 9.
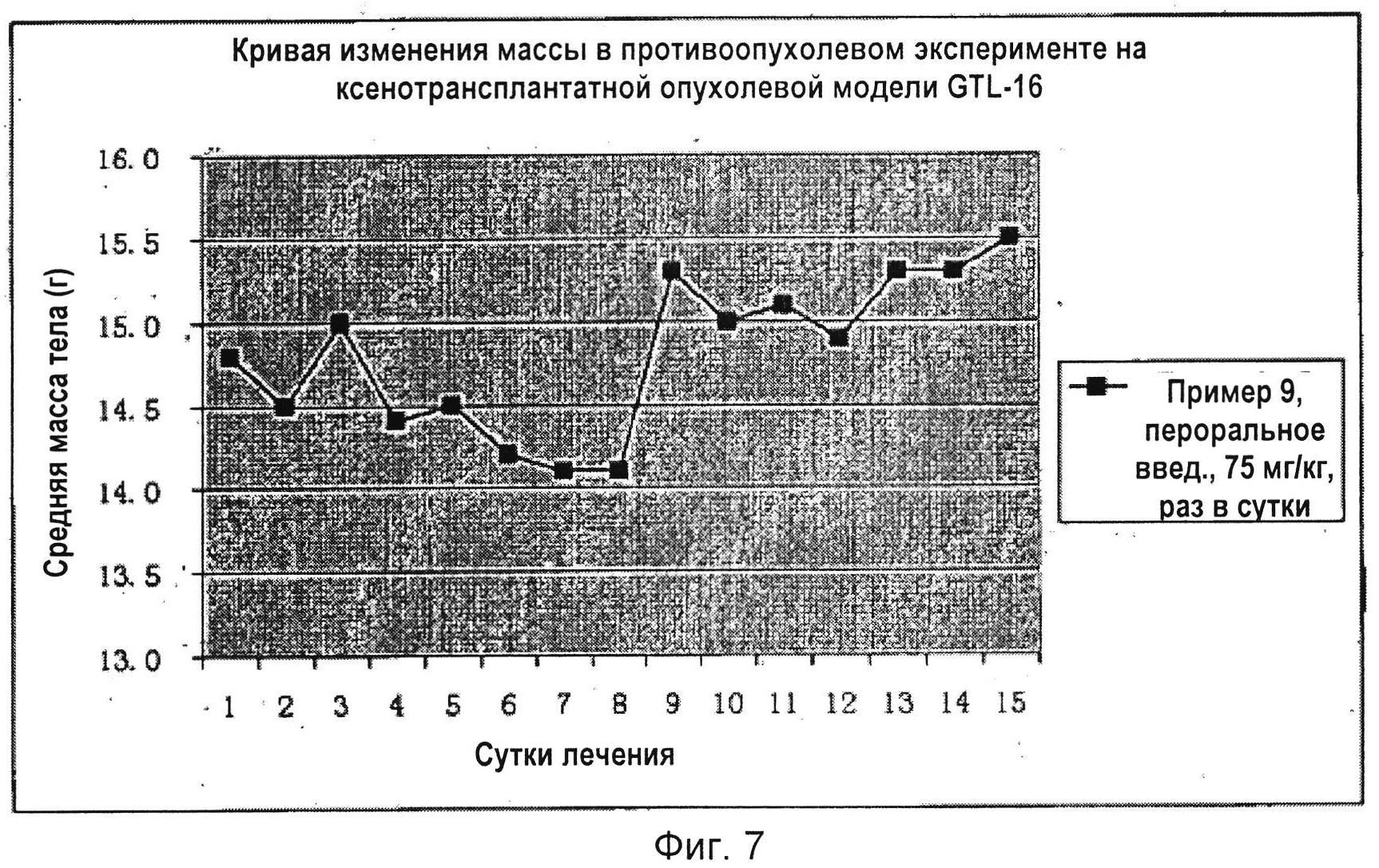
На Фиг. 7 показано сравнение изображений опухолей в мышином противоопухолевом эксперименте с соединением по настоящему изобретению по Примеру 9.
ПРИМЕРЫ
Настоящее изобретение далее описано более подробно вместе со следующими примерами, так что широкому кругу лиц будет понятно соединение по настоящему изобретению и его полезный эффект. Но примеры не следует толковать, как ограничивающие объем настоящей заявки.
Далее представлены сокращения, использованные в примерах, и их соответствующие значения. Если какое-либо сокращение, не перечисленное здесь, появляется в примерах, оно имеет общепринятое значение.
HCl: хлороводород или соляная кислота;
водн.: водный раствор
ТСХ: тонкослойная хроматография
ЖХ-МС: жидкостная хроматография/масс-спектрометрия
нМ: наномоль
[М+Н]: пик молекулярного иона в масс-спектре;
DIPEA: диизопропилэтиламин
HATU: гексафторфосфат 2-(7-азабензотриазол)-N,N,N′,N′-тетраметилурония
Общие условия эксперимента:
Водородные и углеродные спектры ядерного магнитного резонанса (1Н ЯМR и13С ЯМR) получают при использовании оборудования Varian INOVA 500NB, Varian 400 МГц или Bruker 400 МГц (растворителем является дейтеро-ДМСО, дейтерохлороформ или дейтерометанол и так далее, а внутренним стандартом является ТМС). Масс-спектры получают при использовании жидкостной хроматографии/масс-спектрометрии (источник ионизации ESI (электрораспылительная ионизация) или APCI (химическая ионизация при атмосферном давлении) ZQ4000, Waters, США). Ультрафиолетовый спектр (УФ) измеряют с помощью ультрафиолетового спектрофотометра Hitachi UV-3010. Инфракрасный спектр (ИК) измеряют с помощью инфракрасного спектрометра NICOLET6700 (диски KBr). Высокоэффективную жидкостную хроматографию проводят на приборе Waters 2695 ZORBAX HPLC (колонка Вх-C8, 5 мкм, 150×4,6 мм). Точку плавления измеряют с помощью прибора для определения точки плавления Electrothermal IA9100 без коррекции.
Исходные вещества, реагенты и растворители приобретали в: Beta-Pharma, Шанхай; Shanghai PI Chemicals; AndaChem, Тайюань; Shanghai FWD Chemicals; Sigma-Aldrich, Милуоки, Висконсин (WI), США; Acros, Моррис Плейнс, Нью-Джерси (NJ), США; Frontier Scientific, Логан, Юта, США; Alfa Aesar, Уорд Хилл, Массачусетс (MA), США и так далее, или синтезировали способами, описанными в литературе. Если не указано иное, обычно растворитель от поставщика использовали непосредственно без осушения или осушали с помощью молекулярных сит.
Способы получения различных промежуточных соединений, включая промежуточное соединение А, промежуточное соединение В, промежуточное соединение С, промежуточное соединение D, промежуточное соединение F, промежуточное соединение G, промежуточное соединение Н, промежуточное соединение I, промежуточное соединение J, промежуточное соединение K, необходимых для получения соединения по изобретению, являются следующими.
Способ получения промежуточного соединения А:
4-(2-фтор-4-нитрофенокси)-6-метоксихинолил-7-ол:
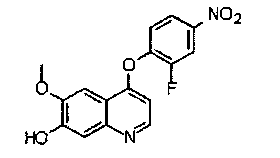
Промежуточное соединение А получали согласно способу, описанному в WO 2008/035209. Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=11.74 (s, br, 1Н), 8.76 (d, J=6,8 Гц, 1Н), 8.47 (dd, J=2,8 Гц, J=10,4 Гц, 1Н), 8.23 (dd, J=1,2 Гц, J=8,8 Гц, 1Н), 7.81 (m, 1Н), 7.65 (s, 1Н), 7.49 (s, 1Н), 7.04 (d, J=6,4 Гц, 1Н), 3.94 (s, 3Н).
Способ получения промежуточного соединения В:
4-(2-фтор-4-нитрофенокси)-7-метоксихинолил-6-ол:
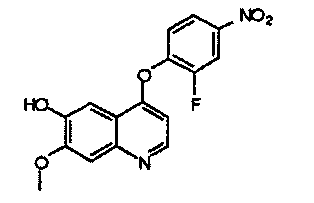
Промежуточное соединение В получали согласно способам, описанным в WO 2003/033472 и WO 2004/039782, и аналитические данные полученного продукта являются следующими: масс-спектр m/z: 331,12 [М+Н].
Способ получения промежуточного соединения С:
трет-бутил-4-[[4-(4-амино-2-фторфенилокси)-6-метокси-7-хинолил]-оксиметил]пиперидин-1-карбоксилат:
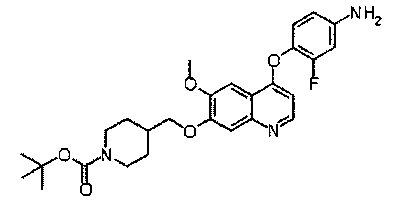
Промежуточное соединение С получали согласно способам, описанным в WO 2008/076415. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 498,21 [М+Н].
Способ получения промежуточного соединения D:
1-[(4-фторфенил)аминокарбонил]циклопропанкарбоновая кислота:
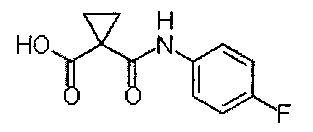
Промежуточное соединение О получали согласно способам, описанным в WO 2005/030140. Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=13.0 (s, 1Н), 10.6 (s, 1Н), 7.62-7.57 (m, 2Н), 7.15-7.09 (m, 2Н), 1.39 (s, 4Н).
Способ получения промежуточного соединения Е:
гидробромид 4-(4-амино-2-фторфенилокси)-6-метокси-7-гидроксихинолина:
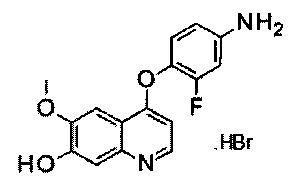
К раствору соли гидробромида 4-(2-фтор-4-нитрофенокси)-6-метокси-7-гидроксихинолина (Промежуточное соединение А) (40 г, 97 ммоль) в метаноле (1000 мл) добавляли никель Ренея (40 г). Полученную смесь перемешивали при 20°С под давлением водорода 30 фунт/кв.дюйм (206,8 кПа) в течение 19 часов. Катализатор удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением целевого продукта гидробромида 4-(4-амино-2-фторфенилокси)-6-метокси-7-гидроксихинолина (34,4 г, выход: 93,3%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 300,9 [М+Н].
Способ получения промежуточного соединения F:
гидробромид 4-(4-амино-2-фторфенилокси)-7-метокси-6-гидроксихинолина:
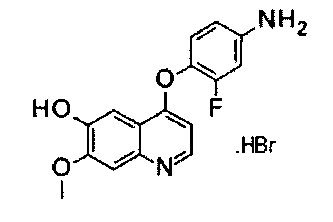
Начиная с Промежуточного соединения В, Промежуточное соединение Р получали согласно такому же способу, как для Промежуточного соединения Е. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 301,0 [М+Н].
Способ получения промежуточного соединения G:
N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид:
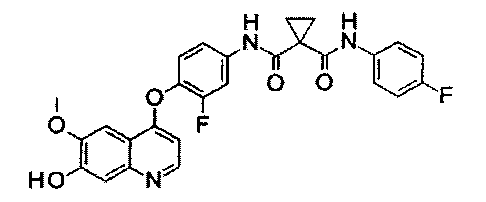
Смесь гидробромида 4-(4-амино-2-фторфенилокси)-6-метокси-7-гидроксихинолина (Промежуточное соединение Е, 30 г, 79 ммоль), 1-[(4-фторфенил)аминокарбонил]циклопропанкарбоновой кислоты (Промежуточное соединение D, 40 г, 180 ммоль), DIPEA (48,8 г, 400 ммоль), HATU (115 г, 300 ммоль) и ОМАР (12,9 г, 100 ммоль) в 300 мл ЭМР перемешивали при 30-40°С в течение ночи и эту реакционную смесь затем вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 200 мл каждый раз). Органические фазы объединяли, сушили над сульфатом натрия и концентрировали до приблизительно 150 мл, затем промывали 15%-ным водным раствором гидроксида натрия и водой 3 раза (по 100 мл каждый раз), сушили над сульфатом натрия и концентрировали с получением неочищенного продукта. Этот продукт очищали путем колоночной хроматографии на силикагеле (элюировали раствором 1%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (22 г, выход: 55%). Аналитические данные полученного продукта:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.11 (s, 1Н), 10.01 (s, 1Н), 8.48 (d, J=5,6 Гц, 1Н), 7.92 (dd, J=2,0, 13,2 Гц, 1Н), 7.66-7.61 (m, 2Н), 7.56-7.52 (m, 2Н), 7.41 (t, J=8,8 Гц, 1Н), 7.33 (s, 1Н), 7.18-7.12 (m, 2Н), 6.45 (d, J=5,6 Гц, 1Н), 3.97 (s, 3Н), 1.46 (d, J=10,4 Гц, 4Н). Масс-спектр m/z: 506,2 [М+Н].
Способ получения промежуточного соединения Н:
N1′-[3-фтор-4-[(6-гидрокси-7-метокси-4-хинолил)окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид:
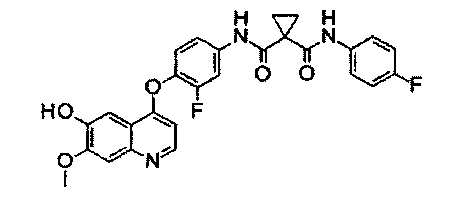
Начиная с Промежуточного соединения F и D, Промежуточное соединение Н получали согласно такому же способу, как для Промежуточного соединения G. Аналитические данные полученного продукта являются следующими: масс-спектр m/Z: 506,1 [М+Н].
Способ получения промежуточного соединения I:
дигидрохлорид N1-[3-фтор-4-[[6-метокси-7-(4-пиперидил метокси)-4-хинолил]окси]фенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
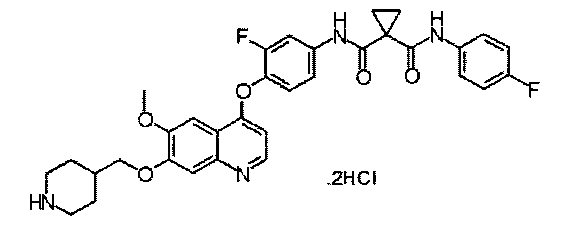
Стадия I: Получение трет-бутил-4-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-оксиметил]пиперидин-1-карбоксилата: смесь Промежуточного соединения С (1,5 г, 3,0 ммоль), Промежуточного соединения D (1,7 г, 7,6 ммоль), DIPEA (1,55 г, 12,0 ммоль), HATU (2,3 г, 6,0 ммоль), DMAP (0,183 г, 1,5 ммоль) в 60 мл DMF перемешивали при 30-40°С в течение ночи, затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (элюировали 1-5% МеОН в DCM) с получением целевого продукта (1,9 г, выход: 90%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 703,30 [М+Н].
Стадия II: Получение дигидрохлорида N1-[3-фтор-4-[[6-метокси-7-(4-пиперидилметокси)-4-хинолил]окси]фенил]-N1′-(4-фторфенил)циклопропан-1,1-дикарбоксамида: к раствору трет-бутил-4-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-оксиметил]пиперидин-1-карбоксилата (1,6 г, 2,3 ммоль), полученного на стадии I, в EtOAc (40 мл) добавляли насыщенный раствор HCl в EtOAc (40 мл) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Осадок собирали фильтрованием и промывали EtOAc с получением целевого соединения (1,0 г, выход: 69%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 603,10 [М+Н].
Способ получения промежуточного соединения J:
дигидрохлорид N1′-[3-фтор-4-[[7-метокси-6-(4-пиперидилметокси)-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
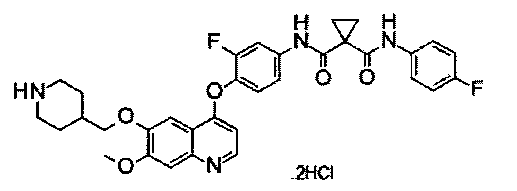
Промежуточное соединение и получали согласно такому же способу, как для Промежуточного соединения I. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 603,24 [М+Н].
Способ получения промежуточного соединения К:
дигидрохлорид N1′-[4-[[7-(3-аминопропокси)-6-метокси-4-хинолил]окси]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
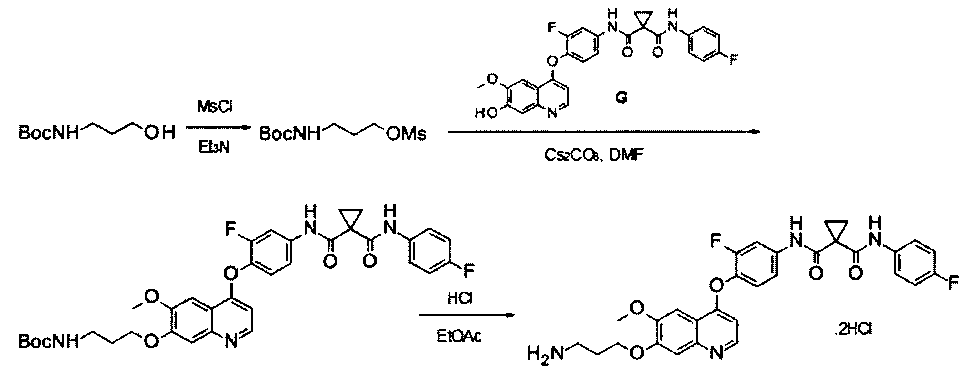
Стадия I: Получение 3-(трет-бутилоксикарбониламино)пропил-метансульфоната: к раствору 3-(Вос-амино)-пропанола (10 г, 57,5 ммоль) в дихлорметане (100 мл) добавляли триэтиламин (11,6 г, 115 ммоль) при 0°С, затем по каплям добавляли метансульфонилхлорид (7,9 г, 69 ммоль). Полученную смесь перемешивали в течение 1 часа при 0°С, вливали в воду и затем экстрагировали дихлорметаном 3 раза (по 100 мл каждый раз). Органические фазы объединяли, сушили и концентрировали с получением продукта 3-(трет-бутилоксикарбониламино)пропилметансульфоната (13,1 г, выход: 94%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, CDCl3): δ=4.76 (s, 1Н), 4.26 (t, J=6,4 Гц, 2Н), 3.22-3.24 (m, 2Н), 3.00 (s, 3Н), 1.89-1.92 (m, 2Н), 1.41 (s, 9H).
Примечание: продукт не очень стабильный, поэтому его следует использовать по возможности сразу же после получения.
Стадия II: Получение трет-бутил-N1-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]пропил]карбамата: к раствору 3-(трет-бутилоксикарбониламино)пропил-метансульфоната (15 г, 59,4 ммоль) и N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение G, 6 г, 11,88 ммоль) в 80 мл DMF добавляли карбонат цезия (11,6 г, 35,6 ммоль). Полученную смесь перемешивали в течение ночи при 20°С, затем вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 200 мл каждый раз). Органические фазы объединяли, сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 5%-20% метанола в дихлорметане) с получением 6 г целевого продукта трет-бутил-N1-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]циклопропанкарбонил]амино]-фенокси]-6-метокси-7-хинолил]окси]пропил]карбамата (выход: 76 г). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 663,1 [М+Н].
Стадия III: Получение дигидрохлорида N1′-[4-[[7-(3-аминопропокси)-6-метокси-4-хинолил]окси]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида: к раствору трет-бутил-N1-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]окси]пропил]карбамата (6 г, 9,06 ммоль) в 20 мл этилацетата по каплям добавляли раствор 4 M HCl в 40 мл этилацетата. Затем эту смесь перемешивали в течение 1 часа при 20°С и концентрировали при пониженном давлении с получением продукта гидрохлорида N1′-[4-[[7-(3-аминопропокси)-6-метокси-4-хинолил]окси]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (4,8 г, выход: 95%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 562,9 [М+Н].
Способ получения промежуточного соединения L:
дигидрохлорид N1′-[4-[[6-(3-аминопропокси)-7-метокси-4-хинолил]окси]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида:
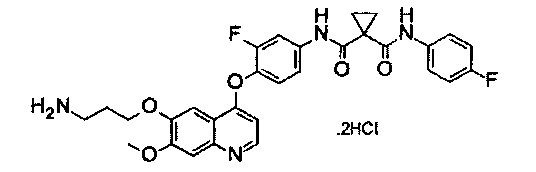
Промежуточное соединение L получали согласно такому же способу, как для Промежуточного соединения K. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 562,9 [М+Н].
Пример 1:
Получение N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидил]метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)-циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
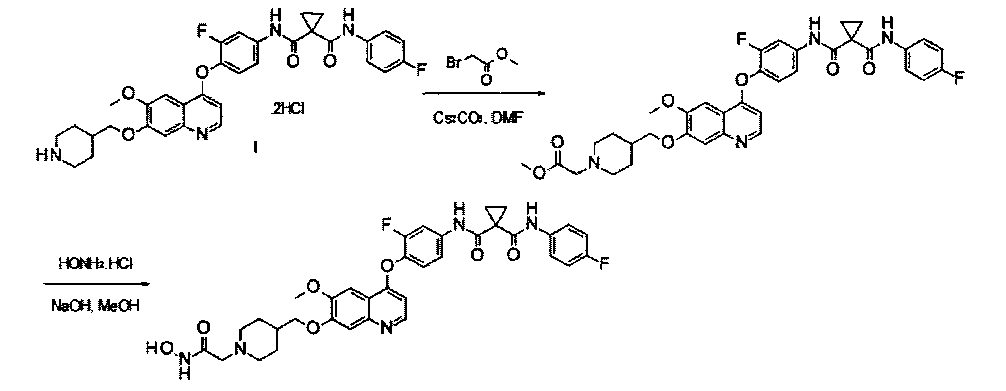
Стадия I: К раствору гидрохлорида N1′-[3-фтор-4-[[6-метокси-7-(4-пиперидил метокси)-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение I, 3 г, 9,4 ммоль) и метилбромацетата (1,44 г, 9,4 ммоль) в 20 мл ЭМР добавляли карбонат цезия (3,1 г, 9,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 1,8 г неочищенного продукта метил-2-[4-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]-циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]оксиметил]-1-пиперидил]ацетата. Неочищенный продукт промывали петролейным эфиром и использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия II: К раствору метил-2-[4-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-оксиметил]-1-пиперидил]ацетата (1,8 г неочищенного продукта, 2,67 ммоль) и гидрохлорида гидроксиламина (1,84 г, 26,7 ммоль) в 20 мл метанола добавляли гидроксид натрия (1,07 г, 26,7 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидил]метокси]-6-метокси-4-хинолил]окси]-фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (225 мг, выход: 12,5%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 676,1 [М+Н].
Пример 2
Получение N1′-[3-фтор-4-[[6-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидил]метокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)-циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
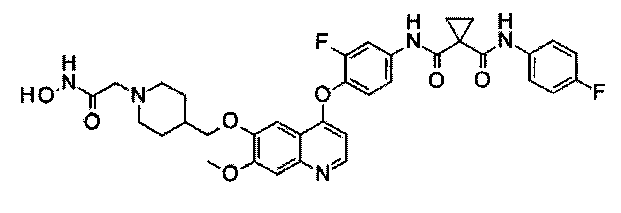
Получение осуществляли согласно такому же способу, как в Примере 1, используя Промежуточное соединение J. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 676,1 [М+Н].
Пример 3
Получение N1′-[3-фтор-4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
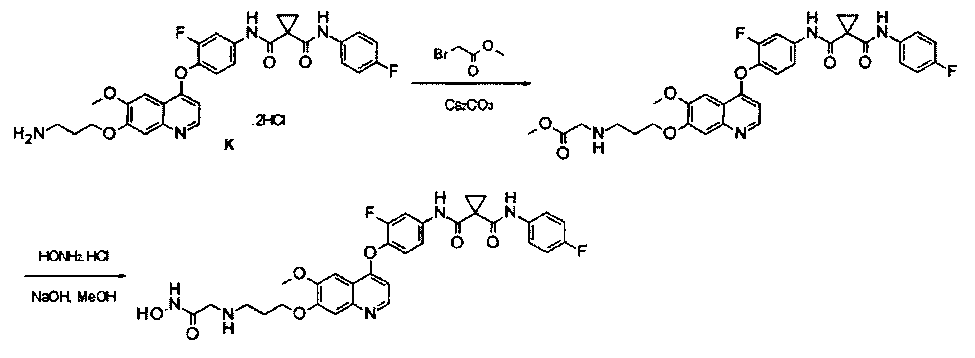
Стадия I: К раствору гидрохлорида N1′-[4-[[7-(3-аминопропокси)-6-метокси-4-хинолил]окси]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение K, 2 г, 3,56 ммоль) и метилбромацетата (0,55 г, 3,56 ммоль) в 30 мл ацетонитрила добавляли карбонат цезия (3,48 г, 10,68 ммоль). Полученную смесь перемешивали в течение ночи при 20°С, затем вливали в воду и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта метил-2-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]окси]пропиламино]ацетата (0,9 г, выход: 40%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 635,1 [М+Н].
Стадия II: К раствору метил-2-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]аланил]ацетата (0,9 г, 1,42 ммоль) в 30 мл метанола добавляли гидрохлорид гидроксиламина (0,98 г, 14,2 ммоль) и гидроксид натрия (0,57 г, 14,2 ммоль). Полученную смесь перемешивали в течение ночи при 20°С. Эту смесь фильтровали, полученное твердое вещество промывали метанолом и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 1%-15% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (220 мг, выход: 24%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО- d6): δ=11.08 (s, 1Н), 10.44 (s, 1Н), 10.02 (s, 1Н), 9.13 (s, 1Н), 8.52 (s, 1Н), 7.92 (d, J=21,2 Гц, 1Н), 7.68-7.64 (m, 2Н), 7.57-7.54 (m, 2Н), 7.47-7.44 (m, 2Н), 7.16 (t, J=8,0 Гц, 2Н), 6.48 (s, 1Н), 4.28 (s, 2Н), 3.98 (s, 3Н), 3.70 (m, 1Н), 3.18-3.15 (m, 4Н), 3.24-3.22 (m, 2Н), 1.49 (d, J=5,2 Гц, 4Н). Масс-спектр m/z: 636,1 [М+Н].
Пример 4
Получение N1′-[3-фтор-4-[[6-[3-[[2-(гидроксиамино)-2-оксопропилоксоэтил]амино]пропокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
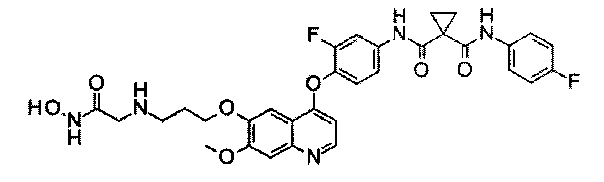
Получение осуществляли согласно такому же способу, как в Примере 3, используя Промежуточное соединение L. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 636,1 [М+Н].
Пример 5
Получение N1′-[3-фтор-4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]-пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
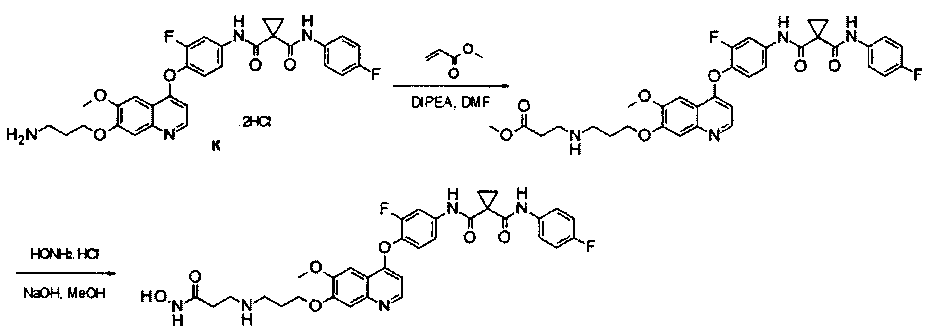
Стадия I: смесь гидрохлорида N1′-[4-[[7-(3-аминопропокси)-6-метокси-4-хинолил]окси]-3-фторфенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение K, 1,0 г, 1,8 ммоль), метилакрилата (0,28 г, 3,25 ммоль) и DIPEA (5 мл) в 10 мл DMF нагревали в течение ночи при 40°С. Полученную смесь вливали в 20 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 5%-20% метанола в дихлорметане) с получением целевого продукта метил-3-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)аминокарбонил]-циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]окси]пропиламино]-пропионата (0,648 г, выход: 55%). Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 649,1 [М+Н].
Стадия II: к раствору метил-3-[3-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]пропиламино]пропионата (0,648 г, 1,00 ммоль) в 30 мл метанола добавляли гидрохлорид гидроксиламина (0,69 г, 10,0 ммоль) и гидроксид натрия (0,40 г, 10,0 ммоль). Полученную смесь перемешивали в течение ночи при 20°С. Эту смесь фильтровали, полученное твердое вещество промывали метанолом и полученный фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 1%-15% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (203 мг, выход: 31%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.70 (s, 1Н), 10.42 (s, 1Н), 10.02 (s, 1Н), 8.93 (s, 1Н), 8.78 (s, 1Н), 8.50 (s, 1Н), 7.92 (d, J=15,2 Гц, 1Н), 7.65-7.63 (m, 2Н), 7.56-7.53 (m, 2Н), 7.45-7.43 (m, 2Н), 7.17 (t, J=7,6 Гц, 2Н), 6.46 (s, 1Н), 4.27 (m, 2Н), 3.97 (s, 3Н), 3.18-3.14 (m, 6Н), 2.21-2.19 (m, 2Н), 1.48 (d, J=6,0 Гц, 4Н). Масс-спектр m/z: 650,1 [М+Н].
Пример 6
Получение N1′-[3-фтор-4-[[6-[3-[[3-(гидроксиамино)-3-оксопропил]амино]-пропокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
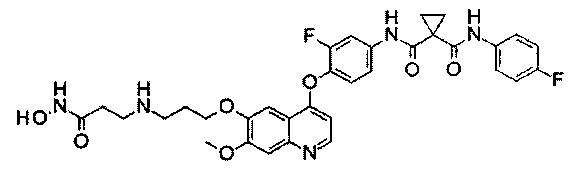
Получение осуществляли согласно такому же способу, как в Примере 5, используя Промежуточное соединение L. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 650,1 [М+Н].
Пример 7
Получение N1′-[3-фтор-4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
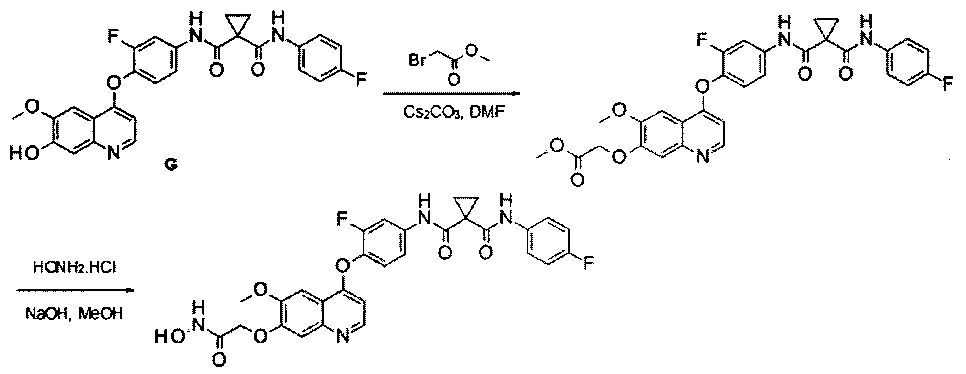
Стадия I: К раствору N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)-окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение G, 2 г, 3,96 ммоль) и метилбромацетата (1,2 г, 7,92 ммоль) в 20 мл DMF добавляли карбонат цезия (2,6 г, 7,92 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 2,1 г неочищенного продукта. Этот неочищенный продукт промывали петролейным эфиром и использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия II: К раствору метил-2-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]ацетата (2,1 г, 3,64 ммоль неочищенного продукта) и гидрохлорида гидроксиламина (2,5 г, 36,4 ммоль) в 20 мл метанола добавляли гидроксид натрия (1,46 г, 36,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (251 мг, выход: 12%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.92 (s, 1Н), 10.39 (s, 1Н), 10.01 (s, 1Н), 9.09 (s, 1Н), 8.48 (d, J=5,2 Гц, 1Н), 7.91 (dd, J=1,6, 13,2 Гц, 1Н), 7.66-7.62 (m, 2Н), 7.55-7.51 (m, 2Н), 7.44-7.36 (m, 2Н), 7.15 (t, J=8,8 Гц, 2Н), 6.44 (d, J=4,8 Гц, 1Н), 4.65 (s, 2Н), 3.96 (s, 3Н), 1.47 (d, J=2,0 Гц, 4Н). Масс-спектр m/z: 579,1 [М+Н].
Пример 8
Получение N1′-[3-фтор-4-[[6-[2-(гидроксиамино)-2-оксоэтокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
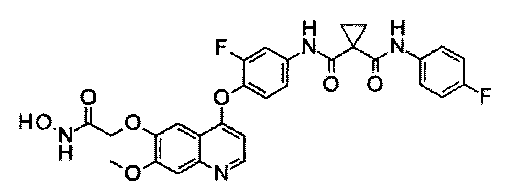
Получение осуществляли согласно такому же способу, как в Примере 7, используя Промежуточное соединение Н. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 579,1 [М+Н].
Пример 9
Получение N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, которое представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
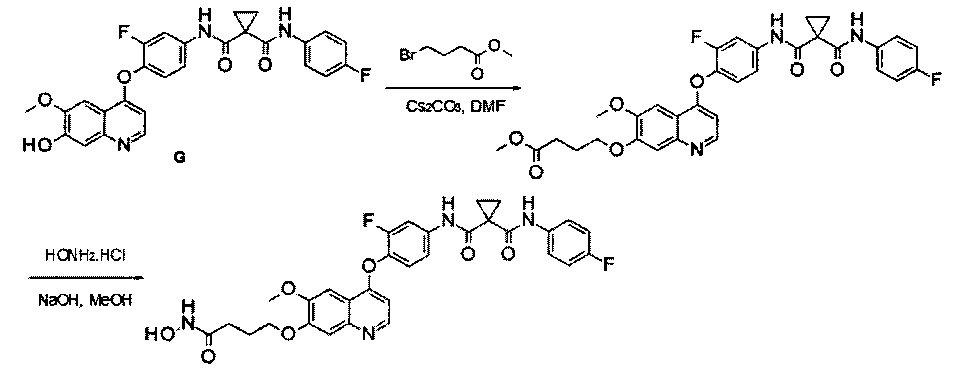
Стадия I: К раствору N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)-окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение G, 2 г, 3,96 ммоль) и метил-4-бромбутирата (1,4 г, 7,92 ммоль) в 20 мл DMF добавляли карбонат цезия (2,6 г, 7,92 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 1,5 г неочищенного продукта. Этот неочищенный продукт промывали петролейным эфиром и использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия II: К раствору метил-4-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]бутирата (1,5 г неочищенного продукта, 2,48 ммоль) и гидрохлорида гидроксиламина (1,71 г, 24,8 ммоль) в 20 мл метанола добавляли гидроксид натрия (1,00 г, 24,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (290 мг, выход: 19%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.46 (s, 1Н), 10.38 (s, 1Н), 10.00 (s, 1Н), 8.74 (s, 1Н), 8.46 (d, J=5,2 Гц, 1Н), 7.91 (dd, J=1,6, 13,2 Гц, 1Н). 7.65-7.62 (m, 2Н), 7.52-7.50 (m, 2Н), 7.43-7.38 (m, 2Н), 7.17-7.13 (m, 2Н), 6.41 (dd, J=1,2, 5,6 Гц, 1Н), 4.15 (t, J=6,4 Гц, 2Н), 3.95 (s, 3Н), 2.18 (m, 2Н), 2.03 (m, 2Н), 1.46 (s, 4Н). Масс-спектр m/z: 607,0 [М+Н].
Пример 10
Получение N1′-[3-фтор-4-[[6-[4-(гидроксиамино)-4-оксобутокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
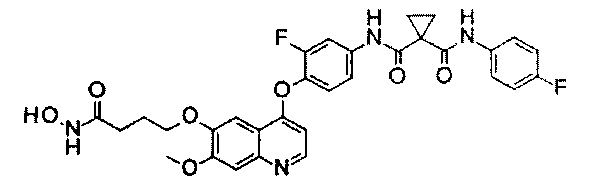
Получение осуществляли согласно такому же способу, как в Примере 9, используя Промежуточное соединение Н. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 607,1 [М+Н].
Пример 11
Получение N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению:
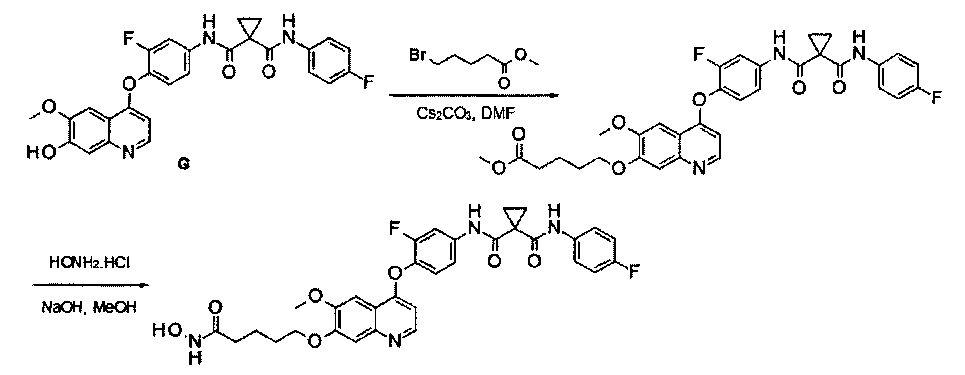
Стадия I: К раствору N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинол ил)окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение G, 2 г, 3,96 ммоль) и метил-5-бромвалерата (1,55 г, 7,92 ммоль) в 20 мл DMF добавляли карбонат цезия (2,6 г, 7,92 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 2,0 г неочищенного продукта. Этот неочищенный продукт промывали петролейным эфиром и использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия II: К раствору метил-5-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]пентаноата (2,0 г неочищенного продукта, 3,23 ммоль) и гидрохлорида гидроксиламина (2,22 г, 32,3 ммоль) в 20 мл метанола добавляли гидроксид натрия (1,29 г, 32,3 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Полученную в результате смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (284 мг, выход: 14,3%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.39 (s, 1Н), 10.38 (s, 1Н), 10.00 (s, 1Н), 8.72 (d, J=1,2 Гц, 1Н), 8.47 (d, J=5,2 Гц, 1Н), 7.82 (dd, J=2,0, 15,6 Гц, 1Н), 7.66-7.62 (m, 2Н), 7.52-7.50 (m, 2Н), 7.44-7.39 (m, 2Н), 7.17-7.13 (m, 2Н), 6.41 (dd, J=1,2, 5,2 Гц, 1Н), 4.15 (t, J=6,4 Гц, 2Н), 3.95 (s, 3Н), 2.06 (m, J=7,2 Гц, 2Н), 1.83-1.76 (m, 2Н), 1.72-1.64 (m, 2Н), 1.47 (d, J=2,4 Гц, 4Н). Масс-спектр m/z: 621,0 [М+Н].
Пример 12
Получение N1′-[3-фтор-4-[6-[5-(гидроксиамино)-5-оксопентилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
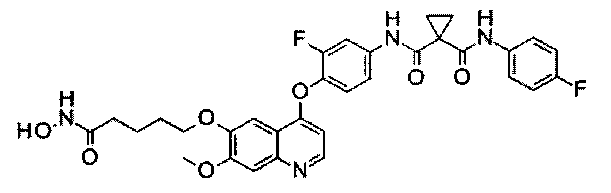
Получение осуществляли согласно такому же способу, как в Примере 11, используя Промежуточное соединение Н. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 621,1 [М+Н].
Пример 13
Получение N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
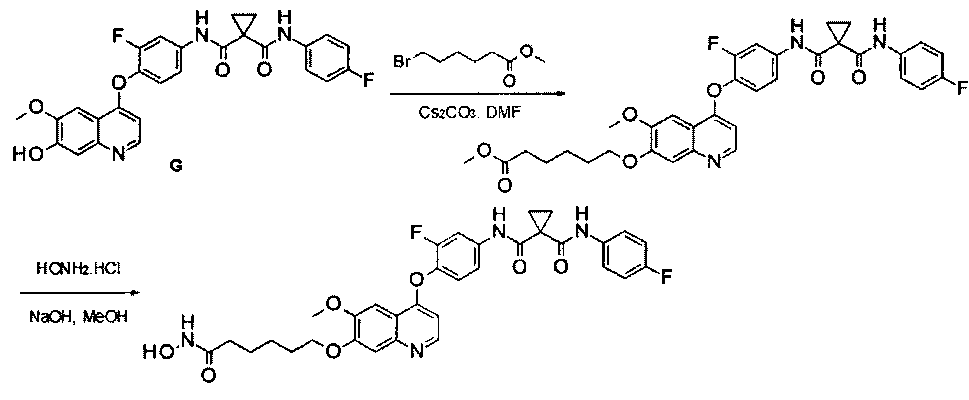
Стадия I: К раствору N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)-окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение G, 2 г, 3,96 ммоль) и метил-6-бромгексаноата (1,66 г, 7,92 ммоль) в 20 мл DMF добавляли карбонат цезия (2,6 г, 7,92 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 1,8 г неочищенного продукта. Этот неочищенный продукт промывали петролейным эфиром и использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия II: К раствору метил-6-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]гексаноата (1,8 г неочищенного продукта, 2,84 ммоль) и гидрохлорида гидроксиламина (1,96 г, 28,4 ммоль) в 20 мл метанола добавляли гидроксид натрия (1,14 г, 28,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Полученную в результате смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (207 мг, выход: 11,5%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.38 (s, 1Н), 10.37 (s, 1Н), 10.00 (s, 1Н), 8.69 (s, 1Н), (d, J=5,2 Гц, 1Н), 7.91 (d, J=8,2 Гц, 1Н), 7.66-7.62 (m, 2Н), 7.52-7.50 (m, 2Н), 7.44-7.39 (m, 2Н), 7.15 (t, J=8,8 Гц, 2Н), 6.41 (dd, J=1,2, 5,2 Гц, 1Н), 4.14 (t, J=6,4 Гц, 2Н), 3.95 (s, 3Н), 2.06 (t, J=6,4 Гц, 2Н), 2.00-1.98 (m, 2Н), 1.60-1.59 (m, 2Н), (m, 6H). Масс-спектр m/z: 635,3 [М+Н].
Пример 14
Получение N1′-[3-фтор-4-[[6-[6-(гидроксиамино)-6-оксогексилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
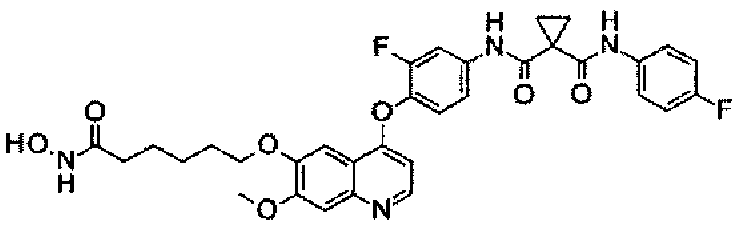
Получение осуществляли согласно такому же способу, как в Примере 13, используя Промежуточное соединение Н. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 635,2 [М+Н].
Пример 15
Получение N1′-[3-фтор-4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
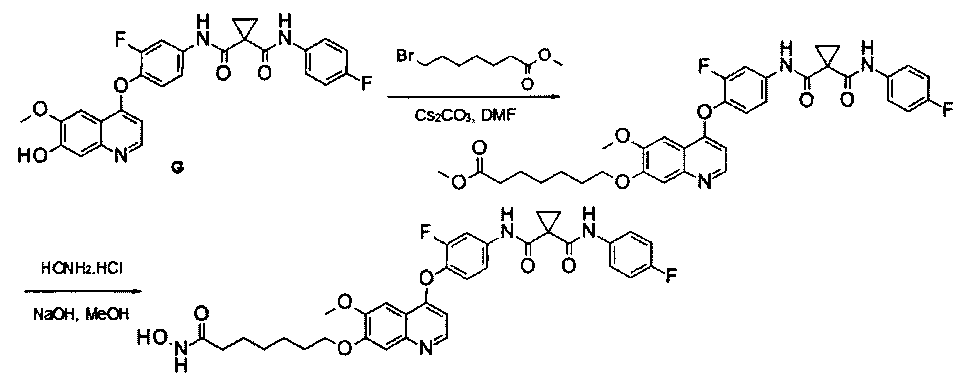
Стадия I: К раствору N1′-[3-фтор-4-[(7-гидрокси-6-метокси-4-хинолил)-окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (Промежуточное соединение G, 2 г, 3,96 ммоль) и метил-7-бромгептаноата (1,77 г, 7,92 ммоль) в 20 мл DMF добавляли карбонат цезия (2,6 г, 7,92 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, вливали в 200 мл воды и экстрагировали этилацетатом 3 раза (по 50 мл каждый раз). Органические фазы объединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 1,7 г неочищенного продукта. Этот неочищенный продукт промывали петролейным эфиром и использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия II: К раствору метил-7-[[4-[2-фтор-4-[[1-[(4-фторфенил)-аминокарбонил]циклопропанкарбонил]амино]фенокси]-6-метокси-7-хинолил]-окси]гептаноата (1,7 г неочищенного продукта, 2,62 ммоль) и гидрохлорида гидроксиламина (1,81 г, 26,2 ммоль) в 20 мл метанола добавляли гидроксид натрия (1,05 г, 26,2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Полученную в результате смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного продукта. Этот неочищенный продукт очищали колоночной хроматографией на силикагеле (элюировали раствором 0%-10% метанола в дихлорметане) с получением целевого продукта N1′-[3-фтор-4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида (315 мг, выход: 18,5%). Аналитические данные полученного продукта являются следующими:1Н ЯМР (400 МГц, ДМСО-d6): δ=10.38 (s, 1Н), 10.34 (s, 1Н), 10.00 (s, 1Н), 8.67 (s, 1Н), 8.46 (d, J=5,2 Гц, 1Н), 7.90 (dd, J=2,0, 12,8 Гц, 1Н), 7.65-7.62 (m, 2Н), 7.51-7.50 (m, 2Н), 7.43-7.38 (m, 2Н), 7.15 (t, J=8,8 Гц, 2Н), 6.41 (d, J=4,4 Гц, 1Н), 4.13 (t, J=6,4 Гц, 2Н), 3.94 (s, 3Н), 1.98-1.95 (m, 2Н), 1.82-1.78 (m, 2Н), 1.55-1.44 (m, 8Н), 1.35-1.33 (m, 2Н). Масс-спектр m/z: 649,1 [М+Н].
Пример 16
Получение N1′-[3-фтор-4-[[6-[7-(гидроксиамино)-7-оксогептилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, который представляет собой одно из хинолил-содержащих соединений гидроксамовой кислоты по настоящему изобретению.
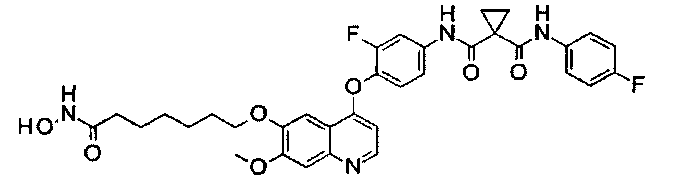
Получение осуществляли согласно такому же способу, как в Примере 15, используя Промежуточное соединение Н. Аналитические данные полученного продукта являются следующими: масс-спектр m/z: 649,2 [М+Н].
Пример 17
Скрининговые эксперименты в отношении ингибирования киназы:
Результаты ингибирования соединения N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, полученного в Примере 13, в 96-киназной панели KinomeScan™ (www.kinomescan.com), отделение DiscoveRx Company (4215 Sorrento Valley Blyd, San Diego, СА 92121) при концентрации соединения 1000 нМ показаны в Таблице 5.
Подробности технологии скрининга описаны в Fabian, М. А. et al, Nat., Biotechnol. 2005, 23, 329 и Karaman, М. W. et al, Nat., Biotechnol. 2008, 26, 127. Из упомянутых выше представленных результатов можно видеть, что соединения по настоящему изобретению проявляют сильную ингибирующую активность в отношении киназ, включая ALK, AXL, VEGFR2, PDGFR-α, PDGFR-β, c-KIT, Flt3, MEK1, MEK2, CSF1R, ЕРНА2, ЕРНА2, MKNK2, SRC, TIE2 и их мутанты. Соответственно соединения по настоящему изобретению могут быть использованы для лечения заболеваний, вызванных аномальной активностью этих киназ, например рака, псориаза, цирроза печени, диабета, опосредованных ангиогенезом заболеваний, заболеваний глаз, заболеваний иммунной системы, сердечно-сосудистых заболеваний и так далее.

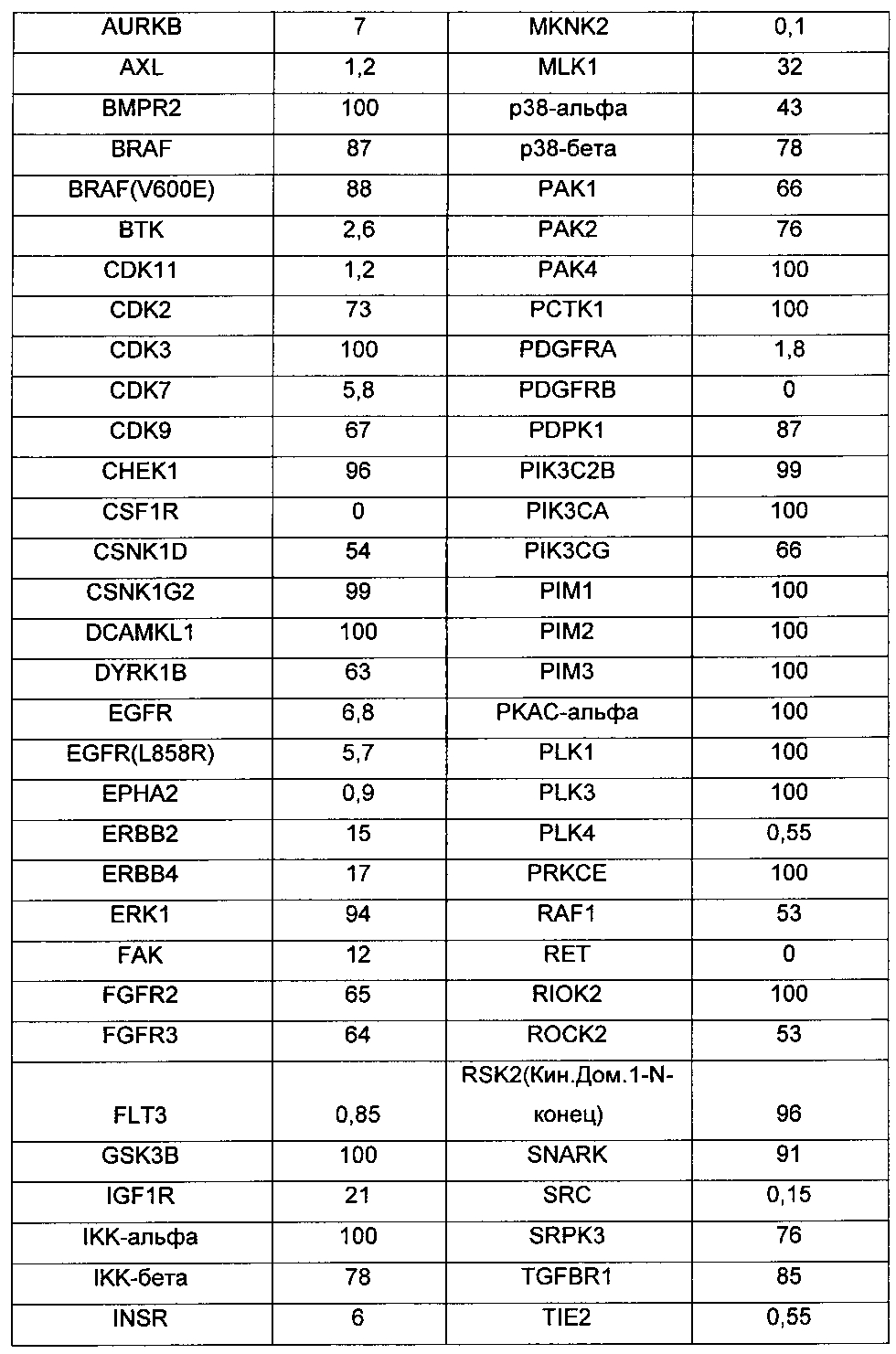

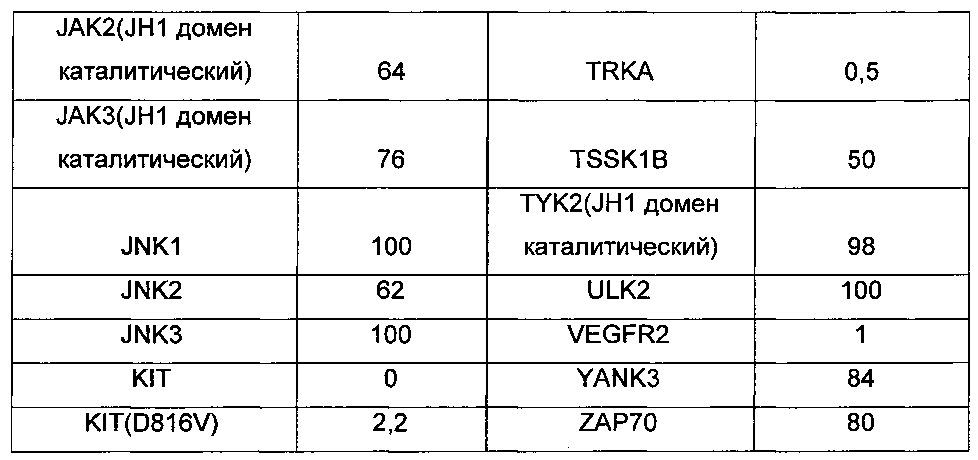
Пример 18
Активность ингибирования киназ в опухолевых клетках:
Этот пример иллюстрирует измерение ингибирующей активности соединения N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]-фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамида, полученного в Примере 9, в клетках в отношении киназ, включая ALK, AXL, FLT3, VEGFR2, c-KIT, с-МЕТ, PDGFR-β, RET и SRC (тестированная с использованием Advanced Cellular Dynamics, 3550 General Atomics Court, Building 2, Room 639, San Diego, СА 92121, www.advancedcelldynamics.com и Carna Biosciences, Inc.(www.carnabio.com)), в соответствии со способом, описанным в литературе (Reference: Daley, G. Q.; Baltimore, D. Proc. Natl. Acd. Sci. USA 1988, 85(23), 9312). Конкретные стадии были следующими:
Соединение по настоящему изобретению растворяли в диметилсульфоксиде (ДМСО) с получением исходного раствора 2 мМ, затем этот исходный раствор разбавляли ДМСО с получением 7-кратного полулогарифмического ряда концентраций в диапазоне от 2 мкМ до 600 пМ.
Методика тестирования:
Клеточные линии поддерживали в RPMI-1640 растворе для культур, содержащем 10%-ную фетальную бычью сыворотку и антибиотики. Использовали клетки логарифмической фазы роста, которые помещали в 384-луночный планшет, содержащий 50 мкл ростовой среды при концентрации 5000 клеток на лунку. 50 нанолитров разбавленного соединения добавляли в соответствующую лунку в двух повторностях. Клетки инкубировали в увлажняемой чашке для культивирования, содержащей 5% СО2 атмосферу, в течение 48 часов при 37°С. Добавляли 15 мкл CellTiter-GLO и активность определяли путем измерения люминесценции.
Результаты тестирования:
Значения IC50 для соединения, полученного в Примере 9 настоящего изобретения, в отношении ингибирования девяти киназ в клетках, показаны в Таблице 6:
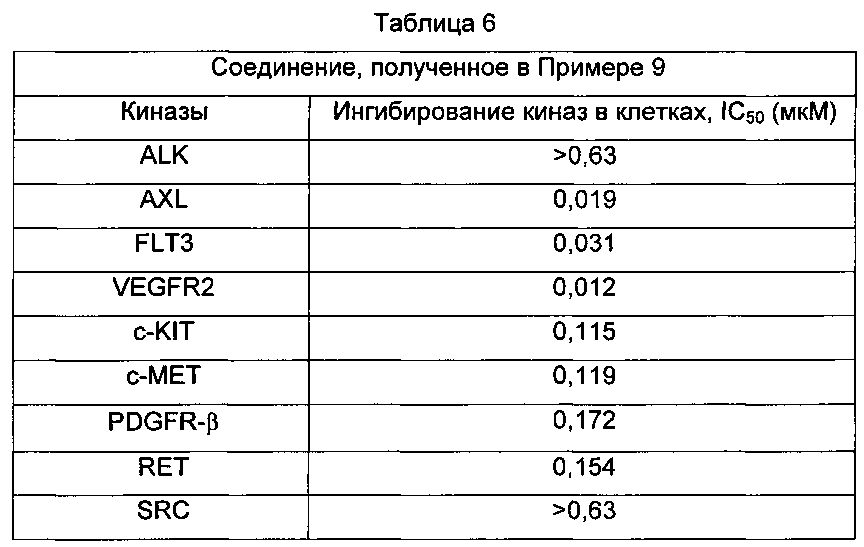
Из приведенных выше данных можно видеть, что соединения по настоящему изобретению проявляют сильную ингибирующую активность в отношении нескольких киназ в опухолевых клетках, а именно AXL, FLT3, VEGFR2, с-KIT, с-МЕТ, PDGFR-β и RET, и значения IC50 в диапазоне от 12 нМ до 154 нМ. Таким образом, соединения по настоящему изобретению могут быть использованы для лечения заболеваний, вызванных аномальной активностью этих киназ, например рака, псориаза, цирроза печени, диабета, опосредованных ангиогенезом заболеваний, заболеваний глаз, заболеваний иммунной системы, сердечно-сосудистых заболеваний и так далее.
Пример 19
Ингибирующая активность в отношении 11 изоформ HDAC ферментов:
Ингибирование активности HDAC ферментов соединениями N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамидом, полученным в Примере 9, и N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]-окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамидом, полученным в Примере 13, измеряли с использованием Reaction Biology Corporation (Reaction Biology Corp., One Great Valley Parkway, Suite 2, Malvern, РА 19355, USA, http://www.reactionbiology.com/pages/hdac.htm). Тестируемые HDAC ферменты включают следующие 11 изоформ HDAC: HDAC1, НОАС2, НРАС3, HDAC4, HDAC5, HDAC6, HDAC7, HDAC8, HDAC9, HDAC10 и HDAC11.
Конкретные стадии были следующими:
Соединение по настоящему изобретению растворяли в диметилсульфоксиде (ДМСО) с получением исходного раствора 10 мМ. Этот исходный раствор разбавляли, используя 4-кратную серию разведений, начиная с 10 мМ, с получением 10 различных дозировок. Субстрат для тестирования активности HDAC8 представлял собой полипептид RHK(Ас)K(Ас), полученный из остатков 379-382 р53. Субстрат для тестирования активности HDAC типа 2А представлял собой Вос-Lys(трифторацетил)-АМС. Субстрат для остальных тестов представлял собой полипептид RHKK(Ас), полученный из остатков 379-382 р53.
Результаты измерений:
Значение IC50 ингибирования 11 изоформ HDAC ферментов соединениями, полученными в Примере 9 и 13, показаны в Таблице 7:

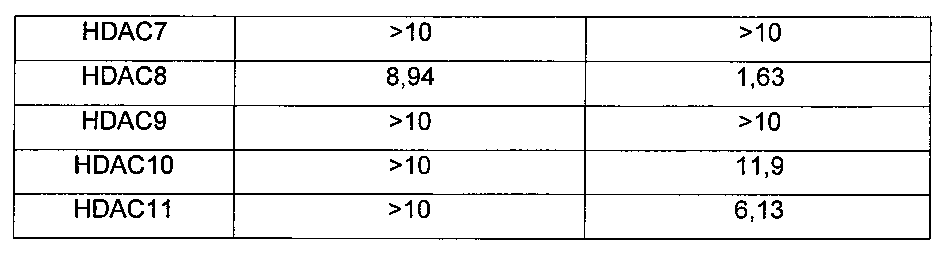
Из представленных выше данных можно видеть, что соединение по настоящему изобретению, полученное в Примере 9, проявляет сильную ингибирующую активность в отношении HDAC2 и HDAC6, причем значения IC50 составляют 431 нМ и 242 нМ соответственно. Соединение, полученное в Примере 13, избирательно ингибирует активность HDAC6, причем значение IC50 составляет 8,3 нМ. Таким образом, соединения по настоящему изобретению могут быть использованы для лечения заболеваний, вызванных аномальной активностью HDAC ферментов, таких как рак, эпилепсия, нейродегенеративные заболевания, болезнь Альцгеймера, болезнь Гентингтона и болезнь Паркинсона.
Пример 20
Противоопухолевый эксперимент:
В данном примере N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидил]метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)-циклопропан-1,1-дикарбоксамид, полученный в Примере 1, использовали для проведения противоопухолевого эксперимента на бестимусных мышах, представляющих собой ксенотрансплантатную животную модель рака желудка человека. Методика эксперимента и результаты представлены ниже.
Материалы эксперимента:
Самок мышей линии SPF level BALB/с-nu/nu 4-5-недельного возраста весом от 12 г до 16 г приобретали в Beijing Vital River Laboratory Animal Technology Со., Ltd., с лицензионным номером продукта: SCXK (Beijing) 2006. Клетки рака желудка GTL-16 приобретали в Shanghai Institutes for Biological Sciences Cell Resource Center. Культуральную клеточную среду RPMI-1640, фетальную бычью сыворотку (FBS) и раствор для переваривания трипсином приобретали в Gibco. Различные антибиотики приобретали в Sigma.
Методика эксперимента:
Клетки рака желудка GTL-16 сначала культивировали: линии клеток GTL-16 инокулировали в культуральную среду RPM 1-1640, содержащую 10% FBS, 100 Ед/мл пенициллина, 100 Ед/мл стрептомицина и культивировали в условиях 37°С, 5% СО2 и 100% влажности в инкубаторе с диоксидом углерода. Через 24 часа была достигнута логарифмическая фаза роста, и клетки полностью покрывали дно культуральной колбы на момент времени приблизительно 48 часов после инокуляции. Эти клетки с 80% GTL-16, покрывающими дно культуральной колбы, подвергали перевариванию и центрифугировали при 1000 об/мин в течение 5 мин. Клетки разбавляли до концентрации 2×107 /мл и имплантировали подкожно в правую переднюю подмышечную впадину бестимусных мышей в объеме 0,1 мл на мышь. Начиная с 12-х суток после инокуляции опухолевых клеток, измеряли массу бестимусных мышей-носителей опухоли и размер опухолей, и мышей с размерами опухолей в интервале 150-200 мм3 распределяли случайным образом в контрольную группу введения носителя (носитель представлял собой 0,25%-ную метансульфоновую кислоту) и группу лечения, в которой мышей лечили N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидил]метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамидом, полученным в Примере 1, по 6 мышей на каждую группу. Затем этих бестимусных мышей ежедневно взвешивали и осуществляли пероральное введение при концентрации 0,1 мл/10 г массы тела посредством методики принудительного питания через зонд (75 мг/кг, один раз в сутки). Размер опухоли каждого животного измеряли один раз в двое суток. Через 14 суток мышей-носителей опухоли умерщвляли смещением шейных позвонков и опухоли извлекали и взвешивали. Методика расчета ингибирования роста опухоли (TGI) состояла в следующем: экспериментальные данные представляли в виде средних значений ± SD (стандартное отклонение):
TGI=[(Vгруппыносителя - Vгруппылечения)÷Vгруппыносителя]×100%, где
Vгруппыносителя представляет собой объем опухоли мыши из группы носителя, и
Vгруппылечения представляет собой объем опухоли мыши из группы лечения.
Результаты эксперимента:
Ингибирующее действие соединения Примера 1 в отношении роста опухоли мыши в группе лечения: после введения в течение 14 суток животным из группы носителя и группы лечения носителя и соединения соответственно средние объемы опухолей животных в группе носителя и группе лечения составили 1811,2±245,6 мм3 (число мышей в каждой группе n=6) и 630,9±354,6 мм3 (число мышей в каждой группе n=6) соответственно. Таким образом, ингибирование роста опухоли (TGI) в группе лечения составило 65%.
Изображение опухолей, демонстрирующее ингибирующее действие соединения по настоящему изобретению по Примеру 1, проиллюстрировано на Фиг. 2: группа лечения показала значительное ингибирование роста опухоли по сравнению с контрольной группой носителя.
Кривая объемов опухолей, демонстрирующая ингибирующее действие соединения по настоящему изобретению по Примеру 1, проиллюстрирована на Фиг. 3: объемы опухолей в группе лечения были значительно меньше объемов в контрольной группе.
Изменение массы тела мышей группы носителя и группы лечения в эксперименте по ингибированию роста опухоли соединением по настоящему изобретению по Примеру 1 проиллюстрировано на Фиг. 4: через 14 суток лечения мыши группы лечения, которых лечили соединением по Примеру 1, имели изменение массы < 10%.
Из представленных выше результатов противоопухолевого эксперимента видно, что репрезентативные соединения по настоящему изобретению показали значительное ингибирующее действие в отношении роста опухоли на ксенотрансплантатных опухолевых животных моделях бестимусных мышей. Ингибирование роста опухоли составило вплоть до 65% после 14 суток перорального введения один раз в сутки. Изменение массы тела в группе лечения было минимальным, демонстрируя, что соединение не проявляет значительной токсичности.
Пример 21
Противоопухолевый эксперимент:
Противоопухолевый эксперимент осуществляли с использованием того же метода, как Примере 20. Соединение, полученное в Примере 9, N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид, использовали в этом примере. Опухолевая модель представляла собой ксенотрансплантатную животную модель рака желудка GTL-16 бестимусных мышей.
Результаты эксперимента:
Ингибирующее действие соединения Примера 9 на рост опухоли мыши в группе лечения: после введения в течение 14 суток животным из группы носителя и группы лечения носителя и соединения соответственно средние объемы опухолей животных в группе носителя и группе лечения составили 1811,2±245,6 мм3 (число мышей в каждой группе n=6) и 241,1±131,4 мм3 (число мышей в каждой группе n=6) соответственно. Таким образом, ингибирование роста опухоли (TGI) в группе лечения составило 87%. Группа лечения показала значительное ингибирование роста опухоли по сравнению с объемом опухоли в контрольной группе носителя. Сравнение опухолей и кривых объемов опухолей соответственно проиллюстрировано на Фиг. 5 и 6.
Изображение опухолей, демонстрирующее ингибирующее действие соединения по настоящему изобретению по Примеру 9, проиллюстрировано на Фиг. 5: Группа лечения показала значительное ингибирование роста опухоли по сравнению с объемом опухоли в контрольной группе носителя.
Кривая объемов опухолей, демонстрирующая ингибирующее действие соединения по настоящему изобретению по Примеру 9, проиллюстрирована на Фиг. 6: объемы опухолей в группе лечения были значительно меньше объемов в контрольной группе.
Изменение массы тела мышей группы носителя и группы лечения в эксперименте по ингибированию роста опухоли соединением по настоящему изобретению по Примеру 9 проиллюстрировано на Фиг. 7: через 14 суток лечения у мышей группы лечения, которых лечили соединением по Примеру 9, наблюдалось значительное снижение в объеме опухоли.
Из представленных выше результатов противоопухолевого эксперимента видно, что репрезентативное соединение по настоящему изобретению показало значительное ингибирующее действие в отношении роста опухоли на ксенотрансплантатных опухолевых животных моделях бестимусных мышей. Ингибирование роста опухоли составило вплоть до 87% после 14 суток перорального введения один раз в сутки. Масса тела животных в группе лечения не уменьшилась, демонстрируя, что соединение не проявляет значительной токсичности.
Пример 22:
Состав композиции для лекарственного средства в форме таблетки (мг/таблетка)
Соединение, полученное в Примере 1: 100;
лактоза (Европейская Фармакопея, Ph EUR): 182,75;
карбоксиметилцеллюлоза натрия: 12,0;
кукурузные крахмалы (5 масс./об.%): 2,25;
стеарат магния: 3,0;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 23:
Состав композиции для лекарственного средства в форме таблетки (мг/таблетка)
Соединение, полученное в Примере 5: 100;
содержание остальных веществ является таким же, как в Примере 22;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 24:
Состав композиции для лекарственного средства в форме таблетки (мг/таблетка)
Соединение, полученное в Примере 9: 50;
лактоза, Ph EUR: 223,75;
карбоксиметилцеллюлоза натрия: 6,0;
кукурузный крахмал: 15,0;
поливинилпирролидон (5 масс./об.%): 2,25;
стеарат магния: 3,0;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 25:
Состав композиции для лекарственного средства в форме таблетки (мг/таблетка)
Соединение, полученное в Примере 9: 50;
содержание остальных веществ является таким же, как в Примере 24;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 26:
Состав композиции для лекарственного средства в форме таблетки (мг/таблетка)
Соединение, полученное в Примере 13: 1,0;
лактоза, Ph EUR: 93,25;
карбоксиметилцеллюлоза натрия: 4,0;
кукурузный крахмал (5 масс./об.%): 0,75;
стеарат магния: 76;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 27:
Состав композиции для лекарственного средства в форме таблетки (мг/таблетка)
Соединение Примера 13: 1,0:
содержание остальных веществ является таким же, как в Примере 26;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 28:
Состав композиции для лекарственного средства в форме капсулы (мг/капсула)
Соединение, полученное в Примере 7: 10,0;
лактоза, Ph EUR: 488,5;
магний: 1,5;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 29:
Состав композиции для лекарственного средства в форме капсулы (мг/капсула)
Соединение, полученное в Примере 2: 10,0;
содержание остальных веществ является таким же, как в Примере 28;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 30:
Состав композиции для лекарственного средства в форме инъекции (50 мг/мл)
Соединение, полученное в Примере 6: 5%;
1 M гидроксид натрия: 15%;
0,1 M раствор HCl (значение рН доведено до рН=7,6);
полиэтиленгликоль 400: 5%;
вода для инъекции до 100%;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 31:
Состав композиции для лекарственного средства в форме инъекции (50 мг/мл)
Соединение, полученное в Примере 12: 5%;
содержание остальных веществ является таким же, как в Примере 30, в конце доведено до 100% водой для инъекций 100%;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 32:
Состав композиции для лекарственного средства в форме инъекции (10 мг/мл)
Соединение, полученное в Примере 11: 1%;
гидрофосфат натрия (Британская Фармакопея, BP): 3,6%;
0,1 M гидроксид натрия: 15%;
вода для инъекций до 100%;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 33:
Состав композиции для лекарственного средства в форме инъекции (10 мг/мл)
Соединение, полученное в Примере 9: 1%,
содержание остальных веществ является таким же, как в Примере 32,
вода для инъекций до 100%;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 34:
Состав композиции для лекарственного средства в форме инъекции (1 мг/мл) (значение рН доведено до рН=6)
Соединение, полученное в Примере 6: 0,1%;
гидрофосфат натрия, BP: 2,26%;
лимонная кислота: 0,38%;
полиэтиленгликоль 400: 3,5%;
вода для инъекций до 100%;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 35:
Состав композиции для лекарственного средства в форме инъекции (1 мг/мл) (значение рН доведено до рН=6)
Соединение, полученное в Примере 10: 0,1%;
содержание остальных веществ является таким же, как в Примере 34, в конце доведено до 100% водой для инъекций 100%;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 36:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 1: 10;
сорбитанмоноолеат: 13,5;
трихлорфторметан: 910,0;
дихлордифторметан: 490,0;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 37:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 3: 10;
содержание остальных веществ является таким же, как в Примере 36;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 38:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 4: 0,2;
сорбитанмоноолеат: 0,27;
трихлорфторметан: 70,0;
дихлордифторметан: 280,0;
дихлортетрафторэтан: 1094,0;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 39:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 7: 0,2;
содержание остальных веществ является таким же, как в Примере 38;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 40:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 8: 2,5;
сорбитанмоноолеат: 3,38;
трихлорфторметан: 67,5;
дихлордифторметан: 1086,0;
дихлортетрафторэтан: 191,60;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 41:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 11: 2,5;
содержание остальных веществ является таким же, как в Примере 40;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 42:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 4: 2,5;
соевый лецитин: 2,7;
трихлорфторметан: 67,5;
дихлордифторметан: 1086,0;
дихлортетрафторэтан: 191,60;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 43:
Состав композиции для лекарственного средства в форме аэрозоля (мг/мл)
Соединение, полученное в Примере 13: 2,5;
содержание остальных веществ является таким же, как в Примере 42;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 44:
Состав композиции для лекарственного средства в форме мази (/мл)
Соединение, полученное в Примере 1: 40 мг;
этанол: 300 мкл;
вода: 300 мкл;
1-додецилазепанон: 50 мкл;
пропиленгликоль: до 1 мл;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Пример 45:
Состав композиции для лекарственного средства в форме мази (/мл)
Соединение, полученное в Примере 7: 40 мг;
содержание остальных веществ является таким же, как в Примере 44;
Подходящие пациенты: люди с заболеваниями, вызванными аномальной активностью протеинкиназы и/или гистондеацетилазы.
Реферат
Настоящее изобретение относится к области органической химии, а именно к новым хинолил-содержащим соединениям гидроксамовой кислоты общей формулы (I), где каждый из Vи Vнезависимо представляет собой галоген; один из R и R′ представляет собой группу Q, содержащую гидроксамовую кислоту, а другой представляет собой метокси, где группа Q, содержащая гидроксамовую кислоту, представлена формулой; А представляет собой О; L представляет собой Салкил; J представляет собой NH, пиперидинил, или J отсутствует; X отсутствует; Y представляет собой Салкил, или Y отсутствует. Также изобретение относится к способу получения соединения формулы (I), фармацевтической композиции на основе соединения формулы (I) и ее применению для лечения заболеваний, вызванных активностью протеинкиназы и/или гистондеацетилазы. Технический результат: получены новые соединения, которые могут быть применимы при лечении рака. 6 н. и 19 з.п. ф-лы, 7 ил., 7 табл., 45 пр.
Формула
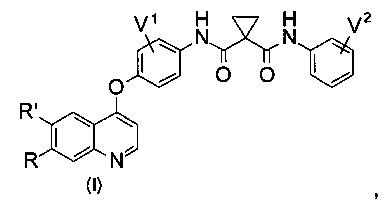
где
каждый из V1 и V2 независимо представляет собой галоген;
один из R и R′ представляет собой группу Q, содержащую гидроксамовую кислоту, а другой представляет собой метокси,
где группа Q, содержащая гидроксамовую кислоту, представлена формулой
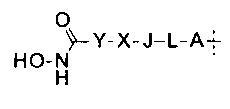
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой NH, пиперидинил, или J отсутствует;
X отсутствует;
Y представляет собой С1-6алкил, или Y отсутствует.
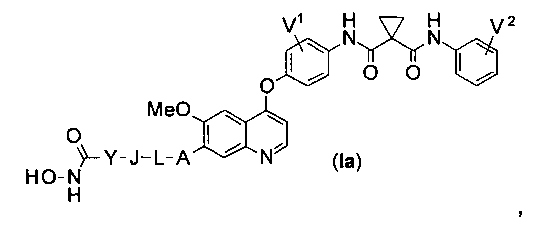
где
каждый из V1 и V2 независимо представляет собой галоген;
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой NH;
Y представляет собой С1-6алкил.
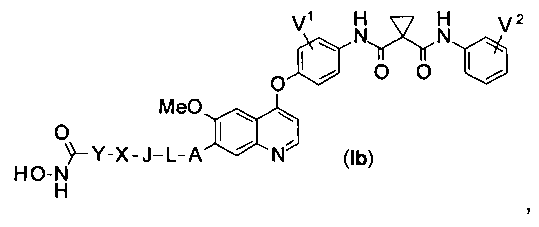
где
каждый из V1 и V2 независимо представляет собой галоген;
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой пиперидинил;
X отсутствует;
Y представляет собой С1-6алкил.
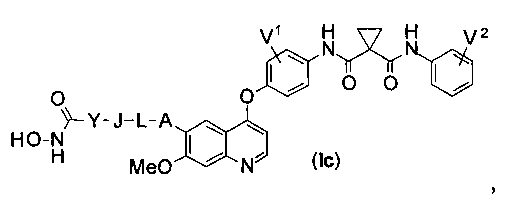
где
каждый из V1 и V2 независимо представляет собой галоген;
А представляет собой О;
L представляет собой C1-6алкил;
J представляет собой NH;
Y представляет собой С1-6алкил.
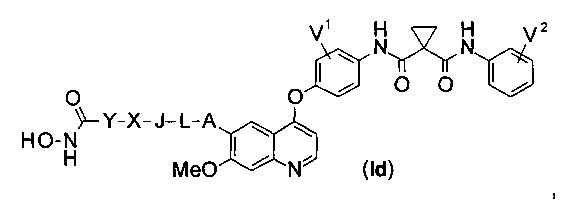
где
каждый из V1 и V2 независимо представляет собой галоген;
А представляет собой О;
L представляет собой С1-6алкил;
J представляет собой пиперидинил;
X отсутствует;
Y представляет собой С1-6алкил.
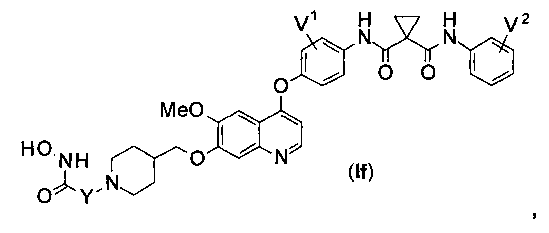
где
каждый из V1 и V2 независимо представляет собой галоген;
Y представляет собой С1-6алкил.
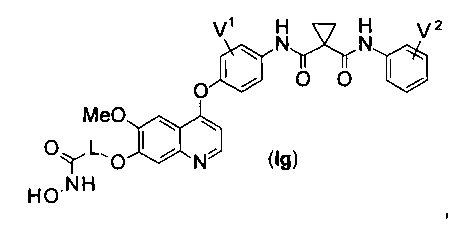
где
каждый из V1 и V2 независимо представляет собой галоген;
L представляет собой C1-6алкил.
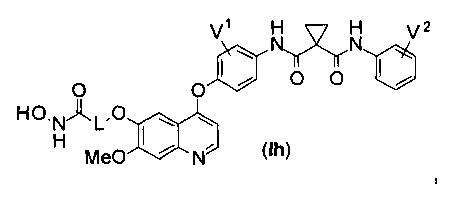
где
каждый из V1 и V2 независимо представляет собой галоген;
L представляет собой C1-6алкил.
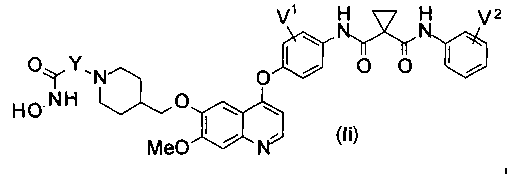
где
каждый из V1 и V2 независимо представляет собой галоген;
Y представляет собой С1-6алкил.
N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[2-(гидроксиамино)-2-оксоэтокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[4-(гидроксиамино)-4-оксобутокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[5-(гидроксиамино)-5-оксопентилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[6-(гидроксиамино)-6-оксогексилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[6-[7-(гидроксиамино)-7-оксогептилокси]-7-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид.
N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[2-(гидроксиамино)-2-оксоэтил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[3-[[3-(гидроксиамино)-3-оксопропил]амино]пропокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[2-(гидроксиамино)-2-оксоэтокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[7-(гидроксиамино)-7-оксогептилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид.
N1′-[3-фтор-4-[[7-[[1-[2-(гидроксиамино)-2-оксоэтил]-4-пиперидинил]-метокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[4-(гидроксиамино)-4-оксобутокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[5-(гидроксиамино)-5-оксопентилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид;
N1′-[3-фтор-4-[[7-[6-(гидроксиамино)-6-оксогексилокси]-6-метокси-4-хинолил]окси]фенил]-N1-(4-фторфенил)циклопропан-1,1-дикарбоксамид.
взаимодействие соединения формулы А-1а или А-1b с соединением формулы В-1 в присутствии основания с получением промежуточного соединения формулы А-2; и
взаимодействие промежуточного соединения формулы А-2 с гидрохлоридом гидроксиламина в присутствии основания с получением соединения формулы А-3
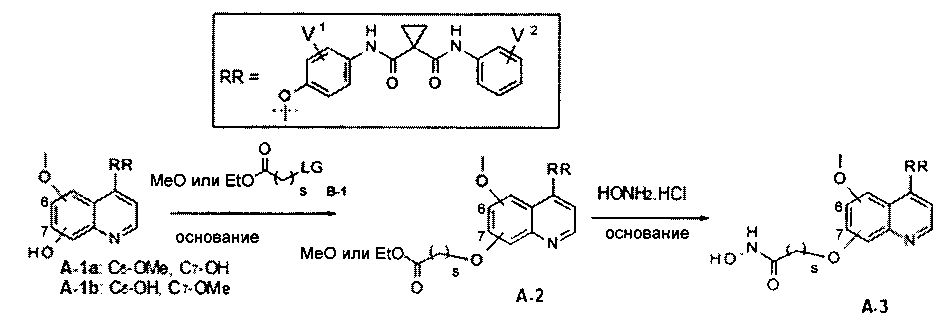
где
s равен от 1 до 10;
каждый из V1 и V2 независимо представляет собой галоген;
LG представляет собой общепринятую в области органической химии уходящую группу и представляет собой любую из F, Cl, Br, I, MsO, TsO или TfO;
PG представляет собой общепринятую в области органической химии защитную группу и представляет собой Boc или CBZ.
взаимодействие соединения формулы А-1а или А-1b с соединением формулы В-2 в присутствии основания с последующим снятием защиты с получением промежуточного соединения формулы А-4;
взаимодействие промежуточного соединения формулы А-4 с соединением формулы В-1 или В-3 в присутствии основания с получением промежуточного соединения формулы А-5; и
взаимодействие промежуточного соединения формулы А-5 с гидрохлоридом гидроксиламина в присутствии основания с получением соединения формулы А-6
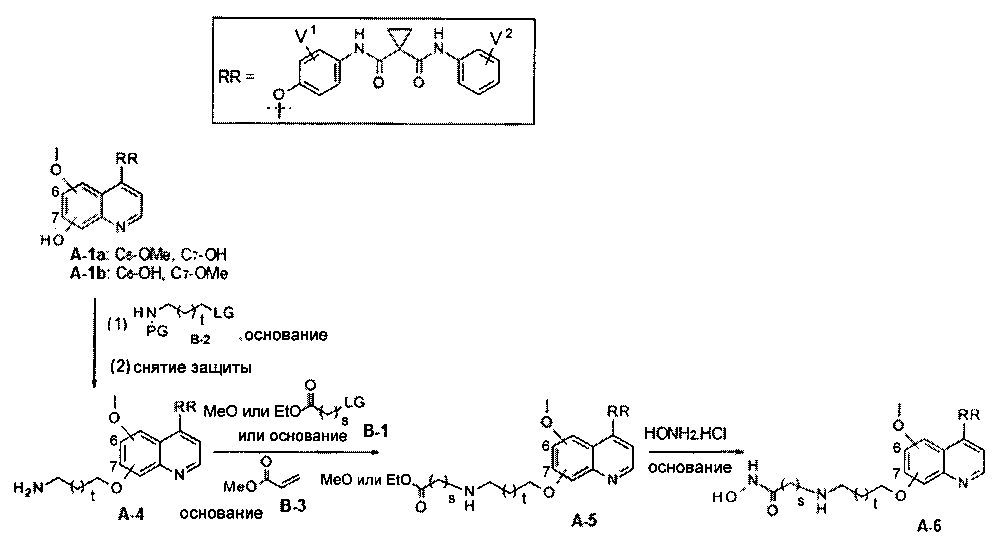
где
t равен от 0 до 4;
s равен от 1 до 6;
каждый из V1 и V2 независимо представляет собой галоген;
LG представляет собой общепринятую в области органической химии уходящую группу и представляет собой любую из F, Cl, Br, I, MsO, TsO или TfO;
PG представляет собой общепринятую в области органической химии защитную группу и представляет собой Boc или CBZ.
взаимодействие соединения формулы А-1а или А-1b с соединением формулы В-4 в присутствии основания с последующей обработкой HCl или TFA (трифторуксусная кислота) с получением промежуточного соединения формулы А-7;
и взаимодействие промежуточного соединения формулы А-7 с соединением формулы В-1 в присутствии основания с последующей обработкой гидрохлоридом гидроксиламина в присутствии основания с получением соединения формулы А-8;
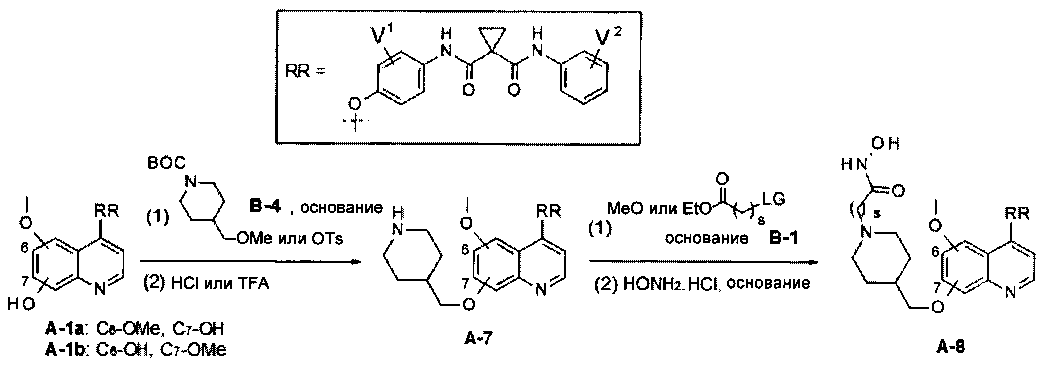
каждый из V1 и V2 независимо представляет собой галоген;
s равен от 1 до 6.
(1) пероральная форма; (2) инъекционная форма; и (3) форма для назальной ингаляции.

Комментарии