Применение лекарственного препарата традиционной китайской медицины для получения лекарственного препарата для предупреждения и/или лечения болезни крона - RU2655797C2
Код документа: RU2655797C2
Чертежи


Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области традиционной китайской медицины (ТСМ). Более конкретно, настоящее изобретение относится к применению лекарственного препарата традиционной китайской медицины в составе лекарственного препарата для предупреждения или лечения болезни Крона.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Болезнь Крона представляет собой тип воспалительного заболевания кишечника. Как правило, в толстой кишке, тонком кишечнике или желудке пациента наблюдается ряд симптомов, например, воспаление, гиперемия или лимфатический отек. Главное отличие от другого воспалительного заболевания кишечника, язвенного колита (UC), заключается в локализации воспаления и в воспалении как таковом. С точки зрения гистопатологии, может быть поражен любой участок пищеварительной системы, например, тонкий кишечник, толстая кишка, желудок и пищевод, и при этом типичная локализация включает терминальный отдел подвздошной кишки, и прилегающий сегмент толстой кишки, и правую половину толстой кишки. Однако UC возникает только в толстой и прямой кишке, часто в прямой и сигмовидной кишке. С точки зрения микроскопии, болезнь Крона может поражать всю внутреннюю стенку кишечника, в то время как UC ограничивается слизистой оболочкой.
Болезнь Крона является хроническим и рецидивирующим заболеванием. Поскольку причина неизвестна, эффективные терапевтические лекарственные средства все еще не разработаны. В настоящее время, лекарственные средства, применяемые для лечения болезни Крона, главным образом, включают глюкокортикоиды, салициловую кислоту, иммунодепрессанты, антибиотики, метотрексат и биологические средства (например, инфликсимаб). Несмотря на то, что эти лекарственные средства характеризуются доказанным эффектом, связанным с изменением естественного развития заболевания, они не могут полностью облегчить состояние заболевания и снизить частоту возникновения осложнений. Кроме того, химические препараты глюкокортикоидов и иммунодепрессантов часто приводят к выраженной нежелательной реакции, и при этом длительное применение, вероятно, будет вредным для организма.
В этом случае, специалисты в данной области техники возлагают надежды на разработку эффективных лекарственных препаратов традиционной китайской медицины, применяемых для лечения болезни Крона, с помощью методики TCM. К примеру, в патенте Китая (CN 102716383A) раскрыта композиция TCM, полученная с использованием 15 сырьевых лекарственных препаратов в соответствии с составом. Поскольку в композиции присутствовало большое количество сырьевых лекарственных препаратов, их рецептура была слишком сложной для того, чтобы сделать ее подходящей для промышленного получения. В патенте Китая (CN 102048728A) раскрыто применение производных артемизинина для получения лекарственного препарата для лечения болезни Крона. Тем не менее, как раскрыто в описании, производные артемизинина применялись для поддерживающего лечения. Иными словами, производные артемизинина не могли полностью вылечить болезнь Крона.
В патенте Китая (CN 1192787C) раскрыт препарат TCM, применяемый для лечения UC. С помощью дальнейших исследований впервые было обнаружено, что препарат ТСМ оказывает очень хороший эффект в отношении болезни Крона без существенной нежелательной реакции. В данном документе вышеупомянутая литература включена в текст во всей полноте посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение применения препарата ТСМ при получении лекарственного препарата для предупреждения и/или лечения болезни Крона. Препарат содержит сырьевые материалы, такие как 1-10% по массе драконовой крови (Xuejie), 15-40% по массе корня пиона красного (Chi Shao), 1-20% по массе натурального индиго (Qing Dai), 1-10% по массе красного галлуазита (Chi Shi Zhi), 15-40% по массе кашу (Er Cha), 1-10% по массе жженых квасцов (Ku Fan), 5-30% по массе корневища блетиллы (Bai Ji) и 1-10% по массе каламина (Lu Gan Shi).
Другой целью настоящего изобретения является обеспечение применения препарата TCM при получении лекарственного препарата для предупреждения и/или лечения внекишечных проявлений и осложнений болезни Крона, таким образом, с обеспечением существенного ослабления внекишечных проявлений и осложнений болезни Крона. Препарат содержит сырьевые материалы, такие как 1-10% по массе драконовой крови (Xuejie), 15-40% по массе корня пиона красного (Chi Shao), 1-20% по массе натурального индиго (Qing Dai), 1-10% по массе красного галлуазита (Chi Shi Zhi), 15-40% по массе кашу (Er Cha), 1-10% по массе жженых квасцов (Ku Fan), 5-30% по массе корневища блетиллы (Bai Ji) и 1-10% по массе каламина (Lu Gan Shi).
Другой целью настоящего изобретения является обеспечение способа предупреждения и/или лечения болезни Крона. Способ предусматривает введение пациенту, нуждающемуся в этом, профилактического и/или терапевтического количества препарата TCM или лекарственной композиции, содержащей препарат TCM.
В соответствии с настоящим изобретением препарат TCM является пригодным для лечения болезни Крона при условии, что его доза достигает уровня эффективной дозы один или несколько раз в день, предпочтительно один раз в день. Если препарат TCM применяется для предупреждения болезни Крона, его доза может быть снижена при определенных условиях.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
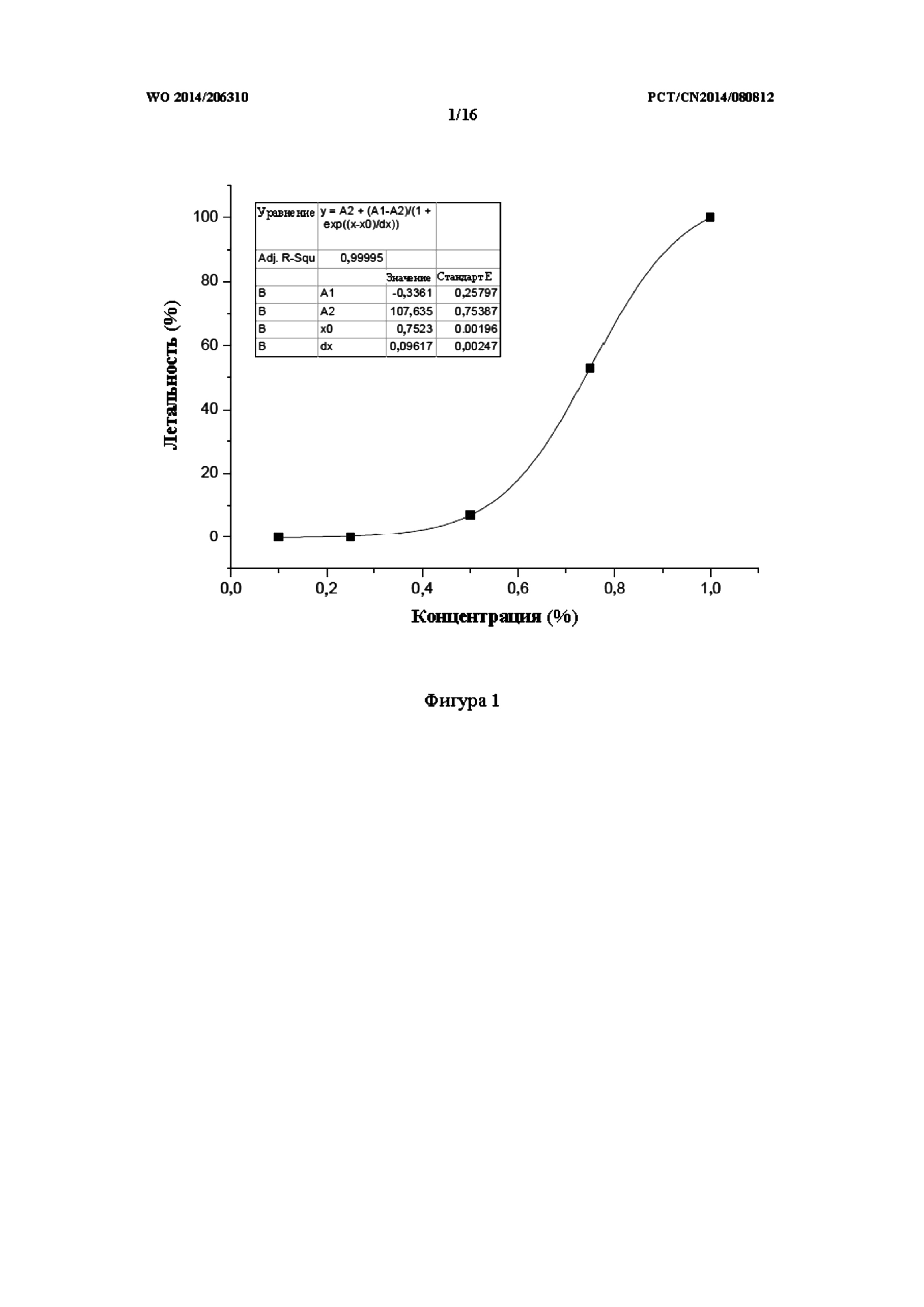
На фиг. 1 показана кривая зависимости концентрация-летальность для препарата TCM.
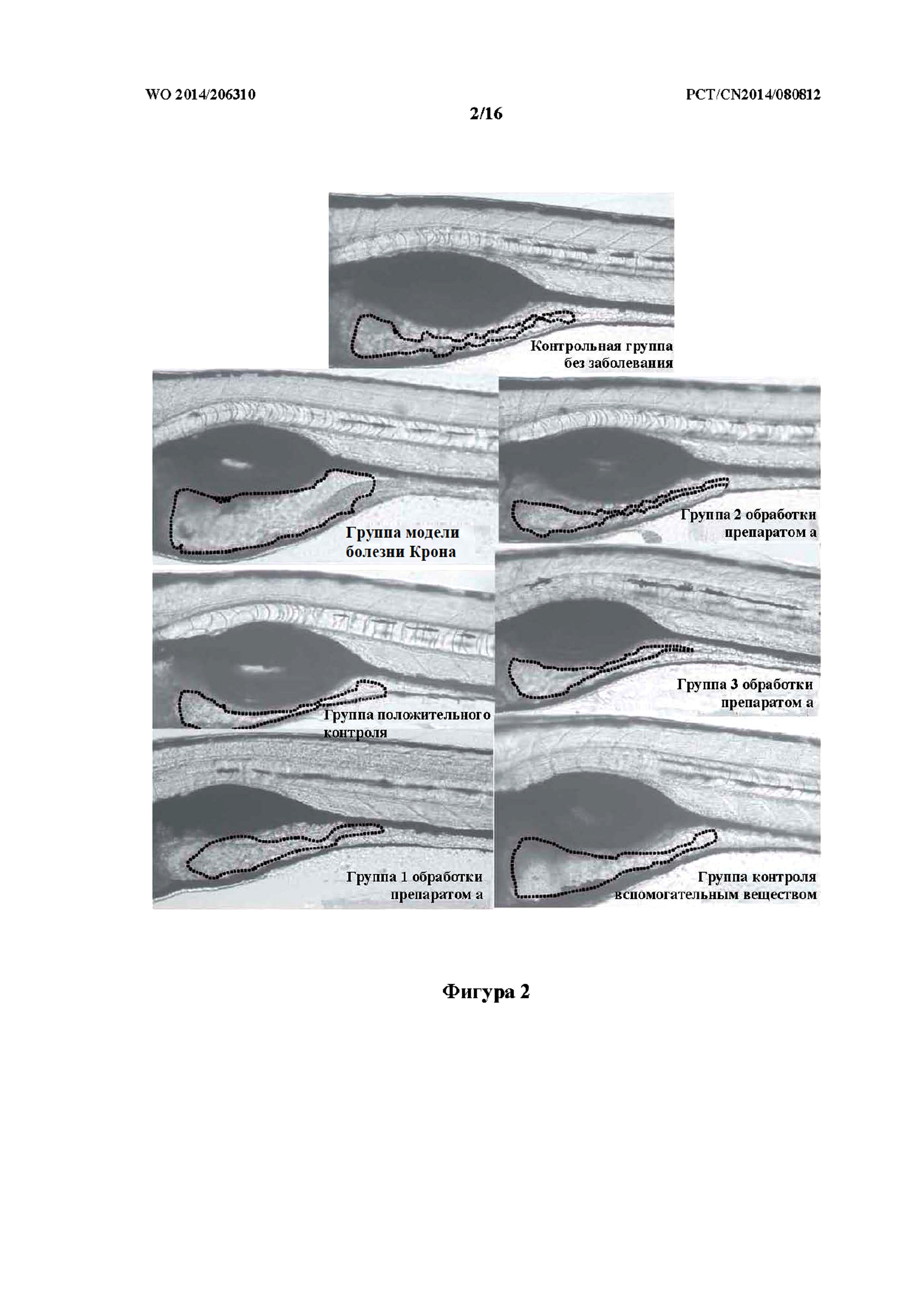
На фиг. 2 показан кишечник данио-рерио в группе обработки, группе модели болезни Крона и контрольной группе без заболевания.
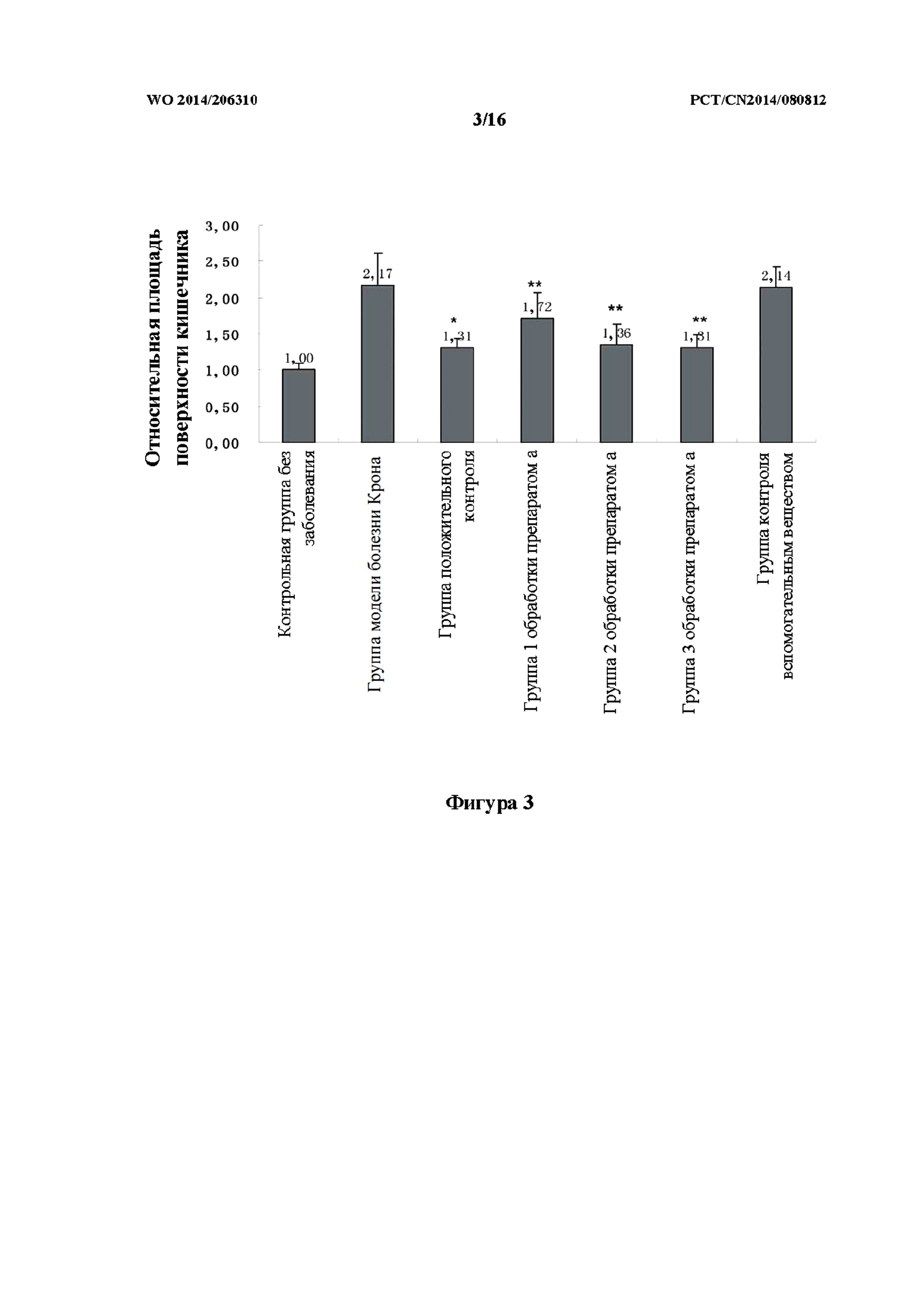
На фиг. 3 показан эффект улучшения в отношении расширения кишечника в группе с болезнью Крона при введении каждого из исследуемых лекарственных средств.
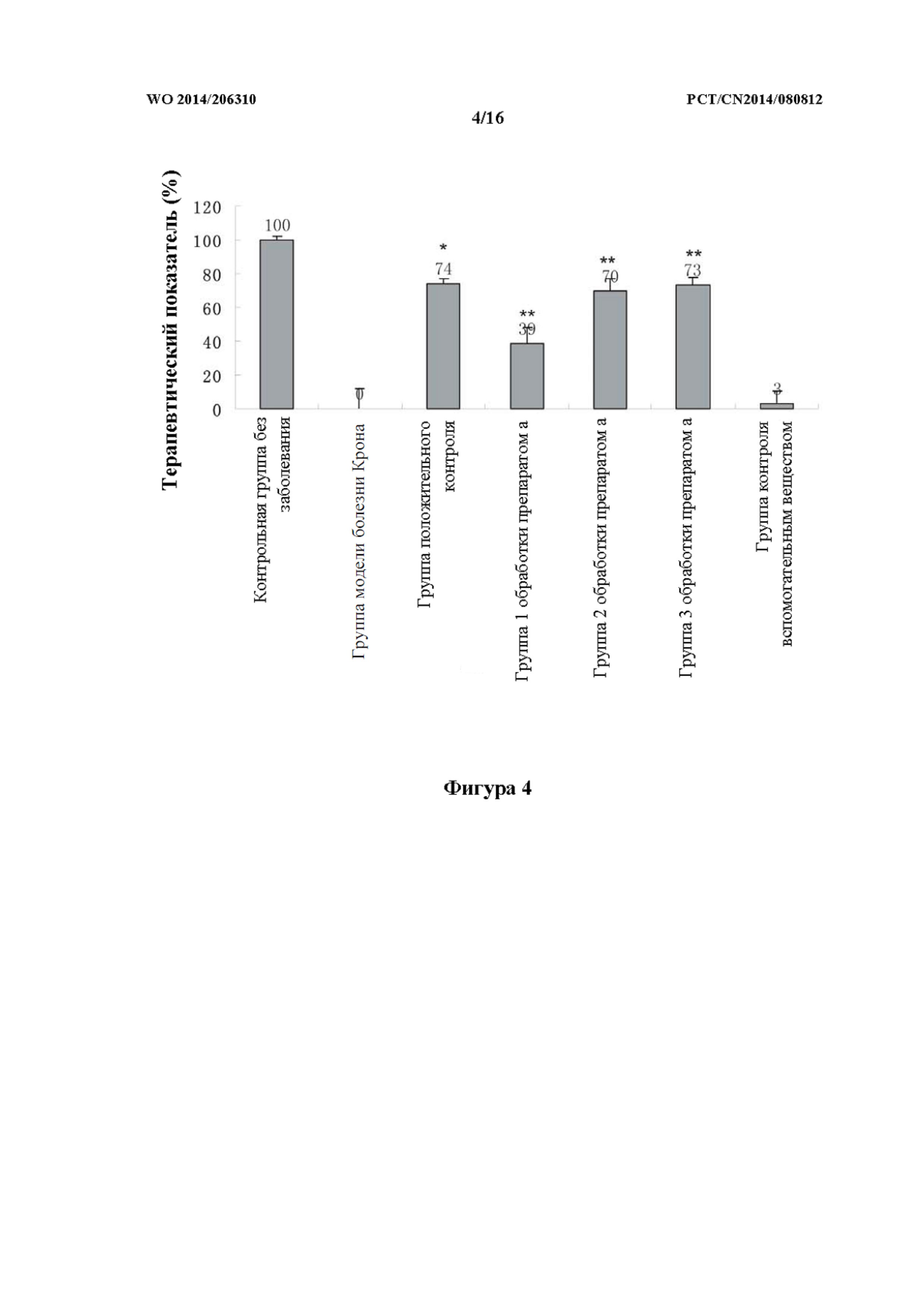
На фиг. 4 показана терапевтическая эффективность каждого из исследуемых лекарственных средств исходя из площади поверхности кишечника в группе с болезнью Крона.
На фиг. 5 показано распределение нейтрофилов в ткани кишечника в группах исследуемого лекарственного средства, группе модели болезни Крона и контрольной группе. (Участок, обозначенный серой линией, представляет собой кишечник данио-рерио, а обозначение в виде белой яркой точки представляет собой нейтрофил).
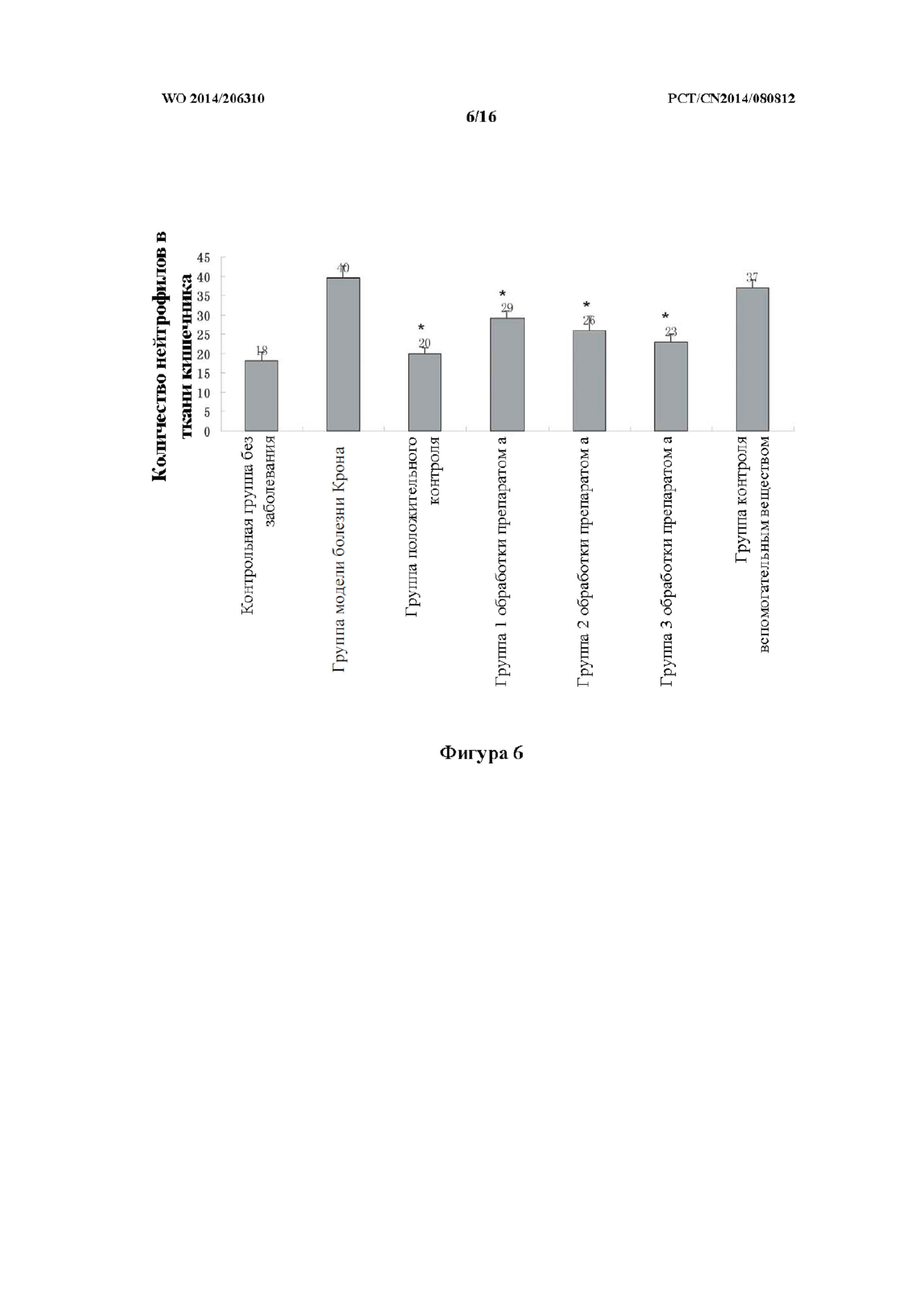
На фиг. 6 показан эффект в отношении количества нейтрофилов в ткани кишечника в группе модели болезни Крона при введении каждого из исследуемых лекарственных средств.
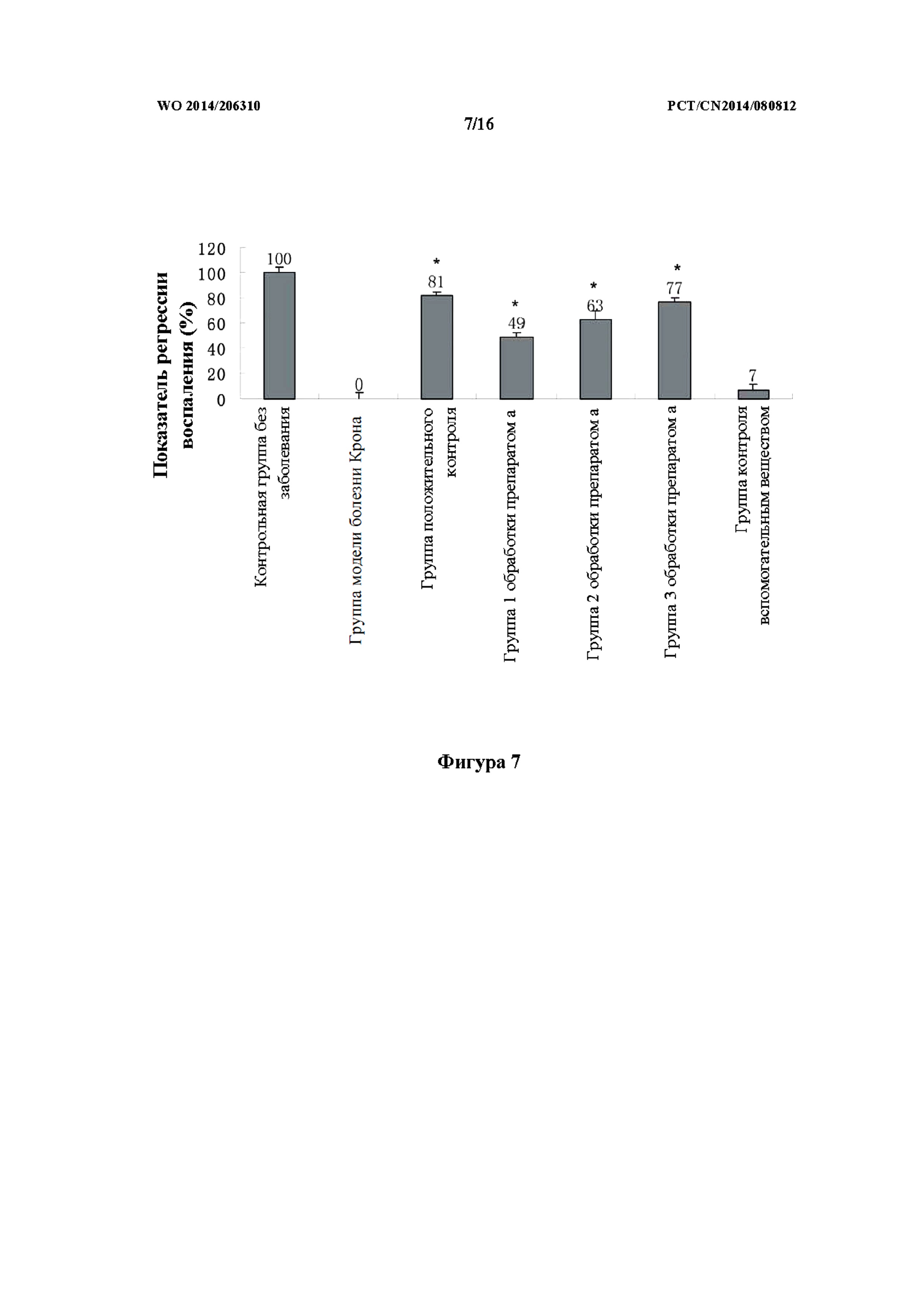
На фиг. 7 показан эффект в отношении регрессии воспаления в группе с болезнью Крона при введении каждого из исследуемых лекарственных средств.
На фиг. 8 показан срез ткани кишечника для группы исследуемого лекарственного средства, группы модели болезни Крона и контрольной группы. (Стрелки указывают на кишечник данио-рерио, при этом увеличение левого и правого изображений составляет 20× и 40×, соответственно).
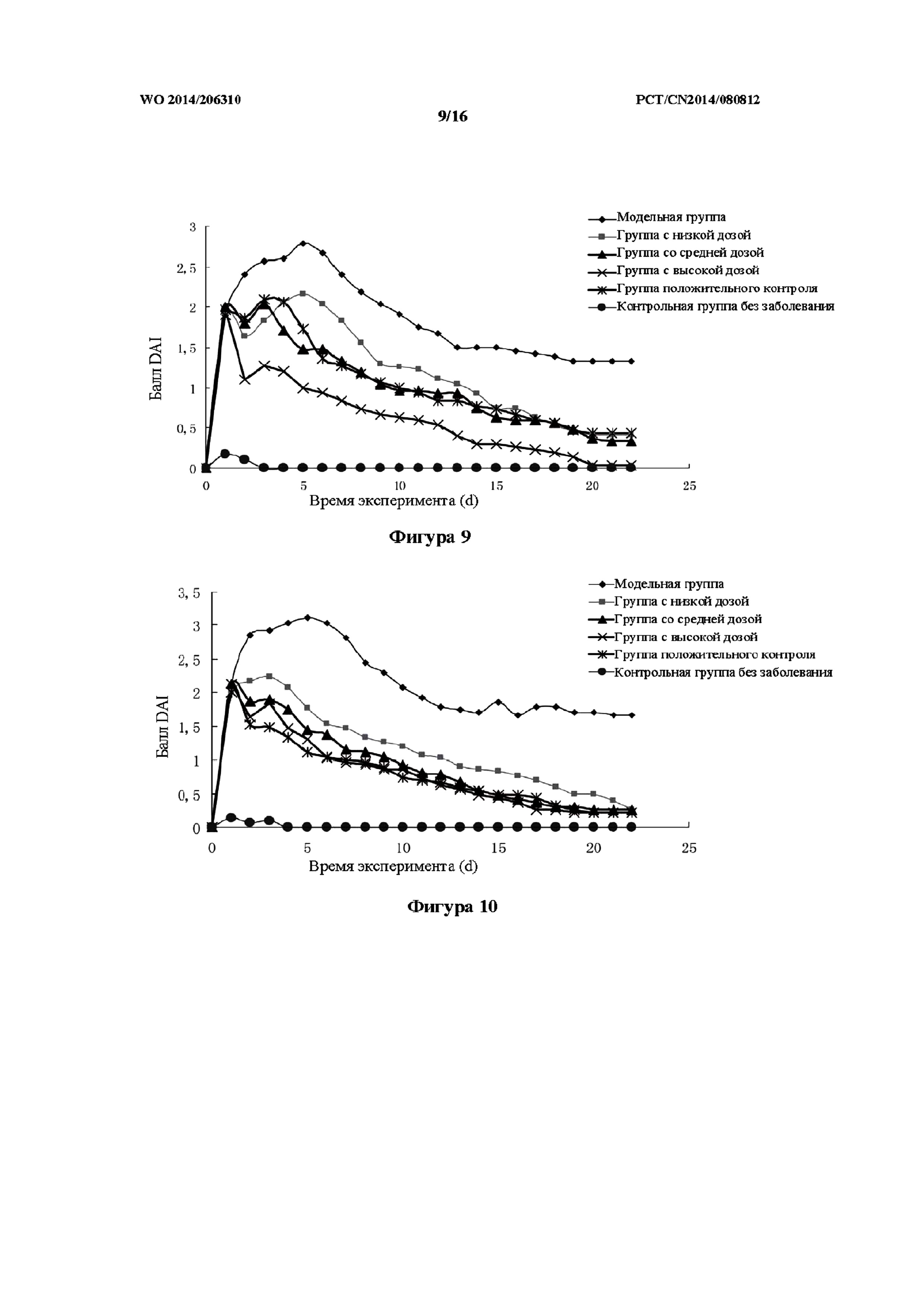
На фиг. 9 показан эффект, связанный с баллами индекса активности заболевания (DAI), в модели TNBS на крысах, которым препарат j TCM вводили в толстую кишку (то есть группа с низкой дозой, средней дозой и высокой дозой).
На фиг. 10 показан эффект, связанный с баллами индекса активности заболевания (DAI), в модели TNBS на крысах, которым препарат j TCM вводили внутрижелудочно (то есть группа с низкой дозой, средней дозой и высокой дозой).
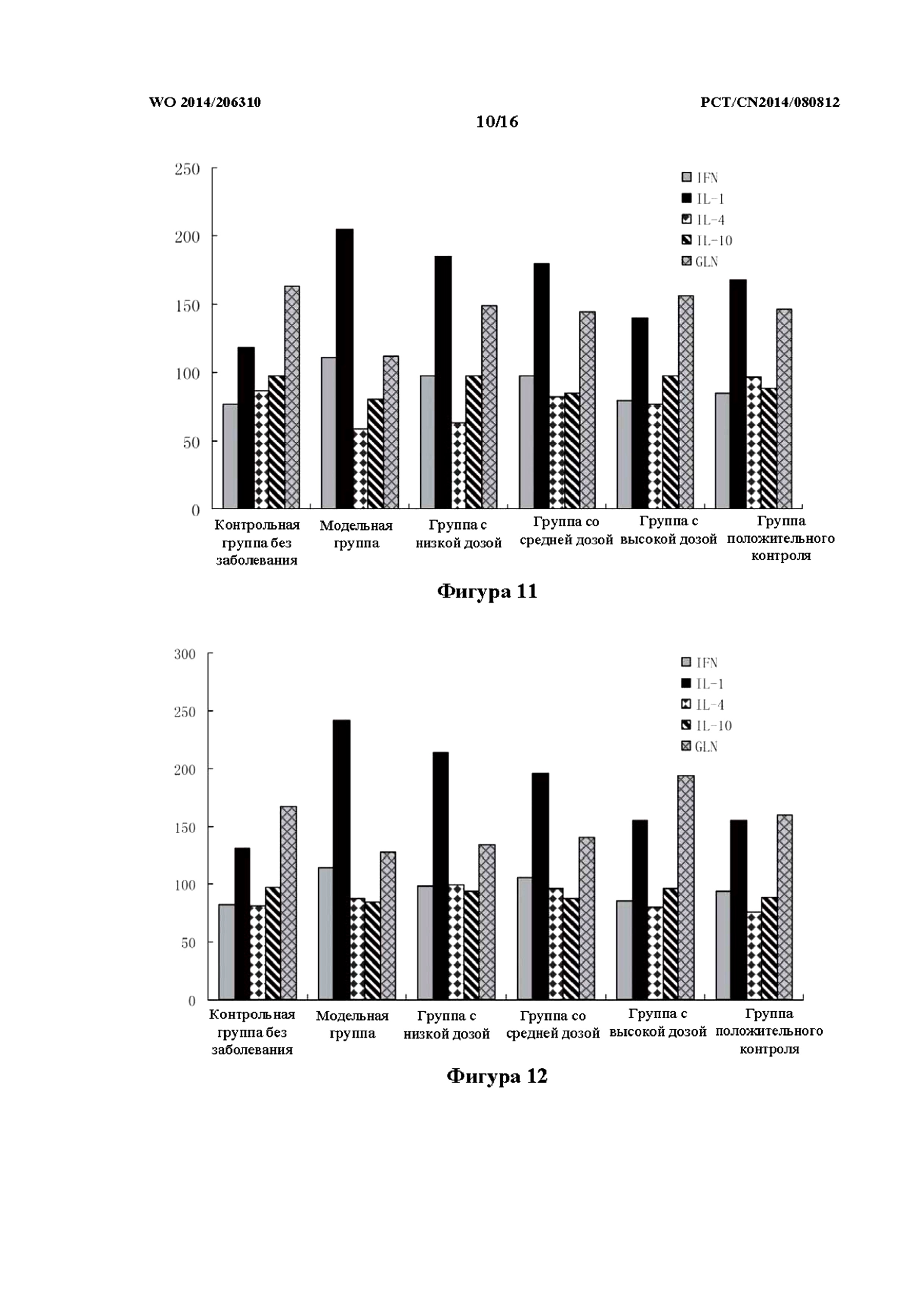
На фиг. 11 показан эффект в отношении содержания в сыворотке IFN-γ, IL-1, IL-4, IL-10 и Gln (глутамина) слизистой оболочки кишечника в модели TNBS на крысах, которым препарат j TCM вводили в толстую кишку (то есть группа с низкой дозой, средней дозой и высокой дозой).
На фиг. 12 показан эффект в отношении содержания в сыворотке IFN-γ, IL-1, IL-4, IL-10 и Gln в модели TNBS на крысах, которым препарат j TCM вводили внутрижелудочно (то есть группа с низкой дозой, средней дозой и высокой дозой).
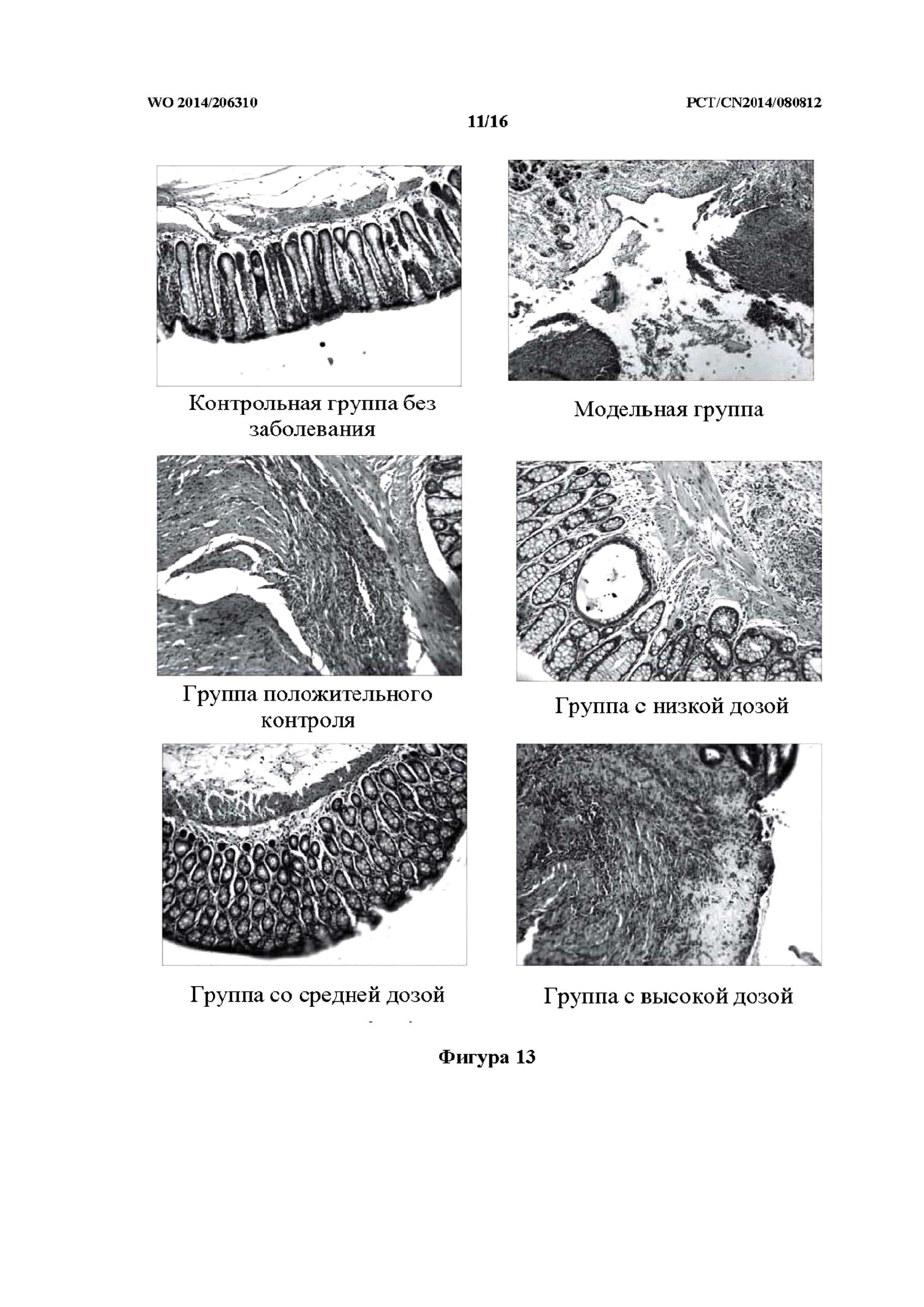
На фиг. 13 показаны фотографии патологических изменений у крыс контрольной группы без заболевания, модельной группы, группы положительного контроля и групп исследуемого лекарственного средства, которым препарат j TCM вводили в толстую кишку (то есть группа с низкой дозой, средней дозой и высокой дозой).
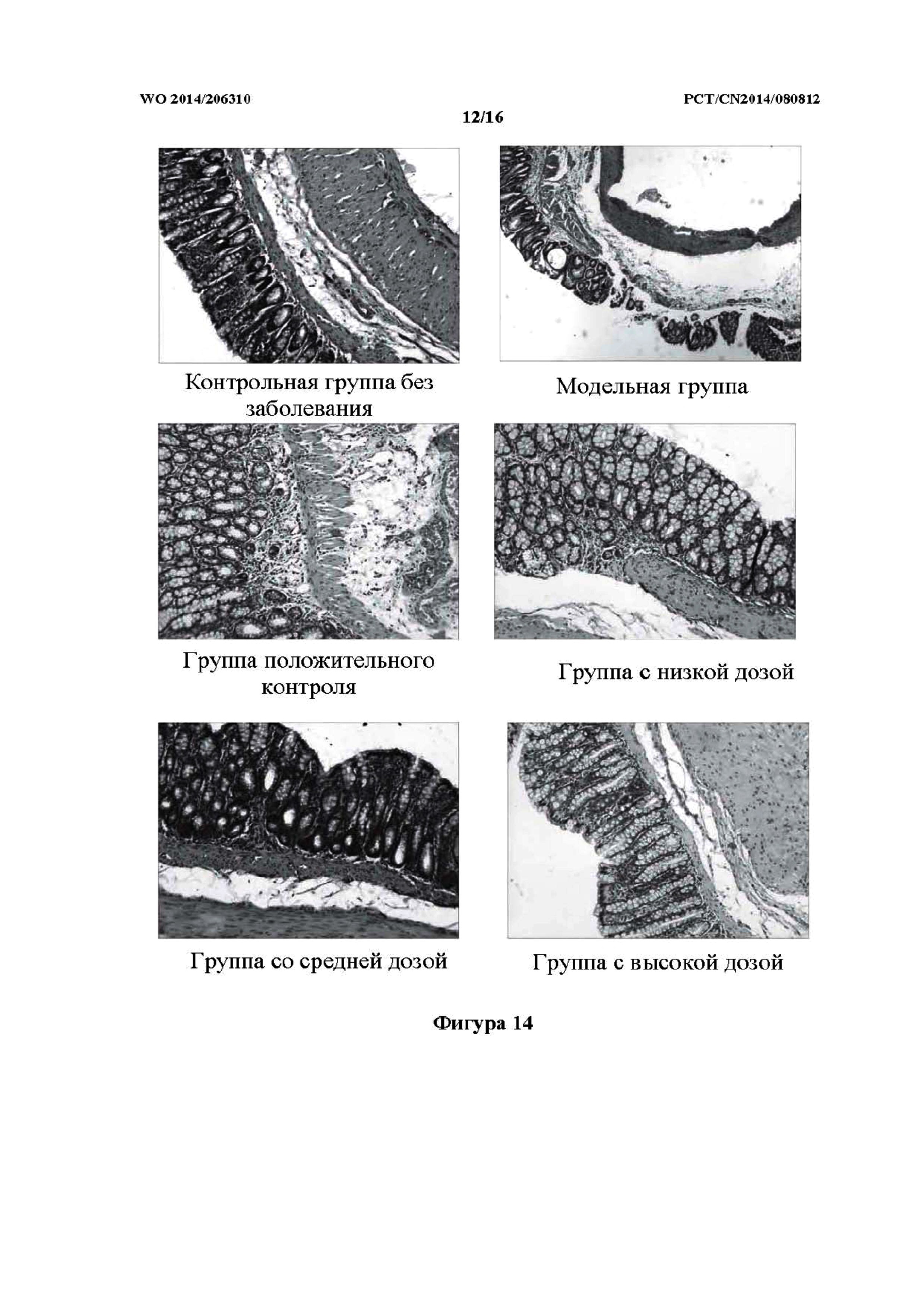
На фиг. 14 показаны фотографии патологических изменений у крыс контрольной группы без заболевания, модельной группы, группы положительного контроля и групп исследуемого лекарственного средства, которым препарат j TCM вводили внутрижелудочно (то есть группа с низкой дозой, средней дозой и высокой дозой).
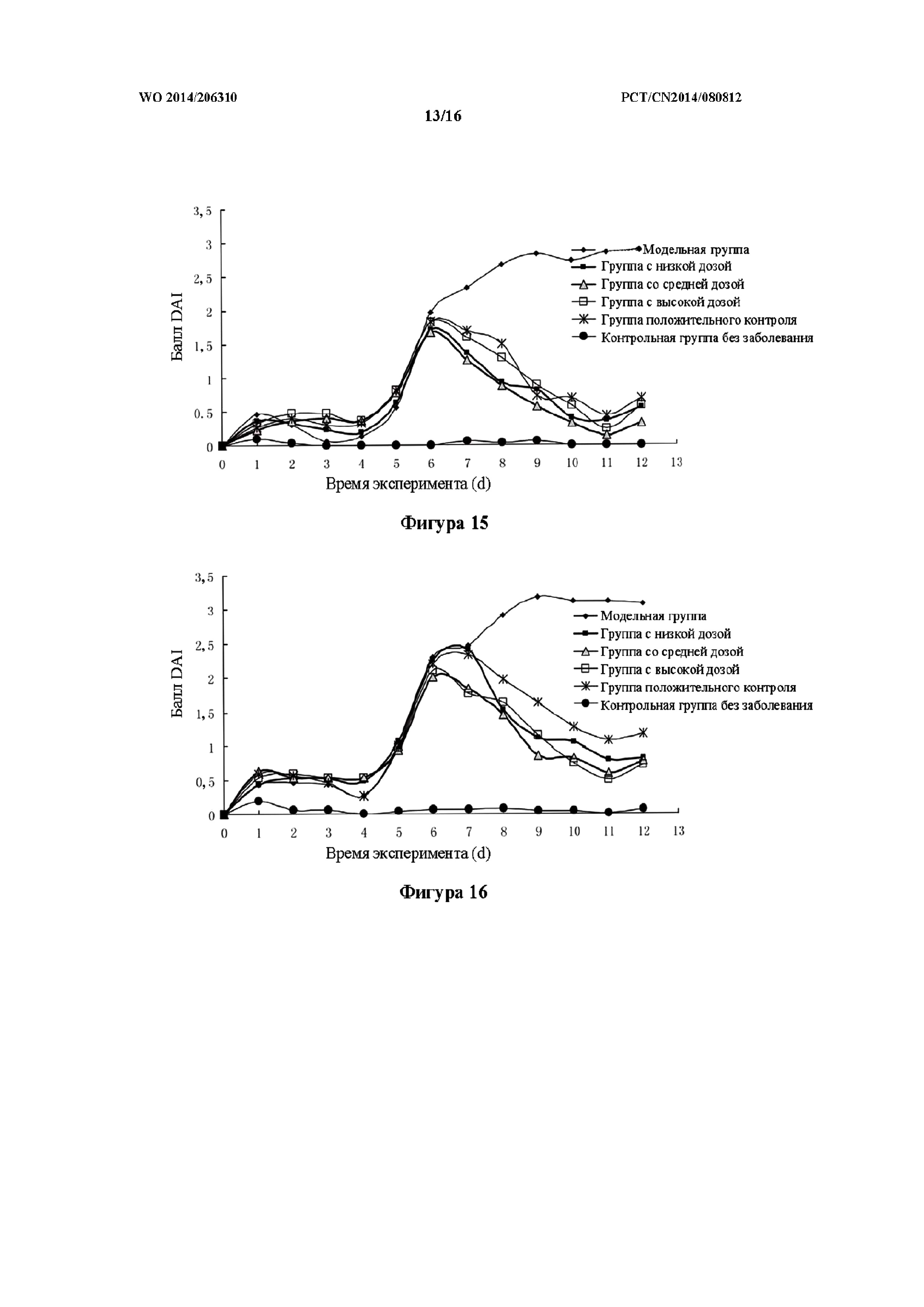
На фиг. 15 показан эффект в отношении баллов DAI в модели OXZ на крысах, которым препарат k TCM вводили внутрижелудочно (то есть группа с низкой дозой, средней дозой и высокой дозой).
На фиг. 16 показан эффект в отношении баллов DAI в модели OXZ на крысах, которым препарат k TCM вводили в толстую кишку (то есть группа с низкой дозой, средней дозой и высокой дозой).
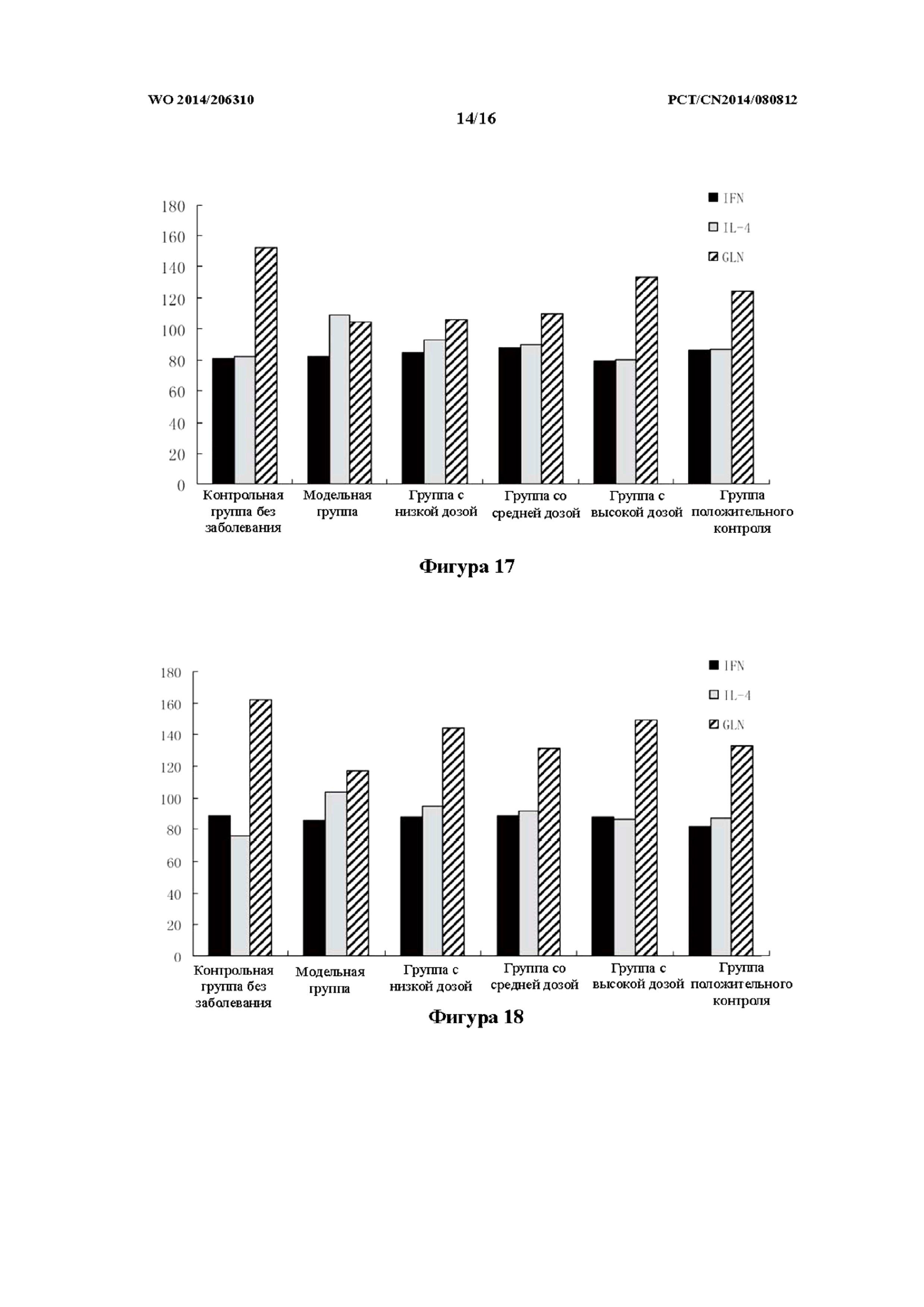
На фиг. 17 показан эффект в отношении содержания в сыворотке IFN-γ, IL-4 и Gln слизистой оболочки кишечника в модели OXZ на крысах, которым препарат k TCM вводили в толстую кишку (то есть группа с низкой дозой, средней дозой и высокой дозой).
На фиг. 18 показан эффект в отношении содержания в сыворотке IFN-γ, IL-4 и Gln слизистой оболочки кишечника в модели OXZ на крысах, которым препарат k TCM вводили внутрижелудочно (то есть группа с низкой дозой, средней дозой и высокой дозой).
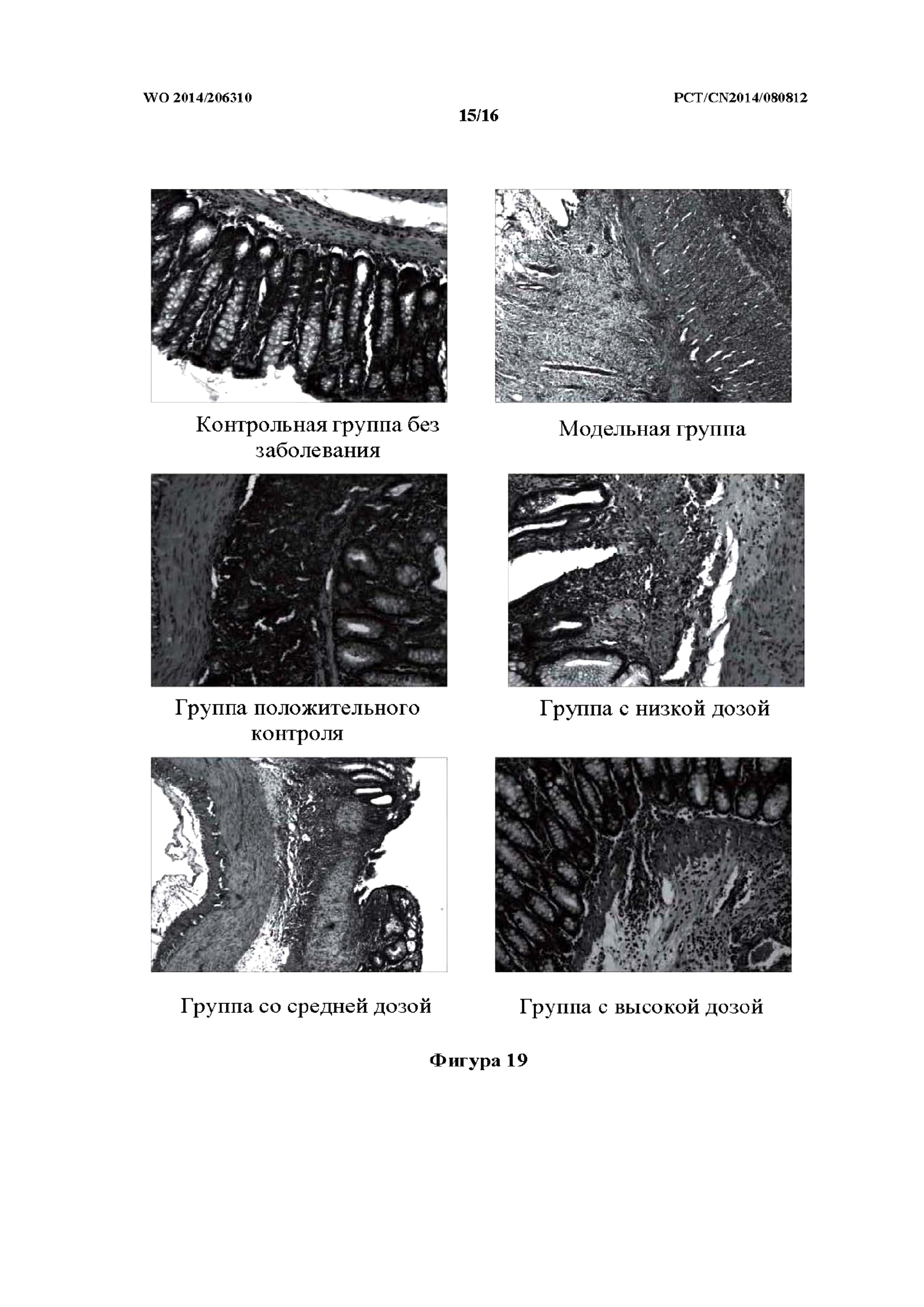
На фиг. 19 показаны фотографии патологических изменений у крыс контрольной группы без заболевания, модельной группы, группы положительного контроля и групп исследуемого лекарственного средства, которым препарат k TCM вводили в толстую кишку (то есть группа с низкой дозой, средней дозой и высокой дозой).
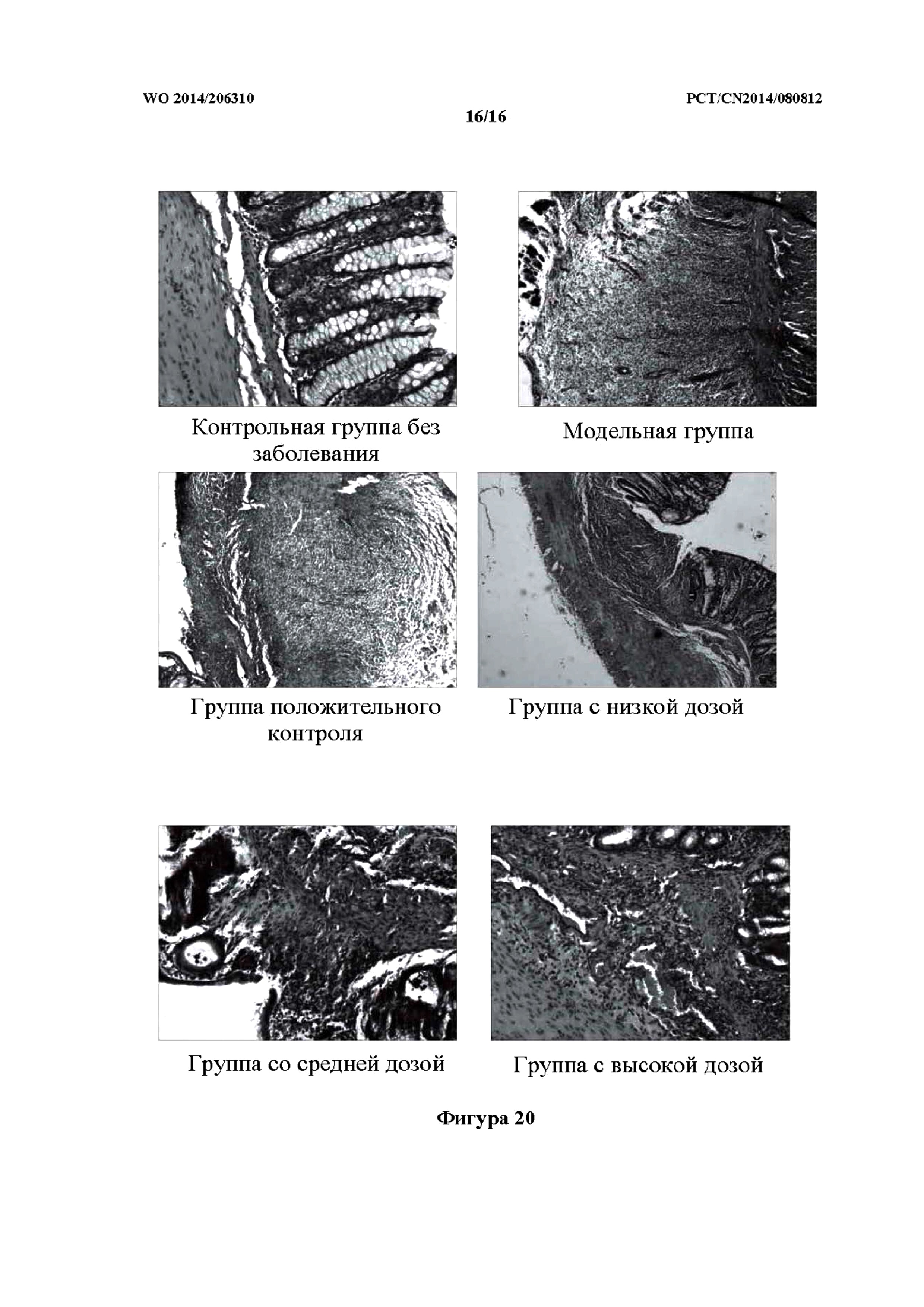
На фиг. 20 показаны фотографии патологических изменений у крыс контрольной группы без заболевания, модельной группы, группы положительного контроля и групп исследуемого лекарственного средства, которым препарат k TCM вводили ректально (то есть группа с низкой дозой, средней дозой и высокой дозой).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение относится к применению препарата ТСМ при получении лекарственного препарата для предупреждения и/или лечения болезни Крона. Препарат содержит сырьевые материалы, такие как 1-10% по массе драконовой крови (Xuejie), 15-40% по массе корня пиона красного (Chi Shao), 1-20% по массе натурального индиго (Qing Dai), 1-10% по массе красного галлуазита (Chi Shi Zhi), 15-40% по массе кашу (Er Cha), 1-10% по массе жженых квасцов (Ku Fan), 5-30% по массе корневища блетиллы (Bai Ji) и 1-10% по массе каламина (Lu Gan Shi).
Предпочтительно препарат содержит сырьевые материалы, такие как 3-7% по массе драконовой крови, 25-35% по массе корня пиона красного, 5-15% по массе натурального индиго, 1-5% по массе красного галлуазита, 25-35% по массе кашу, 1-5% по массе жженых квасцов, 10-20% по массе корневища блетиллы и 1-5% по массе каламина.
Наиболее предпочтительно препарат содержит сырьевые материалы, такие как 5,1% по массе драконовой крови, 30,3% по массе корня пиона красного, 10,1% по массе натурального индиго, 3% по массе красного галлуазита, 30,3% по массе кашу, 3% по массе жженых квасцов, 15,2% по массе корневища блетиллы и 3% по массе каламина.
В другом варианте осуществления настоящее изобретение относится к применению препарата ТСМ при получении лекарственного препарата для предупреждения и/или лечения внекишечных проявлений и осложнений болезни Крона.
В предпочтительном варианте осуществления осложнения болезни Крона включают один или несколько видов непроходимости кишечника, кишечный свищ, массивное кровотечение из нижних отделов желудочно-кишечного тракта, прободение кишечника, сепсис, абдоминальный абсцесс и заболевания заднего прохода.
В другом предпочтительном варианте осуществления внекишечные проявления болезни Крона включают мукозит слизистой оболочки полости рта, например, афтозную язву; патологические изменения кожи, например, узловатую эритему (EN), гангренозную пиодермию (PG) и неспецифическое кожное высыпание; патологические изменения глаза, например, иридоциклит и конъюнктивит; поражение суставов, например, боль в суставах и артрит; поражение печени и желчевыводящих путей, например, нарушение функции печени и желчный камень.
В соответствии с настоящим изобретением препарат TCM может быть получен в виде любой из фармацевтически приемлемых лекарственных форм, в том числе, но без ограничений: раствора для клизмы; таблетки, например, таблетки, покрытой сахарной оболочкой, таблетки, покрытой пленочной оболочкой и таблетки, покрытой кишечнорастворимой оболочкой; капсулы, например, твердой капсулы и мягкой капсулы; жидкости для перорального применения; буккальной таблетки; гранулы; растворимого порошка; пилюли; микропилюли; мелкого порошка, пастообразной массы, например, мазь и пластификатор; Dan; суспензии; порошка; раствора, например, для инъекций; суппозитория; крема; спрея; сухого порошка для ингаляции; аэрозоля; капель; пастилки и пластыря.
В соответствии с настоящим изобретением раствор для клизмы может быть получен с помощью способа, раскрытого в патенте Китая (CN1192787C). Лекарственные формы в виде таблетки, капсулы, жидкости для перорального применения, буккальной таблетки, гранулы, растворимого порошка, пилюли, микропилюли, мелкого порошка, пастообразной массы, Dan, суспензии, порошка, раствора, суппозитория, крема, спрея, сухого порошка для ингаляции, аэрозоля, капель, пастилки и пластыря могут быть получены с помощью общепринятых способов, известных из уровня техники.
В соответствии с настоящим изобретением раствор для клизмы включает общепринятые носители, например, разбавитель, смазывающее вещество и смачивающее вещество и т.д.
В соответствии с настоящим изобретением вводимые пероральным путем лекарственные формы препарата TCM включают общепринятые носители, например, один или несколько типов связывающего вещества, наполнитель, разбавитель, вещество для таблетирования, смазывающее вещество, вещество для улучшения распадаемости таблеток, краситель, вкусовое вещество, смачивающее вещество. При необходимости таблетка может быть покрыта оболочкой.
В соответствии с настоящим изобретением наполнители включают целлюлозу, маннит, лактозу и другие аналогичные наполнители. Надлежащие вещества для улучшения распадаемости таблеток включают крахмал, поливинилпирролидон (PVP) и производное крахмала (например, гидроксиэтилкрахмал натрия). Надлежащие смазывающие вещества включают стеарат магния. Надлежащие фармацевтически приемлемые смачивающие вещества включают додецилсульфат натрия.
В соответствии с настоящим изобретением препараты в виде твердого вещества для перорального применения на основе препаратов TCM могут быть получены с помощью обычного способа перемешивания, наполнения, таблетирования или гранулирования и т.д. Перемешивание повторяют, для того чтобы активные фармацевтические ингредиенты (API) были равномерно распределены в конечной лекарственной форме.
В соответствии с настоящим изобретением жидкие препараты для перорального применения представляют собой лекарственные формы в виде водорастворимой или растворимой в масле суспензии, раствора, эмульсии, сиропа, или настойки, или сухого порошка, который обычно разводят водой или другим пригодным растворителем перед клиническим применением. Жидкий препарат для перорального применения может содержать общепринятые вспомогательные вещества, например, суспендирующее вещество, такое как сорбит, сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, гидроксиметилцеллюлозу, гель стеарата алюминия или гидрогенизированный пищевой жир; эмульгирующее вещество, например, лецитин, сорбитанмоноолеат или гуммиарабик; вспомогательное вещество, отличное от водного (включая пищевое масло), например, миндальное масло, фракционированное кокосовое масло, сложноэфирное масло, пропиленгликоль или этанол, а также консервант, например, метилпарабен, нипазол, сорбиновую кислоту. При необходимости может быть включено вкусовое вещество или краситель.
В соответствии с настоящим изобретением единица препарата для инъекций содержит препарат TCM в качестве API и асептические вспомогательные вещества. Является ли API растворенным или суспендированным в жидкости, зависит от типа и концентрации вспомогательных веществ. Как правило, раствор получают посредством растворения препарата TCM в качестве API во вспомогательных веществах, стерилизации, заполнения соответствующего флакона или ампулы и герметизации. При необходимости могут быть добавлены некоторые фармацевтически приемлемые вспомогательные средства, например, местный анестетик, консервант и буферное вещество. Для того чтобы улучшить стабильность перед заполнением во флакон, этот препарат TCM согласно настоящему изобретению может быть заморожен и обработан в вакууме с целью удаления воды.
В соответствии с настоящим изобретением препарат TCM может быть получен путем необязательного добавления фармацевтически приемлемых вспомогательных веществ. Вспомогательные вещества выбраны из следующих: сахароспирт, например, маннит, сорбит, ксилит; аминокислота, например, гидрохлорид цистеина, метионин, глицин; витамин С; двунатриевая соль ЭДТА, ЭДТА кальция-натрия; неорганическая соль, например, карбонат, ацетат, фосфат одновалентного щелочного металла или его водный раствор, хлорид натрия, хлорид калия, пиросульфит натрия, бисульфит натрия, тиосульфат натрия; карбонат кальция, бикарбонат кальция; стеарат, например, стеарат кальция, стеарат магния; неорганическая кислота, например, соляная, серная, фосфорная кислота; органическая кислота, например, уксусная кислота; соль органической кислоты, например, лактат натрия; полисахарид, целлюлоза и ее производные, например, мальтоза, глюкоза, фруктоза, декстран, сахароза, лактоза, циклодекстрин (β-циклодекстрин), крахмал, меркаптоуксусная кислота; производное кремния; альгинат; желатин; PVP (поливинилпирролидон), глицерин; Tween-80, агаровый гель; поверхностно-активное вещество; фосфолипиды; каолин; порошок талька и т.д.
В соответствии с настоящим изобретением применение и доза препарата ТСМ зависит от клинического состояния пациента. В предпочтительном примере препарат TCM для лечения болезни Крона применяют в виде лекарственной формы раствора для клизмы, который вводят пациентам один или несколько раз в день, предпочтительно один раз в день, в количестве 60-80 мл за один раз, предпочтительно 80 мл за один раз. Доза препарата TCM может быть снижена при определенных условиях при его применении для предупреждения болезни Крона, например, но без ограничения, 1/2, 1/3 и 1/4 от терапевтически эффективной дозы.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Техническая схема согласно настоящему изобретению далее будет представлена более подробно с помощью следующих примеров получения и экспериментальных примеров. Однако следует понимать, что объем правовой охраны согласно настоящему изобретению не ограничивается этими примерами. В данном документе препарат TCM получен посредством способа, раскрытого в патенте Китая (CN 1192787 C).
Пример получения 1
Для получения препарата a TCM использовали сырьевые материалы при следующих значениях массы:
14 г драконовой крови, 84 г корня пиона красного, 28 г натурального индиго, 8,4 г красного галлуазита, 84 г кашу, 8,4 г жженых квасцов, 42 г корневища блетиллы и 8,4 г каламина.
Пример получения 2
Для получения препарата b TCM использовали сырьевые материалы при следующих значениях массы:
22,1 г драконовой крови, 69 г корня пиона красного, 25 г натурального индиго, 25 г красного галлуазита, 69 г кашу, 17 г жженых квасцов, 28 г корневища блетиллы и 22,1 г каламина.
Пример получения 3
Для получения препарата c TCM использовали сырьевые материалы при следующих значениях массы:
19 г драконовой крови, 67 г корня пиона красного, 27,1 г натурального индиго, 19 г красного галлуазита, 67 г кашу, 14,1 г жженых квасцов, 47 г корневища блетиллы и 17 г каламина.
Пример получения 4
Для получения препарата d TCM использовали сырьевые материалы при следующих значениях массы:
11 г драконовой крови, 91 г корня пиона красного, 19 г натурального индиго, 14 г красного галлуазита, 91 г кашу, 12,2 г жженых квасцов, 28 г корневища блетиллы и 11 г каламина.
Пример получения 5
Для получения препарата e TCM использовали сырьевые материалы при следующих значениях массы:
8 г драконовой крови, 97 г корня пиона красного, 14 г натурального индиго, 6 г красного галлуазита, 97 г кашу, 2,2 г жженых квасцов, 47 г корневища блетиллы и 6 г каламина.
Пример получения 6
Для получения препарата f TCM использовали сырьевые материалы при следующих значениях массы:
3 г драконовой крови, 42 г корня пиона красного, 16 г натурального индиго, 4 г красного галлуазита, 45 г кашу, 4 г жженых квасцов, 13 г корневища блетиллы и 5° г каламина.
Пример получения 7
Для получения препарата g TCM использовали сырьевые материалы при следующих значениях массы:
13 г драконовой крови, 56 г корня пиона красного, 23 г натурального индиго, 9 г красного галлуазита, 58 г кашу, 12 г жженых квасцов, 29 г корневища блетиллы и 9° г каламина.
Пример получения 8
Для получения препарата h TCM использовали сырьевые материалы при следующих значениях массы:
20 г драконовой крови, 71 г корня пиона красного, 35 г натурального индиго, 13 г красного галлуазита, 66 г кашу, 19 г жженых квасцов, 47 г корневища блетиллы и 13 г каламина.
Пример получения 9
Для получения препарата i TCM использовали сырьевые материалы при следующих значениях массы:
23 г драконовой крови, 95 г корня пиона красного, 44 г натурального индиго, 20 г красного галлуазита, 83 г кашу, 23 г жженых квасцов, 68 г корневища блетиллы и 19 г каламина.
Пример получения 10
Для получения препарата j TCM использовали сырьевые материалы при следующих значениях массы:
27 г драконовой крови, 110 г корня пиона красного, 56 г натурального индиго, 26 г красного галлуазита, 105 г кашу, 27 г жженых квасцов, 81 г корневища блетиллы и 25 г каламина.
Пример получения 11
Для получения препарата k TCM использовали сырьевые материалы при следующих значениях массы:
1 г драконовой крови, 16 г корня пиона красного, 1 г натурального индиго, 1 г красного галлуазита, 16 г кашу, 1 г жженых квасцов, 3 г корневища блетиллы и 1 г каламина.
Пример получения 12
Для получения препарата l TCM использовали сырьевые материалы при следующих значениях массы:
17 г драконовой крови, 40 г корня пиона красного, 20 г натурального индиго, 10 г красного галлуазита, 40 г кашу, 10 г жженых квасцов, 30 г корневища блетиллы и 10 г каламина.
Пример получения 13
Для получения препарата m TCM использовали сырьевые материалы при следующих значениях массы:
6 г драконовой крови, 94 г корня пиона красного, 20 г натурального индиго, 10 г красного галлуазита, 40 г кашу, 10 г жженых квасцов, 70 г корневища блетиллы и 10 г каламина.
Экспериментальный пример 1: предварительное исследование концентрации для оценки эффективности у данио-рерио в модели болезни Крона
К аквариумной воде, используемой для создания модели болезни Крона на данио-рерио линии AB дикого типа (1 л обратноосмотической воды с добавлением 200 мг быстрорастворимой морской соли с электропроводностью 480-510 мкСм/см, значением pH 6,9-7,2 и жесткостью, обусловленной наличием 53,7-71,6 мг/л CaCO3) добавляли препарат (a) ТСМ, полученный посредством способа из Примера 1, при концентрации 0,1%, 0,25%, 0,5%, 0,75% и 1% по объему. Вместе с этим была создана контрольная группа. 30 данио-рерио обрабатывали с применением каждой концентрации препарата (a), на протяжении этого периода ежедневно подсчитывали количество погибших данио-рерио и в то же время убирали погибшую рыбу. Связь между концентрацией препарата TCM и летальностью представлена в таблице 1, и при этом кривая зависимости концентрация-летальность представлена на фиг. 1.
Таблица 1: статистическая связь между концентрацией препарата a и летальностью
MNLC (максимальная нелетальная концентрация) препаратов TCM была рассчитана как 0,3% по объему с применением программного обеспечения OriginPro 8.0.
Экспериментальный пример 2: эффективность в модели болезни Крона на данио-рерио
Согласно результатам для концентраций, предварительно исследованных в экспериментальном примере 1, для оценки эффективности в модели болезни Крона на данио-рерио была представлена совокупность данных с 3 уровнями для группы обработки, соответственно, при объемных соотношениях 1/10 MNLC (0,03%), 1/3 MNLC (0,1%) и MNLC (0,3%). (Далее в данном документе сокращено как “группа 1 обработки препаратом a”, “группа 2 обработки препаратом a” и “группа 3 обработки препаратом a”). В то же время для исследования были созданы группа положительного контроля, контрольная группа без заболевания, группа модели болезни Крона и группа контроля вспомогательным веществом. В группе положительного контроля в аквариумной воде присутствовал преднизолон при конечной концентрации 10 мкМ. Для группы контроля вспомогательным веществом применяли вспомогательное вещество раствора для клизмы, раскрытое в патенте Китая (CN 1192787 C), включая добавление в аквариумную воду растворов PEG-400, содержащих трагакант и сорбат калия при объемной доле 0,3%. При этом раствор PEG-400 получали следующим способом: добавляли 1,5 г трагаканта и 2 г сорбата калия (с размером частиц 150 мкм) к 28 мл PEG.
Модель болезни Крона на данио-рерио получали с помощью TNBS (2,4,6-тринитробензолсульфоновой кислоты), главным образом, вызывающей воспаление. Для каждой группы случайным образом выбирали 30 данио-рерио. Спустя 48 часов после соответствующей обработки вышеуказанным препаратом (a) TCM (при трех концентрациях, упомянутых выше) в группе обработки, вышеуказанным преднизолоном в группе положительного контроля и вышеуказанным вспомогательным веществом в группе контроля вспомогательным веществом для наблюдения и получения фотографий из каждой группы случайным образом отбирали 10 рыб. Для анализа фотографий применяли программное обеспечение для анализа изображений. Кроме того, под микроскопом тщательно исследовали толщину слизистой оболочки кишечника, диаметр кишечника и площадь поверхности кишечника, причем осуществляли количественный анализ диаметра кишечника и площади поверхности кишечника. Для каждой группы терапевтический показатель исследуемого лекарственного средства для данио-рерио с болезнью Крона рассчитывали в соответствии с площадью поверхности кишечника. Формула расчета представлена следующим образом.
Терапевтический показатель (%) = [1 - (группа обработки - контрольная группа без заболевания)/(модельная группа - контрольная группа без заболевания)] × 100%.
Результаты статистического анализа были представлены как среднее значение ± SE. Для сравнения множества групп применяли дисперсионный анализ, а для сравнения двух групп применяли t-критерий Даннетта. Наблюдали статистически значимую разницу при p<0,05.
Как показано на фиг. 2 - фиг. 4, в контрольной группе без заболевания слизистая оболочка кишечника была целостной и с выраженными складками. В модельной группе (болезнь Крона) кишечник данио-рерио был расширен (выражено при помощи соотношения площади поверхности кишечника в модельной группе и в контрольной группе без заболевания, аналогично дальше), площадь поверхности кишечника увеличена, слизистая оболочка кишечника истончена, и при этом складки не наблюдались. В группе положительного контроля расширение кишечника данио-рерио было снижено, уменьшена площадь поверхности кишечника, и при этом складки кишечника в значительной степени восстанавливались. В группе 2 обработки и группе 3 обработки с применением препарата (a) TCM (препарат (a) вводили при концентрации 0,1% и 0,3%, соответственно), расширение кишечника данио-рерио было значительно снижено, площадь поверхности кишечника восстанавливалась до нормального значения, и при этом складки кишечника по существу восстанавливались. В группе контроля вспомогательным веществом у данио-рерио с болезнью Крона не наблюдалось никакого терапевтического эффекта.
Терапевтический показатель для преднизолона в группе положительного контроля в модели болезни Крона составлял 74 ± 3,40%, причем наблюдали статистически значимую разницу (p<0,01) по сравнению с модельной группой. В группе 1 обработки препаратом (a) при концентрации 0,3% наблюдали показатель частичного терапевтического ответа 39 ± 9,30%. В группах 2 и 3 обработки препаратом (a) терапевтический показатель составлял 70 ± 7,49% и 73 ± 4,81%, соответственно, причем наблюдали значительную статистически значимую разницу (p<0,001) по сравнению с модельной группой.
В таблице 2 представлен терапевтический показатель исследуемых лекарственных средств для данио-рерио в модели болезни Крона.
Таблица 2: терапевтический показатель исследуемых лекарственных средств для данио-рерио в модели болезни Крона
Примечание: по сравнению с модельной группой, * p<0,01,** p<0,001.
Как показано в таблице выше, препарат TCM характеризовался очень хорошим терапевтическим эффектом в отношении болезни Крона, и при этом такой терапевтический эффект в отношении болезни Крона был продемонстрирован даже при низкой концентрации.
Экспериментальный пример 3: эффект в отношении регрессии воспаления у данио-рерио в модели болезни Крона
Применяли способ, аналогичный способу для экспериментального примера 2, за исключением того, что использовали трансгенных данио-рерио с нейтрофилами с флуоресцентной меткой. В модели болезни Крона на трансгенных данио-рерио с нейтрофилами с флуоресцентной меткой к аквариумной воде добавляли препарат (a) TCM, полученный с помощью способа из примера 1, при объемной доле 0,03%, 0,1% и 0,3% для оценки эффекта препарата на регрессию воспаления в модели болезни Крона на данио-рерио.
Для количественного анализа распределения нейтрофилов в воспаленной ткани применяли программное обеспечение для анализа изображений. Показатель регрессии воспаления для исследуемых лекарственных средств в модели болезни Крона на данио-рерио рассчитывали исходя из количества нейтрофилов в кишечнике. Формула для расчета регрессии воспаления представлена следующим образом.
Показатель регрессии воспаления (%) = [1 - (группа обработки - контрольная группа без заболевания)/(модельная группа - контрольная группа без заболевания)] × 100%.
Результаты статистического анализа были представлены как среднее значение ± SE. Применяли дисперсионный анализ и t-критерий Даннетта. Наблюдали статистически значимую разницу при p<0,05.
Как показано на фиг. 5 - фиг. 7, некоторое количество нейтрофилов было обнаружено в ткани кишечника данио-рерио в контрольной группе без заболевания. В модели болезни Крона кишечник характеризовался выраженным расширением, также в ткани кишечника наблюдалась инфильтрация большого количества нейтрофилов, что указывало на сильное воспаление. В группе положительного контроля (преднизолон) количество нейтрофилов в ткани кишечника было существенно снижено. В группах 1, 2 и 3 обработки препаратом (a) TCM количество нейтрофилов было снижено. В группе контроля вспомогательным веществом все еще наблюдалось большое количество нейтрофилов, скопившихся в ткани кишечника.
Для преднизолона в группе положительного контроля показатель регрессии воспаления составлял 81 ± 2,48%, причем наблюдали статистически значимую разницу (p<0,01) по сравнению с модельной группой. Терапевтический показатель для групп 1, 2 и 3 обработки препаратом (a) составлял 49 ± 3,50%, 63 ± 6,48% и 77 ± 3,50%, соответственно, причем в каждой группе наблюдали значительную статистически значимую разницу (p<0,001) по сравнению с модельной группой.
Показатель регрессии воспаления для исследуемого лекарственного средства в модели болезни Крона на данио-рерио представлен в таблице 3.
Таблица 3: показатель регрессии воспаления для исследуемого лекарственного средства в модели болезни Крона на данио-рерио
Примечание: по сравнению с модельной группой, ** p<0,001.
Как показано в таблице выше, препарат TCM характеризовался очень хорошим эффектом в отношении регрессии воспаления в модели болезни Крона, и при этом такой эффект в отношении регрессии воспаления при болезни Крона был продемонстрирован даже при низкой концентрации.
Экспериментальный пример 4: эффект, связанный с улучшением гистопатологических показателей в модели болезни Крона на данио-рерио
Применяли способ, аналогичный способу для экспериментального примера 2. Лекарственные средства применяли в отношении модели болезни Крона. После обработки данио-рерио фиксировали 4% параформальдегидом и переносили в 70% этанол. После высушивания, заливки парафином, получения срезов и окрашивания H&E (гематоксилином и эозином) ткань кишечника оценивали с помощью гистопатологического исследования.
Как показано на фиг. 8, в контрольной группе без заболевания слизистая оболочка кишечника данио-рерио была гладкой, целостной, с четкими складками кишечника, и при этом в полости кишечника наблюдалась секреция слизи. В группе модели болезни Крона кишечник был расширен, слизистая оболочка кишечника истончена, складки кишечника не наблюдались, и при этом слизистая оболочка была поражена эрозией и язвами. В группе положительного контроля (преднизолон) гистопатологические показатели слизистой оболочки были заметно улучшены. В группах 1, 2 и 3 обработки препаратом (a) TCM площадь поверхности кишечника и складки по существу восстанавливались, воспаление слизистой оболочки кишечника было снижено и при этом не наблюдались заметные язвы. В группе контроля вспомогательным веществом не было обнаружено улучшений гистопатологических показателей.
В соответствии с экспериментальными примерами 2-4, приведенными выше, препарат TCM обеспечивал эффективное уменьшение толщины кишечника, уменьшение расширения кишечника, вызванного воспалением, способствовал регрессии воспаления и улучшению состояния в модели болезни Крона. По сравнению с моделью болезни Крона, все количественные оценочные значения (например, терапевтический показатель и показатель регрессии воспаления) для препаратов TCM характеризовались значительной статистически значимой разницей (p<0,001). В группе контроля вспомогательным веществом не наблюдалось никакого терапевтического эффекта в отношении болезни Крона.
Экспериментальный пример 5: терапевтический эффект препарата j TCM в модели болезни Крона, вызванной воздействием TNBS
1. Животные: крысы SD, поровну самцов и самок, масса 180-220 г, приобретены в виварии Института гигиены и медицинской экологии (Institute of Hygiene and Environmental Medicine), Военно-медицинской академии НОА (Academy of Military Medical Sciences of PLA) с номером сертификата SCXK-2009-003.
2. Лекарственное средство и реактив: месаламин, применяемый в качестве лекарственного средства положительного контроля, предоставлен Tasly Pharmaceutical Group Co. Ltd. 5% TNBS приобретен от Sigma Inc., а наборы для ИФА в отношении IFN-γ, IL-1, IL-4, IL-10 и Gln приобретены от bioswamp Inc. Набор для анализа кала на скрытую кровь предоставлен Институтом биоинженерии Nanjing Jiancheng.
3. Оборудование: электронные аналитические весы AB135-S приобретены от Mettle Toledo Inc., Швейцария.
Способ
Распределение по группам: эксперимент проводили с применением двух путей введения, в толстую кишку и внутрижелудочного. Следовательно, крысы были разделены на следующие группы: контрольная группа без заболевания с внутрижелудочным введением, модельная группа с внутрижелудочным введением, группа положительного контроля с внутрижелудочным введением, группа с внутрижелудочным введением высокой дозы препарата j TCM, группа с внутрижелудочным введением средней дозы, группа с внутрижелудочным введением низкой дозы, контрольная группа без заболевания с введением в толстую кишку, модельная группа с введением в толстую кишку, группа положительного контроля с введением в толстую кишку, группа с введением в толстую кишку высокой дозы препарата j TCM, группа с введением в толстую кишку средней дозы и группа с введением в толстую кишку низкой дозы. В каждой группе было 10 крыс.
Способ создания крысиной модели: для создания модели болезни Крона на крысах SD применяли TNBS, см. способ Morris (Морриса) (сокращенно «модель TNBS»). В течение 24 часов до создания модели крыс SD подвергали голоданию, но давали воду. После взвешивания крыс SD анестезировали с помощью интраперитонеальной инъекции пентобарбитала натрия. 1. Получение раствора TNBS для клизмы: 5% TNBS смешивали с обезвоженным этанолом при объемном соотношении 2:1, вносили в сосуд и хранили при 4°. 2. Применение клизмы: в модельной группе крысам ставили клизму с раствором TNBS при соотношении 150 мг/кг массы крыс (то есть 4,5 мл/кг массы крыс), и при этом в контрольной группе без заболевания крысам ставили клизму с 0,9% (масса/объем) физиологическим раствором при том же соотношении. Клизму (резиновую трубку с внешним диаметром 2 мм) вставляли в анальное отверстие на 6-8 см вглубь и вводили клизменный раствор. Крыс поднимали за хвост и держали в перевернутом состоянии в течение 1 минуты для обеспечения воздействия TNBS на полость кишечника, таким образом, предотвращая вытекание раствора.
Способ введения: после создания модели солевые растворы препарата j TCM при соответствующих дозах вводили животным из групп препарата j при всех дозах, и при этом солевой раствор месаламина вводили животным в группе положительного контроля в качестве лекарственного средства положительного контроля. Крыс из контрольной группы без заболевания кормили обычным образом со свободным доступом к воде, и применяли тот же объем физиологического раствора для аналогичных способов введения в соответствии с режимом дозирования для вышеупомянутых групп лечения. Крысам модельной группы вводили такой же объем физиологического раствора с использованием таких же путей введения. Дозы для каждой группы были следующими: для группы месаламина - 100 мг/кг массы крыс, для группы с высокой дозой препарата J TCM - 2,023 г исходного лекарственного препарата/кг массы крыс, для группы со средней дозой - 1,012 г исходного лекарственного препарата/кг массы крыс и для группы с низкой дозой - 0,506 г исходного лекарственного препарата/кг массы крыс. При обоих путях введения, внутрижелудочном и в толстую кишку, солевой раствор исследуемых лекарственных средств или физиологический раствор вводили при соотношении 0,7 мл/100 г массы крыс один раз в день, последовательно в течение 21 дня.
После обработки, раскрытой выше, у крыс из каждой группы оценивали следующие показатели.
(1) Общий показатель: ежедневно наблюдали изменения массы и стула (например, скрытая кровь в кале, кровянистый стул и диарея) для подсчета баллов DAI (индекса активности заболевания).
Балл DAI = (потеря массы в процентах + доля стула с измененными характеристиками + доля кала с кровью в неизмененном виде)/3
Таблица 4: критерии расчета DAI
(2) Показатели сыворотки: после последнего введения исследуемых крыс подвергали голоданию, но давали воду. Через 24 часа отбирали кровь из брюшной аорты. Сывороточные IFN-γ, IL-1, IL-4, IL-10 и Gln в слизистой оболочке кишечника определяли с помощью твердофазного иммуноферментного анализа (ИФА).
(3) Показатель патологических изменений: извлекали толстую кишку крыс. Оценивали общее повреждение ткани толстой кишки, после чего исследовали и оценивали гистопатологические характеристики с помощью традиционного окрашивания HE (гематоксилином и эозином). Критерии оценки представлены в таблице 5.
Таблица 5: критерии оценки повреждения ткани толстой кишки и гистопатологических характеристик
Статистический анализ: для анализа с определением вышеуказанных баллов применяли программное обеспечение для статистического анализа SPSS 17.0. Данные представлены как среднее значение ± SD, и при этом для сравнения групп использовали t-критерий. При p≤0,05 наблюдали статистически значимую разницу.
Результаты, полученные при внутрижелудочном введении или введении в толстую кишку, представлены в следующих таблицах 6-11.
(1) Результаты для общего показателя (баллы DAI)
Таблица 6: эффект препарата j TCM в отношении баллов DAI в модели TNBS на крысах при введении в толстую кишку (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01. При этом “в 0-ой день” относится к баллам DAI для крыс за 1 день до создания модели TNBS.
Как показано в таблице 6 и на фиг. 9, в контрольной группе без заболевания у крыс не наблюдались симптомы значительной потери массы, аномальное изменение характеристик стула, например, диарея, кровянистый стул и положительный результат анализа кала на скрытую кровь. В модельной группе после введения TNBS в толстую кишку в 1-ый день (то есть при введении физиологического раствора) наблюдали стул с кровью в явном виде, что сопровождалось потерей массы тела. Эти симптомы длились в течение 6-8 дней. На 9-ый день после введения физиологического раствора стул крыс из этой группы последовательно характеризовался положительным результатом анализа кала на скрытую кровь, водянистым стулом, и при этом наблюдалось постепенное увеличение массы тела. Баллы DAI в модельной группе были существенно выше, чем в контрольной группе без заболевания, при этом наблюдалась статистически значимая разница. В группах обработки препаратом j TCM при всех дозах и в группе положительного контроля, несмотря на обработку исследуемыми лекарственными средствами, после введения TNBS в толстую кишку у крыс наблюдалась потеря массы тела в течение первых 6-8 дней после введения. По сравнению с модельной группой, масса тела крыс в вышеупомянутых группах для всех доз и в группе положительного контроля была снижена в меньшей степени. Фактически, степень потери массы тела постепенно снижалась при увеличении продолжительности периода введения. Изначально, характеристики стула, главным образом, включали положительный результат анализа кала на скрытую кровь при отсутствии стула с кровью в явном виде. До 21-ого дня после введения характеристики стула у большинства крыс восстанавливались, за исключением нескольких крыс с положительным результатом анализа кала на скрытую кровь с незначительным количеством скрытой крови. При этом в группе с высокой дозой препарата J ТСМ наблюдался наиболее выраженный эффект, связанный с улучшением. В группе обработки препаратом j TCM при всех дозах и в группе положительного контроля баллы DAI были значительно меньше, чем в модельной группе, причем наблюдали статистически значимую разницу (p<0,01).
Таблица 7: эффект препарата j TCM в отношении баллов DAI в модели TNBS на крысах при внутрижелудочном введении (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01. При этом “в 0-ой день” относится к баллам DAI для крыс за 1 день до создания модели TNBS.
Как показано в таблице 7 и на фиг. 10, в контрольной группе без заболевания не наблюдались симптомы значительной потери массы тела, аномального изменения характеристик стула, например, диарея, кровянистый стул и положительный результат анализа кала на скрытую кровь. В модельной группе после введения TNBS в толстую кишку в 1-ый день (то есть при введении физиологического раствора) наблюдали стул с кровью в явном виде, что сопровождалось потерей массы тела. Эти симптомы длились в течение 6-8 дней. На 9-ый день после введения физиологического раствора стул крыс из этой группы последовательно характеризовался положительным результатом анализа кала на скрытую кровь, водянистым стулом, и при этом наблюдалось постепенное увеличение массы тела. Баллы DAI в модельной группе были значительно выше, чем баллы в контрольной группе без заболевания, при этом наблюдали статистически значимую разницу (p<0,01). В группах обработки препаратом j TCM при всех дозах и в группе положительного контроля, несмотря на обработку исследуемыми лекарственными средствами, после введения TNBS в толстую кишку у крыс наблюдалась потеря массы тела в течение первых 6-8 дней после введения. По сравнению с модельной группой, масса тела крыс в вышеупомянутых группах при всех дозах и в группе положительного контроля была снижена в меньшей степени. Фактически, степень потери массы тела постепенно снижалась при увеличении продолжительности периода введения. Изначально, характеристики стула, главным образом, включали положительный результат анализа кала на скрытую кровь при отсутствии стула с кровью в явном виде. До 21-ого дня после введения характеристики стула у большинства крыс восстанавливались, за исключением нескольких крыс с положительным результатом анализа кала на скрытую кровь с незначительным количеством скрытой крови. При этом в группе с высокой дозой препарата J ТСМ наблюдался наиболее выраженный эффект, связанный с улучшением. В группе обработки препаратом j TCM при всех дозах и в группе положительного контроля баллы DAI были значительно меньше, чем в модельной группе, причем наблюдали статистически значимую разницу (p<0,01).
По сравнению с группой, которой препарат j TCM вводили внутрижелудочно, введение высокой дозы препарата j в толстую кишку обеспечивало явное уменьшение баллов DAI у крыс.
(2) Соответствующие результаты для показателей сыворотки
Таблица 8: эффект препарата j TCM при введении в толстую кишку в отношении содержания в сыворотке IFN-γ, IL-1, IL-4, IL-10 и Gln в слизистой оболочке кишечника в модели TNBS на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 8 и на фиг. 11, по сравнению с контрольной группой без заболевания, у крыс модельной группы содержание IFN-γ в сыворотке было значительно увеличено, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, у крыс группы положительного контроля содержание в сыворотке IFN-γ было значительно снижено, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM содержание в сыворотке IFN-γ было снижено до некоторой степени; в частности, у крыс из группы с высокой дозой степень снижения была наиболее выраженной, причем наблюдали статистически значимую разницу (p<0,01).
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-1 было заметно повышено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, у крыс группы положительного контроля содержание в сыворотке IL-1 было явно снижено, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, содержание в сыворотке IL-1 было снижено в некоторой степени в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM; в частности, у крыс из группы с высокой дозой степень снижения была наиболее выраженной, причем наблюдали статистически значимую разницу (p<0,01).
По сравнению с контрольной группой без заболевания, в модельной группе содержание Gln в слизистой оболочке было заметно снижено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM содержание Gln в слизистой оболочке было увеличено, причем наблюдали статистически значимую разницу (p<0,01, p<0,05, p<0,01, p<0,05, соответственно).
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-4 было заметно снижено, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, у крыс группы положительного контроля содержание в сыворотке IL-4 было явно увеличено, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM содержание в сыворотке IL-4 было снижено до некоторой степени; в частности, у крыс из группы с высокой дозой степень снижения была наиболее выраженной, причем наблюдали статистически значимую разницу (p<0,05).
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-10 было незначительно снижено, причем наблюдали статистически значимую разницу (p<0,05). По сравнению с модельной группой, у крыс группы положительного контроля содержание в сыворотке IL-10 было до некоторой степени повышено, при этом статистически значимая разница не наблюдалась (p<0,01). По сравнению с модельной группой, содержание в сыворотке IL-10 было незначительно снижено в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM, причем наблюдали статистически значимую разницу (p<0,05).
Индуцированная TNBS болезнь Крона, главным образом, опосредована Th1-клетками и характеризуется повышенным содержанием IFN-γ и IL-1, пониженной или нормальной экспрессией IL-4 и IL-10. Пониженное содержание IFN-γ и IL-1 у крыс из группы препаратов j TCM при всех дозах говорит о том, что препарат TCM характеризуется определенным терапевтическим эффектом в отношении индуцированной TNBS болезни Крона. В модельной группе содержание Gln в слизистой оболочке было значительно ниже чем такое в контрольной группе без заболевания, указывая на то, что TNBS мог вызвать повреждение клеток слизистой оболочки. У крыс модельной группы препарат j TCM обеспечивал увеличение содержания Gln в слизистой оболочке, что указывает на то, что препарат TCM можно применять для лечения индуцированной TNBS болезни Крона.
Таблица 9: эффект препарата j TCM при внутрижелудочном введении в отношении содержания в сыворотке IFN-γ, IL-1, IL-4, IL-10 и Gln в слизистой оболочке кишечника в модели TNBS на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 9 и на фиг. 12, по сравнению с контрольной группой без заболевания, у крыс модельной группы содержание IFN-γ в сыворотке было значительно увеличено, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, в группе положительного контроля содержание в сыворотке крыс IFN-γ было до некоторой степени снижено, причем статистически значимая разница не наблюдалась. По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой составов j TCM содержание в сыворотке IFN-γ было снижено до некоторой степени; в частности, у крыс из группы с высокой дозой степень снижения была наиболее выраженной, причем наблюдали статистически значимую разницу (p<0,05).
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-1 было заметно повышено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, в группе положительного контроля содержание в сыворотке крыс IL-1 было заметно снижено, причем наблюдали статистически значимую разницу (P<0,01). По сравнению с модельной группой, содержание в сыворотке IL-1 было снижено до некоторой степени в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM; в частности, у крыс из группы с высокой дозой степень снижения была наиболее выраженной, причем наблюдали статистически значимую разницу (p<0,01).
По сравнению с контрольной группой без заболевания, в модельной группе содержание Gln в слизистой оболочке было заметно снижено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, во всех группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM содержание Gln в слизистой оболочке было увеличено, при этом группа с высокой дозой характеризовалась статистически значимой разницей (p<0,01).
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-4 было незначительно повышено, и при этом статистически значимая разница не наблюдалась. По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM не наблюдалось статистически значимой разницы по содержанию в сыворотке IL-4.
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-10 было незначительно снижено, причем наблюдали статистически значимую разницу (p<0,05). По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой препаратов j TCM не наблюдалось статистически значимой разницы по содержанию в сыворотке IL-10.
По сравнению с внутрижелудочным введением препарата j ТСМ, при введении в толстую кишку высокой дозы препарата j ТСМ содержание в сыворотке IFN-γ, IL-1 и Gln более явно изменялось в сторону улучшения, что согласовывалось с результатами, полученными в отношении баллов DAI.
(3) Соответствующие результаты для показателей патологических изменений
Таблица 10: эффект препарата j TCM при введении в толстую кишку в отношении гистопатологических показателей для слизистой оболочки кишечника в модели TNBS на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 10 и на фиг. 13, слизистая оболочка крыс контрольной группы без заболевания была гладкой, без заметного повреждения. Ткань слизистой оболочки, исследованная с помощью микроскопа, была неповрежденной, без застоя крови и отека, без воспалительной инфильтрации и язвенного поражения. В модельной группе в слизистой оболочке большинства крыс был обнаружен ряд симптомов, включая выраженный застой крови и гематому, существенно утолщенную стенку кишечника и спайки кишечника по периферии. У части крыс наблюдалось расширение кишечника, пневматоз и многочисленные язвы, некоторые из которых даже развивались в обширные и глубокие язвы. Очаги язвы или воспаления были исследованы под микроскопом, и при этом некоторые из них характеризовались трансмуральным воспалением и проникновением язвенного поражения в серозную оболочку, а также прободением. У большинства крыс группы положительного контроля, за исключением небольшого числа крыс с умеренным застойным отеком ткани кишечника, не было обнаружено существенных повреждений. У большинства крыс, за исключением 1 случая с видимым повреждением, при помощи микроскопа не наблюдали никакого аномального изменения. У небольшого количества крыс в группах с высокой дозой, средней дозой и низкой дозой препарата j ТСМ был обнаружен незначительный застойный отек стенки кишечника. По сравнению с модельной группой, выраженность всех повреждений ткани толстой кишки была снижена; в частности, у крыс из групп с высокой дозой и средней дозой степень снижения была наиболее выраженной. Показатель общего повреждения слизистой оболочки и гистопатологический показатель были очевидно выше нормальных значений по сравнению с крысами контрольной группы без заболевания, причем наблюдали статистически значимую разницу (p<0,01). Показатель общего повреждения слизистой оболочки и гистопатологический показатель были явно снижены в группах с высокой дозой, средней дозой и низкой дозой составов j ТСМ; в частности, наиболее явная степень снижения для обоих показателей наблюдалась у крыс группы с высокой дозой, причем наблюдали статистически значимую разницу (p<0,01 и p<0,05, соответственно).
Таблица 11: эффект препарата j TCM при внутрижелудочном введении в отношении гистопатологических показателей для слизистой оболочки кишечника в модели TNBS на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 11 и на фиг. 14, слизистая оболочка крыс здоровой контрольной группы была гладкой, без явных очагов повреждения. Ткань слизистой оболочки, исследованная с помощью микроскопа, была неповрежденной, без застоя крови и отека, без воспалительной инфильтрации и язвенного поражения. В модельной группе в слизистой оболочке большинства крыс был обнаружен ряд симптомов, включая выраженный застой крови и гематому, существенно утолщенную стенку кишечника и спайки по всему кишечнику. У части крыс наблюдалось расширение кишечника, пневматоз и многочисленные язвы, и при этом частично образовывались обширные и глубокие язвы. Очаги язвы или воспаления были исследованы под микроскопом, и при этом некоторые из них характеризовались трансмуральным воспалением и проникновением язвенного поражения в серозную оболочку, а также прободением. У крыс группы положительного контроля, за исключением небольшого числа крыс с умеренным застойным отеком ткани кишечника, у большинства крыс не было обнаружено существенных повреждений. При наблюдении под микроскопом, по сравнению с модельной группой, повреждение ткани толстой кишки было уменьшено; в частности, крысы из групп с высокой дозой и средней дозой характеризовались наиболее выраженной степенью уменьшения. Показатель общего повреждения слизистой оболочки и гистопатологический показатель были очевидно выше нормальных значений по сравнению с крысами контрольной группы без заболевания, причем наблюдали статистически значимую разницу (p<0,01). Показатель общего повреждения слизистой оболочки и гистопатологический показатель были очевидно снижены в группах с высокой дозой, средней дозой и низкой дозой составов j ТСМ; в частности, снижение обоих показателей было наиболее выраженным у крыс группы c высокой дозой, причем наблюдали статистически значимую разницу (p<0,01 и p<0,05, соответственно).
Как показало исследование, как внутрижелудочное введение, так и введение препарата j TCM в толстую кишку обеспечивало облегчение симптомов индуцированной TNBS болезни Крона у крыс, снижение повышенного уровня содержания в сыворотке INF-γ и IL-1 и повышение содержания Gln в слизистой оболочке.
Экспериментальный пример 6: профилактический и терапевтический эффект препарата k TCM в модели болезни Крона, вызванной воздействием оксазолона, на крысах
1. Животные: крысы SD, поровну самцов и самок, масса 180-220 г, приобретены в виварии Института гигиены и медицинской экологии (Institute of Hygiene and Environmental Medicine), Военно-медицинской академии НОА (Academy of Military Medical Sciences of PLA) с номером сертификата SCXK-2009-003.
2. Лекарственное средство и реактив: месаламин, применяемый в качестве лекарственного средства положительного контроля, предоставлен Tasly Pharmaceutical Group Co. Ltd. 5% OXZ приобретен от Sigma Inc., а наборы для ИФА в отношении IFN-γ, IL-4 и Gln приобретены от bioswamp Inc. Набор для анализа кала на скрытую кровь предоставлен Институтом биоинженерии Nanjing Jiancheng.
3. Оборудование: электронные аналитичские весы AB135-S приобретены от Mettle Toledo Inc., Швейцария.
Способ
Распределение по группам: эксперимент проводили с применением двух путей введения, в толстую кишку и внутрижелудочного. Следовательно, крысы были разделены на следующие группы: контрольная группа без заболевания с внутрижелудочным введением, модельная группа с внутрижелудочным введением, группа положительного контроля с внутрижелудочным введением, группа с внутрижелудочным введением высокой дозы препарата k TCM, группа с внутрижелудочным введением средней дозы, группа с внутрижелудочным введением низкой дозы, контрольная группа без заболевания с введением в толстую кишку, модельная группа с введением в толстую кишку, группа положительного контроля с введением в толстую кишку, группа с введением в толстую кишку высокой дозы препарата k TCM, группа с введением в толстую кишку средней дозы и группа с введением в толстую кишку низкой дозы. В каждой группе было 10 крыс.
Способ создания крысиной модели: для создания модели болезни Крона на крысах SD применяли OXZ, см. способ Хеллера (Heller) (сокращенно «модель OXZ»). Брили кожу крыс в области шеи и спины (2 см × 2 см). Для приготовления 5% (масса/объем) раствора OXZ использовали этанол, и при этом 0,3 мл полученного в результате раствора OXZ капали на кожу крыс. После высыхания раствора естественным путем у крыс возникала кожная аллергия. После адаптации сенсибилизированных крыс в течение 5 дней, ставили клизму и анестезировали при помощи интраперитонеальной инъекции пентобарбитала натрия. Резиновую трубку с наружным диаметром 2 мм вставляли в анальное отверстие на 6-8 см вглубь, с ее помощью в анальное отверстие вводили 0,45 мл 5% (масса/объем) раствора OXZ; причем раствор получали с использованием 50% (объем/объем) этанола. После завершения этой процедуры крыс держали за хвост в перевернутом состоянии в течение 60 с, для того, чтобы обеспечить возможность полного поглощения раствора. Для крыс контрольной группы без заболевания применяли тот же способ с 50% (объем/объем) этанолом без OXZ. В том случае, если у крыс проявлялась шерсть темного цвета, потеря массы тела, слабый аппетит, апатичность, водянистый стул или диарея, создание модели считалось успешным.
Способ введения: после успешного создания модели с помощью OXZ крысы получали лекарственное средство. В группах со всеми дозами препарата k вводили солевые растворы препарата k TCM при соответствующей дозе, и при этом в группе положительного контроля вводили месаламин, лекарственное средство положительного контроля. Крыс контрольной группы без заболевания кормили обычным образом, давали воду и использовали такой же объем физиологического раствора для таких же способов введения в соответствии с режимом дозирования для вышеупомянутых групп обработки. Крысам модельной группы вводили такой же объем физиологического раствора с использованием таких же путей введения. Дозы для каждой группы были следующими: для группы месаламина - 100 мг/кг массы крыс, для группы с высокой дозой препарата k TCM - 2,023 г исходного лекарственного препарата/кг массы крыс, для группы со средней дозой - 1,012 г исходного лекарственного препарата/кг массы крыс и для группы с низкой дозой - 0,506 г исходного лекарственного препарата/кг массы крыс. При обоих способах введения, внутрижелудочном и в толстую кишку, солевой раствор исследуемого лекарственного средства или физиологический раствор вводили при соотношении 0,7 мл/100 г массы крыс один раз в день, последовательно в течение 11 дней. На 5-ый день после введения для создания модели группам с высокой дозой, средней дозой и низкой дозой препарата k TCM, группе положительного контроля, модельной группе согласно способу моделирования вводили 5% раствор OXZ, а контрольной группе без заболевания ректально вводили 50% этанол.
После обработки, раскрытой выше, у крыс из каждой группы оценивали следующие показатели.
(1) Общий показатель: ежедневно наблюдали изменения массы и стула (например, скрытая кровь в стуле, кровянистый стул и диарея) для подсчета баллов DAI.
Балл DAI = (потеря массы в процентах + доля стула с измененными характеристиками + доля кала с кровью в неизмененном виде)/3
Таблица 12: критерии расчета DAI
(2) Показатели сыворотки: после последнего введения (на 11-ый день), крыс подвергали голоданию, но давали воду. Через 24 часа отбирали кровь из брюшной аорты. IFN-γ, IL-4 сыворотки и Gln в слизистой оболочке кишечника крыс определяли с помощью ИФА.
(3) Показатель патологических изменений: извлекали толстую кишку крыс. Оценивали общее повреждение ткани толстой кишки, после чего исследовали и оценивали гистопатологию с помощью традиционного HE окрашивания. Критерии оценки представлены в таблице 13.
Таблица 13: критерии оценки повреждения ткани толстой кишки и гистопатологических характеристик
Статистический анализ: для анализа с определением вышеуказанных баллов применяли программное обеспечение для статистического анализа SPSS 17.0. Данные представлены как среднее значение ± SD, и при этом для сравнения групп использовали t-критерий. При p≤0,05 наблюдали статистически значимую разницу.
Результаты, полученные при внутрижелудочном введении или введении в толстую кишку, представлены в следующих таблицах 14-19.
(1) Результаты для общего показателя (баллы DAI)
Таблица 14: эффект препарата k TCM в отношении баллов DAI в модели OXZ на крысах при введении в толстую кишку (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 14 и на фиг. 15, в контрольной группе без заболевания не наблюдались симптомы значительной потери массы тела, аномального изменения характеристик стула, например, диарея, кровянистый стул и положительный результат анализа кала на скрытую кровь. У крыс группы модели OXZ c кожной аллергией, после введения крысам физиологического раствора (то есть в 1-ый день), масса тела незначительно снизилась, но существенных изменений характеристик стула не было обнаружено. При этом после введения OXZ в толстую кишку (на 5-ый день после введения физиологического раствора) стул крыс данной группы характеризовался положительным результатом анализа кала на скрытую кровь, водянистым стулом, что сопровождалось потерей массы тела. Баллы DAI в модельной группе были существенно выше, чем в контрольной группе без заболевания, при этом наблюдалась статистически значимая разница. После сенсибилизации кожи OXZ в группах препарата k TCM при всех дозах и в группе положительного контроля в 1-ый день после введения масса тела незначительно снизилась. В течение первых 1-5 дней после введения не наблюдалось существенных изменений характеристик стула. После введения OXZ в толстую кишку (5-ый день после введения) не наблюдали существенной потери массы тела по сравнению с модельной группой, характеризующейся статистически значимой разницей. После введения в толстую кишку OXZ в группах препарата k TCM при всех дозах и в группе положительного контроля, изначально, характеристики стула, главным образом, продемонстрировали положительный результат анализа кала на скрытую кровь, без существенного количества стула с кровью в явном виде. К 11-ому дню после введения у части крыс среди характеристик стула наблюдали положительный результат анализа кала на скрытую кровь без существенного количества водянистого стула, и при этом у большинства крыс нормальные характеристики стула восстанавливались. В группах с высокой и средней дозой препарата k ТСМ наблюдался значительный эффект, связанный с улучшением. Баллы DAI в группе препарата k TCM при всех дозах были существенно ниже баллов в модельной группе, причем наблюдали статистически значимую разницу (p<0,01).
Таблица 15: эффект препарата k TCM в отношении баллов DAI в модели TNBS на крысах при введении в толстую кишку (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 15 и на фиг. 16, в контрольной группе без заболевания у крыс не наблюдались симптомы значительной потери массы тела, аномальное изменение характеристик стула, например, диарея, кровянистый стул и положительный результат анализа кала на скрытую кровь. У крыс из группы модели OXZ с кожной аллергией после введения физиологического раствора (то есть в 1-ый день) масса тела была немного сниженной, но существенных изменений характеристик стула не было обнаружено. Однако после введения OXZ в толстую кишку (на 5-ый день после введения физиологического раствора) стул крыс из данной группы последовательно характеризовался положительным результатом анализа кала на скрытую кровь, водянистым стулом, что сопровождалось потерей массы тела. Баллы DAI в модельной группе были существенно выше, чем в контрольной группе без заболевания, при этом наблюдалась статистически значимая разница. После сенсибилизации кожи OXZ в группах препарата k TCM при всех дозах и в группе положительного контроля в 1-ый день после введения масса тела незначительно снизилась. В течение первых 1-5 дней после введения не наблюдали существенных изменений характеристик стула. После введения OXZ в толстую кишку (5-ый день после введения) не наблюдали существенной потери массы тела по сравнению с модельной группой, характеризующейся статистически значимой разницей. После введения в толстую кишку OXZ в группах препарата k TCM при всех дозах и в группе положительного контроля, изначально, характеристики стула, главным образом, продемонстрировали положительный результат анализа кала на скрытую кровь, без существенного количества стула с кровью в явном виде. К 11-ому дню после введения у части крыс среди характеристик стула наблюдали положительный результат анализа кала на скрытую кровь без существенного количества водянистого стула, и при этом у большинства крыс нормальные характеристики стула восстанавливались. В группах с высокой и средней дозой препарата k ТСМ наблюдался значительный эффект, связанный с улучшением. Баллы DAI в группе препарата k TCM при всех дозах были существенно ниже баллов в модельной группе, причем наблюдали статистически значимую разницу (p<0,01).
По сравнению с группой, в которой препарат k TCM вводили в толстую кишку, внутрижелудочное введение высокой дозы и средней дозы препаратов k оказывало сильно выраженный эффект в отношении снижения баллов DAI у крыс.
(2) Соответствующие результаты для показателей сыворотки
Таблица 16: эффект препарата k TCM при введении в толстую кишку в отношении содержания в сыворотке IFN-γ, IL-1, IL-4, IL-10 и Gln в слизистой оболочке кишечника в модели OXZ на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 16 и на фиг. 17, по сравнению с контрольной группой без заболевания, у крыс не наблюдали существенной разницы по содержанию IFN-γ в сыворотке. По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой составов k TCM и в группе положительного контроля не наблюдали существенной разницы по содержанию IFN-γ в сыворотке.
По сравнению с контрольной группой без заболевания, в модельной группе содержание в сыворотке IL-4 было заметно повышено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, у крыс в группе положительного контроля содержание в сыворотке IL-4 было явно снижено, причем наблюдали статистически значимую разницу (р<0,05). По сравнению с модельной группой, содержание в сыворотке IL-4 было снижено до некоторой степени в группах с высокой дозой и средней дозой препаратов k TCM, причем наблюдали статистически значимую разницу (р<0,01 и р<0,05, соответственно).
По сравнению с контрольной группой без заболевания, в модельной группе содержание Gln в слизистой оболочке было заметно снижено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, содержание Gln в слизистой оболочке было повышено во всех группах с высокой дозой, средней дозой и низкой дозой препаратов k TCM и в модельной группе, причем наблюдали статистически значимую разницу (р<0,01, р<0,01 и р<0,05, соответственно).
OXZ-индуцированная болезнь Крона, главным образом, опосредована Th2-клетками и характеризуется повышенным содержанием IL-4, пониженной или нормальной экспрессией IFN-γ. Препараты k TCM при всех дозах обеспечивали снижение содержания IL-4 у крыс, что указывает на то, что препарат TCM характеризуется определенным эффектом в отношении индуцированной OXZ болезни Крона. В модельной группе содержание Gln в слизистой оболочке было значительно ниже, чем содержание в контрольной группе без заболевания, что указывает на то, что OXZ мог приводить к повреждению клеток слизистой оболочки. У крыс модельной группы препарат k TCM обеспечивал увеличение содержания Gln в слизистой оболочке, что указывает на то, что препарат TCM можно применять для лечения индуцированной OXZ болезни Крона.
Таблица 17: эффект препарата k TCM при внутрижелудочном введении в отношении содержания в сыворотке IFN-γ, IL-1, IL-4, IL-10 и Gln в слизистой оболочке кишечника в модели OXZ на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 17 и на фиг. 18, по сравнению с контрольной группой без заболевания, у крыс не наблюдали существенной разницы по содержанию IFN-γ в сыворотке. По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой составов k TCM и в группе положительного контроля не наблюдали существенной разницы по содержанию IFN-γ в сыворотке.
По сравнению с контрольной группой без заболевания, содержание в сыворотке IL-4 было существенно повышено в модельной группе, причем наблюдали статистически значимую разницу (p<0,01). По сравнению с модельной группой, в группе положительного контроля содержание в сыворотке IL-4 было существенно снижено, причем наблюдали статистически значимую разницу (p<0,05). По сравнению с модельной группой, содержание в сыворотке IL-4 было снижено до некоторой степени в группах с высокой дозой, средней дозой и низкой дозой препаратов k TCM; в частности, наблюдали статистически значимую разницу (p<0,05 и p<0,05, соответственно) для крыс из групп с высокой дозой и средней дозой.
По сравнению с контрольной группой без заболевания, в модельной группе содержание Gln в слизистой оболочке было заметно снижено, причем наблюдали статистически значимую разницу (р<0,01). По сравнению с модельной группой, в группах c высокой дозой, средней дозой и низкой дозой препаратов k TCM содержание в слизистой оболочке Gln было повышено до некоторой степени, причем статистически значимую разницу не наблюдали.
По сравнению с внутрижелудочным введением препарата k TCM, при введении высокой дозы препарата k TCM в толстую кишку улучшение, связанное с содержанием в сыворотке IL-4, было более выраженным.
(3) Соответствующие результаты для показателей патологических изменений
Таблица 18: эффект препарата k TCM в отношении гистопатологических показателей слизистой оболочки в модели OXZ на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 18 и на фиг. 19, слизистая оболочка кишечника крыс в контрольной группе без заболевания была гладкой, без явного повреждения. За исключением воспаления, которое было обнаружено в 1 случае, в ткани слизистой оболочки при исследовании при помощи микроскопа не было обнаружено застоя крови, отека и язвенного поражения. В модельной группе в слизистой оболочке большинства крыс наблюдался ряд симптомов, включая выраженный застой крови и гематому, существенно утолщенную стенку кишечника и спайки кишечника с вовлечением ткани по периферии. У части крыс наблюдалось расширение кишечника, пневматоз и многочисленные язвы, некоторые из которых даже развивались в обширные и глубокие язвы. Выраженные повреждения толстой кишки были исследованы при помощи микроскопа, и при этом ткань толстой кишки характеризовались трансмуральным воспалением и проникновением язвенного поражения в серозную оболочку, а также прободением. У крыс группы положительного контроля в некоторых участках ткани кишечника наблюдалось воспаление и язвенное поражение. По сравнению с модельной группой, повреждения выделялись незначительно. В группах c высокой дозой, средней дозой и низкой дозой препарата k TCM заболевание кишечника было отчасти облегчено, при этом группа с высокой дозой характеризовалась более выраженным эффектом, связанным с улучшением. В модельной группе показатель общего повреждения слизистой оболочки и гистопатологический показатель были явно выше нормального значения, причем наблюдали статистически значимую разницу (p<0,01) по сравнению с контрольной группой без заболевания. Показатель общего повреждения слизистой оболочки и гистопатологический показатель были снижены в группах с высокой дозой, средней дозой и низкой дозой препарата k TCM; в частности, оба показателя были наиболее явно снижены у крыс из группы с высокой дозой, причем наблюдали статистически значимую разницу (p<0,01 и p<0,01, соответственно).
Таблица 19: эффект препарата k TCM при внутрижелудочном введении в отношении гистопатологических показателей для слизистой оболочки кишечника в модели OXZ на крысах (среднее значение ± SD)
Примечание: по сравнению с контрольной группой без заболевания, * p<0,05, ** p<0,01; по сравнению с модельной группой, # p<0,05, ## p<0,01.
Как показано в таблице 19 и на фиг. 20, слизистая оболочка крыс в контрольной группе без заболевания была гладкой, без явного повреждения. При исследовании при помощи микроскопа не было обнаружено никакого повреждения. В модельной группе в слизистой оболочке большинства крыс наблюдался ряд симптомов, включая выраженный застой крови и гематому, существенно утолщенную стенку кишечника и спайки кишечника с вовлечением ткани по периферии. У крыс наблюдались расширение кишечника, пневматоз и многочисленные язвы, некоторые из которых даже развивались в обширные и глубокие язвы. Выраженные повреждения толстой кишки были исследованы при помощи микроскопа, и при этом ткань толстой кишки характеризовались трансмуральным воспалением и проникновением язвенного поражения в серозную оболочку, а также прободением. По сравнению с модельной группой, в группе положительного контроля повреждения кишечника были слабо выраженными, но все еще были видны очаги воспаления и язвенного поражения, и при этом у небольшого числа крыс наблюдалось трансмуральное воспаление. По сравнению с модельной группой, в группах с высокой дозой, средней дозой и низкой дозой препарата TCM поражение кишечника было отчасти уменьшено, при этом группа с высокой дозой характеризовалась более выраженным эффектом, связанным с улучшением. В модельной группе показатель общего повреждения слизистой оболочки и гистопатологический показатель были явно выше нормального значения, причем наблюдали статистически значимую разницу (p<0,01) по сравнению с контрольной группой без заболевания. Показатель общего повреждения слизистой оболочки и гистопатологический показатель были снижены в группах с высокой дозой, средней дозой и низкой дозой препарата k TCM; в частности, оба показателя были наиболее явно снижены у крыс из группы с высокой дозой, причем наблюдали статистически значимую разницу (p<0,01 и p<0,01, соответственно).
Как было продемонстрировано в исследовании, как внутрижелудочное введение, так и введение препарата k TCM в толстую кишку обеспечивало облегчение симптомов индуцированной OXZ болезни Крона у крыс, а также снижение повышенного уровня содержания IL-4 в сыворотке. Введение препарата k TCM в толстую кишку обеспечивало лучший эффект, связанный с улучшением, чем внутрижелудочное введение.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к применению лекарственного средства традиционной китайской медицины для предупреждения или лечения болезни Крона. Применение лекарственного средства традиционной китайской медицины при получении лекарственного препарата для предупреждения и/или лечения болезни Крона, причем указанное средство содержит сырьевые материалы, такие как 1-10% по массе драконовой крови, 15-40% по массе корня пиона красного, 1-20% по массе натурального индиго, 1-10% по массе красного галлуазита, 15-40% по массе кашу, 1-10% по массе жженых квасцов, 5-30% по массе корневища блетиллы и 1-10% по массе каламина. Применение лекарственного средства традиционной китайской медицины при получении лекарственного препарата для предупреждения и/или лечения внекишечных проявлений и осложнений болезни Крона, причем указанное средство содержит сырьевые материалы, такие как 1-10% по массе драконовой крови, 15-40% по массе корня пиона красного, 1-20% по массе натурального индиго, 1-10% по массе красного галлуазита, 15-40% по массе кашу, 1-10% по массе жженых квасцов, 5-30% по массе корневища блетиллы и 1-10% по массе каламина. Вышеописанное средство эффективно для предупреждения и/или лечения болезни Крона, а также для предупреждения и/или лечения внекишечных проявлений и осложнений болезни Крона, в том числе при низкой концентрации. 2 н. и 8 з.п. ф-лы, 20 ил., 19 табл., 6 пр.

Комментарии