Связывающие il-1 белки - RU2615173C2
Код документа: RU2615173C2
Чертежи
























































































































































Описание
Перекрестная ссылка на родственные заявки
По данной заявке испрашивается приоритет по временной заявке США №61/334917, поданной 14 мая 2010 года, и по временной заявке США №61/425701, поданной 21 декабря 2010 года, содержание которых включено в настоящее описание в качестве ссылки в полном объеме.
Область изобретения
Настоящее изобретение относится к связывающим IL-1 белкам, и, в частности, к их применению для профилактики и/или лечения острых и хронических иммунологических заболеваний, таких как ревматоидный артрит, остеоартрит, псориаз, рассеянный склероз и другие аутоиммунные заболевания.
Уровень техники, к которому относится изобретение
Цитокины, такие как интерлейкин-1 (IL-1) и фактор некроза опухоли (TNF), представляют собой молекулы, продуцируемые различными клетками, такими как моноциты и макрофаги, которые являются медиаторами воспалительных процессов. Интерлейкин-1 представляет собой цитокин с широким диапазоном биологических и физиологических эффектов, включая лихорадку, синтез простагландинов (например, в фибробластах, мышечных клетках и эндотелиальных клетках), активацию T-лимфоцитов и продуцирование интерлейкина-2.
Основными представителями суперсемейства IL-1 являются IL-1α, IL-1β и антагонист рецептора IL-1 (IL-1Ra, IL-1RA, IL-1ra, IL-1Rα). IL-1α и IL-1β представляют собой провоспалительные цитокины, вовлеченные в иммунную защиту против инфекции. IL-1Rα представляет собой молекулу, которая конкурирует за связывание рецептора с IL-1α и IL-1β, блокируя их участие в активации иммунной системы. В последние годы к суперсемейству IL-1 были добавлены другие молекулы, включая IL-18 (см. Dinarello et al., FASEB J., 8(15): 1314-3225 (1994); Huising et al., Dev. Comp. Immunol., 28(5):395-413 (2004)) и еще шесть генов со структурной гомологией с IL-1α, IL-1β или IL-IRA. Эти последние шесть представителей называются IL1F5, IL1F6, IL1F7, IL1F8, IL1F9 и IL1F10. В соответствии с этим, IL-1α, IL-1β и IL-1RA были переименованы на IL-1F1, IL-1F2 и IL-1F3, соответственно (см. Sims et al., Trends Immunol., 22(10): 536-537 (2001); Dunn et al., Trends Immunol., 22(10): 533-536 (2001)). Описан следующий предполагаемый представитель семейства IL-1, названный IL-33 или IL-1F11, хотя это название не является официально признанным в базе данных по номенклатуре семейств генов HGNC.
Как IL-1α, так и IL-1β продуцируются макрофагами, моноцитами и дендритными клетками. Они формируют важную часть воспалительного ответа организма против инфекции. Эти цитокины увеличивают экспрессию факторов адгезии на эндотелиальных клетках, обеспечивая трансмиграцию лейкоцитов – клеток, которые осуществляют борьбу с патогенами, в область инфекции, и регулируют терморегуляторный центр гипоталамуса, что приводит к увеличенной температуре тела, которая проявляется как лихорадка. Таким образом, IL-1 называют эндогенным пирогеном. Увеличенная температура тела помогает иммунной системе организма осуществлять борьбу с инфекцией. IL-1 также является важным для регуляции гемопоэза. Продуцирование IL-1β в периферической ткани также ассоциировано с гипералгезией (повышенная чувствительность к боли), связанной с лихорадкой (Morgan et al., Brain Res., 1022(1-2): 96-100 (2004)). По большей части, эти две формы IL-1 связываются с одним и тем же клеточным рецептором. Этот рецептор состоит из двух родственных, но не идентичных, субъединиц, которые передают внутриклеточные сигналы через каскад, который по большей части является общим с определенными другими рецепторами. Они включают Toll-семейство врожденных иммунных рецепторов и рецептор для IL-18. IL-1α и IL-1β также обладают сходными биологическими свойствами, включая индукцию лихорадки, медленноволнового сна и нейтрофилии, активацию T- и B-лимфоцитов, пролиферацию фибробластов, цитотоксичность в отношении определенных клеток, индукцию коллагеназ, синтез белков острой фазы печенью и увеличенное продуцирование колониестимулирующих факторов и коллагена.
кДНК, кодирующие две различных формы IL-1, были выделены и экспрессированы; эти кДНК соответствуют двум продуктам генов, называемым IL-1β (Auron et al., Proc. Natl. Acad. Sci. USA, 81: 7907-7911 (1984)) и IL-1α (Lomedico et al., Nature, 312: 458-462 (1984)). IL-1β является преобладающей формой, продуцируемой моноцитами человека, на уровне как мРНК, так и белка. Эти две формы IL-1 человека обладают гомологией аминокислот, составляющей только 26%. Несмотря на их различающиеся полипептидные последовательности, эти две формы IL-1 имеют структурное сходство (Auron et al., J. Mol. Cell Immunol., 2: 169-177 (1985)), в том, что гомология аминокислот ограничена отдельными областями молекулы IL-1.
IL-1α и IL-1β продуцируются в качестве белков-предшественников. Иными словами они продуцируются в качестве длинного белка, который затем процесссируется с высвобождением более короткой активной молекулы, которую называют зрелым белком. Зрелый IL-1β, например, высвобождается из Pro-IL-1β после расщепления определенным представителем семейства белков-каспаз, называемым каспазой-1 или интерлейкин-1-конвертирующим ферментом (ICE). 3-мерная структура каждого представителя суперсемейства IL-1 человека состоит из 12-14 β-цепей, образующих белок в форме бочонка.
Хотя в последние десятилетия работы с открытия этого важного провоспалительного цитокина описано множество антител к IL-1, остается потребность в усовершенствованных антителах, которые могут эффективно опосредовать или нейтрализовывать активность IL-1 при воспалительном ответе и аутоиммунных нарушениях, и для применения в детекции IL-1β в образцах и тканях.
Сущность изобретения
Это изобретение относится к белкам, которые связывают IL-1α и IL-1β человека. Связывающие белки по изобретению включают, но не ограничиваются ими, антитела, их антигенсвязывающие части и поливалентные полиспецифические связывающие белки, такие как DVD-IgTM, которые могут связывать IL-1α и IL-1β человека. Также изобретение относится к способам получения и применения связывающих IL-1α и IL-1β белков, описанных в настоящем описании, а также различных композиций, которые можно использовать в способах детекции IL-1α и IL-1β в образце или в способах лечения или профилактики расстройства у индивидуума, которое ассоциировано или предположительно ассоциировано с активностью IL-1.
В одном варианте осуществления изобретение относится к связывающему белку, содержащему первую и вторую полипептидные цепи, где указанная первая полипептидная цепь содержит первый VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен тяжелой цепи;
VD2 представляет собой второй вариабельный домен тяжелой цепи;
C представляет собой константный домен тяжелой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 представляет собой Fc-область; и
n независимо представляет собой 0 или 1; и
где указанная вторая полипептидная цепь содержит второй VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен легкой цепи;
VD2 представляет собой второй вариабельный домен легкой цепи;
C представляет собой константный домен легкой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 не содержит Fc-область; и
n независимо представляет собой 0 или 1;
где в указанной первой полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 213 и 227;
где в указанной второй полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189, 197, 199, 201, 203, 205, 207, 209 и 211; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 216 и 229; и
где связывающий белок связывает IL-1β человека и IL-1α человека.
В одном варианте осуществления связывающий белок, описанный выше, содержит первую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 212, 217, 226, 230, 232, 234 и 236.
В другом варианте осуществления связывающий белок, описанный выше, содержит вторую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 215, 218, 228, 231, 233, 235 и 237. В другом аспекте изобретения связывающий белок содержит первую и вторую полипептидные цепи, где указанная первая полипептидная цепь содержит первый VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен тяжелой цепи;
VD2 представляет собой второй вариабельный домен тяжелой цепи;
C представляет собой константный домен тяжелой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 представляет собой Fc-область; и
n независимо представляет собой 0 или 1; и
где указанная вторая полипептидная цепь содержит второй VD1-(X1)n-VD2-C-(X2)n, где:
VD1 представляет собой первый вариабельный домен легкой цепи;
VD2 представляет собой второй вариабельный домен легкой цепи;
C представляет собой константный домен легкой цепи;
X1 представляет собой линкер при условии, что он не является CH1;
X2 не содержит Fc-область; и
n независимо представляет собой 0 или 1;
где в указанной первой полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 213 и 227; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210;
где в указанной второй полипептидной цепи VD1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 216 и 229; и VD2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189, 197, 199, 201, 203, 205, 207, 209 и 211; и
где связывающий белок связывает IL-1β человека и IL-1α человека.
В другом варианте осуществления связывающий белок, описанный выше, содержит первую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 219 и 221.
В другом варианте осуществления связывающий белок, описанный выше, содержит вторую полипептидную цепь, которая содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 220 и 222.
В другом аспекте изобретение относится к связывающему белку, описанному выше, где:
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 212, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 215, 228, 231, 233 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 217, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 218 и 237;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 219, то указанная вторая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 220;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 221, то указанная вторая полипептидная цепь содержит SEQ ID NO: 222;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 226, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 228, 215, 231, 233 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 230, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 231, 215, 228, 233 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO:232, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 233, 215, 228, 231 и 235;
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 234, то указанная вторая полипептидная цепь содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 235, 215, 228, 231 и 233; и
когда указанная первая полипептидная цепь содержит аминокислотную последовательность SEQ ID NO: 236, то указанная вторая полипептидная цепь содержит SEQ ID NO: 237.
В другом аспекте изобретение относится к белку, описанному выше, где:
указанная первая полипептидная цепь содержит SEQ ID NO: 212, и указанная вторая полипептидная цепь содержит SEQ ID NO: 215; или
указанная первая полипептидная цепь содержит SEQ ID NO: 217, и указанная вторая полипептидная цепь содержит SEQ ID NO: 218; или
указанная первая полипептидная цепь содержит SEQ ID NO: 219, и указанная вторая полипептидная цепь содержит SEQ ID NO: 220; или
указанная первая полипептидная цепь содержит SEQ ID NO: 221, и указанная вторая полипептидная цепь содержит SEQ ID NO: 222; или
указанная первая полипептидная цепь содержит SEQ ID NO: 226, и указанная вторая полипептидная цепь содержит SEQ ID NO: 228; или
указанная первая полипептидная цепь содержит SEQ ID NO: 230, и указанная вторая полипептидная цепь содержит SEQ ID NO: 231; или
указанная первая полипептидная цепь содержит SEQ ID NO: 232, и указанная вторая полипептидная цепь содержит SEQ ID NO: 233; или
указанная первая полипептидная цепь содержит SEQ ID NO: 234, и указанная вторая полипептидная цепь содержит SEQ ID NO: 235; или
указанная первая полипептидная цепь содержит SEQ ID NO: 236, и указанная вторая полипептидная цепь содержит SEQ ID NO: 237.
В одном варианте осуществления связывающий белок по изобретению, описанный выше, содержит две первых полипептидных цепи и две вторых полипептидных цепи.
В другом аспекте в связывающем белке, описанном выше, X1 или X2 представляет собой аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 26-57, 233, 224 и 225.
В другом варианте осуществления изобретение относится к связывающему белку, описанному выше, где Fc-область выбрана из группы, состоящей из Fc-области с нативной последовательностью и Fc-области с вариантной последовательностью. В другом варианте осуществления Fc-область выбрана из группы, состоящей из Fc-области из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE и IgD.
В другом варианте осуществления изобретение относится к конъюгату связывающего белка, который содержит связывающий белок, описанный выше, и дополнительно содержит средство. Такие средства включают, но не ограничиваются ими, молекулу иммуноадгезии, радиофармацевтическое средство, лекарственное средство и цитотоксическое средство. Предпочтительные радиофармацевтические средства включают, но не ограничиваются ими, радиоактивную метку, фермент, флуоресцентную метку, люминесцентную метку, биолюминесцентную метку, магнитную метку и биотин. Предпочтительные радиоактивные метки, пригодные для изобретения, включают, но не ограничиваются ими, метки, выбранные из группы, состоящей из:3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho и153Sm. Предпочтительное терапевтическое или цитотоксическое средство включает, но не ограничивается ими, антиметаболит, алкилирующее средство, антибиотик, фактор роста, цитокин, антиангиогенное средство, антимитотическое средство, антрациклин, токсин и апоптотическое средство.
Также изобретение относится к связывающему белку, содержащему антигенсвязывающий домен, где связывающий белок способен связывать IL-1β человека и антигенсвязывающий домен содержит шесть CDR, т.е. CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, как определено ниже:
CDR-H1: X1-Y-D-M-S (SEQ ID NO: 190), где:
X1 представляет собой S, K или R;
CDR-H2: Y-X2-S-X4-G-G-X7-G-T-Y-Y-P-D-X14-X15-K-G (SEQ ID NO:191), где;
X2 представляет собой I или V;
X4 представляет собой S или H;
X7 представляет собой G или A;
X14 представляет собой T или S; и
X15 представляет собой V или А;
CDR-H3: G-G-V-X4-K-G-X7-F-D-X10 (SEQ ID NO: 192), где:
X4 представляет собой T или Y;
X7 представляет собой Y или C; и
X10 представляет собой V, E, L, M, Q или Y;
CDR-L1: R-A-S-G-N-I-X7-X8-X9-L-X11 (SEQ ID NO: 193), где:
X7 представляет собой H, Y или W;
X8 представляет собой N, G, T, Q, E, H, D или K;
X9 представляет собой Y или W; и
X11 представляет собой T, A или N;
CDR-L2: X1-A-K-X4-L-X6-X7 (SEQ ID NO: 194), где:
X1 представляет собой N, Q или D;
X4 представляет собой T, N, I, E или S;
X6 представляет собой A, M или E; и
X7 представляет собой D, E, S или A; и
CDR-L3: Q-X2-F-W-X5-X6-P-X8-X9 (SEQ ID NO: 195), где:
X2 представляет собой H или Q;
X5 представляет собой S, N, T, K, R или M;
X6 представляет собой I или L;
X8 представляет собой Y или A; и
X9 представляет собой T, I и N;
за исключением случая, где, когда CDR-H1 представляет собой S-Y-D-M-S (SEQ ID NO: 17), тогда:
CDR-H2 не может представлять собой Y-I-S-S-G-G-G-G-T-Y-Y-P-D-T-V-K-G (SEQ ID NO: 18);
CDR-H3 не может представлять собой G-G-V-T-K-G-Y-F-D-V (SEQ ID NO: 19);
CDR-L1 не может представлять собой R-A-S-G-N-I-H-N-Y-L-T (SEQ ID NO: 20);
CDR-L2 не может представлять собой N-A-K-T-L-A-D (SEQ ID NO: 21); и
CDR-L3 не может представлять собой Q-H-F-W-S-I-P-Y-T (SEQ ID NO: 22).
В одном варианте осуществления выделенный связывающий белок, описанный выше, содержит по меньшей мере одну CDR, которая содержит аминокислотную последовательность, выбранную из группы последовательностей CDR, состоящей из:
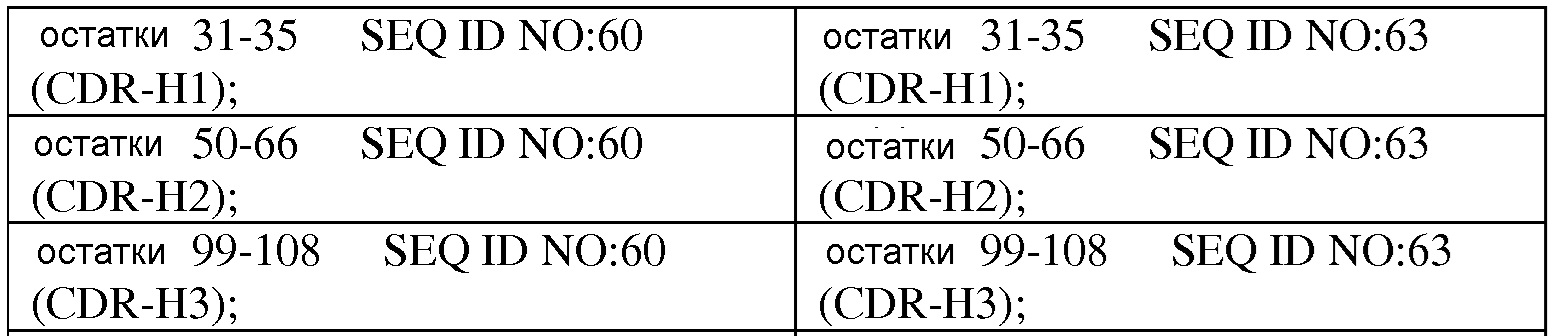













В другом варианте осуществления связывающий белок, описанный выше, содержит по меньшей мере три CDR, где CDR взяты из набора CDR, выбранного из группы наборов CDR, состоящих из:
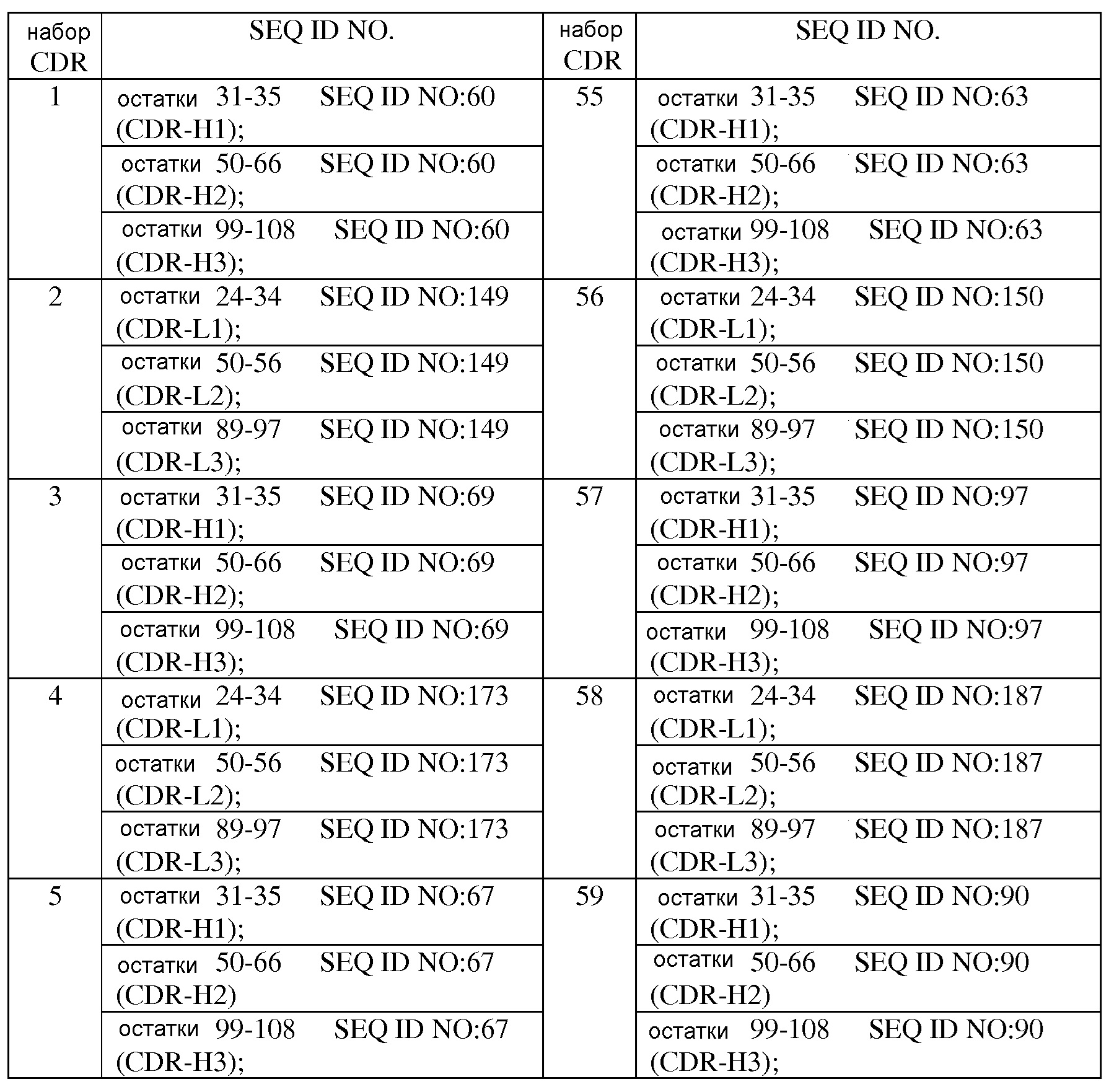












В одном варианте осуществления связывающий белок, описанный выше, содержит CDR из двух наборов CDR, выбранных из описанной выше группы наборов CDR.
В другом варианте осуществления изобретение относится к связывающему белку, содержащему CDR из двух наборов CDR из представленной выше группы, где два набора CDR выбраны из группы, состоящей из:
В другом варианте осуществления связывающий белок, описанный выше, дополнительно содержит акцепторную каркасную область человека. Предпочтительно, каркасная область человека содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7-10, 13-16, 25, 240-316 и 317-381. В одном варианте осуществления связывающий белок по изобретению содержит последовательность каркасной области человека, выбранную из группы, состоящей из SEQ ID NO: 7-10 и 13-16.
Связывающие белки по изобретению включают белки, которые содержат акцепторную каркасную область человека, содержащую по меньшей мере одну аминокислотную замену в каркасной области, где аминокислотная последовательность каркасной области по меньшей мере на 65% идентична последовательности указанной акцепторной каркасной области человека и содержит по меньшей мере 70 аминокислотных остатков, идентичных указанной акцепторной каркасной области человека.
В другом варианте осуществления связывающий белок содержит акцепторную каркасную область человека, где указанная акцепторная каркасная область содержит по меньшей мере одну аминокислотную замену в ключевом остатке каркасной области, причем указанный остаток выбран из группы, состоящей из: остатка, соседнего с CDR; остатка участка гликозилирования; редкого остатка; остатка, способного взаимодействовать с IL-1β человека; остатка, способного взаимодействовать с CDR; канонического остатка; контактного остатка между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи; остатка в зоне Vernier; и остатка в области, которая перекрывается между определяемой по Chothia CDR1 вариабельной областью тяжелой цепи и определяемой по Kabat первой каркасной областью тяжелой цепи.
В иллюстративном варианте осуществления связывающий белок по изобретению содержит ключевой остаток, где указанный ключевой остаток выбран из группы, состоящей из: 2H, 4H, 24H, 26H, 27H, 29H, 34H, 35H, 37H, 39H, 44H, 45H, 47H, 48H, 49H, 50H, 51H, 58H, 59H, 60H, 63H, 67H, 69H, 71H, 73H, 76H, 78H, 91H, 93H, 94H, 2L, 4L, 25L, 29L, 27bL, 33L, 34L, 36L, 38L, 43L, 44L, 46L, 47L, 48L, 49L, 55L, 58L, 62L, 64L, 71L, 87L, 89L, 90L, 91L, 94L, 95L (все согласно нумерации по Kabat). Иллюстративная подгруппа этих остатков для гуманизации связывающего белка по изобретению состоит из 27H, 48H, 67H, 69H, 93H, 36L, 43L, 46L, 47L, 49L, 58L, 71L и 87L.
В другом варианте осуществления связывающий белок по изобретению содержит консенсусный вариабельный домен человека.
В одном варианте осуществления связывающий IL-1β белок по изобретению содержит по меньшей мере один вариабельный домен, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-189.
В другом варианте осуществления связывающий белок по изобретению содержит по меньшей мере одни вариабельную область (или домен) тяжелой цепи (VH), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210.
В другом варианте осуществления связывающий белок по изобретению содержит по меньшей мере одну вариабельную область (домен) легкой цепи (VL), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189.
В другом варианте осуществления связывающий белок согласно изобретению содержит по меньшей мере одну область VH, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 60-148, 196, 198, 200, 202, 204, 206, 208 и 210, и по меньшей мере одну область VL, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 149-189, 197, 199, 201, 203, 205, 207, 209 и 211.
В одном варианте осуществления связывающий белок по изобретению изобретение содержит два вариабельных домена, где два вариабельных домена содержат аминокислотные последовательности, выбранные из группы, состоящей из:




В другом варианте осуществления связывающий IL-1β белок, описанный в настоящем описании, выбран из группы, состоящей из: молекулы иммуноглобулина; scFv; моноклонального антитела; антитела человека; химерного антитела; гуманизированного антитела; однодоменного антитела; Fab-фрагмента; Fab’-фрагмента; F(ab’)2; Fv; и связанного дисульфидной связью Fv. В предпочтительном варианте осуществления связывающий IL-1β белок представляет собой антитело человека.
В одном аспекте изобретения связывающий белок, описанный в настоящем описании, способен модулировать биологическую функцию IL-1. В другом аспекте связывающий белок, описанный в настоящем описании, способен нейтрализовать IL-1.
В одном варианте осуществления связывающий белок, описанный в настоящем описании, имеет константу скорости ассоциации (Kon) для IL-1β, выбранную из группы, состоящей из: по меньшей мере приблизительно 102 M-1c-1; по меньшей мере приблизительно 103 M-1c-1; по меньшей мере приблизительно 104 M-1c-1; по меньшей мере приблизительно 105 M-1c-1; и по меньшей мере приблизительно 106 M-1c-1, при измерении поверхностным плазмонным резонансом.
В другом варианте осуществления связывающий белок, описанный в настоящем описании, имеет константу скорости диссоциации (Koff) для IL-1β, выбранную из группы, состоящей из: не более чем приблизительно 10-3 c-1; не более чем приблизительно 10-4 c-1; не более чем приблизительно 10-5 c-1; и не более чем приблизительно 10-6 c-1, при измерении поверхностным плазмонным резонансом.
В другом варианте осуществления связывающий белок, описанный в настоящем описании, имеет константу диссоциации (KD) для IL-1β, выбранную из группы, состоящей из: не более чем приблизительно 10-7 M; не более чем приблизительно 10-8 M; не более чем приблизительно 10-9 M; не более чем приблизительно 10-10 M; не более чем приблизительно 10-11 M; не более чем приблизительно 10-12 M; и не более чем 10-13 M.
В одном аспекте изобретение относится к конструкции связывающего белка, которая содержит связывающий белок, описанный в настоящем описании, и дополнительно содержит линкер или константный домен иммуноглобулина. В одном варианте осуществления конструкция связывающего белка содержит связывающий белок, где связывающий белок выбран из группы, состоящей из: молекулы иммуноглобулина, связанного дисульфидной связью Fv, моноклонального антитела, scFv, химерного антитела, антитело с пересаженной CDR, диантитела, гуманизированного антитела, полиспецифического антитела, Fab, антитела с двойной специфичностью, Fab’, биспецифического антитела, и F(ab’)2, DVD-IgTM и Fv.
В одном варианте осуществления конструкция связывающего белка содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена IgM человека, константного домена IgG4 человека, константного домена IgG1 человека, константного домена IgE человека, константного домена IgG2 человека и константного домена IgG3 человека и константного домена IgA человека.
В другом варианте осуществления конструкция связывающего белка содержит константный домен иммуноглобулина, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
Также изобретение относится к конъюгату связывающего белка, который содержит конструкцию связывающего белка, описанную в настоящем описании, и дополнительно содержит средство, выбранное из группы, состоящей из молекулы иммуноадгезии, радиофармацевтического средства, лекарственного средства и цитотоксического средства. Радиофармацевтические средства, которые пригодны в качестве частей средства в конъюгатах связывающего белка, описанных в настоящем описании, включают, но не ограничиваются ими, радиоактивную метку, фермент, флуоресцентную метку, люминесцентную метку, биолюминесцентную метку, магнитную метку и биотин. В одном варианте осуществления радиоактивная метка выбрана из группы, состоящей из:3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho и153Sm.
В другом варианте осуществления конъюгат связывающего белка содержит средство, которое является терапевтическим или цитотоксическим средством, выбранным из группы, состоящей из: антиметаболита, алкилирующего средства, антибиотика, фактора роста, цитокина, антиангиогенного средства, антимитотического средства, антрациклина, токсина и апоптотического средства.
В одном варианте осуществления связывающий белок, конструкция связывающего белка или конъюгат связывающего белка, описанные в настоящем описании, обладают паттерном гликозилирования человека.
Связывающие белки, конструкции связывающего белка и конъюгаты связывающего белка, описанные в настоящем описании, могут существовать в качестве растворимых белков или в качестве кристаллов. В одном варианте осуществления такие кристаллы представляют собой не содержащие носителя фармацевтические кристаллы с контролируемым высвобождением. В другом варианте осуществления кристаллические формы связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанных в настоящем описании, имеют большее время полужизни in vivo, чем их растворимые аналоги. В другом варианте осуществления кристаллы связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанных в настоящем описании, сохраняют биологическую активность их растворимых аналогов.
Композиции по изобретению включают композицию для высвобождения кристаллизованного связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанных в настоящем описании, включающую:
(a) состав, где указанный состав содержит кристаллизованный связывающий белок, конструкцию связывающего белка или конъюгат связывающего белка, описанные в настоящем описании, и ингредиент; и
(b) по меньшей мере один полимерный носитель.
Полимерные носители, пригодные в композициях по изобретению, включают, но не ограничиваются ими, один или несколько из группы, состоящей из: поли(акриловой кислоты), поли(цианоакрилатов), поли(аминокислот), поли(ангидридов), поли(депсипептида), поли(сложных эфиров), поли(молочной кислоты), поли(молочной и гликолевой кислоты) или PLGA, поли(b-гидроксибутирата), поли(капролактона), поли(диоксанона); поли(этиленгликоля), поли((гидроксипропил)меткриламида), поли[(органо)фосфазена], поли(сложных ортоэфиров), поли(винилового спирта), поли(винилпирролидона), сополимеров малеинового ангидрида-алкилвинилового простого эфира, полиолов pluronic, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов, их смесей и сополимеров.
В другом аспекте ингредиент композиции по изобретению выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактита, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля.
Также изобретение относится к фармацевтическим композициям, содержащим связывающий белок, конструкцию связывающего белка или конъюгат связывающего белка, описанные в настоящем описании, и фармацевтически приемлемый носитель. Фармацевтические композиции по изобретению, кроме того, могут содержать по меньшей мере одно дополнительное средство. В одном варианте осуществления такое дополнительное средство включает, но не ограничивается ими: терапевтическое средство, радиофармацевтическое средство, цитотоксическое средство, ингибиторы ангиогенеза; ингибиторы киназ; блокаторы костимуляторных молекул; блокаторы молекул адгезии; антитело против цитокина или его функциональный фрагмент; метотрексат; циклоспорин; рапамицин; FK506; поддающуюся детекции метку или репортер; антагонист TNF; противоревматическое средство; мышечный релаксант, наркотическое средство, нестероидное противовоспалительное лекарственное средство (NSAID), анальгетик, анестетик, седативное средство, местный анальгетик, нервно-мышечный блокатор, противомикробное средство, антипсориатическое средство, кортикостероид, анаболический стероид, эритропоэтин, средство для иммунизации и иммуноглобулин, иммунодепрессивное средство, гормон роста, гормон-заместительное лекарственное средство, радиофармацевтическое средство, антидепрессант, антипсихотическое средство, стимулятор, лекарственное средство против астмы, бета-агонист, ингалируемый стероид, адреналин или его аналог, цитокин и антагонист цитокина.
В одном варианте осуществления фармацевтическая композиция по изобретению содержит фармацевтически приемлемый носитель, где носитель также служит в качестве адъюванта, увеличивая абсорбцию или диспергирование связывающего белка, конструкции связывающего белка или конъюгата связывающего белка в композиции. Иллюстративным адъювантом является гиалуронидаза.
В другом варианте осуществления фармацевтическая композиция, кроме того, содержит по меньшей мере одно дополнительное лекарственное средство для лечения нарушения, при котором активность IL-1β является вредоносной.
В другом варианте осуществления изобретение относится к выделенным нуклеиновым кислотам, кодирующим одну или несколько аминокислотных последовательностей связывающего белка, описанного в настоящем описании. Такие нуклеиновые кислоты можно встраивать в вектор для проведения различных генетических анализов и рекомбинантных способов экспрессии, охарактеризации или улучшения одного или нескольких свойств связывающего белка, описанного в настоящем описании. Вектор может содержать одну или несколько молекул нуклеиновых кислот, кодирующих одну или несколько аминокислотных последовательностей связывающего белка, описанного в настоящем описании, где одна или несколько молекул нуклеиновых кислот функционально связаны с соответствующими транскрипционными и/или трансляционными последовательностями, которые позволяют экспрессию связывающего белка в конкретной клетке-хозяине, имеющей вектор. Примеры векторов для клонирования нуклеиновых кислот, кодирующих связывающие белки, описанные в настоящем описании, включают, но не ограничиваются ими, pcDNA, pTT, pTT3, pEFBOS, pBV, pJV и pBJ.
Также изобретение относится к клетке-хозяину, содержащей вектор, включающий нуклеиновую кислоту, кодирующую одну или несколько аминокислотных последовательностей связывающего белка, описанного в настоящем описании. Клетки-хозяева, пригодные для изобретения, могут быть прокариотическими или эукариотическими. Иллюстративной прокариотической клеткой-хозяином является Escherichia coli. Эукариотические клетки, пригодные в клетках-хозяевах по изобретению, включают клетки простейших, клетки животных, клетки растений и клетки грибов. Иллюстративными клетками грибов являются клетки дрожжей, включая Saccharomyces cerevisiae. Иллюстративная клетка животного, пригодная в качестве клетки-хозяина по изобретению, включает, но не ограничивается ими, клетку млекопитающего, клетку птицы и клетку насекомого. Предпочтительные клетки млекопитающих включают клетки CHO и COS. Клетка насекомых, пригодная в качестве клетки-хозяина по изобретению, представляет собой клетку насекомых Sf9.
В другом аспекте изобретение относится к способу получения связывающего белка, описанного в настоящем описании, включающему культивирование клетки-хозяина, содержащей вектор, кодирующий белок в культуральной среде в условиях, достаточных для продуцирования связывающего белка, способного связывать IL-1α и/или IL-1β. Полученный таким образом белок можно выделять и использовать в различных композициях и способах, описанных в настоящем описании.
В другом варианте осуществления изобретение относится к способу снижения активности IL-1 человека, включающему контактирование IL-1 человека со связывающим белком, описанным в настоящем описании, так чтобы активность IL-1 человека снижалась.
Другой вариант осуществления изобретения относится к способу лечения индивидуума от нарушения путем введения индивидууму связывающего белка, описанного в настоящем описании, так чтобы обеспечивалось лечение.
В другом варианте осуществления связывающий белок; описанный в настоящем описании; пригоден для лечения нарушения; выбранного из группы; состоящей из: диабета; увеита; невропатической боли; остеоартритической боли; воспалительной боли; ревматоидного артрита; остеоартрита; ювенильного хронического артрита; септического артрита; артрита Лайма; псориатического артрита; реактивного артрита; спондилоартропатии; системной красной волчанки (SLE); болезни Крона; язвенного колита; воспалительного заболевания кишечника; аутоиммунного диабета; инсулинзависимого сахарного диабета; тиреоидита; астмы; аллергических заболеваний; псориаза; дерматита; склеродермии; реакции "трансплантат против хозяина"; отторжения трансплантата органа; острого иммунного заболевания, ассоциированного с трансплантацией органа; хронического иммунного заболевания, ассоциированного с трансплантацией органа; саркоидоза; атеросклероза; диссеминированного внутрисосудистого свертывания (DIC); болезни Кавасаки; болезни Грэйвса; нефротического синдрома; синдрома хронической усталости; гранулематоза Вегенера; пурпуры Шенлейна-Геноха; микроскопического васкулита почек; хронического активного гепатита; аутоиммунного увеита; септического шока; синдрома токсического шока; септического синдрома; кахексии; инфекционных заболеваний; паразитарных заболеваний; острого поперечного миелита; хореи Гентингтона; болезни Паркинсона; болезни Альцгеймера; инсульта; первичного билиарного цирроза; гемолитической анемии; злокачественных опухолей; сердечной недостаточности; инфаркта миокарда; болезни Аддисона; спорадического полигландулярного дефицита типа I; полигландулярного дефицита типа II (синдрома Шмидта); взрослого респираторного дистресс-синдрома (ARDS); алопеции; очаговой алопеции; серонегативной артропатии; артропатии; болезни Рейтера; псориатической артропатии; связанной с язвенным колитом артропатии; энтеропатического синовита; ассоциированной с Chlamydia, Yersinia и Salmonella артропатии; спондилоартропатии; атероматозного заболевания/артериосклероза; атопической аллергии; аутоиммунного буллезного заболевания; пемфигуса обыкновенного; листовидного пемфигуса; пемфигоида; болезни линейных IgA; аутоиммунной гемолитической анемии; Кумбс-положительной гемолитической анемии; приобретенной пернициозной анемии; ювенильной пернициозной анемии; миалгического энцефалита/"Royal Free Disease"; хронического кожно-слизистого кандидоза; гигантоклеточного артериита (GCA); первичного склерозирующего гепатита; криптогенного аутоиммунного гепатита; синдрома приобретенного иммунодефицита (СПИД); связанных с приобретенным иммунодефицитом заболеваний; гепатита B; гепатита C; вариабельного неклассифицируемого иммунодефицита (вариабельной неклассифицируемой гипогаммаглобулинемии); кардиомиопатии с дилятацией; женского бесплодия; недостаточности яичников; преждевременного угасания функции яичников; фиброзного заболевания легких; криптогенного фиброзного альвеолита; поствоспалительного интерстициального заболевания легких; интерстициального пневмонита; связанного с болезнью соединительной ткани интерстициального заболевания легких; ассоциированного со смешанной болезнью соединительной ткани заболевания легких; ассоциированного с системной склеродермией заболевания легких; ассоциированного с ревматоидным артритом интерстициального заболевания легких; ассоциированного с системной красной волчанкой заболевания легких; ассоциированного с дерматомиозитом/полимиозитом заболевания легких; ассоциированного с болезнью Шегрена заболевания легких; ассоциированного с анкилозирующим спондилитом заболевания легких; васкулитного диффузного заболевания легких; ассоциированного с гемосидерозом заболевания легких; индуцированного лекарственным средством интерстициального заболевания легких; фиброза; связанного с радиацией фиброза; облитерирующего бронхиолита; хронической эозинофильной пневмонии; заболевания легких с инфильтрацией лимфоцитов; постинфекционного интерстециального заболевания легких; подагрического артрита; аутоиммунного гепатита; аутоиммунного гепатита 1 типа (классического аутоиммунного или люпоидного гепатита); аутоиммунного гепатита 2 типа (гепатита, связанного с антителом против LKM); опосредуемой аутоиммунным заболеванием гипогликемии; устойчивости к инсулину типа B с акантокератодермией; гипопаратиреоза; остеоартроза; первичного склерозирующего холангита; псориаза 1 типа; псориаза 2 типа; идиопатической лейкопении; аутоиммунной нейтропении; NOS-болезни почек; гломерулонефрита; микроскопического васкулита почек; болезни Лайма; дискоидной красной волчанки; идиопатического мужского бесплодия; ассоциированного с оксидом азота мужского бесплодия; аутоиммунитета к сперматозоидам; рассеянного склероза (все подтипы, включая первично-прогрессирующий, вторично-прогрессирующий и ремитирующий); симпатической офтальмии; легочной гипертензии, вторичной для болезни соединительной ткани; синдрома Гудпасчера; легочного проявления узелкового полиартериита; острой ревматической атаки; ревматоидного спондилита; болезни Стилла; системной склеродермии; синдрома Шегрена; болезни/артериита Такаясу; аутоиммунной тромбоцитопении (AITP); идиопатической тромбоцитопении; аутоиммунного заболевания щитовидной железы; гипертиреоидизма; зобного аутоиммунного гипотиреоза (болезнь Хашимото); атрофического аутоиммунного гипотиреоза; первичной микседемы; факогенного увеита; первичного васкулита; витилиго; острого заболевания печени; хронического заболевания печени; алкогольного цирроза; индуцированного алкоголем повреждения печени; холестаза; идиосинкразического заболевания печени; индуцированного лекарственным средством гепатита; неалкогольного стеатогепатита; аллергии; стрептококковой инфекции группы B (GBS); психических расстройств (например, депрессия и шизофрения); опосредуемых типом Th2 и типом Th1 заболеваний; острой и хронической боли (различные формы боли); и злокачественной опухоли (такой как рак легкого, молочной железы, желудка, мочевого пузыря, толстого кишечника, поджелудочной железы, яичника, предстательной железы и прямой кишки); гемопоэтических злокачественных опухолей; лейкоза; лимфомы; абеталипопротеинемии; акроцианоза; острых и хронических паразитарных и инфекционных процессов; острого лейкоза; острого лимфобластного лейкоза (ALL); T-клеточного ALL; FAB ALL; острого миелоидного лейкоза (AML); острой или хронической бактериальной инфекции; острого панкреатита; острой почечной недостаточности; аденокарциномы; эктопической систолы предсердий; СПИД-дементного комплекса; индуцированного алкоголем гепатита; аллергического конъюнктивита; аллергического контактного дерматита; аллергического ринита; отторжения аллотрансплантата; дефицита альфа-1-антитрипсина; бокового амиотрофического склероза; анемии; стенокардии; дегенерации клеток передних рогов спинного мозга; терапии против CD3; антифосфолипидного синдрома; реакций гиперчувствительности против рецепторов; аортальных и периферических аневризм; расслоения аорты; артериальной гипертензии; артериосклероза; артериовенозного свища; атаксии; фибрилляции предсердий (постоянной или пароксизмальной); трепетания предсердий; атриовентрикулярной блокады; B-клеточной лимфомы; отторжения трансплантата кости; отторжения трансплантата костного мозга (BMT); блокады пучка Гиса; лимфомы Беркитта; ожогов; аритмий сердца; синдрома оглушения сердца; опухолей сердца; кардиомиопатии; воспалительных ответов на искусственное кровообращение; отторжения трансплантата хряща; дегенерации коры головного мозга; нарушений мозжечка; хаотической или многоочаговой тахикардии предсердий; ассоциированных с химиотерапией нарушений; хронического миелоцитарного лейкоза (CML); хронического алкоголизма; хронических воспалительных патологий; хронического лимфоцитарного лейкоза (CLL); хронического обструктивного заболевания легких (COPD); хронической интоксикации салицилатами; карциномы ободочной и прямой кишки; застойной сердечной недостаточности; конъюнктивита; контактного дерматита; легочного сердца; болезни коронарных артерий; болезни Крейтцфельда-Якоба; культурально-негативного сепсиса; кистозного фиброза; ассоциированных с цитокиновой терапией нарушений; деменции боксеров; демиелинизирующих заболеваний; геморрагической лихорадки денге; дерматита; дерматологических состояний; сахарного диабета; диабетического атеросклеротического заболевания; диффузного заболевания с тельцами Леви; застойной кардиомиопатии с дилятацией; нарушений базальных ганглиев; синдрома Дауна в среднем возрасте; двигательных нарушений, индуцированных лекарственным средством, которое блокирует дофаминовые рецепторы ЦНС; чувствительности к лекарственным средствам; экземы; энцефаломиелита; эндокардита; эндокринопатии; эпиглоттита; инфекции вирусом Эпштейна-Барр; эритромелалгии; экстрапирамидальных и мозжечковых нарушений; семейного гематофагоцитарного лимфогистиоцитоза; отторжения имплантата эмбрионального тимуса; наследственной атаксии Фридрейха; функциональных нарушений периферических артерий; грибкового сепсиса; газовой гангрены; язвы желудка; гломерулонефрита; отторжения трансплантата любого органа или ткани; грамотрицательного сепсиса; грамположительного сепсиса; гранулем вследствие внутриклеточных организмов; волосатоклеточного лейкоза; болезни Галлервордена-Шпатца; тиреоидита Хашимото; сенной лихорадки; отторжения трансплантата сердца; гемахроматоза; гемодиализа; гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры; кровопотери; гепатита A; аритмий пучка Гиса; ВИЧ-инфекции/ВИЧ-невропатии; болезни Ходжкина; гиперкинетических двигательных нарушений; реакций гиперчувствительности; связанного с гиперчувствительностью пневмонита; гипертензии; гипокинетических двигательных нарушений; обследования гипоталамо-гипофизарно-надпочечниковой системы; идиопатической болезни Аддисона; идиопатического фиброза легких (IPF); опосредуемой антителами цитотоксичности; астении; младенческой спинальной мышечной атрофии; воспаления аорты; вируса гриппа a; облучения ионизирующей радиацией; иридоциклита/увеита/оптического неврита; повреждения при ишемии-реперфузии; ишемического инсульта; ювенильного ревматоидного артрита; ювенильной спинальной мышечной атрофии; саркомы Капоши; отторжения трансплантата почки; легионеллеза; лейшманиоза; лепры; повреждений кортикоспинальной системы; жирового отека; отторжения трансплантата печени; лимфатического отека; малярии; злокачественной лимфомы; злокачественного гистиоцитоза; злокачественной меланомы; менингита; менингококкемии; метаболического синдрома; мигрени; идиопатической мигрени; митохондриального полисистемного нарушения; смешанной болезни соединительной ткани; моноклональной гаммапатии; множественной миеломы; полисистемной дегенерации (Менцеля, Дежерина-Тома, Шая-Дрейджера и Мачадо-Джозефа); миастении; внутриклеточных mycobacterium avium, mycobacterium tuberculosis; миелодиспластического синдрома; инфаркта миокарда; ишемических нарушений миокарда; карциномы носоглотки; хронического заболевания легких новорожденных; нефрита; нефроза; нейродегенеративных заболеваний; нейрогенных мышечных атрофий I; нейтропенической лихорадки; неходжкинских лимфом; окклюзии брюшного отдела аорты и ее ветвей; окклюзионных нарушений артерий; терапии OKT3®; орхита/эпидидимита; орхита/возвратных процедур после вазэктомии; органомегалии; остеопороза; отторжения трансплантата поджелудочной железы; карциномы поджелудочной железы; паранеопластического синдрома/гиперкальцемии при злокачественной опухоли; отторжения трансплантата паращитовидной железы; воспалительного заболевания органов таза; круглогодичного ринита; заболевания перикарда; периферического артериосклеротического заболевания; периферических сосудистых нарушений; перитонита; пернициозной анемии; пневмонии Pneumocystis carinii; пневмонии; синдрома POEMS (полиневропатия, органомегалия, эндокринопатия, моноклональная гаммапатия и синдром кожных изменений); постперфузионного синдрома; синдрома после искусственного кровообращения; посткардиотомного синдрома после инфаркта миокарда; преэклампсии; прогрессирующего супрануклеарного паралича; первичной гипертензии легких; лучевой терапии; феномена Рейно; болезни Рейно; болезни Рефсума; регулярной тахикардии с узким QRS; вазоренальной гипертензии; реперфузионного повреждения; рестриктивной кардиомиопатии; сарком; сенильной хореи; сенильной деменции с тельцами Леви; серонегативных артропатий; шока; серповидноклеточной анемии; отторжения аллотрансплантата кожи; синдрома кожных изменений; отторжения трансплантата тонкого кишечника; солидных опухолей; специфических аритмий; спинальной атаксии; спиномозжечковых дегенераций; стрептококкового миозита; структурных повреждений мозжечка; подострого склерозирующего панэнцефалита; обмороков; сифилиса сердечно-сосудистой системы; системной анафилаксии; синдрома системного воспалительного ответа; ювенильного ревматоидного артрита с системным началом; телеангиэктазии; облитерирующего тромбоангита; тромбоцитопении; токсичности; трансплантации; травмы/кровопотери; реакций гиперчувствительности типа III, гиперчувствительности типа IV; нестабильной стенокардии; уремии; уросепсиса; крапивницы; заболеваний клапанов сердца; варикоза вен; васкулита; заболеваний вен; венозного тромбоза; фибрилляции желудочков; вирусных и грибковых инфекций; энцефалита с высоким риском смертельного исхода/асептического менингита; гемофагоцитарного синдрома с высоким риском смертельного исхода; синдрома Вернике-Корсакова; болезни Вилсона; отторжения ксенотрансплантата любого органа или ткани; острого коронарного синдрома; острого идиопатического полиневрита; острой воспалительной демиелинизирующей полирадикулоневропатии; острой ишемии; болезни Стилла взрослых; очаговой алопеции; анафилаксии; синдрома антифосфолипидных антител; апластической анемии; артериосклероза; атопической экземы; атопического дерматита; аутоиммунного дерматита; аутоиммунного нарушения, ассоциированного со стрептококковой инфекцией; аутоиммунной энтеропатии; аутоиммунной потери слуха; аутоиммунного лимфопролиферативного синдрома (ALPS); аутоиммунного миокардита; аутоиммунного преждевременного угасания функции яичников; блефарита; бронхоэктазов; буллезного пемфигоида; сердечно-сосудистого заболевания; катастрофического антифосфолипидного синдрома; глютеиновой болезни; шейного спондилеза; хронической ишемии; рубцового пемфигоида; клинически изолированного синдрома (CIS) с риском рассеянного склероза; конъюнктивита; психиатрического нарушения с началом в детском возрасте; дакриоцистита; дерматомиозита; диабетической ретинопатии; грыжи межпозвоночного диска; пролапса межпозвоночного диска; индуцированной лекарственным средством иммунной гемолитической анемии; эндокардита; эндометриоза; эндофтальмита; эписклерита; полиформной эритемы; тяжелой полиформной эритемы; гестационного пемфигоида; синдрома Гийена-Барре (GBS); сенной лихорадки; синдрома Хьюза; идиопатической болезни Паркинсона; идиопатической интерстициальной пневмонии; опосредуемой IgE аллергии; иммунной гемолитической анемии; миозита с тельцами включения; инфекционного воспалительного заболевания глаз; воспалительного демиелинизирующего заболевания; воспалительного заболевания сердца; воспалительного заболевания почек; ирита; кератита; сухого кератоконъюнктивита; болезни Куссмауля или болезни Куссмауля-Мейера; паралича Ландри; гистиоцитоза клеток Лангерганса; гроздевидной кожи; дегенерации желтого пятна; микроскопического полиангиита; болезни Бехтерева; нарушений двигательных нейронов; пемфигоида слизистых оболочек; полиорганной недостаточности; миастении; миелодиспластического синдрома; миокардита; нарушений корешков нервов; невропатии; не-A не-B гепатита; оптического неврита; остеолизиса; олигоартикулярного JRA; окклюзионого заболевания периферических артерий (PAOD); заболевания периферических сосудов (PVD); заболевания периферических артерий (PAD); флебита; узелкового полиартериита (или нодозного полиартериита); полихондрита; ревматической полимиалгии; полиоза; полиартикулярного JRA; синдрома полиэндокринной недостаточности; полимиозита; ревматической полимиалгии (PMR); синдрома после искусственного кровообращения; первичного паркинсонизма; вторичного паркинсонизма; простатита; истинной эритроцитарной аплазии; первичной недостаточности надпочечников; рецидивирующего оптического нейромиелита; рестеноза; ревматической болезни сердца; SAPHO (синовит, угри, пустулез, гиперостоз и остеит); вторичного амилоидоза; шокового легкого; склерита; ишиаса; вторичной недостаточности надпочечников; ассоциированного с кремнийорганическими соединениями заболевания соединительных тканей; дерматоза Снеддона-Уилкинсона; анкилозирующего спондилита; синдрома Стивенса-Джонсона (SJS); синдрома системного воспалительного ответа; височного артериита; токсоплазменного ретинита; токсического эпидермального некролиза; поперечного миелита; TRAPS (периодический синдром, ассоциированный с рецептором 1 фактора некроза опухоли (TNFR)); резистентности к инсулину типа B с черным акантозом; аллергической реакции 1 типа; диабета типа II; крапивницы; обычной интерстициальной пневмонии (UIP); весеннего конъюнктивита; вирусного ретинита; синдрома Фогта-Коянаги-Харада (синдром VKH); влажной дегенерации желтого пятна; заживления ран; ассоциированной с Yersinia и Salmonella артропатии.
В следующем варианте осуществления способа лечения, описанного в настоящем описании, стадию введения индивидууму связывающего белка, или конструкции связывающего белка, или конъюгата связывающего белка, описанных в настоящем описании, проводят по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, внутрикапсулярного, внутрихрящевого, внутриполостного, внутрибрюшнополостного, внутримозжечкового, интрацеребровентрикулярного, внутрикишечного, внутришеечного, внутрижелудочного, внутрипеченочного, внутримиокардиального, внутрикостного, внутритазового, внутриперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, внутриректального, внутрипочечного, интраретинального, внутрипозвоночного, интрасиновиального, внутригрудного, внутриматочного, внутрипузырного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов.
Другой аспект изобретения представляет собой способ лечения пациента, страдающего нарушением, при котором IL-1 является вредоносным, включающий стадию введения связывающего белка, конструкции связывающего белка или конъюгата связывающего белка, описанного в настоящем описании выше, до, одновременно или после введения второго средства, где второе средство выбрано из группы, состоящей из ингалируемых стероидов; бета-агонистов; бета-агонистов короткого действия или длительного действия; антагонистов лейкотриенов или рецепторов лейкотриенов; ADVAIR; ингибиторов IgE; антител против IgE; XOLAIR; ингибиторов фосфодиэстеразы; ингибиторов PDE4; ксантинов; антихолинергических лекарственных средств; стабилизаторов тучных клеток; кромолина; ингибиторов IL-4; ингибиторов IL-5; ингибиторов эотаксина/CCR3; антагонистов гистамина или его рецепторов, включая антагонисты H1, H2, H3 и H4; антагонистов простагландина D или его рецепторов DP1 и CRTH2; антагонистов TNF; растворимого фрагмента рецептора TNF; ENBREL®; ферментных антагонистов TNF; ингибиторов TNF-конвертирующего фермента (TACE); антагонистов мускариновых рецепторов; антагонистов TGF-бета; интерферона-гамма; перфенидона; химиотерапевтических средств, метотрексата; лефлуномида; сиролимуса (рапамицина) или его аналога, CCI-779; ингибиторов COX2 или cPLA2; NSAID; иммуномодуляторов; ингибиторов p38; ингибиторов TPL-2, MK-2 и NFkB; буденозида; эпидермального фактора роста; кортикостероидов; циклоспорина; сульфасалазина; аминосалицилатов; 6-меркаптопурина; азатиоприна; метронидазола; ингибиторов липоксигеназы; месаламина; олсалазина; балсалазида; антиоксидантов; ингибиторов тромбоксана; антагонистов рецептора IL-1; антител против IL-1β; антител против IL-6; факторов роста; ингибиторов эластазы; пиридинил-имидазольных соединений; антител к TNF, LT, IL-I, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, EMAP-II, GM-CSF, FGF или PDGF или их агонистов; антител к CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандам; FK506; рапамицина; микофенолата мофетила; ибупрофена; преднизолона; ингибиторов фосфодиэстеразы; агонистов аденозина; антитромботических средств; ингибиторов комплемента; адрегергических средств; ингибиторов киназ IRAK, NIK, IKK, p38 или MAP; ингибиторов IL-1β-конвертирующего фермента; ингибиторов TNF-α-конвертирующего фермента; ингибиторов T-клеточной передачи сигнала; ингибиторов металлопротеиназ; 6-меркаптопуринов; ингибиторов ангиотензинпревращающего фермента; растворимых рецепторов цитокинов; растворимого рецептора TNF p55; растворимого рецептора TNF p75; sIL-1RI; sIL-1RII; sIL-6R; противовоспалительных цитокинов; IL-4; IL-10; IL-11 и TGF-β.
Другой аспект изобретения относится по меньшей мере к одному IL-1-антиидиотипическому антителу по меньшей мере к одному связывающему IL-1 белку, описанному в настоящем описании. Антиидиотипическое антитело включает любую содержащую белок или пептид молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, такую как, но не ограничиваясь ими, по меньшей мере одна CDR тяжелой или легкой цепи или ее лиганд-связывающая часть, вариабельная область тяжелой цепи или легкой цепи, константная область тяжелой цепи или легкой цепи, каркасная область или любая их часть, которая может быть включена в связывающий белок по изобретению.
Подробное описание изобретения
Это изобретение относится к связывающим IL-1β белкам, включая, но не ограничиваясь ими, антитела против IL-1β антитела или их антигенсвязывающие части, которые связывают IL-1β, и поливалентные полиспецифические связывающие белки, такие как DVD-IgTM, которые связывают IL-1β и другую мишень. Различные аспекты изобретения относятся к антителам и фрагментам антител, связывающим белкам DVD-Ig, и их фармацевтическим композициям, а также к нуклеиновым кислотам, рекомбинантным экспрессирующим векторам и клеткам-хозяевам для получения таких связывающих IL-1β белков, включая антитела, связывающие белки DVD-Ig и их фрагменты. Также изобретение предусматривает способы применения связывающих IL-1β белков по изобретению для детекции IL-1β человека; для ингибирования IL-1β человека, либо in vitro, либо in vivo; и для регуляции экспрессии генов.
Также изобретение относится к любому связывающему белку или антителу, способным конкурировать со связывающим IL-1β белком, описанным в настоящем описании.
Если в настоящем описании не определено иначе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь те значения, которые обычно понимают специалисты в данной области. Значение и объем терминов должны быть очевидны, однако в случае какой-либо скрытой неопределенности, определения, представленные в настоящем описании, имеют преимущество над любым словарем или посторонним определением. Кроме того, если контекстом не требуется иное, термины в единственном числе включают множественное число, и термины во множественном числе включают единственное число. В этой заявке, применение "или" означает "и/или", если нет иных указаний. Более того, применение термина "включающий", а также других форм, таких как "включает" и "включенный", является неограничивающим. Также термины, такие как "элемент" или "компонент", охватывают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые включают более одной субъединицы, если нет иных конкретных указаний.
Как правило, используемые номенклатура и способы, связанные с культивированием клеток и тканей, молекулярной биологией, иммунологией, микробиологией, генетикой и химией белков и нуклеиновых кислот и гибридизацией, описанные в настоящем описании, представляют собой номенклатуру и способы, хорошо известные и обычно используемые в данной области. Способы и технологии по настоящему изобретению, как правило, проводят в соответствии с общепринятыми способами, хорошо известными в данной области и описанными в различных общих и более научных ссылках, которые цитированы и рассмотрены на протяжении настоящего описания, если нет иных указаний. Ферментативные реакции и способы очистки проводят в соответствии с указаниями изготовителя, как обычно выполняют в данной области или как описано в настоящем описании. Используемые номенклатура и лабораторные процессы, и способы аналитической химии, синтетической органической химии, и медицинской и фармацевтической химии, описанные в настоящем описании, представляют собой номенклатуру и лабораторные процессы и способы, хорошо известные и обычно используемые в данной области. Для химического синтеза, химических анализов, получения, изготовления и доставки фармацевтических средств, и лечения пациентов используют стандартные способы.
Для того чтобы настоящее изобретение могло быть более понятным, ниже определены избранные термины.
Термин "полипептид" относится к любой полимерной цепи аминокислот. Термины "пептид" и "белок" используют взаимозаменяемо с термином полипептид, и они также относятся к полимерной цепи аминокислот. Термин "полипептид" относится к нативным или искусственным белкам, фрагментам белков и полипептидным аналогам белковой последовательности. Полипептид может быть мономерным или полимерным. Термина "полипептид" охватывает полипептид и его фрагменты и варианты (в том числе фрагменты вариантов), если контекст не указывает на иное. Для антигенного полипептида, фрагмент полипептида необязательно содержит по меньшей мере один непрерывный или нелинейный эпитоп полипептида. Точные границы по меньшей мере одного эпитопного фрагмента могут быть установлены с использованием известных в данной области способов. Фрагмент содержит по меньшей мере приблизительно 5 последовательно расположенных аминокислот, например, по меньшей мере приблизительно 10 последовательно расположенных аминокислот, по меньшей мере приблизительно 15 последовательно расположенных аминокислот или по меньшей мере приблизительно 20 последовательно расположенных аминокислот. Вариант полипептида является таким, как описано в настоящем описании.
Термин "выделенный белок" или "выделенный полипептид" представляет собой белок или полипептид, который, исходя из его происхождения или источника, не ассоциирован с ассоциированными с ним в природе компонентами, которые сопровождают его в его нативном состоянии; по существу не содержит других белков того же вида; экспрессируется клеткой отличающегося вида; или не встречается в природе. Таким образом, полипептид, который является химически синтезированным или синтезированным в клеточной системе, отличной от клетки, которая является его природным источником, является "выделенным" из ассоциированных с ним в природе компонентов. Также белок можно делать по существу не содержащим ассоциированных с ним в природе компонентов выделением с использованием способов очистки белка, хорошо известных в данной области.
Термин "извлечение" относится к процессу обеспечения того, чтобы химическая молекула, такая как полипептид, по существу не содержала ассоциированных с ней в природе компонентов, посредством выделения, например, с использованием способов очистки белков, хорошо известных в данной области.
Термин "IL-1α человека" (сокращенно обозначаемый в настоящем описании как hIL-1α или IL-1α), включает плейотропный цитокин, вовлеченный в различные иммунные ответы, воспалительные процессы и гемопоэз. Например, IL-1α включает цитокин человека, продуцируемый активируемыми макрофагами; он стимулирует пролиферацию тимоцитов путем индукции высвобождения IL-2, созревание и пролиферацию B-клеток, и активность фибробластного фактора роста. Термин IL-1α человека включает рекомбинантный IL-1α человека (rhIL-1α), который можно получать стандантными рекомбинантными способами экспрессии.
Термин "IL-1β человека" (сокращенно обозначаемый в настоящем описании как hIL-1β или IL-1β) включает плейотропный цитокин, вовлеченный в различные иммунные ответы, воспалительные процессы и гемопоэз. Термин IL-1β человека включает рекомбинантный IL-1β человека (rhIL-1β), который можно получать стандартными рекомбинантными способами экспрессии.
Аминокислотные последовательности IL-1α и IL-1β человека представлены в таблице 1.
Термин "биологическая активность" относится ко всем присущим цитокину IL-1, например, IL-1α и/или IL-1β, биологическим свойствам. Биологические свойства IL-1α и IL-1β включают, но не ограничиваются ими, связывание с рецептором IL-1.
Термины "специфичное связывание" или "специфично связывающийся" в отношении взаимодействия антитела, белка или пептида со второй химической молекулой, означает, что взаимодействие зависит от наличия конкретной структуры (например, антигенной детерминанты или эпитопа) на химической молекуле; например, антитело распознает и связывает конкретную белковую структуру, а не белки в целом. Если антитело является специфичным к эпитопу "A", наличие молекулы, содержащей эпитоп A (или свободного немеченого A), в реакционной смеси, содержащей меченный "A" и антитело, будет снижать количество меченного A, связавшегося с антителом.
Термин "антитело" в широком значении относится к любой молекуле иммуноглобулина (Ig), содержащей четыре полипептидных цепи: две тяжелых (H) цепи и две легких (L) цепи, или к любому ее функциональному фрагменту, мутанту, варианту или производному, которые сохраняют существенные признаки связывания эпитопа молекулой Ig. Такие формы мутантов, вариантов или производных антител известны в данной области. Их неограничивающие варианты осуществления рассмотрены ниже.
В полноразмерном антителе каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначаемую в настоящем описании как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена: CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в настоящем описании как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен CL. Области VH и VL далее могут быть подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), расположенные между областями, являющимися более консервативными, которые называются каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекулы иммуноглобулинов могут относиться к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
Термин "Fc-область" используют для определения C-концевой области тяжелой цепи иммуноглобулина, которую можно получать расщеплением целого антитела папаином. Fc-область может представлять собой Fc-область с нативной последовательностью или вариант Fc-области. Fc-область иммуноглобулина, как правило, содержит два константных домена: CH2-домен и CH3-домен, и необязательно содержит CH4-домен. Замена аминокислотных остатков в Fc-участке для изменения эффекторной функции антитела известна в данной области (Winter, et al. патенты США №5648260 и 5624821). Fc-участок антитела опосредует несколько важных эффекторных функций, например, индукцию цитокинов, ADCC, фагоцитоз, комплементзависимую цитотоксичность (CDC) и время полужизни/скорость выведения антитела и комплексов антиген-антитело. В некоторых случаях, эти эффекторные функции являются желательными для терапевтического антитела, но в других случаях они могут быть необязательными или нежелательными, в зависимости от терапевтических целей. Определенные изотипы IgG человека, в частности IgG1 и IgG3, опосредуют ADCC и CDC через связывание с FcγR и компонентом комплемента C1q, соответственно. Неонатальные Fc-рецепторы (FcRn) являются основными компонентами, определяющими время полужизни антител в кровотоке. В другом варианте осуществления в константной области антитела, например, Fc-области антитела, заменен по меньшей мере один аминокислотный остаток, для изменения эффекторных функций. Димеризация двух идентичных тяжелых цепей иммуноглобулина опосредуется димеризацией CH3-доменов и стабилизируется дисульфидными мостиками в шарнирной области (Huber et al., Nature, 264: 415-420 (1976); Thies et al., J. Mol. Biol., 293: 67-79 (1999)). Мутация остатков цистеина в шарнирных областях для предотвращения образования дисульфидных мостиков между тяжелыми цепями приводит к дестабилизации димеризации CH3-доменов. Остатки, ответственные за димеризацию CH3, идентифицированы (Dall’ Acqua et al., Biochemistry, 37: 9266-9273 (1998)). Таким образом, можно получить одновалентный половинный Ig. Интересно, что эти одновалентные половинные молекулы Ig выявлены в природе как для подкласса IgG, так и для подкласса IgA (Seligmann et al., Ann. Immunol, 129 C: 855-870 (1978); Biewenga et al., Clin. Exp. Immunol., 51: 395-400 (1983)). Было определено, что стехиометрия FcRn:Fc-область Ig составляет 2:1 (West et al., Biochemistry, 39: 9698-9708 (2000)), и для опосредования связывания FcRn достаточно половины Fc (Kim et al., Eur. J. Immunol, 24: 542-548 (1994)). Мутации для нарушения димеризации CH3-домена могут не иметь существенного эффекта на его связывание с FcRn, поскольку остатки, важные для димеризации CH3, расположены на внутренней границе структуры b-слоя CH3, в то время как область, ответственная за связывание FcRn, расположена на наружной границе CH2-CH3-доменов. Однако половинная молекула Ig может иметь определенное преимущество в проникновении в ткани, вследствие ее меньшего размера по сравнению с размером правильного антитела. В одном из вариантов осуществления в константной области связывающего белка по изобретению, например в Fc-области, заменен по меньшей мере один аминокислотной остаток, так чтобы нарушалась димеризация тяжелых цепей, что приводит к половинным молекулам DVD-Ig. Противовоспалительная активность IgG полностью зависит от сиалирования N-связанного гликана в Fc-фрагменте IgG. Точные требования для гликанов в целях противовоспалительной активности были определены, так что можно получить соответствующий Fc-фрагмент IgG, тем самым получив полностью рекомбинантный сиалированный Fc IgG1 со значительно усиленной эффективностью (Anthony et al., Science, 320:373-376 (2008)).
Термин "антигенсвязывающая часть" антитела относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфично связываться с антигеном (например, hIL-1β). Было показано, что антигенсвязывающую функцию антитела может выполнять один или несколько фрагментов полноразмерного антитела. Такие варианты осуществления антител также могут быть биспецифическими, обладающими двойной специфичностью, или полиспецифическими, специфично связывающимися с двумя или более различными антигенами (например, hIL-1β и другой антигенной молекулой, такой как hIL-1β и hIL-1α). Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающая часть" антитела, включают (i) Fab-фрагмент - одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab’)2-фрагмент - двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидной связью в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., Nature, 341: 544-546 (1989); публикация PCT № WO 90/05144), который содержит один вариабельный домен; и (vi) отдельную определяющую комплементарность область (CDR). Более того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно связывать с использованием рекомбинантных способов синтетическим линкером, который позволяет получение их в качестве единой белковой цепи, в которой области VL и VH образуют пары, формируя одновалентные молекулы (известные как одноцепочечные Fv (scFv); см. например, Bird et al., Science, 242: 423-426 (1988); и Huston et al., Proc. Natl. Acad. Sci. USA, 85: 5879-5883 (1988)). Такие одноцепочечные антитела также охватываются термином "антигенсвязывающая часть" антитела. Также охватываются другие формы одноцепочечных антител, такие как диантитела. Диантитела представляют собой двухвалентные биспецифические антитела, в которых домены VH и VL экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечивать образование пар между двумя доменами на одной цепи, тем самым вынуждая домены образовывать пары с комплементарными доменами другой цепи и формировать два антигенсвязывающих участка (см. например, Holliger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993); Poljak, R.J., Structure, 2: 1121-1123 (1994)) Такие связывающие участки антитела известны в данной области (Kontermann and Diibel eds., Antibody Engineering (Springer-Verlag, New York, 2001), p. 790 (ISBN 3-540-41354-5)). Кроме того, одноцепочечные антитела также включают "линейные антитела", содержащие часть тандемных Fv-сегментов (VH-CH1-VH-CH1), которая, вместе с комплементарными полипептидами легкой цепи, образует пару антигенсвязывающих областей (Zapata et al., Protein Eng., 8(10): 1057-1062 (1995); и патент США №5641870).
Константный (C) домен иммуноглобулина относится к константному домену тяжелой цепи (CH) или легкой цепи (CL). Аминокислотные последовательности константных доменов тяжелых цепей и легких цепей IgG мыши и человека известны в данной области.
Термин "конструкция связывающего IL-1β белка" (или "конструкция связывающего белка") относится к полипептиду, содержащему одну или несколько антигенсвязывающих частей по изобретению, связанных с линкером или константным доменом иммуноглобулина. "Линкерный полипептид" содержит два или более аминокислотных остатка, связанных пептидными связями, и их используют для присоединения одной нескольких антигенсвязывающих частей. Такие линкерные полипептиды хорошо известны в данной области (см. например, Holliger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993); Poljak, R.J., Structure, 2: 1121-1123 (1994)). Константный домен иммуноглобулина относится к константному домену тяжелой или легкой цепи. Аминокислотные последовательности константных доменов тяжелой цепи и легкой цепи IgG человека известны в данной области и представлены в таблице 2.
Более того, связывающий IL-1β белок, такой как антитело или его антигенсвязывающая часть, может быть частью более крупной молекулы иммуноадгезии, образованной ковалентным или нековалентным связыванием антитела или антигенсвязывающей части с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают применение центральной области стрептавидина для получения тетрамерной молекулы scFv (Kipriyanov et al., Human Antibod. Hybridomas, 6: 93-101 (1995)) и применение остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения двухвалентных и биотинилированных молекул scFv (Kipriyanov et al., Mol. Immunol., 31: 1047-1058 (1994)). Части антител, такие как Fab- и F(ab’)2-фрагменты, можно получать из целых антител с использованием общепринятых способов, таких как расщепление папаином или пепсином, соответственно, целых антител. Более того, антитела, их антигенсвязывающие части и молекулы иммуноадгезии можно получать с использованием стандартных способов рекомбинантных ДНК.
"Выделенное антитело" относится к антителу, которое по существу свободно от других антител, имеющих отличающуюся специфичность связывания (например, выделенное антитело, которое специфично связывает hIL-1β по существу свободно от антител, которые специфично связывают антигены, отличные от hIL-1β). Однако выделенное антитело, которое специфично связывает hIL-1β, может обладать перекрестной реактивностью к другим антигенам, таким как молекулы IL-1β из других видов. Более того, выделенное антитело может быть по существу свободно от другого клеточного материала и/или химических веществ.
Термин "моноклональные антитело" или "mAb" относится к антителу, полученному из совокупности по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифическими и направлены против одного антигена. Более того, в противоположность препаратам поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое mAb направлено против одной детерминанты на антигене. Определение "моноклональные" не следует истолковывать как требование продукции антитела конкретным способом.
Термин "антитело человека" включает антитела, имеющие вариабельные и константные области из последовательностей иммуноглобулинов эмбрионального типа человека. Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов эмбрионального типа человека (например, мутации, внесенные случайным или сайт-специфическим мутагенезом in vitro или посредством соматической мутации in vivo), например в CDR и, в частности, в CDR3. Однако термин "антитело человека" не включает антитела, в которых последовательности CDR, образованные из последовательностей эмбрионального типа других видов млекопитающих, таких как мышь, пересажены в каркасные последовательности человека.
Термин "рекомбинантное антитело человека" включает все антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, такие как антитела, экспрессируемые с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина (дополнительно описанную в разделе II, ниже), антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека (Hoogenboom, H.R., Trends Biotechnol., 15: 62-70 (1997); Azzazy and Highsmith, Clin. Biochem., 35: 425-445 (2002); Gavilondo and Larrick, BioTechniques, 29: 128-145 (2000); Hoogenboom and Chames, Immunol. Today, 21: 371-378 (2000)), антитела, выделенные из животного (например, мыши), которое является трансгенным по генам иммуноглобулинов человека (см. Taylor et al., Nucl. Acids Res., 20: 6287-6295 (1992); Kellermann and Green, Curr. Opin. Biotechnol., 13: 593-597 (2002); Little et al., Immunol. Today, 21: 364-370 (2000)) или антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который вовлекает сплайсинг последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области, образованные из последовательностей иммуноглобулинов эмбрионального типа. Однако в определенных вариантах осуществления такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или, когда используют животное, трансгенное по последовательностям Ig человека, они подвергаются соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, когда они образованы из последовательностей VH и VL эмбрионального типа человека или когда они являются родственными им, могут не существовать в природе в наборе антител эмбрионального типа человека in vivo.
Термин "химерное антитело" относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из одного вида и последовательности константных областей из другого вида, таким как антитела, имеющие вариабельные области тяжелой и легкой цепей мыши, связанные с константными областями человека.
Термин "антитело с пересаженной CDR" относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепей одного вида, но в которых последовательности одной или нескольких из областей CDR VH и/или VL заменены последовательностями CDR другого вида, таким как антитела, имеющие вариабельные области тяжелой и легкой цепей мыши, в которых одна или несколько из CDR мыши (например, CDR3) заменены последовательностями CDR человека.
Термин "CDR" относится к определяющей комплементарность области в вариабельных последовательностях антитела. В каждой из вариабельных областей тяжелой и легкой цепи имеется три CDR, которые обозначают как CDR1, CDR2 и CDR3, для каждой из вариабельных областей. Термин "набор CDR", как используют в настоящем описании, относится к группе из трех CDR, которые встречаются в одной вариабельной области, способной связывать антиген. Точные границы этих CDR определяются по-разному в соответствии с различными системами. Система, описанная Kabat (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD (1987) и (1991)) не только обеспечивает однозначную систему нумерации остатков, применимую к любой вариабельной области антитела, но также предоставляет точные границы остатков, определяющих три CDR. Эти CDR могут быть обозначены как CDR по Kabat. Chothia и коллеги (Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987) и Chothia et al., Nature 342:877-883 (1989)) обнаружили, что определенные участки в CDR по Kabat принимают практически идентичные конформации пептидного остова, несмотря на наличие большого разнообразия на уровне аминокислотной последовательности. Эти участки были обозначены как L1, L2 и L3 или H1, H2 и H3, где "L" и "H" обозначают области легкой цепи и тяжелой цепи, соответственно. Эти области могут быть обозначены как CDR по Chothia, которые имеют границы, которые перекрывают CDR по Kabat. Другие границы, определяющие CDR, перекрывающиеся с CDR по Kabat, были описаны Padlan et al. (FASEB J. 9:133-139 (1995)) и MacCallum et al. (J Mol. Biol 262 (5): 732-45 (1996)). Другие определения границ CDR могут не точно соответствовать одной из систем, но тем не менее, они перекрывают CDR по Kabat, хотя они могут иметь большую или меньшую длину с учетом предсказания или экспериментальных данных о том, что конкретные остатки или группы остатки или даже целые CDR не оказывают значительного влияния на связывание антигена. В способах, используемых в рамках изобретения, могут быть использованы CDR, определенные согласно любой из этих систем, хотя в предпочтительных вариантах осуществления используются CDR, определенные по Kabat или Chothia.
Термины "нумерация по Kabat", "определения по Kabat" и "обозначение по Kabat" используют в настоящем описании взаимозаменяемо. Эти термины, которые являются известными в данной области, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающей части (Kabat et al., Ann. NY Acad. ScL , 190: 382-391 (1971); и Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 (1991)). Для вариабельной области тяжелой цепи, гипервариабельная область находится в диапазоне аминокислотных положений с 31 по 35 для CDR1, аминокислотных положений с 50 по 65 для CDR2, и аминокислотных положений с 95 по 102 для CDR3. Для вариабельной области легкой цепи, гипервариабельная область находится в диапазоне аминокислотных положений с 24 по 34 для CDR1, аминокислотных положений с 50 по 56 для CDR2 и аминокислотных положений с 89 по 97 для CDR3.
Расширение и анализ обширных общественных баз данных с аминокислотными последовательностями вариабельных областей тяжелой и легкой цепей на протяжении последних двадцати лет привели к пониманию типичных границ между последовательностями каркасных областей (FR) и CDR в последовательностях вариабельных областей и позволили специалистам в данной области точно определить CDR согласно нумерации Kabat, нумерации Chothia или другим системам. См., например, Martin, "Protein Sequence and Structure Analysis of Antibody Variable Domains", Chapter 31, Antibody Engineering, (Kontermann and Diibel, eds.) (Springer-Verlag, Berlin, 2001), особенно стр.432-433. Пригодный способ определения аминокислотных последовательностей CDR по Kabat в аминокислотных последовательностях вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) представлен ниже:
Для идентификации аминокислотной последовательности CDR-L1:
Начинается приблизительно через 24 аминокислотных остатка от N-конца области VL;
Остаток перед последовательностью CDR-L1 всегда представляет собой цистеин (C);
Остаток после последовательности CDR-L1 всегда представляет собой остаток триптофана (W), как правило, Trp-Tyr-Gln (W-Y-Q), но также Trp-Leu-Gln (W-L-Q), Trp-Phe-Gln (W-F-Q) и Trp-Tyr-Leu (W-Y-L);
Длина, как правило, составляет от 10 до 17 аминокислотных остатков.
Для идентификации аминокислотной последовательности CDR-L2:
Начинается всегда через 16 остатков после конца CDR-L1;
Остатки перед последовательностью CDR-L2, как правило, представляют собой Ile-Tyr (I-Y), но также Val-Tyr (V-Y), Ile-Lys (I-K) и Ile-Phe (I-F);
Длина всегда составляет 7 аминокислотных остатков.
Для идентификации аминокислотной последовательности CDR-L3:
Начинается всегда через 33 аминокислоты после конца CDR-L2;
Остаток перед аминокислотной последовательностью CDR-L3 всегда представляет собой цистеин (C);
Остатки после последовательности CDR-L3 всегда представляют собой Phe-Gly-X-Gly (F-G-X-G) (SEQ ID NO: 11), где X представляет собой любую аминокислоту;
Длина, как правило, составляет от 7 до 11 аминокислотных остатков.
Для идентификации аминокислотной последовательности CDR-H1:
Начинается приблизительно через 31 аминокислотный остаток после N-конца VH-области и всегда через 9 остатков после цистеина (C);
Остатки перед последовательностью CDR-H1 всегда представляют собой Cys-X-X-X-X-X-X-X-X (SEQ ID NO: 12), где X представляет собой любую аминокислоту;
Остаток после последовательности CDR-H1 всегда представляет собой Trp (W), как правило, Trp-Val (W-V), но также Trp-Ile (W-I) и Trp-Ala (W-A);
Длина, как правило, составляет от 5 до 7 аминокислотных остатков.
Для идентификации аминокислотной последовательности CDR-H2:
Начинается всегда через 15 аминокислотных остатков после конца CDR-H1;
Остатки перед последовательностью CDR-H2, как правило, представляют собой Leu-Glu-Trp-Ile-Gly (L-E-W-I-G) (SEQ ID NO: 23), а также другие варианты;
Остатки после последовательности CDR-H2 представляют собой Lys/Arg-Leu/Ile/Val/Phe/Thr/Ala-Thr/Ser/Ile/Ala (K/R-L/I/V/F/T/A-T/S/I/A);
Длина, как правило, составляет от 16 до 19 аминокислотных остатков.
Для идентификации аминокислотной последовательности CDR-H3:
Начинается всегда через 33 аминокислотных остатка после конца CDR-H2 и всегда через 3 остатка после цистеина (C),
Остатки перед последовательностью CDR-H3 всегда представляют собой Cys-X-X (C-X-X), где X представляет собой любую аминокислоту, как правило, Cys-Ala-Arg (C-A-R);
Остатки после последовательности CDR-H3 всегда представляют собой Trp-Gly-X-Gly (W-G-X-G) (SEQ ID NO: 24), где X представляет собой любую аминокислоту;
Длина, как правило, составляет от 3 до 25 аминокислотных остатков.
Как используют в рамках изобретения, термин "канонический" остаток относится к остатку в CDR или каркасной области, который определяет конкретную каноническую структуру CDR, при определении по Chothia et al. (J. Mol. Biol., 196 901-917 (1987)); и Chothia et al. (J. Mol. Biol., 227: 799-817 (1992), оба из которых включены в настоящее описание в качестве ссылок). Согласно Chothia et al., критические положения CDR многих антител имеют практически идентичные конформации пептидного остова, несмотря на большое разнообразие на уровне аминокислотной последовательности. Каждая каноническая структура определяет, главным образом, набор углов поворота пептидного остова для непрерывного сегмента из аминокислотных остатков, образующих петлю.
"Подвергнутое созреванию аффинности" антитело представляет собой антитело с одним или несколькими изменениями в одной или нескольких его CDR, которые приводят к повышению аффинности антитела к антигену, по сравнению с исходным антителом, которое не имеет этого изменения(ий). Иллюстративные подвергнутые созреванию аффинности антитела имеют наномолярную или даже пикомолярную аффинность к антигену-мишени. Подвергнутые созреванию аффинности антитела получают способами, известными в данной области. Marks et al. BioTechnology 10:779-783 (1992) описывают созревание аффинности путем шаффлинга VH- и VL-доменов. Случайный мутагенез остатков CDR и/или каркасной области описан Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); Hawkins et al, J. Mol. Biol 226:889-896 (1992) и селективная мутация в селективных положениях для мутагенеза, положениях контакта или положениях гипермутации посредством усиливающего активность аминокислотного остатка описана в патенте США US 6914128B1.
Термин "поливалентный связывающий белок" обозначает связывающий белок, содержащий два или более антигенсвязывающих участка. Поливалентный связывающий белок предпочтительно конструируют, чтобы он имел три или более антигенсвязывающих участка, и, как правило, он представляет собой не встречающееся в природе антитело. Термин "полиспецифический связывающий белок" относится к связывающему белку, способному связывать две или более родственных или неродственных мишени. Связывающие белки "с двойным вариабельным доменом" ("DVD") по изобретению содержат два или более антигенсвязывающих участка и представляют собой четырехвалентные или поливалентные связывающие белки. DVD могут быть моноспецифическими, способными связывать один антиген, или полиспецифическими, т.е. способными связывать два или более антигенов. Связывающий белок с DVD, содержащий два полипептида DVD тяжелой цепи и два полипептида DVD легкой цепи называют "DVD-иммуноглобулином" или "DVD-Ig". Каждая половина DVD-Ig содержит полипептид DVD тяжелой цепи, и полипептид DVD легкой цепи, и два антигенсвязывающих участка. Каждый связывающий участок содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи всего с шестью CDR, вовлеченными в связывание антигена, на антигенсвязывающий участок.
Описание конструирования, экспрессии и охарактеризации молекул DVD-Ig предоставлено в публикации PCT № WO 2007/024715, патенте США №7612181 и Wu et al., Nature Biotechnol., 25: 1290-1297 (2007). Предпочтительный пример таких молекул DVD-Ig включает тяжелую цепь, которая обладает структурной формулой VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен тяжелой цепи, VD2 представляет собой второй вариабельный домен тяжелой цепи, C представляет собой константный домен тяжелой цепи, X1 представляет собой линкер, при условии что он не является CH1, X2 представляет собой Fc-область, и n равно 0 или 1, но предпочтительно 1; и легкую цепь, которая обладает структурной формулой VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен легкой цепи, VD2 представляет собой второй вариабельный домен легкой цепи, C представляет собой константный домен легкой цепи, X1 представляет собой линкер, при условии что он не является CH1, и X2 не содержит Fc-область; и n равно 0 или 1, но предпочтительно 1. Такой DVD-Ig может содержать две такие тяжелые цепи и две такие легкие цепи, где каждая цепь содержит вариабельные домены, связанные тандемно без встроенной между вариабельными областями константной области, где тяжелая цепь и легкая цепь ассоциируют с образованием тандемных функциональных антигенсвязывающих центров, и пара тяжелой и легкой цепей может ассоциировать с парой тяжелой и легкой цепей с образованием тетрамерного связывающего белка с четырьмя функциональными антигенсвязывающими центрами. В другом примере молекула DVD-Ig может содержать тяжелую и легкую цепи, каждая из которых содержит три вариабельных домена (VD1, VD2, VD3), связанных тандемно без встроенной между вариабельными областями константной области, где пара тяжелой и легкой цепей может ассоциировать с образованием трех антигенсвязывающих центра, и где пара тяжелой и легкой цепей может ассоциировать с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающего белка с шестью антигенсвязывающими центрами.
Связывающий белок DVD-Ig может связывать один или несколько эпитопов IL-1β. Связывающий белок DVD-Ig также может связывать эпитоп IL-1β и эпитоп второго антигена-мишени, отличного от полипептида IL-1β.
Термин "биспецифическое антитело", Как используют в рамках изобретения, относится к полноразмерным антителам, которые получают технологией квадром (см. Milstein and Cuello, Nature, 305: 537-540 (1983)), путем химической конъюгации двух различных моноклональных антител (см. Staerz et al., Nature, 314: 628-631 (1985)), или с помощью "выступа-в-полости" или сходных подходов, в которых в Fc-область вносят мутации (см. Holliger et al., Proc. Natl. Acad. Sci. USA, 90(14): 6444-6448 (1993)), приводящие к множеству различных типов иммуноглобулинов, среди которых только один является функциональным биспецифическим антителом. В соответствии с его молекулярной функцией, биспецифическое антитело связывает один антиген (или эпитоп) одним из его двух связывающих плеч (одной парой HC/LC), и связывает другой антиген (или эпитоп) вторым из его плеч (другой парой HC/LC). Согласно этому определению, биспецифическое антитело имеет два отличающихся антигенсвязывающих плеча (как по специфичности, так и по последовательностям CDR), и является одновалентным для каждого антигена, с которым оно связывается.
Термин "антитело с двойной специфичностью", Как используют в рамках изобретения, относится к полноразмерным антителам, которые могут связывать два различных антигена (или эпитопа) каждым из его двух связывающих плеч (парой HC/LC) (см. публикацию PCT WO 02/02773). Таким образом, связывающий белок с двойной специфичностью имеет два идентичных связывающих антиген плеча с одинаковой специфичностью и идентичными последовательностями CDR и является двухвалентным для каждого антигена, который оно связывает.
"Функциональный антигенсвязывающий центр" связывающего белка представляет собой антигенсвязывающий центр, который способен связывать антиген-мишень. Аффинность связывания антигена антигенсвязывающим центром не обязательно является настолько же высокой, как у исходного антитела, являющегося источником антигенсвязывающего центра, но способность связывать должна быть поддающейся измерению с использованием одного из множества известных способов оценки связывания антитела с антигеном. Более того, аффинность связывания антигена для каждого из антигенсвязывающих центров поливалентного антитела, описанного в настоящем описании, не должна быть количественно одинаковой.
Термин "цитокин" является общим термином для белков, которые высвобождаются одной клеточной популяцией и которые действуют на другую клеточную популяцию в качестве внутриклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относятся гормоны роста, такие как гормон роста человека, N-метионильный гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фибробластный фактор роста; пролактин; плацентарный лактоген; фактор некроза опухоли, такой как фактор некроза опухоли-альфа (TNF-α) и фактор некроза опухоли-бета (TNF-β); мюллерова ингибирующая субстанция; ассоциированный с гонадотропином пептид мыши; ингибин; активин; сосудисто-эндотелиальный фактор роста; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-альфа (NGF-α); фактор роста тромбоцитов; плацентарный фактор роста, трансформирующие факторы роста (TGF), такие как TGF-альфа (TGF-α) и TGF-бета (TGF-β); инсулиноподобный фактор роста-1 и -11; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа (IFN-α), интерферон-бета (IFN-β) и интерферон-гамма (IFN-γ), колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-33; и другие полипептидные факторы, включая LIF и kit-лиганд (KL). Как используют в рамках изобретения, термин "цитокин" включает белки из природных источников или из рекомбинантной клеточной культуры и биологически активные эквиваленты цитокинов с нативной последовательностью.
Как используют в рамках изобретения, термины "донор" и "донорное антитело" относятся к антителу, предоставляющему одну или несколько CDR. В иллюстративном варианте осуществления донорное антитело представляет собой антитело из вида, отличающегося от антитела, из которого получены или происходят каркасные области. В контексте гуманизированного антитела термин "донорное антитело" относится к не являющемуся человеческим антителу, предоставляющему одну или несколько CDR.
Как используют в рамках изобретения, термин "каркасная область" или "последовательность каркасной области" относится к остальным последовательностям вариабельной области без CDR. Поскольку точное определение последовательности CDR можно проводить с помощью различных систем, значение каркасной последовательности подвергают соответственно различным интерпретациям. Шесть CDR (CDR-L1, -L2 и -L3 легкой цепи и CDR-H1, -H2 и -H3 тяжелой цепи) также делят каркасные области легкой цепи и тяжелой цепи на подобласти (FR1, FR2, FR3 и FR4) на каждой цепи, в которых CDR1 расположена между FR1 и FR2, CDR2 расположена между FR2 и FR3, и CDR3 расположена между FR3 и FR4. Без указания конкретных подобластей в качестве FR1, FR2, FR3 или FR4, каркасная область, согласно другим источникам, представляет собой объединенные FR в вариабельной области одной встречающейся в природе цепи иммуноглобулина. Как используют в рамках изобретения, FR, указанная в единственном числе, представляет собой одну из четырех подобластей, и FR, указанные во множественном числе, представляют собой две или более из четырех подобластей, составляющих каркасную область
Как используют в рамках изобретения, термины "акцептор" и "акцепторное антитело" относятся к антителу или последовательности нуклеиновой кислоты, обеспечивающим или кодирующим по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или 100% аминокислотных последовательностей одной или нескольких из каркасных областей. В некоторых вариантах осуществления термин "акцептор" относится к аминокислотной последовательности или последовательности нуклеиновой кислоты антитела, обеспечивающим или кодирующим константную область(и). В другом варианте осуществления термин "акцептор" относится к аминокислотной последовательности или последовательности нуклеиновых кислот антитела, обеспечивающим или кодирующим одну или несколько из каркасных областей и константную область(и). В конкретном варианте осуществления термин "акцептор" относится к аминокислотной последовательности или последовательности нуклеиновых кислот антитела человека, которые обеспечивают или кодируют по меньшей мере 80%, предпочтительно, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или 100% аминокислотных последовательностей одной или нескольких из каркасных областей. В соответствии с этим вариантом осуществления акцептор может содержать по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 10 аминокислотных остатков, которые не встречаются в одном или нескольких конкретных положениях антитела человека. Акцепторная каркасная область и/или акцепторная константная область(и) может быть образована или получена, например, из гена антитела эмбрионального типа, зрелого гена антитела, функционального антитела (например, антител, хорошо известных в данной области, разрабатываемых антител или коммерчески доступных антител).
Акцепторные последовательности тяжелой цепи и легкой цепи человека известны в данной области. В одном из вариантов осуществления изобретения акцепторные последовательности тяжелой цепи и легкой цепи человека выбраны из последовательностей, перечисленных в V-base (http://vbase.mrc-cpe.cam.ac.uk/) или в IMGT®, международной системе ImMunoGeneTics information system® (http://imgt.cines.fr/textes/IMGTrepertoire/LocusGenes/). В другом варианте осуществления изобретения акцепторые последовательности тяжелой цепи и легкой цепи человека выбраны из последовательностей, описанных в таблице 3 и таблице 4.







Как используют в рамках изобретения, термин "ген антитела эмбрионального типа" или "фрагмент гена" относится к последовательности иммуноглобулина, кодируемой нелимфоидными клетками, которая не подвергалась процессу созревания, который приводит к генетической реаранжировке и мутации для экспрессии конкретного иммуноглобулина. (См., например, Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002); Marchalonis et al., Adv Exp Med Biol. 484:13-30 (2001)). Одно из преимуществ, обеспечиваемых различными вариантами осуществления настоящего изобретения, является следствие признания, что гены антитела эмбрионального типа с большей вероятностью, чем гены зрелых антител, сохраняют основные структуры аминокислотной последовательности, характерные для индивидуумов в виде, таким образом, они с меньшей вероятностью будут распознаваться как последовательности из чужеродного источника, при их терапевтическом применении у этого вида.
Как используют в рамках изобретения, термин "ключевые" остатки относится к определенным остаткам в вариабельной области, которые оказывают большее влияние на специфичность связывания и/или аффинность антитела, в частности гуманизированного антитела. Ключевой остаток включает, но не ограничивается ими, один или несколько из следующих: остаток, соседний с CDR, потенциальный участок гликозилирования (может представлять собой участок либо N-, либо O-гликозилирования), редкий остаток, остаток, способный взаимодействовать с антигеном, остаток, способный взаимодействовать с CDR, канонический остаток, контактный остаток между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, остаток в зоне Vernier и остаток в области, которая перерывает вариабельную область тяжелой цепи CDR1, определенную по Chothia, и первую каркасную область тяжелой цепи, определенную по Kabat.
Термин "гуманизированное антитело" относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из вида, не являющегося человеком (например, мыши), но в которых по меньшей мере часть последовательности VH и/или VL изменена так, чтобы она была более "подобной человеческой", т.е. более сходной с вариабельными последовательностями эмбрионального типа человека. Одним из типов гуманизированного антитела является антитело с пересаженными CDR, в котором последовательности CDR человека встроены в последовательности VH и VL, не являющиеся человеческими, для замены соответствующих последовательностей CDR, не являющихся человеческими. Также "гуманизированное антитело" представляет собой антитело или его вариант, производное, аналог или фрагмент, которые иммуноспецифически связываются с представляющим интерес антигеном и которые содержат каркасную (FR) область, по существу имеющую аминокислотную последовательность антитела человека, и определяющую комплементарность область (CDR), по существу имеющую аминокислотную последовательность не являющегося человеческим антитела. Как используют в рамках изобретения, термин "по существу" в контексте CDR относится к CDR, имеющей аминокислотную последовательность, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности CDR антитела, не являющегося человеческим. Гуманизированное антитело содержит по существу все из по меньшей мере одного, и как правило, двух, вариабельных доменов (Fab, Fab’, F(ab’)2, FabC, Fv), в которых все или по существу все из CDR-областей соответствуют CDR-областям не являющегося человеческим иммуноглобулина (т.е. донорного антитела) и все или по существу все из каркасных областей представляют собой каркасные области консенсусной последовательности иммуноглобулина человека. В одном из вариантов осуществления гуманизированное антитело также содержит по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, константной области иммуноглобулина человека. В некоторых вариантах осуществления гуманизированное антитело содержит как легкую цепь, так и по меньшей мере вариабельный домен тяжелой цепи. Антитело также может включать CH1-область, шарнирную область, CH2-, CH3- и CH4-области тяжелой цепи. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную легкую цепь. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную тяжелую цепь. В конкретных вариантах осуществления гуманизированное антитело содержит только гуманизированный вариабельный домен легкой цепи и/или гуманизированную тяжелую цепь.
Гуманизированное антитело может быть выбрано из любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и любого изотипа, включая, но не ограничиваясь ими, IgG1, IgG2, IgG и IgG4. Гуманизированное антитело может содержать последовательности из более чем одного класса или изотипа и конкретные константные домены могут быть выбраны, чтобы оптимизировать желаемые эффекторные функции с использованием способов, хорошо известных в данной области.
Каркасные области и CDR гуманизированного антитела не обязательно должны точно соответствовать исходным последовательностям, например, CDR донорного антитела или консенсусную каркасную область можно подвергать мутагенезу замещением, вставкой и/или делецией по меньшей мере одного аминокислотного остатка, так чтобы остаток CDR или каркасной области в этом участке не соответствовал ни донорному антителу, ни консенсусной каркасной области. В иллюстративном варианте осуществления такие мутации, однако, не являются обширными. Как правило, по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, и наиболее предпочтительно по меньшей мере 95% остатков гуманизированного антитела будут соответствовать остаткам исходных последовательностей FR и CDR. Как используют в рамках изобретения, термин "консенсусная каркасная область" относится к каркасной области в консенсусной последовательности иммуноглобулина. Как используют в рамках изобретения, термин "консенсусная последовательность иммуноглобулина" относится к последовательности, образованной наиболее часто встречающимися аминокислотами (или нуклеотидами) в семействе родственных последовательностей иммуноглобулинов (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987)). В семействе иммуноглобулинов каждое положение в консенсусной последовательности занимает аминокислота, встречающаяся наиболее часто в этом положении в семействе. Если две аминокислоты встречаются с равной частотой, любая из них может быть включена в консенсусную последовательность.
В отношении конструирования DVD-Ig или других молекулы связывающих белков, термин "линкер" используют для обозначения одной аминокислоты или полипептида ("линкерный полипептид"), содержащих два или более аминокислотных остатка, связанных пептидными связями, и их используют для связывания одной или нескольких антигенсвязыващих частей. Такие линкерные полипептиды хорошо известны в данной области (см., например, Holliger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993); Poljak, R.J., Structure, 2: 1121-1123 (1994)). Иллюстративные линкеры включают, но не ограничиваются ими, GGGGSG (SEQ ID NO: 26), GGSGG (SEQ ID NO: 27), GGGGSGGGGS (SEQ ID NO: 28), GGSGGGGSG (SEQ ID NO: 223), GGSGGGGSGS (SEQ ID NO: 29), GGSGGGGSGGGGS (SEQ ID NO: 30), GGGGSGGGGSGGGG (SEQ ID NO: 31), GGGGSGGGGSGGGGS (SEQ ID NO: 32), ASTKGP (SEQ ID NO: 33), ASTKGPSVFPLAP (SEQ ID NO: 34), TVAAP (SEQ ID NO: 35), RTVAAP (SEQ ID NO: 224), TVAAPSVFIFPP (SEQ ID NO: 36), RTVAAPSVFIFPP (SEQ ID NO: 225), AKTTPKLEEGEFSEAR (SEQ ID NO: 37), AKTTPKLEEGEFSEARV (SEQ ID NO: 38), AKTTPKLGG (SEQ ID NO: 39), SAKTTPKLGG (SEQ ID NO: 40), SAKTTP (SEQ ID NO: 41), RADAAP (SEQ ID NO: 42), RADAAPTVS (SEQ ID NO: 43), RADAAAAGGPGS (SEQ ID NO: 44), RADAAAAGGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 45), SAKTTPKLEEGEFSEARV (SEQ ID NO: 46), ADAAP (SEQ ID NO: 47), ADAAPTVSIFPP (SEQ ID NO: 48), QPKAAP (SEQ ID NO: 49), QPKAAPSVTLFPP (SEQ ID NO: 50), AKTTPP (SEQ ID NO: 51), AKTTPPSVTPLAP (SEQ ID NO: 52), AKTTAP (SEQ ID NO: 53), AKTTAPSVYPLAP (SEQ ID NO: 54), GENKVEYAPALMALS (SEQ ID NO: 55), GPAKELTPLKEAKVS (SEQ ID NO: 56) и GHEAAAVMQVQYPAS (SEQ ID NO: 57).
Как используют в рамках изобретения, зона "Vernier" относится к подгруппе каркасных остатков, которые могут корректировать структуру CDR и регулировать соответствие антигену, как описано Foote and Winter, J. Mol. Biol., 224:487-499 (1992), который включен в настоящее описание в качестве ссылки). Остатки зоны Vernier образуют слой, лежащий под CDR, и они могут влиять на структуру CDR и аффинность антитела.
Как используют в рамках изобретения, термин "нейтрализующий" относится к нейтрализации биологической активности антигена (например, цитокина IL-1β), когда связывающий белок специфично связывает антиген. Предпочтительно, нейтрализующий связывающий белок, описанный в настоящем описании, связывается с hIL-1β, что приводит к ингибированию биологической активности hIL-1β. Предпочтительно, нейтрализующий связывающий белок связывает hIL-1β и снижает биологическую активность hIL-1β по меньшей мере приблизительно на 20%, 40%, 60%, 80%, 85% или более. Ингибирование биологической активности hIL-1β нейтрализующим связывающим белком можно оценивать путем определения одного или нескольких индикаторов биологической активности hIL-1β, известной в данной области, например, ингибирования секреции IL-6 человека посредством индукции IL-1β в клетках HS27.
Термин "активность" включает активность, такую как специфичность связывания/аффинность антитела в отношении антигена, например, у антитела против hIL-1β, которое связывается с антигеном IL-1β, и/или нейтрализующую эффективность антитела, например, у антитела против hIL-1β, связывание которого с hIL-1β ингибирует биологическую активность hIL-1β, например, ингибирование секреции IL-6 человека посредством индукции IL-1β в клетках HS27.
Термин "эпитоп" включает любую полипептидную детерминанту, способную специфично связываться с иммуноглобулином или T-клеточным рецептором. В определенных вариантах осуществления детерминанты эпитопов включают химически активные поверхностные группы молекул, такие как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил и, в определенных вариантах осуществления, она может иметь конкретные характеристики трехмерной структуры, и/или конкретные характеристики заряда. Эпитоп представляет собой область антигена, который связывается антителом. В определенных вариантах осуществления, антитело специфично связывает антиген, когда оно предпочтительно распознает его антиген-мишень в комплексной смеси белков и/или макромолекул. Антитела "связывают один эпитоп", если антитела перекрестно конкурируют (одно препятствует связыванию или модулирующему эффекту другого). Кроме того, структурные определения эпитопов (перекрывающиеся, сходные, идентичные) являются информативными, однако функциональные определения часто являются более значимыми, поскольку они охватывают структурные (связывание) и функциональные (модулирование, конкуренция) параметры.
Термин "поверхностный плазмонный резонанс", Как используют в рамках изобретения, относится к оптическому явлению, который позволяет анализ в режиме реального времени биоспецифических взаимодействий путем детекции изменений концентраций белков на биосенсорной матрице, например, с использованием системы BIAcore® (Pharmacia Biosensor AB, Uppsala, Швеция, и Piscataway, New Jersey). Для дальнейшего описания см. Jonsson et al., Ann. Biol. Clin., 51: 19-26 (1993); Jonsson et al., BioTechniques, 11: 620-627 (1991); Johnsson et al., J. Mol. Recognit., 8: 125-131 (1995); и Johnsson et al., Anal. Biochem., 198: 268-277 (1991).
Термин "Kon" (также "Kon", "kon"), Как используют в рамках изобретения, относится к константе скорости ассоциации для ассоциации связывающего белка (например, антитела) с антигеном с образованием комплекса ассоциации, например комплекса антитело/антиген, как известно в данной области. "Kon" также известна под терминами "константа скорости ассоциации" или "ka", Как используют в рамках изобретения взаимозаменяемо. Эту величина указывает на скорость связывания антитела с его антигеном-мишенью или скорость образования комплекса между антителом и антигеном, как показано с помощью уравнения, ниже:
Антитело ("Ab") + Антиген ("Ag") → Ab-Ag.
Термин "Koff" (также "Koff", "koff"), Как используют в рамках изобретения, относится к константе скорости для диссоциации или "константе скорости диссоциации" связывающего белка (например, антитела) из комплекса ассоциации (например, комплекса антитело/антиген), как известно в данной области. Эта величина, указывает на скорость диссоциации антитела от его антигена-мишени или разделения комплекса Ab-Ag с течением времени на свободное антитело и антиген, как показывают с помощью уравнения, ниже:
Ab+Ag←Ab-Ag.
Термин "KD" (также "Kd"), Как используют в рамках изобретения, относится к "равновесной константе диссоциации", и относится к величине, получаемой путем титрационного измерения при равновесии, или путем деления константы скорости диссоциации (Koff) на константу скорости ассоциации (Kon). Константу скорости ассоциации (Kon), константу скорости диссоциации (Koff) и равновесную константу диссоциации (KD) используют для отображения аффинности связывания антитела с антигеном. Способы определения констант скорости ассоциации и диссоциации хорошо известны в данной области. Применение флуоресцентных способов обеспечивает высокую чувствительность и возможность исследовать образцы в физиологических буферах при равновесии. Можно использовать другие экспериментальные подходы и инструменты, такие как BIAcore® (анализ биомолекулярного взаимодействия) (например, инструмент, доступный от BIAcore International AB, GE Healthcare company, Uppsala, Швеция). Кроме того, также можно использовать KinExA® (анализ кинетики исключения), доступный от Sapidyne Instruments (Boise, Idaho).
Термины "метка" и "поддающаяся детекции метка" означает группу, присоединенную к конкретному связывающему партнеру, такому как антитело или анализируемое соединение, например, для того, чтобы сделать реакцию между представителями конкретной связывающей пары, такой как антитело и анализируемое соединение, поддающейся детекции. Конкретный связывающий партнер, например, антитело или анализируемое соединение, меченный таким образом, называют "меченным поддающейся детекции меткой". Таким образом, термин "меченый связывающий белок", Как используют в рамках изобретения, относится к белку с включенной в него меткой, которая обеспечивает идентификацию связывающего белка. В одном из вариантов осуществления метка представляет собой поддающийся детекции маркер, который может давать сигнал, который поддается детекции визуально или с помощью инструментальных средств, например, включение радиоактивно меченной аминокислоты или присоединение к полипептиду биотинильных групп, которые можно выявлять с помощью маркированного авидина или стрептавидина (например, стрептавидина, содержащего флуоресцентный маркер или маркер, обладающий ферментативной активностью, которую можно выявлять оптическими или колориметрическими способами). Примеры меток для полипептидов включают, но не ограничиваются ими, следующие: радиоизотопы или радионуклиды (например,3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho или153Sm); хромогены, флуоресцентные метки (например, FITC, родамин, лантаноидные люминофоры), ферментные метки (например, пероксидаза хрена, люцифераза, щелочная фосфатаза); хемилюминесцентные маркеры; биотинильные группы; определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности "лейциновых молний", участки связывания для вторичных антител, связывающие металл домены, эпитопные метки); и магнитные средства, такие как хелаты гадолиния. Типичные примеры меток, обычно используемых для иммунологических анализов, включают группы, которые генерируют свет, например, соединения акридиния, и группы, которые генерируют флуоресценцию, например, флуоресцеин. Другие метки описаны в настоящем описании. В связи с этим, группа сама по себе может не быть поддающейся детекции, но она может становиться поддающейся детекции при реакции с другой группой. Использование термина "меченный поддающейся детекции меткой" охватывает последний тип мечения поддающейся детекции меткой.
Термин "конъюгат связывающего IL-1β белка" относится к связывающему IL-1β белку, такому как антитело, химически связанному со второй химической группой, такой как терапевтическое или цитотоксическое средство. Термин "средство" используют в настоящем описании для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, полученного из биологических материалов. Предпочтительно, терапевтические или цитотоксические средства включают, но не ограничиваются ими, коклюшный токсин, таксол, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, татракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. Когда конъюгат связывающего IL-1β белка используют в контексте иммунологического анализа, он может представлять собой меченное поддающейся детекции меткой антитело, используемое в качестве антитела для детекции.
Термины "кристалл" и "кристаллизованный", Как используют в рамках изобретения, относятся к связывающему белку (например, антителу) или его антигенсвязывающей части, которые существуют в форме кристалла. Кристаллы представляют собой одну из форм твердого состояния вещества, которая отличается от других форм, таких как аморфное твердое состояние или жидкокристаллическое состояние. Кристаллы состоят из регулярных, повторяющихся, трехмерных структур из атомов, ионов, молекул (например, белков, таких как антитела), или молекулярных агрегатов (например, комплексов антиген/антитело). Эти трехмерные структуры упорядочены в соответствии с определенной математической зависимостью, которая хорошо понятна в данной области. Основное звено, или структурный блок, который повторяется в кристалле, называют асимметричным элементом. Повторение асимметричного элемента в порядке, который придает данную четко определенную кристаллографическую симметрию, обеспечивает "элементарную ячейку" кристалла. Повторение элементарной ячейки посредством правильного сдвига во всех трех измерениях приводит к кристаллу. См. Giege et al., глава 1, Crystallization of Nucleic Acids and Proteins, a Practical Approach, 2nd ed., (Ducruix and Giege, eds.) (Oxford University Press, New York, 1999) pp. 1-16.
Термин "полинуклеотид" означает полимерную форму из двух или более нуклеотидов: либо рибонуклеотидов, либо дезоксинуклеотидов, или модифицированную форму нуклеотидов любого типа. Термин включает одноцепочечную и двухцепочечную формы ДНК.
Термин "выделенный полинуклеотид" означает полинуклеотид (например, геномного происхождения, из кДНК, или синтетического происхождения, или некоторые их комбинации) который, исходя из его происхождения, не ассоциирован со всем полинуклеотидом, или частью, с которым "выделенный полинуклеотид" встречается в природе; функционально связан с полинуклеотидом, который не связан с ним в природе; или не встречается в природе в качестве части более крупной последовательности.
Как используют в рамках изобретения, термин "вектор" относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Одним из типов вектора является "плазмида", которая относится к кольцевой двухцепочечной петле ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, где в вирусный геном могут быть лигированы дополнительные сегменты ДНК. Некоторые векторы способны к аутосомной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный ориджин репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут встраиваться в геном клетки-хозяина при введении в клетку-хозяина, и, тем самым, реплицироваться вместе с геномом хозяина. Более того, определенные векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы обозначают в настоящем описании как "рекомбинантные экспрессирующие векторы" (или просто, "экспрессирующие векторы"). Как правило, экспрессирующие векторы, применимые в способах рекомбинантных ДНК, часто имеют форму плазмид. В настоящем описании, термины "плазмида" и "вектор" могут быть использованы взаимозаменяемо, поскольку плазмида является наиболее часто используемой формой вектора. Однако подразумевают, что изобретение включает другие формы экспрессирующих векторов, такие как вирусные векторы (например, ретровирусы с дефектом репликации, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции.
Термин "функционально связанный" относится к смежному расположению, где описываемые компоненты имеют взаимосвязь, позволяющую им функционировать предполагаемым для них образом. Последовательность контроля, "функционально связанную" с кодирующей последовательностью, лигируют таким образом, чтобы достигать экспрессии кодирующей последовательности в условиях, совместимых с последовательностями контроля. "Функционально связанные" последовательности включают как последовательности контроля экспрессии, которые являются смежными с представляющим интерес геном, так и последовательности контроля экспрессии, которые осуществляют транс-регуляцию, или действуют на расстоянии для регуляции представляющего интерес гена. Термин "последовательность контроля экспрессии", Как используют в рамках изобретения, относится к полинуклеотидным последовательностям, которые необходимы для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Последовательности контроля экспрессии включают соответствующие последовательности инициации, терминации транскрипции, промоторные и энхансерные последовательности; сигналы эффективного процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые усиливают эффективность трансляции (т.е. консенсусная последовательность Козака); последовательности, которые усиливают стабильность белка; и если желательно, последовательности, которые усиливают секрецию белка. Тип таких последовательностей контроля отличается, в зависимости от организма хозяина; в прокариотах такие последовательности контроля, как правило, включают промотор, участок связывания рибосом и последовательность терминации транскрипции; у эукариот, как правило, такие последовательности контроля включают промоторы и последовательность терминатора транскрипции. Термин "последовательности контроля" включает компоненты, наличие которых необходимо для экспрессии и процессинга, и также он может включать дополнительные компоненты, наличие которых является преимущественным, например, лидерные последовательности и последовательности партнера по слиянию.
"Трансформация", как определяют в рамках изобретения, относится к любому процессу, посредством которого ДНК проникает в клетку-хозяина. Трансформация может происходить в природных или искусственных условиях с использованием различных способов, хорошо известных в данной области. Трансформация может быть основана на любом способе встраивания последовательностей чужеродных нуклеиновых кислот в прокариотическую или эукариотическую клетку-хозяина. Способ выбирают, исходя из трансформируемой клетки-хозяина, и он может включать, но не ограничиваться ими, вирусную инфекцию, электропорацию, липофекцию и бомбардировку частицами. Такие "трансформированные" клетки включают стабильно трансформированные клетки, в которых встроенная ДНК способна реплицироваться либо в качестве аутосомно реплицирующейся плазмиды, либо в качестве части хромосомы хозяина. Также они включают клетки, которые временно экспрессируют встроенную ДНК или РНК в течение ограниченных периодов времени.
Термин "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") относится к клетке, в которую вводят экзогенную ДНК. В одном из вариантов осуществления клетка-хозяин содержит две или более (например, несколько) нуклеиновых кислот, кодирующих антитела, например, как клетки-хозяева, описанные в патенте США №7262028. Такие термины относятся не только к конкретной рассматриваемой клетке, но также к потомкам такой клетки. Поскольку в последующих поколениях могут происходить определенные модификации вследствие либо мутации, либо влияний окружающей среды, такие потомки, в действительности, могут не быть идентичными родительской клетке, однако они, тем не менее, включены в объем термина "клетка-хозяин", Как используют в рамках изобретения. В одном из вариантов осуществления клетки-хозяева включают прокариотические и эукариотические клетки, выбранные из любого из царств живых организмов. В другом варианте осуществления эукариотические клетки включают одноклеточные организмы, клетки грибов, растений и животных. В другом варианте осуществления клетки-хозяева включают, но не ограничиваются ими, линию прокариотических клеток Escherichia coli; клеточные линии млекопитающих CHO, HEK 293 и COS; клеточную линию насекомых Sf9; и клетки грибов Saccharomyces cerevisiae.
Для получения рекомбинантных ДНК, синтеза олигонуклеотидов и культивирования тканей и трансформации (например, электропорация, липофекция) можно использовать стандартные способы. Ферментативные реакции и способы очистки можно проводить в соответствии с указаниями изготовителя или как обычно проводят в данной области, или как описано в настоящем описании. Указанные выше способы и процессы можно выполнять, главным образом, в соответствии с общепринятыми способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые цитированы и рассмотрены на протяжении настоящего описания. См. например, Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. (1989).
"Трансгенный организм", как известно в данной области, относится к организму, имеющему клетки, которые содержат трансген, где трансген, введенный в организм (или родительский организм) экспрессирует полипептид, не экспрессирующийся в организме в природе. "Трансген" представляет собой конструкцию ДНК, которая стабильно и функционально встроена в геном клетки, из которой развивается трансгенный организм, направляющую экспрессию кодируемого продукта гена в одном или нескольких типах клеток или тканей трансгенного организма.
Термины "регулирует" и "модулирует" используют взаимозаменяемо, и, Как используют в рамках изобретения, они относятся к переключению или изменению активности представляющей интерес молекулы (например, биологической активности hIL-1β). Модулирование может представлять собой повышение или снижение интенсивности определенной активности или функции представляющей интерес молекулы. Иллюстративные виды активности и функции молекулы включают, но не ограничиваются ими, характеристики связывания, ферментативную активность, активацию клеточного рецептора и передачу сигнала.
Соответственно, термин "модулятор", Как используют в рамках изобретения, представляет собой соединение, способное переключать или изменять активность или функцию представляющей интерес молекулы (например, биологическую активность hIL-1β). Например, модулятор может вызывать повышение или снижение интенсивности определенной активности или функции молекулы по сравнению с интенсивностью активности или функции, наблюдаемых в отсутствии модулятора. В определенных вариантах осуществления модулятор представляет собой ингибитор, который снижает интенсивность по меньшей мере одного вида активности или функции молекулы. Иллюстративные ингибиторы включают, но не ограничиваются ими, белки, пептиды, антитела, пептидные антитела, углеводы или низкомолекулярные органические соединения. Пептидные антитела описаны, например, в публикации PCT № WO 01/83525.
Термин "агонист", Как используют в рамках изобретения, относится к модулятору, который при контактировании с представляющей интерес молекулой вызывает повышение интенсивности определенного вида активности или функции молекулы по сравнению с интенсивностью вида активности или функции, наблюдаемыми в отсутствие агониста. Конкретные представляющие интерес агонисты могут включать, но не ограничиваться ими, полипептиды hIL-1β, нуклеиновые кислоты, углеводы, или любые другие молекулы, которые связываются с hIL-1β.
Термины "антагонист" или "ингибитор", Как используют в рамках изобретения, относятся к модулятору, который при контактировании с представляющей интерес молекулой вызывает снижение интенсивности определенного вида активности или функции молекулы по сравнению с интенсивностью вида активности или функции, наблюдаемой в отсутствие антагониста. Конкретные представляющие интерес антагонисты включают антагонисты, которые блокируют или модулируют биологическую или иммунологическую активность IL-1β человека. Антагонисты и ингибиторы IL-1β человека могут включать, но не ограничиваться ими, белки, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с IL-1β человека.
Как используют в рамках изобретения, термин "эффективное количество" относится к количеству лекарственного средства, которое является достаточным для снижения или смягчения тяжести и/или уменьшения длительности нарушения или одного или нескольких его симптомов, предотвращения прогрессирования нарушения, обеспечения регрессии нарушения, предотвращения рецидива, развития, возникновения или прогрессирования одного или нескольких симптомов, ассоциированных с нарушением, детекции нарушения, или усиления или улучшения профилактического или терапевтического эффекта(ов) другой терапии (например, профилактического или терапевтического средства).
Термины "пациент" и "индивидуум" могут использоваться в настоящем описании взаимозаменяемо, и они относятся к животному, такому как млекопитающее, включая примата (например, человека, обезьяну и шимпанзе), не являющееся приматом млекопитающее (например, корова, свинья, верблюд, лама, лошадь, коза, кролик, овца, хомяк, морская свинка, кошка, собака, крыса, мышь, кит), птица (например, утка или гусь) и акула. Предпочтительно, пациентом или индивидуумом является человек, такой как человек, подвергаемый лечению от заболевания, нарушения или состояния, или оценке заболевания, нарушения или состояния, человек, имеющий риск заболевания, нарушения или состояния, человек, имеющий заболевание, нарушение или состояние, и/или человек, которого лечат от заболевания, нарушения или состояния.
Термин "образец", Как используют в рамках изобретения, применяют в его наиболее широком значении. "Биологический образец", Как используют в рамках изобретения, включает, но не ограничивается ими, любое количество материала из живого существа или ранее живого существа. Такие живые существа включают, но не ограничиваются ими, людей, не являющихся человеком приматов, мышей, крыс, обезьян, собак, кроликов и других животных. Такие материалы включают, но не ограничиваются ими, кровь (например, цельную кровь), плазму, сыворотку, мочу, амниотическую жидкость, синовиальную жидкость, эпителиальные клетки, лейкоциты, моноциты, другие клетки, органы, ткани, костный мозг, лимфатические узлы и селезенку.
Термины "компонент", "компоненты" и "по меньшей мере один компонент" относятся, главным образом, к улавливающему антителу, антителу для детекции или конъюгату антитела, контролю, калибратору, серии калибровок, панели чувствительности, контейнеру, буферу, разбавителю, соли, ферменту, кофактору фермента, реагенту для детекции, реагенту/раствору для предварительной обработки, субстрату (например, такому как раствор), стоп-раствору, и т.п., которые могут быть включены в набор для анализа исследуемого образца, такого как образец мочи, сыворотки или плазмы пациента, в соответствии со способами, описанными в настоящем описании, и с другими способами, известными в данной области. Таким образом, в контексте настоящего описания, "по меньшей мере один компонент", "компонент" и "компоненты" могут включать полипептид или другое анализируемое соединение, как указано выше, например, композицию, содержащую анализируемое соединение, такое как полипептид, которое необязательно иммобилизовано на твердой подложке, например, путем связывания с антителом против анализируемого соединения (например, с антителом против полипептида). Некоторые компоненты могут находиться в растворе или они могут быть лиофилизированными для восстановления для применения в анализе.
"Контроль" относится к композиции, о которой известно, что она не является анализируемым соединением ("отрицательный контроль") или содержит анализируемое соединение ("положительный контроль"). Положительный контроль может содержать известную концентрацию анализируемого соединения. "Контроль", "положительный контроль" и "калибратор" могут использоваться в настоящем описании взаимозаменяемо для обозначения композиции, содержащей известную концентрацию анализируемого соединения. "Положительный контроль" можно использовать для установления рабочих характеристик анализа и он является пригодным индикатором целостности реагентов (например, анализируемых соединений).
Термины "заданный предел" и "заданный уровень" относятся, главным образом, к предельной величине анализа, которую используют для оценки результатов диагностической/прогностической/терапевтической эффективности путем сравнения результатов анализа относительно заданного предела/уровня, где заданный предел/уровень уже связан или ассоциирован с различными клиническими параметрами (например, тяжестью заболевания, прогрессированием/непрогрессированием/ улучшением и т.д.). Хотя в настоящем описании могут быть предоставлены иллюстративные заданные уровни, хорошо известно, что предельные значения могут варьировать, в зависимости от природы иммунологического анализа (например, используемых антител и т.д.). Кроме того, специалист в данной области может адаптировать представленное в настоящем документе описание к другим иммунологическим анализам в целях получения специфичных для других иммунологических анализов предельных значений, исходя из этого описания. В то время как точное значение заданного предела/уровня может варьировать между анализами, главным образом, может быть применима корреляция (при ее наличии) как описано в настоящем описании.
"Реагент для предварительной обработки", например, реагент для лизиса, преципитации и/или солюбилизации, используемый в диагностическом анализе, как описано в настоящем описании, представляет собой реагент, который лизирует любые клетки и/или солюбилизирует любое анализируемое соединение, которое присутствует в исследуемом образце. Предварительная обработка не является обязательной для всех образцов, как описано в настоящем описании далее. Среди прочего, солюбилизация анализируемого соединения (например, представляющего интерес полипептида) может включать высвобождение анализируемого соединения из каких-либо эндогенных связывающих белков, присутствующих в образце. Реагент для предварительной обработки может быть гомогенным (не требующим стадии разделения) или гетерогенным (требующим стадии разделения). При использовании гетерогенного реагента для предварительной обработки проводят удаление любых осажденных связывающих анализируемое соединение белков из исследуемого образца перед переходом на следующую стадию анализа.
"Реагенты контроля качества" в контексте иммунологических анализов и наборов, описанных в настоящем описании, включают, но не ограничиваются ими, калибраторы, контроли и панели чувствительности. "Калибратор" или "стандарт", как правило, используют (например, один или несколько, например множество) для построения калибровочных (стандартных) кривых для интерполяции концентрации анализируемого соединения, такого как антитело или анализируемое соединение. Альтернативно можно использовать один калибратор, который близок к заданному положительному/отрицательному пределу. Множество калибраторов (т.е. более одного калибратора или различное количество калибратора(ов)) можно использовать вместе, так чтобы они составляли "панель чувствительности".
"Риск" относится к возможности или вероятности конкретного события, либо в настоящее время, либо в какой-то момент в будущем. "Стратификация по риску" относится к набору известных клинических факторов риска, которые позволяют врачам классифицировать пациентов на пациентов с низким, умеренным, высоким или наиболее высоким риском развития конкретного заболевания, нарушения или состояния.
"Специфичный" и "специфичность" в контексте взаимодействия между представителями конкретной связывающей пары (например, антигена (или его фрагмента) и антитела (или его реагирующего с антигеном фрагмента)) относятся к селективной реактивности взаимодействия. Выражение "специфично связывается с" и аналогичные выражения относятся к способности антител (или их реагирующих с антигеном фрагментов) специфично связываться с анализируемым соединением (или его фрагментом) и не связываться специфично с другими соединениями.
"Специфический партнер по связыванию" является представителем конкретной связывающейся пары. Конкретная связывающаяся пара включает две различных молекулы, которые специфично связываются друг с другом химическими или физическими способами. Таким образом, в дополнение к конкретным связывающимся парам в распространенных иммуноанализах, представляющим собой антиген и антитело, другие конкретные связывающиеся пары могут включать биотин и авидин (или стрептавидин), углеводы и лектины, комплементарные нуклеотидные последовательности, молекулы эффектора и рецептора, кофакторы и ферменты, ингибиторы ферментов и ферменты и т.п. Более того, конкретные связывающиеся пары могут включать представителей, которые являются аналогами исходных специфических связывающихся представителей, например, аналог анализируемого соединения. Иммунореактивные специфические связывающие представители включают антигены, фрагменты антигенов и антитела, включая моноклональные и поликлональные антитела, а их также комплексы, фрагменты и варианты (включая фрагменты вариантов), как выделенные, так и полученные рекомбинантными способами.
"Вариант", Как используют в рамках изобретения, означает полипептид, который отличается от данного полипептида (например, полипептида IL-1β, BNP, NGAL или HIV или антитела против полипептида) аминокислотной последовательностью вследствие добавления (например, инсерции), делеции или консервативной замены аминокислот, но который сохраняет биологическую активность данного полипептида (например, вариант IL-1β может конкурировать с антителом против IL-1β за связывание с IL-1β). Консервативная замена аминокислоты, т.е. замена аминокислоты отличающейся аминокислотой со сходными свойствами (например, гидрофильностью и степенью и распределением заряженных областей) признается в данной области, как вовлекающая, главным образом, незначительные изменения. Эти незначительные изменения можно идентифицировать, отчасти, учитывая индекс гидропатии аминокислот, как понятно в данной области (см., например, Kyte et al., J. Mol. Biol. 157: 105-132 (1982)). Индекс гидропатии аминокислот основан на гидрофобности и заряде. В данной области известно, что можно осуществлять замену на аминокислоты со сходными индексами гидропатии и все еще сохранять функцию белка. В одном аспекте, заменяют аминокислоты, имеющие индексы гидропатии ±2. Гидрофильность аминокислот также можно использовать для установления замен, которые могут привести к белкам, сохраняющим биологическую функцию. Рассмотрение гидрофильности аминокислот в контексте пептида позволяет вычисление наибольшей локальной средней гидрофильности этого пептида, пригодного показателя, который, согласно литературным данным, коррелирует с антигенностью и иммуногенностью (см., например, патент США №4554101). Замена на аминокислоты, имеющие сходные значения гидрофильности, может привести к пептидам, сохраняющим биологическую активность, например иммуногенность, как понятно в данной области. В одном аспекте замены проводят между аминокислотами, имеющими значения гидрофильности в пределах ±2 между ними. Как на индекс гидрофобности, так и на величину гидрофильности аминокислот влияет конкретная боковая цепь этой аминокислоты. В соответствии с этим наблюдением, аминокислотные замены, которые совместимы с биологической функцией, считаются зависимыми от относительного сходства аминокислот, и в частности, от боковых цепей этих аминокислот, что определяют по гидрофобности, гидрофильности, заряду, размеру и другим свойствам. "Вариант" также можно использовать, чтобы описать полипептид или его фрагмент, который дифференциально процессирован, например, путем протеолиза, фосфорилирования или другой посттрансляционной модификации, но, тем не менее, сохраняет его биологическую активность или реактивность к антигену, например, способность связываться с IL-1β. Применение термина "вариант" в настоящем описании охватывает фрагменты варианта, если контекст этому не противоречит.
I. Антитела, которые связывают IL-1β человека.
Один аспект настоящего изобретения относится к выделенным моноклональным антителам мыши, или их антигенсвязывающим частям, которые связываются с IL-1β с высокой аффинностью, низкой скоростью диссоциации и высокой нейтрализующей способностью. Второй аспект изобретения относится к химерным антителам, которые связывают IL-1β. Третий аспект изобретения относится к антителам с пересаженными CDR, или их антигенсвязывающим частям, которые связывают IL-1β. Четвертый аспект изобретения относится к гуманизированным антителам, или их антигенсвязывающим частям, которые связывают IL-1β. Пятый аспект изобретения относится к молекулам иммуноглобулинов с двойным вариабельным доменом (DVD-IgTM), которые связывают IL-1β и одну другую мишень. Предпочтительно, антитела или их части представляют собой выделенные антитела. Предпочтительно, антитела по изобретению представляют собой нейтрализующие антитела человека против IL-1β.
A. Способ получения антител против IL-1β
Антитела против IL-1β по настоящему изобретению можно получать любым количеством способов, известных в данной области.
1. Получение моноклональных антител против IL-1β с использованием технологии гибридом
Моноклональные антитела можно получать с использованием широкого множества способов, известных в данной области, включая применение гибридом, рекомбинантные технологии и технологии фагового дисплея или их сочетание. Например, моноклональные антитела можно получать с использованием способов гибридом, включающих способы, известные в данной области и описанные, например, в Harlow et al., Antibodies: A Laboratory Manual, 2nd ed. (Cold Spring Harbor Laboratory Press, 1988); Hammerling et al., eds., "Monoclonal Antibodies and T-Cell Hybridomas", In Research Monographs in Immunology, vol. 3 (J.L. Turk, General Editor) (Elsevier, New York, 1981) pp. 563-587 (указанные ссылки включены в качестве ссылки в полном объеме). Термин "моноклональное антитело", Как используют в рамках изобретения, не ограничивается антителами, продуцируемыми технологией гибридом. Термин "моноклональные антитело" относится к антителу, которое получено из одного клона, включающего любой эукариотический, прокариотический или фаговый клон, а не к способу, посредством которого оно получено.
Способы продуцирования и скрининга специфических антител против IL-1β с использованием технологии гибридом являются общепринятыми и хорошо известны в данной области. В одном из вариантов осуществления настоящее изобретение относится к способам получения моноклональных антител, а также к антителам, продуцируемым способом, включающим культивирование клетки гибридомы, секретирующей антитело по изобретению, где, предпочтительно, гибридома получена слиянием спленоцитов, выделенных из мыши, иммунизированной антигеном по изобретению, с клетками миеломы, а затем скрининг гибридом, полученных слиянием, в отношении клонов гибридомы, которые секретируют антитело, способное связывать полипептид по изобретению. В кратком изложении, мышей можно иммунизировать антигеном IL-1β. В иллюстративном варианте осуществления для стимуляции иммунного ответа антиген IL-1β вводят с адъювантом. Такие адъюванты включают полный или неполный адъювант Фрейнда, RIBI (мурамилдипептиды) или ISCOM (иммуностимулирующие комплексы). Такие адъюванты могут защищать полипептид от быстрого рассеивания путем изоляции в локальном депо, или они могут содержать вещества, которые стимулируют секрецию хозяином фактов, которые являются хемотаксическими факторами для макрофагов и других компонентов иммунной системы. Предпочтительно, если вводят полипептид, схема иммунизации включает два или более введений полипептида, рассредоточенных на нескольких недель.
После иммунизации животного антигеном IL-1β, из животного можно получать антитела и/или антителопродуцирующие клетки. Сыворотку, содержащую антитело против IL-1β, получают из животного путем забора крови или умерщвления животного. Сыворотку можно использовать в таком виде, как ее получают из животного, из сыворотки можно получать фракцию иммуноглобулинов или из сыворотки можно очищать антитела против IL-1β. Сыворотка или иммуноглобулины, полученные таким образом, являются поликлональными, таким образом, имеющими гетерогенный набор свойств.
После выявления иммунного ответа в сыворотке мыши выявляют, например, антитела, специфичные к антигену IL-1β, селезенку мышей извлекают и выделяют спленоциты. Затем спленоциты подергают слиянию хорошо известными способами с любыми пригодными клетками миеломы, например, клетками из клеточной линии SP20, доступной от American Type Culture Collection (ATCC, Manassas, Virginia). Гибридомы подвергают селекции и клонируют способом лимитирующих разведений. Затем клоны гибридомы оценивают способами, известными в данной области, в отношении клеток, которые секретируют антитела, способные связывать IL-1β. Асцитную жидкость, которая, как правило, содержит высокие уровни антител, можно получать иммунизацией мышей положительными клонами гибридом.
В другом варианте осуществления из иммунизированного животного можно получать антителопродуцирующие иммортализованные гибридомы. После иммунизации животного умерщвляют и B-клетки селезенки подвергают слиянию с иммортализованными клетками миеломы, как хорошо известно в данной области. См., например, Harlow et al., выше. В иллюстративном варианте осуществления клетки миеломы не секретируют полипептиды иммуноглобулинов (не секретирующая клеточная линия). После слияния и селекции на антибиотике, гибридомы подвергают скринингу с использованием IL-1β, или его части, или клетки, экспрессирующей IL-1β. В иллюстративном варианте осуществления исходный скрининг проводят с использованием твердофазного иммуноферментного анализа (ELISA) или радиоиммунного анализа (RIA), предпочтительно ELISA. Пример скрининга с помощью ELISA предоставлен в публикации международной заявки № WO 00/37504, включенной в настоящее описание в качестве ссылки.
Гибридомы, продуцирующие антитело против IL-1β, подвергают селекции, клонируют и далее подвергают скринингу в отношении требуемых признаков, включая активный рост гибридомы, высокую продукцию антител и требуемые характеристики антитела, как дополнительно рассмотрено ниже. Гибридомы можно культивировать и размножать in vivo у сингенных животных, у животных, которые лишены иммунной системы, например, у мышей nude, или в клеточной культуре in vitro. Способы селекции, клонирования и размножения гибридом хорошо известны специалистам в данной области.
В иллюстративном варианте осуществления гибридомы представляют собой гибридомы мыши, как описано выше. В другом предпочтительном варианте осуществления получают гибридомы видов не человека и не мыши, таких как крысы, овцы, свиньи, козы, крупный рогатый скот или лошади. В другом варианте осуществления, гибридомы представляют собой гибридомы человека, в которых несекретирующую миелому человека подвергают слиянию с клеткой человека, экспрессирующей антитело против IL-1β.
Фрагменты антител, которые распознают определенные эпитопы, можно получать известными способами. Например, Fab- и F(ab’)2-фрагменты по изобретению можно получать протеолитическим расщеплением молекул иммуноглобулинов с использованием ферментов, таких как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab’)2-фрагментов). F(ab’)2-фрагменты содержат вариабельную область, константную область легкой цепи и CH1-домен тяжелой цепи.
2. Моноклональные антитела против IL-1β с использованием SLAM
В другом аспекте изобретения получают рекомбинантные антитела из единичных выделенных лимфоцитов с использованием способа, называемого в данной области способом антител из подвергнутых селекции лимфоцитов (SLAM), как описано в патенте США №5627052, публикации PCT № WO 92/02551 и Babcock, J. S. et al. Proc. Natl. Acad. Sci. USA 93: 7843-7848 (1996). В этом способе отдельные клетки, секретирующие представляющие интерес антитела, например, лимфоциты, полученные из любого из иммунизированных животных, описанных в разделе 1, подвергают скринингу с использованием анализа антиген-специфических гемолитических бляшек, где антиген IL-1β, субъединицу IL-1β, или его фрагмент, связывают с эритроцитами овцы с использованием линкера, такого как биотин, и используют для идентификации отдельных клеток, которые секретируют антитела со специфичностью к IL-1β. После идентификации представляющих интерес секретирующих антитело клеток из этих клеток получают кДНК вариабельных областей тяжелой и легкой цепей (VH и VL) посредством ПЦР с обратной транскриптазой, и эти вариабельные участки затем можно экспрессировать, в связи с соответствующими константными участками иммуноглобулинов (например, константными участками человека), в клетках-хозяевах млекопитающих, таких как клетки COS или CHO. Затем клетки-хозяева, трансфицированные амплифицированными последовательностями иммуноглобулинов, полученных из подвергнутых селекции in vivo лимфоцитов, можно подвергать дальнейшему анализу и селекции in vitro, например, с помощью пэннинга трансфицированных клеток для выделения клеток, экспрессирующих антитела к IL-1β. Амплифицированные последовательности иммуноглобулинов можно далее подвергать манипулированию in vitro, например, способами созревания аффинности in vitro, такими как способы, описанные в публикации PCT № WO 97/29131 и публикации PCT № WO 00/56772.
3. Получение моноклональных антител против IL-1β с использованием трансгенных животных
В другом варианте осуществления настоящего изобретения антитела получают иммунизацией не являющегося человеком животного, содержащего часть, или весь, локус иммуноглобулинов человека, антигеном IL-1β. В иллюстративном варианте осуществления, не являющееся человеком животное представляет собой трансгенную мышь XENOMOUSE, полученную способами инженерии линию мышей, которая содержит крупные фрагменты локусов иммуноглобулинов человека и является дефицитной по продукции антител мыши. См., например, Green et al., Nature Genetics 7:13-21 (1994) и патенты США №5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598 и 6130364. Также см. публикации PCT № WO 91/10741, опубликованную 25 июля 1991 года, WO 94/02602, опубликованную 3 февраля 1994 года, WO 96/34096 и WO 96/33735, обе из которых опубликованы 31 октября 1996 года, WO 98/16654, опубликованную 23 апреля 1998 года, WO 98/24893, опубликованную 11 июня 1998 года, WO 98/50433, опубликованную 12 ноября 1998 года, WO 99/45031, опубликованную 10 сентября 1999 года, WO 99/53049, опубликованную 21 октября 1999 года, WO 00/09560, опубликованную 24 февраля 2000 года и WO 00/037504, опубликованную 29 июня 2000 года. У трансгенной мыши XENOMOUSE® продуцируется набор полностью человеческих антител, подобный набору взрослого человека, и образуются антгенспецифические Mab человека. Трансгенная мышь XENOMOUSE® содержит приблизительно 80% набора антител человека вследствие введения фрагментов YAC, размером, составляющим миллионы пар оснований, с зародышевой конфигурацией локусов тяжелой цепи человека и локусов легкой цепи человека. См. Mendez et al., Nature Genetics 15:146-156 (1997), Green and Jakobovits J. Exp. Med. 188:483-495 (1998), описания которых включены в настоящее описание в качестве ссылок.
4. Получение моноклональных антител против IL-1β с использованием библиотек рекомбинантных антител
Также для получения антител по изобретению можно использовать способы in vitro, где библиотеку антител подвергают скринингу для идентификации антитела, имеющего требуемую специфичность связывания. Способы такого скрининга библиотек рекомбинантных антител хорошо известны в данной области и включают способы, описанные, например, в Ladner et al., патент США №5223409; Kang et al., публикация PCT № WO 92/18619; Dower et al., публикация PCT № WO 91/17271; Winter et al., публикация PCT № WO 92/20791; Markland et al., публикация PCT № WO 92/15679; Breitling et al., публикация PCT № WO 93/01288; McCafferty et al., публикация PCT № WO 92/01047; Garrard et al., публикация PCT № WO 92/09690; Fuchs et al., Bio/Technology, 9: 1369-1372 (1991); Hay et al., Hum. Antibod. Hybridomas, 3: 81-85 (1992); Huse et al., Science, 246: 1275-1281 (1989); McCafferty et al., Nature, 348: 552-554 (1990); Griffiths et al., EMBO J., 12: 725-734 (1993); Hawkins et al., J. Mol. Biol., 226: 889-896 (1992); Clackson et al., Nature, 352: 624-628 (1991); Gram et al., Proc. Natl. Acad. Sci. USA, 89: 3576-3580 (1992); Garrard et al., Bio/Technology, 9: 1373-1377 (1991); Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991); и Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991); публикация США №2003/0186374; и публикация PCT № WO 97/29131, содержание каждого из которых включено в настоящее описание в качестве ссылок.
Библиотека рекомбинантных антител может быть из любого индивидуума, иммунизированного IL-1β, или частью IL-1β. Альтернативно библиотека рекомбинантных антител может быть из наивного индивидуума, т.е. индивидуума, которого не иммунизировали IL-1β, такая как библиотека из человека, которого не иммунизировали IL-1β человека. Антитела по изобретению отбирают скринингом библиотеки рекомбинантных антител с помощью пептида, содержащего IL-1β человека, для селекции тем самым антител, которые распознают IL-1β. Способы проведения такого скрининга и селекции хорошо известны в данной области, как описано в ссылках в предыдущем абзаце. Для отбора антител по изобретению, имеющих конкретную аффинность связывания в отношении IL-1β человека, таких как антитела, которые диссоциируют от IL-1β человека с конкретной константой скорости Koff, можно использовать известный в данной области способ поверхностного плазмонного резонанса для отбора антител, имеющих желаемую константу скорости Koff. Для отбора антител по изобретению, имеющих конкретную нейтрализующую активность в отношении IL-1β человека, таких как антитела с конкретной IC50, можно использовать стандартные известные в данной области способы оценки ингибирования активности IL-1β.
В одном аспекте изобретение относится к выделенному антителу или его антигенсвязывающей части, которое связывает IL-1β человека. Предпочтительно, антитело представляет собой нейтрализующее антитело. В различных вариантах осуществления антитело представляет собой рекомбинантное антитело или моноклональное антитело.
Например, антитела по настоящему изобретению также можно получать с использованием различных способов фагового дисплея, известных в данной области. В способах фагового дисплея функциональные домены антитела экспонируют на поверхности фаговых частиц, которые обладают полинуклеотидными последовательностями, кодирующими их. В частности, такой фаг можно использовать для экспонирования антигенсвязывающих доменов, экспрессированных из библиотеки набора антител или комбинаторной библиотеки антител (например, человека или мыши). Фаг, экспрессирующий антигенсвязывающий домен, который связывает представляющий интерес антиген, можно подвергать селекции и идентифицировать с помощью антигена, например, с использованием меченого антигена или антигена, связанного или фиксированного на твердой поверхности или гранулах. Фаг, используемый в этих способах, как правило, представляет собой нитевидный фаг, включающий fd и M13, связывающий домены, экспрессируемые из фага с доменами антитела Fab, Fv или стабилизированного дисульфидом Fv, рекомбинантно слитыми с фаговым белком гена III или гена VIII. Примеры способов фагового дисплея, которые можно использовать для получения антител по настоящему изобретению, включают способы, описанные в Brinkman et al., J. Immunol. Methods 182:41-50 (1995); Ames et al., J. Immunol. Methods 184:177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994); Persic et al., Gene 187: 9-18 (1997); Burton et al., Adv. Immunol. 57:191-280 (1994); международной заявке № PCT/GB91/01134; публикациях международных заявок № WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и патентах США №5698426; 5223409; 5403484; 5580717; 5427908; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме.
Как описано в указанных выше ссылках, после селекции фага, кодирующие области антитела из фага можно выделять и использовать для получения целых антител, включая антитела человека, или любого другого желаемого антигенсвязывающего фрагмента, и экспрессировать в любом желательном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, например, как подробно описано ниже. Например, также можно использовать технологии рекомбинантной продукции Fab-, Fab’- и F(ab’)2-фрагментов с использованием способов, известных в данной области, таких как способы, описанные в публикации PCT № WO 92/22324; Mullinax et al., BioTechniques 12 (6): 864-869 (1992); и Sawai et al., Am. J. Reprod. Immunol. 34:26-34 (1995); и Better et al., Science 240:1041-1043 (1988) (указанные ссылки включены в качестве ссылок в полном объеме). Примеры технологий, которые можно использовать для получения одноцепочечных Fv и антител включают способы, описанные в патентах США №4946778 и 5258498; Huston et al., Methods Enzymol. 203: 46-88 (1991); Shu et al., Proc. Natl. Acad. Sci. 90:7995-7999 (1993); и Skerra et al., Science 240: 1038-1041 (1988).
Альтернативно скринингу библиотек рекомбинантных антител посредством фагового дисплея для идентификации антител с двойной специфичностью по изобретению можно использовать другие известные в данной области способы скрининга больших комбинаторных библиотек. Одним типом альтернативной экспрессирующей системы является система, в которой библиотека рекомбинантных антител экспрессируется в качестве слитых конструкций РНК-белок, как описано в публикации международной заявки № WO 98/31700, Szostak and Roberts, и в Roberts and Szostak Proc. Natl. Acad. Sci. USA 94: 12297-12302 (1997). В этой системе, проводят ковалентное слияние между мРНК и пептидом или белком, который кодируется посредством трансляции in vitro синтетических мРНК, которые обладают пуромицином, пептидильным акцепторным антибиотиком, на их 3’-конце. Таким образом, комплексную смесь мРНК (например, комбинаторную библиотеку) можно обогащать конкретной мРНК, исходя из свойств конкретного пептида или белка, например, антитела или его части, таких как связывание антитела или его части, с антигеном с двойной специфичностью. Последовательности нуклеиновых кислот, кодирующих антитела или их части, выделенные путем скрининга таких библиотек, можно экспрессировать рекомбинантными способами, как описано выше (например, в клетках-хозяевах млекопитающих) и, более того, их можно подвергать дальнейшему созреванию аффинности либо посредством дополнительных раундов скрининга слитых конструкций мРНК-пептид, в которых в исходно отобранную последовательность(и) были внесены мутации, либо другими способами созревания аффинности in vitro для рекомбинантных антител, как описано выше.
В другом подходе антитела по настоящему изобретению также можно получать с использованием способов дрожжевого дисплея, известных в данной области. В способах дрожжевого дисплея, используют способы генетики для связывания доменов антител с клеточной стенкой дрожжей и экспонирования их на поверхности дрожжей. В частности, такие дрожжи можно использовать для дисплея антигенсвязывающих доменов, экспрессируемых из библиотек наборов антител или комбинаторных библиотек антител (например, человека или мыши). Примеры способов дрожжевого дисплея, которые можно использовать для получения антител по настоящему изобретению, включают способы, описанные Wittrup, et al., патент США №6699658, включенный в настоящее описание в качестве ссылки.
B. Продуцирование рекомбинантных антител против IL-1β
Антитела по настоящему изобретению можно получать любым из множества способов, известных в данной области, например, экспрессией из клеток-хозяев, где экспрессирующий вектор(ы), кодирующий тяжелую и легкую цепи трансфицирован(ы) в клетку-хозяина стандартными способами. Подразумевают, что различные формы термина "трансфекция" включают широкое множество способов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, осаждением фосфатом кальция, трансфекцию DEAE-декстраном и т.п. Хотя можно экспрессировать антитела по изобретению как в прокариотических, так и в эукариотических клетках-хозяевах, экспрессия антител эукариотических клетках является предпочтительной, и наиболее предпочтительной в клетках-хозяевах млекопитающих, поскольку в таких эукариотических клетках (и, в частности, клетках млекопитающих) с большей вероятностью, чем в прокариотических клетках, соберется и будет секретироваться надлежащим образом свернутое и иммунологически активное антитело.
Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают клетки яичника китайского хомяка (клетки CHO) (включая клетки dhfr- CHO, описанные в Urlaub and Chasin, Proc. Natl Acad. Sci. USA, 77: 4216-4220 (1980), используемые с селективным маркером DHFR, например, как описано в Kaufman and Sharp, J. Mol. Biol., 159: 601-621 (1982)), клетки миеломы NSO, клетки COS и клетки SP2. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антитела, вводят в клетки-хозяева млекопитающих, антитела получают культивированием клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии антитела в клетках-хозяевах, или, более предпочтительно, секреции антитела в культуральную среду, в которой клетки-хозяева выращивают. Антитела можно выделять из культуральной среды с использованием стандартных способов очистки белка.
Также клетки-хозяева можно использовать для получения функциональных фрагментов антитела, таких как Fab-фрагменты или молекулы scFv. Понятно, что варианты указанного выше способа находятся в объеме настоящего изобретения. Например, может быть желательной трансфекция клетки-хозяина ДНК, кодирующей функциональные фрагменты либо легкой цепи и/либо тяжелой цепи антитела по этому изобретению. Также можно использовать технологию рекомбинантных ДНК для удаления некоторой части или всей ДНК, кодирующей любую или обе из легкой цепи и тяжелой цеп, которая не является необходимой для связывания представляющих интерес антигенов. Молекулы, экспрессированные с таких укороченных молекул ДНК, также охватываются антителами по изобретению. Кроме того, можно получать бифункциональные антитела, в которых одна тяжелая и одна легкая цепь представляет собой антитело по изобретению, а другая тяжелая и легкая цепь является специфичной к антигену, отличному от представляющих интерес антигенов, путем поперечного сшивания антитела по изобретению со вторым антителом стандартными способами химического сшивания.
В иллюстративной системе для рекомбинантной экспрессии антитела, или его антигенсвязывающей части, по изобретению, рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводят в клетки dhfr-CHO опосредуемой фосфатом кальция трансфекцией. В рекомбинантном экспрессирующем векторе каждый из генов тяжелой и легкой цепей антитела функционально связаны с регуляторными элементами энхансер CMV/промотор AdMLP для обеспечения высоких уровней транскрипции генов. Также рекомбинантный экспрессирующий вектор имеет ген DHFR, который позволяет селекцию клеток CHO, которые трансфицированы вектором, с использованием селекции/амплификации с помощью метотрексата. Отобранные трансформированные клетки-хозяева культивируют для обеспечения экспрессии тяжелой и легкой цепей антитела, и интактное антитело выделяют из культуральной среды. Для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, селекции трансформантов, культивирования клеток-хозяев и выделения антитела из культуральной среды используют стандартные способы молекулярной биологии. Кроме того, изобретение относится к способу синтеза рекомбинантного антитела по изобретению культивированием клетки-хозяина по изобретению в пригодной среде, до тех пор, пока не синтезируется рекомбинантное антитело по изобретению. Кроме того, способ может включать выделение рекомбинантного антитела из культуральной среды.
1. Химерные антитела против IL-1β человека
Химерное антитело представляет собой молекулу, в которой различные части антитела получены из различных видов животных, такую как антитела, имеющие вариабельную область, образованную из моноклонального антитела мыши, и константную область иммуноглобулина человека. Способы получения химерных антител известны в данной области и подробно рассмотрены в настоящем описании. См. например, Morrison, Science 229:1202 (1985); Oi et al., BioTechniques 4:214 (1986); Gillies et al., (1989) J. Immunol. Methods 125:191-202; патенты США №5807715; 4816567 и 4816397, которые включены в настоящее описание в качестве ссылок в полном объеме. Кроме того, можно использовать способы, разработанные для получения "химерных антител" (Morrison et al., 1984, Proc. Natl. Acad. Sci. 81:851-855; Neuberger et al., 1984, Nature 312:604-608; Takeda et al., 1985, Nature 314:452-454, которые включены в настоящее описание в качестве ссылок в полном объеме) посредством сплайсинга генов молекулы антитела мыши с соответствующей антигенной специфичностью с генами молекулы антитела человека с соответствующей биологической активностью.
В одном из вариантов осуществления химерные антитела по изобретению получают, заменяя константную область тяжелой цепи моноклональных антител мыши против IL-β человека, описанных в разделе 1, константной областью IgG1 человека.
2. Антитела против IL-1β с пересаженными CDR
Антитела с пересаженными CDR по изобретению содержат последовательности вариабельных областей тяжелой и легкой цепи из антитела человека, где одна или несколько из областей CDR VH и/или VL заменена последовательностями CDR антител мыши по изобретению. Матрицей для пересадки CDR может служить каркасная последовательность из любого антитела человека. Однако прямая замена цепей в такой каркасной области часто приводит к некоторой потере аффинности связывания с антигеном. Чем более гомологичным является антитело человека исходному антителу мыши, тем менее вероятной является то, что объединение CDR мыши с каркасной областью человека внесет искажения в CDR, которые могут снизить аффинность. Таким образом, предпочтительно, чтобы каркасная область вариабельной области человека, которая выбрана для замены каркасной области вариабельной области мыши, за исключением CDR, имела по меньшей мере 65% идентичность последовательности с каркасной областью вариабельной области антитела мыши. Более предпочтительно, чтобы вариабельные участки человека и мыши, за исключением CDR, имели по меньшей мере 70% идентичность последовательностей. Более предпочтительно, чтобы вариабельные участки человека и мыши, за исключением CDR, имели по меньшей мере 75% идентичность последовательностей. Наиболее предпочтительно, чтобы вариабельные участки человека и мыши, за исключением CDR, имели по меньшей мере 80% идентичность последовательностей. Способы получения химерных антител известны в данной области (см., например, патент Европы № EP 239400; публикацию международной заявки № WO 91/09967; патенты США №5225539; 5530101 и 5585089). Для гиперхимеризации или изменения поверхности антител см., например, патенты Европы № EP 592106 и EP 519596; Padlan, Mol Immunol., 28(4/5): 489-498 (1991); Studnicka et al., Protein Eng., 7(6): 805-814 (1994); и Roguska et al., Proc. Natl Acad. Sci. USA, 91: 969-973 (1994). Что касается шаффлинга цепей антител см., например, патент США №5565352.
3. Гуманизированные антитела против IL-β человека
Гуманизированные антитела представляют собой молекулы антител из антитела не являющегося человеком вида, которые связывают желаемый антиген, имеющие одну или несколько определяющих комплементарность областей (CDR) не являющегося человеком вида и каркасные области из молекулы иммуноглобулина человека. Известные последовательности Ig человека описаны, например, на
www.ncbi.nlm.nih.gov/entrez-/query.fcgi; www.atcc.org/phage/hdb.html; www.sciquest.com/; www.abcam.com/; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/.about.pedro/research_tools.html; www.mgen.uni-heidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH-05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; www.path.cam.ac.uk/.about.mrc7/m-ikeimages.html; www.antibodyresource.com/; mcb.harvard.edu/BioLinks/Immunology.html; www.immunologylink.com/; pathbox.wustl.edu/.about.hcenter/index.-html; www.biotech.ufl.edu/.about.hcl/; www.pebio.com/pa/340913/340913.html-; www.nal.usda.gov/awic/pubs/antibody/;
www.m.ehime-u.acjp/.about.yasuhito-/Elisa.html; www.biodesign.com/table.asp;
www.icnet.uk/axp/facs/davies/lin-ks.html; www.biotech.ufl.edu/.about.fccl/protocol.html;
www.isac-net.org/sites_geo.html; aximtl.imt.unimarburg.de/.about.rek/AEP-Start.html; baserv.uci.kun.nl/.about.jraats/linksl.html;
www.recab.uni-hd.de/immuno.bme.nwu.edu/;
www.mrc-cpe.cam.ac.uk/imt-doc/pu-blic/INTRO.html; www.ibt.unam.mx/vir/V_mice.html;
imgt.cnusc.fr:8104/; www.biochem.ucl.ac.uk/.about.martin/abs/index.html; antibody.bath.ac.uk/;
abgen.cvm.tamu.edu/lab/wwwabgen.html; www.unizh.ch/.about.honegger/AHOsem-inar/Slide01.html; www.cryst.bbk.ac.Uk/.about.ubcg07s/; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm; www.path.cam.ac.uk/.about.mrc7/humanisation/TAHHP.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html; www.cryst.bioc.cam.ac.uk/.abo-ut.fmolina/Web-pages/Pept/spottech.html;
www.jerini.de/frroducts.htm;
www.patents.ibm.com/ibm.html.Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983), все из которых включены в настоящее описание в качестве ссылок в полном объеме. Такие импортные последовательности можно использовать для снижения иммуногенности или снижения, повышения или модификации связывания, аффинности, константы ассоциации, константы диссоциации, авидности, специфичности, времени полужизни, или любой другой приемлемой характеристики, как известно в данной области.
Каркасные (FR) остатки в каркасных областях человека можно заменять соответствующим остатком из антитела, являющегося донором CDR, для изменения, например, повышения, связывания антигена. Эти замены в каркасной области идентифицируют способами, хорошо известными в данной области, например, посредством моделирования взаимодействий остатков CDR и каркасной области для идентификации остатков каркасной области, важных для связывания антигена, и сравнения последовательностей для идентификации необычных остатков каркасной области в конкретных положениях. См., например, Queen et al., патент США №5585089; Riechmann et al., Nature 332:323 (1988), которые включены в настоящее описание в качестве ссылок в полном объеме. Трехмерные модели иммуноглобулинов широко доступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и выводят на экран возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Исследование этих выведенных на экран структур позволяет анализ возможной роли остатков в функционировании последовательности иммуноглобулина-кандидата, т.е. анализ остатков, которые влияют на способность иммуноглобулина-кандидата связывать его антиген. Таким образом, можно отбирать и комбинировать остатки FR из консенсусной и импортной последовательностей, чтобы достигать желательных характеристик антитела, таких как повышенная аффинность к антигену(ам)-мишени. Как правило, остатки CDR прямо и наиболее существенно вовлечены во влияние на связывание антигена. Антитела можно гуманизировать с использованием различных способов, известных в данной области, таких как, но не ограничиваясь ими, способы, описанные в Jones et al., Nature, 321: 522-525 (1986); Verhoeyen et al., Science 239: 1534-1536 (1988), Sims et al., J. Immunol. 151: 2296-2308 (1993); Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89: 4285-4289 (1992); Presta et al., J. Immunol. 151: 2623-2632 (1993), Padlan, Mol. Immunol. 28 (4/5): 489-498 (1991); Studnicka et al., Protein Eng. 7(6): 805-814 (1994); Roguska. et al., PNAS 91: 969-973 (1994); публикации PCT № WO 91/09967; WO 90/14443; WO 90/14424; WO 90/14430; WO 99/06834 (PCT/US98/16280); WO 97/20032 (PCT/US96/18978); WO 92/11272 (PCT/US91/09630); WO 92/03461 (PCT/US91/05939); WO 94/18219 (PCT/US94/01234); WO 92/01047 (PCT/GB91/01134); и WO 93/06213 (PCT/GB92/01755); патентах Европы № EP EP 0592106; EP 0519596 и EP 0239400; патентах США №5565332; 5723323; 5976862; 5824514; 5817483; 5814476; 5763192; 5723323; 5766886; 5714352; 6204023; 6180370; 5693762; 5530101; 5585089; 5225539 и 4816567, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме, включая ссылки, цитированные в них.
4. Связывающие белки DVD-IgTM против IL-1β
Также предусмотрены связывающие белки-иммуноглобулины с двойным вариабельным доменом (DVD-Ig), которые связывают один или несколько эпитопов IL-1β. Связывающий белок DVD-Ig также может связывать эпитоп IL-1β и эпитоп второго антигена-мишени, отличного от полипептида IL-1β. Иллюстративный вариант осуществления таких молекул DVD-Ig включает тяжелую цепь, которая обладает структурной формулой VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен тяжелой цепи, VD2 представляет собой второй вариабельный домен тяжелой цепи, C представляет собой константный домен тяжелой цепи, X1 представляет собой линкер, при условии что он не является CH1, X2 представляет собой Fc-область, и n равно 0 или 1, и предпочтительно 1; и легкую цепь, которая обладает структурной формулой VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен легкой цепи, VD2 представляет собой второй вариабельный домен легкой цепи, C представляет собой константный домен легкой цепи, X1 представляет собой линкер, при условии что он не является CH1, и X2 не содержит Fc-область; и n равно 0 или 1, и предпочтительно 1. Такой DVD-Ig может содержать две таких тяжелых цепи и две таких легких цепи, где каждая цепь содержит вариабельные домены, связанные тандемно, без встроенной между вариабельными областями константной области, где тяжелая цепь и легкая цепь ассоциируют с образованием двух тандемных антигенсвязывающих центров, и пара тяжелой и легкой цепей может ассоциировать с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающего белка с четырьмя антигенсвязывающими центрами. В другом варианте осуществления молекула DVD-Ig может содержать тяжелую и легкую цепи, каждая из которых содержит три вариабельных домена, например, VD1, VD2, VD3, связанных тандемно без встроенной между вариабельными доменами каркасной области, где пара тяжелой и легкой цепей может ассоциировать с образованием трех антигенсвязывающих центров, и где пара тяжелой и легкой цепей может ассоциировать с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающего белка с шестью антигенсвязывающими центрами.
Каждый вариабельный домен (VD) в DVD-Ig можно получать из одного или нескольких "исходных" моноклональных антител, которые связывают один или несколько желаемых антигенов или эпитопов, таких как антигены или эпитопы IL-1β и/или IL-1α.
A. Получение исходных моноклональных антител
Вариабельные домены связывающего белка DVD-Ig можно получать из исходных антител, включая моноклональные антитела (mAb), способные связывать представляющие интерес антигены. Эти антитела могу быть встречающимся в природе или их можно получать с помощью рекомбинантной технологии. Понятно, что если антитело, которое связывает желаемый антиген-мишень или эпитоп, является поликлональным, тогда все еще необходимо получить вариабельные домены антигенсвязывающего центра одного антитела из поликлональной популяции, т.е. одного моноклонального представителя поликлональной популяции, для применения в целях получения DVD-Ig. Моноклональные антитела можно получать любым из множества способов, известных в данной области, включая способы, описанные в настоящем описании (см. разделы A.1.-A.4., выше).
B. Критерии отбора исходных моноклональных антител
Один вариант осуществления изобретения относится к отбору исходных антител по меньшей мере с одним или несколькими свойствами, желательными для молекулы DVD-Ig. В одном из вариантов осуществления желательное свойство выбрано из одного или нескольких параметров антител. В другом варианте осуществления параметры антитела выбраны из группы, состоящей из антигенной специфичности, аффинности к антигену, эффективности, биологической функции, распознавания эпитопа, стабильности, растворимости, эффективности продукции, иммуногенности, фармакокинетики, биодоступности, перекрестной реактивности к тканям и связывания ортологичного антигена.
B1. Аффинность к антигену
Желаемая аффинность терапевтического mAb может зависеть от природы антигена и желаемого терапевтического результата. В одном из вариантов осуществления моноклональные антитела имеют более высокую аффинность (Kd=0,01-0,50 пМ) при блокировании взаимодействия цитокин-рецептор цитокина, поскольку такие взаимодействия обычно представляют собой высокоаффинные взаимодействия (например, диапазоны <пМ-<нМ). В таких случаях, аффинность mAb к его мишени должна быть равна аффинности цитокина (лиганда) к его рецептору, или она должна превышать ее. С другой стороны, терапевтически эффективным может быть mAb с меньшей аффинностью (диапазон >нМ), например, при выведении циркулирующих потенциально патогенных белков, например, моноклональное антитело, которое связывается, изолирует и выводит циркулирующие виды антигена-мишени, такого как амилоид A-β. В других случаях снижение аффинности существующего высокоаффинного mAb сайт-направленным мутагенезом или использование mAb с меньшей аффинностью к его мишени можно использовать для устранения потенциальных побочных действий например, высокоаффинное mAb может изолировать/нейтрализовывать его предполагаемую мишень полностью, тем самым, полностью истощая/устраняя функцию(и) белка-мишени. В этом случае, низкоаффинное mAb может изолировать/нейтрализовывать часть мишени, которая может быть ответственна за симптомы заболевания (патологические или избыточные уровни), таким образом, позволяя части мишени продолжать выполнять ее обычную физиологическую функцию(и). Таким образом, Kd можно снижать для коррекции дозы и/или снижения побочных действий. Аффинность исходного mAb может играть роль в надлежащем нацеливании на молекулы клеточной поверхности для достижения желательного терапевтического исхода. Например, если мишень экспрессируется на злокачественных клетках с высокой плотностью и на нормальных клетках с низкой плотностью, более низкоаффинное mAb связывается с большим количеством мишеней на опухолевых клетках, а не на нормальных клетках, что приводит устранению опухолевых клеток через ADCC или CDC, и таким образом может иметь терапевтически желательные эффекты. Таким образом, выбор mAb с желаемой аффинностью может иметь значение как для растворимых, так и для поверхностных мишеней.
Передача сигнала через рецептор при взаимодействии с его лигандом может зависеть от аффинности взаимодействия рецептор-лиганд. Аналогично, понятно, что аффинность mAb к рецептору на поверхности может определить характер внутриклеточной передачи сигнала и доставку посредством mAb агонистического или антагонистического сигнала. Характер опосредуемой mAb передачи сигнала на основе аффинности может влиять на его профиль побочных действий. Таким образом, желательную аффинность и желательные функции терапевтических моноклональных антител необходимо тщательно определять с помощью экспериментов in vitro и in vivo.
Желаемую Kd связывающего белка (например, антитела) можно определять экспериментально, в зависимости от желаемого терапевтического исхода. В одном из вариантов осуществления отбирают исходные антитела, которые обладают аффинностью (Kd) к конкретному антигену, равной желаемой аффинности DVD-Ig к тому же антигену или превышающей ее. Антигенсвязывающую аффинность и кинетику оценивают с помощью Biacore или другого сходного способа. В одном из вариантов осуществления каждое исходное антитело имеет константу диссоциации (Kd) для его антигена, выбранную из группы, состоящей из: не более чем приблизительно 10-7 M; не более чем приблизительно 10-8 M; не более чем приблизительно 10-9 M; не более чем приблизительно 10-10 M; не более чем приблизительно 10-11 M; не более чем приблизительно 10-12 M; и не более чем 10-13 M. Первое исходное антитело, из которого получают VD1, и второе исходное антитело, из которого получают VD2, могут иметь сходную или отличающуюся аффинность (KD) к соответствующему антигену. Каждое исходное антитело имеет константу скорости ассоциации (Kon) с антигеном, выбранную из группы, состоящей из: по меньшей мере приблизительно 102 M-1с-1; по меньшей мере приблизительно 103 M-1с-1; по меньшей мере приблизительно 104 M-1с-1; по меньшей мере приблизительно 105 M-1с-1; и по меньшей мере приблизительно 106 M-1с-1, при измерении поверхностным плазмонным резонансом. Первое исходное антитело, из которого получают VD1, и второе исходное антитело, из которого получают VD2, может иметь сходную или отличающуюся константу скорости ассоциации (Kon) с его конкретным антигеном. В одном из вариантов осуществления каждое исходное антитело имеет константу скорости диссоциации (Koff) для антигена, выбранную из группы, состоящей из: не более чем приблизительно 10-3 с-1; не более чем приблизительно 10-4 с-1; не более чем приблизительно 10-5 с-1; и не более чем приблизительно 10-6 с-1, при измерении поверхностным плазмонным резонансом. Первое исходное антитело, из которого получают VD1, и второе исходное антитело, из которого получают VD2, может иметь сходные или отличающиеся константы скорости диссоциации (Koff) для соответствующего антигена.
B2. Эффективность
Желаемая аффинность/эффективность исходных моноклональных антител может зависеть от желаемого терапевтического исхода. Например, для взаимодействий рецептор-лиганд (R-L) аффинность (kd) равна kd R-L (диапазон пМ) или превышает ее. Для простого выведения патологических циркулирующих белков, kd может находиться в низком нМ-диапазоне, например, в случае выведения различных типов циркулирующего пептида A-β. Кроме того, kd также может зависеть от того, экспрессирует ли мишень множество копий одного эпитопа, например, в случае mAb, нацеленного на конформационный эпитоп в олигомерах Aβ.
Когда VD1 и VD2 связывают один антиген, но различные эпитопы, DVD-Ig может содержать 4 участка связывания для одного антигена, таким образом, повышая авидность, и, тем самым, кажущуюся kd DVD-Ig. В одном из вариантов осуществления выбирают исходные антитела с kd, равной или меньшей, чем kd, желаемая для DVD-Ig. Факторы аффинности исходного mAb также могут зависеть от того, содержит ли DVD-Ig четыре или более идентичных антигенсвязывающих центра (т.е. DVD-Ig из одного mAb). В этом случае, кажущаяся kd может быть больше чем у mAb вследствие авидности. Такие DVD-Ig можно использовать для перекрестного связывания поверхностного рецептора, повышения эффективности нейтрализации, усиления выведения патологических белков и т.д.
В другом варианте осуществления выбирают исходные антитела с эффективностью нейтрализации конкретного антигена, равной желаемому потенциалу нейтрализации DVD-Ig или превышающей его. Эффективность нейтрализации можно оценивать в биологическом анализе не основе мишени, где клетки соответствующего типа дают поддающийся измерению сигнал (т.е. пролиферация или продукция цитокинов) в ответ на стимуляцию мишени, и нейтрализация мишени посредством mAb может снизить сигнал дозозависимым образом.
B3. Биологические функции
Моноклональные антитела потенциально могут выполнять несколько функций. Некоторые из этих функций приведены в таблице 5. Эти функции можно оценивать как в анализах in vitro (например, клеточных и биохимических анализах), так и в моделях на животных in vivo.
Для достижения требуемых терапевтических исходов можно выбирать MAb с отличающимися функциями, описанными в примерах настоящего описания и в таблице 5. Затем два или более из выбранных исходных моноклональных антител можно использовать в формате DVD-Ig для обеспечения двух отличающихся функций в одной молекуле DVD-Ig. Например, DVD-Ig можно получать путем выбора исходного mAb, которое нейтрализует функцию конкретного цитокина, такого как IL-1β, и отбора исходного mAb, которое усиливает выведение патологического белка. Аналогично, можно выбирать два различных исходных mAb, которые распознают два различных рецептора клеточной поверхности, одно mAb с функцией агониста одного рецептора и другое mAb с функцией антагониста на другом рецепторе. Эти два выбранных mAb, каждое с отличающейся функцией, можно использовать для конструирования одной молекулы DVD-Ig, которая обладает двумя различными функциями (агониста и антагониста) выбранных моноклональных антител в одной молекуле. Аналогично, в формате DVD-Ig можно использовать два антагонистических mAb к рецепторам клеточной поверхности, каждое из которых блокирует связывание соответствующих лигандов рецепторов (например, EGF и IGF). Напротив, для получения DVD-Ig можно выбирать антагонистическое mAb против рецептора (например, против EGFR) и нейтрализующее mAb против растворимого медиатора (например, антитело против IGF1/2).
B4. Распознавание эпитопа
Различные области белков могут выполнять различные функции. Например, конкретные области цитокина, такого как IL-1β, взаимодействуют с рецептором цитокина, осуществляя активацию рецептора, в то время как другие области белка могут требоваться для стабилизации цитокина. В этом случае можно выбирать mAb, которое специфично связывается с взаимодействующей с рецептором областью(ями) на цитокине и, тем самым, блокирует взаимодействие цитокин-рецептор. В некоторых случаях, например, в случае определенных рецепторов хемокинов, которые связывают множество лигандов, можно выбирать mAb, которое связывается с эпитопом (областью на рецепторе хемокина), который взаимодействует только с одним лигандом. В других случаях, моноклональные антитела могут связываться с эпитопами на мишени, которые не прямо ответственны за физиологические функции белка, но связывание mAb с этими областями может либо препятствовать физиологическим функциям (пространственное препятствие), либо изменять конформацию белка, так что белок не может функционировать (mAb к рецепторам со множеством лигандов, которое изменяет конформацию рецептора, так чтобы ни один из лигандов не мог связываться). Также идентифицированы моноклональные антитела против цитокинов, которые не блокируют связывание цитокина с его рецептором, но блокируют передачу сигнала (например, 125-2H, mAb против IL-18).
Примеры эпитопов и функций mAb включают, но не ограничиваются ими, блокирование взаимодействия рецептор-лиганд (R-L) (нейтрализующее mAb, которое связывает взаимодействующий с R участок); пространственное препятствование, приводящее к сниженному связыванию R или к его отсутствию. Ab может связывать мишень в участке, отличном от участка связывания рецептора, но, тем не менее, препятствовать связыванию рецептора и функциям мишени путем индукции конформационного изменения и устранения функции (например, XOLAIR®, омализумаб, Genetech/Novartis) связывания с R, блокируя передачу сигнала (125-2H mAb).
В одном из вариантов осуществления исходное mAb должно быть нацелено на соответствующий эпитоп для максимальной эффективности. Такой эпитоп должен быть сохранен у DVD-Ig. Эпитоп, с которым связывается mAb, можно определять несколькими подходами, включая кокристаллографию, ограниченный протеолиз комплекса mAb-антиген вместе со спектрометрическим картированием пептида (Legros et al., Protein Sci., 9: 1002-1010 (2000)), пептидные библиотеки фагового дисплея (O’Connor et al., J. Immunol. Methods., 299: 21-35 (2005)), а также мутагенез (Wu C. et al., J. Immunol., 170: 5571-5577 (2003)).
B5. Биофизические и фармацевтические свойства
Терапевтическое лечение антителами часто требует введения высоких доз, часто нескольких мг/кг (вследствие низкой эффективности, в расчете на массу, как правило, вследствие большой молекулярной массы). Для обеспечения соблюдением пациента режима лечения и надлежащего выбора лекарственных средств от хронического заболевания и амбулаторного лечения, является желательным подкожное (п/к) или внутримышечное (в/м) введение терапевтических mAb. Например, максимальный объем для подкожного введения составляет ~1,0 мл, и таким образом, являются желательными концентрации >100 мг/мл для ограничения количества инъекций на дозу. В одном из вариантов осуществления терапевтическое антитело вводят в одной дозе. Однако разработка таких составов ограничена белок-белковыми взаимодействиями (например, агрегацией, которая потенциально повышает риск иммуногенности) и ограничениями в ходе процессинга и доставки (например, вязкости). Следовательно, для клинической эффективности требуются большие количества, и связанная с ними разработка ограничивает полное применение потенциального состава антитела и подкожное введение в режимах высоких доз. Очевидно, что наиболее важными являются физико-химические и фармацевтические свойства молекулы белка и раствора белка, например, показатели стабильности, растворимости и вязкости.
B5.1. Стабильность
"Стабильный" состав антитела представляет собой состав, в котором антитело по существу сохраняет его физическую стабильность и/или химическую стабильность и/или биологическую активность при хранении. Стабильность можно измерять при выбранной температуре в течение выбранного периода времени. В одном из вариантов осуществления антитело в составе является стабильным при комнатной температуре (приблизительно 30°С) или при 40°С в течение по меньшей мере 1 месяца и/или является стабильным при приблизительно 2-8°C в течение по меньшей мере 1 года, например в течение по меньшей мере 2 лет. Более того, В одном из вариантов осуществления состав является стабильным после замораживания (например, до -70°С) и размораживания состава, в дальнейшем настоящем описании называемых "циклом замораживания/размораживания". В другом примере "стабильный" состав может представлять собой состав, где менее чем приблизительно 10% и менее чем приблизительно 5% белка присутствует в составе в качестве агрегата.
Является желательным DVD-Ig, стабильный in vitro при различных температурах в течение длительного периода времени. Этого можно достигать быстрым скринингом исходных mAb, стабильных in vitro при повышенной температуре, например, при 40°С в течение 2-4 недель, а затем оценивать стабильность. В процессе хранения при 2-8°C, белок проявляет стабильность в течение по меньшей мере 12 месяцев, например, в течение по меньшей мере 24 месяцев. Стабильность (% мономерной интактной молекулы) можно оценивать с использованием различных способов, таких как катионообменная хроматография, эксклюзионная хроматография, SDS-PAGE, а также тестирование биологической активности. Для более исчерпывающего списка способов анализа, которые можно использовать для анализа ковалентных и конформационных модификаций, см. Jones, A.J.S., "Analytical methods for the assessment of protein formulations and delivery systems", Chapter 2, Formulation and delivery of peptides and proteins, 1st ed., (Cleland and Langer, eds.) (American Chemical Society, Washington, D.C., 1994) pp. 22-45; и Pearlman and Nguyen, "Analysis of protein drugs", Chapter 6, Peptide and protein drug delivery, 1st ed. [Advances in Parenteral Sciences, vol. 4] (Lee, V.H., ed.) (Marcel Dekker, Inc., New York, 1991) pp. 247-301.
Гетерогенность и образование агрегатов: стабильность антитела может быть такой, что состав может обладать менее чем приблизительно 10%, и, В одном из вариантов осуществления, менее чем приблизительно 5%, в другом варианте осуществления, менее чем приблизительно 2%, или, В одном из вариантов осуществления, в диапазоне от 0,5% до 1,5% или менее, в материале антитела GMP, которые присутствуют в качестве агрегата. Эксклюзионная хроматография представляет собой способ, который является чувствительным, воспроизводимым и высоко надежным для детекции агрегатов белка.
В дополнение к низким уровням агрегатов антитело, В одном из вариантов осуществления, должно быть химически стабильным. Химическую стабильность можно определять ионообменной хроматографией (например, катионообменной или анионообменной хроматографией), хроматографией гидрофобного взаимодействия или другими способами, такими как изоэлектрическое фокусирование или капиллярный электрофорез. Например, химическая стабильность антитела может быть такой, что после хранения в течение по меньшей мере 12 месяцев при 2-8°C пик, соответствующий немодифицированному антителу при катионообменной хроматографии, может возрастать не более чем на 20%, В одном из вариантов осуществления, не более чем на 10%, или, в другом варианте осуществления, не более чем на 5% по сравнению с раствором антитела перед тестированием хранения.
В одном из вариантов осуществления исходные антитела проявляют структурную целостность; правильное образование дисульфидных связей и правильное сворачивание: химическая нестабильность вследствие изменений вторичной или третичной структуры антитела может влиять на активность антитела. Например, стабильность, на которую указывает активность антитела, может быть такой, что после хранения в течение по меньшей мере 12 месяцев при 2-8°C активность антитела может снижаться не более чем на 50%, В одном из вариантов осуществления не более чем на 30%, или более того, не более чем на 10%, или, В одном из вариантов осуществления, не более чем на 5% или 1% по сравнению с раствором антитела перед тестированием хранения. Для определения активности антитела можно использовать пригодные анализы связывания антигена.
B5.2. Растворимость
"Растворимость" mAb коррелирует с продукцией правильно свернутого мономерного IgG. Таким образом, растворимость IgG можно оценивать с помощью ВЭЖХ. Например, растворимый (мономерный) IgG может давать один пик на хроматограмме ВЭЖХ, в то время как нерастворимый (например, мультимерный и агрегированный) дает множеству пиков. Таким образом, специалист в данной области способен выявить повышение или снижение растворимости IgG с использованием общепринятых способов ВЭЖХ. Для более исчерпывающего перечня способов анализа, которые можно использовать для анализа растворимости (см., Jones, A.G., Dep. Chem. Biochem. Eng., Univ. Coll. London, "Particle formation and separation in suspension crystallization processes", Chapter 4, Process. Solid-Liquid Suspensions, (P. Ayazi Shamlou, ed.) (Butterworth-Heinemann, Oxford, UK, 1993) pp. 93-117; и Pearlman and Nguyen, "Analysis of protein drugs", Chapter 6, Peptide and protein drug delivery, 1st ed. [Advances in Parenteral Sciences, vol. 4] (Lee, V.H., ed.) (Marcel Dekker, Inc., New York, 1991) pp. 247-301). Растворимость терапевтического mAb является важной для изготовления в высокой концентрации, часто требуемой для надлежащего дозирования. Как указано в настоящем описании, для обеспечения эффективного дозирования антитела может требоваться растворимость >100 мг/мл. Например, растворимость антитела может составлять не менее чем приблизительно 5 мг/мл на ранней фазе исследования, В одном из вариантов осуществления, не менее чем приблизительно 25 мг/мл на развернутых стадиях научного процесса, или, В одном из вариантов осуществления не менее чем приблизительно 100 мг/мл, или, В одном из вариантов осуществления, не менее чем приблизительно 150 мг/мл. Для физико-химических свойств раствора белка, например, стабильности, растворимости, вязкости важны внутренние свойства молекулы белка. Однако специалисту в данной области понятно, что существует широкое множество эксципиентов, которые можно использовать в качестве добавок, для благоприятного влияния на характеристики конечного белкового состава. Эти эксципиенты могут включать: (i) жидкие растворители, сорастворители (например, спирты, такие как этанол); (ii) буферные средства (например, фосфатные, ацетатные, цитратные, аминокислотные буферы); (iii) сахара или спирты сахаров (например, сахарозу, трегалозу, фруктозу, рафинозу, маннит, сорбит, декстраны); (iv) поверхностно-активные вещества (например, полисорбат 20, 40, 60, 80, полоксамеры); (v) модификаторы тоничности (например, соли, такие как NaCl, сахара, спирты сахаров); и (vi) прочие (например, консерванты, хелатирующие агенты, антиоксиданты, хелатирующие агенты (например, EDTA), биологически деградируемые полимеры, молекулы носителей (например, HSA, PEG).
Вязкость является высоко важным параметром с точки зрения изготовления антитела и переработки антитела (например, диафильтрации/ультрафильтрации), процессов заполнения-окончательной обработки (аспекты подачи насосом, аспекты фильтрации) и аспектов доставки (проходимость через иглу, доставка с помощью сложных устройств). Низкая вязкость обеспечивает жидкий раствор антитела, имеющий более высокую концентрацию. Это обеспечивает введение такой же дозы в меньших объемах. Небольшие объемы инъекции обеспечивают преимущества меньшей болезненности в ходе инъекции, и то, что растворы не обязательно должны быть изотоническими для снижения боли при инъекции пациенту. Вязкость раствора антитела может быть такой, что при скорости сдвига 100 (1/с) вязкость раствора антитела составляет менее 200 мПа с, В одном из вариантов осуществления менее 125 мПа с, в другом варианте осуществления менее 70 мПа с, и в другом варианте осуществления менее 25 мПа с или даже менее 10 мПа с.
B5.3. Эффективность продукции
Получение DVD-Ig, который эффективно экспрессируется в клетках млекопитающих, таких как клетки яичника китайского хомяка (CHO), В одном из вариантов осуществления требует двух исходных моноклональных антител, которые сами по себе эффективно экспрессируются в клетках млекопитающих. Выход продукции из стабильной линии млекопитающих (т.е. CHO) должен быть выше чем приблизительно 0,5 г/л, В одном из вариантов осуществления выше чем приблизительно 1 г/л, и в другом варианте осуществления он должен находиться в диапазоне от приблизительно 2 до приблизительно 5 г/л или более (Kipriyanov et al., Mol. Biotechnol., 12: 173-201 (1999); Carroll et al., Expert Opin Biol Ther., 4: 1821-1829 (2004)).
На продукцию антител и слитых с Ig белков в клетках млекопитающих влияет несколько факторов. Конструирование экспрессирующего вектора путем включения сильных промотров, энхансеров и селективных маркеров, может максимизировать транскрипцию представляющего интерес гена со встроенной копии вектора. Идентификация участков интеграции в векторе, которые позволяют высокие уровни транскрипции генов, может усилить экспрессию белка с вектора (Wurm, F.M., Nature Biotechnol., 22(11): 1393-1398 (2004)). Более того, на уровни продукции влияет соотношение тяжелых и легких цепей антитела и различные стадии в ходе сборки и секреции белка (Jiang et al., Biotechnol. Prog., 22(1): 313-318 (2006)).
B.6. Иммуногенность
Введение терапевтического mAb иногда может приводить к возникновению иммунного ответа (т.е. к образованию эндогенных антител, направленных против терапевтического mAb). При выборе исходных моноклональных антител следует анализировать потенциальные элементы, которые могут индуцировать иммуногенность, и перед конструированием DVD-Ig можно предпринимать шаги для оптимизиации исходных моноклональных антител. Было выявлено, что антитела, полученные из мыши, являются высокоиммунногенными у пациентов. Получение химерных антител, содержащих вариабельные области мыши и константные области человека, представляет собой логический следующий шаг для снижения иммуногенности терапевтических антител (Morrison and Schlom, "Recombinant Chimeric Monoclonal Antibodies", Chapter 1, Important Advances in Oncology 1990 (J.B. Lippincott Company, Philadelphia, 1990) pp. 3-18). Альтернативно иммуногенность можно снижать переносом последовательностей CDR мыши в каркасную область антитела человека (изменение формы/пересадка CDR/гуманизация), как описано для терапевтического антитела Riechmann et al., Nature, 332: 323-327 (1988). Другой способ называют "изменением поверхности" или "гиперхимеризацией", которая начинается с вариабельных доменов легкой и тяжелой цепей грызунов: в антителах человека изменяют только доступные поверхностные аминокислоты каркасной области, в то время как CDR и погруженные аминокислоты оставляют из исходного антитела грызуна (Roguska et al., Protein Eng., 9(10): 895-904 (1996)). При другом типе гуманизации вместо пересадки целых CDR в одном способе пересаживают только "определяющие специфичность области" (SDR), определяемые подгруппой остатков CDR, которые вовлечены в связывание антитела с его мишенью (Kashmiri et al., Methods, 36(1): 25-34 (2005)). Это делает необходимой идентификацию SDR, либо с помощью анализа доступных трехмерных структур комплексов антитело-мишень, либо с помощью мутационного анализа остатков CDR антитела для определения того, какой из них взаимодействует с мишенью. Альтернативно полностью человеческие антитела могут иметь сниженную иммуногенность по сравнению с антителами мыши, химерными антителами или гуманизированными антителами.
Другим подходом для снижения иммуногенности терапевтических антител является устранение некоторых конкретных последовательностей, для которых предсказано наличие иммуногенности. В одном подходе после тестирования первого поколения биологических средств у человека и выявления того, что они являются неприемлемо иммуногенными, можно картировать B-клеточные эпитопы, а затем изменять их для предотвращения обнаружения иммунной системой. В другом подходе используются способы предсказания и удаления потенциальных T-клеточных эпитопов. Были разработаны компьютерные способы для сканирования и идентификации пептидных последовательностей биологических лекарственных средств, потенциально связывающихся с белками MHC (Desmet et al., Proteins, 58: 53-69 (2005)). Альтернативно для идентификации CD4+ T-клеточных эпитопов в потенциальных белковых аллергенах можно использовать способ на основе дендритных клеток человека (Stickler et al., Immunother., 23: 654-660 (2000); Morrison and Schlom, Important Adv. Oncol. (1990) pp. 3-18; Riechmann et al. "Reshaping human antibodies for therapy", Nature. 332: 323-327 (1988); Roguska et al., "A comparison of two murine mAbs humanized by CDR-grafting and variable domain resurfacing", Protein Eng., 9: 895-904 (1996); Kashmiri et al., "SDR grafting - a new approach to antibody humanization", Methods, 36(1): 25-34 (2005); Desmet et al., "Anchor profiles of HLA-specific peptides: analysis by a novel affinity scoring method and experimental validation", Proteins, 58: 53-69 (2005); Stickler et al., "CD4+ T-cell epitope determination using unexposed human donor peripheral blood mononuclear cells", J. Immunother., 23: 654-660 (2000)).
B7. Эффективность in vivo
Для получения молекулы DVD-Ig с желаемой эффективностью in vivo, важно получить и выбрать mAb с эффективностью in vivo, сходной с желаемой при введении в комбинации. Однако в некоторых случаях DVD-Ig может обладать эффективностью in vivo, которую нельзя достигнуть с помощью комбинирования двух отдельных mAb. Например, DVD-Ig может тесно сближать две мишени, что приводит к активности, которую нельзя достигнуть в случае комбинации двух отдельных mAb. Дополнительные желаемые биологические функции описаны в настоящем описании в разделе B3. Исходные антитела с характеристиками, желаемыми в молекуле DVD-Ig, можно выбирать с учетом таких факторов, как фармакокинетическое время полужизни (t1/2); распределение в тканях; растворимые мишени относительно поверхностных; и концентрация растворимой мишени/плотность поверхностной мишени.
B8. Распределение в тканях in vivo
Для получения молекулы DVD-Ig с желаемым распределением в тканях in vivo, В одном из вариантов осуществления необходимо выбирать исходные mAb со сходным с желаемым распределением в тканях in vivo. Альтернативно, исходя из механизма стратегии нацеливания с двойной специфичностью, в другом случае может не требоваться выбор исходных mAb с распределением в тканях in vivo, сходным с желаемым распределением при введении в комбинации. Примером этого является случай DVD-Ig, в котором связывающий компонент нацеливает DVD-Ig в конкретную область, тем самым перенося второй связывающий компонент в область той же мишени. Например, одна специфичность связывания DVD-Ig может быть нацелена на поджелудочную железу (островковые клетки), а другая специфичность может доставлять GLP1 в поджелудочную железу для индукции инсулина.
B9. Изотип
Для получения молекулы DVD-Ig с желаемыми свойствами, включая, но не ограничиваясь ими, изотип, эффекторные функции и время полужизни в кровотоке, выбирают исходные mAb с соответствующими эффекторными функциями Fc, в зависимости от терапевтической применимости и желаемого терапевтического результата. Существует пять основных классов или изотипов тяжелых цепей, некоторые из которых имеют несколько подтипов, и они определяют эффекторные функции молекулы антитела. Эти эффекторные функции свойственны шарнирной области, CH2- и CH3-доменам молекулы антитела. Однако остатки в других частях молекулы антитела также могут иметь эффекты на эффекторные функции. Эффекторные функции Fc шарнирной области включают: (i) антителозависимую клеточную цитотоксичность (ADCC), (ii) связывание комплемента (C1q), активацию и комплементзависимую цитотоксичность (CDC), (iii) фагоцитоз/выведение комплексов антиген-антитело, и (iv) в некоторых случаях, высвобождение цитокинов. Эти эффекторные функции Fc молекулы антитела опосредуются взаимодействием Fc-области с рядом класс-специфических рецепторов клеточной поверхности. Антитела изотипа IgG1 являются наиболее активными, в то время как IgG2 и IgG4 имеют минимальные эффекторные функции или не имеют их. Эффекторные функции антител IgG опосредуются взаимодействиями с тремя структурно гомологичными типами (и подтипами) клеточных Fc-рецепторов (FcgRI, FcgRII и FcgRIII). Эти эффекторные функции IgG1 можно устранить мутацией конкретных аминокислотных остатков, которые требуются для связывания FcgR и C1q, в нижней шарнирной области (например, L234A, L235A). Аминокислотные остатки в Fc-области, в частности, в CH2-CH3-доменах, также определяют время полужизни молекулы антитела в кровотоке. Эта функция Fc опосредуется связыванием Fc-области с неонатальным Fc-рецептором (FcRn), который отвечает за возвращение молекул антител из кислых лизосом в общий кровоток.
То, активный или неактивный изотип должно иметь mAb, зависит от желаемого терапевтического результата для антитела. Некоторые примеры применения изотипов и желаемого терапевтического исхода приведены ниже:
1. Если желаемым конечным результатом является функциональная нейтрализация растворимого цитокина, можно использовать неактивный изотип;
2. Если желаемым исходом является выведение патологического белка, можно использовать активный изотип;
3. Если желаемым исходом является выведение агрегатов белка, можно использовать активный изотип;
4. Если желаемым исходом является антагонизм поверхностному рецептору, используют неактивный изотип (Tysabri, IgG4; OKT3®, мутантный IgG1);
5. Если желаемым исходом является устранение клеток-мишеней, используют активный изотип (герцептин, IgG1 (и с усиленными эффекторными функциями); и
6. Если желаемым исходом является выведение белков из кровотока без проникновения в ЦНС можно использовать изотип IgM (например, выведение циркулирующих типов Ab).
Эффекторные функции Fc исходного mAb можно определять различными способами in vitro, хорошо известными в данной области.
Как рассмотрено выше, выбор изотипа, и, тем самым, эффекторных функций, может зависеть от желаемого терапевтического результата. В случаях, когда является желательной простая нейтрализация циркулирующей мишени, например, блокирование взаимодействий рецептор-лиганд, эффекторные функции могут не требоваться. В таких случаях являются желательными изотипы или мутации в Fc-области антитела, которые устраняют эффекторные функции. В других случаях, когда терапевтическим конечным результатом является устранение клеток-мишеней, например, устранение клеток опухоли, желательными являются изотипы или мутации или дефукозилирование Fc-области, которые усиливают эффекторные функции (Presta, L.G., Adv. Drug Del. Rev., 58: 640-656 (2006); Satoh et al., Expert Opin. Biol. Ther., 6: 1161-1173 (2006). Аналогично, в зависимости от терапевтической применимости, время полужизни молекулы в кровотоке может быть снижено/продлено путем модулирования взаимодействий антитело-FcRn внесением определенных мутаций в Fc-область (Dall’Acqua et al., Biol. Chem., 281: 23514-23524 (2006); Petkova et al., Int. Immunol., 18: 1759-1769 (2006); Vaccaro et al., Proc. Natl. Acad. Sci. USA, 103: 18709-18714 (2006).
Опубликованная информация о различных остатках, которые влияют на различные эффекторные функции нормального терапевтического mAb, может потребовать подтверждения для DVD-Ig. Возможно, что в формате DVD-Ig могут быть важными дополнительные (отличающиеся) остатки Fc-области, отличные от остатков, идентифицированных для модулирования эффекторных функций моноклональных антител.
В целом, решение в отношении того, какие эффекторные функции Fc (изотип) являются важными в конечном формате DVD-Ig, зависит от признаков заболевания, терапевтической мишени, желаемого терапевтического результата и соображений безопасности. Ниже приведены иллюстративные соответствующие константные области тяжелых цепей и легких цепей, включая, но не ограничиваясь ими:
- IgG1 - аллотип: G1mz
- IgGl мутант - A234, A235
- IgG2 - аллотип: G2m(n-)
- каппа - Km3; и
- лямбда
Исследования Fc-рецептора и C1q: Возможность нежелательной антителозависимой клеточно-опосредуемой цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC) вследствие образования комплекса антитела с любой сверхэкспрессированной на клеточных мембранах мишени можно устранять мутациями в шарнирной области (например, L234A, L235A). Ожидается, что эти замещенные аминокислоты, присутствующие в шарнирной области IgG1 mAb, приведут к сниженному связыванию mAb с Fc-рецепторами человека (но не FcRn), поскольку полагают, что связывание FcgR происходит в перекрывающихся областях на шарнирной области IgG1. Этот признак mAb может привести к улучшенному профилю безопасности относительно антител, содержащих IgG дикого типа. Связывание mAb с Fc-рецепторами человека можно определять в экспериментах с помощью проточной цитометрии с использованием клеточных линий (например, THP-1, K562) и сконструированной клеточной линии CHO, которая экспрессирует FcgRIIb (или другие FcgR). По сравнению с контрольными моноклональными антителами IgG1, mAb демонстрирует сниженное связывание с FcgRI и FcgRIIa, в то время как связывание FcgRIIb не изменяется. Связывание и активация C1q иммунными комплексами антиген/IgG запускает классический каскад комплемента с последующими воспалительными и/или иммунорегуляторными ответами. Было определено, что участок связывания C1q на IgG расположен в остатках шарнирной области IgG. Связывание C1q с mAb в возрастающих концентрациях оценивали с помощью ELISA для C1q. Как и ожидалось, результаты демонстрируют, что mAb неспособно связываться с C1q, при сравнении со связыванием контрольного IgG1 дикого типа. В целом, мутация L234A, L235A в шарнирной области устраняет связывание mAb с FcgRI, FcgRIIa и C1q, но не влияет на взаимодействие mAb с FcgRIIb. Эти данные указывают на то, что in vivo mAb с мутантной Fc взаимодействует нормально с ингибиторным FcgRIIb, но, вероятно, не взаимодействует с активирующими рецепторами FcgRI и FcgRIIa или C1q.
Связывание FcRn человека: неонатальный рецептор (FcRn) ответственен за транспорт IgG через плаценту и за контроль катаболического времени полужизни молекул IgG. Повышение конечного времени полужизни антитела может быть желательным для повышения эффективности, для снижения дозы или частоты введения или для усиления направления к мишени. Альтернативно, может быть преимущественным противоположное, т.е. снижение конечного времени полужизни антитела для снижения воздействия на весь организм или повышения отношения связывания мишени и не мишени. Коррекция взаимодействия между IgG и его рецептором спасения, FcRn, обеспечивает путь для повышения или снижения конечного времени полужизни IgG. Белки в кровотоке, включая IgG, захватываются в жидкую фазу путем микропиноцитоза определенными клетками, такими как эндотелий сосудов. IgG может связывать FcRn в эндосомах в слабо кислых условиях (pH 6,0-6,5) и может возвращаться на клеточную поверхность, где он высвобождается при практически нейтральных условиях (pH 7,0-7,4). Картирование участка связывания Fc-области на FcRn80, 16, 17 показало, что два остатка гистидина, которые являются консервативными среди видов, His310 и His435, ответственны за pH-зависимость этого взаимодействия. С использованием технологии фагового дисплея была идентифицирована мутация Fc-области мыши, которая усиливает связывание с FcRn и продлевает время полужизни IgG мыши (см. Ghetie et al., Nature Biotechnol., 15(7): 637-640 (1997)). Также идентифицированы мутации Fc-области, которые повышают аффинность связывания IgG человека с FcRn при pH 6,0, но не при pH 7,4 (см., Dall’Acqua et al., J. Immunol, 169(9): 5171-5180 (2002)). Более того, в одном случае также наблюдали сходное pH-зависимое повышение связывания (вплоть до 27 раз) для FcRn макака-резус, и это привело к двукратному повышению времени полужизни в сыворотке макака резус по сравнению с исходным IgG (см., Hinton et al., J. Biol. Chem., 279(8): 6213-6216 (2004)). Эти данные указывают на то, что является возможным продление времени полужизни лекарственных средств на основе антител путем коррекции взаимодействия Fc-области с FcRn. Напротив, мутации Fc-области, которые ослабляют взаимодействие с FcRn, могут снизить время полужизни антитела.
B.10. Фармакокинетика (PK)
Для получения молекулы DVD-Ig с желаемым фармакокинетическим профилем в одном из вариантов осуществления выбирают исходные mAb с фармакокинетическим профилем, сходным с желаемым. Одним из соображений является то, что иммуногенный ответ на моноклональные антитела (т.е. "HAHA", ответ против антител человека; "HACA", ответ против химерных антител) дополнительно усложняет фармакокинетику этих лекарственных средств. В одном из вариантов осуществления для конструирования молекул DVD-Ig используют моноклональные антитела с минимальной иммуногенностью или без нее, так чтобы полученные DVD-Ig также имели минимальную иммуногенность или не имели ее. Некоторые из факторов, которые определяют PK mAb, включают, но не ограничиваются ими, внутренние свойства mAb (аминокислотную последовательность VH); иммуногенность; связывание FcRn и функции Fc.
PK-профиль выбранных исходных моноклональных антител можно легко определять у грызунов, поскольку PK-профиль у грызунов хорошо коррелирует с PK-профилем моноклональных антител (или близко предсказывает его) у яванского макака и человека.
После выбора исходных моноклональных антител с желаемыми характеристиками PK (и другими желаемыми функциональными свойствами, как рассмотрено в настоящем описании), конструируют DVD-Ig. Поскольку молекулы DVD-Ig содержат два антигенсвязывающих домена из двух исходных моноклональных антител, также оценивают PK-свойства DVD-Ig. Таким образом, при определении PK-свойств DVD-Ig можно использовать анализы PK, которые определяют PK-профиль, исходя из функциональности обоих антигенсвязывающих доменов, происходящих из 2 исходных моноклональных антител. PK-профиль DVD-Ig может быть определен. Дополнительные факторы, которые могут влиять на PK-профиль DVD-Ig, включают ориентацию антигенсвязывающего домена (CDR); размер линкера; и взаимодействия Fc/FcRn. PK-характеристики исходных антител можно оценивать с помощью следующих параметров: всасывание, распределение, метаболизм и экскреция.
Всасывание: На сегодняшний день введение терапевтических моноклональных антител проводят парентеральным способом (например, внутривенным [IV], подкожным [SC] или внутримышечным [IM]). Всасывание mAb в системный кровоток после подкожного или внутримышечного введения из интерстициального пространства, главным образом, осуществляется через лимфатический путь. Насыщаемая пресистемная протеолитическая деградация может приводить к переменной абсолютной биодоступности после внесосудистого введения. Обычно повышение абсолютной биодоступности при повышении доз моноклональных антител можно наблюдать вследствие насыщенной протеолитической способности при более высоких дозах. Процесс всасывания для mAb обычно является достаточно медленным, по мере дренирования лимфатической жидкости в сосудистую систему, и длительность всасывания может составлять от нескольких часов до нескольких суток. Абсолютная биодоступность моноклональных антител после подкожного введения, как правило, находится в диапазоне от 50% до 100%. В случае, когда конструкция DVD-Ig нацелена на опосредующей транспорт структуры в гематоэнцефалическом барьере (BBB), время циркуляции в плазме может быть снижено вследствие усиленного чресклеточного транспорта гематоэнцефалического барьера (BBB) в отдел ЦНС, где DVD-Ig высвобождается для обеспечения взаимодействия через его второй антигенсвязывающий центр.
Распределение: После внутривенного введения моноклональные антитела обычно имеют двухфазный профиль концентрация-время в сыворотке (или плазме), начинающийся с фазы быстрого распределения с последующей медленной фазой выведения. Как правило, этот тип фармакокинетического профиля наилучшим образом описывается биэкспоненциальной фармакокинетической моделью. Объем распределения в центральном компартменте (Vc) для mAb обычно равен или немного превышает объем плазмы (2-3 литра). Отчетливый двухфазный паттерн профиля концентрации против времени в сыворотке (плазме) может не выявляться при других парентеральных способах введения, таких как внутримышечное или подкожное, поскольку фаза распределения кривой концентрация-время в сыворотке (плазме) маскируется длительным этапом всасывания. На биораспределение mAb могут влиять многие факторы, включая физико-химические свойства, специфический для определенной области и направленный на мишень опосредуемый рецептором захват, связывающую способность ткани и дозу mAb. Некоторые из этих факторов могут приводить к нелинейности биораспределения для mAb.
Метаболизм и экскреция: вследствие размера молекул, целые моноклональные антитела не экскретируются в мочу через почку. Главным образом, они инактивируются путем метаболизма (например, катаболизма). Для терапевтических моноклональных антител на основе IgG время полужизни, как правило, находится в диапазоне от нескольких часов или 1-2 суток до более чем 20 суток. На выведение mAb может влиять множество факторов, включая, но не ограничиваясь ими, аффинность к рецептору FcRn, иммуногенность mAb, степень гликозилирования mAb, чувствительность mAb к протеолизу и опосредуемое рецептором выведение.
B.11. Паттерн перекрестной реактивности к тканям у человека и tox-вида
Идентичный паттерн окрашивания указывает на то, что потенциальную токсичность у человека можно оценивать у tox-вида. Tox-вид представляет собой животное, у которого исследуют независимую токсичность.
Выбирают отдельные антитела, удовлетворяющие двум критериям: (1) окрашивание тканей является подходящим для известной экспрессии мишени антитела; (2) сходный паттерн окрашивания тканей из одного органа у человека и tox-вида.
Критерий 1: При иммунизации и/или отборе антител, как правило, используют рекомбинантные или синтезированные антигены (белки, углеводы или другие молекулы). Частью скрининга терапевтических антител являются связывание с природным партнером и контрскрининг против неродственных антигенов. Однако скрининг против множества антигенов часто является непрактичным. Таким образом, для исключения нежелательного связывания антитела с любыми неродственными антигенами служат исследования перекрестной реактивности к тканям на тканях человека из всех основных органов.
Критерий 2: Сравнительные исследования перекрестной реактивности к тканям на тканях человека и tox-вида (яванская макака, собака, возможно грызуны и прочие, тестируют те же 36 или 37 тканей, что и в исследованиях у человека) помогают подтвердить выбор tox-вида. В типичных исследованиях перекрестной реактивности на замороженных срезах тканей терапевтические антитела могут демонстрировать ожидаемое связывание с известным антигеном и/или меньшую степень связывания с тканями, вследствие низкого уровня взаимодействий (неспецифическое связывание, низкий уровень связывания со сходными антигенами, низкий уровень взаимодействий на основе заряда и т.д.). В любом случае наиболее подходящим для исследования токсикологии видом животных является вид с наиболее высокой степенью совпадения связывания в тканях этого животного со связыванием в тканях человека.
Исследования перекрестной реактивности к тканям проводят согласно соответствующим нормативным рекомендациям, включая EC CPMP Guideline III/5271/94 "Production and quality control of mAbs" и 1997 US FDA/CBER "Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use". Срезы замороженных тканей человека (5 мкм), полученных при аутопсии или биопсии, фиксировали и сушили на предметном стекле. Проводили окрашивание срезов тканей пероксидазой с использованием системы авидин-биотин. Руководство FDA "Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use". Соответствующие ссылки включают Clarke J (2004), Boon L. (2002a), Boon L (2002b), Ryan A (1999).
Исследования перекрестной реактивности к тканям часто проводят в две стадии, где первая стадия включает замороженные срезы 32 тканей (как правило: надпочечника, желудочно-кишечного тракта, предстательной железы, мочевого пузыря, сердца, скелетных мышц, клеток крови, почки, кожи, костного мозга, печени, спинного мозга, молочной железы, легкого, селезенки, мозжечка, лимфатического узла, яичек, коры головного мозга, яичника, тимуса, толстого кишечника, поджелудочной железы, щитовидной железы, эндотелия, паращитовидной железы, мочеточника, глаза, гипофиза, матки, яйцевода и плаценты) от одного донора-человека. На второй фазе проводят полное исследование перекрестной реактивности с вплоть до 38 тканями (включая надпочечник, кровь, кровеносный сосуд, костный мозг, мозжечок, головной мозг, шейку матки, пищевод, глаз, сердце, почку, толстый кишечник, печень, легкое, лимфатический узел, молочную железу, яичник, яйцевод, поджелудочную железу, паращитовидную железу, периферический нерв, гипофиз, плаценту, предстательную железу, слюнную железу, кожу, тонкий кишечник, спинной мозг, селезенку, желудок, поперечнополосатую мышцу, яичко, тимус, щитовидную железу, миндалевидную железу, мочеточник, мочевой пузырь и матку) от трех неродственных взрослых. Исследования, как правило, проводят минимум при двух уровнях доз.
Терапевтическое антитело (т.е. исследуемое изделие) и совпадающее по изотипу контрольное антитело можно биотинилировать для детекции комплекса авидин-биотин (ABC); другие способы детекции могут включать детекцию третичного антитела для меченного FITC (или иным образом) исследуемого изделия, или предварительное образование комплекса с меченым антителом против IgG человека для немеченого исследуемого изделия.
В кратком изложении, замороженные срезы (приблизительно 5 мкм) тканей человека, полученные при аутопсии или биопсии, фиксируют и сушат на предметном стекле. Проводят окрашивание срезов тканей пероксидазой с использованием системы авидин-биотин. Сначала (в случае системы детекции предварительного образования комплекса), исследуемое изделие инкубируют с вторичным биотинилированным антителом против IgG человека и позволяют образовываться иммунному комплексу. Иммунный комплекс при конечных концентрациях исследуемого изделия 2 и 10 мкг/мл добавляют к срезам тканей на предметном стекле, а затем подвергают реакции в течение 30 минут с набором авидин-биотин-пероксидаза. Затем для окрашивания тканей используют DAB (3,3’-диаминобензидин), субстрат пероксидазной реакции, в течение 4 минут. В качестве положительных контролей срезов тканей используют гранулы антиген-Sepharose.
Любое специфическое окрашивание определяют либо как ожидаемую (например, согласующуюся с экспрессией антигена), либо как неожиданную реактивность, исходя из известной экспрессии рассматриваемого антигена-мишени. Любое окрашивание, определенное как специфическое, оценивают в отношении интенсивности и частоты. Исследования антигенной или сывороточной конкуренции или блокирования могут далее способствовать определению того, является ли наблюдаемое окрашивание специфическим или неспецифическим.
Если определяют, что два выбранных антитела удовлетворяют критериями отбора - соответствующему окрашиванию тканей, совпадающему окрашиванию между определенными тканями человека и животного для исследования токсикологии - их можно выбирать для получения DVD-Ig.
Исследование перекрестной реактивности к тканям необходимо повторить для конечной конструкции DVD-Ig, но, несмотря на то, что эти исследования проводят согласно тому же протоколу, который описан в настоящем описании, их оценку провести сложнее, поскольку любое связывание может быть следствием любого из двух исходных антител, и любое необъяснимое связывание необходимо подтверждать в комплексных конкурентных исследованиях с антигеном.
Понятно, что комплексное проведение исследований перекрестной реактивности к тканям с полиспецифической молекулой, такой как DVD-Ig, значительно упрощается, если исходные антитела выбраны по (1) отсутствию данных о неожиданной перекрестной реактивности к тканям и (2) приемлемому сходству данных перекрестной реактивности к тканям между соответствующими тканями человека и животного, используемого для исследования токсикологии.
B.12. Специфичность и селективность
Для получения молекулы DVD-Ig с желаемой специфичностью и селективностью, необходимо получить и выбрать исходные mAb с желаемым профилем специфичности и селективности.
Исследования специфичности и селективности DVD-Ig по связыванию могут быть трудными вследствие наличия четырех или более участков связывания, по два для каждого антигена. В кратком изложении, в исследованиях связывания с использованием ELISA, BIAcore, KinExA или других исследований взаимодействия с DVD-Ig необходимо проводить мониторинг связывания одного, двух или более антигенов, с молекулой DVD-Ig. В то время как технология BIAcore может анализировать последовательное независимое связывание множества антигенов, более традиционные способы, включающие ELISA или более современные способы, такие как KinExA, не могут этого сделать. Таким образом, является важной тщательная охарактеризация каждого исходного антитела. После охарактеризации каждого отдельного антитела в отношении специфичности, подтверждение сохранения специфичности отдельных связывающих участков в молекуле DVD-Ig существенно упрощается.
Очевидно, что сложное проведение определения специфичности DVD-Ig значительно упрощается, если два исходных антитела перед объединением в DVD-Ig отбирают по специфичности.
Исследования взаимодействий антиген-антитело могут принимать множество форм, включая множество классических исследований белок-белковых взаимодействий, включая ELISA (твердофазный иммуноферментный анализ), масс-спектрометрию, химическое поперечное сшивание, SEC с рассеянием света, равновесный диализ, проницаемость в геле, ультрафильтрацию, гель-хроматографию, крупнозональную аналитическую SEC, микропрепаративное ультрацентифугирование (седиментационное равновесие), спектроскопические способы, титрационную микрокалориметрию, седиментационное равновесие (в аналитической ультрацентрифуге), скорость осаждения (в аналитической центрифуге), поверхностный плазмонный резонанс (включая BIAcore). Соответствующие ссылки включают Current Protocols in Protein Science, Volume 3, chapters 19 и 20, (Coligan et al., eds.) (John Wiley & Sons Inc.) и ссылки, включенные в нее; и Current Protocols in Immunology, (Coligan et al., eds.) (John Wiley & Sons Inc.) и соответствующие ссылки, включенные в нее.
Высвобождение цитокинов в цельной крови: Взаимодействие mAb с клетками крови человека можно исследовать в анализе высвобождения цитокинов (Wing et al., Therapeutic Immunol, 2(4): 183-190 (1995); Current Protocols in Pharmacology, (Enna et al., eds.) (John Wiley & Sons Inc.); Madhusudan et al., Clin. Cancer Res., 10(19): 6528-6534 (2004); Cox et. al., Methods, 38(4): 274-282 (2006); Choi et al., Eur. J. Immunol, 31(1): 94-106 (2001)). В кратком изложении, различные концентрации mAb инкубируют с цельной кровью в течение 24 часов. Исследуемая концентрация должна охватывать широкий диапазон, включающий конечные концентрации, имитирующие типичные уровни в крови у пациентов (включая, но не ограничиваясь ими 100 нг/мл - 100 мкг/мл). После инкубации супернатанты и клеточные лизаты анализируют в отношении присутствия IL-1Rα, TNF-α, IL-1b, IL-6 и IL-8. Профили концентраций цитокинов, полученные для mAb, сравнивают с профилями, полученными с помощью отрицательного контрольного IgG человека и положительного контрольного LPS или PHA. Профиль цитокинов, который проявляет mAb как из клеточных супернатантов, так и из клеточных лизатов, был сравним с контрольным IgG человека. В одном из вариантов осуществления моноклональные антитело не взаимодействует с клетками крови человека, не высвобождая самопроизвольно воспалительные цитокины.
Исследования высвобождения цитокинов для DVD-Ig являются сложными вследствие наличия четырех или более участков связывания, по два для каждого антигена. В кратком изложении, в исследованиях высвобождения цитокинов, как описано в настоящем описании, определяют эффект всей молекулы DVD-Ig на цельную кровь или другие клеточные системы, однако в них нельзя определить, какая часть молекулы приводит к высвобождению цитокинов. После выявления высвобождения цитокинов, необходимо убедиться в чистоте препарата DVD-Ig, поскольку некоторые из совместно очищаемых с ними клеточных компонентов могут сами по себе вызывать высвобождение цитокинов. Если дело не в чистоте, могут потребоваться фрагментация DVD-Ig (включая, но не ограничиваясь ими, удаление Fc-части, разделение участков связывания и т.д.), мутагенез участков связывания или другие способы для объяснения каких-либо наблюдений. Очевидно, что это сложное проведение значительно упрощается, если исходные антитела отбирают по отсутствию высвобождения цитокинов перед комбинированием в DVD-Ig.
B.13. Перекрестная реактивность к другим видам для токсикологических исследований.
В одном из вариантов осуществления отдельные антитела выбирают с достаточной перекрестной реактивностью с соответствующими tox-видами, например, яванского макака. Исходные антитела должны связываться с мишенью ортологичного вида (т.е. яванского макака) и вызывать соответствующий ответ (модулирование, нейтрализацию, активацию). В одном из вариантов осуществления перекрестная реактивность (аффинность/эффективность) к мишени ортологичного вида должна отличаться не более чем в 10 раз от мишени человека. На практике, исходные антитела оценивают для множества видов, включая мышь, крысу, собаку, обезьяну (и другие не являющиеся человеком приматы), а также модельных видов для заболевания (т.е. овца для модели астмы). Приемлемая перекрестная реактивность с tox-видами исходных моноклональных антител позволяет последующие токсикологические исследования DVD-Ig в тех же видах. По этой причине, два исходных моноклональных антитела должны иметь приемлемую перекрестную реактивность с основными tox-видами, таким образом, позволяя токсикологические исследования DVD-Ig в этих видах.
Исходные mAb можно выбирать из различных mAb, способных связывать конкретные мишени и хорошо известных в данной области. Они включают, но не ограничиваются ими, антитело против IL-1β, антитело против TNF (патент США №6258562), антитело против IL-12 и/или против IL-12p40 (патент США №6914128); антитело против IL-18 (публикация US №2005/0147610 A1), антитело против C5, антитело против CBL, антитело против CD147, антитело против gp120, антитело против VLA-4, антитело против CD11a, антитело против CD18, антитело против VEGF, антитело против CD40L, антитело против CD-40 (например, см. публикацию PCT № WO2007124299) антитело против Id, антитело против ICAM-1, антитело против CXCL13, антитело против CD2, антитело против EGFR, антитело против TGF-бета 2, антитело против HGF, антитело против cMet, антитело против DLL-4, антитело против NPR1, антитело против PLGF, антитело против ErbB3, антитело против E-селектина, антитело против Fact VII, антитело против Her2/neu, антитело против F gp, антитело против CD11/18, антитело против CD14, антитело против ICAM-3, антитело против RON, антитело против CD-19, антитело против CD80 (например, см. публикацию PCT WO2003/039486, антитело против CD4, антитело против CD3, антитело против CD23, антитело против бета2-интегрина, антитело против альфа4бета7, антитело против CD52, антитело против HLA DR, антитело против CD22 (например, см. патент США №5789554), антитело против CD20, антитело против MIF, антитело против CD64 (FcR), антитело против TCR-альфа-бета, антитело против CD2, антитело против Hep B, антитело против CA 125, антитело против EpCAM, антитело против gp120, антитело против CMV, антитело против gpIIbIIIa, антитело против IgE, антитело против CD25, антитело против CD33, антитело против HLA, антитело против IGF1,2, антитело против IGFR, антитело против VNR-интегрина, антитело против IL-1 альфа, антитело против IL-1 бета, антитело против рецептора IL-1, антитело против рецептора IL-2, антитело против IL-4, антитело против рецептора IL-4, антитело против IL5, антитело против рецептора IL-5, антитело против IL-6, антитело против IL-6R, RANKL, NGF, DKK, alphaVbeta3, антитело против IL-8, антитело против IL-9, антитело против IL-13, антитело против рецептора IL-13 и антитело против IL-23; IL-23p19 (см. Presta, L.G., "Selection, design, and engineering of therapeutic antibodies", J. Allergy Clin Immunol. 116:731-6 (2005) и на всемирном web-сайте http://www.path.cam.ac.uk/~mrc7/humanisation/antibodies.html).
Исходные mAb также можно выбирать из различных терапевтических антител, одобренных для применения в клинических испытаниях, или в разработке для клинического применения. Такие терапевтические антитела включают, но не ограничиваются ими, ритуксимаб (Rituxan®, IDEC/Genentech/Roche) (см. например патент США №5736137), химерное антитело против CD20, одобренное для лечения неходжскинской лимфомы; HuMax-CD20, антитело против CD20, в настоящее время выпускаемое Genmab, антитело против CD20, описанное в патенте США №5500362, AME-133 (Applied Molecular Evolution), hA20 (Immunomedics, Inc.), HumaLYM (Intracel) и PRO70769 (публикация PCT № WO 2004/056312 (PCT/US2003/040426) под названием "Immunoglobulin Variants and Uses Thereof), трастузумаб (Herceptin®, Genentech) (см. например патент США №5677171), гуманизированное антитело против Her2/neu, одобренное для лечения рака молочной железы; пертузумаб (rhuMab-2C4, Omnitarg®), в настоящее время выпускаемое Genentech; антитело против Her2, описанное в патенте США №4753894; цетуксимаб (Erbitux®, Imclone) (патент США №4943533; публикация PCT № WO 96/40210), химерное антитело против EGFR, проходящее клинические испытания против различных злокачественных опухолей; ABX-EGF (патент США №6235883), в настоящее время выпускаемый Abgenix-Immunex-Amgen; HuMax-EGFr (US с серийным номером №10/172317, опубликованная в качестве US 2003/0091561, в настоящее время патент США №7247301), в настоящее время выпускаемый Genmab; 425, EMD55900, EMD62000 и EMD72000 (Merck KGaA) (патент США №5558864; Murthy et al., Arch. Biochem. Biophys., 252(2): 773-783 (1991)); ICR62 (Institute of Cancer Research), публикация PCT № WO 95/20045; 549-560 (1987); Rodeck et al., J. Cell Biochem., 35(4):315-320 (1987); Kettleborough et al., Protein Eng., 4(7): Modjtahedi et al., J. Cell Biophys., 22(1-3): 129-146 (1993); Modjtahedi et al., Br. J. Cancer, 67(2):247-253 (1993); Modjtahedi et al., Br. J. Cancer, 73(2):228-235 (1996); Modjtahedi et al., Int. J. Cancer, 105(2):273-280 (2003)); TheraCIM hR3 (YM Biosciences, Canada and Centra de Immunologia Molecular, Cuba (патент США №5891996; патент США №6506883; Mateo et al., Immunotechnology, 3(1):71-81(1997)); mAb-806 (Ludwig Institute for Cancer Research, Memorial Sloan-Kettering) (Jungbluth et al., Proc. Natl. Acad. Sci. USA., 100(2): 639-644 (2003)); KSB-102 (KS Biomedix); MRl-1 (IV AX, National Cancer Institute) (публикация PCT № WO 01/62931); и SC100 (Scancell) (публикация PCT № WO 01/88138); алемтузумаб (Campath®, Millenium), гуманизированное mAb, в настоящее время одобренное для лечения B-клеточного хронического лимфоцитарного лейкоза; муромонаб-CD3 антитело против CD3, выпускаемое Ortho Biotech/Johnson & Johnson, ибритутомаб тиуксетан (Zevalin®), антитело против CD20, выпускаемое IDEC/Schering AG, гемтузумаб озагомицин (Mylotarg®), антитело против CD33 (белок p67), выпускаемое Celltech/Wyeth, алефацепт (Amevive®), слитую молекулу Fc против LFA-3, выпускаемую Biogen), абциксимаб (ReoPro®), выпускаемый Centocor/Lilly, базиликсимаб (Simulect®), выпускаемый Novartis, паливизумаб (Synagis®), выпускаемый Medimmune, инфликсимаб (Remicade®), антитело против TNF-альфа, выпускаемое Centocor, адалимумаб (Humira®), антитело против TNF-альфа, выпускаемое Abbott, Humicade®, антитело против TNF-альфа, выпускаемое Celltech, голимумаб (CNTO-148), полностью человеческое антитело против TNF, разработанное Centocor, этанерцепт (Enbrel®), слитую молекулу Fc и рецептора p75 TNF, выпускаемую Immunex/Amgen, ленерцепт, ленерцепт, слитую молекулу рецептора p55TNF и Fc, ранее выпускаемую Roche, ABX-CBL, антитело против CD147, выпускаемое Abgenix, ABX-IL8, антитело против IL8, выпускаемое Abgenix, ABX-MA1, антитело против MUC18, выпускаемое Abgenix, пемтумомаб (R1549, 90Y-muHMFG1), антитело против MUC1, выпускаемое Antisoma, Therex (R1550), антитело против MUC1, выпускаемое Antisoma, AngioMab (AS 1405), выпускаемое Antisoma, HuBC-1, выпускаемое Antisoma, Thioplatin (AS 1407) выпускаемое Antisoma, Antegren® (натализумаб), антитело против альфа-4-бета-1 (VLA-4) и против альфа-4-бета-7, выпускаемое Biogen, VLA-1 mAb, антитело против интегрина VLA-1, выпускаемое Biogen, mAb LTBR, антитело против рецептора лимфотоксина-бета (LTBR), выпускаемое Biogen, CAT-152, антитело против TGF-β2, выпускаемое Cambridge Antibody Technology, ABT 874 (J695), антитело против IL-12 p40, выпускаемое Abbott Laboratories, CAT-192, антитело против TGFβ1, выпускаемое Cambridge Antibody Technology и Genzyme, CAT-213, антитело против эотаксина 1, выпускаемое Cambridge Antibody Technology, LymphoStat-B®, антитело против Blys, выпускаемое Cambridge Antibody Technology и Human Genome Sciences Inc., TRAIL-R1mAb, антитело против TRAIL-R1, выпускаемое Cambridge Antibody Technology и Human Genome Sciences, Inc., Avastine® (бевацизумаб, rhuMAb-VEGF), антитело против VEGF, выпускаемое Genentech, антитело против семейства рецепторов HER, выпускаемое Genentech, Anti-Tissue Factor (ATF), антитело против тканевого фактора, выпускаемое Genentech, Xolair® (омализумаб), антитело против IgE, выпускаемое Genentech, Raptiva® (эфализумаб), антитело против CD11a, выпускаемое Genentech и Xoma, антитело MLN-02 (ранее LDP-02), выпускаемое Genentech и Millenium Pharmaceuticals, HuMax CD4, антитело против CD4, выпускаемое Genmab, HuMax-IL 15, антитело против IL15, выпускаемое Genmab и Amgen, HuMax-Inflam, выпускаемое Genmab и Medarex, HuMax-Cancer, антитело против гепараназы I, выпускаемое Genmab и Medarex и Oxford GcoSciences, HuMax-Limphoma, выпускаемое Genmab и Amgen, HuMax-TAC, выпускаемее Genmab, IDEC-131, и антитело против CD40L, выпускаемое IDEC Pharmaceuticals, IDEC-151 (кленоликсимаб), антитело против CD4, выпускаемое IDEC Pharmaceuticals, IDEC-114, антитело против CD80, выпускаемое IDEC Pharmaceuticals, IDEC-152, антитело против CD23, выпускаемое IDEC Pharmaceuticals, антитела против фактора миграции макрофагов (MIF), выпускаемые IDEC Pharmaceuticals, BEC2, антиидиотипическое антитело, выпускаемое ImClone, IMC-1C11, антитело против KDR, выпускаемое ImClone, DC101, антитело против flk-1, выпускаемое ImClone, антитела против VE-кадгерина, выпускаемые ImClone, CEA-Cide® (лабетузумаб), антитело против канцероэмбрионального антигена (CEA), выпускаемое Immunomedics, LymphoCide® (эпратузумаб), антитело против CD22, выпускаемое Immunomedics, AFP-Cide, выпускаемое Immunomedics, MyelomaCide, выпускаемое Immunomedics, LkoCide, выпускаемое Immunomedics, ProstaCide, выпускаемое Immunomedics, MDX-010, антитело против CTLA4, выпускаемое Medarex, MDX-060, антитело против CD30, выпускаемое Medarex, MDX-070 выпускаемое Medarex, MDX-018, выпускаемое Medarex, Osidem® (IDM-1) и антитело против Her2, выпускаемое Medarex и Immuno-Designed Molecules, HuMax®-CD4, антитело против CD4, выпускаемое Medarex и Genmab, HuMax-IL15, антитело против IL15, выпускаемое Medarex и Genmab, CNTO 148, антитело против TNFα, выпускаемое Medarex и Centocor/J&J, CNTO 1275, антитело против цитокинов, выпускаемое Centocor/J&J, MOR101 и MOR102, антитела против молекулы внутриклеточной адгезии 1 (ICAM-1) (CD54), выпускаемые MorphoSys, MOR201, антитело против рецептора фибробластного фактора роста 3 (FGFR-3), выпускаемое MorphoSys, Nuvion® (висилизумаб), антитело против CD3, выпускаемое Protein Design Labs, HuZAF®, антитело против интерферона-гамма, выпускаемое Protein Design Labs, антитело против интегрина α5β, выпускаемое Protein Design Labs, антитело против IL-12, выпускаемое Protein Design Labs, ING-1, антитело против Ep-CAM, выпускаемое Xoma, Xolair® (омализумаб), гуманизированное антитело против IgE, выпускаемое Genentech и Novartis, и MLNO1, антитело против интегрина-бета2, выпускаемое Xoma. В другом варианте осуществления лекарственное средство включает KRN330 (Kirin); антитело huA33 (A33, Ludwig Institute for Cancer Research); CNTO 95 (альфа-V интегрины, Centocor); MEDI-522 (альфа-Vβ3 интегрин, Medimmune); волоциксимаб (интегрин альфа-Vβ1, Biogen/PDL); mAb 216 человека (гликозилированный эпитоп B-клеток, NCI); BiTE MT103 (биспецифическое CD19 x CD3, Medimmune); 4G7xH22 (биспецифическое B-клетки x Fc-гамма-RI, Medarex/Merck KGa); rM28 (биспецифическое CD28 x MAPG, патент Европы № EP 1444268); MDX447 (EMD 82633) (биспецифическое CD64 x EGFR, Medarex); катумаксомаб (ремоваб) (биспецифическое EpCAM x CD3, Trion/Fres); эртумаксомаб (биспецифическое HER2/CD3, Fresenius Biotech); ореговомаб (OvaRex) (CA-125, ViRexx); Rencarex® (WX G250) (карбоангидраза IX, Wilex); CNTO 888 (CCL2, Centocor); TRC105 (CD105 (эндоглин), Tracon); BMS-663513 (агонист CD137, Brystol Myers Squibb); MDX-1342 (CD19, Medarex); сиплизумаб (MEDI-507) (CD2, Medimmune); офатумумаб (Humax-CD20) (CD20, Genmab); ритуксимаб (ритуксан) (CD20, Genentech); велтузумаб (hA20) (CD20, Immunomedics); эпратузумаб (CD22, Amgen); люмиликсимаб (IDEC 152) (CD23, Biogen); муромонаб-CD3 (CD3, Ortho); HuM291 (CD3 fc-рецептор, PDL Biopharma); HeFi-1 (CD30, NCI); MDX-060 (CD30, Medarex); MDX-1401 (CD30, Medarex); SGN-30 (CD30, Seattle Genentics); SGN-33 (линтузумаб) (CD33, Seattle Genentics); занолимумаб (HuMax-CD4) (CD4, Genmab); HCD122 (CD40, Novartis); SGN-40 (CD40, Seattle Genentics); Campath 1h (алемтузумаб) (CD52, Genzyme); MDX-1411 (CD70, Medarex); hLL1 (EPB-1) (CD74.38, Immunomedics); галиксимаб (IDEC-144) (CD80, Biogen); MT293 (TRC093/D93) (расщепленный коллаген, Tracon); HuLuc63 (CS1, PDL Pharma); ипилимумаб (MDX-010) (CTLA4, Brystol Myers Squibb); тремелимумаб (тицилимумаб, CP-675.2) (CTLA4, Pfizer); HGS-ETR1 (мапатумумаб) (агонист DR4 TRAIL-R1, Human Genome Science/Glaxo Smith Kline); AMG-655 (DR5, Amgen); апомаб (DR5, Genentech); CS-1008 (DR5, Daiichi Sankyo); HGS-ETR2 (лексатумумаб) (агонист DR5 TRAIL-R2, HGS); цетуксимаб (эрбитукс) (EGFR, ImClone); IMC-11F8, (EGFR, ImClone); нимотузумаб (EGFR, YM Bio); панитумумаб (Vectabix) (EGFR, Amgen); залутумумаб (HuMaxEGFr) (EGFR, Genmab); CDX-110 (EGFRvIII, AVANT Immunotherapeutics); адекатумумаб (MT201) (Epcam, Merck); эдреколомаб (Panorex, 17-1A) (Epcam, Glaxo/Centocor); MORAb-003 (фолатный рецептор a, Morphotech); KW-2871 (ганглиозид GD3, Kyowa); MORAb-009 (GP-9, Morphotech); CDX-1307 (MDX-1307) (hCGb, Celldex); трастузумаб (герцептин) (HER2, Celldex); пертузумаб (rhuMAb 2C4) (HER2 (DI), Genentech); аполизумаб (бета-цепь HLA-DR, PDL Pharma); AMG-479 (IGF-IR, Amgen); антитело против IGF-1R R1507 (IGF1-R, Roche); CP 751871 (IGF1-R, Pfizer); IMC-A12 (IGF1-R, ImClone); BIIB022 (IGF-1R, Biogen); Mik-beta-1 (IL-2Rb (CD122), Hoffman LaRoche); CNTO 328 (IL6, Centocor); антитело против KIR (1-7F9) (Ig-подобный рецептор киллерных клеток (KIR), Novo); Hu3S193 (Lewis (y), Wyeth, Ludwig Institute of Cancer Research); hCBE-11 (LTBR, Biogen); HuHMFG1 (MUC1, Antisoma/NCI); RAV12 (N-связанный углеводный эпитоп, Raven); CAL (паратиреоидный гормон-связанный белок (PTH-rP), University of California); CT-011 (PD1, CureTech); MDX-1106 (ono-4538) (PD1, Medarex/Ono); MAb CT-011 (PD1, Curetech); IMC-3G3 (PDGFRa, ImClone); бавитуксимаб (фосфатидилсерин, Peregrine); huJ591 (PSMA, Cornell Research Foundation); muJ591 (PSMA, Cornell Research Foundation); GC 1008 (TGFb (общий) ингибитор (IgG4), Genzyme); инфликсимаб (ремикейд) (TNFa, Centocor); A27.15 (рецептор трансферрина, Salk Institute, INSERM, публикация PCT № WO 2005/111082); E2.3 (рецептор трансферрина, Salk Institute); бевацизумаб (авастин) (VEGF, Genentech); HuMV833 (VEGF, Tsukuba Research Lab, публикация PCT WO/2000/034337, University of Texas); IMC-18F1 (VEGFR1, ImClone); IMC-1121 (VEGFR2, ImClone).
C. Конструирование связывающих белков DVD-IgTM
Поливалентный полиспецифический связывающий белок иммуноглобулина с двойным вариабельным доменом (DVD-IgTM) конструируют так, чтобы два различных вариабельных домена легкой цепи (VL) из двух различных исходных моноклональных антител были тандемно связаны способами рекомбинантных ДНК прямо или через короткий линкер, за которыми следует константный домен легкой цепи. Аналогично, тяжелая цепь содержит два различных вариабельных домена тяжелой цепи (VH), связанных тандемно, за которыми следует константный домен CH1 и Fc-область.
Вариабельные домены можно получать с использованием способов рекомбинантных ДНК из исходного антитела, полученного любым из способов, описанных в настоящем описании. В одном из вариантов осуществления вариабельный домен представляет собой вариабельный домен тяжелой или легкой цепи мыши. В другом варианте осуществления вариабельный домен представляет собой вариабельный домен тяжелой или легкой цепи с пересаженными CDR или гуманизированный вариабельный домен тяжелой или легкой цепей. В одном из вариантов осуществления вариабельный домен представляет собой вариабельный домен тяжелой или легкой цепей человека.
В одном из вариантов осуществления первый и второй вариабельные домены связаны друг с другом прямо с использованием способов рекомбинантных ДНК. В другом варианте осуществления вариабельные домены связаны через линкерную последовательность. В одном из вариантов осуществления связаны два вариабельных домена. Также могут быть связаны три или более вариабельных доменов прямо или через линкер. Вариабельные домены могут связывать один антиген или они могут связывать различные антигены. Молекулы DVD-Ig по изобретению могут включать один вариабельный домен иммуноглобулина и один домен, не являющийся вариабельным доменом иммуноглобулина, такой как связывающий лиганд домен рецептора, активный домен фермента. Также молекулы DVD-Ig могут содержать два или более не-Ig-доменов.
Линкерная последовательность может представлять собой одну аминокислоту или линкерный полипептид, содержащий два или более аминокислотных остатков, соединенных пептидными связями. В одном из вариантов осуществления линкерная последовательность выбрана из группы, состоящей из GGGGSG (SEQ ID NO: 26), GGSGG (SEQ ID NO: 27), GGGGSGGGGS (SEQ ID NO: 28), GGSGGGGSG (SEQ ID NO: 223), GGSGGGGSGS (SEQ ID NO: 29), GGSGGGGSGGGGS (SEQ ID NO: 30), GGGGSGGGGSGGGG (SEQ ID NO: 31), GGGGSGGGGSGGGGS (SEQ ID NO: 32), ASTKGP (SEQ ID NO: 33), ASTKGPSVFPLAP (SEQ ID NO: 34), TVAAP (SEQ ID NO: 35), RTVAAP (SEQ ID NO: 224), TVAAPSVFIFPP (SEQ ID NO: 36), RTVAAPSVFIFPP (SEQ ID NO: 225), AKTTPKLEEGEFSEAR (SEQ ID NO: 37), AKTTPKLEEGEFSEARV (SEQ ID NO: 38), AKTTPKLGG (SEQ ID NO: 39), SAKTTPKLGG (SEQ ID NO: 40), SAKTTP (SEQ ID NO: 41), RADAAP (SEQ ID NO: 42), RADAAPTVS (SEQ ID NO: 43), RADAAAAGGPGS (SEQ ID NO: 44), RADAAAAGGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 45), SAKTTPKLEEGEFSEARV (SEQ ID NO: 46), ADAAP (SEQ ID NO: 47), ADAAPTVSIFPP (SEQ ID NO: 48), QPKAAP (SEQ ID NO: 49), QPKAAPSVTLFPP (SEQ ID NO: 50), AKTTPP (SEQ ID NO: 51), AKTTPPSVTPLAP (SEQ ID NO: 52), AKTTAP (SEQ ID NO: 53), AKTTAPSVYPLAP (SEQ ID NO: 54), GENKVEYAPALMALS (SEQ ID NO: 55), GPAKELTPLKEAKVS (SEQ ID NO: 56) и GHEAAAVMQVQYPAS (SEQ ID NO: 57). Выбор линкерных последовательностей основан на кристаллической структуре нескольких молекул Fab. В структуре молекулы Fab или антитела существует природная гибкая связь между вариабельным доменом и константным доменом CH1/CL. Эта природная связь содержит приблизительно 10-12 аминокислотных остатков, среди которых 4-6 остатков с C-конца V-домена и 4-6 остатков с N-конца CL/CH1-домена. DVD-Ig, описанные в настоящем описании, можно получать с использованием N-концевых 5-6 аминокислотных остатков, или 11-12 аминокислотных остатков, CL или CH1, в качестве линкера в легкой цепи и тяжелой цепи DVD-Ig, соответственно. N-концевые остатки CL- или CH1-доменов, в частности, первые 5-6 аминокислотных остатков, принимают конформацию петли без выраженных вторичных структур, и, таким образом, они могут действовать в качестве гибких линкеров между двумя вариабельными доменами. N-концевые остатки CL- или CH1-доменов являются естественным продолжением вариабельных доменов, поскольку они являются частью последовательностей Ig, и таким образом, в большой степени минимизируют какую-либо иммуногенность, потенциально возникающую вследствие линкеров и точек соединения.
Другие линкерные последовательности могут включать любую последовательность CL/CH1-домена любой длины, но не все остатки CL/CH1-домена, например, первые 5-12 аминокислотных остатков CL/CH1-доменов; линкеры легких цепей могут быть из Cκ или Cλ; и линкеры тяжелых цепей могут быть из CH1 любых изотипов, включая Cγ1, Cγ2, Cγ3, Cγ4, Cα1, Cγ2, Cδ, Cε и Cμ. Линкерные последовательности также могут быть из других белков, таких как Ig-подобные белки, (например, TCR, FcR, KIR); последовательности на основе G/S; последовательности из шарнирной области; и другие природные последовательности из других белков.
В одном из вариантов осуществления константный домен связан с двумя связанными вариабельными доменами с использованием способов рекомбинантных ДНК. В одном из вариантов осуществления последовательность, содержащая тандемно связанные вариабельные домены тяжелой цепи, связана с константным доменом тяжелой цепи, и последовательность, содержащая тандемно связанные вариабельные домены легкой цепи, связана с константным доменом легкой цепи. В одном из вариантов осуществления константные домены представляют собой константный домен тяжелой цепи человека и константный домен легкой цепи человека, соответственно. В одном из вариантов осуществления тяжелая цепь с DVD далее связана с Fc-областью. Fc-область может представлять собой Fc-область с нативной последовательностью или вариант Fc-области. В другом варианте осуществления Fc-область представляет собой Fc-область человека. В другом варианте осуществления Fc-область включает Fc-область из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE или IgD.
В наиболее предпочтительном варианте осуществления два полипептида тяжелой цепи с DVD и два полипептида легкой цепи с DVD комбинируют с образованием молекулы DVD-Ig. Подробное описание конкретных молекул DVD-Ig, способных связывать конкретные антигены-мишени, такие как IL-1β, и способы их получения, представлены в разделе "Примеры" ниже.
D. Получение связывающих белков DVD-Ig
Связывающие белки DVD-Ig по настоящему изобретению можно получать любым из ряда способов, известных в данной области, включая, например, экспрессию из клеток-хозяев, где экспрессирующий вектор(ы), кодирующий тяжелую цепь с DVD-Ig и легкую цепь с DVD-Ig, трансфицируют в клетку-хозяина стандартными способами. Различные формы термина "трансфекция" охватывают широкое множество способов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, осаждение фосфатом кальция, трансфекцию DEAE-декстраном и т.п. Хотя возможно экспрессировать белки DVD-Ig по изобретению как в прокариотических, так и в эукариотических клетках-хозяевах, белки DVD-Ig экспрессируют в эукариотических клетках, например, клетках-хозяевах млекопитающих, поскольку в таких эукариотических клетках (и, в частности, клетках млекопитающих) с большей вероятностью, чем в прокариотических клетках, будут собираться и секретироваться надлежащим образом свернутый и иммунологически активный белок DVD-Ig.
Иллюстративные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по изобретению включают клетки яичника китайского хомяка (клетки CHO) (включая клетки dhfr- CHO, описанные в Urlaub and Chasin, Proc. Natl Acad. Sci. USA, 77: 4216-4220 (1980), используемые с селективным маркером DHFR, например, как описано в Kaufman and Sharp, J. Mol. Biol., 159: 601-621 (1982)), клетки миеломы NS0, клетки COS, клетки SP2 и PER.C6. Когда рекомбинантные экспрессирующие векторы, кодирующие белки DVD-Ig, вводят в клетки-хозяева млекопитающих, белки DVD-Ig продуцируют культивированием клеток-хозяев в течение периода времени, достаточного для обеспечения экспрессии белков DVD-Ig в клетках-хозяевах и секреции белков DVD в культуральную среду, в которой клетки-хозяева выращивают. Белки DVD-Ig можно выделять из культуральной среды с использованием стандартных способов очистки белков.
В иллюстративной системе для рекомбинантной экспрессии белков DVD-Ig по изобретению рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь DVD-Ig, так и легкую цепь DVD-Ig, вводят в клетки dhfr- CHO опосредуемой фосфатом кальция трансфекцией. В рекомбинантном экспрессирующем векторе каждый из генов тяжелой и легкой цепей DVD-Ig функционально связывают с регуляторными элементами, энхансером CMV/промотором AdMLP, для запуска высоких уровней транскрипции генов. Рекомбинантный экспрессирующий вектор также содержит ген DHFR, который позволяет селекцию клеток CHO, трансфицированных вектором, с использованием селекции/амплификации с метотрексатом. Выбранные трансформированные клетки-хозяева культивируют для обеспечения экспрессии тяжелой и легкой цепей DVD-Ig и из культуральной среды выделяют целый белок DVD-Ig. Для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, селекции трансформантов, культивирования клеток-хозяев и выделения белка DVD-Ig из культуральной среды используют стандартные способы молекулярной биологии. Кроме того, изобретение относится к способу синтеза белка DVD-Ig по изобретению культивированием клетки-хозяина по изобретению в пригодной культуральной среде, до тех пор, пока не синтезируется белок DVD-Ig по изобретению. Кроме того, способ может включать выделение белка DVD из культуральной среды.
Важным признаком DVD-Ig является то, что его можно получать и очищать аналогично общепринятому антителу. Продукция DVD-Ig приводит к гомогенному единственному основному продукту с желаемой двойной специфической активностью, без какой-либо модификации последовательности константной области или химической модификации какого-либо типа. Другие ранее описанные способы получения "биспецифическых", "полиспецифических" и "полиспецифических поливалентных" полноразмерных связывающих белков не приводят к одному первичному продукту, а вместо этого приводят к внутриклеточной продукции или продукции с секрецией смеси собранных неактивных, моноспецифических, полиспефицических, поливалентных, полноразмерных связывающих белков и поливалентных полноразмерных связывающих белков с комбинацией различных участков связывания. В качестве примера, на основе схемы, описанной Miller и Presta (публикация PCT WO2001/077342), существует 16 возможных комбинаций тяжелых и легких цепей. Следовательно, только 6,25% белка, вероятно, имеет желаемую активную форму, но он не является единственным основным продуктом или единственным преимущественным продуктом по сравнению с другими 15 возможными комбинациями. Отделение желательных полностью активных форм белка от неактивных и частично активных форм белка с использованием стандартных способов хроматографии, обычно используемых при крупномасштабном производстве, еще не продемонстрировано.
Удивительно, что конструирование "поливалентных полноразмерных связывающих белков с двойной специфичностью" по настоящему изобретению приводит к легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом, которые собираются, главным образом, в желаемые "поливалентные полноразмерные связывающие белки с двойной специфичностью".
По меньшей мере 50%, по меньшей мере 75% и по меньшей мере 90% собранных и экспрессированных молекул DVD-Ig представляют собой желаемый четырехвалентный белок с двойной специфичностью. Этот аспект изобретения, в частности, повышает коммерческую применимость изобретения. Таким образом, настоящее изобретение включает способ экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в одной клетке, приводящей к единственному преимущественному продукту, представляющему собой "четырехвалентный полноразмерный связывающий белок с двойной специфичностью".
Настоящее изобретение относится к способам экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в одной клетке, приводящей к "преобладающему продукту", представляющему собой "четырехвалентный полноразмерный связывающий белок с двойной специфичностью", где "преобладающий продукт" составляет более 50% всего собранного белка и содержит легкую цепь с двойным вариабельным доменом и тяжелую цепь с двойным вариабельным доменом.
Настоящее изобретение относится к способам экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в одной клетке, приводящей к одному "преобладающему продукту", представляющему собой "четырехвалентный полноразмерный связывающий белок с двойной специфичностью", где "преобладающий продукт" составляет более 75% всего собранного белка и содержит легкую цепь с двойным вариабельным доменом и тяжелую цепь с двойным вариабельным доменом.
Настоящее изобретение относится к способам экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в одной клетке, приводящей к одному "преобладающему продукту", представляющему собой "четырехвалентный полноразмерный связывающий белок с двойной специфичностью", где "преобладающий продукт" составляет более чем 90% всего собранного белка и содержит легкую цепь с двойным вариабельным доменом и тяжелую цепь с двойным вариабельным доменом.
6. Получение связывающих IL-1β белков и продуцирующих связывающий белок клеточных линий
Предпочтительно, связывающие IL-1β белки, включая антитела против IL-1β, по настоящему изобретению, проявляют высокую способность снижать или нейтрализовать активность IL-1β, например, при оценке любым из нескольких анализов in vitro и in vivo, известных в данной области. Предпочтительно, связывающие IL-1β белки по настоящему изобретению также проявляют высокую способность снижать или нейтрализовать активность IL-1β.
В предпочтительных вариантах осуществления связывающий белок или его антигенсвязывающая часть связывает IL-1β человека, где связывающий белок или его антигенсвязывающая часть диссоциируют от IL-1β человека с константой скорости koff приблизительно 0,1 с-1 или менее, при определении поверхностным плазмонным резонансом, или он ингибирует активность IL-1β человека с IC50 приблизительно 1×10-6 M или менее. Альтернативно связывающий белок или его антигенсвязывающая часть может диссоциировать от IL-1β человека с константой скорости koff приблизительно 1×10-2с-1 или менее, при определении поверхностным плазмонным резонансом, или может ингибировать активность IL-1β человека с IC50 приблизительно 1×10-7 M или менее. Альтернативно связывающий белок или его антигенсвязывающая часть, могут диссоциировать от IL-1β человека с константой скорости koff приблизительно 1×10-3 с-1 или менее, при определении поверхностным плазмонным резонансом, или может ингибировать IL-1β человека с IC50 приблизительно 1×10-8 M или менее. Альтернативно связывающий белок или его антигенсвязывающая часть может диссоциировать от IL-1β человека с константой скорости koff приблизительно 1×10-4 с-1 или менее, при определении поверхностным плазмонным резонансом, или может ингибировать активность IL-1β человека с IC50 приблизительно 1×10-9 M или менее. Альтернативно связывающий белок или его антигенсвязывающая часть может диссоциировать от IL-1β человека с константой скорости koff приблизительно 1×10-5 с-1 или менее, при определении поверхностным плазмонным резонансом, или может ингибировать активность IL-1β человека с IC50 приблизительно 1×10-10 M или менее. Альтернативно связывающий белок или его антигенсвязывающая часть могут диссоциировать от IL-1β человека с константой скорости koff приблизительно 1×10-5 с-1 или менее при определении поверхностным плазмонным резонансом, или может ингибировать активность IL-1β человека с IC50 приблизительно 1×10-11 M или менее.
В определенных вариантах осуществления связывающий белок содержит константную область тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Предпочтительно, константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG4. Более того, антитело может содержать константную область легкой цепи, либо константную область легкой цепи каппа, либо константную область легкой цепи лямбда. Предпочтительно, антитело содержит константную область легкой цепи каппа. Альтернативно часть антитела может представлять собой, например, Fab-фрагмент или одноцепочечный Fv-фрагмент.
Замена аминокислотных остатков в Fc-участке для изменения эффекторной функции антитела известна в данной области (Winter, et al. патенты США №5648260 и 5624821). Fc-участок антитела опосредует несколько важных эффекторных функций, например, индукцию цитокинов, ADCC, фагоцитоз, комплементзависимую цитотоксичность (CDC) и время полужизни/скорость выведения антитела и комплексов антиген-антитело. В некоторых случаях, эти эффекторные функции являются желательными для терапевтического антитела, но в других случаях они могут быть необязательными или нежелательными, в зависимости от терапевтических целей. Определенные изотипы IgG человека, в частности IgG1 и IgG3, опосредуют ADCC и CDC через связывание с FcγR и компонентом комплемента C1q, соответственно. Неонатальные Fc-рецепторы (FcRn) являются основными компонентами, определяющими время полужизни антител в кровотоке. В другом варианте осуществления в константной области антитела, например, Fc-области антитела, заменен по меньшей мере один аминокислотный остаток, для изменения эффекторных функций.
Один из вариантов осуществления относится к меченому связывающему белку, где антитело или часть антитела по изобретению преобразованы в производное или связаны с другой функциональной молекулой (например, другим пептидом или белком). Например, меченый связывающий белок по изобретению может быть получен функциональным связыванием антитела или части антитела по изобретению (путем химического связывания, генетического слияния, нековалентной ассоциации или иным образом) с одной или несколькими другими молекулярными группами, такими как другое антитело (например, биспецифическое антитело или диантитело), поддающийся детекции агент, цитотоксический агенто, фармацевтическое средство и/или белок или пептид, который может опосредовать связывание связывающего белка с другой молекулой (такой как центральная область стрептавидина или полигистидиновая метка).
Пригодные поддающиеся детекции агенты, посредством которых может быть преобразован связывающий белок, такой как антитело или антигенсвязывающая часть, по изобретению, включают флуоресцентные соединения. Иллюстративные флуоресцентные поддающиеся детекции агенты включают флуоресцеин, флуоресцеинизотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Также антитело может быть преобразовано в производное с поддающимися детекции ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. Когда антитело преобразован в производное с поддающимся детекции ферментом, его детекцию проводят добавлением дополнительных реагентов, которые фермент использует для образования поддающегося детекции продукта реакции. Например, когда имеется поддающийся детекции агент пероксидаза хрена, добавление пероксида водорода и диаминобензидина приводит к окрашенному продукту реакции, который является поддающимся детекции. Также антитело может быть преобразовано в производное с биотином, и подвергнуто детекции посредством непрямого измерения связывания авидина или стрептавидина.
Другой вариант осуществления изобретения относится к кристаллизованному связывающему белку. Предпочтительно, изобретение относится к кристаллам целых антител против IL-1β и их фрагментов, как описано в настоящем описании, и к составам и композициям, содержащим такие кристаллы. В одном из вариантов осуществления кристаллизованный связывающий белок имеет время полужизни in vivo, превышающее время полужизни in vivo растворимого аналога связывающего белка. В другом варианте осуществления связывающий белок сохраняет биологическую активность после кристаллизации.
Кристаллизованный связывающий белок по изобретению можно получать способами, известными в данной области, и как описано в публикации PCT № WO 02/072636, включенной в настоящее описание в качестве ссылки.
Другой вариант осуществления изобретения относится к гликозилированному связывающему белку, где антитело или его антигенсвязывающая часть содержит один или несколько углеводных остатков. Образующийся in vivo белковый продукт может подвергаться дальнейшему процессингу, известному как посттрансляционная модификация. В частности, могут быть ферментативно добавлены остатки сахара (гликозильные остатки), посредством процесса, известного как гликозилирование. Образованные белки, имеющие ковалентно связанные с ними олигосахаридные боковые цепи, известны как гликозилированные белки или гликопротеины.
Встречающиеся в природе антитела представляют собой гликопротеины с одним или несколькими углеводными остатками в Fc-домене, а также в вариабельном домене. Углеводные остатки в Fc-домене имеют важный эффект на эффекторную функцию Fc-домена, и минимальный эффект на связывание антигена или время полужизни антитела (Jefferis, R., Biotechnol. Prog. 21: 11-16 (2005)). В противоположность этому, гликозилирование вариабельного домена может оказывать эффект на активность связывания антигена антителом. Гликозилирование в вариабельном домене может оказывать отрицательный эффект на аффинность связывания антитела, вероятно вследствие пространственного препятствия (Co et al., Mol. Immunol. 30: 1361-1367 (1993)), или приводить к повышенной аффинности к антигену (Wallick et al., Exp. Med. 168: 1099-1109 (1988); Wright et al., EMBO J. 10: 2717-2723 (1991)).
Один из аспектов настоящего изобретения относится к получению мутантов по участку гликозилирования, в которых участок O- или N-связанного гликозилирования связывающего белка подвергнут мутации. Специалист в данной области может получить такие мутанты с использованием стандартных хорошо известных способов. Создание мутантов по участкам гликозилирования, которые сохраняют биологическую активность, но обладают повышенной или сниженной активностью связывания, является другой задачей настоящего изобретения.
В другом варианте осуществления гликозилирование антитела или его антигенсвязывающей части является модифицированным. Например, можно получать агликозилированное антитело (т.е. антитело, лишенное гликозилирования). Гликозилирование можно изменять, например, для повышения аффинности антитела к антигену. Такие модификации углеводов можно проводить, например, посредством изменения одного или нескольких участков гликозилирования в последовательности антитела. Например, можно вносить одну или несколько аминокислотных замен, которые приводят к устранению одного или нескольких участков гликозилирования вариабельной области, устраняя тем самым гликозилирование в этом участке. Такое агликозилирование может повысить аффинность антитела к антигену. Такой подход более подробно описан в публикации PCT № WO2003/016466, и патентах США №5714350 и 6350861.
Дополнительно или альтернативно, можно получать модифицированный связывающий белок по изобретению, который имеет измененный тип гликозилирования, такой как гипофукозилированное антитело, имеющее сниженные количества фукозильных остатков (см., Kanda et al., J. Biotechnol., 130(3): 300-310 (2007)), или антитело, имеющие увеличенное количество биссекторных структур GlcNAc. Было показано, что такие измененные паттерны гликозилирования повышают способность антител к ADCC. Такие модификации углеводов можно проводить, например, путем экспрессии антитела в клетке-хозяине с измененным аппаратом гликозилирования. Клетки с измененным аппаратом гликозилирования описаны в данной области и их можно использовать в качестве клеток-хозяев для экспрессии рекомбинантных антител по изобретению с получением, тем самым, антитела с измененным гликозилированием. См., например, Shields et al., J. Biol. Chem., 277: 26733-26740 (2002); Umana et al., "Engineered glycoforms of an antineuroblastoma IgG1 with optimized antibody-dependent cellular cytotoxic activity", Nat. Biotechnol, 17: 176-180 (1999), а также европейскую публикацию № EP 1176195; публикации PCT № WO 03/035835 и WO 99/54342.
Гликозилирование белков зависит от аминокислотной последовательности представляющего интерес белка, а также от клетки-хозяина, в которой экспрессируется белок. Различные организмы могут продуцировать различные ферменты гликозилирования (например, гликозилтрансферазы и гликозидазы), и имеют различные доступные субстраты (сахара нуклеотидов). Вследствие таких факторов, паттерн гликозилирования белка и состав гликозильных остатков могут отличаться, в зависимости от системы хозяина, в которой экспрессируется конкретный белок. Гликозильные остатки, пригодные для изобретения, могут включать, но не ограничиваться ими, глюкозу, галактозу, маннозу, фукозу, н-ацетилглюкозамин и сиаловую кислоту. В одном из вариантов осуществления гликозилированный связывающий белок содержит гликозильные остатки, так что паттерн гликозилирования является человеческим.
Специалистам в данной области известно, что различное гликозилирование белка может приводить к различным характеристикам белка. Например, эффективность терапевтического белка, продуцируемого в микроорганизме-хозяине, таком как дрожжи, и гликозилированного с использованием эндогенного каскада дрожжей, может быть снижена по сравнению с гликозилированием того же белка, экспрессируемого в клетке млекопитающего, такой как клеточная линия CHO. Такие гликопротеины также могут быть иммуногенными у человека и могут демонстрировать сниженное время полужизни in vivo после введения. Определенные рецепторы у человека и других животных могут распознавать определенные гликозильные остатки и обеспечивать быстрое выведение белка из кровотока. Другие неблагоприятные эффекты могут включать изменение сворачивания белка, его растворимости, чувствительности к протеазам, кругооборота, транспорта, компартментализации, секреции, распознавания другими белками или факторами, антигенности или аллергенности. Таким образом, практикующий специалист может предпочесть терапевтический белок с определенным составом и паттерном гликозилирования, например составом и паттерном гликозилирования, идентичными, или по меньшей мере сходными, с составом и паттерном гликозилирования в клетках человека или в видоспецифичных клетках предполагаемого животного.
Экспрессии гликозилированных белков, отличных от белков клетки-хозяина, можно достигать генетической модификацией клетки-хозяина для экспрессии гетерологичных ферментов гликозилирования. С использованием способов, известных в данной области, практикующий специалист может получить антитела или их антигенсвязывающие части, проявляющие гликозилирование белков человека. Например, штаммы дрожжей генетически модифицировали для экспрессии не встречающихся в природе ферментов гликозилирования, так чтобы гликозилированные белки (гликопротеины), продуцированные в этих штаммах дрожжей, проявляли гликозилирование белка, идентичное гликозилированию клеток животных, особенно клеток человека (публикации US №2004/0018590 и 2002/0137134).
В дополнение к связывающим белкам, настоящее изобретение также относится к антиидиотипическим (анти-Id) антителам, специфичным к таким связывающим белкам по изобретению. Анти-Id антитело представляет собой антитело, которое распознает уникальные детерминанты, главным образом, ассоциированные с антигенсвязывающей областью другого антитела. Анти-Id можно получать иммунизацией животного связывающим белком или его областью, содержащей CDR. Иммунизированное животное будет распознавать идиотипические детерминанты иммунизирующего антитела и отвечать на них и продуцировать анти-Id антитело. Понятно, что может быть более простым получение антиидиотипических антител к двум или более исходным антителам, включенным в молекулу DVD-Ig; и проверка в исследованиях связывания способами, хорошо известными в данной области (например, BIAcore, ELISA) для подтверждения того, что антитидиотипические антитела, специфичные к идиотипу каждого исходного антитела, также распознают идиотип (например, антигенсвязывающий центр) в контексте DVD-Ig. Антиидиотипические антитела, специфичные к каждому из двух или более антигенсвязывающих центров DVD-Ig, обеспечивают идеальные реагенты для измерения концентраций DVD-Ig человека в сыворотке пациента; анализы концентрации DVD-Ig могут быть разработаны с использованием "сэндвич-формата анализа ELISA" с антителом к первому антигенсвязывающему центру, нанесенным на твердую фазу (например, чип BIAcore, планшет для ELISA и т.д.), промытым буфером для промывания, инкубацией с образцом сыворотки, другой стадией промывания и, наконец, промыванием другим антиидиотипическим антителом к другому антигенсвязывающему центру, которое само мечено ферментом, для количественного определения реакции связывания. В одном из вариантов осуществления для DVD-Ig с более чем двумя различными участками связывания антиидиотипические антитела к двум крайним участкам связывания (наиболее дистальному и проксимальному от константной области), не только могут помочь определить концентрацию DVD-Ig в сыворотке человека, но также подтвердить целостность молекулы in vivo. Каждое анти-Id антитело также можно использовать в качестве "иммуногена" для индукции иммунного ответа у другого животного, получая так называемое анти-анти-Id антитело.
Кроме того, специалисту в данной области будет понятно, что представляющий интерес белок может быть экспрессирован с использованием библиотеки клеток-хозяев, созданных способами генетической инженерии для экспрессии различных ферментов гликозилирования, так что клетки-хозяева, являющиеся членами библиотеки, продуцируют представляющий интерес белок с вариантами паттернов гликозилирования. Затем практикующий специалист может проводить селекцию и выделение представляющего интерес белка с конкретными новыми паттернами гликозилирования. В одном из вариантов осуществления белок, имеющий конкретный выбранный новый паттерн гликозилирования, проявляет улучшенные или измененные биологические свойства.
7. Применение связывающих IL-1β белков
С учетом способности связывающих IL-1β белков или их антигенсвязывающих частей по изобретению связывать IL-1β человека, их можно использовать для детекции IL-1β (например, в биологическом образце, таком как сыворотка или плазма), с использованием общепринятого иммунологического анализа, такого как твердофазный иммуноферментный анализ (ELISA), радиоиммунный анализ (RIA) или иммуногистохимия ткани. Изобретение относится к способу детекции IL-1β в биологическом образце, включающему контактирование биологического образца со связывающим белком или его антигенсвязывающей частью по изобретению и детекцию их связывающего белка (или антигенсвязывающей части), связанного с IL-1β, или несвязанного связывающего белка (или его части), тем самым, осуществляя детекцию IL-1β в биологическом образце. Для облегчения детекции связанного или несвязанного антитела связывающий белок прямо или непрямо метят поддающимся детекции агентом. Пригодные поддающиеся детекции агенты включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры пригодных ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры пригодных комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры пригодных флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеин изотиоцианат, родамин, дихлортриазиниламин флуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; и примеры пригодного радиоактивного материала включают3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho или153Sm.
Альтернативно мечению связывающего белка, IL-1β человека можно анализировать в биологических жидкостях посредством конкурентного иммуноанализа с использованием стандартов rhIL-1β, меченных поддающимся детекции агентом, и немеченого связывающего IL-1β белка. В этом анализе, биологический образец, меченые стандарты rhIL-1β и связывающий IL-1β белок человека объединяют и определяют количество меченого стандарта rhIL-1β, связанного с немеченым антителом. Количество IL-1β человека в биологическом образце обратно пропорционально количеству меченого стандарта rhIL-1β, связанного со связывающим IL-1β белком. Аналогично, IL-1β человека также можно анализировать в биологических жидкостях с помощью конкурентного иммуноанализа с использованием стандартов rhIL-1β, меченых поддающимся детекции агентом, и немеченого связывающего IL-1β белка человека.
Связывающие IL-1β белки и их части по изобретению способны нейтрализовывать активность IL-1β человека как in vitro, так и in vivo. Таким образом, такие связывающие IL-1β белки и их части можно использовать для ингибирования активности IL-1β человека, например, в клеточной культуре, содержащей IL-1β человека, у людей или у других млекопитающих, имеющих IL-1β, с которыми связывающий белок по изобретению перекрестно реагирует. В другом варианте осуществления изобретение относится к способу ингибирования активности IL-1β человека, включающему контактирование IL-1β человека со связывающим IL-1β белком или его антигенсвязывающей частью по изобретения, так чтобы ингибировалась активность IL-1β человека. Например, в клеточной культуре, содержащей или предположительно содержащей IL-1β человека, связывающий IL-1β белок или его связывающую часть по изобретению можно добавлять в культуральную среду для ингибирования активности IL-1β человека в культуре.
В другом варианте осуществления изобретение относится к способу снижения активности IL-1β человека у индивидуума, преимущественно у индивидуума, страдающего заболеванием или нарушением, при котором активность IL-1β является вредоносной. Изобретение относится к способам снижения активности IL-1β у индивидуума, страдающего таким заболеванием или нарушением, который включает введение индивидууму антитела или части антитела по изобретению, так чтобы активность IL-1β у индивидуума снижалась. Предпочтительно, IL-1β представляет собой IL-1β человека и индивидуумом является человек. Альтернативно индивидуумом может быть млекопитающее, экспрессирующее IL-1β, с которым антитело по изобретению способно связываться. Более того, индивидуумом может быть млекопитающее, которому введен IL-1β (например, посредством введения IL-1β или посредством экспрессии трансгена IL-1β). Связывающий IL-1β белок по изобретению можно вводить человеку для терапевтических целей. Более того, связывающий белок по изобретению можно вводить не являющемуся человеком млекопитающему, у которого экспрессируется IL-1β, с которым антитело способно связываться, для ветеринарных целей или в качестве модели заболеваний человека на животных. В отношении последнего, такие модели на животных могут быть пригодны для оценки терапевтической эффективности антител по изобретению (например, тестирования дозировок и времени введения).
Как используют в рамках изобретения, термин "нарушение, при котором активность IL-1β является вредоносной", включает заболевания и другие нарушения, при которых, как показано, наличие IL-1β у индивидуума, страдающего нарушением, является или предположительно является ответственным за патофизиологию нарушения или представляет собой фактор, который приводит к ухудшению состояния при нарушении. Таким образом, нарушение, при котором активность IL-1β является вредоносной, представляет собой нарушение, при котором снижение активности IL-1β, как ожидается, смягчит некоторые или все симптомы и/или прогрессирование нарушения. О таких нарушениях может свидетельствовать, например, повышение концентрации IL-1β в биологической жидкости индивидуума, страдающего нарушением (например, повышение концентрации IL-1β в сыворотке, плазме, синовиальной жидкости и т.д. индивидуума). Неограничивающие примеры нарушений, которые можно лечить связывающими белками по изобретению, включают нарушения, рассмотренные в представленном ниже разделе, относящемся к фармацевтическим композициям антител по изобретению.
DVD-Ig по изобретению могут связывать IL-1β отдельно или они могут связывать множество антигенов (например, IL-1β человека и другой антиген, не являющийся IL-1β). Таким образом, DVD-Ig может блокировать или снижать активность huIL-1β и активность другого антигена-мишени. Такие другие антигены-мишени могут включать растворимые мишени (например, IL-1α) и мишени-рецепторы клеточной поверхности (например, VEGFR, EGFR).
Такие антигены включают, но не ограничиваются ими, мишени, приведенные в следующих базах данных, которые включают базы данных, доступные во всемирной сети и включенные в настоящее описание в качестве ссылок. Эти базы данных мишеней включают:
Терапевтические мишени
(http://xin.cz3.nus.edu.sg/group/cjttd/ttd.asp);
Цитокины и рецепторы цитокинов
(http://www.cytokinewebfacts.com/,
http://www.copewithcytokines.de/cope.cgi, и http://cmbi.bjmu.edu.cn/cmbidata/cgf/CGF_Database/cytokine.medic.kumamoto-u.ac.jp/CFC/indexR.html);
Хемокины
(http://cytokine.medic.kumamoto-u.ac.jp/CFC/CK/Chemokine.html);
Рецепторы хемокинов и GPCR (http://csp.medic.kumamoto-u.ac.jp/CSP/Receptor.html, http://www.gpcr.org/7tm/);
Обонятельные рецепторы
(http://senselab.med.yale.edu/senselab/ORDB/default.asp);
Рецепторы
(http://www.iuphar-db.org/iuphar-rd/list/index.htm);
Мишени злокачественных опухолей
(http://cged.hgc.jp/cgi-bin/input.cgi);
Секретируемые белки в качестве потенциальных мишеней антител
(http://spd.cbi.pku.edu.cn/);
Протеинкиназы (http://spd.cbi.pku.edu.cn/), и
CD-маркеры человека
(http://content.labvelocity.com/tools/6/1226/CD_table_final_locked.pdf) и (Zola et al., "CD molecules 2005: human cell differentiation molecules Blood", Blood, 106: 3123-3126 (2005)).
DVD-Ig пригодны в качестве лекарственных средств для одновременного блокирования двух различных мишеней, т.е. IL-1β человека и одного или нескольких антигенов-мишеней, не являющихся IL-1β, в целях усиления эффективности/безопасности и/или увеличения охвата пациентов. Такие мишени могут включать растворимые мишени (например TNF) и рецепторные мишени клеточной поверхности (например, VEGFR и EGFR).
Кроме того, DVD-Ig по изобретению можно использовать для тканеспецифической доставки (нацеливание на маркер ткани и медиатор заболевания для усиленной локальной PK и, таким образом, более высокой эффективности и/или более низкой токсичности), включая внутриклеточную доставку (нацеливание на интернализующийся рецептор и внутриклеточную молекулу), доставки в головной мозг (нацеливание на рецептор трансферрина и медиатор заболевания ЦНС для прохождения через гематоэнцефалический барьер). Также DVD-Ig может служить в качестве белка-переносчика для доставки антигена в конкретную область путем связывания с не нейтрализующим эпитопом этого антигена и для повышения времени полужизни антигена. Более того, DVD-Ig можно конструировать так, чтобы он был либо физически связан с медицинским устройством, имплантированным пациентам, либо был нацелен на эти медицинские устройства (см. Burke et al., "Zotarolimus eluting stents", Adv. Drug Deliv. Rev., 58(3): 437-446 (2006); Hildebrand et al., "Surface coatings for biological activation and funcionalization of medical devices", Surface and Coatings Technology, 200(22-23): 6318-6324 (2006); Wu et al., "Drug/device combinations for local drug therapies and infections prophylaxis", Biomaterials, 27: 2450-2467 (2006); Marques et al., "Mediation of the Cytokine Network in the Implantation of Orthopedic Devices", Chapter 21, In Biodegradable Systems in Tissue Engineering and Regenerative Medicine, (Reis et al., eds.) (CRC Press LLC, Boca Raton, 2005) pp. 377-397). В кратком изложении, направление определенных типов клеток в область медицинского имплантата может обеспечить заживление и восстановление нормальной функции ткани. Альтернативно также предусматривается ингибирование медиаторов (включая, но не ограничиваясь ими, цитокины), высвобождаемых при имплантации устройства, с помощью DVD-Ig, связанного с устройством или нацеленного на него. Например, стенты многие годы используют в хирургической кардиологии для освобождения блокированных артерий и для повышения притока крови к сердечной мышце. Однако известно, что традиционные стенты из чистого металла вызывают рестеноз (повторное сужение артерии в обработанной области) у некоторых пациентов и могут привести к сгусткам крови. Недавно был описан стент, покрытый антителом против CD34, который снижает рестеноз и препятствует образованию сгустков крови путем улавливания эндотелиальных клеток-предшественников (EPC), циркулирующих в крови. Эндотелиальные клетки представляют собой клетки, которые выстилают кровеносные сосуды, делая кровоток плавным. EPC прикрепляются к твердой поверхности стента, образуя гладкий слой, который не только обеспечивает заживление, но также препятствует рестенозу и образованию сгустков крови - осложнениям, ранее ассоциированным с использованием стентов (Aoki et al., J. Am. Coll. Cardiol., 45(10): 1574-1579 (2005)). В дополнение к улучшению исходов у пациентов, которым требуются стенты, также существует значение для пациентов, которым требуется хирургическая операция по шунтированию сосудов сердца. Например, протезная сосудистая трубка (искусственная артерия), покрытая антителами против EPC, может устранить необходимость в применении артерий из ног или рук пациентов в качестве трансплантатов при хирургической операции по шунтированию. Это может снизить время хирургической операции и анестезии, что, в свою очередь, может снизить количество смертей во время хирургических операций на сердце. DVD-Ig конструируют таким образом, чтобы они связывались с маркером клеточной поверхности (таким как CD34), а также с белком (или эпитопом любого типа, включая, но не ограничиваясь ими белки, липиды и полисахариды), которые нанесены на имплантируемое устройство для облегчения привлечения клеток. Как правило, такие подходы также можно применять для других медицинских имплантатов. Альтернативно DVD-Ig можно наносить на медицинские устройства, и при имплантации и высвобождении всех DVD из устройства (или в случае любой необходимости, которая может потребовать дополнительного свежего DVD-Ig, включая старение и денатурацию уже помещенного в устройство DVD-Ig) устройство можно повторно заполнять путем системного введения свежего DVD-Ig пациенту, где DVD-Ig сконструирован так, чтобы он связывался с представляющей интерес мишенью (цитокином, маркером клеточной поверхности (таким как CD34) и т.д.) через один набор участков связывания и с мишенью, нанесенной на устройство (включая белок, эпитоп любого типа, включая, но не ограничиваясь ими, липиды, полисахариды и полимеры) через другой набор. Эта технология имеет преимущество продления пригодности покрытых имплантатов.
A. Применение DVD-Ig при различных заболеваниях
Молекулы DVD-Ig по изобретению пригодны в качестве терапевтических молекул для лечения различных заболеваний. Такие молекулы DVD могут связывать одну или несколько мишеней, вовлеченных в конкретное заболевание. Примеры таких мишеней при различных заболеваниях описаны ниже.
Аутоиммунный и воспалительный ответ человека
В одном аспекте связывающий белок DVD-Ig по изобретению способен связывать IL-1β человека и один или несколько антигенов, которые вовлечены в общие аутоиммунные и воспалительные ответы, включая C5, CCL1 (I-309), CCL11 (эотаксин), CCL13 (mcp-4), CCL15 (MIP-1d), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19, CCL2 (mcp-1), CCL20 (MIP-3a), CCL21 (MIP-2), CCL23 (MPIF-1), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26, CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (mcp-3), CCL8 (mcp-2), CXCL1, CXCL10 (IP-10), CXCL11 (I-TAC/IP-9), CXCL12 (SDF1), CXCL13, CXCL14, CXCL2, CXCL3, CXCL5 (ENA-78/LIX), CXCL6 (GCP-2), CXCL9, IL13, IL8, CCL13 (mcp-4), CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CR1, IL8RA, XCR1 (CCXCR1), IFNA2, IL10, IL13, IL17C, IL1A, IL1B, IL1F10, IL1F5, IL1F6, IL1F7, IL1F8, IL1F9, IL22, IL5, IL8, IL9, LTA, LTB, MIF, SCYE1 (эндотелиальный активирующий моноциты цитокин), SPP1, TNF, TNFSF5, IFNA2, IL10RA, IL10RB, IL13, IL13RA1, IL5RA, IL9, IL9R, ABCF1, BCL6, C3, C4A, CEBPB, CRP, ICEBERG, IL1R1, IL1RN, IL8RB, LTB4R, TOLLIP, FADD, IRAK1, IRAK2, MYD88, NCK2, TNFAIP3, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5, TRAF6, ACVR1, ACVR1B, ACVR2, ACVR2B, ACVRL1, CD28, CD3E, CD3G, CD3Z, CD69, CD80, CD86, CNR1, CTLA4, CYSLTR1, FCER1A, FCER2, FCGR3A, GPR44, HAVCR2, OPRD1, P2RX7, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, BLR1, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL11, CCL13, CCL15, CCL16, CCL17, CCL18, CCL19, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CL1, CX3CR1, CXCL1, CXCL2, CXCL3, CXCL5, CXCL6, CXCL10, CXCL11, CXCL12, CXCL13, CXCR4, GPR2, SCYE1, SDF2, XCL1, XCL2, XCR1, AMH, AMHR2, BMPR1A, BMPR1B, BMPR2, C19orf10 (IL27w), CER1, CSF1, CSF2, CSF3, DKFZp451J0118, FGF2, GFI1, IFNA1, IFNB1, IFNG, IGF1, IL1A, IL1B, IL1R1, IL1R2, IL2, IL2RA, IL2RB, IL2RG, IL3, IL4, IL4R, IL5, IL5RA, IL6, IL6R, IL6ST, IL7, IL8, IL8RA, IL8RB, IL9, IL9R, IL10, IL10RA, IL10RB, IL11, IL11RA, IL12A, IL12B, IL12RB1, IL12RB2, IL13, IL13RA1, IL13RA2, IL15, IL15RA, IL16, IL17, IL17R, IL18, IL18R1, IL19, IL20, KITLG, LEP, LTA, LTB, LTB4R, LTB4R2, LTBR, MIF, NPPB, PDGFB, TBX21, TDGF1, TGFA, TGFB1, TGFB1I1, TGFB2, TGFB3, TGFBI, TGFBR1, TGFBR2, TGFBR3, TH1L, TNF, TNFRSF1A, TNFRSF1B, TNFRSF7, TNFRSF8, TNFRSF9, TNFRSF11A, TNFRSF21, TNFSF4, TNFSF5, TNFSF6, TNFSF11, VEGF, ZFPM2 и RNF110 (ZNF144).
Астма
Аллергическая астма характеризуется наличием эозинофилии, метаплазией бокаловидных клеток, изменениями эпителиальных клеток, гиперреактивностью дыхательных путей (AHR), и экспрессией Th2- и Th1-цитокинов, а также повышенными уровнями IgE в сыворотке. В настоящее время широко признано, что воспаление дыхательных путей является ключевым фактором, лежащим в основе патогенеза астмы, вовлекающего комплексное взаимодействие воспалительных клеток, таких как T-клетки, B-клетки, эозинофилы, тучные клетки и макрофаги, и секретируемых ими медиаторов, включающих цитокины и хемокины. Кортикостероиды являются наиболее важной противовоспалительной терапией астмы на сегодняшний день, однако их механизм действия является неспецифическим и существует проблема безопасности, особенно в популяции молодых пациентов. Таким образом, требуется разработка более специфических и нацеленных лекарственных средств.
В данной области известны модели на животных, такие как модель OVA-индуцированной астмы у мышей, где можно оценивать как воспаление, так и AHR, и их можно использовать для определения способности различных молекул DVD-Ig лечить астму. Модели на животных для исследования астмы описаны в Coffman et al., J. Exp. Med., 201(12): 1875-1879 (2005); Lloyd et al., Adv. Immunol, 77: 263-295 (2001); Boyce et al., J. Exp. Med., 201(12): 1869-1873 (2005); и Snibson et al., Clin. Exp. Allergy, 35(2): 146-152 (2005). В дополнение к общепринятой оценке безопасности этих пар мишеней, могут быть оправданы и полезны при выборе наилучших пар мишеней конкретные тесты степени иммуносупрессии (см. Luster et al., Toxicology, 92(1-3): 229-243 (1994); Descotes, J., Develop. Biol. Standard., 77: 99-102 (1992); Hart et al., J. Allergy Clin. Immunol, 108(2): 250-257 (2001)).
Один аспект изобретения относится к молекулам DVD-Ig, способным связывать IL-1β и одну или несколько, например две, мишеней, выбранных из группы, состоящей из IL-4, IL-5, IL-8, IL-9, IL-13, IL-18, IL-5R(α), TNFSF4, IL-4R(α), интерферона α, эотаксина, TSLP, PAR-2, PGD2 и IgE. Один вариант осуществления включает DVD-Ig с двойной специфичностью против IL-1β/IL-1α в качестве лекарственного средства, полезного для лечения астмы.
Ревматоидный артрит (RA)
Ревматоидный артрит (RA) - системное заболевание - характеризуется хронической воспалительной реакцией в синовиальной оболочке суставов и ассоциирован с дегенерацией хряща и эрозией околосуставной кости. В пораженных суставах экспрессируются многие провоспалительные цитокины, включая TNF, хемокины и факторы роста. Было показано, что системное введение антитела против TNF или слитого белка sTNFR модельным мышам с RA является противовоспалительным и защищает суставы. В RA вовлечены различные цитокины, включая IL-β. Клинические исследования, в которых активность TNF у пациентов с RA блокировали внутривенно вводимым инфликсимабом (Harriman et al., "Summary of clinical trials in rheumatoid arthritis using infliximab, an anti-TNFalpha treatment", Ann. Rheum. Dis., 58 (Suppl 1): 161-164 (1999)), химерным mAb против TNF, обеспечили данные о том, что TNF регулирует продукцию IL-6, IL-8, MCP-1 и VEGF, привлечение иммунных и воспалительных клеток в суставы, ангиогенез и снижение в крови уровней матриксных металлопротеиназ-1 и -3. Лучшее понимание воспалительного каскада при ревматоидном артрите привело к идентификации других терапевтических мишеней, вовлеченных в ревматоидный артрит. Перспективные лекарственные средства, такие как антагонисты интерлейкина-6 (антитело против рецептора IL-6 MRA, выпускаемое Chugai, Roche (см. Nishimoto et al., Arthritis Rheum., 50(6): 1761-1769 (2004)), CTLA4Ig (абатацепт, Genovese et al., "Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition", N. Engl. J. Med., 353: 1114-1123 (2005)) и лекарственное средство против B-клеток (ритуксимаб, Okamoto et al., "Rituximab for rheumatoid arthritis" N. Engl. J. Med., 351: 1909 (2004)) уже протестированы в рандомизированных контролируемых испытаниях в течение прошлого года. С использованием моделей RA на животных в качестве играющих роль были идентифицированы IL-1β и другие цитокины, такие как IL-15 и IL-18 (терапевтическое антитело HuMax-IL_15, AMG 714 см. Baslund et al., Arthritis Rheum., 52(9): 2686-2692 (2005)). Терапия антителом с двойной специфичностью, комбинирующим антитело против TNF и другого медиатора, такого как IL-1β, имеет большой потенциал в отношении повышения клинической эффективности и/или охвата пациентов. Например, блокирование как TNF, так и VEGF, может потенциально устранять воспаление и ангиогенез, оба из которых вовлечены в патофизиологию RA. Также предусматривается DVD-Ig связывающий белок DVD-Ig, способный блокировать TNF-α и IL-1β. В дополнение общепринятой оценке безопасности этих пар мишеней, при выборе наилучших пар мишеней могут быть обоснованы и полезны конкретные тесты в отношении степени иммуносупрессии (см. Luster et al., Toxicology, 92(1-3): 229-243 (1994); Descotes et al., Develop. Biol. Standard., 77: 99-102 (1992); Hart et al., J. Allergy Clin. Immunol., 108(2): 250-257 (2001)) Пригодность молекулы DVD-Ig для лечения ревматоидного артрита можно оценивать с использованием доклинических моделей RA на животных, таких как модель на мышах индуцируемого коллагеном артрита. Также в данной области хорошо известны другие полезные модули (см. Brand, D.D., Comp. Med., 55: 114-122 (2005)). Исходы из перекрестной реактивности исходных антител в отношении ортологов человека и мыши (например, реактивность в отношении TNF человека и мыши, IL-15 человека и мыши и т.д.) можно проводить подтверждающие исследования в моделях CIA на мышах с помощью молекулы DVD-Ig, происходящих из "подобранного заместительного антитела". В кратком изложении, DVD-Ig, основанный на двух (или более) антителах, специфичных к мишени мыши, можно подбирать в той степени, в которой это возможно, согласно характеристикам исходных антител человека или гуманизированных антител, использованных для конструирования DVD-Ig человека (сходная аффинность, сходная эффективность нейтрализации, сходное время полужизни и т.д.).
В одном из вариантов осуществления DVD-Ig по изобретению, который связывает IL-1β человека и другую мишень, не являющуюся IL-1β, также можно использовать для лечения других заболеваний, в которых участвует IL-1β. Такие заболевания включают, но не ограничиваются ими, SLE, рассеянный склероз (MS), сепсис, различные неврологические заболевания и злокачественные опухоли (включая злокачественные опухоли шейки матки, молочной железы, желудка). Более широкий список заболеваний и нарушений, в которых участвует IL-1β, также представлен ниже.
Один из вариантов осуществления изобретения относится к молекулам DVD-Ig, способным связывать IL-1β человека и одну или несколько мишеней, выбранных из группы, состоящей из IL-1α, TNFα, IL-12, TWEAK, IL-23, CXCL13, CD40, CD40L, IL-18, VEGF, VLA-4, TNFβ, CD45RB, CD200, IFN-γ, GM-CSF, FGF, C5, CD52, склеростина и CCR2.
Системная красная волчанка (SLE)
Иммунопатогенным признаком SLE является поликлональная активация B-клеток, которая приводит к гиперглобулинемии, продукции аутоантител и образованию иммунных комплексов. Основным нарушением, по-видимому, является неспособность T-клеток подавлять недопустимые клоны B-клеток вследствие генерализованного нарушения регуляции T-клеток. Кроме того, взаимодействию B- и T-клеток способствуют некоторые цитокины, такие как IL-10, а также костимуляторные молекулы, такие как CD40 и CD40L, B7 и CD28 и CTLA-4, которые инициируют второй сигнал. Эти взаимодействия вместе с нарушенным фагоцитарным выведением иммунных комплексов и апоптотического материала, делают бесконечным иммунный ответ с повреждением, в итоге, ткани.
В одном аспекте связывающий белок DVD-Ig по изобретению способнее связывать IL-1β человека и один или несколько из следующих антигенов, которые вовлечены в SLE: нацеленная на B-клетки терапия: CD-20, CD-22, CD-19, CD28, CD4, CD80, HLA-DRA, IL10, IL2, IL4, TNFRSF5, TNFRSF6, TNFSF5, TNFSF6, BLR1, HDAC4, HDAC5, HDAC7A, HDAC9, ICOSL, IGBP1, MS4A1, RGS1, SLA2, CD81, IFNB1, IL10, TNFRSF5, TNFRSF7, TNFSF5, AICDA, BLNK, GALNAC4S-6ST, HDAC4, HDAC5, HDAC7A, HDAC9, IL10, IL11, IL4, INHA, INHBA, KLF6, TNFRSF7, CD28, CD38, CD69, CD80, CD83, CD86, DPP4, FCER2, IL2RA, TNFRSF8, TNFSF7, CD24, CD37, CD40, CD72, CD74, CD79A, CD79B, CR2, IL1R2, ITGA2, ITGA3, MS4A1, ST6GAL1, CD1C, CHST10, HLA-A, HLA-DRA и NT5E; костимуляторные сигналы: CTLA4 или B7.1/B7.2; ингибирование выживания B-клеток: BlyS, BAFF; активация комплемента: C5; модулирование цитокинов: ключевой принцип заключается в том, что суммарный биологический ответ в любой ткани является результатом баланса между локальными уровнями провоспалительных или противовоспалительных цитокинов (см. Sfikakis et al., Curr. Opin. Rheumatol., 17:550-557 (2005)). Считается, что SLE представляет собой запускаемое Th-2 заболевание с документированным повышением уровней IL-4, IL-6, IL-10 в сыворотке. DVD-Ig, способные связывать одну или несколько мишеней, выбранных из группы, состоящей из IL-4, IL-6, IL-10, IFN-α и TNF-α, также предусматриваются. Комбинирование мишеней, рассмотренных в настоящем описании, может усилить терапевтическую эффективность в отношении SLE, которую можно тестировать в ряде доклинических моделей волчанки (см., Peng S.L., Methods Mol. Med., 102: 227-272 (2004)). Исходя из перекрестной реактивности исходных антител к ортологам человека и мыши (например, реактивность к CD20 человека мыши, интерферону-альфа человека и мыши и т.д.) можно проводить подтверждающие исследования в модели волчанки на мышах с помощью полученных из "подобранного замещающего антитела" молекул DVD-Ig; в кратком изложении, DVD-Ig на основе двух (или более) специфичных к мишени мыши антител можно подбирать, насколько это возможно, в соответствии с характеристиками исходных человеческих или гуманизированных антител, использованных для конструирования DVD-Ig человека (сходная аффинность, сходная эффективность нейтрализации, сходное время полужизни и т.д.).
Рассеянный склероз (MS)
Рассеянный склероз (MS) представляет собой комплексное заболевание человека аутоиммунного типа, главным образом, с неизвестной этиологией. Иммунологическое разрушение основного белка миелина (MBP) по всей нервной системе является основной патологией рассеянного склероза. MS представляет собой заболевание с комплексной патологией, которое вовлекает инфильтрацию CD4+ и CD8+ T-клеток и ответ в центральной нервной системе. При MS описана экспрессия в ЦНС цитокинов, активных форм азота и костимуляторных молекул. Особенно значимыми являются иммунологические механизмы, которые приводят к развитию аутоиммунтитета. В частности, для идентификации терапевтических мишеней важными областями являются экспрессия антигенов, взаимодействия цитокинов и лейкоцитов и регуляторные T-клетки, которые способствуют равновесию/модулируют другие T-клетки, такие как Th1- и Th2-клетки.
IL-12 представляет собой провоспалительный цитокин, который продуцируется APC и запускает дифференцировку Th1-эффекторных клеток. IL-12 продуцируется в развивающихся очагах у пациентов в MS, а также у животных, страдающих EAE. Ранее было показано, что вмешательство в каскады IL-12 эффективно предотвращает EAE у грызунов, и что нейтрализация IL-12p40 in vivo с использованием mAb против IL-12 имеет благоприятные эффекты в модели индуцированного миелином EAE у обыкновенных игрунок.
TWEAK является представителем семейства TNF, конститутивно экспрессируемым в центральной нервной системе (CNS), с провоспалительными, пролиферативными или апоптотическими эффектами, в зависимости от типов клеток. Его рецептор, Fn14, экспрессируется в ЦНС эндотелиальными клетками, реактивными астроцитами и нейронами. Экспрессия мРНК TWEAK и Fn14 возрастала в спинном мозге в ходе экспериментального аутоиммунного энцефаломиелита (EAE). Лечение антителом против TWEAK при EAE, индуцированным олигодендроцитарным гликопротеином миелина (MOG), у мышей C57BL/6 приводило к уменьшению тяжести заболевания и инфильтрации лейкоцитов, когда мышей лечили после фазы стимуляции.
Один из аспектов изобретения относится к молекулам DVD-Ig, способным связывать IL-1β и одну или несколько, например две, мишеней, выбранных из группы, состоящей из IL-12, TWEAK, IL-23, CXCL13, CD40, CD40L, IL-18, VEGF, VLA-4, TNF, CD45RB, CD200, IFN-гамма, GM-CSF, FGF, C5, CD52, остеопонтина и CCR2. Один из вариантов осуществления включает DVD-Ig с двойной специфичностью против IL-1β/TWEAK в качестве лекарственного средства, полезного при лечении MS.
В данной области известно несколько моделей на животных для оценки применимости молекул DVD для лечения MS (см. Steinman et al., Trends Immunol., 26(11): 565-571 (2005); Lublin et al., Springer Semin Immunopathol, 8(3): 197-208 (1985); Genain et al., J. Mol. Med, 75(3): 187-197 (1997); Tuohy et al., J. Exp. Med., 189(7): 1033-1042 (1999); Owens et al., Neurol. Clin., 13(1): 51-73 (1995); и ‘t Hart et al., J. Immunol, 175(7): 4761-4768 (2005)). Исходя из перекрестной реактивности исходных антител к ортологам человека и видов животных (например, реактивность к IL-1β человека и мыши, TWEAK человека и мыши и т.д.) можно проводить подтверждающие исследования в модели EAE на мышах с полученными из "подобранного замещающего антитела" молекулами DVD-Ig; в кратком изложении, DVD-Ig на основе двух (или более) специфичных к мишени мыши антител можно подбирать, насколько это возможно, в соответствии с характеристиками исходных человеческих или гуманизированных антител, использованных для конструирования DVD-Ig человека (сходная аффинность, сходная эффективность нейтрализации, сходное время полужизни и т.д.). Та же идея применима к моделям на животных других видов, не являющихся грызунами, где полученный из "подобранного замещающего антитела" DVD-Ig можно выбирать для ожидаемой фармакологии и возможных исследований безопасности. В дополнение к общепринятой оценке безопасности этих пар мишеней, могут быть оправданными и полезными при выборе наилучших пар мишеней конкретные тесты степени иммуносупрессии (см. Luster et al., Toxicology, 92(1-3): 229-243 (1994); Descotes et al., Develop. Biol. Standard., 77: 99-102 (1992); Jones, R., "Rovelizumab -ICOS Corp", IDrugs, 3(4):442-446 (2000)).
Сепсис
Патофизиология сепсиса инициируется компонентами наружной мембраны как в грамотрицательных организмах (липополисахарид [LPS], липид A, эндотоксин), так и в грамположительных организмах (липотейхоевая кислота, пептидогликан). Эти компоненты наружной мембраны способны связываться с рецептором CD14 на поверхности моноцитов. Затем посредством недавно описанных toll-подобных рецепторов сигнал передается в клетку, что в итоге приводит продукции провоспалительных цитокинов: фактора некроза опухоли-альфа (TNF-альфа) и интерлейкина-1 (IL-1). Чрезмерные воспалительные и иммунные ответы являются основным признаком септического шока и играют центральную роль в патогенезе повреждения тканей, полиорганной недостаточности и гибели, вызванной сепсисом. Было показано, что цитокины, особенно фактор некроза опухоли (TNF) и интерлейкин (IL-1), являются критическими медиаторами септического шока. Эти цитокины имеют прямой токсический эффект на ткани; также они активируют фосфолипазу A2. Эти и другие эффекты приводят к повышенным концентрациям фактора активации тромбоцитов, стимуляции активности синтазы оксида азота, стимуляции инфильтрации тканей нейтрофилами, и стимуляции активности нейтрофилов.
Лечение сепсиса и септического шока остается клинической проблемой, и недавние проспективные испытания с модификаторами биологического ответа (т.е. против TNF, против MIF), нацеленными на воспалительный ответ, показали только умеренную клиническую пользу. Недавно, интерес сместился в сторону способов лечения, нацеленных на реверсию сопутствующих периодов иммунной супрессии. Исследования у экспериментальных животных и критически больных пациентов продемонстрировали, что к этой иммунной супрессии, анергии и дисфункции систем органов приводит повышенный апоптоз лимофидных органов и некоторых паренхимных тканей. В ходе синдромов сепсиса, апоптоз лимфоцитов может запускаться отсутствием IL-2 или высвобождением глюкокортикоидов, гранзимов или так называемых цитокинов "смерти": фактора некроза опухоли альфа или Fas-лиганда. Апоптоз происходит путем аутоактивации цитозольных и/или митохондриальных каспаз, на которые могут влиять про- и антиапоптотические представители семейства Bcl-2. У экспериментальных животных лечение ингибиторами апоптоза может не только предотвратить апоптоз лимфоидных клеток; также оно может улучшить исход. Несмотря на то, что клинические испытания с антиапоптотическими средствами остаются отдаленными, по большей части, вследствие технических трудностей, ассоциированных с их введением и нацеливанием на ткани, ингибирование апоптоза лимфоцитов является привлекательной терапевтической мишенью для конкретного пациента. Аналогично, средство с двойной специфичностью, нацеленное как на медиатор воспаления, так и на медиатор апоптоза, может иметь дополнительное преимущество. Один из аспектов изобретения относится к DVD-Ig, способным связывать IL-1β и одну или несколько мишеней, вовлеченных в сепсис, В одном из вариантов осуществления две мишени, выбранных из группы, состоящей из TNF, IL-1, MIF, IL-6, IL-8, IL-18, IL-12, IL-23, FasL, LPS, Toll-подобных рецепторов, TLR-4, тканевого фактора, MIP-2, ADORA2A, CASP1, CASP4, IL-10, IL-1B, NFKB1, PROC, TNFRSF1A, CSF3, CCR3, IL1RN, MIF, NFKB1, PTAFR, TLR2, TLR4, GPR44, HMOX1, HMG-B1, мидкина, IRAKI, NFKB2, SERPINA1, SERPINE1 и TREM1. Эффективность таких DVD-Ig против сепсиса можно оценивать в доклинических моделях на животных, известных в данной области (см., Buras et al., Nat. Rev. Drug Discov., 4(10): 854-865 (2005); и Calandra et al., Nature Med., 6(2): 164-170 (2000)).
Неврологические нарушения и нейродегенеративные заболевания
Нейродегенеративные заболевания являются либо хроническими, в случае которых они обычно связаны со старением, либо острыми (например, инсульт, травматическое повреждение головного мозга, повреждение спинного мозга и т.д.). Они характеризуются прогрессирующей утратой нейрональных функций (гибель нейрональных клеток, демиелинизация), потерей подвижности и снижением памяти. Появляющиеся знания о механизмах, лежащих в основе хронических нейродегенеративных заболеваний (например, болезни Альцгеймера, AD) демонстрируют комплексную этиологию, и в качестве участвующих в их развитии и прогрессировании были признаны множество факторов, например, возраст, гликемический статус, продукция и мультимеризация амилоида, накопление конечных продуктов гликирования (AGE), которые связываются с их рецептором RAGE (рецептор для AGE), повышенный окислительный стресс головного мозга, сниженный кровоток головного мозга, нейровоспаление, включая высвобождение воспалительных цитокинов и хемокинов, нейрональная дисфункция и активация микроглии. Таким образом, эти хронические нейродегенеративные заболевания отражают комплексное взаимодействие между множеством типов клеток и медиаторов. Стратегии лечения таких заболеваний ограничены, и, главным образом, представляют собой либо блокирование воспалительных процессов неспецифическими противовоспалительными средствами (например, кортикостероидами, ингибиторами COX) или средствами для предотвращения потери нейронов и/или синаптических функций. Эти способы лечения неспособны остановить прогрессирование заболевания. Недавние исследования указывают на то, что более нацеленные способы лечения, такие как антитела к растворимому пептиду Aβ (включая олигомерные формы Aβ) могут не только помочь остановить прогрессирование заболевания, но также могут способствовать сохранению памяти. Эти предварительные наблюдения указывают на то, что конкретные способы лечения, нацеленные более чем на один медиатор заболевания (например, Aβ и провоспалительный цитокин, такой как TNF), могут обеспечить даже лучшую терапевтическую эффективность при хронических нейродегенеративных заболеваниях, чем наблюдается при нацеливании на один механизм заболевания (например, растворимый Aβ отдельно) (см. Shepherd et al., Neuropathol. Appl. Neurobiol., 31: 503-511(2005); Nelson, R.B., Curr. Pharm. Des., 11: 3335-3352 (2005); Klein, W.L., Neurochem. Int., 41: 345-352 (2002); Janelsins et al., "Early correlation of microglial activation with enhanced tumor necrosis factor-alpha and monocyte chemoattractant protein-I expression specifically within the entorhinal cortex of triple transgenic Alzheimer disease mice", J. Neuroinflammation, 2(23): 1-12 (2005); Soloman, B., Curr. Alzheimer. Res., 1: 149-163 (2004); Klyubin et al., Nature Med., 11 :556-561 (2005); Arancio et al., EMBO J., 23: 4096-4105 (2004); Bornemann et al., Am. J. Pathol., 158: 63-73 (2001); Deane et al., Nature Med., 9: 907-913 (2003); и Masliah et al., Neuron, 46: 857-868 (2005)).
Молекулы DVD-Ig по изобретению могут связывать IL-1β и одну или несколько мишеней, вовлеченных в хронические нейродегенеративные заболевания, такие как болезнь Альцгеймера. Такие мишени включают, но не ограничиваются ими, любой медиатор, растворимый или клеточной поверхности, вовлеченный в патогенез AD, например, AGE (S100 A, амфотерин), провоспалительные цитокины (например, IL-1), хемокины (например, MCP-1), молекулы, которые ингибируют регенерацию нервов (например, Nogo, RGM A), молекулы, которые усиливают рост нейритов (нейротрофины) и молекулы, которые могут опосредовать транспорт через гематоэнцефалический барьер (например, рецептор трансферрина, рецептор инсулина или RAGE). Эффективность молекул DVD-Ig можно подтверждать в доклинических моделях на животных, таких как трансгенные мыши, которые сверхэкспрессируют амилоидный белок-предшественник или RAGE и у которых развиваются симптомы, подобные болезни Альцгеймера. Кроме того, молекулы DVD-Ig можно конструировать и тестировать в отношении эффективности в моделях на животных, и наилучшие терапевтические DVD-Ig можно выбирать для тестирования у пациентов-людей. Молекулы DVD-Ig также можно использовать для лечения других нейродегенеративных заболеваний, таких как болезнь Паркинсона. В патологию болезни Паркинсона вовлечен альфа-синуклеин. DVD-Ig, которые могут нацеливаться IL-1β и LINGO-1, альфа-синуклеин и/или медиаторы воспаления, такие как TNF, IL-1, MCP-1, могут обеспечить эффективную терапию болезни Паркинсона, и они предусматриваются этим изобретением.
Нейрональная регенерация и повреждение спинного мозга
Несмотря на накопление знаний о патологических механизмах, повреждение спинного мозга (SCI) все еще является изнуряющим состоянием и представляет собой медицинский признак, характеризующийся высокими потребностями в медицине. Большинство повреждений спинного мозга представляют собой ушибы или компрессионные повреждения и за первичным повреждением обычно следуют механизмы вторичного повреждения (воспалительные медиаторы, например, цитокины и хемокины), которые ухудшают начальное повреждение и приводят к значительному увеличению области повреждения, иногда более чем в 10 раз. Эти первичные и вторичные механизмы при SCI очень сходны с механизмом при повреждении головного мозга, вызываемом другими причинами, например, инсультом. Удовлетворительного лечения не существует, и болюсная инъекция высокой дозы метилпреднизолона (MP) является единственным используемым способом лечения в узком временном окне, составляющем 8 часов после повреждения. Однако это лечение предназначено только для предотвращения вторичного повреждения, не вызывая какого-либо значительного функционального восстановления. Его сильно критикуют за отсутствие определенной эффективности и тяжелые побочные эффекты, такие как иммуносупрессия, с последующими инфекциями и тяжелыми гистопатологическими изменениями мышц. Не существует других одобренных лекарственных средств, биологических средств или низкомолекулярных соединений, стимулирующих эндогенный регенеративный потенциал, однако перспективные принципы лечения и лекарственные средства-кандидаты показали эффективность в моделях SCI на животных в последние годы. В большой степени отсутствие функционального восстановления при SCI у человека является следствием факторов, ингибирующих рост нейритов в областях повреждения, в рубцовой ткани, в миелине, а также на ассоциированных с повреждением клетках. Такими факторами являются ассоциированные с миелином белки NogoA, OMgp и MAG, RGM A, ассоциированные с рубцовой тканью CSPG (хондроитинсульфатные протеогликаны) и ингибиторные факторы на реактивных астроцитах (некоторые семафорины и эфрины). Однако в области повреждения встречаются не только ингибирующие рост молекулы, но также и стимулирующие рост нейритов факторы, такие как нейротрофины, ламинин, L1 и другие. Эта совокупность ингибирующих и стимулирующих рост нейритов молекул может объяснить то, что блокирование отдельных факторов, таких как NogoA или RGM A, приводило к значительному функциональному восстановлению в моделях SCI на грызунах, поскольку снижение ингибиторных влияний могло сдвинуть баланс от ингибирования роста до стимуляции роста. Однако восстановление, наблюдаемое при блокировании отдельной ингибирующей рост нейритов молекулы, было неполным. Для достижения более быстрого и более выраженного восстановления, может быть желательным либо блокирование двух ингибирующих рост нейритов молекул, например, Nogo и RGM A, либо блокирование ингибирующей рост нейритов молекулы и усиление функции усиливающей рост нейритов молекулы, например, Nogo и нейротрофинов, либо блокирование ингибирующей рост нейритов молекулы, например Nogo, и провоспалительной молекулы, например TNF (см. McGee et al., Trends Neurosci., 26: 193-198 (2003); Domeniconi et al., J. Neurol. Sci., 233: 43-47 (2005); Makwana et al., FEBS J., 272: 2628-2638 (2005); Dickson, B.J., Science, 298: 1959-1964 (2002); Teng et al., J. Neurosci. Res., 79: 273-278 (2005); Karnezis et al., Nature Neurosci., 7: 736 (2004); Xu et al., J. Neurochem., 91: 1018-1023 (2004)).
В одном из аспектов DVD-Ig, способные связывать IL-1β человека, также могут связывать одну или обе мишени из пар мишеней, таких как NgR и RGM A; NogoA и RGM A; MAG и RGM A; OMGp и RGM A; RGM A и RGM B; CSPG и RGM A; аггрекан, мидкин, нейрокан, версикан, фосфакан, Te38 и TNF-α; предусматриваются специфичные к Aβ-глобулломеру антитела в комбинации с антителами, стимулирующими рост дендритов и аксонов. Патология дендритов является очень ранним признаком AD и известно, что NOGO A ограничивает рост дендритов. Можно комбинировать такой тип ab с любым из Ab против кандидата при SCI (белки миелина). Другие мишени DVD-Ig могут включать любую комбинацию NgR-p75, NgR-Troy, NgR-Nogo66 (Nogo), NgR-Lingo, Lingo-Troy, Lingo-p75, MAG или Omgp. Кроме того, мишени также могут включать любой медиатор, растворимый или клеточной поверхности, вовлеченный в ингибирование нейрита, например, Nogo, Ompg, MAG, RGM A, семафорины, эфрины, растворимый Aβ, провоспалительные цитокины (например, IL-1), хемокины (например, MIP-1a), молекулы, которые ингибируют регенерацию нервов. Эффективность молекул против nogo/против RGM A или сходных молекул DVD-Ig можно подтверждать в доклинических моделях повреждения спинного мозга на животных. Кроме того, эти молекулы DVD-Ig можно конструировать и тестировать в отношении эффективности в моделях на животных, и наилучшие терапевтические DVD-Ig можно выбирать для тестирования у пациентов-людей. Кроме того, можно конструировать молекулы DVD-Ig, которые нацелены на два различных лиганд-связывающих участка на одном рецепторе, например, рецепторе Nogo, который связывает три лиганда: Nogo, Ompg и MAG, и на RAGE, который связывает Aβ и S100 A. Более того, ингибиторы роста нейритов, например, nogo и рецептор nogo, также участвуют в предотвращении регенерации нервов при иммунологических заболеваниях, таких как рассеянный склероз. Было показано, что ингибирование взаимодействия nogo-рецептор nogo усиливает восстановление в моделях рассеянного склероза на животных. Таким образом, молекулы DVD-Ig, которые могут блокировать функцию одного иммунного медиатора, например, цитокина, такого как IL-12, и молекулы ингибитора роста нейритов, например, Nogo или RGM, могут обеспечить более быструю и более высокую эффективность, чем блокирование либо иммунной молекулы, либо молекулы ингибитора роста нейритов, отдельно.
Как правило, антитела не проходят через гематоэнцефалический барьер (BBB) эффективно и на значимых уровнях. Однако при определенных неврологических заболеваниях, например инсульте, травматическом повреждении головного мозга, рассеянном склерозе и т.д., BBB может нарушаться и позволять увеличенное проникновение DVD-Ig и антител в головной мозг. При других неврологических состояниях, где не происходит просачивания через BBB, можно использовать нацеливание на эндогенные транспортные системы, включая опосредуемые носителями транспортеры, такие как переносчики глюкозы и аминокислот, и структуры/рецепторы, опосредующие опосредуемый рецепторами трансцитоз на эндотелии сосудов BBB, таким образом, обеспечивая транспорт DVD-Ig через BBB. Структуры в BBB, обеспечивающие такой транспорт, включают, но не ограничиваются ими, рецептор инсулина, рецептор трансферрина, LRP и RAGE. Кроме того, эти стратегии также обеспечивают применение DVD-Ig в качестве переносчиков для транспорта потенциальных лекарственных средств в ЦНС, включая низкомолекулярные лекарственные средства, наночастицы и нуклеиновые кислоты (Coloma et al., Pharm. Res., 17(3):266-274 (2000); Boado et al., Bioconjug. Chem., 18(2):447-455 (2007)).
Онкологические нарушения
Терапия моноклональными антителами оказалась важным терапевтическим воздействием при злокачественной опухоли (von Mehren et al. Monoclonal Antibody therapy for cancer. Ann. Rev Med.; 54:343-369 (2003)). Антитела могут оказывать противоопухолевые эффекты путем индукции апоптоза, перенаправления цитотоксичности, препятствования взаимодействий лиганд-рецептор, или предотвращения экспрессии белков, которые важны для неопластического фенотипа. Кроме того, антитела могут быть нацелены на компоненты микроокружения опухоли, нарушая жизненно-важные структуры, например, образование ассоциированной с опухолью сосудистой сети. Антитела также могут быть нацелены на рецепторы, лигандами которых являются факторы роста, такие как рецептор эпидермального фактора роста. Таким образом, антитело ингибирует связывание природных лигандов, которые стимулируют рост клеток, с опухолевыми клетками-мишенями. Альтернативно антитела могут индуцировать антиидиотипическую сеть, комплементзависимую цитотоксичность или антителозависимую клеточную цитотоксичность (ADCC). Применение антитела с двойной специфичностью, которое нацелено на два отдельных медиатора опухоли, вероятно, может обеспечить дополнительное преимущество по сравнению с моноспецифической терапией.
В другом варианте осуществления DVD-Ig по изобретению, которое связывает IL-1β человека, также может быть способно связывать другую мишень, вовлеченную в онкологические заболевания, включая, но не ограничиваясь ими: IGFR, IGF, VGFR1, PDGFRb, PDGFRa, IGF1,2, ERB3, CDCP, 1BSG2, ErbB3, CD52, CD20, CD 19, CD3, CD4, CD8, BMP6, IL12A, IL1A, IL1B, IL2, IL24, INHA, TNF, TNFSF10, BMP6, EGF, FGF1, FGF10, FGF11, FGF12, FGF13, FGF14, FGF16, FGF17, FGF18, FGF19, FGF2, FGF20, FGF21, FGF22, FGF23, FGF3, FGF4, FGF5, FGF6, FGF7, FGF8, FGF9, GRP, IGF1, IGF2, IL12A, IL1A, IL1B, IL2, INHA, TGFA, TGFB1, TGFB2, TGFB3, VEGF, CDK2, FGF10, FGF18, FGF2, FGF4, FGF7, IGF1R, IL2, BCL2, CD164, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2C, CDKN3, GNRH1, IGFBP6, IL1A, IL1B, ODZ1, PAWR, PLG, TGFB1I1, AR, BRCA1, CDK3, CDK4, CDK5, CDK6, CDK7, CDK9, E2F1, EGFR, ENO1, ERBB2, ESR1, ESR2, IGFBP3, IGFBP6, IL2, INSL4, MYC, NOX5, NR6A1, PAP, PCNA, PRKCQ, PRKD1, PRL, TP53, FGF22, FGF23, FGF9, IGFBP3, IL2, INHA, KLK6, TP53, CHGB, GNRH1, IGF1, IGF2, INHA, INSL3, INSL4, PRL, KLK6, SHBG, NR1D1, NR1H3, NR1I3, NR2F6, NR4A3, ESR1, ESR2, NR0B1, NR0B2, NR1D2, NR1H2, NR1H4, NR112, NR2C1, NR2C2, NR2E1, NR2E3, NR2F1, NR2F2, NR3C1, NR3C2, NR4A1, NR4A2, NR5A1, NR5A2, NR6A1, PGR, RARB, FGF1, FGF2, FGF6, KLK3, KRT1, APOC1, BRCA1, CHGA, CHGB, CLU, COL1A1, COL6A1, EGF, ERBB2, ERK8, FGF1, FGF10, FGF11, FGF13, FGF14, FGF16, FGF17, FGF18, FGF2, FGF20, FGF21, FGF22, FGF23, FGF3, FGF4, FGF5, FGF6, FGF7, FGF8, FGF9, GNRH1, IGF1, IGF2, IGFBP3, IGFBP6, IL12A, IL1A, IL1B, IL2, IL24, INHA, INSL3, INSL4, KLK10, KLK12, KLK13, KLK14, KLK15, KLK3, KLK4, KLK5, KLK6, KLK9, MMP2, MMP9, MSMB, NTN4, ODZ1, PAP, PLAU, PRL, PSAP, SERPINA3, SHBG, TGFA, TIMP3, CD44, CDH1, CDH10, CDH19, CDH20, CDH7, CDH9, CDH1, CDH10, CDH13, CDH18, CDH19, CDH20, CDH7, CDH8, CDH9, ROBO2, CD44, ILK, ITGA1, APC, CD164, COL6A1, MTSS1, PAP, TGFB1I1, AGR2, AIG1, AKAP1, AKAP2, CANT1, CAV1, CDH12, CLDN3, CLN3, CYB5, CYC1, DAB2IP, DES, DNCL1, ELAC2, ENO2, ENO3, FASN, FLJ12584, FLJ25530, GAGEB1, GAGEC1, GGT1, GSTP1, HIP1, HUMCYT2A, IL29, K6HF, KAI1, KRT2A, MIB1, PART1, PATE, PCA3, PIAS2, PIK3CG, PPID, PR1, PSCA, SLC2A2, SLC33A1, SLC43A1, STEAP, STEAP2, TPM1, TPM2, TRPC6, ANGPT1, ANGPT2, ANPEP, ECGF1, EREG, FGF1, FGF2, FIGF, FLT1, JAG1, KDR, LAMA5, NRP1, NRP2, PGF, PLXDC1, STAB1, VEGF, VEGFC, ANGPTL3, BAI1, COL4A3, IL8, LAMA5, NRP1, NRP2, STAB1, ANGPTL4, PECAM1, PF4, PROK2, SERPINE1, TNFAIP2, CCL11, CCL2, CXCL1, CXCL10, CXCL3, CXCL5, CXCL6, CXCL9, IFNA1, IFNB1, IFNG, IL1B, IL6, MDK, EDG1, EFNA1, EFNA3, EFNB2, EGF, EPHB4, FGFR3, HGF, IGF1, ITGB3, PDGFA, TEK, TGFA, TGFB1, TGFB2, TGFBR1, CCL2, CDH5, COL18A1, EDG1, ENG, ITGAV, ITGB3, THBS1, THBS2, BAD, BAG1, BCL2, CCNA1, CCNA2, CCND1, CCNE1, CCNE2, CDH1 (E-кадгерин), CDKN1B (p27Kipl), CDKN2A (p16INK4a), COL6A1, CTNNB1 (b-катенин), CTSB (катепсин B), ERBB2 (Her-2), ESR1, ESR2, F3 (TF), FOSL1 (FRA-1), GATA3, GSN (гельсолин), IGFBP2, IL2RA, IL6, IL6R, IL6ST (гликопротеин 130), ITGA6 (a6-интегрин), JUN, KLK5, KRT19, MAP2K7 (c-Jun), MKI67 (Ki-67), NGFB (NGF), NGFR, NME1 (NM23A), PGR, PLAU (uPA), PTEN, SERPINB5 (маспин), SERPINE1 (PAI-1), TGFA, THBS1 (тромбоспондин-1), TIE (Tie-1), TNFRSF6 (Fas), TNFSF6 (FasL), TOP2A (топоизомераза Iia), TP53, AZGP1 (цинк-a-гликопротеин), BPAG1 (плектин), CDKN1A (p21Wap1/Cip1), CLDN7 (клаудин-7), CLU (кластерин), ERBB2 (Her-2), FGF1, FLRT1 (фибронектин), GABRP (GABAa), GNAS1, ID2, ITGA6 (a6-интегрин), ITGB4 (b4-интегрин), KLF5 (GC Box BP), KRT 19 (кератин 19), KRTHB6 (специфичный для волос кератин типа II), MACMARCKS, MT3 (металлотионектин-III), MUC1 (муцин), PTGS2 (COX-2), RAC2 (p21Rac2), S100A2, SCGB1D2 (липофилин B), SCGB2A1 (маммаглобин 2), SCGB2A2 (маммаглобин 1), SPRR1B (Spr1), THBS1, THBS2, THBS4 и TNFAIP2 (B94), RON, c-Met, CD64, DLL4, PLGF, CTLA4, фосфатидилсерин, ROBO4, CD80, CD22, CD40, CD23, CD28, CD55, CD38, CD70, CD74, CD30, CD138, CD56, CD33, CD2, CD137, DR4, DR5, RANKL, VEGFR2, PDGFR, VEGFR1, MTSP1, MSP, EPHB2, EPHA1, EPHA2, EpCAM, PGE2, NKG2D, LPA, SIP, APRIL, BCMA, MAPG, FLT3, PDGFR-альфа, PDGFR-бета, ROR1, PSMA, PSCA, SCD1 и CD59.
D. Фармацевтические композиции
Также изобретение относится к фармацевтическим композициям, содержащим антитело (включая DVD-Ig, описанный в настоящем описании) или его антигенсвязывающую часть по изобретению и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие антитела по изобретению, предназначены для применения, но не ограничиваясь этим, в диагностике, детекции или мониторинге нарушения, в профилактике, лечении, управлении течением или смягчении нарушения или одного или нескольких его симптомов, и/или в исследованиях. В конкретном варианте осуществления композиция содержит одно или несколько антител по изобретению. В другом варианте осуществления фармацевтическая композиция содержит одно или несколько антител по изобретению и одно или несколько профилактических или терапевтических средств, отличных от антител по изобретению, для лечения нарушения, при котором активность IL-1β является вредоносной. В одном из вариантов осуществления профилактические или терапевтические средства представляют собой средства, которые известны в качестве пригодных или которые ранее использовали или в настоящее время используют для профилактики, лечения, управления течением или смягчения нарушения или одного или нескольких его симптомов. В соответствии с этими вариантами осуществления композиция может дополнительно содержать носитель, разбавитель или эксципиент.
Антитела и части антител по изобретению можно включать в фармацевтические композиции, пригодные для введения индивидууму. Как правило, фармацевтическая композиция содержит антитело или часть анититела по изобретению и фармацевтически приемлемый носитель. Как используют в рамках изобретения, "фармацевтически приемлемый носитель" включает любые и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают одно или несколько из воды, физиологического раствора, фосфатно-солевого буфера, декстрозы, глицерина, этанола и т.п., а также их комбинации. Во многих случаях в композицию предпочтительно включают изотонические средства, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Кроме того, фармацевтически приемлемые носители могут содержать небольшие количества вспомогательных веществ, таких как смачивающие средства или эмульгаторы, консерванты или буферы, которые повышают срок хранения или эффективность антитела или части антитела.
Известны различные системы для доставки и их можно использовать для доставки одного или нескольких антител по изобретению или комбинации одного или нескольких антител по изобретению и профилактического средства или терапевтического средства, пригодного для профилактики, управления течением, лечения или смягчения нарушения или одного или нескольких его симптомов, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать антитело или фрагмент антитела, опосредуемый рецептором эндоцитоз (см., например, Wu and Wu, J. Biol. Chem. 262:4429-4432 (1987)), конструирование нуклеиновой кислоты в качестве части ретровирусного или другого вектора, и т.д. Способы введения профилактического или терапевтического средства по изобретению включают, но не ограничиваются ими, парентеральное введение (например, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, внутриопухолевое введение и введение на слизистую оболочку (например, интраназальный и пероральный путь). Кроме того, можно использовать легочное введение, например, с использованием ингалятора или распылителя, и состава с образующим аэрозоль средством. См., например, патенты США №6019968, 5985320, 5985309, 5934272, 5874064, 5855913 и 5290540; и публикации PCT № WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждый из которых включен в настоящее описание в качестве ссылки. В одном из вариантов осуществления антитело или часть антитела по изобретению, комбинированную терапию, или композицию по изобретению вводят с использованием технологии для легочной доставки лекарственного средства Alkermes AIR® (Alkermes, Inc., Cambridge, Massachusetts). В конкретном варианте осуществления профилактические или терапевтические средства по изобретению вводят внутримышечно, внутривенно, внутрь опухоли, перорально, интраназально, через легкие или подкожно. Профилактические или терапевтические средства можно вводить любым удобным способом, например инфузией или болюсной инъекцией, посредством всасывания через эпителиальные или кожно-слизистые выстилки (например, слизистые оболочки полости рта, прямой кишки, кишечника и т.д.) и их можно вводить вместе с другими биологически активными средствами. Введение может быть системным или местным.
В одном из вариантов осуществления для нацеливания на опухолевые клетки можно использовать специфическое связывание углеродных нанотрубок (CNT), к которым присоединено антитело, с опухолевыми клетками in vitro, с последующим их высокоспецифичным устранением с помощью излучения в ближней инфракрасной области (NIR). Например, биотинилированные полярные липиды можно использовать для получения стабильных, биосовместимых, нецитотоксических дисперсий CNT, к которым затем присоединяют одно или два различных нейтрализующих производных DVD-Ig с авидином, направленных против одного или нескольких опухолевых антигенов (например, CD22) (Chakravarty et al., Proc. Natl. Acad. Sci. USA, 105: 8697-8702 (2008)).
В конкретном варианте осуществления может быть желательным введение профилактических или терапевтических средств по изобретению локально в область, нуждающуюся в лечении; этого можно достигать, например, и не ограничиваясь этим, локальной инфузией, инъекцией или с помощью имплантата, причем указанный имплантат представляет собой пористый или непористый материал, включающий мембраны и матрицы, такие как силастиковые мембраны, полимеры, фиброзные матрицы (например, Tissuel®) или коллагеновые матрицы. В одном из вариантов осуществления эффективное количество одного или нескольких антител-антагонистов по изобретению вводят локально в пораженную область индивидууму для профилактики, лечения, управления течением и/или смягчения нарушения или его симптома. В другом варианте осуществления эффективное количество одного или нескольких антител по изобретению вводят локально в пораженную область индивидуума в комбинации с эффективным количеством одного или нескольких лекарственных средств (например, одного или нескольких профилактических или терапевтических средств), отличных от антитела по изобретению для профилактики, лечения, управления течением и/или смягчения нарушения или одного или нескольких его симптомов.
В другом варианте осуществления профилактическое или терапевтическое средство можно доставлять в системе для контролируемого высвобождения или замедленного высвобождения. В одном из вариантов осуществления для достижения контролируемого или замедленного высвобождения можно использовать насос (см. Langer, выше; Sefton, M.V., CRC Crit. Rev. Biomed. Eng., 14: 201-240 (1987); Buchwald et al., Surgery, 88: 507-516 (1980); Saudek et al., N. Engl. Med., 321: 574-579 (1989)). В другом варианте осуществления для достижения контролируемого или замедленного высвобождения лекарственных средств по изобретению можно использовать полимерные материалы (см., например, Goodson, J.M., Chapter 6, In Medical Applications of Controlled Release, Vol. II, Applications and Evaluation, (Langer and Wise, eds.) (CRC Press, Inc., Boca Raton, 1984) pp. 115-138; Langer and Peppas, J. Macromol. Sci. Rev. Macromol. Chem. Phys., C23(1): 61-126 (1983); также см. Levy et al., Science, 228: 190-192 (1985); During et al., Ann. Neurol., 25:351-356 (1989); Howard et al., J. Neurosurg., 71: 105-112 (1989)); патент США №5679377; патент США №5916597; патент США №5912015; патент США №5989463; патент США №5128326; публикацию PCT № WO 99/15154; и публикацию PCT № WO 99/20253. Примеры полимеров, используемых для составов с замедленным высвобождением, включают, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), полиметилметакрилат, полиакриловую кислоту, сополимер этилена и винилацетата, полиметакриловую кислоту, полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поливиниловый спирт, полиакриламид, полиэтиленгликоль, полилактиды (PLA), сополимер лактидов и гликолидов (PLGA) и сложные полиортоэфиры. В иллюстративном варианте осуществления полимер, используемый в составе с замедленным высвобождением, является инертным, не содержащим вымываемых примесей, стабильным при хранении, стерильным и биодеградируемым. В другом варианте осуществления вблизи профилактической или терапевтической мишени можно помещать систему с контролируемым или замедленным высвобождением, что, таким образом, делает необходимой только часть системной дозы (см., например, Goodson, Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)).
Системы с контролируемым высвобождением рассмотрены в обзоре Langer (Science, 249: 1527-1533 (1990)). Для получения составов с замедленным высвобождением, включающих одно или несколько лекарственных средств по изобретению, можно использовать любой способ, известный специалисту в данной области. См., например, патент США №4526938, публикацию PCT № WO 91/05548, публикацию PCT №. WO 96/20698; Ning et al., "Intratumoral radioimmunotherapy of a human colon cancer xenograft using a sustained-release gel", Radiotherapy Oncol., 39: 179-189 (1996); Song et al., "Antibody Mediated Lung Targeting of Long-Circulating Emulsions", PDA J. Pharm. Sci. Technol., 50: 372-377 (1996); Cleek et al., "Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application", Proceed. Int’l. Symp. Control. Rel. Bioact. Mater., 24: 853-854 (1997); и Lam et al., "Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery", Proceed. Int’l. Symp. Control Rel. Bioact. Mater., 24: 759-760 (1997), каждый из которых включен в настоящее описание в качестве ссылки в полном объеме.
В конкретном варианте осуществления, где композиция по изобретению представляет собой нуклеиновую кислоту, кодирующую профилактическое или терапевтическое средство, нуклеиновую кислоту можно вводить in vivo для обеспечения экспрессии кодируемого ей профилактического или терапевтического средства, посредством конструирования ее в качестве части соответствующего экспрессирующего нуклеиновую кислоту вектора и введения его так, чтобы он стал внутриклеточным, например, с использованием ретровирусного вектора (см. патент США №4980286), или посредством прямой инъекции, или с использованием бомбардировки микрочастицами (например, генная пушка; Biolistic®, DuPont), или покрытия липидами или рецепторами клеточной поверхности или трансфицирующими агентами, или введения его в форме, связанной с гомеобокс-подобным пептидом, который, как известно, проникает в ядро (см., например, Joliot et al., Proc. Natl. Acad. Sci. USA 88:1864-1868 (1991)). Альтернативно нуклеиновую кислоту для экспрессии можно вводить внутрь клетки и встраивать с помощью гомологичной рекомбинации в ДНК клетки-хозяина.
Фармацевтическую композицию по изобретению изготавливают так, чтобы она была совместима с предполагаемым путем введения. Примеры способов введения включают, но не ограничиваются ими, парентеральное, например, внутривенное, внутрикожное, подкожное, пероральное, интраназальное (например, ингаляционное), трансдермальное (например, местное), трансмукозальное и ректальное введение. В конкретном варианте осуществления композицию изготавливают в соответствии с общепринятыми способами в качестве фармацевтической композиции, адаптированной для внутривенного, подкожного, внутримышечного, перорального, интраназального или местного введения человеку. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. Когда необходимо, композиция может включать солюбилизирующее вещество и местный анестетик, такой как лидокаин, для смягчения боли в области инъекции.
Если композиции по изобретению предназначены для местного введения, композиции можно изготавливать в форме мази, крема, чрескожного пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, хорошо известной специалисту в данной области. См., например, Remington’s Pharmaceutical Sciences and Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pennsylvania. (1995). Для нераспыляемых местных дозированных форм, как правило, используют формы от вязких до полутвердых или твердых, содержащие носитель или один или несколько эксципиентов, совместимых с местным применением и имеющих динамическую вязкость, предпочтительно превышающую вязкость воды. Пригодные составы включают, но не ограничиваются ими, растворы, суспензии, эмульсии, кремы, мази, порошки, линименты, бальзамы и т.п., которые, если желательно, являются стерилизованными или смешанными с вспомогательными средствами (например, консервантами, стабилизаторами, смачивающими средствами, буферами или солями) для влияния на различные свойства, например, такие как осмотическое давление. Другие пригодные местные дозированные формы включают распыляемые аэрозольные препараты, где активный ингредиент предпочтительно в комбинации с твердым или жидким инертным носителем, упакован в смеси с находящимся под давлением летучим веществом (например, газообразным пропеллентом, таким как FREON®) или в сдавливаемой бутыли. Также, если желательно, в фармацевтические композиции и дозированные формы можно добавлять увлажнители или смачивающие вещества. Примеры таких дополнительных ингредиентов хорошо известны в данной области.
Если способ по изобретению включает интраназальное введение композиции, композицию можно изготавливать в форме аэрозоля, спрея, жидкости для распыления или в форме капель. В частности, профилактические или терапевтические средства для применения в соответствии с настоящим изобретением можно удобным образом доставлять в форме аэрозольного спрея из находящихся под давлением пакетов или устройства для распыления, с использованием пригодного пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого пригодного газа). В случае находящегося под давлением аэрозоля, дозированную единицу можно определять посредством предоставления клапана для доставки дозированного количества. Можно изготавливать капсулы и кассеты (состоящие, например, из желатина) для применения в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и пригодной порошковой основы, такой как лактоза или крахмал.
Если способ по изобретению включает пероральное введение, пероральные композиции можно изготавливать в форме таблеток, капсул, крахмальных капсул, желатиновых капсул, растворов, суспензий и т.п. Таблетки или капсулы можно получать общепринятыми способами с использованием фармацевтически приемлемых эксципиентов, таких как связующие вещества (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие вещества (например, картофельный крахмал или натрия крахмала гликолят); или смачивающие вещества (например, лаурилсульфат натрия). Таблетки можно покрывать способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут иметь форму, но не ограничиваясь ими, растворов, сиропов или суспензий, или они могут быть представлены в качестве сухого продукта для растворения водой или другим пригодным носителем перед применением. Такие жидкие препараты можно получать общепринятыми способами с использованием фармацевтически приемлемых добавок, таких как суспендирующие вещества (например, сироп сорбита, производные целлюлозы, или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота). Также препараты могут содержать буферные соли, вкусовые добавки, красители и подсластители, в соответствующих случаях. Препараты для перорального введения могут быть пригодным образом изготовлены для медленного высвобождения, контролируемого высвобождения или непрерывного высвобождения профилактического или терапевтического средства(средств).
Способ по изобретению может включать легочное введение, например, с использованием ингалятора или устройства для распыления, композиции, изготовленной с образующим аэрозоль средством. См., например, патенты США №6019968, 5985320, 5985309, 5934272, 5874064, 5855913 и 5290540; и публикации PCT № WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме. В конкретном варианте осуществления антитело по изобретению, комбинированное лекарственное средство и/или композицию по изобретению вводят с использованием технологии легочной доставки лекарственного средства Alkermes AIR® (Alkermes, Inc., Cambridge, Massachusetts).
Способ по изобретению может включать введение композиции, изготовленной для парентерального введения, посредством инъекции (например, посредством болюсной инъекции или непрерывной инфузии). Составы для инъекции могут быть предоставлены в единичной дозированной форме (например, в ампулах или контейнерах для многократного дозирования) с добавленным консервантом. Композиции могут иметь такие формы, как формы суспензий, растворов или эмульсий в масляных или водных носителях, и они могут содержать средства для изготовления состава, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Альтернативно активный ингредиент может находиться в форме порошка для растворения пригодным носителем (например, стерильной не содержащей пирогенов водой) перед применением.
Кроме того, способы по изобретению могут включать введение композиций, изготовленных в качестве депо-препаратов. Такие составы длительного действия можно вводить посредством имплантации (например, подкожной или внутримышечной) или посредством внутримышечной инъекции. Таким образом, например, композиции можно изготавливать с использованием пригодных полимерных или гидрофобных материалов (например, таких как эмульсия в приемлемом масле) или ионообменных смол, или в качестве малорастворимых производных (например, малорастворимой соли).
Способы по изобретению включают введение композиций, изготовленных в качестве нейтральной формы или формы соли. Фармацевтически приемлемые соли включают соли, образованные с анионами, такими как анионы хлористоводородной, фосфорной, уксусной, щавелевой, виннокаменной кислот, и т.д., и соли, образованные с катионами, такими как катионы натрия, калия, аммония, кальция, гидроксидов железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
Как правило, ингредиенты композиций предоставляют либо по отдельности, либо в смеси друг с другом в единичной дозированной форме, например, в качестве сухого лиофилизированного порошка или не содержащего воды концентрата в герметично закрытом контейнере, таком как ампула или саше, с указанием количества активного вещества. Когда способом введения является инфузия, композицию можно дозировать с помощью бутыли для инфузии, содержащей стерильную воду для фармацевтического применения или физиологический раствор. Когда способом введения является инъекция, может быть предоставлена ампула со стерильной водой для инъекции или физиологическим раствором, так чтобы ингредиенты можно было смешать перед введением.
В частности, изобретение также предусматривает, что одно или несколько профилактических или терапевтических средств, или фармацевтических композиций по изобретению упакованы в герметично закрытый контейнер, такой как ампула или саше, с указанием количества активного вещества. В одном из вариантов осуществления одно или несколько из профилактических или терапевтических средств или фармацевтических композиций по изобретению предоставляют в качестве сухого стерилизованного лиофилизированного порошка или не содержащего воды концентрата в герметично закрытом контейнере, и их можно восстанавливать (например, водой или физиологическим раствором) до концентрации, пригодной для введения индивидууму. Предпочтительно одно или несколько из профилактических или терапевтических средств или фармацевтических композиций по изобретению предоставляют в качестве сухого стерильного лиофилизированного порошка в герметично закрытом контейнере в единичной дозировке, составляющей по меньшей мере 5 мг, более предпочтительно по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг, или по меньшей мере 100 мг. Лиофилизированные профилактические или терапевтические средства или фармацевтические композиции по изобретению следует хранить при температуре от 2°C до 8°C в их исходном контейнере, и профилактические или терапевтические средства, или фармацевтические композиции по изобретению должны быть введены в пределах 1 недели, предпочтительно в пределах 5 суток, в пределах 72 часов, в пределах 48 часов, в пределах 24 часов, в пределах 12 часов, в пределах 6 часов, в пределах 5 часов, в пределах 3 часов или в пределах 1 часа после восстановления. В альтернативном варианте осуществления одно или несколько из профилактических или терапевтических средств или фармацевтических композиций по изобретению предоставляют в жидкой форме в герметично закрытом контейнере, на котором указаны количество и концентрация вещества. Предпочтительно жидкую форму вводимой композиции предоставляют в герметично закрытом контейнере в концентрации по меньшей мере 0,25 мг/мл, более предпочтительно по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/кг, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл. Жидкую форму следует хранить при температуре от 2°C до 8°C в ее исходном контейнере.
Антитела и части антител по изобретению могут быть включены в фармацевтическую композицию, пригодную для парентерального введения. Предпочтительно антитело или части антитела получают в качестве инъецируемого раствора, содержащего 0,1-250 мг/мл антитела. Инъецируемый раствор может состоять либо из жидкой, либо из лиофилизированной дозированной формы в бесцветном или янтарном флаконе, ампуле или предварительно заполненном шприце. Буфер может представлять собой L-гистидин (1-50 мМ), оптимально 5-10 мМ, при pH от 5,0 до 7,0 (оптимально pH 6,0). Другие пригодные буферы включают, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Для модификации токсичности раствора можно использовать хлорид натрия в концентрации 0-300 мМ (оптимально 150 мМ для жидкой дозированной формы). Для лиофилизированной дозированной формы можно добавлять криопротектор, главным образом, 0-10% сахарозу (оптимально 0,5-1,0%). Другие пригодные криопротекторы включают трегалозу и лактозу. Для лиофилизированной дозированной формы можно добавлять наполнители, главным образом, 1-10% маннит (оптимально 2-4%). Как в жидких, так и с лиофилизированных дозированных формах можно использовать стабилизаторы, главным образом, 1-50 мМ L-метионин (оптимально 5-10 мМ). Другие пригодные наполнители включают глицин, аргинин, и можно добавлять 0-0,05% полисорбат-80 (оптимально 0,005-0,01%). Дополнительные поверхностно-активные вещества включают, но не ограничиваются ими, полисорбат 20 и поверхностно-активные вещества BRIJ. Фармацевтическая композиция, содержащая антитело или часть антитела по изобретению, полученная в качестве инъецируемого раствора для парентерального введения, может дополнительно содержать средство, пригодное в качестве адъюванта, такое как средства, используемые для повышения всасывания или диспергирования терапевтического белка (например, антитело). Особенно пригодным адъювантом является гиалуронидаза, такая как Hylenex® (рекомбинантная гиалуронидаза человека). Добавление гиалуронидазы в инъецируемый раствор повышает биодоступность у человека после парентерального введения, в частности подкожного введения. Также оно позволяет вводить большие объемы на область инъекции (т.е. более 1 мл) при снижении боли и неприятных ощущений и минимальной встречаемости реакций области инъекции (см. публикацию PCT № WO 2004/078140 и публикацию US № 2006/104968).
Композиции по этому изобретению могут иметь различные формы. Они включают, например, жидкие, полутвердые и твердые дозированные формы, такие как жидкие растворы (например, инъецируемые и инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого пути введения и терапевтического применения. Типичные предпочтительные композиции имеют форму инъецируемых или инфузируемых растворов, таких как композиции, сходные с композициями, используемыми для пассивной иммунизации человека другими антителами. Предпочтительным способом введения является парентеральный (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В иллюстративном варианте осуществления антитело вводят посредством внутривенной инфузии или инъекции. В другом предпочтительном варианте осуществления антитело вводят посредством внутримышечной или подкожной инъекции.
Терапевтические композиции, как правило, должны быть стерильными и стабильными в условиях изготовления и хранения. Композицию можно изготавливать в качестве раствора, микроэмульсии, дисперсии, липосом или другой упорядоченной структуры, пригодной для высокой концентрации лекарственного средства. Стерильные инъецируемые растворы можно получать включением активного соединения (т.е. антитела или части антитела) в требуемом количестве в соответствующий растворитель с одним или с комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрацией. Как правило, дисперсии получают добавлением активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты из тех, что перечислены выше. В случае стерильных лиофилизированных порошков для приготовления стерильных инъецируемых растворов, предпочтительными способами изготовления являются вакуумная сушка и распылительная сушка, которые приводят к порошку активного ингредиента с любыми дополнительными желательными ингредиентами из их предварительно стерилизованного фильтрацией раствора. Надлежащую текучесть раствора можно поддерживать, например, с использованием покрытия, такого как лецитин, подержанием требуемого размера частиц в случае дисперсии, и с использованием поверхностно-активных веществ. Пролонгированного всасывания инъецируемых композиций можно достигать включением в композицию средства, которое замедляет всасывание, например, солей моностеарата и желатина.
Связывающие белки по настоящему изобретению можно вводить множеством способов, известных в данной области, хотя для многих терапевтических применений предпочтительным путем/способом введения является подкожная инъекция, внутривенная инъекция или инфузия. Как будет понятно специалисту в данной области, путь и/или способ введения может варьировать, в зависимости от желаемых результатов. В определенных вариантах осуществления активное соединение можно изготавливать с носителем, который предотвращает быстрое высвобождение соединения, таким как состав с контролируемым высвобождением, включающий имплантаты, чрескожные пластыри и микроинкапсулированные системы для доставки. Можно использовать биодеградируемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Для получения таких составов запатентовано или, главным образом, известно специалистам в данной области множество способов. См., например, Sustained and Controlled Release Drug Delivery Systems, (J. R. Robinson, ed.) (Marcel Dekker, Inc., New York, 1978).
В определенных вариантах осуществления антитело или часть антитела по изобретению можно вводить перорально, например, с инертным разбавителем или усваиваемым пищевым носителем. Соединение (и другие ингредиенты, если желательно) также можно заключать в желатиновую капсулу с твердой или мягкой оболочкой, прессовать в таблетки, или включать непосредственно в рацион индивидуума. Для перорального терапевтического введения соединения можно включать с эксципиентами и использовать в форме проглатываемых таблеток, таблеток для трансбуккального введения, лепешек, капсул, эликсиров, суспензий, сиропов, пластинок и т.п. Для введения соединения по изобретению способом, отличным от парентерального введения, может быть необходимым покрытие соединения материалом для предотвращения его инактивации, или введение соединения совместно с ним.
Также в композиции можно включать дополнительные активные соединения. В определенных вариантах осуществления связывающий белок по изобретению совместно включают в состав и/или совместно вводят с одним или несколькими дополнительными терапевтическими средствами, которые пригодны для лечения нарушений, при которых активность IL-1β является вредоносной. Например, антитело против IL-1β человека или часть антитела по изобретению можно совместно включать в состав и/или совместно вводить с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антитела, которые связывают другие цитокины или которые связывают молекулы клеточной поверхности). Более того, одно или несколько антител по изобретению можно использовать в комбинации с двумя или более из указанных выше лекарственных средств. Такие комбинированные лекарственные средства можно преимущественно использовать с более низкими дозировками вводимых лекарственных средств, таким образом, избегая возможной токсичности или осложнений, ассоциированных с различными способами монотерапии.
В определенных вариантах осуществления антитело против IL-1β или его фрагмент связаны с носителем, удлиняющим время полужизни, известным в данной области. Такие носители включают, но не ограничиваются ими, Fc-домен, полиэтиленгликоль и декстран. Такие носители описаны, например, в US с серийным номером №09/428082 (в настоящее время патент США №6660843), которая включена в настоящее описание в качестве ссылки для любых целей.
В конкретном варианте осуществления последовательности нуклеиновых кислот, содержащие нуклеотидные последовательности, кодирующие антитело по изобретению или другое профилактическое или терапевтическое средство по изобретению, вводят для лечения, профилактики, управления течением или смягчения нарушения или одного или нескольких его симптомов с помощью генной терапии. Генная терапия относится к терапии, проводимой путем введения индивидууму экспрессированной или экспрессируемой нуклеиновой кислоты. В этом варианте осуществления изобретения, нуклеиновые кислоты продуцируют кодируемое ими антитело или профилактическое или терапевтическое средство по изобретению, которое опосредует профилактический или терапевтический эффект.
В соответствии с настоящим изобретением можно использовать любые способы генной терапии, доступные в данной области. Для основных обзоров способов генной терапии, см. Goldspiel et al., Clinical Pharm., 12: 488-505 (1993); Wu et al., "Delivery systems for gene therapy", Biotherapy, 3: 87-95 (1991); Tolstoshev, P., Ann. Rev. Pharmacol. Toxicol., 32: 573-596 (1993); Mulligan, R.C., Science, 260: 926- 932 (1993); и Morgan and Anderson, "Human Gene Therapy", Ann. Rev. Biochem., 62: 191-217 (1993); Robinson, C., Trends Biotechnol., 11: 155 (1993). Широко известные в данной области способы технологии рекомбинантных ДНК, которые можно использовать, описаны в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, New York (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, New York (1990). Подробное описание различных способов генной терапии представлено в публикации US №2005/0042664 A1, которая включена в настоящее описание в качестве ссылки.
Представители семейства IL-1 (IL-1β и IL-1α) играют важную роль в патологии, ассоциированной с различными нарушениями, вовлекающими иммунные и воспалительные элементы. Связывающий IL-1 белок, описанный в настоящем описании, можно вводить индивидууму для лечения таких нарушений. В одном варианте осуществления нарушение, которое можно лечить способом по изобретению, включающим введение индивидууму связывающего IL-1 белка, описанного в настоящем описании, включает, но не ограничивается ими, диабет; увеит; невропатическую боль; остеоартритическую боль; воспалительную боль; ревматоидный артрит; остеоартрит; ювенильный хронический артрит; септический артрит; артрит Лайма; псориатический артрит; реактивный артрит; спондилоартропатию; системную красную волчанку (SLE); болезнь Крона; язвенный колит; воспалительное заболевание кишечника; аутоиммунный диабет; инсулинзависимый сахарный диабет; тиреоидит; астму; аллергические заболевания; псориаз; дерматит; склеродермию; реакцию "трансплантат против хозяина"; отторжение трансплантата органа; острое иммунное заболевание, ассоциированное с трансплантацией органа; хроническое иммунное заболевание, ассоциированное с трансплантацией органа; саркоидоз; атеросклероз; диссеминированное внутрисосудистое свертывание (DIC); болезнь Кавасаки; болезнь Грэйвса; нефротический синдром; синдром хронической усталости; гранулематоз Вегенера; пурпуру Шенлейна-Геноха; микроскопический васкулит почек; хронический активный гепатит; аутоиммунный увеит; септический шок; синдром токсического шока; септический синдром; кахексию; инфекционные заболевания; паразитарные заболевания; острый поперечный миелит; хорею Гентингтона; болезнь Паркинсона; болезнь Альцгеймера; инсульт; первичный билиарный цирроз; гемолитическую анемию; злокачественные опухоли; сердечную недостаточность; инфаркт миокарда; болезнь Аддисона; спорадический полигландулярный дефицит типа I; полигландулярный дефицит типа II (синдром Шмидта); взрослый респираторный дистресс-синдром (ARDS); алопецию; очаговую алопецию; серонегативную артропатию; артропатию; болезнь Рейтера; псориатическую артропатию; связанную с язвенным колитом артропатию; энтеропатический синовит; ассоциированную с Chlamydia, Yersinia и Salmonella артропатию; спондилоартропатию; атероматозное заболевание/артериосклероз; атопическую аллергию; аутоиммунное буллезное заболевание; пемфигус обыкновенный; листовидный пемфигус; пемфигоид; болезнь линейных IgA; аутоиммунную гемолитическую анемию; Кумбс-положительную гемолитическую анемию; приобретенную пернициозную анемию; ювенильную пернициозную анемию; миалгический энцефалит/"Royal Free Disease"; хронический кожно-слизистый кандидоз; гигантоклеточный артериит (GCA); первичный склерозирующий гепатит; криптогенный аутоиммунный гепатит; синдром приобретенного иммунодефицита (СПИД); связанные с приобретенным иммунодефицитом заболевания; гепатит B; гепатит C; вариабельный неклассифицируемый иммунодефицит (вариабельную неклассифицируемую гипогаммаглобулинемию); кардиомиопатию с дилятацией; женское бесплодие; недостаточность яичников; преждевременное угасание функции яичников; фиброзное заболевание легких; криптогенный фиброзный альвеолит; поствоспалительное интерстициального заболевание легких; интерстициальный пневмонит; связанное с болезнью соединительной ткани интерстициальное заболевание легких; ассоциированное со смешанной болезнью соединительной ткани заболевание легких; ассоциированное с системной склеродермией заболевание легких; ассоциированное с ревматоидным артритом интерстициальное заболевание легких; ассоциированное с системной красной волчанкой заболевание легких; ассоциированное с дерматомиозитом/полимиозитом заболевание легких; ассоциированное с болезнью Шегрена заболевание легких; ассоциированное с анкилозирующим спондилитом заболевание легких; васкулитное диффузное заболевание легких; ассоциированное с гемосидерозом заболевание легких; индуцированное лекарственным средством интерстициальное заболевание легких; фиброз; связанный с радиацией фиброз; облитерирующий бронхиолит; хроническую эозинофильную пневмонию; заболевание легких с инфильтрацией лимфоцитов; постинфекционное интерстециальное заболевание легких; подагрический артрит; аутоиммунный гепатит; аутоиммунный гепатит 1 типа (классический аутоиммунный или люпоидный гепатит); аутоиммунный гепатит 2 типа (гепатит, связанный с антителом против LKM); опосредуемую аутоиммунным заболеванием гипогликемию; устойчивость к инсулину типа B с акантокератодермией; гипопаратиреоз; остеоартроз; первичный склерозирующий холангит; псориаз 1 типа; псориаз 2 типа; идиопатическую лейкопению; аутоиммунную нейтропению; NOS-болезнь почек; гломерулонефрит; микроскопический васкулит почек; болезнь Лайма; дискоидную красную волчанку; идиопатическое мужское бесплодие; ассоциированное с оксидом азота мужское бесплодие; аутоиммунитет к сперматозоидам; рассеянный склероз (все подтипы, включая первично-прогрессирующий, вторично-прогрессирующий и ремитирующий); симпатическую офтальмию; легочную гипертензию, вторичную для болезни соединительной ткани; синдром Гудпасчера; легочное проявление узелкового полиартериита; острую ревматическую атаку; ревматоидный спондилит; болезнь Стилла; системную склеродермию; синдром Шегрена; болезнь/артериит Такаясу; аутоиммунную тромбоцитопению (AITP); идиопатическую тромбоцитопению; аутоиммунное заболевание щитовидной железы; гипертиреоидизм; зобный аутоиммунный гипотиреоз (болезнь Хашимото); атрофический аутоиммунный гипотиреоз; первичную микседему; факогенный увеит; первичный васкулит; витилиго; острое заболевание печени; хроническое заболевание печени; алкогольный цирроз; индуцированное алкоголем повреждение печени; холестаз; идиосинкразическое заболевание печени; индуцированный лекарственным средством гепатит; неалкогольный стеатогепатит; аллергию; стрептококковую инфекцию группы B (GBS); психические расстройства (например, депрессию и шизофрению); опосредуемые типом Th2 и типом Th1 заболевания; острую и хроническую боль (различные формы боли); и злокачественную опухоль (такую как рак легкого, молочной железы, желудка, мочевого пузыря, толстого кишечника, поджелудочной железы, яичника, предстательной железы и прямой кишки); гемопоэтические злокачественные опухоли; лейкоз; лимфому; абеталипопротеинемию; акроцианоз; острые и хронические паразитарные и инфекционные процессы; острый лейкоз; острый лимфобластный лейкоз (ALL); T-клеточный ALL; FAB ALL; острый миелоидный лейкоз (AML); острую или хроническую бактериальную инфекцию; острый панкреатит; острую почечнцю недостаточность; аденокарциному; эктопическую систолу предсердий; СПИД-дементный комплекс; индуцированный алкоголем гепатит; аллергический конъюнктивит; аллергический контактный дерматит; аллергический ринит; отторжение аллотрансплантата; дефицит альфа-1-антитрипсина; боковой амиотрофический склероз; анемию; стенокардию; дегенерацию клеток передних рогов спинного мозга; терапию против CD3; антифосфолипидный синдром; реакцию гиперчувствительности против рецепторов; аортальные и периферические аневризмы; расслоение аорты; артериальную гипертензию; артериосклероз; артериовенозный свищ; атаксию; фибрилляцию предсердий (постоянную или пароксизмальную); трепетание предсердий; атриовентрикулярную блокаду; B-клеточную лимфому; отторжение трансплантата кости; отторжение трансплантата костного мозга (BMT); блокаду пучка Гиса; лимфому Беркитта; ожоги; аритмии сердца; синдром оглушения сердца; опухоли сердца; кардиомиопатию; воспалительные ответы на искусственное кровообращение; отторжение трансплантата хряща; дегенерацию коры головного мозга; нарушения мозжечка; хаотическую или многоочаговую тахикардию предсердий; ассоциированные с химиотерапией нарушения; хронический миелоцитарный лейкоз (CML); хронический алкоголизм; хронические воспалительные патологии; хронический лимфоцитарный лейкоз (CLL); хроническое обструктивное заболевание легких (COPD); хроническую интоксикацию салицилатами; карциному ободочной и прямой кишки; застойную сердечную недостаточность; конъюнктивит; контактный дерматит; легочное сердце; болезнь коронарных артерий; болезнь Крейтцфельда-Якоба; культурально-негативный сепсис; кистозный фиброз; ассоциированные с цитокиновой терапией нарушения; деменцию боксеров; демиелинизирующие заболевания; геморрагическую лихорадку денге; дерматит; дерматологические состояния; сахарный диабет; диабетическое атеросклеротическое заболевание; диффузное заболевание с тельцами Леви; застойную кардиомиопатию с дилятацией; нарушения базальных ганглиев; синдром Дауна в среднем возрасте; двигательные нарушения, индуцированные лекарственным средством, которое блокирует дофаминовые рецепторы ЦНС; чувствительность к лекарственным средствам; экзему; энцефаломиелит; эндокардит; эндокринопатию; эпиглоттит; инфекцию вирусом Эпштейна-Барр; эритромелалгию; экстрапирамидальные и мозжечковые нарушения; семейный гематофагоцитарный лимфогистиоцитоз; отторжение имплантата эмбрионального тимуса; наследственную атаксию Фридрейха; функциональные нарушения периферических артерий; грибковый сепсис; газовую гангрену; язву желудка; гломерулонефрит; отторжение трансплантата любого органа или ткани; грамотрицательный сепсис; грамположительный сепсис; гранулемы вследствие внутриклеточных организмов; волосатоклеточный лейкоз; болезнь Галлервордена-Шпатца; тиреоидит Хашимото; сенную лихорадку; отторжение трансплантата сердца; гемахроматоз; гемодиализ; гемолитический уремический синдром/тромболитическую тромбоцитопеническую пурпуру; кровопотерю; гепатит A; аритмию пучка Гиса; ВИЧ-инфекцию/ВИЧ-невропатию; болезнь Ходжкина; гиперкинетические двигательные нарушения; реакции гиперчувствительности; связанный с гиперчувствительностью пневмонит; гипертензию; гипокинетические двигательные нарушения; обследование гипоталамо-гипофизарно-надпочечниковой системы; идиопатическую болезнь Аддисона; идиопатический фиброз легких (IPF); опосредуемую антителами цитотоксичность; астению; младенческую спинальную мышечную атрофию; воспаление аорты; вирус гриппа a; облучение ионизирующей радиацией; иридоциклит/увеит/оптический неврит; повреждение при ишемии-реперфузии; ишемический инсульт; ювенильный ревматоидный артрит; ювенильную спинальную мышечную атрофию; саркому Капоши; отторжение трансплантата почки; легионеллез; лейшманиоз; лепру; повреждения кортикоспинальной системы; жировой отек; отторжение трансплантата печени; лимфатический отек; малярию; злокачественную лимфому; злокачественный гистиоцитоз; злокачественную меланому; менингит; менингококкемию; метаболический синдром; мигрень; идиопатическую мигрень; митохондриальное полисистемное нарушение; смешанную болезни соединительной ткани; моноклональную гаммапатию; множественную миелому; полисистемную дегенерацию (Менцеля, Дежерина-Тома, Шая-Дрейджера и Мачадо-Джозефа); миастению; внутриклеточные mycobacterium avium, mycobacterium tuberculosis; миелодиспластический синдром; инфаркт миокарда; ишемические нарушения миокарда; карциному носоглотки; хроническое заболевание легких новорожденных; нефрит; нефроз; нейродегенеративные заболевания; нейрогенные мышечные атрофии I; нейтропеническую лихорадку; неходжкинские лимфомы; окклюзию брюшного отдела аорты и ее ветвей; окклюзионные нарушения артерий; терапию OKT3®; орхит/эпидидимит; орхит/возвратные процедуры после вазэктомии; органомегалию; остеопороз; отторжение трансплантата поджелудочной железы; карциному поджелудочной железы; паранеопластический синдром/гиперкальцемию при злокачественной опухоли; отторжение трансплантата паращитовидной железы; воспалительное заболевание органов таза; круглогодичный ринит; заболевание перикарда; периферическое артериосклеротическое заболевание; периферические сосудистые нарушения; перитонит; пернициозную анемию; пневмонию Pneumocystis carinii; пневмонию; синдром POEMS (полиневропатия, органомегалия, эндокринопатия, моноклональная гаммапатия и синдром кожных изменений); постперфузионний синдром; синдром после искусственного кровообращения; посткардиотомный синдром после инфаркта миокарда; преэклампсию; прогрессирующий супрануклеарный паралич; первичную гипертензию легких; лучевую терапию; феномен Рейно; болезнь Рейно; болезнь Рефсума; регулярную тахикардию с узким QRS; вазоренальную гипертензию; реперфузионное повреждение; рестриктивную кардиомиопатию; саркомы; сенильную хорею; сенильную деменцию с тельцами Леви; серонегативные артропатии; шок; серповидноклеточную анемию; отторжение аллотрансплантата кожи; синдром кожных изменений; отторжение трансплантата тонкого кишечника; солидные опухоли; специфические аритмии; спинальную атаксию; спиномозжечковые дегенерации; стрептококковый миозит; структурные повреждения мозжечка; подострый склерозирующий панэнцефалит; обмороки; сифилис сердечно-сосудистой системы; системную анафилаксию; синдром системного воспалительного ответа; ювенильный ревматоидный артрит с системным началом; телеангиэктазию; облитерирующий тромбоангита; тромбоцитопению; токсичность; трансплантацию; травму/кровопотерю; реакции гиперчувствительности типа III, гиперчувствительности типа IV; нестабильную стенокардию; уремию; уросепсис; крапивницу; заболевания клапанов сердца; варикоз вен; васкулит; заболевания вен; венозный тромбоз; фибрилляцию желудочков; вирусные и грибковые инфекции; энцефалит с высоким риском смертельного исхода/асептический менингит; гемофагоцитарный синдром с высоким риском смертельного исхода; синдром Вернике-Корсакова; болезнь Вилсона; отторжение ксенотрансплантата любого органа или ткани; острый коронарный синдром; острый идиопатический полиневрит; острую воспалительную демиелинизирующую полирадикулоневропатию; острую ишемию; болезнь Стилла взрослых; очаговую алопецию; анафилаксию; синдром антифосфолипидных антител; апластическую анемию; артериосклероз; атопическую экзему; атопический дерматит; аутоиммунный дерматит; аутоиммунное нарушение, ассоциированное со стрептококковой инфекцией; аутоиммунную энтеропатию; аутоиммунную потерю слуха; аутоиммунный лимфопролиферативный синдром (ALPS); аутоиммунный миокардит; аутоиммунное преждевременное угасание функции яичников; блефарит; бронхоэктазы; буллезный пемфигоид; сердечно-сосудистое заболевание; катастрофический антифосфолипидный синдром; глютеиновую болезнь; шейный спондилез; хроническую ишемию; рубцовый пемфигоид; клинически изолированный синдром (CIS) с риском рассеянного склероза; конъюнктивит; психиатрическое нарушение с началом в детском возрасте; дакриоцистит; дерматомиозит; диабетическую ретинопатию; грыжу межпозвоночного диска; пролапс межпозвоночного диска; индуцированную лекарственным средством иммунную гемолитическую анемию; эндокардит; эндометриоз; эндофтальмит; эписклерит; полиформную эритему; тяжелую полиформную эритему; гестационный пемфигоид; синдром Гийена-Барре (GBS); сенную лихорадку; синдром Хьюза; идиопатическую болезнь Паркинсона; идиопатическую интерстициальную пневмонию; опосредуемую IgE аллергию; иммунную гемолитическую анемию; миозит с тельцами включения; инфекционное воспалительное заболевание глаз; воспалительное демиелинизирующее заболевание; воспалительное заболевание сердца; воспалительное заболевание почек; ирит; кератит; сухой кератоконъюнктивит; болезнь Куссмауля или болезнь Куссмауля-Мейера; паралич Ландри; гистиоцитоз клеток Лангерганса; гроздевидную кожу; дегенерацию желтого пятна; микроскопический полиангиит; болезнь Бехтерева; нарушения двигательных нейронов; пемфигоид слизистых оболочек; полиорганную недостаточность; миастению; миелодиспластический синдром; миокардит; нарушения корешков нервов; невропатию; не-A не-B гепатит; оптический неврит; остеолизис; олигоартикулярный JRA; окклюзионое заболевание периферических артерий (PAOD); заболевание периферических сосудов (PVD); заболевание периферических артерий (PAD); флебит; узелковый полиартериит (или нодозный полиартериит); полихондрит; ревматическую полимиалгию; полиоз; полиартикулярный JRA; синдром полиэндокринной недостаточности; полимиозит; ревматическую полимиалгию (PMR); синдром после искусственного кровообращения; первичный паркинсонизм; вторичный паркинсонизм; простатит; истинную эритроцитарную аплазию; первичную недостаточность надпочечников; рецидивирующий оптический нейромиелит; рестеноз; ревматическую болезнь сердца; SAPHO (синовит, угри, пустулез, гиперостоз и остеит); вторичный амилоидоз; шоковое легкое; склерит; ишиас; вторичную недостаточность надпочечников; ассоциированное с кремнийорганическими соединениями заболевание соединительных тканей; дерматоз Снеддона-Уилкинсона; анкилозирующий спондилит; синдром Стивенса-Джонсона (SJS); синдром системного воспалительного ответа; височный артериит; токсоплазменный ретинит; токсический эпидермальный некролиз; поперечный миелит; TRAPS (периодический синдром, ассоциированный с рецептором 1 фактора некроза опухоли (TNFR)); резистентность к инсулину типа B с черным акантозом; аллергическую реакцию 1 типа; диабет типа II; крапивницу; обычную интерстициальную пневмонию (UIP); весенний конъюнктивит; вирусный ретинит; синдром Фогта-Коянаги-Харада (синдром VKH); влажную дегенерацию желтого пятна; заживление ран; ассоциированную с Yersinia и Salmonella артропатию.
Связывающие белки по изобретению можно применять для лечения людей, страдающих аутоиммунными заболеваниями, в частности ассоциированными с воспалением аутоиммунными заболеваниями, ревматоидным артритом (RA), остеоартритом, псориазом, рассеянным склерозом (MS) и другими аутоиммунными заболеваниями.
Антитело или часть антитела по изобретению также можно вводить с одним или несколькими дополнительными лекарственными средствами, пригодными для лечения аутоиммунных и воспалительных заболеваний.
В одном из вариантов осуществления заболевания, которые можно лечить или диагностировать с помощью композиций и способов по изобретению, включают, но не ограничиваются ими, первичные и метастазирующие злокачественные опухоли, включая карциномы молочной железы, толстого кишечника, прямой кишки, легкого, ротоглотки, гортанной части глотки, пищевода, желудка, поджелудочной железы, печени, желчного пузыря и желчных протоков, тонкого кишечника, мочевыводящих путей (включая почку, мочевой пузырь и уротелий), женских половых путей (включая шейку матки, матку и яичники, а также хориокарциному и гестационное трофобластное заболевание), мужских половых путей (включая опухоли предстательной железы, семенных пузырьков, яичек и половых клеток), эндокринных желез (включая щитовидную железу, надпочечники и гипофиз), и кожи, а также гемангиомы, меланомы, саркомы (включая саркомы из кости и мягких тканей, а также саркому Капоши), опухоли головного мозга, нервов, глаз и мягких мозговых оболочек (включая астроцитомы, глиомы, глиобластомы, ретинобластомы, нейромы, нейробластомы, шванномы и менингиомы), солидные опухоли из гемопоэтических злокачественных опухолей, таких как лейкозы и лимфомы (как ходжкинская, так и неходжскинская лимфомы).
В одном из вариантов осуществления антитела по изобретению или их антигенсвязывающие части используют для лечения злокачественной опухоли или для профилактики метастазов опухолей. Такое лечение может вовлекать введение антитела или его антигенсвязыващей части отдельно или в комбинации с другим терапевтическим средством или способом лечения, такими как лучевая терапия и/или химиотерапевтическое средство.
Антитела по изобретению или их антигенсвязывающие части можно комбинировать со средствами, которые включают, но не ограничиваются ими, антинеопластические средства, лучевую терапию, химиотерапию, такую как алкилирующие ДНК средства, цисплатин, карбоплатин, антитубулиновые средства, паклитаксел, доцетаксел, таксол, доксорубицин, гемцитабин, гемзар, антрациклины, адриамицин, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, 5-фторурацил (5-FU), лейковорин, иринотекан, ингибиторы рецепторных тирозинкиназ (например, эрлотиниб, гефитиниб), ингибиторы COX-2 (например, целекоксиб), ингибиторы киназ и siRNA.
Связывающий белок по изобретению также можно вводить с одним или несколькими терапевтическими средствами, пригодными для лечения различных заболеваний.
Антитела по изобретению или их антигенсвязывающие части можно использовать для лечения таких заболеваний отдельно или в комбинации. Следует понимать, что антитела по изобретению или их антигенсвязывающие части можно использовать отдельно или в комбинации с дополнительным средством, например лекарственным средством, причем дополнительное средство выбирает квалифицированный специалист для предполагаемой цели. Например, дополнительное средство может представлять собой лекарственное средство, признанное в данной области в качестве пригодного для лечения заболевания или состояния, подвергаемого лечению антителом по настоящему изобретению. Дополнительное средство также может представлять собой средство, которое придает полезное свойство терапевтической композиции, например, средство, которое влияет на вязкость композиции.
Кроме того, следует понимать, что комбинации, которые подлежат включению в это изобретение, представляют собой комбинации, пригодные для предполагаемой для них цели. Средства, указанные иже, представлены для иллюстративных целей и не предназначены для ограничения. Комбинации, которые являются частью этого изобретения, могут представлять собой антитела по настоящему изобретению и по меньшей мере одно дополнительное средство, выбранное из списков, приведенных ниже. Также комбинация может включать более одного дополнительного средства, например, два или три дополнительных средства, если комбинация является такой, что образованная композиция может выполнять предполагаемую для нее функцию.
Предпочтительными комбинируемыми средствами является нестероидное противовоспалительное средство(а), также обозначаемое NSAID, которое включает лекарственные средства, такие как ибупрофен. Другими комбинируемыми средствами являются кортикостероиды, включая преднизолон; хорошо известные побочные эффекты применения стероидов могут быть снижены или даже устранены снижением требуемой дозы стероидов при лечении ими пациентов в комбинации с антителами против IL-1β по этому изобретению. Неограничивающие примеры лекарственных средств от ревматоидного артрита, с которыми можно комбинировать антитело, или часть антитела, по изобретению, включают следующие средства: цитокин-супрессивное противовоспалительное лекарственное средство(а) (CSAID); антитела, или антагонисты, к другим цитокинам или факторам роста человека, например, к TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, интерфероны, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие части можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, или их лигандам, включая CD154 (gp39 или CD40L).
Предпочтительные комбинации лекарственных средств могут препятствовать на различных этапах аутоиммунному и последующему воспалительному каскаду; их предпочтительные примеры включают антагонисты TNF, такие как химерные, гуманизированные или человеческие антитела против TNF, D2E7 (публикация PCT № WO 97/29131), CA2 (RemicadeTM), CDP 571, и растворимые рецепторы p55 или p75 TNF, их производные (p75TNFR1gG (EnbrelTM) или p55TNFR1gG (Lenercept), и также ингибиторы TNFα-превращающего фермента (TACE); аналогично могут быть эффективны ингибиторы IL-1 (ингибиторы интерлейкин-1-превращающего фермента, IL-1RA и т.д.) по той же причине. Другие предпочтительные комбинируемые средства включают интерлейкин-11. Другими предпочтительными комбинируемыми средствами являются другие ключевые участники аутоиммунного ответа, которые могут действовать параллельно, в зависимости или согласованно с функцией IL-1β. Другими предпочтительными комбинируемыми средствами являются неистощающие ингибиторы CD4. Другие предпочтительные комбинируемые средства включают антагонисты комтимуляторного каскада CD80 (B7.1) или CD86 (B7.2), включая антитела, растворимые рецепторы или антагонистические лиганды.
Антитела по изобретению или их антигенсвязывающие части также можно комбинировать со средствами, такими как метотрексат, 6-MP, азатиоприн, сульфасалазин, месалазин, олсалазин, хлорхинин/гидроксихлороквин, реницилламин, ауротиомалат (внутримышечный и пероральный), азатиоприн, колхицин, кортикостероиды (пероарльные, ингалируемые и локальная инъекция), агонисты бета-2-адренорецепторов (салбутамол, тербуталин, салметерал), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропиум и окситроопиум, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента, ингибиторы TNFα-превращающего фермента (TACE), ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназ, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы p55 или p75 TNF и производные p75TNFRIgG (EnbrelTM) и p55TNFRIgG (Lenercept), sIL-1RI, sIL-1RII, sIL-6R), противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ), целекоксиб, фолиевая кислота, гидроксихлороквин сульфат, рофекоксиб, этанерцепт, инфликсимаб, напроксен, вальдекоксиб, сульфасалазин, метилпреднизолон, мелоксикам, метилпреднизолон ацетат, золота натрия тиомалат, аспирин, триамцинолона ацетонид, пропоксифена напсилат/apap, фолат, набуметон, диклофенак, пироксикам, этодолак, диклофенак натрия, оксапрозин, оксикодон hcl, гидрокодона битартрат/apap, диклофенак натрия/мизопростол, фентанил, анакинра, человеческий рекомбинантный, трамадол hcl, салсалат, сулиндак, цианкобаламин/fa/пиридоксин, ацетаминофен, алендронат натрий, преднизолон, морфина сульфат, лидокаина гидрохлорид, индометацин, глюкозамин сульфат/хондроитин, амитриптилин hcl, сульфадиазин, оксикодон hcl/ацетаминофен, олопатадин hcl, мизопростол, напроксен натрия, омепразол, циклофосфамид, ритуксимаб, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, антитело против IL-18, антитело против IL15, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, рофлумиласт, IC-485, CDC-801 и мезапрам. Предпочтительные комбинируемые средства включают метотрексат или лефлуномид и, в случаях умеренного или тяжелого ревматоидного артрита, циклоспорин.
Неограничивающие дополнительные средства, которые также можно использовать в комбинации со связывающим белком для лечения ревматоидного артрита (RA) включают, но не ограничиваются ими, следующие средства: нестероидное противовоспалительное средство(а) (NSAID); цитокин-супрессивное противовоспалительное лекарственное средство(а) (CSAID); CDP-571/BAY-10-3356 (гуманизированное антитело против TNFα антитело; Celltech/Bayer); cA2/инфликсимаб (химерное антитело против TNFα; Centocor); 75 kd TNFR-IgG/этанерцепт (слитый белок рецептор TNF-IgG массой 75 кДа; Immunex; см. например, Moreland et al. (Abstract No. 813), Arthritis Rheum., 37: S295 (1994); Baumgartner et al., Invest. Med., 44(3): 235A (март 1996 года); 55 kdTNF-IgG (слитый белок рецептор TNF-IgG массой 55 кДа; Hoffmann-LaRoche); IDEC-CE9.1/SB 210396 (неистощающее приматизированное антитело против CD4; IDEC/SmithKline; см. например, Kaine et al. (Abstract No. 195), Arthritis Rheum., 38: S185 (1995)); DAB 486-IL-2 и/или DAB 389-IL-2 (слитые белки IL-2; Seragen; см. например, Sewell et al., Arthritis Rheum., 36(9): 1223-1233 (сентябрь 1993 года)); антитело против Tac (гуманизированное антитело против IL-2Rα; Protein Design Labs/Roche); IL-4 (противовоспалительный цитокин; DNAX/Schering); IL-10 (SCH 52000; рекомбинантный IL-10, противовоспалительный цитокин; DNAX/Schering); IL-4; агонисты IL-10 и/или IL-4 (например, агонистические антитела); IL-1RA (антагонист рецептора IL-1; Synergen/Amgen); анакинра (Kineret®/Amgen); TNF-bp/s-TNF (растворимый связывающий TNF белок; см., например, Evans et al. (Abstract No. 1540), Arthritis Rheum., 39(9)(supplement): S284 (1996)); Kapadia et al., Amer. J. Physiol. - Heart and Circulatory Physiology, 268: H517-H525 (1995)); RP73401 (ингибитор фосфодиэстеразы типа IV; см., например, Chikanza et al. (Abstract No. 1527), Arthritis Rheum., 39(9)(supplement): S282 (1996)); MK-966 (ингибитор COX-2; см. например, Erich et al. (Abstract No. 328 and 329), Arthritis Rheum., 39(9)(supplement): S81 (1996)); илопрост (см. например, Scholz, P. (Abstract No. 336), Arthritis Rheum., 39(9) (supplement): S82 (1996)); метотрексат; талидомид (см., например, Lee et al. (Abstract No. 1524), Arthritis Rheum., 39(9)(supplement): S282 (1996)) и родственные талидомиду лекарственные средства (например, Celgen); лефлуномид (противовоспалительное средство и ингибитор цитокинов; см. например, Finnegan et al. (Abstract No. 627), Arthritis Rheum., 39(9)(supplement): S131 (1996)); Thoss et al., Inflamm. Res., 45: 103-107 (1996)); транексамовая кислота (ингибитор активации плазминогена; см., например, Ronday et al. (Abstract No. 1541), Arthritis Rheum., 39(9)(supplement): S284 (1996)); T-614 (ингибитор цитокином; см. например, Hara et al. (Abstract No. 1526), Arthritis Rheum., 39(9)(supplement): S282 (1996)); простагландин E1 (см. например, Moriuchi et al. (Abstract No. 1528), Arthritis Rheum., 39(9)(supplement): S282 (1996)); тенидап (нестероидное противовоспалительное средство; см. например, Guttadauria, M. (Abstract No. 1516), Arthritis Rheum., 39(9)(supplement): S280 (1996)); Напроксен (нестероидное противовоспалительное средство; см. например, Fiebich et al., Neuro Report, 7: 1209-1213 (1996)); мелоксикам (нестероидное противовоспалительное средство); ибупрофен (нестероидное противовоспалительное средство); пироксикам (нестероидное противовоспалительное средство); диклофенак (нестероидное противовоспалительное средство); индометацин (нестероидное противовоспалительное средство); сульфасалазин (см. например, Farr et al. (Abstract No. 1519), Arthritis Rheum., 39(9)(supplement): S281 (1996)); азатиоприн (см. например, Hickey et al. (Abstract No. 1521), Arthritis Rheum., 39(9)(supplement): S281 (1996)); ингибитор ICE (ингибитор фермент интерлейкин-1β-конвертирующего фермента); ингибитор zap-70 и/или lck (ингибитор тирозинкиназы zap-70 или lck); ингибитор VEGF и/или ингибитор VEGF-R (ингибиторы сосудисто-эндотелиального фактора роста клеток или рецептора сосудисто-эндотелиального фактора роста клеток; ингибиторы ангиогенеза); кортикостероидные противовоспалительные лекарственные средства (например SB203580); ингибиторы TNF-конвертазы; антитела против IL-12; антитела против IL-18; интерлейкин-11 (см. например, Keith Jr. et al. (Abstract No. 1613), Arthritis Rheum., 39(9)(supplement): S296 (1996)); интерлейкин-13 (см. например, Bessis et al. (Abstract No. 1681), Arthritis Rheum., 39(9)(supplement): S308 (1996)); ингибиторы интерлейкина-17 (см. например, Lotz et al. (Abstract No. 559), Arthritis Rheum., 39(9)(supplement): S120 (1996)); золото; пеницилламин; хлороквин; хлорамбуцил; гидроксихлороквин; циклоспорин; циклофосфамид; тотальное облучение лимфоидных органов; антитимоцитарный глобулин; антитела против CD4; CD5-токсины; перорально вводимые пептиды и коллаген; лобензарит динатрия; цитокин-регулирующие средства (CRA) HP228 и HP466 (Houghten Pharmaceuticals, Inc.); антисмысловые фосфоротиоатные олигодезоксинуклеотиды для ICAM-1 (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый рецептор 1 комплемента (TP10; T Cell Sciences, Inc.); преднизон; орготеин; гликозаминогликана полисульфат; миноциклин; антитела против IL2R; липиды морских животных и ботанические липиды (такие как жирные кислоты рыб и семян растений; см. например, DeLuca et al. Rheum. Dis. Clin. North Am. 21:759-777 (1995)); ауранофин; фенилбутазон; меклофенаминовая кислота; флуфенаминовая кислота; внутривенный иммуноглобулин; зилеутон; азарибин; микофеноловая кислота (RS-61443); такролимус (FK-506); сиролимус (рапамицин); амиприлоза (терафектин); кладрибин (2-хлордезоксиаденозин); метотрексат; ингибиторы bcl-2 (см. Bruncko, Milan et al., J. Med. Chem., 50(4), 641-662 (2007)); противовирусные и иммуномодулирующие средства.
В одном из вариантов осуществления связывающий белок или его антигенсвязывающую часть, вводят в комбинации с одним из следующих средств для лечения ревматоидного артрита (RA): низкомолекулярный ингибитор KDR, низкомолекулярный ингибитор Tie-2; метотрексат; преднизон; целекоксиб; фолиевая кислота; гидроксихлороквина сульфат; рофекоксиб; этанерцепт; инфликсимаб; лефлуномид; напроксен; вальдекоксиб; сульфасалазин; метилпреднизолон; ибупрофен; мелоксикам; метилпреднизолона ацетат; золота натрия тиомалат; аспирин; азатиоприн; триамцинолона ацетонид; пропоксифена напсилат/apap; фолат; набуметон; диклофенак; пироксикам; этодолак; диклофенак натрия; оксапрозин; оксикодон hcl; гидрокодона битартрат/apap; диклофенак натрия/мизопростол; фентанил; анакинра, человеческий рекомбинантный; трамадол hcl; салсалат; сулиндак; цианкобаламин/fa/пиридоксин; ацетаминофен; алендронат натрий; преднизолон; морфина сульфат; лидокаина гидрохлорид; индометацин; глюкозамина сульфат/хондроитин; циклоспорин; амитриптилин hcl; сульфадиазин; оксикодон hcl/ацетаминофен; олопатадин hcl; мизопростол; напроксен натрия; омепразол; микофенолата мофетил; циклофосфамид; ритуксимаб; IL-1 TRAP; MRA; CTLA4-IG; IL-18 BP; IL-12/23; антитело против IL-18; антитело против IL-15; BIRB-796; SCIO-469; VX-702; AMG-548; VX-740; рофлумиласт; IC-485; CDC-801 и мезапрам.
Неограничивающие примеры лекарственных средств от воспалительного заболевания кишечника, с которыми можно комбинировать связывающий белок по изобретению, включают следующие лекарственные средства: буденозид; эпидермальный фактор роста; кортикостероиды; циклоспорин, сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы лиооксигеназы; месаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты рецептора IL-1; mAb против IL-1β; mAb против IL-6; факторы роста; ингибиторы эластазы; пиридинил-имидазольные соединения; антитела к, или антагонисты, другим цитокинам человека или факторам роста, например, к TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-17, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению, или их антигенсвязывающие части, можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лиганды. Антитела по изобретению, или их антигенсвязывающие части, также можно комбинировать со средствами, такими как метотрексат, циклоспорин, FK506, рапамицин, микофенолат мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназ), ингибиторы IL-1β-превращающего фермента, ингибиторы TNFα-превращающего фермента, ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназ, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы p55 или p75 TNF, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ) и ингибиторы bcl-2.
Примеры лекарственных средств от болезни Крона, с которыми можно комбинировать связывающий белок, включают следующие средства: антагонисты TNF, например, антитела против TNF, Adalimumab (публикация PCT № WO 97/29131; HUMIRA®), cA2 (REMICADE), CDP 571, конструкции TNFR-Ig (p75TNFRIgG (ENBREL®) и p55TNFRIgG (LENERCEPTTM)) и ингибиторы PDE4. Антитела по изобретению, или их антигенсвязывающие части, можно комбинировать с кортикостероидами, например, буденозидом и дексаметазоном. Также антитела можно комбинировать со средствами, такими как сульфасалазин, 5-аминосалициловая кислота и олсалазин, и средствами, которые препятствуют синтезу или действию провоспалительных цитокинов, таких как IL-1, например, ингибиторами IL-1β-превращающего фермента и IL-1ra. Антитела по изобретению также можно использовать с ингибиторами T-клеточной передачи сигнала, например, ингибиторами тирозинкиназы 6-меркаптопуринами. Антитела или их антигенсвязывающие части можно комбинировать с IL-11. Связывающие белки по изобретению, или их антигенсвязывающие части, можно комбинировать с мезаламином, преднизоном, азатиоприном, меркаптопурином, инфликсимабом, метилпреднизолона натрия сукцинатом, дифеноксилатом/атропина сульфатом, лоперамида гидрохлоридом, метотрексатом, омепразолом, фолатом, ципрофлоксацином/водным раствором декстрозы, гидрокодона битартратом/apap, тетрациклина гидрохлоридом, флуоционидом, метронидазолом, тимеросалом/борной кислотой, холестирамином/сахарозой, ципрофлоксацина гидрохлоридом, хиосциамина сульфатом, меперидина гидрохлоридом, мидазолама гидрохлоридом, оксикодоном hcl/ацетаминофеном, прометазина гидрохлоридом, фосфатом натрия, сульфаметоксазолом/триметопримом, целекоксибом, поликарбофилом, пропоксифена напсилатом, гидрокортизоном, мультивитаминами, балсалазидом динатрия, кодеина фосфатом/apap, колесевеламом hcl, цианкобаламином, фолиевой кислотой, левофлоксацином, метилпреднизолоном, натализумабом и интерфероном-гамма.
Неограничивающие примеры лекарственных средств от рассеянного склероза, с которыми можно комбинировать связывающие белки по изобретению, включают следующие лекарственные средства: кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; метотрексат; 4-аминопиридин; тизанидин; интерферон-β1a (AVONEX; Biogen); интерферон-β1b (BETASERON; Chiron/Berlex); интерферон α-n3 (Interferon Sciences/Fujimoto), интерферон-α (Alfa Wassermann/J&J), интерферон-β1A-IF (Serono/Inhale Therapeutics), пегинтерферон-α2b (Enzon/Schering-Plough), сополимер 1 (Cop-1; COPAXONE; Teva Pharmaceutical Industries, Inc.); гипербарический кислород; внутривенный иммуноглобулин; кладрибин; антитела, или антагонисты, к другим цитокинам человека или факторам роста, например, к TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-23, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Связывающие белки по изобретению можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лигандам. Связывающие белки по изобретению также можно комбинировать со средствами, такими как метотрексат, циклоспорин, FK506, рапамицин, микофенолата мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β-превращающего фермента, ингибиторы TACE, ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензинпревращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы p55 или p75 TNF, sIL-1RI, sIL-1RII, sIL-6R) противовоспалительные цитокины (например, IL-4, IL-10, IL-13 и TGFβ) и ингибиторы bcl-2.
Примеры лекарственных средств от рассеянного склероза, с которыми можно комбинировать связывающие белки по изобретению, включают интерферон-β, например, IFNβ1a и IFNβ1b; копаксон, кортикостероиды, ингибиторы каспаз, например, ингибиторы каспазы-1, ингибиторы IL-1, ингибиторы TNF и антитела к лиганду CD40 и CD80.
Связывающие белки по изобретению также можно комбинировать с такими средствами, как алемтузумаб, дронабинол, Unimed, даклизумаб, митоксантрон, ксалипродена гидрохлорид, фампридин, глатирамера ацетат, натализумаб, синнабидол, a-иммунокин NNSO3, ABR-215062, AnergiX.MS, антагонисты рецепторов хемокинов, BBR-2778, калагуалин, CPI-1189, LEM (инкапсулированный в липосомы митоксантрон), THC.CBD (каннабиноидный агонист) MBP-8298, мезапрам (ингибитор PDE4), MNA-715, антитело против рецептора IL-6, нейровакс, пирфенидон allotrap 1258 (RDP-1258), sTNF-R1, талампанел, терифлуномид, TGF-бета2, типлимотид, антагонисты VLA-4 (например, TR-14035, VLA4 Ultrahaler, Antegran-ELAN/Biogen), антагонисты интерферона-гамма, агонисты IL-4.
Неограничивающие примеры лекарственных средств от стенокардии, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: аспирин, нитроглицерин, изосорбита мононитрат, метопролола сукцинат, атенолол, метопролола тартрат, амлодипина безилат, дилтиазема гидрохлорид, изосорбита динитрат, клопидогрела бисульфат, нифедипин, аторвастатин кальция, хлорид калия, фуросемид, симвастатин, верапамил hcl, дигоксин, пропранолола гидрохлорид, карведилол, лизиноприл, спиронолактон, гидрохлортиазид, эналаприла малеат, надолол, рамиприл, эноксапарин натрия, гепарин натрия, валсартан, соталола гидрохлорид, фенофибрат, эзетимиб, буметанид, лозартан калия, лизиноприл/гидрохлортиазид, фелодипин, каптоприл, бизопролола фумарат.
Неограничивающие примеры лекарственных средств от анкилозирующего спондилита, с которым можно комбинировать связывающие белки по изобретению, включают следующие: ибупрофен, диклофенак и мизопростол, напроксен, мелоксикам, индометацин, диклофенак, целекоксиб, рофекоксиб, сульфасалазин, метотрексат, азатиоприн, миноциклин, преднизон, этанерцепт, инфликсимаб.
Неограничивающие примеры лекарственных средств от астмы, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: альбутерол, сальметерол/флукатизон, монтелукаст натрия, флукатизона пропионат, будезонид, преднизон, сальметерола ксинафоат, левальбутерол hcl, альбутерола сульфат/ипратропиум, преднизолона натрия фосфат, триамцинолона ацетонид, беклометазона дипропионат, ипратропиума бромид, азитромицин, пиребутерола ацетат, преднизолон, безводный теофиллин, метилпреднизолона натрия сукцинат, кларитромицин, зафирлукаст, формотерола фумарат, вакцина против вируса гриппа, метилпреднизолон, амоксициллина тригидрат, флунизолид, противоаллергическая инъекция, кромолин натрия, фексофенадина гидрохлорид, флунизолид/ментол, амоксициллин/клавуланат, левофлоксацин, вспомогательное устройство для ингалятора, гуайфенезин, дексаметазона натрия фосфат, моксифлоксацин hcl, доксицилина гиклат, гуайфенезин/d-меторфан, п-эфедрин/cod/хлорфенир, гатифлоксацин, цетиразина гидрохлорид, мометазона фуроат, сальметерола ксинафоат, бензонатат, цефалексин, pe/гидрокодон/хлорфенир, цетиразин hcl/псевдоэфед, фенилэфрин/cod/прометазин, кодеин/прометазин, цефпрозил, дексаметазон, гуайфенезин/псевдоэфедрин, хлорфенирамин/гидрокодон, недокромил натрия, тербуталина сульфат, адреналин, метилпреднизолон, метапротеренола сульфат.
Неограничивающие примеры лекарственных средств от COPD, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: альбутерола сульфат/ипратропиум, ипратропиума бромид, сальметерол/флукатизон, альбутерол, сальметерола ксинафоат, флукатизона пропионат, преднизон, безводный теофиллин, метилпреднизолона натрия сукцинат, монтелукаст натрия, будезонид, формотерола фумарат, триамцинолона ацетонид, левофлоксацин, гуайфенезин, азитромицин, беклометазона дипропионат, левальбутерол hcl, флунизолид, цефтриаксон натрия, амоксициллина тригидрат, гатифлоксацин, зафирлукаст, амоксициллин/клавуланат, флунизолид/ментол, хлорфенирамин/гидрокодон, метапротеренола сульфат, метилпреднизолон, мометазона фуроат, п-эфедрин/cod/хлорфенир, пиребутерола ацетат, п-эфедрин/лоратидин, тербуталина сульфат, тиотропиум бромид, (R,R)-формотерол, TgAAT, циломиласт, рофлумиласт.
Неограничивающие примеры лекарственных средств от HCV, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: интерферон-альфа-2a, интерферон-альфа-2b, интерферон-альфа conl, интерферон-альфа-n1, пегилированынй интерферон-альфа-2a, пегилированный интерферон-альфа-2b, рибавирин, пегинтерферон-альфа 2b+рибавирин, урсодезоксихолевая кислота, глицирризиновая кислота, тималфазин, максамин, VX-497 и любые соединения, которые используют для лечения HCV путем воздействия на следующие мишени: полимераза HCV, протеаза HCV, хеликаза, HCV IRES (внутренний сайт связывания рибосомы).
Неограничивающие примеры лекарственных средств от идиопатического легочного фиброза, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: преднизон, азатиоприн, альбутерол, колхицин, альбутерола сульфат, дигоксин, гамма-интерферон, метилпреднизолона натрия сукцинат, лоразепам, фуросемид, лизиноприл, нитроглицерин, спиронолактон, циклофосфамид, ипратропиума бромид, актиномицин d, альтеплаза, флукатизон пропионат, левофлоксацин, метапротеренола сульфат, морфина сульфат, оксикодон hcl, хлорид калия, триамцинолона ацетонид, безводный такролимус, кальций, интерферон-альфа, метотрексат, микофенолата мофетил, интерферон-гамма-1β.
Неограничивающие примеры лекарственных средств от инфаркта миокарда, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: аспирин, нитроглицерин, метопролола тартрат, эноксапарин натрия, гепарин натрия, клопидогрела бисульфат, карведилол, атенолол, морфина сульфат, метопролола сукцинат, варфарин натрия, лизиноприл, изосорбита мононитрат, дигоксин, фуросемид, симвастатин, рамиприл, тенектеплаза, эналаприла малеат, торсемид, ретаваза, лозартан калия, квинаприл hcl/карбонат магния, буметанид, альтеплаза, эналаприлат, амиодарона гидрохлорид, тирофибан hcl м-гидрат, дилтиазема гидрохлорид, каптоприл, ирбесартан, валсартан, пропранолола гидрохлорид, фосиноприл натрия, лидокаина гидрохлорид, эптифибатид, цефазолин натрия, атропина сульфат, аминокапроновая кислота, спиронолактон, интерферон, соталола гидрохлорид, хлорид калия, докузат натрия, добутамин hcl, альпразолам, правастатин натрия, аторвастатин кальция, мидазолама гидрохлорид, меперидина гидрохлорид, изосорбита динитрат, адреналин, дофамина гидрохлорид, бивалирудин, розувастатин, эзетимиб/симвастатин, авасимиб, карипорид.
Неограничивающие примеры лекарственных средств от псориаза, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: низкомолекулярный ингибитор KDR, низкомолекулярный ингибитор Tie-2, кальципотриен, клобетазола пропионат, триамцинолона ацетонид, галобетазола пропионат, тазаротен, метотрексат, флуоционид, бетаметазона дипропионат усиленный, флуоцинолона ацетонид, ацитретин, шампунь с дегтем, бетаметазона валерат, мометазона фуроат, кетоконазол, прамоксин/флуоцинолон, гидрокортизона валерат, флурандренолид, мочевина, бетаметазон, клобетазола пропионат/emoll, флукатизона пропионат, азитромицин, гидрокортизон, увлажняющий состав, фолиевая кислота, дезонид, пимекролимус, каменноугольный деготь, дифлоразона диацетат, этанерцепта фолат, молочная кислота, метоксален, hc/bismuth subgal/znox/resor, метилпреднизолона ацетат, преднизон, солнцезащитный крем, галцинонид, салициловая кислота, антралин, клокортолона пивалат, угольный экстракт, каменноугольный деготь/салициловая кислота, каменноугольный деготь/салициловая кислота/сера, дезоксиметазон, диазепам, смягчитель, флуоционид/смягчитель, минеральное масло/касторовое масло/na lact, минеральное масло/арахисовое масло, вазелин/изопропилмиристат, псорален, салициловая кислота, мыло/трибромсалан, тимеросал/борная кислота, целекоксиб, инфликсимаб, циклоспорин, алефацепт, эфализумаб, такролимус, пимекролизмус, PUVA, UVB, сульфасалазин.
Неограничивающие примеры лекарственных средств от псориатического артрита, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: метотрексат, этанерцепт, рофекоксиб, целекоксиб, фолиевая кислота, сульфасалазин, напроксен, лефлуномид, метилпреднизолона ацетат, индометацин, гидроксихлороквина сульфат, преднизон, сулиндак, бетаметазона дипропионат усиленный, инфликсимаб, метотрексат, фолат, триамцинолона ацетонид, диклофенак, диметилсульфоксид, пироксикам, диклофенак натрия, кетопрофен, мелоксикам, метилпреднизолон, набуметон, толметин натрия, кальципотриен, циклоспорин, диклофенак натрия/мизопростол, флуоционид, глюкозамина сульфат, золота натрия тиомалат, гидрокодона битартрат/apap, ибупрофен, ризедронат натрия, сульфадиазин, тиогуанин, вальдекоксиб, алефацепт, эфализумаб и ингибиторы bcl-2.
Неограничивающие примеры лекарственных средств от рестеноза, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: сиролимус, паклитаксел, эверолимус, такролимус, зотаролимус, ацетаминофен.
Неограничивающие примеры лекарственных средства от ишиаса, с которыми можно комбинировать связывающие белки по изобретению, включают следующие: гидрокодона битартрат/apap, рофекоксиб, циклобензаприн hcl, метилпреднизолон, напроксен, ибупрофен, оксикодон hcl/ацетаминофен, целекоксиб, вальдекоксиб, метилпреднизолона ацетат, преднизон, кодеина фосфат/apap, трамадол hcl/ацетаминофен, метаксалон, мелоксикам, метокарбамол, лидокаина гидрохлорид, диклофенак натрия, габапентин, дексаметазон, карисопродол, каторолака трометамин, индометацин, ацетаминофен, диазепам, набуметон, оксикодон hcl, тизанидин hcl, диклофенак натрия/мизопростол, пропоксифена напсилат/apap, asa/oxycod/оксикодон ter, ибупрофен/гидрокодон bit, трамадол hcl, этодолак, пропоксифен hcl, амитриптилин hcl, карисопродол/кодеин phos/asa, морфина сульфат, мультивитамины, напроксен натрия, орфенадрина цитрат, темазепам.
Примеры лекарственных средств от SLE (волчанки), с которыми можно комбинировать связывающие белки по изобретению, включают следующие: NSAID, например, диклофенак, напроксен, ибупрофен, пироксикам, индометацин; ингибиторы COX2, например, целекоксиб, рофекоксиб, вальдекоксиб; противомалярийные средства, например, гидроксихлороквин; стероиды, например, преднизон, преднизолон, буденозид, дексаметазон; цитотоксические средства, например, азатиоприн, циклофосфамид, микофенолата мофетил, метотрексат; ингибиторы PDE4 или ингибитор синтеза пуринов, например Cellcept. Связывающие белки по изобретению также можно комбинировать с такими средствами, как сульфасалазин, 5-аминосалициловая кислота, олсалазин, Imuran и средства, которые препятствуют синтезу, продукции или действию провоспалительных цитокинов, таких как IL-1, например, ингибиторы каспаз, такие как ингибиторы IL-1β-превращающего фермента и IL-1ra. Связывающие белки по изобретению также можно использовать с ингибиторами T-клеточной передачи сигнала, например, ингибиторами тирозинкиназы; или молекулами, которые нацелены на молекулы активации T-клеток, например, CTLA-4-IgG или антитела против семейства B7, антитела против семейства PD-1. Связывающие белки по изобретению можно комбинировать с IL-11 или антителами против цитокинов, например, фонотолизумабом (антитело против IFNg), или антителами против рецепторов, например, антитела против рецептора IL-6 и антитела к молекуле поверхности B-клеток. Антитела по изобретению или их антигенсвязывающую часть также можно использовать с LJP 394 (абетимус), средствами, которые истощают или инактивируют B-клетки, например, ритуксимабом (антитело против CD20), лимфостатом-B (антитело против BlyS), антагонистами TNF, например, антителами против TNF, Adalimumab (публикация PCT № WO 97/29131; HUMIRA®), CA2 (REMICADE®), CDP 571, конструкциями TNFR-Ig, (p75TNFRIgG (ENBREL®) и p55TNFRIgG (LENERCEPT®)) и ингибиторами bcl-2, поскольку было показано, что сверхэкспрессия bcl-2 у трансгенных мышей приводит к подобному волчанке фенотипу (см. Marquina et al., J. Immunol., 172(11): 7177-7185 (2004)), таким образом, ожидается, что его ингибирование может иметь терапевтические эффекты.
Фармацевтические композиции по изобретению могут включать "терапевтически эффективное количество" или "профилактически эффективное количество" антитела или части антитела по изобретению. "Терапевтически эффективное количество" относится к количеству, эффективному, в дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может определить специалист в данной области, и оно может варьировать, в зависимости от таких факторов, как болезненное состояние, возраст, пол и масса индивидуума, и способность связывающего белка вызвать желаемый ответ у индивидуума. Также терапевтически эффективное количество представляет собой количество, при котором терапевтически благоприятные эффекты перевешивают любые токсические или вредные эффекты антитела или части антитела. "Профилактически эффективное количество" относится к количеству, эффективному, в дозировках и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Как правило, поскольку профилактическую дозу используют у индивидуумов до заболевания или на ранней стадии заболевания, профилактически эффективное количество является меньшим, чем терапевтически эффективное количество.
Режимы дозирования можно изменять для обеспечения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Например, можно проводить однократное болюсное введение, можно вводить несколько разделенных доз с течением времени или дозу можно пропорционально снижать или увеличивать в зависимости от терапевтической ситуации. Особенно преимущественным является изготовление парентеральных композиций в виде единичной дозированной формы для простоты введения и единообразия дозировки. Единичная дозированная форма, Как используют в рамках изобретения, относится к физически отдельным единицам, пригодным для однократных дозировок у млекопитающих, подлежащих лечению; причем каждая единица содержит заданное количество активного соединения, вычисленное для достижения желаемого эффекта, вместе с требуемым фармацевтическим носителем. Характеристики единичных дозированных форм по изобретению определяются и прямо зависят от (a) уникальных характеристик активного соединения и конкретного терапевтического или профилактического эффекта, подлежащего достижению, и (b) ограничений, свойственных области изготовления такого активного соединения, для лечения чувствительности у индивидуумов.
Следует отметить, что величины дозировок могут варьировать, в зависимости от типа и тяжести состояния, подлежащего смягчению. Кроме того, следует понимать, что для конкретного индивидуума, конкретные режимы дозирования следует корректировать в соответствии с потребностями индивидуума и профессиональным решением лица, вводящего или наблюдающего за введением композиций, и что диапазоны дозировок, указанных в настоящем описании, являются только иллюстративными и не предназначены для ограничения объема или применения на практике заявленной композиции.
Диагностика
Также в описании, представленном в настоящем документе, предоставлены диагностические применения. Это дополнительно пояснено ниже. Антитела, которые связывают IL-1β по изобретению, можно использовать в любом из множества форматов для детекции IL-1β in vivo, in vitro или ex vivo (т.е. в клетках или тканях, полученных от живого индивидуума, которые подвергли процедуре, а затем вернули индивидууму). DVD-Ig по изобретению обеспечивает дополнительное преимущество в том, что он способен связываться с эпитопом IL-1β, а также с другими антигенами или эпитопами в различных форматах диагностических и детектирующих анализов.
I. Способ анализа
В настоящем описании также предоставлен способ определения наличия, количества или концентрации IL-1β или его фрагмента ("анализируемого соединения") в исследуемом образце с использованием по меньшей мере одного связывающего IL-1β белка или его антигенсвязывающей части, включая DVD-Ig, как описано в настоящем описании. В этом способе можно использовать любой пригодный анализ, известный в данной области. Их примеры включают, но не ограничиваются ими, иммуноанализ, такой как сэндвич-иммуноанализ (например, сэндвич-иммуноанализы с моноклональными, поликлональными антителами и/или DVD-Ig или любые их варианты (например, моноклональные антитела/DVD-Ig, DVD-Ig/поликлональные антитела, и т.д.), включая детекцию с помощью радиоизотопа (радиоиммунный анализ (RIA)) и ферментную детекцию (иммуноферментный анализ (EIA) или твердофазный иммуноферментный анализ (ELISA) (например, анализы Quantikine ELISA, R&D Systems, Minneapolis, Minnesota))), конкурентный иммуноанализ ингибирования (например, прямой обратный), флуоресцентный поляризационный иммуноанализ (FPIA), технология усиленного иммуноферментного анализа (EMIT), резонансный перенос энергии биолюминесценции (BRET), и гомогенный хемилюминесцентный анализ, и т.д. В иммуноанализе на основе SELDI, улавливающий реагент, который специфично связывается с представляющим интерес анализируемым соединением (или его фрагментом), связывают с поверхностью масс-спектрометрического зонда, такого как предварительно активированный чип белковый чип. Затем анализируемое соединение (или его фрагмент) специфично улавливается на биочипе, и уловленное анализируемое соединение (или его фрагмент) выявляют масс-спектрометрией. Альтернативно анализируемое соединение (или его фрагмент) можно элюировать из улавливающего реагента и выявлять традиционной MALDI (лазерная десорбция-ионизация в присутствии матрицы) или SELDI. Примером иллюстративного иммуноанализа является иммуноанализ хемилюминесцентных микрочастиц, в частности, анализ с использованием автоматического анализатора ARCHITECT® (Abbott Laboratories, Abbott Park, Illinois).
При применении на практике настоящего изобретения используют способы, хорошо известные в данной области для сбора, содержания и переработки мочи, крови, сыворотки и плазмы, и других жидкостей организма, например, когда связывающий IL-1β белок, как описано в настоящем описании, используют в качестве иммунодиагностического реагента и/или в наборе для иммуноанализа анализируемого соединения. В дополнение к представляющему интерес анализируемому соединению, исследуемый образец может содержать другие молекулы, такие как антитела, антигены, гаптены, гормоны, лекарственные средства, ферменты, рецепторы, белки, пептиды, полипептиды, олигонуклеотиды и/или полинуклеотиды. Например, образец может представлять собой образец цельной крови, полученный от индивидуума. Может быть необходимым и желательным, чтобы исследуемый образец, в частности, цельную кровь, обрабатывали перед иммуноанализом, как описано в настоящем описании, например, реагентом для предварительной обработки. Даже в случаях, когда предварительная обработка не является необходимой (например, большинство образцов мочи), предварительную обработку необязательно можно проводить (например, в качестве части режима на коммерческой основе).
Реагент для предварительной обработки может представлять собой любой реагент, пригодный для применения с иммуноанализом и наборами по изобретению. Предварительная обработка необязательно включает: (a) один или несколько растворителей (например, метанол и этиленгликоль) и необязательно, соль, (b) один или несколько растворителей и соль, и необязательно, детергент, (c) детергент, или (d) детергент и соль. Реагенты для предварительной обработки известны в данной области, и такую предварительную обработку можно использовать, например, как используют для анализов на анализаторах Abbott TDx, AxSYM® и ARCHITECT® (Abbott Laboratories, Abbott Park, Illinois), как описано в литературе (см., например, Yatscoff et al., "Abbott TDx Monoclonal Antibody Assay Evaluated for Measuring Cyclosporine in Whole Blood", Clin. Chem., 36: 1969-1973 (1990), и Wallemacq et al., "Evaluation of the New AxSYM Cyclosporine Assay: Comparison with TDx Monoclonal Whole Blood and EMIT Cyclosporine Assays", Clin. Chem., 45: 432-435 (1999)), и/или согласно коммерчески доступным способам. Кроме того, предварительную обработку можно проводить, как описано в патенте США №5135875, Abbott, европейской публикации Европы №0471293, публикации PCT № WO 2008/082984, и в публикации US №2008/0020401 (включенных в настоящее описание в качестве ссылок в полном объеме в отношении указаний в них, касающихся предварительной обработки). Реагент для предварительной обработки может представлять собой гетерогенное вещество или гомогенное вещество.
При использовании гетерогенного реагента для предварительной обработки, реагент для предварительной обработки преципитирует связывающий анализируемое соединение белок (например, белок, который может связываться с анализируемым соединением или его фрагментом), присутствующий в образце. Такая стадия предварительной обработки включает удаление связывающего анализируемое соединение белка путем отделения от преципитированного связывающего анализируемого соединение белка супернатанта смеси, образованной добавлением средства для предварительной обработки в образец. В таком анализе, используют супернатанты смесей, в которых отсутствует какой-либо связывающий белок, и этот анализ переходит прямо на стадию улавливания антитела.
При использовании гомогенного реагента для предварительной обработки отсутствует такая стадия отделения. Всю смесь исследуемого образца и реагента для предварительной обработки подвергают контактированию с меченным связывающим партнером, специфичным к анализируемому соединению (или его фрагменту), таким как меченое антитело против анализируемого соединения (или его реагирующий с антигеном фрагмент). Реагент для предварительной обработки, используемый для такого анализа, как правило, разбавляют в предварительно обработанной смеси исследуемого образца, либо до, либо в процессе улавливания первым специфическим связывающим партнером. Несмотря на такое разбавление, некоторое количество реагента для предварительной обработки все еще присутствует (или остается) в смеси исследуемого образца в процессе улавливания. Согласно изобретению, иллюстративный меченый специфический связывающий партнер может представлять собой DVD-Ig (или его фрагмент, вариант, или фрагмент варианта).
В гетерогенном формате после получения исследуемого образца от индивидуума получают первую смесь. Смесь содержит образец, оцениваемый в отношении анализируемого соединения (или его фрагмента) и первый специфический связывающий партнер, где первый специфический связывающий партнер и любое анализируемое соединение, содержащееся в исследуемом образце, образуют первый специфический комплекс, связывающий партнер-анализируемое соединение. Предпочтительно, первый специфический связывающий партнер представляет собой антитело против анализируемого соединения или его или фрагмент. Первый специфический связывающий партнер может представлять собой DVD-Ig (или его фрагмент, вариант или фрагмент варианта), как описано в настоящем описании. Порядок, в котором исследуемый образец и первый специфический связывающий партнер добавляют для образования смеси, не является критическим. Предпочтительно, первый специфический связывающий партнер иммобилизуют на твердой фазе. Твердая фаза, используемая в иммуноанализе (для первого специфического связывающего партнера и, необязательно, второго специфического связывающего партнера), может представлять собой любую твердую фазу, известную в данной области, такую как, но не ограничиваясь ими, магнитные частицы, гранулы, пробирка, микропланшет для титрования, кювета, мембрана, молекула подложки, пленка, фильтровальная бумага, диск и чип.
После образования смеси, содержащей комплекс первый специфический связывающий партнер-анализируемое соединение, любое не связавшееся анализируемое соединение отделяют от комплекса с использованием любых способов, известных в данной области. Например, не связавшееся анализируемое соединение можно удалять промыванием. Однако желательно, чтобы первый специфический связывающий партнер присутствовал в избытке относительно любого анализируемого соединения, присутствующего в исследуемом образце, так чтобы все анализируемое соединение, которое присутствует в исследуемом образце, связывалось первым специфическим связывающим партнером.
После удаления не связавшегося анализируемого соединения в смесь добавляют второй специфический связывающий партнер с образованием комплекса первый специфический связывающий партнер-анализируемое соединение-второй специфический связывающий партнер. Второй специфический связывающий партнер предпочтительно представляет собой антитело против анализируемого соединения, которое связывается с эпитопом на анализируемом соединении, который отличается от эпитопа на анализируемом соединении, связываемого первым специфическим связывающим партнером. Более того, также предпочтительно, второй специфический связывающий партнер метят поддающейся детекции меткой или он содержит ее, как описано выше. Второй специфический связывающий партнер может представлять собой DVD-Ig (или его фрагмент, вариант или фрагмент варианта), как описано в настоящем описании.
Можно использовать любую поддающуюся детекции метку, как известно в данной области. Например, поддающаяся детекции метка может представлять собой радиоактивную метку (такую как3H,125I,35S,14C,32P и33P), ферментную метку (такую как пероксидаза хрена, щелочная пероксидаза, глюкоза-6-фосфат-дегидрогеназа и т.п.), хемилюминесцентную метку (такую как сложные эфиры акридиния, сложные тиоэфиры или сульфонамиды; люминол, изолюминол, сложные эфиры фенантридиния и т.п.), флуоресцентную метку (такую как флуоресцеин (например, 5-флуоресцеин, 6-карбоксифлуоресцеин, 3’6-карбоксифлуоресцеин, 5(6)-карбоксифлуоресцеин, 6-гексахлорфлуоресцеин, 6-тетрахлорфлуоресцеин, флуоресцеина изотиоцианат и т.п.)), родамин, фикобилипротеины, R-фикоэритрин, квантовые точки (например, селенид кадмия в оболочке из сульфида цинка), термометрическую метку или метку иммунно-полимеразной цепной реакции. Вводный курс о метках, способах мечения и детекции меток представлен в Polak and Van Noorden, Introduction to Immunocytochemistry, 2nd ed., Springer Verlag, N.Y. (1997), и Haugland, Handbook of Fluorescent Probes and Research Chemicals (1996), которая объединяет справочник и каталог, опубликованный Molecular Probes, Inc., Eugene, Oregon. Флуоресцентную метку можно использовать в FPIA (см., например, патенты США №5593896; 5573904; 5496925; 5359093 и 5352803). Соединение акридиния можно использовать в качестве поддающейся детекции метки в гомогенном и гетерогенном хемилюминесцентном анализе (см., например, Adamczyk et al., Bioorg. Med. Chem. Lett. 16: 1324-1328 (2006); Adamczyk et al., Bioorg. Med. Chem. Lett. 14: 2313-2317 (2004); Adamczyk et al., Biorg. Med. Chem. Lett. 14: 3917-3921 (2004); и Adamczyk et al., Org. Lett. 5: 3779-3782 (2003)).
Иллюстративным соединением акридиния является акридиний-9-карбоксамид. Способы получения акридиний-9-карбоксамидов описаны в Mattingly, J. Biolumin. Chemilumin. 6: 107-114 (1991); Adamczyk et al., J. Org. Chem. 63: 5636-5639 (1998); Adamczyk et al., Tetrahedron 55: 10899-10914 (1999); Adamczyk et al., Org. Lett. 1: 779-781 (1999); Adamczyk et al., Bioconjugate Chem. 11 714-724 (2000); Adamczyk and Mattingly, In Luminescence Biotechnology: Instruments and Applications; (Dyke, K. V. ed.) (CRC Press: Boca Raton, 2002, pp. 77-105; Adamczyk et al., Org. Lett. 5: 3779-3782 (2003); и патентах США №5468646, 5543524 и 5783699. Другим предпочтительным соединением акридиния является ариловый сложный эфир акридиний-9-карбоксилата. Примером арилового сложного эфира акридиний-9-карбоксилата является фторсульфонат 10-метил-9-(феноксикарбонил)акридиния (доступный от Cayman Chemical, Ann Arbor, Michigan). Способы получения ариловых сложных эфиров акридиний-9-карбоксилата описаны в McCapra et al., Photochem. Photobiol. 4: 1111-21 (1965); Razavi et al., Luminescence 15: 245-249 (2000); Razavi et al., Luminescence 15: 239-244 (2000); и патенте США №5241070. Дополнительные детали, касающиеся арилового сложного эфира акридиний-9-карбоксилата и его применения, указаны в публикации US №2008-0248493.
Хемилюминесцентные анализы (например, с использованием акридиния, как описано выше, или других хемилюминесцентных агентов) можно проводить в соответствии со способами, описанными в Adamczyk et al., Anal. Chim. Acta 579(1): 61-67 (2006). Хотя можно использовать любой пригодный формат анализа, хемилюминометр для микропланшетов (Mithras LB-940, Berthold Technologies USA., LLC, Oak Ridge, Tennessee) обеспечивает быстрый анализ множества образцов в малых объемах.
Порядок, в котором исследуемый образец и конкретный связывающий партнер(ы) добавляют для образования смеси для хемилюминесцентного анализа, не является критическим. Если первый специфический связывающий партнер метят поддающимся детекции хемилюминесцентным агентом, таким как соединение акридиния, образуются меченные поддающимся детекции агентом комплексы первый специфический связывающий партнер-анализируемое соединение. Альтернативно, если используют второй специфический связывающий партнер и второй специфический связывающий партнер мечен поддающимся детекции хемилюминесцентным агентом, таким как соединение акридиния, образуются меченные поддающимся агентом комплексы первый специфический связывающий партнер-анализируемое соединение-второй специфический связывающий партнер. Любой не связавшийся специфический связывающий партнер, как меченый, так и немеченый, можно удалять из смеси с использованием любого способа, известного в данной области, такого как промывание.
Пероксид водорода может образовываться in situ в смеси или он может быть предоставлен смеси или подан в смесь (например, источником пероксида водорода является один или несколько буферов или других растворов, которые, как известно, содержат пероксид водорода) до, одновременно или после добавления описанного выше соединения акридиния. Пероксид водорода можно образовываться in situ рядом путей, понятных специалисту в данной области.
При одновременном или последовательном добавлении к образцу по меньшей мере одного основного раствора, генерируется поддающийся детекции сигнал, а именно, хемилюминесцентный сигнал, указывающий на присутствие анализируемого соединения. Основной раствор содержит по меньшей мере одно основание и имеет значение pH, превышающее или равное 10, предпочтительно, превышающее или равное 12. Примеры основных растворов включают, но не ограничиваются ими, растворы гидроксида натрия, гидроксида калия, гидроксида кальция, гидроксида аммония, гидроксида магния, карбоната натрия, бикарбоната натрия, гидроксида кальция, карбоната кальция и бикарбоната кальция. Количество основного раствора, добавляемого в образец, зависит от концентрации основного раствора. Исходя из используемой концентрации основного раствора, специалист в данной области может легко определить количество основного раствора, добавляемого к образцу.
Генерируемый хемилюминесцентный сигнал можно выявлять с использованием общепринятых способов, известных специалистам в данной области. Исходя из интенсивности созданного сигнала, можно определять количество анализируемого соединения в образце. Конкретно, количество анализируемого соединения в образце пропорционально интенсивности созданного сигнала. Количество присутствующего анализируемого соединения можно количественно определять путем сравнения количества генерированного света со стандартной кривой для анализируемого соединения или путем сравнения с эталонным стандартом. Стандартную кривую можно строить с использованием серийных разведений или растворов известных концентраций анализируемого соединения масс-спетроскопией, гравиметрическими способами и другими способами, известными в данной области. Хотя указанное выше описано с акцентом на применении соединения акридиния в качестве хемилюминесцентного агента, специалист в данной области может легко адаптировать это описание для применения других хемилюминесцентных агентов.
Иммуноанализы анализируемого соединения, как правило, можно проводить с использованием любого формата, известного в данной области, такого как, но не ограничиваясь ими, сэндвич-формат. Конкретно, в одном формате иммуноанализа используют по меньшей мере два антитела для отделения и количественного определения анализируемого соединения, такого как анализируемое соединение человека, или его фрагмент, в образце. Более конкретно, по меньшей мере два антитела связываются с различными эпитопами на анализируемом соединении (или его фрагменте), образуя иммунный комплекс, который называют "сэндвичем". Как правило, в иммуноанализах одно или несколько антител можно использовать для улавливания анализируемого соединения (или его фрагмента) в исследуемом образце (эти антитела часто называют "улавливающим" антителом или "улавливающими" антителами), и одно или несколько антител можно использовать для связывания поддающейся детекции (а именно, поддающейся количественной детекции) метки с сэндвичем (эти антитела часто называют "антителом для детекции", "антителами для детекции", "конъюгатом" или "конъюгатами"). Таким образом, в контексте формата сэндвич-иммуноанализа, DVD-Ig (или его фрагмент, вариант или фрагмент варианта), как описано в настоящем описании, можно использовать в качестве улавливающего антитела, антитела для детекции или обоих из них. Например, один DVD-Ig, имеющий домен, который связывает первый эпитоп на анализируемом соединении (или его фрагменте) можно использовать в качестве улавливающего антитела, и/или другой DVD-Ig, имеющий домен, который может связывать второй эпитоп на анализируемом соединении (или его фрагменте) можно использовать в качестве антитела для детекции. В связи с этим, DVD-Ig, имеющий первый домен, который связывает первый эпитоп на анализируемом соединении (или его фрагменте) и домен, который может связывать второй эпитоп на анализируемом соединении (или его фрагменте) можно использовать в качестве улавливающего антитела и/или антитела для детекции. Альтернативно один DVD-Ig, имеющий первый домен, который связывает первый эпитоп на анализируемом соединении (или его фрагменте) и домен, который может связывать второй эпитоп на анализируемом соединении (или его фрагменте) можно использовать в качестве улавливающего антитела и/или антитела для детекции в целях детекции, и необязательно количественного определения, двух или более анализируемых соединений. В случае, когда анализируемое соединение может присутствовать в образце более чем в одной форме, такой как мономерная форма и димерная/мультимерная форма, которая может быть гомомерной или гетеромерной, один DVD-Ig, имеющий домен, который связывает эпитоп, который экспонируется только на мономерной форме, и другой DVD-Ig, имеющий домен, который может связывать эпитоп на другой части димерной/мультимерной формы, можно использовать в качестве улавливающих антител и/или антител для детекции, тем самым, обеспечивая детекцию, и, необязательно, количественное определение, различных форм данного анализируемого соединения. Более того, использование DVD-Ig с отличающейся аффинностью в отдельном DVD-Ig и/или в различных DVD-Ig может обеспечить преимущество авидности. В контексте иммуноанализов, как описано в настоящем описании, как правило, может быть полезным или желательным включение в структуру DVD-Ig одного или более линкеров. Когда линкер присутствует, он оптимально должен иметь достаточную длину и структурную гибкость для обеспечения связывания эпитопа внутренними доменами, а также связывания другого эпитопа наружными доменами. В связи с этим, если DVD-Ig может связывать два различных анализируемых соединения, и одно анализируемое соединение является большим, чем другое анализируемое соединение, желательно, чтобы большее анализируемое соединение связывалось наружными доменами.
В общих чертах, образец, исследуемый (например, предположительно содержащий) на белок IL-1β (или его фрагмент) можно контактировать по меньшей мере с одним улавливающим антителом (или антителами) и по меньшей мере с одним антителом для детекции (которое может представлять собой второе антитело для детекции или третье антитело для детекции или даже последующее антитело, например, когда улавливающее антитело и/или антитело для детекции содержат множество антител), либо одновременно, либо последовательно, и в любом порядке. Например, исследуемый образец можно сначала контактировать по меньшей мере с одним улавливающим антителом, а затем (последовательно) по меньшей мере с одним антителом для детекции. Альтернативно исследуемый образец сначала можно контактировать по меньшей мере с одним антителом для детекции, а затем (последовательно) по меньшей мере с одним улавливающим антителом. В другой альтернативе исследуемый образец можно контактировать одновременно с улавливающим антителом и антителом для детекции.
В формате сэндвич-анализа, образец, предположительно содержащий IL-1β (или его фрагмент) сначала контактируют по меньшей мере с одним первым улавливающим связывающим белком (например антителом против IL-1β) в условиях, которые позволяют образование комплекса первый связывающий белок/ IL-1β. Если используют более одного улавливающего связывающего белка, образуется первый комплекс улавливающий связывающий белок/ IL-1β, содержащий две или более улавливающих форм связывающих белков. В сэндвич-анализе связывающие белки, т.е., предпочтительно, по меньшей мере один улавливающий связывающий белок, используют в молярном избытке относительно максимального количества анализируемого соединения IL-1β (или его фрагмента), ожидаемого в исследуемом образце. Например, можно использовать от приблизительно 5 мкг до приблизительно 1 мг антитела на мл буфера (например, буфер для нанесения на микрочастицы).
Иммуноанализы конкурентного ингибирования, которые часто используют для определения небольших анализируемых соединений, поскольку требуется связывание только одного антитела, включают последовательный и классический форматы. В последовательном иммуноанализе конкурентного ингибирования улавливающий связывающий белок к IL-1β наносят на лунку микропланшета для титрования или другой твердой подложки. Когда в образец, содержащий IL-1β, добавляют в лунку, IL-1β связывается улавливающим антителом. После промывания в лунку добавляют известное количество меченного (например, биотин или пероксидаза хрена (HRP)) IL-1β. Для создания сигнала необходим субстрат ферментной метки. Примером пригодного субстрата для HRP является 3,3’,5,5’-тетраметилбензидин (TMB). После промывания определяют сигнал, созданный меченым анализируемым соединением, и он обратно пропорционален количеству IL-1β в образце. В классическом иммуноанализе конкурентного ингибирования связывающий белок к IL-1β наносят на твердую подложку (например, лунку микропланшета для титрования). Однако в отличие от последовательного иммуноанализа конкурентного ингибирования, образец и меченый IL-1β добавляют в лунку одновременно. Любой IL-1β в образце конкурирует с меченым IL-1β за связывание улавливающего связывающего белка. После промывания измеряют сигнал, сгенерированный меченым IL-1β, и он обратно пропорционален количеству IL-1β в образце.
Необязательно, перед контактированием исследуемого образца по меньшей мере с одним улавливающим связывающим белком (например, первым улавливающим антителом), по меньшей мере один улавливающий связывающий белок может быть связан с твердой подложкой, что облегчает отделение комплекса первый связывающий белок/IL-1β (или его фрагмент) от исследуемого образца. Субстрат, с которым улавливающий связывающий белок связывают, может представлять собой любую пригодную твердую подложку или твердую фазу, которая облегчает отделение комплекса улавливающее антитело-анализируемое соединение от образца.
Примеры подложек включают лунку планшета, такого как a микропланшет для титрования, пробирку, пористый гель (например, силикагель, агароза, декстран или желатин), полимерную пленку (например, полиакриламид), гранулы (например, полистироловые гранулы или магнитные гранулы), полоску фильтра/мембраны (например, нитроцеллюлозы или нейлона), микрочастицы (например, латексные частицы, намагничивающиеся микрочастицы (например, микрочастицы, имеющие сердцевину из оксида железа или оксида хрома и гомо- или гетерополимерное покрытие и радиус приблизительно 1-10 микрон). Субстрат может содержать пригодный пористый материал с приемлемой аффинностью поверхности для связывания антигенов и достаточной пористый для того, чтобы обеспечить доступ антителам для детекции. Как правило, предпочтительным является микропористый материал, хотя можно использовать гелеобразный материал в гидратированном состоянии. Такие пористые субстраты предпочтительно имеют форму слоев, имеющих толщину от приблизительно 0,01 до приблизительно 0,5 мм, предпочтительно приблизительно 0,1 мм. Хотя размер пор может варьировать совсем немного, предпочтительно размер пор составляет от приблизительно 0,025 до приблизительно 15 микрон, более предпочтительно от приблизительно 0,15 до приблизительно 15 микрон. Поверхность таких субстратов можно активировать путем химических процессов, которые приводят к ковалентному присоединению антитела к субстрату. Результатом этого является необратимое связывание, как правило, путем адсорбции посредством гидрофобных сил, антигена или антитела с субстратом; альтернативно для ковалентного связывания антитела с субстратом можно использовать химический связывающий реагент или другое средство, при условии что такое связывание не препятствует способности антитела связываться с анализируемым соединением. Альтернативно антитело может быть связано с микрочастицами, предварительно покрытыми стрептавидином (например, DYNAL® Magnetic Beads, Invitrogen, Carlsbad, California) или биотином (например, с использованием покрытых стрептавидином микрочастиц Power-BindTM-SA-MP (Seradyn, Indianapolis, Indiana)) или специфичными для вида моноклональными антителами. Если необходимо, субстрат может быть преобразован для того, чтобы обеспечить реакционную способность к различным функциональным группам антитела. Такое преобразование требует применения определенных агентов для присоединения, примеры которых включают, но не ограничиваются ими, малеиновый ангидрид, N-гидроксисукцинимид и 1-этил-3-(3-диметиламинопропил)карбодиимид. Если желательно один или несколько улавливающих реагентов, таких как антитела (или их фрагменты), каждой из которых является специфичным для анализируемого соединения(ий), можно присоединять к твердым фазам в различных физических или адресуемых положениях (например, таким как конфигурация биочипа (см., например, патент США №6225047; публикацию PCT № WO 99/51773; патент США №6329209; публикацию PCT № WO 00/56934 и патент США №5242828). Если улавливающий реагент присоединяют к масс-спектрометрическому зонду в качестве твердой подложки, количество анализируемого соединения, связанного с зондом, можно определять с помощью масс-спетрометрии с ионизацией лазерной десорбцией. Альтернативно одну колонку можно заполнять различными гранулами, которые преобразованы с помощью одного или нескольких улавливающих реагентов, тем самым улавливая анализируемое соединение в одном месте (см., технологии преобразованных антителами гранул, например, технологию xMAP, Luminex (Austin, Texas)).
После того, как исследуемый образец, анализируемый в отношении анализируемого соединения (или его фрагмента), контактируют по меньшей мере с одним улавливающим антителом (например, первым улавливающим антителом), смесь инкубируют для обеспечения образования комплекса первое антитело (или несколько антител)-анализируемое соединение (или его фрагмент). Инкубацию можно проводить при pH от приблизительно 4,5 до приблизительно 10,0, при температуре от приблизительно 2°C до приблизительно 45°C, и в течение периода от по меньшей мере приблизительно одной (1) минуты до приблизительно восемнадцати (18) часов, предпочтительно от приблизительно 1 до приблизительно 24 минут, наиболее предпочтительно в течение от приблизительно 4 до приблизительно 18 минут. Иммунологический анализ, описанный в настоящем описании, можно проводить на одной стадии (что означает, что исследуемый образец, по меньшей мере одно улавливающее антитело и по меньшей мере антитело для детекции добавляют в реакционную емкость последовательно или одновременно) или более чем за одну стадию, например за две стадии, три стадии и т.д.
После образования комплекса (первое или несколько) улавливающее антитело/анализируемое соединение (или его фрагмент), контактируют по меньшей мере с одним антителом для детекции в условиях, которые позволяют образование комплекса (первое или несколько) улавливающее антитело/анализируемое соединение (или его фрагмент)/второе антитело для детекции. Несмотря на называние для ясности "вторым" антителом (например, второе антитело для детекции), в действительности, когда используют несколько антител для улавливания и/или детекции, по меньшей мере одно антитело для детекции может быть вторым, третьим, четвертым и т.д. антителом, используемым в иммуноанализе. Если комплекс улавливающее антитело/анализируемое соединение (или его фрагмент) контактируют более чем с одним антителом для детекции, тогда образуется комплекс (первое или несколько) улавливающее антитело/анализируемое соединение (или его фрагмент)/(несколько) антител для детекции. Как в случае улавливающего антитела (например, первого улавливающего антитела), когда по меньшей мере одно (например, второе и любое последующее) антитело для детекции контактируют с комплексом улавливающее антитело/анализируемое соединение (или его фрагмент), для образования комплекса (первое или несколько) улавливающее антитело/анализируемое соединение (или его фрагмент)/(второе или несколько) антитело для детекции требуется период инкубации в условиях, сходных с условиями, описанными выше. Предпочтительно, по меньшей мере одно антитело для детекции содержит поддающуюся детекции метку. Поддающаяся детекции метка может быть связана по меньшей мере с одним антителом для детекции (например, вторым антителом для детекции) до, одновременно или после образования комплекса (первое или несколько) улавливающее антитело/анализируемое соединение (или его фрагмент)/(второе или несколько) антитело для детекции. Можно использовать любую поддающуюся детекции метку, известную в данной области (см. обсуждение выше, включая ссылки Polak and Van Noorden (1997) и Haugland (1996)).
Поддающаяся детекции метка может быть связана с антителами либо прямо, либо через связывающий агент. Примером связывающего агента, который можно использовать, является EDAC (1-этил-3-(3-диметиламинопропил)карбодиимид, гидрохлорид), который является коммерчески доступным от Sigma-Aldrich, St. Louis, Missouri. Другие связывающие агенты, которые можно использовать, известны в данной области. Способы связывания поддающейся детекции метки с антителом известны в данной области. Кроме того, можно приобретать или синтезировать множество поддающихся детекции меток, которые уже содержат концевые группы, которые способствуют присоединению поддающейся детекции метки к антителу, таких как CPSP-сложный эфир акридиния (т.е. 9-[N-тозил-N-(3-карбоксипропил)]-10-(3-сульфопропил)акридиния карбоксамид) или SPSP-сложный эфир акридиния (т.е. N10-(3-сульфопропил)-N-(3-сульфопропил)акридиния-9-карбоксамид).
Перед количественным определением метки комплекс (первое или несколько) улавливающее антитело/анализируемое соединение/(второе или несколько) антитело для детекции можно, но не обязательно, отделять от остальной части исследуемого образца. Например, если по меньшей мере одно улавливающее антитело (например, первое улавливающее антитело) связано с твердой подложкой, такой как лунка или гранула, разделение можно проводить путем удаления жидкости (исследуемого образца), контактирующей с твердой подложкой. Альтернативно, если по меньшей мере первое улавливающее антитело связано с твердой подложкой, его можно одновременно контактировать с содержащим анализируемое соединение образцом и по меньшей мере одним вторым антителом для детекции с образованием комплекса первое (несколько) антитело/анализируемое соединение/второе (несколько) антитело, с последующим удалением жидкости (исследуемого образца), контактирующей с твердой подложкой. Если по меньшей мере одно первое улавливающее антитело не связано с твердой подложкой, тогда комплекс (первое или несколько) улавливающее антитело/анализируемое соединение/(второе или несколько) антитело для детекции не обязательно удалять из исследуемого образца для количественного определения количества метки.
После образования комплекса меченое улавливающее антитело/анализируемое соединение/антитело для детекции (например, комплекса первое улавливающее антитело/анализируемое соединение/второе антитело для детекции), количество метки в комплексе количественно определяют с использованием способов, известных в данной области. Например, если используют ферментную метку, меченый комплекс подвергают реакции с субстратом для метки, что приводит к поддающейся количественному определению реакции, такой как появление цвета. Если метка представляет собой радиоактивную метку, метку количественно определяют с использованием соответствующих способов, таких как сцинтилляционный счетчик. Если метка представляет собой флуоресцентную метку, метку количественно определяют путем стимуляции метки светом одного цвета (который известен как "длина волны возбуждения") и детекции другого цвета (который известен как "длина волны испускания"), который испускается меткой в ответ на стимуляцию. Если метка представляет собой хемилюминесцентную метку, метку количественно определяют путем детекции испускаемого света, либо визуально, либо с использованием люминометров, рентгеновской пленки, высокочувствительной фотографической пленки, камеры CCD, и т.д. После количественного определения метки в комплексе определяют концентрацию анализируемого соединения или его фрагмента в исследуемом образце пригодными способами, такими как применение стандартной кривой, полученной с использованием серийных разведений анализируемого соединения или его фрагмента с известной концентрацией. Помимо применения серийных разведений анализируемого соединения или его фрагмента, стандартную кривую можно получать гравиметрически, с помощью масс-спектроскопии и других способов, известных в данной области.
В анализе хемилюминесцентных микрочастиц с использованием анализатора ARCHITECT®, значение pH разбавителя конъюгата должно составлять приблизительно 6,0±0,2, буфер для нанесения на микрочастицы необходимо поддерживать приблизительно при комнатной температуре (т.е. при от приблизительно 17 до приблизительно 27°С), значение pH буфера для нанесения на микрочастицы должно составлять приблизительно 6,5±0,2, и значения pH разбавителя микрочастиц должно составлять приблизительно 7,8±0,2. Твердые вещества предпочтительно составляют менее 0,2%, например, менее чем приблизительно 0,15%, менее чем приблизительно 0,14%, менее чем приблизительно 0,13%, менее чем приблизительно 0,12% или менее чем приблизительно 0,11%, например, приблизительно 0,10%.
Способы FPIA основаны на принципах конкурентного иммуноанализа связывания. Флуоресцентно меченное соединение, когда оно возбуждается линейно поляризованным светом, испускает флуоресценцию, имеющую степень поляризации, обратно пропорциональную его скорости вращения. Когда комплекс флуоресцентная метка-антитело возбуждается линейно поляризованным светом, испускаемый свет остается поляризованным, поскольку флуорофор удерживается от вращения между моментом времени, когда свет поглощается, и моментом времени, когда свет испускается. Когда "свободная" метка (т.е. соединение, которое не связано с антителом) возбуждается линейно поляризованным светом, ее вращение является значительно более быстрым, чем у соответствующего конъюгата метка-антитело, полученного в конкурентном иммуноанализе связывания. FPIA являются преимущественными над RIA, поскольку не требуется специального содержания и размещения радиоактивных веществ. Кроме того, FPIA являются гомогенными анализами, которые можно проводить легко и быстро.
Ввиду вышесказанного, предусматривается способ определения присутствия, количества или концентрации анализируемого соединения (или его фрагмента) в исследуемом образце. Способ включает анализ исследуемого образца в отношении анализируемого соединения (или его фрагмента) путем анализа (i), в котором используется (i’) по меньшей мере одно из антитела, фрагмента антитела, который может связываться с анализируемым соединением, варианта антитела, который может связываться с анализируемым соединением, фрагмента варианта антитела, который может связываться с анализируемым соединением, и DVD-Ig (или его фрагмента, варианта или фрагмента варианта), который может связываться с анализируемым соединением, и (II’) по меньшей мере одна поддающаяся детекции метки и (ii) который включает сравнение сигнала, созданного поддающейся детекции меткой, в качестве прямого или непрямого показателя присутствия, количества или концентрации анализируемого соединения (или его фрагмента) в исследуемом образце, с сигналом, созданным в качестве прямого или непрямого показателя присутствия, количества или концентрации анализируемого соединения (или его фрагмента) в контроле или калибраторе. Калибратор необязательно является частью серии калибраторов, в которой каждый из калибраторов отличается от других калибраторов концентрацией анализируемого соединения.
Способ может включать (i) контактирование исследуемого образца по меньшей мере с одним первым специфическим связывающим партнером для анализируемого соединения (или его фрагмента), выбранным из группы, состоящей из антитела, фрагмента антитела, который может связываться с анализируемым соединением, варианта антитела, который может связываться с анализируемым соединением, фрагмента варианта антитела, который может связываться с анализируемым соединением, и DVD-Ig (или его фрагмента, вариант или фрагмент варианта), который может связываться с анализируемым соединением, так чтобы образовывался комплекс первый специфический связывающий партнер/анализируемое соединение (или его фрагмент), (ii) контактирование комплекса первый специфический связывающий партнер/анализируемое соединение (или его фрагмент) по меньшей мере с одним вторым специфическим связывающим партнером для анализируемого соединения (или его фрагмента), выбранным из группы, состоящей из меченного поддающейся детекции меткой антитела против анализируемого соединения, меченного поддающейся детекции меткой фрагмента любого антитела против анализируемого соединения, который может связываться с анализируемым соединением, меченного поддающейся детекции меткой варианта антитела против анализируемого соединения, который может связываться с анализируемым соединением, меченного поддающейся детекции меткой фрагмента варианта антитела против анализируемого соединения, который может связываться с анализируемым соединением, и меченного поддающейся детекции меткой DVD-Ig (или его фрагмента, варианта или фрагмента варианта), так чтобы образовывался комплекс первый специфический связывающий партнер/анализируемое соединение (или его фрагмент)/второй специфический связывающий партнер, и (iii) определение присутствия, количества или концентрации анализируемого соединения в исследуемом образце путем детекции или измерения сигнала, созданного поддающейся детекции меткой в комплексе первый специфический связывающий партнер/анализируемое соединение (или его фрагмент)/второй специфический связывающий партнер, образованном на (ii). Предпочтительным может быть способ, в котором по меньшей мере один первый специфический связывающий партнер для анализируемого соединения (или его фрагмента) и/или по меньшей мере один второй специфический связывающий партнер для анализируемого соединения (или его фрагмента) представляет собой DVD-Ig (или его фрагмент, вариант или фрагмент варианта) как описано в настоящем описании.
Альтернативно способ может включать контактирование исследуемого образца по меньшей мере с одним первым специфическим связывающим партнером для анализируемого соединения IL-1β (или его фрагмента), выбранным из группы, состоящей из антитела, фрагмента антитела, который может связываться с анализируемым соединением, варианта антитела, который может связываться с анализируемым соединением, фрагмента варианта антитела, который может связываться с анализируемым соединением, и DVD-Ig (или его фрагмента, варианта или фрагмента варианта) и одновременно или последовательно, в любом порядке, контактирование исследуемого образца по меньшей мере с одним вторым специфическим связывающим партнером, который может конкурировать с анализируемым соединением (или его фрагментом) за связывание по меньшей мере с одним первым специфическим связывающим партнером и который выбран из группы, состоящей из меченого поддающейся детекции меткой анализируемого соединения, меченного поддающейся детекции меткой фрагмента анализируемого соединения, который может связываться с первым специфическим связывающим партнером, меченного поддающейся детекции меткой варианта анализируемого соединения, который может связываться с первым специфическим связывающим партнером, и меченного поддающейся детекции меткой фрагмента варианта анализируемого соединения, который может связываться с первым специфическим связывающим партнером. Любой IL-1β (или его фрагмент), присутствующий в исследуемом образце, и по меньшей мере один второй специфический связывающий партнер, конкурируют друг с другом с образованием комплекса первый специфический связывающий партнер/анализируемое соединение (или его фрагмент) и комплекса первый специфический связывающий партнер/второй специфический связывающий партнер, соответственно. Способ дополнительно включает определение присутствия, количества или концентрации анализируемого соединения в исследуемом образце путем детекции или количественного определения сигнала, созданного поддающейся детекции меткой в комплексе первый специфический связывающий партнер/второй специфический связывающий партнер, образованном на стадии (ii), где сигнал, созданный поддающейся детекции меткой в комплексе первый специфический связывающий партнер/второй специфический связывающий партнер обратно пропорционален количеству или концентрации анализируемого соединения в исследуемом образце.
Кроме того, указанные выше способы могут включать диагностику, прогнозирование или оценку эффективности терапевтического/профилактического лечения пациента, от которого получен исследуемый образец. Если способ дополнительно включает оценку эффективности терапевтического/профилактического лечения пациента, от которого получен исследуемый образец, способ необязательно дополнительно включает модификацию терапевтического/профилактического лечения пациента, если это необходимо для повышения эффективности. Способ можно адаптировать для применения в автоматизированной системе или полуавтоматизированной системе.
Что касается способов анализа (и набора для них), может быть возможным применение коммерчески доступных антител против анализируемого соединения или способов продукции антитела против анализируемого соединения, как описано в литературе. Коммерческие поставщики различных антител включают, но не ограничиваются ими, Santa Cruz Biotechnology Inc. (Santa Cruz, California), Gen Way Biotech, Inc. (San Diego, California), и R&D Systems (RDS; Minneapolis, Minnesota).
Как правило, в качестве ориентира, против которого оценивают результаты, полученные при анализе исследуемого образца в отношении анализируемого соединения или его фрагмента, например, для детекции заболевания или риска заболевания, можно использовать заданный уровень. Как правило, при проведении такого сравнения, заданный уровень получают проведением конкретного анализа достаточное количество раз и в соответствующих условиях, так чтобы можно было получить связь или ассоциацию присутствия, количества или концентрации анализируемого соединения с конкретной стадией или конечным результатом заболевания, нарушения или состояния или с конкретными клиническими признаками. Как правило, заданный уровень получают при анализах эталонных индивидуумов (или популяций индивидуумов). Измеряемое анализируемое соединение может включать его фрагменты, его продукты деградации, и/или его продукты ферментативного расщепления.
В частности, в отношении заданного уровня, используемого для мониторинга прогрессирования и/или лечения заболевания, количество или концентрация анализируемого соединения или его фрагмента могут быть "неизмененными", "благоприятными" (или "благоприятно измененными"), или "неблагоприятными" (или "неблагоприятно измененными"). Термины "повышенный" или "увеличенный" относятся к количеству или концентрации в исследуемом образце, которые превышают типичный или нормальный уровень или диапазон (например, заданный уровень), или превышают другой эталонный уровень или диапазон (например, уровень предшествующего или исходного образца). Термины "сниженный" или "уменьшенный" относится к количеству или концентрации в исследуемом образце, которые ниже типичного или нормального уровня или диапазона (например, заданного уровня), или ниже другого эталонного уровня или диапазона (например, предшествующего или исходного образца). Термин "измененный" относится к количеству или концентрации в образце, которые изменены (повышены или снижены) относительно типичного или нормального уровня диапазона (например, заданного уровня), или относительно другого эталонного уровня или диапазона (например, предшествующего или исходного уровня).
Типичный или нормальный уровень или диапазон для анализируемого соединения определяют согласно стандартной практике. Поскольку уровни анализируемого соединения в некоторых случаях могут быть очень низкими, можно считать, что так называемый измененный уровень или изменение появились, когда существует какое-либо суммарное изменение по сравнению с типичным или нормальным уровнем или диапазоном, или эталонным уровнем или диапазоном, который нельзя объяснить экспериментальной ошибкой или разбросом выборки. Таким образом, уровень, измеренный в конкретном образце, можно сравнивать с уровнем или диапазоном уровней, определенных в сходных образцах от так называемого нормального индивидуума. В этом контексте, "нормальным индивидуумом" является индивидуум без поддающегося выявлению заболевания, например, и "нормальный" (иногда называемый "контрольным") пациент или популяция представляют собой, например, пациента (популяцию), который не имеет поддающегося выявлению заболевания, соответственно. Более того, с учетом того, что у большей части человеческой популяции анализируемое соединение не встречается обычно на высоком уровне, "нормального индивидуума" можно считать индивидуумом без существенного поддающегося детекции повышенного количества или концентрации анализируемого соединения, и "нормальный" (иногда называемый "контрольным") пациент или популяция представляют собой, например, пациента (популяцию), который не проявляет поддающихся выявлению повышенных или увеличенных количества или концентрации анализируемого соединения. "По-видимому нормальный индивидуум" представляет собой индивидуума, у которого анализируемое соединение еще не оценивали или оценивается в настоящее время. Уровень анализируемого соединения называют "повышенным", когда анализируемое соединение в норме не поддается детекции (например, нормальный уровень составляет ноль, или находится в диапазоне от приблизительно 25 до приблизительно 75 процентилей от нормальной популяции), однако выявляется в исследуемом образце, а также когда анализируемое соединение присутствует в исследуемом образце на уровне, выше нормального. Таким образом, среди прочего, в описании предоставлен способ скрининга индивидуума, имеющего конкретное заболевание, нарушение или состояние, или имеющего риск их наличия. Способ анализа также может вовлекать анализ других маркеров и т.п.
Таким образом, способы, описанные в настоящем описании, также можно использовать для определения того, имеет ли индивидуум данное заболевание, нарушение или состояние, или не имеет их, или имеет ли он риск развития данного заболевания, нарушения или состояния, или не имеет его. Конкретно, такой способ может включать стадии:
(a) определения концентрации или количества IL-1β (или его фрагмента) в исследуемом образце от индивидуума (например, с использованием способов, описанных в настоящем описании, или способов известных в данной области); и
(b) сравнения концентрации или количества IL-1β (или его фрагмента), определенных на стадии (a), с заданным уровнем, где, если концентрация или количество анализируемого соединения, определенные на стадии (a), являются благоприятными относительно заданного уровня, тогда индивидуума определяют как не имеющего данного заболевания, нарушения или состояния, или как не имеющего риска данного заболевания, нарушения или состояния. Однако, если концентрация или количество IL-1β, определенные на стадии (a), являются неблагоприятными относительно заданного уровня, тогда индивидуума определяют как имеющего данное заболевание, нарушение или состояние, или имеющего их риск.
Кроме того, в настоящем описании предоставлен способ мониторинга прогрессирования заболевания у индивидуума. В оптимальном случае, способ включает стадии:
(a) определения концентрации или количества IL-1β в исследуемом образце от индивидуума;
(b) определения концентрации или количества IL-1β в последнем исследуемом образце от индивидуума; и
(c) сравнения концентрации или количества анализируемого соединения при определении на стадии (b) с концентрацией или количеством IL-1β, определенными на стадии (a), где, если концентрация или количество, определенные на стадии (b), являются неизмененными или неблагоприятными по сравнению с концентрацией или количеством IL-1β, определенными на стадии (a), тогда определяют, что заболевание у индивидуума продолжается, прогрессирует или ухудшается. Аналогично, если концентрация или количество IL-1β, определенные на стадии (b), являются благоприятными по сравнению с концентрацией или количеством IL-1β, определенными на стадии (a), тогда определяют, что заболевание у индивидуума прекратилось, подверглось регрессии или улучшению.
Необязательно, способ дополнительно включает сравнение концентрации или количества анализируемого соединения IL-1β, определенного на стадии (b), например, с заданным уровнем. Кроме того, необязательно способ включает лечение индивидуума одной или несколькими фармацевтическими композициями в течение периода времени, если сравнение показывает, что концентрация или количество анализируемого соединения, определенные на стадии (b), например, благоприятно изменились относительно заданного уровня.
Кроме того, способы можно использовать для мониторинга лечения у индивидуума, которому проводят лечение одной или несколькими фармацевтическими композициями. Конкретно, такие способы вовлекают получение первого исследуемого образца от индивидуума до введения индивидууму одной или нескольких фармацевтических композиций. Далее, определяют концентрацию или количество IL-1β в первом исследуемом образце от индивидуума (например, с использованием способов, описанных в настоящем описании или известных в данной области). После определения концентрации или количества IL-1β, необязательно концентрацию или количество IL-1β сравнивают с заданным уровнем. Если концентрация или количество IL-1β, определенные в первом исследуемом образце, ниже заданного уровня, тогда индивидуума не лечат одной или несколькими фармацевтическими композициями. Однако если концентрация или количество IL-1β, определенные в первом исследуемом образце, превышает заданный уровень, тогда индивидуума лечат одной или несколькими фармацевтическими композициями в течение некоторого периода времени. Период времени, в течение которого лечат индивидуума одной или несколькими фармацевтическими композициями, может определить специалист в данной области (например, период времени может составлять от приблизительно семи (7) суток до приблизительно двух лет, предпочтительно от приблизительно четырнадцати (14) суток до приблизительно одного (1) года).
В процессе лечения одной или несколькими фармацевтическими композициями, от индивидуума получают второй и последующие исследуемые образцы. Количество исследуемых образцов и время, в течение которого указанные исследуемые образцы получают от индивидуума, не являются критическими. Например, второй исследуемый образец можно получать через семь (7) суток после первого введения индивидууму одной или нескольких фармацевтических композиций, третий исследуемый образец можно получать через две (2) недели после первого введения индивидууму одной или нескольких фармацевтических композиций, четвертый исследуемый образец можно получать через три (3) недели после первого введения индивидууму одной или нескольких фармацевтических композиций, пятый исследуемый образец можно получать через четыре (4) недели после первого введения индивидууму одной или нескольких фармацевтических композиций, и т.д.
После получения каждого второго или последующих исследуемых образцов от индивидуума, во втором или последующих исследуемых образцах определяют концентрацию или количество анализируемого соединения IL-1β (например, с использованием способов, описанных в настоящем описании или известных в данной области). Затем концентрацию или количество IL-1β, определенных в каждом из второго и последующих исследуемых образцах, сравнивают с концентрацией или количеством анализируемого соединения, определенных в первом исследуемом образце (например, исследуемый образец, который первоначально необязательно сравнивали с заданным уровнем). Если концентрация или количество IL-1β, определенные на стадии (c), являются благоприятными по сравнению с концентрацией или количеством анализируемого соединения, определенными на стадии (a), тогда определяют, что заболевание у индивидуума прекратилось, подверглось регрессии или улучшению, и индивидууму следует продолжить введение одной или нескольких фармацевтических композиций стадии (b). Однако если концентрация или количество, определенные на стадии (c) являются неизмененными или неблагоприятными по сравнению с концентрацией или количеством анализируемого соединения, определенных на стадии (a), тогда определяют, что заболевание у индивидуума продолжается, прогрессирует или ухудшается, и индивидуума следует лечить более высокой концентрацией одной или нескольких фармацевтических композиций, вводимых индивидууму на стадии (b) или что индивидуума следует лечить одной или несколькими фармацевтическими композициями, которые отличаются от одной или нескольких фармацевтических композиций, вводимых индивидууму на стадии (b). Конкретно, индивидуума можно лечить одной или несколькими фармацевтическими композициями, которые отличаются от одной или нескольких фармацевтических композиций, которые ранее вводили индивидууму для снижения или уменьшения уровня анализируемого соединения у указанного индивидуума.
Как правило, для анализов, в которых может быть проведено повторное тестирование (например, мониторинг прогрессирования заболевания и/или ответа на лечения), второй или последующий исследуемые образцы получают через некоторый период времени после получения от индивидуума первого исследуемого образца. Конкретно, второй исследуемый образец от индивидуума можно получать через несколько минут, часов, суток, недель или лет после получения от индивидуума первого исследуемого образца. Например, второй исследуемый образец можно получать от индивидуума через период времени, составляющий приблизительно 1 минуту, приблизительно 5 минут, приблизительно 10 минут, приблизительно 15 минут, приблизительно 30 минут, приблизительно 45 минут, приблизительно 60 минут, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов, приблизительно 12 часов, приблизительно 13 часов, приблизительно 14 часов, приблизительно 15 часов, приблизительно 16 часов, приблизительно 17 часов, приблизительно 18 часов, приблизительно 19 часов, приблизительно 20 часов, приблизительно 21 час, приблизительно 22 часа, приблизительно 23 часа, приблизительно 24 часа, приблизительно 2 суток, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток, приблизительно 7 суток, приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 5 недель, приблизительно 6 недель, приблизительно 7 недель, приблизительно 8 недель, приблизительно 9 недель, приблизительно 10 недель, приблизительно 11 недель, приблизительно 12 недель, приблизительно 13 недель, приблизительно 14 недель, приблизительно 15 недель, приблизительно 16 недель, приблизительно 17 недель, приблизительно 18 недель, приблизительно 19 недель, приблизительно 20 недель, приблизительно 21 неделю, приблизительно 22 недели, приблизительно 23 недели, приблизительно 24 недели, приблизительно 25 недель, приблизительно 26 недель, приблизительно 27 недель, приблизительно 28 недель, приблизительно 29 недель, приблизительно 30 недель, приблизительно 31 неделю, приблизительно 32 недели, приблизительно 33 недели, приблизительно 34 недели, приблизительно 35 недель, приблизительно 36 недель, приблизительно 37 недель, приблизительно 38 недель, приблизительно 39 недель, приблизительно 40 недель, приблизительно 41 неделю, приблизительно 42 недели, приблизительно 43 недели, приблизительно 44 недели, приблизительно 45 недель, приблизительно 46 недель, приблизительно 47 недель, приблизительно 48 недель, приблизительно 49 недель, приблизительно 50 недель, приблизительно 51 неделю, приблизительно 52 недели, приблизительно 1,5 года, приблизительно 2 года, приблизительно 2,5 года, приблизительно 3,0 года, приблизительно 3,5 года, приблизительно 4,0 года, приблизительно 4,5 года, приблизительно 5,0 лет, приблизительно 5,5 лет, приблизительно 6,0 лет, приблизительно 6,5 лет, приблизительно 7,0 лет, приблизительно 7,5 лет, приблизительно 8,0 лет, приблизительно 8,5 лет, приблизительно 9,0 лет, приблизительно 9,5 лет или приблизительно 10,0 лет после получения от индивидуума первого исследуемого образца.
При применении для мониторинга прогрессирования заболевания, указанный выше анализ можно использовать для мониторинга прогрессирования заболевания у индивидуумов, страдающих острыми состояниями. Острые состояния, также известные как критические состояния, относятся к острым угрожающим жизни заболеваниям или другим критическим медицинским состояниям, вовлекающим, например, сердечно-сосудистую систему или выделительную систему. Как правило, критические состояния относятся к состояниям, требующим острого медицинского вмешательства в больничных условиях (включая, но не ограничиваясь ими, комнату оказания экстренной помощи, блок интенсивной терапии, травматологический пункт или другие помещения для неотложной помощи) или контроля средним медицинским персоналом или другим персоналом полевой медицины. Для критических состояний, повторный мониторинг обычно проводят в течение более коротких временных рамок, а именно, минут, часов или суток (например, приблизительно 1 минута, приблизительно 5 минут, приблизительно 10 минут, приблизительно 15 минут, приблизительно 30 минут, приблизительно 45 минут, приблизительно 60 минут, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов, приблизительно 12 часов, приблизительно 13 часов, приблизительно 14 часов, приблизительно 15 часов, приблизительно 16 часов, приблизительно 17 часов, приблизительно 18 часов, приблизительно 19 часов, приблизительно 20 часов, приблизительно 21 час, приблизительно 22 часа, приблизительно 23 часа, приблизительно 24 часа, приблизительно 2 суток, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток, приблизительно 7 суток), и аналогично исходный анализ обычно проводят через более короткий период времени, например, приблизительно через нескольких минут, часов или суток, после начала заболевания или состояния.
Также анализы можно использовать для мониторинга прогрессирования заболевания у индивидуумов, страдающих хроническими или неострыми состояниями. Некритические или неострые состояния относится к состояниям, отличным от острых угрожающих жизни заболеваний или других критических медицинских состояний, вовлекающих, например, сердечно-сосудистую и/или выделительную системы. Как правило, неострые состояния включают длительные или хронические состояния. Для неострых состояний, повторный мониторинг обычно проводят в течение более длительного периода времени, например, часов, суток, недель, месяцев или лет (например, приблизительно 1 час, приблизительно 2 часа, приблизительно 3 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 6 часов, приблизительно 7 часов, приблизительно 8 часов, приблизительно 9 часов, приблизительно 10 часов, приблизительно 11 часов, приблизительно 12 часов, приблизительно 13 часов, приблизительно 14 часов, приблизительно 15 часов, приблизительно 16 часов, приблизительно 17 часов, приблизительно 18 часов, приблизительно 19 часов, приблизительно 20 часов, приблизительно 21 час, приблизительно 22 часа, приблизительно 23 часа, приблизительно 24 часа, приблизительно 2 суток, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток, приблизительно 7 суток, приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 5 недель, приблизительно 6 недель, приблизительно 7 недель, приблизительно 8 недель, приблизительно 9 недель, приблизительно 10 недель, приблизительно 11 недель, приблизительно 12 недель, приблизительно 13 недель, приблизительно 14 недель, приблизительно 15 недель, приблизительно 16 недель, приблизительно 17 недель, приблизительно 18 недель, приблизительно 19 недель, приблизительно 20 недель, приблизительно 21 неделю, приблизительно 22 недели, приблизительно 23 недели, приблизительно 24 недели, приблизительно 25 недель, приблизительно 26 недель, приблизительно 27 недель, приблизительно 28 недель, приблизительно 29 недель, приблизительно 30 недель, приблизительно 31 неделю, приблизительно 32 недели, приблизительно 33 недели, приблизительно 34 недели, приблизительно 35 недель, приблизительно 36 недель, приблизительно 37 недель, приблизительно 38 недель, приблизительно 39 недель, приблизительно 40 недель, приблизительно 41 неделю, приблизительно 42 недели, приблизительно 43 недели, приблизительно 44 недели, приблизительно 45 недель, приблизительно 46 недель, приблизительно 47 недель, приблизительно 48 недель, приблизительно 49 недель, приблизительно 50 недель, приблизительно 51 неделю, приблизительно 52 недели, приблизительно 1,5 года, приблизительно 2 года, приблизительно 2,5 года, приблизительно 3,0 года, приблизительно 3,5 года, приблизительно 4,0 года, приблизительно 4,5 года, приблизительно 5,0 лет, приблизительно 5,5 лет, приблизительно 6,0 лет, приблизительно 6,5 лет, приблизительно 7,0 лет, приблизительно 7,5 лет, приблизительно 8,0 лет, приблизительно 8,5 лет, приблизительно 9,0 лет, приблизительно 9,5 лет или приблизительно 10,0 лет), и аналогично исходный анализ обычно проводят через более длительный период времени, например, приблизительно через несколько часов, суток, месяцев или лет, после начала заболевания или состояния.
Более того, описанные выше анализы можно проводить с использованием первого исследуемого образца, полученного от индивидуума, где исследуемый образец получен из одного источника, такого как моча, сыворотка или плазма. Необязательно, указанные выше анализы можно впоследствии повторять с использованием второго исследуемого образца, полученного от индивидуума, где второй исследуемый образец получен из другого источника. Например, если первый исследуемый образец был получен из мочи, второй исследуемый образец можно получать из сыворотки или плазмы. Результаты, полученные в анализах с использованием первого исследуемого образца и второго исследуемого образца, можно сравнивать. Сравнение можно использовать для оценки статуса заболевания или состояния у индивидуума.
Более того, настоящее описание также относится к способам определения того, будет ли полезным лечение для индивидуума, предрасположенного к данному заболеванию, нарушению или состоянию, или страдающего ими. В частности, описание относится к сопутствующим способам и продуктам для диагностики анализируемого соединения. Таким образом, способ "мониторинга лечения заболевания у индивидуума", как описано в настоящем описании, в оптимальном случае может дополнительно охватывать выбор или идентификацию кандидатов для лечения.
Таким образом, в конкретных вариантах осуществления описание также относится к способу определения того, является ли индивидуум, имеющий заболевание, нарушение или состояние, или имеющий их риск, кандидатом для лечения. Как правило, индивидуумом является индивидуум, который имеет какой-либо симптом данного заболевания, нарушения или состояния, или который в фактически диагностирован как имеющий данное заболевание, нарушение или состояние, или имеющий их риск, и/или у которого выявлена неблагоприятная концентрация или количество анализируемого соединения или его фрагмента, как описано в настоящем описании.
Способ необязательно включает анализ, как описано в настоящем описании, где IL-1β оценивают до и после лечения индивидуума одной или несколькими фармацевтическими композициями (например, в частности, фармацевтической композицией, связанной с механизмом действия, вовлекающим анализируемое соединение), иммуносупрессивной терапией, или иммуносорбционной терапией, или где после такого лечения оценивают анализируемое соединение, и концентрацию или количество анализируемого соединения сравнивают с заданным уровнем. Неблагоприятные концентрация или количество IL-1β, наблюдаемые после лечения, подтверждают, что индивидууму не будет полезно проведение дополнительного лечения или продолжение лечения, в то время как благоприятные концентрация или количество анализируемого соединения, наблюдаемые после лечения, подтверждают, что индивидууму будет полезно проведение дополнительного лечения или продолжение лечения. Это подтверждение содействует проведению клинических испытаний и предоставлению пациенту улучшенного ухода.
Разумеется, хотя определенные варианты осуществления, описанные в настоящем описании, являются преимущественными при использовании для оценки данного заболевания, нарушения или состояния, как рассмотрено в настоящем описании, анализы и наборы можно использовать для оценки анализируемого соединения при других заболеваниях, нарушениях и состояниях. Способ анализа также может вовлекать анализ других маркеров и т.п.
Способ анализа также можно использовать для идентификации соединения, которое приводит к смягчению данного заболевания, нарушения или состояния. Например, клетку, которая экспрессирует анализируемое соединение, можно контактировать с соединением-кандидатом. Уровень экспрессии анализируемого соединения в клетке после контакта с соединением можно сравнивать с уровнем экспрессии в контрольной клетке с использованием способа анализа, описанного в настоящем описании.
II. Наборы
Также предусматривается набор для анализа исследуемого образца в отношении присутствия, количества или концентрации анализируемого соединения (или его фрагмента) в исследуемом образце. Набор содержит по меньшей мере один компонент для анализа исследуемого образца в отношении IL-1β (или его фрагмента) и инструкции по анализу анализируемого соединения (или его фрагмента) в исследуемом образце. По меньшей мере один компонент для анализа анализируемого соединения (или его фрагмента) в исследуемом образце может включать композицию, содержащую связывающий IL-1β белок, такой как моноклональное антитело или DVD-Ig (или его фрагмент, вариант или фрагмент варианта), как описано в настоящем описании, и который необязательно иммобилизован на твердой фазе.
Набор может содержать по меньшей мере один компонент для анализа IL-1β в исследуемом образце с помощью иммуноанализа, например, иммуноанализа хемилюминесцентных микрочастиц, и инструкции по анализу исследуемого образца в отношении IL-1β с помощью иммуноанализа, например, иммуноанализа хемилюминесцентных микрочастиц. Например, набор может содержать по меньшей мере один специфический связывающий партнер для IL-1β, такой как моноклональное/поликлональное антитело против IL-1β (или его фрагмент, который может связываться с IL-1β, его вариант, который может связываться с анализируемым соединением, или фрагмент варианта, который может связываться с анализируемым соединением) или DVD-Ig против IL-1β (или его фрагмент, вариант или фрагмент варианта), каждый из которых может быть мечен поддающейся детекции меткой. Альтернативно или дополнительно, набор может содержать поддающийеся детекции IL-1β (или его фрагмент, который может связываться с моноклональным/поликлональным антителом против анализируемого соединения или an DVD-Ig против анализируемого соединения (или его фрагментом, вариантом или фрагментом варианта)), которые могут конкурировать с анализируемым соединением в исследуемом образце за связывание с моноклональным/поликлональным антителом против анализируемого соединения (или его фрагментом, который может связываться с анализируемым соединением, его вариантом, который может связываться с анализируемым соединением или фрагментом варианта, который может связываться с анализируемым соединением) или с DVD-Ig против анализируемого соединения (или его фрагментом, вариантом или фрагментом варианта), каждый из которых может быть иммобилизован на твердой подложке. Набор может содержать калибратор или контроль, например, выделенное или очищенное анализируемое соединение. Набор может содержать по меньшей мере один контейнер (например, пробирку, микропланшет для титрования или полоски, которые, например, могут уже быть покрыты первым специфическим связывающим партнером) для проведения анализа, и/или буфер, такой как буфер для анализа или буфер для промывания, каждый из которых может быть предоставлен в качестве концентрированного раствора, раствор субстрата для поддающейся детекции метки (например, ферментной метки), или стоп-раствор. Предпочтительно, набор содержит все компоненты, т.е. реагенты, стандарты, буферы, разбавители и т.д., которые необходимы для проведения анализа. Инструкции могут быть предоставлены в бумажной форме или в считываемой компьютером форме, такой как диск, CD, DVD или сходные с ними.
Любой связывающий белок, такой как связывающий белок против IL-1β или DVD-Ig против анализируемого соединения, или индикатор могут включать поддающуюся детекции метку, как описано в настоящем описании, такую как флуорофор, радиоактивная группа, фермент, метка биотин/авидин, хромофор, хемилюминесцентная метка или сходные с ними, или набор может включать реагенты для проведения поддающегося детекции мечения. Антитела, калибраторы и/или контроли могут находиться в отдельных контейнерах или они могут быть предварительно распределены в соответствующем формате для анализа, например, в микропланшете для титрования.
Необязательно, набор включает компоненты контроля качества (например, панели чувствительности, калибраторы и положительные контроли). Приготовление реагентов контроля качества хорошо известно в данной области и описано на листках-вкладышах для различных иммунодиагностических продуктов. Компоненты панели чувствительности необязательно используют для установления рабочих характеристик анализа и для стандартизации анализов, и, кроме того, они необязательно являются пригодными индикаторами целостности реагентов набора для иммуноанализа.
Также набор необязательно может включать другие реагенты, требующиеся для проведения диагностического анализа или облегчения оценки контроля качества, такие как буферы, соли, ферменты, кофакторы ферментов, субстраты ферментов, реагенты для детекции и т.п. Также в набор могут быть включены другие компоненты, такие как буферы и растворы для выделения и/или обработки исследуемого образца (например, реагенты для предварительной обработки). Кроме того, набор может включать один или несколько других контролей. Один или несколько компонентов набора могут быть лиофилизированными, и в этом случае набор может дополнительно содержать реагенты, пригодные для восстановления лиофилизированных компонентов.
Различные компоненты набора необязательно предоставляют в пригодных контейнерах, при необходимости, например, в микропланшете для титрования. Кроме того, набор может включать контейнеры для содержания или хранения образца (например, контейнеры или кассеты для образца мочи). Когда это целесообразно, набор необязательно также может содержать реакционные емкости, емкости для смешивания и другие компоненты, которые облегчают приготовление реагентов или исследуемого образца. Также набор может включать один или несколько инструментов, облегчающих получение исследуемого образца, таких как шприц, пипетка, пинцет, мерная ложка или сходные с ними.
Если поддающаяся детекции метка представляет собой по меньшей мере одно соединение акридиния, набор может содержать по меньшей мере один акридиний-9-карбоксамид, по меньшей мере один ариловый сложный эфир акридиний-9-карбоксилата, или любую их комбинацию. Если поддающаяся детекции метка представляет собой по меньшей мере одно соединение акридиния, набор также может содержать источник пероксида водорода, такой как буфер, раствор, и/или по меньшей мере один основной раствор. Если желательно, набор может содержать твердую фазу, такую как магнитные частицы, гранулы, пробирка, микропланшет для титрования, кювета, мембрана, молекулы подложки, пленка, фильтровальная бумага, диск или чип.
III. Адаптация набора и способа
Набор (или его компоненты), а также способ определения присутствия, количества или концентрации анализируемого соединения в исследуемом образце с помощью анализа, такого как иммуноанализ, как описано в настоящем описании, можно адаптировать для применения во множестве автоматизированных и полуавтоматизированных систем (включая системы, где твердая фаза содержит микрочастицы), описанных, например, в патентах США №5089424 и 5006309, и коммерчески продаваемых, например, Abbott Laboratories (Abbott Park, Illinois), например ARCHITECT®.
Некоторые из различий между автоматизированной или полуавтоматизированной системой по сравнению с неавтоматизированной системой (например, ELISA) включают субстрат, с которым связан первый специфический связывающий партнер (например, моноклональное/поликлональное антитело против анализируемого соединения (или его фрагмента, его варианта или его фрагмента варианта) или DVD-Ig против анализируемого соединения (или его фрагмент, его вариант или его фрагмент варианта); в любом случае, может изменяться образование сэндвича и реактивность анализируемого соединения, и длительность и распределение во времени стадий улавливания, детекции и/или каких-либо необязательных стадий промывания. В то время как неавтоматизированный формат, такой как ELISA, может требовать относительно более длительного времени инкубации с образцом и улавливающим реагентом (например, приблизительно 2 часа), автоматизированный или полуавтоматизированный формат (например, ARCHITECT®, Abbott Laboratories) может иметь относительно более короткое время инкубации (например, приблизительно 18 минут для ARCHITECT®). Аналогично, в то время как в неавтоматизированном формате, таком как ELISA, инкубация антитела для детекции, такого как реагент конъюгата, может происходить в течение относительно более длительного времени инкубации (например, приблизительно 2 часа), автоматизированный или полуавтоматизированный формат (например, ARCHITECT®) может иметь относительно более короткое время инкубации (например, приблизительно 4 минуты для ARCHITECT®).
Другие платформы, доступные от Abbott Laboratories, включают, но не ограничиваются ими, AxSYM®, IMx® (см., например, патент США №5294404), PRISM®, EIA (гранулы), и QuantumTM II, а также другие платформы. Кроме того, анализы, наборы и компоненты наборов можно использовать в других форматах, например, на электрохимических или других переносных или локальных системах для анализа. Настоящее изобретение, например, применимо для коммерческой системы локального электрохимического иммуноанализа от Abbott (i-STAT®, Abbott Laboratories), которая осуществляет сэндвич-иммуноанализы. Иммуносенсоры и способы их изготовления и применение в одноразовых устройствах для тестирования описаны, например, в патенте США №5063081, публикации US №2003/0170881, публикации US №2004/0018577, публикации US №2005/0054078 и публикации US №2006/0160164.
В частности, в отношении адаптации анализа анализируемого соединения к системе I-STAT®, предпочтительной является следующая конфигурация. Кремниевый чип, изготавливаемый с помощью микротехнологий, изготавливают с помощью пары золотых амперометрических рабочих электродов и эталонного электрода из серебра-хлорида серебра. На одном из рабочих электродов, с его полимерным покрытием из структурированного поливинилового спирта связаны полистироловые гранулы (диаметр 0,2 мм) с иммобилизованным моноклональным/поликлональным антителом против анализируемого соединения (или его фрагментом, его вариантом или его фрагментом варианта) или DVD-Ig против анализируемого соединения (или его фрагментом, его вариантов или его фрагментом варианта). Чип собран в кассету I-STAT® со струйным форматом, пригодным для иммуноанализа. На части стенки содержащей образец камеры кассеты находится слой, содержащий специфический связывающий партнер для анализируемого соединения, такой как моноклональное/поликлональное антитело против анализируемого соединения (или его фрагмент, его вариант или его фрагмент варианта) или DVD-Ig против анализируемого соединения (или его фрагмент, его вариант или его фрагмент варианта), любой из которых может быть меченным поддающейся детекции меткой. В мешке с жидкостью кассеты находится водный реагент, который включает фосфат п-аминофенола.
В ходе работы, образец, предположительно содержащий анализируемое соединение, добавляют в камеру для содержания в исследуемой кассете, и кассету помещают в устройство для считывания I-STAT®. После растворения в образце специфического связывающего партнера для анализируемого соединения, насосный элемент кассеты подает образец в трубку, содержащую чип. Здесь он раскачивается для обеспечения образования сэндвича. На предпоследней стадии анализа, жидкость подается из пакета в трубку для смывания образца с чипа в камеру для отходов. На последней стадии анализа метка на основе щелочной фосфатазы, реагирует с фосфатом п-аминофенола, отщепляя фосфатную группу и позволяя высвобожденному п-аминофенолу электрохимически окисляться на рабочем электроде. Исходя из измеренного тока, устройство для считывания способно вычислить количество анализируемого соединения в образце с помощью встроенного алгоритма и определенной в заводских условиях калибровочной кривой.
Кроме того, разумеется, что способы и наборы, описанные в настоящем описании, безусловно охватывают другие реагенты и способы для проведения иммуноанализа. Например, они охватывают различные буферы, которые известны в данной области и/или которые можно легко получить или оптимизировать для применения, например, для промывания, в качестве разбавителя конъюгата, разбавителя микрочастиц и/или в качестве разбавителя калибратора. Иллюстративным разбавителем конъюгата является разбавитель конъюгата ARCHITECT®, используемый в определенных наборах (Abbott Laboratories, Abbott Park, Illinois) и содержащий 2-(N-морфолино)этансульфоновую кислоту (MES), соль, блокатор белка, противомикробное средство и детергент. Иллюстративным разбавителем калибратора является разбавитель калибратора для анализа у человека ARCHITECT®, используемый в определенных наборах (Abbott Laboratories, Abbott Park, IL), который содержит буфер, содержащий MES, другую соль, блокатор белка и противомикробное средство. Кроме того, как описано в US с серийным номером №12/650241 (публикация US №2010/0167301; также см. публикацию PCT № WO 2010/078443), можно обеспечить повышенное создание сигнала, например, в формате кассеты I-Stat, с использованием последовательности нуклеиновой кислоты, связанной с сигнальным антителом в качестве усилителя сигнала.
Специалистам в данной области понятно, что другие пригодные модификации и адаптации способов по изобретению, описанных в настоящем описании, являются очевидными и их можно проводить с использованием пригодных эквивалентнов без отклонения от объема изобретения или вариантов осуществления, описанных в настоящем описании.
После подробного описания настоящего изобретения, оно станет более понятным с помощью следующих примеров, которые включены только для иллюстрации и не предназначены для ограничения изобретения.
ПРИМЕРЫ
Пример 1: Получение подвергнутых созреванию аффинности гуманизированных антител против IL-1β из клона E26
В таблице 6 представлены аминокислотные последовательности VH и VL гуманизированного антитела мыши E26 (GlaxoSniithKline, публикация PCT № WO 95/01997). Аминокислотные остатки отдельных CDR каждой последовательности VH и VL указаны полужирным шрифтом.

Подвергнутые созреванию аффинности гуманизированные антитела мыши E26 получали следующим образом. Одну библиотеку легких цепей конструировали так, чтобы она обладала ограниченным мутагенезом в следующих остатках: CDRL1: 30, 31, 32; CDRL2: 50, 53, 55, 56; CDRL3: 92, 93, 94, 96 и 97 (нумерация по Kabat). Получали две библиотеки тяжелых цепей, чтобы они обладали ограниченным мутагенезом в CDRH1 и CDRH2 в остатках 31, 33, 50, 52a, 55, 56, 57, 58 и 60 (нумерация по Kabat) или в CDRH3 в остатках 95, 96, 97, 98, 99, 100, 100a, 100b и 102. Библиотеки тяжелых цепей также обладали бинарным разнообразием в остатках 23(A/S), 24(A/S), 62(T/S), 84(P/A), 88(G/A), 91(F/Y) и 108(P/L) для обеспечения преобразования каркасной области в каркасную область эмбрионального типа в ходе селекций библиотек. Все три библиотеки подвергали селекции по отдельности с помощью снижающихся концентраций IL-1β яванского макака (cyno). Затем все мутантные последовательности CDR объединяли в одну библиотеку, имеющую мутации только в CDR VH, и другую библиотеку, имеющую мутации во всех шести CDR. Эти две комбинированных библиотеки подвергали более жестким условиям селекции с IL-1β человека и яванского макака до того, как отдельные антитела были идентифицированы и экспрессированы в качестве белков IgG для дальнейшей охарактеризации.
В таблице 7 представлен перечень аминокислотных последовательностей VH-области подвергнутых созреванию аффинности антител против IL-1β, происходящих из гуманизированного E26. Аминокислотные остатки отдельных CDR каждой последовательности VH показаны полужирным шрифтом.









В таблице 8 представлен перечень аминокислотных последовательностей областей VL подвергнутых созреванию аффинности гуманизированных антител против IL-1β, происходящих из E26. Аминокислотные остатки отдельных CDR каждой последовательности VL указаны полужирным шрифтом. N-концевая мутация D (Asp) на G (Gly), наблюдаемая в некоторых из подвергнутых созреванию аффинности последовательностях VL в таблице 8 ниже, наиболее вероятно, была результатом непреднамеренного мутагенеза, который происходил в ходе полимеразной цепной реакции (ПЦР), проводимой в процессе конструирования библиотеки. N-концевой остаток G можно было удалить без последствий, когда эти области использовали при конструировании молекул IgG.





Последовательности отдельных CDR областей VH и VL подвергнутых созреванию аффинности антител против IL-1β из гуманизированного E26 в представленных выше таблицах можно выравнивать для получения консенсусных последовательностей CDR, таких как последовательности в таблице 9.


Последовательности в таблице 10 конвертировали в IgG для дальнейшей охарактеризации. Клон подвергали мутации в J-области вариабельной области тяжелой и легкой цепей, называемых E26.13 JM VH и E26.13 JM VL, соответственно, для удаления мутаций каркасной области, не являющиеся мутациями эмбрионального типа. Аминокислотные остатки отдельных CDR указаны полужирным шрифтом.






Пример 2: Функциональная охарактеризация антител против IL-1β
Пример 2.1: Протокол твердофазного иммуноферментного анализа для IL-1β
Для определения того, связываются ли mAb против IL-1β с IL-1β человека, планшеты для ELISA (Nunc, MaxiSorp, Rochester, New York) инкубировали в течение ночи при 4°С с антителом против Fc человека, разбавленным буфером Pierce Coat до концентрации 2 мкг/мл (Jackson Immunoresearch, West Grove, Pennsylvania). Планшеты промывали пять раз в буфере для промывания (PBS, содержащий 0,05% Tween 20), и блокировали в течение 1 часа при 25°С в блокирующем буфере superblock (Thermo scientific, №37515) в количестве 200 мкл на лунку. Блокирующий буфер удаляли путем постукивания планшетов, и в лунки добавляли 2 мкг/мл каждого антитела в PBS, содержавшем 10% Superblock, 0,5% Tween-20 в количестве 100 мкл/лунка и инкубировали при 25°C в течение 1 часа. Лунки промывали пять раз в 1XPBST, и титровали 1 мкг/мл биотинилированного антигена в серийных разведениях 1:6 (для диапазона от мкг до пг в PBS, содержащем 10% Superblock, 0,05% Tween 20). Затем каждое разведение антигена добавляли в планшеты и инкубировали в течение 1 часа при 25°C. Лунки промывали пять раз в 1XPBST и инкубировали в течение 1 часа при 25°C с поли-HRP-стрептавидином (KPL №474-3000, Gaithersburg, Maryland). Лунки промывали пять раз в 1XPBST, и добавляли 100 мкл ULTRA-TMB ELISA (Pierce, Rockford, Illinois) на лунку. После проявления цвета реакцию останавливали 1 Н HCl и измеряли поглощение при 450 нМ. Результаты представлены в таблице 11 и числовая величина указывает на связывание антител против IL-1β с IL-1β человека.
Пример 2.2: Эффективность нейтрализации антител против IL-1β
Для исследования функциональной активности антител против IL-1β человека по изобретению антитела использовали в анализе MRC-5, который определяет способность антитела ингибировать активность IL-1β. Клеточная линия MRC-5 представляет собой клеточную линию фибробластов легкого человека, которая продуцирует IL-8 в ответ на IL-1β человека дозозависимым образом. Эта клеточная линия также продуцирует IL-8 в ответ на IL-1β яванского макака (cyno IL-1β). Клетки MRC-5 первоначально получали от ATCC и субкультивировали в полной MEM с 10% FBS и выращивали при 37°C в инкубаторе с 5% CO2. Для определения эффективности антитела в отношении нейтрализации IL-1β, антитела (50 мкл) добавляли в 96-луночный планшет (диапазон конечных концентраций от 1E-7 до IE-15 M) и предварительно инкубировали с 50 мкл IL-1β человека или яванского макака (конечная концентрация 50 пг/мл) в течение 1 часа при 37°C, 5% CO2. Затем к клеткам MRC-5 (посеянным за 24 часа до этого в концентрации 1E5/мл в количестве 100 мкл клеток/лунка) добавляли комплексы антиген-антитело (100 мкл). Планшеты для анализа инкубировали в течение ночи при 37°C в инкубаторе с 5% CO2. Эффективность антитела определяли по его способности ингибировать продуцирование IL-8. Продуцирование IL-8 человека измеряли в анализе на основе хемилюминесценции. В таблице 12 обобщенно представлена эффективность антител в отношении IL-1β человека и яванского макака.
Пример 2.3: Определение аффинности антител IL-1β с помощью поверхностного плазмонного резонанса
Анализ BIACORE (Biacore, Inc, Piscataway, New Jersey) определяет аффинность антител путем кинетических измерений констант скорости ассоциации и скорости диссоциации. Связывание антител с рекомбинантным очищенным IL-1β человека и IL-1β яванского макака определяли на основе поверхностного плазмонного резонанса с помощью устройства Biacore® 1000 или 3000 (Biacore® AB, Uppsala, Швеция) с использованием HBS-EP для прогонки (10 мМ HEPES [pH 7,4], 150 мМ NaCl, 3 мМ EDTA и 0,005% поверхностно-активное вещество P20) при 25°C. Все химические реагенты получали от Biacore® AB (Uppsala, Швеция) или в ином случае от из другого источника, как описано в тексте. Приблизительно 5000 RU специфического к фрагменту (Fcγ) IgG мыши поликлонального антитела козы (Pierce Biotechnology Inc, Rockford, Illinois), разбавленного в 10 мМ ацетате натрия (pH 4,5) прямо иммобилизовали на биосенсорном чипе CM5 для исследовательских целей с использованием стандартного набора присоединения аминов согласно инструкциям и процедурам изготовителя, в концентрации 25 мкг/мл. Не вступившие в реакцию группы на поверхности биосенсора блокировали этаноламином. Модифицированную карбоксиметилдекстраном поверхность в проточной ячейке 2 и 4 использовали в качестве реакционной поверхности. Немодифицированный карбоксиметилдекстран без антитела козы против IgG мыши в проточной ячейке 1 и 3 использовали в качестве эталонной поверхности. Для анализа кинетики, уравнения скорости реакции, полученные в модели Ленгмюра для связывания 1:1, приводили в соответствие одновременно с фазами ассоциации и диссоциации для всех восьми реакций (с использованием анализа глобального соответствия) с использованием программного обеспечения Biaevaluation 4.0.1. Очищенные антитела разбавляли в забуференном HEPES физиологическом растворе для улавливания на реакционных поверхностях со специфическими антителами козы против IgG мыши. Антитела, подлежащие улавливанию в качестве лиганда (25 мкг/мл), инжектировали над реакционными матрицами со скоростью потока 5 мкл/мин. Константы скорости ассоциации и диссоциации, Kon (единицы M-1с-1) и kOff (единицы c-1) определяли при постоянной скорости потока 25 мкл/мин. Константы скоростей определяли путем проведения измерений кинетики связывания при различных концентрациях антигена в диапазоне 10-200 нМ. Затем из кинетических констант скорости вычисляли равновесную константу диссоциации (единицы M) реакции между антителами или DVD-Ig и антигеном-мишенью по следующей формуле: KD=koff/kon. Связывание регистрировали как функцию времени и вычисляли кинетические константы скорости. В этом анализе, могут быть измерены константы скорости ассоциации до 106 M-1с-1 и константы скорости диссоциации до 10-6 с-1. В таблице 13 представлены показатели аффинности для антител против IL-1β человека.
Пример 3: Получение молекул IL-1α/β DVD-IgTM
Пример 3.1: Конструирование конструкций ДНК IL-1α/β DVD-Ig
Вариабельный домен антитела против IL-1α ("X3"; см. публикацию PCT № WO 95/14780) комбинировали с несколькими вариабельными доменами антитела против IL-1β в формате DVD-Ig (Wu et al., Nature Biotechnol., 25: 1290-1297 (2007); публикация PCT № WO 2007/024715 A2) амплификацией с помощью перекрывающейся ПЦР со встроенными последовательностями ДНК линкера. X3 также подвергали мутации в J-области вариабельной области тяжелой и легкой цепей, называемых X3 JM VH и X3 JM VL, соответственно, для удаления мутаций каркасной области, не являющихся мутациями эмбрионального типа. Амплифицированные продукты ПЦР субклонировали в экспрессирующие векторы, пригодные для временной экспрессии в клетках HEK293 и области открытых рамок считывания подтверждали секвенированием перед экспрессией DVD-Ig.
Пример 3.2: Экспрессия и продуцирование связывающих белков IL-1α/β DVD-Ig
После подтверждения последовательности ДНК все конструкции ДНК DVD-Ig размножали в E. coli и ДНК очищали с использованием Qiagen Hispeed Maxi Prep (каталожный номер №12662, QIAGEN). ДНК DVD-Ig трансфицировали в клетки 293E, находящиеся в log-фазе (0,5×106/мл, жизнеспособность >95%) путем смешения PEI и ДНК в соотношении 2:1 с 0,2 мкг/мл ДНК тяжелой цепи и 0,3 мкг/мл ДНК легкой цепи. Комплексу ДНК:PEI давали образовываться при комнатной температуре в вытяжном шкафу TC в течение пятнадцати минут перед добавлением клеток 293E. Через двадцать четыре к клеткам 293E добавляли 0,5% TNI. На пятые сутки супернатант собирали для измерения титра IgG1 человека. Клеточный супернатант собирали на седьмые сутки и фильтровали через 0,2-мкм фильтр PES. Супернатант очищали с использованием аффинной хроматографий с Sepharose с белком A согласно инструкциям изготовителя. Очищенные DVD-Ig элюировали с колонки 0,1 M глицином (pH 2,99) и сразу подвергали диализу в 15 мМ гистидиновый буфер (pH 6,0). Связывающие белки количественно определяли по A280 и анализировали масс-спектрометрией и SEC.
Пример 3.3: Последовательности конструкций IL-1α/β DVD-Ig
Определяли аминокислотные последовательности тяжелых и легких цепей белков DVD-Ig, способных связывать IL-1β человека и IL-1α человека. Аминокислотные последовательности вариабельных областей тяжелой цепи (VH), вариабельных областей легкой цепи (VL), константных областей легкой цепи (CL) и константных областей тяжелой цепи (CH) связывающих белков IL-1α/β DVD-Ig представлены в таблице 14 ниже. В таблице 14 аминокислотные последовательности для областей VL E26.13 и E26.35 обозначены SEQ ID NO: 238 и SEQ ID NO: 239, соответственно, вместо SEQ ID NO: 205 и SEQ ID NO: 209, как ранее представлено в таблице 10, чтобы учесть включение C-концевого остатка аргинина (R). Как понимают специалисты в области инженерии антител, этот C-концевой остаток аргинина является аминокислотным остатком в области соединения VL и CL каппа-областей в молекуле IgG и иногда его включают в область CL или, как в таблице 14 ниже, в область VL.














Линкерные последовательности указаны в качестве подчеркнутых остатков.
Пример 4:
Функциональная охарактеризация белков IL-1α/β DVD-Ig
Пример 4.1:
Протокол твердофазного иммуноферментного анализа IL-1α/β
Связывание IL-1β и IL-1α связывающими белками IL-1β/α DVD-Ig оценивали с помощью ELISA (анализ описан выше, пример 2.1). Результаты представлены в таблице 15.
Пример 4.2: Биоанализ и анализ нейтрализации IL-1α/β
Клетки MRC5 высевали в количестве 1,5-2×104 клеток на лунку в объеме 100 мкл и инкубировали в течение ночи при 37°C, 5% CO2. Приготавливали рабочий исходный раствор 20 мкг/мл DVD-Ig (4X концентрированный) в полной среде MEM. Проводили серийное разведение из восьми точек (5 мкг/мл-0,0003 мкг/мл) в полной MEM в планшетах для разведения Marsh. В 96-луночный планшет с v-образным дном (Costar №3894) добавляли шестьдесят пять мкл/лунка каждого разведения антитела в четырех экземплярах и 65 мкл раствора 200 пг/мл раствор IL-1α или IL-1β или 65 мкл смешанного раствора, содержавшего раствор 50 пг/мл как IL-1α, так и IL-1β. В контрольные лунки добавляли 65 мкл IL-1α или IL-1β в концентрации 200 пг/мл или смешанного IL-1α/β (4x концентрированного) в концентрации 50 пг/мл плюс 65 мкл среды MEM и в лунки с контролем среды добавляли 130 мкл среды. После инкубации в течение 1 часа к клеткам MRC5 добавляли 100 мкл смеси DVD-Ig/Ag. Все объемы лунок были равны 200 мкл. Следовательно все реагенты планшетов имели концентрацию 1X. После инкубации в течение 16-20 часов содержимое лунок (150 мкл переносили в 96-луночный планшет с круглым дном (Costar №3799) и помещали в морозильную камеру при -20°C. Супернатанты тестировали в отношении уровней hIL-8 с использованием набора для ELISA IL-8 человека (R&D Systems, Minneapolis, Minnesota) или MSD hIL-8 (хемилюминесцентный набор). Эффективность нейтрализации определяли путем вычисления процентного ингибирования относительно величины для контроля в виде IL-1α, IL-1β или IL-1α/β отдельно (таблица 16).
Пример 4.3: Измерение аффинности молекул IL-1α/β DVD-Ig
Связывание IL-1α/β DVD-Ig с очищенными рекомбинантными IL-1β и IL-1α человека и IL-1β и IL-1α яванского макака определяли с использованием поверхностного плазмонного резонанса, как описано в примере 2.3, и результаты представлены в таблице 17.
Включение в качестве ссылки
Настоящее изобретение включает в полном объеме способы, хорошо известные в области молекулярной биологии и доставки лекарственных средств. Эти способы включают, но не ограничиваются ими, способы, описанные в следующих публикациях: Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Ausubel, F. M. et al. eds., Short Protocols In Molecular Biology (4th Ed. 1999) John Wiley & Sons, NY. (ISBN 0-471-32938-X). Controlled Drug Bioavailability Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Giege et al., Chapter 1, Crystallization of Nucleic Acids and Proteins, A Practical Approach, 2nd ed., (Ducruix and Giege, eds.) (Oxford University Press, New York, 1999) pp. 1-16; Goodson, J.M., Chapter 6, Medical Applications of Controlled Release, Vol. II, Applications and Evaluation, (Langer and Wise, eds.) (CRC Press, Inc., Boca Raton, 1984), pp. 115-138; Hammerling et al., eds., "Monoclonal Antibodies and T-Cell Hybridomas", Research Monographs in Immunology, vol. 3 (J.L. Turk, General Editor) (Elsevier, New York, 1981), pp. 563-587; Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987); Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Kontermann and Diibel, eds., Antibody Engineering (2001) Springer-Verlag. New York. 790 pp. (ISBN 3-540-41354-5); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990); Lu and Weiner eds., Cloning and Expression Vectors for Gene Function Analysis (2001) BioTechniques Press. Westborough, Mass. 298 pp. (ISBN 1-881299-21-X); Goodson, J.M., Medical Applications of Controlled Release, (Langer and Wise, eds.) (CRC Press, Boca Raton, 1974); Old and Primrose, Principles of Gene Manipulation: An Introduction To Genetic Engineering (3d Ed. 1985) Blackwell Scientific Publications, Boston; Studies in Microbiology. V.2:409 pp. (ISBN 0-632-01318-4); Sambrook, J. et al., Molecular Cloning: A Laboratory Manual (2d Ed. 1989) Cold Spring Harbor Laboratory Press, NY. Vols. 1-3 (ISBN 0-87969-309-6); Sustained and Controlled Release Drug Delivery Systems, (J.R. Robinson, ed.) (Marcel Dekker, Inc., New York, 1978); Winnacker, E.L. From Genes To Clones: Introduction To Gene Technology (1987) VCH Publishers, N.Y. (translated by Horst Ibelgaufts), 634 pp. (ISBN 0-89573-614-4).
Содержание всех цитированных ссылок (включая литературные ссылки, патенты, патентные заявки и web-сайты), которые цитированы на протяжении данной заявки, включено в настоящее описание в качестве ссылки в полном объеме, также как и ссылки, цитированные в них. Для осуществления настоящего изобретения на практике используются, если нет иных указаний, общепринятые способы иммунологии, молекулярной биологии и клеточной биологии, которые хорошо известны в данной области.
Эквиваленты
Изобретение может быть осуществлено в других конкретных формах без отклонения от его сущности или неотъемлемых характеристик. Представленные выше варианты осуществления, таким образом, следует считать во всех отношениях иллюстративными, а не ограничивающими изобретение, описанное в настоящем описании. Таким образом, объем изобретения определяется прилагаемой формулой изобретения, а не представленным выше описанием, и, таким образом, подразумевается, что все изменения, которые попадают в значение и диапазон эквивалентности формулы изобретения, охватываются настоящим описанием.
Реферат
Настоящая группа объектов изобретения относится к области биотехнологии и иммунологии. Предложен биспецифический связывающий белок, который содержит первую полипептидную цепь, включающую два вариабельных домена тяжелой цепи антитела, и вторую полипептидную цепь, включающую два вариабельных домена легкой цепи антитела, (DVD-Ig). Белок по изобретению связывает IL-1β человека и IL-1α человека. В дополнение рассмотрена выделенная молекула нуклеиновой кислоты, вектор экспрессии, клетка-хозяин и основанный на их использовании способ получения связывающего белка по изобретению. Кроме того, представлена фармацевтическая композиция, способы понижения активности IL-1 человека и способ лечения субъекта-человека от воспалительного нарушения. Белок по настоящему изобретению обладает нейтрализующей активностью в отношении IL-1β человека и IL-1α человека и, таким образом, может найти дальнейшее применение в терапии заболеваний, связанных с IL-1. 9 н. и 6 з.п. ф-лы, 17 табл., 4 пр.









Комментарии