Композиции и способы перорального введения эксенатида - RU2566063C2
Код документа: RU2566063C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям для перорального приема, содержащим эксенатид, и способам их применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Благодаря достижениям биотехнологии в значительной степени увеличилась доступность биологически активных белков для фармацевтической промышленности. Однако ограничивающим фактором в развитии белковых препаратов стала их относительная неэффективность при пероральном применении. Почти все белковые препараты вводят парентерально, несмотря на то, что парентеральное введение белковых препаратов часто связано с низкой комплаентностью у пациента.
Эксенатид представляет собой агонист глюкагоноподобного пептида (GLP-1), который одобрен Управлением по контролю над пищевыми продуктами и лекарственными препаратами в качестве средства дополнительной терапии в случае, когда контроль состояния пациентов с диабетом 2-го типа при помощи метформина оказывается неоптимальным. Эксенатид представляет собой миметик инкретина и усиливает секрецию инсулина, с одновременным ингибированием секреции глюкагона и замедлением эвакуации пищи из желудка.
Эксенатид (коммерчески доступный под названием Баета) производится и выпущен на рынок компаниями «Amylin Pharmaceuticals» и «Eli Lilly and Company». Эксенатид представляет собой синтетическую форму эксендина-4, гормона, присутствующего в слюне ядозуба Хила, ящерицы, обитающей в некоторых юго-западных штатах США. Обычные реакции организма человека на эксенатид включают положительные изменения в первоначальном быстром высвобождении эндогенного инсулина, подавлении выработки панкреатического глюкагона, замедлении эвакуации содержимого из желудка и снижении аппетита, назначение которых снизить уровень глюкозы в крови. В отличие от сульфонилмочевины и меглитинидов эксенатид увеличивает синтез и секрецию инсулина только в присутствии глюкозы, что уменьшает риск гипогликемии. Также Баету применяют некоторые врачи для лечения инсулинорезистентности.
Эксенатид усиливает реакцию поджелудочной железы (то есть увеличивает секрецию инсулина) в ответ на прием пищи. Результатом является выработка большего, более адекватного количества инсулина, что помогает снизить повышение уровня сахара в крови после еды. Как только уровень сахара в крови приближается к нормальным показателям, выработка инсулина поджелудочной железой уменьшается. Тем не менее, другие препараты (подобные инсулину в виде инъекций), эффективные для снижения уровня сахара в крови, могут оказать чрезмерное влияние и стать причиной слишком низкого уровня сахара в крови, что может привести к опасному состоянию гипогликемии.
Эксенатид также подавляет выработку глюкагона в поджелудочной железе в ответ на прием пищи, что приостанавливает синтез избыточного количества сахара в печени, когда в этом нет необходимости, и предотвращает возникновение гипергликемии (высокого уровня сахара в крови).
Эксенатид помогает замедлить эвакуацию содержимого из желудка и таким образом уменьшает скорость, при которой глюкоза, полученная вместе с пищей, поступает в кровяное русло.
Эксенатид оказывает незначительное, однако пролонгированное действие в отношении снижения аппетита и, следовательно, может препятствовать увеличению массы тела. Большинство людей, применяющих эксенатид, медленно теряют в весе и, как правило, наибольшую потерю массы тела наблюдают у людей, которые имеют наибольший избыточный вес в начале лечения эксенатидом. Клинические испытания показывают, что эффект уменьшения массы тела сохраняется на том же уровне в течение 2.25 лет постоянного применения. При разделении данных по потере массы тела на квартили - верхние 25% испытуемых испытывают существенную потерю в весе, а у нижних 25% вес не изменился или слегка увеличился.
Эксенатид уменьшает содержание жира в печени. Накопление жира в печени, или неалкогольная жировая болезнь печени (NAFLD, НАЖБП), имеет непосредственное отношение к нескольким метаболическим нарушениям, в частности к низкому уровню холестерола-ЛПВП и повышенному содержанию триглицеридов у пациентов с диабетом 2-го типа. Было обнаружено, что эксенатид уменьшает содержание жиров в печени у мышей и позднее у человека.
Эксенатид представляет собой полипептид, состоящий из 39 аминокислот с молекулярной массой 4186.6. Исследования перфузии плаценты человека ex vivo выявили минимальные уровни со стороны плода (коэффициент плод:мать 0.017).
На сегодняшний день эксенатид вводят как подкожную инъекцию, как правило, одновременно с сульфонилмочевиной или метформином. Хотя такое применение оказывает незначительный эффект на снижение уровня глюкозы в крови натощак, зато заметно уменьшает уровень глюкозы после приема пищи.
Настоящее изобретение устраняет необходимость в альтернативном пути введения эксенатида.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает, в одном варианте осуществления, композицию, которая содержит эксенатид и ингибитор протеазы, при этом указанная композиция представляет собой фармацевтическую композицию для перорального применения или фармацевтическую композицию для ректального применения.
В другом варианте реализации настоящее изобретение обеспечивает способ перорального или ректального введения эксенатида субъекту, в результате чего значительная часть эксенатида сохраняет свою активность после абсорбции через барьер слизистой оболочки кишечника или через ректальные ткани вышеуказанного субъекта, и который включает пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей вышеуказанный эксенатид.
В другом варианте реализации настоящее изобретение обеспечивает способ лечения сахарного диабета у субъекта, включающий пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей эксенатид, что обеспечивает лечение сахарного диабета.
В другом варианте реализации настоящее изобретение обеспечивает способ уменьшения потребления пищи субъектом, включающий пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей эксенатид, что приводит к сокращению количества потребляемой указанным субъектом пищи.
В другом варианте реализации настоящее изобретение обеспечивает способ уменьшения перистальтики желудка у субъекта, включающий пероральное или ректальное введение перорально или ректально указанному субъекту фармацевтической композиции, содержащей эксенатид, что приводит к уменьшению перистальтики желудка у указанного субъекта.
В другом варианте реализации настоящее изобретение обеспечивает способ снижения уровня глюкагона в плазме крови у субъекта, включающий пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей эксенатид, что приводит к снижению уровня глюкагона в плазме крови у указанного субъекта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
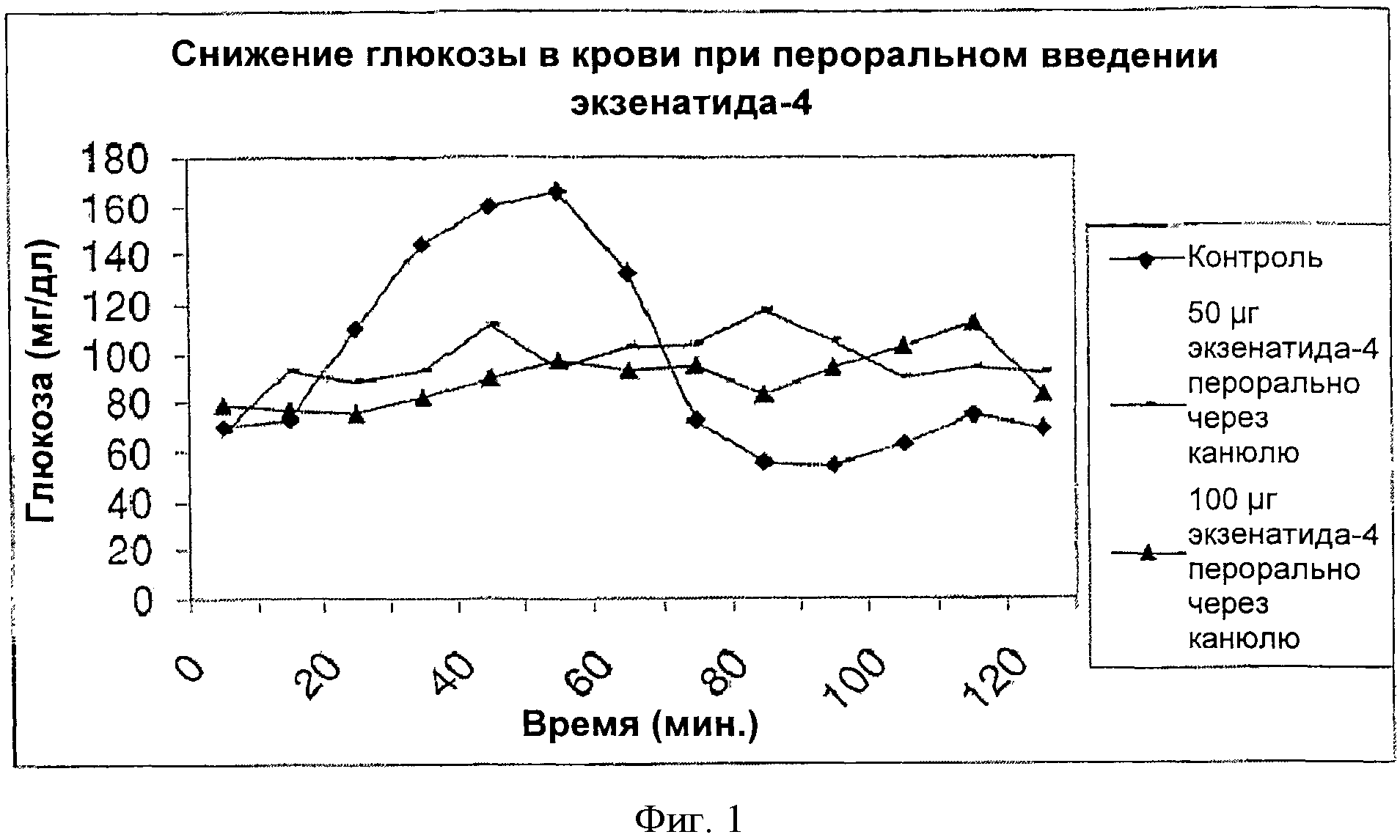
Фигура 1 представляет собой график, показывающий действие пероральной лекарственной формы Эксендина-4 в отношении снижения уровня глюкозы в крови у собак по сравнению с контролем.
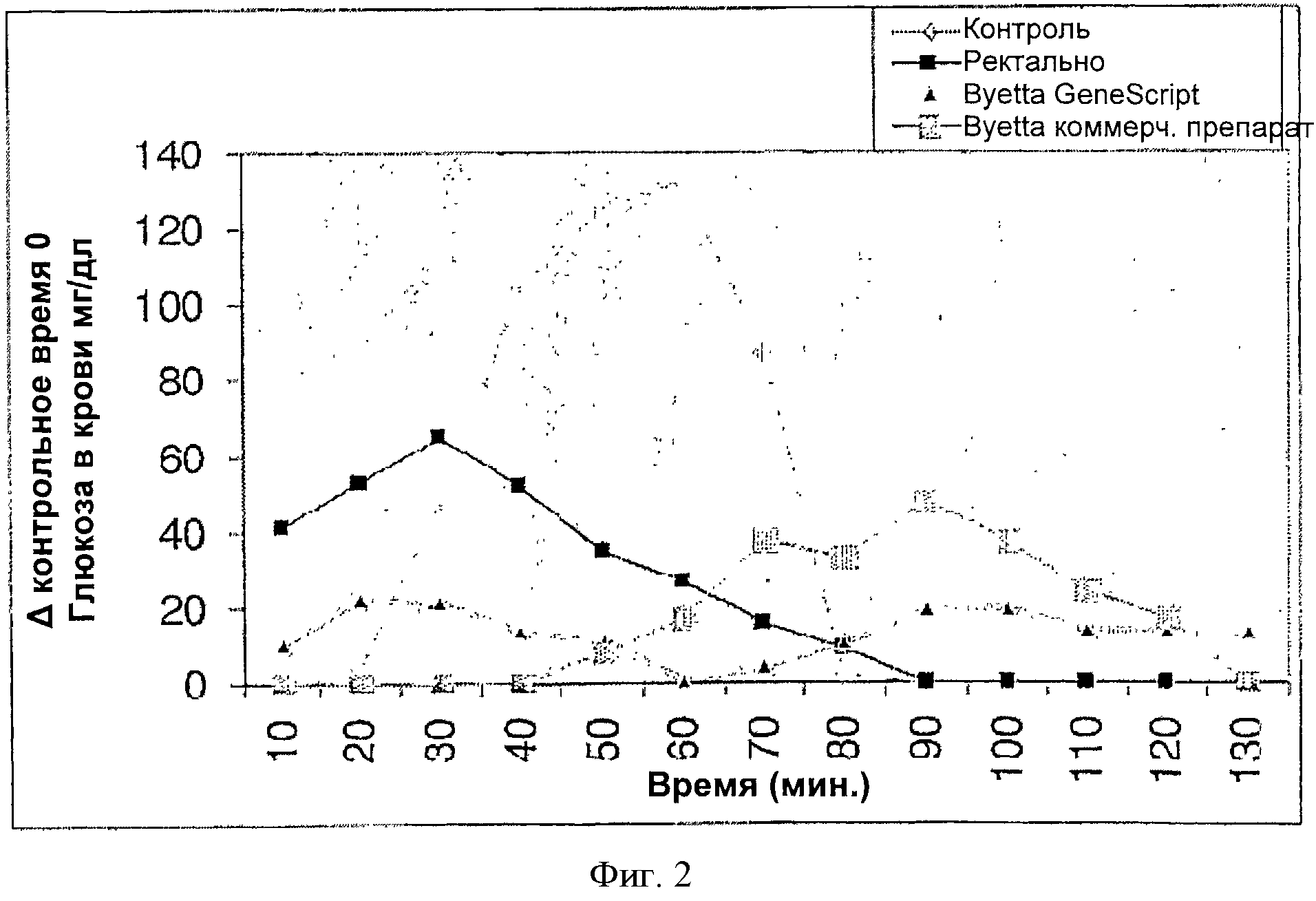
Фигура 2 представляет собой график, показывающий сравнительное действие Эксендина-4 в виде ректальной лекарственной формы (твердая желатиновая капсула, 100 мкг эксендина-4) и инъецируемых лекарственных форм (2.5 мкг Баеты ГенСкрипт и 2.5 мкг Баеты коммерческий) в отношении снижения уровня глюкозы в крови у собак по сравнению с контролем. Значения рассчитаны для нулевого времени (концентрацию глюкозы в крови при нулевом времени вычитали из каждого значения, полученного за данный период).
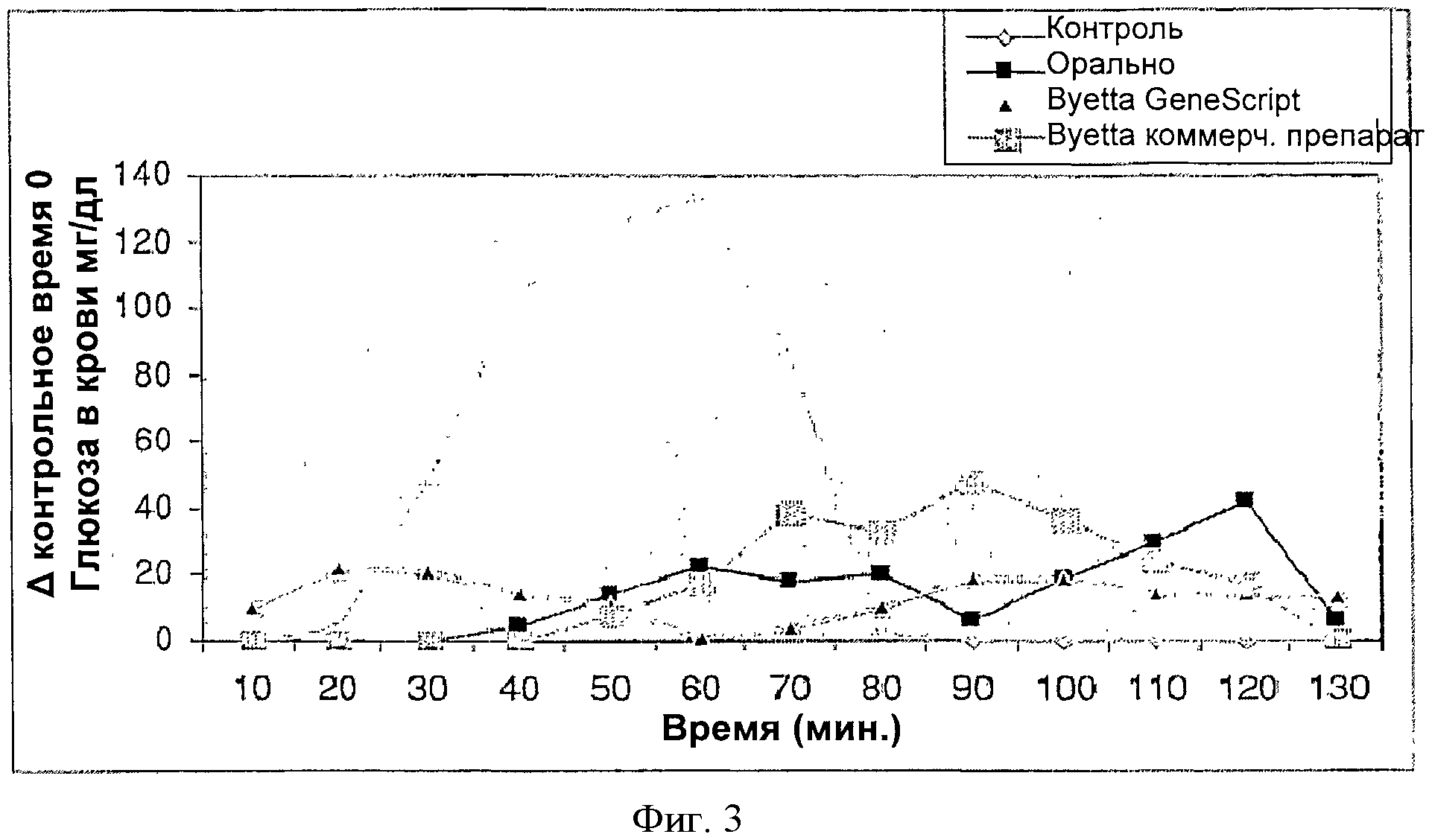
Фигура 3 представляет собой график, показывающие сравнительное действие Эксендина-4 в виде ректальной лекарственной формы (100 мкг эксендина-4) и инъецируемых лекарственных форм (2.5 мкг Баеты ГенСкрипт и 2.5 мкг Баеты коммерческий) на снижение уровня глюкозы в крови у собак по сравнению с контролем (концентрацию глюкозы в крови при нулевом времени вычитали из каждого значения, полученного заданный период).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает композиции и способы, включающие применение эксенатида и омега-3 жирной кислоты. В другом варианте осуществления настоящее изобретение обеспечивает композиции и способы, включающие применение эксенатида и ингибитора протеаз. В другом варианте осуществления настоящее изобретение обеспечивает композиции и способы, включающие применение эксенатида и энхансера, такого как ЭДТА (EDTA) и ее соли, такой как натрий ЭДТА (Na-EDTA). В другом варианте реализации настоящее изобретение обеспечивает композиции и способы, включающие применение эксенатида и натрий ЭДТА. В другом варианте реализации настоящее изобретение обеспечивает пероральные композиции, содержащие эксенатид. В другом варианте реализации настоящее изобретение обеспечивает пероральные композиции, содержащие эксенатид и натрий ЭДТА. В другом варианте осуществления настоящее изобретение обеспечивает пероральные композиции, содержащие эксенатид, омега-3 жирную кислоту и натрий ЭДТА. В другом варианте осуществления настоящее изобретение обеспечивает ректальные композиции, содержащие эксенатид и натрий ЭДТА. В другом варианте осуществления настоящее изобретение обеспечивает ректальные композиции, содержащие эксенатид, омега-3 жирную кислоту и натрий ЭДТА. В одном из вариантов осуществления настоящее изобретение обеспечивает композицию, содержащую эксенатид и омега-3 жирную кислоту. Согласно данному описанию (Примеры) указанные композиции полезны для обеспечения перорального введения эксенатида, в результате чего эксенатид абсорбируется из кишечника в кровяное русло в активной форме.
В другом варианте осуществления настоящего изобретения баета представляет собой патентованное название активного компонента эксенатида. В другом варианте осуществления настоящего изобретения эксенатид обозначют как АС 2993, и он представляет собой синтетический эксендин-4. В другом варианте осуществления настоящего изобретения эксенатид представляет собой 39-аминокислотный пептид. В другом варианте осуществления настоящего изобретения эксенатид содержит последовательность аминокислот:
HGEGTFTSDLSKOMEE EAVRLFIEWLKNGGPSSGAPPPS (SEQ ID NO:1). В другом варианте осуществления настоящего изобретения эксенатид включает аминокислотную последовательность SEQ ID NO:1. В другом варианте осуществления настоящего изобретения эксенатид содержит аминокислотную последовательность, имеющую по меньшей мере 70% идентичности с SEQ ID NO:1. В другом варианте осуществления настоящего изобретения эксенатид содержит аминокислотную последовательность, имеющую по меньшей мере 80% идентичности с SEQ ID NO:1. В другом варианте осуществления настоящего изобретения эксенатид содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с SEQ ID NO:1. В другом варианте осуществления настоящего изобретения эксенатид содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности с SEQ ID NO:1. В другом варианте осуществления настоящего изобретения эксенатид содержит аминокислотную последовательность, имеющую по меньшей мере 99% идентичности с SEQ ID NO:1.
В другом варианте осуществления настоящего изобретения пероральный или ректальный состав эксенатида согласно настоящему изобретению эффективен при лечении диабета. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению усиливает секрецию инсулина. В другом варианте осуществления настоящего изобретения эксенатид усиливает зависимую от глюкозы секрецию инсулина. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению подавляет повышенную секрецию глюкагона. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению снижает скорость эвакуации содержимого желудка. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению связывается с рецептором глюкагоноподобного пептида (GLP-1, ГПП-1) поджелудочной железы. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению уменьшает количество принимаемой пищи. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению становится причиной потери веса. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению оказывает инсулин-сенсибилизирующее действие. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению улучшает гликемический контроль у пациентов с диабетом 2-го типа. В другом варианте осуществления пероральный или ректальный состав эксенатида согласно настоящему изобретению улучшает гликемический контроль у пациентов с с диабетом 2-го типа, которые проходят лечение сульфонилмочевиной или метформином, отдельно или в сочетании.
В другом варианте осуществления настоящего изобретения эксенатид представляет собой Эксендин-4, аминокислотная последовательность которого на 53% совпадает с последовательностью GLP-1 млекопитающих. В другом варианте осуществления настоящего изобретения оральный или ректальный состав, содержащий эксенатид, устойчив к деградации под действием ДПП-4 (PDD IV). В другом варианте осуществления настоящего изобретения оральный или ректальный состав, содержащий эксенатид, уменьшает постпрандиальную гликемию. В другом варианте осуществления настоящего изобретения оральный или ректальный состав, содержащий эксенатид, стимулирует выработку инсулина и амилина. В другом варианте осуществления настоящего изобретения пероральный или ректальный состав, содержащий эксенатид, не связан с увеличением массы тела. В другом варианте осуществления настоящего изобретения пероральный или ректальный состав, содержащий эксенатид, уменьшает концентрацию триглицеридов в сыворотке крови после приема пищи. В другом варианте осуществления настоящего изобретения пероральный или ректальный состав, содержащий эксенатид, вызывает меньше побочных эффектов, чем инъецируемый состав, содержащий эксенатид. В другом варианте осуществления изобретения пероральный или ректальный состав, содержащий эксенатид, не вызывает тошноты. В другом варианте осуществления настоящего изобретения пероральный или ректальный состав, содержащий эксенатид, вызывает только легкие приступы тошноты. В другом варианте осуществления настоящего изобретения пероральный или ректальный состав, содержащий эксенатид, не вызывает гастропарез.
В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 10 мкг до 1 мг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 10 мкг до 25 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 25 мкг до 50 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 50 мкг до 60 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 60 мкг до 70 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 70 мкг до 80 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 80 мкг до 90 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 90 мкг до 100 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 100 мкг до 110 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 110 мкг до 125 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 125 мкг до 150 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 150 мкг до 175 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 175 мкг до 200 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 200 мкг до 220 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 220 мкг до 240 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 240 мкг до 260 мкг. В другом варианте осуществления настоящего изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 260 мкг до 300 мкг.
В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 300 мкг до 350 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 350 мкг до 400 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 400 мкг до 450 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 450 мкг до 500 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 550 мкг до 600 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 600 мкг до 700 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 700 мкг до 800 мкг. В другом варианте осуществления изобретения количество эксенатида в составе, описанном в настоящей заявке, составляет от 900 мкг до 1 мг.
В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают один раз в день. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают два раза в день. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают три раза в день. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают четыре раза в день. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают пять раз в день. В другом варианте осуществления настоящего изобретения специалист в данной области определяет дозу состава эксенатида, описанного в настоящей заявке. В другом варианте осуществления изобретения специалист в данной области определяет ежедневную дозу состава эксенатида, описанного в настоящей заявке. В другом варианте осуществления настоящего изобретения специалист в данной области определяет ежедневный режим дозирования состава эксенатида, описанного в настоящей заявке.
В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 15 минут до еды. В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 30 минут до еды. В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 45 минут до еды. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 60 минут до еды. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 75 минут до еды. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 90 минут до еды. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 100 минут до еды. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 120 минут до еды. В другом варианте осуществления изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 150 минут до еды. В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, принимают по меньшей мере за 180 минут до еды.
В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, уменьшает побочные эффекты, связанные с инъецируемой лекарственной формой, содержащей эксенатид. В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, уменьшает тошноту, которая является побочным эффектом, связанным с инъецируемой лекарственной формой, содержащей эксенатид. В другом варианте осуществления настоящего изобретения состав эксенатида, описанный в настоящей заявке, не вызывает тошноты, которая является побочным эффектом, который связан с инъецируемой лекарственной формой, содержащей эксенатид.
В другом варианте осуществления настоящего изобретения применение лекарственных форм с замедленным высвобождением (например, микрокапсул с замедленным высвобождением) позволяет сократить частоту лечения до одного или двух раз в сутки. В другом варианте осуществления настоящего изобретения дозу эксенатида увеличивают соответственно с уменьшением частоты введения.
Любое количество эксенатида представляет собой отдельный вариант осуществления настоящего изобретения. Средства измерения уровня эксенатида хорошо известны в данной области техники. В другом варианте осуществления настоящего изобретения также измеряют уровни пептида С для определения относительного вклада эндогенного и экзогенного эксенатида в обнаруженное увеличение уровня эксенатида. В другом варианте осуществления настоящего изобретения уровни эксенатида измеряют любыми другими способами, известными в данной области техники. Любая возможность представляет отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления настоящего изобретения омега-3 жирную кислоту получают из растительных источников, таких как семена чии, периллы, льна, грецкого ореха, портулака, брусники, облепихи и конопли. В некоторых вариантах осуществления изобретения омега-3 жирная кислота может быть обнаружена в плодах пальмовой асаи. В других вариантах осуществления настоящего изобретения омега-3 жирную кислоту обеспечивают в форме синтетической омега-3 жирной кислоты. В одном из вариантов осуществления омега-3 жирную кислоту для применения в способах и композициях согласно настоящему изобретению обеспечивают в виде рыбьего жира. В другом варианте осуществления настоящего изобретения омега-3 жирную кислоту обеспечивают в форме канолового масла. В другом варианте осуществления настоящего изобретения омега-3 жирную кислоту обеспечивают в форме льняного масла. В другом варианте осуществления настоящего изобретения омега-3 жирную кислоту обеспечивают в любой другой форме омега-3 жирной кислоты из богатого жирными кислотами источника, известного в данной области техники. В другом варианте осуществления изобретения омега-3 жирную кислоту обеспечивают в форме синтетической омега-3 жирной кислоты. Любая форма омега-3 жирной кислоты представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления омега-3 жирная кислота согласно способам и композициям настоящего изобретения представляет собой омега-3 полиненасыщенную жирную кислоту. В другом варианте осуществления настоящего изобретения омега-3 жирная кислота представляет собой ДГК (DHA), омега-3 полиненасыщенная, содержащая 22 углерода жирная кислота, также именуемая 4, 7, 10, 13, 16, 19- докозагексаеновая кислота. В другом варианте осуществления настоящего изобретения омега-3 жирная кислота представляет собой α-линоленовую кислоту (6, 9, 12, 15 - октадекатриеновая кислота). В другом варианте осуществления настоящего изобретения омега-3 жирная кислота представляет собой стеаридоновую кислоту (6, 9, 12, 15 - октадекатетраеновая кислота). В другом варианте осуществления настоящего изобретения омега-3 жирная кислота представляет собой эйкозатриеновую кислоту (ЭТК, 11, 14, 17 - эйкозатриеновая кислота). В другом варианте осуществления изобретения омега-3 жирная кислота представляет собой эйкозатетраеновую кислоту (8, 11, 14, 17 - эйкозатетраеновую кислоту). В одном из вариантов осуществления настоящего изобретения омега-3 жирная кислота представляет собой эйкозапентаеновую кислоту (ЭПК; 5, 8, 11, 14, 17 - эйкозапентаеновая кислота). В другом варианте осуществления настоящего изобретения омега-3 жирная кислота представляет собой эйкозагексаеноевую кислоту (также именуемая ЭПК; 5, 7, 9, 11, 14, 17 - эйкозагексаеноевая кислота). В другом варианте осуществления изобретения омега-3 жирная кислота представляет собой докозапентаеновую кислоту (ДПК; 7, 10, 13, 16, 19 - докозапентаеновая кислота). В другом варианте осуществления изобретения омега-3 жирная кислота представляет собой тетракозагексаеновую кислоту (6, 9, 12, 15, 18, 21 - тетракозагексаеновая кислота). В другом варианте осуществления настоящего изобретения омега-3 жирная кислота представляет собой любую другую омега-3 жирную кислоту, известную в данной области. Любая омега-3 кислота представляет отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления композиции согласно настоящему изобретению дополнительно содержат ингибитор протеаз. В другом варианте осуществления композиции согласно настоящему изобретению содержат комбинацию по меньшей мере из двух ингибиторов протеаз. Согласно настоящему описанию ингибиторы протеаз увеличивают способность омега-3 жирных кислот защищать эксенатид и усиливают его абсорбцию в кишечнике.
В некоторых вариантах осуществления настоящего изобретения указанный ингибитор протеаз ингибирует функцию пептидаз. В одном из вариантов осуществления настоящего изобретения ингибиторы протеаз усиливают способность омега-3 жирных кислот защищать белок согласно настоящему изобретению и усиливают его абсорбцию в кишечнике. В некоторых вариантах осуществления указанный ингибитор протеаз согласно настоящему изобретению представляет собой белок. В некоторых вариантах осуществления настоящего изобретения ингибиторы протеаз включают ингибиторы цистеиновых протеаз, ингибиторы сериновых протеаз (серпины), трипсиновые ингибиторы, ингибиторы треониновых протеаз, ингибиторы аспарагиновых протеаз, ингибиторы металлопротеиназ. В некоторых вариантах осуществления настоящего изобретения указанные ингибиторы протеаз включают суицидные ингибиторы, ингибиторы переходного состояния или хелатообразующие агенты.
В одном из вариантов осуществления настоящего изобретения указанный ингибитор протеаз представляет собой ингибитор трипсина из сои (soybean trypsin inhibitor, SBTI). В другом варианте осуществления настоящего изобретения указанный ингибитор протеаз представляет собой AEBSF-HCl. В другом варианте осуществления настоящего изобретения указанный ингибитор представляет собой (эпсилон) - аминокапроновую кислоту. В другом варианте осуществления настоящего изобретения указанный ингибитор представляет собой (альфа) 1-антихимотрипсин. В другом варианте осуществления изобретения ингибитор представляет собой антипаин. В другом варианте осуществления изобретения указанный ингибитор представляет собой антитромбин 3. В другом варианте осуществления изобретения указанный ингибитор представляет собой (альфа) 1-антитрипсин ([альфа] ингибитор протеиназы 1). В другом варианте осуществления изобретения указанный ингибитор представляет собой APMSF-HCl (4-амидинофенилметан сульфонилфторида). В другом варианте осуществления изобретения указанный ингибитор представляет собой апротинин. В другом варианте осуществления изобретения указанный ингибитор представляет собой бензамидин-HCl. В другом варианте осуществления изобретения указанный ингибитор представляет собой химостатин. В другом варианте осуществления изобретения указанный ингибитор представляет собой DFP (диизопропилфторфосфат). В другом варианте осуществления изобретения указанный ингибитор представляет собой лейпептин. В другом варианте осуществления настоящего изобретения указанный ингибитор представляет собой PEFABLOC® SC (4-(2-аминоэтил)-бензолсульфонил фторид гидрохлорида). В другом варианте осуществления изобретения ингибитор представляет собой PMSF (фенилметил сульфонил фторида). В другом варианте осуществления изобретения ингибитор представляет собой TLCK (1-хлоро-3-тозиламидо-7-амино-2-гептанон HCl). В другом варианте осуществления изобретения ингибитор представляет собой ТРСК (1-хлоро-3-тозиламидо-4-фенил-2-бутанон). В другом варианте осуществления настоящего изобретения указанный ингибитор представляет собой трипсиновый ингибитор из яичного белка (овомукоид). В другом варианте осуществления изобретения ингибитор представляет собой трипсиновый ингибитор из соевых бобов. В другом варианте осуществления изобретения ингибитор представляет собой апротинин. В другом варианте осуществления настоящего изобретения указанный ингибитор представляет собой изетионад пентамидина. В другом варианте осуществления изобретения ингибитор представляет собой пепстатин. В другом варианте осуществления изобретения указанный ингибитор представляет собой гуанидин. В другом варианте осуществления изобретения указанный ингибитор представляет собой альфа-2-макроглобулин. В другом варианте осуществления изобретения указанный ингибитор представляет собой хелатообразующий агент цинка. В другом варианте осуществления изобретения указанный ингибитор представляет собой йодоацетат. В другом варианте осуществления изобретения указанный ингибитор представляет собой цинк. Любая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления количество ингибитора протеазы, используемое в способах и композициях согласно настоящему изобретению, составляет 0.1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество ингибитора протеазы составляет 0.2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.3 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.4 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.6 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.8 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1.5 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2.5 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 7 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 12 мг/единица дозирования. В другом варианте осуществления настоящего изобретения указанное количество составляет 15 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 50 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 70 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 100 мг/единица дозирования.
В другом варианте осуществления изобретения указанное количество ингибитора протеаз составляет 0.1-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество ингибитора протеаз составляет 0.2-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.3-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.5-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.1-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.2-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.3-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.5-2 мг/единица дозирования. В другом варианте осуществления изобретения количество составляет 1-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5-20 мг/единица дозирования. В другом варианте осуществления настоящего изобретения указанное количество составляет 10-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 50-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 50-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 100-200 мг/единица дозирования.
В другом варианте осуществления изобретения количество ингибитора протеаз, которое используют в способах и композициях согласно настоящему изобретению, составляет 1000 КИЕ (калликреин инактивирующие единицы)/таблетка. В другом варианте осуществления изобретения указанное количество составляет 10 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 12 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 15 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 40 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 50 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 70 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 100 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 150 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 200 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 300 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 500 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 700 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1500 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3000 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 4000 КИЕ/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5000 КИЕ/единица дозирования.
Любое количество ингибитора протеаз представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления настоящего изобретения протеаза, являющаяся мишенью для указанного ингибитора протеаз согласно способам и композициям настоящего изобретения, представляет собой сериновую протеазу. В другом варианте осуществления изобретения указанная протеаза представляет собой трипсин. В другом варианте осуществления изобретения указанная протеаза представляет собой химотрипсин. В другом варианте осуществления изобретения указанная протеаза представляет собой карбоксипептидазу. В другом варианте осуществления изобретения указанная протеаза представляет собой аминопептидазу. В другом варианте осуществления изобретения указанная протеаза представляет собой любую другую протеазу, которая функционирует в двенадцатиперстной кишке и тонком кишечнике. Любая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления композиция согласно настоящему изобретению дополнительно содержит вещество, которое усиливает абсорбцию эксенатида сквозь слизистые оболочки кишечника. Такое вещество обозначают в данном описании как «энхансер». Согласно данному описанию энхансеры при использовании вместе с омега-3 жирными кислотами увеличивают способность эксенатида абсорбироваться в кишечнике.
В одном из вариантов осуществления настоящего изобретения указанный энхансер представляет собой дидеканоилфосфатидилхолин (ДДФХ, DDPC). В одном из вариантов осуществления изобретения указанный энхансер представляет собой хелатообразующий агент, такой как этилендиаминтетрауксусная кислота (ЭДТА, EDTA) или ЭГТА (egtazic acid, EGTA). В предпочтительном варианте осуществления изобретения ЭДТА представляет собой натрий ЭДТА. В некоторых вариантах осуществления настоящего изобретения указанный энхансер представляет собой NO донор. В некоторых вариантах осуществления настоящего изобретения указанный энхансер представляет собой желчную кислоту, глицин-конъюгированную форму желчной кислоты или соль щелочного металла. В одном из вариантов осуществления изобретения увеличение абсорбции достигается путем использования комбинации α-галактозидазы и β-маннаназы. В некоторых вариантах осуществления изобретения указанный энхансер представляет собой жирную кислоту, такую как капрат натрия. В одном из вариантов осуществления изобретения указанный энхансер представляет собой гликохолат натрия. В одном из вариантов осуществления изобретения указанный энхансер представляет собой салицилат натрия. В одном из вариантов осуществления изобретения указанный энхансер представляет собой n-додецил-β-D-мальтопиранозид. В некоторых вариантах осуществления изобретения в качестве указанного энхансера абсорбции выступают поверхностно активные вещества (сурфактанты). В одном из вариантов осуществления настоящего изобретения указанный энхансер представляет собой хитозан, такой как N,N,N-триметилхитозанхлорид (ТМХ, ТМС).
В одном из вариантов осуществления NO доноры согласно настоящему изобретению включают 3-(2-гидрокси-1-(1-метилэтил)-2-нитрозогидразин)-1-пропанамин, N-этил-2-(1-этил-гидрокси-2-нитрозогидразин)-этанамин или S-нитрозо-N-ацетилпеницилламин.
В другом варианте осуществления настоящего изобретения указанная желчная кислота представляет собой холевую кислоту. В другом варианте осуществления изобретения желчная кислота представляет собой хенодезоксихолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой таурохолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой таурохенодезоксихолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой гликохолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой гликохенохолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой 3 бета-моногидроксихлорноватую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой литохолевую кислоту. В другом варианте осуществления изобретения желчная кислота представляет собой 5 бета-холановую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой 3,12-диол-7-он-5 бета холановую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой 3 альфа-гидрокси-12-кетохолановую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой 3 бета-гидрокси-12-кетохолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой 12 альфа-3 бета-дигидрохолевую кислоту. В другом варианте осуществления изобретения указанная желчная кислота представляет собой урсодезоксихолевую кислоту.
В одном из вариантов осуществления изобретения указанный энхансер представляет собой неионогенное поверхностно-активное вещество (сурфактант). В одном из вариантов осуществления изобретения указанный энхансер представляет собой поверхностно-активное вещество на основе неионогенного эфира полиоксиэтилена (например, с величиной гидрофильно-липофильного баланса от 6 до 9, при котором среднее количество полиоксиэтиленовых единиц составляет от 4 до 30). В другом варианте осуществления настоящего изобретения указанный энхансер представляет собой анионное поверхностно-активное вещество. В другом варианте осуществления изобретения указанный энхансер представляет собой катионное поверхностно-активное вещество. В другом варианте осуществления настоящего изобретения указанный энхансер представляет собой амфотерное поверхностно-активное вещество. В одном из вариантов осуществления настоящего изобретения в качестве энхансеров абсорбции применяют цвиттер-ионные сурфактанты, такие как ацилкарнитины.
В другом варианте осуществления изобретения количество энхансера, которое используют в способах и композициях согласно настоящему изобретению, составляет 0.1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество энхансера составляет 0.2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.3 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.4 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.6 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.8 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1.5 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2.5 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 7 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10 мг/единица дозирования. В другом варианте осуществления настоящего изобретения указанное количество составляет 12 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 15 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 50 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 70 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 100 мг/единица дозирования.
В другом варианте осуществления настоящего изобретения указанное количество энхансера составляет 0.1-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество энхансера составляет 0.2-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.3-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.5-1 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.1-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.2-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.3-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 0.5-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1-2 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5-10 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 1-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 2-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 3-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10-20 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 5-100 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 10-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 20-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 30-200 мг/единица дозирования. В другом варианте осуществления изобретения указанное количество составляет 50-200 мг/единица дозирования. В другом варианте осуществления настоящего изобретения указанное количество составляет 100-200 мг/единица дозирования.
Любые тип и количество энхансера представляют собой отдельные варианты осуществления настоящего изобретения.
В другом варианте осуществления композиции согласно настоящему изобретению дополнительно содержат покрытие, которое препятствует разрушению композиции в желудке субъекта.
В одном из вариантов осуществления изобретения указанное покрытие препятствует разрушению композиции в желудке субъекта. В одном из вариантов осуществления покрытые лекарственные составы согласно настоящему изобретению высвобождают лекарство при смещении рН в сторону щелочного диапазона. В одном из вариантов осуществления настоящего изобретения покрытие представляет собой монослой, причем при других вариантах осуществления настоящего изобретения используют многослойное покрытие. В одном из вариантов осуществления покрытие представляет собой биоадгезивный полимер, который выборочно связывается со слизистыми оболочками кишечника и таким образом делает возможным высвобождение лекарства в месте присоединения. В одном из вариантов осуществления настоящего изобретения кишечнорастворимое покрытие представляет собой пленочную кишечнорастворимую оболочку. В некоторых вариантах осуществления покрытие содержит биодеградируемые полисахариды, хитозан, водный раствор ацетатфталат целлюлозы, водную дисперсию этилцеллюлозы (ЭЦД, ECD), азополимер, фталат ацетата целлюлозы, тримеллитат ацетата целлюлозы, фталат гидроксипропилметила целлюлозы, желатин, фталат ацетата поливинила, гидрогель, pulsincap или их комбинации. В одном из вариантов осуществления настоящего изобретения можно применять покрытие, которое чувствительно к значению рН предпочтительного места и/или профиля высвобождения, как известно специалисту в данной области техники.
В одном из вариантов осуществления настоящего изобретения указанное покрытие представляет собой кишечнорастворимую оболочку. Средства получения кишечнорастворимой оболочки хорошо известны в данной области техники и описаны, например, в Siepmann F, Siepmann J и др. Смеси водных дисперсий полимеров, используемые для покрытия гранул: значение размеров частиц. J Control Release 2005; 105 (3): 226-39; and Huyghebaert N, Vermeire A, Remon JP. Анализ in vitro полимерных покрытий для кишечнорастворимой оболочки и прицельное воздействие на повздошную кишку человека. Int J Pharm 2005; 298 (1): 26-37. Любой способ представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления изобретения в качестве кишечнорастворимой оболочки применяют акриловый полимер - Eudragit®. Применение акрилового полимера для кишечнорастворимой оболочки в фармацевтических составах хорошо известно в данной области техники. Было показано, что акриловый полимер Эудрагит является безопасным, не абсорбируется, не метаболизируется в организме и выводится почти полностью.
В другом варианте осуществления настоящего изобретения указанное покрытие представляет собой желатиновое покрытие. В другом варианте осуществления изобретения для защиты эксенатида от расщепления в желудке применяют микроинкапсулирование. Способы нанесения желатинового покрытия и микроинкапсулирования хорошо известны в данной области техники. Любой способ представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления настоящего изобретения указанное покрытие представляет собой пленочную оболочку. В другом варианте осуществления настоящего изобретения указанное покрытие представляет собой водную дисперсию этилцеллюлозы, например гидроксипропилметил целлюлозы (ГПМЦ, НРМС) Е15. В другом варианте осуществления изобретения указанное покрытие представляет собой устойчивое к желудочному соку оболочку, например полимер, содержащую группы карбоновых кислот в качестве функциональной части. В другом варианте осуществления настоящего изобретения указанное покрытие представляет собой монолитный матрикс. В другом варианте осуществления изобретения указанное покрытие представляет собой эфир целлюлозы (например, (НРМС)). Любой тип покрытия представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления настоящего изобретения для предотвращения переваривания композиции в желудке применяют лекарственные формы, состоящие из множества частиц.
Любой тип покрытия, лекарственная форма и т.п., которые предотвращают переваривание указанной композиции в желудке, представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления настоящее изобретение обеспечивает способ перорального или ректального введения эксенатида субъекту, при котором значительная часть эксенатида сохраняет свою активность после абсорбции через барьер слизистых оболочек кишечника или через барьер ректальных слизистых оболочек субъекта и который включает пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей эксенатид и ингибитор протеаз, что таким образом обеспечивает пероральное или ректальное введение эксенатида указанному субъекту. В другом варианте осуществления настоящее изобретение обеспечивает способ перорального или ректального введения эксенатида субъекту, при котором значительная часть эксенатида сохраняет свою активность после абсорбции через барьер слизистых оболочек кишечника или через барьер ректальных слизистых оболочек субъекта и который включает пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей эксенатид и омега-3 жирную кислоту.
В другом варианте осуществления настоящее изобретение обеспечивает способ лечения сахарного диабета у субъекта, включающий пероральное или ректальное введение указанному субъекту фармацевтической композиции, содержащей эксенатид и омега-3 жирную кислоту, что обеспечивает лечение сахарного диабета.
В одном из вариантов осуществления настоящего изобретения сахарный диабет представляет собой сахарный диабет 1-го типа. В другом варианте осуществления изобретения сахарный диабет представляет собой сахарный диабет 2-го типа. В другом варианте осуществления изобретения сахарный диабет представляет собой инсулинозависимый диабет.
В другом варианте осуществления изобретения сахарный диабет представляет собой инсулиннезависимый диабет. В другом варианте осуществления изобретения сахарный диабет представляет собой любой другой тип диабета, известный в данной области. Любая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В одном из вариантов осуществления настоящего изобретения проводят шесть процедур лечения указанной композицией эксенатида в день. В одном из вариантов осуществления настоящего изобретения проводят пять процедур лечения указанной композицией эксенатида в день. В другом варианте осуществления изобретения проводят четыре процедуры лечения указанной композицией эксенатида в день. В другом варианте осуществления настоящего изобретения проводят три процедуры лечения указанной композицией эксенатида в день. В другом варианте осуществления изобретения проводят две процедуры в день. В другом варианте осуществления изобретения проводят четыре процедуры в день. В другом варианте осуществления изобретения проводят одну процедуру в день. В другом варианте осуществления изобретения проводят более чем четыре процедуры в день. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления настоящего изобретения в результате перорального или ректального введения эксенатида пациентам с диабетом 2-го типа концентрация эксенатида в плазме резко увеличивается и достигает среднего значения пиковой концентрации в плазме в течение 1.5-3 часов. В другом варианте осуществления настоящего изобретения в результате перорального или ректального введения наблюдают измеряемые концентрации эксенатида в течение примерно 10 часов после введения состава.
В другом варианте осуществления настоящего изобретения в результате 2-дневного перорального или ректального введения эксенатида пациентам с диабетом 2-го типа наблюдают уменьшение среднего показателя HbA1C. В другом варианте осуществления изобретения в результате 3-дневного перорального или ректального введения эксенатида наблюдают уменьшение среднего показателя HbA1C. В другом варианте осуществления изобретения в результате 4-дневного перорального или ректального введения эксенатида наблюдают уменьшение среднего показателя HbA1C. В другом варианте осуществления настоящего изобретения в результате 2-дневного перорального или ректального введения эксенатида наблюдают уменьшение среднего показателя HbA1C.
В другом варианте осуществления настоящего изобретения 20-300 мкм эксенатида, введенного дозами до еды, обеспечивают снижение колебаний уровня глюкозы после еды. Кроме того, вероятность временного снижения уровня глюкозы в крови была выше, когда пациенты получали эксенатид, который вводили после еды. В другом варианте осуществления настоящего изобретения 20-300 мкм эксенатида следует вводить не позднее, чем за 180 минут до еды. В другом варианте осуществления изобретения 20-300 мкм эксенатида следует вводить не позднее, чем за 150 минут до еды. В другом варианте осуществления изобретения 20-300 мкм эксенатида следует вводить не позднее, чем за 120 минут до еды. В другом варианте осуществления изобретения 20-300 мкм эксенатида следует вводить не позднее, чем за 90 минут до еды. В другом варианте осуществления настоящего изобретения 20-300 мкм эксенатида следует вводить не позднее, чем за 60 минут до еды. В другом варианте осуществления изобретения 20-300 мкм эксенатида следует вводить не позднее, чем за 30 минут до еды.
В другом варианте осуществления настоящего изобретения эксенатид показан для лечения сахарного диабета 1-го типа. В другом варианте осуществления настоящего изобретения эксенатид показан для лечения сахарного диабета (СД, DM) 2-го типа в сочетании с метформином и/или сульфонилмочевиной у пациентов, у которых не достигнут адекватный гликемический контроль при максимально допустимых дозах. В другом варианте осуществления настоящего изобретения эксенатид показан для лечения сахарного диабета (СД, DM) 2-го типа в сочетании с метформином. В другом варианте осуществления настоящего изобретения эксенатид показан для лечения сахарного диабета (СД, DM) 2-го типа в сочетании с сульфонилмочевиной. В другом варианте осуществления эксенатид согласно настоящему изобретению получают в форме единичной дозы в комбинации с сульфонилмочевиной. В другом варианте осуществления эксенатид согласно настоящему изобретению получают в форме единичной дозы в комбинации с метформином.
В другом варианте осуществления составы эксенатида согласно настоящему изобретению полезны благодаря их фармакологическим свойствам. В другом варианте осуществления составы эксенатида согласно настоящему изобретению обладают активностью в отношении снижения уровня глюкагона в крови. В другом варианте осуществления составы эксенатида согласно настоящему изобретению подавляют секрецию глюкагона, что подтверждает их способность снижать уровень глюкагона у животных и человека. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для лечения состояний или заболеваний, которые можно облегчить посредством снижения уровня глюкагона и подавления секреции глюкагона.
Соединения, упомянутые выше, могут образовывать соли с разными органическими и неорганическими кислотами и основаниями. Такие соли включают соли, полученные на основе органических и неорганических кислот, таких как, например: HCl, HBr, H2SO4, H3PO4, трифторуксусная кислота, уксусная кислота, муравьиная кислота, метансульфоновая кислота, толуолсульфоновая кислота, малеиновая кислота, фумаровая кислота и камфорсульфоновая кислота. Соли, полученные из оснований, включают соли аммония, соли щелочных металлов, например соли натрия и калия, соли щелочноземельных металлов, например соли кальция и магния. Предпочтительными являются соли ацетатов, гидрохлоридов и трифторацетатов. Соли могут быть образованы традиционными способами, например, путем взаимодействия продукта в форме свободной кислоты или основания с одним или более эквивалентом соответствующего основания или кислоты в растворителе или среде, в которой соль нерастворима, или в растворителе, таком как вода, которую затем удаляют под вакуумом, или путем лиофилизации, или путем обмена ионами имеющейся соли на другой ион на подходящей ионообменной смоле.
Ожирение и переедание
В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для предупреждения ожирения. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для предупреждения избытка жировой ткани. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для предупреждения рисков для здоровья, связанных с чрезмерным потреблением пищи. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для предупреждения заболеваний, связанных с ожирением, таких как диабет 2-го типа, увеличенный риск сердечных заболеваний, гипертензия, атеросклероз, дегенеративный артрит и увеличенная вероятность осложнений хирургического вмешательства с применением общей анестезии. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для лечения заболеваний, связанных с ожирением, таких как диабет 2-го типа, увеличенный риск сердечных заболеваний, гипертензия, атеросклероз, дегенеративный артрит и увеличенная вероятность осложнений хирургического вмешательства с применением общей анестезии. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для уменьшения риска развития заболеваний, связанных с ожирением, таких как диабет 2-го типа, увеличенный риск сердечных заболеваний, гипертензия, атеросклероз, дегенеративный артрит и увеличенная вероятность осложнений хирургического вмешательства с применением общей анестезии.
В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для контроля над массой тела. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для поддержания массы тела. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для сокращения потребления пищи. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для сокращения потребления пищи у субъектов, страдающих ожирением. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для уменьшения уровня глюкозы в плазме крови. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для уменьшения уровня липидов в плазме крови. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для предупреждения переедания. В другом варианте осуществления составы эксенатида согласно настоящему изобретению применяют для лечения переедания.
В другом варианте осуществления изобретения необходимо принять во внимание, что доступность эффективного способа сокращения количества принимаемой пищи является главной задачей, и улучшенный способ лечения может оказаться очень полезным. Такие полезные способ, соединения и композиции, содержащие эксенатид, соответственно, были разработаны, описаны и заявлены в настоящем документе. В любом способе согласно настоящему изобретению можно применить, в разных вариантах осуществления настоящего изобретения, любую из композиций согласно настоящему изобретению.
В другом варианте осуществления настоящее изобретение обеспечивает композицию для перорального или ректального введения эксенатида, содержащего белок эксенатида и ингибитор протеазы, при этом значительная часть эксенатида сохраняет ферментативную активность после абсорбции через барьер слизистых оболочек кишечника у указанного субъекта. В другом варианте осуществления настоящее изобретение обеспечивает композицию для перорального или ректального введения эксенатида, содержащего белок эксенатида и энхансер, при этом значительная часть эксенатида сохраняет ферментативную активность после абсорбции через барьер слизистых оболочек кишечника у указанного субъекта. В другом варианте осуществления настоящее изобретение обеспечивает композицию для перорального или ректального введения эксенатида, содержащего белок эксенатида и омега-3 жирную кислоту, при этом значительная часть эксенатида сохраняет ферментативную активность после абсорбции через барьер слизистых оболочек кишечника у указанного субъекта.
В одном из вариантов осуществления настоящее изобретение обеспечивает применение эксенатида и ингибитора протеазы в производстве медикамента для перорального или ректального введения эксенатида субъекту, при этом значительная часть эксенатида сохраняет свою активность после абсорбции через барьер слизистых оболочек кишечника у указанного субъекта. В одном из вариантов осуществления настоящее изобретение обеспечивает применение эксенатида и энхансера в производстве медикамента для перорального или ректального введения эксенатида субъекту, при этом, значительная часть эксенатида сохраняет свою активность после абсорбции через барьер слизистых оболочек кишечника у указанного субъекта. В одном из вариантов осуществления настоящее изобретение обеспечивает применение эксенатида и омега-3 жирной кислоты в производстве медикамента для перорального или ректального введения эксенатида субъекту, при этом значительная часть эксенатида сохраняет свою активность после абсорбции через барьер слизистых оболочек кишечника у указанного субъекта.
В одном из вариантов осуществления настоящее изобретение обеспечивает применение белка эксенатида и ингибитора протеазы в производстве медикамента для лечения сахарного диабета у субъекта. В одном из вариантов осуществления настоящее изобретение обеспечивает применение белка эксенатида и энхансера в производстве медикамента для лечения сахарного диабета у субъекта. В одном из вариантов осуществления настоящее изобретение обеспечивает применение белка эксенатида и омега-3 жирную кислоту в производстве медикамента для лечения сахарного диабета у субъекта.
В другом варианте осуществления настоящего изобретения разные компоненты композиции согласно настоящему изобретению абсорбируются с разной скоростью из полости кишечника в кровяное русло. Абсорбция желчной кислоты в одном из вариантов осуществления настоящего изобретения происходит значительно быстрее, чем абсорбция эксенатида.
По этой причине в другом варианте осуществления настоящего изобретения схема приема лекарственного средства включает прием внутрь пары таблеток через определенные интервалы времени, например вторую таблетку, содержащую высокую концентрацию энхансера, принимают через определенный интервал (например, 30 минут) после приема первой таблетки. В другом варианте осуществления настоящего изобретения определенные компоненты микроинкапсулированы, чтобы усилить системную абсорбцию эксенатида.
В одном из вариантов осуществления протокол лечения согласно настоящему изобретению является терапевтическим. В другом варианте осуществления изобретения указанный протокол является профилактическим. Любая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В другом варианте осуществления настоящее изобретение обеспечивает пероральное или ректальное введение эксенатида, которое сравнимо с существующими инъецируемыми дозированными формами эксенатида. В другом варианте осуществления настоящее изобретение обеспечивает пероральное или ректальное введение эксенатида, которое лучше по сравнению с существующими инъецируемыми дозированными формами эксенатида. В другом варианте осуществления настоящего изобретения пероральное или ректальное введение эксенатида является дешевле, чем инъецируемые дозированные формы эксенатида. В другом варианте осуществления настоящего изобретения пероральное или ректальное введение эксенатида обеспечивает более высокую комплаентность, чем инъецируемые дозированные формы эксенатида. В другом варианте осуществления настоящего изобретения пероральное или ректальное введение эксенатида обеспечивает меньше побочных эффектов, чем инъецируемые дозированные формы эксенатида.
В другом варианте осуществления твердые носители/разбавители для применения в способах и композициях согласно настоящему изобретения включают, но не ограничиваются перечисленными: камедь, крахмал (например, крахмал из кукурузы, пептизированный крахмал), сахар (например, лактоза, маннитол, сахароза, декстроза), целлюлозный материал (например, микрокристаллическая целлюлоза), акрилат (например, полиметилакрилат), карбонат кальция, оксид магния, тальк или их смеси.
В другом варианте осуществления настоящего изобретения композиции дополнительно содержат связующие (например, камедь, кукурузный крахмал, желатин, карбомер, этилцеллюлозу, гуаровую камедь, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, повидон), дезинтегрирующие агенты (например, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, диоксид кремния, кроскармеллозу натрия, кросповидон, гуаровую камедь, натрия гликолят крахмала), буферы (например, Трис-HCl, ацетат, фасфат) для разных значений рН и ионной силы, добавки, такие как альбумин или желатин, для предотвращения абсорбции на поверхностях, детергенты (например, Твин 20, Твин 80, Плюроник F68, соли желчных кислот), ингибиторы протеаз, сурфактанты (например, лаурилсульфат натрия), энхансеры проницаемости, солюбилизирующие агенты (например, глицерол, полиэтиленгликоль), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия, бутилированный оксианизол), стабилизаторы (например, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу), загустители (например, карбомер, коллоидный диоксид кремния, этилцеллюлозу, гуаровую камедь), подсластители (например, аспартам, лимонную кислоту), консерванты (например, тимеросал, бензиловый спирт, парабены), лубриканты (например, стеариновую кислоту, стеарат магния, полиэтиленгилколь, лаурилсульфат натрия), регулирующие текучесть добавки (например, коллоидный диоксид кремния), пластификаторы (например, диэтилфталат, триэтилцитрат), эмульгаторы (например, карбомер, гидроксипропилцеллюлозу, лаурилсульфат натрия), полимерные покрытия (например, полоксамеры или полоксамины), глазировочные вещества и пленкообразователи (например, этилцеллюлозу, акрилаты, полиметакрилаты) и/или адъюванты. Любое вышеперечисленное вспомогательное вещество представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления лекарственные формы согласно настоящему изобретению получены в форме для обеспечения профиля с немедленным высвобождением, профиля пролонгированного действия или профиля с отложенным действием. В некоторых вариантах осуществления настоящего изобретения профиль высвобождения композиции задают с помощью применения специфичных вспомогательных веществ, которые служат в качестве примера как связующие, дезинтегранты, наполнители или покрывающие материалы. В одном из вариантов осуществления настоящего изобретения указанная композиция может быть получена для обеспечения профиля специфичного высвобождения, который известен специалисту в данной области техники.
В другом варианте реализации пероральный или ректальный состав согласно настоящему изобретению дополнительно получен в форме для осуществления непрерывного высвобождения эксенатида. В другом варианте реализации пероральный или ректальный состав согласно настоящему изобретению дополнительно получен в форме для осуществления немедленного высвобождения эксенатида. В другом варианте реализации пероральный или ректальный состав согласно настоящему изобретению дополнительно получен в форме для осуществления медленного высвобождения эксенатида. В другом варианте реализации пероральный или ректальный состав согласно настоящему изобретению дополнительно получен в форме для осуществления сочетания непрерывного и немедленного высвобождения эксенатида. В другом варианте реализации изобретения скорость высвобождения эксенатида можно менять с помощью разных способов получения составов, известных специалистам в данной области техники.
В одном из вариантов осуществления настоящего изобретения композиция получена в виде пероральной лекарственной формы. В одном из вариантов осуществления настоящего изобретения композиция представляет собой твердую пероральную лекарственную форму, включающую таблетки, жевательные таблетки, суппозитории или капсулы. В одном из вариантов осуществления изобретения указанные капсулы представляют собой мягкие желатиновые капсулы.
В других вариантах осуществления настоящего изобретения покрытия с контролируемым или непрерывным высвобождением, используемые в способах и композициях согласно настоящему изобретению, включают составы в виде липофильных депо (например, жирных кислот, воска, масел).
Указанные композиции также содержат, в другом варианте осуществления настоящего изобретения, включение активного вещества вовнутрь или на поверхности препаратов частиц полимерных соединений, таких как полимолочная кислота, полигликолевая кислота, гидрогели и т.п., или внутрь липосом, микроэмульсий, мицелл, однослойных или многослойных везикул, в «тени» эритроцитов или сферопласты. Такие композиции будут воздействовать на физическое состояние, растворимость, стабильность, скорость высвобождения in vivo и скорость выведения in vivo. В другом варианте осуществления настоящего изобретения композиции частиц активных соединений покрыты полимерами (например, полоксамерами или полоксаминами).
В другом варианте осуществления настоящего изобретения доставку композиций, содержащих эксенатид и омега-3 жирную кислоту, осуществляют с применением везикул, например, липосом (см. Langer, Science 249:1527-1533 (1990); Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez- Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); Lopez-Berestein, там же, pp.317-327; там же).
Получение фармацевтических композиций, которые содержат активный компонент, например, путем смешивания, измельчения или в процессе формования таблеток, широко распространены в данной области техники. Активный терапевтический ингредиент часто смешивают со вспомогательными веществами, которые фармацевтически приемлемы и совместимы с указанным активным ингредиентом. Для перорального применения активные ингредиенты композиций согласно настоящему изобретению смешивают с добавками, традиционными для данной цели, такими как носители, стабилизаторы или инертные разбавители, и преобразуют с помощью традиционных способов в соответствующие формы для введения, такие как таблетки, таблетки, покрытые оболочкой, твердые и мягкие желатиновые капсулы, водные, спиртовые или масляные растворы.
В другом варианте осуществления состав согласно настоящему изобретению дополнительно содержит основу. В другом варианте осуществления изобретения основа, применяемая в фармацевтической композиции, согласно настоящему изобретению может представлять такие, которые известны как основы суппозиториев для интраректального введения. В некоторых вариантах осуществления настоящего изобретения указанная основа включает масла и жиры, содержащие триглицериды в качестве основных компонентов, таких как масло какао, пальмовый жир, пальмоядровое масло, кокосовое масло, фракционированное кокосовое масло, лярд или ВИТЕРСОЛ (WITEPSOL.RTM), воски, такие как ланолин и восстановленный ланолин, гидрокарбоны, такие как вазелин, сквален, сквалан и жидкий парафин; жирные кислоты с длинными и средними цепями, такие как каприловая кислота, лауриновая кислота, стеариновая кислота и олеиновая кислота; высшие спирты, такие как лауриловый спирт, цетанол и стеариловый спирт; эфиры жирных кислот, такие как бутилстеарат и диурилмалонат; эфиры глицерина и карбоновой кислоты со средними и длинными цепями, такие как триолеин и тристеарин; эфиры глицеринзамещенных карбоновых кислот, такие как глицеринацетоацетат; и полиэтиленгликоли и их производные, такие как макроголы и цетомакроголы. Указанные вещества можно применять либо по одному, либо в виде комбинации двух или более веществ.
В некоторых вариантах осуществления композиция согласно настоящему изобретению может дополнительно содержать поверхностно-активный агент, консервант или окрашивающий агент, которые обычно применяют в суппозиториях.
В другом варианте осуществления дозированные лекарственные формы фармацевтических композиций согласно настоящему изобретению включают твердый суппозиторий, имеющий в качестве основы твердый жир, который при введении в прямую кишку становится жидкотекучим внутри прямой кишки, такой как масло какао и ВИТЕРСОЛ (WITERSOL), твердый суппозиторий, имеющий в качестве основы твердое гидрофильное вещество, которое становится жидкотекучим в прямой кишке точно так же, как макрогол, и суппозиторий в виде желатиновой капсулы, имеющий обычно жидкое вещество (жидкое при комнатной температуре), такое как триглицериды нейтральных жирных кислот и растительные масла в качестве основы, и покрытый желатиновой пленкой.
Любые вышеперечисленные добавки, вспомогательные вещества, составы и средства введения представляют собой отдельные варианты осуществления настоящего изобретения.
В одном из вариантов осуществления настоящего изобретения термин «терапия» относится к лечению заболевания. В другом варианте осуществления изобретения «терапия» относится к предупреждению заболевания. В другом варианте осуществления настоящего изобретения «терапия» относится к сокращению случаев заболевания. В другом варианте осуществления изобретения «терапия» относится к улучшению признаков заболевания. В другом варианте осуществления изобретения «терапия» относится к индукции ремиссии. В другом варианте осуществления настоящего изобретения «терапия» относится к замедлению прогрессирования заболевания.
РАЗДЕЛ ПОДРОБНОГО ОПИСАНИЯ ЭКСПЕРИМЕНТОВ
Животные
Во всех экспериментах, описанных ниже в данном документе, использовали самцов собак породы Бигль, весивших примерно 9 кг.
ПРИМЕР 1
ЗАЩИТА ЭКСЕНАТИДА ОТ ПРОТЕАЗ И УСПЕШНОЕ ВВЕДЕНИЕ ЧЕРЕЗ ДВЕНАДЦАТИПЕРСТНУЮ КИШКУ У СОБАК
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Приготовление лекарственных составов
(1) Был приготовлен состав, содержащий 150 миллиграммов Na-EDTA (Sigma-Aldrich, St. Louis, МО), 125 мг ингибитора трипсина из сои (SBTI; Sigma), 50 мкг эксенатида и 0.8 миллилитров (мл) рыбьего жира.
(2) Был приготовлен состав, содержащий 150 миллиграммов Na-EDTA (Sigma-Aldrich, St. Louis, МО), 125 мг ингибитора трипсина из сои (SBTI; Sigma), 100 мкг эксенатида и 0.8 миллилитров (мл) рыбьего жира.
(3) Был приготовлен состав, содержащий 150 миллиграммов Na-EDTA (Sigma-Aldrich, St. Louis, МО), 125 мг ингибитора трипсина из сои (SBTI; Sigma), 0.8 миллилитров (мл) рыбьего жира.
РЕЗУЛЬТАТЫ
Чтобы проверить, можно ли защитить эксенатид от протеаз и обеспечить его абсорбцию через двенадцатиперстную кишку, состав 1 (опыт) и 3 (контроль) вводили прямо в двенадцатиперстную кишку собакам породы бигль, весом примерно 9 кг, или с помощью эндоскопа свиньям, весом примерно 9 кг.
Всем собакам и свиньям были введены 40 мл 50%-ного раствора глюкозы. Уровень глюкозы в крови измеряли каждые 5 минут после введения. Как представлено ниже в Таблице 1, уровни глюкозы в крови значительно снизились в ответ на эксенатид.
Способность формулы 1 значительно снижать уровень глюкозы в крови у собак также показана на Фигуре 1. Подобные результаты были обнаружены у свиней. Более того, на Фигуре 3 показано, что пероральная лекарственная форма Эксендина-4 заменяет инъецируемые лекарственные формы Эксендина-4 (см. Пример 2), снижая уровень глюкозы в крови.
Таким образом, пероральные композиции, содержащие ингибитор протеаз и Na-EDTA, могут защитить эксенатид от протеаз в малом кишечнике и облегчают прямую абсорбцию перорально введенного эксенатида.
ПРИМЕР 2: СРАВНЕНИЕ ИНЪЕЦИРУЕМЫХ ЛЕКАРСТВЕННЫХ ФОРМ С РЕКТАЛЬНЫМИ И ПЕРОРАЛЬНЫМИ ЛЕКАРСТВЕННЫМИ ФОРМАМИ
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Приготовление составов
Были приготовлены следующие состава:
(1) Инъецируемый состав, содержащий 2.5 мкг промышленного состава баеты.
(2) Инъецируемый состав, содержащий 2.5 мкг баеты GeneScript (Piscataway, NJ).
(3) Пероральный состав, содержащий 150 миллиграммов (мг) Na-EDTA (Sigma-Aldrich, St. Louis, МО), 125 мг ингибитора трипсина из сои (SBTI; Sigma), 50 мкг эксенатида (GeneScript (Piscataway, NJ)) и 0.8 миллилитров (мл) рыбьего жира.
(4) Пероральный состав, содержащий 150 миллиграммов (мг) Na-EDTA (Sigma-Aldrich, St. Louis, МО), 125 мг ингибитора трипсина из сои (SBTI; Sigma), 0.8 миллилитров (мл) рыбьего жира.
(5) Твердая желатиновая капсула (ректальная), содержащая 150 миллиграммов (мг) Na-EDTA (Sigma-Aldrich, St. Louis, МО), 125 мг ингибитора трипсина из сои (SBTI; Sigma), 50 мкг эксенатида (GeneScript (Piscataway, NJ)) и 0.8 миллилитров (мл) рыбьего жира.
РЕЗУЛЬТАТЫ
Чтобы исследовать эффективность пероральных и ректальных составов, содержащих эксенатид, пероральные и ректальные составы сравнили с коммерчески доступными инъецируемыми составами.
Всем собакам было введено 40 мл 50%-ного раствора глюкозы. Уровень глюкозы в крови измеряли каждые 5 минут после введения.
Полученные результаты показывают, что неожиданным образом пероральные (Фигуры 1 и 3) и ректальные (Фигура 2) лекарственные формы, содержащие Эксендин-4, могут заменять инъецируемые лекарственные формы, содержащие Эксендин-4, в отношении контроля уровня глюкозы в крови в течение 2 часов после нагрузки глюкозой.
Данные результаты дополнительно подтверждают результаты Примера 1, показывающего, что композиции, содержащие ингибитор протеаз и Na-EDTA, могут защитить эксенатид от протеаз в малом кишечнике и облегчают прямую абсорбцию перорально введенного эксенатида.
Эксендин-4, применяемый в указанных пероральных и ректальных лекарственных формах, был приобретен в GeneScript. Представленные результаты (Фигура 2 и 4) показывают, что Эксендин-4, приобретенный у GeneScript, эффективен так же, как коммерческий Эксендин-4 (Eli Lilly, USA). В заключение, пероральные и/или ректальные пути введения являются более предпочтительными по сравнению с инъецируемым путем введения по ряду причин, которые известны специалисту в данной области техники. Неожиданные результаты, представленные в данном описании, демонстрируют возможность эффективного введения Эксендин-4 с помощью перорального или ректального пути введения.
ПРИМЕР 3: ЭНТЕРАЛЬНОЕ ВВЕДЕНИЕ ЭКСЕНАТИДА-4:
ФАРМАКОДИНАМИЧЕСКИЕ ИССЛЕДОВАНИЕ НА СОБАКАХ ОТНОСИТЕЛЬНО СОСТАВА, КОТОРЫЙ СПОСОБСТВУЕТ АБСОРБЦИИ ЭКСЕНАТИДА-4 ЧЕРЕЗ БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Исследования проводили на 4 собаках породы бигль со средним весом 10 кг. У всех собак была канюля, расположенная в тощей кишке, через которую вводили лекарство. После ночного голодания собакам вводили разные дозы перорального аналога GLP-1 или подкожно инъекцию этого аналога. Абсорбцию аналога GLP-1 определяли путем измерения воздействия на колебания глюкозы после пероральной нагрузки глюкозой. Контрольный опыт состоял в пероральном приеме доз без введения аналога GLP-1. Интервал между пероральным введением и пероральной нагрузкой глюкозой составлял 30 минут. Основным критерием оценки эффективности было колебание содержания глюкозы выше уровня глюкозы в предварительном оГТТ (OGTT) в течение 150-минутного периода (зона приращения под кривой (AUC)0-150).
РЕЗУЛЬТАТЫ
Прямая инстилляция в тощую кишку аналога GLP-1 значительно (ss) сдерживает колебание глюкозы после нагрузки глюкозой (как по сравнению с плацебо, так и среди отдельных групп).
Результаты показаны в Таблице 2 и на Фигуре 4.
Пероральная система доставки белков и пептидных составов остается главной задачей по причине их уникальных физико-химических и биологических свойств. Как продемонстрировано в данном описании, представленная патентуемая технология может эффективно и надежно транспортировать макромолекулы, включая полипептиды и белки, такие как эксенатид, через биологические мембраны. Более того, неожиданно обнаружено, что природное соединение сохраняет свою биологическую активность при попадании в системный кровоток.
В частности, результаты настоящего исследования на собаках ясно демонстрируют, что пероральный аналог GLP-1, эксенатид, при введении перед едой может снижать вызываемые приемом пищи гликемические колебания примерно на 40% по сравнению с 50%-ной снижающей способностью парентерального эксенатида. Pd-эффекты широко используют при полуколичественном способе определения уровня GLP-1 в исследованиях, оценивающих ингибирование ДПП IV (DPP IV). В данном исследовании неожиданно было продемонстрировано, что эксенатид, аналог GLP-1, можно получить в виде пероральной лекарственной формы и его можно принимать перорально незадолго до еды. Эти два качества состава значительно облегчают его принятие пациентами и развивают высокую комплаентность у пациентов и соблюдение предписаний врача.
Результаты данного исследования на собаках показывают, что эксенатид, аналог GLP-1, при комбинировании с энхансером доставки и изготовлении в форме капсулы, абсорбируется, что в результате ведет к значительному снижению колебания глюкозы после оГТТ. Фармакодинамический ответ на пероральный прием эксенатида является устойчивым и воспроизводимым, а короткий интервал между приемом капсулы и приемом пищи предполагает, что можно получить практичную и удобную для пациентов пероральную лекарственную форму.
ПРИМЕР 4
ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ ПИЛЮЛЬ, СОДЕРЖАЩИХ ЭКСЕНАТИД И ИНГИБИТОР ПРОТЕАЗЫ
Приготовление сердцевины таблеток
Сердцевины таблеток, содержащих эксенатид и ингибитор протеазы, получают с помощью способов, хорошо известных в данной области техники.
Покрытие
Покрытие может представлять собой любое покрытие с замедленным высвобождением, известное в данной области. Например, покрытие может представлять собой полимер, содержащий следующие компоненты:
- 4 мг Эудрагита L-100 (Полимер Эфиров Акриловой и Метакриловой Кислоты)
- 4 мг Талька NF
- 4 мг Полиэтиленгликоль 6000 NF
В одном из вариантов осуществления настоящего изобретения раствор полимера для кишечнорастворимого покрытия получают путем растворения полимера в составе хлористого метилена с изопропиловым спиртом. Таблетки покрывают путем опрыскивания раствором в слегка теплом сосуде при постоянном перемешивании. Пары раствора непрерывно отсасываются.
Измерение уровня и активности рекомбинантного эксенатида в плазме пациента
Уровень пептида С измеряют, чтобы определить относительный вклад эндогенного и экзогенного эксенатида в наблюдаемых увеличениях уровня эксенатида.
РЕЗУЛЬТАТЫ
Смесь Na-EDTA, SBTI, эксенатида и рыбьего жира была приготовлена в виде сердцевины для таблетки или капсулы, покрытой кишечнорастворимой оболочкой или желатиновой оболочкой, и введена человеку. Уровень глюкозы в крови у субъектов измеряли периодически, как описано в предыдущих Примерах. Кроме того, измеряли уровень рекомбинантного эксенатида и его активность в плазме субъекта. Было показано, что покрытые пилюли обеспечивают доставку функционального эксенатида пациентам, а эксенатид значительно снижает их уровень глюкозы в крови, демонстрируя, что активный эксенатид можно доставить в кровяное русло при пероральном введении. Проводили испытания разных типов покрытий с отложенным высвобождением, имеющихся в продаже, чтобы определить, какое покрытие обеспечивает лучшую доставку эксенатида, и такое покрытие применяли в последующих Примерах.
ПРИМЕР 5
ОПТИМИЗАЦИЯ ИСТОЧНИКА ОМЕГА-3 ЖИРНЫХ КИСЛОТ
Разные омега-3 жирные кислоты или источники омега-3 жирных кислот (например, те, что перечислены выше в описании заявки) сравнивают в отношении их способности предохранять эксенатид после перорального введения в способах и композициях согласно настоящему изобретению. Таблетки и капсулы эксенатида получают согласно описанным выше Примерам, за исключением того, что эксенатид объединяют с альтернативным источником вместо рыбьего жира. Наиболее эффективный источник омега-3 жирных кислот применяют в последующих Примерах.
ПРИМЕР 6
ОПТИМИЗАЦИЯ ИНГИБИТОРОВ ПРОТЕАЗ
Разные ингибиторы протеаз (нетоксичные или имеющие приемлемый токсичный профиль: например, те, что перечислены выше в описании) сравнивают в отношении их способности предохранять эксенатид после перорального введения в способах и композициях согласно настоящему изобретению. Таблетки и капсулы эксенатида получают согласно описанным выше Примерам, за исключением того, что SBTI заменяют альтернативными ингибиторами протеаз. Количество ингибиторов протеаз также варьируют, чтобы определить оптимальные количества. Самый эффективный ингибитор протеаз/количество применяют в последующих примерах.
ПРИМЕР 7
ОПТИМИЗАЦИЯ ЭНХАНСЕРА
Разные энхансеры (например, те, что перечислены выше в спецификации) сравнивают по их способности облегчать абсорбцию эксенатида после перорального введения в способах и композициях согласно настоящему изобретению. Таблетки и капсулы эксенатида получают согласно описанным выше Примерам, за исключением того, что ЭДТА заменяют альтернативными энхансерами. Количество энхансеров также варьируют с целью определить оптимальные количества. Самый эффективный энхансер/количество применяют в последующих примерах.
ПРИМЕР 8
ОПТИМИЗАЦИЯ ТИПА И КОЛИЧЕСТВА ЭКСЕНАТИДА
Разные типы и количества эксенатида (например, те, что перечислены выше в спецификации) сравнивают по их способности регулировать уровень сахара в крови в способах и композициях согласно настоящему изобретению. Таблетки и капсулы эксенатида получают согласно описанным выше Примерам за исключением того, что варьируют тип и количество эксенатида. Самый эффективный тип/количество применяют в клинических испытаниях.
Реферат
Изобретение относится к медицине и касается композиции, содержащей эффективное количество эксенатида, ингибитор протеазы, ЭДТА, омега-3 жирную кислоту и покрытие, которое ингибирует расщепление эксенатида в желудке субъекта, причем указанная композиция представляет собой фармацевтическую композицию для перорального применения при лечении заболеваний, при которых агонистическое действие в отношении глюкагоноподобного пептида (GLP-1) является благоприятным. Изобретение обеспечивает контроль уровня сахара в крови после приема глюкозы. 18 з.п. ф-лы, 4 ил., 2 табл., 8 пр.

Комментарии