Композиции ректальной пены - RU2757275C2
Код документа: RU2757275C2
Чертежи

Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет по предварительной заявке США №62/435265, поданной 16 декабря 2016 года, полное содержание которой включено в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
В данном документе описаны фармацевтические композиции для ректальной пены, подходящие, например, для ректального введения лекарственных средств, а именно 5-аминосалициловой кислоты (5-АСК), а также способы получения таких композиций для пены и терапевтические способы с их применением.
УРОВЕНЬ ТЕХНИКИ
5-АСК (также известная как месаламин) представляет собой противовоспалительное лекарственное средство, применяемое для лечения воспалительного заболевания кишечника, а именно язвенного колита и болезни Крона от легкой до умеренной степени тяжести. Активность 5-АСК против этих расстройств является в основном локальной, и поэтому 5-АСК, как правило, вводят путем дозированной формы и способа введения, который доставляет 5-АСК, например, в толстую кишку. Следовательно, 5-АСК доступен в пероральных и ректальных лекарственных формах, включая ректальные свечи и лекарственные формы в виде ректальной пены.
Лекарственная форма в виде ректальной пены на основе 5-АСК продается в Великобритании под названием ASACOL® (Warner Chilcott UK Limited). Данный продукт содержит сорбитан моноолеат, полисорбат 20, воск эмульсионный, кремния диоксид коллоидный безводный, метабисульфит натрия, динатрия эдетат, этилгидроксибензоат, пропилгидроксибензоат, додекагидрат или гептагидрат фосфата натрия, фосфорнокислый натрий, глицерин, Макрогол 300, очищенную воду, пропан, изобутан и н-бутан, и содержит 1 г 5-АСК в отмеренной дозе.
Другой лекарственной формой в виде ректальной пены является UCERIS® (Salix Pharmaceuticals, Inc.), которая содержит активные ингредиенты - будесонид, и неактивные ингредиенты - цетиловый спирт, моногидрат лимонной кислоты, динатрия эдетат, воск эмульсионнный, полиоксил(10)стеариловый эфир, пропиленгликоль и очищенную воду, и пропелленты - н-бутан, изобутан и пропан. Патент США 5914122 включен в «Оранжевую книгу» для UCERIS® и раскрывает растворы будесонида с рН не более 6,0, в которых будесонид растворен в растворителе, который представляет собой воду, спирт, а именно этанол, изопропанол или пропиленгликоль, или смесь воды/спирта. Растворы также предпочтительно содержат стабилизатор, а именно натриевую соль этилендиаминтетрауксусной кислоты, циклодекстрины или их смеси, и считаются подходящими в качестве активного ингредиента для ректальных растворов для клизмы или ректальной пены.
Однако, существующие композиции ректальной пены могут быть улучшены в отношении доставки локально активных соединений, а именно 5-АСК, в толстую кишку. Например, при введении 5-АСК ректально для доставки в толстую кишку для лечения, например, язвенного колита, идеальная пена будет диффундировать из точки ректального введения вглубь толстой кишки, расширяться постепенно, расширяться до большого объема, так что она будет равномерно распределена внутри по предполагаемой области лечения, и демонстрировать хорошее удержание в толстой кишке.
Следовательно, остается потребность в композициях ректальной пены, включая составы на основе 5-АСК, которые проявляют улучшенные свойства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описаны фармацевтические композиции ректальной пены, включая безводные и эмульсионные композиции ректальной пены, подходящие для ректального введения лекарственных средств.
В некоторых вариантах реализации изобретения безводная фармацевтическаяий композиция ректальной пены, описанная в данном документе, содержит лекарственное средство, а именно лекарственное средство на основе аминосалицилата или его фармацевтически приемлемую соль или сложный эфир, воскообразный/липидный компонент, растворитель/носитель, эмульгирующий компонент/поверхностно-активное вещество, камедь/смолистый компонент и пропеллент. Типичные воскообразные/липидные компоненты представляют собой один или более компонентов, выбранных из группы, состоящей из вазелина, цетилового спирта, стеарилового спирта, каприловых/каприновых триглицеридов (ККТ), каприловых/каприновых глицеридов и стеарата натрия. Типичные растворители/носители представляют собой один или более компонентов, выбранных из группы, состоящей из полиэтиленгликоля 400, глицерина, пропиленгликоля и минерального масла. Типичные эмульгирующие компоненты/поверхностно-активные вещества представляют собой один или более компонентов, выбранных из группы, состоящей из глицерилизостеарата, воска эмульсионного, глицерилстеарата, глицерилтристеарата, сорбитан олеата, полиглицерил-3 лаурата и полиглицерил-3 диизостеарата. Типичные камеди/смол истые компоненты представляют собой один или более компонентов, выбранных из группы, состоящей из метил целлюлозы, гидроксипропилцеллюлозы, ксантановой камеди, пектина и декстрина.
В некоторых вариантах реализации изобретения, безводная композиция содержит около 5-15% мас./мас. воскообразного/липидного компонента. В некоторых вариантах реализации изобретения, безводная композиция содержит около 55-65% мас./мас. растворителя/носителя. В некоторых вариантах реализации изобретения, безводная композиция содержит около 5-25% мас./мас. эмульгирующего компонента/поверхностно-активного вещества. В некоторых вариантах реализации изобретения, безводная композиция содержит около 0,1-2% мас./мас. камеди/смолистого компонента.
В конкретных вариантах реализации изобретения, безводная композиция содержит около 20% мас./мас. 5-АСК, около 25% мас./мас. полиэтиленгликоля 400, около 4% мас./мас. глицерина, около 29,35% мас./мас. пропиленгликоля, около 2,9% мас./мас. ККТ, около 2,1% мас./мас. воска эмульсионного, около 0,6% мас./мас. глицерилстеарата, около 0,8% мас./мас. сорбитан олеата, около 12% мас./мас. вазелина, около 0,2% мас./мас. ксантановой камеди и около 10% мас./мас. пропеллента А31.
В некоторых вариантах реализации изобретения, фармацевтическая композиция для ректальной пены в виде эмульсии масло-в-воде, описанная в данном документе, содержит лекарственное средство, а именно лекарственное средство на основе аминосалицилата или его фармацевтически приемлемую соль или сложный эфир, растворитель/носитель, содержащий воду, эмульгирующий компонент/поверхностно-активное вещество, воскообразный/липидный компонент, камедь/смолистый компонент и пропеллент. Типичные растворители/носители представляют собой один или более компонентов, выбранных из группы, состоящей из полиэтиленгликоля 400, глицерина, пропиленгликоля и С12-С15-алкилбензоатов. Типичные эмульгирующие компоненты/поверхностно-активные вещества представляют собой один или более компонентов, выбранных из группы, состоящей из полиэтиленгликоля 75, полиэтиленгликоль(40)стеарата и сорбитан олеата. Типичные воскообразные/липидные компоненты представляют собой один или более компонентов, выбранных из группы, состоящей из вазелина, цетилового спирта, каприловых/каприновых триглицеридов (ККТ), каприловых/каприновых глицеридов и стеариновой кислоты. Типичные камеди/смол истые компоненты представляют собой один или более компонентов, выбранных из группы, состоящей из гидроксиэтилцеллюлозы и ксантановой камеди.
В некоторых вариантах реализации изобретения, эмульсионная композиция содержит около 30-50% мас./мас. воды и около 4% мас./мас. пропиленгликоля. В некоторых вариантах реализации изобретения, эмульсионная композиция содержит около 2-25% мас./мас. эмульгирующего компонента/поверхностно-активного вещества. В некоторых вариантах реализации изобретения, эмульсионная композиция содержит около 10-25% мас./мас. воскообразного/липидного компонента. В некоторых вариантах реализации изобретения, эмульсионная композиция содержит около 0,1-0,2% мас./мас. камеди/смол истого компонента.
В конкретных вариантах реализации изобретения, эмульсионная композиция, описанная в данном документе, содержит около 20% мас./мас. 5-АСК, около 47,95% мас./мас. воды, около 4% мас./мас. пропиленгликоля, около 1,5% мас./мас. полиэтиленгликоля 75, около 5% мас./мас. полиэтиленгликоль(40)стеарата, около 0,5% мас./мас. сорбитан олеата, около 18% мас./мас. вазелина, около 1,25% мас./мас. цетилового спирта, около 0,2% мас./мас. ксантановой камеди и около 8% мас./мас. пропеллента А31.
В конкретных вариантах реализации изобретения, лекарственное средство на основе аминосалицилата представляет собой 5-АСК или его фармацевтически приемлемую соль или сложный эфир. В некоторых вариантах реализации изобретения, безводная или эмульсионная композиция содержит от около 5% мас./мас. до около 30% мас./мас. 5-АСК.
В некоторых вариантах реализации изобретения, композиция дополнительно содержит пропеллент. В некоторых вариантах реализации изобретения, композиция содержит около 5-15% мас./мас. пропеллента, а именно один или более из пропеллента А-31 и пропеллента А-46.
В некоторых вариантах реализации изобретения, композиция дополнительно содержит усилитель всасывания, а именно диметилизосорбид.
В некоторых вариантах реализации изобретения, композиция дополнительно содержит один или более дополнительных компонентов, выбранных из группы, состоящей из агентов, регулирующих рН, антиоксидантов и консервантов.
Также предложена пена, изготовленная из композиций, описанных в данном документе. В некоторых вариантах реализации изобретения, пена имеет объем расширения по меньшей мере 15 мл за 5 минут при испытании согласно монографии 1105 Европейской фармакопеи. В некоторых вариантах реализации изобретения, время разрушения пены в испытании на разрушение пены составляет по меньшей мере 3 минуты. В некоторых вариантах реализации изобретения, время отделения пены в испытании на инверсию пены составляет по меньшей мере 20 минут. В некоторых вариантах реализации изобретения, пена показывает прилипание не более 6 см/г на 1-2 г пены в течение 5 минут. В некоторых вариантах реализации изобретения, пена имеет плотность по меньшей мере 0,10 г/мл.
Также предложены способы изготовления безводной композиции, включающие: (а) приготовление первой смеси из растворителя/носителя, воскообразного/липидного компонента и эмульгирующего компонента/поверхностно-активного вещества; (б) добавление камеди/смолистого компонента в первую смесь; (в) добавление лекарственного средства, а именно лекарственного средства на основе аминосалицилата или его фармацевтически приемлемой соли или сложного эфира, в смесь (б) для образования конечной смеси; и (г) объединение конечной смеси с пропеллентом.
Также предложены способы приготовления эмульсионной композиции, включающие: (а) приготовление первой смеси из растворителя/носителя, содержащего воду, и камеди/смол истого компонента; (б) приготовление второй смеси из эмульгирующего компонента/поверхностно-активного вещества и воскообразного/липидного компонента; (б) объединение первой и второй смесей для получения третьей смеси; (в) добавление лекарственного средства, а именно лекарственного средства на основе аминосалицилата или его фармацевтически приемлемой соли или сложного эфира, в третью смесь для образования конечной смеси; и (г) объединение конечной смеси с пропеллентом.
Также предложены способы введения лекарственного средства, а именно лекарственного средства на основе аминосалицилата, нуждающемуся в этом субъекту, включающие ректальное введение композиции, описанной в данном документе. В некоторых вариантах реализации изобретения, композиция содержит 5-АСК и вводится из аэрозольного распылителя, дозирующего количество композиции и обеспечивающего от около 1 г до около 5 г 5-АСК на дозу.
Также предложены способы лечения воспалительного заболевания кишечника у субъекта, нуждающегося в этом, включающие ректальное введение субъекту, нуждающемуся в этом, композиции, описанной в данном документе. Воспалительное заболевание кишечника выбирают из язвенного колита и болезни Крона.
Также предложены композиции, описанные в данном документе, для введения лекарственного средства на основе аминосалицилата субъекту, нуждающемуся в этом, или для лечения воспалительного заболевания кишечника, а именно язвенного колита или болезни Крона, у субъекта, нуждающегося в этом.
Также предложены применения композиций, описанных в данном документе, при приготовлении лекарственных препаратов для введения лекарственного средства на основе аминосалицилата субъекту, нуждающемуся в этом, или для лечения воспалительного заболевания кишечника, а именно язвенного колита или болезни Крона, у субъекта, нуждающегося в этом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 изображены результаты испытаний ex vivo, описанных в Примере 5. Слева изображены результаты испытания на прилипание пены к ткани толстой кишки свиньи, расположенной под углом 70°. Справа изображены результаты испытания на инверсию пены с использованием перевернутой ткани толстой кишки свиньи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном тексте описаны фармацевтические композиции для ректальной пены, подходящие, например, для ректального введения лекарственных средств, а именно 5-аминосалициловой кислоты (5-АСК). В соответствии с некоторыми вариантами реализации изобретения, композиции для пены, описанные в данном документе, дают пены с целевыми свойствами, включая пену, которая расширяется постепенно, расширяется до большого общего объема и/или демонстрирует хорошую сохранность в толстой кишке.
Термины и определения
Если не указано иное, технические и научные термины, применяемые в данном документе, имеют общепринятые значения, понятные рядовым специалистам в области фармацевтики, к которой относится данное изобретение. В данном документе сделана ссылка на различные методологии, известные рядовым специалистам в данной области техники. При реализации данного изобретения, могут применяться любые подходящие материалы и/или способы, известные рядовым специалистам в данной области техники. Однако, приведено описание конкретных материалов и способов. Если не указано иное, материалы, реагенты и т.п., на которые сделаны ссылки в приведенном ниже описании и примерах, получают из коммерческих источников.
Используемые в данном документе существительные единственного числа обозначают как единственное, так и множественное число, если явно не указано только единственное число.
Применяемый в данном документе термин «около» означает, что число или диапазон не ограничены точным указанным числом или диапазоном, но охватывают значения вблизи указанного числа или диапазона, в зависимости от контекста, в котором используется число или диапазон, что должно быть понятно рядовым специалистам в данной области техники. Если иное не вытекает из контекста или условности в данной области техники, «около» означает до 10% больше или меньше от конкретной величины.
Применяемый в данном документе термин «субъект» относится к любому млекопитающему, включая людей. Например, субъект страдает от или подвержен риску развития расстройства, которое может быть диагностировано, излечено или предотвращено с помощью лекарственного средства, описанного в данном документе, или он может принимать лекарственные средства для других целей.
Применяемый в данном документе термины «вводить», «прием» или «введение» относятся к (1) предоставлению, выдаче, определению дозировки и/или назначению, в частности, сделанному либо медицинским работником, либо его или ее уполномоченным агентом, или под его руководством, и (2) введению внутрь, приему или потреблению, в частности, произведенному медицинским работником или самим пациентом или особой самостоятельно.
Применяемые в данном документе термины «лечить», «лечение» или «терапия» включают смягчение, ослабление или уменьшение заболевания или расстройства, или одного или более его симптомов, независимо от того, считаются ли болезнь или расстройство «излеченными» или «вылеченными», и независимо от того, устранены ли все симптомы. Термины также включают уменьшение или предотвращение прогрессирования заболевания или расстройства, или одного или более их симптомов, блокирование или противодействие основному механизму развития заболевания или расстройства, или одного или более их симптомов, и достижение любого терапевтического и/или профилактического эффекта.
Применяемый в данном документе термин «терапевтически эффективное количество» относится к дозе, обеспечивающей конкретный фармакологический эффект, для достижения которого лекарство вводится субъекту, нуждающемуся в таком лечении. Следует особо отметить, что терапевтически эффективное количество не всегда будет эффективным при лечении расстройств, описанных в данном документе, даже если специалисты в данной области техники считают такую дозу терапевтически эффективным количеством. Только из соображений удобства, ниже приведены типичные дозы и терапевтически эффективные количества применительно ко взрослым людям. Специалисты в данной области техники могут регулировать такие количества в соответствии со стандартными методиками, необходимыми для лечения конкретного субъекта и/или расстройства/заболевания.
Лекарственные средства
Как отмечено выше, фармацевтические композиции для ректальной пены, описанные в данном документе, содержат один или более лекарственных средств, которые для достижения терапевтического эффекта вводят ректально. В некоторых вариантах реализации изобретения, лекарственное средство проявляет локальное действие на одном или нескольких уровнях толстой кишки, а именно как средство с антиинфекционным/ антибиотическим, противовоспалительным/ антифлогистонным, антиспазматическим, антиметеоретическим, прокинетическим или слабительным эффектом.
Фармацевтические композиции для ректальной пены содержат производное салициловой кислоты, а именно лекарственное средство на основе аминосалицилата, а именно 5-АСК, или его фармацевтически приемлемую соль или сложный эфир. 5-АСК также известна как месалазин, 5-аминосалициловая кислота, 2-гидрокси-5-аминобензойная кислота, 3-карбокси-4-гидроксианилин, месаламин и 5-амино-2-гидроксибензойная кислота и имеет молекулярную формулу C7H7NO3 и молекулярную массу 153,14. Она зарегистрирована под регистрационным номером CAS 89-57-6 и Einecs 201-919-1. Типичные фармацевтически приемлемые соли включают кислотно-аддитивные соли, а именно гидрохлориды.
Как правило, композиции для ректальной пены составляют с применением диагностически или терапевтически эффективного количества одного или более лекарственных средств, например количества, эффективного для достижения предполагаемого эффекта. Количество лекарственного средства зависит от приготовляемой композиции, количества композиции, дозируемой за одно нажатие, конкретного приготовляемого лекарственного средства, целевого эффекта и продолжительности, в течение которой композиция должна обеспечивать лечение. В некоторых вариантах реализации изобретения, лекарственное средство в композиции находится в количестве от около 1% мас./мас. до около 50% мас./мас., включая от около 5% мас./мас. до около 40% мас./мас, от около 10% мас./мас. до около 30% мас./мас. и от около 15% мас./мас. до около 25% мас./мас. от общей композиции и в количествах между любыми из этих значений, включая 1% мас./мас., 5% мас./мас., 10% мас./мас., 15% мас./мас., 20% мас./мас., 25% мас./мас., 30% мас./мас., 35% мас./мас., 40% мас./мас., 45% мас./мас. или 50% мас./мас.
Количество лекарственного средства, дозируемого за одно нажатие распылителя для ректальной пены, составляет от около 0,1 г до около 10 г, включая от около 0,5 г до около 5 г, от около 1 г до около 3 г и от около 1 г до около 2 г, и количества между любыми из этих значений.
В конкретных вариантах реализации изобретения, композиция для ректальной пены, описанная в данном документе, содержит от около 5% мас./мас. до около 30% мас./мас. 5-АСК, включая около 10% мас./мас., около 15% мас./мас., около 20% мас./мас. 5-АСК, около 25% мас./мас. 5-АСК или около 30% мас./мас. 5-АСК, и количества между любыми из этих значений, а количество лекарственного средства, дозируемого за одно нажатие распылителя для ректальной пены, составляет от около 0,5 г до около 5 г, включая от около 1 г до около 2 г, и количества между любыми из этих значений.
Композиции
Фармацевтические композиции для ректальной пены, описанные в данном документе, включают безводные композиции и композиции в виде эмульсии масло-вводе, что более подробно описано ниже. В дополнение к одному или более лекарственным средствам безводные композиции, описанные в данном документе, содержат воскообразный/липидный компонент, неводный растворитель/носитель, эмульгирующий компонент/поверхностно-активное вещество, камедь/смолистый компонент и пропеллент, в композиции в виде эмульсии, описанные в данном документе, содержат растворитель/носитель, содержащий воду, эмульгирующий компонент/поверхностно-активное вещество, воскообразный/липидный компонент, камедь/смолистый компонент и пропеллент.
Не желая быть связанными какой-либо теорией, полагают, что комбинации компонентов, описанных в данном документе, дают пену с целевыми свойствами, а именно пену, которая расширяется постепенно, расширяется до большого общего объема и/или демонстрирует хорошее время сохранности, не разрушается сразу после дозирования и является стабильной с точки зрения разрушения, разделения, гелеобразования или инверсии эмульсии при хранении. Дополнительная информация о свойствах пен, описанных в данном документе, изложена более подробно ниже и в примерах.
Безводные композиции
Применяемый в данном документе термин «безводная» композиция обозначает композицию, которая содержит менее 5% мас. воды. В некоторых вариантах реализации изобретения, безводную композицию готовят без добавления воды, хотя некоторое количество воды может присутствовать. В некоторых вариантах реализации изобретения, безводная композиция практически не содержит воды, например, содержит не более чем следовые количества воды.
Как отмечено выше, описанные в данном документе безводные композиции содержат действующее вещество, воскообразный/липидный компонент, растворитель/носитель, эмульгирующий компонент/поверхностно-активное вещество, камедь/смол истый компонент и пропеллент.
Воскообразный/липидный компонент безводной композиции содержит один или более из вазелина, цетилового спирта, стеарилового спирта, стеариновой кислоты, ланолина, водного ланолина, ланолинового спирта, парафина, каприловых/каприновых триглицеридов (ККТ), каприловых/каприновых глицеридов и стеарата натрия.
В некоторых вариантах реализации изобретения воскообразный/липидный компонент в безводной композиции присутствует в количестве от около 1% мас./мас. до около 25% мас./мас., от около 2% мас./мас. до около 20% мас./мас. или от около 5% мас./мас. до около 15% мас./мас. от общей композиции, включая около 10% мас./мас., и количествах между любыми из этих значений, включая 1% мас./мас., 2% мас./мас., 5% мас./мас., 10% мас./мас., 15% мас./мас., 20% мас./мас. и 25% мас./мас. В конкретных вариантах реализации изобретения, безводная композиция на основе 5-АСК содержит от около 5% мас./мас. до около 15% мас./мас. воскообразных/липидных компонентов, а именно 5% мас./мас., 10% мас./мас. или 15% мас./мас. воскообразных/липидных компонентов.
Растворитель/носитель безводной композиции содержит один или более из полиэтиленгликоля (а именно ПЭГ 400), глицерина, пропиленгликоля, бутиленгликоля, этилацетата, глицерина, гликофурола, диэтилфталата, этанола, С12-С15-алкилбензоатов, диметилового эфира, триацетина, трикаприлина, триэтилцитрата, миндального масла, арахисового масла, сафлорового масла, кунжутного масла, подсолнечного масла, соевого масла, касторового масла, минерального масла и легкого минерального масла.
В некоторых вариантах реализации изобретения, растворитель/носитель в безводной композиции находится в количестве от около 30% мас./мас. до около 65% мас./мас., включая от около 40% мас./мас. до около 65% мас./мас., от около 45% мас./мас. до около 65% мас./мас. или от около 50% мас./мас. до около 65% мас./мас. от общей композиции, и в количествах между любыми из этих значений, включая 30% мас./мас., 35% мас./мас., 40% мас./мас., 45% мас./мас., 50% мас./мас., 55% мас./мас., 60% мас./мас. и 65% мас./мас. В конкретных вариантах реализации изобретения безводная композиция на основе 5-АСК содержит от около 55% мас./мас. до около 65% мас./мас. растворителя/носителя.
Эмульгирующий компонент/поверхностно-активное вещество безводной композиции содержит один или более из глицерилизостеарата, анионогенных и неионогенных эмульсионных восков, глицерилмоностеарата, глицерилтристеарата, глицерилмоноолеата, глицерилпальмитостеарата, сорбитан олеата, полиглицерил-3 лаурата, полиглицерил-3 диизостеарата, полиэтиленгликоля 75, полиэтиленгликоль(40)стеарата, миристилового спирта, спиртов минеральных масел, ланолиновых спиртов, лецитина, линолевой кислоты, полоксамеров (блок-сополимеров полиоксиэтилена/полиоксипропилена/полиоксиэтилена, а именно полоксамера 181, 182 и/или 331), простых эфиров полиоксиэтиленалкилов, полиэтоксилированных касторовых масел (а именно касторового масла полиоксил 35 и/или гидрированного касторового масла полиоксил 40), сложных эфиров сорбитана и жирных кислот, сложных эфиров полиоксиэтиленсорбитана и жирных кислот, полиоксиэтиленстеаратов, полиоксилглицеридов, полиэтиленгликольсукцината витамина Е, альгината пропиленгликоля и сапонита. В конкретных вариантах реализации изобретения, эмульгирующий компонент/поверхностно-активное вещество безводной композиции содержит один или более компонентов, выбранных из группы, состоящей из глицерилизостеарата (включая Global 4075, который представляет собой смесь глицерилизостеарата и каприловых/каприновых глицеридов), эмульсионного воска (например., Polawax NF), глицерилстеарата, глицерилтристеарата, сорбитан олеата (например, Span 80), полиглицерил-3 лаурата и полиглицерил-3 диизостеарата.
В некоторых вариантах реализации изобретения, эмульгирующий компонент/поверхностно-активное вещество в безводной композиции находится в количестве от около 1% мас./мас. до около 45% мас./мас., включая от около 5% мас./мас. до около 45% мас./мас. или от около 5% мас./мас. до около 35% мас./мас., или от около 5% мас./мас. до около 20% мас./мас., или от около 5% мас./мас. до около 15% мас./мас., от общей композиции и количества между любыми из этих значений, включая около 5% мас./мас., 10% мас./мас., 15% мас./мас. и 20% мас./мас. В конкретных вариантах реализации изобретения, безводная композиция на основе 5-АСК содержит от около 5% мас./мас. до около 25% мас./мас., включая от около 5% мас./мас. до около 10% мас./мас. эмульгирующего компонента/поверхностно-активного вещества.
Камедь/смолистый компонент в безводной композиции содержит один или более компонентов, выбранных из группы, состоящей из метилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гипромеллозы, ксантановой камеди, гуаровой камеди, каолина, акации, агара, альгиновой кислоты, аттапульгита, бентонита, карбомера, кальциевой соли карбоксиметилцеллюлозы, натриевой соли карбоксиметилцеллюлозы, каррагинана, желатина, пектина, поликарбофила, альгината калия, альгината натрия, трагаканта, повидона и декстрина. В конкретных вариантах реализации изобретения, камедь/смолистый компонент в безводной композиции содержит один или более из гидроксиэтилцеллюлозы и ксантановой камеди.
В некоторых вариантах реализации изобретения, камедь/смолистый компонент в безводной композиции находится в количестве от около 0,01% мас./мас. до около 5% мас./мас., включая от около 0,1% мас./мас. до около 5% мас./мас., от около 0,1% мас./мас. до около 2% мас./мас. или около 2% мас./мас., от общей омпозиции и в количествах между любыми из этих значений, включая 0,1% мас./мас., 0,5% мас./мас., 1% мас./мас., 2% мас./мас., 3% мас./мас., 4% мас./мас. и 5% мас./мас. В конкретных вариантах реализации изобретения, безводная композиция на основе 5-АСК содержит от около 0,1% мас./мас. до около 2% мас./мас. камеди/смол истого компонента или около 0,2% мас./мас.
Эмульсионные композиции
Как отмечено выше, эмульсионные композиции, описанные в данном документе, содержат активное средство, воскообразный/липидный компонент, растворитель/носитель, содержащий воду, эмульгирующий компонент/поверхностно-активное вещество, камедь/смолистый компонент и пропеллент.
Воскообразный/липидный компонент эмульсионной композиции содержит один или более из вазелина, цетилового спирта, стеарилового спирта, стеариновой кислоты, ланолина, каприловых/каприновых триглицеридов (ККТ), каприловых/каприновых глицеридов, водного ланолина, ланолинового спирта, парафина и стеарата натрия. В конкретных вариантах реализации изобретения, эмульсионная композиция на основе 5-АСК в качестве воскообразного/липидного компонента содержит один или более из вазелина, цетилового спирта и стеариновой кислоты.
В некоторых вариантах реализации изобретения, воскообразный/липидный компонент в эмульсионной композиции находится в количестве от около 5% мас./мас. до около 30% мас./мас. или от около 10% мас./мас. до около 25% мас./мас., включая около 10% мас./мас., около 15% мас./мас. и около 20% мас./мас., от общей композиции, и количества между любыми из этих значений, включая 10% мас./мас., 15% мас./мас., 20% мас./мас. и 25% мас./мас. В конкретных вариантах реализации изобретения, эмульсионная композиция на основе 5-АСК содержит от около 10% мас./мас. до около 25% мас./мас. воскообразных/липидных компонентов, а именно около 20% мас./мас. воскообразных/липидных компонентов.
Растворитель/носитель эмульсионной композиции содержит воду и, необязательно, другой растворитель/носитель, а именно один или более смешивающихся с водой растворителей/носителей, а именно любой смешивающийся с водой растворитель/носитель, перечисленный выше со ссылкой на безводные композиции, включая один или более из полиэтиленгликоля (а именно ПЭГ 400), глицерина, пропиленгликоля, бутиленгликоля, этилацетата, глицерина, гликофурола, диэтилфталата, этанола, диметилового эфира, триацетина, трикаприлина, триэтилцитрата, С12-С15-алкилбензоатов, миндального масла, арахисового масла, сафлорового масла, кунжутного масла, подсолнечного масла, соевого масла, касторового масла, минерального масла и легкого минерального масла.
В некоторых вариантах реализации изобретения, эмульсионная композиция содержит воду в количестве от около 20% мас./мас. до около 60% мас./мас., включая от около 30% мас./мас. до около 50% мас./мас. от общей композиции, и количества между любыми из этих значений, включая 20% мас./мас., 25% мас./мас., 30% мас./мас., 35% мас./мас., 40% мас./мас., 45% мас./мас., 50% мас./мас., 55% мас./мас. или 60% мас./мас. В конкретных вариантах реализации изобретения, эмульсионная композиция на основе 5-АСК содержит от около 40% мас./мас. до около 50% мас./мас. воды, а именно 40% мас./мас., 45% мас./мас. или 50% мас./мас. воды.
Как отмечено выше, в некоторых вариантах реализации изобретения эмульсионная композиция содержит, помимо воды, дополнительный растворитель/носитель, а именно один или более из полиэтиленгликоля (а именно ПЭГ 400), глицерина и пропиленгликоля, или любой один или более из других растворителей/носителей, перечисленных выше. В соответствии с такими вариантами реализации изобретения дополнительный растворитель/носитель находится в любом количестве, включая от около 0,1% мас./мас. до около 10% мас./мас., включая от около 1,0% мас./мас. до около 5% мас./мас., включая от 1,0% мас./мас. до 5% мас./мас., от общей композиции и в количествах между любыми из этих значений, включая 1,0% мас./мас., 2,0% мас./мас., 3,0% мас./мас., 4,0% мас./мас. или 5,0% мас./мас. В конкретных вариантах реализации изобретения эмульсионная композиция на основе 5-АСК содержит от около 30% мас./мас. до около 50% мас./мас. воды и от около 1,0% мас./мас. до около 5% мас./мас. пропиленгликоля, а именно около 4% мас./мас. пропиленгликоля.
Эмульгирующий компонент/поверхностно-активное вещество эмульсионной композиции содержит один или более из дилаурата пропиленгликоля, сорбитан триолеата и полиглицерил-3 полирицинолеата, полисорбата 20, глицерилизостеарата, анионных и неионогенных эмульсионных восков, глицерилмоностеарата, глицерилтристеарата, глицерилмоноолеата, глицерилпальмитостеарат, сорбитан олеата, полиглицерил-3 лаурата, полиглицерили-3 диизостеарата, полиэтиленгликоля 75, полиэтиленгликоль(40)стеарата, миристилового спирта, спиртов минерального масла, ланолиновых спиртов, лецитина, линолевой кислоты, полоксамеров (блок-сополимеров полиоксиэтилена/полиоксипропилена/полиоксиэтилена, а именно полоксамера 181, 182 и/или 331), полиоксиэтиленалкиловых эфиров, полиэтоксилированных касторовых масел (а именно касторового масла полиоксил 35 и/или гидрированного касторового масла полиоксил 40), сложных эфиров сорбитана и жирных кислот, сложных эфиров полиоксиэтиленсорбитана и жирных кислот, полиоксиэтиленстеаратов, полиоксилглицеридов, полиэтиленгликольсукцината витамина Е, пропиленгликольальгината и сапонита. В конкретных вариантах реализации изобретения эмульгирующий компонент/поверхностно-активное вещество эмульсионной композиции содержит один или более компонентов, выбранных из группы, состоящей из глицерилизостеарата (например, Global 4075), эмульсионного воска (например, Polawax NF), глицерилстеарата, глицерилтристеарата, сорбитан олеата (например, Span 80), полиглицерил-3 лаурата и полиглицерил-3 диизостеарата. В конкретных вариантах реализации эмульсионных композиций эмульгирующий компонент/поверхностно-активное вещество содержит один или более из полиэтиленгликоля 75, полиэтиленгликоль(40)стеарата и сорбитан олеата.
В некоторых вариантах реализации изобретения эмульсионная композиция содержит эмульгирующий компонент/поверхностно-активное вещество в количестве от около 1% мас./мас. до около 25% мас./мас., включая от около 2% мас./мас. до около 20% мас./мас., от общей композиции и количества между любыми из этих значений, включая около 2% мас./мас., 2,5% мас./мас., 3% мас./мас., 5% мас./мас., 10% мас./мас., 15% мас./мас. и 20% мас./мас. В конкретных вариантах реализации изобретения эмульсионная композиция на основе 5-АСК содержит от около 2% мас./мас. до около 15% мас./мас. эмульгирующего компонента/поверхностно-активного вещества.
Камедь/смолистый компонент эмульсионной композиции содержит один или более компонентов, выбранных из группы, состоящей из метилцеллюлозы, гидроксипропилцеллюлозы, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, гипромеллозы, ксантановой камеди, гуаровой камеди, каолина, акации, агара, альгиновой кислоты, аттапульгита, бентонита, карбомера, кальциевой соли карбоксиметилцеллюлозы, натриевой соли карбоксиметилцеллюлозы, каррагинана, желатина, пектина, поликарбофила, альгината калия, альгината натрия, трагаканта, повидона и декстрина. В конкретных вариантах реализации изобретения камедь/смол истый компонент в безводной композиции содержит одну или более из гидроксиэтилцеллюлозы и ксантановой камеди. В конкретных вариантах реализации изобретения, камедь/смол истый компонент в эмульсионной композиции содержит один или более из гидроксиэтилцеллюлозы и ксантановой камеди.
В некоторых вариантах реализации изобретения, камедь/смолистый компонент в безводной композиции находится в количестве от около 0,01% мас./мас. до около 5% мас./мас., включая от около 0,1% мас./мас. до около 5% мас./мас., от около 0,1% мас./мас. до около 2% мас./мас. или около 2% мас./мас., от общей омпозиции и в количествах между любыми из этих значений, включая 0,1% мас./мас., 0,5% мас./мас., 1% мас./мас., 2% мас./мас., 3% мас./мас., 4% мас./мас. и 5% мас./мас. В конкретных вариантах реализации изобретения, безводная композиция на основе 5-АСК содержит от около 0,1% мас./мас. до около 2% мас./мас. камеди/смолистого компонента или около 0,2% мас./мас.
Другие компоненты
В дополнение к вышесказанному, композиции, описанные в данном документе, содержат один или более других необязательных компонентов, а именно один или более усилителей всасывания, один или более агентов, регулирующих рН, один или более антиоксидантов, один или более консервантов и/или один или более других компонентов, подходящих для применения в фармацевтической композиции ректальной пены. В конкретных вариантах реализации изобретения любые применяемые необязательные компоненты не оказывают существенного влияния на терапевтическую эффективность композиции. Дополнительно или в альтернативном варианте, в конкретных вариантах реализации изобретения любые применяемые необязательные компоненты не оказывают существенного влияния на свойства пены у композиции. Необязательные компоненты, если они присутствуют, вводят в композиции в любом подходящем количестве, достаточном для достижения целевого эффекта компонента без существенного влияния на целевые свойства композиций, а именно их пенообразование и доставку лекарственного средства. Показательные компоненты и их количества приведены ниже в данном документе.
В соответствии с любыми вариантами реализации изобретения, описанными в данном документе, может применяться усилитель всасывания. В конкретных вариантах реализации композиций на основе 5-АСК усилитель всасывания представляет собой или содержит диметилизосорбид, хлорид бензалкония, хлорид цетилпиридиния, диэтилсебацат, гликофурол, олеиловый спирт, монолаурат пропиленгликоля, изопропилмиристат, изопропилпальмитат, лаурилсульфат натрия, этанол, пентиленгликоль, пропиленгликоль и бутиленгликоль. В некоторых вариантах реализации изобретения усилитель всасывания в безводной или эмульсионной композиции применяется в количестве от около 0,5% мас./мас. до около 5% мас./мас. В конкретных вариантах реализации изобретения усилитель всасывания в безводной или эмульсионной композиции применяется в количестве от около 1% мас./мас. до около 2,5% мас./мас. В дополнительных конкретных вариантах реализации изобретения безводная композиция на основе 5-АСК содержит около 1% мас./мас. диметилизосорбида. В других конкретных вариантах реализации изобретения эмульсионная композиция на основе 5-АСК содержит около 2,5% мас./мас. диметилизосорбида.
В соответствии с любыми вариантами реализации изобретения, описанными в данном документе, применяется агент, регулирующий рН. В конкретных вариантах реализации изобретения аент, регулирующий рН, представляет собой или содержит триэтаноламин, гидроксиды натрия или калия, бикарбонаты или карбонаты натрия или калия, цитраты калия или натрия, диэтаноламин, моноэтаноламин или трометамин. В некоторых вариантах реализации изобретения аент, регулирующий рН, в безводной или эмульсионной композиции применяется в количестве от около 0,1% мас./мас. до около 2% мас./мас. В других конкретных вариантах реализации изобретения безводная композиция на основе 5-АСК не содержит аент, регулирующий рН. В дополнительных конкретных вариантах реализации изобретения эмульсионнная композиция на основе 5-АСК содержит около 0,75% мас./мас. триэтаноламина в качестве агента, регулирующего рН. В соответствии с любыми вариантами реализации изобретения, описанными в данном документе, применяется антиоксидант. В конкретных вариантах реализации изобретения антиоксидант выбирают из одного или более из альфа-токоферола, токоферилацетата, аскорбиновой кислоты, аскорбата натрия, аскорбилпальмитата, моногидрата лимонной кислоты, метабисульфита калия, метабисульфита натрия, сульфита натрия, тиосульфата натрия, полиэтиленгликольсукцината витамина Е пропилгаллат, бутилированного гидроксианизола (БГА) или бутилированного гидрокситолуола (БГТ). В некоторых вариантах реализации изобретения антиоксидант в безводной или эмульсионной композиции применяется в количестве от около 0,01% мас./мас. до около 1% мас./мас. В других конкретных вариантах реализации изобретения безводная композиция на основе 5-АСК содержит от около 0,3% мас./мас. до около 0,7% мас./мас. антиоксиданта. В других конкретных вариантах реализации изобретения эмульсионная композиция на основе 5-АСК содержит от около 0,05% мас./мас. до около 0,2% мас./мас. антиоксиданта.
В соответствии с любыми вариантами реализации изобретения, описанными в данном документе, применяется консервант.В конкретных вариантах реализации изобретения консервант выбирают из одного или более из метилпарабена, пропилпарабена, бензоата натрия, тетранатрий ЭДТК, бензалкония хлорида, бензилового спирта, хлорида цетилпиридиния, хлоргексидина, хлоркрезола, имидомочевины, монотиоглицерола, бората натрия, тимеросала, этилпарабена, бутилпарабена, сорбиновой кислоты, бензойной кислоты, ундекановой кислоты и глутанальдегида.
В некоторых вариантах реализации изобретения консервант в безводной или эмульсионной композиции применяют в количестве от около 0,1% мас./мас. до около 1,0% мас./мас. В дополнительных конкретных вариантах реализации изобретения безводная композиция на основе 5-АСК содержит от около 0,1% мас./мас. до около 0,2% мас./мас. консерванта, включая около 0,15% мас./мас. консерванта. В дополнительных конкретных вариантах реализации изобретения эмульсионная композиция на основе 5-АСК содержит от около 0,2% мас./мас. до около 0,4% мас./мас. консерванта.
Пропеллент
Композиции дополнительно содержат пропеллент. В некоторых вариантах реализации изобретения пропеллент представляет собой традиционный аэрозольный пропеллент, применяемый в фармацевтических композициях, а именно углеводородный пропеллент (например, пропан, пентан, бутен, бутан, изобутан), фторуглеводородный пропеллент (а именно HFC-134a) или их комбинации. Конкретные примеры подходящих пропеллентов для любого типа композиции включают один или более из пропеллента А-31 (изобутен), пропеллента А-46 (пропан/изобутан) и пропеллента HFC-134a (тетрафторэтан), транс-1,3,3,3-тетрафторпроп-1-ен (а именно 1234ze от Honeywell), диметиловый эфир (ДМЭ) или комбинацию двух или более из них. В конкретных вариантах реализации изобретения пропеллент содержит один или более из пропеллента А-31 и пропеллента А-46. Если применяется более чем один пропеллент, они могут использоваться в любом соотношении, включая 1:1. В конкретных вариантах реализации изобретения безводная композиция на основе 5-АСК содержит от около 10% мас./мас. до около 25% мас./мас. пропеллента, включая около 10% мас./мас. и около 20% мас./мас. пропеллента. В дополнительных конкретных вариантах реализации изобретения эмульсионная композиция на основе 5-АСК содержит от около 10% мас./мас. до около 20% мас./мас. пропеллента, включая около 14% мас./мас., 15% мас./мас. и 16% мас./мас. пропеллента.
Иллюстративные композиции
Ниже описаны различные иллюстративные безводные композиции на основе 5-АСК. В соответствии с конкретными вариантами реализации изобретения, проиллюстрированными в приведенных ниже примерах, безводная композиция на основе 5-АСК содержит около 20% мас./мас. 5-АСК, около 25% мас./мас. полиэтиленгликоля 400, около 4% мас./мас. глицерина, около 29,35% мас./мас. пропиленгликоля, около 2,9% мас./мас. ККТ, около 2,1% мас./мас. эмульсионного воска, около 0,6% мас./мас. глицерилстеарата, около 0,8% мас./мас. сорбитан олеата, около 12% мас./мас. вазелина, около 0,2% мас./мас. ксантановой камеди и около 10% мас./мас. пропеллента А31.
Ниже описаны различные иллюстративные эмульсионные композиции на основе 5-АСК. В соответствии с конкретными вариантами реализации изобретения, проиллюстрированными в приведенных ниже примерах, эмульсионная композиция на основе 5-АСК содержит около 20% 5-АСК, около 47,95% мас./мас. воды, около 4% мас./мас. пропиленгликоля, около 1,5% мас./мас. полиэтиленгликоля 75, около 5% мас./мас. полиэтиленгликоль(40)стеарата, около 0,5% мас./мас. сорбитан олеата, около 18% мас./мас. вазелина, около 1,25% мас./мас. цетилового спирта, около 0,2% мас./мас. ксантановой камеди и около 8% мас./мас. пропеллента А31.
Приготовление композиций пены
Описанные в данном документе композиции пены получают способами, известными в данной области техники. Например, все компоненты, кроме пропеллента, объединяют и заливают в подходящий распылитель, а пропеллент добавляют после этого. Как правило, в распылитель вводят композицию (кроме пропеллента), а затем добавляют пропеллент, и в распылителе создают избыточное давление и герметизируют его. Компоненты (кроме пропеллента) объединяют и смешивают в любом подходящем порядке.
В некоторых вариантах реализации изобретения безводную композицию получают способом, включающим (а) приготовление первой смеси растворителя/носителя, воскообразного/липидного компонента и эмульгирующего компонента/поверхностно-активного вещества; (б) добавление камеди/смолистого компонента в первую смесь; (в) добавление лекарственного средства в смесь (б) для образования конечной смеси; и (г) объединение конечной смеси с пропеллентом. В некоторых вариантах реализации изобретения способ дополнительно включает добавление других необязательных компонентов на соответствующих этапах до объединения с пропеллентом.
В некоторых вариантах реализации изобретения эмульсионную композицию получают способом, включающим (а) приготовление первой смеси раствор ителя/носителя, содержащего воду, и камеди/смол истого компонента; (б) приготовление второй смеси эмульгирующего компонента/поверхностно-активного вещества и воскообразного/липидного компонента; (в) объединение первой и второй смесей для получения третьей смеси; (г) добавление лекарственного средства в третью смесь для образования конечной смеси; и (д) объединение конечной смеси с пропеллентом. В некоторых вариантах реализации изобретения способ дополнительно включает добавление других необязательных компонентов на соответствующих этапах до объединения с пропеллентом.
Дозаторы композиций пен
Описанные в данном документе композиции пены предложены в любом подходящем дозирующем устройстве фармацевтической композиции пены. Как правило, дозирующее устройство адаптировано к пути введения, а именно, например, ректальному. В некоторых вариантах реализации изобретения дозатор представляет собой дозирующее устройство, а именно дозирующее устройство, имеющее дозирующий клапан, который дозирует одну дозу композиции за раз. В некоторых вариантах реализации изобретения дозирующее устройство представляет собой аэрозольный дозатор.
Разовая доза зависит от вводимого лекарственного препарата, его концентрации в композиции и расстройства, которое лечат, и варьируется в зависимости от других факторов, а именно возраста, веса или состояния субъекта. В конкретных вариантах реализации изобретения, относящихся к композициям на основе 5-АСК, разовая доза может обеспечивать от около 0,1 г до около 10 г 5-АСК (или эквивалентного количества другого лекарственного средства на основе аминосалицилата, или фармацевтически приемлемой соли или эфира 5-АСК, или еще какого-нибудь лекарственного средства на основе аминосалицилата), включая от около 0,5 г до около 5 г, от около 1 г до около 3 г и от около 1 г до около 2 г, и количества между любыми из этих значений, включая 0,5 г, 1 г, 1,5 г, 2 г, 3 г, 4 г или 5 г 5-АСК (или эквивалентное количество другого лекарственного средства на основе аминосалицилата или фармацевтически приемлемой соли или эфира 5-АСК, или еще какого-нибудь лекарственного средства на основе аминосалицилата). В некоторых вариантах осуществления отмеренная доза содержит 1 г 5-АСК, 2 г 5-АСК или 4 г 5-АСК (или эквивалентное количество другого лекарственного средства на основе аминосалицилата или фармацевтически приемлемой соли или эфира 5-АСК, или еще какого-нибудь лекарственного средства на основе аминосалицилата).
Свойства композиций пены
Различные свойства композиций пены, описанных в данном документе, оценивают способами, известными в данной области, а именно изложенными в монографии 1105 Европейской Фармакопеи. Например, одно или более свойств из расширения пены, прилипания пены, инверсии пены, плотности пены и разрушения пены оценивают способами, известными в данной области техники.
В соответствии с некоторыми вариантами реализации изобретения композиции пены на основе 5-АСК, описанные в данном документе, обладают одним или более свойствами, которые являются улучшенными по сравнению с композициями пены ASACOL®.
Расширение пены
Как отмечено выше, при введении 5-АСК ректально для доставки в толстую кишку для лечения, например, язвенного колита, идеальная пена будет расширяться постепенно и расширяться до большого объема, так что она будет равномерно распределена внутри по предполагаемой области лечения.
Объем расширения оценивают следующим образом, исходя из Евр. Фарм. 1105:
В качестве измерительного прибора используется бюретка Pyrex, 72,5 см × 1,3 см, на 50 мл с ценой деления 1 мл. Она крепится к дозатору пены (Precision Valve, Juno, отверстие дозатора 1 дюйм, диаметр стержня 4 мм) с помощью гибкой трубки 7,5 см × 5 мм. Контейнеры с образцами выдерживают перед испытанием при температуре около 25°С в течение не менее 24 часов. Образцы энергично встряхивают в течение около 30 секунд, и от 5 до 10 мл пены дозируется в отходы до прикрепления к гибкой трубке/носику дозатора пенки. Когда дозатор надежно прикреплен к гибкой трубе, контейнер переворачивают и нажимают на дозатор, чтобы отдозировать достаточное количество пены для достижения деления бюретки в 40-30 мл. Кран бюретки немедленно закрывают, и засекают время расширения с помощью калиброванного секундомера. Уровни пены (L) записываются каждую минуту (0-5) в течение 5 минут. Если уровень пены превышает деление 0 мл до истечения 5 минут, отмечают и записывают время, прошедшее до достижения отметки 0 мл. Объем расширения за период испытания рассчитывается как разница между максимальным уровнем и начальным уровнем.
При испытании в соответствии с данным протоколом до хранения композиция пены ASACOL® демонстрирует объем расширения около 5 мл за 5 минут. Напротив, композиции пены, описанные в данном документе (при испытании в соответствии с данным протоколом до хранения), демонстрируют объем расширения более 5 мл, а именно более чем 10 мл, более чем 15 мл, более чем 20 мл, более чем 25 мл, более чем 30 мл или более чем 35 мл. В конкретных вариантах реализации изобретения композиция пены, описанная в данном документе, демонстрирует объем расширения по меньшей мере 15 мл за 5 минут. В конкретных вариантах реализации изобретения композиция пены, описанная в данном документе, демонстрирует объем расширения по меньшей мере 20 мл за 5 минут.
Прилипание пены
Как отмечено выше, при введении 5-АСК ректально для доставки в толстую кишку для лечения, например, язвенного колита, идеальная пена демонстрирует хорошую сохранность в толстой кишке. Хотя прилипание пены необязательно является показателем просвета толстой кишки, его измеряют in vitro или ex vivo, как расстояние, которое один грамм пены проходит при определенном наклоне (а именно наклоне 60°) за определенный период времени (а именно 5 минут). (Чем короче расстояние, тем больше свойство «прилипания».) Улучшенные свойства прилипания пены указывают на улучшенную когезию и/или адгезию композиций пены, по меньшей мере в отношении поверхностей, на которых проводится испытание.
Прилипание пены оценивают следующим образом:
Пластину из оргстекла 5 мм × 28,5 см × 28,5 см разлинеевают в горизонтальном направлении от 1 до 25 см с шагом в 1 см. Пластину помещают в алюминиевое основание, которое было предварительно фрезеровано, чтобы зафиксировать и удерживать пластину под углом 60° от вертикали. Контейнеры с образцами выдерживают перед испытанием при температуре около 25°С в течение не менее 24 часов. Образцы энергично встряхивают в течение приблизительно 30 секунд, и от 5 до 10 мл пены дозируют в отходы. Контейнер взвешивают, и этот вес записывается как начальный вес (W0). Образцы дозируют в течение около 2 секунд на 2 см-ую отмеченную линию. Откалиброванный секундомер используют для немедленного начала отсчета периода времени (Т0= начальное время) не более чем 5 минут. Контейнер взвешивают после дозирования, и этот вес записывают как конечный вес (WF), а вес рассчитывается путем вычитания W0 из WF. Время рассчитывается путем вычитания Т0 из конечного времени (TF). Прилипание пены рассчитывается следующим образом:
Прилипание пены (см/г)=(DF - D0)/(W0 - WF)
Прилипание пены ((см/г)/мин)=((DF - D0)/(W0 - WF))/(TF T0)
При испытании в соответствии с данным протоколом до хранения композиция пены ASACOL® демонстрирует прилипание пены около 7,5 см/г. В соответствии с некоторыми вариантами реализации изобретения пена, полученная с применением любого типа композиции, описанного в данном документе (при испытании в соответствии с данным протоколом до хранения), демонстрирует прилипание пены менее чем 7,5 см/г, а именно менее чем 5 см/г, менее чем 3 см/г или менее чем 2 см/г.33. В конкретных вариантах реализации изобретения пена, как описано в данном документе, демонстрирует прилипание пены не более чем 6 см/г на 1-2 г пены.
Инверсия пены
Инверсия пены представляет собой еще одну меру свойств удержания пены, например когезию и/или адгезию композиций пены.
Инверсию пены измеряют как время, прошедшее до того, как пена отделится и упадет с перевернутого стекла. Конкретный протокол изложен ниже:
Контейнеры с образцами выдерживают перед испытанием при температуре около 25°С в течение не менее 24 часов. Образцы энергично встряхивают в течение около 30 секунд, и от 5 до 10 мл пены дозируют в отходы. Вес контейнера для образца записывают (W0), и образцы дозируют на круг диаметром 12,1 см (4
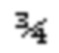
Инверсия пены (мин/г)=TX/(W0 - WF)
При испытании в соответствии с данным протоколом до хранения композиция пены ASACOL® демонстрирует время инверсии пены около 1,6 минуты для около 20 г. В соответствии с некоторыми вариантами реализации изобретения, пена, полученная с применением любого типа состава, описанного в данном документе (при испытании в соответствии с данным протоколом до хранения), характеризуется большим временем инверсии пены, чем у композиции пены ASACOL®, а именно более чем около 5 минут, более чем около 10 минут, более чем около 15 минут или более чем около 20 минут, все из которых для около 20 г пены.
Плотность пены
Плотность пены измеряют как массу пены в единице объема.
При испытании до хранения композиция пены ASACOL® имеет плотность пены около 0,067 г/мл. В соответствии с некоторыми вариантами реализации изобретения пена, полученная из эмульсионной композиции, как описано в данном документе (при испытании до хранения), имеет плотность пены, сопоставимую с плотностью пены ASACOL®, а именно плотность пены от около 0,05 г/мл до около 0,07 г/мл. В соответствии с некоторыми вариантами реализации изобретения пена, полученная из безводной композиции, как описано в данном документе (при испытании до хранения), имеет плотность пены, превышающую плотность пены ASACOL®, а именно плотность пены более чем около 0,067 г/мл, а именно по меньшей мере около 0,08 г/мл или по меньшей мере около 0,1 г/мл, включая около 0,1 г/мл. В соответствии с некоторыми вариантами реализации изобретения пена, полученная из эмульсионной композиции, как описано в данном документе (при испытании до хранения), имеет плотность пены по меньшей мере 0,05 г/мл, включая около 0,05 г/мл.
Разрушение пены
В контексте введения композиции пены для трансмукозальной доставки активного средства, разрушение пены является мерой того, как быстро и в течение какого времени активные компоненты композиции пены вступят в контакт со слизистой оболочкой, потому что, как только пена разрушится, основная масса композиции начнет непосредственно контактировать с поверхностью слизистой оболочки, но это может ограничивать общую продолжительность времени контакта между слизистой оболочкой и композицией. Разрушение пены измеряют как время, прошедшее (в минутах) с момента, когда пену поместили в сушильный шкаф, установленный на 36-37°С, до момента, когда лопнет последний наблюдаемый пузырь пены.
При испытании в соответствии с данным протоколом до хранения композиция пены ASACOL® демонстрирует время разрушения пены более 5 минут. В соответствии с некоторыми вариантами реализации изобретения пена, полученная из эмульсионной композиции, как описано в данном документе (при испытании до хранения), демонстрирует разрушение пены, сравнимое с разрушением пены ASACOL®, а именно время разрушения пены более 5 минут. В соответствии с некоторыми вариантами реализации изобретения, пена, полученная из безводной композиции, как описано в данном документе (при испытании до хранения), характеризуется временем разрушения пены, равным или меньшим, чем у пены ASACOL®, а именно временем разрушения пены более 5 минут или временем разрушения пены менее 5 минут, а именно временем разрушения пены менее 4 минут или менее 3 минут.
Стабильность
В некоторых вариантах реализации изобретения композиции пены, описанные в данном документе, проявляют хорошие свойства пены после хранения, а именно хорошие свойства расширения, прилипания, инверсии, плотности и разрушения. В конкретных вариантах реализации изобретения еще одно из свойств расширения, инверсии, прилипания, плотности и разрушения практически одинаково до и после хранения, а именно до и после хранения в течение 14 дней в условиях ускоренного испытания (40°С и относительная влажность 70%), а именно проявляющие одинаковые свойства или практически одинаковые свойства, отличающиеся на +/- 20%, +/- 10% или менее от измеряемого параметра (который измеряют, как показано выше).
Терапевтические способы
Как отмечено выше, композиции пены, описанные в данном документе, применяются для ректального введения любого лекарственного средства для любого целевого эффекта, включая диагностический, профилактический, терапевтический или косметический эффект. В таких способах композицию, как правило, вводят ректально из распылительного устройства, специально предназначенного для этой цели. В некоторых вариантах реализации изобретения композицию пены вводят 1-3 раза в день. В других вариантах реализации изобретения композицию пены вводят один раз в день.
В конкретных вариантах реализации изобретения композиции пены, описанные в данном документе и составленные с 5-АСК (или другим лекарственным средством на основе аминосалицилата, или фармацевтически приемлемой солью или эфиром 5-АСК или еще каким-либо лекарственным средством на основе аминосалицилата), применяют ректально для лечения воспалительного заболевания кишечника, включая язвенный колит или болезнь Крона. В некоторых вариантах реализации изобретения композицию пены на основе 5-АСК, как описано в данном документе, вводят один или два раза в день в течение периода времени от 4 до 6 недель.
ПРИМЕРЫ
Следующие конкретные примеры включены в качестве иллюстрации композиций, описанных в данном документе, с использованием 5-АСК в качестве типичного лекарственного средства. Эти примеры никоим образом не предполагают ограничение объема изобретения. Другие аспекты данного изобретения будут очевидны специалистам в области техники, к которой относится изобретение.
Применяют следующие методики для получения композиций пены, описанных в примерах ниже.
Пример 1: Приготовление безводной композиции пены
Безводную композицию пены готовят с применением следующих компонентов:


Глицерин вводят в боковой сосуд подходящего размера и перемешивают с помощью пропеллерной мешалки. Посыпают ксантановой камедью и перемешивание продолжают до тех пор, пока она хорошо не диспергируется. Премикс глицерина/ксантановой камеди хранят до необходимости.
ПЭГ 400 вводят в основной смесительный сосуд, и в сосуд загружают азот, чтобы минимизировать воздействие воздуха. В сосуд продолжают пропускать поток азота на низком уровне наряду с перемешиванием пропеллерной мешалкой. Смешивание продолжается в течении приготовления всей партии, если не указано иное. При нагревании до 70-75°С добавляют Polawax™ NF (самоэмульсионный воск, доступный от Croda, Inc), глицерилстеарат, Span 80 (сорбитан олеат), вазелин, диметилизосорбид, каприловый/каприновый триглицерид, метилпарабен, пропилпарабен, БГА и БГТ с перемешиванием в промежутках между добавлениями. Нагревание продолжают до 70-75°С.
Премикс глицерина/ксантановой камеди добавляют в основной смесительный сосуд и перемешивают не менее 10 минут.
Затем при перемешивании пропеллерной мешалкой добавляют пропиленгликоль, и смесь охлаждают до 35-40°С. Когда температура партии составляет менее 35°С, и в главном сосуде устанавливается соответствующий уровень азота, в него всыпают мезаламин, и, при необходимости, увеличивают скорость перемешивания. После последнего добавления смесь гомогенизируют в течение минимум 15 минут или до однородного состояния.
Добавляют токоферилацетат и перемешивание продолжают в течение минимум 15 минут.
Партии дают отстояться не менее 12 часов до заполнения, хранят в хорошо укупоренной таре под азотной подушкой и защищают от воздействия света.
Для наполнения партию тщательно перемешивают под азотной подушкой и отвешивают в распылительное устройство, а именно контейнер 35×70 от CCL (алюминий) для дозирования фармацевтических композиций пены. Распылительное устройство подвергают вакуумной опрессовке, наполняют пропеллентом (при коэффициенте заполнения 90,0% композиции/10,0% пропеллента) и устанавливают дозирующий клапан (а именно клапан S90 630 EQL). Перед заполнением пропеллентом распылительное устройство дополнительно продувают азотом.
Дополнительные безводные композиции пены, как описано ниже, готовят в соответствии со способом, описанным выше.

Применяя композиции, перечисленных выше, готовят шесть композиций пены при использовании в качестве пропеллента А31 и А46, соответственно, при коэффициенте заполнения 90,0% композиции/10,0% пропеллента.
Пример 2. Приготовление композиции пены в виде эмульсии масло-в-воде
Композицию пены в виде эмульсии масло-в-воде готовят с применением следующих компонентов:

Премикс: пропиленгликоль вводят в боковой сосуд соответствующего размера и перемешивают с помощью пропеллерной мешалки. Посыпают ксантановой камедью и перемешивание продолжают до тех пор, пока она хорошо не диспергируется. Премикс хранят до необходимости.
Основная смесь: очищенную воду вводят в основной смесительный сосуд. Сосуд заполнен азотом, чтобы минимизировать воздействие воздуха. Сосуд продолжают продувать потоком азота на низком уровне, и запускают перемешивание пропеллерной мешалкой. Смешивание продолжается в течение приготовления всей партии, если не указано иное. Премикс вводят в основной смесительный сосуд и перемешивают не менее 10 минут.
В основной смесительный сосуд вводят метилпарабен, ПЭГ-75, диметилизосорбид и тетранатрий ЭДТК и нагревают до 80-85°С. Перемешивание продолжают при 80-85°С до тех пор, пока не будет добавлена вспомогательная смесь.
Вспомогательная смесь: во вспомогательный сосуд вводят компоненты вспомогательной смеси (вазелин, цетиловый спирт, Span 80, полиэтиленгликоль(40)стеарат, пропилпарабен, БГТ и БГА) и нагревают до 83-88°С при перемешивании пропеллерной мешалкой. Когда температура вспомогательной смеси составит 83-88°С, ее медленно добавляют в основной смесительный сосуд.
Перемешивание продолжают в основном смесительном сосуде в течение 10 минут при 80-88°С, затем смесь охлаждают до 25°С при перемешивании пропеллерной мешалкой в потоке азота.
Когда температура партии составляет менее 35°С и в главном сосуде устанавливается соответствующий уровень азота, в него всыпают мезаламин, и, при необходимости, увеличивают скорость перемешивания. Когда температура партии достигает 25°С, перемешивание продолжают еще 10 минут.
Партии дают отстояться не менее 12 часов до заполнения, хранят в хорошо укупоренной таре с азотной подушкой и защищают от воздействия света.
Для наполнения партию тщательно перемешивают под азотной подушкой и отвешивают в распылительное устройство, а именно контейнер 35×70 от CCL (алюминий) для дозирования фармацевтических композиций пены. Распылительное устройство подвергают вакуумной обжимке, наполняют пропеллентом при кэффициенте заполнения 92,0% композиции/8,0% пропеллента и устанавливают дозирующий клапан (а именно клапан S90 630 EQL). Перед заполнением пропеллентом распылительное устройство необязательно продувают азотом.
Дополнительные композиции пены в виде эмульсии масло-в-воде, как описано ниже, готовят в соответствии со способом, описанным выше.

Используя композицию, описанную выше, готовят две композиции пены при использовании в качестве пропеллента А31 и А46, соответственно, при коэффициенте заполнения 92,0% композиции/8,0% пропеллента.
Пример 3. Исследования свойств и стабильности пены
Свойства пены композиций пен, описанных выше, и композиций пены Asacol® оценивают до хранения (например, в течение 30 дней с момента изготовления) (Т0) или после хранения в течение 14 дней при условиях ускоренного испытания (40°С (±2°С) и 75% OB (±5% OB)) (14 дней по ускоренному испытанию) в соответствии с методологией, изложенной выше. Для каждой композиции оценивают два пропеллента. Безводная: А = пропеллент представляет собой 10% мас./мас. А-31; В = пропеллент представляет собой 10% мас./мас. А-46.
Эмульсия: А = пропеллент представляет собой 8% мас./мас. А-31; В = пропеллент представляет собой 8% мас./мас. А-46.
Результаты представлены ниже.


Исследования стабильности показали, что все примеры сохраняют подходящие свойства, так что количество компонентов остается в диапазоне 90-110%.
Пример 4: Исследования устойчивости
Безводная композиция
Композиция А, описанная в Примере 1 выше, применяется в качестве контрольной композиции для исследования устойчивости безводной композиции пены. Состав композиции варьируется, как указано в таблице ниже, и оцениваются свойства полученной композиции.

Эмульсионная композиция
Композиция Е, описанная в Примере 2 выше, применяется в качестве контрольной композиции для исследования устойчивости эмульсионной композиции пены. Состав композиции варьируется, как указано в таблице ниже, и оцениваются свойства полученной композиции.


На основании результатов определены следующие компоненты, влияющие на следующие параметры:


Пример 5: Исследования ex vivo
Композицию А, описанную в Примере 1, и композицию Е, описанную в Примере 2, испытывают ex vivo на прилипание пены и инверсию пены с помощью слизистой оболочки толстой кишки свиньи с применением пены ASACOL® в качестве сравнительного образца. Результаты представлены на Фиг. 1.
В испытании на прилипание пены (слева) композиция Е («масло в воде») проходит кратчайшее расстояние за единицу времени для грамма. Это значение значительно ниже, чем для пены ASACOL® («сравнительный образец»), согласно испытанию Манна-Уитни. Для композиции А («безводная») три из шести параллельных испытаний демонстрировали более медленное движение пены, чем пены сравнительного образца, тогда как наблюдались два выпавших образца, которые быстро перемещались вниз по ткани толстой кишки. В испытании на инверсию пены (справа), которое включает нанесение на поверхность ткани толстой кишки и переворачивание, обе исследуемые композиции показывают лучшую адгезию, чем сравнительная композиция.
Результаты показывают, что композиции, описанные в данном документе, проявляют повышенную адгезию после нанесения на соответствующую биологическую поверхность (ткани толстой кишки), по сравнению с пеной ASACOL®.
Реферат
Группа изобретений касается фармацевтических композиций для ректальной пены, способов получения таких композиций, пены, изготовленной из таких композиций, и терапевтических способов с их применением. Безводная фармацевтическая композиция ректальной пены содержит лекарственное средство на основе аминосалицилата или его фармацевтически приемлемую соль или сложный эфир; воскообразный/липидный компонент, содержащий вазелин и каприловые/каприновые триглицериды (ККТ); растворитель/носитель; эмульгирующий компонент/поверхностно-активное вещество; камедь/смолистый компонент и пропеллент. Фармацевтическая композиция ректальной пены в виде эмульсии масло-в-воде содержит лекарственное средство на основе аминосалицилата или его фармацевтически приемлемую соль или сложный эфир, растворитель/носитель, содержащий воду, эмульгирующий компонент/поверхностно-активное вещество, воскообразный/липидный компонент, камедь/смолистый компонент и пропеллент, при этом воскообразный/липидный компонент содержит вазелин, цетиловый спирт и необязательно стеариновую кислоту. Способы получения композиций включают смешивание указанных выше компонентов в определенной последовательности; добавление лекарственного средства на основе аминосалицилата с получением конечной смеси; объединение конечной смеси с пропеллентом. Предлагаются также способ введения лекарственного средства и способ лечения воспалительного заболевания кишечника (в частности, язвенного колита или болезни Крона), включающие ректальное введение любой из указанных композиций или пены, полученной из них. Комбинации компонентов указанных выше композиций дают пену с целевыми свойствами, а именно пену, которая расширяется постепенно, расширяется до большого общего объема и/или демонстрирует хорошее время сохранности, не разрушается сразу после дозирования и является стабильной с точки зрения разрушения, разделения, гелеобразования или инверсии эмульсии при хранении. 7 н. и 18 з.п. ф-лы, 2 табл., 5 пр., 1 ил.

Комментарии