Композиция, содержащая щелочную фосфатазу, для применения при лечении артритов - RU2754854C2
Код документа: RU2754854C2
Чертежи




Описание
Данное изобретение относится к композициям для применения при лечении артритов (в настоящем документе название этих заболеваний используется также в единственном числе - «артрит»)
Артриты – это группа, объединяющая более 100 различных воспалительных или дегенеративных заболеваний, поражающих суставы и сопровождающихся болью или скованностью в скелетно-мышечной системе. Артрит – это воспаление одного или более суставов. Наиболее часто встречаются остеоартрит и ревматоидный артрит, подагра, анкилозирующий спондилит; артрит может быть также вторичным по отношению к другим заболеваниям, например псориатическому артриту, системной красной волчанке. Примеры артрита (не острые формы) включают остеоартрит, ревматоидный артрит и подагрический артрит. Острые формы обычно обусловлены заражением бактериями.
Ревматоидный артрит, патогенез которого остается неизвестным, характеризуется хроническим воспалением во многих суставах, приводящим к эрозии маргинальной костной ткани и хряща, околосуставной потере костной ткани и общим сокращением костной массы. Считается, что клетки, участвующие в воспалении, в частности лимфоциты и макрофаги, играют ключевую роль в патогенезе ревматоидного артрита и что в нем действуют также цитокины, например альфа-фактор некроза опухолей (TNFα) и интерлейкины (IL-1, IL-6 и IL-8). Кроме того, недавно получены данные, свидетельствующие о том, что при ревматоидном артрите в разрушении суставов и остеопорозе играют важную роль остеокласты, деятельность которых не компенсируется активностью остеобластов, то есть отношение активностей этих клеток (активность остеокластов : активность остеобластов) больше 1. Хотя ревматоидный артрит выражается в поражении суставов, его причины могут быть системными. У больных ревматоидным артритом наблюдаются повышенные уровни интерлейкинов (IL-1, IL-6) и фактора некроза опухолей (TNFα) при обострениях или хроническом течении заболевания, что указывает на провоспалительный характер физиологического состояния.
Ревматоидный артрит является основным системным аутоиммунным заболеванием и отличается высокой заболеваемостью и смертностью: 50% больных ревматоидным артритом через 10 лет после начала заболевания теряют трудоспособность, а продолжительность жизни у них сокращается на 3-18 лет. С ревматоидным артритом сопряжены высокие затраты на медицинское обслуживание и сокращение периода работоспособности.
Хотя первичный причинный фактор или механизм, ведущий к ревматоидному артриту, еще не известен, в усугублении или индукции этого заболевания предполагается участие системных пусковых факторов воспаления. Например, существует, по-видимому, корреляция между выраженностью и степенью заболеваний кишечника и тяжестью артрита. Чрезмерное размножение бактерий в тонком кишечнике вызывает ревматоидный артрит, а его начало предотвращается рекомбинантным бактерицидным белком, повышающим проницаемость, (BPI), который является агентом, нейтрализующим эндотоксин, и метронидазолом, обладающим активностью против анаэробных бактерий. Также, подобно токсинам грамотрицательных бактерий (например, липополисахаридов), вызывать артрит могут токсины грамположительных бактерий (например, липотейхоевая кислота). Помимо бактериальных токсинов к провоспалительному состоянию приводит обусловленный присутствием бактерий избыточный уровень аденозинтрифосфата/аденозиндифосфата (ATP/ADP) в кишечнике. На животных моделях ревматоидного артрита, индуцируемого коллагеном, было обнаружено, что ревматоидный артрит не начинался, если подопытные особи выращивались в септических условиях. Это говорит о том, что компоненты, происходящие из бактерий-комменсалов и патогенных штаммов могут влиять на локальный и системный гомеостаз и иммунный ответ.
Поскольку неизвестно, как лечить ревматоидный артрит, целью медикаментозной терапии является ослабление симптомов, предотвращение повреждения суставов и достижение ремиссии. Наилучшим средством, облегчающим течение ревматоидного артрита, является метотрексат. Показано, что метотрексат сдерживает воспалительную реакцию и в этом отношении считается лечебным агентом первой линии. Имеются убедительные данные о долгосрочном эффекте этого лекарства, однако его применение редко приводит к истинной/полной ремиссии. Монотерапия метотрексатом лишь в отдельных случаях дает устойчивую ремиссию при ревматоидном артрите. Главным недостатком метотрексата являются его цитотоксичность и нефротоксичность, а также негативные явления при длительном применении. Из-за токсичности через 5 лет терапии метотрексатом ее продолжают только у 50% пациентов. Еще один существенный недостаток метотрексата заключается в том, что известны случаи возникновения невосприимчивости к нему и поэтому метотрексат часто используют в сочетании с другими лекарствами.
К числу других лекарственных агентов, используемых для лечения ревматоидного артрита, относятся препараты, противодействующие фактору некроза опухолей (TNF), например этанерцепт или инфликсимаб, которые называют блокаторами TNFα. Показано, что у больных ревматоидном артритом такие средства снижают активность заболевания, быстро облегчают боль и ослабляют опухание суставов, уменьшая их повреждение. TNFα – важный цитокин, участвующий в ряде провоспалительных реакций и играющий большую роль в воспалительных заболеваниях, в том числе в развитии ревматоидного артрита, будучи ключевым элементом его патогенеза. Современные препараты, противодействующие TNFα, используются для того, чтобы блокировать TNFα и тем самым ослаблять воспалительную реакцию, что потенциально может предотвращать или уменьшать повреждение суставов. Препараты, противодействующие TNFα, применяются сами по себе или же в комбинированной терапии, например в сочетании с метотрексатом.
Однако имеющиеся в настоящее время в продаже биологические препараты, противодействующие TNFα, обладают некоторыми побочными эффектами. Один из наиболее важных состоит в том, что нарушается иммунологическая толерантность в отношении антительных препаратов из-за неестественной природы этих лекарств. Этот эффект ведет к образованию неактивных антител и снижает действенность применяемых доз. В результате у больного не наблюдается более положительных эффектов данного вещества. В таких случаях пациентам назначают другие фармакологические средства, например кортикостероидные препараты, которые имеют значительное негативное влияние в течение индивидуального промежутка времени. Также применение антител против TNF может повышать риск тяжелых инфекций, в частности туберкулеза.
С учетом всего сказанного выше в данной области техники имеется настоятельная потребность в новых подходах к лечению артрита. Притом нужны терапевтические средства, обладающие меньшими побочными эффектами в ходе лечения больных ревматоидным артритом и более действенные, нежели доступные в настоящее время лечебные мероприятия.
Цель данного изобретения помимо других задач направлена на указанные выше потребности. Цель данного изобретения помимо других задач достигается с помощью данного изобретения согласно прилагаемой формуле изобретения.
Говоря конкретно, указанная выше цель помимо других задач достигается согласно первому аспекту данного изобретения с использованием эктофосфатазы в сочетании с препаратами, влияющими на течение ревматоидного артрита, противодействуя его развитию (DMARD), для применения при лечении млекопитающих, больных ревматоидным артритом. В настоящем документе термин «артрит» включает, например, остеоартрит, ревматоидный артрит и подагрический артрит. Неадекватная системная реакция врожденной иммунной системы в ходе провоспалительных процессов приводит к дальнейшему прогрессированию заболевания. Таким образом, ослабление обусловленных вспышками (обострениями) заболевания системные воспалительные реакции (например, резкое увеличение количества продуцируемых иммунной системой провоспалительных белков-цитокинов) может оказаться благотворным для больного. Такую функцию может выполнять щелочная фосфатаза, которую соответственно можно использовать как обычный терапевтический агент.
В другом своем аспекте данное изобретение относится к комбинации эктофосфатазы с лекарственным препаратом, влияющим на течение ревматоидного артрита, противодействуя заболеванию (DMARD) для применения при использовании метотрексата в качестве DMARD. Терапия с использованием комбинации со щелочной фосфатазой, обеспечивает эффективный лечебный режим, включающий более низкие дозы метотрексата. Когда метотрексат применяется в дозах, назначаемых для противодействия ревматоидному артриту, приводит к выведению/высвобождению из клеток внутриклеточных нуклеотидов, например аденозинтрифосфата (АТР) и аденозиндифосфата (ADP), которые затем превращаются в аденозин. Аденозин обладает мощным противовоспалительным действием и инактивирует активированные белые кровяные клетки (лейкоциты), играющие причинную роль в патогенезе ревматоидного артрита. Следовательно, щелочная фосфатаза дает синергический эффект при лечении метотрексатом, способствуя образованию обладающего противовоспалительным действием аденозина. Также превращения нуклеотидов, высвобождающихся из клеток при окислительном стрессе, как, например, в участках организма, поражаемых при ревматоидном артрите, создают противовоспалительное микроокружение, например, в суставах.
Щелочная фосфатаза является мощенным модификатором, например, реакции с участием фактора некроза опухолей (TNFα) в условиях воспаления; активность щелочной фосфатазы приводит к значительному ослаблению «цитокинового шторма» - резкого увеличения количества продуцируемых иммунной системой провоспалительных белков-цитокинов, что было показано в предклинических и клинических исследованиях, например, у больных, перенесших обширное хирургическое вмешательство. Особенно значительное ослабление указанного опасного цитокинового каскада наблюдалось в случае таких провоспалительных маркеров, как TNFα, IL-6 и IL-8, а уровень IL-10 в плазме крови существенно не изменялся. Последний факт позволяет предполагать, что основное событие, являющееся пусковым для воспалительной реакции, в присутствии достаточного количества щелочной фосфатазы не происходит, например, в макрофагах и других белых кровяных клетках и, следовательно, не образуется обладающего противовоспалительным действием интерлейкина-10 (IL10). Кроме того, в отличие от современных агентов, противодействующих ревматоидному артриту, которые нацелены на какой-то один из интермедиатов основных цитиокинов, щелочная фосфатаза, как предполагается, служит контролирующим фактором в системе врожденной иммунной защиты и влияет на многие цитокины.
Предполагается, что щелочная фосфатаза, будучи в нормальных условиях физиологически эффективным и активным эндогенным белком, не обладает вредными эффектами вроде повышения риска инфекций и развития проявлений толерантности или же невосприимчивости. Принимая во внимание тот факт, что у беременных даже высокие уровни эндогенной щелочной фосфатазы безопасны как для плода, так и для будущей матери и хорошо переносятся в течение продолжительного времени, мы считаем, что терапия с использованием щелочной фосфатазы принесет пользу больным ревматоидным артритом в прогрессирующей стадии.
Обусловленные окислительным стрессом (например, при ишемическом повреждении тканей) явления могут приводить к высвобождению нуклеотидов (аденозинмоно-, аденозинди- и аденозинтрифосфата) из пораженных клеток. Эти вещества, которые в норме находятся внутри клеток, участвуют в обеспечении клеточных механизмов энергией, а оказавшись в межклеточной среде, становятся мощными провоспалительными факторами (компонентами, запускающими воспаление, ITM). Эти пусковые факторы обезвреживаются в результате активности эктофосфатаз, например, щелочной фосфатазы, CD39 и CD73. При воздействии на ATP и ADP образуется аденозин, противодействующий воспалению. Таким образом. щелочная фосфатаза предлагается в качестве противовоспалительного агента, эффективного как в отдельности, так и в сочетании с другими терапевтическими агентами. Преимущество комбинированной терапии с использованием щелочной фосфатазы состоит в том, что требуются более низкие дозы сочетаемых с фосфатазой других фармакохимических или биологических агентов. противодействующих ревматоидному артриту. Тем самым снижается вероятность возникновения невосприимчивости к лекарствам или изменения толерантности.
В одном из других предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для применения при артрите, а именно при ревматоидном артрите.
По данному изобретению млекопитающее, больное ревматоидным артритом, может быть представлено любым позвоночным животным, например обезьяной, лошадью, крупным рогатым скотом, грызуном, человеком, предпочтительно человеком.
В одном из других предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), причем эктофосфатазу выбирают из группы. состоящей из щелочной фосфатазы, CD39 и CD73. Источников таких фосфатаз много: эктофосфатаза может происходить из природных источников или быть полученной с помощью технологии рекомбинантной ДНК путем экспрессии данного белка в одноклеточных организмах, например, в дрожжах или в многоклеточных организмах, например, в растениях или животных.
В одном из других предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), причем эктофосфатаза представлена рекомбинантной щелочной фосфатазой.
В одном из других предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), причем эктофосфатаза представлена рекомбинантной щелочной фосфатазой млекопитающего, предпочтительно человека. Предпочтительно фосфатаза, используемая в комбинированной терапии по данному изобретению совместима с намеченным терапевтическим вмешательством, которому и должна способствовать, например лечению человека с помощью композиции по данному изобретению, содержащей рекомбинантную человеческую щелочную фосфатазу. Однако можно использовать и другие комбинации, например, при лечении человека с использованием композиции по данному изобретению, содержащей нечеловеческую природную или рекомбинантную щелочную фосфатазу, например, кишечные щелочные фосфатазы крупного рогатого скота.
Эктофосфатазу в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для использования по данному изобретению можно применять местно (например, перорально или путем вдыхания) или путем парентерального введения в составе препаратов, пригодных для указанных путей введения. Но только после парентерального введения щелочная фосфатаза может воздействовать непосредственно на свою мишень. Существующие в настоящее время способы лечения хронических воспалительных заболеваний, например, ревматоидного артрита предполагают частое введение на протяжении длительного времени лечебного средства обычными путями введения, например, перорально, путем внутримышечных или внутривенных инъекций, что приводит к накоплению лекарственного вещества вне воспаленного участка и иногда вызывает нежелательные системные побочные эффекты. Более специфичное нацеливание на мишень достигается, например, с помощью нано-составов щелочной фосфатазы.
В одном из других предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), дополнительно в комбинации с наночастицами. Показано, что наночастицы, нагруженные эктофосфатазой по данному изобретению в отдельности или в сочетании с DMARDS, эффективно противодействую как таковые ревматоидному артриту, и можно разработать действенные способы лечения. При использовании наночастиц для доставки композиции по данному изобретению лекарственные вещества специфично высвобождаются в воспаленном участке замедленным образом с постоянной или с непостоянной скоростью и таким образом ослабляются нежелательные эффекты и улучшается соблюдение больным режима и схемы лечения.
В одном из своих предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для применения с наночастицами, которые состоят из материала, выбираемого из группы, состоящей из фуллеренов, липосом, золота, поли(молочной-ко-гликолевой) кислоты (PLGA) и поли-L-молочной кислоты (PLA). Наночастицы, которые можно использовать для того, чтобы заключать в них композицию по данному изобретению, предпочтительно состоят из золота, поли(молочной-ко-гликолевой) кислоты (PLGA) или поли-L-молочной кислоты (PLA), более предпочтительно из PLGA или PLA, наиболее предпочтительно из PLGA.
Щелочная фосфатаза, пригодная по данному изобретению, - это предпочтительно рекомбинантная человеческая щелочная фосфатаза, отличающаяся продленным временем пребывания в плазме крови. Таким образом, рекомбинантную человеческую щелочную фосфатазу можно охарактеризовать как вещество для использования в качестве альтернативы существующим в настоящее время агентам, применяемым для лечения ревматоидного артрита.
Также применение рекомбинантной человеческой щелочной фосфатазы должно позволить обходить возможные иммунологические реакции, возникающие после длительного лечения с помощью не человеческих гликопротеинов, например бычьей щелочной фосфатазы, которая используется в кардиохирургии только непродолжительное время. Для гликопротеинов, у которых по клиническим показаниям продлено время пребывания в плазме крови, характерна полностью гликозилированная сложная олигосахаридная цепь. Щелочная фосфатаза из большинства источников не обладает достаточно сложной цепочкой из остатков сахаров, присоединенной к полипептидной цепи, и поэтому отличается временем пребывания в плазме крови, составляющим лишь часть того, что свойственно предпочтительным лекарствам. Хотя нечеловеческие щелочные фосфатазы, например крупного рогатого скота, обладают значительной активностью как блокаторы TNFα даже при коротком времени пребывания в плазме крови, предполагается, что они не очень эффективны при постоянном применении. Однако такие фосфатазы можно использовать в качестве препарата для применения в период прекращения курса лечения больных ревматоидным артритом, в схемах применения, предполагающих периоды отмены терапии, включающей блокаторы фактора некроза опухолей (TNFα). Иными словами, нечеловеческие щелочные фосфатазы предлагаются по данному изобретению в качестве препаратов, используемых в периоды отмены основной терапии. Для временного использования в качестве такого препарата берут определенные источники щелочной фосфатазы. Источники, которые идентифицированы и в которых обнаружена биологически релевантная активность AP, включают нативные и рекомбинантные AP, экспрессируемые, например, в экспрессионной модели дрожжей, растений, мхов и млекопитающих.
В одном из своих предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для применения при лечении, включающем парентеральное или пероральное введение композиции по данному изобретению. Терапевтическое вмешательство осуществляется при этом либо местно (например, перорально или путем вдыхания). Либо парентерально в составе пригодных для данного пути введения препаратов.
В еще одном из своих предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для применения при лечении, включающем профилактику, или отсрочку начала заболевания, или замедление прогрессирования артрита. Иными словами, эктофосфатаза в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для применения по данному изобретению может использоваться в профилактических целях для предотвращения или ослабления воспалительной реакции в процессе предвоспалительных явлений, что ведет к сдерживанию дальнейшего прогрессирования заболевания. Также щелочную фосфатазу можно использовать терапевтически для лечения млекопитающих, больных артритом.
В другом своем предпочтительном воплощении данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), для применения при указанном лечении, когда оно включает ослабление воспалительной реакции у млекопитающего, больного артритом. Это ослабление воспалительной реакции может включать также лечение обострений у больного артритом.
В еще одном из предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), в тех случаях, когда эктофосфатаза является тканеспецифичной и лечение осуществляется в отношении хронического артрита.
В одном из предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом(DMARDs), в тех случаях, когда тканеспецифичную эктофосфатазу выбирают из группы, состоящей из кишечной щелочной фосфатазы (IAP), плацентарной щелочной фосфатазы (PALP) и печеночной щелочной фосфатазы (LAP); предпочтительна плацентарная щелочная фосфатаза (PALP). Хотя как не тканеспецифичная щелочная фосфатаза (TNSALP), так и тканеспецифичная щелочная фосфатаза, например кишечная (IAP) или плацентарная обладают активностью в отношении нуклеотидов, что показано в собственных исследованиях нашей фирмы in vitro и in vivo, существует значительная разница в молекулярной структуре между, с одной стороны, TNSALP и, с другой стороны, IAP или PALP. В тканеспецифичных IAP и PLAP отсутствует так называемый «краун»-домен, включающий сайт связывания RGD (аминокислотную последовательность Arg-Gly-Asp), который свойствен изозимам TNSALP щелочной фосфатазы костной ткани. Мы предполагаем, что этот «краун»-домен служит структурой, обеспечивающей «хоминг» (возвращение на свое место) для TNSALP, и, таким образом, объясняется, что, например, хотя кишечная щелочная фосфатаза, содержание которой у больных ревматоидным артритом относительно повышено, может частично компенсировать эффект нуклеотидной токсичности, но не образование костной ткани. Предпочтительно у больных ревматоидным артритом в качестве альтернативы можно использовать плацентарную щелочную фосфатазу. Безопасность длительного применения плацентарной щелочной фосфатазы обеспечивается тем, что во время беременности ее уровень в плазме крови до 30 раз превышает нормальный. Повышенный уровень щелочной фосфатазы в плазме крови имеет место даже тогда, когда у беременных, больных ревматоидным артритом, его клинические симптомы ослаблены – возможно, потому, что снижена потребность в пополнении эндогенных тканеспецифичных (костной, печеночной, почечной) форм. Известно, что у беременных женщин уровень плацентарной щелочной фосфатазы значительно повышен во втором и в последнем триместрах беременности, причем этот фермент выводится из кровотока со временем полужизни (T1/2), составляющем 7 суток. Мы рекомендуем в качестве лечения хронического ревматоидного артрита введение человеческой плацентарной щелочной фосфатазы. Также описано, что клинический фенотип многих аутоиммунных заболеваний ослабляется в указанные периоды беременности, но возвращается к прежнему уровню по ее окончании с той же кинетикой, что и выведение плацентарной щелочной фосфатазы. Человеческая плацентарная щелочная фосфатаза представляет собой полностью гликозилированный белок, причем на концах боковых олигосахаридных цепочек находится остаток сиаловой кислоты, в связи с чем этот фермент не быстро выводится из кровотока при участии печеночного рецептора сиалогликопротеинов.
В принципе, возможно также использование изоферментов кишечной щелочной фосфатазы, поскольку она весьма сходна с плацентарной, однако, мы предлагаем предпочесть кишечному ферменту плацентарный, так как у последнего время пребывания в плазме крови, составляет около 6-7 суток, что приемлемо в схемах лечения хронических заболеваний. У кишечного изофермента по сравнению с плацентарным продолжительность пребывания в плазме крови меньше, так что кишечная форма прекрасно подходит для применения при определенных неотложных лечебных вмешательствах, например при обширном хирургическом вмешательстве для противодействия осложнениям, обусловленным ишемическим поражением.
В одном из предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболеванию (DMARDs), в тех случаях, когда тканеспецифичную эктофосфатазу выбирают из группы, состоящей из кишечной щелочной фосфатазы (IAP), плацентарной щелочной фосфатазы (PALP) и печеночной щелочной фосфатазы (LAP); предпочтительна кишечная щелочная фосфатаза, более предпочтительна плацентарная щелочная фосфатаза (PALP) или их комбинация.
В еще одном из предпочтительных воплощений данное изобретение относится к композиции, в которой эктофосфатаза не является тканеспецифичной и с ее помощью лечат не хронический артрит.
В одном из предпочтительных воплощений данное изобретение относится к эктофосфатазе в комбинации с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), в тех случаях, когда эктофосфатазу в сочетании с лекарственным препаратом от ревматоидного артрита, влияющим на течение заболевания (DMARDs), применяют таким образом, что препарат по данному изобретению вводят больному по меньшей мере один раз в месяц, предпочтительно по меньшей мере два раза в месяц, более предпочтительно по меньшей мере три раза в месяц, еще более предпочтительно по меньшей мере четыре раза в месяц, наиболее предпочтительно по меньшей мере пять раза в месяц. Также данное изобретение относится к композиции, в которой указанная комбинация вводится по меньшей мере один раз в неделю, более предпочтительно два раза в неделю, предпочтительно по меньшей мере три раза в неделю, более предпочтительно по меньшей мере один раз в месяц и наиболее предпочтительно с периодичностью введения, превышающей один месяц. Кроме того, комбинацию веществ по данному изобретению можно вводить больному по меньшей мере один раз в два месяца, предпочтительно по меньшей мере один раз в три месяца, более предпочтительно по меньшей мере один раз в четыре месяца, наиболее предпочтительно по меньшей мере один раз в пять месяцев. Комбинацию веществ по данному изобретению можно вводить больному по меньшей мере один раз в неделю.
Как говорилось выше, преимущество плацентарной щелочной фосфатазы, например природной или рекомбинантной человеческой щелочной фосфатазы (hRESCAP), в сравнении с кишечным, костным, печеночным и почечным изоферментами в том, что продолжительность пребывания в плазме крови у плацентарной формы составляет 6-7 суток. При времени полужизни (T1/2) это делает приемлемым парентеральное введение два раза в месяц, тогда как кишечную щелочную фосфатазу нежно вводить ежедневно, что в схемах лечения артрита при хроническом течении заболевания не приемлемо.
Ниже данное изобретение раскрывается подробнее на примерах, сопровождаемых следующими иллюстрациями.
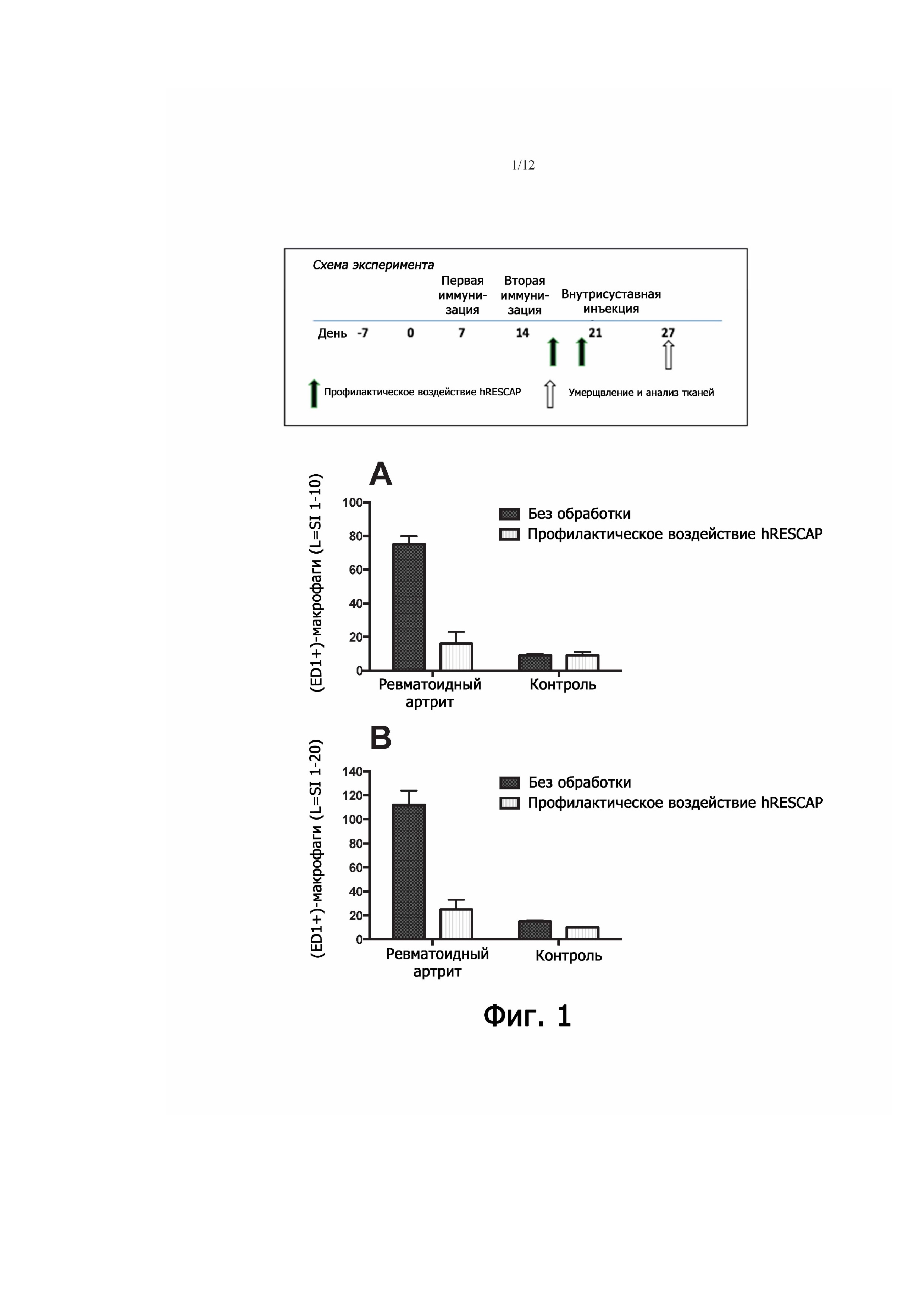
Фигура 1 - демонстрирует влияние профилактической терапии щелочной фосфатазой на синовиальные (ED1+)-макрофаги у крыс с артритом (двукратное введение щелочной фосфатазы до внутрисуставной инъекции антигена). В воспаленном колене («ревматоидный артрит») у крыс после иммунизации и бустерного введения (внутрисуставно) метилированного бычьего сывороточного альбумина (mBSA) наблюдалась массовая инфильтрация активированными (ED1+)-макрофагами. Этот эффект имел место и в выстилке сустава (на глубине десяти слоев клеток; фиг. 1А), и в подлежащих тканях (на глубине двадцати слоев клеток; фиг. 1B). Притом в контрольных коленных суставах отмечалась лишь умеренная инфильтрация макрофагами; сходная умеренная инфильтрация макрофагами наблюдалась после воздействия щелочной фосфатазой («профилактическая терапия .hRESCAP»), а в контрольном суставе у каждой особи была еще более слабая реакция.
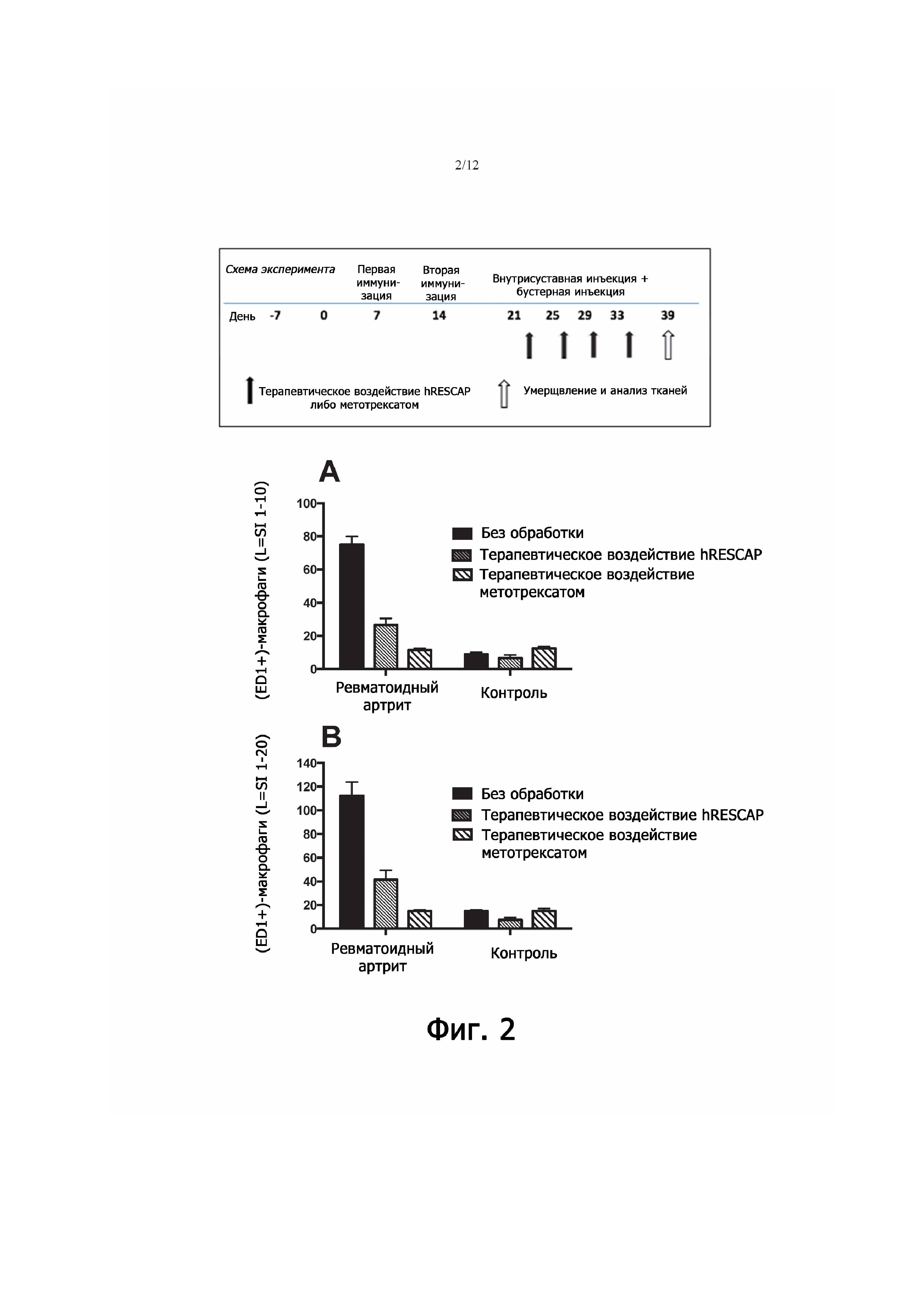
Фигура 2 - демонстрирует влияние терапевтического воздействия щелочной фосфатазой на синовиальные (ED1+)-макрофаги у крыс с артритом (четырехкратное введение щелочной фосфатазы после первой внутрисуставной инъекции и между бустерными введениями антигена). Терапевтическое воздействие щелочной фосфатазой сравнивали с воздействием метотрексата (MTX). После стимуляции метилированным бычьим сывороточным альбумином (mBSA) у животных в правом коленном суставе наблюдалось увеличение численности (ED1+)-макрофагов, а у особей, получавших щелочную фосфатазу такой активности не отмечалось. Этот эффект имел место и в выстилке сустава (на глубине десяти слоев клеток; фиг. 2А), и в подлежащих тканях (на глубине двадцати слоев клеток; фиг. 2B). Притом воздействие щелочной фосфатазой после внутрисуставной инъекции mBSA приводило к сокращению инфильтрации (ED1+)-макрофагами. Воздействие метотрексатом вызывало еще большее снижение количества (ED1+)-клеток, но в коленных суставах, служивших отрицательным контролем, численность таких макрофагов была выше, чем у крыс, получавших щелочную фосфатазу.
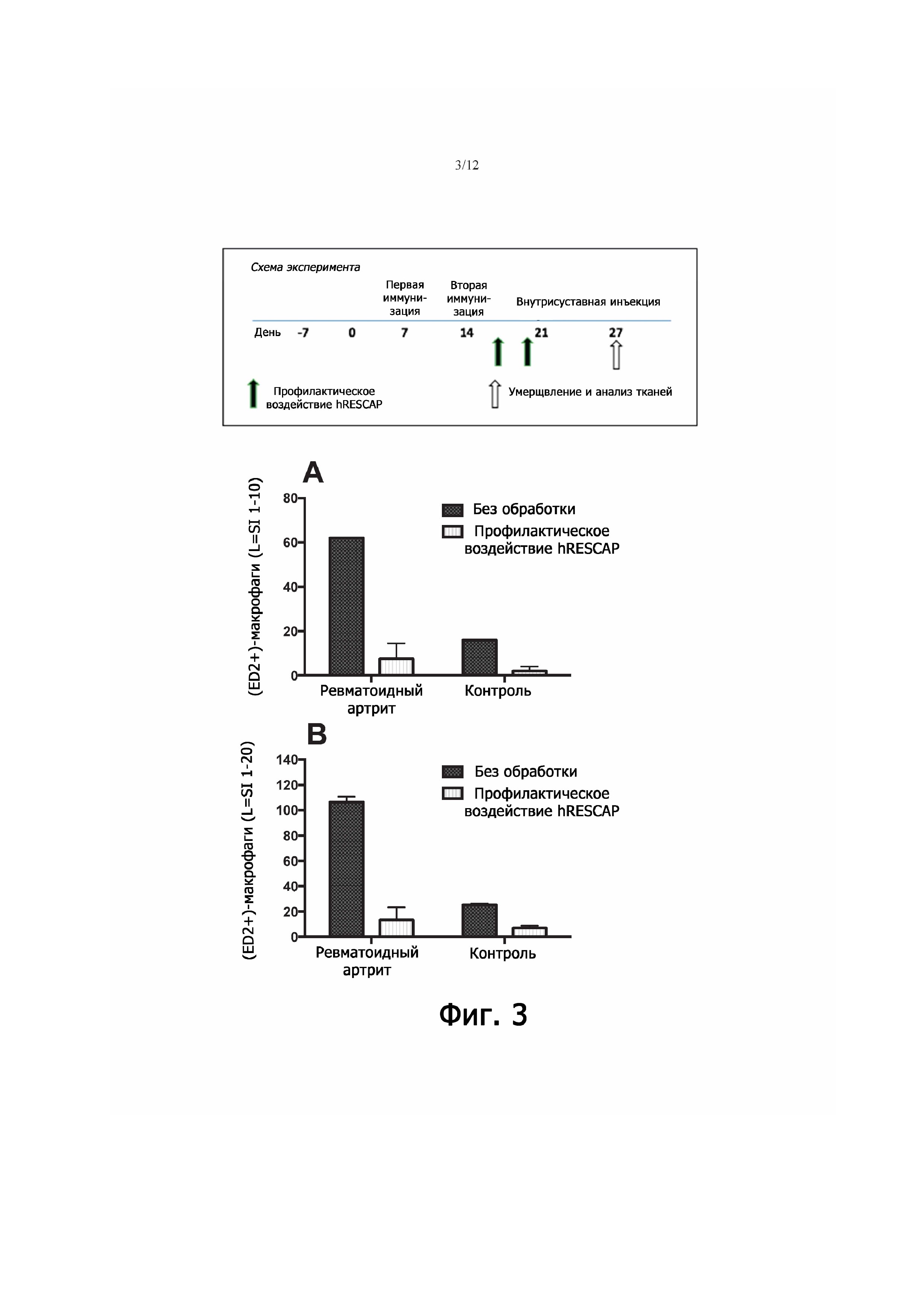
Фигура 3 - демонстрирует влияние терапии щелочной фосфатазой на синовиальные (ED2+)-макрофаги у крыс с артритом (двукратное введение щелочной фосфатазы до внутрисуставной инъекции антигена). У тех особей, у которых после стимуляции метилированным бычьим сывороточным альбумином (mBSA) в правом коленном суставе возрастало количество (ED1+)-макрофагов, также наблюдалась активность ED2+, тогда как у животных, получавших щелочную фосфатазу, такой активности не отмечалось, что согласуется с общим преставлением об индуцировании противовоспалительной реакции только после провоспалительных явлений. Этот эффект имел место и в выстилке сустава (на глубине десяти слоев клеток; фиг. 3А), и в подлежащих тканях (на глубине двадцати слоев клеток; фиг. 3B). Очевидно, в отсутствие провоспалительных явлений воздействие щелочной фосфатазой не приводит к противовоспалительной реакции, как явствует из снижения численности (ED2+)-макрофагов по данным иммуногистохимического анализа.
Фигура 4 - демонстрирует влияние терапии щелочной фосфатазой на синовиальные (ED2+)-макрофаги у крыс с артритом (четырехкратное введение щелочной фосфатазы после первой внутрисуставной инъекции и между бустерными введениями антигена). У тех особей, у которых после стимуляции метилированным бычьим сывороточным альбумином (mBSA) в правом коленном суставе возрастало количество (ED1+)-макрофагов, также наблюдалась активность ED2+, тогда как у животных, получавших щелочную фосфатазу, такой активности не отмечалось, что согласуется с общим преставлением об индуцировании противовоспалительной реакции только после провоспалительных явлений. Очевидно, в отсутствие провоспалительных явлений воздействие щелочной фосфатазой после внутрисуставной инъекции mBSA не приводит к противовоспалительной реакции, как явствует из снижения численности (ED2+)-макрофагов по данным иммуногистохимического анализа. Отметим, что в случае воздействия щелочной фосфатазой после внутрисуставной инъекции mBSA ее эффекты значительно слабее и сходны с таковыми от воздействия метотрексатом. Этот эффект имел место и в выстилке сустава на глубине десяти слоев клеток (фиг. 4А), и в подлежащих тканях на глубине двадцати слоев клеток (фиг. 4B).
Фигура 5 - демонстрирует опухание колена (толщина в миллиметрах) у крыс, которым 4 раза делали терапевтическое воздействие (вводили щелочную фосфатазу либо метотрексат) и внутрисуставную инъекцию. Черная кривая, проведенная через не закрашенные треугольники, относится к положительному контролю. Левое (не подвергавшееся обработке) колено у этих особей опухало умеренно (фиг. 5А), а правое (подвергавшееся обработке) – выраженно (фиг. 5B). Ослабление опухания наблюдалось и после профилактического, и после терапевтического воздействия щелочной фосфатазой, а также после воздействия метотрексатом вслед за внутрисуставной инъекцией метилированного бычьего сывороточного альбумина (mBSA) в правое колено. Отметим, что благотворный эффект как щелочной фосфатазы, так и метотрексата в левом (не подвергавшемся обработке) колене очевиден, поскольку опухание ослаблено по сравнению с положительным контролем.
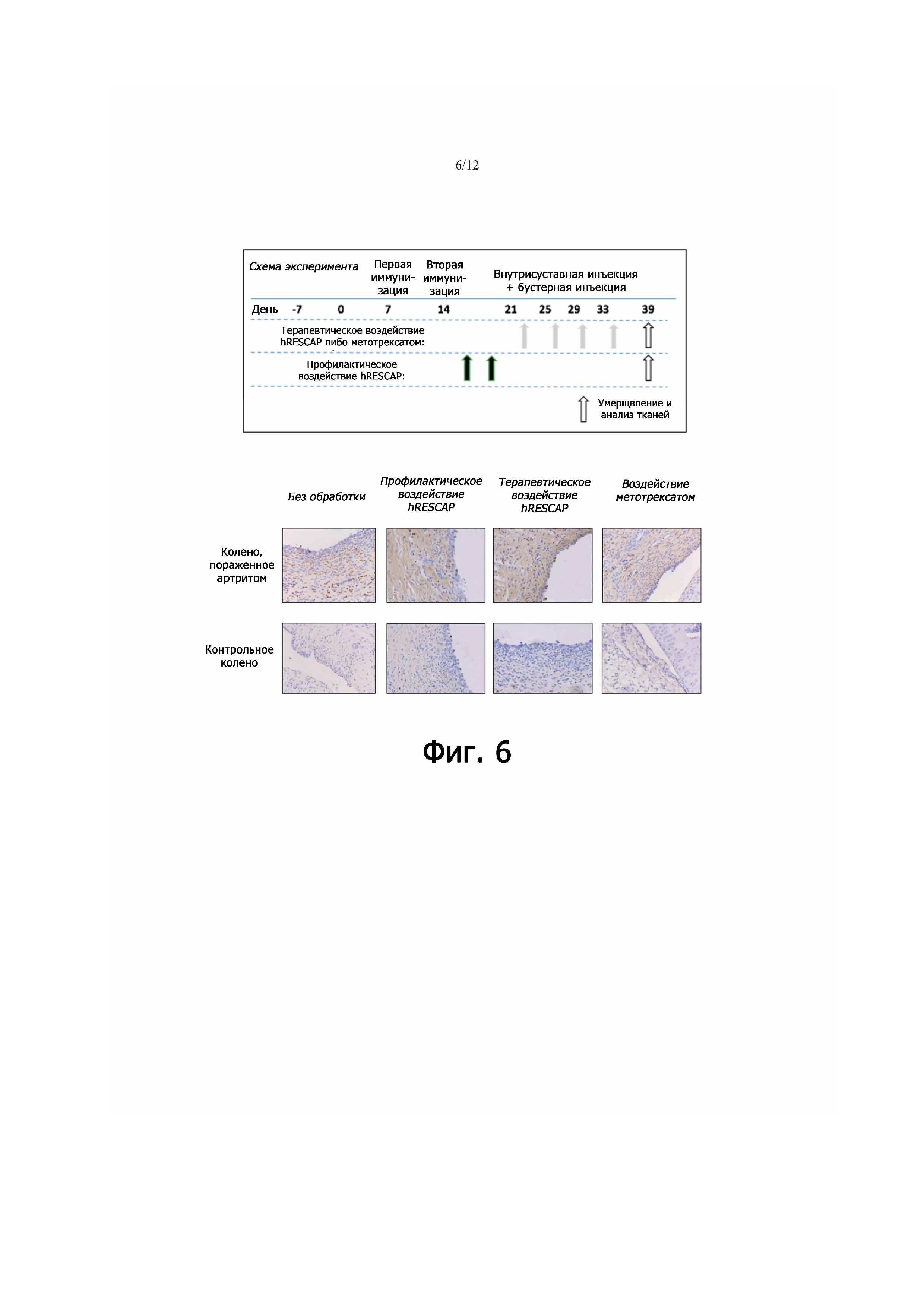
Фигура 6 - демонстрирует иммуногистохимическую локализацию и количество (ED1+)-макрофагов в синовиальных тканях коленного сустава, пораженного артритом, в тех группах крыс, которые не получали никакой обработки, или же подвергались профилактическому либо терапевтическому воздействию щелочной фосфатазы (hRESCAP), либо терапевтическому воздействию метотрексата. В пораженном ревматоидным артритом коленном суставе, не подвергавшимся обработке, содержалось много (ED1+)-макрофагов, которые практически отсутствовали в контрольном колене. Количество (ED1+)-макрофагов в пораженном артритом коленном суставе значительно уменьшалось после профилактического и терапевтического воздействия щелочной фосфатазы или метотрексата.
Фигура 7 - демонстрирует фармакокинетику щелочной фосфатазы в плазме крови у здоровых крыс и у крыс с артритом. (А) показывает схему лечения и время фармакокинетических измерений. И здоровым, и больным артритом животным вводили человеческую рекомбинантную щелочную фосфатазу в дозе 700 Ед на 1 кг массы тела, а для контроля особям с артритом делали инъекцию PBS. (B) Данные для образцов крови были взяты до и спустя 15, 60, 120 и 240 минут после введения щелочной фосфатазы, после чего в образцах плазмы анализировали на ферментативную активность. Результаты представлены как среднее ± стандартное отклонение (SD) для двух крыс в каждой группе; анализ проводили дважды.
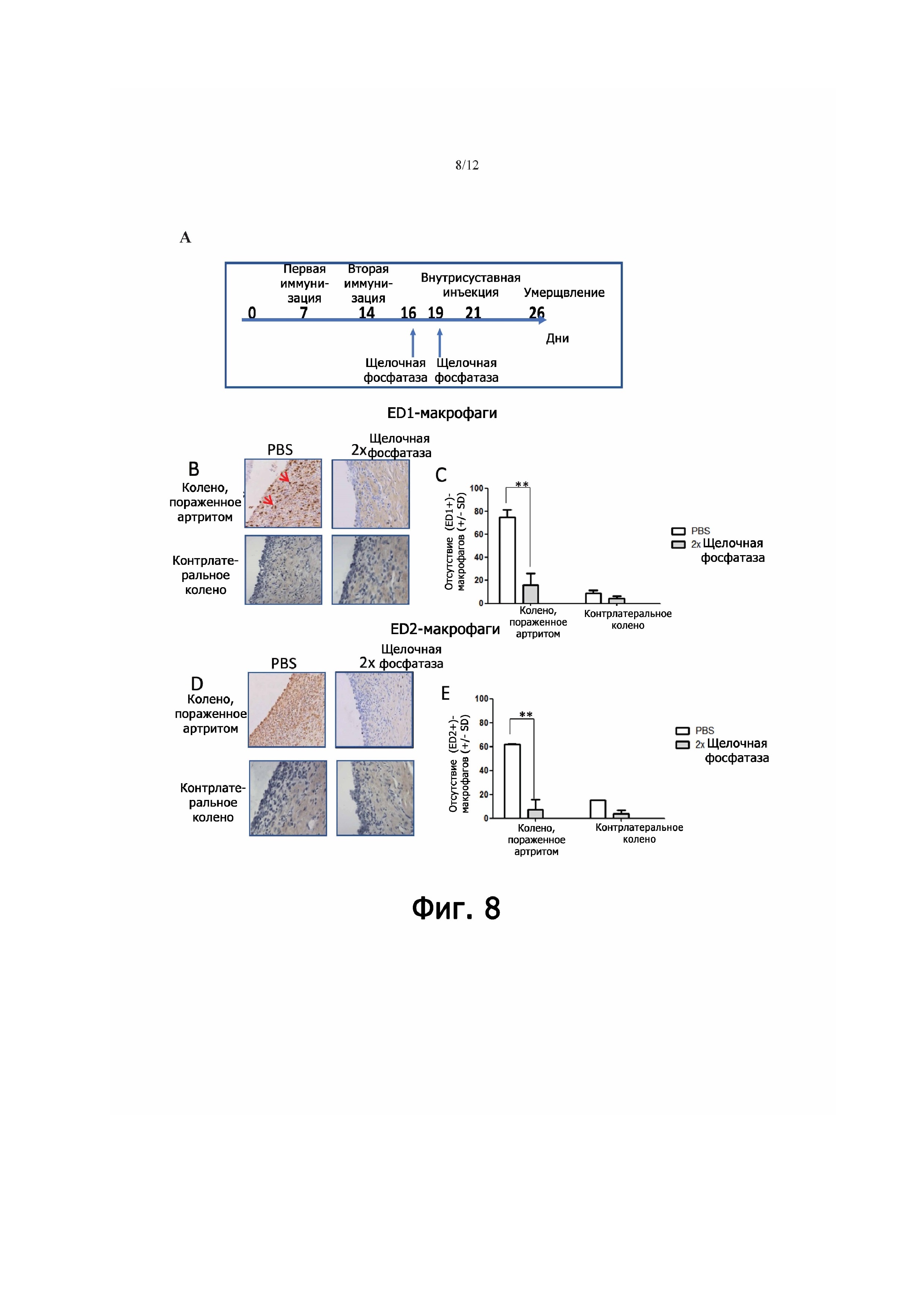
Фигура 8 - репрезентативные изображения и определение количеств (ED1+)- и (ED2+)-макрофагов в срезах колена крыс, получавших профилактическую терапию щелочной фосфатазой (2-кратное введение). (А) показывает хронологию индуцирования артрита у крыс и профилактического воздействия щелочной фосфатазой. В дни 7 и 14 делали первую и вторую иммунизацию (Im1 и Im2) метилированным бычьим сывороточным альбумином (mBSA); в день 21 делали внутрисуставную инъекцию (i.a.). В дни 16 и 19 проводили профилактическое воздействие щелочной фосфатазой либо вводили PBS. (В) показывает изображения, демонстрирующие ED1 в пораженном артритом и контрлатеральном коленных суставах у не подвергавшихся обработке животных и у особей, получавших два раза щелочную фосфатазу. На (С) представлено определение количества (ED1+)-макрофагов у не подвергавшихся обработке животных и у особей, получавших два раза щелочную фосфатазу. На (D) представлены изображения, демонстрирующие ED2 в пораженном артритом и контрлатеральном коленных суставах у не подвергавшихся обработке животных и у особей, получавших два раза щелочную фосфатазу. (Е) Определение количества (ED2+)-макрофагов в пораженном артритом и контрлатеральном коленных суставах у не подвергавшихся обработке животных и у особей, получавших два раза щелочную фосфатазу. Вертикальными черточками показано стандартное отклонение (SD).
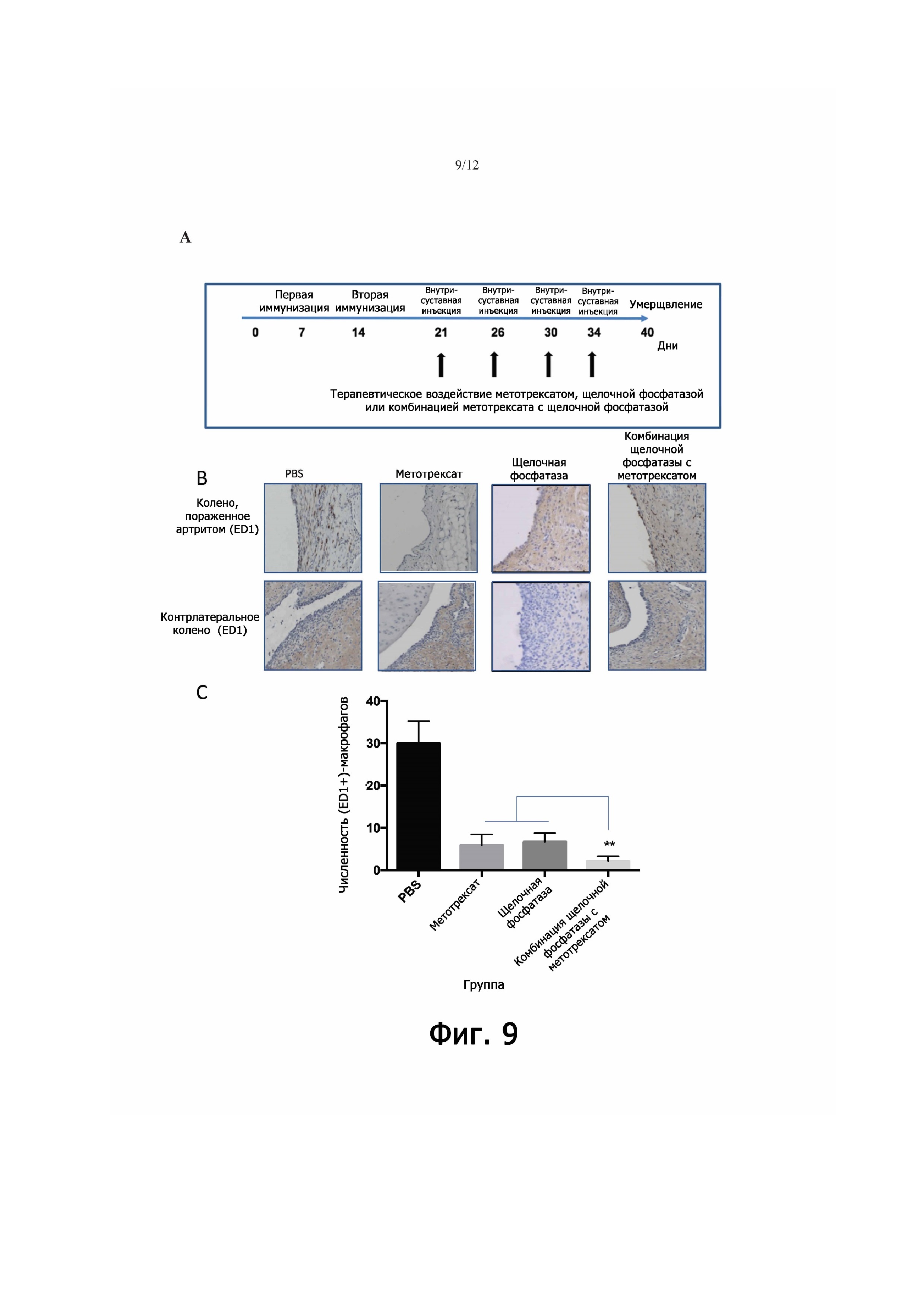
Фигура 9 - репрезентативные изображения и определение количеств (ED1+)- макрофагов в срезах колена крыс с артритом, получавших щелочную фосфатазу, метотрексат и комбинацию щелочной фосфатазой с метотрексатом. (А) Хронология эксперимента. В дни 7 и 14 делали первую и вторую иммунизацию (Im1 и Im2) метилированным бычьим сывороточным альбумином (mBSA); в дни 21, 26, 30 и 34 делали внутрисуставную инъекцию (i.a.) mBSA. Воздействие производили щелочной фосфатазой (700 Ед/кг), метотрексатом (0,3 мг/кг либо 1,0 мг/кг) или же комбинацией щелочной фосфатазы с метотрексатом. Для контроля крысам с артритом, не подвергавшимся обработке, делали инъекции PBS. (В) Изображения, демонстрирующие ED1 у здоровых крыс, у крыс с артритом в пораженных и контрлатеральных коленных суставах, получавших PBS, метотрексат в дозе 1,0 мг/кг, щелочную фосфатазу в дозе 700 Ед/кг и комбинацию щелочной фосфатазы с метотрексатом. (С) Определение количества (ED1+)-макрофагов у здоровых крыс, у крыс с артритом в пораженных и контрлатеральных коленных суставах, получавших PBS, метотрексат, щелочную фосфатазу и комбинацию щелочной фосфатазы с метотрексатом. Метотрексат брали в двух дозировках – а именно 0,3 мг/кг и 1,0 мг/кг; в обеих дозах наблюдалось одинаковое влияние на количество ED1-макрофагов в пораженных артритом коленных суставах, поэтому мы сгруппировали результаты по этим двум группам крыс. Численность групп: PBS.- n=4; метотрексат - n=8, щелочная фосфатаза - n= 4, комбинация метотрексата с щелочной фосфатазой - n=8. Эффект комбинированной терапии щелочной фосфатазой с метотрексатом значительно отличался от эффектов метотрексата и щелочной фосфатазы по отдельности ( **p<0,01).
Фигура 10 - репрезентативные результаты фронтального сканирования путем позитронно-эмиссионной томографии- компьютерной томографии (PET-CT) с [18F]фтор-ПЭГ-фолатом коленных суставов, пораженных артритом, у крыс, получавших (В) PBS и (С) получавших 4 раза щелочную фосфатазу.18F]фтор-ПЭГ-фолат – это метка для PET, которая относительно специфично связывается с макрофагами. (А) Хронология эксперимента. (D и E) стандартизованные уровни накопления (SUV) в графическом масштабе min 0 - max 1, характеризующие накопление метки. Кривые активность-время для накопления [18F]фтор-ПЭГ-фолата построены по значениям SUV, полученным при анализе пораженных артритом и контрлатеральных коленных суставов у крыс с артритом, не подвергавшихся обработке, получавших только PBS, (D) и у крыс с артритом, получавших 4 раза щелочную фосфатазу (Е). РЕТ-сканирование проводили на 40-й день эксперимента.
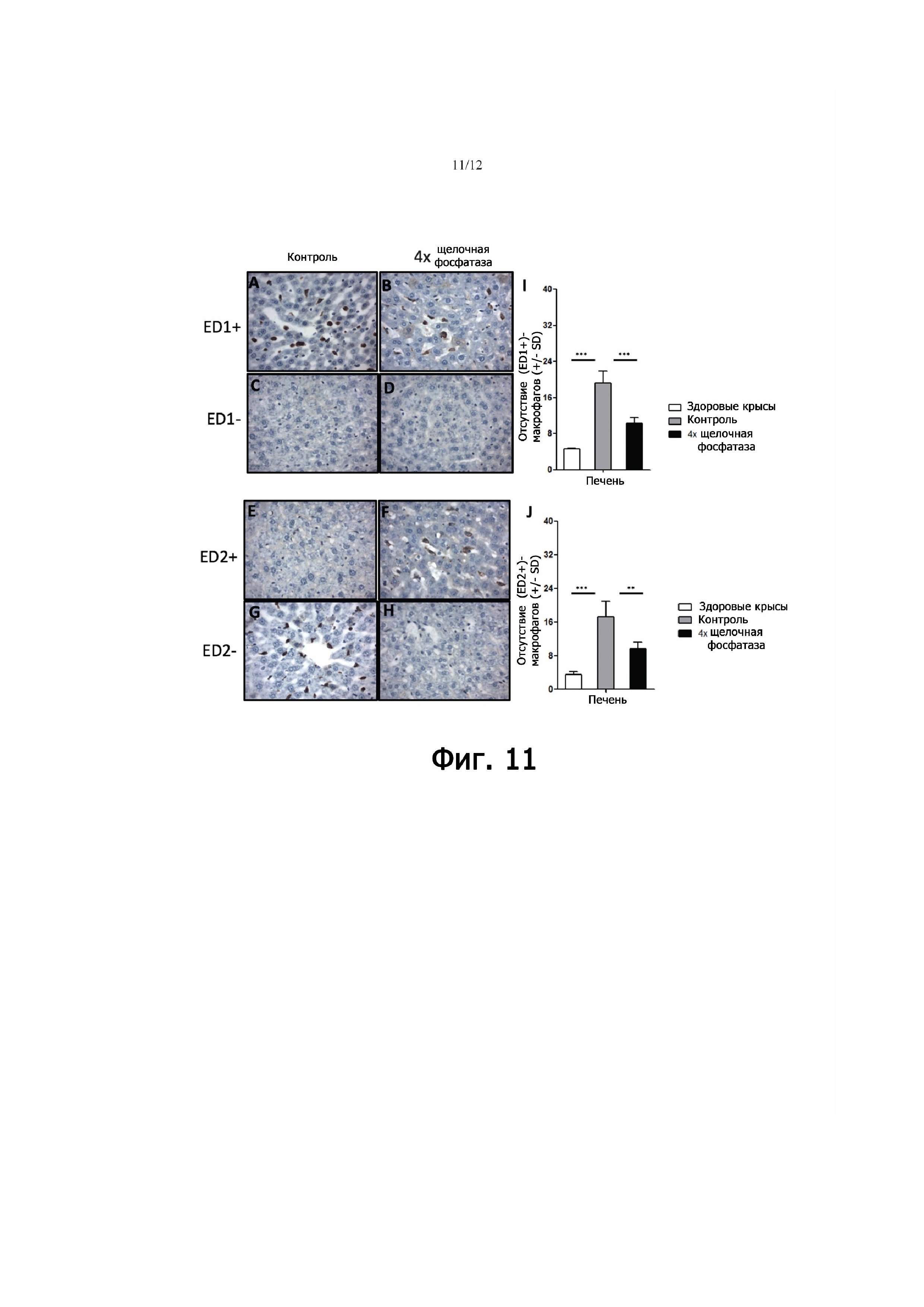
Фигура 11 - представляет репрезентативные иммуногистохимические изображения (ED1+)- и (ED2+)-макрофагов в срезах печени здоровых крыс, крыс с артритом, получавших PBS (контроль), и крыс с артритом, получавших щелочную фосфатазу. (A,B): (ED1+)-макрофаги в печени животных с артритом, получавших PBS и щелочную фосфатазу соответственно. (C,D): срезы печени, окрашенные для контроля изотипа, от крыс с артритом, получавших PBS либо щелочную фосфатазу соответственно. (E,F): (ED2+)-макрофаги в печени крыс с артритом, получавших PBS и щелочную фосфатазу соответственно. (G,H): срезы печени, окрашенные для контроля изотипа, от крыс с артритом, получавших PBS либо щелочную фосфатазу соответственно. (I,J): определение количеств (ED1+)- и (ED2+)-макрофагов в срезах печени здоровых крыс, крыс с артритом, получавших PBS, и у крыс с артритом, получавших щелочную фосфатазу. Приведенные значения - средние значения количеств макрофагов, подсчитанных в заранее определенных областях печени. «Усы» ошибки указывают стандартное отклонение (SD). **. p<0,01, ***. p<0,001.
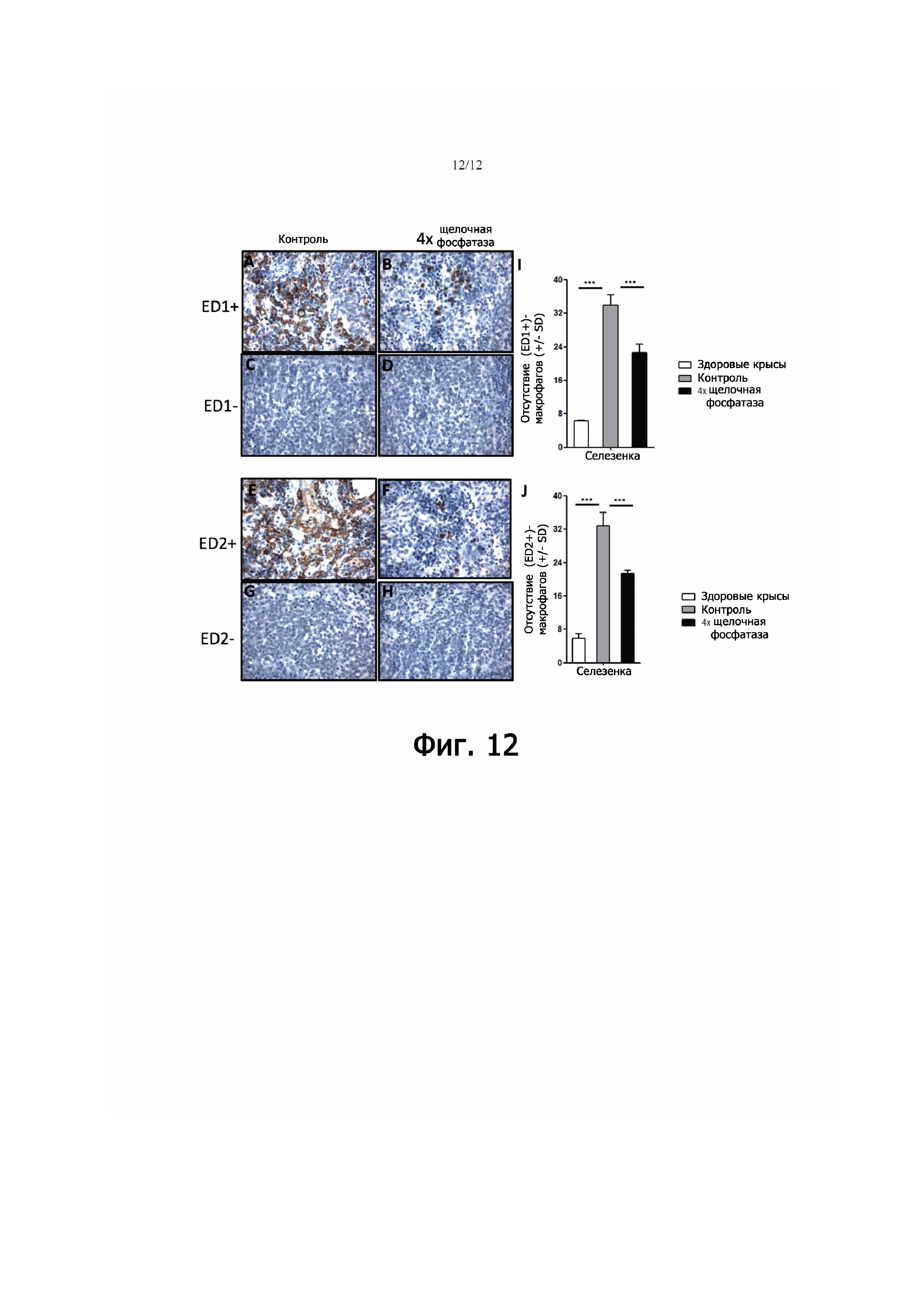
Фигура 12 - представляет репрезентативные иммуногистохимические изображения (ED1+)- и (ED2+)-макрофагов в срезах селезенки здоровых крыс, крыс с артритом, получавших PBS (контроль), и крыс с артритом, получавших щелочную фосфатазу. (A,B): (ED1+)-макрофаги в селезенке животных, получавших PBS и щелочную фосфатазу соответственно. (C,D): срезы селезенки, окрашенные для контроля изотипа, от крыс, получавших PBS либо щелочную фосфатазу соответственно. (E,F): (ED2+)-макрофаги в селезенке крыс, получавших PBS и щелочную фосфатазу соответственно. (G,H): срезы селезенки, окрашенные для контроля изотипа, от крыс, получавших PBS либо щелочную фосфатазу соответственно. (I,J): определение количеств (ED1+)- и (ED2+)-макрофагов в срезах селезенки здоровых крыс, крыс с артритом, получавших солевой раствор, и у крыс, получавших щелочную фосфатазу. Приведенные значения - средние значения количеств макрофагов, подсчитанных в заранее определенных областях селезенки. «Усы» ошибки указывают стандартное отклонение (SD). ***. p<0,001.
Пример 1. Колено, пораженное ревматоидным артритом
Влияние hRESCAP (лечение щелочной фосфатазой) на инфильтрацию макрофагами синовиальных тканей у крыс с артритом
Для изучения эффектов рекомбинантной человеческой щелочной фосфатазы (hRESCAP) при ревматоидном артрите проводились опыты на крысиной модели ревматоидного артрита по работе Chandruputla et al. (BioMedInt, 2015). Эффекты hRESCAP сравнивали с таковыми метотрексата, который служил положительным контролем. Для получения крысиной модели, индуцированной антигеном, крыс иммунизировали два раза путем подкожного введения смеси метилированного бычьего сывороточного альбумина (mBSA), полного адъюванта Фрейнда (CFA) и антигена возбудителя коклюша Bordetella pertussis (СВР) и внутрисуставных инъекций mBSA в коленный сустав с одной стороны тела и физиологического раствора (в качестве отрицательного контроля) с другой стороны тела. После терапевтической обработки метотрексатом либо hRESCAP проводили иммуногистохимический анализ, специфический для определения инфильтрации макрофагами, и оценивали опухание колена.
В крысиной модели ревматоидный артрит вызывали у крыс в правом колене (колено RA), а контрлатеральное левое колено служило внутренним контролем («контрольное колено»). Эта модель позволяет делать различные лечебные вмешательства либо до внутрисуставных инъекций, либо в ходе бустерных инъекций mBSA. Дозы hRESCAP (700 единиц на 1 кг массы тела; внутрибрюшинно), как указано на фигурах. За два часа до введения щелочной фосфатазы крысы получали дозу левамизола (50 мг/кг; подкожно). Для сравнения подопытные особи с артритом получали метотрексат (1 мг/кг; внутрибрюшинно).
В конце опыта животных умерщвляли, коленный сустав подвергали декальцификации и обрабатывали для иммуногистохимического анализа с целью определения инфильтрации макрофагами; в том числе определяли два вида антител крысиных макрофагов - ED1 (гомолог человеческого маркерного белка макрофагов CD68) и ED2 (гомолог человеческого белка CD163, предположительно являющегося маркером противовоспалительных макрофагов M2). Иммуногистохимический анализ на ED1 и ED2 крысиных макрофагов проводили по квадрантам синовиальной ткани, как описано в работе Chandruputla et al (BioMedInt, 2015). Макрофаги подсчитывали в синовиальной выстилке (SL 1-10) и в слоях подлежащей ткани (SL 1-20).
Животные
Группы по 3-6 особей Wistar (самцов с массой тела 150-200 г, предоставленные компанией Charles River International Inc, Шульцфельд, Германия) содержались в стандартных условиях и получали стандартный корм и воду (в неограниченном количестве). Все опыты на животных проводились в соответствии с распоряжениями Директива Совета Европейского Сообщества 2010/63/EU относительно обращения с лабораторными животными и законодательством королевства Нидерландов относительно экспериментов на животных. Протоколы опытов проверяли и утверждали в местном комитете по экспериментированию на животных медицинского центра Амстердамского Свободного университета (DEC PET13-07).
Индукция артрита и лечебные вмешательства
Всех крыс (за исключением здоровых контрольных особей) иммунизировали путем одной или четырех (с интервалом 4-5 суток) внутрисуставных инъекций mBSA в правое колено, и у них в нем развивался артрит; контрлатеральное (то есть левое) колено служило контролем. Для лечебных вмешательств животным вводили рекомбинантную человеческую плацентарную щелочную фосфатазу (предоставлена Нидерландской организацией по прикладным научным исследованиям – TNO; Зейст, Нидерланды) в дозировке 700 Ед/кг (≈ 200 мкг) подкожно, метотрексат (предоставлен Фармацевтической службой медицинского центра Амстердамского Свободного университета) внутрибрюшинно в двух дозировках: 0,3 мг/кг (низкая доза) и 1,0 мг/кг (высокая доза). Крыс разделили на 8 групп в зависимости от состава обработки и ее схемы. В случае профилактической схемы две крысы получали щелочную фосфатазу дважды до внутрисуставной индукции артрита и четыре крысы получали щелочную фосфатазу дважды до внутрисуставной индукции артрита щелочную фосфатазу дважды до внутрисуставной индукции артрита и четыре раза солевой раствор, забуференный фосфатом (PBS) между внутрисуставными инъекциями. В группах крыс, получавших обработку, особям с артритом вводили щелочную фосфатазу два или четыре раза после индукции артрита либо саму по себе, либо в сочетании с метотрексатом в низкой или же высокой дозе. Контрольные особи получали 500 мкл PBS внутрибрюшинно. У здоровых (контрольных) крыс не вызывали артрит и не делали им никакую обработку. В конце эксперимента всех животных умерщвляли и извлекали нужные ткани для дальнейшей обработки и различных анализов.
Активность щелочной фосфатазы
Чтобы установить концентрацию щелочной фосфатазы в плазме крови, определяли ее ферментативную активность до и через 0-4 часа после введения щелочной фосфатазы в дозе 700 Ед/кг здоровым крысам и крысам с артритом, фиг. 7. Спустя 0, 15, 60, 120 и 240 минут после введения щелочной фосфатазы у животных брали образцы крови из хвостовой вены и помещали их в микропробирки типа Eppendorf объемом 1 мл, содержавшие в качестве противосвертывающего агента гепарин (454081, Greiner bio-one; Charlotte, США). Для контроля в те же моменты времени брали кровь у крыс с артритом, которым вводили путем инъекции в момент t=0 500 мкл PBS. Пробирки с образцами крови центрифугировали при 3,000 x g в течение 5 минут при температуре 4°C, после чего собирали плазму и хранили ее при температуре -80°C вплоть до использования.
Определение ферментативной активности щелочной фосфатазы основывается на превращении субстрата - пара-нитрофенолфосфата (PNP; 104105, Sigma-Aldrich; Звайндрехт, Нидерланды) в пара-нитрофенол, которое измеряется спектрофотометрически при 405 нм и температуре 25°C. В кювету объемом 3 мл помещают 2,9 мл раствора субстрата (содержащим глицин в конечной концентрации 25 мМ, MgCl2в конечной концентрации 10 мМ, пара-нитрофенолфосфат, в конечной концентрации 3 мМ; рН доводят до 9,6, добавляя NaOH). Реакцию начинают добавлением 30 мкл образца плазмы крови, разведенным (1:1) в буферном растворе для разбавления фермента (25 мМ глицин, 1 мМ MgCl2, 0,1 мM ZnCl2, 10% (объем/объем) глицерин;) рН доводят до 9,6, добавляя NaOH). Параллельно проводят измерение для контрольной (без субстрата) кювете. Реакцию прослеживают в реальном масштабе времени в течение 5 мин при температуре 25°C непрерывно регистрируя возрастание поглощения на длине волны 405 нм с помощью спектрофотометра (10037-434, VWR; Раднор, шт. Пенсильвания, США). По линейной фазе возрастания поглощения на длине волны 405 нм рассчитывают активность щелочной фосфатазы, используя стандартную кривую для серийных разведений исходного раствора рекомбинантной человеческой плацентарной щелочной фосфатазы. За 1 единицу активности брали такое количество фермента, которое нужно для разложения 1 мкмоля пара-нитрофенолфосфата за 1 минуту при температуре 25°C.
Гистопатологическое и иммуногистохимическое исследование
У всех крыс иссекали целиком пораженное артритом и контрлатеральное (здоровое, то есть контрольное) колено и фиксировали в течение 7 суток при температуре 4°C в 10%-ном свежеприготовленном растворе формальдегида в солевом растворе, забуференном фосфатом (PBS), содержавшим 2% сахарозы (pH=7,3). После этого проводили декальцификацию в растворе Osteosoft (101728, Merck; Германия) в течение ~2,5 недель при комнатной температуре. Затем декальцифицированные образцы погружали в парафин, делали срезы толщиной 5 мкм через центр коленного сустава в продольном направлении и окрашивали гематоксилином-эозином, чтобы определить степень воспаления в синовиальной ткани. У всех крыс также иссекали участки печени и селезенки и фиксировали их в 4%-ном формальдегиде в течение 24 часов. После чего погружали в парафин, делали срезы толщиной 5 мкм и окрашивали их гематоксилином-эозином, а затем визуализировали макрофаги, для чего окрашивали с помощью ED1 (гомолога человеческого белка CD68) и ED2 (гомолога человеческого белка CD163 – маркера противовоспалительных макрофагов М2), а также использовали контрольные изотипы антител. Изображения получали с помощью автоматизированного лабораторного микроскопа Leica 4000B и цифровой камеры Leica DC500 (Microsystems B.V; Рейсвейк, Нидерланды).
Иммунофлуоресцентный анализ и микроскопическое исследование для определения рецептора фолата FRβ
Образцы печеночной и селезеночной ткани, взятые в конце эксперимента, быстро замораживали в жидком азоте и хранили при температуре -80°C. Образцы погружали в подходящую среду (OCT; SKU4583, Tissue-Tek, Netherlands), делали срезы при помощи микротома-криостата для замороженной ткани при температуре -20°C) (Leica, Нидерланды) и помещали их на предметные стекла Superfrost (4951PLUS4, ThermoFisher; Нидерланды) для иммунофлуоресцентного окрашивания. Делали срезы толщиной 8 мкм и окрашивали их гематоксилином-эозином. Для окрашивания на FRβ использовали мышиные антитела против крысиного FRβ либо антитела контрольного изотипа. А именно, срезам печеночной и селезеночной ткани сначала давали согреться в течение 30 минут до комнатной температуры (RT), затем фиксировали в ацетоне (439126, Sigma-Aldrich, Netherlands) в течение 10 минут при температуре -20°C и высушивали на воздухе в течение 10 при комнатной температуре (RT). Срезы обводили фломастером DAKO Pen (S2002, DAKO; Санта-Клара, шт. Калифорния, США)), затем промывали три раза PBS, перемешивая на качалке. После этого срезы инкубировали со 100%-ной плодной бычьей сывороткой (FBS) в течение 30 минут при комнатной температуре (RT), чтобы блокировать неспецифическое связывание, и вновь промывали в PBS (три раза по 5 минут). Теперь срезы инкубировали с антителами против крысиного FRβ, разведенными в соотношении 1:50 10%-ным FBS/PBS или 10%-ным FBS/PBS в течение 24 часов при температуре 4°C. Промывали PBS три раза по 5 минут, перемешивая на качалке, и инкубировали в течение 1 часа при комнатной температуре (RT) со вторыми антителами (козьи антимышиные, несущие флуооресцентную метку Alexa 488 (1:500) (R37120) ThermoFisher Scientific, Нидерланды) в 10%-ном FBS/PBS, высушивали на воздухе и закрепляли (2 мкл закрепляющей среды MOWIOL (81381, Merck; Звейндрехт, Нидерланды). Получали 2D-слайды с помощью инвертированного микроскопа Zeiss Axiovert 200M Marianas™ (иммерсионный объектив, увеличение х40). Микроскоп, камера и обработка данных управлялись с помощью программного обеспечения SlideBook™ (SlideBook™ version 6 (Intelligent Imaging Innovations, Денвер, шт. Колорадо, США)).
Подсчет макрофагов в срезах коленного сустава, печени и селезенки
Все стекла с окрашенными препаратами оценивались и обсчитывались двумя независимыми сотрудниками слепым методом для выявления отрицательных по ED1 и положительных по ED2 синовиальных макрофагов. Для этого каждый срез коленного сустава разделяли на четыре квадранта (Q1 - Q4), в каждом была представлена суставная капсула с выстилкой синовиальной ткани по какой-либо одной из сторон (проксимальной и дистальной) кости. Под микроскопом (Leica) при увеличении х400 подсчитывали макрофаги в 2-3 областях каждого квадранта в выстилке и в подлежащих слоях клеток (1-10 слоев) синовиальной оболочки. Средние значения численности макрофагов в данной области по всем четырем квадрантам объединяли и представляли как суммарное количество ED1 или ED2 макрофагов (±стандартное отклонение).
Стекла с окрашенными срезами печени и селезенки крыс с артритом и крыс с артритом, получавших обработку щелочной фосфатазой, обсчитывались двумя независимыми сотрудниками слепым методом для выявления положительных по FRβ, ED1 и ED2 макрофагов. Для количественной оценки репрезентативные области срезов печени и селезенки разделяли на четыре участка, каждый из которых представлял центральную часть паренхимы и вену соответственно. Положительные по FRβ, ED1 и ED2 макрофаги подсчитывали при увеличении Х400, как описано выше. Средние значения численности макрофагов в данной области по всем четырем квадрантам объединяли и представляли как суммарное количество макрофагов, положительных по FRβ, ED1 или ED2. Контролем служили срезы печени и селезенки здоровых крыс.
[18F]фтор-PEG-фолат и позитронно-эмиссионная томография с компьютерной томографией (PET-CT)
Для отслеживания макрофагов с помощью PET синтезировали радиоактивно меченный [18F]фтор-ПЭГ-фолат с радиохимической чистотой >96,5% и средней удельной активностью 27,6 ± 3,5 ГБк/мкмоль. Крысам, не подвергавшимся никакой обработке, и крысам с артритом, получавшим четыре раза щелочную фосфатазу, делали анестезию через вдыхание 2(-2,5%-ного изофлурана и 0,45%-ного (объем/объем) кислорода). Вводили в хвостовую вену полиуретановую канюлю французского калибра 3 (0,7 мм x 19 мм; BD Angiocath, Бреда, Нидерланды) Netherlands). В процессе PET-CT (MedisonanoPET-CT; Будапешт, Венгрия) животных помещали на столик с подогревом (~35°C), отслеживая дыхательные функции. Компьютерную томографию (СТ) проводили в течение 5 минут, после чего вводили радиоактивную метку (10,7±1,8 MБк) в начале динамического наблюдения путем ЗЕТ-сканирования в течение 60 минут. Данные, полученные путем позитронно-эмиссионной томографии, нормализовали и вводили поправки на рассеяние, случайные сигналы, затухание, распад и запаздывание.Список данных, полученных путем ПЭТ/КТ, повторно сортировали в 19 последовательных фреймах (4x5, 4x10, 2x30, 3x60, 2x300, 3x600 и 1x900 с), которые восстанавливали используя 3D итеративный алгоритм ожидаемой максимизации упорядоченных подмножеств Пуассона с четырьмя итерациями и шестью подмножествами. В полученных изображениях размеры матрицы были 225 × 225 × 236 вокселов по 0,4 × 0,4 × 0,46 мм3 каждый. Изображения анализировали с помощью программы AMIDE (A Medical Image Data Examiner, version 0.9.2) и выражали как стандартизированные уровни накопления (SUV). CT- и PET-изображения совмещали для получения картины нужной области (ROI). Используя фиксированные размеры последнего фрейма (размеры: 7 × 4 × 8 мм3) вручную изображали эллипсоидной формы ROI для пораженного артритом и здорового коленного суставов. Строили график зависимости активности от времени (TAC), проецируя ROI на динамическую последовательность изображений. Значения TAC выражали как стандартизированные уровни накопления (SUV), то есть средние значения концентрации радиоактивного агента в ROI нормализовали соответственно введенной дозе и массе тела.
Исследование распределения в тканях еx vivo
В конце периода обработки подопытным крысам: особям с артритом, получавшим по четыре раза щелочную фосфатазу, щелочную фосфатазу и высокую дозу метотрексата, щелочную фосфатазу и низкую дозу метотрексата, и животным, никак не обработанным – вводили [18F]фтор-ПЭГ-фолат в качестве метки. Через 60 минут после введения метки крыс умерщвляли. Крыс с артритом, получавших метотрексат в низкой и высокой дозах, умерщвляли без введения метки. У всех умерщвленных животных иссекали коленные суставы и брали кровь и различные внутренние органы, которые промывали, высушивали, взвешивали и определяли в них количество радиоактивной метки с помощью гамма-спектрометра LKB 1282 Compugamma CS (LKB, Wallac; Турку, Финляндия). Данные по накоплению радиоактивной метки в различных тканях выражали как отношение (в процентах) к введенной дозе (ID) на 1 грамм ткани (%ID/г).
Статистический анализ
Статистический анализ осуществляли с помощью программы SPSS (версия 15) для Windows (SPSS INc,; Чикаго, шт. Иллинойс, США). Для определения различий в парных наблюдениях (например, инфильтрации макрофагов в пораженном артритом коленном суставе по сравнению со здоровым контрлатеральным коленом) использовали одновыборочный критерий Уилкоксона. Для определения различий в инфильтрации макрофагами между группами подопытных животных, между коленным суставом, пораженным артритом, и коленом, обработанным PBS, использовали критерий Манна-Уитни. Статистически значимыми считались значения p<0,05. Все результаты представляли как среднее +/- стандартное отклонение (SD).
Результаты
Индуцирование артрита и лечение щелочной фосфатазой с метотрексатом
Индуцирование артрита у крыс было ассоциировано с макроскопическим утолщением пораженного артритом колена по сравнению с контрлатеральным (контрольным) коленом (данные не показаны). По наблюдениям, лечебные вмешательства, включавшие применение щелочной фосфатазы, метотрексата или их комбинации, переносились животными хорошо и не были ассоциированы с какими бы то ни было негативными явлениями или с существенными изменениями массы тела.
Фармакокинетика щелочной фосфатазы
Фармакокинетику щелочной фосфатазы в плазме крови определяли у здоровых крыс и у крыс с артритом после внутрибрюшинной инъекции человеческой рекомбинантной плацентарной щелочной фосфатазы в дозе 700 Ед на 1 кг массы тела; количества щелочной фосфатазы, взятые для лечебных вмешательств, указаны на фиг. 7 A, B. Для контроля определяли уровни щелочной фосфатазы у крыс с артритом после введения PBS. У здоровых животных исходный уровень щелочной фосфатазы в плазме крови был несколько выше, чем у крыс с артритом: 0,27 ± 0,01 Ед/мл против 0,21 ± 0,02 Ед/мл (фиг. 7B). После введения щелочной фосфатазы ее уровень в плазме крови через 1 час возрастал, достигая максимума (превышение исходного уровня в 1,5 раз у здоровых особей и в 1,7 раз у особей с артритом). Повышенный уровень щелочной фосфатазы в плазме крови у здоровых животных сохранялся до 4 часов, а у особей с артритом он постепенно возвращался к исходному значению. У крыс с артритом, получавших инъекции PBS, уровень щелочной фосфатазы в плазме крови за указанные 4 часа не изменялся (фиг.7B).
Влияние щелочной фосфатазы, метотрексата и комбинации щелочной фосфатазы с метотрексатом на инфильтрацию синовиальными макрофагами
В качестве основного критерия для оценки эффективности терапии по данному изобретению использовали способность щелочной фосфатазы, метотрексата и комбинации щелочной фосфатазы с метотрексатом подавлять инфильтрацию коленного сустава синовиальными макрофагами у крыс с артритом. При этом количественное определение численности макрофагов в срезах коленного сустава, пораженного артритом, проводилось у крыс с артритом в сравнении с тканями контрлатерального колена путем иммуногистохимического анализа, позволяющего установить суммарное количество макрофагов, положительных по ED1 и ED2; последние являются репрезентативными маркерами присутствия противовоспалительных макрофагов. Репрезентативные изображения и данные по количеству (ED1+)-и (ED2+)-макрофагов для срезов коленных суставов, пораженных артритом, и контрлатеральных суставов до и после лечебных вмешательств показаны на фиг. 8 и 9. Во-первых, двукратное введение щелочной фосфатазы до внутрисуставной инъекции метилированного бычьего сывороточного альбумина вызывало значительную профилактическую активность, подавляя индуцирование артрита, о чем свидетельствует заметное снижение инфильтрации как (ED1+)- (фиг. 8В), так и (ED2+)-макрофагами (фиг. 8D) в коленных суставах, пораженных артритом. Это подтверждается в 4 раза (p<0,01) и в 8 раз (p<0,01) меньшим количеством (ED1+)- (фиг. 8C) и (ED2+)-макрофагов (фиг. 8E) в коленных суставах, пораженных артритом, у крыс с артритом, получавших щелочную фосфатазу, по сравнению с особями, которым такую обработку не делали (однократная внутрисуставная инъекция). Эти пониженные уровни были сопоставимы с количеством макрофагов в контралатеральных коленях. Двукратное введение щелочной фосфатазы (с последующим 4-кратным введением PBS) приводило к снижению в 2 раза (p<0,01) и в 3 раза (p<0,01) инфильтрации синовиальными (ED1+)- и (ED2+в коленных суставах крыс, пораженных артритом. В случае лечебного вмешательства четырехкратное введение щелочной фосфатазы также приводило к снижению количества макрофагов в коленных суставах, пораженных артритом, еще в приблизительно 8 раз (<0,001). Кроме того, наблюдалось изменение инфильтрации синовиальными макрофагами в результате введения комбинации щелочной фосфатазы с метотрексатом. В этих опытах метотрексат брали в эффективной дозе, составлявшей 1 мг на 1 кг массы тела, и в низкой дозе, составлявшей 0,3 мг/кг. Комбинацию щелочной фосфатазы с метотрексатом подопытные животные переносили хорошо, причем дальнейшее снижение накопления синовиальных макрофагов при сочетании щелочной фосфатазы с метотрексатом дополнительно немного увеличивалось – по сравнению с введением метотрексата и щелочной фосфатазы по отдельности (фиг. 9).
Визуализация макрофагов путем позитронно-эмиссионной томографии с использованием [18F]фтор-ПЭГ-фолата
Чтобы выяснить, возможно ли снижение инфильтрации синовиальными макрофагами у крыс с артритом, вызванное введением щелочной фосфатазы, отслеживать путем визуализации данных позитронно-эмиссионной томографии (РЕТ), для одной из крыс, которым 4 раза вводили щелочную фосфатазу, получили РЕТ-сканы, используя мечение макрофагов [18F]фтор-ПЭГ-фолатом, и сравнили эти данные с аналогичными данными, полученными для особей с артритом, которым вводили только (PBS) (фиг. 10). Фронтальное изображение, полученное путем PET-CT, демонстрирует большее накопление метки у животных с артритом, которым не вводили щелочную фосфатазу (см. фиг. 10А) по сравнению с особями, которым делали четыре инъекции этого фермента. (см. фиг. 10B). Были рассчитаны стандартизированные уровни накопления (SUV) [18F]фтор-ПЭГ-фолата в нужной области синовиальных тканей (закрашенный эллипсоид), которые продемонстрировали усиленное в 1,5 раз накопление метки в коленных суставах, пораженных артритом, у крыс, которым не вводили щелочную фосфатазу (фиг. 10С) по сравнению с особями, которым делали четыре инъекции этого фермента (фиг. 10D).
Изучение распределения [18F]фтор-ПЭГ-фолата в тканях еx vivo
Данные о влиянии введения щелочной фосфатазы самой по себе в отдельности или в сочетании с метотрексатом на накопление метки [18F]фтор-ПЭГ-фолата в других тканях представлено в таблице 1. Во всех группах, различавшихся по обработке подопытных крыс, [18F]фтор-ПЭГ-фолат быстро исчезал из плазмы крови (таблица 1). Отметим, что щелочная фосфатаза - как отдельно взятая, так и в сочетании с метотрексатом - вызывала снижение накопления [18F]фтор-ПЭГ-фолата в органах с высоким содержанием макрофагов в резидентгных органах, например в легких, сердце, печени и селезенке (таблица 1). С учетом высокой экспрессии фолатного рецептора α в почках и кишечнике накопление метки было высоким в этих органах, но не подвергалось воздействию ни в случае щелочной фосфатазы, ни в случае сочетания щелочной фосфатазы с метотрексатом.
Таблица 1. Распределение [18F]фтор-ПЭГ-фолата в различных тканях еx vivo в группах крыс, различавшихся по обработке: 4-кратное введение PBS (контрольная группа), 4-кратное введение только щелочной фосфатазы (4AP), 4-кратное введение метотрексата (0,3) с щелочной фосфатазой (4AP+ 0,3MTX) и 4-кратное введение метотрексата с щелочной фосфатазой (4AP + 1MTX) через 60 минут после инъекции метки. Результаты представлены как средняя доля (в процентах) от введенной дозы на 1 грамм ткани (%ID/г) ± стандартное отклонение (SD), (n= 4 на группу).
MTX-метотриксат
АР-щелочная фосфатаза
Влияние щелочной фосфатазы на системную воспалительную реакцию у крыс с артритом
Чтобы установить, связано ли пониженное накопление метки в печени и селезенке у крыс с артритом, получавших щелочную фосфатазу, с ослаблением инфильтрации макрофагами в этих органах, был проведен иммуногистохимический анализ срезов печени (фиг. 11) и селезенки (фиг. 12) с использованием ED1 и ED2 у крыс с артритом, получавших щелочную фосфатазу, в сравнении с особями, получавшими солевой раствор, и со здоровыми животными. Репрезентативные изображения (ED1+)- и (ED2+)-макрофагов в срезах печени и селезенки показаны на фиг. 11A-H и фиг. 12A-H соответственно. Определение количества (ED1+)-и (ED2+)-макрофагов в печени (фиг. 11 I/J) и селезенке (фиг. 12 I/J) продемонстрировало значительно более высокий уровень (приблизительно в ~4-5 раз, p<0,01) у крыс с артритом по сравнению со здоровыми животными, что указывало на системное воспаление. После введения щелочной фосфатазы у крыс с артритом в печени наблюдалось выраженное значительное снижение (~50%, p<0,001) инфильтрации как (ED1+)-, так и (ED2+)-макрофагами (фиг. 11 I/J). Сходным образом в селезенке у крыс с артритом введение щелочной фосфатазы вызывало значительное снижение (~30%; 0,001) инфильтрации как (ED1+)-, так и (ED2+)-макрофагами (фиг. 11 I/J). Контрольное окрашивание с помощью антител срезов печени и селезенки дало явно отрицательный результат как для (ED1+)-, так и для (ED2+)-макрофагами (фиг. 11 и 12 C,D,G,H). Эти данные подчеркивают, что щелочная фосфатаза обеспечивает системный противовоспалительный эффект, ослабляя инфильтрацию макрофагами в печени и селезенке у крыс с артритом.
Выводы
В настоящем документе мы показали, что воздействие щелочной фосфатазы вызывает в организме у крыс активность, противодействующую артриту и предотвращающую его, путем подавления артрита, индуцированного внутрисуставной инъекции антигена. Более того, при лечении, то есть после индукции артрита, воздействие щелочной фосфатазы также обеспечивает местные эффекты, которые противодействуют артриту и выражаются значительным сокращением инфильтрации синовиальными макрофагами пораженных суставов, а также противодействующие артриту системные эффекты, выражающиеся в ослаблении инфильтрации макрофагами печени и селезенки у крыс с артритом. Наконец, указанная активность щелочной фосфатазы сохраняется при комбинированной терапии с метотрексатом.
Крысы, больные артритом, хорошо переносили многократное с интервалом в 4 суток воздействие рекомбинантной человеческой плацентарной щелочной фосфатазы (hRESCAP). Схема введения раз в 4 дня была выбрана исходя из того, что время полужизни hRESCAP у крыс составляет ≈ 3 суток. Отслеживание фармакокинетики щелочной фосфатазы в плазме крови после однократного внутрибрюшинного введения щелочной фосфатазы в дозе 700 Ед на 1 кг массы тела у здоровых крыс и у особей с артритом продемонстрировало, что уровень этого фермента в плазме крови через 1 час после введения достигает максимума, превышающего исходный уровень на 50-70% (см. фиг. 7). У здоровых животных уровень введенной hRESСАР в плазме крови оставался стабильно выше контрольного уровня на протяжении 4 часов, а у особей с артритом он за 4 часа падал до исходного значения. Эти результаты подтверждают ранее полученные данные о поглощении доступной щелочной фосфатазы в процессе окислительного стресса, какой наблюдается при ревматоидном артрите, а также данные клинических исследований на людях. В ходе своего воздействия щелочная фосфатаза поглощается – предположительно путем связывания с субстратами пусковых механизмов воспалительной реакции (ITM) и удаления купферовскими клетками. Такой механизм действия может участвовать в профилактической активности щелочной фосфатазы при подавлении антигенном индуцирования артрита у крыс. Действуя как противовоспалительный белковый агент щелочная фосфатаза в итоге предотвращает продуцирование провоспалительных цитокинов, например альфа-фактора некроза опухолей (TNFα) и интерлейкина-6 (IL6), активированными клетками иммунной системы, тем самым препятствуя последующим этапам каскада воспалительной реакции. Тот же механизм действия щелочной фосфатазы может давать вклад в ее терапевтическую активность у крыс с развившимся артритом и выражаться в ослаблении инфильтрации синовиальной оболочки макрофагами. Удаление пусковых факторов воспалительной реакции должно приводить к подавлению продуцирования провоспалительных цитокинов и ослаблять хемотаксис, необходимый для привлечения клеток моноцитов/макрофагов. Также развивается как системное, так и местное воспаление, сопровождающиеся повышенной проницаемостью сосудов и выходом из них лейкоцитов. В этой связи щелочная фосфатаза противодействует нарушениям барьерной функции, способствуя восстановлению плотных контактов между поляризованными клетками, тем самым ослабляя миграцию клеток.
В воспаленной синовиальной оболочке сустава присутствуют поляризованные макрофаги, среди которых представлены как провоспалительные (называемые М1) макрофаги, так и противовоспалительные (М2). Введение щелочной фосфатазы влияет на инфильтрацию синовиальных тканей и (ED1+)-, и (ED2+)- макрофагами. ED2 является гомологом человеческого белка CD163, считающегося маркером макрофагов типа М2. Такая классификация не вполне точная, поскольку обнаружено, что при артрите в микроокружении синовиальных тканей с антителами ACPA и комплексом аутоантител IgG макрофаги М2 производят провоспалительные цитокины. Возможно, что щелочная фосфатаза таким образом влияет на инфильтрацию синовиальных тканей поляризованными воспалительными макрофагами.
Поскольку при ревматоидном артрите терапию многими обычными и биологическими лекарственными препаратами от ревматоидного артрита, влияющими на течение заболевания (сDMARD и bDMARD), комбинируют с лечением метотрексатом, мы проверили эффективность комбинаций щелочной фосфатазы с метотрексатом у крыс с артритом. Животные хорошо переносили такую комбинированную терапию и она была более эффективной в отношении ослабления инфильтрации синовиальными макрофагами. Ранее это было показано для дозы метотрексата 1,0 мг/кг, но также справедливо для более низкой дозы, а именно 0,3 мг/кг; это свидетельствует, что дозировку метотрексата можно и далее снижать для достижения оптимальной эффективности схемы введения метотрексата в комбинации с щелочной фосфатазой. Следовательно, в сочетании с метотрексатом щелочная фосфатаза действует синергически, дополняя внеклеточное превращение AMP, ADP, ATP, обладающих провоспалительным эффектом, в аденозин, являющийся противовоспалительным агентом, под действием эктофосфатаз CD39 и CD73 на иммунокомпетентные клетки.
Изучение распределения в тканях еx vivo путем позитронно-эмиссионной томографии с использованием метки для макрофагов [18F]фтор-ПЭГ-фолата показало, что щелочная фосфатаза - как взятая в отдельности, так и в сочетании с метотрексатом – обладает системными эффектами помимо сокращения инфильтрации синовиальными макрофагами. Сообщалось о системной воспалительной реакции, о которой свидетельствует усиление инфильтрации макрофагами в печени и селезенке, у крыс с артритом, индуцированным адъювантом. В исследовании, описанном в настоящем документе, в печени и селезенке у крыс с артритом тоже отмечалось усиление инфильтрации макрофагами, которое заметно уменьшалось при воздействии щелочной фосфатазы (см. фиг. 11, 12). В числе тех макрофагов, которых становилось меньше, были положительные по FRβ+, который является маркером активированных макрофагов. Уменьшением численности (FRβ+)-макрофагов после введения щелочной фосфатазы может обнаружится по сокращению накопления метки в печени и селезенке при изучении распределения в тканях ex vivo (таблица 1). Эти результаты указывают на вызванные щелочной фосфатазой системные эффекты, противодействующие артриту, что подчеркивает системную активность щелочной фосфатазы, наблюдавшуюся на других животных моделях воспалительных заболеваний.
В целом воздействие эктофосфатаз на примере щелочной фосфатазы создает новую оригинальную и не использовавшуюся ранее возможность лечения ревматоидного артрита путем сочетания различных, но дающих синергический эффект агентов – метотрексата и других сDMARD и bDMARD. Щелочная фосфатаза как противовоспалительный белковый агент может применяться в периоды перерыва терапии другими сDMARD (которые отменяют из-за развития резистентности к ним или их токсичности) или bDMARD (из-за развития толерантности). При столь различных механизмах действия щелочную фосфатазу можно применять как саму по себе, так и в комбинированной терапии, сочетая ее с другими лечебными средствами; тем самым значительно расширяется «терапевтическое окно». Будучи эндогенным белком. Щелочная фосфатаза не вызывает резистентности или толерантности. Наконец, потенциал этого фермента еще более подтверждаются необычайно широким окном безопасности применения и доказанной безопасностью рекомбинантной человеческой щелочной фосфатазы в клинических исследованиях на людях.
В модели артрита у крыс щелочная фосфатаза проявила себя как превосходное профилактическое и терапевтическое средство противодействия артриту, обладающее местной и системной эффективностью. Описанное в настоящем документе исследование служит основанием для дальнейших доклинических и клинических испытаний щелочной фосфатазы как перспективного нового терапевтического средства от артрита.
Реферат
Изобретение относится к области медицины и фармацевтики, а именно к комбинации эктофосфатазы с метотрексатом (MTX) для применения при лечении млекопитающего, страдающего артритом, причем эта эктофосфатаза является тканеспецифичной эктофосфатазой и выбирается из кишечной щелочной фосфатазы (IAP) или плацентарной щелочной фосфатазы (PALP), а указанное лечение является лечением хронического артрита. Изобретение обеспечивает повышение эффективности лечения хронического артрита при снижении побочных эффектов. 8 з.п. ф-лы, 12 ил., 1 табл., 1 пр.

Комментарии