Эмульсия перфторорганических соединений медицинского назначения и способ её получения - RU2259819C1
Код документа: RU2259819C1
Описание
Изобретение относится к области биофизики и медицины, в частности к лекарственным средствам, предназначенным для лечения кровопотерь, гипоксических и ишемических состояний, улучшения доставки кислорода кровью, сохранения изолированных перфузируемых органов и тканей.
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ, СИМВОЛОВ, ЕДИНИЦ И ТЕРМИНОВ
Успех разработки инфузионных сред, включающих в себя эмульсии перфторорганических соединений (ПФС) во многом зависит от физико-химических свойств выбранных ПФС, физико-химических свойств эмульсий на их основе и технологии получения эмульсий ПФС.
ПФС, предназначенные для создания на их основе медицинских препаратов, представляют собой полностью фторированные органические соединения разных классов. По внешнему виду это прозрачные бесцветные жидкости без запаха, большой плотности - примерно в 2 раза тяжелее воды. Необычайная прочность связи C-F (485,6 кДж/моль) приводит к тому, что межмолекулярные силы у этих соединений очень слабые. Проявлением слабых межмолекулярных сил в ПФУ является их аномально высокая способность растворять газы, в том числе и газы крови.
Благодаря прочности связи C-F, ПФС характеризуются химической инертностью. ПФС плохо растворяются в Н2О и не подвергаются метаболизму в организме. Химическая инертность ПФС не означает инертности биологической. ПФУ, введенные внутривенно в виде эмульсий, задерживаются в органах и тканях, причем время пребывания в органах зависит от природы ПФС и дозы вводимой эмульсии.
Изучение биологических свойств ПФС разных классов показали, что скорость выведения из органов зависит от ряда связанных между собой физико-химических параметров этих соединений: структуры и молекулярной массы, температуры кипения и упругости пара, а также критической температуры растворения ПФУ в гексане (Ткр). Ткр. - это температура, при которой смешиваются друг с другом равные объемы исследуемого соединения и гексана. Ткр рассматривают как меру относительной растворимости ПФУ в липидах, которая характеризует скорость их прохождения через мембраны. Чем ниже Ткр, тем лучше соединение растворимо в липидах и тем оно быстрее выводится из организма. В табл. 1 приведены значения физико-химических параметров, используемых в качестве критерия выбора для ПФУ медицинского назначения.
Согласно приведенным данным, четко прослеживается корреляция между Ткр и t1/2 (период полувыведения). Для упругости пара такой зависимости не обнаруживается. В большей степени связаны между собой Ткр и ММ ПФС. Оптимальным диапазоном ММ для ПФУ считается интервал 460-520. В целом, все предложенные критерии по отбору ПФС для биологических целей не противоречат друг другу, но носят качественный характер. В настоящее время внимание исследователей, занятых разработкой и изучением эмульсий ПФС, сосредоточено на относительно небольшом числе соединений. В таблице 2 и 3 приведены структурные формулы и основные физико-химические характеристики наиболее известных ПФС.
В ходе изучения первичных биологических свойств различных ПФС было выработано важное требование - отсутствие в них неидентифицируемых примесей. Присутствие примесей с неизвестными свойствами может исказить истинную картину поведения основного вещества при внутривенном введении животным (задержка в органах, токсичность, влияние на различные системы организма).
Жидкие ПФС являются плохими растворителями для различных водорастворимых биологически активных веществ. Поэтому для применения ПФС в качестве кислородпереносящих сред их диспергируют в водном растворе эмульгатора до образования тонкодисперсных эмульсий.
Способность к газообмену для эмульсий ПФС определяется общим количеством кислорода, содержащимся в эмульсии, концентрация которого подчиняется закону Генри: прямо пропорциональна парциальному давлению кислорода. Принцип физического растворения газов в ПФС распространяется и на эмульсии ПФС. Количество О2, растворенного в эмульсии, зависит от содержания фторуглеродной фазы и не зависит от размера частиц, то есть количество растворенного в эмульсиях ПФУ кислорода близко к расчетным значениям при сложении значений содержания этого газа в каждой фазе в отдельности (количество растворенного кислорода в водной фазе плюс количество растворенного кислорода в ПФС). Содержание инертных газов в смесях эмульсия ПФС/плазма также подчиняется правилу сложения объемов газа в каждой фазе. Таким образом, количество любого газа, содержащегося в эмульсии ПФУ, может быть рассчитано в соответствии с физическими законами их растворимости, исходя из парциального давления газа и объемного соотношения фракций ПФС/Н2О. Это значит, что содержание кислорода в эмульсиях ПФУ будет тем выше, чем выше его парциальное давление или напряжение (pO2) и доля фторуглеродной фазы.
Специфическое (функциональное) действие любого препарата при введении в организм определяется его переносимостью, которую характеризуют величиной ЛД50, и отсутствием побочного действия, проявляющегося главным образом в виде реактогенности. Величина ЛД50 для эмульсий ПФУ в значительной мере зависит от размера частиц. Средний диаметр частиц для эмульсий ПФУ не должен превышать 0,2 мкм. При увеличении доли крупных частиц (со средним диаметром, превышающим 0,4 мкм) с 3% до 10% ЛД50 для названных эмульсий снижается более чем в 2 раза. Выявление возможной реактогенности у эмульсий ПФУ - один из наиболее сложных вопросов, который необходимо решать при создании на их основе лекарственной формы для внутрисосудистого введения. При введении реактогенного препарата человеку может развиться разная по степени проявления «аллергическая» реакция от легкого покраснения кожи вплоть до анафилактоидной реакции с остановкой дыхания и сердца.
Большинство исследователей считают, что реактогенность в основном зависит от природы эмульгатора, используемого для диспергирования фторуглеродной основы эмульсии и формирующего адсорбционный (поверхностный) слой вокруг частиц. Сложилось устойчивое представление о том, что в эмульсиях первого поколения причиной реактогенности был неионогенный ПАВ блок-сополимер полиоксиэтилена и полиоксипропилена Pluronic F 68 (F-68) и что его замена на природные фосфолипиды полностью ликвидирует проблемы реактогенности. Эта точка зрения не совсем верна, поскольку жировые эмульсии несмотря на то, что они стаблизированы природными фосфолипидами, все-таки обладают реактогенностью. Реактогенность эмульсий ПФС также не может быть ликвидирована просто использованием фосфолипидов в качестве эмульгатора и стабилизатора ПФС. Действительно, оказалось, что реактогенность эмульсий ПФС определяется прежде всего свойствами поверхности эмульгированных частиц, то есть состоянием стабилизирующего частицы слоя эмульгатора. Однако наряду с химической структурой - природой молекул ПАВ, ключевыми параметрами, определяющими как стабильность дисперсной системы, так и возможность развития побочных реакций являются: прочность связи ПАВ с масляным «ядром» частиц эмульсии, характер расположения молекул ПАВ на поверхности, плотность их упаковки, выраженность адсорбционных свойств по отношению к белкам и другим биологически активным молекулам, находящимся в кровотоке, и, наконец, размер частиц эмульсии. О последнем параметре, следует сказать особо: уменьшение среднего размера частиц эмульсии в препарате Перфторан, стабилизированным только блок-сополимером полиоксиэтилена и полиокиспропилена - проксанолом 268, являющимся близким аналогом F-68, способствовало резкому уменьшению частоты развития побочных реакций. Отсюда ясно, что поверхностные явления (т.е. взаимодействие двух гетерогенных систем - эмульсии и крови или плазмы) в поведении эмульсий ПФУ при внутривенном введении играют решающую роль при формировании рецептуры и технологии получения эмульсий ПФС. И здесь следует опытным путем подбирать как состав масляного «ядра» и взаимодействующего с ним ПАВ, так апробировать приемлемость принятой технологии получения эмульсий ПФС.
При разработке представленной в настоящем изобретении эмульсии ПФС медицинского назначения и способа ее получения мы исследовали каждую рецептуру и элемент технологии по биологическому эффекту с помощью анимационной модели. Известно, что у кроликов одним из эквивалентов реактогенной реакции на введении эмульсий ПФС является резкое падение содержания нейтрофильных лейкоцитов в периферической крови. В эксперименте при оценке возможной реактогенности эмульсий ПФС используется показатель, называемый индекс реактогенности Ip, который определяется по следующей формуле: Ip=Ск/Со, где Ск и Со - количество нейтрофилов в процентах к исходному уровню в контрольной и опытной группах животных. Если величина Ip через 5 и 20 минут после введения препарата не превышает 3, то вероятность реактогенности минимальна [3].
Известны различные способы получения эмульсий ПФС. Эмульсии масло-вода, к которым относятся эмульсии ПФС и фторуглеродная основа, является масляной фазой, получают с затратой энергии. Измельчение масляной фазы проводят с помощью воздействия ультразвука или механическим путем.
При ультразвуковом воздействии диспергирование происходит за счет разрывающих усилий резких локальных изменений давления, которые возникают вследствие двух причин. Во-первых, чередования локальных сжатий и расширений в жидкости при прохождении волны; во-вторых, воздействия кавитаций, т.е. образования и спадания полостей, заполняемых растворенным в жидкости газом. Энергия и мощность ультразвукового воздействия, необходимого для получения субмикронной эмульсии столь велики, что наряду с диспергированием приводят с разрыву связи C-F. В результате в водной фазе эмульсии появляется высоко токсичные концентрации ионов F-, порядка 3-5 мМ. Эмульсия с таким содержанием F- не пригодна ни для возмещения кровопотери, ни для сохранения перфузируемых органов, ее следует очищать от избыточного количества F- посредством пропускания через ионообменную смолу. Вторым недостатком эмульсий ПФС, полученных с помощью ультразвукового диспергирования, является чрезвычайно широкая величина дисперсии: при среднем размере частиц 0,1 мкм может встречаться значительная доля частиц с размером более 0,4 мкм и частиц с размером менее 0,01 мкм.
Механическое диспергирование за счет встряхивания или энергичного перемешивания позволяют получать только грубодисперсные эмульсии ПФС с неприемлемым для биомедицинского использования размером: более мм. Для получения тонкодисперсных эмульсий используют метод выдавливания вещества дисперсной фазы через тонкие отверстия в дисперсионную среду под большим давлением (метод экструзии), что приводит к разрыву движущей струи жидкости на капли. Диспергирование вызывается градиентом давления и силами гидравлического трения. Обычно наработку эмульсий ПФС осуществляют на гомогенизаторах высокого давления. Закрепление достигнутого на гомогенизаторах измельчения частиц, т.е. стабилизация эмульсий, достигается с помощью ПАВ или эмульгаторов. Их стабилизирующее действие объясняется двумя причинами: во-первых, снижением избытка межфазной поверхностной энергии или снижением поверхностного натяжения; во-вторых, образованием структурно-механического барьера (адсорбционного слоя), обеспечивающего устойчивость частиц и препятствующего их контакту или слипанию.
Среди большого числа ПАВ только немногие отвечают требованиям возможности их использования для получения препаратов, предназначенных для внутривенного введения (табл. 4).
До настоящего времени используются главным образом два эмульгатора для получения эмульсий ПФС - проксанол-268 (плюроник-F-68) и фосфолипиды природного сырья (яичного желтка, сои и др.).
Структура проксанола не соответствует характерным особенностям молекул водорастворимых ПАВ, которые имеют полярную головку (гидрофильная часть) и неполярный хвост (гидрофобная часть). У проксанола две цепи полиокиси этилена (ПОЭ) обуславливают гидрофильный характер молекул, образуя водородные связи с молекулами H2O. Метальные группы блока полиокиси пропилена (ПОПр) обусловливают липофильные свойства его молекулы. Соотношение блоков ПОЭ: ПОПр для F-68 и П-268 в среднем одинаково и составляет 80:20. Стабилизирующее действие этих эмульгаторов главным образом обусловлено стерическим эффектом защитной пленки, образуемой молекулами ПАВ вокруг частиц ПФУ. При этом наряду с ПАВ, связанным в адсорбционном слое, значительная часть молекул ПАВ образует разнообразные мицеллярные структуры в водной фазе, в том числе свободные от ПФС. Между молекулами ПАВ, находящимися в адсорбционном слое и в мицеллах в водной фазе, устанавливается динамическое равновесие, необходимое для стабилизации адсорбционного слоя с одной стороны, а с другой - нарушающее плотность упаковки молекул ПАВ в адсорбционном слое при длительном хранении.
Фосфолипиды (ФЛ) представляют собой смесь соединений природного происхождения, общая структура которых отражена в табл. 4. ФЛ не растворимы в воде и одновременно не являются хорошим липофильным агентом по отношению к различным ПФС, хотя в бислое частиц фосфатидилхолина (ФХ) частично растворяются ПФД и ПФТПА. Взаимодействие ФЛ и ПФС в водной фазе носит двойственный характер. Возможно заключение ПФС в ламелярные структуры ФЛ и (или) образование монослоев ФЛ, необратимо связанных с поверхностью частиц. Возможно существование неоднородных частиц в эмульсиях ПФС/ФЛ, т.е. частиц, покрытых защитным слоем ФЛ и свободных ФЛ. Эта неоднородность может быть связана с особенностями технологического процесса и/или с избытком ФЛ по отношению к фторуглеродной фазе.
Для тонкодисперсных эмульсий ПФС определяющим механизмом снижения степени дисперсности (укрупнение частиц) является изотермическая или молекулярная перегонка вещества дисперсной фазы от мелких частиц в более крупные частицы путем диффузии молекул ПФС через дисперсионную среду. Этот процесс называют еще созреванием эмульсии по Оствальду или переконденсацией. Движущей силой этого процесса является большее давление насыщенного пара над частицами меньших размеров сравнительно с более крупными. В этом случае важным параметром является также степень растворимости ПФС в водной среде. Предотвращение переконденсации может иметь решающее значение для сохранения агрегативной устойчивости эмульсий ПФУ, т.е. сохранения ими дисперсности и индивидуальности частиц. Основные пути дестабилизации - молекулярная диффузия и меньшая значимость флокуляции или коагуляции - характерны и для относительно разбавленных эмульсий ПФУ, в которых содержание фторуглеродной фазы не превышает 20% (по объему), и для более концентрированных эмульсий ПФУ, в которых объемная фракция фторуглеродной фазы составляет 50%.
Известны пути стабилизации эмульсий ПФУ. Общий принцип стабилизации коллоидных систем - предотвращение механизмов их разрушения. Введение в эмульсии ПФС/ФЛ сахаров и отрицательно заряженных соэмульгаторов (минорных компонентов ФЛ) предотвращает процесс флокуляции частиц за счет изменения пространственных взаимодействий молекул ПАВ в адсорбированном слое, а также и за счет увеличения электростатических сил отталкивания между частицами.
Снижение основного процесса разрушения эмульсий ПФС, вызываемого молекулярной диффузией, достигают обычно введением во фторуглеродную основу второго компонента (дополнительного перфторированного соединения) менее растворимого в воде, имеющего более высокую температуру кипения и замедляющего этот процесс.
Этот принцип стабилизации использован при разработке препаратов флюозол-ДА, перфторан и оксигент. В таблице 5 представлены сводные данные по составу и физико-химическим свойствам названных препаратов.
В первых двух препаратах к ПФД, составляющему большую часть масляной фазы, введены добавки перфторированных соединений ПФТПА и ПФМЦП, более высококипящих и менее растворимых в воде. В качестве эмульгатора использован водорастворимый плюроник F-68 с добавками ФЛ (флюозол ДА) или его аналог проксанол-268 (перфторан). По физико-химическим параметрам препараты не очень отличаются друг от друга. Их относят к препаратам первого поколения, общий недостаток которых заключается в необходимости хранения в замороженном состоянии из-за недостаточной стабильности. В случае препарата оксигент к его фторуглеродной основе - ПФОБ добавлен ПФДБ, который имеет более высокую температуру кипения и менее растворим в воде. Преимущество препарата оксигент, относящегося ко второму поколению, определяется возможностью хранения его в не замороженном состоянии. Кроме того, ПФОБ, составляющий фторуглеродную основу препарата, быстро выводится из организма, примерно с той же скоростью, что и ПФД (t1/2 ˜ 4 и 7 дней соответственно).
Препарат Оксигент является коммерческим названием инфузионных сред, несколько различающихся по составу.
Роль эмульгатора при получении эмульсий не сводится только к снижению межфазового поверхностного натяжения в системе Н2О/ПФС, необходимому для уменьшения дисперсности. Изменение природы эмульгатора может повлиять на скорость процесса молекулярной диффузии. Перспективными признаны фторированные ПАВ-ФПАВ, содержащие в своей молекуле гидрофобную фторированную и гидрофильную нефторированную части. Большой успех по синтезу ФПАВ для ПФУ достигнут в последние годы французской школой химиков [4]. Общая структура синтезированных ФПАВ представляет комбинацию полифторированной цепи и полярной головки. В качестве соединительного звена этих элементов берется углеводородная цепь. Полярная головка выбирается из природных веществ или их производных. ФПАВ, содержащие в качестве полярной головки спирты или производные сахаров, проявляют синергизм с плюроником F-68. Использование в качестве полярной головки фосфолипидов, фосфатов сахаров или фосфатидилхолина в составе ФПАВ увеличивает стабильность эмульсий ПФУ, содержащих природные ФЛ в качестве эмульгатора. Предложен также новый класс смешанных ФПАВ для стабилизации ПФУ [4]. Молекулы этого класса ФПАВ представляют собой блок из двух линейных составных частей - углеводородной и перфторированной. Общие формулы этих соединений записываются следующим образом:
CnF2n+1CmH2m+1 или СnF2n+1СН=СНСmН2m+1
Авторы называют эти молекулы "dowel", что означает в дословном переводе «шпонка» или иначе соединительный элемент, скрепка.
Считается, что молекулы ФПАВ общего линейного строения RH-RF выполняют роль закрепляющего элемента, углеводородный конец которого входит в липидную пленку, окружающую частицы ПФУ, а другой, фторированный, входит в масляную фазу ПФУ, то есть молекулы типа RH-RF улучшают адгезивные свойства поверхностного слоя ПАВ.
До настоящего времени ПФД и ПФОБ являются наиболее приемлемыми соединениями при создании эмульсий медико-биологического назначения в силу того, что они наиболее быстро выводятся из организма по сравнению с другими перфторированными соединениями.
Известны патенты [5, 6], в которых предложены составы кровезаменителя, фторуглеродной основой которого являются смеси двух ПФС (ПФД/ПФМЦП или ПФД/ПФТБА или ПФОБ/ПФМЦП); смеси трех ПФС (ПФОБ/ПФД/ПФМЦП или ПФОБ/ПФД/ПФТБА) и даже смеси четырех ПФС (ПФОБ/ПФД/ПФМЦП/ПФТБА), взятых в различных соотношениях. Диспергируют указанные смеси с помощью водорастворимого эмульгатора проксанола П-268. Использование этого эмульгатора не позволяет хранить эмульсии названных составов при положительной температуре. Кроме того, после размораживания эмульсии данного типа имеют ограниченный срок хранения при +4°С (не более 1 месяца). Это их главный недостаток.
Запатентованы эмульсии с использованием фторированных ПАВ (ФПАВ). Микроэмульсии ПФС, содержащие ФПАВ [7], до настоящего времени не нашли практического применения в качестве инфузионной среды, скорее всего, в силу недостаточной стабильности в условиях in vivo. Известен другой состав эмульсий ПФС, полученных с использованием смешанного ФПАВ, содержащего в молекуле фторофильную и липофильную части [8]. Эти эмульсии хотя и сохраняют средний диаметр частиц при положительных температурах хранения, но только в течение 3 месяцев.
Известен патент [9], в котором источником ФЛ для получения эмульсий ПФС служит жировая эмульсия Liposyn 10%. В качестве фторуглеродной основы эмульсий запатентованы три группы ПФС. В первую группу входят перфторциклоалканы или перфторалкилциклоалканы (в том числе ПФД, ПФметилдекалин, ПФпергидрофенантрен и др.). Вторая группа включает в себя перфторалкилнасыщенные гетероциклические соединения. Третью группу составляют перфторированные третичные амины - ПФТПА, ПФТБА и др. Включен в число используемых ПФС и ПФОБ. Однако с помощью названной эмульсии Liposyn 10% не удалось получить стабильную эмульсию ПФД. Максимальный срок ее хранения составил 25 дней.
В патенте [10] использованы ФЛ яичного желтка для получения эмульсий ПФС. Содержание фторуглеродной фазы в этих средах варьируется в широких пределах от 10 до 50 об.%, а содержание ФЛ - от 0,5 до 7 вес.%. В качестве масляной фазы в патенте используется какой-либо один ПФС, выбранный из широкого класса соединений. В частности группа перфторгидрофенантренов с числом атомов фтора от 1 до 24, а также ПФД; перфторированные амины; ПФОБ; перфторметиладамантан и перфторпергидрофенантрен.
Основное внимание в двух вышеназванных патентах уделяется методам сохранения различных органов и систем с использованием полученных эмульсий ПФС. Перед началом физиологических экспериментов наработанные эмульсии смешивают с кристалоидными растворами и/или с онкотическими агентами (альбумин, гидроксиэтилкрахмал). Предложенные эмульсии хотя и относятся к эмульсиям второго поколения, но имеют существенный недостаток. В обоих патентах отсутствуют результаты наблюдений за стабильностью предложенных эмульсий, т.е. сохранении размера частиц при длительных сроках хранения (более месяца). Патенты [9, 10] мы рассматриваем в качестве аналогов.
Более близкой по сущности к заявляемой эмульсии ПФС является эмульсия, предложенная в [11]. Эта эмульсия, взятая за прототип, относится к числу эмульсий второго поколения и содержит быстро выводящееся перфторированное соединение в количестве от 40 до 50 об.% и перфорированную добавку более высококипящего соединения в количестве от 5 до 10 об.%. В качестве быстро выводящегося ПФС используют ПФД или ПФОБ (основной компонент), а в качестве добавки - ПФМЦП. Эмульгатором служат ФЛ яичного желтка или сои.
ПФМЦП является стабилизатором эмульсии, снижающим скорость процесса молекулярной диффузии (переконденсации) основного компонента ПФД или ПФОБ и используется при получении эмульсий другого состава, в частности препарата Перфторан. Главным недостатком заявленной в [11] эмульсии ПФС является относительно большой средний диаметр частиц - больше 0,2 мкм.
Задачей настоящего изобретения является увеличение стабильности эмульсии и улучшения ее качества, т.е. сохранения биосовместимости с биологической средой (кровью, плазмой или сывороткой) при хранении в незамороженном состоянии не менее 12 месяцев.
Для этого предложена эмульсия ПФС медицинского назначения, содержащая быстро выводящиеся соединения ПФД и ПФОБ, перфторорганическую (перфторированную) добавку и фосфолипиды, отличающаяся тем, что содержит фосфолипиды в виде дисперсии, приготовленной гомогенизацией под давлением не менее 100 атм в водно-солевой среде, а перфторорганическая добавка представляет собой смесь перфорированных третичных аминов - перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3,4диметилпирролидона и перфтор-1-пропил-4-метилпиперидина.
Эмульсия характеризуется тем, что суммарная концентрация ПФС в эмульсии находится в пределах от 2 до 40 об.%;
Эмульсия характеризуется тем, что композиция быстро выводящихся ПФС содержит ПФД и ПФОБ в соотношении от 10:1 до 1:10, перфторорганическая добавка составляет от 1% до 50% от общего содержания ПФС в эмульсии.
Эмульсия характеризуется тем, что перфторорганическая добавка в виде указанных перфторированных аминов дополнительно содержит перфтор-N-метилциклогексилпиперидин и его копродукты: изомеры перфторметилпропил (метилциклопентил) амина, цис/транс-перфторметилпропил (4-метилциклогексил) амин, перфторметилбутил-(4- метилциклогексил) амин, цис/транс-перфтор-N-(4-метилциклогексил)-2- метилпирролидин.
Эмульсия характеризуется тем, что содержит дисперсию ФЛ яичного желтка или дисперсию ФЛ сои или их смесь в водно-солевой среде в концентрации от 0,2 до 5 вес.%.
Эмульсия, характеризуется тем, что дисперсия ФЛ в водно-солевой среде содержит адъювант в количестве от 1 до 15% от суммарного содержания ФЛ; адъювантом является растительное масло: соевое, подсолнечное или касторовое.
Эмульсия характеризуется тем, в качестве адъюванта содержит смесь растительных масел, выбранных из группы, включающей соевое, подсолнечное и касторовое масла в эффективном соотношении.
Эмульсия характеризуется тем, что водно-солевая среда содержит натриевые и калиевые соли хлоридов и фосфатов и моносахарид маннитол в воде для инъекций и концентрация компонентов водно-солевой среды имеет осмотическое давление в диапазоне от 100 до 350 мосмолей на литр.
Эмульсия характеризуется тем, что средний диаметр частиц не превышает 0,2 мкм и находится в пределах 0,06-0,2 мкм.
Эмульсия характеризуется тем, что срок ее хранения в незамороженном виде при + 4°С составляет не менее 12 месяцев.
Способ получения заявленной эмульсии перфторорганических соединений, включающий получение дисперсии фосфолипидов гомогенизацией под давлением не менее 100 атм в водно-солевой среде с последующей тепловой стерилизацией, гомогенизацию под давлением указанных перфторорганических соединений в дисперсии фосфолипидов и тепловую стерилизацию готовой эмульсии.
Способ получения заявленной эмульсии ПФС характеризуется тем, что гомогенизируют ПФС в дисперсии ФЛ под давлением от 300 до 650 атм.
Способ получения заявленной эмульсии ПФС характеризуется тем, что дисперсию ФЛ стерилизуют при температуре 100°С.
Способ получения заявленной эмульсии ПФС характеризуется тем, что эмульсию ПФС стерилизуют при температуре 100°С.
Как указано выше, задачей изобретения является увеличение стабильности эмульсии и улучшения ее качества, т.е. сохранения биосовместимости с биологической средой (кровью, плазмой или сывороткой) при хранении в незамороженном состоянии не менее 6-12 месяцев. Термин «биосовместимость» не определен однозначно в научной литературе и включает в себя различные значения и нуждается в уточнении применительно к эмульсиям ПФС. В цитируемых выше патентах [8-11] под термином биосовместимость используются следующие представления - относительно большая скорость выведения из органов выбранных ПФС; способность сохранять ткани и органы, через сосуды которых перфузируется эмульсия ПФС; сравнительно низкая токсичность для животных (на уровне не менее двух объемов циркулирующей крови). Эти представления не исключают друг друга, но не отражает самого первого этапа - взаимодействия дисперсных частиц ПФС с плазмой и кровью при попадании эмульсии ПФС в сосудистое русло. Мы рассматриваем явление биосовместимости, начиная со степени выраженности взаимодействия (реагирования) эмульсии ПФС с биологической средой (кровью, плазмой или сывороткой). Результат этого взаимодействия можно оценивать не только in vivo, но прежде всего в опытах in vitro по степени стабильности эмульсии при влиянии на нее ряда факторов, моделирующих повреждение адсорбционного слоя при хранении и попадании эмульсии в кровоток.
Качество и стабильность эмульсий ПФС принято характеризовать, исходя из размера частиц: средний диаметр частиц в эмульсиях ПФУ не должен превышать 0,2-0,3 мкм. Такой подход недостаточен для дисперсных препаратов медико-биологического назначения, вводимых внутривенно. Это связано с тем, что частицы ПФУ, как чужеродный материал, при попадании в сосудистое русло взаимодействуют с белками и молекулами других соединений, находящихся в плазме, а также с клетками крови. Общий характер взаимодействия зависит от свойств поверхности частиц. Функциональная активность (газотранспортная функция) эмульсий ПФУ также во многом зависит от совместимости поверхности эмульгированных частиц с кровью и плазмой, поскольку в случае, например, активации системы комплемента на чужеродной поверхности происходит запуск каскада реакции, вызывающих спазм сосудов и нарушение регионарного кровотока. Следует отметить также, что стабильность эмульсий в условиях in vitro во многом определяется свойствами адсорбционного слоя ПАВ вокруг частиц (прочность, топография поверхности и др.). В свете сказанного вопрос о стабильности эмульсий ПФУ не может быть решен только с помощью обычных коллоидно-химических методов изучения размера частиц без оценки особенностей структуры. Весьма актуальным является разработка для этой цели достаточно простых методов и подходов, позволяющих получать информацию о размере частиц и целостности их структуры. При этом необходимо также уточнить само понятие структуры применительно к эмульсиям ПФУ.
Прогресс в изучении стабильности эмульсий ПФУ in vitro и in vivo связан с расширением и углублением самого понятия структуры эмульсий ПФУ и разработкой методов ее изучения. Понятие стабильности какого-либо препарата или вещества определяется устойчивостью его свойств. Параметры, используемые для характеристики свойств эмульсий ПФУ, не являются исчерпывающими характеристиками их стабильности. Проведенные опыты расширили представления о критериях стабильности эмульсий ПФС с учетом особенностей их структуры.
Стабильность эмульсий ПФУ принято оценивать на основании изменения размера частиц при хранении. Такой чисто коллоидно-химический подход недостаточен. Для эмульсий ПФУ, являющихся основой препаратов, предназначенных для внутривенного введения, большое значение приобретает информация об их стабильности не только в опытах in vitro, но и возможность предсказывать их стабильность при циркуляции в сосудистом русле. Получение таких сведений может быть достигнуто, если более четко обозначить представление о структуре эмульсий ПФУ. Частицы эмульсий ПФУ имеют структуру двухслойного шара, в центре которого находится ПФУ (ядро частицы), а на поверхности слой эмульгатора (оболочка) [12]. Толщина оболочки эмульгатора мала и составляет не более 5-10% от диаметра частиц. Тем не менее поведение эмульсий ПФУ в сосудистом русле (взаимодействие с белками плазмы и клетками крови, скорость выведения и др.), а также стабильность при длительном хранении во многом будут зависеть от прочности и состояния поверхностно-активного вещества вокруг частицы. Поэтому необходимо одновременно получать информацию о размере частиц и структурных изменениях, имеющих место в исследуемых средах при тех или иных воздействиях.
Для теоретического описания и анализа изменения структуры эмульсий ПФС, как основы инфузионных сред, предложено выделить следующие представления [13].
1) "Общую структуру" эмульсий ПФУ и ее изменения. Этот аспект характеризуется средним диаметром и распределением частиц по размерам.
2) "Микроструктуру", которая определяется состоянием эмульгатора в оболочке, степенью его взаимодействия с ПФУ, взаимным расположением молекул ПАВ, их упорядоченностью, плотностью упаковки, степенью окисленности, фазовым состоянием структурированных молекул.
До настоящего времени все исследователи ограничивались анализом «общей структуры», что крайне недостаточно, так как стабильность эмульсий, биосовместимость и, в частности поверхностные свойства частиц и их адсорбционная способность, определяются «микроструктурой».
Представленные в настоящем изобретении эмульсии ПФС сравнивались с прототипом и исследовались, во-первых, по параметрам, характеризующим изменение «общей структуры» в разные сроки хранения полученных эмульсий.
Во-вторых, моделировали воздействие повреждающих эмульсию факторов в условиях, позволяющих оценивать состояние «микроструктуры» эмульсии ПФУ. В частности, использовали «стресс-воздействие» в виде разведения эмульсии водой и определяли изменение параметров по сравнению с нативной эмульсией. Разведение эмульсий ПФУ водой нарушает сложившееся равновесие между адсорбционным слоем ПАВ (оболочкой) и молекулами ПАВ в дисперсионной среде. Поэтому оно имеет определенную предсказательную силу в отношении сохранения стабильности метастабильной системы (эмульсии ПФС) или ее разрушения.
Кроме того, наблюдали изменение микроструктуры и совместимость эмульсий ПФС при контакте с сывороткой крови как модельной системой (изучение биосовместимости эмульсий ПФС в опытах in vitro). Взаимодействие двух гетерогенных дисперсных систем - сыворотки крови и эмульсии ПФУ - характеризует изменение поверхностных свойств частиц при попадании в кровоток и изменение микроструктуры эмульсий ПФУ при хранении. Наблюдения за динамикой «общей структуры» и «микроструктуры» проводили в одни и те же сроки в течение 12 месяцев хранения эмульсий ПФУ.
Для выявления различий в названных параметрах состояния при хранении эмульсий ПФС требовались методы и подходы, которые не вносили бы дополнительных возмущений в исследуемую систему при проведении соответствующих измерений. В качестве таковых были выбраны, апробированы и разработаны оптические методы контроля.
Для оценки общей структуры был выбран метод спектротурбидиметрии или метод спектра мутности (CM) [14]. Его же использовали для оценки распределения частиц по размерам в исследуемых эмульсиях после их центрифугирования и фракционирования. Изменение микроструктуры эмульсий или поверхностных свойств частиц, вызванное изменением взаимосвязей молекул ПАВ в адсорбционном слое вокруг ПФС, оценивали с помощью косвенного метода нахождения индекса взаимодействия (Кτ) исследуемой эмульсии с сывороткой крови по отношению к физиологическому раствору: относительная мутность Кτ=τ1/τ2, где τ1 и τ2 - мутности смесей «сыворотка/эмульсия» и «сыворотка/физиологический раствор» при соответствующих изменениях соотношений компонентов смесей [15]. Дополнительно для подтверждения неизменности природы эмульгированных частиц ПФУ (отсутствия свободных ФЛ) проводили сопоставление экспериментальных и расчетных значений τ: τрасч.=ΣNi·τi (ΣNi=1), где τi и Ni - мутность и доля выделенной фракции; τэксп. - мутность той же пробы эмульсии до фракционирования.
I. Ниже приведены конкретные составы предложенной эмульсии ПФС в соответствии с настоящим изобретением.
Состав 1. Эмульсия содержит 40 об.% фторуглеродной фазы (Сv) в виде ПФД и ПФОБ, взятых в соотношении 1:1, с перфторированной добавкой в виде смеси перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3,4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидин в количестве 50% от суммарного содержания основных ПФС, стабилизированных в эмульгированном состоянии 5% дисперсией ФЛ, содержащей ЯФЛ и адъювант в виде касторового масла, взятого в концентрации 15% от суммарного содержания ЯФЛ, в водно-солевой среде следующего состава: 2 мМ (115 мг в литре) хлорида натрия, 2 мМ калия фосфорнокислого однозамещенного (310 мг безводной соли в литре), 7,5 мМ натрия фосфорнокислого двузамещенного (460 мг безводной соли в литре), 318 мМ маннита (58 г маннитола в литре) в воде для инъекций. Осмотическое давление эмульсии составляет 310 мОсмолей на литр. Средний размер частиц эмульсии 0,195 мкм.
Состав 2. Эмульсия по примеру (составу) 1, отличающаяся тем, что эмульсия содержит 20 об.% фторуглеродной фазы (Сv) в виде ПФД и ПФОБ, взятых в соотношении 10:1, с перфторированной добавкой смеси перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3, 4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидин, дополнительно содержащей перфтор-N-метилциклогескипиперидин и его копродукты изомеры перфторметилпропил (метилциклопентил) амина, цис/транс-перфторметилпропил (4-метилциклогексил) амин, перфторметилбутил-(4-метилциклогексил) амин, цис/транс-перфтор-N-(4-метилциклогексил)-2-метилпирролидин в суммарном количестве 25% от содержания основных ПФС, стабилизированных в эмульгированном состоянии 2,5% дисперсией ФЛ, содержащей СФЛ и адъювант в виде соевого масла, взятого в концентрации 10% от суммарного содержания ЯФЛ, в водно-солевой среде следующего состава: 2 мМ натрия фосфорнокислого однозамещенного (276 мг безводной соли в литре), 7,5 мМ натрия фосфорнокислого двузамещенного (460 мг безводной соли в литре), 278 мМ маннита (50 г маннитола в литре) в воде для инъекций. Осмотическое давление эмульсии составляет 270 мОсмолей на литр. Средний размер частиц эмульсии 0,1 мкм.
Состав 3. Эмульсия по примеру 1, отличающаяся тем, что эмульсия содержит 15 об.% фторуглеродной фазы (Сv) в виде ПФД и ПФОБ, взятых в соотношении 1:10, с перфторированной добавкой смеси перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3,4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидин, дополнительно содержащей перфтор-N-метилциклогексилпиперидин в суммарном количестве 5% от содержания основных ПФС, стабилизированных в эмульгированном состоянии 2% дисперсией ФЛ, содержащей смесь ЯФЛ и СФЛ, а также адъювант в виде подсолнечного масла, взятого в концентрации 5% от суммарного содержания ФЛ, в водно-солевой среде следующего состава: 1 мМ натрия фосфорнокислого однозамещенного (138 мг безводной соли в литре), 3,7 мМ натрия фосфорнокислого двузамещенного (230 мг безводной соли в литре), 100 мМ маннита (18 г маннитола в литре) в воде для инъекций. Осмотическое давление эмульсии составляет 105 мОсмолей на литр. Средний размер частиц эмульсии 0,08 мкм.
Состав 4. Эмульсия по примеру 1, отличающаяся тем, что эмульсия содержит 10 об.% фторуглеродной фазы (Сv) в виде ПФД и ПФОБ, взятых в соотношении 2:1, с перфторированной добавкой смеси перфтортрипропиламина и его копродуктов: цис- и транс-изомеров перфтор-1-пропил-3,4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидин, дополнительно содержащей перфтор-N-метилциклогексилпиперидин в суммарном количестве 0,2% от содержания основных ПФС, стабилизированных в эмульгированном состоянии 2% дисперсией ФЛ, содержащей ЯФЛ, а также адъювант в виде смеси подсолнечного и касторового масла, взятого в концентрации 2% от суммарного содержания ЯФЛ, в водно-солевой среде следующего состава: 1 мМ натрия фосфорнокислого однозамещенного (138 мг безводной соли в литре), 3,7 мМ натрия фосфорнокислого двузамещенного (230 мг безводной соли в литре), 90 мМ маннита (13 г маннитола в литре) в воде для инъекций. Осмотическое давление эмульсии составляет 100 мОсмолей на литр. Средний размер частиц эмульсии 0,07 мкм.
Состав 5. Эмульсия по примеру 1, отличающаяся тем, что эмульсия содержит 2 об.% фторуглеродной фазы (Сv) в виде ПФД и ПФОБ, взятых в соотношении 1:2, с перфторированной добавкой смеси перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3,4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидин, дополнительно содержащей перфтор-N-метил-циклогексилпиперидин в суммарном количестве 10% от содержания основных ПФС, стабилизированных в эмульгированном состоянии 0.2% дисперсией ФЛ, содержащей СФЛ, а также адъювант в виде смеси соевого и касторового масла, взятого в концентрации 5% от суммарного содержания СФЛ, в водно-солевой среде следующего состава: 2 мМ (115 мг в литре) хлорида натрия, 2 мМ натрия фосфорнокислого однозамещенного (276 мг безводной соли в литре), 7,5 мМ натрия фосфорнокислого двузамещенного (460 мг безводной соли в литре), 318 мМ маннита (58 г маннитола в литре) в воде для инъекций. Осмотическое давление эмульсии составляет 350 мОсмолей на литр. Средний размер частиц эмульсии 0,06 мкм.
Состав 6. Эмульсия по примеру 1, отличающаяся тем, что эмульсия содержит 10 об.% фторуглеродной фазы (Сv) в виде ПФД и ПФОБ, взятых в соотношении 4:1, с перфторированной добавкой смеси перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3,4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидин в суммарном количестве 4% от содержания основных ПФС, стабилизированных в эмульгированном состоянии 2% дисперсией ФЛ, содержащей СФЛ, а также адъювант в виде смеси подсолнечного, соевого и касторового масла, взятого в концентрации 4% от суммарного содержания СФЛ, в водно-солевой среде следующего состава: 2 мМ натрия фосфорнокислого однозамещенного (276 мг безводной соли в литре), 7,5 мМ натрия фосфорнокислого двузамещенного (460 мг безводной соли в литре), 200 мМ маннита (36 г маннитола в литре) в воде для инъекций. Осмотическое давление эмульсии составляет 225 мОсмолей на литр. Средний размер частиц эмульсии 0,09 мкм.
В таблице 6 приведены составы эмульсии в соответствии с изобретением по примерам 1-6.
II. Далее приведены конкретные примеры реализации способа получения эмульсий ПФС заявляемого состава и их физико-химические параметры.
Пример 1. Эмульсию готовили в асептических условиях.
1.1. Для приготовления 1 л эмульсии, содержащей 10 об.% ПФС, приготовляли 1% дисперсию ФЛ.
1.2. Первый этап приготовления дисперсии ФЛ: в стерильную круглодонную колбу наливали 100 мл 10%-ного спиртового раствора ЯФЛ и отгоняли спирт на ротационном испарителе, добавляли 1 г касторового масла (концентрация адъюванта 10% от содержания ЯФЛ) и наливали 900 мл водно-солевого раствора.
1.3. Для приготовления водно-солевого раствора также использовали апирогенную воду. Порошок однозамещенного фосфорнокислого натрия, порошок двузамещенного фосфорнокислого натрия и кристаллический маннит высушивали в сухожаровом шкафу при температуре 110°С в течение 2 часов. Затем навески 0,138 г безводного однозамещенного фосфорнокислого натрия, 0,523 г безводного двузамещенного фосфорнокислого натрия и 50,0 г маннита растворяли в асептических условиях в ламинарном боксе в 1 л апирогенной воды. Полученную водно-солевую композицию пропускали через стерильный фильтр фирмы Миллипор с диаметром пор 0,4 мкм.
1.4. Смесь фосфолипидов, растительного масла и водно-солевого раствора механически перемешивали в колбе до образования гомогенной суспензии молочно-желтоватого цвета. Полученную суспензию ФЛ переносили в стерильную емкость гомогенизатора высокого давления.
1.5. Гомогенизатор предварительно стерилизовали пропусканием перегретого водяного пара, пропусканием медицинского спирта в объеме 500 мл и промыванием 500 мл горячей апирогенной воды.
1.6. Суспензию ФЛ диспергировали в гомогенизаторе при давлении 100 атм 4-кратным пропусканием до образования полупрозрачной гомогенной жидкости - дисперсии ФЛ, которую разливали во флаконы. Через флаконы пропускали стерильный инертный газ (азот, аргон или смесь азота с углекислотой) в течение 2-4 минут.
1.7. Флаконы закрывали резиновыми пробками и завальцовывали под обкатку алюминиевыми колпачками. После этого флаконы стерилизовали термообработкой при 100°С в течение 1 часа. Флаконы хранили при комнатной температуре до начала следующего этапа получения эмульсии ПФС.
1.8. Следующий этап заключался в обработке ПФС. Смешивали 72 мл ПФД с 8 мл ПФОБ. К 80 мл этой композиции ПФС добавляли 20 мл ПФОЖ. Полученную композицию смеси ПФД и ПФОБ с ПФС добавкой смешивали с равным объемом спирта медицинского. Перфторуглеродную фазу как более тяжелую отделяли от спирта на делительной воронке. Отделенную от спирта смесь ПФС смешивали с 3-х кратным объемом апирогенной воды, встряхивали и также отделяли на делительной воронке (удельный вес ПФС почти в два раза превышает удельный вес воды).
1.9. Далее получали эмульсию. В рабочую емкость гомогенизатора вносили 900 мл дисперсии ФЛ и 100 мл обработанной смеси ПФС (композицию ПФД/ПФОБ=9/1 + ПФОЖ - 20%), все содержимое рабочей емкости механически перемешивали и подвергали диспергированию под давлением 500 атм, пропуская весь объем 8 раз через камеру высокого давления, до образования полупрозрачной опалесцирующей желтоватой жидкости - субмикронной эмульсии ПФС. Эмульсию разливали во флаконы по 100 мл, закрывали резиновыми пробками и завальцовывали алюминиевыми колпачками.
1.10. Флаконы с эмульсией ПФС стерилизовали нагреванием при 100°С в течение 1 часа, охлаждали и хранили при 4°С в течение года.
Состав полученной эмульсии: содержание фторуглеродной фазы (Сv) равно 10 об.%, соотношение ПФД/ПФОБ равно 9/1, относительное количество ПФОЖ в смеси ПФС составляет 20%, концентрация ЯФЛ - 1 вес.%, концентрация касторового масла - 0,1% (относительное количество касторового масла как адъюванта в суспензии равно 10% от суммарного содержания ЯФЛ). Серия 1.
Определяли вязкость этой серии в вискозиметре ВПЖ-2. Ее величина составила 0,953 спз. Для сравнения вязкость препарата Перфторан с тем же содержанием фторуглеродной фазы составляет 2,5 спз.
Пример 2. Эмульсию ПФС готовили, как описано в примере 1, идентичного состава. Только в качестве адъюванта к ЯФЛ брали смесь двух масел: касторового и масла сои в соотношении 1/1. Состав Сv - 10 об.%, соотношение ПФД/ПФОБ равно 9/1, относительное содержание ПФОЖ составляет 20%, концентрация ЯФЛ - 1 вес.%, относительное содержание адъюванта - смеси двух масел (касторовое масло/соевое масло = 1/1) - составляет 10%. Серия 2.
Пример 3. Эмульсию ПФС готовили, как описано в примере 1, но в объеме 800 мл и содержанием 20 об.% ПФС, идентичного примеру 1 состава. В кругло-донную колбу вносили 200 мл 10%-ного спиртового раствора соевых ФЛ (СФЛ). Спирт отгоняли на ротационном испарителе, добавляли в колбу адъювант - смесь соевое масло/касторвое масло в соотношении1/2 - в суммарном количестве 3 г, что составляло 15% от общего количества СФЛ. Водно-солевой раствор содержал 0,276 г безводного однозамещенного фосфорнокислого натрия, 1,046 г безводного двузамещенного фосфорнокислого натрия и 10,0 г маннита. В колбу, содержащую СФЛ и адъювант, вносили 1 л водно-солевого раствора, встряхивали, переносили в гомогенизатор, диспергировали, разливали во флаконы, стерилизовали, как в примере 1. Подготавливали фторуглеродную фазу. К 160 мл ПФД добавляли 40 мл ПФОБ, отбирали 160 мл этой композиции и смешивали ее с 40 мл ПФОЖ. 200 мл полученной смеси ПФС после очистки прокапывали в гомогенизатор, в котором находилось 800 мл дисперсии СФЛ. Полученную эмульсию разливали во флаконы и стерилизовали.
Состав эмульсии: Сv=20 об.%, соотношение ПФД/ПФОБ = 8/2; относительное содержание ПФОЖ - 20%; концентрация СФЛ равна 2 вес.%, относительное содержание адъюванта (смесь двух масел - масло сои/масло касторовое в соотношении1/2) составляет 15%. Серия 3.
Пример 4. Эмульсию получали, как в примере 1, за исключением того, что соотношение компонентов в композиции ПФД/ ПФОБ также было тем же самым и равнялось 8/2. К 170 мл этой композиции добавляли 30 мл ПФМЦП, перемешивали взбалтыванием, очищали стандартным образом и прокапывали в гомогенизатор, где находилось 800 мл дисперсии СФЛ (полученной, как в примере 3), содержащей тот же адъювант - смесь двух масел: масло сои/масло касторовое в соотношении1/2 в количестве 15% от содержания СФЛ. Эмульсию диспергировали под давлением 400 атм.
Состав эмульсии: Сv=20 об.%; соотношение ПФД/ПФОБ = 8/2; относительное содержание ПФМЦП - 15%; концентрация СФЛ равна 2 вес.%, относительное содержание адъюванта (смеси двух масел: масло сои/масло касторовое в соотношении1/2) в дисперсии СФЛ составляет 15%. Серия 4.
Пример 5. Эмульсию получали как в примере 1, за исключением того, что использовали другое количество ЯФЛ для получения дисперсии ФЛ. 50 мл спиртового раствора ЯФЛ поместили в круглодонную колбу, отогнали спирт на ротационном испарителе, поместили туда 0,6 г подсолнечного масла, добавили 0,95 л солевого раствора, перемешали встряхиванием и гомогенизировали при давлении 150 атм. Композицию ПФД/ПФОБ в соотношении 5/5 готовили смешением 25 мл ПФД с 25 мл ПФОБ. 49,5 мл этой смешали с 0,5 мл ПФОЖ. Приготовленные 50 мл смеси ПФС, после очистки прокапывали в гомогенизатор, куда предварительно было залито 0,95 л суспензии ЯФЛ. Гомогенизацию предварительной грубой дисперсии осуществляли при давлении 350 атм. Розлив и стерилизацию тонкодисперсной эмульсии проводили согласно указанным правилам.
Состав полученной эмульсии: Сv=5 об.%; соотношение ПФД/ПФОБ=5/5; относительное содержание ПФОЖ составляет 1%; концентрация ЯФЛ равна 0,5 вес.%; относительное содержание подсолнечного масла, взятого в качестве адъюванта, составляет 12%. Серия 5.
Пример 6. 50 мл 10%-ного спиртового раствора СФЛ поместили в круглодонную колбу, отогнали спирт по описанной методике, поместили туда 0,6 г соевого масла, добавили 950 мл солевого раствора, после перемешивания перенесли в гомогенизатор для получения дисперсии при давлении 180 атм. После стерилизации ее использовали для получения эмульсии.
Композицию ПФД/ПФОБ (соотношение 5/5) получали смешиванием 25 мл ПФД с 25 мл ПФОБ. К 49,5 мл этой композиции добавили 0,5 мл ПФМЦП. После очистки спиртом 50 мл полученной смеси прокапали ее в гомогенизатор, в котором находилось 950 мл дисперсии СФЛ. Гомогенизацию проводили, как было указано ранее, в два этапа. Сначала при давлении 200 атм, а потом при давлении 500 атм.
Состав полученной эмульсии: Cv=5 об.%; соотношение ПФД/ПФОБ=5/5; относительное содержание ПФМЦП составляет 1%; концентрация СФЛ равна 0,5 вес.%; относительное содержание соевого масла, взятого в качестве адъюванта, составляет 12%. Серия 6.
Пример 7. Готовили суспензию с концентрацией СФЛ, равной 0,2 вес.%. Для этого 20 мл спиртового раствора СФЛ поместили в ротационный испаритель, отогнали спирт, поместили туда 0,02 г в качестве адъюванта смесь двух масел подсолнечного и соевого в соотношении 1/1. Добавили в колбу 980 мл солевого раствора. Диспергирование и стерилизацию осуществляли как указано в примере 6.
Композицию ПФД/ПФОБ получили смешиванием 4 мл ПФД и 16 мл ПФОБ (соотношение компонентов 2/8). К 19 мл полученной смеси ПФС добавили 1 мл ПФМЦП. 20 мл образовавшейся 3-х компонентной смеси прокапывали в гомогенизатор, в который предварительно было залито 980 мл суспензии СФЛ. Процесс диспергирования проводили так как указано в предыдущем примере, розлив и стерилизацию образовавшейся эмульсии осуществляли по стандартной методике.
Состав полученной эмульсии: Cv=2 об.%; соотношение ПФД/ПФОБ составляет 2/8; относительное содержание ПФМЦП равно 5%; концентрация СФЛ составляет 0,2 вес.%; относительное количество адъюванта - смесь подсолнечного и соевого масел в соотношении 1/1 - равно 1%. Серия 7.
Пример 8. Для получения эмульсии, содержащей 40 об.% приготовляли суспензию ЯФЛ в концентрации 5 вес.%. Для этого 500 мл спиртового раствора ЯФЛ помещали в круглодонную колбу, отгоняли спирт, вносили в нее 2,5 г касторового масла в качестве адъюванта, наливали в нее 600 мл солевого раствора, перемешивали и диспергировали на гомогенизаторе при 200 атм до образования однородной среды желтовато-белого цвета. Стерилизовали ее как было указано ранее.
Композицию ПФС готовили смешиванием 40 мл ПФД с 360 мл ПФОБ (соотношение компонентов 1/9). К 360 мл этой композиции добавили 40 мл ПФМЦП. Полученные 400 мл 3-х компонентной смеси ПФС прокапывали в гомогенизатор, где находилось 600 мл полученной ранее суспензии ЯФЛ. Гомогенизацию проводили в два этапа: на первом - при давлении 250 атм, на втором - при давлении 600 атм. Разливали и стерилизовали эмульсию в соответствие с принятой методикой.
Состав полученной эмульсии: Cv=40 об.%; соотношение ПФД/ПФОБ=1/9; относительное количество добавки ПФМЦП составляет 10%; концентрация ЯФЛ в эмульсии (в виде суспензии) составляет 5 вес.%; относительное содержание адъюванта - касторового масла-равно 5%. Серия 8.
Пример 9. Фторуглеродную фазу эмульсии готовили смешиванием 40 мл ПФД с 360 мл ПФОБ. К 320 мл этой композиции добавляли 80 мл смеси, содержащей 40 мл ПФМЦП и 40 мл ПФОЖ. Суспензия эмульгатора содержала 4,2 вес.% ЯФЛ, 4,2 вес.% СФЛ и адъювант - смесь касторового и подсолнечного масел - в соотношении 9/1 в количестве 4,2 г, т.е. 5% от суммарного содержания ЯФЛ.
Для получения эмульсии в гомогенизатор заливали 600 мл полученной суспензии и прокапывали в гомогенизатор 400 мл 3-х компонентной смеси ПФС вышеуказанного состава. Процессы гомогенизации, розлива и стерилизации осуществляли так же, как в предыдущем примере.
Состав эмульсии: Cv=40 об.%; соотношение ПФД/ПФОБ=1/9; относительное содержание смеси ПФМЦП с ПФОЖ составляет 20%; концентрация ФЛ (смесь ЯФЛ и СФЛ 1:1) в эмульсии 5 вес.%; содержание адъюванта - 0, 25% (смесь двух масел касторового и подсолнечного в соотношении 9/1). Серия 9.
В таблице 7 приведен состав всех серий эмульсий.
Далее в табличной форме (табл. 8) приведены результаты наблюдений за изменением среднего диаметра частиц для нативной (неразведенной) и разведенной водой эмульсии в разные ПФС в разные сроки хранения.
Расчеты n выполнялись по методу наименьших квадратов. Среднеквадратичная ошибка в определении n равнялась 0,01-0,03. Отсюда погрешность в определении n составляет 0,3-1%. Параметр n является характеристической функцией используемого метода спектра мутности и вычисляется не менее, чем по 3-5 точкам. Для тонкодисперсных эмульсий ПФС n однозначно связан со средним диаметром частиц а [14].
Согласно полученным результатам, усредненные параметры n и а практически не менялись в течение 12 месяцев хранения. Разведение водой как стресс-воздействие мало влияло на размер частиц. Несколько большим было увеличение значений а для эмульсий, содержащих СФЛ, в отдаленные сроки наблюдения: 9-12 месяцев. Интервал изменения волнового экспонента в течение 1 года хранения для всех серий эмульсий ПФУ/дисперсия ФЛ находился в пределах 3,4-2,7. Это соответствовало увеличению среднего диаметра частиц с 0,11 до 0,15-0,195 мкм.
Для наблюдения за изменением распределения частиц по размерам использовали прием фракционирования исследуемых сред. Эмульсии центрифугировали в мягких условиях (1500 об/мин) и выделяли (точно) 3 фракции: верхнюю - 20%, среднюю - 60%, нижнюю - 20% от общего объема пробы (фиг. 1). Как показано на фиг. 1, в эмульсии ПФС, взятой за прототип, помимо трех фракции, различающихся по среднему размеру частиц эмульсии ПФС, имеется верхняя легкая фракция, содержащая свободные фосфолипиды (ФЛс), что свидетельствует о слабой связи адсорбционного слоя с перфторорганической масляной фазой и о наличии не связанных в адсорбционном слое ПАВ. Для каждой фракции находили значения n и а. Величины названных параметров для фракционированных эмульсий заявленного состава при хранении в течение 1-12 месяцев представлены в табл. 9. Оказалось, что n и а для верхней и средней фракций практически не менялись в течение 1-12 месяцев хранения. В нижней фракции отмечено некоторое увеличение размера частиц по мере увеличения срока хранения. Это приводило к увеличению ширины распределения частиц по размерам. При этом максимальная ширина распределения находилась в интервале 0,06-0,19 мкм.
Полученные результаты показали, что в течение 12 месяцев хранения средний диаметр частиц для нативных эмульсий и при разведении их водой (стресс-воздействие) увеличивался незначительно, оставаясь в допустимых пределах: менее 0,20 мкм.
Обнаруженное увеличение было связано с увеличением ширины распределения частиц по размерам за счет появления в эмульсиях относительно крупных частиц. Так при фракционировании эмульсий после 12 месяцев хранения размер частиц в нижней фракции возрастал с 0,12 до 0,198 мкм. В целом эти результаты соответствуют основному механизму разрушения эмульсий по Оствальду (или молекулярной перегонке). Однако доля таких относительно крупных частиц была настолько мала (˜10%), что это обстоятельство не сказывалось на увеличении среднего диаметра частиц. Следует подчеркнуть, что при фракционировании эмульсий отмечалось только равномерное оседание частиц, что говорило об отсутствии в эмульсиях свободных ФЛ даже спустя 1 год хранения, т.е. характер распределения частиц в эмульсиях не менялся, оставаясь мономодальным. Полученные результаты свидетельствуют о сохранении общей структуры полученных эмульсий ПФУ в течение 1-12 месяцев хранения.
В табл. 10 приведены значения индексов взаимодействия К, частиц исследованных эмульсий с сывороткой крови, модифицированной добавлением 5%-ного раствора альбумина в соотношении 1/1.
Индексы взаимодействия эмульсий ПФУ с сывороткой крови Кτ, которые характеризуют их микроструктуру, для эмульсий ПФУ/ЯФЛ в течение 12-месячного срока наблюдений колебались в некотором достаточно узком интервале (соотношение сыворотка:эмульсия = 1:0,05 и 1:0,1). При увеличении соотношения сыворотка:эмульсия до 1:0,10 интервал колебания индексов Кτ и Кτ/n возрастал. Для эмульсий ПФУ/СФЛ узкий интервал колебаний Кτ сохранялся только до 6-тимесячного срока хранения. Как уже было отмечено, установленные колебания Кτ связаны, скорее всего, с тем, что стандартизовать смесь сывороток от опыта к опыту при различных сроках хранения эмульсий весьма сложно. Вместе с тем сохранение интервала колебаний индекса взаимодействия эмульсий с сывороткой крови в определенных и достаточно узких пределах для каждой серии свидетельствует о том, что поверхностные свойства частиц при столь длительных сроках хранения (6-9 мес.) меняются мало. Скачок Кτ к концу срока хранения при отсутствии в эмульсиях свободных ФЛ может быть связан с возникновением дополнительных взаимодействий между частицами и макромолекулами сыворотки. Для проверки этого предположения были рассчитаны экспериментальные и расчетные значения мутности τ - дополнительного независимого параметра оценки целостности структуры эмульсий ПФУ (табл. 11) [13].
По физическому смыслу τ для дисперсных систем является суммой потерь мощности светового пучка на отдельных частицах в случае отсутствия кооперативных эффектов и многократного рассеяния. Совпадение экспериментальных и расчетных значений τ как для нативных, так и для разведенных водой эмульсий свидетельствовало о том, что взаимодействие между частицами и макромолекулами сыворотки практически не меняется даже спустя 9-12 месяцев хранения при +4°С. Скачок Кτ, скорее всего, связан с появлением в водной дисперсионной среде дополнительных надмолекулярных структур ПФУ/ФЛ, причем соотношение в них ПФУ и ФЛ остается таким же, что и в эмульсиях.
Прежде чем говорить о преимуществах заявленного состава и способа получения эмульсий ПФС, следует подчеркнуть, что главными условиями выполнения эмульсиями ПФС газотранспортной функции при циркуляции в сосудистом русле является сохранение корпускулярной природы частиц и отсутствие реактогенности. С позиции коллоидной химии и биофизики попадание эмульсии ПФУ в сосудистое русло можно рассматривать как стресс-воздействие, которое должно приводить к изменению свойств дисперсной среды. Это воздействие можно свести к следующим моментам. Разбавление эмульсии ПФУ и уменьшение концентрации свободного эмульгатора в среде (быстрая стадия). В результате этого процесса происходит ослабление связей молекул ПАВ с поверхностью частиц (замедленная стадия). Это изменение прочности связей ПАВ с ПФУ усугубляется контактом и взаимодействием частиц с макромолекулами плазмы, что может привести к изменению состава адсорбционного слоя или разрушению частиц. Обозначенная последовательность процессов представляет собой несколько упрощенную схему.
В наших опытах разведение эмульсий водой моделирует первую стадию - разбавление эмульсии и уменьшение концентрации свободного эмульгатора вокруг частиц. Изучение взаимодействия полученных эмульсий с сывороткой крови моделирует вторую стадию - влияние контакта макромолекул сыворотки на свойства поверхности частиц. Оказалось, что даже спустя год хранения частицы эмульсий ПФУ сохраняют свою «микроструктуру»: разбавление эмульсий водой не влияло на размер частиц, что свидетельствовало о прочности связи адсорбционного слоя ПАВ с ядром частиц - ПФС; не менялся также индекс взаимодействия частиц эмульсий с сывороткой крови (в пределах погрешности измерений), что свидетельствовало о сохранении поверхностных свойств частиц. Совпадали расчетные значения τ (после фракционирования) с экспериментальными (до фракционирования), что подтверждает сохранение «природы» частиц (их структуры) и свидетельствует об отсутствии свободных ФЛ в эмульсиях спустя 1 год хранения.
Использованные методологические подходы значительно увеличивают достоверность прогноза стабильности эмульсий при попадании в сосудистое русло. Подтверждением сказанному являются результаты параллельных исследований по изучению стабильности и определению индекса реактогенности (Ip нескольких серий эмульсий идентичного состава. Ip находили по методу [3].
Пример 10. Было получено 4 серии однотипных эмульсий состава, соответствующего примеру 2: содержание фторуглеродной основы составило 9±1 об.%, соотношение ПФД/ПФОБ 9:1; добавка ПФОЖ составляла 20%; содержание ЯФЛ равнялось 1 вес.%; количество адъюванта - касторового масла и соевого масла в соотношении 1:1 составляло 8% от концентрации ЯФЛ.
В таблице 12 приведены значения n и а для этих серий разных сроков хранения.
Согласно полученным данным средний диаметр частиц во всех случаях для нативной и разведенной водой эмульсии не менялся в течение 6 месяцев хранения, оставаясь в пределах 0,06-0,17 мкм. Ширина распределения частиц по размерам для нативной и разведенной водой эмульсий названного состава практически не менялась в указанный период наблюдений (табл. 13). Индекс взаимодействия полученных эмульсий с модифицированной сывороткой крови Кτ с учетом относительной погрешности измерения (±10%) колебался в достаточно узких пределах (табл. 14).
Приведенные результаты свидетельствует о том, что в предлагаемых эмульсиях и способе их получения удается достигнуть высокого качества микроструктуры эмульсий, не повреждаемой при хранении в не замороженном виде и последующих стрессовых воздействиях in vitro (разведение водой, взаимодействие с сывороткой крови, обогащенной альбумином). Результаты проверки реактогенности тех же образцов эмульсий полностью подтверждают данные модельных исследований: ни в один из сроков исследования индекс реактогенности не превысил критической величины, равной 3 (табл. 15).
Пример 11. Сохранность структуры и анализ уровня реактогенности эмульсий с пониженным объемным содержанием ПФС на уровне 5 об.%. Состав эмульсии ПФД/ПФОБ 1:1, ПФМЦП 1%, СФЛ - 0,5%, адъювант масло сои - 12%. Ширина распределения размеров частиц находилась в диапазоне 0,03 до 0,12 мкм, исходный индекс реактогенности составлял 1,61. Исследовались изменения при хранении среднего размера частиц нативных и разведенных водой четырех однотипных эмульсий (табл. 16) и реактогенность после 6 месяцев хранения (табл. 17). Как следует из приведенных данных, наблюдаемое приращение размера частиц при использованной рецептуре и предложенном способе получения обеспечивают сохранение низкого уровня индекса реактогенности.
Пример 12. Длительное в течение 18 месяцев хранение эмульсии, содержащей 10 об.% ПФС, при соотношении ПФД/ПФОБ 8:2, ПФОЖ 20%, ЯФЛ 2%, адъювант касторовое масло 10%. Результаты исследования изменения среднего размера частиц при хранении и разведении эмульсии водой представлены в табл. 18, динамика индекса взаимодействия эмульсии с сывороткой крови, обогащенной альбумином до 50%-в табл. 19.
Как видно из приведенных данных, полученная эмульсия сохраняла измеряемые физико-химические характеристики. Очевидно, благодаря этому через 18 мес. хранения индекс реактогенности Ip для эмульсии ПФД/ПФОБ/ПФОЖ/ЯФЛ составлял всего 1,5.
Пример 13. Сопоставление качества эмульсий ПФС, полученных по прототипу, эмульсии Оксигент AF 0104 (фирмы Alliance Therapeutic, США) и эмульсии ПФС, полученной предлагаемым в настоящем изобретении способом. Сравнение проводилось по изменению волнового экспонента и среднего диаметра частиц при разведении водой.
В сравниваемых эмульсиях при разном абсолютном содержании ПФС соблюдено равное соотношение компонентов ПФС/ФЛ. Указанные эмульсии отличаются по способу получения. В результате эмульсия ПФОБ-2 (полученная по заявляемому способу) не содержит после центрифугирования свободной фосфолипидной фазы (фиг. 1Б), тогда как эмульсия Оксигент и эмульсия прототип ПФОБ-1 содержат не связанные в адсорбционном слое частиц свободные фосфолипиды, легко всплывающие при центрифугировании (фиг. 1А). Именно поэтому при разведении эмульсий водой, когда происходит разрушение агрегатов ФЛ и частиц эмульсий происходило «уменьшение» среднего размера частиц эмульсии в препарате Оксигент с 0,35 до 0,15.
В эмульсии прототипа (ПФОБ-1), очевидно, отсутствовали такие грубые агрегаты, но об их присутствии свидетельствуют, помимо результатов центрифугирования и выделения фракции свободных ФЛ, резкие различия между расчетными и экспериментально определенными параметрами значений мутности, определяемыми по правилам аддитивности, для нативных и разведенных водой эмульсий. Тогда как для препаратов эмульсий ПФС, полученных заявленным способом, наблюдалось практически полное соответствие по параметру мутности между экспериментальными и расчетными значениями (таблица 21). Следует отметить, что по физическому смыслу определяемый параметр отражает сумму потерь мощности светового пучка на отдельных частицах в отсутствии кооперативных эффектов и многократного рассеяния. Несоответствие экспериментальных и расчетных значений мутности для препарата Оксигент и эмульсии ПФОБ-1 (прототип) свидетельствовало о несоблюдении правила аддитивности для этих сред, т.е. о наличии в названных дисперсных системах дополнительных взаимодействий между частицами и световым потоком. Эти взаимодействия отчетливо выявляются при разведении водой препарата Оксигент и эмульсий ПФОБ-1, что отражает неоднородность вида частиц, в частности наличие наряду с частицами эмульсии ПФС различных мицел-лярных структур ФЛ. Для эмульсии ПФОБ-2 и эмульсии ПФД/ПФОБ (серия 5-03) взаимодействия между частицами и световым потоком подчинялись правилу аддитивности даже спустя месяц хранения в незамороженном состоянии.
Фиг. 1. Схема разделения эмульсий ПФС по фракциям в зависимости от способа получения: А - по прототипу (эмульсия содержит свободные ФЛ); Б - по предлагаемому способу эмульсия содержит лишь различные по размерам частицы). 1, 2, 3 - верхняя, основная и нижняя фракции, 1a - свободные ФЛ в верхней фракции
Таким образом, приведенные примеры свидетельствуют о целом комплексе преимуществ описанного состава и способа получения заявленной эмульсии по сравнению с прототипом и аналогами. Это обусловлено благодаря следующим синергически взаимодействующим факторам.
1. ПФД и ПФОБ взяты в качестве основных компонентов потому, что именно эти ПФС проверены по своим биологическим и физико-химическим свойствам как биологически приемлемые, обладающие высокой скоростью выведения из организма, т.е. из клеток ретикуло-эндотелиальной системы, аккумулирующих частицы ПФС.
2. Совместное использование ПФД и ПФОБ в эффективном соотношении формирует смешанную масляную фазу, свойства которой меняются градуально от центра к периферии таким образом, что позволяет использовать в рецептуре мало липофильные и негидрофильные перфторированные третичные амины, которые имеют существенно меньшее давление пара (см. табл. 1) и уменьшают тем самым скорость диффузионного проникновения липофильных молекул ПФД и ПФОБ в водную фазу. Это обстоятельство замедляет скорость основного механизма разрушения эмульсий - «созревание по Оствальду» - и увеличивает стабильность выбранного состава эмульсий ПФС.
3. Введение ПФОБ в состав эмульсий увеличивает их кислородную емкость при том же содержании ПФС и придает им дополнительные рентгеноконтрастные свойства.
4. Наличие в составе композиции ПФОБ/ПФД и смеси перфторированных третичных аминов способствует снижению вязкости конечной формы благодаря более прочному связыванию адсорбционного слоя ПАВ вокруг частиц, что позволяет полностью исключить содержание свободных мицеллярных форм ФЛ в водной фазе эмульсий.
5. Использование наряду с фосфолипидами различных по физико-химическим характеристикам масел способствует формированию более плотного мембраноподобного адсорбционного слоя вокруг частиц при меньшем количестве фосфолипидов, предотвращает образование мицеллярных, не содержащих ПФС структур.
6. Особенности использованной водно-солевой среды обеспечивают сохранение на поверхности частиц отрицательного заряда, что препятствует их слипанию при хранении и транспортировке.
7. Наряду с технологическими приемами, обеспечивающими получение высококалиброванной (с узким распределением размеров частиц) эмульсии, вышеуказанные приемы ослабляют процесс молекулярной перегонки ПФС и также способствуют более высокой сохранности эмульсий.
8. Отсутствие агрегатов частиц и мицеллярных форм ФЛ обеспечивает уменьшение адсорбционных и комплемент активирующих свойств эмульсии при попадании ее в кровоток, что обусловливает низкий уровень реактогенности и способствует повышению биосовместимости эмульсий предложенного состава.
III. Ниже приведены эксперименты биомедицинского использования предложенных эмульсий.
Эксперимент 1. Использование эмульсии ПФС для массивного кровезамещения. Здоровым крысам породы Wistar массой 250-300 г (n=20) под нембуталовым наркозом проводили изоволюмическое кровезамещение эмульсией ПФС, приготовленной согласно примеру 1 (разд. II). Определяли выживаемость крыс после массивного кровезамещения и сохранность митохондрий печени после возмещения кровопотери (метод см. [16]). Для обеспечения поддержания онкотического давления после массивного кровезамещения эмульсию ПФС смешивали перед инфузией животному с 20%-ным раствором человеческого альбумина в соотношении 1 часть раствора 20% альбумина и 6 частей эмульсии ПФС так, чтобы конечная концентрация альбумина составляла 3,5% (с учетом того, что 10 объемных процентов эмульсии составляют ПФС). Во время операции кровезамещения крысы дышали воздухом, обогащенным кислородом с величиной FiO2 0,5, подаваемым под прозрачный колпак из оргстекла, которым накрывалась голова фиксированного на спине животного. Из венозного синуса (правого предсердия) забирали шприцом 3, 5 мл крови и вводили 3,5 мл эмульсии ПФС. Через 10 минут вновь забирали 3,5 мл крови и вводили равное количество эмульсии ПФС. Затем вновь повторяли процедуру кровезамещения так, чтобы конечный объем взятой крови составлял в среднем не менее 3,5% от массы тела животного, например, у животного массой 250 г объем забираемой крови и объем вводимой эмульсии ПФС составляли по 8,8 мл. До и после кровезамещения определяли содержание гемоглобина в периферической крови, парциальное давление кислорода и рН в артериальной и венозной крови. В этой серии экспериментов концентрация гемоглобина снижалась после кровезамещения в среднем 1,9 раза. В контрольной группе (n=20) животным вместо эмульсии ПФС вводили 0,15 М раствор хлорида натрия, содержащий 3,5% альбумина. С помощью ЯМР-спектрометра определяли у животных содержание ПФС в периферической крови. После операции кровезамещения животные в течение 5 дней содержались в специальной камере с подачей воздуха, обогащенного кислородом при FiO2 0,5.
В опытной группе (кровезамещение эмульсией ПФС) все животные выжили и содержание гемоглобина, эритроцитов и лейкоцитов восстановилось в течение 5 дней. В контрольной группе 3 животных погибло. Через 5 суток всех выживших животных забивали под нембуталовым наркозом и из ткани печени выделяли митохондрии. Дыхание митохондрий печени регистрировали полярографически в закрытой термостатируемой ячейке при 27°С. Было обнаружено, что в контрольной группе скорость дыхания в активном состоянии (при синтезе АТФ) и собственно скорость синтеза АТФ при окислении НАД-зависимого субстрата 3-гидрокси-бутирата снижаются в среднем в 1,5 раза, при 20% активации окисления сукцината. Эти данные свидетельствует о перенесенном животными умеренном ишемическом поражении ткани печени. Тогда, как в митохондриях печени, выделенных у животных через 5 дней после возмещения кровопотери эмульсией ПФС, наблюдалась активация всех скоростей дыхания и синтеза АТФ в среднем на 25%, что свидетельствовало о наличии в анамнезе лишь умеренной гипоксии.
Эксперимент 2. Все процедуры проводили также, как в предыдущем примере, но использовали эмульсию, содержащую 20 об.% ПФС, и содержание гемоглобина снижали в 3 раза по сравнению с исходным, замещая в среднем 65-70% объема циркулирующей крови. Объем взятой крови и введенного кровезамещающего состава составлял по 12,25 мл для животного массой 250 г. В результате в опытной группе выжили все животные, в контрольной погибло 5 животных.
Эксперимент 3. Все процедуры проводили так же, как в примере 1, за исключением того, что по 5 животных в каждой группе забивали через 6 часов, 1 сутки и 3 суток после кровезамещения. Выделяли митохондрии из печени и регистрировали параметры фосфорилирующего дыхания. У животных контрольной группы во все указанные сроки наблюдалось резкое подавление скоростей дыхания и фосфорилирования при окислении как НАД-зависимых субстратов, так и сукцината в среднем более чем на 50%, что характерно для тяжелого ишемического повреждения митохондрий. В опытной группе через 6 часов после кровезамещения наблюдалось 40% активация фосфорилирующего дыхания, которая сохранялась через сутки и составляла не более 25% через 3 суток после кровезамещения эмульсией ПФС. Такие сдвиги характерны для сохранных митохондрий печени животных, перенесших гипоксию, но не ишемию.
Эксперимент 4. Сохранение почек у собак, перенесших геморрагический шок. Сохранность почек определялась по восстановлению функции почек после пересадки животному реципиенту с обеими удаленными почками (исследование проводилось по специальному разрешению Минздрава), а также по результатам оценки состояния уровня адениловых нуклеотидов и содержанию лактата и пирувата в ткани почки через час после возмещения кровопотери. Исследование выполнено на 10 собаках, по 5 собак в каждой группе.
Ход исследования. У интубированной собаки массой 20 кг, находящейся под общим ингаляционным наркозом с управляемым дыханием, из бедренной артерии струйно забирается 400 мл крови, что сопровождается резким падением артериального давления (до 50-60 мм рт.ст.), двукратным увеличением частоты сердечных сокращений, увеличением концентрации лактата в плазме крови до 20 мМ. Через час после взятия крови животному вводили кровезаменитель в дозе, превышающей объем кровопотери на 15%: в опытной группе - эмульсию, содержащую 10 об.% ПФС по примеру 1 с добавлением альбумина до 3,5% (как в примере 14), в контрольной группе вводили плазмоэкспандер полиглюкин. Еще через час животных забивали и забирали обе почки: одну для пересадки через час собаке реципиенту, другую для исследования параметров энергетического обмена ткани почки.
В контрольной группе отношение ATP/ADP снижалось в 3 раза, а величина энергетического заряда ([ATP]+1/2[ADP])/([ATP]+[ADP]+[AMP]) - до 0,45. В опытной группе (кровезамещение эмульсией ПФС) отношение ATP/ADP снижалось не более, чем в 2 раза, а величина энергетического заряда уменьшалась до 0,65-0,70. Отношение лактат/пируват в ткани почки у животных контрольной группы возрастало до 25-30, тогда как в опытной группе не превышало 6.
Во всех случаях при пересадке собакам-реципиентам почек, взятых у собак, леченных с помощью эмульсии ПФС, сразу же после подключения почек к кровотоку начиналось выделение мочи. В контрольной группе в 2 случаях из 5 после пересадки наблюдалось развитие реперфузионного повреждения с резким отеком ткани и полным прекращением кровотока (почки погибали). В 3 случаях в контрольной группе кровоток в пересаженной почке восстанавливался, но выделение мочи начиналось лишь через несколько часов.
Представленные данные свидетельствуют о том, что лечение геморрагического шока у собак с использованием полученной эмульсии ПФС обеспечивает существенно лучшую защиту органов от ишемического и последующего реперфузионного повреждения.
Эксперимент 5. Использование эмульсии ПФС, полученной по примеру 2, для сохранения перфузируемого сердца кролика. Непосредственно перед использованием (за 1-2 час) эмульсия ПФС смешивалась с изотоническим раствором Кребса-Хенселяйта в соотношении 2:1:400 мл эмульсии и 200 мл солевого раствора. К 600 мл полученной смеси добавляли 80 мл 20%-ного раствора сывороточного альбумина. Контрольный состав для сравнительных исследований содержал 600 мл солевого раствора с добавлением 7,2 г маннитола и 80 мл 20%-ного раствора альбумина. Эти составы использовали в качестве перфузионной среды для сохранения сердца кролика. Перфузию по Лангендорфу осуществляли в рециркуляторном режиме при температуре 37°С. Регистрировали время сохранения частоты и амплитуды сокращений сердца. В контроле и в опыте было взято по 8 сердец. При использовании перфузата на основе эмульсии ПФОС сократительная способность изолированного сердца кролика сохранялась в течение не менее 6-8 часов, тогда как при перфузии контрольным составом через 2 часа наблюдалось резкое снижение частоты и амплитуды сокращений вплоть до полной остановки сердца.
В заключение следует отметить, что преимущества перед прототипом и аналогами предложенной эмульсии заключаются в следующем.
Представленные рецептура и способ получения эмульсий ПФС обеспечивают получение тонкодисперсной, калиброванной эмульсии с заданным средним размером частиц в диапазоне от 0,06 до 0,195 мкм, содержащей от 2 до 40 об.% ПФС, стабилизированных фосфолипидной дисперсией в биологически приемлемом водно-солевом составе. Показана высокая сохранность дисперсности и «микроструктуры» эмульсий ПФС при хранении до 18 месяцев в не замороженном состоянии, что позволяет сохранять высокую биосовместимость, выражающуюся в низком уровне реактогенности. Разработанные эмульсии ПФС пригодны для биомедицинского использования, в частности, для возмещения массивных кровопотерь, лечения геморрагического шока, предотвращения развития реперфузионных постишемических повреждений, подготовки органов к трансплантации, перфузионного сохранения изолированных органов, обладают достаточно выраженными кислородтранспортными и реологическими свойствами, обеспечивающими предотвращение и ликвидацию ишемических повреждений кислородзависимых функций митохондрий и поддержание аэробного энергетического обмена в тканях в условиях кровезамещений и лечения геморрагического шока.
Источники информации
1. Журн. Всесоюзного химического общества им. Д.И.Менделеева, 1985, т.30, №4, с.387-394.
2. J.G. Riess et al.// Физиологическая активность фторсодержащих соединений (эксперимент и клиника): Сборник науч. труд. - Пущино, 1995. - с.73-90.
3. М.В.Беркос, Автореф. диссертации. ... канд. мед. наук, Ленинград, 1991, 24 с.
4. J.G. Riess // Chem. Rev., 2001, v.101, №9, с.2797-2914.
5. Патент РФ 2162692, кл.7 А 61 К 31/02, 9/10, 1999.
6. Патент РФ 2199311, кл. 7 А 61 9/107, 31/02, 2001.
7. Патент US №3778381, 1973.
8. Патент US №6113919, 2000.
9. Патент US №4866096; А 61 К 31/025, 1989.
10. Патент US № 5374624, А 61 К 31/025, 1994.
11. Патент РФ №2088217,6 А 61 К 9/10, 31/02, 1997.
12. Биофизика, 1988, т.33, №1, с.126-129.
13. И.Н.Кузнецова. Автореф. диссертации. ... докт. биол. наук, С-Пб., 1999 г., 38 с.
14. Химико-фармацевтический журнал, 1987, №12, с.1498-1503.
15. Журнал физической химии, 1993, т. 67, №9, с.1884-1888.
16. Е.И.Маевский. Автореф. диссертации. ... докт. мед. наук, Москва, 1998 г., 36 с.
Реферат
Эмульсия содержит быстровыводящиеся перфторорганические соединения перфтордекалин и перфтороктилбромид, перфторорганическую добавку и фосфолипиды в виде дисперсии, приготовленной гомогенизацией под давлением не менее 100 атм в водно-солевой среде. Перфторорганическая добавка представляет собой смесь перфорированных третичных аминов - перфтортрипропиламина и его копродуктов: цис- и трансизомеров перфтор-1-пропил-3, 4-диметилпирролидона и перфтор-1-пропил-4-метилпиперидина. Способ получения эмульсии включает получение дисперсии фосфолипидов гомогенизацией под давлением не менее 100 атм в водно-солевой среде с последующей тепловой стерилизацией, гомогенизацию под давлением указанных перфторорганических соединений в дисперсии фосфолипидов и тепловую стерилизацию готовой эмульсии. Эмульсия предназначена для лечения кровопотерь, гипоксических и ишемических состояний, улучшения доставки кислорода кровью, сохранения изолированных перфузируемых органов и тканей. В соответствии с настоящим изобретением повышена стабильность эмульсии и улучшены ее качества. Срок хранения эмульсии в незамороженном виде при +4°С составляет не менее 12 месяцев, при этом сохраняется биосовместимость эмульсии с биологической средой (кровью, плазмой или сывороткой). 2 с. и 18 з.п. ф-лы, 21 табл., 1 ил.
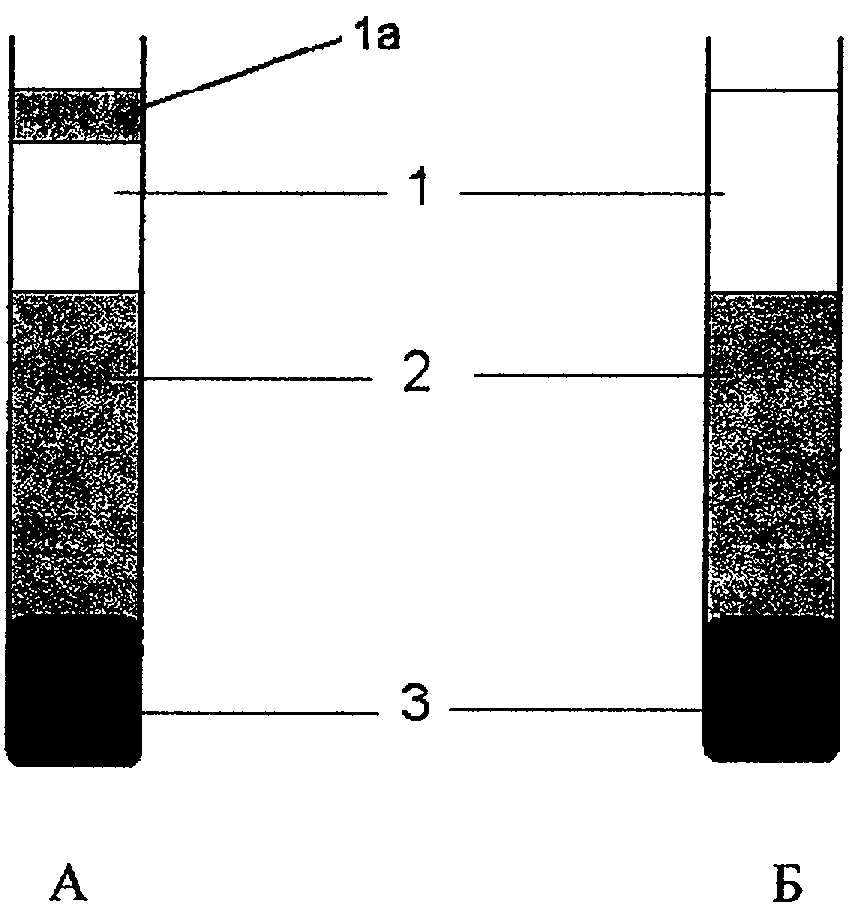


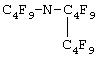

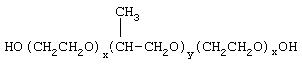




Комментарии