Фотоуправляемые фотохромные электролюминесцирующие и электропроводящие полимеры для фотоники - RU2345998C2
Код документа: RU2345998C2
Чертежи
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым фотохромным мономерам, новым фотохромным полимерам, способам их получения для создания новых информационных технологий, фотоуправляемых электролюминесцирующих и электропроводящих устройств, в том числе дисплеев, фотопереключаемых полимерных светодиодов.
Уровень техники
В настоящее время актуальной задачей в области информационных технологий является создание гибких и рельефных дисплеев, а также светоизлучающих диодов на основе органических электролюминесцирующих и электропроводящих полимеров с использованием полиазометинов или конденсационных азотсодержащих гетероцепных полимеров. Эти полимерные слои могут служить аналогами изобретения.
Недостатком таких полимерных материалов является то, что их электролюминесценция и электропроводность не управляются светом.
В настоящее время было обнаружено, что придание новых свойств этим полимеров позволяет расширить их функциональные возможности и области практического использования в фотонике.
Задача настоящего изобретения состоит в синтезе фотохромных электролюминесцирующих и электропроводящих полимеров, свойства которых за счет введения в их структуру фотохромных фрагментов становятся обратимо фотоуправляемыми. Следовательно, такие полимеры обладают расширенными функциональными возможностями. Фотохромные полимеры этого типа пригодны для использования в разработке фотохромных материалов для различных областей фотоники ("Applied Photochromic Polymer Systems". McArdle С. В., Ed. Blackie, Glasgow, 1992; Barachevsky V.A. «Photochromic organic media: state-of-the-art and future». Proc. SPIE, vol.2968, 77-86, 1997). Применение предлагаемых систем на основе электропроводящих и электролюминесцирующих полимеров с фотохромными фрагментами открывает перспективы разработки дисплеев различного типа с двойным фото- и электроуправлением. Термически необратимые фотохромные превращения, характерные для соединений из класса дигетарилэтенов, успешно используются для создания фотохромных регистрирующих сред, обеспечивающих разработку трехмерной побитовой (bitwise) оперативной оптической памяти (М. Irie. "Dihetarylethenes for Memories and Switches". Chem. Reviews, vol.100, 1685-1716, 2000). Включение фотохромных фрагментов в полимерную цепь позволяет усовершенствовать разработанные фотохромные регистрирующие среды за счет увеличения концентрации фотохромных молекул в полимерной среде и резкого снижения их диффузионного перемещения. Результатом такого усовершенствования является значительное повышение информационной емкости. Отсутствие взаимного термического превращения двух форм молекул дигетарилэтенов, используемых в качестве фотохромных фрагментов полимеров, расширяет область применения реверсивных фотохромных фотопереключателей излучения (J.A.Delaire, К.Nakatani. "Linear and Nonlinear Optical Properties of Photochromic Molecules and Materials". Chem. Reviews, vol.100, 1817-1845, 2000).
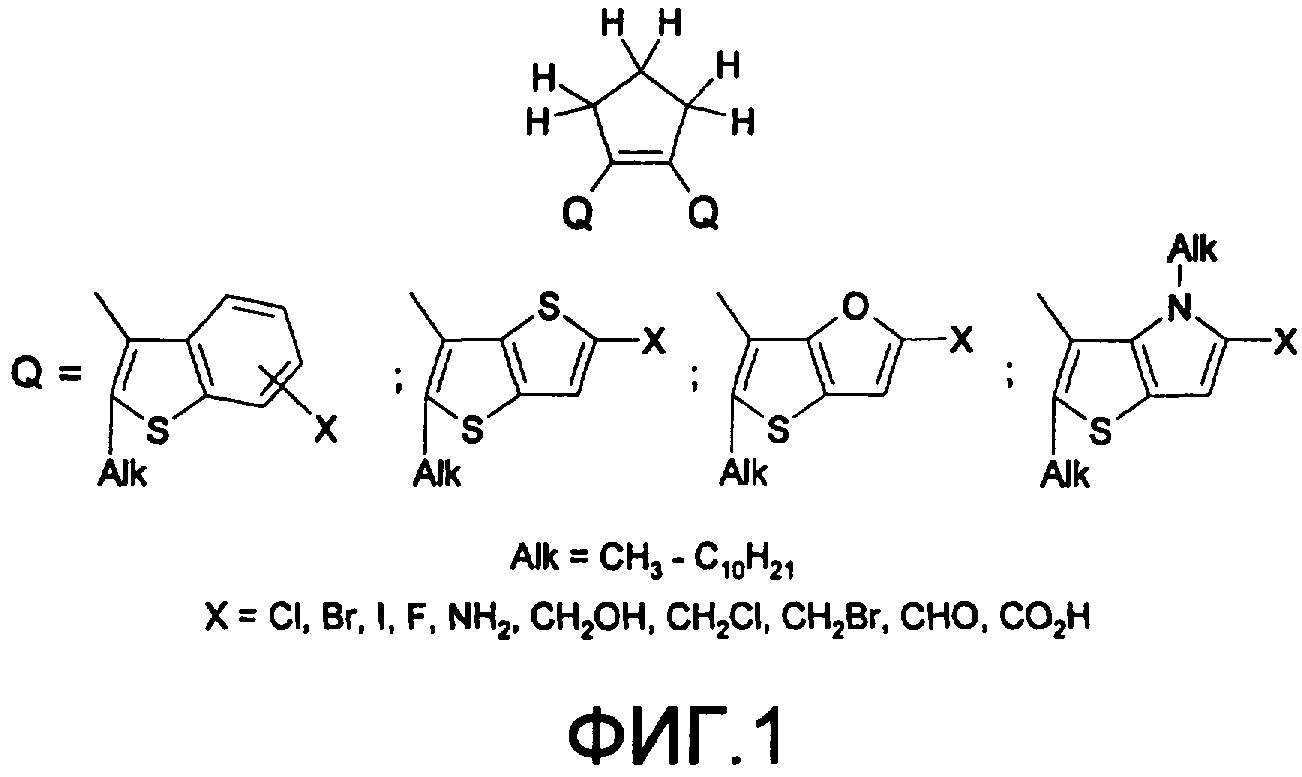
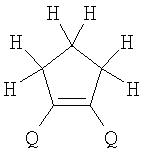
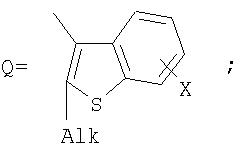
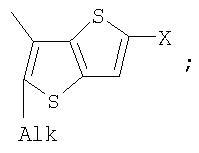
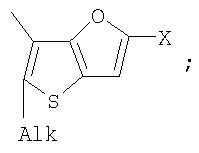
Поставленная задача решается за счет того, что в качестве фотохромных мономеров для получения фотоуправляемых эдектролюминесцирующих и электропроводящих полимеров используются следующие функциональные соединения из класса дигетарилэтенов (1):
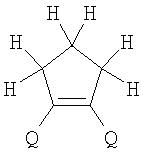
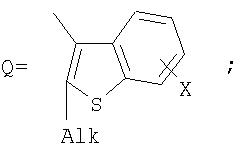
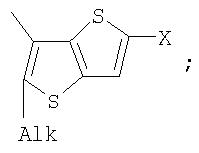
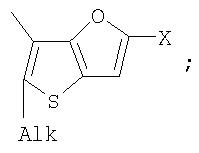
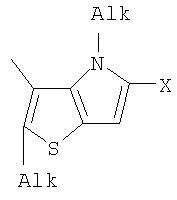
Alk=СН3-С10Н21
Х=Cl, Br, I, F, NH2, СН2ОН, CH2Cl, CH2Br, CHO, СО2Н
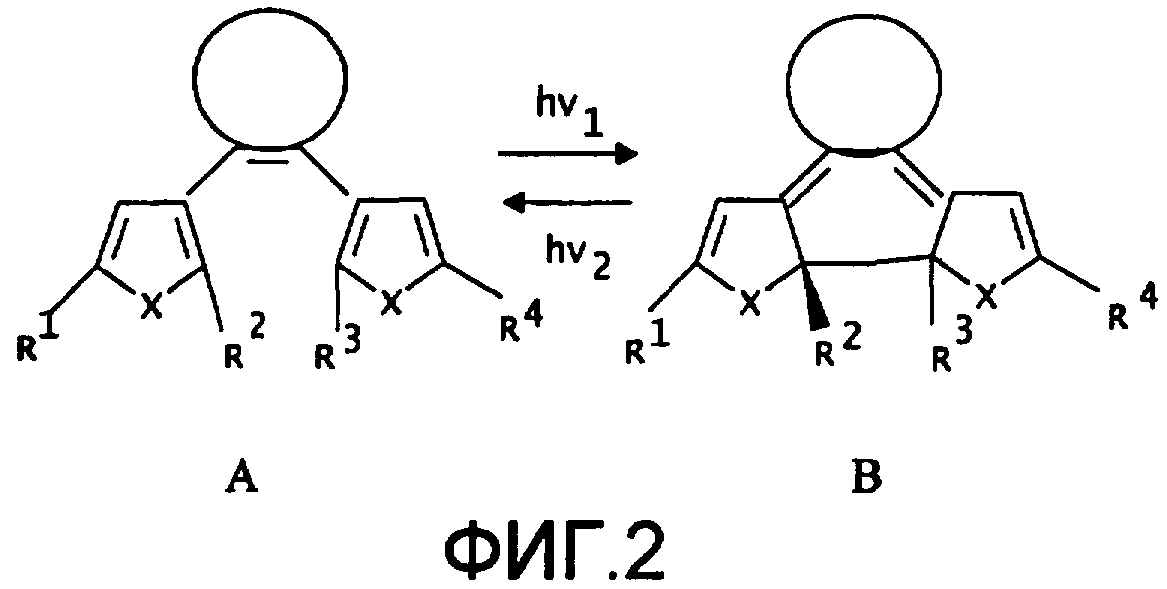
Фотохромизм диарилэтенов (ДАЭ) состоит в обратимой фотоциклизации, т.е. в фотоиндуцированном переходе из открытой формы (ОФ) А в циклическую форму (ЦФ) В
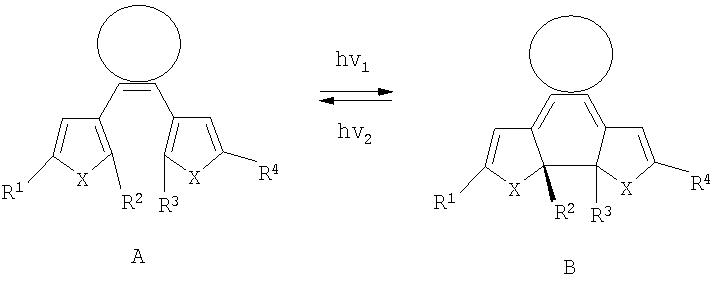
Поскольку при этом происходит изменение сопряженной системы связи в фотохромных молекулах, то они позволяют управлять указанными свойствами полимеров.
Настоящее изобретение направлено на новые функциональные дигетарилэтены (1), на способ их получения, на фотохромные полиазометины, фотохромные кардовые полиэометины и способы их получения, на использование в качестве фотохромных фрагментов новых функциональных дигетарилэтенов (1). Использование этих фотохромных соединений обеспечивает полиазометинам на их основе обратимое фотоуправление электролюминесцентными и электропроводящими свойствами за счет фотохромных превращений полимерных фрагментов, изменяющих степень электронного сопряжения.
Способ получения фотохромных мономеров включает ацилирование производных бензотиофена (а также пироллотиофена, тиенотиофена, фуранотиофена) дихлорангидридом глутаровой кислоты в хлористом метилене в присутствии хлористого алюминия и последующую восстановительную циклизацию полученных дикетонов под действием TiCl4, Zn в ТГФ в присутствии пиридина, с дальнейшим формилированием продуктов реакции дихлорметиловым эфиром в нитробензоле в присутствии хлористого алюминия.
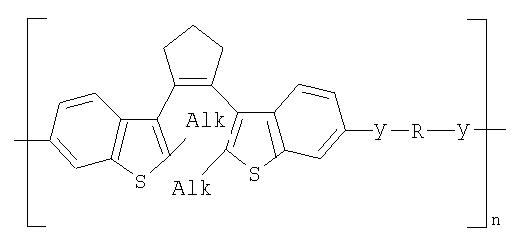
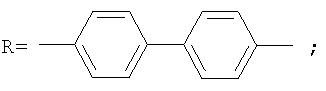
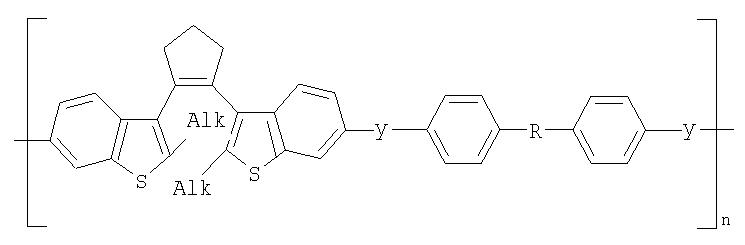
Фотохромные полиазометины на основе фотохромных мономеров (1) имеют следующую общую структурную формулу и молекулярную массу от 25000 до 50000:
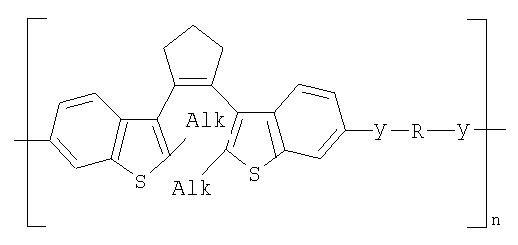
где Alk=СН3-C10H21
y=-C=N-; -N=C-
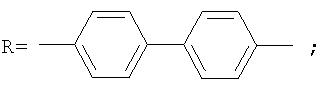
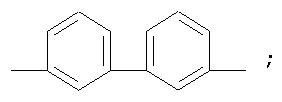
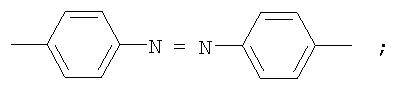
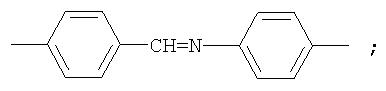
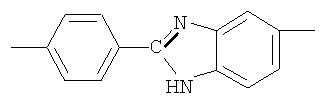
где n=50-100.
Способ их получения включает поликонденсацию в растворе мономеров по п.1 с ароматическими диаминами или диальдегидами при температуре примерно от 20 до 200°С.
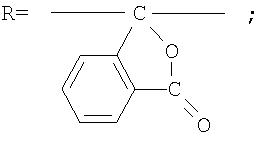
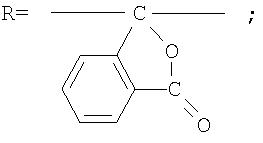
Под кардовыми полимерами понимают полимеры, центральный углеродный атом которых входит в состав объемной боковой циклической (кардовой) группировки.
Фотохромные кардовые полиазометины в соответствии с настоящим изобретением имеют молекулярную массу от 30000 до 50000 и общую структурную формулу:
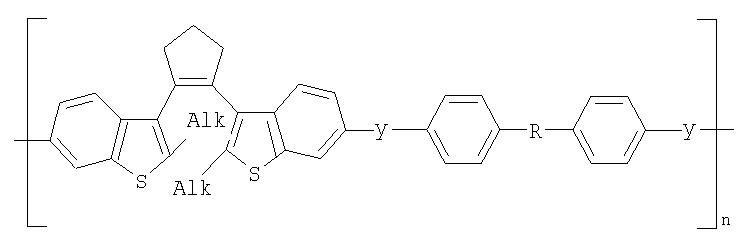
где Alk=СН3-C10H21
y=-C=N-; -N=C-
где n=50-100.
Способ их получения включает поликонденсацию в растворе фотохромного мономера (1) с кардовыми ароматическими диаминами или диальдегидами при температуре примерно 20-200°С.
Анализ известной научно-технической и патентной литературы показал, что полной совокупности признаков, характеризующих данные технические решения, ранее не известно, т.е. заявляемые решения отвечают критерию "новизна".
Сущность изобретения поясняется примерами и чертежами.
На фиг.1 представлены структурные формулы фотохромных мономеров, использованных для получения фотохромных сополимеров и полимеров.
На фиг.2 приведена обобщенная схема фотохромных превращений дигетарилэтенов.
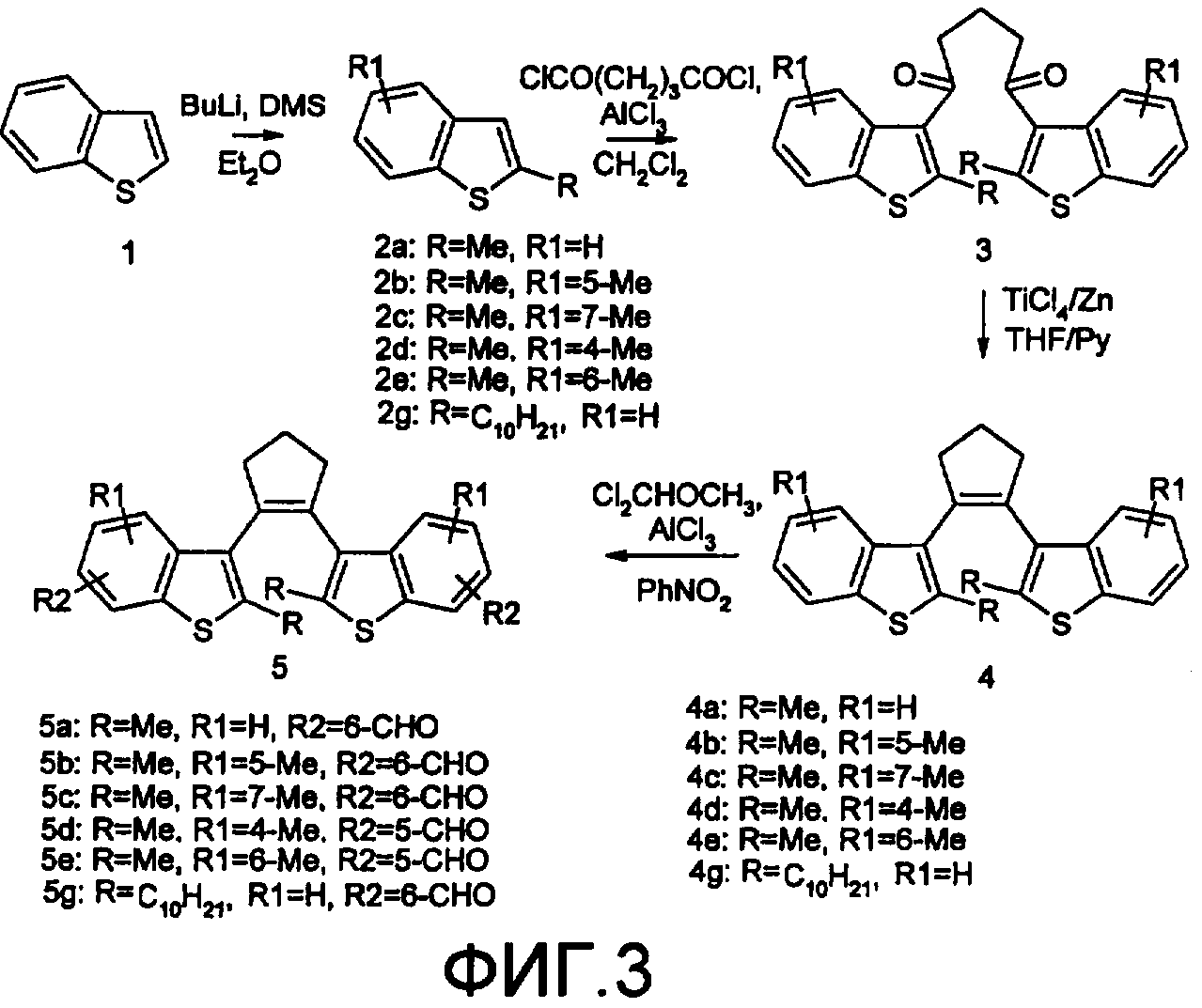
На фиг.3 представлена схема получения фотохромного мономера 5 из класса заявляемых фотохромных функциональных соединений.
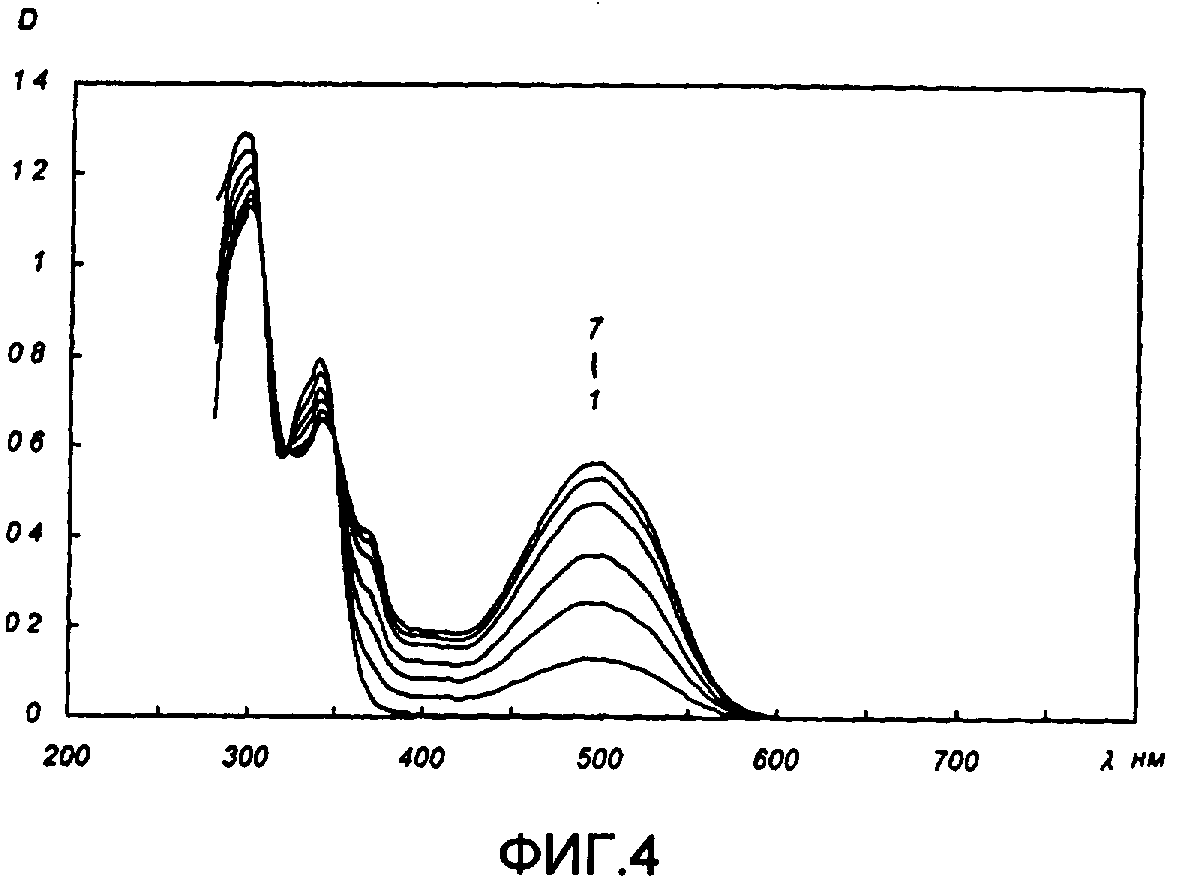
На фиг.4 приведены спектры поглощения исходной открытой А (кривая 1) и фотоиндуцированной В (кривые 2-7) фотохромного мономера 5 в толуоле до (1) и после облучения УФ светом по мере увеличения экспозиции соответственно.
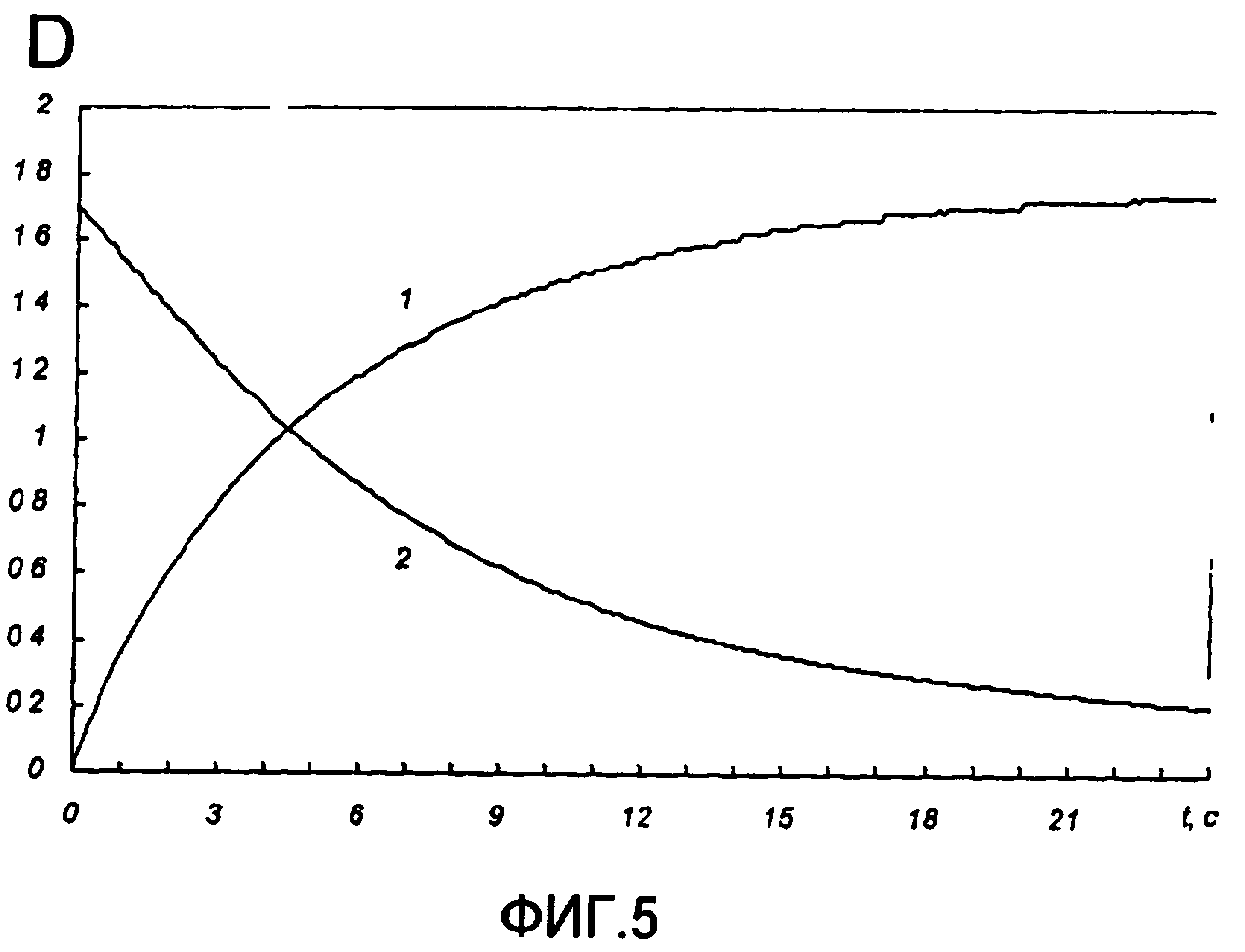
На фиг.5 представлены кинетические кривые (D(t) - оптическая плотность) фотоокрашивания УФ светом (кривая 1) и фотообесцвечивания видимым светом (кривая 2) раствора фотохромного мономера 5 в толуоле на длине волны максимума полосы поглощения циклической формы В.
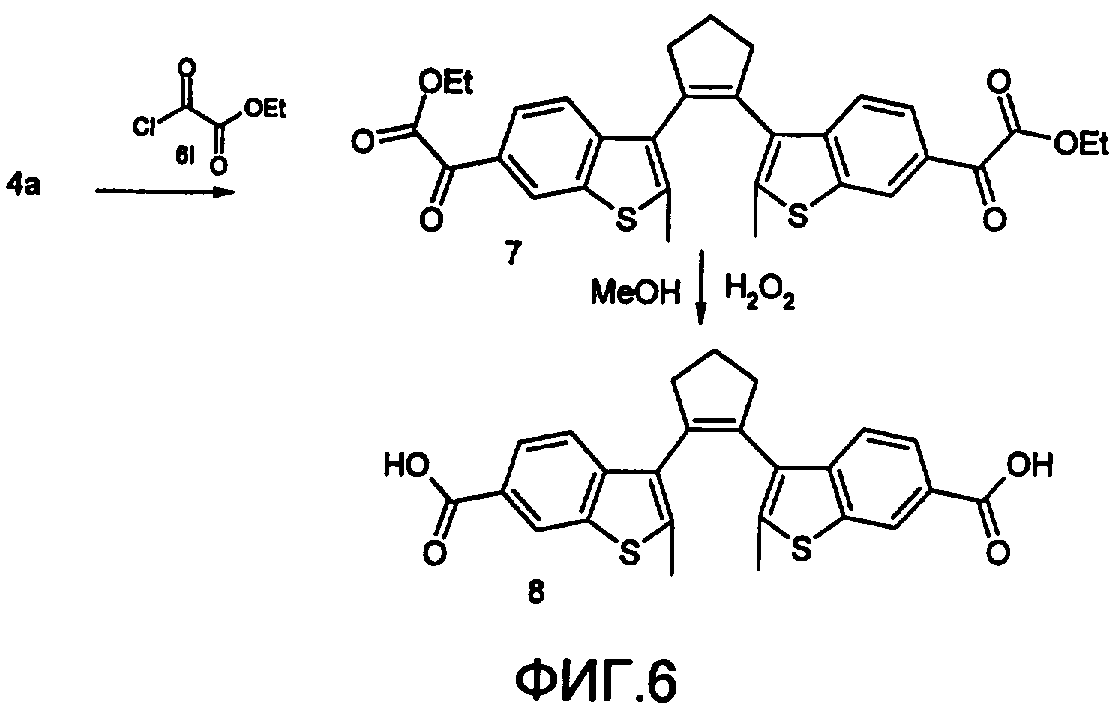
На фиг.6 представлена схема получения фотохромного мономера 8 из класса заявляемых фотохромных функциональных соединений.
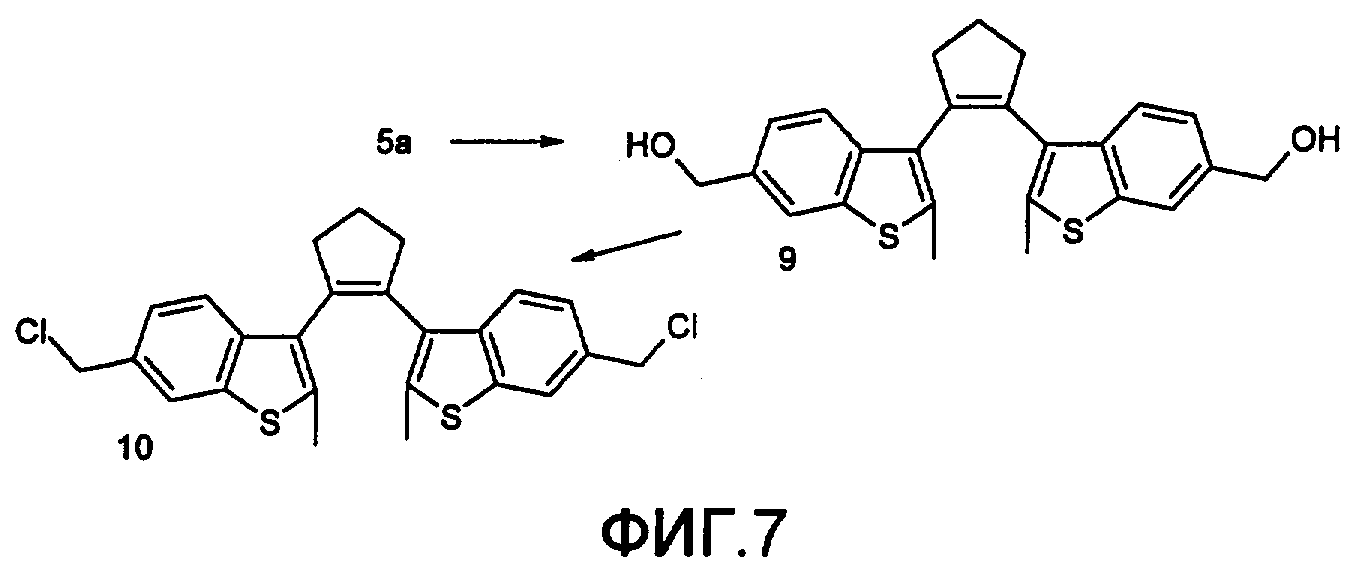
На фиг.7 представлена схема получения фотохромного мономера 10 из класса заявляемых фотохромных функциональных соединений.
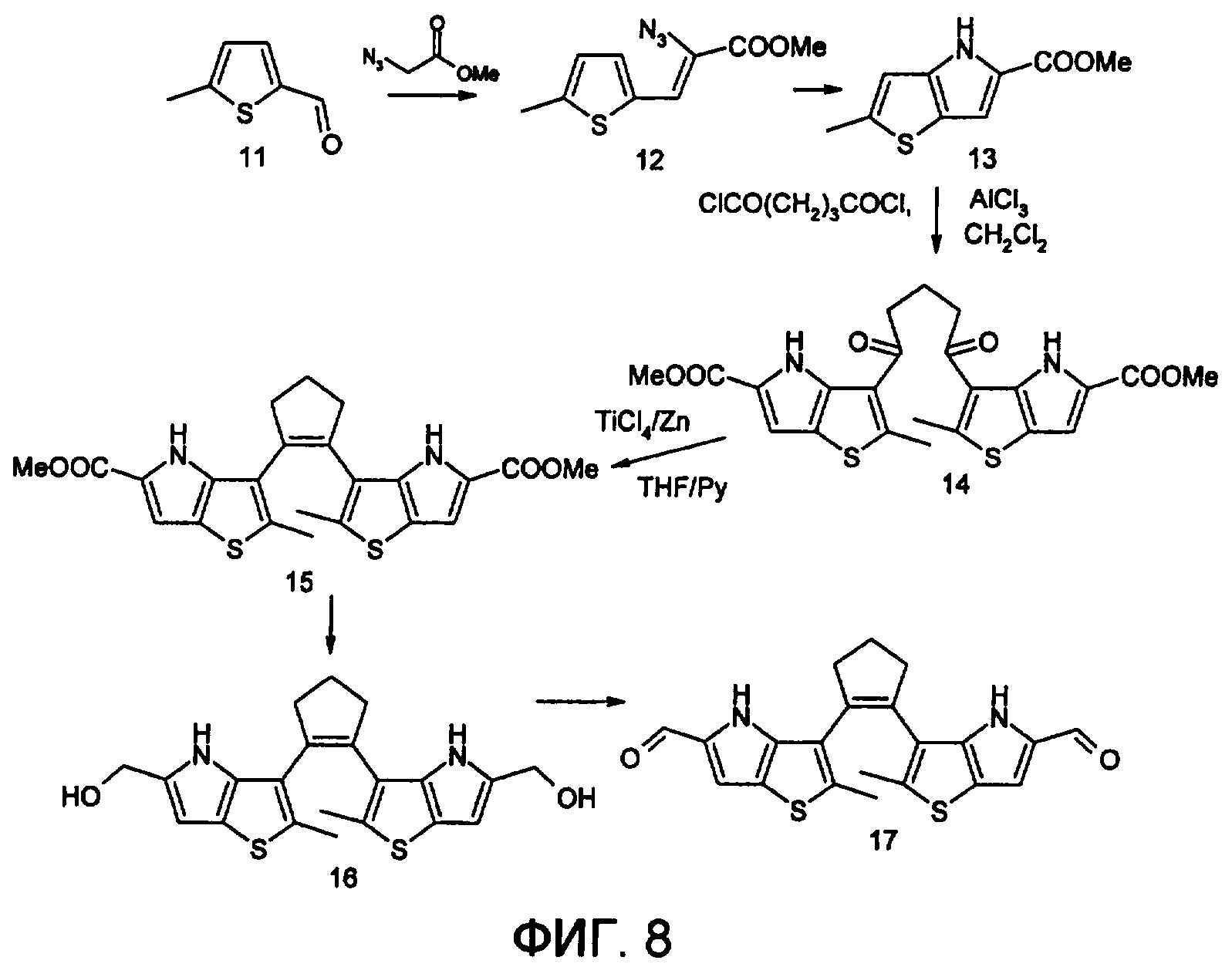
На фиг.8 представлена схема получения фотохромного мономера 17 из класса заявляемых фотохромных функциональных соединений.
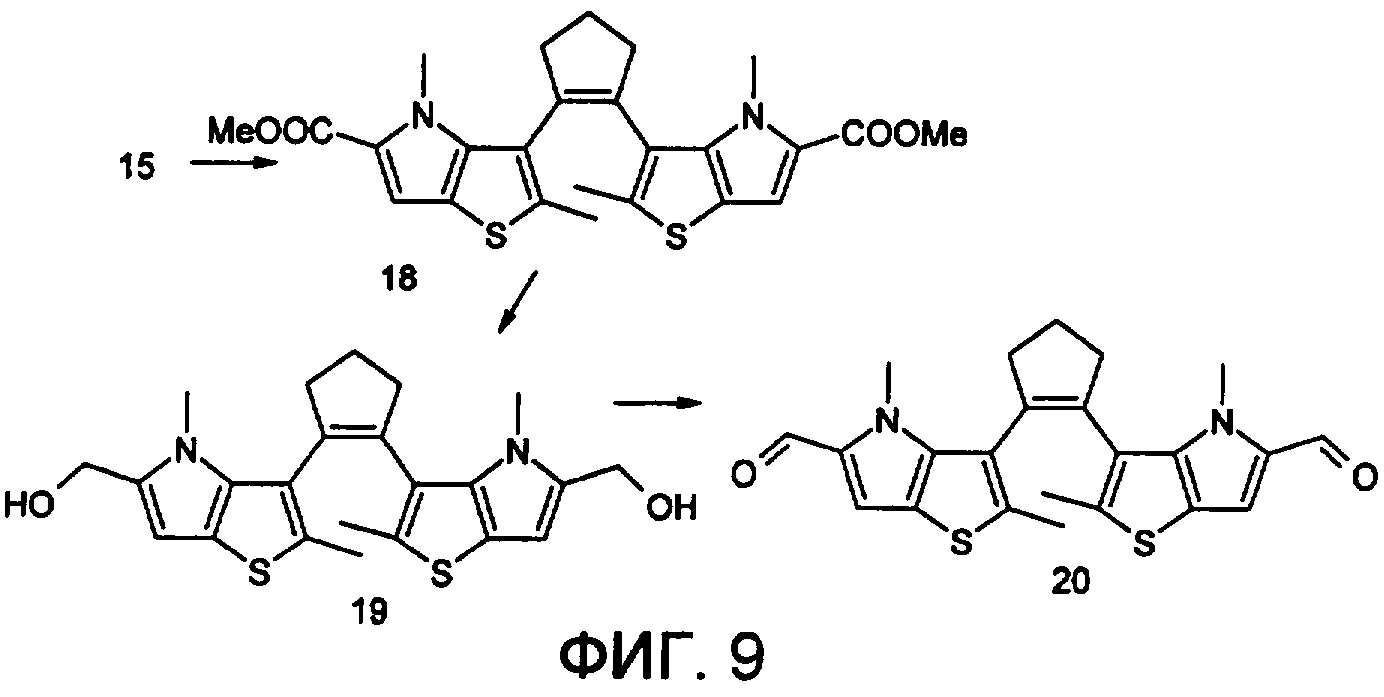
На фиг.9 представлена схема получения фотохромного мономера 20 из класса заявляемых фотохромных функциональных соединений.
На фиг.10 представлена схема получения фотохромного мономера 25 из класса заявляемых фотохромных функциональных соединений.
На фиг.11 представлена схема получения фотохромного мономера 31 из класса заявляемых фотохромных функциональных соединений.
На фиг.12 представлена схема получения полиазометина III.
На фиг.13 приведены спектры поглощения исходной открытой А формы (кривая 1) и фотоиндуцированной В (кривая 2) формы после УФ облучения через стеклянный светофильтр УФС-2, а также после облучения видимым светом через стеклянный светофильтр ЖС-12 (кривая 3) для пленки фотохромного полимера III в поликарбонате (4 вес.% от веса сухого полимера).
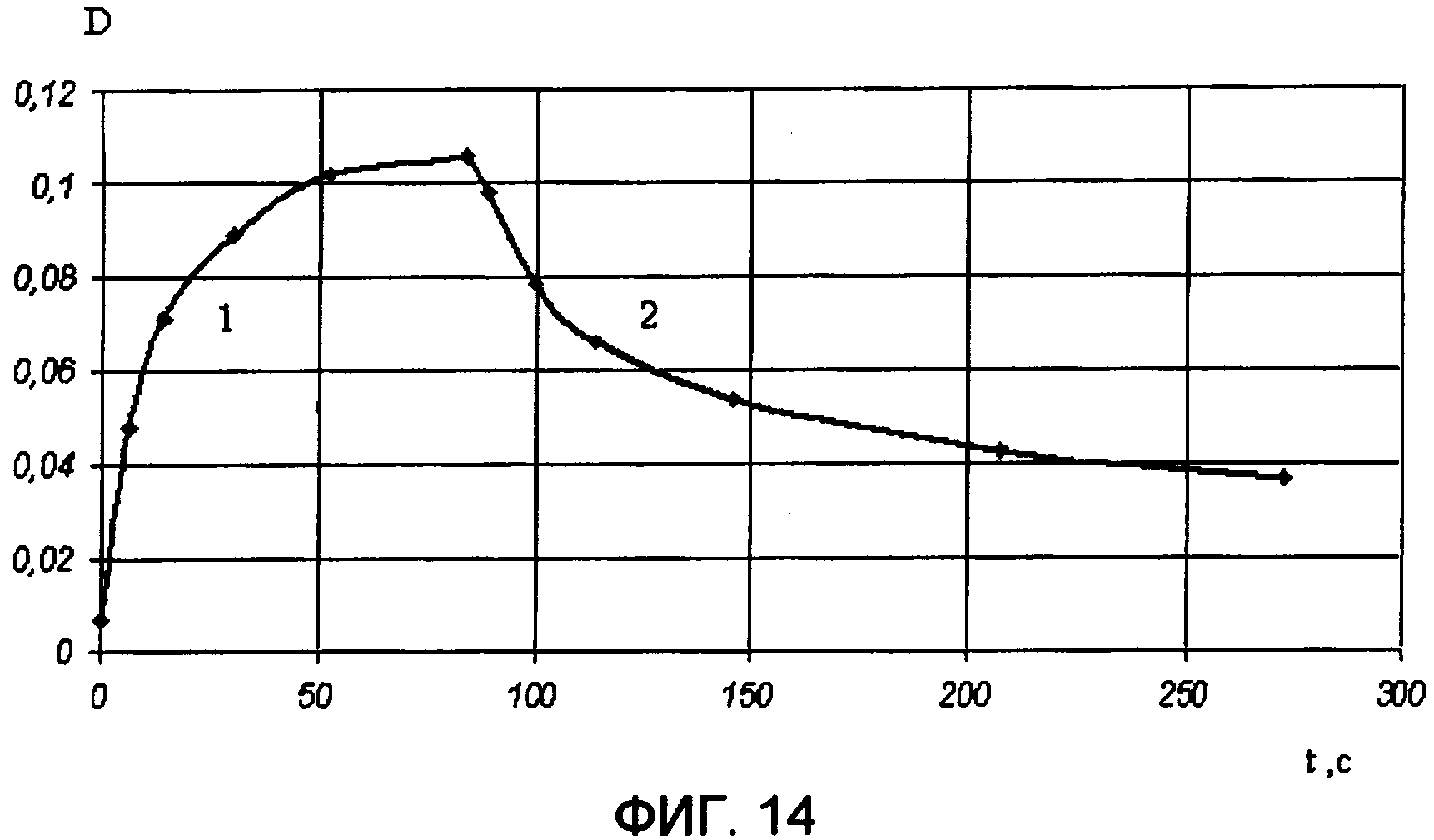
На фиг.14 представлены кинетические кривые фотоокрашивания УФ светом через стеклянный светофильтр УФС-2 (кривая 1) и фотообесцвечивания видимым светом через стеклянный светофильтр ЖС-12 (кривая 2) для пленки фотохромного полимера III в поликарбонате (4 вес.% от веса сухого полимера) на длине волны максимума полосы поглощения циклической формы В.
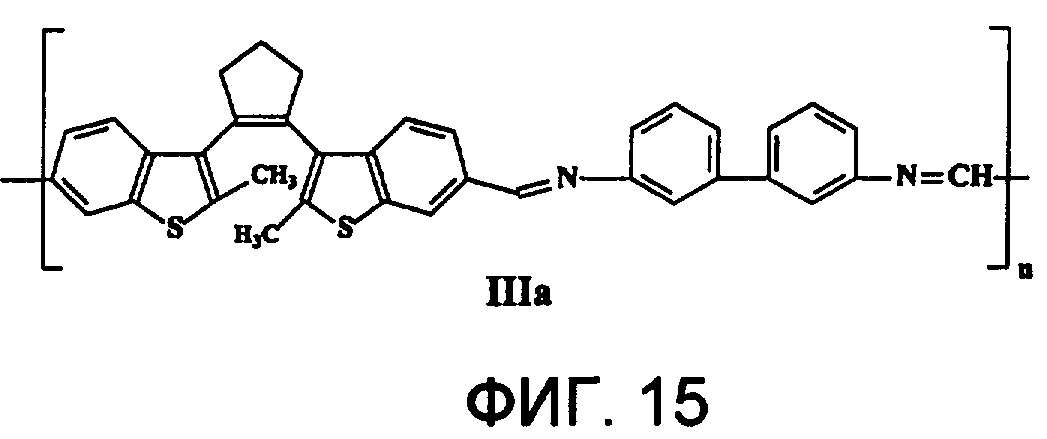
На фиг.15 представлена структура фотохромного полимера IIIa.
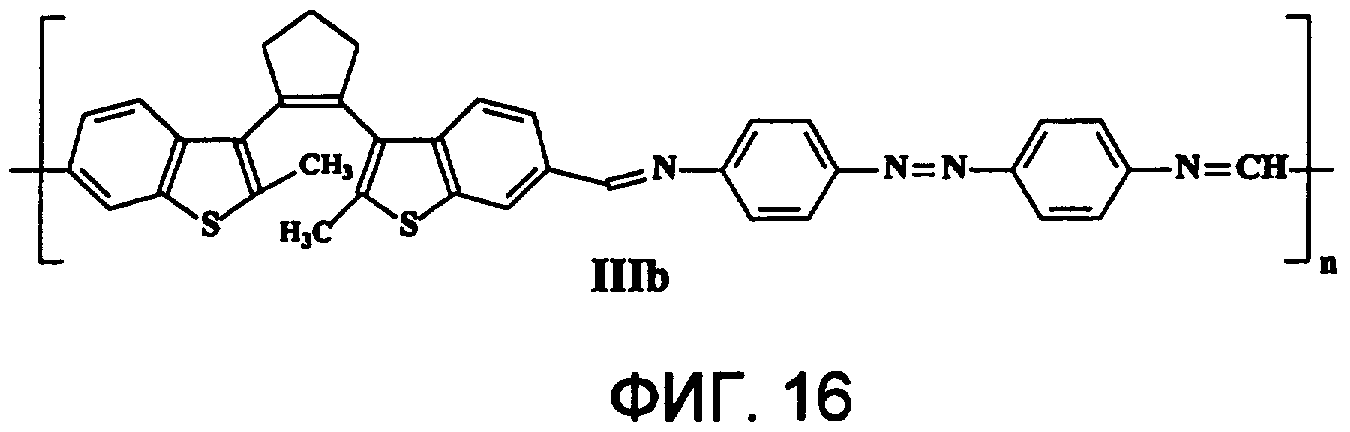
На фиг.16 представлена структура фотохромного полимера IIIb.
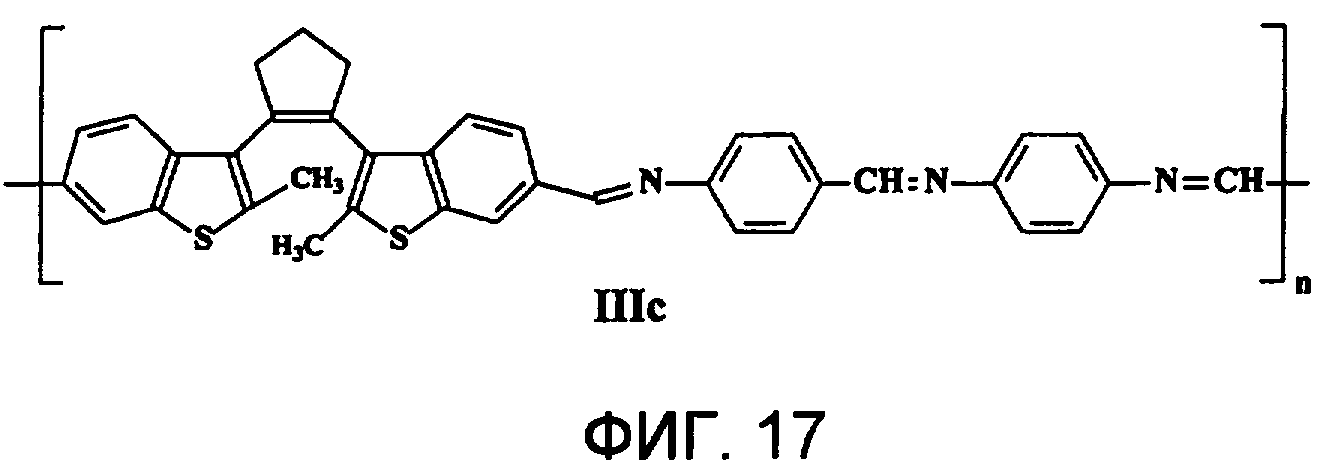
На фиг.17 представлена структура фотохромного полимера IIIc.
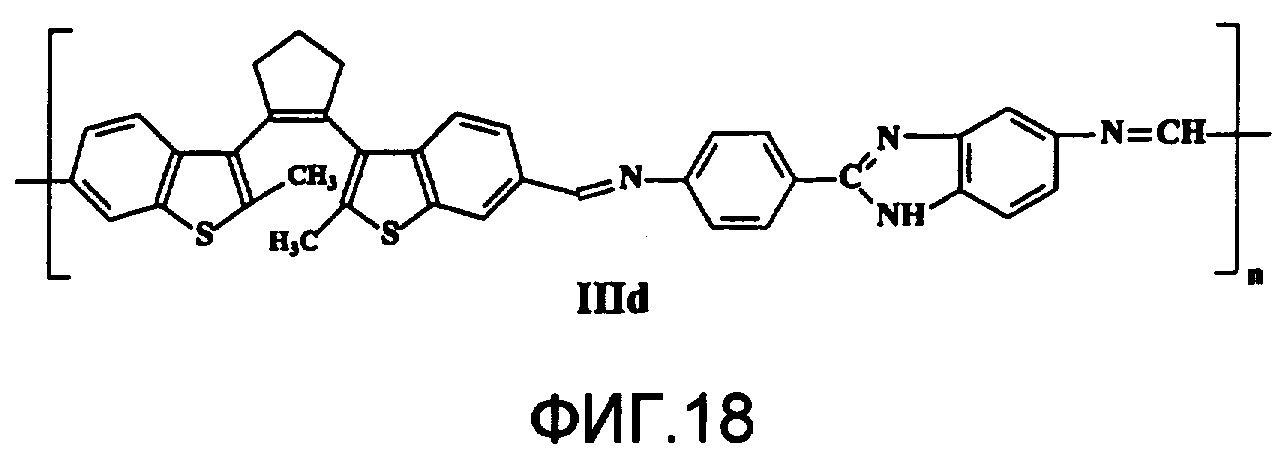
На фиг.18 представлена структура фотохромного полимера IIId.
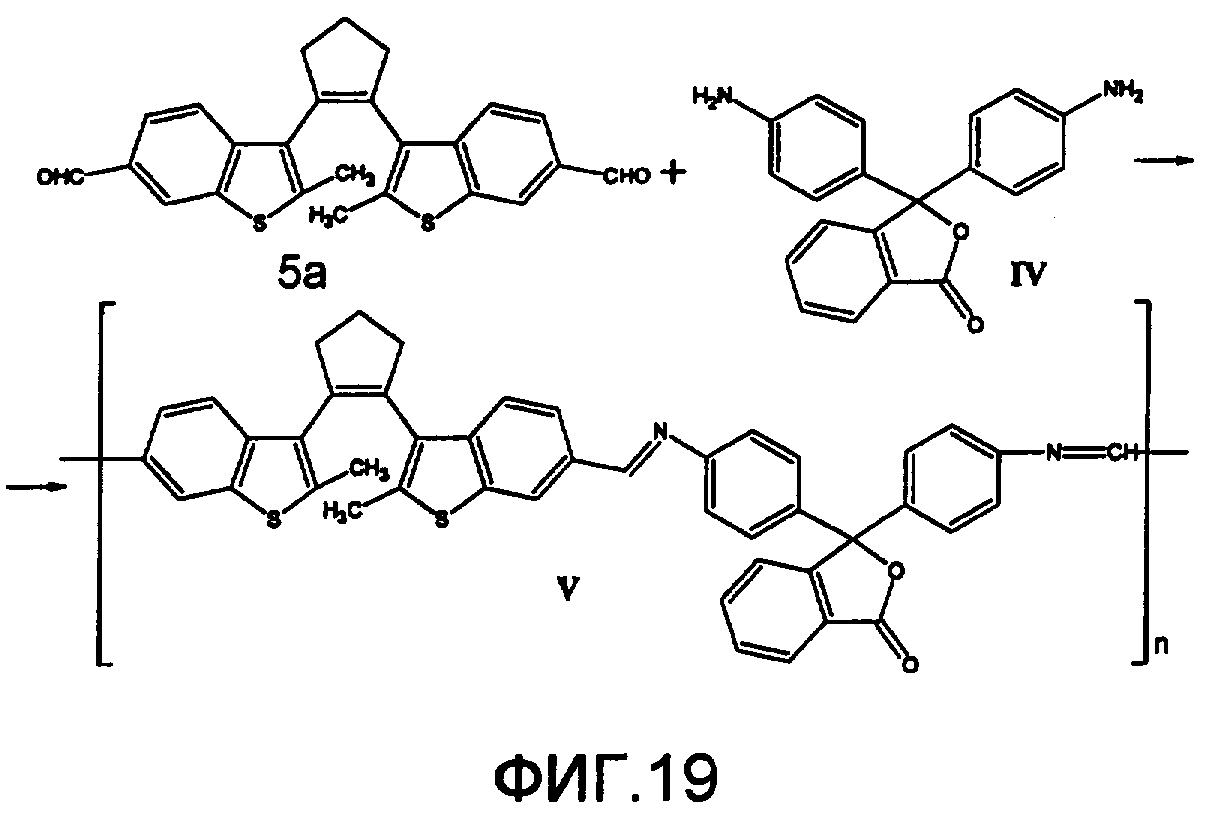
На фиг.19 схема синтеза фотохромного полимера V.
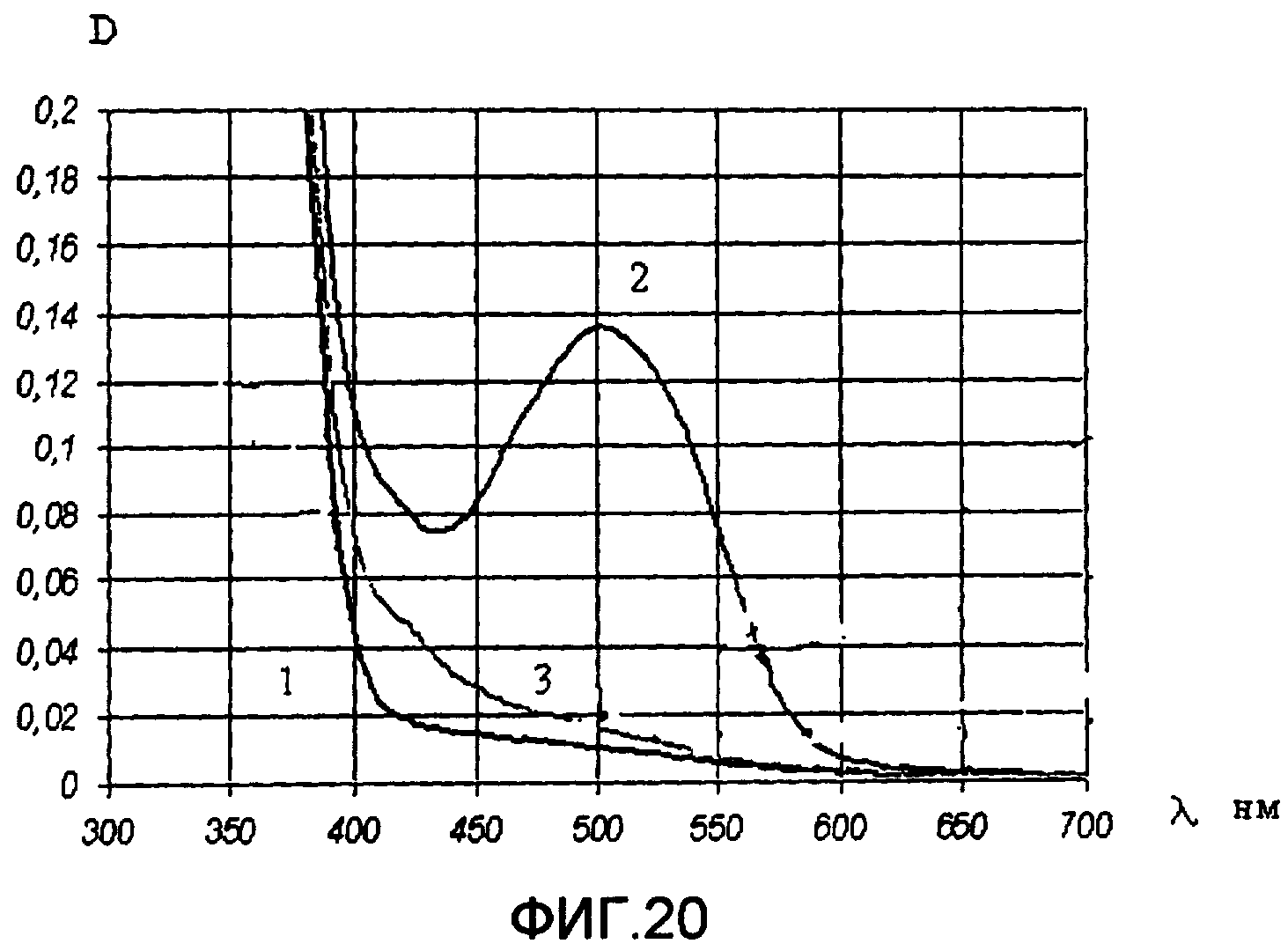
На фиг.20 приведены спектры поглощения исходной открытой А формы (кривая 1) и фотоиндуцированной В формы после облучения УФ светом через стеклянный светофильтр УФС-2 (кривая 2), а также после облучения видимым светом через стеклянный светофильтр ЖС-12 (кривая 3) для пленки фотохромного полимера V в поликарбонате (4 вес.% от веса сухого полимера).
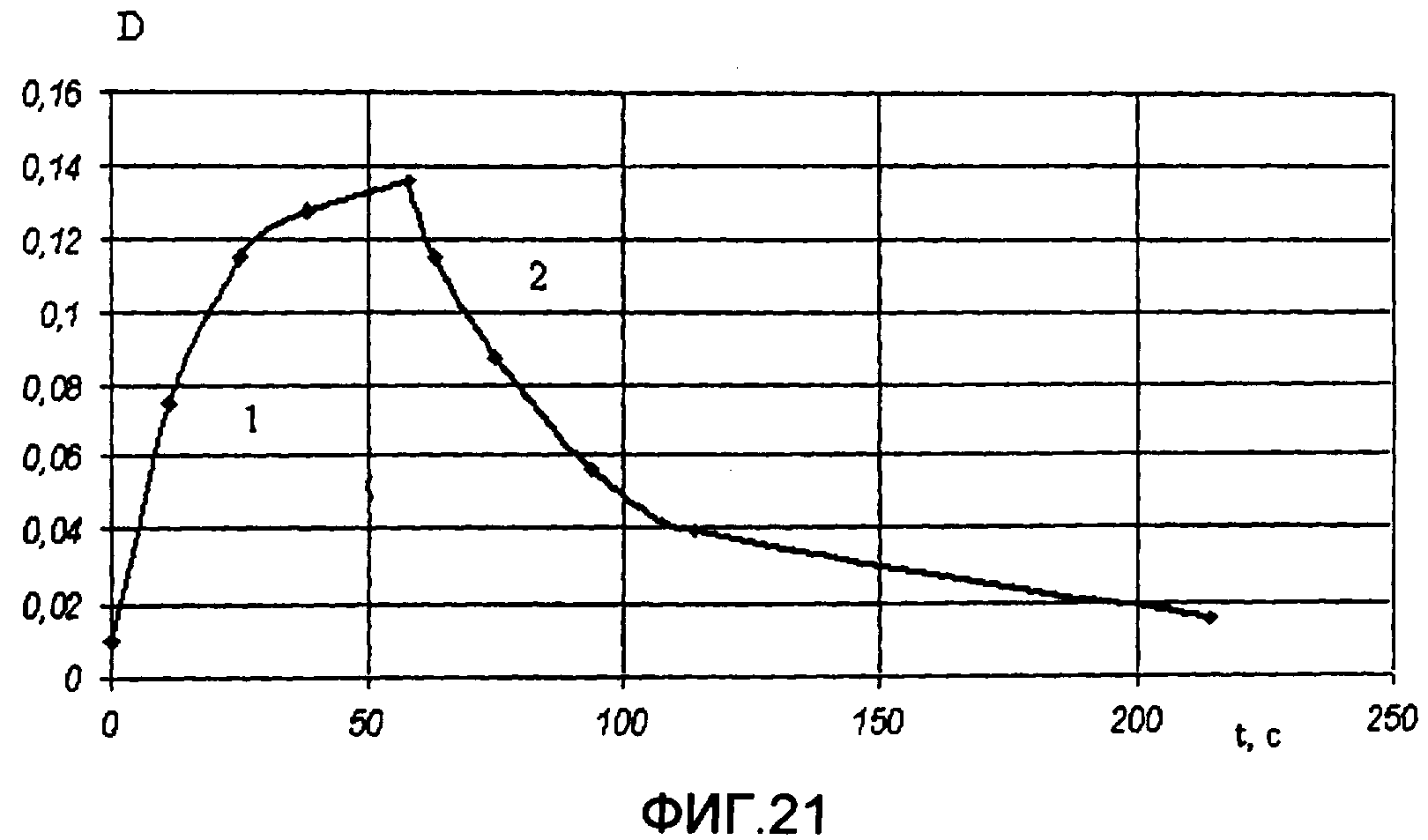
На фиг.21 представлены кинетические кривые фотоокрашивания УФ светом через стеклянный светофильтр УФС-2 (кривая 1) и фотообесцвечивания видимым светом через стеклянный светофильтр ЖС-12 (кривая 2) для пленки фотохромного полимера V в поликарбонате (4 вес.% от веса сухого полимера) на длине волны максимума полосы поглощения циклической формы В.
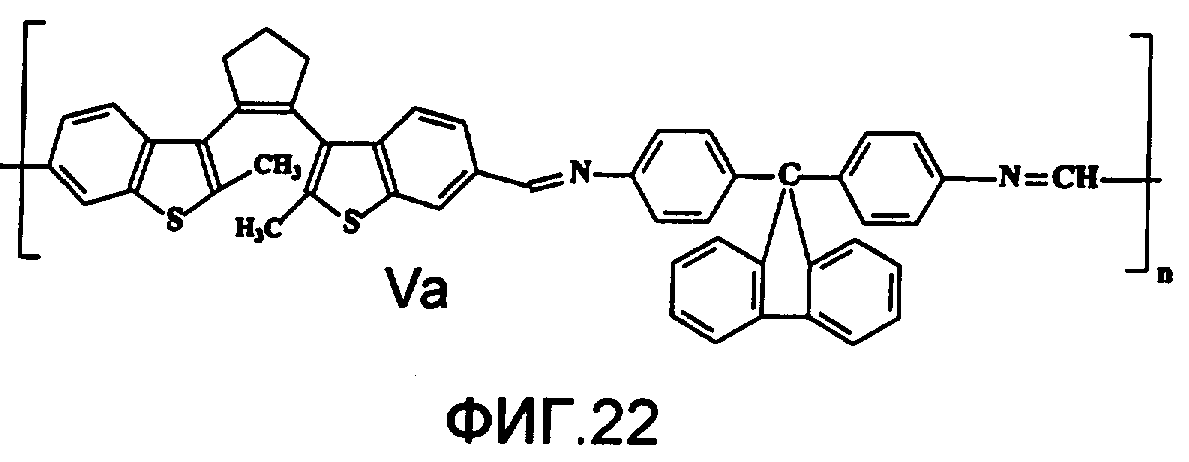
На фиг.22 представлена структура фотохромного полимера Va.
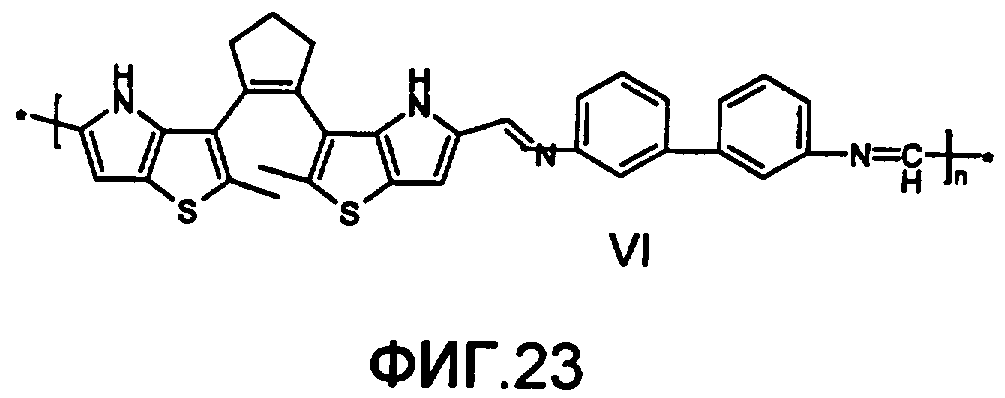
На фиг.23 представлена структура фотохромного полимера VI
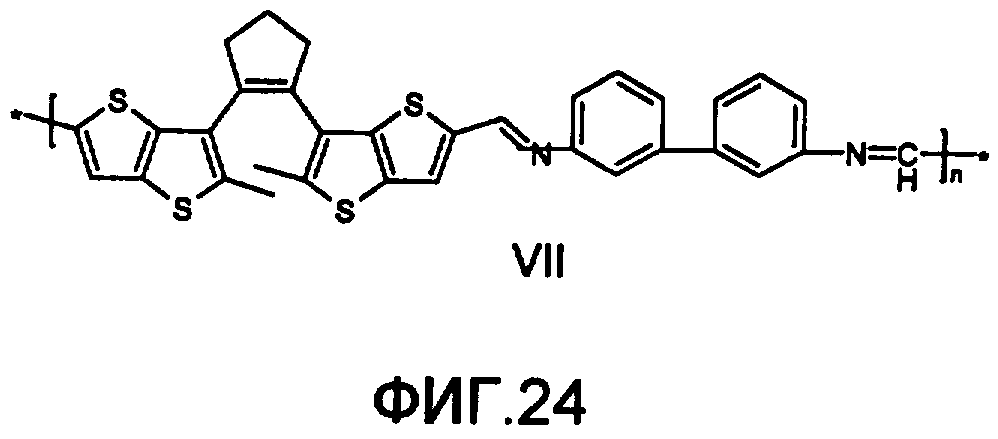
На фиг.24 представлена структура фотохромного полимера VII.
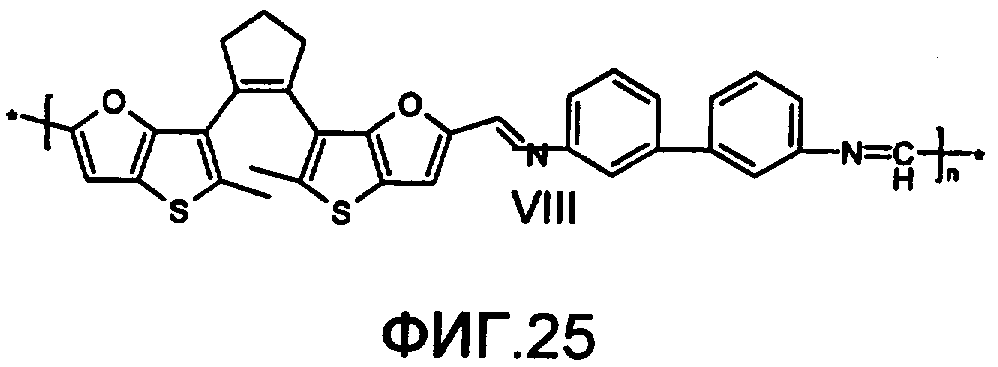
На фиг.25 представлена структура фотохромного полимера VIII.
Сведения, подтверждающие возможность осуществления изобретения, но не ограничивающие объем заявленных притязаний.
Пример 1
Фотохромные мономеры 1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентены 5а-е из класса использованных фотохромных мономеров, содержащие бензотиофеновые фрагменты, связанные циклопентеновым мостиком, синтезировали на основе бензотиофенов 2а-е по схеме, представленной на фиг.3.
Исходные бензотиофены 2а-е были получены по описанным методикам: 2-метилбензотофен (2а) (Синтез сульфидов, тиофенов и тиолов типа соединений, встречающихся в нефти. Под ред. Е.Н.Карауловой. М.: «Наука», 1988, с.180), 2,4-диметилбензотиофен и 2,7-диметилбензотиофен (2b, 2с) (Monatsh. Chem. 1960, 91, 1070), 2,4-диметилбензотиофен и 2,6-диметилбензотиофен (2d, 2e) (J.Chem. Soc., Chem. Com. 1974, 5, 174).
Синтез 1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентенов 5а-е включал в себя ацилирование бензотиофенов 2а-е дихлорангидридом глутаровой кислоты в хлористом метилене в присутствии хлористого алюминия и последующую восстановительную циклизацию полученных дикетонов 3а-е, которая отличалась тем, что соединения 4а-е было получены с 60-73% выходом при циклизации дикетонов 3а-е под действием TiCl4, Zn в ТГФ в присутствии пиридина, тогда как в литературе описано получение соединения 4а циклизацией дикетона 3а под действием TiCl4, Zn в ТГФ с выходом 54% (Synthesis 1998, 1092-1094). Последующее формилирование продуктов 4а-е дихлорметиловым эфиром в нитробензоле в присутствии хлористого алюминия привело к образованию 1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентенов 5а-е.
Общая схема синтеза 1,5-бис-(метил-1-бенэотиофен-3-ил)пентан-1,5-дионов 3а-е
К хорошо перемешиваемой смеси 20,2 ммоль метилбензотиофена 2а-е и 10,1 ммоль дихлорангидрида глутаровой кислоты в 50 мл хлористого метилена прибавляют при 0°С 42,5 ммоль безводного хлористого алюминия. Реакционную массу перемешивают при комнатной температуре 3-6 часов. Выливают на лед с водой, экстрагируют хлористым метиленом (3×100 мл), собранные органические слои промывают водным раствором NaHCO3, сушат над сульфатом магния, растворитель упаривают под вакуумом. Остаток перекристаллизовывают из гексана.
1,5-Бис-(2-метил-1-бензотиофен-3-ил)пентан-1,5-дион 3а
Получают 3,25 г продукта 3а (82%), т.пл. 165-167°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 392, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,0-2,2 (м, 2Н, СН2), 2,62 (с, 6Н, 2×СН3), 3,1-3,2 (уш.м., 4Н, 2×СН2), 7,3-7,5 (уш.м., 4Н, 4×СНаром), 7,85-8,2 (уш.м, 4Н, 4×СНаром). Найдено (%): С, 70,42; Н, 5,16; S, 16,29. С23Н20O2S2. Вычислено (%): С, 70,37; Н, 5,14; S, 16,34.
1,5-Бис-(2,5-диметил-1-бензотиофен-3-ил)пентан-1,5-дион 3b
Получают 3,57 г продукта (3b) (84%), т.пл. 171-173°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 420, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,0-2,3 (м, 2Н, СН2), 2,40 (с, 6Н, 2×СН3), 2,62 (с, 6Н, 2×СН3), 2,75-3,2 (уш.м., 4Н, 2×СН2), 7,4-8,1 (уш.м., 6Н, 6×СНаром). Найдено (%): С, 71,45; Н, 5,77; S, 15,20. C25H24O2S2. Вычислено (%): С, 71,39; Н, 5,75; S, 15,25.
1,5-Бис-(2,7-диметил-1-бензотиофен-3-ил)пентан-1,5-дион 3с
Получают 3,61 г продукта (3с) (85%), т.пл. 159-161°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 420, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,1-2,4 (м, 2Н, СН2), 2,56 (с, 6Н, 2×СН3), 2,66 (с, 6Н, 2×СН3), 2,8-3,2 (уш.м., 4Н, 2×СН2), 7,1-7,5 (уш.м., 4Н, 4×СНаром), 8,0-8,3 (уш.м., 2Н, 2×СНаром). Найдено (%): С, 71,43; Н, 5,73; S, 15,29. С25Н24O2S2. Вычислено (%): С, 71,39; Н, 5,75; S, 15,25.
1,5-Бис-(2,4-диметил-1-бензотиофен-3-ил)пентан-1,5-дион 3d
Получают 3,32 г продукта (3d) (78%), т.пл. 156-158°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 420, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,0-2,3 (м, 2Н, СН2), 2,62 (с, 6Н, 2×СН3), 2,64 (с, 6Н, 2×СН3), 2,9-3,2 (уш.м., 4Н, 2×СН2), 7,2-8,0 (уш.м., 6Н, 6×СНаром). Найдено (%): С, 71,35; Н, 5,77; S, 15,30. C25H24О2S2. Вычислено (%): С, 71,39; Н, 5,75; S, 15,25.
1,5-Бис-(2,6-диметил-1-бензотиофен-3-ил)пентан-1,5-дион 3е
Получают 3,66 г продукта (3е) (86%), т.пл. 171-173°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 420, [М]+. Спектр ЯМР1Н (ДМСО-d6, δ, м.д., J/Гц): 2,05-2,25 (м, 2Н, СН2), 2,44 (с, 6Н, 2×СН3), 2,62 (с, 6Н, 2×СН3), 2,9-3,15 (уш.м., 4Н, 2×СН2), 7,25-7,4 (уш.м., 2Н, 2×СНаром), 7,7-7,9 (уш.м, 4Н, 2×СНаром). Найдено (%): С, 71,47; Н, 5,73; S, 15,31. C25H24O2S2. Вычислено (%): С, 71,39; Н, 5,75; S, 15,25.
Общая методика синтеза 1,2-бис(2-метил-1-бензотиофен-3-ил)циклопентена 4
К хорошо перемешиваемой суспензии 7,93 ммоль цинка в свежеперегнанном безводном THF (50 мл) при -10°С под аргоном добавляют по каплям 2,8 мл TiCl4. После окончания прибавления реакционную смесь нагревают под аргоном 1 ч. Охлаждают до 20°С и прибавляют 12,8 ммоль дикетона 3а-е и безводный пиридин (5 мл). Кипятят под аргоном еще 20 ч. Выливают в 10% K2СО3 (150 мл) и водный слой экстрагируют Et2O (5×100 мл). Собранные органические экстракты сушат MgSO4 и отгоняют под вакуумом. Остаток чистят с помощью флэш-хроматографии на силикагеле (Merck, 0,063-0,1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.).
1,2-бис(2-метил-1-бензотиофен-3-ил)циклопентен 4а
Получают 2,76 г продукта 4а (60%) с т.пл. 186,5-187,5°С, т.пл. лит. 187-188°С (Synthesis 1998, 1092-1094).
1,2-бис(2,5-диметил-1-бензотиофен-3-ил)циклопентен 4b
Получают 3,19 г продукта (4b) (69%), т.пл. 165-167°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 388, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,08-2,23 (уш.м, 2Н, СН2), 2,40 (с, 6Н, 2×СН3), 2,52 (с, 6Н, 2×СН3), 3,09-3,24 (уш.м, 4Н, 2×CH2), 7,16 (м, 2Н, Hаром) 7,31 (м, 2Н, Наром) 7,55 (м, 2Н, Hаром). Найдено (%): С, 77,30; Н, 6,21; S, 16,43. C25H24S2. Вычислено (%): С, 77,35; Н, 6,23; S, 16,38.
1,2-бис(2,7-диметил-1-бензотиофен-3-ил)циклопентен 4с
Получают 3,37 г продукта (4с) (73%), т.пл. 174-176°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 388, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,08-2,23 (уш.м, 2Н, СН2), 2,50 (с, 6Н, 2×СН3), 2,52 (с, 6Н, 2×СН3), 3,09-3,24 (уш.м, 4Н, 2×СН2), 7,02 (м, 2Н, Наром), 7,12 (м, 2Н, Наром), 7,21 (м, 2Н, Hаром). Найдено (%): С, 77,32; Н, 6,24; S, 16,45. C25H24S2. Вычислено (%): С, 77,25; Н, 6,26; S, 16,50,
1,2-бис(2,4-диметил-1-бензотиофен-3-ил)циклопентен 4d
Получают 2,82 г продукта (4d) (61%), т.пл. 171-173°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 388, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,08-2,23 (уш.м, 2Н, СН2), 2,52 (с, 6Н, 2×СН3), 2,69 (с, 6Н, 2×СН3), 3,09-3,24 (уш.м., 4Н, 2×СН2), 7,00 (м, 2Н, Hаром), 7,20 (м, 2Н, Hаром), 7,52 (м, 2Н, Hаром). Найдено (%): С, 77,33; Н, 6,24; S, 16,48. C25H24S2. Вычислено (%): С, 77,26; Н, 6,23; S, 16,52.
1,2-бис(2,6-диметил-1-бензотиофен-3-ил)циклопентен 4е
Получают 3,0 г продукта (4е) (65%), т.пл. 184-186°С (Масс-спектр, m/z: 388, [М]+. Спектр ЯМР1Н (ДМСО-d6, δ, м.д., J/Гц): 2,21-2,23 (уш.м, 2Н, СН2), 2,44 (с, 6Н, 2×СН3), 2,52 (с, 6Н, 2×СН3), 3,09-3,24 (уш.м, 4Н, 2×СН2), 7,18 (м, 2Н, Наром), 7,38 (м, 2Н, Hаром), 7,53 (м, 2Н, Hаром). Найдено (%): С, 77,30; Н, 6,24; S, 16,44. C25H24S2. Вычислено (%): С, 77,41; Н, 6,22; S, 16,50.
Общая методика синтеза 1,2-бис(формил-1-бензотиофен-3-ил)циклопентенов 5а-е
К перемешиваемому раствору 3,33 ммоль 1,2-бис(диметил-1-бензотиофен-3-ил)циклопентена 4а-е в нитробензоле (25 мл) при 0°С добавляют 50 ммоль дихлорметилового эфира и 13,35 ммоль безводного хлористого алюминия, перемешивают 30 мин при 0°С и 20 часов при комнатной температуре. Реакционную смесь выливают в лед с водой и продукт экстрагируют этилацетатом, промывают водой, сушат сульфатом магния. После отгонки нитробензола под вакуумом продукт очищают с помощью колоночной хроматографии (Silica Gel, 0,063-0,1), элюент - петрол. эфир (40/70):этилацетат (6:1, об.).
1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентен 5а
Получают 0,56 г диальдегида (5а) (40%), т.пл. 196-197°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 416, [М]+. Спектр ЯМР1Н (ДМСО-d6, δ, м.д., J/Гц): 2,25 (м, 6Н, 2×СН3), 2,97 (уш.с., 6Н, 3×СН2), 7,6-8,5 (уш.м., 6Н, СНаром), 9,98 (уш.с., 2Н, 2×СНО). Найдено (%): С, 72,16; Н, 4,86; S, 15,34. C25H20O2S2. Вычислено (%): С, 72,08; Н, 4,84; S, 15,40.
Полученное соединение 5а растворяли в толуоле в концентрации С=2.10-4 М. Спектры поглощения форм А и В измеряли на спектрофотометре Cary 50 (Varian) сразу после растворения (фиг.4, кр.1) и после облучения УФ светом ртутной лампы ДРШ-250 через стеклянный светофильтр УФС-2 из стандартного набора стеклянных оптических светофильтров (фиг.4, кр.2-7). Фотохромный мономер характеризуется высокой обратимостью (цикличностью) фотохромных превращений, о чем свидетельствует наличие изобестической точки на кривых поглощения (фиг.4). Затем измеряли изменение оптической плотности (кинетику) раствора в максимуме полосы поглощения циклической формы В под действием того же самого УФ света (процесс фотоокрашивания) (фиг.5, кр.1) и после достижения состояния равновесия под действием видимого излучения того же источника света, пропущенного через стеклянный светофильтр ЖС-12 (процесс фотообесцвечивания) (фиг.5, кр.2). Из спектрально-кинетических данных видно, что соединение обладает приемлемыми для практического использования фотохромными свойствами.
1,2-бис (2,5-диметил-6-формил-1-бензотиофен-3-ил)циклопентен 5b
Получают 0,71 г диальдегида (5b) (48%), т.пл. 181-183°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 444, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,0-2,4 (м, 2Н, СН2), 2,55 (с, 6Н, 2×СН3), 2,86 (с, 6Н, 2×СН3), 2,95-3,25 (м, 4Н, 2×СН2), 7,40 (уш.с, 2Н, 2×СНаром), 8,24 (уш.с, 2Н, 2×СНаром), 10,09 (уш.с., 2Н, 2×СНО). Найдено (%): С, 73,03; Н, 5,43; S, 14,37. C27H24O2S2. Вычислено (%): С, 72,94; Н, 5,44; S, 14,42.
1,2-бис(2,7-диметил-6-формил-1-бензотиофен-3-ил)циклопентен 5с
Получают 0,96 г диальдегида (5с) (65%), т.пл. 163-165°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 444, [М]+. Спектр ЯМР1H (ДМСО-d6, 5, м.д., J/Гц): 2,05-2,35 (м, 2Н, СН2), 2,50 (с, 6Н, 2×СН3), 2,91 (с, 6Н, 2×СН3), 3,0-3,25 (м, 4Н, 2×СН2), 7,32 (уш.д, 2Н, 2×СНаром), 7,79 (уш.д, 2Н, 2×СНаром), 10,10 (уш.с., 2Н, 2×СНО). Найдено (%): С, 72,90; Н, 5,43; S, 14,48. C27H24O2S2. Вычислено (%): С, 72,94; Н, 5,44; S, 14,42.
1,2-бис(2,4-диметил-5-формил-1-бензотиофен-3-ил)циклопентен 5d
Получают 1,05 г диальдегида (5d) (68%), т.пл. 187-189°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 444, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,0-2,35 (м, 2Н, СН2), 2,54 (с, 6Н, 2×СН3), 2,97 (с, 6Н, 2×СН3), 3,1-3,3 (м, 4Н, 2×СН2), 7,47 (уш.д, 2Н, 2×СНаром), 7,90 (уш.д, 2Н, 2×СНаром), 10,31 (уш.с., 2Н, 2×СНО). Найдено (%): С, 72,99; Н, 5,45; S, 14,38. C27H24O2S2. Вычислено (%): С, 72,94; Н, 5,46; S, 14,42.
1,2-бис (2,6-диметил-5-формил-1-бензотиофен-3-ил)циклопентен 5е
Получают 0,77 г диальдегида (5е) (52%), т.пл. 201-203°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 444, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2,0-2,4 (м, 2Н, СН2), 2,52 (с, 6Н, 2×СН3), 2,85 (с, 6Н, 2×СН3), 3,0-3,35 (м, 4Н, 2×СН2), 7,31 (уш.с, 2Н, 2×СНаром), 8,42 (уш.с, 2Н, 2×СНаром), 10,28 (уш.с., 2Н, 2×СНО). Найдено (%): С, 73,01; Н, 5,46; S, 14,35. C27H24O2S2. Вычислено (%): С, 72,94; Н, 5,44; S, 14,42.
Пример 2
1. Методика синтеза 1,2-бис(2-децил-6-формил-1-бензотиофен-3-ил)циклопентена 5g.
1,2-бис(2-децил-6-формил-1-бензотиофен-3-ил)циклопентен 5g получают аналгично 1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентену 5а-е (см. Пример 1) с использованием в качестве исходного соединения 2-децилбензотиофена (см. общую схему на фиг.3).
Целевой 1,2-бис(2-децил-6-формил-1-бензотиофен-3-ил)циклопентен 5g получают в виде аморфного порошка.
Масс-спектр, m/z: 668, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 0.88 (тр, 6Н, 2×СН3); 1.40-1.8 (м 16Н, 8×СН2) 2.97 (уш.с., 6Н, 3×СН2), 3.20 (м, 4Н, 2×СН2); 7.6-8.5 (уш.м., 6Н, СНаром), 9.98 (уш.с., 2Н, 2×СНО). Найдено (%): С, 77.16; Н, 8.86; S, 9.34. С43Н56O2S2. Вычислено (%): С, 77.25; Н, 8.38; S, 9.58.
2. Методика синтеза 1,2-бис(2-метил-6-карбокси-1-бензотиофен-3-ил)циклопентена 8. Синтез ведут по схеме, приведенной на фиг.6.
Синтез дикетоэфира 7
К раствору 0,75 г (2,1 ммоль) соединения 4а в 15 мл СН2Cl2 добавили 0,75 г (5,6 ммоль) AlCl3, реакционную смесь охладили до температуре 5°С и затем прикапали 5,5 ммоль хлорангидрида 6. Перемешивали смесь при температуре 5-15°С в течение 3 часов, затем прилили 50 мл воды и экстрагировали 3×50 мл этилацетата. Органический слой сушили над MgSO4 и затем упарили. Остаток чистили на хроматографической колонке (4:1 петролейный эфир - этилацетат). Выход соединения 7 составил 0,45 г (39%). Т.пл.=158-162°С.
Синтез дикислоты 8
К раствору 0,09 г (0,16 ммоль) соединения 7 в 3 мл диоксана добавили 0,035 г (0,8 ммоль) NaOH в 3 мл воды и 0,5 мл Н2O2 (30% раствор в Н2O). Реакционную смесь перемешивали в течение 10 ч, затем прилили 10 мл воды и подкислили раствор до рН=4 разбавленной серной кислотой. Выпавший аморфный осадок отфильтровали и посушили. Выход соединения 8 72%.
Масс-спектр, m/z: 448, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2.26 (м, 6Н, 2×СН3), 2.93 (уш.с., 6Н, 3×СН2), 7.6-8.5 (уш.м., 6Н, СНаром). Найдено (%): С, 66.46; Н, 4.86; S, 14.34. C25H20O4S2. Вычислено (%): С, 66.70; Н, 4.46; S, 14.28.
3. Методика синтеза 1,2-бис(2-метил-6-метилокси-1-бензотиофен-3-ил)циклопентена 9. Синтез ведут по схеме, приведенной на фиг.7.
Восстановление диальдегида 5а проводили по стандартной методике NaBH4 в метаноле. Выход соединения 9-52%.
Масс-спектр, m/z: 420, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2.28 (м, 6Н, 2×СН3), 2.87 (уш.с., 6Н, 3×СН2), 4.56 (уш.с., 4Н, 2×СН2), 7.6-8.5 (уш.м., 6Н, СНаром). Найдено (%): С, 71.76; Н, 5.86; S, 15.34. C25H20O4S2. Вычислено (%): С, 71.43; Н, 5.71; S, 15.23.
4. Методика синтеза 1,2-бис(2-метил-6-хлорметил-1-бензотиофен-3-ил)циклопентена 10. Синтез ведут по схеме, приведенной на фиг.7.
Получение дихлорида 10 проводили по стандартной методике в двухфазной системе хлороформ - 32% соляная кислота. Выход 67%.
Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2.25 (м, 6Н, 2×СН3), 2.97 (уш.с., 6Н, 3×СН2), 4.45 (с., 4Н, 2×СН2), 7.6-8.5 (уш.м., 6Н, СНаром). Найдено (%): С, 65.76; Н, 4.96; Cl 15.92, S, 14.34. C25H20Cl2S2. Вычислено (%): С, 65.79; Н, 4.82; Cl 15.35, S, 14.03.
Пример 2а
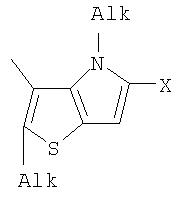
Фотохромный 1,2-бис(2-метил-5-формил-4Н-тиено[3,2-b]пиррол-3-ил)циклопентен 17 из класса использованных фотохромных мономеров синтезировали по схеме, представленной на фиг.8.
Метиловый эфир 2-азидо-3-(5'-метил-2'-тиенил)акриловой кислоты 12
К смеси метилата натрия, приготовленного из (1,8 г, 78,3 ммоль) Na и 30 мл абс. метанола, и (22,8 г, 0,2 моль) метилового эфира азидоуксусной кислоты при перемешивании и температуре -5-0°С прибавляют 30 ммолей метилтиофенкарбоксальдегида 11 [метилтиофенкарбоксальдегид 11 синтезировали по методике, описанной в Orsanic Syntheses, Coll. Vol.4, p.915 (1963); Vol.31. p.108 (1951)]. Смесь перемешивают при 0°С 30 минут и 2 часа при комнатной температуре. Добавляют водный раствор насыщенного NH4Cl и перемешивают 10 минут. Выпавший осадок отфильтровывают, сушат. Выход 11 (76%), т.пл. 51°С (с разд.). Масс-спектр, m/z: 223, [М]+. Спектр ЯМР1H (CDCl3, δ, м.д.): 2.55 (с, 3Н, СН3), 3.80 (с, 3Н, СН3О), 6,74 (с, 1Н, СН), 7.10 (с, 1Н, СНаром), 7.15 (с, 1Н, СНаром). ИК-спектр (таблетка с KBr), ν/см-1: 2120 оч.с. (N3). Найдено (%): С, 48.52; Н, 4.20; N, 19.02; S, 14.81. C9H9N3O2S. Вычислено (%): С, 48.42; Н, 4.06; N, 18.82; S, 14.36.
Метиловый эфир 2-метил-4Н-тиено[3,2-b]пиррол-5-карбоновой кислоты 13
Раствор 30 ммолей метилового эфира 2-азидо-3-(тиенил-2')-акриловой кислоты 12 в 50 мл толуола кипятят в течение 3 часов. Выпавший осадок отфильтровывают, маточник упаривают под вакуумом и перекристаллизовывают из толуола. Осадки объединяют. Выход 13 (95%), т.пл. 189-190°С (из толуола). Масс-спектр, m/z: 195, [М]+. Спектр ЯМР1Н (CDCl3, δ, м.д.): 2.54 (с, 3Н, СН3), 3.82 (с, 3Н, СН3О), 6.65 (с, 1Н, СНаром), 7.06 (с, 1Н, СНаром), 9.25 (уш.с, 1Н, NH). Найдено (%): С, 55.40; Н, 4.65; N, 7.23; S, 16.53. C9H9NO2S. Вычислено (%): С, 55.37; Н, 4.65; N, 7.17; S, 16.42.
1,5-бис-(2-метил-5-метоксикарбонил-4Н-тиено[3,2-b]пиррол-3-ил)пентан-1,5-дион 14
К хорошо перемешиваемой смеси 20.2 ммоль тиенопиррола 13 и 10.1 ммоль дихлорангидрида глутаровой кислоты в 50 мл хлористого метилена прибавляют при 0°С 42.5 ммоль безводного хлористого алюминия. Реакционную массу перемешивают при комнатной температуре 6 часов. Выливают на лед с водой, экстрагируют хлористым метиленом (3×100 мл), собранные органические слои промывают водным раствором NaHCO3, сушат над сульфатом магния, растворитель упаривают под вакуумом. Остаток перекристаллизовывают из гексана. Выход 14 (82%), т.пл. 175-177°С (гексан; хлороформ, 6:1, об.). Масс-спектр, m/z: 486, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2.0-2.2 (м, 2Н, CH2), 2.62 (с, 6Н, 2×СН3), 3.1-3.2 (уш.м., 4Н, 2×СН2), 3.82 (с, 6Н, 2×СН3О), 6.84 (с, 2Н, 2×СНаром), 9.25 (уш.с, 2Н, 2×NH). Найдено (%): С, 56.64; Н, 4.42; N, 5.82. С23Н2N2O6S2. Вычислено (%): С, 56.78; Н, 4.56; N, 5.76.
1,2-бис(2-метил-5-метоксикарбонил-4Н-тиено[3,2-b]пиррол-3-ил)циклопентен 15
К хорошо перемешиваемой суспензии 7.93 ммоль цинка в свежеперегнанном безводном ТГФ (THF) (50 мл) при -10°С под аргоном добавляют по каплям 2.8 мл TiCl4. После окончания прибавления реакционную смесь нагревают под аргоном 1 ч. Охлаждают до 20°С и прибавляют 12.8 ммоль дикетона 14 и безводный пиридин (5 мл). Кипятят под аргоном еще 20 ч. Выливают в 10% K2СО3 (150 мл) и водный слой экстрагируют Et2O (5×100 мл). Собранные органические экстракты сушат MgSO4 и отгоняют под вакуумом. Остаток чистят с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 10 (60%) с т.пл. 196.5-197.5°С. Масс-спектр, m/z: 454, [M]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 3.71 (с, 6Н, 2×СН3О), 6.63 (с, 2Н, 2×СНаром), 9.12 (уш.с, 2Н, 2×NH). Найдено (%): С, 60.64; Н, 4.72; N, 6.22. С23Н22N2O4S2. Вычислено (%): С, 60.77; Н, 4.88; N, 6.16.
1,2-бис(2-метил-5-оксиметил-4Н-тиено[3,2-b]пиррол-3-ил)циклопентен 16
К хорошо перемешиваемому раствору соединения 15 (12 ммоль) в 5 мл эфира добавили LiAlH4 (10 ммоль) и реакционную смесь перемешивали в течение 1 часа. При охлаждении добавили воды и отделили эфирный слой. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 16 (59%) с т.пл. 166.5-167.5°С. Масс-спектр, m/z: 398, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2H, СН2), 2.42 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 4.82 (с, 4Н, 2×СН2), 6.61 (с, 2R, 2×СНаром), 9.11 (уш.с, 2Н, 2×NH). Найдено (%): С, 63.34; Н, 5.62; N, 7.12. С; C21H22N2O2S2. Вычислено (%): С, 63.29; Н, 5.56; N, 7.03.
1,2-бис(2-метил-5-формил-4Н-тиено[3,2-b]пиррол-3-ил)циклопентен 17
К хорошо перемешиваемому раствору соединения 16 (12 ммоль) в 20 мл хлористого метилена добавили комплекс хромового ангидрида с двумя молекулами пиридина (72 ммоль) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 17 (28%) в виде вязкого масла. Масс-спектр, m/z: 394, [М]+. Спектр ЯМР1Н (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.0 (м, 2Н, СН2), 2.40 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 6.58 (с, 2Н, 2×СНаром), 9.18 (уш.с, 2Н, 2×NH), 10.02 (уш.с., 2Н СНО). Найдено (%): С, 63.66, Н, 4.62; N, 7.15. C21H18N2O2S2. Вычислено (%): С, 63.96, Н, 4.57; N, 7.11.
Пример 3
Методика получения 1,2-бис[N-метил(2-метил-5-формил-4Н-тиено[3,2-b]пиррол-3-ил)]циклопентена 20. Синтез осуществляли по схеме, приведенной на фиг.9.
1,2-бис[N-метил(2-метил-5-метоксикарбонил-4Н-тиено[3,2-b]пиррол-3-ил)]циклопентен 18 получили по стандарной методике при метилировании 15 йодистым метилом.
Масс-спектр, m/z: 482, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 2.92 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 3.71 (с, 6Н, 2×СН3О), 6.63 (с, 2Н, 2×СНаром). Найдено (%): С, 62.64; Н, 5.72; N, 5.22. C25H26N2O4S2. Вычислено (%): С, 62.24; Н, 5.39; N, 5.80.
1,2-бис(2-метил-5-оксиметил-4Н-тиено[3,2-b]пиррол-3-ил)циклопентен 19
К хорошо перемешиваемому раствору соединения 18 (12 ммоль) в 5 мл эфира добавили LiAlH4 (10 ммоль) и реакционную смесь перемешивали в течение 1 часа. При охлаждении добавили воды и отделили эфирный слой. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 19 (43%) с т.пл. 155-157.5°С. Масс-спектр, m/z: 426, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 2.92 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 4.82 (с, 4Н, 2×СН2), 6.61 (с, 2Н, 2×СНаром). Найдено (%): С, 64.34; Н, 6.32; N, 6.12. C23H26N2O2S2. Вычислено (%): С, 64.79; Н, 6.10; N, 6.57.
1,2-бис(2-метил-5-формил-4Н-тиено[3,2-b]пиррол-3-ил)циклопентен 20
К хорошо перемешиваемому раствору соединения 19 (12 ммоль) в 20 мл хлористого метилена добавили комплекс хромового ангидрида с двумя молекулами пиридина (72 ммоль) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 20 (32%) в виде вязкого масла.
Масс-спектр, m/z: 422, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.0 (м, 2Н, СН2), 2.40 (с, 6Н, 2×СН3), 2.92 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 6.58 (с, 2Н, 2×СНаром.), 10.02 (уш.с., 2Н СНО). Найдено (%): С, 65.66, Н, 7.62; N, 10.45. C23H22N2O2S2. Вычислено (%): С, 65.40, Н, 7.97; N, 10.14.
Пример 4
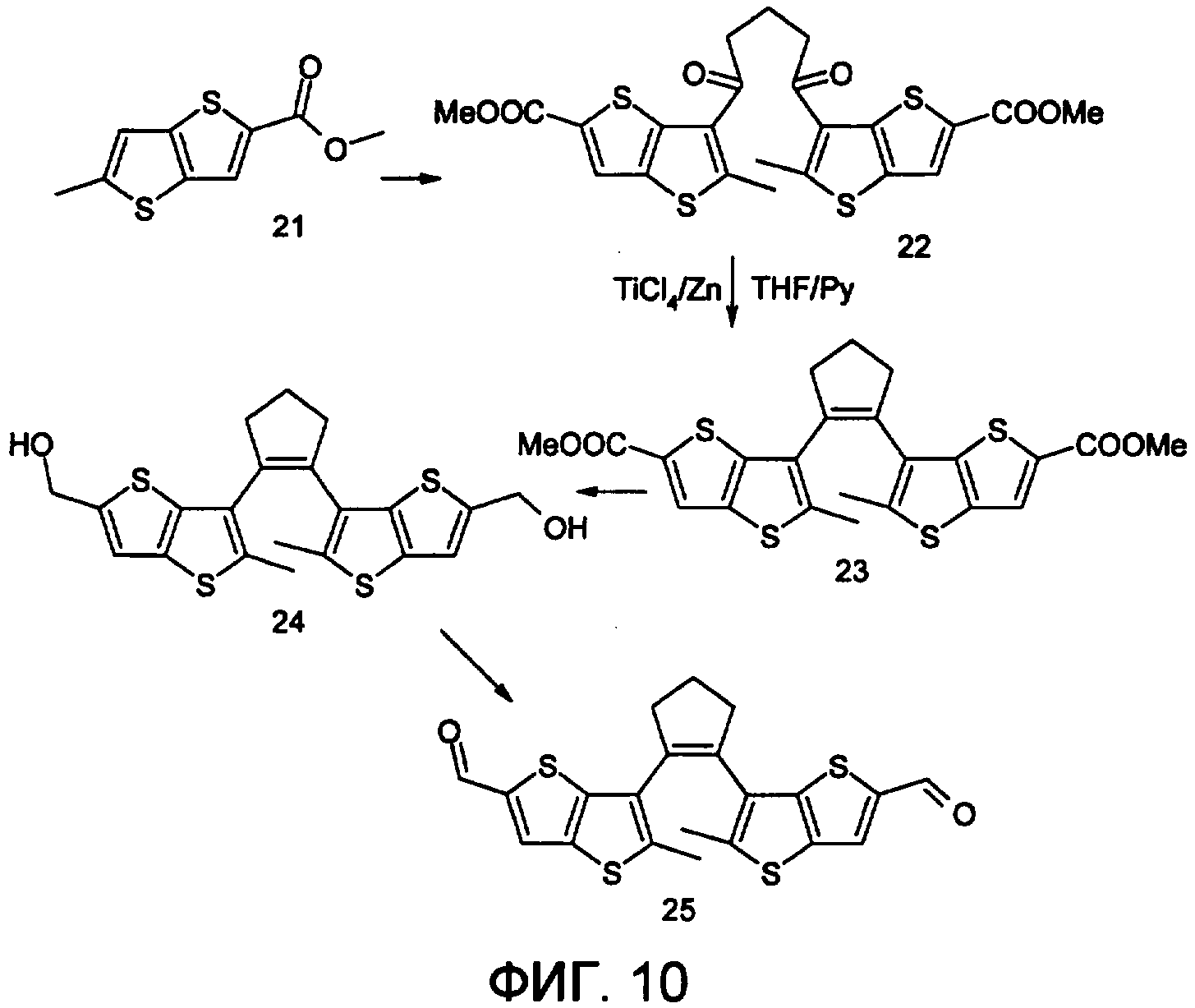
Фотохромный 1,2-бис(2-метил-5-формилтиено[3,2-b]тиофен-3-ил)циклопентен 25 из класса использованных фотохромных мономеров синтезировали по схеме, представленной на фиг.10.
1,5-бис-(2-метил-5-метоксикарбонил-4Н-тиено[3,2-b]тиофен-3-ил)пентан-1,5-дион 22
К хорошо перемешиваемой смеси 20.2 ммоль 2-метил-5-метоксикарбонил-4Н-тиено[3,2-b]тиофена 21 и 10.1 ммоль дихлорангидрида глутаровой кислоты в 50 мл хлористого метилена прибавляют при 0°С 42.5 ммоль безводного хлористого алюминия. Реакционную массу перемешивают при комнатной температуре 6 часов. Выливают на лед с водой, экстрагируют хлористым метиленом (3×100 мл), собранные органические слои промывают водным раствором NaHCO3, сушат над сульфатом магния, растворитель упаривают под вакуумом. Остаток перекристаллизовывают из гексана. Выход 22 (82%), т.пл. 165-167°С (гексан; хлороформ, 6:1, об.). Масс-спектр, m/z: 520, [М]+, Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 2.0-2.2 (м, 2Н, СН2), 2.62 (с, 6Н, 2×СН3), 3.1-3.2 (уш.м., 4Н, 2×СН2), 3.82 (с, 6Н, 2×СН3О), 6.84 (с, 2Н, 2×СНаром), Найдено (%): С, 53.28; Н, 3.65. С23Н20О6S4. Вычислено (%); С, 53.08; Н, 3.87.
1,2-бис(2-метил-5-метоксикарбонил-4Н-тиено[3,2-b]тиофен-3-ил)циклопентен 23
К хорошо перемешиваемой суспензии 7.93 ммоль цинка в свежеперегнанном безводном THF (50 мл) при -10°С под аргоном добавляют по каплям 2.8 мл TiCl4. После окончания прибавления реакционную смесь нагревают под аргоном 1 ч. Охлаждают до 20°С и прибавляют 12.8 ммоль дикетона 22 и безводный пиридин (5 мл). Кипятят под аргоном еще 20 ч. Выливают в 10% K2СО3 (150 мл) и водный слой экстрагируют Et2O (5×100 мл). Собранные органические экстракты сушат MgSO4 и отгоняют под вакуумом. Остаток чистят с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 23 (60%) с т.пл. 177.5-176.5°С. Масс-спектр, m/z: 488, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 3.71 (с, 6Н, 2×СН3О), 6.63 (с, 2Н, 2×СНаром). Найдено (%): С, 56.83; Н, 4.22. С23Н20O4S4. Вычислено (%): С, 56.55; Н, 4.10.
1,2-бис(2-метил-5-оксиметил-4Н-тиено[3,2-b]тиофен-3-ил)циклопентен 24
К хорошо перемешиваемому раствору соединения 23 (12 ммоль) в 5 мл эфира добавили LiAlH4 (10 ммоль) и реакционную смесь перемешивали в течение 1 часа. При охлаждении добавили воды и отделили эфирный слой. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 24 (59%) в виде вязкого масла. Масс-спектр, m/z: 432, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 4.82 (с, 4Н, 2×СН2), 6.61 (с, 2Н, 2×СНаром). Найдено (%): С, 63.34; Н, 4.52. C21H20O2S4. Вычислено (%): С, 63.89; Н, 4.63.
1,2-бис(2-метил-5-формил-4Н-тиено[3,2-b]тиофен-3-ил)циклопентен 25
К хорошо перемешиваемому раствору соединения 24 (12 ммоль) в 20 мл хлористого метилена добавили комплекс хромового ангидрида с двумя молекулами пиридина (72 ммоль) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 25 (28%) в виде вязкого масла. Масс-спектр, m/z: 428, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 4.82 (с, 4Н, 2×СН2), 6.61(с, 2Н, 2×СНаром), 9.11 (уш.с, 2Н, СНО). Найдено (%); С, 64.34; Н, 3.62. С21H16S4. Вычислено (%): С, 64.49; Н, 3.74.
Пример 5
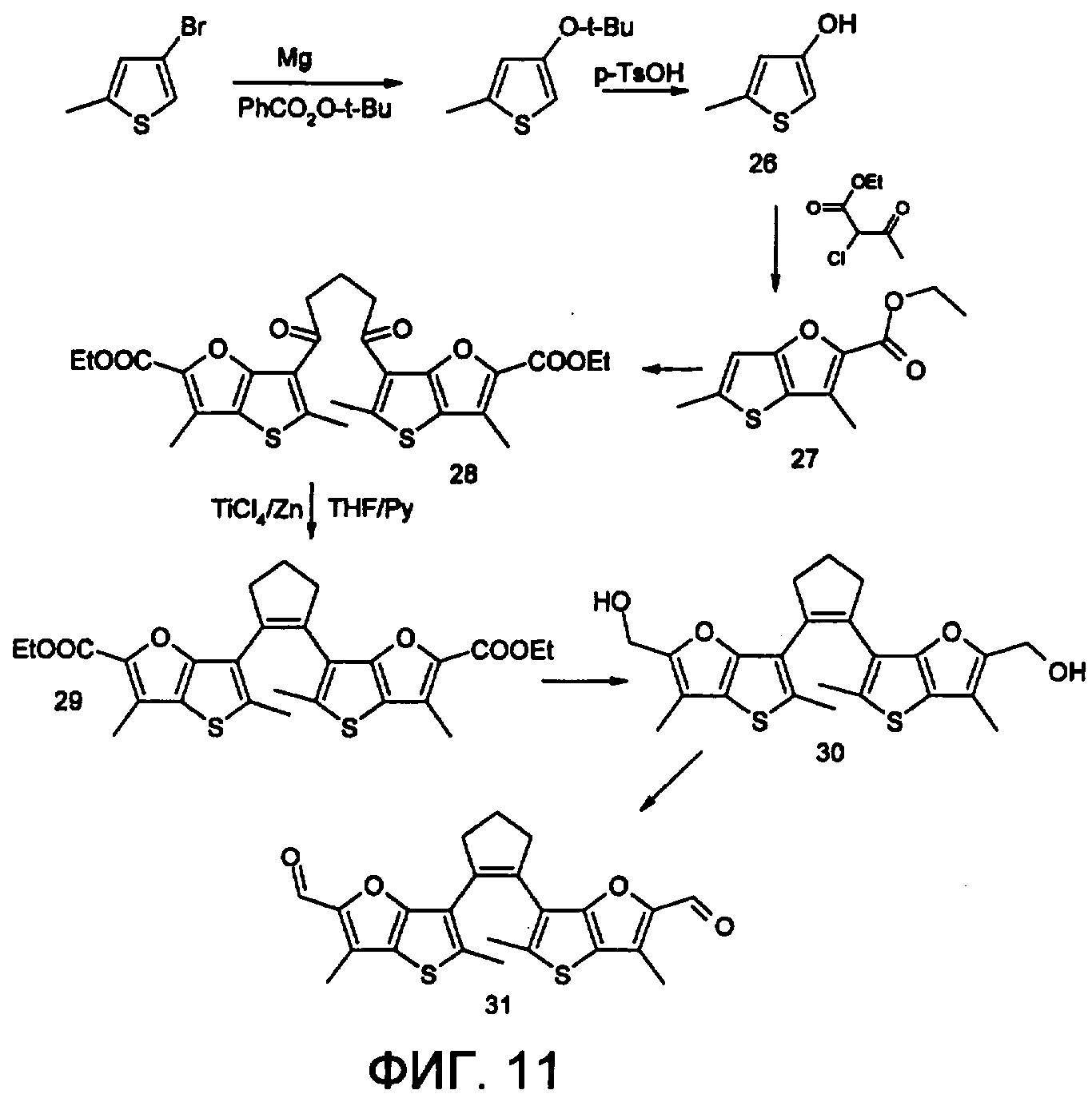
Фотохромный 1,2-бис(3,5-диметил-2-формилтиено[3,2-b]фуран-6-ил)циклопентен 31 из класса использованных фотохромных мономеров синтезировали по схеме, представленной на фиг.11.
Этил 3,5-диметилтиено[3,2-b]фуран-2-карбоксилат 27
3-Гидроокси-5-метилтиофен 26 был получен из 2-метил-4-бром-тиофена по методике, описанной в Organic Syntheses, Coll. Vol.5, p.642 (1973); Vol.43, p.55 (1963). К раствору гидрокситиофена 18 (1.5 ммоль) в 5 мл бензола добавили 1 ммоль NaH и к нагретой до кипения реакционной смеси добавили 1.5 ммоля этилхлорацетоацетата. Смесь кипятили в течение 4 часов и охладили, промыли водой, органический слой сушили над MgSO4. Растворитель отогнали, полученное вещество добавили при перемешивании в течение 1 ч к 3 мл концентрированной серной кислоты при температуре 5°С. Смесь перемешивали еще 1 ч. Затем добавили смесь воды и льда и экстрагировали 2 раза по 5 мл бензола. Органический слой промыли водой, раствором карбоната натрия, сушили над MgSO4 и удалили, продукт выделяли на колонке с силикагелем (элюент CHCl3). Выход 27 (48%), т.пл. 120-121°С. Масс-спектр, m/z: 224, [М]+. Спектр ЯМР1H (DMSO-d6, δ, м.д.); 1.31 (м. 3Н, СН3), 1.93 (с, 3Н, СН3), 2.43 (с, 3Н, СН3), 4.31 (м. 2Н, СН2), 6.76 (с, Н, Наром). Найдено (%); С, 58.83; Н, 5.22; S, 14,18. С11Н12О3S. Вычислено (%): С, 58.91; Н, 5.39; S, 14.30.
1,5-бис(3,5-диметил-2-этоксикарбонилтиено[3,2-b]фуран-6-ил)пентан-1,5-дион 28
К хорошо перемешиваемой смеси 20.2 ммоль тиенофурана 27 и 10.1 ммоль дихлорангидрида глутаровой кислоты в 50 мл хлористого метилена прибавляют при 0°С 42.5 ммоль безводного хлористого алюминия. Реакционную массу перемешивают при комнатной температуре 6 часов. Выливают на лед с водой, экстрагируют хлористым метиленом (3×100 мл), собранные органические слои промывают водным раствором NaHCO3, сушат над сульфатом магния, растворитель упаривают под вакуумом. Остаток перекристаллизовывают из гексана. Выход 28 (82%), т.пл. 169-170°С (гексан: хлороформ, 6:1, об.). Масс-спектр, m/z: 544, [М]+. Спектр ЯМР1H (DMSO-d6, δ, м.д.): 1.34 (м. 6Н, 2×СН3), 1.96 (м, 2Н, СН2), 1.98 (с, 6Н, 2×СН3), 2.40 (м, 4Н, 2×СН2), 2.43 (с, 6Н, 2×СН3), 4.31 (м. 4Н, 2×CH2). Найдено (%): С, 59.64; Н, 5.22; S, 11.82. С27Н28O8S2. Вычислено (%): С, 59.54; Н, 5.18; S, 11.77.
1,2-бис(3,5-диметил-2-этоксикарбонилтиено[3,2-b]фуран-6-ил)циклопентен 29
К хорошо перемешиваемой суспензии 7.93 ммоль цинка в свежеперегнанном безводном THF (50 мл) при -10°С под аргоном добавляют по каплям 2.8 мл TiCl4. После окончания прибавления реакционную смесь нагревают под аргоном 1 ч. Охлаждают до 20°С и прибавляют 12.8 ммоль дикетона 28 и безводный пиридин (5 мл). Кипятят под аргоном еще 20 ч. Выливают в 10% K2СО3 (150 мл) и водный слой экстрагируют Et2O (5×100 мл). Собранные органические экстракты сушат MgSO4 и отгоняют под вакуумом. Остаток чистят с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 29 (62%) с т.пл. 198.5-199.5°С. Масс-спектр, m/z; 512, [М]+. Спектр ЯМР1H (DMSO-d6, δ, м.д.): 1.34 (м. 6Н, 2×СН3), 1.94 (м, 2Н, СН2), 1.98 (с, 6Н, 2×СН3), 2.31 (м. 4Н, 2×СН2), 2.40 (м, 4Н, 2×СН2), 2.42 (с, 6Н, 2×СН3). Найдено (%): С, 63.34; Н, 5.62; N, 12.36. С27Н28O6S2. Вычислено (%): С, 63.26; Н, 5.51; S, 12.51.
1,2-бис(3,5-диметил-2-оксиметилтиено[3,2-b]фуран-6-ил)циклопентен 30
К хорошо перемешиваемому раствору соединения 29 (12 ммоль) в 5 мл эфира добавили LiAlH4 (10 ммоль) и реакционную смесь перемешивали в течение 1 часа. При охлаждении добавили воды и отделили эфирный слой. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 30 (59%) с т.пл. 168.5-169.5°С. Масс-спектр, m/z; 428, [М]+. Спектр ЯМР1H (DMSO-d6, δ, м.д.): 1.94 (м, 2Н, СН2), 1.98 (с, 6Н, 2×СН3), 2.31 (м. 4Н, 2×СН2), 2.42 (с, 6Н, 2×СН3) 4.62 (с, 4Н, 2×CH2). Найдено (%): С, 64.34; Н, 5.52. С23Н24O4S2. Вычислено (%): С, 64.48; Н, 5.64; S, 14.96.
1,2-бис(3,5-диметил-2-формилтиено[3,2-b]фуран-6-ил)циклопентен 31
К хорошо перемешиваемому раствору соединения 30 (12 ммоль) в 20 мл хлористого метилена добавили комплекс хромового ангидрида с двумя молекулами пиридина (72 ммоль) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Растворитель отогнали, полученный продукт чистили с помощью флэш-хроматографии на силикагеле (Merck, 0.063-0.1), элюент - петролейный эфир (40/70)-AcOEt (10:1, об.). Выход 31 (28%) в виде вязкого масла. Масс-спектр, m/z: 424, [М]+. Спектр ЯМР1H (ДМСО-d6, δ, м.д., J/Гц): 1.9-2.1 (м, 2Н, СН2), 2.42 (с, 6Н, 2×СН3), 3.0-3.1 (уш.м., 4Н, 2×СН2), 4.82 (с, 4Н, 2×СН2), 6.78 (с, 2Н, 2×СНаром), 9.34 (уш.с, 2Н, СНО). Найдено (%): С, 65.24; Н, 4.56. С23Н20O4S2. Вычислено (%); С, 65.09; Н, 4.72.
Пример 6
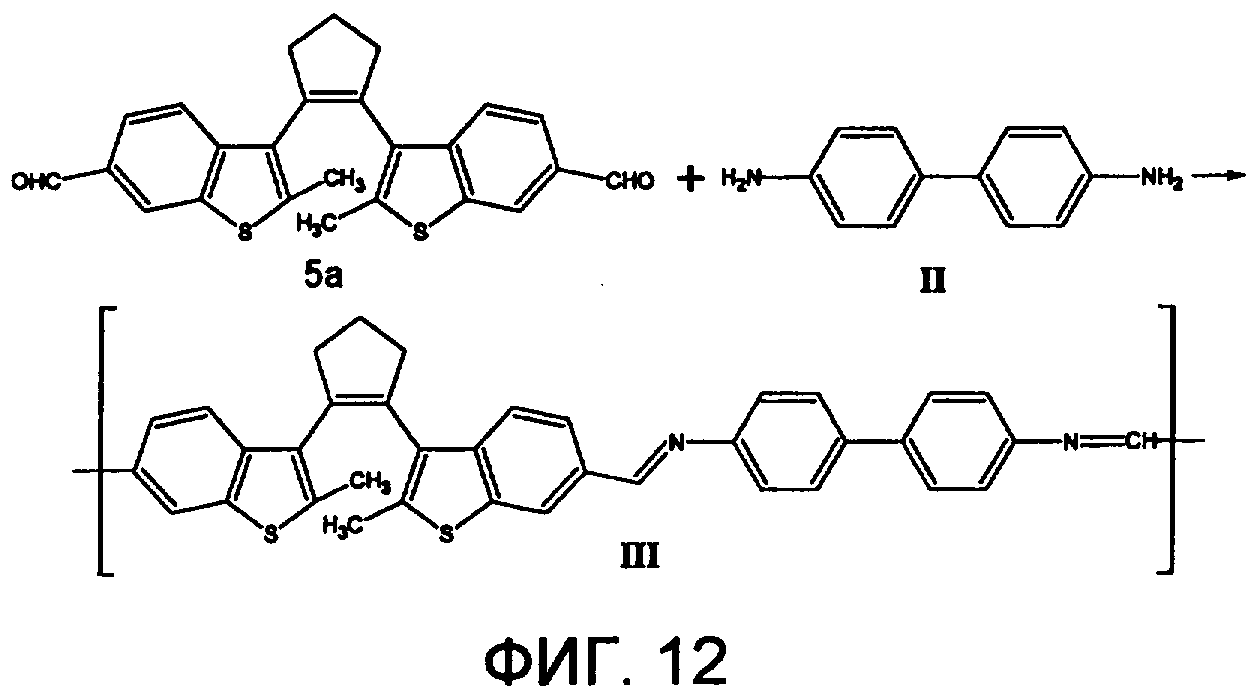
Синтез полиазометина III осуществлялся из 1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентена (соединение 5а) и бензидина по схеме, представленной на фиг.12. В трехгорлую колбу емкостью 25 мл, снабженную мешалкой, обратным холодильником и вводом для аргона, помещают 0,25 г (0,6 ммоль) 1,2-бис(2-метил-6-формил-1-бензотиофен-3-ил)циклопентена (соединение 5а), 0,110 г (0,6 ммоль) бензидина (II), по 1 мл N-метилпирролидона, гексаметилфосфорамида и 0,047 г сухого LiCl. Раствор перемешивают в течение 16 часов при комнатной температуре, затем реакционную смесь выливают в метанол, осадок промывают водой, затем метанолом и полимер сушат под вакуумом в течение 24 часов при t=60°C.
Выход полимера III 97%. ИКС (KBr, см-1): C=N 1680. Mn=35000. Полимер растворим в хлороформе, тетрагидрофуране (ТГФ), при нагревании в диметилформамиде (ДМФА) и толуоле, не растворим в этаноле и ацетоне.
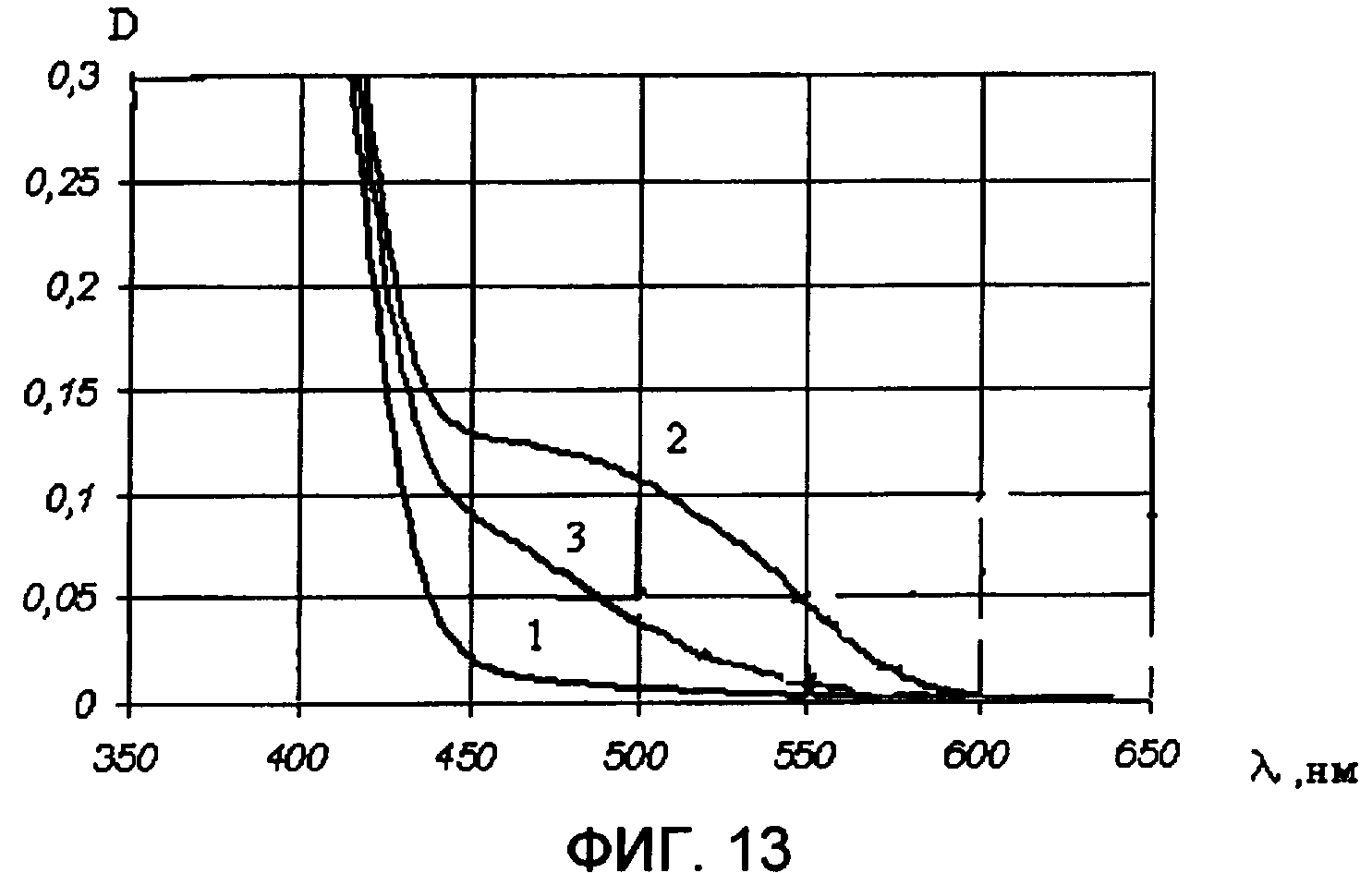
Образец фотохромного полимера для измерения спектрально-кинетических характеристик готовили путем совместного растворения фотохромного полимера и поликарбоната, который использовался в качестве полимерного связующего, в хлороформе. Затем раствор наносился на кварцевую подложку методом центрифугирования. В результате была получена фотохромная пленка, для которой были измерены по методике примера 1 спектры поглощения формы А (фиг.13, кривая 1) и формы В (фиг.13, кривая 2), а также кинетические кривые фотоокрашивания (фиг.14, кривая 1) и фотообесцвечивания (фиг.14, кривая 2). В пользу обратимости фотохромных превращений свидетельствует снижение фотоиндуцированной оптической плотности под действием видимого света (фиг.13, кривая 3). Полученные спектрально-кинетические данные свидетельствуют о фотохромизме полученного образца фотохромной пленки.
Пример 7
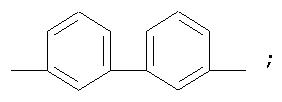
Полиазометин IIIa (фиг.15) получен из фотохромного мономера I и 3,3'-диаминодифенила аналогично примеру 6. Выход 92%. Mn=28000. Полимер растворим в хлороформе, тетрагидрофуране, в диметилформамиде и толуоле, не растворим в этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 5, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 8
Полиазометин IIIb (фиг.16) получен из фотохромного мономера I и 4,4'-диаминоазобензола аналогично примеру 6. Выход 95%. Mn=26000. Полимер растворим в хлороформе, тетрагидрофуране, в диметилформамиде, не растворим в толуоле, этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 5, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 9
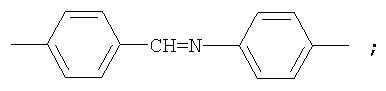
Полиазометин IIIc (фиг.17) получен из фотохромного мономера I и 4,4'-диаминодифенилазометилена аналогично примеру 6. Выход 90%. Mn=31000. Полимер растворим в хлороформе, тетрагидрофуране, в диметилформамиде, не растворим в толуоле, этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 2, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 10
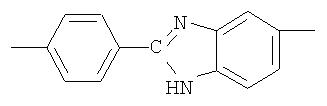
Полиазометин IIId (фиг.18) получен из фотохромного мономера I и 2-(п-аминофенил)-5(6)-аминобензимидазола аналогично примеру 6. Вызод 98%. Mn=38000. Полимер растворим в диметилформамиде, не растворим в хлороформе, тетрагидрофуране, толуоле, этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 6, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 11
Синтез кардового полиазометина V из фотохромного мономера I и анилинфталеина IV осуществлялся по схеме, представленной на фиг.19. Полимер V на основе соединения 5а и анилинфталеина IV получен аналогично полиазометину III согласно примеру 6. Выход 96%. ИК (KBr, см-1): C=N 1680. Mn=30000. Полимер растворим в хлороформе, тетрагидрофуране, диметилформамиде и при нагревании в толуоле, не растворим в этаноле и ацетоне.
Образец фотохромного полимера для спектрально-кинетических исследований изготавливали методом, описанным в примере 5.
Спектрально-кинетические измерения проводились по методике, описанной в примере 6. Полученные спектры поглощения исходной и фотоиндуцированной форм (фиг.20) и кинетические кривые фотоокрашивания и фотообесцвечивания (фиг.21) свидетельствуют о приемлемом фотохромизме полученного образца фотохромной пленки.
Пример 12
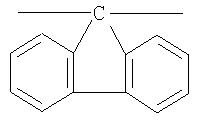
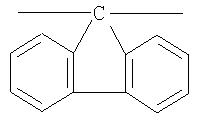
Кардовый полимер Va (фиг.22) на основе фотохромного мономера I и анилинфлуорена получен аналогично полиазометину V. Выход 92%. Mn=32000. Полимер растворим в хлороформе, тетрагидрофуране, диметилформамиде, не растворим в толуоле, этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 6, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 13
Полиазометин VI (фиг.23) получен из фотохромного мономера 17 и 3,3'-диаминодифенила аналогично примеру 6. Выход 92%. Mn=28000. Полимер растворим в хлороформе, тетрагидрофуране, в диметилформамиде и толуоле, не растворим в этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 6, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 14
Полиазометин VII (фиг.24) получен из фотохромного мономера 25 и 3,3'-диаминодифенила аналогично примеру 6. Выход 92%. Mn=30000. Полимер растворим в хлороформе, тетрагидрофуране, в диметилформамиде и толуоле, не растворим в этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 6, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Пример 15
Полиазометин VIII (фиг.25) получен из фотохромного мономера 31 и 3,3'-диаминодифенила аналогично примеру 6. Выход 92%. Mn=26000. Полимер растворим в хлороформе, тетрагидрофуране, в диметилформамиде и толуоле, не растворим в этаноле и ацетоне.
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для образца фотохромного полимера, изготовленного по методике, представленной в примере 6, свидетельствуют о практически приемлемом фотохромизме этого полимера.
Реферат
Изобретение относится к новым фотохромным мономерам
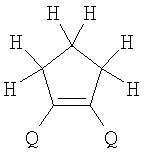
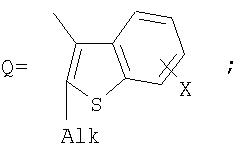
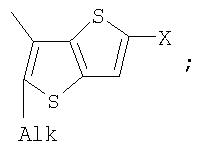
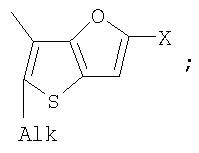
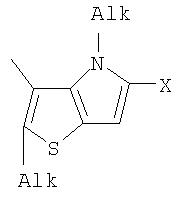
Alk=СН3-С10Н21
Х=Cl, Br, I, F, NH2, СН2ОН, CH2Cl, CH2Br, CHO, СО2Н, к способу их получения, к фотохромным полимерам-полиазометинам, которые являются обратимо фотоуправляемыми за счет введения в их структуру фотохромных фрагментов из класса дигетарилэтенов. Технический результат, достигаемый при помощи настоящего изобретения, заключается в получении новых фотохромных фотоуправляемых полимеров для создания новых информационных технологий. 8 н.п. ф-лы, 25 ил.
Формула
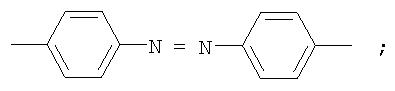

Комментарии