Способ формирования микрочастиц - RU2521388C2
Код документа: RU2521388C2
Чертежи















Описание
Это описание содержит воплощения, имеющие отношение к способу формирования микрочастиц и, в частности, микрочастиц, которые включают, по меньшей мере, одну структурированную смесь. Дальнейшие воплощения относятся к микрочастицам.
УРОВЕНЬ ТЕХНИКИ
Микрочастицы помещены между наночастицами слева и макроскопические частицы - справа на шкале размеров. Не существует каких-либо четких границ в обоих направлениях, и диапазон размера главным образом находится между 100 нм и 100 µm. Биологические ячейки, например, относятся к микрочастицам, если рассматривать их относительно размера. Микрочастицы классифицированы согласно различным аспектам: природные и синтетические; органические и неорганические; прозрачные и аморфные; пористые и не имеющие пор; по структуре ядра и оболочки, матричной или гомогенной структуры и т.д. Производственные способы для микрочастиц вообще разделены на нисходящие и восходящие. В первом случае макроскопический материал ломается вследствие размалывания или гомогенизации высокого давления, во втором, частицы собираются из их молекулярных соединений осаждением, кристаллизацией, сушкой распылением и т.д.
Кроме того, процедуры собирания микрочастиц, имитирующие биологические процессы, были разработаны в последние годы. Вообще, частицы выращиваются интерактивным поперечным сшиванием органических и неорганических материалов, так называемым биомиметическим процессом.
Некоторые из процедур, описанных выше, позволяют синтезировать микрочастицы со специальной внутренней структурой. Типичные примеры - пористые микрочастицы с обширной внутренней поверхностью из-за пор и полостей матрицы. Очень интересная мелкозернистая структура может быть создана, если пористые частицы используются для того, чтобы собрать дополнительные структуры. Частицы тогда состоят из пористой матрицы и структуры, которая заполняет поры и полости матрицы.
Для различных применений желательно произвести большое количество микрочастиц, у которых должен быть четко выраженный средний размер. Далее, сформированные микрочастицы должны быть устойчивыми, чтобы храниться в течение долгого времени. Легкое и выгодное производство микрочастиц, состоящих из различных смесей, является также настоящим желанием.
КРАТКОЕ ОПИСАНИЕ
Ввиду вышеизложенного предоставлен способ формирования микрочастиц, который является простым, универсальным и подходящим для различных материалов. Сформированные микрочастицы могут состоять из одного или различных материалов или составов и могут использоваться для различных целей.
Согласно воплощению, предоставлен способ формирования микрочастиц. Способ включает:
- предоставление первого раствора, который включает, по меньшей мере, анион;
- предоставление второго раствора, который включает, по меньшей мере, катион;
- смесь первого раствора со вторым раствором в присутствии, по меньшей мере, первого состава для формирования пористых матриц, где пористые матрицы сформированы осаждением соли, которая включает анион и катион, и где первый состав, по меньшей мере, частично включен в пористые матрицы; и
- по меньшей мере, частично структурированный первый состав в пористых матрицах.
Согласно воплощению, предоставлен способ формирования микрочастиц. Способ включает:
- предоставление суспензии пористых матриц и раствора, который включает, по меньшей мере, первый состав;
- смесь раствора с суспензией для частично включенного первого состава в пористые матрицы; и
- без дальнейшего включения дальнейшего состава на отдельном этапе, по меньшей мере, частично структурированный, по меньшей мере, первый состав в пористых матрицах.
Согласно дополнительному воплощению, предоставлен способ формирования микрочастиц. Способ включает:
- предоставление первого раствора, который включает, по меньшей мере, анион;
- предоставление второго раствора, который включает, по меньшей мере, катион;
- смесь первого раствора со вторым раствором в присутствии микроматриц и, по меньшей мере, первого состава формирования пористых матриц, которые включают микроматрицы, такие как ядро, где пористые матрицы сформированы осаждением соли, которые включают анион и катион, и где первый состав, по меньшей мере, частично включен в пористые матрицы; и
- по меньшей мере, частично структурированный первый состав в пористых матрицах.
Согласно воплощению, предоставлены микрочастицы. Микрочастицы включают:
- по меньшей мере, первый состав, который структурирован; и
- пористая или губчатая полимерная сетчатая структура, которая сформирована, по меньшей мере, первым составом.
Согласно воплощению, предоставлен заменитель крови, который включает микрочастицы, которые включают пористую или губчатую полимерную сетчатую структуру, которая сформирована, по меньшей мере, структурированным гемоглобином.
В отличие от частиц, которые сформированы поперечным сшиванием в свободном растворе и которые плотно скомпонованы, микрочастицы как описано здесь имеют открытые ячейки или открытые поры. Размер микрочастиц, используемых как заменитель крови, может быть в диапазоне от приблизительно 1 µm до приблизительно 5 µm и обычно в диапазоне от приблизительно 2 µm до приблизительно 4 µm.
В некоторых осуществлениях пористые матрицы сформированы осаждением соли в присутствии состава, который был включен в пористые матрицы. Состав предоставлен, по меньшей мере, в одном из первого и второго раствора или в обоих. Во время осаждения матрицы растут и кумулятивно включают состав. Состав может быть предоставлен высокой концентрации, которая приводит к высокой норме включения, поэтому загрузка матрицы составом высока. В некоторых осуществлениях смесь составов включена в растущие пористые матрицы. В дальнейших осуществлениях, по меньшей мере, два состава впоследствии включены пошаговым или повторившимся осаждением пористых матриц.
Катион и анион обычно отобраны таким образом, что они формируют соль, которая плохо растворима в растворителе, который обычно является водным раствором. Термин “плохо растворимая соль”, который используется в этом описании, предназначен для обозначения того, что соль в основном не растворима в воде, поэтому сформированные пористые матрицы в основном устойчивы в воде.
Дальнейшее преимущество состоит в том, что матрицы, наполненные составом и, после дополнительного растворения матрицы, микрочастицы, состоявшие из состава, могут выпускаться серийно, чтобы получить большие количества микрочастиц.
Поперечное сшивание состава, включенного в пористые матрицы, позволяет легко формировать полимеры и избегать жестких условий, которые произошли бы при нормальных условиях полимеризации, таких как радикальная полимеризация. Поэтому, полимеры, основанные на чувствительных составах, таких как биомолекулы, например белки и ферменты, можно сформировать при умеренных условиях, которые в основном не воздействуют на функционирование состава. Следовательно, структурированный состав поддерживает свою определенную особенность, которая делает сформированную микрочастицу подходящей для применений, который требует, чтобы структурированный состав поддержал свою определенную функцию или активность (такую как ферментативная активность, кислородная адсорбция и способность десорбции, активность лекарственного вещества, и т.д.).
Поперечное сшивание смеси составов также возможно, поэтому может быть сформирован полимер, который состоит, по меньшей мере, из двух различных составов.
Далее, может быть сформирована полимерная сетчатая структура, которая достаточно устойчива даже после дополнительного растворения пористых матриц. Полимерная сетчатая структура также обеспечивает большую поверхность объемной доли из-за ее большой внутренней поверхности, которая доступна после растворения пористых матриц. Как правило, у микрочастиц есть открытая ячейка или открыто-пористая структура, сформированная полимерной сеткой. Поэтому дальнейшие составы могут быть адсорбированы или соединены с полимерной сетчатой структурой.
Размер сформированных микрочастиц может быть откорректирован, например, управляя процессом осаждения для формирования пористых матриц.
В некоторых осуществлениях матрицы удалены, и только матричная мелкозернистая структура остается как сетка тонких цилиндров, сетки или трубочек. Типичные матрицы, которые легко растворимы, являются, например, углекислым кальцием, всеми фосфорнокислыми кальциями и кремнеземом.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Полное и достаточное раскрытие настоящего изобретения, включая его лучший вариант, для одного среднего специалиста, сформулированы более подробно в оставшейся части описания, включая ссылку на сопутствующие числа. В этом отношении:
Рисунок 1A показывает микроснимок поперечно сшитых микрочастиц альбумина приготовленных с низкой нормой перемешивания в течение 1 минуты перед ополаскиванием. Образец содержит 1% меченного флуоресцирующего альбумина для лучшей визуализации.
Рисунок 1B показывает микроснимок поперечно сшитых микрочастиц альбумина приготовленных с высокой нормой перемешивания в течение 20 секунд перед ополаскиванием. Образец содержит 1% меченного флуоресцирующего альбумина для лучшей визуализации.
Рисунок 2A показывает микроснимок поперечно сшитых микрочастиц гемоглобина приготовленных с очень низкой нормой перемешивания в течение 2 минут перед промывкой.
Рисунок 2B показывает микроснимок поперечно сшитых частиц гемоглобина приготовленных со средней нормой перемешивания в течение 30 секунд перед промывкой.
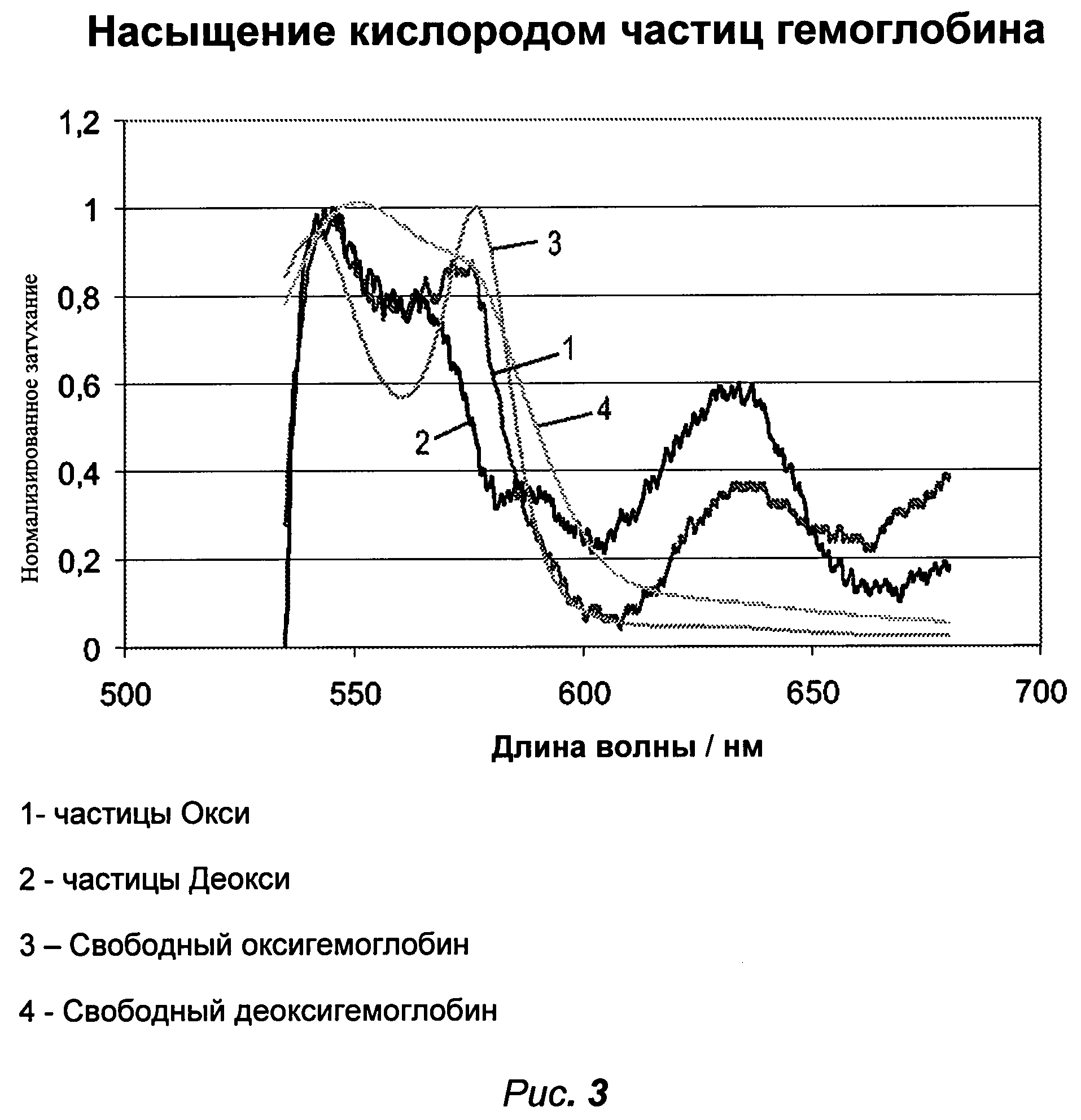
Рисунок 3 показывает график спектров поглощения поперечно сшитых микрочастиц гемоглобина при высоком и низком pO2. Для сравнения показаны спектры оксигемоглобина и гемоглобина.
Рисунок 4 показывает микроснимок поперечно сшитых микрочастиц гемоглобина/альбумина приготовленных осаждением в два приема. Во время второго осаждения добавляется 1% меченного флуоресцирующего (зеленый) альбумина для лучшей визуализации.
Рисунок 5 показывает микроснимок поперечно сшитых микрочастиц трипсина/альбумина приготовленных осаждением в два приема. Во время второго осаждения добавляется 1% меченного флуоресцирующего (зеленый) альбумин для лучшей визуализации.
Рисунок 6A показывает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченным флуоресцирующим декстраном, имеющий молекулярную массу приблизительно от 64 до 76 кДа.
Рисунок 6B показывает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченным флуоресцирующим декстраном, имеющий молекулярную массу приблизительно 564 кДа.
Рисунок 6C показывает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченным флуоресцирующим декстраном, имеющим молекулярную массу приблизительно 64-67 кДа.
Рисунок 6D показывает микроснимок поперечно сшитых микрочастиц декстрана подготовленных с декстраном, имеющим молекулярную массу приблизительно 464 кДа.
Рисунок 6E показывает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченным флуоресцирующим декстраном, имеющим молекулярную массу приблизительно 464 кДа.
Рисунок 7 показывает гистограмму интенсивности флюоресценции поверхности измененных микрочастиц, подготовленных с альбумином, и присоединенным инсулином. NK: негативная регуляция; I-MP: инсулино-поддерживающие микрочастицы
Рисунок 8 иллюстрирует последовательности способа формирования микрочастиц.
Рисунок 9 иллюстрирует рост матриц и наполнение пор.
Рисунок 10 иллюстрирует формирование микрочастиц, включающих ядро и оболочку.
ОПИСАНИЕ ПРЕДСТАВЛЕННЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
С целью улучшения понимания принципов изобретения теперь будет сделана ссылка на предпочтительные воплощения, показанные на рисунках, и будет использоваться определенный язык, чтобы описать их. Будет, однако, подразумеваться, что никакого ограничения объема изобретения, таким образом, не будет сделано, такие изменения и дальнейшие модификации в иллюстрированных устройствах и/или способах, и такие дальнейшие применения принципов изобретения также иллюстрированных, будут рассмотрены как это обычно происходило бы теперь или в будущем для одного среднего специалиста, к которому имеет отношение изобретение.
Аспект существующего изобретения как указано в этом описании - способ формирования микрочастицы осаждением, по меньшей мере, одной соли в присутствии состава или вещества, где осажденные соли формируют матрицы, в которые состав или вещество включаются во время роста матрица. При осуществлении, как показано на рисунках 7 и 8, предоставлен первый раствор 11, который включает анионы. Далее предоставлен второй раствор 12, который включает катионы. Анионы и катионы отобраны таким образом, что они производят формирование соли, которая плохо растворима в водном растворе. Анионы и катионы могут быть органическими или неорганическими. Как правило, анионы имеют неорганическую природу и могут быть отобраны из группы, содержащей ионы кальция, марганца, магния и их смеси. Далее, катионы имеют обычно неорганическую природу и могут быть отобраны из группы, содержащей ионы карбонатов, фосфатов, кислых фосфатов, вторичных кислых фосфатов, и их смеси.
Например, первый раствор может включить CaCl2 для того, чтобы обеспечить ионы кальция и второй раствор Na2CO3 для того, чтобы обеспечить ионы карбонатов, что приводит к формированию частиц CaCO3. Специалист должен понять, что катионы и анионы не ограничены вышеупомянутым примером.
Катионы и анионы далее отбираются таким образом, чтобы они допускали формирование пористых матриц путем осаждения. Частицы CaCO3 - пример пористых матриц. Другие примеры включают, не будучи ограниченным этим, MnCO3, все частицы фосфорнокислого кальция, такие как Ca3(PO4)2, CaHPO4 и Ca(H2PO4)2 и BaCO3.
Состав, который должен быть включен в пористые матрицы, которые должны сформироваться, предоставлен в первом или втором растворе 11, 12 или в обоих. Альтернативно, смесь составов может быть предоставлена в первом или втором растворе или в обоих растворах. Также возможно обеспечить состав в первом растворе и другой состав во втором растворе, таким образом, чтобы оба состава были включены во время осаждения. Предоставление составов в отдельных растворах помогает замедлять нежелательные взаимодействия между составами до включения.
Первый и второй раствор 11, 12 впоследствии смешиваются (13). Это инициирует формирование матрица 21 (рисунок 9) осаждением плохо растворимой или даже не растворимой соли, которая сформировала катионы и анионы. Осаждение имеет место в присутствии состава 25 (рисунок 9) или составов, которые, следовательно, будут одновременно и все в большей степени включены в растущие матрицы 21. Присутствие состава или составов 25 может влиять на кристаллизацию матриц 21 и ее структуру. Естественная пористая структура матриц облегчает включение состава или составов. Так как поры матриц могут быть полностью заполнены составом или составами 21 во время роста и может быть получен сильный состав в процентном соотношении матрицы, который обычно в основном выше, чем соотношение, которое может быть получено, когда состав 21 включен впоследствии в полностью сформированные пористые матрицы 21. Рисунок 9 иллюстрирует рост матриц 21.
Пористые матрицы 21 обычно формируются путем кристаллизации. Чтобы инициировать и/или управлять кристаллизацией, кристаллическая затравка может быть добавлена к смеси или к любому или обоим из первого и второго растворов. Кристаллическая затравка может быть, например, очень малыми частицами, состоящими из материала пористых матриц. Пористые матрицы, которые были подготовлены заранее или в другом состоянии, могут также использоваться как затравочные кристаллы. Это приводит к пошаговому формированию микрочастиц для последовательного или пошагового включения отдельных составов.
Преимущество “подхода осаждения”, описанного здесь, состоит в высокой загрузке матриц и таким образом можно получить микрочастицы. Предполагается, что состав или смесь составов наполняют поры растущих матриц. Матрицы, таким образом, заполнены “от внутренней стороны до внешней стороны”, что позволяет реальную полную загрузку матриц.
Этот способ отличается от других подходов, которые включают состав в предоставленные подготовленные пористые матрицы. Там, состав смешивается с подготовленными матрицами, чтобы адсорбция имела место после формирования матриц. Таким образом, матрицы заполняются “от внешней стороны до внутренней стороны”. Когда адсорбция началась на внешней стороне матриц и на входах в поры, поры могут стать заблокированными и замедлять дальнейшую загрузку матриц составом, поэтому внутренние поры могут быть не заполненными. По сравнению с этим подходом “подход осаждения” предлагает высокую норму загрузки, независимо от типа состава.
В некоторых осуществлениях, которые показаны на рисунке 10, пористые матрицы 31 сформировались в присутствии первого состава 35 или первой смеси составов путем осаждения от первой смеси, которая сформировалась путем смешивания первого раствора, который включает анионы и второй раствор, который включает. Пористые матрицы 31, например, могут быть сформированы непосредственной кристаллизацией без любого добавления затравочных кристаллов. Таким образом, сформированные пористые матрицы 31 с включенным первым составом 35 или первой смесью составов называют предварительными матрицами. В последующем шаге предварительные матрицы 31 могут использоваться как затравочные кристаллы и поэтому вводятся или смешиваются со второй смесью, которая формируется путем смешивания третьего раствора, включающего анионы с четвертым раствором, включающего катионы.
Вторая смесь также включает вторые составы 36 или вторую смесь составов, которая предоставлена в одном из третьего и четвертого раствора. Третий и четвертый раствор может включить те же самые анионы и катионы, что и первый и второй растворы. Предварительные матрицы 31 вызывает или инициирует кристаллизацию соли, которая сформирована анионами и катионами второй смеси на поверхности предварительных матриц 31, которые приводят к формированию оболочки 32 на предварительных матрицах 31. Второй состав 36 или вторая смесь составов включена в оболочку 32, которая растет на предварительных матрицах 31. Такие сформированные матрицы 37 включают ядро 31 и оболочку 32, каждый из которых заполнен определенным составом или смесями составов.
Непосредственная кристаллизация также может произойти в смеси, включающей третий и четвертый раствор, но приведет к образованию меньших пористых матриц, которые включают только второй состав или вторую смесь составов. Эти матрицы легко могут быть отделены от больших матриц, включающих предварительные матрицы путем соответствующего разделения, такого как фильтрация, сортирование или центрифугирование.
В основном, любые пористые частицы или твердые частицы могут использоваться как предварительные матрицы, чтобы инициировать формирование оболочки, которые включает состав или смесь составов. У таких пористых или твердых частиц функция как у затравочного кристалла для кристаллизации оболочки.
Формирование оболочки может быть повторено, если необходимо сформировать многократные слои оболочки, каждый из которых может включать определенный состав или смесь составов. Это позволяет приспосабливать под заказ производство микрочастиц. Например, состав или составы внешней оболочки существуют для защиты состава или составов внутренней оболочки (или оболочек) и ядра. Этот подход также позволяет капсулирование материала составом или составами, которые формируют оболочку.
У пор микрочастиц, включая ядро и оболочку, может быть средний размер (диаметр) в диапазоне приблизительно от 2 нм до 50 нм.
В некоторых осуществлениях состав или составы, включенные в матрицы, структурированы (Шаг 14 на рисунке 14). Поперечное сшивание может быть сделано после каждой стадии осаждения или в конце формирования матрицы.
Например, различные составы, возможно, нуждаются в различных агентах для структурирования, которые открывает возможность для выборочного структурирования составов. Далее, состав или составы ядра и/или оболочки или оболочек могут структурироваться отдельно или одновременно. Для того, чтобы структурировать состав или составы, используется вещество, у которого обычно есть, по меньшей мере, две функциональных группы. Такой агент является, например бифункциональным агентом. Структурирующий агент или агенты могут быть отобраны, не ограничиваясь тему, что указаны в таблице 1. Другие структурирующие агенты также могут использоваться в зависимости от состава или составов, которые будут структурированы. Например, фиксирующий раствор, используемый для фиксирования ткани, также может быть выбран.
В некоторых осуществлениях состав или составы могут быть активизированы или подготовлены к структурированию до включения и осаждения. Например, активизированные составы добавляются к любому солевому раствору для осаждения или добавляются к раствору подготовленных пористых матриц. Предактивация может включать, например, ломку специфических молекулярных мостов, которые позже используются для структурирования.
В определенных осуществлениях дисульфидные связи белков могут быть сломаны, например, дитиотреитол (DTT). Поперечное сшивание впоследствии вызывается кислородом или воздухом. Другой вариант состоит в том, чтобы связать соответствующие группы или молекулы с составом или составами, чтобы подготовить их к структурированию. Пример - биотин, который может быть связан с множеством составов. Поперечное сшивание тогда вызывает авидин.
Состав или составы, которые будут структурированы, должны иметь, по меньшей мере, одну функциональную группу, которая может формировать, будучи посредником или структурирующим агентом, связанным с другими функциональными группами того же самого или другого типа. Примерами функциональных групп являются карбоновые, карбониловыми, амино, гидроксильные и сульфгидрильные группы.
Структурированный состав или составы, полимерная сетчатая структура формируется в пористых матрицах. В зависимости от составов и структурирующего агента или используемых веществ, все составы могут быть структурированы друг с другом или могут только выборочно быть структурированы. Далее, состав 35, который формирует ядро 31, и состав 36, формирующий оболочку 32, могут быть выборочно или совместно структурированы.
Составы могут быть отобраны из группы, которая включает полимеры, биомолекулы, белки, ферменты, наночастицы, активные фармацевтические составы, пищевые добавки и их смеси. Определенные примеры включают молекулы, которые способны к закреплению молекулярного кислорода, такого как гемопротеины, гемоглобин, мышечный гемоглобин, альбумин, и их смеси. Другие примеры включают молекулы, которые являются подходящими для связывающих токсинов или инициирования в естественных условиях формирования антител. Конкретный пример для такого токсина - сакситоксин.
Как правило, пористые матрицы с капсульным составом или составами можно промыть до структурирования, чтобы удалить свободные составы, которые не были включены в матрицы. Делая так, в основном не будут сформированы структурированные свободные составы, которые имели бы преимущество для дальнейших дополнительных процедур, таких как очистка и обогащение матриц. Далее, после каждого шага осаждения/включения, полученные матрицы или предварительные матрицы обычно отделяются от смеси подходящими способами разделения, включая промывание, фильтрацию и центрифугирование.
В некоторых осуществлениях пористые матрицы 21, 37 растворяются (шаг 15 на рисунке 8) после структурирования, чтобы сформировать микрочастицы 24, 38, которые состоят, по меньшей мере, из одного структурированного состава (рисунки 9 и 10). Термин “микрочастица”, который используется в этом описании, обозначает частицы, которые включают полимерную сетчатую структуру, у которых есть пористая или губчато-подобная структура. Микрочастицы 24, 28 обычно являются сферическими, но могут быть любой другой формы - кубической, эллиптической или подобной стержню. У микрочастиц может быть размер (диаметр или наибольшая длина), по меньшей мере, 20 нм, в том числе 100 нм и в том числе 500 нм. Далее, у микрочастиц может быть размер меньше 50 µm, также меньше 20 µm и чаще меньше чем 5 µm. В некоторых осуществлениях у микрочастицы имеют средний размер приблизительно между 3 µm и 5 µm.
Размер сформированных матриц 21, 37 и таким образом микрочастиц 24, 38 является настраиваемым, не ограничиваясь этим, изменяя любой из следующих параметров: температура, концентрация солевых растворов, нормы и продолжительности перемешивания во время процесса кристаллизации, или комбинации этих параметров.
Растворение должно быть выполнено в такой окружающей среде, которая не воздействует или в основном не воздействует на функционирование и/или активность составов. В случае с CaCO3 матрицы могут быть легко растворены агентом для образования хелатных соединений, таких как EDTA в умеренных условиях для большинства биомолекул.
Составы, которые будут включены обычным способом, имеют молекулярную массу, по меньшей мере, 20 кДа, в частности 30 кДа. Наблюдалось, что составы, имеющие минимальную молекулярную массу около 20 кДа, формируют устойчивые микрочастицы после растворения пористых матриц. Для длительного или постоянного включения меньших составов, то есть составов, у которых есть молекулярная масса меньше чем 20 кДа, после растворения пористых матриц, может использоваться смесь большего состава, имеющего молекулярную массу выше, чем 20 кДа и малого состава. Больший состав или составы формируют “основу” полимерной сетчатой структуры, с которой связывается малый состав.
В некоторых осуществлениях первый состав включен в предварительно подготовленные пористые матрицы.
Для этой цели пористые матрицы предоставлены в суспензии, которая смешана с раствором, включающим, по меньшей мере, первый состав. Позволяя первому составу быть адсорбированным в матрицах в течение данного времени, пористые матрицы хотя бы частично заполнены составом. В данном случае, первый состав адсорбирован после формирования матриц.
Два или больше составов могут быть включены посредством предоставления их в растворе. Если адсорбция установлена электростатическим взаимодействием, у составов должен быть тот же самый заряд, чтобы избежать электростатической помехи. Этот подход - одношаговый процесс, где все составы включаются за один шаг. Без дальнейших процедур включения объединенный состав или составы частично структурированы, как описано выше. Наполненные пористые матрицы могут впоследствии использоваться, как затравочный кристалл для формирования оболочки в наполненных пористых матрицах как описано выше. В качестве альтернативы, наполненные пористые матрицы могут быть растворены, как описано выше, чтобы получить микрочастицы, состоящие из полимерной сетчатой структуры, как описано выше.
Пористые матрицы, используемые для одношагового процесса, могут быть отобраны, не будучи ограниченным этим, из группы, включающей SiO2, карбонаты, такие как CaCO3 и MnCO3, фосфаты, такие как Ca3(PO4)2, CaHPO4, Ca(H2PO4)2, и их смеси.
Независимо от их формирования, микрочастицы могут быть маркированы, функционализированы и/или лиофилизированы. Маркировка и функционализирование может быть сделано во время включения, до или после растворения матриц. В некоторых осуществлениях микрочастицы маркированы и/или функционализированы после растворения матриц, чтобы иметь свободный проход ко всем структурированным составам. Микрочастицы с или без матриц могут быть лиофилизированы.
Независимо от их формирования, сформированные микрочастицы или матрицы могут использоваться в различных целях. Пример - носитель лекарственных средств. Активный фармацевтический препарат может быть или структурированным составом или составом, который адсорбирован на полимерной сетчатой структуре или ковалентно связан с ней после растворения матриц. Когда препарат будет структурирован, он будет выпущен в естественных условиях расколом связи, которая может быть, например, установлена ферментно.
С другой стороны, когда препарат адсорбирован полимерной сетчатой структурой, он будет выпущен десорбцией, которая например, может быть вызвана изменениями физико-химической окружающей среды.
В этом описании термин “активный фармацевтический препарат” описывает структурный химический элемент, который изменяет, замедляет, активизирует или иначе воздействует на биологические процессы. Например, препарат включает, но не ограничивается, антираковые вещества, противовоспалительные агенты, иммунодепрессанты, противокоагулирующие средства, антитромботические агенты, ингибиторы ферментации, анальгетики, антипролиферативные агенты, противогрибковые вещества, цитостатические вещества, факторы роста, гормоны, стероиды, нестероидные вещества и антигистамины.
В некоторых осуществлениях микрочастицы включают покрытие, которое заключает в капсулу микрочастицы. Покрытие можно сформировать до или после растворения матриц. Как правило, покрытие сформировано до растворения, чтобы была доступна в большей степени плотная поверхность, на которой сформировали покрытие. Покрытие можно сформировать различными способами, такими как смещение полимеров, липидов и/или полиэлектролитов.
Конкретный пример относится к микрочастицам, который включает инсулин, который может быть выпущен в естественных условиях. Такие микрочастицы могут включать инсулин, который был включен в пористые матрицы во время осаждения или адсорбции в предварительно подготовленные пористые матрицы. Тогда, второе осаждение с декстраном, содержащим растворы, приводит к генерации оболочки на инсулине и вокруг него, содержащего микрочастицу. Декстран в оболочке впоследствии структурируется, и пористая матрица растворена. Выпуск захваченного инсулина зависит от структуры оболочки декстрана.
Другой Конкретный пример относится к микрочастицам, используемым как заменитель крови. Такие микрочастицы могут включать структурированный гемоглобин, который был включен в пористые матрицы во время осаждения или адсорбции в предварительно подготовленные пористые матрицы. Структурированный гемоглобин формирует пористую полимерную сетку, которая обычно имеет структуру открытой ячейки и запускает диффузию растворителя и кислорода. Такие структурированные микрочастицы гемоглобина обеспечивают адсорбцию и десорбцию кислорода, который делает их подходящими как заменитель крови. При структурировании, микрочастицы являются в основном не содержащими гемоглобина тетрамера. Можно использовать человеческий или бычий, или любой другой гемоглобин.
Размер микрочастиц гемоглобина находится обычно в диапазоне приблизительно от 1 µm и до 5 µm и, особенно в диапазоне приблизительно от 2 µm до 4 µm. У полимерной сетки, которая сформировала структурированный гемоглобин, может быть молекулярная масса 560 кДа. Заменитель крови обычно далее включает физиологический раствор, в котором рассеяны микрочастицы. Альтернативно, микрочастицы, состоящие из структурированного гемоглобина, могут быть представлены в виде порошка, такой как лиофилизированные частицы, для того, чтобы рассеяться в физиологическом растворе.
Согласно осуществлению, предоставлен комплект, включая сухой порошок поперечно сшитых микрочастиц гемоглобина и физиологического раствора.
В дополнение к гемоглобину микрочастицы могут включать вспомогательный фактор, такой как 2,3-DPG, например, когда используется человеческий гемоглобин. Далее, микрочастицы гемоглобина могут также включать ферменты, такие как ферменты эритроцита. Примеры - карбоангидраза и каталаза.
Для производства микрочастиц гемоглобина гемоглобин включается во время осаждения и роста матриц. Гемоглобин может также быть адсорбирован в предоставленные пористые матрицы. Дополнительный вспомогательный фактор и/или ферменты могут быть включены в матрицы во время осаждения матриц или адсорбции вместе с гемоглобином. Само собой разумеется, что другие составы также могут быть включены в микрочастицы гемоглобина. Гемоглобин и дополнительные составы (вспомогательный фактор, ферменты и белки) будут структурированы.
Микрочастицы гемоглобина могут включать ядро и, по меньшей мере, одну оболочку. Ядро обычно состоит из структурированного гемоглобина с дополнительным вспомогательным фактором, в то время как оболочка состоит из белка, такого как альбумин. Дополнительные ферменты могут быть в ядре и/или оболочке.
Дополнительно, микрочастицы гемоглобина могут включать покрытие, которое заключает микрочастицы в капсулу. Покрытие обычно сформировывается до растворения пористых матриц. Подходящие материалы покрытия - альбумин или другие белки, декстраны, полиэтиленоксиды и полиэтиленгликоли различных молекулярных масс и липиды различного состава.
Для производства поперечно сшитых микрочастиц гемоглобина может использоваться любой из способов, содержащихся в этом описании. Квалифицированный человек поймет, что модификации, которые могли бы потребоваться, станут очевидными из описания. Для того, чтобы закончить заменитель крови, структурированные микрочастицы гемоглобина могут быть рассеяны в физиологическом растворе, который может включать дополнительные добавки.
В основном, микрочастицы могут использоваться как носители для разных веществ, которые могут быть адсорбированы или иначе связаны с открытой ячейкой или открыто-пористой полимерной сетчатой структурой. В зависимости от используемых поперечно сшитых составов, гидрофильные или гидрофобные вещества могут быть включены в микрочастицы после растворения матриц.
Микрочастицы могут далее использоваться как микрокатализатор или косметические препараты.
В некоторых осуществлениях микрочастицы включают ядро и, по меньшей мере, одну оболочку, где каждый включает различный фермент. Такие микрочастицы могут формировать ферментный каскад таким образом, что вещество будет пошагово ферментно изменено или изменено соответствующими ферментами. Микрочастицы, которые включают две или больше оболочки, обеспечивают расширение каскада на три или больше шага.
Далее будут описаны конкретные примеры вместе с рисунками.
Пример 1: Способ формирования микрочастиц альбумина
Примером 1 является определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают, по меньшей мере, один структурированный состав, который включается в пористые матрицы во время осаждения.
Начальные растворы - CaCl2, Na2CO3 и альбумин (человеческий, бычий…) - раствор Na2CO3 предоставлен в надлежащем резервуаре. Альбумин, который представляет здесь состав, который будет включен, добавлен к раствору CaCl2, и смесь добавляется к раствору Na2CO3 при непрерывном перемешивании. Конечная концентрация CaCl2 и Na2CO3 была равна. Продукты процедуры - альбумин, содержащий частицы CaCO3 (матрицы) и NaCl. Размер частиц альбумина/CaCO3 является корректируемым за счет изменения температуры, концентрации солевых растворов, нормы и/или продолжительности перемешивания во время процесса кристаллизации. Сформированные частицы (матрицы) отделяются центрифугированием 1000×r за 1 минуту, и супернатант декантируется. Затем гранула вымывается три раза дистиллированной водой, чтобы удалить избыток альбумина в суспензии.
Для структурирования хорошо смешанные уплотненные частицы добавляются к раствору глютаральдегида при конечной концентрации 2% и инкубируются при комнатной температуре в течение 1 часа. Время инкубации может варьироваться, если требуется различная норма структурирования. Затем структурированные частицы альбумина/CaCO3 отделяются центрифугированием 1000×r за 1 минуту, и супернатант декантируется. Затем гранула вымывается три раза дистиллированной водой, чтобы удалить избыток глютаральдегида в суспензии.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и растворяются кристаллы CaCO3. Таким образом, получены микрочастицы чистого структурированного альбумина с определенным размером (рисунки 1A и 1B). Микрочастицы отделяются центрифугированием 2000×r за 10 минут, и супернатант декантируется. Затем гранула вымывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии. Чтобы обеспечить лучшую визуализацию микрочастиц и подтверждения, что микрочастицы внутренне включали альбумин, используется 1% меченного флуоресцирующего альбумина. Рисунок 1A показывает структурированные частицы альбумина, подготовленные по низкой норме перемешивания (приблизительно 1 s-1 в этом примере) в течение 1 минуты перед ополаскиванием, тогда как рисунок 1B показывает структурированные частицы альбумина, подготовленные по высокой норме перемешивания (10 s-1 в этом примере) за 20 секунд перед ополаскиванием.
Пример 2: Способ Формирования микрочастиц гемоглобина
Примером 2 является определенное осуществление, имеющее отношение к формированию микрочастиц, подходящих как заменитель крови.
Начальные растворы - CaCl2, Na2CO3 и гемоглобин (изолированный например, от эритроцитов млекопитающих). Раствор CaCl2 предоставлен в соответствующем резервуаре. Гемоглобин, который является составом, который будет включен, добавляется к раствору Na2CO3, и смесь добавлена к раствору CaCl2 при перемешивании. Конечная концентрация CaCl2 и Na2CO3 была равна. Продукты процедуры - гемоглобин, содержащий частицы CaCO3 (матрицы) и NaCl. Размер частиц гемоглобин/CaCO3 является регулируемым за счет изменения температуры, концентрации солевых растворов, норм и продолжительности перемешивания во время процесса кристаллизации. Затем сформированные частицы отделяются центрифугированием при 1000×r за 1 минуту, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток гемоглобина в суспензии.
Для структурирования, хорошо смешанные уплотненные частицы (матрицы с объединенным гемоглобином) добавляются к раствору глютаральдегида с конечной концентрацией 2% и инкубируются при комнатной температуре в течение 1 часа. Время инкубации может быть различным, если требуется различная норма структурирования. Структурированные частицы гемоглобина/CaCO3 отделяются центрифугированием при 1000×r за 1 минуту, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток глютаральдегида в суспензии.
Наконец, частицы добавляются к раствору 0.2 М EDTA, и кристаллы CaCO3 растворяются. Таким образом, получены микрочастицы чистого структурированного гемоглобина с определенным размером (рисунки 2A и 2B). Микрочастицы тогда отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза с дистиллированной водой, чтобы удалить избыток EDTA в суспензии.
Структурированные микрочастицы гемоглобина показали способность обратимого связывания кислорода как показано спектрами поглощения на рисунке 3, где 1 обозначает насыщенные кислородом микрочастицы и 2 безкислородные микрочастицы.
Показано для сравнения спектр гемоглобина (4) и оксигемоглобина (3). Насыщенные кислородом микрочастицы (pO2=17 кПа) показали типичный спектр оксигемоглобина. После экспонирования в атмосфере CO2/N2 в течение 20 минут был достигнуто 5 кПа pO2, и поглощение суспензии микрочастиц гемоглобина изменено до типичного спектра деокси-гемоглобина (4).
Спектры раствора гемоглобина и частиц гемоглобина были измерены, используя спектрофотометр (“Хитачи” К2800). Значения pO2 и pCO2 были измерены посредством анализатора кислотно-основного баланса крови (ABL 700, радиометр).
Рисунок 2A показывает микроснимок поперечно сшитых микрочастиц гемоглобина, подготовленных при низкой или очень низкой норме перемешивания (приблизительно 0.5 s-1 в этом примере) в течение 2 минут до промывания, в то время как рисунок 2B показывает микроснимок поперечно сшитых частиц гемоглобина, подготовленных при средней норме перемешивания (приблизительно 5 s-1 в этом примере) в течение 30 секунд перед промыванием.
Пример 3: Способ для подготовки сложных микрочастиц гемоглобина/альбумина
Примером 3 является определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают ядро и оболочку, каждый из которых состоит из разных составов.
Начальные растворы - CaCl2, Na2CO3, гемоглобин (изолированный от эритроцитов млекопитающих) и альбумин. Раствор CaCl2 предоставлен в надлежащем резервуаре. Гемоглобин добавлен к раствору Na2CO3 и смесь добавлена к раствору CaCl2 при перемешивании. Конечная концентрация CaCl2 и Na2CO3 была равна. Продукты процедуры - гемоглобин, содержащий частицы CaCO3 и NaCl. Размер частицы гемоглобина/CaCO3 является регулируемым за счет изменения температуры, концентрации солевых растворов, нормы и продолжительности перемешивания во время процесса кристаллизации. Затем сформированные частицы отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток гемоглобина в суспензии.
Затем частицы повторно суспендируются в растворе CaCl3, который содержит альбумин, и раствор Na2CO3 добавляется при перемешивании. Инициированное новое осаждение CaCO3 частично происходит на поверхности существующих частиц, приводящее к генерации оболочки, содержащей альбумин. Частицы, содержащие только альбумин, отделяются постепенным центрифугированием плотности или фильтрацией, основанной на их значительно меньшем диаметре.
Для структурирования, хорошо смешанные уплотненные частицы добавляются к раствору глютаральдегида при конечной концентрации 2% и инкубируются при комнатной температуре в течение 1 часа. Время инкубации может быть различным, если требуется различная норма структурирования. Затем структурированные частицы гемоглобина/альбумина/CaCO3 отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток глютаральдегида в суспензии.
Реакция структурирования может также быть выполнена после каждого шага осаждения.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и кристаллы CaCO3 растворяются. Таким образом, получены микрочастицы структурированного гемоглобина с оболочкой структурированного альбумина. Затем микрочастицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза с дистиллированной водой, чтобы удалить избыток EDTA в суспензии.
Рисунок 4 отображает микроснимок таких сформированных поперечно сшитых микрочастиц гемоглобина/альбумина, подготовленных двушаговым осаждением. Во время второго шага осаждения добавляется 1% меченного флуоресцирующего (зеленого) альбумина для лучшей визуализации. Как становится очевидным из рисунка 4, микрочастицы включает флуоресцентную наружную оболочку, которая относится к оболочке альбумина.
Пример 4: Способ подготовки соединения микрочастиц трипсина/альбумина
Примером 4 является определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают ядро и оболочку двух различных составов.
Начальные растворы - CaCl2, Na2CO3, трипсин и альбумин. Раствор Na2CO3 предоставлен в надлежащем резервуаре. Трипсин добавляется к раствору CaCl2, и смесь добавляется к раствору Na2CO3 при перемешивании. Конечная концентрация CaCl2 и Na2CO3 была равна. Продукты процедуры - трипсин, содержащий частицы CaCO3 и NaCl. Размер частиц трипсина/CaCO3 является регулируемым за счет изменения температуры, концентрации солевых растворов, нормы и продолжительности перемешивания во время процесса кристаллизации. Затем сформированные частицы отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток трипсина в суспензии.
Затем частицы повторно суспендируются в растворе CaCl2, который содержит альбумин, и добавляется раствор Na2CO3 при перемешивании. Инициированное новое осаждение CaCO3 частично происходит на поверхности существующих частиц, приводящих к генерации оболочки, содержащей альбумин. Частицы, содержащие только альбумин, отделяются постепенным центрифугированием плотности или фильтрацией, основанной на их значительно меньшем диаметре.
Для структурирования, хорошо смешанные уплотненные частицы добавляются к раствору глютаральдегида при конечной концентрацией 2% и инкубируются при комнатной температуре в течение 1 часа. Время инкубации может быть различным, если требуется различная норма структурирования. Затем частицы структурированного трипсина/альбумина/CaCO3 отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток глютаральдегида в суспензии.
Реакция структурирования также может быть выполнена после каждого шага осаждения.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и кристаллы CaCO3 растворяются. Таким образом, получены микрочастицы структурированного трипсина с оболочкой структурированного альбумина.
Затем микрочастицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии.
Рисунок 5 отображает микроснимок поперечно сшитых микрочастиц трипсина/альбумина, подготовленных двушаговым осаждением. Во время второго шага осаждения добавляется 1% меченного флуоресцирующего (зеленого) альбумина для лучшей визуализации. Как можно увидеть на рисунке 5, большие микрочастицы сформировали нефлуоресцентное ядро и флуоресцентную оболочку, а меньшие микрочастицы те, которые просто включают флуоресцентное ядро. Меньшие микрочастицы сформированы непосредственно кристаллизацией CaCO3 в растворе альбумина и таким образом не включают ядро трипсина как большие микрочастицы. Ядра/оболочки микрочастиц могут быть отделены от меньших микрочастиц любой подходящей способикой разделения.
Пример 5: Способ Формирования частицы декстрана
Примером 5 является другое определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают, по меньшей мере, один структурированный состав.
Начальные растворы - CaCl2, Na2CO3 и декстран (MW 4-2500 кДа). Раствор Na2CO3 предоставлен в надлежащем резервуаре. Декстран добавляется к раствору CaCl2 (концентрация декстрана варьируется от 2,5 до 10%), и добавляется смесь к раствору Na2CO3 при непрерывном перемешивании. Конечная концентрация CaCl2 и Na2CO3 была равна. Продукты процедуры - декстран, содержащий частицы Ca2CO3 и NaCl. Размер частиц декстрана/CaCO3 является регулируемым за счет изменения температуры, концентрации соли и растворов декстрана, нормы и продолжительности перемешивания во время процесса кристаллизации. Затем сформированные частицы отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток декстрана в суспензии.
Для структурирования, хорошо смешанные уплотненные частицы повторно суспендируются в 0,1 М NaOH и дивинилсульфон (DVS) добавляется до конечной концентрации 0,1-0,3% (объем/объем), и образцы инкубируются при перемешивании при комнатной температуре в течение 2 часов.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и кристаллы CaCO3 растворяются при комнатной температуре в пределах 20 мин. Таким образом, получены микрочастицы чистого структурированного декстрана с различным распределением по крупности (рисунки 6A-6E). Частицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии. Оптимальная концентрация DVS для частиц с размером от 2 до 10 µm составляла 0,1% (объем/объем).
Рисунок 6A отображает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченым флуоресцирующим декстраном, имеющим молекулярную массу приблизительно 64-76 кДа. Рисунок 6B отображает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченым флуоресцирующим декстраном, имеющим молекулярную массу приблизительно 564 кДа. Рисунок 6C отображает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченым флуоресцирующим декстраном, имеющим молекулярную массу приблизительно 64-67 кДа. Рисунок 6D отображает микроснимок поперечно сшитых микрочастиц декстрана приготовленных с декстраном, имеющим молекулярную массу приблизительно 464 кДа. Рисунок 6E отображает микроснимок поперечно сшитых микрочастиц декстрана, подготовленных с меченым флуоресцирующим декстраном, имеющим молекулярную массу приблизительно 464 кДа.
Пример 6: Способ для Формирования микрочастиц альбумина
Примером 6 является определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают, по меньшей мере, один структурированный состав, включением состава в предварительно подготовленные пористые матрицы.
Начальные растворы - CaCl2, Na2CO3 и альбумин (человеческий, бычий…). Раствор Na2CO3 предоставлен в надлежащем резервуаре, и раствор CaCl2 добавлен при непрерывном перемешивании. Конечная концентрация CaCl2 и Na2CO3 была равна. Продукты процедуры - пористые частицы CaCO3 и NaCl. Размер частиц CaCO3 - регулируемый за счет изменения температуры, концентрации солевых растворов, нормы и продолжительности перемешивания во время процесса кристаллизации.
Сформированные частицы отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой.
Затем промываются частицы, повторно суспендируются в водном растворе альбумина, и суспензия инкубируется при перемешивании в течение 1 часа, чтобы провести адсорбцию белка в порах частиц.
Для структурирования хорошо смешанные уплотненные частицы добавляются к раствору глютаральдегида при конечной концентрации 2% и инкубируются при комнатной температуре в течение 1 часа. Время инкубации может быть различным, если требуется различная норма структурирования. Затем структурированные частицы альбумина/CaCO3 отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток глютаральдегида в суспензии.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и кристаллы CaCO3 растворяются. Таким образом, получены микрочастицы чистого структурированного альбумина с определенным размером. Микрочастицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии.
Пример 7: Способ добавления пептидов и белков на поверхности поперечно сшитых полимерных микрочастиц
Пример 7 описывает определенное осуществление, касающееся модификации, функционализирования и/или покрытия поверхности микрочастиц.
Белки и пептиды присоединяются к микрочастицам, подготовленным согласно любому из примеров 1-6, используя соединение авидина/биотина. С этой целью микрочастицы сначала соединяются с биотином (1 мг сульфо-NHS-LG-биотин в PBS (фосфатно-солевой буферный раствор) на 10 частиц) инкубацией при комнатной температуре в течение 1 часа. Затем микрочастицы промываются три раза PBS, чтобы удалить избыток биотина.
Соединенные биотином микрочастицы повторно суспендируются в PBS, содержащий авидин (50 µg на 108 частиц), и инкубируются при перемешивании в течение 1 часа (комнатная температура) и наконец промываются 3 раза в PBS. Теперь соединенные биотином пептиды, белки, ДНК и т.д. NH3-несущие молекулы могут быть присоединяются к поверхности частиц. Соединение молекул было определено количественно посредством проточно-цитометрических измерений (рисунок 7), используя меченный флуоресцирующий авидин или биотин (NK: негативная регуляция; I-MP: инсулино-несущие микрочастицы).
Пример 8: Способ добавления полиэтиленгликоля на поверхности поперечно сшитых полимерных микрочастиц
Пример 8 описывает еще одно определенное осуществление, касающееся модификации, функционализирования и/или покрытия поверхности микрочастиц.
Поверхность микрочастиц, подготовленных согласно любому из примеров 1-6, была изменена ковалентным добавлением PEG (MW 2-20000). С этой целью микрочастицы повторно суспендировались в растворе метоксильного полиэтиленгликоля 20 мг/мл (mPEG) в борнокислом буферном 0,1 М с pH фактором 9 и инкубировались при перемешивании при комнатной температуре в течение 1 часа. Три промывания дистиллированной водой завершают процедуру.
Соединение PEG с микрочастицами было подтверждено измерениями дзета-потенциала (Nanosizer 3000, Malvern, U.K.) c PEG-модифицированными частицами, имеющими значительно более низкий дзэта-потенциал. Например, значение дзета-потенциала немодифицированных частиц гемоглобина составляло 28±5 мВ, который был измерен в чистой дистиллированной воде (удельная электропроводность 0,01-0,03 миллисекунда/см). PEG-модифицированные частицы гемоглобина показали потенциал только 9±3 мВ, который был измерен при подобных условиях.
В то время как предпочтительные осуществления были подробно иллюстрированы и описаны на рисунках и в предшествующем описании, то же самое нужно считать иллюстративным и не ограничивающим значения, подразумевается, что только предпочтительные осуществления, показанные и описанные, и что все изменения и модификации, которые осуществляются в пределах идеи изобретения теперь или в будущем, должны быть защищены.
Пример 9: Способ Формирования микрочастиц полимера/протеина кислородным поперечное сшиванием
Примером 9 является определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают, по меньшей мере, один структурированный состав, который включен в пористые матрицы, сформировавшиеся во время осаждения. Структурированный состав может быть белком и/или полимером. В этом примере частицы протеина/полимера сформировались за один шаг, где впоследствии происходит поперечное сшивание. В отличие от примера 1, состав активизирован до осаждения, и структурирован кислородом.
Начальные растворы - CaCl2, Na2CO3 и белок, полимер или раствор мономера или смесь любого белка, полимера и мономера. Белок, полимер или мономер, которые представляют здесь состав, который будет включен, активизированы. В случае белков для активации может использоваться дитиотреитол (DTT). DTT ломает дисульфидные связи. Активизированный состав добавляется к любому из растворов Na2CO3 и CaCl2. Затем, эта смесь смешана с другими из Na2CO3 и раствора CaCl2. Например, раствор Na2CO3 с добавленным активизированным составом может быть предоставлен в надлежащем резервуаре, и затем раствор CaCl2 добавлен к нему при непрерывном перемешивании. Конечная концентрация CaCl2 и Na2CO3 примерно равна. Во время смешивания происходит осаждение с одновременным включением активизированного состава. Продукты процедуры являются составными (например, альбумин) содержащий частицы CaCO3 (матрицы) и NaCl. Размер частиц состава/CaCO3 - регулируемый за счет изменения любого из температуры, концентрации солевых растворов, нормы и/или продолжительности перемешивания во время процесса кристаллизации/осаждения. Сформированные частицы (матрицы) отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток состава в суспензии.
Альтернативно или впоследствии, гранула может также повторно суспендироваться в воде или в растворе HCl при умеренном смешивании. В то же самое время, воздух или кислород могут быть введены в раствор для структурирования, активизированного состава. Продолжительность этого шага и количество подачи воздуха/кислорода через раствор определяют уровень структурирования.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и кристаллы CaCO3 растворяются при комнатной температуре в пределах 20 мин. Таким образом, получены микрочастицы структурированного состава. Частицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии. В случае с альбумином сформировались структурированные микрочастицы альбумина.
Пример 10: Способ Формирования микрочастиц альбумина/гемоглобина кислородным поперечное сшиванием
Примером 10 является определенное осуществление, имеющее отношение к формированию микрочастиц, которые включают альбумин и гемоглобин, где альбумин активизирован перед осаждением. Активация и формирование микрочастиц могут быть сделаны, как описано в примере 9.
Начальные растворы - CaCl2, Na2CO3, раствор альбумина, и раствор гемоглобина. Альбумин активизирован, используя дитиотреитол (DTT) как описано выше. Активизированный альбумин добавлен к любому из растворов Na2CO3 и CaCl2. Раствор гемоглобина добавлен к другим из растворов Na2CO3 и CaCl2, и затем оба раствора смешиваются при непрерывном перемешивании. Конечная концентрация CaCl2 и Na2CO3 обычно равна. Во время смешивания происходит осаждение с увеличивающимся включением гемоглобина и активизированного альбумина. Продукты процедуры - альбумин/гемоглобин, содержащий частицы CaCO3 и NaCl. Сформированные частицы отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток состава в суспензии.
Альтернативно или впоследствии, гранула может также повторно суспендироваться в воде или в растворе HCl при умеренном смешивании. В то же самое время, воздух или кислород вводятся в раствор для структурирования активизированного альбумина, где альбумин также структурирован с гемоглобином. Продолжительность этого шага и количество подачи воздуха/кислорода через раствор определяют уровень структурирования.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и кристаллы CaCO3 растворяются при комнатной температуре в пределах 20 мин. Таким образом, получены микрочастицы структурированного альбумина/гемоглобина. Частицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии.
Пример 11: Способ формирования поперечно сшитых плазменных микрочастиц
Этот пример отличается от примера 1 использованием плазмы крови вместо альбумина, где плазма крови структурирована, используя тромбин. Следовательно, этот определенный пример относится к формированию микрочастиц, которые включают структурированную плазму.
Начальные растворы - CaCl2, Na2CO3 и плазма крови (человеческая, бычья…). Раствор Na2CO3 предоставлен в надлежащем резервуаре. Плазма крови, которая здесь представляет состав, который будет включен, добавляется к раствору CaCl2, и смесь добавляется к раствору Na2CO3 при непрерывном перемешивании. Конечная концентрация CaCl2 и Na2CO3 в основном равна. Плазма, содержащая частицы CaCO3, сформирована осаждением. Сформированные частицы (матрицы) отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток альбумина в суспензии.
Для структурирования тромбин добавляется к хорошо смешанным частицам при концентрации приблизительно 8 МЕ/мл и выводится при комнатной температуре в течение 20 минут при 37°C. 1 ME (международная единица) соответствует тромбину массой приблизительно 0,0583 мг; 8 ME тромбина - это приблизительно 0,4664 мг. Тромбин приводит к структурированию фибронектина, который содержится в плазме крови. Время инкубации и/или температура могут быть различными, если требуется различная норма структурирования. Выбирая температуру и/или время инкубации, особенности сформированных частиц, например плотность структурирования, могут быть отрегулированы. Затем структурированные частицы плазмы крови / CaCO3 отделяются центрифугированием при 1000×r в течение 1 минуты, и супернатант декантируется.
Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток тромбина в суспензии.
Наконец, частицы добавляются к раствору 0,2 М EDTA, и частицы CaCO3 растворяются. Таким образом, получены микрочастицы структурированной плазмы крови с определенным размером, как показано на рисунках 1A и 1B, пример 1. Микрочастицы отделяются центрифугированием при 2000×r в течение 10 минут, и супернатант декантируется. Затем гранула промывается три раза дистиллированной водой, чтобы удалить избыток EDTA в суспензии.
Этим процессом сформированы полые или губчато-подобные микрочастицы плазмы крови, которые могут включать другие составы, если они добавляются во время осаждения или содержались в любом из солевых растворов. Например, могут добавляться пептиды, которые захватываются микрочастицами плазмы крови.
Пример 12: Способ формирования микрочастицы, которые включают биотинилированные составы
Пример относится к способу формирования микрочастиц, которые включают биотинилированные составы, отобранные из белков, ДНК, РНК, пептидов, антител, антигенов, биополимеров и их смесей. Эти составы могут быть включены в пористые частицы осаждением, как описано выше в любом из примеров, включая адсорбцию в предоставленные пористые частицы.
В отличие от других примеров, поперечное сшивание осуществляется с применением авидина, который структурируется с биотином биотинилированными составами. Составы могут быть предоставлены в их биотинилированной форме или могут быть биотинилированны в предыдущем шаге. Концентрация, и отношение между авидином и биотином определяет уровень структурирования. Например, отношение между биотином к авидин может быть около 5:1. Конкретный пример - биотинилированный альбумин. Применяя биотинилированный альбумин, используется приблизительно 16 ммоль биотинов и приблизительно 3 ммоль. Квалифицированный человек должен понять, что другие составы могут требовать других соотношений.
После растворения пористых матриц как описано выше, получены микрочастицы, которые могут включать пептиды, ДНК, РНК или другие составы.
Реферат
Изобретение относится к способу формирования микрочастиц. Заявленный способ включает обеспечение первого раствора, включающего анион, и обеспечение второго раствора, включающего катион, смешивание указанных первого и второго растворов в присутствии первого соединения, имеющего молекулярную массу по меньшей мере 20 кДа, для формирования пористых матриц. Пористые матрицы формируются путем осаждения соли, содержащей указанный анион и указанный катион, при этом указанное первое соединение, по меньшей мере, частично включено в пористые матрицы. Далее способ включает частичное поперечное сшивание указанного первого соединения в пористых матрицах и растворение пористых матриц с формированием микрочастиц, содержащих указанное поперечно-сшитое первое соединение. Изобретение направлено на обеспечение высокой загрузки матрицы первым соединением, устойчивости сформированных микрочастиц в воде и легкости формирования полимеров, а также сохранения функции первого соединения, например ферментативной активности или кислородной адсорбции. 5 з.п. ф-лы, 10 ил., 1 табл., 12 пр.
Формула
- обеспечение первого раствора, включающего, по меньшей мере, анион;
- обеспечение второго раствора, включающего, по меньшей мере, катион;
- смешивание указанного первого и указанного второго растворов в присутствии, по меньшей мере, первого соединения, имеющего молекулярную массу по меньшей мере 20 кДа, для формирования пористых матриц, где пористые матрицы формируются путем осаждения соли, содержащей указанный анион и указанный катион, и где указанное первое соединение, по меньшей мере, частично включено в пористые матрицы;
- по меньшей мере, частичное поперечное сшивание указанного первого соединения в пористых матрицах;
- растворение пористых матриц с формированием микрочастиц, содержащих, по меньшей мере, указанное поперечно-сшитое первое соединение.
- обеспечение третьего раствора, включающего, по меньшей мере, анион;
- обеспечение четвертого раствора, включающего, по меньшей мере, катион;
- смешивание указанного третьего и указанного четвертого растворов в присутствии указанных пористых матриц и, по меньшей мере, второго соединения, имеющего молекулярную массу по меньшей мере 20 кДа, так, что пористые матрицы растут путем осаждения соли, содержащей указанный анион и указанный катион, где указанное второе соединение, по меньшей мере, частично включено в пористые матрицы;
- по меньшей мере, частичное поперечное сшивание указанного второго соединения в пористых матрицах;
- растворение пористых матриц с формированием микрочастиц, содержащих, по меньшей мере, указанное поперечно-сшитое первое соединение и указанное поперечно-сшитое второе соединения.
- промывание указанных пористых матриц перед поперечным сшиванием указанного первого и/или указанного второго соединения.
- связывание антител и/или антигенов с микрочастицами.

Комментарии