Микрокапсулы, содержащие рисперидон, фармацевтическая композиция и способы их получения - RU2178695C2
Код документа: RU2178695C2
Чертежи

Описание
Изобретение относится к микрокапсулированному рисперидону, способу получения и применению в лечении психических заболеваний.
Патент США 4804663 раскрывает 3-пиперидинил-1,2-бензизотиазолы и 3-пиперидинил-1,2-бензизоксазолы, обладающие противопсихотическими свойствами. В частности, описан 3-[2-[4-(6-фтор-1,3-бензизоксазол-3-ил)-1-пиперидинил] этил] -6,7,8,9-тетрагидро-2-метил-4Н-пиридо[1,2-а] пиримидин-4-он ("рисперидон").
В патенте США 5158952 описываются 3-пиперидинил-1,2- бензизоксазолы, обладающие противопсихотическими свойствами длительного действия. В частности, 3-[2-(4-(6-фтор-1, 2-бензизоксазол-3-ил)-1-пиперидинил] этил] -6,7,8, 9-тетрагидро-9-гидрокси-2-метил-4Н-пиридо[1,2-а] пиримидин-4-он ("9-гидрокси-рисперидон").
Известен ряд способов, с помощью которых соединения в форме микрочастиц можно включить в капсулу. Во многих таких способах материал для введения в капсулу диспергируют в растворителе, содержащем материал, образующий пленку. На единственной стадии способа растворитель удаляют из микрочастиц и сразу получают продукт микрочастиц.
Патент США 3737337 раскрывает получение полимерного материала, образующего пленку или оболочку, в растворителе, который только частично смешивается с водой. Твердый материал или основу растворяют или диспергируют в растворе, содержащем полимер, и затем раствор, содержащий основу, диспергируют в водной жидкости, не смешиваемой с органическим растворителем, с тем, чтобы удалить растворитель из микрочастиц.
Другой пример способа, в котором растворитель удаляют из микрочастиц, содержащих вещество, раскрыт в патенте США 3523906. В этом способе материал, подлежащий включению в капсулы, эмульгируют в растворе полимерного материала в растворителе, который не смешивается с водой, и затем эмульсию эмульгируют в водном растворе, содержащем гидрофильный коллоид. Затем удаление растворителя из микрочастиц проводят выпариванием и получают целевой продукт.
В патенте США 3691090 органический растворитель выпаривают из дисперсии микрочастиц в водной среде, предпочтительно при пониженном давлении.
Патент США 3891570 раскрывает аналогичный способ, в котором растворитель из дисперсии микрочастиц в среде многоатомного спирта выпаривают из микрочастиц путем нагревания или понижая давление. Другой пример способа удаления растворителя указан в патенте США 3960757.
В патентах США 4389330 и 4530840 описывается получение микрочастиц, содержащих активное вещество, способом, включающим: (а) растворение или диспергирование активного вещества в растворителе и растворение материала, образующего пленку, в этом растворителе; (б) диспергирование растворителя, содержащего активное вещество и материал, образующий пленку, в среде обработки с однородной фазой; (в) выпаривание части растворителя из дисперсии стадии (б) с образованием микрочастиц, содержащих в суспензии активное вещество; и (г) экстрагирование остальной части растворителя из микрочастиц.
Задачей изобретения является создание фармацевтической композиции, включающей биологически распадающиеся и биологически совместимые микрочастицы,
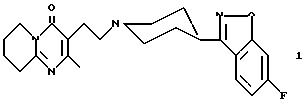
содержащие 1,2-бензазол формулы (1):

или его фармацевтически приемлемую соль кислотного присоединения, в которой
R - водород или С1-6алкил;
R1 и R2 - независимо водород, галоген, гидрокси, C1-6-алкилокси и С1-6 алкил;
Х - О или S;
Alk - C1-4алкандиил; и
R3 - водород или С1-6алкил;
Z - -S-, -СН2- или -CR4= CR5-; где R4 и R5 независимо - водород или С1-6алкил;
А - двухвалентный радикал -СН2-СН2-, -СН2-СН2-СН2- или -CR6= CR7-, где R6 и R7 - водород, галоген, амино или С1-6алкил; и
R8 - водород или гидроксил.
В вышеперечисленных определениях термин "галоген" является общим для фтора, хлора, брома и йода; "С1-6алкил" включает насыщенные углеводородные радикалы с прямой и разветвленной цепью с 1-6 атомами углерода, такие, как, например, метил, этил, пропил, бутил, пентил, гексил и их изомеры; "С1-4алкандиил" включает двухвалентные радикалы алкандиила с прямой или разветвленной цепью с 1-4 атомами углерода, такие как, например, метилен, этилен, пропилен, бутилен и их изомеры.
Предпочтительными соединениями изобретения являются те, в которых R3 представляет собой С1-6алкил и, в частности, метил, и А является двухвалентным радикалом -СН2-СН2-, -СН2-СН2-СН2- или -CR6 = CR7-, в котором R6 и R7 независимо - водород или С1-6алкил.
Еще более предпочтительны соединения, в которых Х - кислород, R - водород, R1 - галоген или, в частности, водород, и R2 - водород, галоген, гидрокси или С1-6алкилокси.
Особо предпочтительны из предшествующих соединения, в которых -Z-A- представляют собой -СН2-СН2 -СН2-СН2-, -S-CH2-CH2-, -S-(СН2)3-, -S-CR6= CR7 - или -CH= CH-CR6= CR7-, где R6 и R7 независимо - водород или метил, и R8 - водород или 9-гидрокси.
Наиболее предпочтительными соединениями являются 3-[2-[4-(6-фтор-1, 2-бензизоксазол-3-ил)-1-пиперидинил] этил] -6,7,8,9-тетрагидро-2-метил-4Н-пиридо[1,2-а] пиримидин-4-он ("Рисперидон") и его фармацевтически приемлемые соли кислотного присоединения.
Соединения формулы (1) обычно можно получить способами, описанными в патентах США 4804663 и 5158952.
Соединения формулы (1) обладают основными свойствами и, следовательно, могут быть преобразованы в их терапевтически активные нетоксичные формы соли кислотного присоединения обработкой соответствующими кислотами, такими как, например, неорганические кислоты, такие как галоидоводородная кислота, например, хлористоводородная, бромистоводородная и другие; серная кислота, фосфорная кислота и другие; или органические кислоты, такие как, например, уксусная, пропановая, уксусноводородная, 2-оксипропионовая, пировиноградная, этандикислота, пропандикислота, бутандикислота, (Z)-2-бутендикислота, 2-яблочная кислота, 2, 3-дияблочная кислота, 2-гидрокси-1,2, 3-пропантрикарбоновая кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, толуолсульфокислота, циклогексансульфаминовая кислота, 2-оксибензойная кислота, 4-амино-2-оксибензойная кислота и другие.
Соединения формулы (1) являются сильнодействующими антагонистами ряда нейротрансмиттеров и, следовательно, обладают полезными фармакологическими свойствами. В частности, соединения формулы (1) представляют собой комбинированные антагонисты серотонина и допамина. Следовательно, они полезны в качестве противопсихотических средств и в лечении многих нарушений, при которых высвобождение серотонина играет важнейшую роль, таких как, например, в блокировании вызванных серотонином сокращений бронхиальных тканей и кровяных сосудов, артерий и вен. Терапевтические показания к применению настоящих соединений - заболевания ЦНС, т. е. в качестве противопсихотических средств, и поэтому их можно применять в лечении психозов, в частности шизофрении, агрессивного поведения, беспокойства, депрессии и мигрени. Кроме того, соединения формулы (1) полезны также в качестве успокаивающих, седативных средств, средств, снимающих стресс, агрессивность, и защитных мышечных средств.
Далее настоящее изобретение предлагает способ лечения теплокровных животных, страдающих психотичесхими нарушениями, который включает систематическое назначение эффективного количества микрокапсулированного соединения формулы (1) или его фармацевтически приемлемой соли кислотного присоединения в смеси с фармацевтическим носителем. Или предлагается применение для получения лекарственного средства микрокапсулированного соединения формулы (1) для лечения психотических расстройств. Или же предлагается применение микрокапсулированного соединения формулы (1), либо его фармацевтически приемлемой соли кислотного присоединения в смеси с фармацевтическим носителем для лечения психотических расстройств. В общем, эффективное количество активного ингредиента, как таковое, составит от 0,01 до 4 мг/кг веса тела пациента, более предпочтительно от 0,04 до 2 мг/кг веса тела.
Под термином "назначенный" здесь понимается любой способ введения 1, 2-бензазолсодержащих микрочастиц изобретения теплокровному животному, такой как, например, парентеральный (внутривенный, внутримышечный или подкожный).
Под "микрочастицами" понимаются твердые частицы, которые содержат активное вещество, здесь 1,2-бензазол, либо в растворе, либо в кристаллической форме. Активное вещество диспергируется или растворяется внутри полимера, который служит оболочкой частицы.
В другом аспекте настоящее изобретение относится к способу торможения серотонергической или допаминергической избыточной стимуляции у теплокровных животных, в котором указанный способ включает назначение биологически распадающейся и биологически совместимой композиции микрочастиц, содержащей 1,2-бензазол формулы (1) внутри полимерной матрицы. Или предлагается применение для получения лекарственного средства из биологически распадающейся и биологически совместимой композиции микрочастиц, содержащей 1,2-бензазол формулы (1) внутри полимерной оболочки, для торможения серотонергической или допаминергической избыточной стимуляции у теплокровных животных. Или применение биологически распадающейся и биологически совместимой композиции микрочастиц, содержащей 1,2-бензазол формулы (1) внутри полимерной оболочки для торможения серотонергической или допаминергической избыточной стимуляции у теплокровных животных.
Еще в одном аспекте изобретение относится к микрочастицам (микрокапсулам), сделанным из биологически распадающейся и биосовместимой оболочки, содержащей соединение формулы (1) или его фармацевтически приемлемую соль кислотного присоединения.
Композиции по изобретению полезны в лечении психических заболеваний у теплокровных животных, предпочтительно млекопитающих, еще предпочтительнее у людей (далее обобщенно именуемых "пациентами"), которое включает введение таким пациентам 6 нераспадающихся микрочастиц, нагруженных 1,2-бензазолом, как описано выше.
Композиции настоящего изобретения включают микрочастицы, предназначенные для контролируемого высвобождения из биораспадающейся, биосовместимой оболочки эффективного количества 1,2-бензазола формулы (1) в течение пролонгированного периода времени. Они обеспечивают преимущества в сравнении с известными композициями, такие, как предотвращение потери дозы при лечении, поскольку это биораспадающаяся, инъецируемая система, - возможность смешивать микрочастицы, содержащие различные лекарства, и возможность программировать высвобождение (многофазные схемы высвобождения) и регулировать быстрее или медленнее скорости выделения лекарства по необходимости.
В предпочтительном варианте назначение 1, 2-бензазола пациентам достигается одним введением микрочастиц, нагруженных лекарством, с выделением лекарственного средства в постоянном или периодическом режиме, при этом не возникает необходимости в повторных инъекциях.
Продукт настоящего изобретения предлагает преимущество длительности действия от 7 до более, чем 200 дней, в зависимости от типа выбранных микрочастиц. В предпочтительном варианте предлагаемые микрочастицы позволяют проводить лечение пациентов в течение от 14 до 100 дней, в частности, от 14 до 50 или 60 или от 30 до 60 дней. Длительность действия можно контролировать манипуляцией композиции полимера, соотношением полимер: лекарство и размером микрочастиц.
Другим важным преимуществом настоящего изобретения является то, что практически все активное вещество попадает в организм пациента, так как используемый полимер подвергается биологическому распаду, позволяя всему заключенному в нем агенту высвобождаться в организм пациента.
Полимерный материал оболочки микрочастиц настоящего изобретения представляет собой биосовместимый полимерный материал, способный к биоразложению. Термин "биосовместимый" определяется как полимерный материал, который нетоксичен для человека, не является канцерогенным и не вызывает значительного воспаления тканей тела. Материал оболочки должен быть биоразлагающимся в том смысле, что он должен разлагаться процессами в организме на продукты, которые легко выводятся и не накапливаются в организме. Продукты биоразложения должны быть также биосовместимыми с организмом в том смысле, что полимерная матрица (оболочка) должна быть биосовместима с организмом.
Подходящие примеры полимерных материалов оболочки включают поли(гликолевую кислоту), поли-D, L-молочную кислоту, их сополимеры, поли(алифатические карбоновые кислоты), сополиоксалаты, поликапролактон, полидиоксонон, поли(ортокарбонаты), поли(ацетали), поли(молочную кислоту-капролактон), полиортоэстеры, поли(гликолевой кислоты капролактон), полиангидриды и природные полимеры, включающие альбумин, казеин и воски, такие, как глицерола моно- и дистеарат и другие. Предпочтительным полимером для применения в практике этого изобретения является dl-(полилактид-со-гликолид), т. е. сополимер поли(гликолевой кислоты) и поли-D, L-молочной кислоты. Желательно, чтобы молярное соотношение лактида к гликолиду в таком сополимере было в пределах от около 85: 15 до около 35: 65, конкретнее от около 75: 25 до около 50: 50, например, 85: 15, 75: 25, 65: 35 или 50: 50.
Качество активного вещества, включенного в микрочастицы, обычно колеблется от 1 вес. % до около 90 вес. %, предпочтительно 30-50 вес. %, еще лучше 35-40 вес. %. Весовой процент означает содержание частей агента на общий вес микрочастицы. Например, 10 вес. % агента будет означать 10 частей агента или активного вещества и 90 частей полимера по весу.
Молекулярная масса полимерного материала оболочки представляет собой определенную важность. Молекулярная масса должна быть достаточно высокой, чтобы позволить образовать удовлетворительные полимерные покрытия, т. е. полимер должен образовать хорошую пленку. Обычно удовлетворительной молекулярной массой может быть масса в пределах от 5000 до 500 000 дальтонов, предпочтительно от 50000 до 400000, еще предпочтительнее от 100000 до 300000, в частности от 100000 до 200000 и особенно около 150000 дальтонов. Однако, поскольку свойства пленки частично зависят также от конкретного используемого полимерного материала, очень трудно определить соответствующий диапазон молекулярной массы для всех полимеров. Молекулярная масса полимера еще важна с точки зрения его влияния на скорость биораспада полимера. Для диффузионного механизма высвобождения лекарства полимер должен оставаться целым до тех пор, пока все лекарственное средство не выйдет из микрочастиц, и затем распадаться. Лекарство может также высвобождаться из микрочастиц по мере биоэрозирования полимерного наполнителя. Соответствующим подбором полимерных материалов можно получить препарат микрочастиц, в котором полученные микрочастицы демонстрируют как свойства диффузионного выхода, так и свойства биораспада. Это находит применение в многофазных схемах выхода.
Продукт микрочастиц настоящего изобретения можно получить любым способом, способным производить микрочастицы в пределах размера, приемлемого для применения в качестве инъекционной композиции, таким, как способы, описанные в патентах США 4389330 и 4530840. Один предпочтительный способ получения тот, который описан в первом патенте и включает растворение или диспергирование активного агента в соответствующем растворителе. К среде, содержащей агент, добавляют полимерный материал матрицы в таком количестве относительно активного ингредиента, которое дает продукт с нужной нагрузкой активным агентом. В другом случае все активные ингредиенты продукта микрочастиц можно смешивать вместе в среде растворителя.
Растворители для агента и полимерного материала матрицы (оболочки), которые можно использовать в практике настоящего изобретения, включают органические растворители, такие как ацетон, галогенированные углеводороды, такие как хлороформ, метиленхлорид и прочие; ароматические углеводородные соединения; галогенированные ароматические углеводородные соединения; циклические эфиры, спирты, такие как бензиловый спирт, этилацетат и другие. Предпочтительный растворитель включает смесь бензилового спирта и этилацетата.
Смесь ингредиентов в растворителе эмульгируют в среде обработки с однородной фазой; среда однородной фазы такова, что в ней образуют дисперсию микрокапель, содержащих указанные ингредиенты. Естественно, среда обработки с однородной фазой и органическая фаза должны быть в значительной степени несмешиваемыми. Обычно чаще всего в качестве среды обработки с однородной фазой используют воду, хотя можно применять и неводную среду, такую как ксилен, толуол и синтетические и природные масла.
Как правило, в среду обработки с однородной фазой добавляют ПАВ, чтобы не допустить агломерации микрочастиц и контролировать размер микрокапель в эмульсии. Предпочтительная комбинация ПАВ-диспергирующей среды составляет 0,1-10 вес. %, лучше 0,5-2 вес. % раствора поли(винилового спирта) в воде. Дисперсию образуют механическим взбалтыванием смешанных материалов. Эмульсию можно также образовать добавлением небольших капель раствора активного агента, образующего оболочку материала, к среде обработки с однородной фазой.
Температура в образовании эмульсии не особенно важна, но может влиять на размер и качество микрочастиц и растворимость агента в однородной фазе. Конечно, лучше, если в однородной фазе будет как можно меньше агента. Кроме того, в зависимости от растворителя и используемой среды обработки с однородной фазой температура не должна быть слишком низкой, иначе растворитель и среда обработки затвердеют или будут слишком вязкими. С другой стороны, она не должна быть настолько высокой, при которой среда обработки будет испаряться или будет трудно сохранить среду обработки жидкой. Более того, температура среды не должна быть настолько высокой, чтобы отрицательно влиять на стабильность измельченного активного агента, включенного в микрочастицы. Следовательно, процесс дисперсии можно проводить при любой температуре, которая поддерживает стабильные рабочие условия, предпочтительно от около 20oС до около 60oС, в зависимости от выбранного агента и наполнителя.
Полученная дисперсия является стабильной и в первой стадии процесса удаления растворителя из этой дисперсии можно частично удалить жидкость органической фазы. Растворитель легко удаляют традиционной технологией, такой, как нагревание, применение пониженного давления или комбинацией того и другого. Температура при выпаривании растворителя из микрокапель некритична, но не должна быть настолько высокой, чтобы разрушить вещество, используемое в получении данной микрочастицы, или выпарить растворитель со скоростью, достаточно высокой, чтобы вызвать появление дефектов в материале, образующем оболочку. Как правило, на первой стадии растворитель удаляют от 10 до 90%, лучше от 40 до 60% растворителя. После первой стадии диспергированные частицы в жидкой среде несмешиваемых растворителей отделяют от жидкой среды любым удобным способом отделения Так, например, жидкость можно декантировать от микрочастиц, либо суспензию с микрочастицами можно отфильтровать. При желании можно использовать различные другие комбинации технологии отделения.
После отделения микрочастиц от среды обработки с однородной фазой остальную часть растворителя в микрочастицах удаляют экстракцией. На этой стадии микрочастицы можно суспендировать в той же среде обработки с однородной фазой, которую использовали на первой стадии, с ПАВ или без него, или в другой жидкости. Экстракционная среда удаляет растворитель из микрочастиц, но не растворяет их. Во время экстракции экстракционную среду, содержащую растворенный растворитель, необходимо удалять и заменять свежей средой. Это лучше всего делать непрерывно и скорость пополнения экстракционной среды важна. Если она слишком низкая, кристаллы вещества могут выступать из микрочастиц или расти в экстракционной среде. Очевидно, скорость пополнения экстракционной среды для данного способа является переменной величиной, которую можно легко определить во время проведения способа, и поэтому заранее указать точные границы скорости невозможно. После удаления остальной части растворителя микрочастицы высушиваются воздухом или другой традиционной технологией сушки, такой, как, например, вакуумная сушка, сушка над дессикантом, или другим способом. Этот способ очень эффективен в капсулировании агента, так как его нагруженность составляет до 80 вес. %, лучше до 50 вес. %.
Наиболее предпочтительный способ капсулирования активного агента для получения микрочастиц настоящего изобретения с контролируемым выделением лекарственного средства включает использование статических мешалок. Статические или неподвижные мешалки состоят из трубки или трубы, в которой размещается ряд статических смесительных элементов. Статические мешалки обеспечивают однородное смешивание в трубке относительно небольшой длины и в относительно короткий период времени. В статических мешалках не какая-то часть мешалки, такая, как лопасть, движет жидкость, а жидкость сама движется через мешалку. Статическая мешалка более подробно описана в патенте США 4511258.
При использовании статической мешалки для образования эмульсии размер частиц эмульсии определяет ряд факторов. Эти факторы включают плотность и вязкость различных смешиваемых растворов или фаз, объемное соотношение фаз, поверхностное натяжение между фазами, параметры статической мешалки (диаметр трубки, длина смесительного элемента, число смесительных элементов) и линейную скорость через статическую мешалку. Температура является переменной, так как она влияет на плотность, вязкость и поверхностное натяжение. Контролируемыми переменными являются линейная скорость, скорость сдвига и падение давления на единицу длины статической мешалки. В частности, размер капли уменьшается при повышении линейной скорости и размер капли увеличивается при снижении падения давления. Капли достигнут равновесного размера при фиксированном количестве элементов для данной скорости потока. Чем выше скорость потока, тем меньше элементов требуется. Благодаря этим взаимосвязям переход с лабораторных масштабов партий на коммерческие будет точным и надежным по расчетам и то же самое оборудование можно использовать для лабораторных и коммерческих партий.
Чтобы получить микрочастицы, содержащие активный агент, соединяют органическую фазу и водную фазу. Органическая и водная фазы представляют собой значительно или достаточно несмешиваемые, при этом водная фаза включает однородную фазу эмульсии. Органическая фаза содержит активный агент, а также образующий оболочку полимер или полимерный материал матрицы. Органическую фазу можно получить растворением активного агента в органическом или другом подходящем растворителе или образованием дисперсии или эмульсии, содержащей активный агент. Предпочтительно, органическая фаза и водная фаза закачиваются таким образом, что обе фазы одновременно текли через статическую мешалку с образованием эмульсии, которая содержит микрочастицы, включающие активный агент, капсулированный в полимерном материале матрицы. Органическая и водная фазы закачиваются через статическую мешалку в большой объем охлаждающей жидкости. Охлаждающей жидкостью могут быть простая вода, водный раствор или другая приемлемая жидкость. Органический растворитель можно удалять из микрочастиц, пока они промываются или перемешиваются в охлаждающей жидкости. После промывания в охлаждающей жидкости для экстракции или удаления органического растворителя микрочастицы отделяют, например, через сито и высушивают.
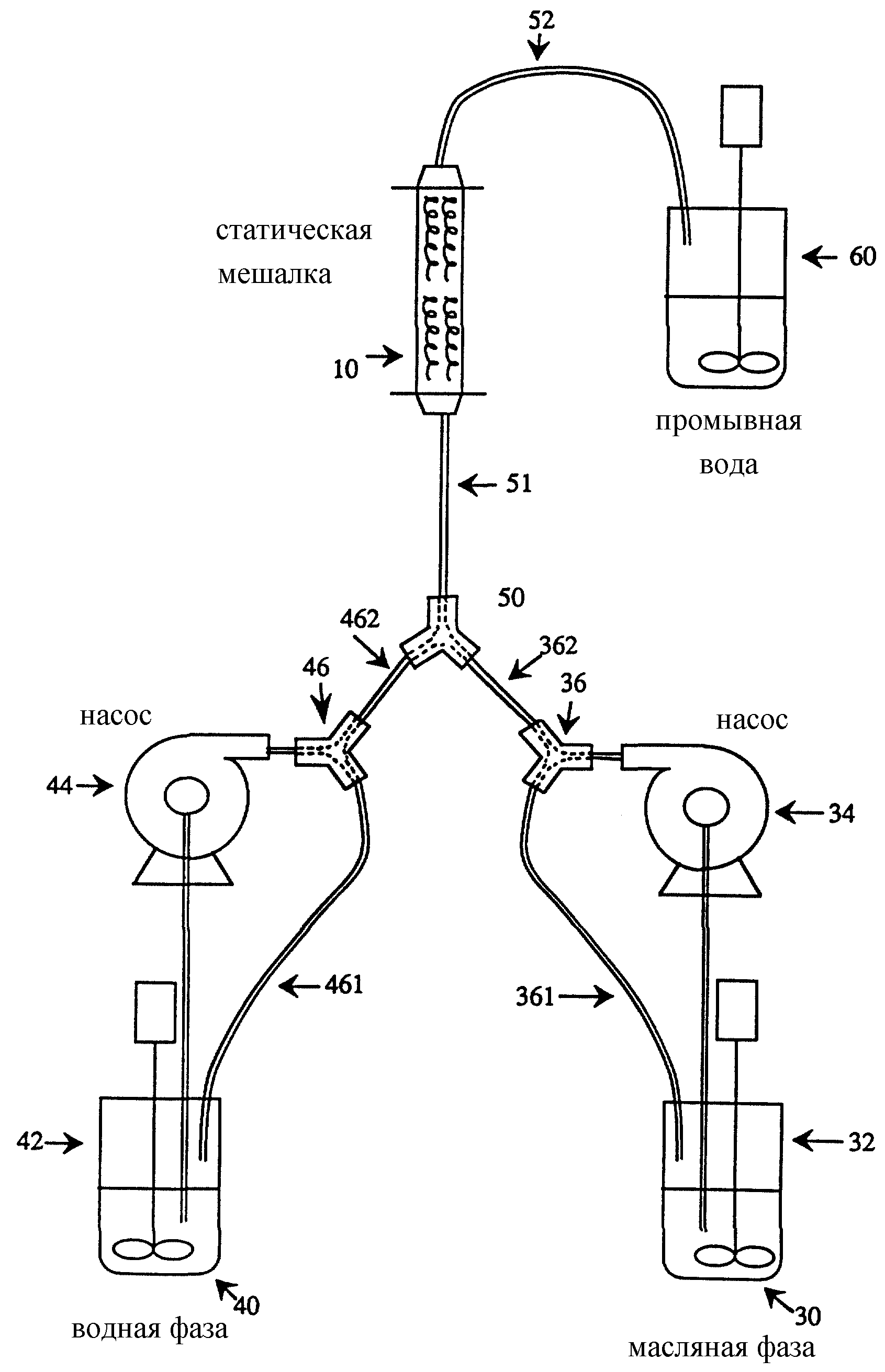
Лабораторная установка для проведения способа в статической мешалке показана на чертеже.
Органическую или масляную фазу 30 готовят растворением и, возможно, нагреванием активного агента и полимерного материала матрицы или полимера в резервуаре 32 с мешалкой на горячей плите. Однако способ настоящего изобретения не ограничивается приготовлением органической фазы 30 растворением активного агента. В другом случае органическую фазу 30 можно готовить диспергированием активного агента в растворе, содержащем полимерный материал матрицы. В такой дисперсии активный агент только слегка растворяется в органической фазе 30. Кроме того, органическую фазу можно приготовить получением эмульсии, содержащей активный агент и полимерный материал матрицы (способ двойного эмульгирования). Способом двойного эмульгирования готовят первичную эмульсию, которая содержит активный агент и полимерный материал матрицы (органическую фазу 30). Первичная эмульсия может быть эмульсией масло-в-воде или другой приемлемой эмульсией. Затем первичную эмульсию (органическую фазу 30) и водную фазу закачивают через статическую мешалку для получения второй эмульсии, которая содержит микрочастицы, включающие активный агент, капсулированный в полимерном материале матрицы.
Органическую фазу 30 выкачивают из резервуара 32 шестеренчатым насосом 34 с магнитным приводом. Содержимое из насоса 34 попадает в У-образный патрубок 36. Один отвод 361 У-образного патрубка 36 возвращается в резервуар 32 для ре циркуляции. Другой отвод 362 подает содержимое в работающую статическую мешалку 10. Водную фазу 40 готовят аналогичным образом в резервуаре 42 с перемешиванием, шестеренчатым насосом 44 с магнитным приводом и У-образным патрубком 46. Один отвод 461 У-образного патрубка 46 возвращается в резервуар 42 для рециркуляции. Другой отвод 462 подает содержимое в статическую мешалку 10. Органическая фаза 30 и водная фаза 40 в значительной степени несмешиваемы.
Отводы от каждого раствора, идущие в статическую мешалку 10, соединяются другим У-образным патрубком 50 и подают содержимое через входную линию 51 в статическую мешалку 10. Мешалка 10 выдает содержимое через выходную линию 52 в промывной резервуар 60. В системе, показанной на чертеже, используют силиконовые трубки и полипропиленовые фитинги. Во всех линиях, за исключением выходной линии 52 из мешалки, используют силиконовые трубки с внутренним диаметром 9,53 мм. Для выходной линии 52 используют трубку с меньшим диаметром (ВД 4,76 мм), чтобы предотвратить оседание эмульсии в выходной линии 52 из мешалки и при поступлении в промывной резервуар 60.
В одном варианте способа насосы 34 и 44 включают в режиме рециркуляции и для органической фазы 30 и водной фазы 40 устанавливают нужные скорости потока. Скорость потока водной фазы 40 предпочтительно выше скорости потока органической фазы 30. Однако скорости обоих потоков могут быть практически одинаковыми. Желательно, чтобы соотношение скорости потока водной фазы 40 и скорости потока органической фазы 30 было порядка от 1: 1 до 10: 1. Затем включают У-образный патрубок 46, чтобы водная фаза 40 текла через отвод 462 к статической мешалке 10. Когда водная фаза 40 заполняет входную линию 51, статическую мешалку 10 и выходную линию из мешалки 52, У-образный патрубок 36 переключают, так что через отвод 362 к мешалке 10 подается органическая фаза 30. Органическая фаза 30 и водная фаза 40 теперь одновременно протекают через статическую мешалку 10. Когда нужный объем органической фазы закачивается в статическую мешалку 10, У-образный патрубок 36 переключается на рециркуляцию через отвод 361. Водная фаза 40 продолжает течь в течение короткого времени, чтобы вычистить органическую фазу, остающуюся во входной линии 51, статической мешалке 10 и выходной линии 52. Затем включается У-образный патрубок 46 на рециркуляцию через отвод 461. Органическая фаза 30 и водная фаза 40 смешиваются в статической мешалке 10 с образованием эмульсии. Образованная эмульсия содержит микрочастицы, включающие активный агент, капсулированный в полимерном материале матрицы.
Микрочастицы, полученные способом настоящего изобретения, имеют обычно сферическую форму, хотя могут быть и неправильной формы. Такие частицы могут быть разными по размеру, диаметром от менее микрона до миллиметра. В предпочтительном варианте настоящего изобретения элементы 14 статического смешивания в мешалке 10 выбирают такими, чтобы размер полученных микрочастиц составлял от 1 до 500 мкм, предпочтительно 25-180 мкм, в частности 60-120 мкм, например 90 мкм, так чтобы микрочастицы можно было вводить стандартным шприцом. Микрочастицы могут перемешиваться в промывном резервуаре 60, который содержит охлаждающую жидкость. От охлаждающей жидкости микрочастицы можно отделить применением, например, ситчатой колонны. Высушивают микрочастицы традиционной технологией сушки и затем можно провести дополнительное отделение по размеру.
Получают микрочастицы, несущие активный агент, которые хранят в виде сухого материала. До введения пациенту сухие микрочастицы можно суспендировать в приемлемом фармацевтическом жидком носителе, желательно 2,5 вес%. растворе карбоксиметилцеллюлозы, после чего суспензию вводят в нужную часть тела. Можно смешивать разные размеры или типы частиц, с тем, чтобы вводить пациенту активный агент по многофазной схеме и/или схеме, которая обеспечивает введение разных агентов в разное время, или смесь агентов одновременно.
Исследования растворимости ин витро с определением выхода рисперидона из микрочастиц по изобретению показали почти постоянное высвобождение рисперидона на протяжении продолжительного периода времени. Аналогичным образом исследования ин виво собак, которым внутримышечно вводились препараты микрочастиц по изобретению, в частности препараты, описанные далее в примерах, показали почти постоянные концентрации активного агента в плазме на протяжении долгого времени.
Следующие примеры описывают далее материалы и способы, примененные в реализации изобретения. Примеры ни коим образом не ограничивают изобретение.
Пример 1: Получение микрочастиц с теоретическим содержанием 35% рисперидона (Партия Prodex 2)
Вначале готовят водную фазу (раствор А) взвешиванием и смешиванием 906,1 г 1% поли(винилового
спирта) (Vinil 205TM, Dir Products and Chemical Inc. ), 29,7 г бензилового спирта и 65,3 г этилацетата. Затем готовят органическую фазу (раствор В) растворением 29,3 г 75-25
dl(полилактида-со-гликолида) с высокой вязкостью в 108,7 г этилацетата и 108,4 г бензилового спирта. Когда полимер полностью растворен, добавляют 15,7 г основы рисперидона и растворяют в полимерном
растворе. Время растворенного рисперидона с полимером сводят к минимуму (<10 мин). Затем растворы А и В закачивают через статическую мешалку диаметром 6,35 мм (Cole Palmer L04667-14)
посредством шестеренчатого насоса под напором (Cole Palmer L07149-04, L07002-16) со скоростями потоков 198 и 24 мл/мин соответственно в охлаждающую жидкость, состоящую из 55 л воды для инъекции,
содержащей 1276,0 г этилацетата, 92,3 г (0,02 М) безводного бикарбоната натрия и 116,2 г (0,02 М) безводного карбоната натрия при 11oС. Микрочастицам дают перемешаться в первой промывной
жидкости 1,75 ч, затем отделяют просеиванием через сито в 25 мкм. Продукт, оставшийся на сите, переносят в промывную жидкость объемом 20 л при 13oС. После перемешивания в пропущенной через
сито промывной жидкости 2,25 ч микрочастицы отделяют и разделяют на фракции по размеру просеиванием через ситчатую колонну из нержавеющей стали с ситами размером ячеек в 25 и 180 мкм. Микрочастицы
высушивают всю ночь, собирают и взвешивают.
Пример 2: Получение микрочастиц с теоретическим содержанием 40% рисперидона (Партия Prodex 3)
Вначале готовят водную фазу (раствор
А) взвешиванием и смешиванием 904,4 г 1% поли(винилового спирта) (Vinil 205ТМ, Dir Products and Chemical Inc. ), 30,1 г бензилового спирта и 65,8 г этилацетата. Затем готовят органическую
фазу (раствор В) растворением 27,1 г 75: 25 dl(полилактида-со-гликолида) с высокой вязкостью в 99,3 г этилацетата и 99,1 г бензилового спирта. Когда полимер полностью растворен, добавляют 18,1 г
основы рисперидона и растворяют в растворе полимера. Время экспозиции растворенного рисперидона с полимером сводят к минимуму (<10 мин). Затем растворы А и В закачивают под напором через
статическую мешалку диаметром 6,35 мм (Cole Palmer L04667-14) посредством шестеренчатого насоса (Cole Palmer L07149-04, L07002-16) со скоростями потоков 198 и 24 мл/мин. Соответственно, в охлаждающую
жидкость, состоящую из 55 л воды для инъекции, содержащей 1375,6 г этилацетата, 92,4 г (0,02 М) безводного бикарбоната натрия и 116,6 г (0,02 М) безводного карбоната натрия при 12oС.
Микрочастицам дают перемешаться в первой промывной жидкости 2 ч, затем отделяют просеиванием через сито в 25 мкм. Продукт, оставшийся на сите, переносят в промывную жидкость объемом в 20 л при 12oС. После перемешивания в пропущенной через сито промывной жидкости в течение 3 ч микрочастицы отделяют и разделяют на фракции по размеру просеиванием через ситчатую колонну из нержавеющей
стали
с ситами размером ячеек в 25 и 180 мкм. Микрочастицы высушивают всю ночь, затем собирают и взвешивают.
Пример 3: Лиофилизация и гамма-облучение микрочастиц из партий Prodex 2 и
Prodex
3 (Образцы Prodex 4A, Prodex 4В и Prodex 4C)
Микрочастицы из партий Prodex 2 и Prodex 3 лиофилизировали. Микрочастицы развешивались во флаконы для сыворотки в 5 см3. Затем
во
флаконы добавляли водный носитель, состоящий из 0,75% КМЦ (карбоксиметилцеллюлозы), 5% маннита и 0,1% Tween 80. Микрочастицы суспендировали в носителе взбалтыванием, затем быстро замораживали в
бане с
сухим льдом/ацетоном. Далее флаконы лиофилизировали в опытном лиофилизаторе с использованием возрастающего температурного цикла с максимальной температурой 30oС в течение 50 ч.
Образцы
Prodex 4А и Prodex 4C представляли собой лиофилизированные образцы из Prodex 2 и Prodex 3 соответственно. Образец Prodex 4В лиофилизировали из Prodex 2, который в последующем стерилизовали
гамма-облучением в 2,2 Мрад, что соответствует 0,022 Дж/кг, от источника Со 60.
Пример 4: Исследования ин виво
Исследовали длительность действия препаратов рисперидона на
основе микрочастиц на рвоту, вызванную апоморфином у собак. Известно, что нейролептические средства являются антагонистами рвоты, вызванной апоморфином, блокируя допаминовые D2 рецепторы в
постремальной области четвертого желудочка. Испытание используют для прогнозирования начала и длительности противопсихотического действия нейролептических средств у человека (Janssen и др. , Arzneim.
-Forsch. /Drug Res. 15: 1196-1206 (1965); Niemegeers и др. , Sife Sci. 24: 2201-2216 (1979)).
9-ОН-рисперидон имеет фармакологический профиль, который идентичен профилю рисперидона. Оба составляют вместе "активную часть", которая определяет биологическую активность рисперидона.
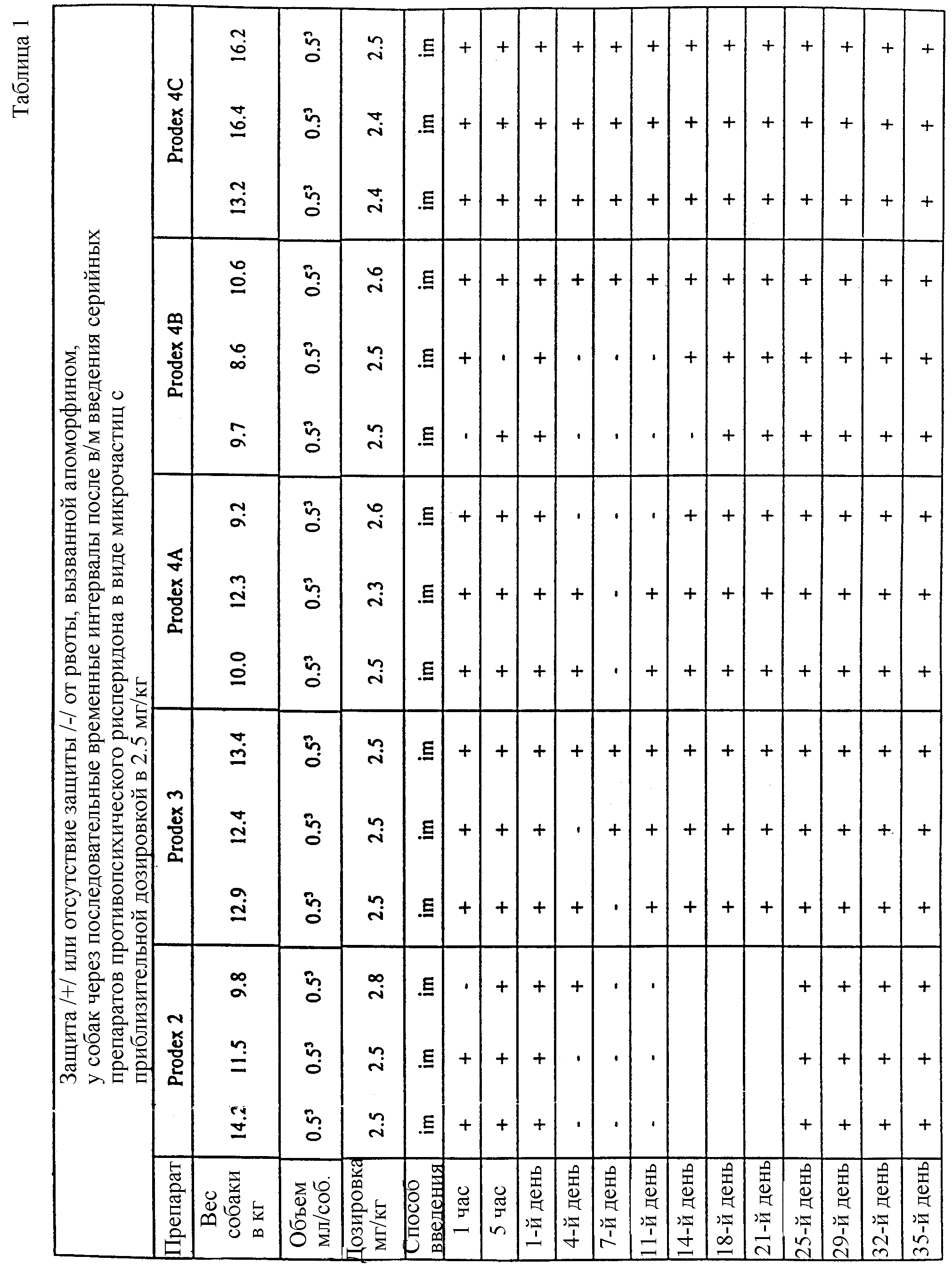
Апоморфин вводили подкожно с дозировкой 0,31 мг/кг собакам дважды в неделю на протяжении всего курса эксперимента. После провокации апоморфином в течение 1 ч собаки наблюдались на симптомы рвоты. Считалось, что полное отсутствие рвоты в течение 1 ч отражает значительную противорвотную активность. Длительность противорвотного действия определяли как интервал времени, в течение которого 2 из 3-х собак были защищены от рвоты.
Препараты вводились в объеме 0,5 мл в бедреную двуглавую мышцу одной из задних ног на уровне бедра. Через некоторое время после внутримышечной инъекции периодически бралась кровь на анализ, и сразу же после этого собаки провоцировались дозой апоморфина. Полное отсутствие рвоты в течение 1 ч после провокации апоморфином (что никогда не наблюдалось у контрольных животных; кол-во >1000) говорило о значительной противорвотной активности.
В табл. 1 показано, защищены (+) собаки или нет (-) от рвоты, вызванной апоморфином, в различные временные интервалы после внутримышечной инъекции серийных препаратов. Все препараты показали немедленное начало проявления противорвотного действия.
Реферат
Изобретение относится к медицине. Композиция содержит микрокапсулы из рисперидона и полимерной матрицы, а также подходящий фармацевтический носитель. Микрокапсулы получают путем растворения полимерного материала в органическом растворителе с последующим растворением активного компонента в полученном растворе, диспергированием смеси в водной среде и погружением полученной дисперсии в охлаждающую жидкость сушки полученных микрокапсул. Предложенные композиции высвобождают активное вещество более длительное время с необходимой для проявления действия скоростью. 4 с. и 9 з. п. ф-лы, 1 табл. , 1 ил.
Формула
причем указанные микрокапсулы выполнены из полимерного материала матрицы, имеющего молекулярную массу в интервале от 100000 до 300000.

причем указанные микрокапсулы выполнены из полимерного материала матрицы, имеющего молекулярную массу в интервале от 100000 до 300000.

Комментарии