Имплантируемые композиции для доставки лекарственных средств и способы их применения - RU2739033C2
Код документа: RU2739033C2
Чертежи




















Описание
Родственные заявки
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №62/181707, поданной 18 июня 2015 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
Уровень техники
[0002] Замедленная доставка фармацевтических агентов, обеспечивающая эффективность с низкой системной токсичностью, необходима для лечения заболеваний, включая, но не ограничиваясь ими, злокачественные новообразования и некоторые инфекции. Лекарственные средства можно вводить различными способами, в том числе перорально, путем ингаляции аэрозоля, подкожно, внутримышечно, интраперитонеально, чрескожно, внутрижелудочно и внутривенно.
[0003] Доставка лекарственных средств относится к подходам, составам, технологиям и системам для транспортировки фармацевтического соединения в организме, необходимым для безопасного достижения желаемого терапевтического эффекта. Традиционная доставка лекарственных средств может включать направленное воздействие на организм или обеспечение системной фармакокинетики. В любом случае традиционная доставка лекарственных средств, как правило, связана как с количеством, так и с продолжительностью присутствия лекарственного средства.
[0004] К сожалению, системное введение лекарственных средств может привести к нежелательной токсичности. Токсичность, возникающая в результате системного введения многих лекарственных средств, часто связана с общим системным воздействием лекарственного средства при определенных концентрациях. Внутривенная и системная терапия лекарственными средствами обычно не дает результата вследствие одного или более из следующих факторов: низкая растворимость лекарственного средства, токсичность, кратковременная стабильность лекарственного средства in vivo, неудовлетворительная фармакокинетика лекарственного средства, плохое биораспределение, низкая биодоступность, быстрый метаболизм и экскреция и отсутствие избирательности в отношении цели заболевания.
[0005] Изменчивость в абсорбции лекарственного средства в плазме и выведении лекарственного средства из системного кровообращения для отдельных пациентов может составлять значительную часть различий в токсичности между пациентами и различий в токсичности для отдельного пациента в разные дни. Фармакокинетическая изменчивость может возникать в результате ежедневных изменений в способности отдельного пациента метаболизировать или экскретировать лекарственное средство, или вследствие различий между пациентами в метаболизме или экскреции лекарственного средства. Как правило, лекарственные средства, вводимые внутривенно (т.е., ВВ), имеют относительно ограниченный период полувыведения вследствие клиренса из плазмы путем связывания и экскреции белка. Концентрация лекарственного средства, которую необходимо вводить системно для достижения эффективности, как правило ограничивается максимально переносимой дозой или скоростью введения вследствие системных побочных эффектов. Указанное ограничение снижает возможность доставки устойчивого и эффективного уровня лекарственного средства вследствие токсичности, ограничивающей дозу.
[0006] Концентрацию лекарственного средства in vivo как правило определяют в крови. Для большинства лекарственных средств требуется минимальная эффективная концентрация в плазме и продолжительность присутствия этой концентрации для проявления эффекта лекарственного средства. Токсичность, ограничивающая дозу, возникает, когда концентрация лекарственного средства превышает определенную пороговую концентрацию и/или продолжительность выше определенной пороговой концентрации. Лекарственные средства не оказывают предполагаемого эффекта, когда уровень падает ниже минимальной эффективной концентрации в плазме.
[0007] Определение уровня лекарственного средства в крови является полезным инструментом, но представляет собой лишь упрощенный показатель фактических концентраций в целевой ткани. Эффективность коррелирует с целевой продолжительностью и интенсивностью действия лекарственного средства, которые зависят от скорости абсорбции, распределения и удаления из организма (биотрансформация, экскреция). Для стандартных пероральных, внутривенных или интраперитонеальных путей введения отсутствует направленное воздействие, и продолжительность терапевтического уровня лекарственного средства вследствие указанных эффектов является относительно кратковременной, что часто приводит к недостаточному лечению ткани-мишени, побочному действию и токсичности, ограничивающей дозу, и может приводить к смещению в сторону химиорезистентного заболевания (например, к возникновению хеморезистентной популяции клеток и раковых стволовых клеток и т.д.). Локализованную доставку лекарственных средств в место заболевания давно применяют в качестве способа безопасного увеличения продолжительности терапевтических уровней лекарственного средства, снижения системной токсичности, не вызывающей побочных эффектов, устранения смещения в сторону хеморезистентности путем поддержания селективного давления. Терапевтический индекс представляет собой сравнение количества терапевтического средства, которое вызывает терапевтический эффект, с количеством, которое вызывает токсичность. Создание технологии доставки лекарственных средств, которая благотворно влияет на терапевтический индекс и доставляет лекарственное средство только туда, где это необходимо, исторически было очень желательным, но очень сложным для достижения на практике.
[0008] Многие фармакологические свойства традиционных («свободных») лекарственных средств могут быть улучшены за счет применения систем доставки лекарственных средств, обеспечивающих замедленное высвобождение биологических и химиотерапевтических агентов. Способы регулируемого, медленного и локализованного высвобождения лекарственного средства обладают значительными фармакодинамическими преимуществами для повышения эффективности и безопасности лекарственного средства. Раковые клетки, резистентные к лекарственным средствам, которые остаются живыми после химиотерапии, отвечают за повторное появление опухолей и плохой прогноз для пациентов. Резистентность опухоли к химиотерапии в клинической практике может быть связана с неэффективным распределением или кратковременной продолжительностью терапевтических концентраций лекарственного средства по отношению к его целевой опухолевой ткани. Возникновение резистентности к лекарственным средствам приводит к неудачному лечению опухолей. Резистентность к лекарственным средствам может быть либо первичной либо приобретенной. Первичная резистентность возникает, когда опухолевые клетки способны избегать воздействия или восстанавливать повреждение, вызванное цитотоксическими эффектами химиотерапии при первоначальном воздействии. Приобретенная резистентность преобладает, когда в популяции, изначально чувствительной к химиотерапии, выживают резистентные клетки. Доставка лекарственных средств может быть достигнута путем контроля за замедленной диффузией лекарственных средств к опухолям через полимерные матрицы и/или за разрушением указанных систем.
[0009] Устойчивые терапевтические концентрации лекарственного средства, высвобождаемого в целевую опухоль, обеспечивают превосходное соблюдение пациентом режима лечения и результаты лечения пациента, увеличивает терапевтический индекс лекарственных средств и предотвращает селекцию популяций хеморезистентных клеток. Замедленное высвобождение лекарственного средства как правило достигается либо путем введения терапевтического лекарственного средства в имплантируемый резервуар, либо путем имплантации биоразлагаемых или небиоразлагаемых материалов, содержащих необходимое лекарственное средство. Лекарственное средство можно активно высвобождать с определенной скоростью с помощью помпы. В качестве альтернативы, лекарственное средство может высвобождаться пассивно прогнозируемым и контролируемым образом из имплантата путем диффузии, эрозии или их комбинации.
[0010] Разработка биоразлагаемых имплантатов для доставки химиотерапевтических лекарственных средств полезна для лечения локализованного заболевания (например, злокачественного новообразования, или противомикробных соединений для лечения постхирургических инфекций или очаговых инфекций у пациентов с ослабленным иммунитетом и т.д.). Эффективность систем с медленным высвобождением лекарственного средства обычно определяют измерением концентраций имплантированного лекарственного средства в плазме или путем оценки основного заболевания, подлежащего лечению (например, улучшение при инфекции или уменьшение размера злокачественной опухоли, предотвращение рецидива и т.д.). Например, имплантаты для доставки химиотерапии против рака, помещенные на хирургический край, уменьшают риск возникновения локализованного рецидива. Один пример касается удаления и/или резекции стенки грудной клетки у пациентов с саркомой. Стенка грудной клетки представляет собой костно-тканевый каркас, включая позвоночник, грудную клетку и ребра, которая образует клетку вокруг жизненно важных органов, таких как сердце и легкие. В этой структуре могут развиваться многие типы опухолей. Некоторые из них являются первичными опухолями, которые возникают в грудной клетке и могут быть либо доброкачественными, либо злокачественными; некоторые из них являются вторичными опухолями, которые метастазируют в грудную стенку с другого места в организме и почти всегда являются злокачественными.
[0011] Злокачественные опухоли грудной клетки включают множество видов саркомы, которая представляет категорию раковой опухоли, которая может образовываться в костях, мягких тканях и хряще в любом месте организма. Симптомы саркомы грудной стенки варьируются в зависимости от классификации и тяжести опухоли и могут включать затрудненное дыхание, а также боль и припухлость вокруг опухоли.
[0012] Лечение может варьироваться в зависимости от таких факторов, как тип опухоли и стадия ее прогрессирования. Хирургическая резекция является основой лечения большинства опухолей стенки грудной клетки на ранней стадии. Дополнительное лечение может включать лучевую терапию (применение радиации для уничтожения раковых клеток) и/или химиотерапию (применение лекарственных средств для уничтожения раковых клеток). Часто встречаются локальные и отдаленные рецидивы. С помощью локализованной доставки лекарственных средств доказали перспективный подход для предотвращения рецидива саркомы на небольших животных моделях заболевания. Никакого эффективного лечения для предотвращения рецидива для применения у человека до настоящего момента не было одобрено.
[0013] Рак легких является раком с наибольшей смертностью во всем мире. В большинстве случаев рак легких обнаруживают на поздней стадии заболевания и лечат системно. Тем не менее, у значительной части пациентов рак легких диагностируют на стадии, которую можно лечить путем радикального хирургического вмешательства. В случае операбельного рака легких, когда пациент признан физиологически достаточно здоровым, чтобы перенести хирургическое вмешательство, хирургическая резекция является популярным способом лечения и дает наилучший шанс для излечения. Операция по лечению рака легких может включать: пневмонэктомию, лобэктомию (т.е., анатомическое иссечение сегментов совместно с их сосудистым снабжением и лимфатическим дренажом), сегментэктомию или клиновидную резекцию. Вместо процедуры пневмонэктомии или лобэктомии врач может выбрать осуществление иссечения меньшего размер, чтобы избежать потери жизненной емкости легких и сохранить функционирование легкого после операции как можно больше, но это может поставить под угрозу онкологический результат вследствие неполного удаления опухолевых клеток, оставшихся в крае резекции легкого. Повторная клиновидная резекция или сублобарная анатомическая резекция включает удаление сублобарной секции тканевой массы, охватывающей опухоль или поражение, включая некоторый запас за пределами исходной опухоли. Иссеченную ткань закрепляют швом или хирургическими скобами. Скрепочный шов вдоль краев края резекции предотвращает просачивание воздуха и крови. В целом, восстановление клиновидной резекции осуществляют посредством скрепочного шва по линии резекции, позволяющего основному органу сохранять свою форму без искажений. Как правило, клиновидная резекция оставляет только одностежковый шов или скрепочный шов вдоль края резекции неправильной формы. Несмотря на преимущества хирургической процедуры, клиновидные резекции не считаются оптимальным способом онкологической резекции рака у пациентов, которые физиологически способны перенести лобетктомию. Наблюдается более высокая частота локализованного рецидива рака по краю резекции по сравнению с лобэктомией, что делает клиновидную резекцию компромиссом между сохранением функции легких и удалением всех возможных злокачественных тканей вдоль хирургического края.
[0014] Одним из способов локализованного обработки края резекции, применяемым для предотвращения рецидива, является брахитерапия. Брахитерапия включает применение викриловой вставки/сетки, в которую сшиваются брахитерапевтические зерна. Затем биодеградируемую сетку с радиоактивными зернами прикрепляют к ткани легкого, покрывающей область резекции. Такую брахитерапевтическую сетку вводят посредством торакотомии или с минимальной инвазивностью посредством межреберного доступа с помощью торакоскопической хирургии с видеоподдержкой (VATS) и прикрепляют к скрепочному шву. Исследование показало, что клиновидная резекция и брахитерапия привели к 1% возникновения локального рецидива (LR), в то время как клиновидная резекция сама по себе приводила к 19% LR (см., d’Amato et al., “Intraoperative Brachytherapy Following Thoracoscopic Wedge Resection of Stage 1 Lung Cancer”, Chest Off. Pub. Of the Am. Coll. Of Chest Phys., 114(4):1112-5 October 1998). Адъювантная интраоперационная брахитерапия, по-видимому, не влияет на локальное рецидивирование при проведении анатомической сегментэктомии с соответствующими хирургическими краями. Однако у пациентов с высоким риском, не подходящих для анатомической резекции, роль брахитерапии может заключаться в снижении локального рецидива при выполнении сублобарной неанатомической резекции и в тех случаях, когда хирургические края подвержены риску. См., например, Fernando HC, Landreneau RJ, Mandrekar SJ, Nichols FC, Hillman SL, Heron DE et al. Impact of brachytherapy on local recurrence rates after sublobar resection: results from ACOSOG z4032 (Alliance), a phase III randomized trial for high-risk operable non-small-cell lung cancer. J Clin Oncol 2014;32: 2456–62]. Несмотря на этот ограниченный положительный результат, процедура имеет много практических недостатков. Во-первых, она зависит от оперирующего хирурга, тем самым имея переменные результаты в зависимости от опыта хирургической бригады. Во-вторых, воспроизводимость является трудоемкой, особенно в случаях с видеоподдержкой, добавляя час или больше ко времени проведения сложной процедуры у пациентов с физиологическими нарушениями. В-третьих, хирургический и медицинский персонал подвергаются излишнему излучению во время хирургической подготовки и процедуры. Несмотря на снижение возникновения местного рецидива, вышеупомянутые и другие недостатки, к сожалению, помешали широкому распространению брахитерапии.
[0015] Во многих хирургических процедурах, в том числе при открытой, лапароскопической и эндоскопической хирургии, часто необходимо смыкать, скреплять, сшивать, склеивать, зажимать или соединять ткань. Клиницисты оповещали о необходимости хирургических композиций и способов применения таких композиций, которые могут доставлять лекарственные средства локально, чтобы предотвратить рецидив или лечить заболевание локально, которые являются менее зависимыми от оперирующего хирурга, воспроизводимыми, эффективными и безопасными как для пациента, так и для тех, кто участвует в хирургической процедуре. Композиции и способы, которые достигают таких результатов, включают описанные в настоящем документе.
Краткое описание изобретения
[0016] В настоящем документе представлены имплантируемые композиции, содержащие матрицу совместно с по меньшей мере одним полимером и терапевтически активным агентом.
[0017] Также в настоящем документе представлено применение указанных имплантируемых композиций для доставки (например, местной доставки) терапевтически активного агента для лечения, улучшения или предотвращения рецидива заболевания. К таким заболеваниям относятся, например, описанные в настоящем документе.
[0018] Далее в настоящем документе представлено применение указанных имплантируемых композиций для индуцирования болезненного состояния в модельной системе.
[0019] Среди других свойств, описанных в настоящем документе, раскрытые композиции подходят, например, для преодоления проблем, связанных с рецидивом рака, в одном аспекте, вследствие неполного лечения микроскопических опухолей. Например, хирургическое удаление опухолей, как правило, является лучшим вариантом лечения для лечения определенных видов рака (таких как рак легких). Для предотвращения рецидива обычно требуется удаление дополнительной ткани края резекции, составляющей 10-20 мм. Вследствие пожилого возраста, места опухоли и множественных сопутствующих заболеваний пациенты, однако, обычно не способны перенести оптимальную резекцию. Поэтому остаются сохранившиеся раковые клетки, и это приводит к рецидиву. См., например, фиг. 1. Размещение имплантируемых композиций, описанных в настоящем документе, на крае резекции, не только обеспечивает целостность скрепочного шва (тем самым предотвращая попадание воздуха и кровотечение), но также обеспечивает устойчивые терапевтические концентрации лекарственного средства при наибольшем риске рецидива, эффективно уничтожая сохранившиеся раковые клетки и предотвращая рецидив. См., например, фиг. 1.
[0020] В настоящем документе описаны технические преимущества и преимущества безопасности, связанные с композициями и их применением. Технические преимущества включают повышенный терапевтический индекс лекарственного средства, например, длительные терапевтические концентрации лекарственного средства в областях с наивысшим риском рецидива, низкое системное высвобождение, отсутствие побочных эффектов при восстановлении после операции (например, в случае имплантации в или на место хирургического края или поражения), соблюдение режима лечения и отсутствие вымывания, высокую степень переносимости, простоту применения по стандарту хирургического лечения и легкую адаптируемость, для охвата широкого спектра терапевтических агентов и процедур. См., например, фиг. 2.
Краткое описание чертежей
[0021] На фиг. 1 представлена проблема рецидива рака и решение, предложенное с помощью композиций, описанных в настоящем документе.
[0022] На фиг. 2 изображено, что примерная композиция, описанная в настоящем документе, является эффективной и хорошо переносимой в ткани, где на А) изображена имплантируемая композиция на легочную ткань совместно с областью проникновения противоракового агента паклитаксела в размере >25 мм; на B) изображен процент паклитаксела (нМ) по сравнению с проникновением паклитаксела (мм); и на C) изображена терапевтическая концентрация >30 нМ.
[0023] На фиг. 3 изображена воспроизводимость способа нанесения для получения композиций, описанных в настоящем документе.
[0024] На фиг. 4 изображены данные высвобождения in vitro с применением ABC103-A в соответствии с настоящим изобретением с увеличением содержания терапевтически активного агента, где A) представляет собой высвобождение кумулятивного активного агента в мкг/см2 относительно времени; B) представляет собой высвобождение кумулятивного активного агента в % относительно времени; и C) представляет собой высвобождение кумулятивного активного агента в мкг относительно времени.
[0025] На фиг. 5 изображены данные высвобождения in vitro в последующем исследовании с применением ABC103-A в соответствии с настоящим изобретением с содержанием терапевтически активного агента, составляющим 1%, 5% и 10%, где A) представляет собой высвобождение кумулятивного активного агента в мкг/см2 относительно времени; B) представляет собой высвобождение кумулятивного активного агента в % относительно времени; и C) представляет собой высвобождение кумулятивного активного агента в мкг относительно времени.
[0026] На фиг. 6 изображены данные высвобождения in vitro с применением ABC103-B в соответствии с настоящим изобретением с увеличением содержания терапевтически активного агента, где A) представляет собой высвобождение кумулятивного активного агента в мкг/см2 относительно времени; B) представляет собой высвобождение кумулятивного активного агента в % относительно времени; и C) представляет собой высвобождение кумулятивного активного агента в мкг относительно времени.
[0027] На фиг. 7 изображены данные высвобождения in vitro с применением ABC103-A в соответствии с настоящим изобретением с увеличением содержания терапевтически активного агента, где A) представляет собой высвобождение кумулятивного активного агента в мкг/см2 относительно времени; B) представляет собой высвобождение кумулятивного активного агента в % относительно времени; и C) представляет собой высвобождение кумулятивного активного агента в мкг относительно времени.
[0028] На фиг. 8 показано высвобождение паклитаксела между обработанными EtO (слева) и необработанными EtO (справа) композициями в единицах мкг/см2,% и высвобождение в мкг с применением ABC103-A в соответствии с настоящим описанием, где A) представляет собой высвобождение кумулятивного активного агента в мкг/см2 относительно времени; B) представляет собой высвобождение кумулятивного активного агента в % относительно времени; и C) представляет собой высвобождение кумулятивного активного агента в мкг относительно времени.
[0029] На фиг. 9 показана секция легкого для анализа на содержание паклитаксела.
[0030] На фиг. 10 показано содержание лекарственного средства паклитаксела в радиальной секции легкого, для композиций, содержащих 1% паклитаксела и 10% паклитаксела, в ABC103-B.
[0031] На фиг. 11 представлен пример резекции и удаления одной из секций in vivo имплантируемой композиции, описанной в настоящем изобретении.
[0032] На фиг. 12 проиллюстрирована легочная ткань кролика после 14-дневного прикрепления укрепляющего материала на основе PGA, при: отсутствии терапевтически активного агента (А), 1% терапевтически активного агента (В), 5% терапевтически активного агента (С) и 10% терапевтически активного агента (D).
[0033] На фиг. 13 показана общая схема процедуры резекции с применением композиций, описанных в настоящем изобретении, где: на А) показана ткань, зажатая между двумя зажимами степлера; на B) показано, что скобы закреплены; на C) показана оставшаяся легочная ткань; и на D) показана иссеченная ткань.
[0034] На фиг. 14 представлена микроскопия фиксированных окрашенных тканей после обработки примерной композицией: на A) представлен контроль с укрепляющим материалом без нанесения покрытия; на B) представлен другой контроль, содержащий укрепляющий материал при отсутствии лекарственного средства; и на C) представлены примерные композиции.
[0035] На фиг. 15 представлено распределение in vivo паклитаксела в легких кролика из примерной композиции.
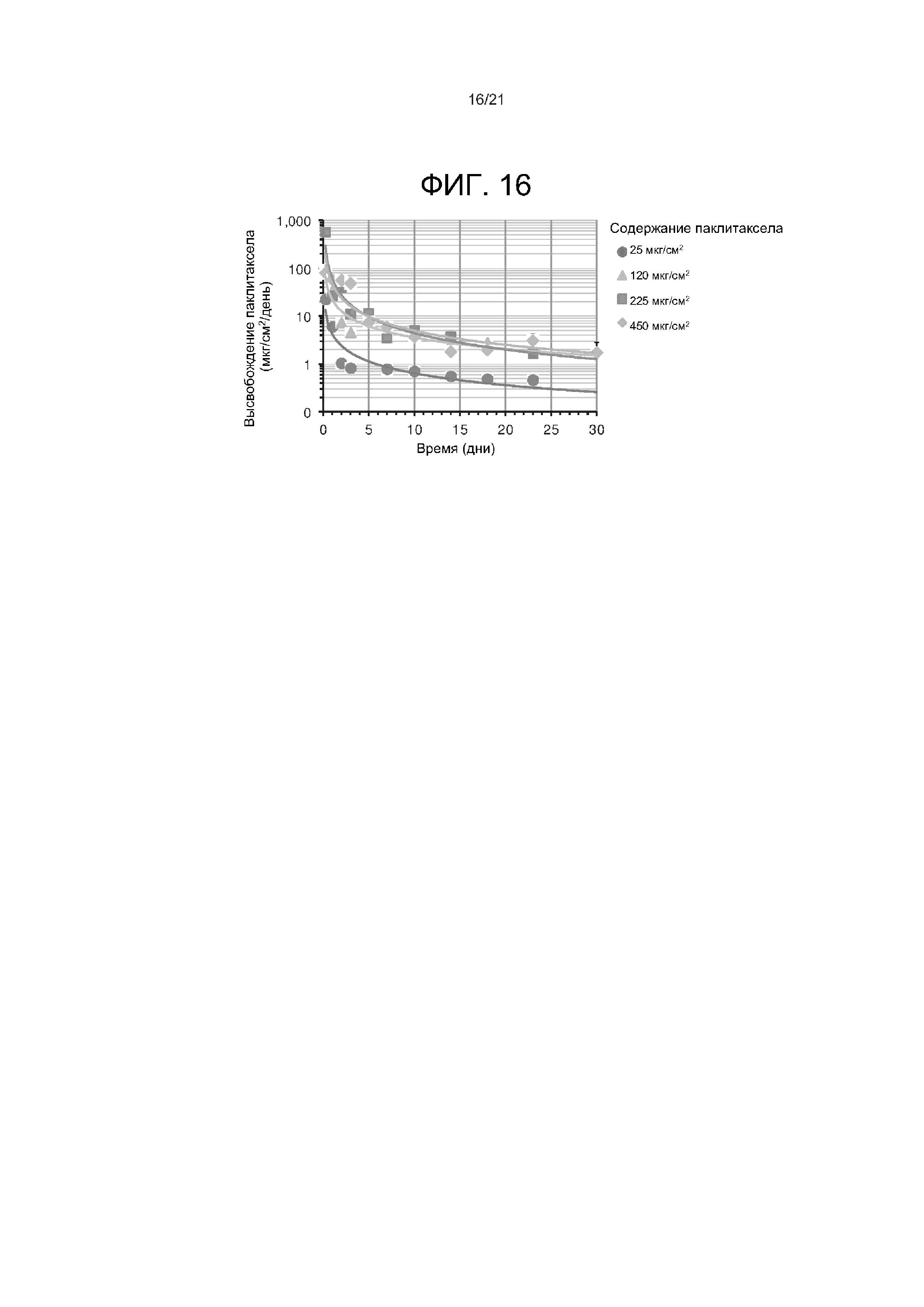
[0036] На фиг. 16 представлена кинетика высвобождения паклитаксела in vitro из примерных композиций, ABC103-A.
[0037] На фиг. 17 представлены грубые изображения примерной композиции и окружающей ткани легкого после 30 дней имплантации в легкие свиньи: участок лобэктомии левого легкого (в пунктирном круге) с композицией (стрелка).
[0038] На фиг. 18 представлено распределение паклитаксела in vivo в легком свиньи через 30 дней после имплантации примерной композиции с дозировкой 1 мкг и 1,9 мг (225 мкг/см2 и 415 мкг/см2, соответственно).
[0039] На фиг. 19 представлено распределение паклитаксела in vivo в А) легких свиней, и В) органах на 2, 14, 30 и 60 день после имплантации имплантатов ABC103-A при дозировке 225 мкг/см2.
[0040] На фиг. 20 показана гистология легкого через 60 дней после имплантации ABC103-A.
Подробное описание изобретения
А. Композиции
[0041] В первом варианте реализации в настоящем описании представлена имплантируемая композиция, содержащая матрицу совместно с по меньшей мере одним полимером и терапевтически активным агентом.
[0042] Следует понимать, что термин «имплантируемый» относится к одному или более слоям раскрытой композиции, имеющим механические свойства, достаточные для покрытия и/или прикрепления к внутренней ткани организма (например, к внутреннему поражению хирургического края). Термин «имплантируемый» можно применять взаимозаменяемо с термином «имплантат». Примеры имплантата включают, но не ограничиваются ими, хирургический укрепляющий материал или хирургическую сетку, обладающие одним или более свойствами, определенными в настоящем документе.
[0043] В настоящем документе ABC103-A включает укрепляющий материал из PGA (полигликолевая кислота) (Neoveil® или подходящий эквивалент); при этом ABC103-B включает укрепляющий материал на основе PGA/TMC (полигликолевая кислота/триметиленкарбонат) (например, GORE® SEAMGUARD®); и ABC103-C включает укрепляющий материал из PGA (например, Neoveil®). Каждый из указанных составов состоит из 25% PEG8K + 50/50 PLGA + Паклитаксел (в случае содержания лекарственного средства), нанесенных на данный укрепляющий материал.
[0044] Во втором варианте реализации в настоящем описании предложена имплантируемая композиция, содержащая матрицу совместно с по меньшей мере одним полимером, по меньшей мере одним вспомогательным веществом и терапевтически активным агентом.
[0045] В третьем варианте реализации по меньшей мере один полимер, по меньшей мере одно вспомогательное вещество и терапевтически активный агент в первом или втором варианте реализации представляют собой отдельные и разные компоненты.
[0046] В четвертом варианте реализации по меньшей мере один полимер, по меньшей мере одно вспомогательное вещество и терапевтически активный агент из первого, второго или третьего вариантов реализации встроены в матрицу, нанесены на матрицу в форме покрытия, встроены и нанесены на матрицу в форме покрытия или ковалентно связаны с матрицей. В альтернативном варианте по меньшей мере один полимер, по меньшей мере одно вспомогательное вещество и терапевтически активный агент из первого, второго или третьего варианта реализации встроены и нанесены на матрицу в форме покрытия.
[0047] В пятом варианте реализации матрица из композиций, описанных в настоящем документе, содержит мембранный или пористый каркас, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем или четвертом вариантах реализации. В качестве альтернативы, матрица из композиций, описанных в настоящем документе, содержит мембранный или непористый каркас, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем или четвертом вариантах реализации.
[0048] В шестом варианте реализации матрица из композиций, описанных в настоящем документе, представляет собой нетканую или тканую полимерную сетку, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом или пятом вариантах реализации.
[0049] В седьмом варианте реализации матрица из композиций, описанных в настоящем документе, представляет собой биологическую матрицу, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. Биологические матрицы включают, например, любую матрицу, полученную из материала или ткани в клетках животных. Материалы на биологической основе включают, например, гиалуроновую кислоту, агарозу, фиброин шелка, самоупорядочивающиеся пептиды, полисахаридные материалы, такие как хитозан, гликозаминогликаны, бесклеточный дермальный трансплантат (ALLODERM), бесклеточный коллаген (PERISTRIPS), тканый, трикотажный или нетканый материал, и они могут быть биоабсорбируемыми или небиоабсорбируемыми. Биологические матрицы включают, например, изготовленные из гомополимеров, сополимеров или смесей, полученных из одного или более мономеров, выбранных из группы, состоящей из гликолида, гликолевой кислоты, лактида, молочной кислоты, п-диоксанона, α-капролактона и триметиленкарбоната. Полимерные матрицы включают, но не ограничиваются ими, поли(молочную кислоту), поли(гликолевую кислоту), поли(гидроксибутират), поли(фосфазин), сложные полиэфиры, полиэтиленгликоли, полиэтиленоксиды, полиакриламиды, полигидроксиэтилметилакрилат, поливинилпирролидон, поливиниловые спирты, полиакриловые кислоты, полиацетат, поликапролактон, полипропилен, алифатические сложные полиэфиры, глицерины, поли(аминокислоты), сополи(эфиры-сложные эфиры), полиалкилен оксалаты, полиамиды, поли(иминокарбонаты), полиалкилен оксалаты, полиоксиэфиры, полиортоэфиры, полифосфазены и сополимеры, блок-сополимеры, гомополимеры, смеси и их комбинации.
[0050] В восьмом варианте реализации матрица из композиций, описанных в настоящем документе, представляет собой биологическую матрицу, выбранную из коллагеновых листов, бычьего перикарда, твердой мозговой оболочки человека или животного или тому подобного, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом или седьмом вариантах реализации.
[0051] В девятом варианте реализации матрица из композиций, описанных в настоящем документе, представляет собой полимерную матрицу, содержащую один или более из поли(этилена), поли(пропилена), поли(тетрафторэтилена), поли(метилметакрилата), этилен-ковинилацетата, поли(диметилсилоксана), поли(эфир-уретанов), поликарбоната, полиэфирсульфона, полибензимидазола, акрилонитрилбутадиенстирола (АБС), поливинилхлорида (ПВХ), полиэфирэфиркетона (PEEK), поли(этилентерефталата), поли(сульфона), поли(сложные эфиры) на основе полилактида (PLA), полигликолида (PGA), поликапролактона (PCL), поли(гидроксиалканоат)ов, поли(сахарид)ов, их сополимеров и смесей или комбинаций сополимеров и смесей, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. В качестве альтернативы матрица из композиций, описанных в настоящем документе, представляет собой полимерную матрицу, содержащую полигликолевую кислоту (ПГА), при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. В качестве другой альтернативы матрица из композиций, описанных в настоящем документе, представляет собой биоразлагаемую сетку из полигликолевой кислоты (PGA), такую как, например, Neoveil® от Gunze и Bard Sepramesh от Covidien, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. В качестве еще одной альтернативы матрица из композиций, описанных в настоящем документе, представляет собой гибкую композитную сетку, такую как, например, Parietex™ Composite (PCO) Mesh от Covidien, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. В качестве других альтернатив матрица из композиций, описанных в настоящем документе, представляет собой комбинацию полигликолевой кислоты и триметиленкарбоната, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. В качестве еще одной альтернативы матрица из композиций, описанных в настоящем документе, представляет собой сетку из полигликолевой кислоты: триметиленкарбоната (PGA:TMC), имеющую, например, молярное соотношение PGA:TMC примерно 10:90, примерно 15:85, примерно 20:80, примерно 25:75, примерно 30:70, примерно 35:65, примерно 40:60, примерно 45:55, примерно 50:50, примерно 55:45, примерно 60:40, примерно 65:35, примерно 70:30, примерно 75:25, примерно 80:20, примерно 85:15 или примерно 90:10, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации. В качестве другой альтернативы матрица из композиций, описанных в настоящем документе, представляет собой сетку из полигликолевой кислоты:триметиленкарбоната (PGA:TMC), имеющую, например, молярное соотношение PGA:TMC примерно 85:15, например, GORE® SEAMGUARD®, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом или шестом вариантах реализации.
[0052] В десятом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций содержит примерно 50 масс. % или менее от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации. В качестве альтернативы, терапевтически активный агент содержит примерно масс. % или менее от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации. В качестве альтернативы, терапевтически активный агент содержит примерно 20 масс. % или менее от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации. В качестве другой альтернативы, терапевтически активный агент содержит примерно 15 масс. % или менее от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации. В качестве другой альтернативы, терапевтически активный агент содержит примерно 10 масс. % от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации. В качестве другой альтернативы, терапевтически активный агент содержит примерно 5 масс. % от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации. В качестве другой альтернативы, терапевтически активный агент содержит примерно 1 масс. % от общей массы по меньшей мере одного полимера и по меньшей мере одного вспомогательного вещества, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом или девятом вариантах реализации.
[0053] В одиннадцатом варианте реализации по меньшей мере одно вспомогательное вещество из описанных в настоящем документе композиций содержит примерно 50 масс. % или менее от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации. В качестве альтернативы вспомогательное вещество содержит от примерно 10 масс. % до примерно 40 масс. % или менее от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации. В качестве другой альтернативы вспомогательное вещество содержит от примерно 5 масс. % до примерно 50 масс. % от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации. В качестве другой альтернативы вспомогательное вещество содержит от примерно 5 масс. % до примерно 35 масс. % от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации. В качестве другой альтернативы вспомогательное вещество содержит от примерно 5 масс. % до примерно 20 масс. % от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации. В качестве другой альтернативы вспомогательное вещество содержит от примерно 5 масс. % до примерно 35 масс. % от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации. В качестве другой альтернативы вспомогательное вещество содержит от примерно 5 масс. % до примерно 20 масс. % от общей массы по меньшей мере одного полимера и терапевтически активного агента, встроенного в матрицу, нанесенного на матрицу в качестве покрытия или встроенного и нанесенного на матрицу в качестве покрытия, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом или десятом вариантах реализации.
[0054] В настоящем документе термин «терапевтически активный агент» относится к любому агенту, который способен проявлять биологический эффект in vitro и/или in vivo, который является терапевтическим по своей природе.
[0055] В двенадцатом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций выбран из синтетических органических молекул, белков, ферментов, факторов роста, полианионов, нуклеозидов, нуклеотидов, полинуклеотидов и известных фармацевтических агентов и лекарственных средств, содержащих подобные, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации. В качестве одной альтернативы терапевтически активный агент из описанных в настоящем документе композиций выбран из (1) анальгезирующих нестероидных противовоспалительных лекарственных средств (НПВП), таких как диклофенак, ибупрофен, кетопрофен и напроксен; (2) анальгезирующих агонистов опиатных рецепторов, таких как кодеин, фентанил, гидроморфон и морфин; (3) салицилатных анальгетиков, таких как аспирин (ASA) (ASA с энтеросолюбильным покрытием); (4) антигистаминных H1-блокаторов, таких как клемастин и терфенадин; (5) антигистаминных H2-блокаторов, таких как циметидин, фамотидин, низадин и ранитидин; (6) противоинфекционных агентов, таких как мупироцин; (7) противоинфекционных лекарственных средств против анаэробной флоры, таких как хлорамфеникол и клиндамицин; (8) противогрибковых антибиотических противоинфекционных средств, таких как амфотерицин b, клотримазол, флуконазол и кетоконазол; (9) противоинфекционных антибиотиков группы макролидов, таких как азитромицин и эритромицин; (10) различных бета-лактамных антибиотических противоинфекционных средств, таких как азтреонам и имипенем; (11) противоинфекционных антибиотиков группы пенициллина, таких как нафциллин, оксациллин, пенициллин G и пенициллин V; (12) противоинфекционных антибиотиков группы хинолонов, таких как ципрофлоксацин и норфлоксацин; (13) противоинфекционных антибиотиков группы тетрациклина, таких как доксициклин, миноциклин и тетрациклин; (14) противотуберкулезных антимикобактериальных противоинфекционных средств, такие как изониазид (INH) и рифампин; (15) противопротозойных противоинфекционных средств, таких как атовакуон и дапсон; (16) противомалярийных антипротозойных противоинфекционных средств, таких как хлорохин и пириметамин; (17) противоретровирусных противоинфекционных средств, таких как ритонавир и зидовудин; (18) противовирусных противоинфекционных агентов, таких как ацикловир, ганцикловир, интерферон альфа и римантадин; (19) алкилирующих противоопухолевых агентов, таких как карбоплатин и цисплатин; (20) алкилирующих противоопухолевых средств на основе нитрозомочевины, таких как кармустин (BCNU); (21) противоопухолевых антиметаболитов, таких как метотрексат; (22) противоопухолевых антиметаболитов, аналогов пиримидина, таких как фторурацил (5-ФУ) и гемцитабин; (23) гормональных противоопухолевых средств, таких как гозерелин, лейпролид и тамоксифен; (24) природных противоопухолевых средств, таких как альдеслейкин, интерлейкин-2, доцетаксел, этопозид (VP-16), интерферон альфа, паклитаксел и третиноин (ATRA); (25) антибиотических природных противоопухолевых средств, таких как блеомицин, дактиномицин, даунорубицин, доксорубицин и митомицин; (26) природных противоопухолевых средств на основе алкалоидов барвинка, таких как винбластин и винкристин; (27) агентов, действующих на вегетативную нервную систему, таких как никотин; (28) антихолинергических агентов, действующих на вегетативную нервную систему, таких как бензтропин и тригексифенидил; (29) антимускариновых антихолинергических агентов, действующих на вегетативную нервную систему, таких как атропин и оксибутинин; (30) агентов, действующих на вегетативную нервную систему, на основе алкалоидов спорыньи, таких как бромокриптин; (31) холинергических агонистов парасимпатомиметиков, таких как пилокарпин; (32) парасимпатомиметиков ингибиторов холинэстеразы, таких как пиридостигмин; (33) симпатолитиков альфа-блокаторов, таких как празозин; (34) симпатолитиков бета-блокаторов, таких как атенолол; (35) симпатомиметиков адренергических агонистов, таких как альбутерол и добутамин; (36) сердечно-сосудистых агентов, таких как аспирин (ASA), плавикс (клопидогреля бисульфат) и т.д.; (37) антиангинальных бета-блокаторов, таких как атенолол и пропранолол; (38) антиангинальных блокаторов кальциевых каналов, таких как нифедипин и верапамил; (39) нитратных антиангинальных агентов, таких как изосорбид динитрат (ISDN); (40) антиаритмических сердечных гликозидов, таких как дигоксин; (41) антиаритмических средств класса I, таких как лидокаин, мексилетин, фенитоин, прокаинамид и хинидин; (42) антиаритмических средств класса II, таких как атенолол, метопролол, пропранолол и тимолол; (43) антиаритмических средств класса III, таких как амиодарон; (44) антиаритмических средств класса IV, таких как дилтиазем и верапамил; (45) антигипертензивных альфа-блокаторов, таких как празозин; (46) антигипертензивных ингибиторов ангиотензинпревращающего фермента (ингибиторов АПФ), таких как каптоприл и эналаприл; (47) антигипертензивных бета-блокаторов, таких как атенолол, метопролол, надолол и пропанолол; (48) антигипертензивных блокаторов кальциевых каналов, таких как дилтиазем и нифедипин; (49) адренергических антигипертензивных агентов центрального действия, таких как клонидин и метилдопа; (50) диуретических антигипертензивных агентов, таких как амилорид, фуросемид, гидрохлоротиазид (HCTZ) и спиронолактон; (51) периферических сосудорасширяющих антигипертензивных агентов, таких как гидралазин и миноксидил; (52) антилипемических средств, таких как гемфиброзил и пробукол; (53) антилипемических агентов, способствующих выведению желчных кислот, таких как холестирамин; (54) антилипемических ингибиторов HMG-CoA-редуктазы, таких как ловастатин и правастатин; (55) инотропов, таких как амринон, добутамин и допамин; (56)сердечных гликозидов инотропного действия, таких как дигоксин; (57) тромболитических агентов или ферментов, таких как альтеплаза (ТРА), анистреплаза, стрептокиназа и урокиназа; (58) дерматологических агентов, таких как колхицин, изотретиноин, метотрексат, миноксидил, третиноин (ATRA); (59) дерматологических кортикостероидных противовоспалительных агентов, таких как бетаметазон и дексаметазон; (60) противогрибковых противоинфекционных местных агентов, таких как амфотерицин B, клотримазол, миконазол и нистатин; (61) противовирусных местных противоинфекционных агентов, таких как ацикловир; (62) местных противоопухолевых агентов, таких как фторурацил (5-FU); (63) электролитических и почечных агентов, таких как лактулоза; (64) петлевых диуретиков, таких как фуросемид; (65) калийсберегающих диуретиков, таких как триамтерен; (66) тиазидных диуретиков, таких как гидрохлоротиазид (HCTZ); (67) агентов, способствующих выведению мочевой кислоты, таких как пробенецид; (68) ферментов, таких как РНКаза и ДНКаза; (69) иммуносупрессорных агентов, таких как циклоспориновые стероиды, метотрексат, такролимус, сиролимус, рапамицин; (70) противорвотных средств, таких как прохлорперазин; (71) салицилатных желудочно-кишечных противовоспалительных агентов, таких как сульфасалазин; (72) противоязвенных агентов, ингибирующих секрецию желудочной кислоты, таких как омепразол; (73) противоязвенных H2-блокаторов, таких как циметидин, фамотидин, низатидин и ранитидин; (74) агентов, способствующих пищеварению, таких как панкрелипаза; (75) прокинетических агентов, таких как эритромицин; (76) внутривенных анестетических агонистов опиатных рецепторов, таких как фентанил; (77) гематопоэтических противоанемических агентов, таких как эритропоэтин, филграстим (G-CSF) и сарграмостим (GM-CSF); (78) коагуляционных агентов, таких как антигемофильные факторы 1-10 (XHF 1-10); (79) антикоагулянтов, таких как варфарин, гепарин и аргатробан; (80) ингибиторов рецепторов роста, таких как эрлотиниб и гефетиниб; (82) абортивных агентов, таких как метотрексат; (83) противодиабетических агентов, таких как инсулин; (84) пероральных контрацептивов, таких как эстроген и прогестин; (85) прогестиновых контрацептивов, таких как левоноргестрел и норгестрел; (86) эстрогенов, таких как конъюгированные эстрогены, диэтилстильбэстрол (DES), эстроген (эстрадиол, эстрон и эстропипат); (87) агентов фертильности, таких как кломифен, хорионический гонадатропин человека (ХГЧ) и менотропины; (88) паратиреоидных агентов, таких как кальцитонин; (89) гормонов гипофиза, таких как десмопрессин, гозерелин, окситоцин и вазопрессин (ADH); (90) прогестинов, таких как медроксипрогестерон, норэтиндрон и прогестерон; (91) тиреоидных гормонов, таких как левотироксин; (92) иммунобиологических агентов, таких как интерферон бета-1b и интерферон гамма-1b; (93) иммуноглобулинов, таких как иммуноглобулин IM, IMIG, IGIM и иммуноглобулин IV, IVIG, IGIV; (94) амидных местных анестетиков, таких как лидокаин; (95) эфирных местных анестетиков, таких как бензокаин и прокаин; (96) кортикостероидных противовоспалительных агентов для опорно-двигательного аппарата, таких как беклометазон, бетаметазон, кортизон, дексаметазон, гидрокортизон и преднизон; (97) противовоспалительных иммуносупрессоров для опорно-двигательного аппарата, таких как азатиоприн, циклофосфамид и метотрексат; (98) нестероидных противовоспалительных лекарственных средств для опорно-двигательного аппарата (НПВП), таких как диклофенак, ибупрофен, кетопрофен, кеторолак и напроксен; (99) релаксантов скелетной мускулатуры, таких как баклофен, циклобензаприн и диазепам; (100) нервно-мышечных блокаторов релаксантов скелетной мускулатуры обратимого действия, таких как пиридостигмин; (101) неврологических агентов, таких как нимодипин, рилузол, такрин и тиклопидин; (102) противосудорожных агентов, таких как карбамазепин, габапентин, ламотриджин, фенитоин и вальпроевая кислота; (103) барбитуратных противосудорожных агентов, таких как фенобарбитал и примидон; (104) бензодиазепиновых противосудорожных агентов, таких как клоназепам, диазепам и лоразепам; (105) агентов против болезни Паркинсона, таких как бромокриптин, леводопа, карбидопа и перголид; (106) агентов против головокружения, таких как меклизин; (107) агонистов опиатов, таких как кодеин, фентанил, гидроморфон, метадон и морфин; (108) антагонистов опиатов, таких как налоксон; (109) бета-блокаторов против глаукомы, таких как тимолол; (110) мейотических агентов против глаукомы, таких как пилокарпин; (111) офтальмологических аминогликозидных противоинфекционных агентов, таких как гентамицин, неомицин и тобрамицин; (112) офтальмологических хинолоновых противоинфекционных агентов, таких как ципрофлоксацин, норфлоксацин и офлоксацин; (113) офтальмологических кортикостероидных противовоспалительных агентов, таких как дексаметазон и преднизолон; (114) офтальмологических нестероидных противовоспалительных агентов (НПВП), таких как диклофенак; (115) антипсихотических агентов, таких как клозапин, галоперидол и рисперидон; (116) бензодиазепиновых анксиолитических агентов, седативных и снотворных агентов, таких как клоназепам, диазепам, лоразепам, оксазепам и празепам; (117) психостимуляторов, таких как метилфенидат и пемолин; (118) противокашлевых агентов, таких как кодеин; (119) бронхорасширяющих агентов, таких как теофиллин; (120) адренергических бронхорасширяющих агонистов, таких как альбутерол; (121) респираторных кортикостероидных противовоспалительных агентов, таких как дексаметазон; (122) противоядий, таких как флумазенил и налоксон; (123) антагонистов тяжелых металлов/хелатирующих агентов, таких как пеницилламин; (124) агентов, подавляющих химическую зависимость, таких как дисульфирам, налтрексон и никотин; (125) агентов, прекращающих химическую зависимость, таких как бромокриптин; (126) минералов, таких как железо, кальций и магний; (127) соединений витамина В, таких как цианокобаламин (витамин B12) и ниацин (витамин B3); (128) соединений витамина С, таких как аскорбиновая кислота; (129) соединений витамина D, таких как кальцитриол; (130) витамина А, витамина Е и соединений витамина Е; (131) отравляющих агентов, таких как рацин (racin); (132) кровоостанавливающих агентов, такие как протамин; (133)противогельминтных противоинфекционных агентов, таких как метронидазол; и (134) склерозирующих агентов, такие как тальк, спирт и доксициклин, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации.
[0056] В тринадцатом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций выбран из анаболических агентов, анестезирующих агентов, антацидов, противоастматических агентов, антихолестеринемических и противолипидных агентов, антикоагулянтов, противосудорожных агентов, противодиарейных агентов, противорвотных агентов, противоинфекционных агентов, агентов для лечения маний, противорвотных агентов, противоопухолевых агентов, агентов против ожирения, жаропонижающих и обезболивающих агентов, противоспазматических агентов, противотромботических агентов, агентов, снижающих уровень мочевой кислоты, антиангинальных агентов, антигистаминных агентов, противокашлевых агентов, подавителей аппетита, биологических агентов, агентов, расширяющих сосуды головного мозга, агентов, расширяющих коронарные сосуды, противоотечных агентов, диуретиков, диагностических агентов, эритропоэтических агентов, отхаркивающих агентов, желудочно-кишечных седативных агентов, гипергликемических агентов, снотворных агентов, гипогликемических агентов, ионообменных смол, слабительных агентов, минеральных добавок, муколитических агентов, нервно-мышечных лекарственных средств, агентов, расширяющих периферические сосуды, психотропных агентов, седативных агентов, стимуляторов, тиреоидных и антитиреоидных агентов, релаксантов матки, витаминов и пролекарств, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации. Примеры конкретных лекарственных средств, которые можно применять, включают: аспарагиназу, блеомицин, бусульфан, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, дексразоксан, доцетаксел, доксорубицин, этопозид, флоксуридин, флударабин, фторурацил, гемцитабин, гидроксимочевину, идарубицин, ифосфамид, иринотекан, ломустин, мехлорэтамин, мелфалан, меркаптопурин, метотрексат, митомицин, митотан, митоксантрон, паклитаксел, пентостатин, пликамицин, премекстред, прокарбазин, ритуксимаб, стрептозоцин, тенипозид, тиогуанин, тиотепа, винпластин, винкристин и винорелбин, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации.
[0057] В четырнадцатом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций выбран из противогрибкового агента, противоинфекционного противоопухолевого агента, противовирусного агента, анальгетика, нестероидного противовоспалительного лекарственного средства, наркотизирующего агента, агента против болезни Альцгеймера, противоракового агента, андрогенного агента, модулятора ангиотензина, антикоагулянта, противосудорожного агента, антидепрессанта, агента против болезни Паркинсона, антипсихотического агента, антиангинального агента, бета и альфа-блокатора, супрессора резорбции кости и родственного агента, агента BPH, антихолинергического и бета-антагонистического бронходилататора, блокатора кальциевых каналов, цитокина и антагониста CAM, глюкокортикоида, гормона, агента для лечения гепатита, модификатора лейкотриена, агента против рассеянного склероза, офтальмологического агента против глаукомы и антагониста рецептора легочного антигипертензивного эндотелина, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации. В качестве одной альтернативы терапевтически активный агент представляет собой противоопухолевый агент, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации. В качестве другой альтернативы терапевтически активный агент представляет собой противоопухолевый агент, выбранный из алкилирующего агента, сшивающего ДНК агента, ингибирующей нуклеиновой кислоты, противоопухолевого антибиотика, ингибитора тирозин/серин/треонинкиназы, ингибитора топоизомеразы, митотического ингибитора, кортикостероида, терапевтического антитела, модификаторов биологического ответа или стабилизатора микротрубочек, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации. В качестве другой альтернативы терапевтически активный агент выбран из паклитаксела, дискодермолида, эпотилона А, эпотилона В, эпотилона С, эпотилона D, эпотилона Е, эпотилона F, эпотилона B N-оксида, эпотилона A N-оксида, 16-аза-эпотилона B, 21-аминоэпотилона B, 21-гидроксиэпотилона D, преднизона, 26-фторэпотилона, топотекана, блеомицина, доксорубицина, 5-фторурацила, 6-меркаптопурина, капецитабина, цитарабина, флоксуридина, флударабина, гемцитабина, пеметрекседа, актиномицина-D, иринотекана, этопозида, дексаметазона, FR-182877, BSF-223651, AC-7739, AC-7700, фиджанолида В, лаулималида, карибеозида, карибеолина, таккалонолида, элеутеробина, саркодиктина, лаулималида, диктиостатина-1 и сложных эфиров ятрофана и их аналогов и производных, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или одиннадцатом вариантах реализации.
[0058] В пятнадцатом варианте реализации терапевтически активный агент представляет паклитаксел или цисплатин, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом или тринадцатом вариантах реализации. В качестве альтернативы, терапевтически активный агент представляет собой паклитаксел, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, тринадцатом или четырнадцатом вариантах реализации.
[0059] В шестнадцатом варианте реализации терапевтически активный агент представляет собой паклитаксел в количестве в диапазоне от примерно 10 мкг/см2 до примерно 450 мкг/см2, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, четырнадцатом или пятнадцатом вариантах реализации. В качестве одной альтернативы терапевтически активный агент представляет собой паклитаксел в количестве в диапазоне от примерно 150 мкг/см2 до примерно 300 мкг/см2, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, четырнадцатом или пятнадцатом вариантах реализации. В качестве другой альтернативы терапевтически активный агент представляет собой паклитаксел в количестве в диапазоне от примерно 225 мкг/см2 до примерно 275 мкг/см2, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, четырнадцатом или пятнадцатом вариантах реализации. В качестве другой альтернативы терапевтически активный агент представляет собой паклитаксел в количестве примерно 250 мкг/см2, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, четырнадцатом или пятнадцатом вариантах реализации.
[0060] В семнадцатом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций инкапсулирован в микро или наноструктуру, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом или шестнадцатом вариантах реализации.
[0061] В восемнадцатом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций инкапсулирован в липосому, полимерный, дендримерный, кремниевый или углеродный материал или магнитную частицу, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом или семнадцатом вариантах реализации.
[0062] В девятнадцатом варианте реализации терапевтически активный агент из описанных в настоящем документе композиций инкапсулирован в полимер, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом или восемнадцатом вариантах реализации.
[0063] В двадцатом варианте реализации по меньшей мере одно вспомогательное вещество из описанных в настоящем документе композиций выбрано из поливинилпирролидона (ПВП), полиэтиленоксида (ПЭО), поливинилового спирта (PVA), гидроксипропилцеллюлозы (HPC), сукцинатацетата гидроксипропилметилцеллюлозы (HPMCAS), этиленвинилацетата (EVA), метакрилатов, этилцеллюлозы (EC), ацетатбутирата целлюлозы (CAB), ацетатфталата целлюлозы (CAP), полиэтиленгликоля, поливинилацетата (PVAc), полилактида (PLA), полигликолида (PGA), сополимеров PLA/PGA и поликапролактона (PCL), поливинилпирролидон-ковинилацетата и полиуретанов, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом или девятнадцатом вариантах реализации. В качестве одной альтернативы по меньшей мере одно вспомогательное вещество представляет собой полиэтиленгликоль, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом или девятнадцатом вариантах реализации.
[0064] В двадцать первом варианте реализации по меньшей мере одно вспомогательное вещество из описанных в настоящем документе композиций представляет собой полиэтиленгликоль, обладающий молекулярной массой более примерно 1000 г/моль, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом или двадцатом вариантах реализации. В качестве одной альтернативы по меньшей мере одно вспомогательное вещество представляет собой полиэтиленгликоль, обладающий молекулярной массой в диапазоне от примерно 2000 г/моль до примерно 15000 г/моль, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом или двадцатом вариантах реализации. В качестве другой альтернативы по меньшей мере одно вспомогательное вещество представляет собой полиэтиленгликоль, обладающий молекулярной массой в диапазоне от примерно 4000 г/моль до примерно 10000 г/моль, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом или двадцатом вариантах реализации. В качестве другой альтернативы по меньшей мере одно вспомогательное вещество представляет собой полиэтиленгликоль, обладающий молекулярной массой в диапазоне от примерно 7000 г/моль до примерно 9000 г/моль, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом или двадцатом вариантах реализации. В качестве другой альтернативы по меньшей мере одно вспомогательное вещество представляет собой полиэтиленгликоль 8000, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как во втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом или двадцатом вариантах реализации.
[0065] В двадцать втором варианте реализации по меньшей мере один полимер из описанных в настоящем документе композиций представляет собой сополимер поли(молочной-со-гликолевой кислоты) (PGLA), при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом, двадцатом или двадцать первом вариантах реализации.
[0066] В двадцать третьем варианте реализации по меньшей мере один полимер из описанных в настоящем документе композиций представляет собой сополимер поли(молочной-со-гликолевой кислоты) (PGLA), имеющий молярное соотношение лактид/гликолид, составляющее примерно 20:80, примерно 25:75, примерно 40:60, примерно 45:55, примерно 53:47, примерно 55:45, примерно 50:50, примерно 60:40, примерно 75:25 или примерно 80:20, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом, двадцатом, двадцать первом или двадцать втором вариантах реализации. В качестве альтернативы, по меньшей мере один полимер представляет собой сополимер поли(молочной-со-гликолевой кислоты) (PGLA), имеющий молярное соотношение лактид/гликолид, составляющее примерно 50:50, примерно 47:53 и/или примерно 53:47, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом, двадцатом, двадцать первом или двадцать втором вариантах реализации. В качестве другой альтернативы, по меньшей мере один полимер представляет собой сополимер поли(молочной-со-гликолевой кислоты) (PGLA), имеющий молярное соотношение лактид/гликолид, составляющее примерно 50:50, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом, двадцатом, двадцать первом или двадцать втором вариантах реализации.
[0067] В двадцать четвертом варианте реализации по меньшей мере один полимер из описанных в настоящем документе композиций представляет собой сополимер поли(молочной-со-гликолевой кислоты) (PGLA), имеющий молекулярную массу в диапазоне от примерно 20000 г/моль до примерно 250000 г/моль, от примерно 50000 г/моль до примерно 150000 г/моль, от примерно 65000 г/моль до примерно 100000 г/моль, от примерно 70000 г/моль до примерно 80000 г/моль или примерно 725000 г/моль, при этом остальные свойства композиции являются такими, как описано в настоящем документе, например, как в первом, втором, третьем, четвертом, пятом, шестом, седьмом, восьмом, девятом, десятом, одиннадцатом, двенадцатом, тринадцатом, четырнадцатом, пятнадцатом, шестнадцатом, семнадцатом, восемнадцатом, девятнадцатом, двадцатом, двадцать первом, двадцать втором и двадцать третьем вариантах реализации.
В. Способы применения
[0068] Композиции, описанные в настоящем документе, такие как, например, примерно представленные в вариантах реализации с первого по двадцать пятый, подходят для лечения или снижения риска возникновения множества заболеваний или состояний у субъекта (например, человека). Ниже приведены примеры таких заболеваний и состояний.
[0069] В настоящем документе термин «снижение риска возникновения» обозначает препятствовать, останавливать или уменьшать вероятность возникновения заболевания или состояния, описанного в настоящем документе. Термин «снижение риска возникновения» можно применять взаимозаменяемо с терминами «уменьшение риска возникновения» и «сниженный риск возникновения». Уменьшение одного или нескольких состояний, описанных в настоящем документе, может включать, например, предотвращение или уменьшение одного или более факторов риска, связанных с указанным заболеванием или расстройством. В случае рака, например, предотвращение или уменьшение риска возникновения рецидива указанного рака или других потенциальных видов рака, путем прикрепления композиции, как определено в настоящем документе, будет считаться «снижением риска возникновения» указанного рака. Например, и в случае прикрепления композиции, описанной в настоящем документе, восприимчивому индивидууму до начала возникновения симптомов или диагноза (например, в свете симптомов в анамнезе и/или в свете генетических или других факторов восприимчивости, включая симптомы или состояния, которые известны или склонны к возникновению или рецидиву после хирургического удаления состояния), таким образом считают профилактическим лечением.
[0070] В настоящем документе термины «лечение», «лечить» и «обработка» относятся к обратному развитию, облегчению, дальнейшему ингибированию прогрессирования или индуцированию ремиссии заболевания или расстройства или одного или более симптомов, как описано в настоящем документе, после обнаружения состояния или одного или нескольких симптомов; т.е. к терапевтическому лечению. В одном аспекте лечение является терапевтическим.
[0071] Состояния или заболевания включают, например, такие, которые описаны и/или поддаются лечению терапевтически активными агентами, определенными в композициях, указанных выше, например, в вариантах реализации с первого по двадцать пятый. В одном варианте реализации состояние или заболевание, подлежащее лечению композициями, описанными в настоящем документе, например, как в вариантах реализации с первого по двадцать пятый, представляет собой рак.
[0072] В одном варианте реализации состояния или заболевания, подлежащие лечению композициями, определенными в настоящем документе, такие как, например, перечисленные в вариантах реализации с первого по двадцать пятый, или заболевания или состояния, риск возникновения которых снижается посредством вышеупомянутых композиций, представляют собой заболевания, после которых возникает локальный рецидив после хирургического лечения и, в некоторых случаях, те заболевания, которые также повторно локально возникают в месте резекции. Такие заболевания и состояния включают, например, рак головы и шеи, рак грудной клетки, рак глаз, рак носа, рак горла, рак легких, рак молочной железы, рак анального канала, рак брюшной полости и рак мочевого пузыря.
[0073] В одном варианте реализации состояние или заболевание, подлежащее лечению описанными в настоящем документе композициями, представляет собой рак легкого. Таким образом, в одном варианте реализации в настоящем описании представлен способ лечения или снижения риска возникновения рака (например, рака легкого) у субъекта, включающий прикрепление в или на субъект, композиции, описанной в настоящем документе, например, как описано в вариантах реализации с первого по двадцать пятый.
[0074] Как описано выше, композиции, описанные в настоящем документе, могут быть прикреплены (например, хирургически прикреплены) в или на субъект.В случае заболевания или расстройства, после которого возникает локальный рецидив после хирургического лечения, и в случаях, когда рецидив возникает локально в месте резекции (например, в случае резекции после удаления рака легкого), описанные в настоящем документе композиции можно прикреплять непосредственно в или на месте резекции, хирургического края или поражения. Композиции включают, например, описанные в вариантах реализации с первого по двадцать пятый. Таким образом, в одном аспекте композиции, описанные в настоящем документе, например, описанные в вариантах реализации с первого по двадцать пятый, могут быть нанесены в или, например, на грудную клетку субъекта, нуждающегося в этом, в или на брюшную полость субъекта, в или на конечности субъекта, в или на голову субъекта, нуждающегося в этом, в или на шею субъекта, нуждающегося в этом, в или на легочную систему субъекта, нуждающегося в этом, в или на глаза субъекта, нуждающегося в этом, в или на нос субъекта, нуждающегося в этом, или в или на горло субъекта, нуждающегося в этом, или их комбинации.
[0075] В одном варианте реализации композицию, описанную в настоящем документе, например, в вариантах реализации с первого по двадцать пятый, прикрепляют в или на легкие субъекта. В другом варианте реализации вышеупомянутую композицию прикрепляют в или на ткань легкого субъекта, нуждающегося в этом. Например, в другом варианте реализации в настоящем описании представлен способ лечения или снижения риска возникновения рака легкого у субъекта, нуждающегося в этом, включающий прикрепление в или на ткань легкого субъекта композиции, описанной в настоящем документе, например, как описано в вариантах реализации с первого по двадцать пятый. В еще одном варианте реализации в настоящем описании представлен способ лечения или снижения риска возникновения рака легкого у субъекта, нуждающегося в этом, включающий прикрепление на место хирургического среза или поражения в результате удаления рака легкого у субъекта, композиции, описанной в настоящем документе, например, как описано в вариантах реализации с первого по двадцать пятый.
[0076] В одном варианте реализации было обнаружено, что композиции, описанные в настоящем документе, например, в вариантах реализации с первой по двадцать пятый, доставляют терапевтически активный агент (например, паклитаксел) в медиастинальную ткань, головной мозг, тимус и почку. См. фиг. 19. Таким образом, в настоящем документе представлены способы доставки терапевтически активного агента в лимфатическую систему с применением композиций, описанных в настоящем документе, например, в вариантах реализации с первого по двадцать пятый.
[0077] В одном варианте реализации композиции, описанные в настоящем документе, например, в вариантах реализации с первого по двадцать пятый, проявляют непрерывное, переменное или сигмоидальное высвобождение терапевтически активного агента (например, паклитаксела).
[0078] В другом варианте реализации и/или в комбинации с предыдущими вариантами реализации композиции, описанные в настоящем документе, например, в вариантах реализации с первого по двадцать пятый, поддерживают непрерывное высвобождение терапевтически активного агента (например, паклитаксела) при менее примерно 100 нМ, при менее примерно 50 нМ, примерно от 2 до примерно 20 нМ. В одном случае непрерывное высвобождение составляет примерно 20 нМ в день. В некоторых случаях и/или в комбинации с предыдущими вариантами реализации при менее примерно 100 нМ паклитаксела токсические эффекты не проявляются.
[0079] В одном варианте реализации и/или в комбинации с предшествующими вариантами реализации композиции, описанные в настоящем документе, например, в вариантах реализации с первого по двадцать пятый, поддерживают замедленное высвобождение паклитаксела при менее примерно 100 нМ в день, при менее примерно 50 нМ в день, от примерно 2 до примерно 20 нМ в день. В одном случае замедленное высвобождение составляет примерно 20 нМ в день. В некоторых случаях и/или в комбинации с предыдущими вариантами реализации при менее примерно 100 нМ в день паклитаксела токсические эффекты не проявляются.
[0080] В одном варианте реализации и/или в комбинации с предшествующими вариантами реализации более 70%, более 75%, более 80% или более 85% терапевтического агента паклитаксела высвобождается с применением описанных в настоящем документе композиций, например, в вариантах реализации с первого по двадцать пятый.
[0081] В одном варианте реализации и/или в комбинации с предшествующими вариантами реализации полное растворение терапевтического агента паклитаксела поддерживается на протяжении всего периода доставки и высвобождения.
С. Технические преимущества
[0082] Ниже представлены некоторые технические преимущества описанных в настоящем документе композиций. Указанные преимущества никоим образом не являются ограничивающими и представлены только в иллюстративных целях. Они не предназначены и не должны толковаться как ограничивающие объем настоящего изобретения. Следует также понимать, что преимущества, описанные в настоящем документе, никоим образом не должны быть признаны исчерпывающими относительно всех преимуществ настоящих композиций. Скорее, преимущества, описанные ниже, просто представляют некоторые технические характеристики, чтобы дополнительно проиллюстрировать проблемы, решаемые настоящим изобретением.
[0083] Как описано выше, во многих хирургических процедурах, в том числе при открытой и эндоскопической хирургии, часто необходимо смыкать, скреплять, сшивать, склеивать, зажимать или соединять ткань. Устройства для хирургического закрытия, такие как устройства для сшивания скобами, нашли широкое применение в хирургических операциях, где необходимо скреплять или удалять ткань организма. При работе на тонкой ткани, такой как тонкая эмфизематозная легочная ткань, важно эффективно герметизировать ткань, которая может быть особенно подвержена просачиванию воздуха. Предотвращение или уменьшение просачивания воздуха может значительно снизить время послеоперационного восстановления. Таким образом, было бы целесообразно обеспечить хирургическую сетку или хирургический укрепляющий материал, который эффективно прикреплял и герметизировал бы хирургический участок в месте резекции. Композиции, описанные в настоящем документе, обеспечивают такой результат, как показано, например, на фиг. 1, где легочная ткань оставалась герметичной без просачивания после 14-дневного прикрепления композиции согласно настоящему изобретению. Более подробная информация описана, например, в разделе «Примеры» ниже.
[0084] В дополнение к обеспечению соответствующей герметизации в месте резекции еще одним преимуществом было бы прикрепление композиции, которая также обеспечивает эффекты элюирования лекарственного средства. Это было бы особенно важно в случаях после удаления инфицированной или злокачественной ткани. Как описано выше в отношении рака, например, клиновидная резекция является нежелательной вследствие частоты возникновения локализованного рецидива рака на границе резекции, составляющей 19%. Однако композиции, описанные в настоящем документе, не только эффективны для герметизации места резекции, но и локально доставляют терапевтические концентрации лекарственного средства на участок прикрепления (ткань). Таким образом, например, после удаления одного или более злокачественных новообразований (например, из легких пациента), настоящие композиции могут быть прикреплены для герметизации хирургического края (или прикреплены к участку поражения) и эффективной герметизации участка и доставки терапевтических концентраций активных агентов (например, противораковых агентов, таких как паклитаксел и/или цисплатин) для предотвращения локального рецидива.
[0085] В дополнение к герметизации участка резекции для увеличения времени заживления и локальной доставки терапевтических концентраций лекарственного средства в ткань на участке прикрепления настоящие композиции дополнительно обеспечивают превосходные дозирующие свойства. Терапевтические агенты из описанных в настоящем документе композиций не высвобождаются системно. См., например, фиг. 14. Никаких побочных эффектов при последующем заживлении не наблюдалось, и композиции хорошо переносились in vivo, как описано в приведенном ниже примере. В случае композиций, содержащих терапевтический агент паклитаксел, никакой токсичности не наблюдалась даже при высвобождении в концентрациях более 50 нМ и независимо от тенденции высвобождения, т.е., при непрерывном, переменном, сигмоидальном, «взрывном» высвобождении, их комбинациях и т.д. Кроме того, полное растворение (способ многократных стоков) поддерживалось в течение доставки и высвобождения с помощью данных композиций, содержащих терапевтический агент паклитаксел. Скорость доставки дозы в этих случаях составляет примерно 10,1 мг на пациента для композиции, содержащей 450 мкг/см2 и концентрацию паклитаксела 10%.
[0086] Еще одно преимущество настоящих композиций заключается в минимизации сброса дозы и неблагоприятных эффектов, вызванных разрушением лекарственных средств. В случае паклитаксела данные композиции локально доставляют более 80% указанного терапевтического агента в ткань-мишень, в то же время оказывая терапевтический эффект. См., например, фиг. от 4С до 8С, на которых показано фактическое кумулятивное высвобождение концентрации паклитаксела в день. Благодаря этому, а также вследствие преимуществ, описанных выше, необходимо меньше лекарственного средства в целом (то есть паклитаксела) и, следовательно, риск, связанный со сбросом доз (например, в нецелевые области), снижается, и применение становится более безопасным, поскольку для разрушения остаются незначительные количества.
[0087] Указанные технические преимущества в совокупности обеспечивают единую композицию, которую можно применять для эффективной герметизации участка резекции после удаления инфицированной или злокачественной ткани и, кроме того, для локального лечения участка резекции терапевтическим агентом, при этом композиция эффективно доставляется в обширную локальную область ткани в течение периода по меньшей мере 60 дней (или по меньшей мере 30 дней) без какого-либо наблюдаемого токсического эффекта. Другими словами, никаких нежелательных явлений в течение указанных периодов не наблюдалось.
[0088] Некоторые примерные предложенные композиции и виды применения, описанные выше, изложены в разделе «ПРИМЕРЫ» ниже. В некоторых вариантах реализации предложенная композиция и/или применение представляет собой одно или более, выбранное из примеров, представленных в разделе «Примеры» ниже.
Примеры
[0089] Приведенные ниже типичные примеры предназначены, чтобы помочь проиллюстрировать настоящее изобретение, и не предназначены и не должны быть истолкованы как ограничивающие объем изобретения. В действительности, различные модификации настоящего изобретения и многие другие варианты его реализации в дополнение к тем, которые показаны и описаны в настоящем документе, станут очевидными для специалистов в данной области из полного содержания этого документа, включая последующие примеры и ссылки на научную и патентную литературу, приведенные в настоящем документе. Следует также понимать, что содержание цитированных ссылок включено в настоящий документ посредством ссылки, чтобы проиллюстрировать уровень техники.
[0090] Терапевтические уровни паклитаксела доставляли в более 2,5 см легочной ткани в течение 14 дней при применении имплантатов из укрепляющего материала, покрытого 1%, 5% и 10% паклитаксела. Процедура и имплантаты хорошо переносились. Нормальное заживление наблюдали при применении всех имплантатов, даже с микромолярной концентрацией лекарственного средства непосредственно под терапевтическим имплантатом. Уровни паклитаксела составляли ниже 0,5 пг/мл в крови на 2, 7 и 14 день, и в плевральной жидкости определяли 10-100 нМ.
[0091] Для измерений 1% равно или приблизительно составляет 25 мкг/см2, 5% равно или приблизительно составляет 120 мкг/см2, 10% равно или приблизительно составляет 225 мкг/см2, и 20% равно или приблизительно составляет 415 мкг/см2.
1. Общая методика и способы разработки для высвобождения in vitro
[0092] С применением пленочного аппликатора/Gate способа, композицию, описанную в настоящем документе, содержащую 7%, 10%, 15% и 20% паклитаксела, получали путем покрытия PGA или PGA/TMC сетки 20% масс./об. растворами 25% PEG8K 50/50PLGA+Pax. На фиг. 3 проиллюстрирована воспроизводимость между образцами из разных мест на субстрате. Как показано на фиг. 4А-С, данные высвобождения демонстрируют увеличение «взрывного» высвобождения и общего высвобождения с увеличением содержания паклитаксела (Pax).
[0093] Последующее исследование проводили с применением 1%, 5% и 10% составов, содержащих Pax, для уменьшения количества высвобождаемого лекарственного средства (мкг/день). См. фиг. 5A-C. На фиг. 7 показаны данные двух дополнительных исследований по высвобождению, одно из которых проводили в течение 30 дней.
[0094] Аналогичные эксперименты проводили с применением других укрепляющих материалов. Например, в качестве сравнительного коммерческого контроля применяли укрепляющий материал PGA/TMC (GORE® SEAMGUARD). Результаты этих экспериментов представлены на фиг. 6.
2. +/- действие стерилизации in vitro
[0095] Определенное действие на высвобождение описанных композиций in vitro наблюдали при обработке этиленоксидом (EtO). Например, на фиг. 8А-С показано, что обработка EtO ингибирует высвобождение паклитаксела (Pax) по всем показателям (мкг, %, мкг/см2) во всех составах. Этот эффект наиболее выраженно проявился в составах с самым высоким % Pax. Однако, неожиданно оказалось, что, хотя этот результат оказал нежелательное действие при увеличении содержания лекарственного средства, оказалось, что он не проявил выраженного эффекта in vivo. Действительно, замедление высвобождения паклитаксела (и уменьшение «взрывного» высвобождения при высоком процентном содержании Pax) может представлять собой еще один кумулятивный эффект в отношении того, почему раскрытые композиции осуществляют исключительно in vivo.
3. Общая методика исследования имплантата в легком кролика с применением композиций по настоящему изобретению
[0096] Осуществляли разрез в грудную клетку анестезированных кроликов в 8-м межреберном промежутке. Каудальную долю частично высвобождали от ниже расположенной связки. Имплантаты прикрепляли в виде «сэндвича» на апикальном конце иссеченной каудальной доли. Во всех случаях 2 имплантата, верхний и нижний, предварительно помещали на 30 мм GIA степлер. Сшивание скобами и резекцию выполняли с помощью степлера 30 мм GIA. Животных зашивали, воздух из грудной клетки удаляли и закрывали рану. Все животные перенесли процедуру и нормально восстанавливались. Общая схема процедуры резекции представлена на фиг. 13. Например, зажимы степлера (с имплантатом) располагали таким образом, чтобы захватывать ткань (фиг. 13A). Затем скобы пропускали сквозь имплантат, закрепляя его на ткани, в то время как внутреннее лезвие разделяло сшитую ткань на две части (фиг. 13B). Затем разделенный имплантат освобождали от степлера. Иссеченную ткань удаляли. Имплантаты удерживались скобами на краю резекции, предотвращая просачивание воздуха и крови и обеспечивая локальное введение паклитаксела (фиг. 13C).
а. Тестируемые композиции
[0097] Стандартный укрепляющий материал PGA (т.е., сетка из PGA).
[0098] Стандартный укрепляющий материал PGA (т.е., сетка из PGA)+покрытие PLGA/PEG - не содержит ABC103-A
[0099] Стандартный укрепляющий материал PGA (т.е., сетка из PGA)+покрытие PLGA/PEG с 1% масс./масс. лекарственного средства (паклитаксел) в покрытии - ABC103-A 25 мкг/см2.
[0100] Стандартный укрепляющий материал PGA (т.е., сетка из PGA)+покрытие PLGA/PEG с 5% масс./масс. лекарственного средства (паклитаксел) в покрытии - ABC103-A 120 мкг/см2.
[0101] Стандартный укрепляющий материал PGA (т.е., сетка из PGA)+покрытие PLGA/PEG с 10% масс./масс. лекарственного средства (паклитаксел) в покрытии - ABC103-A 225 мкг/см2.
[0102] Укрепляющий материал PGA/TMC (GORE® SEAMGUARD).
[0103] Укрепляющий материал PGA/TMC (GORE® SEAMGUARD).+покрытие PLGA/PEG - не содержит - ABC103-B.
[0104] Укрепляющий материал PGA/TMC (GORE® SEAMGUARD).+покрытие PLGA/PEG с 1% масс./масс.лекарственного средства (паклитаксел) в покрытии - ABC103-B 25 мкг/см2.
[0105] Каждый вид образца тестировали на двух животных. Сухая масса покрытого укрепляющего материала увеличилась примерно на 50% по сравнению с непокрытым укрепляющим материалом.
B. Анализ на содержание паклитаксела и гистология
[0106] Проводили анализ крови, плевральной жидкости и ткани на концентрацию паклитаксела. Концентрации паклитаксела в крови определяли через 2 дня, 7 дней и в конце через 14 дней, и определяли как концентрации ниже пределов, поддающихся количественной оценке (<500 пг/мл). В рамках указанного протокола не было обнаружено метаболитов паклитаксела. Паклитаксел в плевральной жидкости тестировали в день 0 и день 14 при вскрытии, и в легочной ткани на 14 день при вскрытии. Все основные органы и стенку грудной клетки на разрезе восстанавливали и разделяли на две части, одну половину замораживали при -80 оC для последующего анализа на паклитаксел, а вторую половину фиксировали в формалине для последующей гистологии. На фиг. 9 представлен способ восстановления серии 5 мм участков легкого для анализа на паклитаксел на расстоянии 2,5 см от края разреза. В таблице 1 ниже показаны концентрации паклитаксела в ткани в легких кролика с радиальными интервалами 5 мм от края резекции (нМ).
[0107] Таблица 1:
[0108] На фиг. 10 проиллюстрировано лекарственное средство паклитаксел в наномолярной концентрации в 5 мм радиальной секции легкого при 1% и 10%. Диапазон терапевтической концентрации паклитаксела определили как IC50 = >7 нМ или примерно 6 нг/мл, и IC90 = примерно 50 нМ или примерно 42,5 нг/мл. Точка данных для концентрации паклитаксела непосредственно под имплантатом во избежание сомнений не была включена в графики для 5 мм по краю резекции под имплантатом. Данные являются неравномерными вследствие малого количества животных, протестированных в указанном предварительном эксперименте (n=2 кролика).
[0109] На фиг. 11 представлен пример резекции и удаления половины имплантируемых композиций, где секции in vivo были обрезаны на ширину не более чем на 5 мм, чем расположенное ниже легкое.
[0110] На фиг. 12 проиллюстрирована легочная ткань кролика после 14-дневного прикрепления ABC103-A, при: отсутствии терапевтически активного агента (А), 1% терапевтически активного агента (В), 5% терапевтически активного агента (С) и 10% терапевтически активного агента (D). Легкие в (C) и (D) наполняются воздухом без просачивания.
[0111] Дополнительная кинетика высвобождения in vitro в зависимости от дозы паклитаксела из ABC103-A представляла собой следующую.
[0112] Для количественной оценки кинетики высвобождения лекарственного средства in vitro из имплантатов синтезировали образцы 1 см2 ABC103-A с различным содержанием паклитаксела: 25 мкг/см2, 120 мкг/см2, 225 мкг/см2 или 415 мкг/см2 (1%, 5%, 10% или 20% содержание, соответственно). Каждый имплантат помещали в условия емкости: 100 мл 1X забуференного фосфатом физиологического раствора (PBS) с 2% (об./об.) ТВИН 80 при 37°C с ежедневной сменой буфера. Аликвоты из емкости отбирали в моменты времени (день): 0,25, 1, 2, 3, 5, 7, 10, 14, 18, 23, 30), и количественно определяли содержание паклитаксела посредством LC-MS.
[0113] Результаты продемонстрировали воспроизводимую кинетику высвобождения паклитаксела из имплантатов. После первоначального «взрывного» высвобождения в первый и второй день скорость высвобождения принимала линейный профиль без каких-либо признаков критического высвобождения в результате гидролиза полимера (фиг. 16); выпавшие данные были удалены во время анализа.
4. Распределение лекарственного средства и безопасность
[0114] Животных наблюдали на наличие просачивания крови, просачивания воздуха, истирания раны и прогрессирование нормального общего и гистологического излечения в течение 14 дней. Распределение паклитаксела измеряли на 14 день в органах, тканях и биологических жидкостях.
[0115] Наблюдали нормальное заживление без очевидных признаков токсичности. Нормальное заживление в месте резекции легкого подтверждали с применением гистологии/микроскопии фиксированных окрашенных тканей (фиг. 14). На фиг. 14А показан контроль с укрепляющим материалом без нанесения покрытия. Площадь укрепляющего материала (аппроксимировано пунктирной линией) с минимальной окружающей фиброзной соединительной тканью (звездочки) и мягкой фиброваскулярной тканью (двойные звездочки), где a. представляет собой область с большим увеличением. Следует обратить внимание на область укрепляющего материала (в пределах пунктирной линии) с широко распространенной инфильтрацией воспалительных клеток (преимущественно гистиоцитов и многоядерных гигантских клеток) и/или ткани. На фиг. 14В показан укрепляющий материал, как описано в настоящем документе, без лекарственного средства (паклитаксел). Следует обратить внимание на имплантат (аппроксимировано пунктирной линией) с минимальной окружающей фиброваскулярной тканью (двойные звездочки), где на b. показана область более высокого увеличения в нижней части. Следует обратить внимание на имплантат (в пределах пунктирной линии) с минимальной инфильтрацией воспалительных клеток и/или ткани. На фиг. 14C показан укрепляющий материал, покрытый паклитакселом, с содержанием 225 мкг/см2. Следует обратить внимание на имплантат (аппроксимировано пунктирной линией) с минимальным количеством окружающего фибрина (звездочки), смешанным с продуктами клеточного распада (двойные звездочки), и минимальной связанной с ним воспалительной или фиброваскулярной тканью, где c. представляет собой область более высокого увеличения в нижней части. Следует обратить внимание на область имплантата (в пределах пунктирной линии) с минимальной инфильтрацией или воспалительными клетками и/или тканью.
[0116] Во время хирургической операции или при 14-дневном окончательном вскрытии не наблюдалось острого просачивания воздуха или крови. Определяли уровни паклитаксела в крови, плевральной жидкости, тканях и органах. Уровни паклитаксела были ниже количественных пределов <0,5 нг/мл в крови и тканях вне грудной клетки. Проникновение паклитаксела более чем на 2,5 см от имплантата/края резекции составляло в концентрациях от 350 нМ до 3 мкМ с имплантом, содержащим 225 мкг/см2 (фиг. 15). Эти результаты показывают, что кинетика высвобождения паклитаксела из покрытого паклитакселом укрепляющего материала была контролируемой и хорошо переносилась на ортотопической модели кролика.
5. Распределение лекарственного средства и безопасность имплантата в легких свиней
[0117] ABC103-A вводили йоркширским свиньям в дозировке 225 мкг/см2 = ~1 мг (1 см x 4,5 см имплантата) и в дозировке 415 мкг/см2 = ~1,9 мг (1 см × 4.5 см имплантата).
[0118] Животным проводили единственную хирургическую процедуру в День 0, в которой получали доступ к левой краниальной доле, и два отдельных устройства ABC103-A наносили на дистальные и проксимальные края доли, а затем скрепляли на месте. После нанесения укрепляющего материала, оставшиеся дистальные ткани легкого иссекали, и избыток укрепляющего материала обрезали и сохраняли в замороженном виде для анализа, вместе с избытком укрепляющего материала, который обрезали через 45 мм от места крепления скобы перед резекцией. Степлер Covidien Endo Gia применяли для резекции легких/имплантатов укрепляющего материала. Covidien EGIA60AMT для дистального имплантата (60 мм) и Covidien EGIA45AMT для проксимального имплантата (45 мм). Было подтверждено, что перед закрытием никакого просачивания воздуха не происходило.
[0119] Наблюдения за участками разреза проводили ежедневно до заживления, и клинические наблюдения проводили ежедневно в течение 14 дней, далее еженедельно и перед вскрытием. Животных наблюдали на наличие просачивания крови, просачивания воздуха, истирания раны и прогрессирования нормального общего и гистологического излечения в течение 30 дней. В дни 2, 14, 30 и 60 животных анестезировали, и измеряли количество паклитаксела в крови на 2, 14 и 30 день, и в органах и тканях на 30 день. Участки имплантатов левой доли легкого проверяли на наличие просачивания, и собирали образец жидкости лаважа. Участки имплантации собирали, включая скрепочные швы/участки имплантации, соответствующие плевральные области и секции стенки организма. На 30 день и 60 день образцы имплантированных легких/укрепляющего материала и образцы участков плевральной области/секции стенки организма вблизи места имплантации во все моменты времени обрабатывали для гистопатологической оценки. Образцы для гистологии фиксировали в 10% нейтральном забуференном формалине. Образцы, которые включали имплантированное устройство, обрабатывали смолой и окрашивали гематоксилином и эозином (H&E) и трихромом Массона. Образцы тканей без устройства обрабатывали парафином и окрашивали посредством H&E. Все образцы для анализа на паклитаксел замораживали при номинально -80°C.
[0120] Никаких измеримых признаков локальной или системной токсичности при грубом осмотре или гистологическом исследовании при нормальном заживлении выявлено не было. Просачивания крови, просачивания воздуха или остро возникающего истирания раны при вскрытии не наблюдалось (фиг. 17). Определяемый паклитаксел появился в обработанном легком и ипсилатеральных трахеобронхиальных лимфатических узлах с клинически значимой доставкой паклитаксела на расстоянии не менее 8 см от края имплантата/резекции в концентрациях от 145 нМ до 85 мкМ (фиг. 18). Указанные данные и данные 60 дней на фиг. 19 указывают, что имплантаты хорошо переносятся.
[0121] Неожиданно, что измеряемое количество паклитаксела также появилось в ткани средостения (2,74-3,95 нг/г для 2 из 3 животных), головного мозга (5,05 нг/г для 1 из 3 животных), тимуса (2,96 нг/г для 1 из 3 животных) и почек (2,73 нг/г для 1 из 3 животных). На сегодняшний день полагают, что информации о каких-либо других средствах, когда препарат доставлялся через лимфатическую систему в другие места при отсутствии токсичности, не предоставлялось. Это было неожиданно и примечательно.
[0122] Наконец, на фиг. 20 показана репрезентативная гистология легкого через 60 дней после имплантации ABC103-A 225 мкг/см2. На фиг. 20А показаны H&E легкого, каудальной доли, обработанной ABC103-A 225 мкг/см2, через 60 дней после имплантации. Имплантат отмечен пунктирной линией. Звездочки указывают на незначительное уплотнение и воспаление в областях легкого, прилегающих к области имплантата. На фиг. 20 В показано окрашивание трихромом Массона (МТ) секции из фиг. 20А, которое показывает незначительный фиброз (стрелки) на периферии участка имплантации. На фиг. 20C показан вид из фиг. 20А с большим увеличением, показывающий фибрин (звездочка) в пределах частично резорбированного имплантата, легкое мононуклеарное воспаление прилежащей области (двойная звездочка) и очаг гигантских клеток (стрелка), содержащий незначительно преломляющий материал.
[0123] У всех животных были обнаружены участки, связанные с торакотомией (животные, которые получали имплантаты ABC103-A 225 мкг/см2 и были умерщвлены через 2, 14, 30 или 60 дней после имплантации), включая темное/красное обесцвечивание у всех животных на 2 день, утолщение и/или связанные с этим легочные спайки у всех животных на 14 день, и связанные с этим легочные спайки у всех животных на 30 и 60 день. Считают, что указанные данные связаны с хирургической моделью торакотомии, а не с имплантатом. Никаких истираний, связанных с имплантатом, отмеченных при вскрытии в любой момент времени, обнаружено не было. Не было свидетельства просачивания воздуха на 2-й день или 14-й день. Просачивание воздуха присутствовало у всех трех животных на 30 день и у одного животного на 60 день. Учитывая, что присутствуют легочно-грудные спайки, и что не было клинических признаков одышки или макроскопических или гистологических признаков ателектаза, чтобы предположить пневмоторакс, возможно, что просачивание воздуха было связано с разрушением ткани (т.е. разрушением спаек) как части торакального воздействия во время вскрытия. Не было обнаружено никаких других значительных макроскопических изменений (например, некроза, воспаления), связанных с обработанными участками, прилегающей паренхимой легкого и прилегающими поверхностями плевры (см. фиг. 20). У одного животного на 2 день наблюдали красное/темное обесцвечивание латеральной средней легочной доли, связанное с адгезией на участке торакотомии. У одного животного на 14 день обнаружен твердый, зернистый, темный узел размером ~ 12 × 10 мм вблизи участка обработки, состоящий из изолированного очага фибрина или некротического материала, и типичный для локализованного обнаружения после хирургического вмешательства.
[0124] Признаков неблагоприятной воспалительной реакции на имплантаты не наблюдалось. Среднее воспаление, связанное с имплантатом (то есть либо в пределах имплантатов, либо вдоль поверхностей имплантатов на легком, в отличие от бронхо-бронхиолярной лимфоидной ткани в более отдаленных местах) было гетерогенным и от минимального до средне-умеренного на 30 день. Общее воспаление немного увеличилось на 60 день с незначительными изменениями в составе лейкоцитов, незначительным снижением гранулоцитов (нейтрофилов и эозинофилов) и незначительным увеличением количества мононуклеарных клеток (макрофагов, гигантских клеток и лимфоцитов).
[0125] Воспаление в областях лобэктомии, но не непосредственно вокруг или в пределах имплантатов, обычно интерпретировали как связанное с хирургической моделью, а не с устройством/обработкой, но низкие размеры выборки исключали окончательную интерпретацию.
Реферат
Изобретение имеет отношение к имплантируемой композиции и способу ее применения для лечения или снижения риска возникновения рака. Имплантируемая композиция содержит матрицу вместе с сополимером поли(молочной-со-гликолевой кислоты) (PLGA), полиэтиленгликолем (PEG) 8000 и паклитакселом, в которой матрица представляет собой нетканую или тканую полимерную сетку, или представляет собой биологическую матрицу, выбранную из коллагеновых листов, бычьего перикарда, твердой мозговой оболочки человека или животного; PLGA имеет молекулярную массу в диапазоне от 20000 г/моль до около 250000 г/моль и молярное соотношение лактид/гликолид, составляющее от около 40:60 от около 60:40; паклитаксел содержится в количестве около 50 масс. % или менее от общей массы PLGA и PEG 8000; и PEG 8000 содержится в количестве от около 5 масс. % до около 35 масс. % от общей массы PLGA и паклитаксела. Технический результат - увеличенный терапевтический индекс лекарственного средства, низкое системное высвобождение, отсутствие нежелательных явлений при восстановлении после операции, соблюдение режима лечения и отсутствие вымывания, высокая степень переносимости, простота применения по стандарту хирургического лечения и легкая адаптируемость, для охвата широкого спектра терапевтических агентов и процедур. 2 н. и 13 з.п. ф-лы, 20 ил., 1 табл.
Формула
Документы, цитированные в отчёте о поиске
Имплантируемая композиция (варианты) и способ ее приготовления
Патенты аналоги
Имплантируемая композиция (варианты) и способ ее приготовления

Комментарии