Инъекционная композиция для мечения поражения - RU2717239C1
Код документа: RU2717239C1
Чертежи




Описание
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к инъекционной композиции для мечения поражения и к способу обеспечения информации о положении поражения с использованием инъекционной композиции.
Предшествующий уровень техники настоящего изобретения
Хотя были разработаны различные способы противоракового лечения с использованием противораковых лекарственных средств, удаление раковых клеток хирургическими способами остается наиболее широко используемым способом лечения.
Однако для хирургических способов, по сути, необходимы методы минимизации диапазона, подвергаемого хирургическому вмешательству, для улучшения здоровья и благополучия больного после хирургической операции. В частности, для достижения цели операции по сохранению молочной железы у корейских женщин, у которых, как правило, молочные железы не большого размера, поражения, которые удаляются хирургическим путем, должны быть меньше у корейских женщин, чем у женщин из других стран.
Между тем диапазон, затрагиваемый хирургическим вмешательством, определяют с учетом как поражения, так и краевых областей вокруг поражения. Если хирург не может определить точное местоположение или степень поражения, то он должен установить широкую краевую область вокруг поражения. Это связано с тем, что часть опухоли может оставаться на крае резекции поражения, если диапазон хирургического вмешательства снижать неосторожно.
Тем не менее существует не так много способов, которые могут быть использованы хирургом, чтобы точно идентифицировать поражение в режиме реального времени в ходе фактического клинического хирургического вмешательства. Хотя и были разработаны очень точные способы диагностики, но, поскольку такие способы диагностики не могут использоваться во время хирургического вмешательства, хирург в основном полагается на осязание или зрение в ходе фактического хирургического вмешательства, в таких случаях зачастую поражения четко не идентифицируют.
В частности, более мелкие поражения сложнее идентифицировать. Для целей достижения минимально инвазивного хирургического вмешательства и сохраняющего хирургического вмешательства необходима технология, которая показывала бы хирургу поражение в режиме реального времени в ходе хирургического вмешательства.
При традиционных хирургических вмешательствах по поводу удаления опухолей, в частности, при хирургическом вмешательстве при злокачественной опухоли молочной железы, перед хирургическим вмешательством определяют положение мелкого поражения у больного с использованием ультразвуковых волн, маммографии или магнитно-резонансной визуализации, предварительно определенное положение поражения маркируют и связанные с маркированным поражением ткани удаляют. Способы, используемые для маркировки поражений, включают в себя способы нанесения рисунка на поверхность кожи, способ с использованием проволоки, способ введения инъекцией черного пигмента, такого как активированный уголь, и т.п.
Однако, хотя способ нанесения рисунка на поверхность кожи ручкой, чтобы отметить положение поражения, является самым простым в использовании, он также имеет проблемы, заключающиеся очень низкой степени точности, поскольку форма молочной железы изменяется от диагноза до операции из-за чрезвычайно мягкого характера ткани молочной железы, и этот способ является неудовлетворительным в отношении маркировки положения поражения на поверхности кожи, если поражение находится глубоко внутри молочной железы.
Кроме того, в способе прокалывания поражения молочной железы проволокой было бы оптимальным вставлять проволоку перпендикулярно поверхности кожи. Однако такой способ имеет недостатки, заключающиеся в том, что проволока вставляется наклонно из-за ее потенциального влияния на ультразвуковое зондирование, положение проволоки может меняться при движении молочной железы, что приводит к более низкой точности, чем можно было бы ожидать, вставленная проволока может мешать хирургическому вмешательству, и необходима дополнительная процедура резекции участка вставленной проволоки. Наконец, хотя способ введения инъекцией пигмента, такого как активированный уголь, имеет преимущество, заключающееся в том, что введенный инъекцией пигмент может связываться с поражением с маркировкой точного положения поражения, он также имеет недостатки, заключающиеся в том, что черный пигмент не может быть идентифицирован снаружи молочной железы, если поражение располагается глубоко в молочной железе, а участок хирургического вмешательства может быть загрязнен пигментом. Вышеупомянутые недостатки могут также относиться к хирургическим операциям по поводу удаления раковых тканей, отличных от случаев злокачественной опухоли молочной железы.
Поскольку сложно точно определить диапазон хирургического вмешательства для хирургического удаления поражения, в частности, поражения злокачественной опухолью, с использованием методов, которые были разработаны на данный момент, диапазон резекции должен быть расширен при хирургическом удалении поражения злокачественной опухолью, а также после хирургического вмешательства должны проводиться тесты по определению того, было ли поражение удалено надлежащим образом.
Для решения этих проблем в корейском зарегистрированном патенте № 10-1552138 раскрывается композиция для мечения поражения злокачественной опухолью, которая включает в себя комплекс, в котором краситель для окрашивания биологических тканей, радиоактивный изотоп или их комбинация связываются с макроагрегированным альбумином. В этом случае композиция позволяет маркеру эффективно абсорбироваться в поражение злокачественной опухолью для маркировки точного положения поражения и позволяет отслеживать пигмент в режиме реального времени так, что может быть подтвержден диапазон подлежащего удалению поражения.
Между тем, хотя комплекс в форме водного раствора, раскрытый в корейском зарегистрированном патенте № 10-1552138, является полезным в качестве маркера для хирургической операции, поскольку комплекс не диффундирует в ткани в определенной пигментной форме, при фактическом применении он имеет недостаток, заключающийся в том, что предварительно определенное количество комплекса не может быть введено инъекцией, потому что оно осаждается в инъекционном препарате.
Кроме того, слишком много или слишком мало комплекса в форме водного раствора, раскрытого в корейском зарегистрированном патенте № 10-1552138, может быть введено инъекцией из-за его низкой вязкости. Поэтому, если у практикующего специалиста не большой опыт инъекций, или ситуация в клинике затрудняет введение инъекций, то предварительно определенное количество макроагрегированного альбумина не может быть введено инъекцией. Если комплекс в инъекционном препарате оседает в шприце, то комплекс вводится инъекцией в форме комочка, и в маркированной области иногда наблюдаются неровности. Кроме того, если комплекс вводят инъекцией с большим количеством, или если ткани, в которые вводят инъекцией комплекс, жесткие для проникновения в них (рубцовая ткань или мышечная ткань), то инъекционный раствор имеет тенденцию широко распространяться по рыхлым тканям мембран только между различными тканями или областями мышц.
То есть инъекционный раствор может широко распространяться в мышцах вдоль мышечной фасции и может распространяться в рубцовые ткани вдоль волокон фиброзных тканей в рубцовых тканях. Чтобы этого избежать, небольшое количество инъекционного раствора следует вводить инъекцией с использованием относительно толстой иглы, но этот способ имеет недостаток, заключающийся в том, что на практике он очень неудобен.
Соответственно, существует потребность в композиции для инъекций, способной решать проблемы засорения инъекционной иглы из-за комкования комплекса в процессе инъекции, невозможности введения инъекцией предварительно определенного количества комплекса и быстрого распространения комплекса в окружающие ткани.
Краткое раскрытие настоящего изобретения
Техническая задача
Для решения упомянутых выше проблем целью настоящего изобретения является обеспечение инъекционной композиции для мечения поражения, с помощью которой можно решить проблему быстрого оседания комплекса за счет добавления композиции, которая может регулировать вязкость в инъекционной композиции.
В частности, целью настоящего изобретения является обеспечение инъекционной композиции для мечения поражения, которая способна решить проблему быстрого распределения комплекса в окружающих тканях, при этом также решается проблема быстрого оседания комплекса, и, таким образом может быть введено инъекцией предварительно определенное количество комплекса.
Другая цель настоящего изобретения заключается в обеспечении способа обеспечения информации о положении поражения с использованием упомянутой выше инъекционной композиции для мечения поражения.
Техническое решение
Для достижения целей настоящего изобретения согласно аспекту настоящего изобретения представлена инъекционная композиция для мечения поражения, которая включает в себя:
первую композицию, включающую в себя комплекс, содержащий активный ингредиент и имеющий среднюю плотность 1,1-1,4 г/мл; и
вторую композицию, имеющую среднюю молекулярную массу 0,5-3,0 МДа,
при этом вторая композиция имеет вязкость 24-1500 сП при комнатной температуре.
Другой аспект настоящего изобретения относится к способу обеспечения информации о положении поражения, который предусматривает:
(a) введение упомянутой выше инъекционной композиции в поражение, которое развивается у субъекта; и
(b) определение положения поражения посредством созданного у субъекта сигнала активного ингредиента.
Полезные эффекты
Инъекционная композиция для мечения поражения в соответствии с настоящим изобретением включает в себя первую композицию, включающую в себя комплекс, содержащий активный ингредиент, и вторую композицию, включающую в себя биосовместимый вязкий материал, который дает возможность решить проблему быстрого оседания комплекса.
В частности, инъекционная композиция для мечения поражения в соответствии с настоящим изобретением может обладать эффектом, заключающимся в решении проблемы быстрого оседания комплекса в ходе приготовления инъекции, чтобы можно было ввести инъекцией предварительно определенное количество комплекса, и эффектом, заключающимся в обеспечении клинически удобного и стабильного применения комплекса путем решения проблем инъекции избыточного количества комплекса и быстрого распределения комплекса в окружающей его среде.
Кроме того, при добавлении предварительно определенного количества биосовместимого вязкого материала, такого как гиалуроновая кислота или коллаген, в инъекционную композицию в соответствии с настоящим изобретением для инъекции эквивалентного количества вязкого материала в различные ткани, такие как мышечная ткань, ткань молочной железы, подкожная клетчатка, ткань кожи и т.п., инъекционная композиция в соответствии с настоящим изобретением может обладать эффектом, позволяющим предварительно определенное количество комплекса вводить инъекцией намного эффективнее по сравнению с тем, когда вязкий материал не содержится, а также может обладать эффектом, заключающимся в значительном уменьшении распределения комплекса, даже если инъекционную композицию вводить инъекцией быстро, по сравнению с тем, когда вязкий материал не содержится.
Краткое описание графических материалов
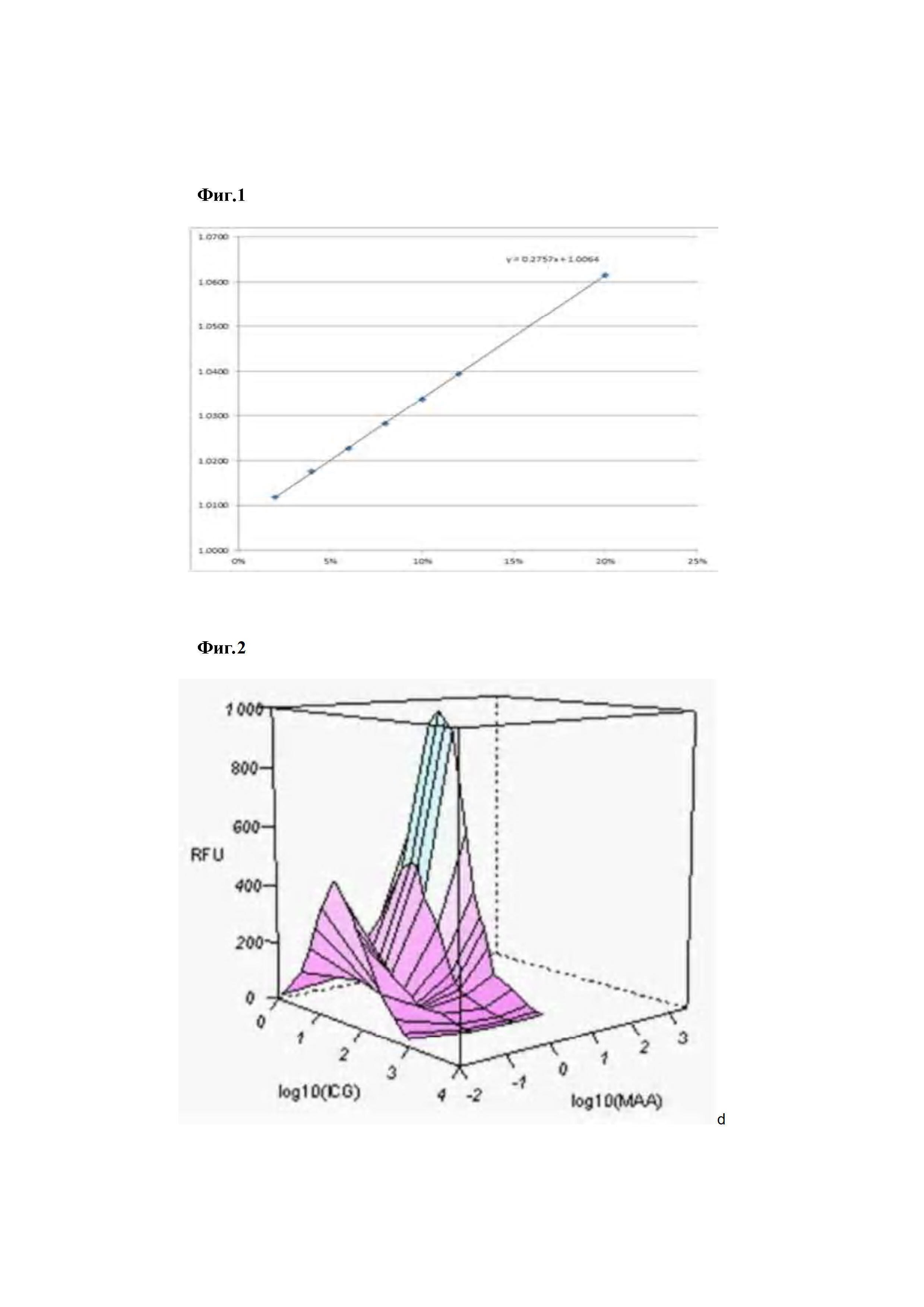
На фиг. 1 представлен график линейного уравнения регрессии для оценивания плотности ICG-MAA.
На фиг. 2 представлен график, иллюстрирующий изменение интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне комплекса ICG-MAA в зависимости от изменений концентраций ICG и MAA.
На фиг. 3 представлено изображение, иллюстрирующее сравнение двух типов MAA с разными концентрациями HA ((A) 0,1% HA и (B) 0,5% HA).
На фиг. 4 показано изображение в светлом поле водного раствора MAA в присутствии/отсутствии HA.
На фиг. 5 показаны сигналы флуоресценции, измеренные с 5 мкМ ICG при различных концентрациях МАА.
На фиг. 6 показаны изображения флуоресценции в ближнем инфракрасном диапазоне (NIRF) куриных грудок и мускульных желудков, сфотографированных до и после разреза после введения инъекцией комплекса в куриные грудки и мускульные желудки.
На фиг. 7 показаны изображения в светлом поле и NIRF фрагмента разрезанной куриной грудки, визуализированные после введения инъекцией комплекса вдоль пути инъекционной иглы.
На фиг. 8 показано тестирование применимости смеси ICG-MAA-HA в хирургическом вмешательстве по поводу злокачественной опухоли желудка с использованием эндоскопического катетера.
На фиг. 9 представлена диаграмма, демонстрирующая результаты измерения сигналов флуоресценции в присутствии/отсутствии гиалуроновой кислоты ((A) гиалуроновую кислоту не добавляют, и (B) добавляют 0,1% гиалуроновой кислоты).
Подробное раскрытие настоящего изобретения
Наилучший вариант осуществления настоящего изобретения
Настоящее изобретения может быть подвергнуто многочисленным изменениям и модификациям и может иметь несколько форм. Конкретные варианты осуществления настоящего изобретения иллюстрируются графическими материалами и детально описываются в подробном раскрытии нестоящего изобретения.
Однако следует учитывать, что настоящее изобретение не должно быть ограничено конкретными формами, изложенными в настоящем документе, и предусматривает все типы модификаций, эквивалентов и замен, охватываемых техническим объемом и идеей настоящего изобретения.
Кроме того, следует учитывать, что используемые в настоящем документе термины «содержит», «содержащий», «включает в себя», «включающий в себя», «имеет» и/или «имеющий» означают наличие указанных признаков, целых чисел, стадий, операций, элементов, компонентов и/или их групп, но не исключают наличие или добавление одного или нескольких других признаков, целых чисел, стадий, операций, элементов, компонентов и/или их групп.
Настоящее изобретение относится к инъекционной композиции для мечения поражения и, более конкретно, к инъекционной композиции для мечения поражения, которая способна решать проблему быстрого оседания комплекса путем добавления в инъекционную композицию композиции, способной регулировать вязкость инъекционной композиции.
В частности, инъекционная композиция для мечения поражения в соответствии с настоящим изобретением может решать проблему быстрого оседания комплекса путем добавления композиции, способной регулировать вязкость в инъекционной композиции, и, таким образом, может обладать эффектом, позволяющим вводить инъекцией предварительно определенное количество комплекса.
Далее настоящее изобретение будет описываться подробно.
Согласно одному экспериментальному варианту осуществления настоящего изобретения представлена инъекционная композиция для мечения поражения, которая включает в себя:
первую композицию, включающую в себя комплекс, содержащий активный ингредиент и имеющий среднюю плотность 1,1-1,4 г/мл; и
вторую композицию, имеющую молекулярную массу 0,5-3,0 МДа,
при этом вторая композиция имеет вязкость 24-1500 сП при комнатной температуре.
Более конкретно, поскольку комплекс, в котором активный ингредиент связывается с макроагрегированным альбумином, имеет относительно высокую плотность, то есть среднюю плотность 1,1-1,4 г/мл, комплекс имеет недостаток, заключающийся в том, что комплекс оседает в шприце в ходе приготовления инъекции.
Поэтому, настоящее изобретение служит для решения проблемы быстрого оседания комплекса в ходе приготовления инъекции и характеризуется добавлением второй композиции, имеющей среднюю молекулярную массу 0,5-3,0 МДа, в упомянутую выше первую композицию для регулирования вязкости инъекционной композиции.
Первая композиция в соответствии с настоящим изобретением будет первой описана подробно ниже.
Согласно одному экспериментальному варианту осуществления настоящего изобретения первая композиция может включать в себя композицию, активный ингредиент которой связывается с макроагрегированным альбумином (MAA).
В соответствии с настоящим изобретением термин «макроагрегированный альбумин (MAA)» относится к белковой частице с диаметром 10-50 мкм, которую получают путем нагревания человеческого сывороточного альбумина так, что человеческий сывороточный альбумин коагулирует.
В то же время, структура и физические свойства MAA могут отличаться от таковых человеческого сывороточного альбумина, который имеет диаметр менее 10 нм. Поскольку MAA может характеризоваться задержкой в легочных капиллярах с диаметром приблизительно 8 мкм при введении внутривенной инъекцией, что может вызывать микроэмболию, использовали MAA, меченный радиоактивным изотопом, для легочных сцинтиграмм (для диагностики патологий тока крови в легком, таких как легочная эмболия, легочный тромбоз, синдром аортита, пневмония, злокачественная опухоль легкого и т.п., или для диагностики шунтов справа налево или легочной венозной гипертензии), сканирований вен (для диагностики центрального венозного давления крови на участке сканирования), сканирований артерий (для диагностики патологий тока периферической артериальной крови, таких как болезнь Педжета и т.п.) или подобного с использованием упомянутой выше характеристики. MAA в соответствии с настоящим изобретением может быть использован в качестве медиатора для связывания материала мечения с пораженной злокачественной опухолью тканью при введении MAA инъекцией в пораженную злокачественной опухолью ткань.
Кроме того, MAA в соответствии с настоящим изобретением может быть синтезирован с использованием рекомбинантного HSA, а также неаутологичного HSA. Также MAA, который коммерчески доступен, может быть приобретен и использован. MAA в соответствии с настоящим изобретением может быть использован в качестве медиатора для связывания материала мечения с пораженной злокачественной опухолью тканью при введении MAA инъекцией в пораженную злокачественной опухолью ткань. В этом случае медиатор может обеспечивать абсорбцию материала мечения и предотвращать распределение материала мечения в пораженной злокачественной опухолью ткани.
Кроме того, согласно одному экспериментальному варианту осуществления настоящего изобретения термин «активный ингредиент» относится к компоненту, который повышает энергию молекул, атомных ионов и т.п., за счет абсорбции, разряда и облучения пучком частиц энергии излучения так, что может вызвать химическую реакцию. В этом случае активный ингредиент может быть красителем для окрашивания биологических тканей, радиоактивным изотопом или их комбинацией.
Согласно одному экспериментальному варианту осуществления настоящего изобретения краситель для окрашивания биологических тканей может быть визуально выявляемым красителем или флуоресцентным красителем.
Визуально выявляемый краситель может быть выбран из группы, состоящей из нейтрального красного, нильского синего, бисмарка коричневого, карминового лития, трипанового синего, януса зеленого, метилового фиолетового, O-ламина, малахитового зеленого, сафранина, эозина, конго красного, эритрозина, нигрозина, альциана синего с гематоксилином, анилина синего, светло-зеленого и их комбинации.
Согласно одному экспериментальному варианту осуществления настоящего изобретения флуоресцентным красителем может быть флуоресцентный в ближнем инфракрасном диапазоне краситель, а флуоресцентным в ближнем инфракрасном диапазоне красителем может быть индоцианин зеленый (ICG), но настоящее изобретение этим не ограничивается.
В соответствии с настоящим изобретением термин «краситель для окрашивания биологических тканей» относится к веществу, которое связывается с биологической тканью для маркирования положения связанной ткани с тем, чтобы положение меченной ткани можно было определить невооруженным глазом или инструментом для выявления. Для целей настоящего изобретения красителем для окрашивания биологических тканей может быть материал мечения, который может связываться с раковой тканью так, что материал мечения может быть использован с целью мечения участка, на котором развилась злокачественная опухоль. Предпочтительно, визуально выявляемый краситель, флуоресцентный краситель, способный испускать флуоресценцию на участке связывания так, что краситель может быть выявлен с использованием устройства, такого как флуоресцентная камера и т.п., может быть использован отдельно или в комбинации с другими, но настоящее изобретение не ограничивается конкретно этим.
В соответствии с настоящим изобретением термин «визуально выявляемый краситель» относится к типу пигмента, который позволяет материалу мечения, связанному с биологической тканью, излучать цвет в видимом цветовом спектре так, что положение меченой ткани может быть определено невооруженным глазом. Для целей настоящего изобретения при введении инъекцией визуально выявляемого красителя в участок, на котором развилась злокачественная опухоль, с целью удаления злокачественной опухоли с использованием хирургического способа визуально выявляемый краситель может служить повышению частоты успеха хирургического вмешательства по поводу злокачественной опухоли, поскольку он позволяет четко идентифицировать поражение злокачественной опухолью, подлежащее резекции. Визуально выявляемый материал мечения предпочтительно включает в себя нейтральный красный, нильский синий, бисмарк коричневый, карминовый литий, трипановый синий, янус зеленый, метиловый фиолетовый, O-ламин, малахитовый зеленый, сафранин, эозин, конго красный, эритрозин, нигрозин, альциан синий с гематоксилином, анилин синий, светло-зеленый или подобные, которые могут быть использованы отдельно или в комбинации. Однако визуально выявляемый материал мечения конкретно не ограничивается, при условии, что он может достигать цели идентификации поражения ткани злокачественной опухолью.
В соответствии с настоящим изобретением термин «флуоресцентный краситель» относится к органическому соединению, которое испускает флуоресценцию. В этом случае флуоресцентный краситель может поглощать свет с определенными длинами волн с формированием состояния возбуждения, максимизацией глубины проникновения света и минимизацией вызванных влагой ошибочных сигналов. Предпочтительно, органическим соединением может быть флуоресцентный краситель в ближнем инфракрасном диапазоне, который представляет собой органическое соединение, испускающее флуоресценцию с длиной волны в ближнем инфракрасном диапазоне от 700 нм до 3000 нм, предпочтительно от 750 нм до 900 нм. Флуоресценцию с длинами волн в ближнем инфракрасном диапазоне, испускаемую флуоресцентным красителем в ближнем инфракрасном диапазоне, можно фотографировать в форме изображений или наблюдать в режиме реального времени с использованием устройства, такого как флуоресцентная камера, чувствительный к флуоресценции зонд (PCT/KR2011/009271) или подобные. В соответствии с настоящим изобретением, поскольку флуоресценция с длинами волн в ближнем инфракрасном диапазоне поглощается in vivo при относительно небольшой дозе в отличие от других диапазонов длин волн, свет в ближнем инфракрасном диапазоне, испускаемый из участка, расположенного относительно глубоко в биологической ткани, также может быть выявлен снаружи биологической ткани. Для целей настоящего изобретения при введении инъекцией флуоресцентного красителя в ближнем инфракрасном диапазоне в участок, на котором развилась злокачественная опухоль, для удаления злокачественной опухоли с использованием хирургического способа флуоресцентный краситель в ближнем инфракрасном диапазоне может служить повышению частоты успеха хирургического вмешательства по поводу злокачественной опухоли, поскольку он позволяет четко идентифицировать участок поражения злокачественной опухолью перед резекцией. В частности, в отличие от визуально выявляемого красителя флуоресцентный краситель в ближнем инфракрасном диапазоне может обеспечивать быстрое и точное хирургическое вмешательство по поводу злокачественной опухоли, поскольку флуоресцентный краситель в ближнем инфракрасном диапазоне может быть использован для внешнего выявления положения поражения до произведения разреза ткани для прямой идентификации поражения. Индоцианин зеленый и т.п. предпочтительно могут быть использованы в качестве флуоресцентного красителя в ближнем инфракрасном диапазоне. При этом любой флуоресцентный краситель в ближнем инфракрасном диапазоне, который может быть использован в организме человека, может быть включен в объем настоящего изобретения.
Комплекс, в котором флуоресцентный краситель в ближнем инфракрасном диапазоне, связывается с MAA, может характеризоваться высокой вероятностью в отношении поиска мелкого поражения и улучшения степени точности резекции поражения, поскольку комплекс имеет преимущество, заключающееся в том, что комплекс обладает превосходной стабильностью и точностью в отношении подлежащих выявлению сигналов флуоресценции по сравнению с комплексами, в которых флуоресцентный краситель в ближнем инфракрасном диапазоне связывается с другими материалами, как известно, накапливающимися в опухолях.
В соответствии с настоящим изобретением термин «индоцианин зеленый (ICG)» относится к флуоресцентному визуализирующему красителю, испускающему флуоресценцию в ближнем инфракрасном диапазоне, который широко используют в области биологии или медицины. В этом случае желательно, чтобы ICG клинически применялся в качестве флуоресцентного красителя, который может быть использован для человеческого организма, поскольку ICG разлагается и исчезает или выводится с мочой или фекалиями в течение часа после введения инъекцией ICG в организм человека. Фактически, в различных тезисах сообщалось о случаях, когда индоцианин зеленый использовали для применения в организме человека. В одном примере сообщалось о безопасном клиническом применении индоцианина зеленого у 18 больных злокачественной опухолью молочной железы (T. Kitai, et al., Breast Cancer, 12:211-215, 2005). Кроме того, адсорбционное связывание флуоресцентного красителя в ближнем инфракрасном диапазоне может быть достигнуто путем смешивания флуоресцентного красителя в ближнем инфракрасном диапазоне с MAA в соответствии с настоящим изобретением.
Согласно одному экспериментальному варианту осуществления настоящего изобретения подтвердили, что отношение связывания, приемлемое для получения комплекса, проявляющего высокий уровень сигналов флуоресценции в ближнем инфракрасном диапазоне, при получении комплекса, в котором ICG связывается с MAA (ICG-MAA), составляет 3,9 мкМ ICG к 0,23 мг/мл MAA, 6,5 мкМ ICG к 2,3 мг/мл MAA и 6,5 мкМ ICG к 11,5 мг/мл MAA. Поскольку концентрации MAA и ICG варьируют из-за in vivo диффузии, при введении MAA и ICG инъекцией in vivo невозможно определить точные концентрации MAA и ICG на момент инъекции. Однако подтвердили, что комплекс имеет наивысшее значение флуоресценции при введении инъекцией при 6,5 мкМ ICG к 2-4 мг/мл MAA, который легко вводится инъекцией в экспериментальном аспекте. Поэтому предпочтительно использовать 6,5 мкМ ICG к 2 мг/мл MAA.
В соответствии с настоящим изобретением термин «радиоактивный изотоп» относится к элементу, который имеет то же атомное число, но отличается атомной массой и может испускать радиацию. В этом случае радиоактивный изотоп часто используют в качестве важного маркера для традиционной диагностики заболеваний в результате испускания гамма-лучей или других субатомных частиц с использованием характеристик радиоактивного распада радиоактивного изотопа. Для целей настоящего изобретения при введении инъекцией радиоактивного изотопа в участок, на котором развилась злокачественная опухоль в ткани, на глубину, на которой флуоресценция, испускаемая из флуоресцентного красителя в ближнем инфракрасном диапазоне, не может быть выявлена, для удаления злокачественной опухоли с использованием хирургического способа радиоактивный изотоп может служить повышению частоты успеха хирургического вмешательства по поводу злокачественной опухоли, поскольку он обеспечивает четкую идентификацию участка поражения злокачественной опухолью перед резекцией. Радиоактивный изотоп конкретно не ограничивается, при условии, что он обладает способностью мечения MAA, способного связываться с поражением злокачественной опухолью. Однако предпочтительным радиоактивным изотопом может быть H-3, C-14, P-32, S-35, Cl-36, Cr-51, Co-57, Co-58, Cu-64, Fe-59, Y-90, I-124, I-125, Re-186, I-131, Tc-99m, Mo-99, P-32, CR-51, Ca-45, Ca-68 или подобные, а более предпочтительным - I-124, I-125, I-131, Cu-64, Tc-99m, Mo-99, CR-51, Ca-45, Ca-68 или подобные, все из которых используют в медицинских целях. Наиболее предпочтительно использовать Tc-99m в качестве радиоактивного изотопа.
В соответствии с настоящим изобретением термин «Tc-99m» относится к радиоактивному изотопу технеция (Tc), который широко использовали для медицинских исследований, поскольку он характеризуется коротким периодом полураспада 6 часов, продуцирует гамма-лучи, которые могут быть использованы для визуализации, требует очень низкой дозы излучения, демонстрирует хорошую проницаемость в ткань и не вызывает аллергическую реакцию, вызываемую некоторыми пигментами.
В соответствии с настоящим изобретением термин «субъект» относится к живому организму, который может иметь поражение из-за возникновения злокачественной опухоли и которому можно вводить комплекс или композицию для мечения поражения злокачественной опухолью в соответствии с настоящим изобретением.
При введении инъекционной композиции для мечения поражения, обеспечиваемой в соответствии с настоящим изобретением, in vivo в поражение ткани злокачественной опухолью вводимая инъекционная композиция связывается с поражением злокачественной опухолью с маркированием положения поражения посредством цвета, флуоресценции в ближнем инфракрасном диапазоне, радиоактивности или их комбинации. Кроме того, поскольку положение, размер и т.п. поражения злокачественной опухолью могут быть выявлены в режиме реального времени в ходе хирургического вмешательства путем выявления метки, может быть улучшена точность, и может быть предупреждена избыточная потеря здоровой ткани при удалении поражения злокачественной опухолью посредством хирургической операции.
Кроме того, поскольку комплекс, включенный в инъекционную композицию в соответствии с настоящим изобретением, может оставаться в in vivo поражении злокачественной опухолью на протяжении длительного времени в отличие от комплексов, в которых краситель для окрашивания биологических тканей связан с другим материалом, может быть легко определена степень точности в отношении резекции поражения злокачественной опухолью путем хирургической операции, а также хирургическая резекция поражения злокачественной опухолью. Например, после определения положения небольшого поражения перед хирургическим вмешательством с использованием ультразвуковых волн и т.п. комплекс в соответствии с настоящим изобретением может быть введен инъекцией в участок поражения, и участок поражения может быть надежно и точно определен в ходе хирургического вмешательства в течение часов.
Согласно одному экспериментальному варианту осуществления настоящего изобретения MAA предпочтительно используют при концентрации 1-8 мг/мл по отношению к буферу, но настоящее изобретение этим не ограничивается.
Согласно одному экспериментальному варианту осуществления настоящего изобретения ICG предпочтительно используют при 4-250 мкМ на 1-8 мг/мл MAA. С учетом растворимости MAA может быть более предпочтительным использование 6,5 мкМ ICG на 2-4 мг/мл MAA. Однако можно надлежащим образом регулировать концентрации MAA и ICG при in vivo инъекции в диапазонах, описываемых в примерах, для проявления максимальной интенсивности флуоресценции в соответствии с условиями.
Согласно одному экспериментальному варианту осуществления настоящего изобретения радиоактивный изотоп может быть выбран из группы, состоящей из H-3, C-14, P-32, S-35, Cl-36, Cr-51, Co-57, Co-58, Cu-64, Fe-59, Y-90, I-124, I-125, Re-186, I-131, Tc-99m, Mo-99, P-32, CR-51, Ca-45, Ca-68 и их комбинации.
Далее будет подробно описана вторая композиция согласно одному типичному варианту осуществления настоящего изобретения.
Вторая композиция согласно одному типичному варианту осуществления настоящего изобретения характеризуется молекулярной массой 0,5-3,0 МДа и включает в себя биосовместимый вязкий материал.
В частности, поскольку вторая композиция имеет предварительно определенную вязкость, вторая композиция может быть добавлена в инъекционную композицию для мечения поражения с целью решения проблемы быстрого оседания комплекса, включенного в первую композицию, и, таким образом обладает эффектом, позволяющим предварительно определенное количество комплекса вводить инъекцией.
Молекулярная масса второй композиции может находиться в диапазоне 0,5-3,0 МДа или в диапазоне 1,0-2,0 МДа. Поскольку вторая композиция имеет относительно низкую молекулярную массу и предварительно определенную вязкость, то вторая композиция может решать проблему быстрого оседания комплекса, включенного в первую композицию.
В настоящем документе единица молекулярной массы «Да» является единицей, представляющей массу. В этом случае 1/16 массы атома кислорода можно называть одним дальтоном.
Кроме того, вторая композиция может иметь вязкость 5-1,500 сП при комнатной температуре, а также может иметь вязкость 100-900 сП, предпочтительно вязкость 100-350 сП при комнатной температуре.
Более конкретно, если вязкость второй композиции менее 5 сП при комнатной температуре, то можно решить проблему быстрого оседания комплекса, включенного в первую композицию, из-за низкой вязкости. С другой стороны, если вязкость второй композиции превышает 1500 сП, то может быть сложно вводить инъекцией инъекционную композицию из-за очень высокой вязкости, и, таким образом, необходимо приложение высокого давления при введении инъекцией инъекционной композиции в ткань.
Согласно одному экспериментальному варианту осуществления настоящего изобретения вторая композиция может включать в себя биосовместимый вязкий материал, а биосовместимым вязким материалом может быть гиалуроновая кислота (HA) или коллаген, но настоящее изобретение этим не ограничивается.
Предпочтительно, биосовместимый вязкий материал может быть гиалуроновой кислотой.
Согласно одному экспериментальному варианту осуществления настоящего изобретения вторая композиция может быть добавлена в количестве от 0,2% (масса/объем) до 1% (масса/объем) от общей массы инъекционной композиции.
Более конкретно, если вторая композицию включена в количестве менее 0,2% (масса/объем) от общей массы инъекционной композиции, то может быть сложно вводить инъекцией предварительно определенное количество комплекса в ткань, поскольку комплекс быстро оседает из-за короткого времени сохранения суспензированности инъекционной композиции. В частности, возникает проблема введения инъекцией избыточного количества комплекса или слишком быстрого распределения комплекса в окружающую ткань при введении в ткани инъекцией.
Кроме того, при содержании второй композиции более 1% (масса/объем) от общей массы инъекционной композиции повышение вязкости может быть вызвано степенью концентрации второй композиции, и, таким образом, может потребоваться приложение высокого давления при инъекции, что затрудняет введение инъекцией инъекционной композиции вручную.
Согласно одному аспекту инъекционная композиция может быть добавлена при 0,2% (масса/объем) - 1% (масса/объем) в состоянии, при котором инъекционная композицию набирают в шприц с иглой 18-26 G. Согласно другому аспекту инъекционная композиция может быть включена при 0,2-0,5% (масса/объем) при использовании эндоскопического катетера.
В то же время, один типичный вариант осуществления настоящего изобретения характеризуется тем, что обеспечивает инъекционную композицию для мечения поражения, которая отвечает следующему математическому выражению 1 при измерении при комнатной температуре:
Математическое выражение 1
|T2-T1|<15%,
в котором T1 представляет собой светопроницаемость (%) при 550 нм при измерении в точке одной четвертой высоты прозрачного контейнера, имеющего размер 1×1×3 см3, в состоянии, при котором полученную инъекционную композицию загружают в прозрачный контейнер, и
T2 представляет собой светопроницаемость (%) при 550 нм при измерении в точке одной четвертой высоты прозрачного контейнера, имеющего размер 1×1×3 см3, после обеспечения отстаивания в течение 120 минут в состоянии, при котором полученную инъекционную композицию загружают в прозрачный контейнер.
В этот момент светопроницаемость можно называть степенью прохождения света через слой материала. В это время, если интенсивность света, падающего на слой материала, представляет собой I1, а интенсивность света, испускаемого через слой материала, представляет собой I2, то светопроницаемость можно рассматривать как T=I2I1.
Кроме того, прозрачный контейнер может иметь размер 1×1×3 см3 (ширина × длина × высота), но настоящее изобретение этим не ограничивается.
Также термин «точка одной четвертой высоты прозрачного контейнера» может относиться к точке, соответствующей одной четвертой контейнера при измерении от его дна.
В качестве одного примера, светопроницаемость (T1) при 550 нм при измерении в точке одной четвертой контейнера в состоянии, при котором добавляют 0,4% (масса/объем) гиалуроновой кислоты и полученную инъекционную композицию загружают в прозрачный контейнер, имеющий размер 1×1×3 см3, может составлять 0,4%. Светопроницаемость (T2) при 550 нм при измерении в точке одной четвертой контейнера после обеспечения отстаивания в течение 120 минут в состоянии, при котором полученную инъекционную композицию загружают в прозрачный контейнер, имеющий размер 1×1×3 см3, может составлять 78,71%.
То есть время сохранения суспензированности может отвечать выражению |T2-T1|<15%, поскольку время сохранения суспензированности продлевается за счет добавления второго компонента, способного регулировать вязкость, в инъекционную композицию.
Кроме того, согласно одному типичному варианту осуществления настоящего изобретения может быть обеспечена инъекционная композиция для мечения поражения, которая отвечает следующему математическому выражению 2 при измерении при комнатной температуре:
Математическое выражение 2
|F2-F1|<20 gf,
в котором F1 представляет собой силу трения скольжения, измеренную в начале инъекции в состоянии, при котором полученную инъекционную композицию набирают в шприц с иглой 26 G, и
F2 представляет собой силу трения скольжения, измеренную в начале инъекции, при введении инъекцией после поддерживания в течение 120 минут в состоянии, при котором полученную инъекционную композицию набирают в шприц с иглой 26 G.
В настоящем документе единица «gf» силы трения скольжения относится к величине силы, которую можно называть гравитационной силой. В настоящем документе одна единица гравитационной силы (g) представляет собой 0,0098 Н.
Кроме того, термин «сила трения скольжения» относится к силе трения скольжения, которая воздействует на палец при введении композиции инъекцией через шприц в состоянии, при котором композицию набирают в шприц.
В то же время, шприц 26 калибра (G) может относиться к шприцу с иглой, имеющей внутренний диаметр 0,241 мм.
Согласно конкретному аспекту сила трения скольжения, измеренная по математическому выражению 2, может быть меньше или равной 5 gf. То есть |F2-F1| может быть меньше или равно 5 gf.
В частности, небольшое числовое значение |F2-F1| указывает на небольшую разницу в давлении между начальной точкой инъекции после обеспечения отстаивания инъекционной композиции в течение предварительно определенного времени и промежуточной точкой инъекции, что указывает на то, что суспензированность инъекционной композиции сохраняется, даже если инъекционной композиции позволили отстаиваться в течение 120 минут, в частности, на то, что скорость осаждения комплекса в инъекционной композиции замедлилась.
Кроме того, F2 характеризуется силой трения скольжения 120-165 gf. Более конкретно, F2 может находиться в диапазоне 120-165 gf, если вторая композиция составляет от 0,2% (масса/объем) до 1% (масса/объем) от общей массы инъекционной композиции.
То есть инъекционная композиция в соответствии с настоящим изобретением может обладать эффектом, позволяющим введение инъекцией предварительно определенного количества комплекса, поскольку проблема быстрого оседания комплекса в ходе получения инъекции решается путем добавления предварительно определенного количества биосовместимого вязкого материала, такого как гиалуроновая кислота или коллаген, в инъекционную композицию, а также может решить проблему введения инъекцией избыточного количество комплекса и проблему распределения комплекса в окружающие ткани. Кроме того, инъекционная композиция в соответствии с настоящим изобретением может обладать эффектом значительного снижения распределения комплекса посредством добавления предварительно определенного количества биосовместимого вязкого материала, такого как гиалуроновая кислота или коллаген, в инъекционную композицию при введении инъекцией того же количества инъекционной композиции в различные ткани, такие как мышечная ткань, ткань молочной железы, подкожная клетчатка, ткань кожи и т.п., по сравнению с тем, когда вязкий материал не содержится. Даже при быстром введении инъекцией инъекционной композиции инъекционная композиция в соответствии с настоящим изобретением может обладать эффектом значительного снижения распределения комплекса по сравнению с тем, когда вязкий материал не содержится.
Согласно одному экспериментальному варианту осуществления настоящего изобретения поражением может быть поражение злокачественной опухолью, но настоящее изобретение этим не ограничивается.
Согласно одному экспериментальному варианту осуществления настоящего изобретения злокачественная опухоль может быть солидной злокачественной опухолью, выбранной из группы, состоящей из злокачественной опухоли предстательной железы, злокачественной опухоли молочной железы, злокачественной опухоли матки, злокачественной опухоли кожи, злокачественной опухоли шейки матки, злокачественной опухоли легкого, опухолей головного мозга, опухолей желудочно-кишечного тракта, злокачественной опухоли печени, саркомы мягкой ткани, лимфомы и их комбинации.
Согласно одному экспериментальному варианту осуществления настоящего изобретения инъекционная композиция в соответствии с настоящим изобретением может быть использована для определения размера и положения поражения ткани злокачественной опухолью в режиме реального времени в ходе хирургического вмешательства по поводу удаления злокачественной опухоли.
Кроме того, настоящее изобретение относится к способу обеспечения информации о положении поражения, который предусматривает:
(a) введение инъекционной композиции в соответствии с настоящим изобретением в поражение, которое возникает у субъекта; и
(b) определение положения поражения с использованием сигнала активного ингредиента, создаваемого у субъекту.
Вариант осуществления настоящего изобретения
Далее настоящее изобретение будет описано в дополнительных подробностях со ссылкой на его примеры и экспериментальные примеры. Однако рядовому специалисту в данной области будет понятно, что следующие примеры приводятся исключительно с целью более подробного описания настоящего изобретения и не предназначены ограничивать объем настоящего изобретения.
Примеры получения
Пример получения 1. Получение макроагрегированного альбумина (MAA)
Для получения макроагрегированного альбумина (MAA) 10 мл 2% человеческого сывороточного альбумина (SK Plasma), разбавленного 0,1 M ацетатным буфером (pH 5,4, Sigma-Aldrich, Korea), смешивали с 50 мг хлорида олова (Sigma-Aldrich, Korea) и полученную в результате смесь энергично взбалтывали при комнатной температуре в течение 10 минут, а затем подвергали реагированию при взбалтывании при 70°C еще 20 минут.
Затем для предупреждения дополнительной коагуляции после завершения реакции продукт реакции помещали на лед для быстрого охлаждения.
Затем добавляли 0,35 мл 20% человеческого сывороточного альбумина (70 мг в случае сыворотки человека) в охлажденный продукт реакции, а затем взбалтывали при комнатной температуре в течение 10 минут. Затем продукт реакции делили на стеклянные флаконы с содержанием 1, 2, 4 и 8 мг к MAA, а затем сушили замораживанием с получением высушенных замораживанием наборов MAA.
Наборы MAA в конечном итоге включали в себя высушенный замораживанием MAA с содержанием 1, 2, 4 и 8 мг.
Как описано выше, в ходе процесса получения использовали ацетатный буфер при получении MAA, а наборы высушенного замораживанием МАА использовали после растворения наборов MAA в воде для инъекции или в воде для инъекции, включающей в себя HA.
Пример получения 2. Получение маркера на основе MAA, с которым связывается индоцианин зеленый (ICG)
Пример получения 2-1. Определение отношения связывания ICG и MAA
Для получения испускающего флуоресценцию в ближнем инфракрасном диапазоне маркера на основе MAA индоцианин зеленый (ICG, Jeil Pharmaceutical Co., Ltd., Diagnogreen Инъекция), испускающий флуоресценцию в ближнем инфракрасном диапазоне, связывали с MAA, полученным в примере 1, с получением комплекса (ICG-MAA).
В этом случае, для определения отношения связывания ICG и MAA, способного испускать самую сильную флуоресценцию в ближнем инфракрасном диапазоне, осуществляли реагирование 1,3-1,032 мкМ ICG и 0-11,5 мг/мл MAA при различных отношениях с получением соответствующих комплексов ICG-MAA.
Затем измеряли интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне, испускаемой из полученных комплексов ICG-MAA (таблица 1 и фиг. 2).
На фиг. 2 представлен график, иллюстрирующий изменение интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне для комплекса ICG-MAA согласно изменениям при концентрациях ICG и MAA.
Таблица 1
Что касается таблицы 1 и фиг. 2, подтвердили, что 25,8 мкМ ICG характеризовались наивысшим значением интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне при отсутствии обработки MAA, и что 3,9 мкМ ICG характеризовались наивысшим значением интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне при обработке 0,23 мг/мл MAA.
Кроме того, можно видеть, что 6,5 мкМ ICG характеризовались наивысшим значением интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне при обработке 2,3 мг/мл MAA, и что 7,5 мкМ ICG характеризовались наивысшим значением интенсивности сигнала флуоресценции в ближнем инфракрасном диапазоне при обработке 11,5 мг/мл MAA.
В то же время, поскольку концентрации MAA и ICG варьировали из-за in vivo диффузии при введении инъекцией MAA и ICG in vivo, было невозможно определить точные концентрации MAA и ICG на момент инъекции. Однако эксперименты подтвердили, что комплексы характеризовались наивысшим значением флуоресценции при введении инъекцией 6,5 мкМ ICG на 2 мг/мл MAA.
Пример получения 2-2. Получение комплекса ICG-MAA, в котором ICG связывается
Получали комплексы ICG-MAA, в которых концентрации MAA составляли 1, 2, 4 и 8 мг/мл. Осуществляли реакции для получения комплексов ICG-MAA при комнатной температуре.
Более конкретно, добавляли 0,5 мл 13 мкМ ICG в каждый из высушенных замораживанием наборов с 1, 2, 4 и 8 мг MAA и осуществляли реагирование при осторожном взбалтывании в течение приблизительно одной минуты. После этого добавляли 0,5 мл дистиллированной воды в каждый из высушенных замораживанием наборов МАА и осторожно взбалтывали в течение приблизительно пяти минут с получением комплексов 6,5 мкМ ICG-MAA с разными концентрациями MAA.
Примеры
Пример 1. Получение ICG-MAA-HA
Получали инъекционные композиции ICG-MAA-HA, включающие в себя MMA при концентрациях 1, 2, 4 и 8 мг/мл, 6,5 мкМ ICG и гиалуроновую кислоту (HA; Shandong Focuschem Biotech Co.) при концентрации 0,5%.
Более конкретно, соответственно добавляли 0,5 мл 13 мкМ ICG в высушенные замораживанием наборы с 1, 2, 4 и 8 мг МАА и осуществляли реагирование при осторожном взбалтывании в течение приблизительно одной минуты. После этого туда добавляли по 0,5 мл каждой из 0,2, 0,4, 0,6, 0,8, 1, 2, 4 и 8% (масса/объем) HA (1448 кДа), предварительно растворенной, а затем смешивали до однородности при энергичном взбалтывании в течение приблизительно 5 минут.
В результате получали всего 32 инъекционных композиции ICG-MAA-HA, включающих в себя HA при концентрациях 0,1, 0,2, 0,3, 0,4, 0,5, 1, 2 и 4% (масса/объем), ICG при концентрации 6,5 мкМ и MAA при концентрациях 1, 2, 4 и 8 мг/мл.
В качестве справочной информации, процесс получения ICG-MAA-HA выполняли при комнатной температуре.
Экспериментальные примеры
Экспериментальный пример 1. Измерение плотностей комплексов ICG-MAA
Измеряли плотности комплексов ICG-MAA.
Поскольку комплексы ICG-MAA были представлены в форме, фактически используемой в водной фазе раствора, было затруднительно измерять непосредственно плотности комплексов без повреждения форм биологических материалов и т.п. Поэтому, плотности комплексов ICG-MAA измеряли опосредованно с учетом изменения в плотности в зависимости от концентрации.
Плотность измеряли с использованием полученного комплекса ICG-MAA, включающего в себя MMA при концентрации 2 мг/мл и 6,5 мкМ ICG, и плотности ICG-MAA измеряли с использованием комплексов ICG-MAA при концентрациях 20 мг/мл к 200 мг/мл (2 к 20% (масса/объем), как изложено ниже.
Более конкретно, 20 мл дистиллированной воды выливали в прозрачный контейнер при комнатной температуре и добавляли туда упомянутый выше комплекс ICG-MAA для измерения варьирующей плотности дистиллированной воды, включающей в себя комплекс ICG-MAA. В частности, измеряли варьирующую плотность в зависимости от концентрации комплекса ICG-MAA.
Для сравнения, можно видеть, что при добавлении и растворении комплекса ICG-MAA в дистиллированной воде дистиллированная вода демонстрировала белую суспензию.
В таблице 2 приводятся плотности по отношению к дистиллированной воде, включающей в себя комплексы ICG-MAA, которые кратко излагаются в зависимости от концентрации дистиллированной воды, включающей в себя комплексы ICG-MAA.
Таблица 2
Что касается таблицы 2, получали линейное уравнение регрессии посредством линейного регрессионного анализа, а плотность, когда она достигала 100%, измеряли путем экстраполяции (0,2757*100+1,0064=1,2821).
В результате определили, что плотность комплекса ICG-MAA составляла 1,2821 г/мл согласно уравнению регрессии (фиг. 1).
Кроме того, можно видеть, что при проверке дистиллированной воды, в которой растворяли комплекс ICG-MAA, через 20 минут, на дне контейнера оседала белая суспензия.
В результате установили, что плотность комплекса ICG-MAA составляла 1,2821 г/мл, что превышало плотность (0,99821 г/мл) дистиллированной воды при комнатной температуре.
Экспериментальный пример 2. Оценивание применимости инъекционной композиции
Экспериментальный пример 2-1. Применимость ICG-MAA-HA в качестве инъекционной композиции-1
Для оценивания применимости ICG-MAA-HA в качестве инъекционной композиции измеряли время сохранения суспензированности ICG-MAA-HA в зависимости от концентрации HA. Для сравнения, MAA использовали при концентрации 2 мг/мл, а конечный инъекционный раствор ICG-MAA-HA обладал характеристикой светло-зеленой суспензии при полном растворении MAA и ICG.
Более конкретно, измеряли время сохранения суспензированности после получения инъекционного раствора ICG-MAA-HA, а время сохранения суспензированности измеряли в зависимости от повышающейся концентрации HA. В настоящем документе суспензированность определяет время сохранения суспензии как контрольную точку времени, когда область осаждения и плавающая область разделяются на основании 20% светопроницаемости света с 500 нм.
Результаты представлены в таблице 2.
В таблице 2 приводится время сохранения суспензированности после получения инъекционного раствора ICG-MAA-HA в зависимости от концентрации растворителя HA.
Таблица 3
Что касается таблицы 3, можно видеть, что инъекционная композиция, в которую не добавляли HA, характеризовалась более коротким временем сохранения суспензированности, чем композиция, в которую HA добавляли, и время сохранения суспензированности увеличивалось с повышением пропорции добавляемой HA.
В то же время подтвердили, что время сохранения суспензированности увеличивалось до менее 30 минут при добавлении 0,1% HA в инъекционную композицию, и что время сохранения суспензированности превышало 2 часа, когда концентрация HA была больше 0,2% (масса/объем), а время сохранения суспензированности превышало 8 часов, когда концентрация HA была больше 0,3% (масса/объем).
То есть установили, что комплекс был действительно эффективен в качестве инъекционного препарата, когда концентрация HA превышала 0,2% (масса/объем).
На фиг. 3 показано изображение, иллюстрирующее сравнение двух типов MAA с разными концентрациями HA.
Более конкретно, поскольку изображения полученной таким образом инъекции ICG-MAA-HA сфотографированы через 30 минут, на фиг. 3(A) представлено изображение MAA, к которому добавили 0,1% HA, а на фиг. 3(B) представлено изображение MAA, к которому добавили 0,5% HA.
Что касается фиг. 3, можно видеть, что инъекционная композиция, к которой добавили 0,1% HA, быстро оседала, но инъекционная композиция, к которой добавили 0,5% HA, не оседала на протяжении длительного времени. То есть можно видеть, что, поскольку ICG-MAA-HA, при этом в ICG-MAA добавляли0,5% HA, быстро не оседала в ходе получение инъекции, она может быть очень полезной в качестве инъекционной композиции, как показано на фиг. 3.
Экспериментальный пример 2-2. Применимость ICG-MAA-HA в качестве инъекционной композиции-2
В экспериментальном примере 2-2 измеряли силы трения скольжения, воздействующие на палец при инъекции, в зависимости от концентрации гиалуроновой кислоты (HA) при различных условиях, и оценивали применимость ICG-MAA-HA в качестве инъекционной композиции.
Более конкретно, при использовании окончательно полученного инъекционного раствора в качестве инъекции оценивали легкость инъекции с использованием одноразовых шприцев на 1 см3, оснащенных иглами 18 G, 21 G, 22 G, 23 G и 26 G.
В то же время, для характеристики композиции проверяли нагрузки, применяемые при инъекции с использованием иглы 18 калибра (внутренний диаметр иглы: 0,838 мм), иглы 21 G (внутренний диаметр иглы: 0,495 мм), иглы 22 G (внутренний диаметр иглы: 0,394 мм), иглы 23 G (внутренний диаметр иглы: 0,318 мм) и иглы 26 G (внутренний диаметр иглы: 0,241 мм).
Кроме того, измеряли сопротивление (силу, воздействующую палец при инъекции) с использованием эндоскопического катетера (7 Fr, длина: 180 см, MTW, Germany), оснащенного соединительной трубкой длиной 1,8 м.
Результаты представлены в следующей таблице 4.
Таблица 4
Как правило, при использовании инъекционной иглы, используемой для клинических испытаний, при инъекции прилагали силу от 60 до 140 gf. Инъекционную иглу использовали без затруднений из-за низкого сопротивления во время инъекций до достижения концентрации гиалуроновой кислоты (HA) 1%.
С другой стороны, при использовании иглы эндоскопического катетера (7 Fr, 180 см), в котором сопротивление повышалось из-за длинной трубки, прилагали силу 140 gf в случае воды и прилагали силу 780 gf в случае HA при концентрации 0,60% (масса/объем), что указывает на то, что инъекционный раствор вводили инъекцией с чрезвычайно высоким давлением.
Хотя это могло отличаться у индивидуумов, при приложении силы трения скольжения 700 gf было затруднительно вводить инъекцией инъекционный раствор в ткани, что осложняло точное введение инъекцией инъекционного раствора. С другой стороны, при использовании иглы эндоскопического катетера (7 Fr, 180 см) при использовании иглы эндоскопического катетера 780, когда HA присутствовала при концентрации 0,60%, что указывает на то, что инъекционный раствор вводили инъекцией с чрезвычайно высоким давлением. Когда концентрация HA превышала 0,70%, инъекционный раствор невозможно было вводить инъекцией вручную из-за высокого сопротивления.
То есть инъекционный раствор вводили инъекцией при общих условия инъекции до достижения концентрации гиалуроновой кислоты 1% (масса/объем) и инъекционный раствор вводили инъекцией вручную до достижения концентрации гиалуроновой кислоты 0,5% (масса/объем) в случае специального эндоскопического катетера с длинной иглой, в котором шприц соединялся с иглой через трубку.
В то же время, можно видеть, что при использовании обычных шприцев (от 26 G до 18 G), приводимых в непосредственный контакт с тканями, было желательно, чтобы инъекционный раствор плавно вводился инъекцией в ткани, то есть чтобы к шприцу прилагалась сила менее 200 gf, и была возможность вводить инъекцией инъекционный раствор с силой менее 200 gf до достижения концентрации гиалуроновой кислоты 1% (масса/объем).
Экспериментальный пример 3. Изменение давления шприца в зависимости от осаждения ICG-MAA-HA
Экспериментальный пример 3-3. Изменение давления шприца в зависимости от осаждения ICG-MAA-HA-1
В примере 3-3 измеряли давление (A), прилагаемое к шприцу при ведении инъекцией инъекционной композиции, в которую добавляли гиалуроновую кислоту, немедленно после добавления HA, и давление (B), прилагаемое к шприцу, после того, как инъекционной композиции позволяли отстаиваться в течение 120 минут так, что композиция оседала, при этом показатели приведены в следующей таблице.
В этом случае использовали шприц, оснащенный иглой 26 G, для измерения силы трения скольжения шприца.
Кроме того, единицей силы трения скольжения является gf, что представляет гравитационную силу (1 g = 0,0098 Н).
Таблица 5
Что касается таблицы 5, можно видеть, что давление (A), прилагаемое к шприцу при ведении инъекцией инъекционной композиции, в которую добавляли гиалуроновую кислоту, немедленно после добавления HA, и давление (B), прилагаемое к шприцу, после того как инъекционной композиции позволяли отстаиваться в течение 120 минут так, что композиция оседала, повышалось с повышением концентрации гиалуроновой кислоты.
Кроме того, по мере повышения концентрации гиалуроновой кислоты не наблюдалась разница между давлением (B), прилагаемым к шприцу, после того как инъекционной композиции позволяли отстаиваться в течение 120 минут, и давлением (A), прилагаемым к шприцу при немедленном ведении инъекцией инъекционной композиции. В частности, при повышении концентрации гиалуроновой кислоты от 0,2% (масса/объем) до 1,0% (масса/объем) среднее значение B-A составляло 13,27778 gf, а стандартное отклонение составляло 2,969755.
Экспериментальный пример 3-3. Изменение давления шприца (силы трения скольжения) в зависимости от осаждения ICG-MAA-HA-2
Как правило, давление, прилагаемое к шприцу с иглой 26 G, в зависимости от концентрации гиалуроновой кислоты повышалось от приблизительно 20 gf (0,1% HA) до 70 gf (1,0% HA). Давление, прилагаемое к шприцу, повышалось в зависимости от инъекционной композиции, отличной от гиалуроновой кислоты в инъекции. В одном примере дополнительно прилагали силу приблизительно 15 gf, когда MAA присутствовал при концентрации 8 мг/мл.
Поэтому, в экспериментальном примере 3-3 измеряли давления, прилагаемые к шприцу при введении инъекцией инъекционной композиции, в которую добавляли гиалуроновую кислоту, немедленно после добавления гиалуроновой кислоты и после того, как инъекционной композиции позволяли отстаиваться в течение 120 минут для обеспечения оседания композиции, при этом показатели приведены в следующей таблице.
Для сравнения, в таблице 6 в графе (A) приведены давления при немедленном введении инъекцией инъекционной композиции, а в графе (B) приведены давления в начале инъекции после того, как инъекционной композиции позволяли отстаиваться в течение 120 минут. Также в графе (С) приведены давления (силы, воздействующие на палец, т.e. силы трения скольжения) в промежуточной точке инъекции после того, как инъекционной композиции позволяли отстаиваться в течение 120 минут.
Таблица 6
Что касается таблицы 6, можно видеть, что без добавления гиалуроновой кислоты давление превышало 400 gf, когда инъекцию начинали после того, как инъекционной композиции позволяли отстаиваться в течение 2 часов, что указывает на то, что при инъекции инъекционная игла забивалась композицией.
Кроме того, давление падало до 120 gf после того, как забитую композицией иглу открывали.
Когда гиалуроновая кислота присутствовала при концентрации 0,2% (масса/объем) или больше, инъекционная игла не забивалась композицией при инъекции, даже после того, как инъекционной композиции позволяли отстаиваться в течение 120 минут, и, таким образом, композицию вводили инъекцией с небольшим усилием (200 gf) подобно тому, как композиции вводили инъекцией немедленно.
То есть при добавлении гиалуроновой кислоты в надлежащем количестве (0,2% или больше) скорость осаждения удавалось замедлить и удавалось устранить недостаток, заключающийся в приложении избыточной силы в начале инъекции по причине того, что инъекционная игла забивалась осаждающейся композицией.
В то же время, при превышении концентрации гиалуроновой кислоты 1% (масса/объем) сопротивление в ходе инъекции было высоким из-за вязкости гиалуроновой кислоты.
Экспериментальный пример 3. Изменение светопроницаемости в зависимости от осаждения ICG-MAA-HA
Измеряли изменение оптической плотности за время для инъекционной композиции, полученной в примере 1. Для сравнения, изменение оптической плотности измеряли для инъекционной композиции, включающей в себя 2 мг/мл MAA.
Кроме того, светопроницаемость получали с помощью измерения светопроницаемости для света в видимой части спектра с использованием спектрометра УФ области спектра (TECAN. Infinite M200PRO).
Более конкретно, при измерении светопроницаемости в точке одной четвертой высоты прозрачного контейнера, имеющего размер 1×1×3 см3, с использованием спектрометра УФ области спектра в состоянии, при котором инъекционную композицию загружали в контейнер, измеряли светопроницаемость при 550 нм.
В этом случае T1 представляет собой светопроницаемость (%) при 550 нм при измерении в точке одной четвертой высоты прозрачного контейнера, имеющего размер 1×1×3 см3, в состоянии, при котором полученную инъекционную композицию загружают в прозрачный контейнер, и T2 представляет собой светопроницаемость (%) при 550 нм при измерении в точке одной четвертой высоты прозрачного контейнера, имеющего размер 1×1×3 см3, после обеспечения отстаивания в течение 120 минут в состоянии, при котором полученную инъекционную композицию загружают в прозрачный контейнер.
Таблица 7
Что касается таблицы 7, подтвердили, что при изучении изменения светопроницаемости в зависимости от осаждения ICG-MAA-HA, светопроницаемость, измеряемая в начале, когда гиалуроновая кислота не была добавлена, составляла 77,76%, и светопроницаемость повышалась до 87,88%, когда инъекционной композиции позволяли отстаиваться в течение 120 минут.
Это было вызвано тем, что сначала инъекционная композиция суспендировалась по мере растворения ICG-MAA в инъекционной композиции, и частицы ICG-MAA осаждались из-за высокой плотности через 120 минут, что приводило к повышению светопроницаемости в точке одной четвертой контейнера от его дна.
Кроме того, когда концентрация гиалуроновой кислоты (HA) превышала или равнялась 0,4% (масса/объем), разница между светопроницаемостью (T1), измеренной в начале, и светопроницаемостью (T2), измеренной после того, как инъекционной композиции позволяли отстаиваться в течение 120 минут, составляла немного меньше 1%.
Это указывает на то, что суспензированность инъекционной композиции поддерживалась постоянной со временем, когда ICG-MAA-HA включали в инъекционную композицию.
В результате можно видеть, что удавалось избежать быстрого осаждения комплекса в инъекционной композиции, когда вязкость комплекса ICG-MAA контролировали путем добавления гиалуроновой кислоты (HA) в инъекционную композицию.
В то же время, можно видеть, что комплекс осаждался в пределах 2 часов, поскольку разница составляла 9,19% между T1 и T2, когда гиалуроновая кислота присутствовала при концентрации 0,2% (масса/объем). Однако установили, что комплекс ICG-MAA можно будет использовать в качестве инъекционной композиции даже при добавлении 0,2% гиалуроновой кислоты (HA) к комплексу ICG-MAA, поскольку комплекс ICG-MAA, как правило, вводят за 30 минут при приготовлении для применения в качестве инъекционной композиции.
Экспериментальный пример 4. Изображение в светлом поле ICG-MAA в зависимости от применения HA
На фиг. 4 показано изображение в светлом поле инъекционных растворов ICG-MAA-HA, включающих в себя 0,5% (масса/объем) HA, 6,5 мкМ ICG и 2, 4 и 8 мг/мл MAA, и инъекционных растворов ICG-MAA, включающих в себя 6,5 мкМ ICG и 2, 4 и 8 мг/мл MAA. Распределение частиц MAA визуализировали с использованием оптического микроскопа с гемоцитометром. Каждый квадрат представляет размер 0,05 мм2. На верхней панели (фиг. 4-1, 2 и 3) показан ICG-MAA, не включающий в себя HA, а на нижней панели (фиг. 4-4, 5 и 6) показан ICG-MAA-HA, включающий в себя 0,5% HA (масса/объем). Концентрации MAA являются следующими: на фиг. 4-1 и 4-4: 2 мг/мл; на фиг. 4-2 и 4-5: 4 мг/мл; а на фиг. 4-3 и 4-6: 8 мг/мл. На верхней панели получали четкое изображение, поскольку частицы MAA находились в фокусе в светлом поле, так как все частицы MAA осели. С другой стороны, на нижней панели, поскольку частицы MAA оседали и плавали в инъекционных растворах, некоторые частицы находились в фокусе, и получали четкое изображение этих частиц, а другие частицы не находились в фокусе на изображении.
Экспериментальный пример 5. Характеристики поддержания флуоресценции в ICG-MAA-HA
На фиг. 5 показаны сигналы флуоресценции, измеренные для ICG-MAA-HA, в который добавляли 5 мкМ ICG и 0,5% HA, при различных концентрациях MAA. На фиг. 5A показано изображение в светлом поле, а на фиг. 5B показано изображение NIRF. Концентрации MAA составляли 0 мг/мл, 1 мг/мл, 2 мг/мл, 4 мг/мл и 8 мг/мл, как показано слева направо на фиг. 5A и 5B. Изображение NIRF получали с помощью света, испускаемого из 17 LED NIR по 2 мА, имеющих пиковую длину волны 740 нм. Изображение получали путем фотографирования и визуализации с помощью программного обеспечения для устройства просмотра AVT UniCam (Allied Vision Technologies) согласно следующим установкам камеры: время экспозиции: 200 мс; увеличение: 200; целевое значение по шкале оттенков серого: 125; и яркость: 16.
Поскольку MAA, присутствующий в воде, оседал очень быстро на стенки пробирок Эппендорфа, авторы настоящего изобретения получали изображение путем фотографирования в светлом поле, смешивали соответствующие пробирки, а затем пробирки переставляли. В этом случае небольшие изменения в положениях пробирок наблюдали между фиг. 5A и 5B.
На фиг. 5C показан спектр испускания флуоресценции 5 мкМ ICG, присутствующего при различных концентрациях MAA. Получали относительную интенсивность флуоресценции («a.u.» - произвольная единица) с использованием компьютеризированного устройства для считывания флуоресценции с микропланшетов (Safire II; Tecan, Durham, NC). Длина волны возбуждения для ICG составляла 760 нм, а длина волны испускания находилась в диапазоне от 790 до 850 нм.
То есть можно видеть, что флуоресценция сохранялась для ICG-MAA-HA, как показано на фиг. 5A - 5C.
Экспериментальный пример 6. Результаты введения инъекцией ICG-MAA-HA в куриную грудку
На фиг. 6 показаны экспериментальные результаты, иллюстрирующие разницу в зависимости от добавления 0,5% (масса/объем) HA. Кроме того, определяли разницу в прочности ткани с использованием куриной грудки, характеризующейся типичным сопротивлением ткани, и куриного мускульного желудка, характеризующегося сопротивлением плотной ткани. По 50 мкл каждого из ICG-MAA-HA и ICG-MAA медленно вводили инъекцией 5 раз в куриную грудку и куриный мускульный желудок на глубину 5 мм. Изображение NIRF получали с помощью света, испускаемого из 17 LED NIR по 2 мА, имеющих пиковую длину волны 740 нм. Изображение получали путем фотографирования и визуализации с помощью программного обеспечения для устройства просмотра AVT UniCam (Allied Vision Technologies) согласно следующим установкам камеры: время экспозиции: 195 мс; увеличение: 170; целевое значение по шкале оттенков серого: 125; и яркость: 16. Требовалось приблизительно 2-3 минуты для получения и введения инъекций. Когда ICG-MAA вводили инъекцией два раза из пяти в куриную грудку и вводили инъекцией три раза из пяти в куриный мускульный желудок, частицы ICG-MAA оседали и забивали инъекционную иглу, что затрудняло введение инъекцией инъекционных растворов. Когда вводить инъекцией инъекционные растворы было трудно, шприц встряхивали и инъекционные растворы снова вводили инъекцией за короткое время. С другой стороны, ICG-MAA-HA за все десять попыток вводился плавно.
На фиг. 6-1 и 6-2 представлены изображения NIRF, сфотографированные до и после разреза после введения инъекцией ICG-MAA-HA, включающего в себя 0,5% HA, в куриную грудку. Можно видеть, что метки были распределены надлежащим образом. На фиг. 6-3 и 6-4 представлены изображения NIRF, сфотографированные до и после разреза после введения инъекцией ICG-MAA-HA, включающего в себя 0,5% HA, в куриный мускульный желудок. Также можно видеть, что метки были распределены надлежащим образом. На фиг. 6-5 и 6-6 представлены два изображения NIRF, сфотографированные после введения инъекцией ICG-MAA, не включающего в себя 0,5% HA, в куриную грудку. Приходили к выводу, что эти метки были распределены надлежащим образом, как показано на фиг. 6-5, но вводили инъекцией небольшое количество меток, поскольку частицы ICG-MAA оседали в ходе инъекции при введении инъекцией того же общего количества, как показано на фиг. 6-6. На фиг. 6-7 и 6-8 представлены изображения NIRF, сфотографированные до и после разреза после введения инъекцией ICG-MAA, не включающего в себя 0,5% HA, в куриный мускульный желудок. ICG-MAA вытекал назад по инъекционному каналу так, что метки не распределялись надлежащим образом.
На фиг. 7 показано изображение в светлом поле и NIRF фрагмента разрезанной куриной грудки, визуализированное после введения инъекцией комплекса вдоль пути инъекционной иглы. Область, в которую ICG-MAA-HA вводили инъекцией, указана белым кружочком на изображении в светлом поле. Изображение NIRF получали с помощью света, испускаемого из 17 LED NIR по 2 мА, имеющих пиковую длину волны 740 нм. Изображение получали путем фотографирования и визуализации с помощью программного обеспечения для устройства просмотра AVT UniCam (Allied Vision Technologies) согласно следующим установкам камеры: время экспозиции: 195 мс; увеличение: 170; целевое значение по шкале оттенков серого: 125; и яркость: 16.
Из результатов можно видеть, что при введении инъекцией ICG-MAA-HA в ткани (куриную грудку) характеристики флуоресценции хорошо поддерживались, а также растекаемость была низкой. То есть можно видеть, что проблема распределения комплекса ICG-MAA в окружающие области слишком быстро и слишком далеко решалась с использованием ICG-MAA-HA.
Экспериментальный пример 7. Результаты введения инъекцией ICG-MAA-HA в куриную грудку с использованием эндоскопического катетера
На фиг. 8 показано тестирование применимости смеси ICG-MAA-HA в хирургическом вмешательстве по поводу злокачественной опухоли желудка с использованием эндоскопического катетера. На фиг. 8-1 - 8-3 и 8-5 показаны изображения в светлом поле, а на фиг. 8-4 и 8-6 показаны изображения NIRF.
На фиг. 8-1: смесь ICG-MAA-HA [6,5 мкМ ICG, 2 мг/мл MAA и 0,5% HA (масса/объем)] вводили инъекцией в одну сторону куриной грудки с использованием одноразового эндоскопического катетера.
На фиг. 8-2: смесь вводили инъекцией во второй участок куриной грудки.
На фиг. 8-3: две стрелки показывают участки для инъекций.
На фиг. 8-4: показано изображение NIRF участков для инъекций, подобных выстилающим стенки желудка.
На фиг. 8-5: показано изображение перевернутой инъецированной куриной грудки.
На фиг. 8-6: показано изображение NIRF участков инъекции на перевернутой куриной грудке. В этом случае участки инъекций можно увидеть с использованием внешних источников NIR.
Изображение NIRF получали с помощью света, испускаемого из 17 LED NIR по 2 мА, имеющих пиковую длину волны 740 нм. Изображение получали путем фотографирования и визуализации с помощью программного обеспечения для устройства просмотра AVT UniCam (Allied Vision Technologies) согласно следующим установкам камеры: время экспозиции: 195 мс; увеличение: 170; целевое значение по шкале оттенков серого: 125; и яркость: 16.
Из результатов можно видеть, что при введении инъекцией ICG-MAA-HA в ткани (куриную грудку) с использованием эндоскопического катетера характеристики флуоресценции хорошо поддерживались, а также растекаемость была очень низкой. То есть можно видеть, что даже при выполнении хирургического вмешательства по поводу злокачественной опухоли желудка с куриной грудкой можно было предотвратить распределение комплекса ICG-MAA в окружающие области слишком быстро и слишком далеко с поддержанием при этом характеристик флуоресценции при использовании ICG-MAA-HA.
Экспериментальный пример 8. Эффект постоянной концентрации ICG-MAA-HA
Для изучения эффекта введения инъекцией предварительно определенного количества инъекционной композиции в зависимости от повышения скорости осаждения каждую из инъекционной композиции ICG-MAA, в которую не добавляли гиалуроновую кислоту, и инъекционной композиции ICG-MAA, в которую добавляли 0,1% (масса/объем) HA, последовательно вводили инъекцией в пробирку в количестве 100 мкл для измерения сигнала флуоресценции.
При этом сигналы флуоресценции измеряли после введения инъекцией инъекционной композиции в пробирки и осаждения в течение 5 минут.
Для сравнения, когда MAA присутствовал при концентрации 2 мг/мл, то добавляли 1,5 мкМ (приблизительно 0,001 мг) ICG в инъекционную композицию ICG-MAA и добавляли 0,1% (масса/объем) HA в инъекционную композицию ICG-MAA.
На фиг. 9 представлена диаграмма, демонстрирующая результаты измерения сигналов флуоресценции в зависимости от присутствия/отсутствия гиалуроновой кислоты (в начальном количестве 100 мкл слева: (A) гиалуроновую кислоту не добавляют, и (B) добавляют 0,1% гиалуроновой кислоты).
Изображения флуоресценции в ближнем инфракрасном диапазоне (NIRF) на фиг. 9 получали с помощью света, испускаемого из 17 LED NIR по 2 мА, имеющих пиковую длину волны 740 нм. Изображение получали путем фотографирования и визуализации с помощью программного обеспечения для устройства просмотра AVT UniCam (Allied Vision Technologies) согласно следующим установкам камеры: время экспозиции: 200 мс; увеличение: 200; целевое значение по шкале оттенков серого: 125; и яркость: 16.
На фиг. 9 CV (стандартное отклонение/среднее) объема инъецируемой композиции составляло 28% в случае инъекционной композиции, в которую не добавляли гиалуроновую кислоту.
В частности, при сравнении интенсивностей флуоресценции, как показано на фиг. 9(A), наблюдали большую разницу в интенсивностях флуоресценции между левой и правой сторонами. Из результатов заключили, что большое количество ICG-MAA вводили инъекцией в начале, но затем количество вводимого инъекцией ICG-MAA снижалось, что указывает на то, что предварительно определенное количество ICG-MAA не было введено.
С другой стороны, на фиг. 9(B) можно видеть, что при добавлении гиалуроновой кислоты в инъекционную композицию осаждение ICG-MAA замедлялось, что тем самым позволяло вводить инъекцией предварительно определенное количество ICG-MAA.
Настоящее изобретение было описано подробно. Однако специалистам в области, к которой относится настоящее изобретение, следует учитывать, что настоящее описание и конкретные примеры, при том, что показывают предпочтительные варианты осуществления настоящего изобретения, приводятся исключительно с иллюстративной целью, поскольку специалистам в данной области из данного подробного описания станут очевидными различные изменения и модификации в идее и объеме настоящего изобретения.
Реферат
Настоящее изобретение относится к инъекционной композиции для мечения поражения и способу обеспечения информации о положении поражения с использованием инъекционной композиции. Более конкретно, инъекционная композиция для мечения поражения в соответствии с настоящим изобретением может включать в себя вторую композицию, содержащую биосовместимый вязкий материал, в первой композиции, содержащей комплекс, включающий в себя активный ингредиент, для решения проблемы быстрого оседания комплекса. Кроме того, инъекционная композиция для мечения поражения в соответствии с настоящим изобретением, в частности, может обладать эффектом, позволяющим предварительно определенное количество комплекса вводить инъекцией за счет решения проблемы быстрого оседания комплекса в ходе приготовления инъекции, что позволяет определенное количество комплекса вводить инъекцией, и эффектом, обеспечивающим удобное и стабильное ее применение для клинических целей путем решение проблем введения инъекцией избыточного количество комплекса и быстрого его распределения на край участка. 2 н. и 3 з.п. ф-лы, 7 табл., 8 пр., 9 ил.

Комментарии