Биоразлагаемые устройства на основе кремния для доставки терапевтических агентов - RU2640918C2
Код документа: RU2640918C2
Чертежи


Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет предварительной заявки на патент США №61/408934, поданной 1 ноября 2010 года, и заявки на патент США №61/470299, поданной 31 марта 2011 года. Полное содержание указанных заявок включено во всей своей полноте в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Со стороны фармацевтической индустрии наблюдается значительный интерес к разработке дозированных форм, которые обеспечивают контролируемое высвобождение терапевтических агентов во времени. Высвобождение активной субстанции таким способом может помочь повысить биодоступность и гарантировать обеспечение соответствующих концентраций агента без потребности повторного дозирования в течение продолжительного периода. В свою очередь, это помогает минимизировать явления несовместимости пациента, что очень часто связано с другими формами введения.
Пациенты могут отказываться от их режима лечения, поскольку его соблюдение может быть болезненным и травматичным. Например, сегодня существуют терапевтические агенты, которые могут со значительным клиническим успехом лечить офтальмологические состояния, такие как ассоциированная с возрастом макулярная дегенерация, диабетический макулярный отек, диабетическая ретинопатия, хориоидальная неоваскуляризация и другие состояния, которые могут привести к слепоте или почти полной слепоте. Часто пораженной популяцией является группа пациентов старшего возраста, которые обязаны корректировать свою дневную активность, чтобы справиться с ранними стадиями этих заболеваний. Однако по мере прогрессирования заболевания возникает перманентное повреждение глаза и многие клинически эффективные способы лечения являются лишь превентивными, но не восстановительными. Следовательно, постоянная совместимость с режимом лечения является практически обязательной для предотвращения потери зрения.
К сожалению, обычно режимы лечения требуют от пациентов нахождения в неподвижном состоянии во время прокалывания врачом глаза пациента гиподермальной иглой для доставки терапевтического агента в глаз, обычно в стекловидное тело глаза. Это может быть травматичным и болезненным и соответственно пациент может отказываться от инъекций, которые могут быть необходимыми еженедельно. Способность обеспечивать более длительное действие каждой инъекции и тем самым уменьшать боль и травмы, которым подвержены пациенты, требует определенной фармакокинетики терапевтического агента и имплантата, который несет и высвобождает агент.
Некоторые известные имплантаты имеют активные ингредиенты, которые включены в полимер и системы золь-гель путем захвата во время синтеза матричной фазы. Способы микрокапсулирования для биоразлагаемых полимеров включают такие способы, как отливка пленки, молдинг, распылительная сушка, экструзия, плавильная дисперсия, межфазное осаждение, разделение фаз путем эмульсификации и испарения растворителя, воздушное суспензионное покрытие, дражирование и полимеризация in-situ. Способы плавильной дисперсии описаны, например, в патентах США №5807574 и №5665428.
В необязательном подходе активный ингредиент вводится после завершения формирования пористой матрицы. Обычно такие системы носителей имеют микро-, а не нанопоры для проникновения агентов в поры. Патент США №6238705, например, описывает заполнение полимерных композиций с макропорами путем простого смачивания раствором активного ингредиента, а Патенты США №5665114 и №6521284 описывают использование давления для заполнения пор имплантируемого протеза, выполненного из политетрафторэтилена (ПТФЭ). В то время как этот подход может быть эффективен для малых органических молекул, большие молекулы, такие как белки, тяготеют к агрегации в больших порах и не высвобождаются эффективно контролируемым образом in vivo.
В случае малых пор трудно помещать большие концентрации терапевтических агентов из-за блокирования узких пор. Нанесение материала перед открытием пор предотвращает занятие системы пор значительной частью материала. Проблема достижения высокого заполнения активным ингредиентом ограничивает эффективность многих известных на сегодня систем доставки.
Другой проблемой при доставке терапевтических агентов через имплантат является биоразложение имплантата после высвобождения лекарственного средства. Биоразлагаемые или резорбируемые материалы для имплантатов являются привлекательной альтернативой имплантатам, которые требуют удаления после высвобождения лекарственного средства. Начали изучаться разработка и создание биоразлагаемых имплантатов как носителей терапевтических агентов. РСТ публикация №WO 2009/009563 описывает систему доставки лекарственного средства, содержащую пористый кремниевый материал.
В силу вышесказанного остается потребность в разработке улучшенных дозированных форм для контролируемого высвобождения терапевтических агентов, которые являются биосовместимыми и могут доставлять большие молекулы в постоянном режиме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Раскрываются биоразлагаемые устройства, такие как имплантаты, для контролируемой доставки терапевтических агентов, в частности больших молекул, таких как белки, антитела, углеводы, полимеры или полинуклеотиды. Устройства содержат пористый кремниевый материал-носитель, заполненный терапевтическим агентом. Устройство может использоваться для доставки терапевтического агента in vitro или in vivo, предпочтительно контролируемым образом в определенный период времени, например в течение нескольких дней, недель или месяцев. Материал-носитель предпочтительно создается из биоразлагаемого или резорбируемого материала, например кремниевого материала, такого как элементный кремний или диоксид кремния, благодаря чему удаление после высвобождения терапевтического агента является ненужным. В некоторых таких вариантах воплощения изобретения материал-носитель и продукты его распада являются биосовместимыми, вследствие чего биологические побочные эффекты от биоразложения материала-носителя являются минимальными или безвредными.
В некоторых вариантах воплощения изобретения материал-носитель содержит пористый диоксид кремния, такой как мезопористый диоксид кремния. Средний размер пор материала-носителя, как правило, выбирается так, чтобы он мог нести терапевтический агент, и примерами размеров пор являются поры с диаметром от 2-50 нм, такие как от примерно 5 до примерно 40 нм в диаметре, от примерно 15 до примерно 40 нм в диаметре, от примерно 20 до примерно 30 нм в диаметре, от примерно 2 до примерно 15 нм в диаметре или от примерно 5 до примерно 10 нм в диаметре.
В некоторых вариантах воплощения изобретения терапевтическим агентом является белок с молекулярной массой между 5000 а.е.м. и 200000 а.е.м. и может быть примерно от 10000 до 150000 а.е.м., между 10000 а.е.м. и 50000 а.е.м., между 50000 а.е.м. и 100000 а.е.м. или между 100000 а.е.м. и 200000 а.е.м.
Размер терапевтического агента может необязательно характеризоваться молекулярным радиусом, который может быть определен, например, кристаллографическим рентген-анализом или гидродинамическим радиусом. Терапевтическим агентом может быть белок, например, с молекулярным радиусом, выбранным от 0,5 нм до 20 нм, таким как от примерно 0,5 до 10 нм, даже от примерно 1 до 8 нм. Предпочтительно подходящий радиус пор, обеспечивающий доступ к конкретным агентам, например белкам, выбран в соответствии с разницей пора-терапевтический агент (агент), определенной в настоящем документе как разница между радиусом агента и радиусом поры. Например, разница пора-агент для инсулина с гидродинамическим радиусом 1,3 нм и порой с минимальным радиусом 4,8 нм имеет разницу пора-белок 3,5 нм. Разница пора-агент может использоваться для определения минимального подходящего среднего размера пор для размещения белка с конкретным радиусом пор. Разница пора-белок, как правило, может быть выбрана от примерно 3,0 до примерно 5,0 нм.
Как правило, устройства выбираются таким образом, чтобы имели средний размер пор для размещения терапевтического агента. Средний размер пор материала-носителя может быть выбран, основываясь на молекулярной массе или молекулярном радиусе терапевтического агента, которым необходимо заполнить поры материала-носителя. Например, терапевтический агент, молекулярная масса которого выбрана от 100000 до 200000 а.е.м., может быть использован с материалом-носителем с большим средним размером пор, таким как от примерно 15 нм до примерно 40 нм. В некоторых вариантах воплощения изобретения терапевтический агент с молекулярной массой, выбранной от 5000 до 50000 а.е.м., может быть использован с материалом-носителем с меньшим средним размером пор, таким как от примерно 2 нм до примерно 10 нм.
В определенных вариантах воплощения изобретения устройства изготавливаются путем первоначального формирования пористого материала-носителя, а затем заполнения пор терапевтическим агентом.
Изобретение включает способы заполнения терапевтическим агентом поры пористого кремниевого материала-носителя, включающие контакт пористого кремниевого материала-носителя с терапевтическим агентом. Один из примеров заполнения терапевтическим агентом поры пористого кремниевого материала-носителя включает выбор пористого кремниевого носителя с размером пор, адаптированным к заполнению поры одним белком таким образом, что противоположные стороны белка соприкасаются с противоположными сторонами поры. Один способ заполнения терапевтическим агентом поры пористого кремниевого материала-носителя включает выбор пористого кремниевого носителя с размером пор, адаптированным для вмещения только одного агента в ширине одной поры в один момент времени (т.е. продольные ряды вдоль длины поры не исключены), например, два агента не могут быть размещены, если они расположены сторона-к-стороне (буквально) в поре.
Устройство может быть размещено на коже или на поверхности глаза. Необязательно, устройство может быть размещено в теле млекопитающего, например в глазу пациента, или внутри любой другой ткани или органа тела пациента. В конкретных заявках устройство помещается подкожно, субконьюнктивально или в стекловидном теле глаза. Устройство может быть использовано для лечения или предотвращения состояний пациента, таких как хронические заболевания. В некоторых вариантах воплощения изобретения устройства предназначены для лечения или предотвращения заболеваний глаза, таких как глаукома, макулярная деградация, диабетический макулярный отек и дегенерация сетчатки, ассоциированная с возрастом. Терапевтический агент может контролируемо высвобождаться в течение недель или месяцев, например, для лечения или предотвращения заболеваний глаза, таких как макулярная деградация.
Изобретение включает стабилизированные лекарственные формы и способы стабилизации терапевтических агентов в пористом материале-носителе, что описано в настоящем документе. В некоторых вариантах воплощения изобретение включает стабилизирующие биомолекулы, такие как антитела, в порах материала-носителя, благодаря чему период полураспада или срок годности биомолекулы превышает период полураспада или срок годности биомолекулы вне материала-носителя.
Изобретение дополнительно включает шприц, содержащий композицию пористого кремниевого материала-носителя, в котором композиция содержит менее 2% биомолекул. Шприцы могут быть использованы для введения терапевтического агента путем: а) обеспечения шприца, предварительно заполненного пористым кремниевым материалом-носителем; б) контакта материала-носителя с терапевтическим агентом; и в) введения материала-носителя пациенту. Этап б) может быть реализован путем внесения терапевтического агента в шприц. Между этапами б) и в) может потребоваться инкубационное время, например, 10 мин, 20 мин или 30 мин для адсорбции терапевтического агента в поры материала-носителя. Терапевтический агент может быть выбран из малой молекулы или биомолекулы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
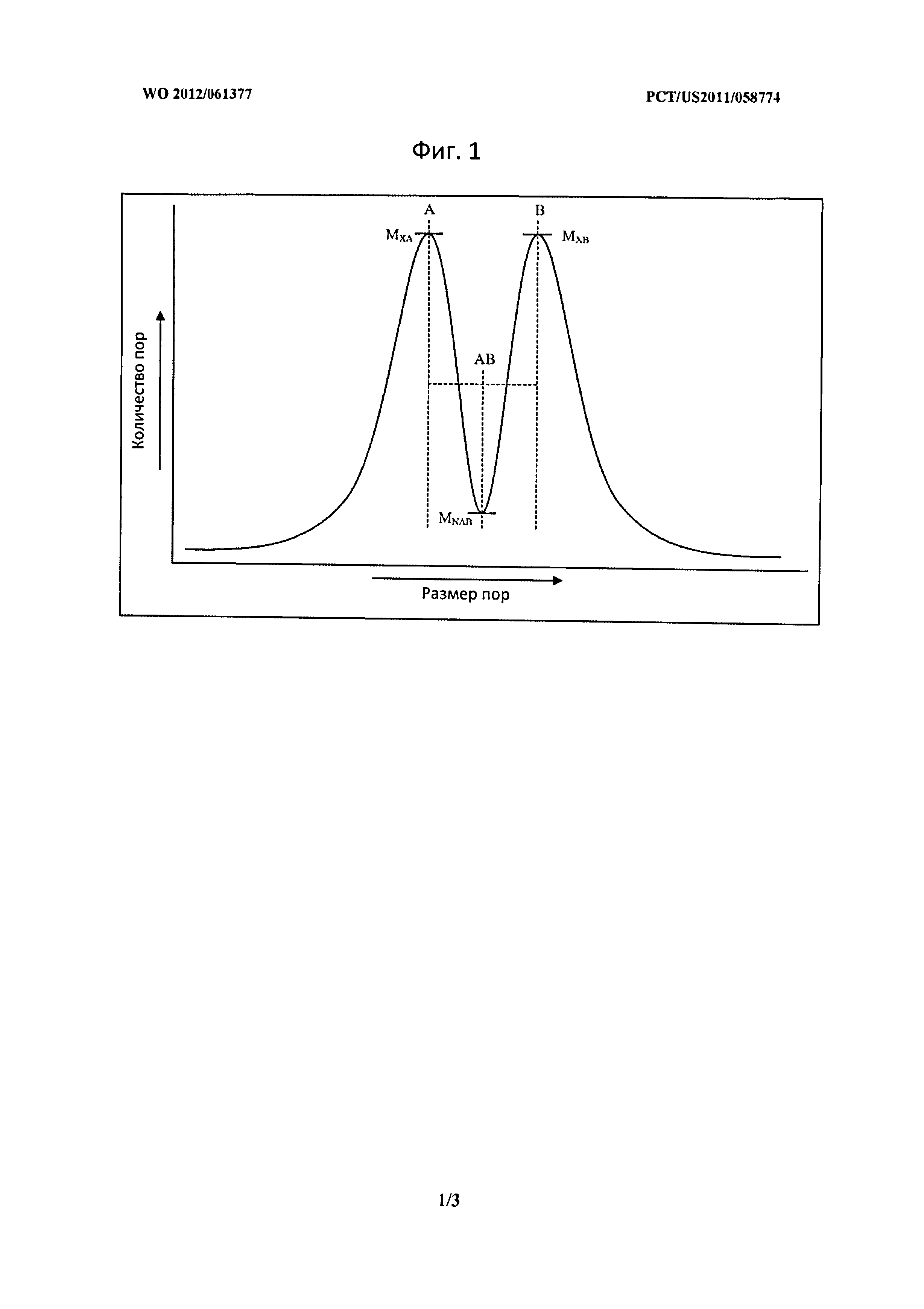
Фигура 1 описывает распределение размера пор для материала-носителя с неравномерным, бимодальным распределением размеров пор.
Фигура 2 описывает высвобождение лизоцима из различных кремнеземных матриц как в PBS, так и в PBS, насыщенным SiO2. Растворитель: - PBS: ♦, Дависил 60 Å; ■, Дависил 150 Å; ▲, Дависил 250 Å. PBS, насыщенный SiO2: ◊ Дависил 60 Å; □, Davisil 150 Å; ∆ Дависил 250 Å.
Фигура 3 описывает совокупное высвобождение бевацизумаба из кремнеземных адсорбентов в PBS.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обзор
Длительная и контролируемая доставка терапевтических агентов пациентам, в частности пациентам с хроническими состояниями, такими как глаукома или рак, становится все более важной для современной медицинской терапии. Многие препараты наиболее эффективны при введении в частых интервалах для поддержания практически постоянного наличия активного агента в теле. Поскольку рекомендуемым может стать частое введение, неудобство и ассоциированная трудность совместимости пациента могут существенно препятствовать лечению данным образом. Как результат, средства с длительным высвобождением, которые контролируемо высвобождают терапевтические агенты, являются очень привлекательными в таких областях, как терапия рака и лечение других хронических заболеваний.
Средства, высвобождающие терапевтические агенты in vitro или in vivo, могут быть выполнены из множества биосовместимых или по меньшей мере большей частью биосовместимых материалов. Один из типов средств использует кремниевый материал-носитель. Кремниевые материалы-носители могут включать, например, элементный кремний и окисленный кремний в таких формах, как диоксид кремния (кремнезем) или силикаты. Некоторые кремниевые устройства продемонстрировали высокую биосовместимость и преимущественную деградацию в биологических системах, устраняя необходимость удаления устройства после высвобождения терапевтического агента.
Испытания демонстрируют, что высокопористые кремниевые материалы, например с 80%-ной пористостью, резорбируются быстрее, чем кремниевый материал средней пористости, например с 50%-ной пористостью, который в свою очередь резорбируется быстрее, чем монолитный кремниевый материал, который не демонстрирует или практически не демонстрирует способности к биоразложению или резорбции в биологических системах. Более того, понятно, что средний размер пор материала-носителя будет влиять на скорость резорбции. Путем регуляции среднего размера пор материала-носителя, а также пористости материала,может быть оптимизирована и выбрана скорость биоразложения.
Кремниевые устройства часто изготавливаются с использованием высоких температур и органических растворителей или кислотных сред для образования пористого материала и заполнения пор терапевтическим агентом. Эти условия могут быть приемлемыми для определенных молекул, таких как соли, элементы и определенные высокостабильные малые органические молекулы. Однако для заполнения большими органическими молекулами, такими как белки или антитела, условия едкой щелочи и/или суровые условия во время изготовления или заполнения матрицы могут привести к денатурации и деактивации, если не полному разрушению активного агента. Чертой описываемых в настоящем документе способов является заполнение большими молекулами, такими как антитела, материала-носителя при средних условиях, что особенно предпочтительно для больших органических молекул, таких как белки.
Размер частиц кремниевого материала-носителя может также влиять на скорость, с которой поры материала-носителя могут быть заполнены терапевтическим агентом. Меньшие частицы, например частицы, наибольший диаметр которых составляет 20 мкм или менее, могут заполнять быстрее, чем частицы, наибольший диаметр которых составляет более 20 мкм. Это частично наблюдается, когда диаметры пор близки по размеру молекулярным диаметрам или размеру терапевтических агентов. Быстрое заполнение меньшими частицами может быть связано с меньшей средней глубиной пор, на которую должен проникнуть терапевтический агент в малых частицах.
Определение терминов
В контексте данного изобретения формы единственного числа могут обозначать один или более. Как это используется в формуле изобретения, при использовании вместе со словом «включая», формы единственного числа могут обозначать один или более одного. Используемый в настоящем документе термин "другой" может означать, по меньшей мере, второй или более.
Термины "антитело" и "антитела" в общем охватывают естественно встречающиеся формы антител и рекомбинантные антитела, такие как одноцепочные антитела, антитела верблюдовых, химерные и гуманизированные антитела, и мультиспецифические антитела, а также фрагменты и производные всех вышеупомянутых антител, предпочтительно фрагменты и производные, которые по меньшей мере имеют антигенсвязывающий сайт.Производные антител могут содержать белок или химический остаток, связанный с антителом. Термин «антитело» используется в широчайшем смысле и охватывает полностью собранные антитела и содержащие их рекомбинантные белки.
"Фрагменты антител" включают часть интактного антитела, предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примеры фрагментов антител включают Fab, Fab’, F(ab’) 2 и Fv-фрагменты; диатела; линейные антитела (Zapata et ей.. Protein Eng. 8(10): 1057-1062 (1995); одноцепочечные молекулы антител; и мультиспецифические антитела, образованные из фрагментов антител. Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых “Fab”-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и остаточный “Fc”-фрагмент, название которого отражает его способность к быстрой кристаллизации. Обработка пепсином дает Р(ab’)2-фрагмент, который имеет два антигенсвязывающих сайта и все еще способен к перекрестному связыванию антигена.
Термин «биоэродирование» или «биоразложение», используемый в настоящем документе, относится к постепенному распаду или разрушению структуры или контура в течение периода времени в биологической системе, например, одним или более физическими или химическими процессами деградации, например ферментативным воздействием, гидролизом, ионным обменом или растворением путем солюбилизации, образования эмульсии или образования мицеллы.
Термины "устройство" и "имплантат" в настоящем документе используются по существу взаимозаменяемо для обозначения раскрытых материалов; термин "имплантат" преимущественно используется для обозначения устройств, которые имплантированы в тело пациента, а не вводятся при помощи других средств. Различные описания вариантов воплощения устройств предназначены для применения в равной степени к имплантатам и наоборот.
Термин "предупреждение" является признанным в данной области, и при использовании в отношении состояния, такого как местный рецидив (например, боль), заболевания, такого как рак, сложного синдрома, такого как сердечная недостаточность, или любого другого медицинского состояния, имеет хорошо известное в науке значение и включает в себя введение композиции, которая уменьшает частоту или отсрочивает начало симптомов медицинского состояния у субъекта в сравнении с субъектом, который не получает композиции. Таким образом, профилактика рака включает, например, сокращение числа выявляемых раковых новообразований в популяции пациентов, получающих профилактическое лечение по сравнению с контрольной популяцией, не получавшей лечения, и/или задержку появления выявляемых раковых новообразований в популяции, получавшей лечение, по сравнению с контрольной популяцией, не получавшей лечения, например, статистически и/или клинически значимым количеством. Предотвращение инфекции включает, например, уменьшение числа диагнозов инфекции в популяции, получавшей лечение, по сравнению с контрольной популяцией, не получавшей лечения, и/или задержку начала симптомов инфекции в популяции пациентов, получавших лечение, по сравнению с контрольной популяцией, не получавшей лечения. Предупреждение боли включает, например, уменьшение величины или, необязательно, задержку болевых ощущений, испытываемых субъектами в популяции, получавшей лечение, по сравнению с контрольной популяцией, не получавшей лечения.
Термин "профилактическое или терапевтическое" лечение является признанным в данной области и включает введение хозяину одной или более композиций по изобретению. Если ее применяют до клинического проявления нежелательного состояния (например, заболевания или другого нежелательного состояния животного-хозяина), то лечение является профилактическим (т.е. оно защищает хозяина от развития нежелательного состояния), тогда как если ее вводят после проявления нежелательного состояния, лечение является терапевтическим (т.е. оно предназначено для уменьшения, облегчения или стабилизации существующего нежелательного состояния или его побочных эффектов).
Резорпция или резорбция, как этот термин используется в настоящем документе, относится к распаду материала при введении в или на физиологический орган, ткань или жидкость живого человека или животного.
Термин "терапевтически эффективное количество" соединения по отношению к рассматриваемому способу лечения относится к количеству соединения (ий) в препарате, которое(ые) при введении в качестве части желаемого режима дозирования (млекопитающему, предпочтительно человеку) облегчает симптом, улучшает состояние или замедляет начало болезненных состояний в соответствии с клинически приемлемыми стандартами для подвергнутого лечению расстройства или состояния, или для косметических целей, например, при разумном соотношении польза/риск применимо к любому консервативному лечению.
Используемый в настоящем документе термин "лечение" или "терапия" включает реверсию, снижение или задержку симптомов, клинических признаков и основной патологии состояния таким образом, чтобы улучшить или стабилизировать состояние субъекта.
Если не указано иное, термин «большая терапевтическая молекула» относится к молекулам с молекулярной массой, равной или превышающей 1000 а.е.м., предпочтительно более 2000 а.е.м., или даже более 3000 а.е.м. Если не указано иное, низкомолекулярная терапевтическая молекула относится к молекуле с молекулярной массой менее 1000 а.е.м.
Кремниевые материалы и другие биоразлагаемые носители
Устройства и способы, описанные в настоящем документе, обеспечивают, в частности, устройства, содержащие пористый кремниевый материал-носитель, в котором по меньшей мере один терапевтический агент расположен в поре материала-носителя. Описанные способы используют такие устройства для лечения или профилактики заболеваний, особенно хронических заболеваний. Кроме того, описанные способы изготовления устройств описывают устройства, которые характеризуются устойчивым и контролируемым высвобождением терапевтических агентов, особенно больших молекул, таких как белки или антитела.
Как правило, устройство содержит кремниевый материал-носитель, такой как элементный кремний, диоксид кремния (кремнезем), монооксид кремния, силикаты (соединения, содержащие анион, несущий кремний, например , или ) или любую комбинацию таких материалов. В некоторых вариантах воплощения изобретения материал-носитель содержит полный или частичный каркас из элементного кремния и эта структура в значительной степени или полностью покрыта поверхностным слоем диоксида кремния. В других вариантах воплощения изобретения материал-носитель является полностью или практически полностью кремнеземом.
Хотя материалы на основе кремния являются предпочтительными материалами-носителями для использования в настоящем изобретении, дополнительные биоразлагаемые материалы с определенными общими свойствами (например, пористостью, размером пор, размером частиц, характеристиками поверхности, биоразлагаемостью и рассасыванием) в качестве кремниевых материалов, описанных в настоящем документе, могут быть использованы в настоящем изобретении. Примерами дополнительных материалов, которые могут быть использованы как пористые материалы-носители, являются биоразлагаемая керамика, биоразлагаемые оксиды металлов, биоразлагаемые полупроводники, костный фосфат, фосфаты кальция (например, гидроксиапатит), другие неорганические фосфаты, сажа, карбонаты, сульфаты, алюминаты, бораты, алюмосиликаты, оксид магния, оксид кальция, оксиды железа, оксиды циркония, оксиды титана и другие аналогичные материалы.
В некоторых вариантах воплощения изобретения материал-носитель содержит кремнезем, например более чем примерно 50% кремнезема; более чем примерно 60 мас.% кремнезема, более чем примерно 70 мас.% кремнезема, более чем примерно 80 мас.% кремнезема, более чем примерно 90 мас.% кремнезема, более чем примерно 95 мас.% кремнезема, более чем 99 мас.% кремнезема или даже более чем 99,9 мас.% кремнезема. Пористый кремнезем можно приобрести у таких поставщиков как Davisil, Silicycle и Macherey-Nagel.
В некоторых вариантах воплощения изобретения материал-носитель содержит элементный кремний, более чем 60 мас.% кремния, более чем 70 мас.% кремния, более, чем 80 мас.% кремния, более чем 90 мас.% кремния или даже более чем 95 мас.% кремния. Кремний можно приобрести у поставщиков, таких как Vesta Ceramics.
Чистота кремниевого материала может быть количественно оценена при помощи таких способов, как энергетический дисперсионный рентгеновский анализ, рентгеновская флуоресценция, индуктивно связанная оптическая эмиссионная спектроскопия или масс-спектроскопия с тлеющим разрядом.
Материал-носитель может содержать другие компоненты, такие как металлы, соли, минералы или полимеры. Материал-носитель может иметь покрытие, нанесенное, по меньшей мере, на часть поверхности, например, для улучшения биосовместимости устройства и/или воздействия на кинетику высвобождения.
Кремниевый материал-носитель может содержать элементный кремний или его соединения, например диоксид кремния или силикаты в аморфной форме. В некоторых вариантах воплощения изобретения элементный кремний или его соединения присутствуют в кристаллической форме. В других вариантах воплощения изобретения материал-носитель содержит аморфный кремнезем и/или аморфный кремний. В некоторых вариантах воплощения изобретения кремниевый материал более чем примерно на 60 мас.% аморфный, более чем примерно на 70 мас.% аморфный, более чем примерно на 80 мас.% аморфный, более чем примерно на 90 мас.% аморфный, более чем примерно на 92 мас.% аморфный, более чем примерно на 95% мас.% аморфный, более чем примерно на 99 мас.% аморфный или даже более чем на 99,9 мас.% аморфный.
Для идентификации кристаллических фаз кремниевого материала может быть использован рентгеноструктурный анализ. Порошковая дифракция может быть проведена, например, на дифрактометре Scintag PAD-X, например, снабженном охлаждаемым жидким азотом твердотельным германиевым детектором, используя Cu K-альфа излучение.
Кремниевый материал может иметь пористость от примерно 40% до примерно 95%, например, от примерно 60% до примерно 80%. Пористость, используемая в настоящем документе, является мерой пустот в материале и является частью объема пустот по всему объему материала. В некоторых вариантах воплощения изобретения материал-носитель имеет пористость по меньшей мере примерно 10%, по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80% или даже по меньшей мере примерно 90%. В конкретных вариантах воплощения изобретения пористость равна более чем примерно 40%, например, более чем примерно 50%, более чем примерно 60% или даже более чем примерно 70%.
Материал-носитель устройств может иметь площадь поверхности на единицу веса, выбранную от примерно 20 м2/г до примерно 2000 м2/г, например, от примерно 20 м2/г до примерно 1000 м2/г или даже от примерно 100 м2/г до примерно 300 м2/г. В некоторых вариантах воплощения изобретения площадь поверхности равна более чем примерно 200 м2/г, более чем примерно 250 м2/г или более чем примерно 300 м2/г.
В некоторых вариантах воплощения изобретения терапевтический агент распространяется на глубину пор от поверхности материала, по меньшей мере, примерно на 10 мкм, по меньшей мере примерно на 20 мкм, по меньшей мере примерно на 30 мкм, по меньшей мере примерно на 40 мкм, по меньшей мере примерно на 50 мкм, по меньшей мере примерно на 60 мкм, по меньшей мере примерно на 70 мкм, по меньшей мере примерно на 80 мкм, по меньшей мере примерно на 90 мкм, по меньшей мере примерно на 100 мкм, по меньшей мере примерно на ПО мкм, по меньшей мере примерно на 120 мкм, по меньшей мере примерно на 130 мкм, по меньшей мере примерно на 140 мкм или по меньшей мере примерно на 150 мкм. В некоторых вариантах воплощения изобретения терапевтический агент распределяется в порах материала-носителя по существу равномерно.
Терапевтический агент может быть загружен в материал-носитель на глубину, которая определяется как отношение глубины, на которую терапевтический агент проникает в материал-носитель, к полной ширине материала-носителя. В некоторых вариантах воплощения изобретения терапевтический агент распространяется на глубину по меньшей мере примерно на 10% в материал-носитель, по меньшей мере примерно на 20% в материал-носитель, по меньшей мере примерно на 30% в материал-носитель, по меньшей мере примерно на 40% в материал-носитель, по меньшей мере примерно на 50% в материал-носитель или по меньшей мере примерно на 60% в материал-носитель.
Количественная оценка валового заполнения может быть проведена при помощи ряда аналитических способов, например, гравиметрического, EDX (энергодисперсионного анализа рентгеновских лучей), ИК-Фурье спектроскопии (FTIR) или рамановской спектроскопии фармацевтической композиции или при помощи УФ-спектрофотометрии, титриметрического анализа, ВЭЖХ или масс-спектроскопии элюированого в раствор терапевтического агента. Количественная оценка равномерности заполнения может быть проведена при помощи композиционных приемов, которые имеют пространственное разрешение, таких как кросс-секционный EDX, послойный элементный анализ, микрорамановская спектроскопия и микро-FTIR.
Пористые кремниевые материалы настоящего изобретения могут быть классифицированы по среднему диаметру размера пор. Микропористый кремниевый материал имеет средний размер пор менее 2 нм, мезопористый кремниевый материал имеет средний размер пор 2-50 нм и макропористый кремниевый материал имеет размер пор более 50 нм. В некоторых вариантах воплощения изобретения более 50% пор кремниевого материала имеют размер пор 2-50 нм, более 60% пор кремниевого материала имеют размер пор 2-50 нм, более 70% пор кремниевого материала имеют размер пор 2-50 нм, более 80% пор кремниевого материала имеют размер пор 2-50 нм или даже более 90% пор кремниевого материала имеют поры размером 2-50 нм.
В некоторых вариантах воплощения изобретения материал-носитель содержит пористый диоксид кремния, такой как мезопористый диоксид кремния. В некоторых вариантах воплощения изобретения средний размер пор материала-носителя выбирают из 2-50 нм, например, от примерно 5 до примерно 40 нм, от примерно 15 до примерно 40 нм, например, от примерно 20 до примерно 30 нм. В некоторых вариантах воплощения изобретения средний размер пор выбирают из примерно от 2 до примерно 15 нм, например, от примерно 5 до примерно 10 нм. В некоторых вариантах воплощения изобретения средний размер пор составляет примерно 30 нм.
В некоторых вариантах воплощения изобретения материал-носитель имеет популяцию пор с четко определенным размером пор, т.е. распределение размеров пор в материале-носителе находится в пределах заданного диапазона. В некоторых вариантах воплощения изобретения четко определенная популяция пор имеет примерно от 50% до примерно 99% размеров пор со средним размером пор для данной популяции в пределах примерно от 1 нм до 15 нм, предпочтительно примерно 10 нм, примерно 5 нм, или со средним размером пор для данной популяции, даже равным 3 нм или 2 нм. В некоторых таких вариантах воплощения изобретения более чем примерно 50%, более чем примерно 60%, более чем примерно 70%, более чем примерно 80%, более чем примерно 90% или даже более чем примерно 95% пор материала-носителя имеют размер пор в пределах указанного диапазона. Кроме того, популяция пор с четко определенным размером пор может быть популяцией, в которой более чем примерно 50%, более чем примерно 60%, более чем примерно 70%, более чем примерно 80%, более чем примерно 90% или даже более чем примерно 95% пор имеют размер пор в пределах 20%, предпочтительно в пределах 15%, 10% или даже 5% среднего размера пор в данной популяции.
Распределение размеров пор (например, мезопор) может быть определено количественно с использованием установленных аналитических способов, таких как газовая адсорбция, сканирующая электронная микроскопия высокого разрешения, ЯМР крипорометрия и дифференциальная сканирующая калориметрия. В определенных вариантах воплощения изобретения более чем один способ используется для данного образца.
Кроме того, популяция пор с четко определенным размером пор может быть популяцией, для которой стандартное отклонение размеров пор составляет менее 20%, предпочтительно менее 15%, менее 10% или даже менее 5% от среднего размера пор в этой популяции.
Размер пор может быть предварительно выбран для пространственных характеристик терапевтического агента для контроля скорости высвобождения терапевтического агента в биологической системе. Как правило, размеры пор, которые слишком малы, препятствуют заполнению терапевтическим агентом, в то время как большие поры не взаимодействуют с терапевтическим агентом достаточно сильно, чтобы оказывать желаемый контроль над скоростью высвобождения. Например, средний диаметр пор для материала-носителя может быть выбран из более крупных пор, например, от 15 нм до 40 нм, для высокомолекулярных молекул, например 200000-500000 а.е.м. и более мелких пор, например, от 2 до 10 нм, для молекул с меньшей молекулярной массой, например 10000-500000 а.е.м. Например, средние размеры пор примерно 6 нм в диаметре могут быть пригодны для молекул с молекулярной массой примерно от 14000 до 15000 а.е.м., например, примерно 14700 а.е.м. Средние размеры пор примерно 10 нм в диаметре могут быть выбраны для молекул с молекулярной массой примерно 45000 до 50000 а.е.м., например, примерно 48000 а.е.м. Средние размеры пор примерно 25-30 нм в диаметре могут быть выбраны для молекул с молекулярной массой примерно 150000 а.е.м.
Размер пор может быть предварительно выбран для адаптации к молекулярному радиусу терапевтического агента для контроля скорости высвобождения терапевтического агента в биологической системе. Например, средние размеры пор от примерно 25 нм до примерно 40 нм в диаметре могут быть пригодны для молекул с наибольшим молекулярным радиусом от примерно 6 нм до примерно 8 нм. Молекулярные радиусы могут быть рассчитаны при помощи любого подходящего способа, например, используя физические размеры молекулы на основе данных рентгеновской кристаллографии или используя гидродинамический радиус, который представляет собой размер молекулы в растворенном состоянии. Поскольку расчет в растворе зависит от природы раствора, в котором произведен расчет, для некоторых измерений предпочтительным может быть использование физических размеров молекулы на основе данных рентгеновской кристаллографии. Используемый в настоящем документе крупнейший радиус молекулы отражает половину наибольшего размера терапевтического агента.
В некоторых вариантах воплощения изобретения средний диаметр пор выбирают таким образом, чтобы ограничить агрегацию молекул, например, белков, в поре. Предпочтительным является предотвращение агрегации биомолекул, таких как белки, в устройстве, так как это, как полагают, препятствует контролируемому высвобождению молекул в биологической системе. Таким образом, поре, которая, благодаря отношению между ее размером и размером биомолекулы, позволяет, например, только одной биомолекуле входить в пору в любой один момент времени, будет отдано предпочтение над порой, которая позволяет множеству биомолекул входить в пору вместе и агрегировать внутри поры. В некоторых вариантах воплощения изобретения в пору может быть загружено много биомолекул, но благодаря глубине поры белки, распределенные по всей глубине поры, будут агрегировать в меньшей степени.
В некоторых вариантах воплощения изобретения материал-носитель содержит два или более различных материала с различными свойствами (например, размером пор, диаметром частиц или характеристиками поверхности), каждый из которых предварительно выбран для адаптации к различному терапевтическому агенту. Например, два различных материала-носителя могут быть смешаны, один с порами первой популяции, размер пор которых адаптирован к первому терапевтическому агенту, второй с порами второй популяции, размер пор которых адаптирован ко второму терапевтическому агенту. В некоторых других вариантах воплощения изобретения материал-носитель содержит один материал, который имеет две или более четко определенных популяций пор, например, в котором материал-носитель изготовлен по молекулярному матричному способу, в котором характеристики пор предварительно выбраны для двух или более терапевтических агентов, например, двух терапевтических агентов с различными молекулярными радиусами. Таким образом, материал-носитель может контролируемо доставлять два или более терапевтических агента, описанных в настоящем документе. В таких вариантах воплощения изобретения заполнение терапевтическими агентами предпочтительно идет в порядке от большего к меньшему агенту таким образом, что больший агент выбирательно адсорбируется в самые большие поры (то есть, он не помещается в более мелкие поры), благодаря чему более крупные поры не адсорбируют меньшие агенты.
Например, если материал-носитель содержит первую популяцию четко определенных пор, которые имеют в диаметре примерно 6 нм (то есть пригодны для молекул с молекулярной массой примерно от 14000 до 15000 а.е.м.), и вторую популяцию четко определенных пор примерно 10 нм в диаметре (то есть пригодных для молекул с молекулярной массой примерно от 45000 до 50000 а.е.м.), последний терапевтический агент (то есть с молекулами с молекулярной массой примерно от 45000 до 50000 а.е.м.) предпочтительно добавляют к материалу-носителю перед добавлением меньшего терапевтического агента (то есть с молекулами с молекулярной массой примерно от 14000 до 15000 а.е.м.). Необязательно и дополнительно в варианте воплощения изобретения, в котором два различных пористых материала вместе составляют устройство, каждый материал-носитель может быть отдельно заполнен различным терапевтическим агентом, а затем материалы-носители могут быть объединены с изготовлением устройства.
В некоторых вариантах воплощения изобретения, в которых материал-носитель имеет две или более отдельных популяций с четко определенными порами (например, различные популяции пор по существу не перекрываются), различия между свойствами различных популяций пор предпочтительно выбирают для ограничения адсорбции каждого различного терапевтического агента в определенную популяцию пор. В некоторых вариантах воплощения изобретения средний размер пор двух или более отдельных популяции четко определенных пор может быть выбран для ограничения адсорбции больших терапевтических агентов в меньшие поры. Средняя разница размера пор может быть определена как разница между средним размером пор для различных популяций пор в материале-носителе. Например, средняя разница в размере пор по меньшей мере 10 нм может означать, что материал-носитель может содержать по меньшей мере две популяции пор, средний размер пор которых отличается ("средняя разница размера пор"), по меньшей мере, на 10 нм, например, композиция может содержать две популяции пор, имеющие средний размер пор 10 нм и 20 нм, три популяции пор со средним размером пор 10 нм, 20 нм и 30 нм, или четыре популяции пор со средним размером пор 10 нм, 20 нм, 30 нм и 40 нм. В некоторых вариантах воплощения изобретения средняя разница размера пор предпочтительно составляет по меньшей мере примерно 5 нм, по меньшей мере примерно 10 нм, по меньшей мере 15 нм, по меньшей мере примерно 20 нм или по меньшей мере примерно 30 нм. В некоторых вариантах воплощения изобретения две или более популяции четко определенных пор имеют различные средние размеры пор так, что средние размеры пор любых двух популяций различаются по меньшей мере на 20%, предпочтительно по меньшей мере на 30%, на 40% или даже на 50% меньшего среднего размера пор.
В некоторых вариантах воплощения изобретения, в которых материал-носитель имеет неравномерное распределение размеров пор, материал-носитель имеет две или более популяции четко определенных пор с различными средними размерами пор как описано выше. Подобным образом, ссылаясь на Фиг.1, материал-носитель с неравномернымраспределением размеров пор может быть охарактеризован как имеющий распределение размеров пор по меньшей мере с двумя локальными максимумами (например, один, равный размеру пор А, и один, равный размеру пор В на Фиг.1), но не более чем тремя или четырьмя локальными максимумами, в которых количество пор имеют размер двух соседних локальных максимумов (например, MXA и MXB на Фиг.1), который, по меньшей мере, в три раза, а предпочтительно в пять раз, в десять раз, или даже в 20 раз больше количества пор, имеющих размер пор, который является средним размером пор двух локальных максимумов (например, MNAB на фиг.1, в котором средний размер пор двух локальных максимумов является AVAB). Распределение размеров пор может быть также описано при помощи следующих уравнений, которые также применяются в некоторых вариантах воплощения изобретения, в которых МХА являются МХВ являются не эквивалентными, например, распределение не является строго бимодальным:
МХА≥3(MNAB) и МХВ≥3(MNAB),
где МХА - количество частиц с размером пор А; МХВ - количество частиц с размером пор В; и MNAB - количество частиц с размером пор (А+В)/2, и где 3 может быть заменен любым подходящим множителем, описанным выше.
В некоторых вариантах воплощения изобретения терапевтический агент выбран из любого агента, пригодного для лечения или профилактики заболеваний. В некоторых вариантах воплощения изобретения агент выбирают из низкомолекулярных терапевтических агентов, то есть соединений с молекулярной массой менее 1000 а.е.м.. В предпочтительных вариантах воплощения изобретения терапевтические агенты выбирают из больших молекул с молекулярной массой, равной или превышающей 1000 а.е.м.. В некоторых вариантах воплощения изобретения терапевтический агент согласно изобретению представляет собой биомолекулу. Биомолекулы, используемые в настоящем документе, относятся к любой молекуле, которая продуцируется живым организмом, включая большие полимерные молекулы, такие как белки, полисахариды и нуклеиновые кислоты, а также малые молекулы, такие как первичные метаболиты, вторичные метаболиты и натуральные продукты или их синтетические вариации. В частности, белки, такие как антитела, лиганды и ферменты могут быть использованы в качестве терапевтических агентов согласно изобретению. В конкретных вариантах воплощения изобретения биомолекулы согласно изобретению имеют молекулярные массы в диапазоне от примерно 10000 а.е.м. до примерно 500000 а.е.м. В некоторых вариантах воплощения изобретения терапевтический агент выбран из одного или более моноклональных антител, таких как ранибизумаб (Lucentis) и бевацизумаб (Avastin).
В некоторых вариантах воплощения изобретения терапевтический агент имеет молекулярную массу между 10000 и 50000 а.е.м., между 50000 и 100000 а.е.м. или между 100000 и 150000 а.е.м. В некоторых вариантах воплощения изобретения терапевтический агент представляет собой белок с молекулярной массой между 5000 а.е.м. и 200000 а.е.м., например, от примерно 10000 до примерно 150000 а.е.м.
Размер терапевтического агента может быть, кроме того, охарактеризован молекулярным радиусом, который может быть определен, например, при помощи рентгеноструктурного анализа или при помощи гидродинамического радиуса. Терапевтический агент может быть белком, например, с молекулярным радиусом, выбранным от 0,5 нм до 20 нм, например, от примерно 0,5 нм до 10 нм, даже от примерно 1 до 8 нм.
Терапевтический агент с молекулярным радиусом от 1 до 2,5 нм, может быть преимущественно использован с материалом-носителем с минимальным радиусом пор от 4,5 до 5,8 нм. Терапевтический агент с молекулярным радиусом 7 нм может быть преимущественно использован с материалом-носителем с минимальным радиусом пор от 11 до 13 нм, например, примерно 12 нм. Например, инсулин с гидродинамическим радиусом 1,3 нм может быть использован с материалом-носителем, который имеет средний минимальный радиус пор 4,8 нм.
Разница белок-пора может быть использована для выбора подходящего материала-носителя для размещения терапевтического агента. Этот расчет вычитает молекулярный радиус из радиуса пор. Как правило, радиус терапевтического агента будет гидродинамическим радиусом или наибольшим радиусом, определенным рентгеноструктурным анализом. Радиус пор, как правило, будет средним радиусом пор материала-носителя. Например, разница пора-белок для инсулина с гидродинамическим радиусом 1,3 нм и порой с минимальным радиусом 4,8 нм имеет разницу пора-белок 3,5 нм. В некоторых вариантах воплощения изобретения разница пора-белок выбрана от 3 до 6 нм, например, от 3,2 до 4,5 нм. Разница пора-белок может быть примерно 3,2 нм, примерно 3,3 нм, примерно 3,4 нм, примерно 3,5 нм, примерно 3,6 нм, примерно 3,7 нм, примерно 3,8 нм, примерно 3,9 нм, примерно 4,0 нм, примерно 4,1 нм, примерно 4,2 нм, примерно 4,3 нм, примерно 4,4 нм или примерно 4,5 нм.
В некоторых вариантах воплощения изобретения терапевтический агент представляет собой антитело, и средний размер пор материала-носителя выбран от примерно 5 нм до примерно 40 нм, например, от примерно 10 нм до примерно 40 нм, например, от примерно 20 нм до примерно 40 нм, например, от примерно 25 нм до 35 нм, например, примерно 30 нм. В некоторых вариантах воплощения изобретения терапевтический агент представляет собой антитело, выбранное из бевацизумаба или ранибизумаба, и средний размер пор материала-носителя выбран от примерно 5 нм до примерно 40 нм, например, от 10 нм до примерно 40 нм, например, от примерно 25 нм до 35 нм, например, примерно 30 нм. В некоторых вариантах воплощения изобретения терапевтическим агентом является бевацизумаб, и средний размер пор материала-носителя составляет примерно 30 нм.
В некоторых вариантах воплощения изобретения стенки материала-носителя, разделяющие поры, имеют среднюю ширину менее 5 нм, например, примерно 4,8 нм, примерно 4,6 нм, примерно 4,4 нм, примерно 4,2 нм, примерно 4,0 нм, примерно 3,8 нм, примерно 3,6 нм, примерно 3,4 нм, примерно 3,2 нм, примерно 3,0 нм, примерно 2,8 нм или даже примерно 2,6 нм. В некоторых вариантах воплощения изобретения стенки материала-носителя, разделяюющие поры, имеют среднюю ширину менее, чем примерно 3 нм, например, примерно 2,8 нм, примерно 2,6 нм, примерно 2,4 нм, примерно 2,2 нм, примерно 2,0 нм, примерно 1,8 нм, примерно 1,6 нм, примерно 1,4 нм, примерно 1,2 нм, примерно 1,0 нм или даже примерно 0,8 нм.
Размерность и морфологию устройства возможно измерить, например, способом просвечивающей электронной микроскопии (ПЭМ) с использованием электронного микроскопа 2000 JEOL, работающегоя, например, при 200 кэВ. Образцы для ПЭМ могут быть изготовлены путем распределения большого числа пористых материалов-носителей на пористой карбоновой пленке на металлической сетке при помощи разбавленной суспензии.
В некоторых вариантах воплощения изобретения поры материала-носителя определяют пространство, имеющее объем от примерно 0,1 мл/г до примерно 5 мл/г материала-носителя. В некоторых вариантах воплощения изобретения объем пор составляет от примерно 0,2 мл/г до примерно 3 мл/г, например, от примерно 0,4 мл/г до примерно 2,5 мл/г, например, от примерно 1,0 мл/г до примерно 2,5 мл/г.
В некоторых вариантах воплощения изобретения уровень заполнения материала-носителя составляет до 70%, например, до 40% по массе, основываясь на общей массе материала-носителя и терапевтического агента. Уровень заполнения рассчитывается путем деления массы заполненного терапевтического агента на общую массу заполненного терапевтического агента и материала-носителя и умножением на 100. В некоторых вариантах воплощения изобретения уровень заполнения материала-носителя составляет более 10%, в частности, более 15%, более 20%, более 25%, более 30%, более 35%, более 40%, более 45% или более 50%. В некоторых вариантах воплощения изобретения уровень заполнения материала-носителя составляет менее 5%. Уровень заполнения может быть от примерно 5% до примерно 10%. В некоторых вариантах воплощения изобретения уровень заполнения материала-носителя составляет между примерно 10% и примерно 20%, между примерно 20% и примерно 30%, между примерно 30% и примерно 40%, между примерно 40% и примерно 50%, или между примерно 50% и примерно 60% по весу.
Объем заполнения устройств, описанных в настоящем документе, может быть рассчитан в показателях объема пор в пористом материале, занятом терапевтическим агентом. Процент от максимального объема заполнения, который занят терапевтическим агентом (который является процентом от общего объема пор в пористом материале-носителе, занимаемом терапевтическим агентом) для материалов-носителей в соответствии с изобретением может составлять от примерно 30% до примерно 100%, например, от примерно 50% до примерно 90%. Для любого данного материала-носителя эта величина может быть определена делением объема терапевтического агента, поглощенного во время заполнения, на свободный объем материала-носителя до заполнения и умножением на сто.
В некоторых вариантах воплощения изобретения устройства согласно изобретению являются частицами, которые, измеренные при наибольшем диаметре, имеют средний размер от примерно 1 до примерно 500 мкм, например, примерно от 5 до примерно 100 мкм. В некоторых вариантах воплощения изобретения одно устройство, измеренное при своем наибольшем диаметре, составляет от примерно 1 до примерно 500 мкм, например, примерно от 5 до примерно 500 мкм.
Для увеличения скорости заполнения частиц согласно изобретению предпочтительным может быть использование относительно малых частиц. Поскольку меньшие частицы имеют поры с меньшей глубиной, на которую проникает терапевтический агент, количество времени, необходимое для заполнения частицами, может быть снижено. Это может быть особенно предпочтительными, если диаметры пор имеют одинаковые размеры с молекулярными диаметрами или размером терапевтических агентов. Меньшие частицы могут быть 1-20 мкм, например, примерно 10-20 мкм, например, примерно 15-20 мкм, измеренные при наибольшем размере.
В некоторых аспектах, более 60%, более 70%, более 80% или более 90% частиц имеют размер частиц 1-20 мкм, предпочтительно 5-15 мкм, измеренный при наибольшем размере. Частицы могут иметь средний размер между 1 и 20 мкм, например, между 5-15 мкм или примерно 15 мкм, примерно 16 мкм, примерно 17 мкм, примерно 18 мкм, примерно 19 мкм.
Распределение размера частиц, в том числе средний диаметр частиц, может быть измерено, например, при помощи анализатора размера частиц Malvern, модель Mastersizer, от Malvern Instruments, Великобритания. Через оптическую кювету, содержащую суспензию материала-носителя, может быть спроецирован гелий-неоновый лазерный луч. Лучи света, падающие на материал-носитель, рассеиваются по углам, которые обратно пропорциональны размеру частиц. Матрица фотодетектора измеряет интенсивность света в нескольких заданных углах, и электрические сигналы, пропорциональные измеренным значениям светового потока, затем обрабатываются системой микрокомпьютера по отношению к точечной модели, рассчитанной от показателей преломления образца материала-носителя и водного диспергатора.
Более крупные устройства/имплантаты также предусмотрены для контролируемой доставки терапевтических агентов. Устройства/имплантаты согласно изобретению могут иметь средний размер от примерно 1 мм до примерно 5 см, измеренный при наибольшем размере. В некоторых вариантах воплощения изобретения устройства/имплантаты имеют средний размер от примерно 5 мм до примерно 3 см, измеренный при наибольшем размере. Имплантаты более 1 мм, измеренные при наибольшем размере, могут быть полезны для внутримышечной, подкожной, интравитреальной или подкожной доставки лекарственного средства.
В некоторых вариантах воплощения изобретения пористые материалы-носители, описанные в настоящем документе, используют для стабилизации чувствительных терапевтических соединений, таких как биомолекулы, например, антитела. В некоторых вариантах воплощения изобретения биомолекулы, которые частично или полностью нестабильны при повышенных температурах, например, при комнатной температуре или выше, могут быть стабилизированы при комнатной температуре в течение длительных периодов времени. Биомолекулы могут быть внесены в материал-носитель, вследствие чего водная суспензия биомолекул, введенная в материал-носитель, является более стабильной, чем соответствующий водный раствор биомолекулы (то есть идентичный водный раствор с добавлением и без добавления пористого материала-носителя). Например, биомолекула в материале-носителе может иметь период полураспада при комнатной температуре (например, примерно 23°C), который превышает период полураспада биомолекулы без материала-носителя при тех же условиях. В некоторых вариантах воплощения изобретения биомолекула в порах материала-носителя имеет период полураспада, который, по меньшей мере, в два раза превышает этот показатель для биомолекулы вне материала-носителя в тех же условиях, более предпочтительно, по меньшей мере, в пять раз, по меньшей мере в 10 раз, по меньшей мере в 15 раз, по меньшей мере в 20 раз, по меньшей мере в 30 раз, по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз или по меньшей мере в 100 раз до тех пор, пока биомолекула находится за пределами материала-носителя. Например, антитело в порах материала-носителя может иметь период полураспада, который по меньшей мере в 10 раз превышает данный показатель для антитела вне материала-носителя, более предпочтительно, превышает его по меньшей мере в 20 раз.
Также биомолекулы могут иметь более длительный срок хранения в порах материала-носителя, чем в соответствующем водном растворе, предпочтительно по меньшей мере в два раза дольше, по меньшей мере в пять раз дольше, по меньшей мере в 10 раз дольше, по меньшей мере в 20 раз дольше, по меньшей мере в 30 раз дольше, по меньшей мере в 40 раз дольше, по меньшей мере в 50 раз дольше, по меньшей мере в 60 раз дольше или по меньшей мере в 100 раз дольше. Например, антитело в порах материала-носителя может иметь больший срок хранения по сравнению с антителом вне материала-носителя, предпочтительно по меньшей мере в 10 раз дольше или по меньшей мере в 20 раз дольше.
В некоторых вариантах воплощения изобретения пористые устройства, содержащие материал-носитель и биомолекулу, такую как антитело, проявляют стабильность при температуре 25°C в течение по меньшей мере 15 дней или даже примерно 1 месяц. Дополнительно или необязательно, в некоторых вариантах воплощения изобретения заполненные антителом устройства являются стабильными при 25°C в течение по меньшей мере 6 месяцев, по меньшей мере одного года, по меньшей мере 1,5 лет, по меньшей мере 2 лет, по меньшей мере 2,5 лет, по меньшей мере 3 лет или по меньшей мере 4 лет. Стабильность может быть оценена, например, при помощи высокоэффективной эксклюзионной хроматографии (HPSEC) или сравнения биологической активности хранимых устройств, заполненных биомолекулами, по сравнению с образцом свежеизготовленных устройств, заполненных биомолекулами, или по сравнению с активностью устройств, определенной перед хранением. Активность антител, например, может быть измерена различными иммунологическими анализами, включая, например, твердофазный иммуноферментный анализ (ELISA) и радиоиммунный анализ. Предпочтительно, чтобы в конце периода хранения активность хранимых устройств составляла по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, по меньшей мере 99%, по меньшей мере 99,5%, по меньшей мере 99,8% или даже по меньшей мере 99,9% от активности соответствующих свежеизготовленных устройств. Соответственно изобретение предусматривает способы лечения, в которых устройства, заполненные биомолекулами, хранятся при 25°C в течение по меньшей мере 6 месяцев, по меньшей мере одного года, по меньшей мере 1,5 года, по меньшей мере 2 лет, по меньшей мере 2,5 лет, по меньшей мере 3 лет или по меньшей мере 4 лет перед введением устройств пациенту.
Изобретение дополнительно включает способы стабилизации биомолекул. Способы согласно изобретению включают загрузку биомолекул в поры материала-носителя посредством любого подходящего способа для формирования устройств согласно изобретению.
Способы изготовления
Изобретение также описывает способы изготовления кремниевых устройств. В некоторых вариантах воплощения изобретения пористый кремниевый материал-носитель может быть изготовлен синтетическим путем. Например, пористый кремнезем может быть синтезирован взаимодействием тетраэтоксисиликата с матрицей, сделанной из мицеллярных стержней. В некоторых вариантах воплощения изобретения результатом является отбор сфер или стержней, которые заполнены регулярным расположением пор. Затем матрица может быть удалена, например, путем промывки растворителем, доведенным до надлежащего pH. В некоторых вариантах воплощения изобретения пористый кремниевый материал-носитель может быть изготовлен с использованием золь-гель способа или способом распылительной сушки. В некоторых вариантах воплощения изобретения при изготовлении материала-носителя используются один или более способов, пригодных для изготовления пористого кремниевого материала.
Поры могут быть введены в кремниевый материал-носитель при помощи таких способов как анодирование, травление красителем или электрохимическое травление. В примерном варианте воплощения изобретения анодирование использует платиновый катод и кремнеземную анодную пластину, погруженные в электролит фтористого водорода (HF). Коррозия анода, продуцирующая поры в материале, генерируется путем пропускания электрического тока через ячейку. В конкретных вариантах воплощения изобретения пропускание постоянного тока (ПК), как правило, применяется для обеспечения устойчивой концентрации HF на наконечнике, что дает более однородный пористый слой.
В некоторых вариантах воплощения изобретения поры вводят в кремниевый материал-носитель путем травления фтористоводородной кислотой, азотной кислотой и водой. В некоторых вариантах воплощения изобретения используется комбинация одного или более реагентов для травления, например, фтористоводородной кислоты и азотной кислоты. В некоторых вариантах воплощения изобретения раствор фтористоводородной кислоты и азотной кислоты используются для формирования пор в кремниевом материале.
Пористость материала может быть определена путем измерения массы. Для определения любого одного или более объемов пор, размера пор, распределения размера пор и площади поверхности материала-носителя может быть использован BET анализ. Теория BET, названная путем комбинации инициалов фамилий авторов теории, относится к физической адсорбции молекул газа на твердой поверхности и служит в качестве основы важного аналитического способа измерения удельной площади поверхности материала (J. Am. Chem. Soc, v.60, p.309 (1938)). BET анализ может быть выполнен, например, на приборе Micromeritics ASAP 2000, производства Micromeritics Instrument Corporation, Norcross, Georgia. В примерной процедуре образец материала-носителя может быть дегазирован в вакууме при температурах, например, превышающих 200°C в течение периода времени, например, около 2 часов или более до измерения. В некоторых вариантах воплощения изобретения кривая распределения размера пор выстраивается из анализа адсорбционной ветви при изготовлении изотермы. Объем пор может быть собран в одной точке Р/Ро=0,985.
Один или более способов сушки могут быть использованы для изготовления пористых кремниевых материалов согласно изобретению. Например, для предотвращения растрескивания пористого кремниевого материала, материал может быть высушен сверхкритической сушкой, сушкой вымораживанием, сушкой пентаном или медленным испарением. Сверхкритическая сушка включает перегрев жидкостных пор выше критической точки во избежание поверхностного натяжения. Сублимационная сушка предусматривает замораживание и сублимацию любых растворителей в вакууме. Сушка пентаном использует вместо воды пентан как жидкость для сушки и как результат может уменьшить капиллярный стресс из-за более низкого поверхностного натяжения. Медленное испарение является способом, который может быть использован после обработки водой или этанолом и может быть эффективным в уменьшении плотности ловушек растворителя в материале.
Поверхность пористого кремниевого материала может быть модифицирована для проявления таких свойств, как повышенная стабильность, клеточная адгезия или биосовместимость. Необязательно материал может быть подвергнут воздействию в окислительных условиях, например, посредством термического окисления. В примерном варианте воплощения изобретения процесс термического окисления включает нагревание кремниевого материала до температуры свыше 1000°C для обеспечения полного окисления кремниевого материала. Кроме того, поверхность материала-носителя может быть окислена так, что материал-носитель содержит каркас элементного кремния, который частично, по существу или полностью покрыт окисленной поверхностью, такой как поверхность диоксида кремния.
Поверхность пористого кремниевого материала или его часть могут быть дериватизированы. В примерном варианте воплощения изобретения поверхность пористого кремниевого материала может быть модифицирована органическими группами, такими как алканы или алкены. В конкретном варианте воплощения изобретения поверхность материала-носителя может быть модифицирована путем гидросилилирования кремния. В конкретных вариантах воплощения изобретения дериватизированные материалы-носители могут функционировать в качестве биоматериалов, внедренных в живую ткань.
Любое одно или более электростатических взаимодействий, капиллярных действий и гидрофобных взаимодействий могут способствовать заполнению терапевтическим агентом пор материала-носителя. В некоторых вариантах воплощения изобретения материал-носитель и терапевтические молекулы помещены в раствор, и большие молекулы, например, белки или другие антитела, переносятся из раствора в поры материала-носителя, напоминающие способности молекулярного сита пропускать воду из органической жидкости. Гидрофобные лекарственные средства могут лучше подходить для заполнения материалов-носителей, которые преимущественно формируются из кремния (например, более 50% материала составляет кремний), в то время как гидрофильные лекарственные средства могут лучше подходить для заполнения материала-носителя, который главным образом характеризуется как кремнеземный (например, более 50% материала-носителя составляет кремнезем). В некоторых вариантах воплощения изобретения заполнение большими молекулами пор материала-носителя обусловлено внешними факторами, такими как обработка ультразвуком или теплом. Материал-носитель или его часть могут иметь электростатический заряд, и/или терапевтический агент или его часть могут иметь электростатический заряд. Предпочтительно, чтобы материал-носитель или его часть имел противоположный электростатический заряд от терапевтического агента или его части, в результате чего адсорбция терапевтического агента в поры материала-носителя облегчена притягивающимися электростатическими силами. В некоторых вариантах воплощения изобретения терапевтический агент или материал-носитель может сам по себе не иметь электростатического заряда, но вместо этого поляризуется и имеет модифицированную полярность в непосредственной близости от материала-носителя или терапевтического агента, соответственно, что способствует адсорбции терапевтического агента в поры материала-носителя.
Материал-носитель может содержать покрытие или модификацию поверхности для привлечения терапевтического агента в поры. В некоторых вариантах воплощения изобретения материал-носитель покрыт или полностью или частично модифицирован материалом, содержащим остатки, которые заряжены для привлечения белка или антитела в поры материала-носителя. В других вариантах воплощения изобретения остатки могут быть присоединены непосредственно к материалу-носителю. Например, аминогруппы могут быть ковалентно присоединены к поверхности материала-носителя так, что при протонировании при физиологическом pH, поверхность материала-носителя несет положительный заряд, тем самым, например, привлекая белок или антитело с отрицательно заряженной поверхностью. В других вариантах воплощения изобретения материал-носитель может быть модифицирован остатками карбоновых кислот так, что при депротонировании при физиологическом pH материал-носитель несет отрицательный заряд, тем самым привлекая в поры белки или антитела с положительно заряженными поверхностями.
В некоторых вариантах воплощения изобретения материал-носитель может быть материалом, отличным от пористого кремнезема. Хотя кремниевые материалы являются предпочтительными материалами-носителями для использования в настоящем изобретении, дополнительные биоразлагаемые материалы с определенными свойствами (например, пористостью, размером пор, размером частиц, характеристиками поверхности, биоразлагаемостью и рассасыванием), схожими с описанными в настоящем документе кремниевыми материалами, могут быть использованы в настоящем изобретении. Примерами дополнительных материалов, которые могут быть использованы в качестве материалов-носителей, являются биоразлагаемая керамика, биоразлагаемые оксиды металлов, биоразлагаемые полупроводники, костный фосфат, фосфаты кальция (например, гидроксиапатит), другие неорганические фосфаты, пористая сажа, карбонаты, сульфаты, алюминаты, бораты, алюмосиликаты, оксид магния, оксид кальция, оксиды железа, оксиды циркония, оксиды титана и другие аналогичные материалы. Многие из этих пористых материалов могут быть изготовлены с использованием способов (например, сборки на матрице, окисления, сушки и модификации поверхности), которые аналогичны вышеупомянутым способам, используемым для изготовления пористых кремниевых материалов-носителей.
В некоторых вариантах воплощения изобретения терапевтический агент может быть включен в материал-носитель после полного формирования материала-носителя.Кроме того, терапевтический агент может быть включен в материал-носитель на одной или более стадий изготовления материала-носителя. Например, терапевтический агент может быть введен в материал-носитель до стадии сушки материала-носителя или после сушки материала-носителя, или на обоих стадиях. В некоторых вариантах воплощения изобретения терапевтический агент может быть введен в материал-носитель после этапа термического окисления материала-носителя. В некоторых аспектах терапевтический агент вводят в качестве конечного этапа изготовления устройств.
Более чем один терапевтический агент может быть включен в устройство. В некоторых таких вариантах воплощения изобретения каждый терапевтический агент может быть индивидуально выбран из малых органических молекул и больших молекул, таких как белки и антитела. Например, глазной имплантат может быть импрегнирован двумя терапевтическими агентами для лечения глаукомы или одним терапевтическим агентом для лечения макулярной дегенерации и другим агентом для лечения глаукомы.
В некоторых аспектах, например, когда как низкомолекулярные терапевтические агенты, так и высокомолекулярные терапевтические агенты, такие как белки, включены в устройство, терапевтические агенты могут быть введены в материал-носитель на различных стадиях изготовления устройства. Например, низкомолекулярное лекарственное средство может быть введено в материал-носитель перед этапом окисления или сушки, и высокомолекулярный терапевтический агент может быть введен после этапа окисления или сушки. Аналогичным образом, несколько различных терапевтических агентов одного и того же или разных типов могут быть введены в готовый материал-носитель в различных порядках или по существу одновременно. Когда материал-носитель содержит один материал или комбинацию нескольких материалов с несколькими размерами пор, больший терапевтический агент предпочтительно добавляют к материалу-носителю перед добавлением меньшего терапевтического агента во избежание заполнения более крупных пор меньшим терапевтическим агентом и препятствия адсорбции большего терапевтического агента. Например, если материал-носитель содержит один материал или комбинацию нескольких материалов, имеющих некоторые четко определенные поры примерно 6 нм в диаметре (то есть которые пригодны для молекул с молекулярной массой от примерно 14000 до 15000 а.е.м.) и некоторые хорошо определенные поры, которые имеют примерно 10 нм в диаметре (то есть которые пригодны для молекул с молекулярной массой от около 45000 до 50000 а.е.м.), последний терапевтический агент (то есть агент с молекулами с молекулярной массой от примерно 45000 до 50000 а.е.м.) предпочтительно добавляют к материалу-носителю перед добавлением меньшего терапевтического агента (то есть агента с молекулами с молекулярной массой от примерно 14000 до 15000 а.е.м.). Необязательно и дополнительно в варианте воплощения изобретения, в котором два различных пористых материала вместе составляют устройство, каждый материал-носитель может быть отдельно заполнен различным терапевтическим агентом, а затем материалы-носители могут быть объединены с изготовлением указанного устройства.
Терапевтический агент может быть введен в материал-носитель в смеси или растворе с одним или более фармацевтически приемлемыми наполнителями. Терапевтический агент может быть изготовлен для введения любым подходящим способом, например, в виде имплантата, предпочтительно для подкожного, внутримышечного, внутрибрюшинного или эпидермального введения или для имплантации в орган (например, глаз, печень, легкое или почку). Терапевтические агенты согласно изобретению могут быть изготовлены для парентерального введения в виде инъекции, например, для внутриглазного, внутривенного, интраваскулярного, подкожного, внутримышечного или инфузионного, либо перорального введения.
В некоторых вариантах воплощения изобретения пористый кремниевый материал-носитель заполняется одним или более терапевтическими агентами в пункте обслуживания, например, в кабинете врача или в больнице, до введения имплантата. Например, пористый кремниевый материал-носитель может быть заполнен терапевтическим агентом в малый промежуток времени перед введением, например, за 24 часа или менее до введения, за 3 часа или менее до введения, за 2 часа или менее до введения, за 1 час или менее до введения или за 30 минут или менее до введения.
Материал-носитель может быть в любой подходящей форме перед заполнением терапевтическим агентом, например, в виде сухого порошка или частиц или в форме водной суспензии, например, с использованием буферного раствора или другой фармацевтически приемлемой жидкости. Терапевтический агент может быть в любой подходящей форме перед заполнением материала-носителя, например, в растворе, в суспензии или в форме твердого вещества, такой как лиофилизат. Материал-носитель и/или терапевтический агент могут быть изготовлены с другими компонентами, такими как наполнители, консерванты, стабилизаторы или терапевтические агенты, например, антибиотики.
В некоторых вариантах воплощения изобретения материал-носитель может быть изготовлен (и упакован и/или распространен) уже заполненным биомолекулами, такими как белки или антитела, тогда как в других вариантах воплощения изобретения материал-носитель или композиция материала-носителя изготовлена (и упакована и/или распространена) такой, что по существу не содержит биомолекул, например, содержит менее 5% биомолекул или менее 2% биомолекул, например, для комбинации с биомолекулой во время введения.
В некоторых вариантах воплощения изобретения биомолекула является белком слияния. Белок слияния содержит, по меньшей мере, два полипептидных домена, которые обычно не являются соединены в природе. Например, полипептидные домены могут быть изготовлены от различных организмов или различных генов. В некоторых вариантах воплощения изобретения один такой домен имеет терапевтическую активность, а другой домен облегчает получение или улучшает фармакокинетические свойства. Широко используемые домены в белках слияния включают, но не ограничиваются ими, полигистидин, Глу-Глу, глутатион S-трансферазу (GST), тиоредоксин, белок А, белок G и константную область тяжелой цепи иммуноглобулина (Fc), белок, связывающий мальтозу (МВР), которые являются особенно полезными для выделения белков слияния при помощи аффинной хроматографии. Белки слияния могут также включать "эпитопные метки", которые обычно являются короткими пептидными последовательности, для которых имеется специфическое антитело, например, FLAG, гемагглютинин вируса гриппа (НА) и тэги с-myc. В некоторых вариантах воплощения изобретения полипептиды слияния могут иметь одну или более модификаций, которые способны стабилизировать полипептиды. Например, такие модификации увеличивают период полужизни полипептидов in vitro, увеличивают период полужизни полипептидов в кровотоке или снижают протеолитическую деградацию полипептидов. В некоторых вариантах воплощения изобретения линкерная область расположена между двумя полипептидными доменами. Способы изготовления белков слияния хорошо известны. Один из способов представлен изготовлением гибридного гена,, при этом клетка-хозяин регулирует экспрессию белка слияния. В качестве другого примера, возможно изготовить один или более полипептидных доменов отдельно, а затем ковалентно связать домены, используя химический кросс-линкер.
Терапевтический агент может быть изготовлен (и упакован и/или распространен) в виде раствора с концентрацией >50 мг/мл, например, >60 мг/мл, например, >75 мг/мл. В примерном варианте воплощения изобретения терапевтический агент является бекацизумабом, и бекацизумаб может быть изготовлен с концентрацией >50 мг/мл, например, >60 мг/мл, например, >75 мг/мл, например, в фосфатно-буферном растворе. Терапевтический агент может быть изготовлен (и упакован и/или распространен) с поверхностно-активным веществом, в котором терапевтический агент имеет максимальную концентрацию 50 мг/мл. Фрагмент белка, например, фрагмент антитела, может быть изготовлен (и упакован и/или распространен) в виде раствора с концентрацией >10 мг/мл, >15 мг/мл или >20 мг/мл.
Терапевтический агент может быть изготовлен (и упакован и/или распространен) со стабилизаторами, наполнителями, поверхностно-активными веществами или консервантами. В конкретных вариантах воплощения изобретения терапевтический агент изготовлен (и упакован и/или распространен) по существу без любого одного или более стабилизаторов, наполнителей, поверхностно-активных веществ и консервантов, например, содержит менее 1 мг/мл или предпочтительно менее 0,1 мг/мл стабилизатора, наполнителей, поверхностно-активного вещества или консерванта. Композиция терапевтического агента может содержать менее 1 мг/мл поверхностно-активных веществ, например, менее 0,1 мг/мл поверхностно-активных веществ.
В некоторых вариантах воплощения изобретения материал-носитель может быть реализован и/или распространен предварительно заполненным в любую часть шприца, например в цилиндр шприца или иглу шприца, в любой подходящей форме, например, в виде сухого порошка или частиц, либо в виде суспензии (например, в комбинации с биосовместимой жидкостью, такой как водный раствор). Предварительно заполненный шприц может содержать другие компоненты в дополнение к материалу-носителю, такие как наполнители, консерванты, терапевтические агенты, например, антибиотики или стабилизаторы. Предварительно заполненный шприц может включать биомолекулы, такие как белки и/или антитела, или может содержать раствор, который по существу не содержит биомолекул, например, менее 5% биомолекул или менее 2% биомолекул.
В некоторых вариантах воплощения изобретения пористый кремниевый материал-носитель заполнен одним или более терапевтическими агентами в цилиндре шприца. В конкретных вариантах воплощения изобретения материал-носитель находится в цилиндре шприца, как описано выше, или он может быть введен в шприц из отдельной емкости. Вместе с материалом-носителем в шприце, в шприц может быть введен раствор, содержащий один или более терапевтических агентов, тем самым контактируя с материалом-носителем. Кроме того, материал-носитель может быть введен в шприц после введения в цилиндр шприца терапевтического агента или его раствора. После объединения этих компонентов смесь инкубируют в течение определенного периода времени для заполнения пор материала-носителя терапевтическим агентом. В некоторых вариантах воплощения изобретения смесь инкубируют в течение примерно 3 часов или менее, примерно 2 часов или менее или примерно 1 часа или менее, например, примерно 30 минут, примерно 20 минут, примерно 10 минут или примерно 5 минут.
В некоторых вариантах воплощения изобретения устройство, такое как имплантат, может содержать покрытие для регулирования высвобождения терапевтического агента. Например, устройство может быть покрыто наполнителем, таким как масло какао, для изготовления желаемого профиля высвобождения терапевтического агента из устройства.
Способы применения
В некоторых вариантах воплощения изобретения устройства используются для предотвращения или лечения состояния пациента. Различные варианты воплощения изобретения, приведенные в настоящем документе, в общем созданы для доставки терапевтически эффективного количества терапевтического агента локально, т.е. в месте боли, болезни и т.д. пациенту. В некоторых вариантах воплощения изобретения устройства согласно изобретению могут быть доставлены в любой участок на поверхности или внутри тела пациента. Например, устройства согласно изобретению могут использоваться на поверхности кожи или глаза или могут быть имплантированы под кожу, в мышцу, в орган, прилегать к кости, внутри глаза или в любом другом месте, где контролируемое высвобождение терапевтического агента является благоприятным. Имплантат может быть введен в стекловидное тело, подкожно, субконъюнктивально, внутрибрюшинно, внутримышечно или субретинально. В некоторых вариантах воплощения изобретения имплантат согласно изобретению доставлен на поверхность глаза или внутрь глаза, например, в увеальный тракт глаза или в стекловидное тело глаза.
В некоторых вариантах воплощения изобретения устройства согласно изобретению используют для лечения внутриглазных заболеваний, таких как заболеваний задней части глаза. Примеры внутриглазных заболеваний включают глаукому, возрастную макулярную дегенерацию, такую как влажная форма возрастной макулярной дегенерации, диабетический макулярный отек, географическую атрофию, неоваскуляризацию сосудистой оболочки, увеит, диабетическую ретинопатию, ретиноваскулярное заболевание и другие виды дегенерации сетчатки.
В некоторых вариантах воплощения изобретения устройства согласно изобретению используют для лечения заболеваний на поверхности глаза. Примеры заболеваний включают вирусный кератит и хронический аллергический конъюнктивит.
В некоторых вариантах воплощения изобретения способ лечения глазного состояния включает размещение устройства на поверхности глаза или внутри глаза, например, в стекловидном теле или водянистой влаге камер глаза. В некоторых вариантах воплощения изобретения имплантат вставляют или хирургически вводят в глаз пациента. В некоторых вариантах воплощения изобретения имплантат вводится в глаз пациента, например, в стекловидное тело глаза. В некоторых вариантах воплощения изобретения имплантат вводят в виде композиции. В некоторых вариантах воплощения изобретения композиция устройства содержит несколько устройств. Композиция устройства может содержать устройства со средним размером от примерно 1 мкм до примерно 500 мкм. В некоторых вариантах воплощения изобретения композиция содержит устройства со средним размером устройства между 5 мкм и 300 мкм, например, между примерно 5 мкм и 100 мкм.
В некоторых вариантах воплощения изобретение относится к способу заполнения терапевтическим агентом пористого кремниевого материала-носителя перед введением пациенту, например, незадолго перед введением пациенту. Медицинский работник может изготовить терапевтический агент или агенты и кремниевый материал-носитель, например, вместе в пакете как часть набора или по отдельности. Терапевтический агент или агенты могут быть изготовлены в растворе, например, водном или органическом растворе, или как лиофилизат для восстановления или в любой другой подходящей форме.
Специалист-практик может вводить терапевтический агент или агенты в материал-носитель любым подходящим способом, например, путем инкубации агента и материала-носителя во флаконе или в цилиндре шприца, троакаре или игле. В конкретных вариантах воплощения изобретения, в которых материал-носитель заполняют терапевтическим агентом во флаконе, материал-носитель может быть инкубирован с терапевтическим агентом или агентами или его раствором во флаконе в течение определенного периода времени, например, менее 24 часов, менее 2 часов, менее 1 часа или даже примерно 30 минут или менее.
В других вариантах воплощения изобретения материал-носитель предварительно внесен в цилиндр шприца, и терапевтический агент или агенты или его раствор внесен в шприц, образуя смесь с материалом-носителем. Смесь в шприце возможно инкубировать в течение периода времени, такого как 30 минут или менее. В некоторых вариантах воплощения изобретения частицы стерилизуют на одной или более стадий изготовления устройств, например, непосредственно перед введением или перед заполнением шприца. В некоторых вариантах воплощения изобретения может быть использован любой подходящий способ стерилизации имплантатов при подготовке к имплантации.
В некоторых аспектах устройства согласно изобретению могут быть использованы для введения любого терапевтического агента в течение длительного времени пациенту, нуждающемуся в этом. Имплантаты согласно изобретению не ограничиваются глазным и внутриглазным использованием и могут быть использованы в любой части тела. Например, имплантаты согласно изобретению могут быть использованы для введения терапевтических агентов подкожно аналогично контрацептивному устройству Norplant. В других вариантах воплощения изобретения имплантаты согласно изобретению используются для введения биомолекул в течение длительного периода времени для лечения хронических заболеваний, таких как артрит. Например, имплантаты согласно изобретению могут быть использованы для доставки терапевтических агентов, таких как этанерцепт или адалимумаб пациентам, нуждающимся в этой терапии. Имплантаты согласно изобретению могут быть размещены в любой части тела, например, в мышце. Имплантат может содержать многократно рассеянные мелкие частицы, такие как многократно рассеянные частицы размером 500 мкм или менее. Имплантаты могут содержать более крупные частицы, например, более 500 мкм или одну или более частиц размером более 1 мм, например, более 10 мм.
Способ введения терапевтического агента может включать: а. создание шприца, предварительно заполненного пористым кремниевым материалом-носителем; б. контакт материала-носителя с терапевтическим агентом; и в. введение материала-носителя пациенту. Пористый кремниевый материал-носитель может быть предварительно внесен в любую часть шприца, такую как цилиндр шприца, вставка между иглой и цилиндром, или в иглу шприца. Пористый материал может быть предварительно внесен в часть шприца, которая может быть съемным образом соединена с другими частями шприца, например, с картриджем. Например, пористый кремниевый материал может быть предварительно внесен во вставку, которая может быть съемным образом прикреплена между цилиндром и иглой шприца, в которой оставшиеся части шприца выбраны из любых коммерчески доступных частей шприца. В таких вариантах воплощения изобретения вставка может содержать один или более фильтров для предотвращения выхода частиц из вставки, такие как проксимальный фильтр по отношению к точке соединения цилиндра с пористым материалом-носителем, расположенным между фильтром и иглой шприца. Фильтр может служить для вмещения материала-носителя, контактируя с терапевтическим агентом для заполнения пор материала-носителя терапевтическим агентом. Фильтр может быть затем удален, реверсирован, заменен или уничтожен для введения заполненного материала-носителя пациенту.
Пористый кремниевый материал может быть предварительно внесен в иглу шприца, отверстия которой могут быть заблокированы одним или более отключаемыми блоками или фильтрами, которые предотвращают выход частиц из иглы до тех пор, пока это не будет необходимым. Либо до, либо после заполнения материала-носителя терапевтическим агентом, блок может быть отключен для введения заполненного материала-носителя пациенту, например, через иглу. Предварительно заполненная игла может быть съемным образом соединена с любым коммерчески доступным цилиндром шприца или может быть прикреплена к цилиндру шприца.
Этап 6 описанного способа введения терапевтического агента может быть осуществлен путем внесения терапевтического агента в шприц, например, внесением терапевтического агента в смеси или растворе в цилиндр шприца. Терапевтический агент может быть малой молекулой или биомолекулой. Терапевтический агент может высвобождаться в пациенте в течение до четырех, шести или даже до двенадцати месяцев после введения. В некоторых вариантах воплощения изобретения терапевтический агент высвобождается в пациенте в течение периода от 1 месяца до 6 месяцев.
В некоторых вариантах воплощения изобретения устройство заполняется in vivo путем раздельного введения пациенту материала-носителя и терапевтического агента. Вначале пациенту вводится или материал-носитель, или терапевтический агент, или состав, содержащий материал-носитель или терапевтический агент. Затем в ту же часть тела пациента вводится материал-носитель или терапевтический агент, или состав, содержащий материал-носитель или терапевтический агент, который не был доставлен на первом этапе, что позволяет терапевтическому агенту адсорбироваться в поры материала-носителя. Адсорбция терапевтического агента в поры материала-носителя происходит в течение первых минут, часов или дней после второго этапа до тех пор, пока адсорбция терапевтического агента в поры материала-носителя не достигает равновесия с десорбцией агента из материала-носителя в окружающую среду, например, на поверхность или в тело пациента. После этого устройство может высвобождать терапевтически эффективное количество терапевтического агента в течение периода времени, превышающего первоначальный период повторного установления равновесия, например, часами, днями, неделями, месяцами или годами.
В некоторых вариантах воплощения изобретения имплантат вставляют или хирургически вводят подкожно. В других вариантах воплощения изобретения устройство доставляется пациенту внутривенно или внутрисуставно.
В некоторых вариантах воплощения изобретения композиция вводится перорально. Пероральное введение может быть использовано, например, для доставки активных агентов в желудок, тонкий кишечник или толстую кишку. Составы для перорального введения могут быть в форме капсул, крахмальных капсул пилюль, таблеток, пастилок (с использованием вкусовой основы, обычно сахарозы и камеди или трагаканта), порошков, гранул и тому подобного, каждый из которых содержит заранее определенное количество активного ингредиента. Твердые дозированные формы для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и тому подобное) могут содержать устройство и одно или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальция фосфат, и/или любой из следующих: (1) наполнители или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота, (2) связывающие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; (3) увлажнители, такие как глицерин; (4) дезинтегрирующие агенты, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) агенты, замедляющие растворение, такие как парафин; (6) ускорители абсорбции, такие как четвертичные аммониевые соединения; (7) смачивающие агенты, такие как, например, цетиловый спирт и моностеарат глицерина, (8) абсорбенты, такие как каолин и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и его смеси; и (10) окрашивающие агенты. В случае капсул, таблеток и пилюль фармацевтические композиции могут содержать также буферные агенты. Твердые композиции подобного типа могут также применяться в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких вспомогательных веществ как лактоза или молочные сахара, а также высокомолекулярных полиэтиленгликолей в массовом выражении и тому подобного. Пероральные композиции могут также включать подсластители, ароматизаторы, отдушки и консерванты.
В некоторых вариантах воплощения изобретения несколько имплантатов доставляются пациенту, например, два имплантата, три имплантата, четыре имплантата или пять имплантатов или более. Имплантаты могут быть по существу идентичны по размеру или композиции или могут иметь различные размеры, быть созданы из различных материалов-носителей или заполнены различными терапевтическими агентами. Несколько имплантатов могут быть введены пациенту одновременно или в течение определенного периода времени, и в одной или более частях тела пациента.
В некоторых вариантах воплощения изобретения терапевтический агент высвобождается из устройства в окружающую биологическую систему в течение нескольких дней, недель, месяцев или лет. В некоторых таких вариантах воплощения изобретения терапевтический агент высвобождается в течение выбранного периода времени от одного дня до двух лет, например, от двух недель до примерно одного года, например, от примерно одного месяца до примерно одного года. Устройство может высвобождать лекарственное средство в глаз в течение периода от 1 дня до 12 месяцев, например, от 1 дня до 6 месяцев, например, в течение периода от 1 недели до 3 месяцев. В некоторых вариантах воплощения изобретения терапевтический агент высвобождается в течение двух лет, например, в течение 18 месяцев, в течение 15 месяцев, в течение одного года, в течение 6 месяцев, в течение трех месяцев или даже в течение двух месяцев. В некоторых вариантах воплощения изобретения высвобождение терапевтического агента из устройства происходит контролируемым образом, так что большой процент от общего импрегнированного терапевтического агента не высвобождается немедленно или в течение короткого промежутка времени, например, в течение нескольких минут или часов после введения. Например, если желаемое время доставки лекарственного средства составляет 2 месяца, весь импрегнированный терапевтический агент может быть, например, высвобожден со скоростью примерно 1/60 импрегнированного терапевтического агента в день. В некоторых вариантах воплощения изобретения контролируемое высвобождение включает высвобождение терапевтического агента в течение, например, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев или 8 месяцев, при которых количество высвобожденного агента является линейным по отношению к полному объему доставки. В некоторых вариантах воплощения изобретения может быть «взрывной» эффект высвобождения терапевтического агента вскоре после введения, после чего по существу идет постоянное высвобождение в течение последующего периода времени. «Взрывной» эффект может продолжаться, например, 1-10 дней, в течение которых высвобождается процент заполненного лекарственного средства. После «взрыва» остаток терапевтического агента может постоянно высвобождаться в течение определенного периода времени. Например, в некоторых вариантах воплощения изобретения менее 10% терапевтического агента высвобождается на протяжении первого дня после введения, а еще 50% постоянно высвобождается в течение последующих 2-30 дней, например, по существу с постоянной скоростью высвобождения. В другом примерном варианте воплощения менее 10% терапевтического агента высвождается в первые 5 дней после введения, затем следует постоянное высвобождение 50% терапевтического агента в течение последующих 25 дней. По существу постоянное высвобождение означает, что скорость высвобождения терапевтического агента из устройства по существу постоянна в течение определенного периода времени.
В некоторых вариантах воплощения изобретения терапевтический агент начинает высвобождаться сразу после введения. В некоторых вариантах воплощения изобретения терапевтический агент высвобождается в течение периода примерно от 3 до 8 месяцев, например, в течение примерно 6 месяцев. В некоторых вариантах воплощения изобретения дополнительные устройства согласно изобретению вводятся пациенту в соответствующие периоды для обеспечения по существу непрерывного терапевтического эффекта. Например, последовательные дозы имплантата, высвобождающего лекарственное средство в течение шести месяцев, можно вводить два раза в год, то есть один раз каждые шесть месяцев.
Фармакокинетика может быть определена путем анализа сыворотки и стекловидного тела при помощи ИФА.
В некоторых вариантах воплощения изобретения устройство может полностью или частично биоразлагаться в биологической системе. В некоторых вариантах воплощения изобретения устройство может быть резорбировано биологической системой. В некоторых вариантах воплощения изобретения устройство может быть как биоразлагаемым, так и резорбируемым в биологической системе. В некоторых вариантах воплощения изобретения материал-носитель может быть частично биологически активным, благодаря чему материал вводится в живую ткань. В некоторых вариантах воплощения изобретения материал-носитель после имплантации по существу не минерализуется или не привлекает минеральные отложения. Например, в некоторых вариантах воплощения изобретения устройство-носитель по существу не кальцинируется при помещении in situ в месте, где кальцинация является нежелательной.
В некоторых вариантах воплощения изобретения устройство может биоразлагаться в биологической системе. В некоторых вариантах воплощения изобретения более чем примерно 80% материала-носителя будет подвергаться биоразложению в биологической системе, например, более чем примерно 85%, более чем примерно 90%, более чем примерно 92%, более чем примерно 95%, более чем примерно 96%, более чем примерно 97%, более чем примерно 98%, более чем примерно 99%, более чем 99,5% или даже более чем 99,9%). В некоторых вариантах воплощения изобретения, в которых материал-носитель биоразлагаем, он частично или полностью резорбируется.
В некоторых вариантах воплощения изобретения устройство может быть по существу биоразлагаемым в течение периода от 1 недели до 3 лет. В некоторых вариантах воплощения изобретения по существу биоразложение относится к разложению более чем 95% материала-носителя. В некоторых вариантах воплощения изобретения основное биоразложение происходит в течение периода от примерно 1 месяца до примерно 2 лет, например, от примерно 3 месяцев до 1 года. В некоторых вариантах воплощения изобретения основное биоразложение происходит в течение примерно 3 лет, например, в течение примерно 2 лет, в течение примерно 21 месяца, в течение примерно 18 месяцев, в течение примерно 15 месяцев, в течение примерно 1 года, в течение примерно 11 месяцев, в течение примерно 10 месяцев, в течение примерно 9 месяцев, в течение примерно 8 месяцев, в течение примерно 7 месяцев, в течение примерно 6 месяцев, в течение примерно 5 месяцев, в течение примерно 4 месяцев, в течение примерно 3 месяцев, в течение примерно 2 месяцев, в течение примерно 1 месяца, в течение примерно 3 недель, в течение примерно 2 недель, в течение примерно 1 недели или даже в течение примерно 3 дней. В некоторых вариантах воплощения изобретения, в которых материал-носитель биоразлагается, он частично или полностью резорбируется.
В некоторых вариантах воплощения изобретения степень биоразложения может быть оценена любым подходящим способом, используемым в данной области. В примерных вариантах воплощения изобретения биоразложение оценивают посредством анализа in vitro для идентификации продуктов деградации или гистологией in vivo и анализом. Кинетика биоразлагаемости пористого материала-носителя может быть оценена in vitro путем анализа концентрации основного продукта деградации в соответствующей жидкости тела. Для пористых кремниевых материалов-носителей в задней части глаза, например, продукт разложения может включать ортокремниевую кислоту, количественно определенную, например, при помощи анализа с синим молибдатом, и может быть смоделирована жидкость организма или реальное стекловидное тело. Кинетика биоразлагаемости in vivo может быть определена путем имплантации известного количества пористого кремниевого материала в соответствующий участок тела и мониторинга его сохранности во времени при помощи гистологического анализа в сочетании, например, со стандартными способами микроанализа.
Примеры
Материалы
Характеристики представленного на рынке пористого кремнезема
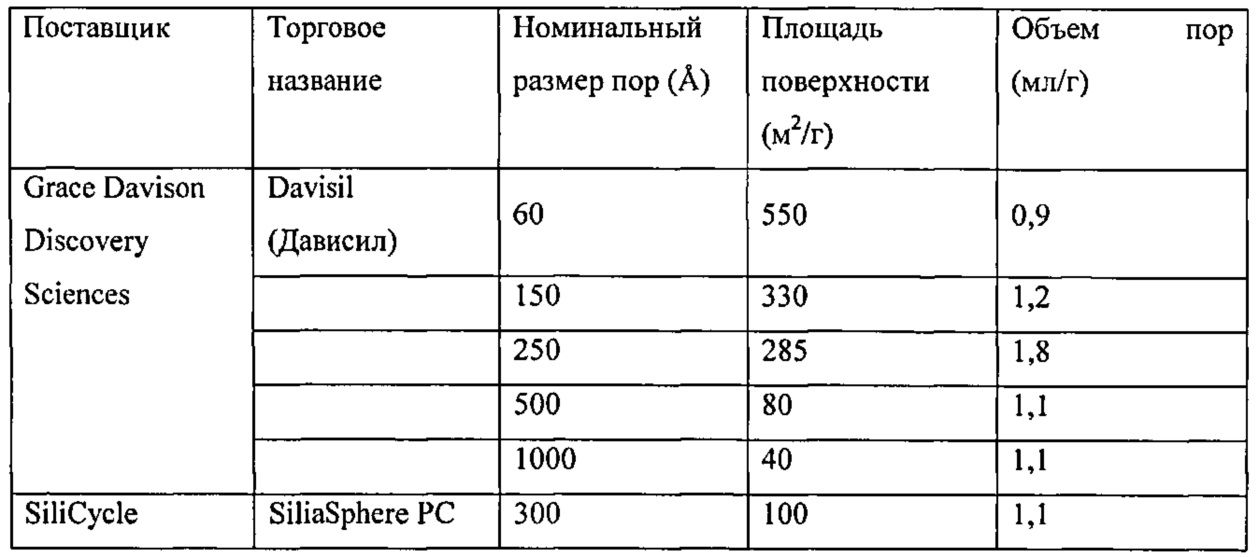
Пример 1
Для установления взаимосвязи между размером белка и необходимым размером пор для облегчения заполнения лекарственным средством, количество площади поверхности, занимаемое белком при адсорбции на однослойном покрытии коррелировало с суммарной площадью поверхности по отношению к данным размерам пор, изготовленным, основываясь на данных сорбции азота в ходе анализа Баррета-Джойнера-Халенды (BJH). Точка, в которой данные площади поверхности адсорбции белка стали эквивалентными совокупной общей площади поверхности, полученной путем анализа сорбции азота, определила минимальный доступный размер пор для облегчения адсорбционного заполнения. Данные в Таблице 1 описывают минимальные радиусы пор, доступные для диапазона размеров белков. Вычитание гидродинамического радиуса белка из минимального радиуса пор дает разницу белок-пора, которая является минимальным количеством дополнительного размера пор, необходимого для обеспечения доступа белка. Для диапазона исследованных белков средняя разница белок-пора составила 3,9 нм.
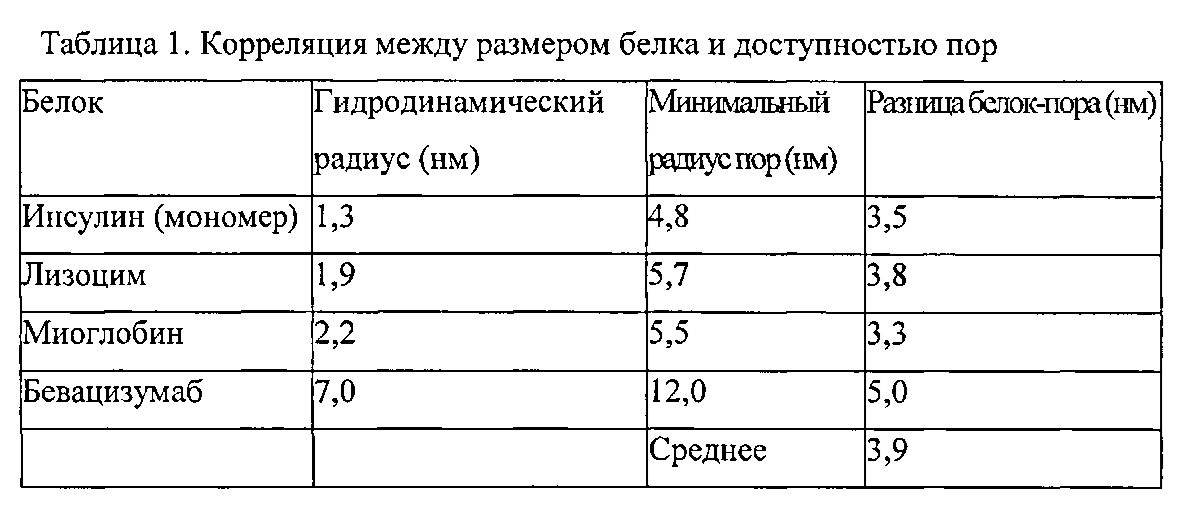
Пример 2
Кинетика адсорбции бевацизумаба в Davisil 250 Å была определена инкубированием 5 мг адсорбента с 25 мкл 25 мг/мл бевацизумаба в фосфатном буфере с pH 6,2 (Табл.2). После определенного времени установления равновесия к суспензии было добавлено 1,975 мл фосфатного буфера и перемешано способом инверсии в течение не более 30 секунд, и частицы удаляли фильтрацией через фильтр с размером пор 0,2 мкм. Количество белка в фильтрате было определено с использованием анализа ВСА (Thermo Scientific, США). Количество адсорбированного белка было рассчитано путем вычитания количества в фильтрате из начальной концентрации. В Таблице 2 представлена кинетика адсорбции для диапазона размеров частиц. Наименьший размер частиц 8,4 мкм (D50) продемонстрировал адсорбцию на уровне 95,6% в течение 30 минут по сравнению с 73,7% и 19,8% для 15,8 мкм (D50) и 54,5 мкм (D50), соответственно.

Пример 3
Изотермы адсорбции были изготовлены путем уравновешивания 1 мл лизоцима белка куриного яйца (Sigma) в концентрациях в пределах от 270 мкмоль до 1 мкмоль в 50 ммоль фосфатном буфере с pH 6,2 с 5 мг адсорбента. Через 16 ч количество оставшегося лизоцима в выравнивающем растворе было определено при помощи УФ-спектроскопии при 280 нм. Количество лизоцима, адсорбированного на адсорбенте, было затем отложено по отношению к уравновешивающей концентрации. Количество адсорбированного монослоя лизоцима и коэффициент адсорбции Ленгмюра (К) были оценены при помощи стандартных способов линейного преобразования.
Для измерения степени и скорости высвобождения лизоцима матрицы адсорбента были уравновешены при комнатной температуре в течение 16 часов с лизоцимом белка куриного яйца (Sigma) в 50 ммоль фосфатном буфере с pH 6,2 (табл.3). Количество высвобожденного лизоцима в 2 мл забуференного фосфатом физиологического раствора (pH 7,4), насыщенного SiCh, было измерено через определенный период время. В каждой временной точке образцы центрифугировали при 16300 g и удаляли 1 мл супернатанта и заменяли свежей средой. Количество высвобожденного лизоцима затем определяли при помощи высокоэффективной жидкостной хроматографии. Скорость высвобождения лизоцима коррелировала с размером пор адсорбента, а также интенсивностью взаимодействия между лизоцимом и адсорбентом, что определено коэффициентом адсорбции Лэнгмюра (К).

Пример 4
Лизоцим (белок куриного яйца, Sigma) был заполнен путем адсорбции в кремнеземные адсорбенты с увеличивающимся размером пор путем уравновешивания 50 мкл 25 мг/мл раствора с 10 мг адсорбента. Через 16 ч 3,95 мл забуференного фосфатом физиологического раствора (PBS; pH 7,4) или забуференного фосфатом физиологического раствора, насыщенного SiO2, добавляли, и суспензию инкубировали при 37°C. В каждой временной точке частицы осаждали путем центрифугирования при 16300 g и 2 мл супернатанта удаляли и заменяли 2 мл свежей среды. Количество лизоцима в растворителе затем определяли при помощи ОФ-ВЭЖХ. Кинетика высвобождения лизоцима была определена регрессионным анализом совокупного высвобождения по отношению к корню квадратному времени. Результаты приведены на Фиг.2 и в Таблице 4.
Изотермы адсорбции были изготовлены путем уравновешивания 1 мл лизоцима белка куриного яйца (Sigma) в концентрациях в пределах от 270 мкмоль до 1 мкмоль в 50 ммоль фосфатного буфера с pH 6,2 с 5 мг адсорбента. Через 16 ч количество лизоцима, оставшегося в выравнивающем растворе, было определено при помощи УФ-спектроскопии при 280 нм. Количество лизоцима, адсорбированного на адсорбент, затем было внесено на график по отношению к уравновешивающей концентрации. Количество адсорбированного монослоя лизоцима и коэффициент адсорбции Ленгмюра (К) были оценены при помощи стандартных способов линейного преобразования.
Эксперименты были проведены как в забуференном фосфатом физиологическом растворе, так и в насыщенном SiO2 забуференном фосфатом физиологическом растворе для демонстрации того, что высвобождение лизоцима происходит по двум механизмам. Насыщение забуференного фосфатом физиологического раствора SiO2 предотвращает растворение пористой кремнеземной матрицы. Таким образом, любое высвобождение лизоцима происходило через процесс десорбции. В забуференном фосфатом физиологическом растворе высвобождение лизоцима в результате комбинации матрицы объединило растворение и десорбцию. Результаты в Таблице 4 демонстрируют сопутствующее увеличение в десорбционном компоненте высвобождения лизоцима с увеличением размеров пор матрицы. Высказывается гипотеза, что скорость десорбции лизоцима обратно пропорциональна силе адсорбции между лизоцимом и пористой матрицей, что определено коэффициентом Ленгмюра.
Таблица 4. Скорость высвобождения лизоцима из кремнеземных адсорбентов в забуференном фосфатом физиологическом растворе и насыщенном SiO2 забуференном фосфатом физиологическом растворе.

а, % Десорбционного компонента, высвобождение лизоцима в насыщенном SiO2 PBS / высвобождение лизоцима в PBS × 100
Пример 5
Бевацизумаб был адсорбирован на кремнеземных адсорбентах с увеличивающимся размером пор путем уравновешивания 25 мкл 25 мг/мл раствора с 5 мг адсорбента. После 16 часов было добавлено 1,975 мл забуференного фосфатом физиологического раствора (pH 7,4) и суспензию инкубировали при 37°C. В каждой временной точке частицы удаляли путем центрифугирования при 16300 g и удаляли 1 мл супернатанта и заменяли 1 мл свежей среды (Фиг.3, таблица 5). Затем количество бевацизумаба в растворителе определяли анализом Micro ВСА (Thermo Scientific, США). Кинетика высвобождения бевацизумаба была определена при помощи регрессионного анализа совокупного высвобождения по отношению к корню квадратному времени. Результаты демонстрируют, что скорость высвобождения бевацизумаба увеличивается с увеличением размера пор адсорбента.

Пример 6
Кинетика адсорбции белка в пористый кремнезем с различным размером пор была определена путем инкубации 5 мг адсорбента с 25 мкл 25 мг/мл раствора белка в фосфатном буфере с pH 6,2. После определенного количества времени установления равновесия к суспензии было добавлено 1,975 мл фосфатного буфера и перемешано способом инверсии в течение не более 30 секунд, а частицы удаляли фильтрацией через фильтр с размером пор 0,2 мкм. Количество белка в фильтрате было определено использованием анализа ВСА (Thermo Scientific, США) в случае бевацизумаба, и ОФ-ВЭЖХ для лизоцима. Количество адсорбированного белка было рассчитано путем вычитания количества в фильтрате из начальной концентрации. Таблицы 5а, 5b, 6а и 6b демонстрируют кинетику адсорбции для диапазона размеров частиц и размеров пор пористого кремнезема.
Как для лизоцима, так и для бевацизумаба было очевидно, что увеличение размера пор матрицы способствовало большей скорости адсорбции белка. Результаты в таблицах 6а и 6b также демонстрируют, что уменьшение размера частиц способствовало увеличению скорости адсорбции белка.




Эквиваленты
Специалисты в данной области будут осведомлены или смогут определить с использованием стандартных способов экспериментов множество эквивалентов соединениям и способам их использования, описанным в настоящем документе. Такие эквиваленты включены в объем данного изобретения и описываются в нижеследующей формуле изобретения. Специалисты в данной области также определят, что все комбинации вариантов воплощения изобретения, описанные в настоящем документе, включены в объем изобретения.
Реферат
Группа изобретений относится к медицине. Описаны биоразлагаемые устройства, такие как имплантаты для контролируемой доставки терапевтических агентов, в частности больших молекул, таких как белки и антитела. Устройства содержат пористый кремниевый материал-носитель, импрегнированный терапевтическим агентом. Улучшенная лекарственная форма для контролируемого высвобождения терапевтических агентов может быть использована in vitro или in vivo для доставки терапевтического агента в течение предполагаемого периода времени, например нескольких дней, недель или месяцев. Устройство может быть использовано для лечения или предотвращения состояний пациента, таких как хронические заболевания. 5 н. и 14 з.п. ф-лы, 3 ил, 6 табл., 6 пр.

Комментарии