Способ прививки клеток печени субъекту с заболеванием или дисфункцией печени - RU2736955C2
Код документа: RU2736955C2
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается имплантации клеток.
Уровень техники
Согласно современным методикам при терапии клеточной трансплантацией донорские клетки вводят в организм хозяина через сосудистые пути, осуществляя стратегию, моделированную после гематопоэтической терапии. Однако терапия гематопоэтическими клетками осуществляется относительно легко, поскольку эти клетки находятся в суспензии и имеют врожденные свойства, которые поддерживают их возвращение к специфическим тканям-мишеням. Таким образом, многие тысячи исследований трансплантации субпопуляций гематопоэтических клеток имеют мало отношения к трансплантации клеток из плотных органов, таких как кожа или внутренние органы (например, печень, легкие, сердце). Действительно, когда клетки из плотных органов трансплантируют через сосудистые пути, их эффекты ослаблены из-за неэффективной имплантации, плохой приживаемости клеток и предрасположенности к образованию опасной для жизни эмболии. Следовательно, заболевания большинства плотных органов должны быть излечимы в будущем настолько успешно, насколько это возможно, при попытках использовать другие подходы к трансплантации.
Таким образом, настоящее изобретение направлено на способы трансплантации клеток из плотных органов по протоколам пересадки с помощью различных доступных стратегий.
Раскрытие изобретения
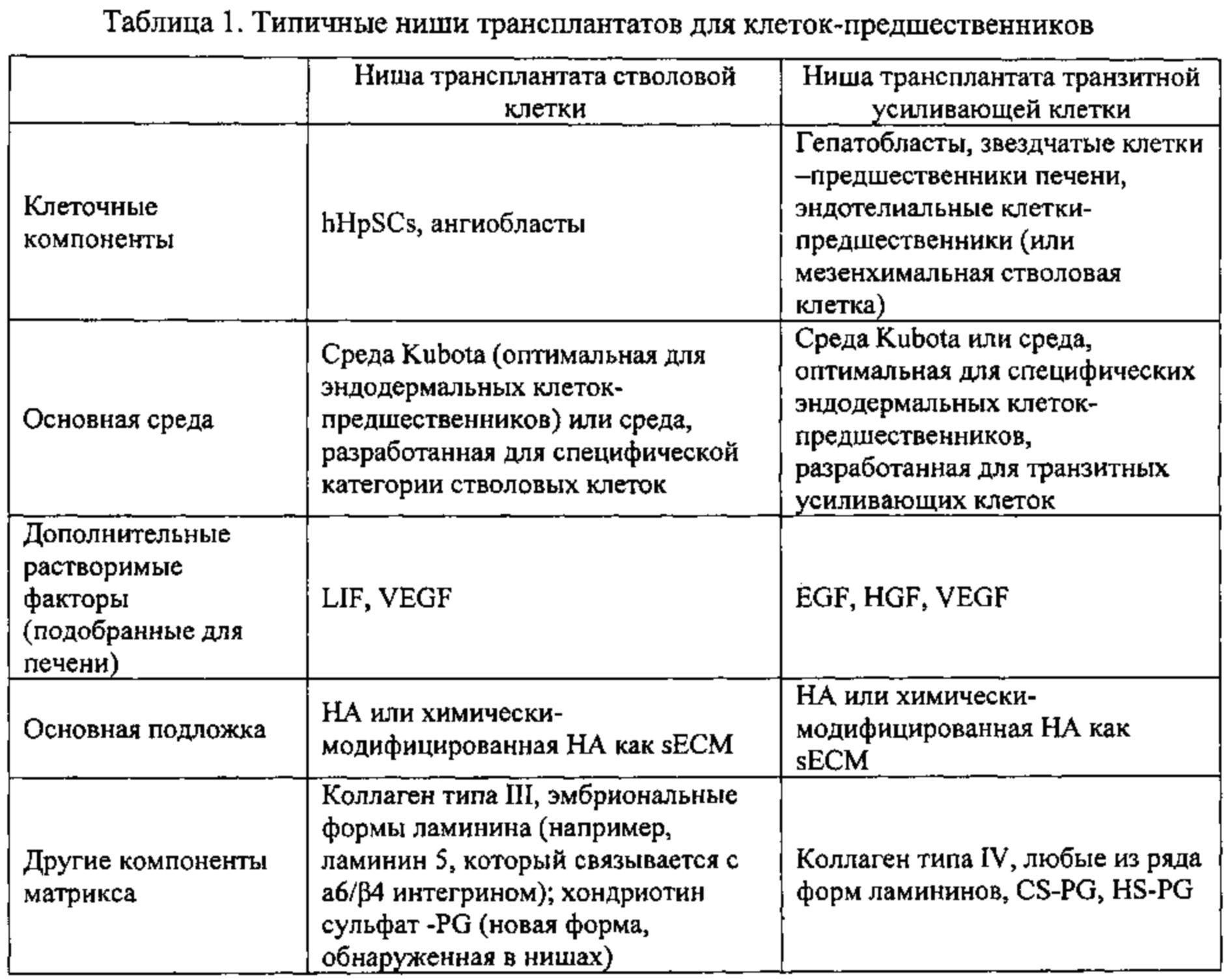
В одном воплощении настоящего изобретения предложен способ имплантации ткани внутреннего органа субъекту, у которого имеется повреждение или дисфункция внутреннего органа. Способ включает: (а) получение изолированных клеток внутреннего органа донора; (b) включение клеток в биоматериалы, содержащие компоненты внеклеточного матрикса, в некоторых случаях, в смеси с питательной средой и/или сигнальными молекулами (факторами роста, цитокинами, гормонами) и с) введение клеток в орган-мишень, где смесь клеток и гелей биоматериалов или загустителей помещают во внутренний орган или на его поверхность или в тот и другой отдел in vivo. В качестве внутренних органов могут служить печень, желчные протоки, поджелудочная железа, легкие, кишечник, щитовидная железа, простата, молочная железа, матка или сердце. Подходящие сигнальные молекулы - факторы роста и цитокины, которые могут включать, например, эпидермальный фактор роста (EGF), фактор роста гепатоцитов (HGF), фактор роста из клеток стромы (SGF), ретиноиды (например, витамин А), фактор роста фибробластов (FGF, например, FGF2, FGF10), фактор роста эндотелиальных клеток сосудов (VEGF), инсулиноподобный фактор роста I (IGF-I), инсулиноподобный фактор роста II (IGF-II), онкостатин М, фактор ингибирования лейкемии (LIF), трансферрин, инсулин, глюкокортикоиды, (например, гидрокортизон), гормон роста, любой из гипофизарных гормонов (например, гормон, стимулирующий фолликулы (FSH)), эстрогены, андрогены и тироидные гомоны (например, Т3 или Т4).
Для лечения поврежденных или не работающих органов донор клеток может не совпадать с реципиентом (аллотрансплантат) или может быть субъектом (аутологичным) с повреждением или дисфункцией внутреннего органа, обеспечивая получение нормальных клеток из той части внутреннего органа, которая не подвергнута повреждению или дисфункции. С целью создания модельной системы для исследования заболевания, донорские клетки могут иметь патологию и быть трансплантированными на/в нормальную ткань экспериментального животного
Клетки могут содержать стволовые клетки, зрелые клетки, ангиобласты, эндотелий, стволовые клетки мезенхимы (из любого источника), звездчатые клетки, фибробласты или их смеси. Кроме того, биоматериалы могут включать коллагены адгезионные молекулы (ламинины, фибронектины, нидогены), эластины, протеогликаны, гиалуронаны (НА), гликозаминогликановые цепи, хитозан, алгинат и синтетические, биодеградируемые и биосовместимые полимеры. Одним из предпочтительных материалов являются гиалуронаны.
Выделенные клетки внутреннего органа могут быть загущены ex vivo в биоматериалах перед введением клеток хозяину или, иначе, введены в виде жидкой субстанции, предоставив им загустевать in vivo. Предпочтительно, клетки вводят в поврежденную или дисфункциональную ткань, или вблизи нее, и введение может осуществляться путем инъекции, биодеградируемого покрытия или губки.
В другом воплощении настоящего изобретения предлагается способ восстановления ткани внутреннего органа у субъекта, страдающего от повреждения или дисфункции внутреннего органа. Способ включает (а) получение нормальных клеток внутреннего органа у донора; (b) соединение клеток с одним или несколькими биоматериалами; (с) в некоторых случаях соединение суспензии клеток с сигнальными молекулами (факторами роста, цитокинами), дополнительными клетками или их комбинациями; и (d) введение смеси (b) в организм субъекта, где смесь становится нерастворимой и образует трансплантат снаружи или внутри внутреннего органа in vivo.
Еще одно воплощение настоящего изобретения предлагает способ локализации клеток внутреннего органа на поверхности, во внутренней части или в обеих частях внутреннего органа-мишени, причем способ включает введение содержащего клетки препарата внутреннего органа и раствора одного или нескольких предшественников, образующих гидрогель, в присутствии эффективного количества кросс-линкера на поверхность внутреннего органа-мишени, в его внутреннюю часть или в обе части внутреннего органа-мишени in vivo, где препарат образует гидрогель, содержащий клетки внутреннего органа на поверхности, во внутренней части или в обеих частях внутреннего органа-мишени. Кроме того смесь содержит питательную среду, молекулы внеклеточного матрикса и сигнальные молекулы. Загустевшая смесь, такая как гидрогель, создает трансплантат во внутреннем органе как на его поверхности, так и в его внутренней части или в обеих частях.
Клетки могут быть локализованы за время, по меньшей мере, равное двенадцати часам, по меньшей мере, двадцати четырем часам, по меньшей мере, приблизительно сорока восьми часам или по меньшей мере, приблизительно 72 часам в/на внутреннем органе-мишени, который может быть печенью, поджелудочной железой, желчными протоками, легкими, щитовидной железой, кишечником, молочной железой, простатой, костью или почкой. При лечении пациентов донорские клетки внутренних органов не должны быть поврежденными клетками (например, опухолевыми или раковыми клетками). Однако поврежденные клетки могут участвовать в трансплантате при попытках создать экспериментальную модельную систему заболевания.
Биоматериалы, которые могут образовывать гидрогели или частично нерастворимый комплекс, могут включать гликозаминогликаны, протеогликаны, коллагены, ламинины, нидоген, гиалуронаны, модифицированный тиолом гиалуронат натрия, их денатурированные формы (например, желатин) или их комбинации. Триггером загустевания диакрилат может быть любой фактор, обеспечивающий поперечное связывание компонент матрикса или при возможности образование гелей. Кросс-линкер может содержать диакрилат полиэтилен гликоля или его производные, содержащие дисульфид. Предпочтительно нерастворимый комплекс клеток и биоматериалов обладает вязкостью в интервале от приблизительно 0,1 до приблизительно 100 kПа, предпочтительно от приблизительно 1 до е 10 kПа, более предпочтительно, от приблизительно 2 до приблизительно 4 kПа, и наиболее предпочтительно, обладает жесткостью от приблизительно 11 до приблизительно 3500 Па.
В еще одном воплощении настоящего изобретения предложен способ криоконсервирования клеток, включающий: (а) получение изолированных клеток; (b) соединение клеток с гель-образующими биоматериалами и, в некоторых случаях, одну или несколько изотонических базальных сред, сигнальных молекул (цитокинов, факторов роста, гормонов), и компонентов внеклеточного матрикса (например, гиалуронанов); и замораживание клеточной смеси, с целью ее хранения в морозильной камере при температурах от -90°C или -180°C. Изотоническая среда может быть CS10 (biolife) или эквивалентным изотоническим буфером для криоконсервирования. Сигнальные молекулы могут быть факторами роста и цитокинами и включают, например, эпидермальный фактор роста (EGF), фактор роста гепатоцитов (HGF), фактор роста из клеток стромы (SGF), ретиноиды (например, витамин А), фактор роста фибробластов (FGF, например, FGF2, FGF10), фактор роста эндотелиальных клеток сосудов (VEGF), инсулиноподобный фактор роста I (IGF-I), инсулиноподобный фактор роста II (IGF-II), онкостатин М, фактор ингибирования лейкемии (LIF), трансферрин, инсулин, глюкокортикоиды, (например, гидрокортизон), гормон роста, любой из гормонов гипофиза (например, гормон, стимулирующий фолликулы (FSH)), эстрогены, андрогены и тироидные гормоны (например, Т3 или Т4). Внеклеточные матриксные компоненты могут быть, гиалуронанами, коллагенами, адгезионными молекулами (ламининами, фибронектинами), протеогликанами, хитозаном, алгинатом и синтетическими, биодеградируемыми и биосовместимыми полимерами или их комбинациями.
Для криоконсервирования смесей клеток и биоматериалов их можно комбинировать с (i) криоконсервантом, выбранным из группы, состоящей из диметил сульфоксида (DMSO), глицерина, этилен гликоля, этилендиолэталендиола, 1,2-пропаендиола, 2,3-бутендиола, формамида, N-метилформамида, 3-метокси-1,2-пропандиола по отдельности и их комбинаций и/или (ii) добавки, выбранной из группы, состоящей из сахара, глицина, аланина, поливинилпирролидона, пирувата, ингибитора апоптоза, кальция, лактобионата, раффинозы, дексаметозона, восстановленных ионов натрия, холина, антиоксидантов, гормонов или их комбинации, а антиоксидантами могут быть витамин Е, витамин А, бета-каротин или их комбинации.
Краткое описание фигур
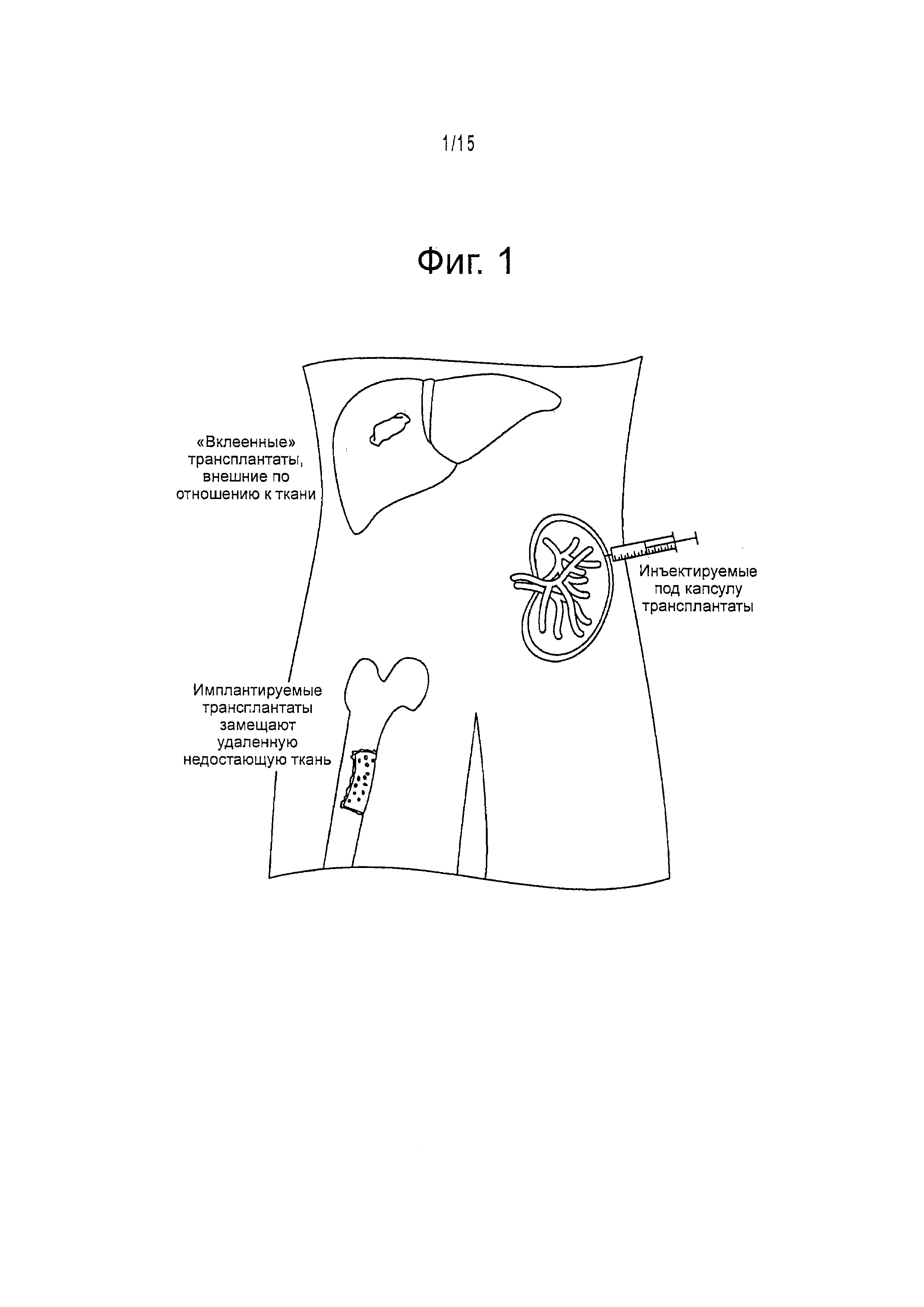
Фигура 1 - схематическое представление способов по данному изобретению трансплантации клеток в различные ткани-мишени. Эти способы включают имплантируемые трансплантаты, инъектируемые трансплантаты и трансплантаты, которые могут быть прикреплены к поверхности органа-мишени. («приклеенные трансплантаты»).
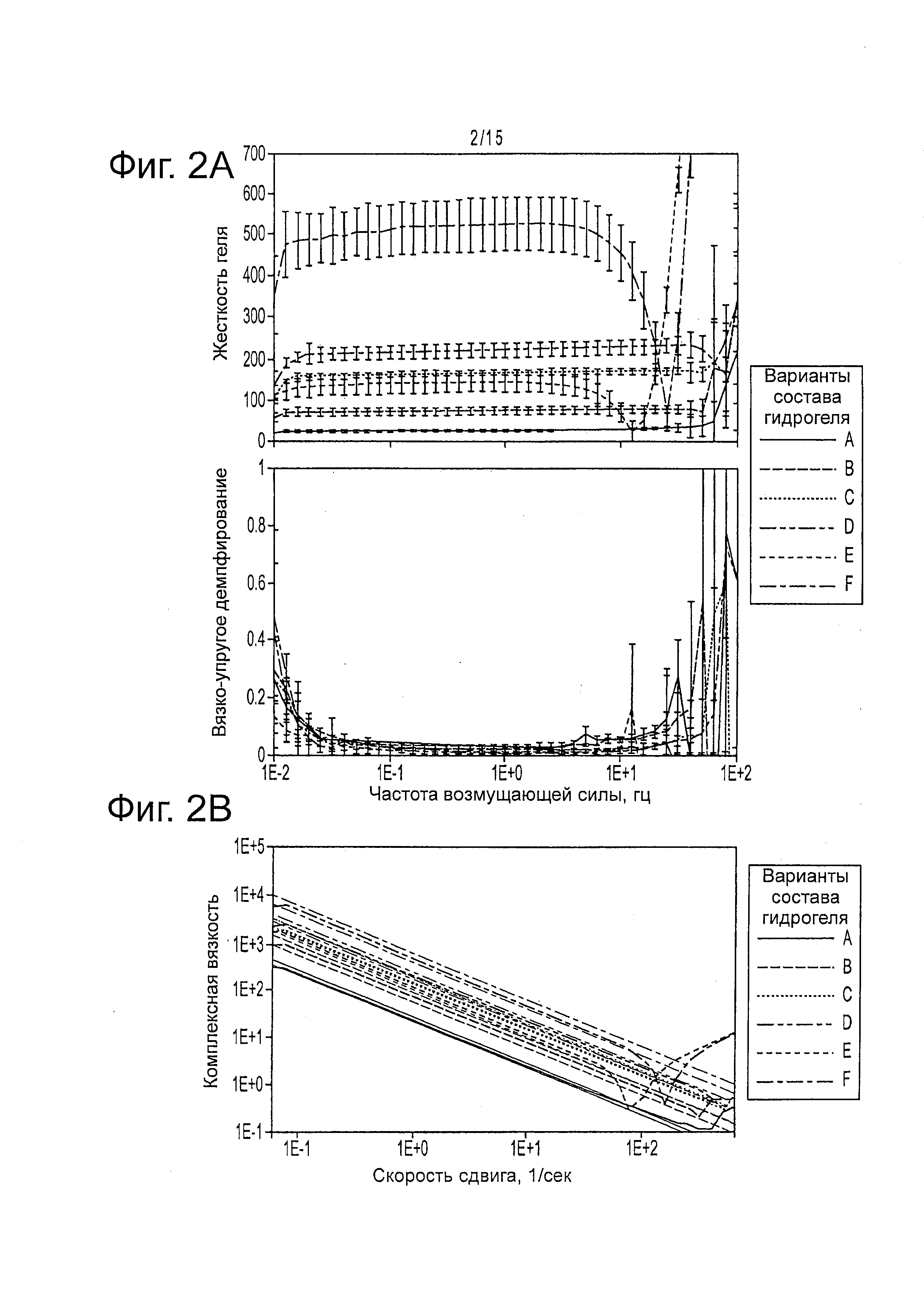
Фигура 2 предлагает реологические измерения на гиалуронанах, приготовленных с помощью среды Kubota Medium (KM-HA). а) Модули сдвига |G*| KM-HAs, измерение механической жесткости геля остаются постоянными, в то время как вязкоэластичное демпфирование |Gʺ/G'|, измерение деформации под действием внешней силы, пренебрежимо мало в интервале частот действующих сил 0,1 гц - 10 гц для каждой из исследованных композиций; значения погрешностей: 95% доверительный интервал измерений при каждой исследованной частоте. b) KM-HA демонстрируют сдвиговое утоньшение, то есть уменьшение вязкости при увеличении частот действующих сил, в экспериментальном интервале скоростей сдвига 0,6 1/сек - 60 1/сек [частоты действующих сил 0,1 гц - 10 гц]; верхний и нижний пределы: основанный на модели степенной зависимости 95% доверительный интервал (правило предположения Cox-Merz), R2>0.993 для всех композиций в интервале скоростей сдвига 0,3 1/сек - 30 1/сек [частоты действующих сил 0,05 гц - 5 гц]). Реологические измерения выполняли только по обозначенным буквами техникам, показанным в таблице 3.
Фигура 3 демонстрирует размер, морфологию и результаты пролиферации стволовых клеток печени человека (hHpSCs) в KM-HA. Колонии hHpSCs приобретают трехмерную конфигурацию и демонстрируют а) агломерацию сфероидного типа (внизу слева) или складки (в середине, наверху справа) при посеве на KM-HA [рисунки в рамке: 900 мкм × 1200 мкм]. Конфокальная микроскопия на гистологических срезах hHpSC, засеянных на КМ-НА, через 1 неделю культивирования обнаруживает клеточную морфологию смешанных фенотипов с размерами клеток b) приблизительно 7 мкм, или с) до 10-15 мкм среди паренхиматозных клеток [клеточное ядро при контрастном окрашивании DAPI синее, для b) и с) ядро ЕрСАМ красное, для b) CD44, или с) CDH1 зеленое; рисунки в рамке b) и с): 150 мкм × 150 мкм; выделенные белым участки изображения на b) и с): 15 мкм × 15 мкм]. d) Жизнеспособность hHpSC в KM-HA, измеренная с помощью метаболического восстановления AlamarBlue, демонстрирует функциональную репарацию и пролиферацию в KM-HA гидрогелях с 1,6% CMHA-S и 0,4% PEGDA (вариант среды Е, таблица 3) в течение 1 недели культивирования; Измерения восстановления AlamarBlue после 24 часов инкубации нормировали по отношению к измерениям через 2-3 дня после посева; результаты представлены как среднее ± стандартная ошибка.
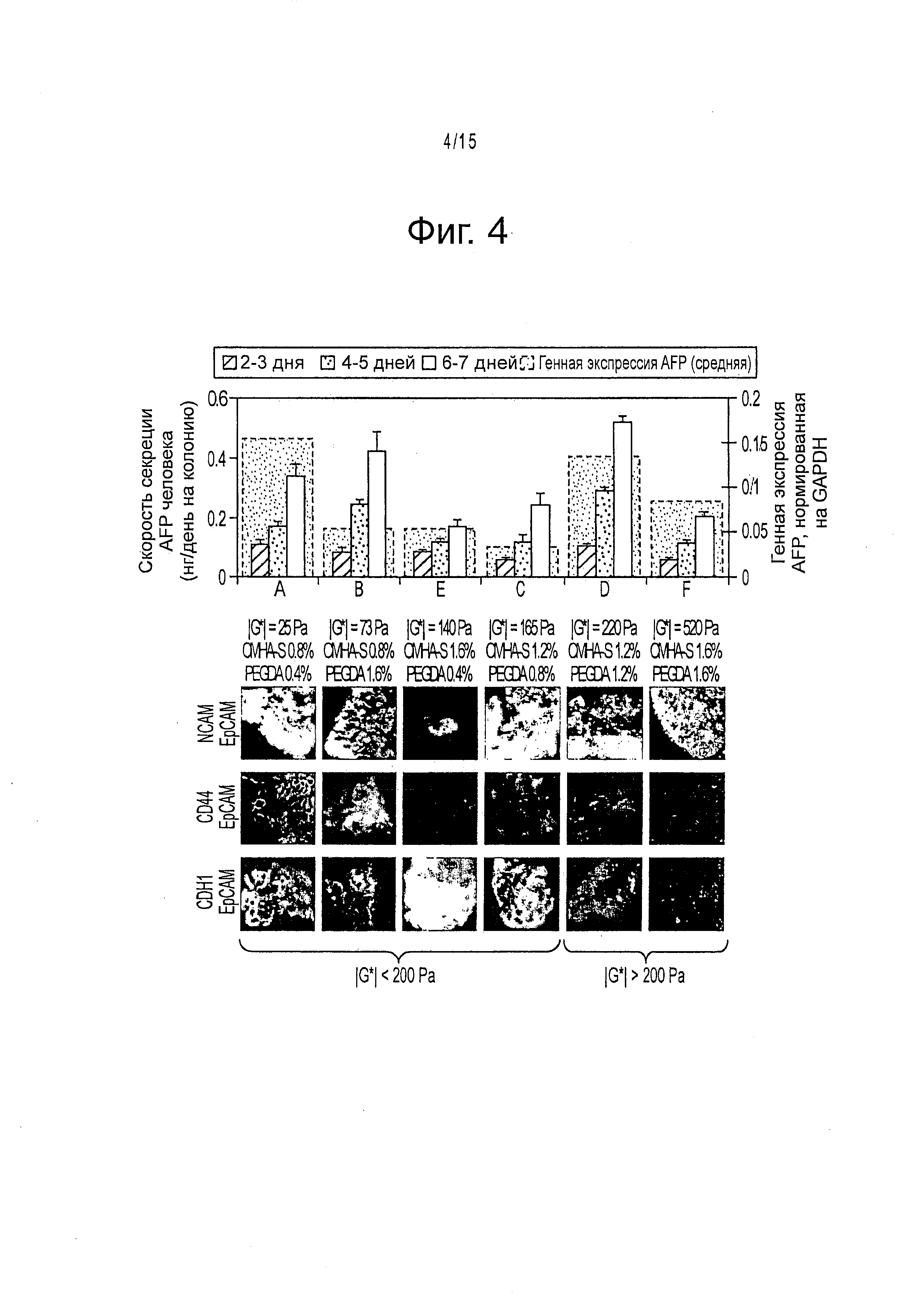
Фигура 4 демонстрирует экспрессию белков с помощью маркеров дифференцирования в среде KM-HA, засеянной hHpSC после 1 недели культивирования. В колониях hHpSC наблюдаются различные уровни экспрессии маркеров дифференцирования в hHpSC при уровне трансляции, зависящем от свойств KM-HA. Скорости метаболической секреции AFP человека коррелируют с экспрессией mRNA в культурах KM-HA. Экспрессия NCAM положительна во всех KM-HA, а экспрессия CD44 самая высокая в KM-HAs с содержанием CMHA-S 1,2% или меньше (обозначенные буквами варианты сред, А, В, С, D; таблица 3). Экспрессия CDH1 положительна для KM-HA гидрогелей с |G*|<200 Па и отрицательна для |G*|>200 Па. Данные по скорости секреции AFP человека приведены как среднее ± стандартная ошибка. Иммуногистохимическое окрашивание ЕрСАМ, NCAM, CD44 и CDH1 выполнено на 15-20 мкм срезах (~2 до 3 hHpSC толщиной; hHpSC диаметром: 5-7 мкм) и проявлено флуоресцентной микроскопией [изображения в рамках: 100 мкм × 100 мкм]. KM-HA композиции, упорядоченные относительно роста жесткости (|G*|=25 Pa for A, |G*|=73 Па для В, |G*|=140 Па для Е, |G*|=165 Па для С, |G*|=220 Па для D, и |G*|=520 Па для F).
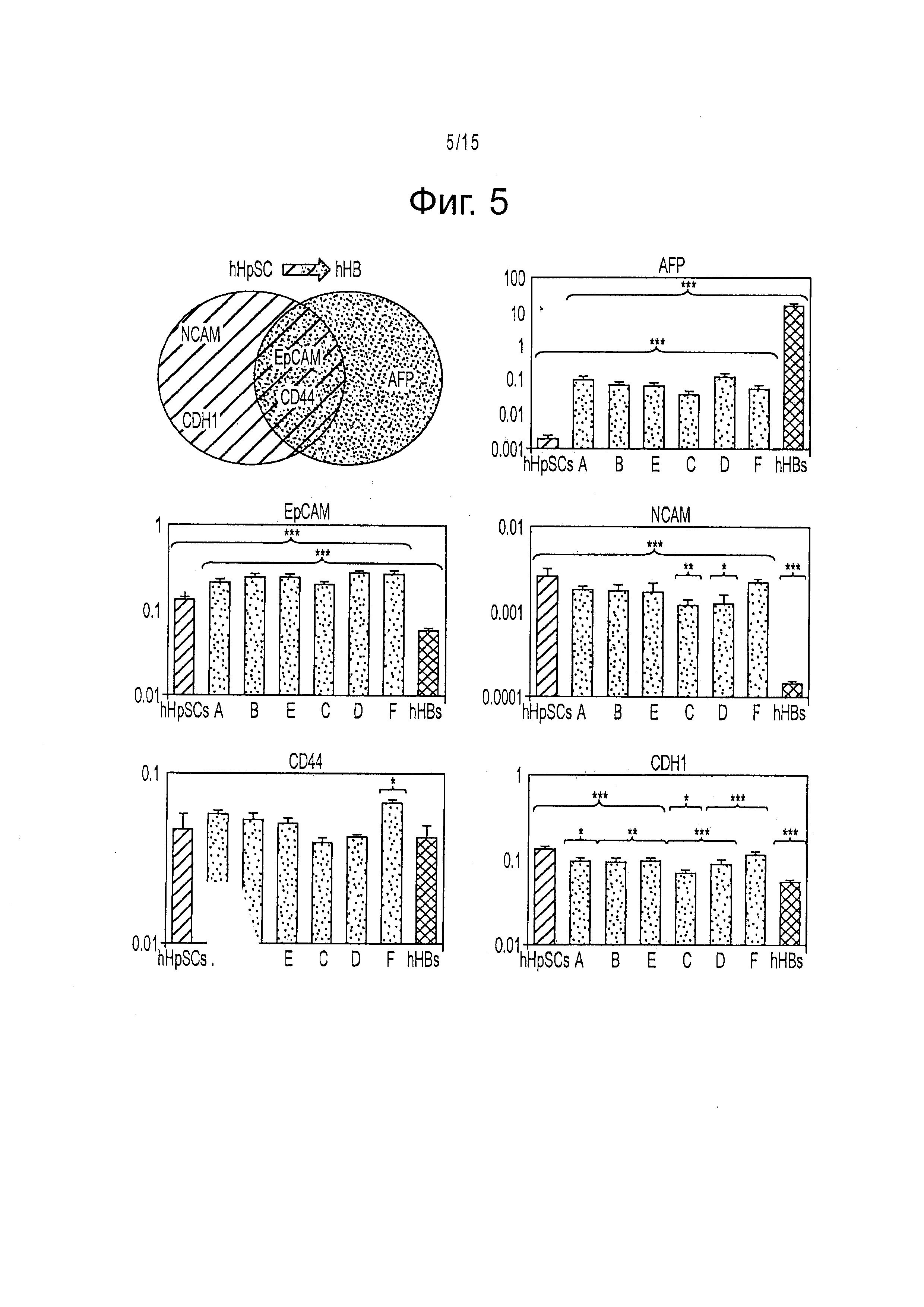
Фигура 5 представляет уровни экспрессии генов, полученные с помощью полимеразной цепной реакции qRT-PCR для маркеров предшественников гепатоцитов hHpSC, выращенных на KM-HA после 1 недели культивирования. Сравнение между уровнями экспрессии mRNA маркеров для hHpSC и их непосредственных потомков hHBs (гепатоспецифических AFP, ЕрСАМ, NCAM, CD44 и CDH1) показывают, что выращенные на KM-HA hHpSC быстро приобретают hHB характеристики на уровне транскрипции в пассивной культуре в течение 1 недели. Диапазоны экспрессии в hHpSC и в свежевыделенных hHBs для CD44 сравнимы; Уровни экспрессии для остающихся маркеров статистически различаются, причем уровень в ЕрСАМ уменьшается приблизительно вдвое, в CDH1 уменьшается втрое, наблюдается NCAM сайленсинг и обогащение AFP при дифференцировании hHpSC в hHB. Во всех культурах на KM-HA, средние уровни экспрессии засеянных hHpSC относительно AFP, NCAM и CDH1 сдвигались наружу из диапазона hHpSC по направлению к диапазону hHB, в то время как экспрессия ЕрСАМ полностью возрастала после 1 недели культивирования. Варианты сред KM-HA, расположенные в порядке возрастания жесткости (|G*|=25 Па для A, |G*|=73 Па для В, |G*|=140 Па для Е, |G*|=165 Па для С, |G*|=220 Па для D, и |G*|=520 Па для F). Значения экспрессии (среднее ± стандартная ошибка) нормировали относительно GAPDH. Измерения в обозначенных буквами KM-HA вариантах сред, (таблица 3) сравнивали с колониями hHpSC (зелеными) и свежевыделенными hHB (красными) для определения значимости отличий (t-test Стьюдента).
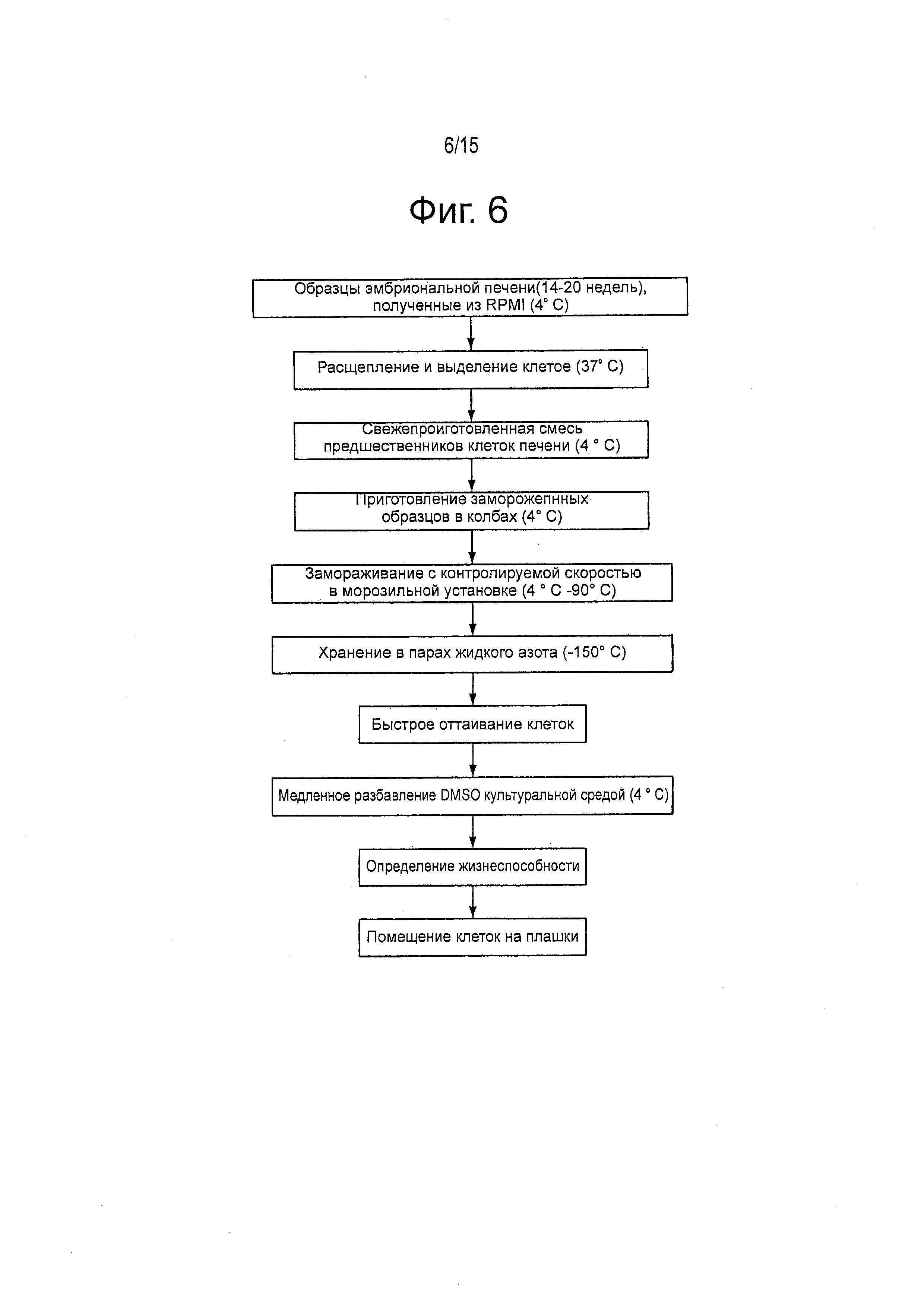
Фигура 6 представляет схему одного из воплощений разработанных способов криоконсервирования и оттаивания.
Фигура 7 показывает результаты, полученные на основе in vivo изображений в реальном времени люминесцентных сигналов от люциферин-производящих клеток, как при трансплантации гиалуронанами, так и при инъекции клеточной суспензии.
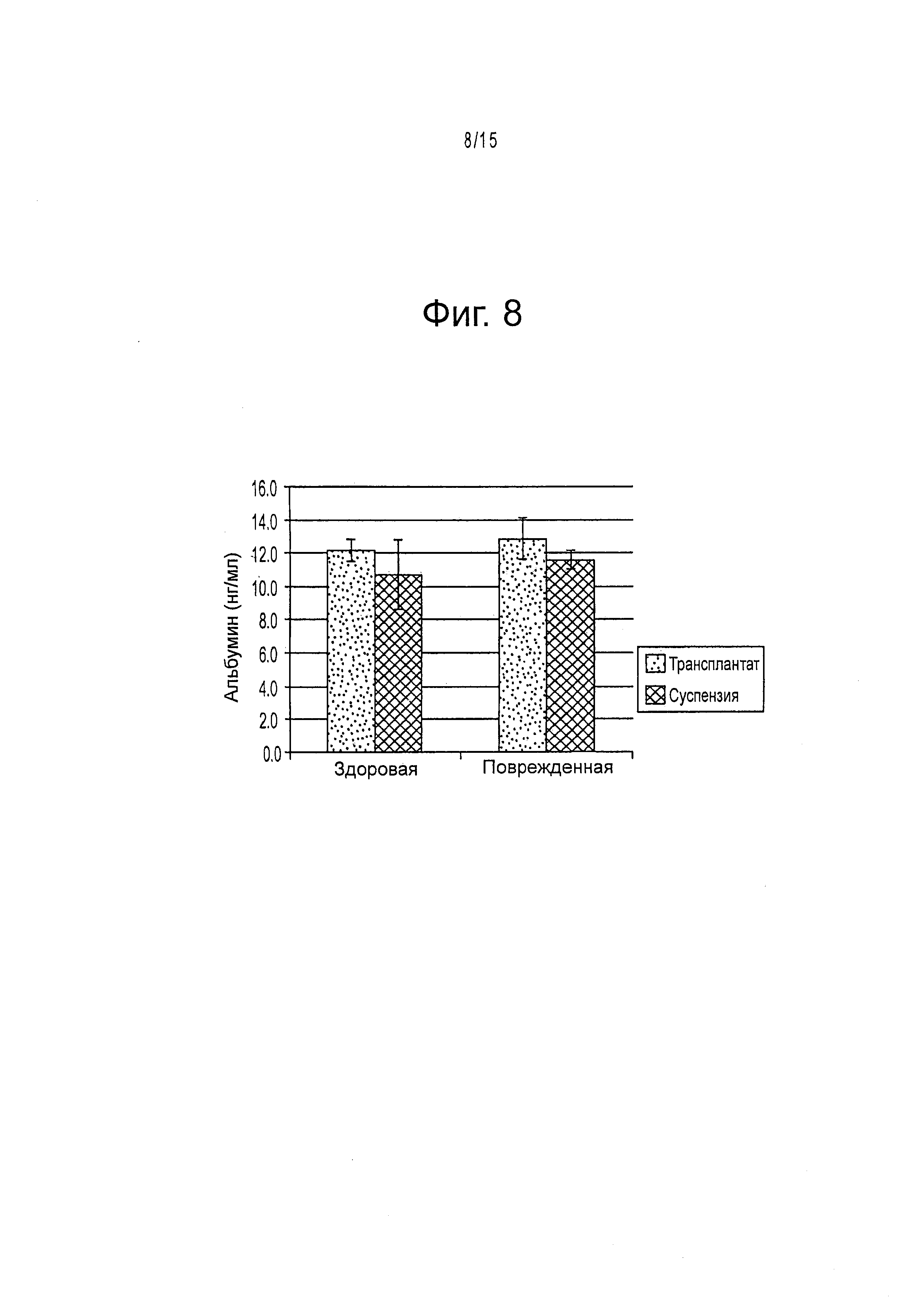
Фигура 8 демонстрирует сывороточный альбумин человека на 7 день после трансплантации в трансплантате по сравнению с клеточной суспензии в здоровой и поврежденной СС14 моделях печени.
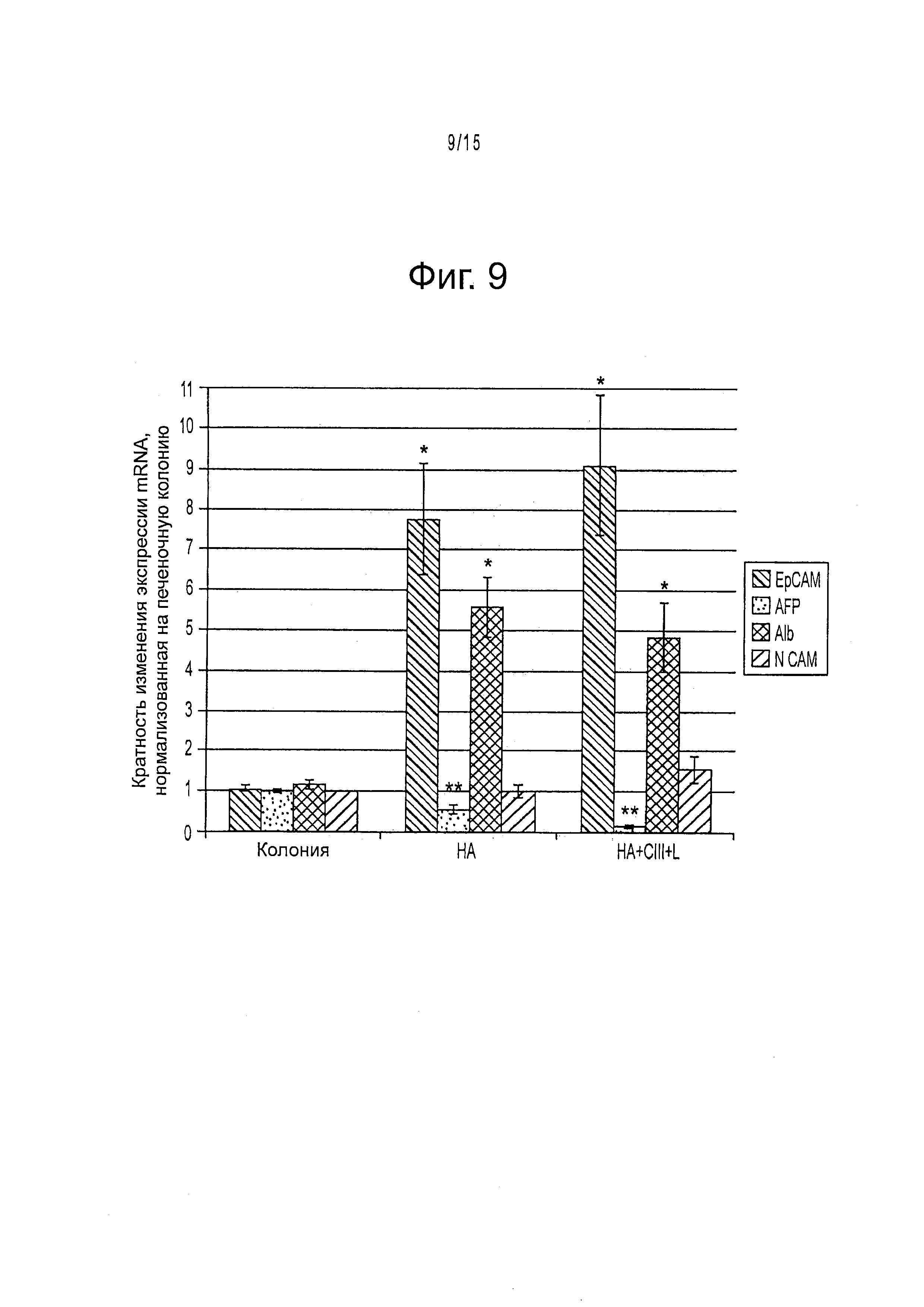
Фигура 9 демонстрирует экспрессию генов маркеров фенотипа. Уровни экспрессии стволовых клеток печени нормируют на экспрессию GAPDH, и изменения сгибов нормируют на начальную экспрессию в колониях. * обозначает р<0,05% значимость различий между экспериментальными условиями и начальной экспрессией в колониях. ** обозначает р<0,05% значимость различий между экспериментальными условиями и начальной экспрессией в колониях, а также значимость различий между значениями экспрессии в двух экспериментальных условиях.
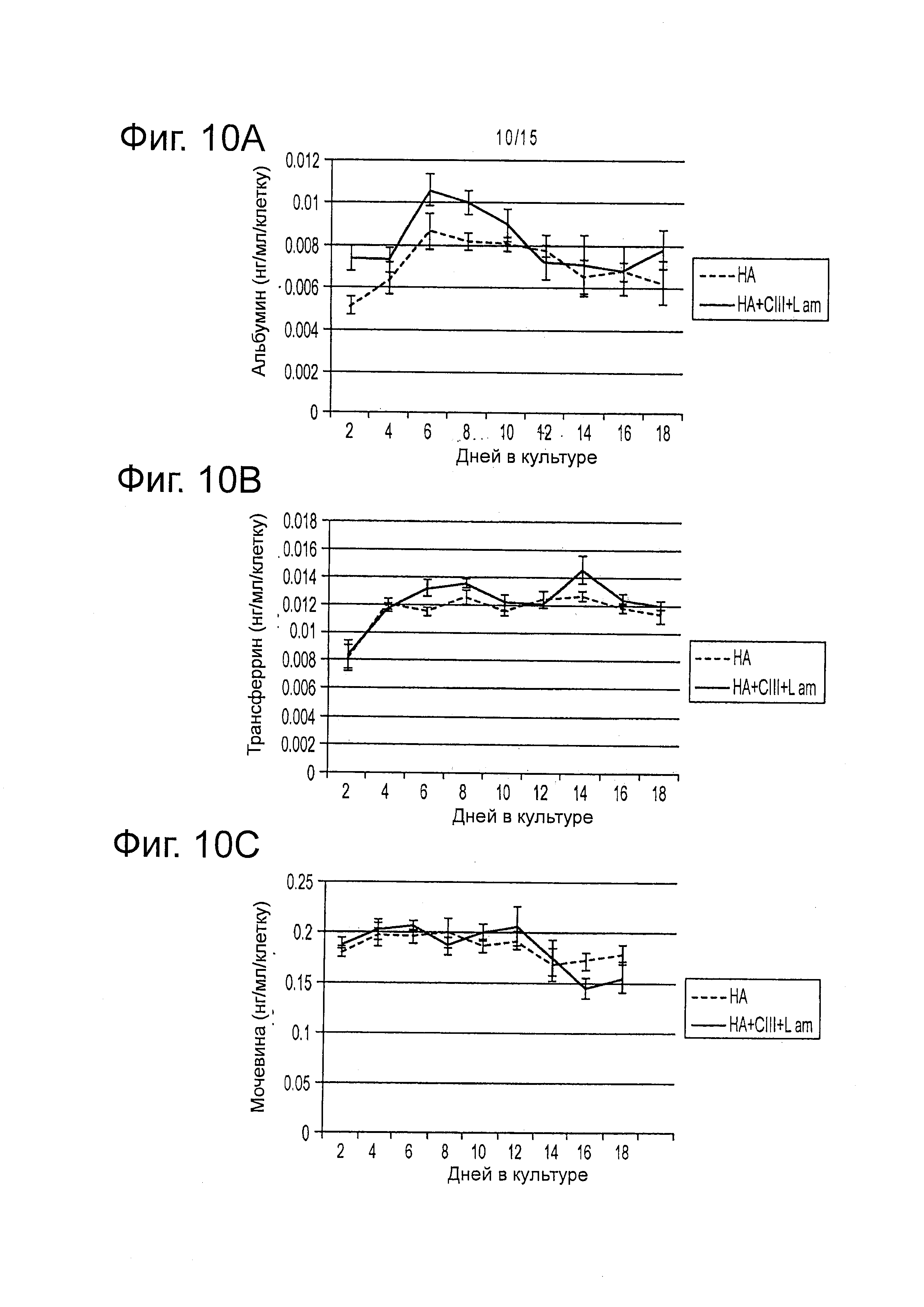
Фигура 10 представляет результаты функциональных исследований функции печени во времени. А) альбумин, В) Трансферрин, и С) Мочевина в трехмерной культуре гиалуронана во времени для разных уровней, нормализованных на клетку.
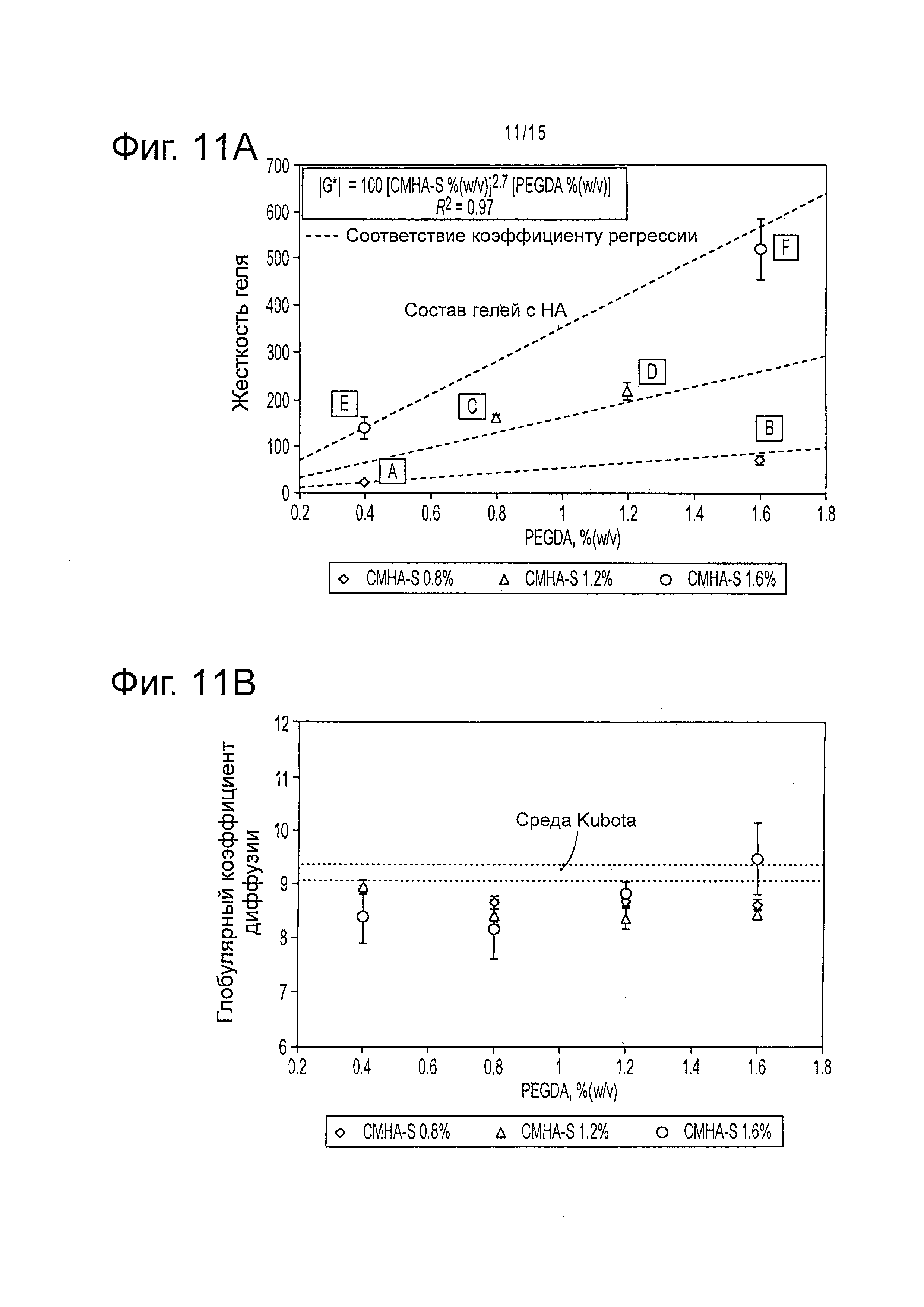
Фигура 11 представляет результаты изучения механических характеристик KM-HA. а) Жесткость KM-HA контролируема и зависит от содержания CMHA-S и PEGDA. Средний модуль сдвига |G*| возрастает экспоненциально с увеличением содержания CMHA-S и PEGDA, осуществляя прямой контроль конечных механических свойств KM-HAs в течение начального смешивания гидрогеля; реологические измерения выполняли только в обозначенных буквами вариантах сред, показанных в таблице 3. Величина ошибки: ± 1 стандартное отклонение для измерений в интервале частот возмущающей силы 0,05 Hz - 5 Hz. b) Диффузия в KM-HA. Измерения коэффициента диффузии в KM-HA с помощью FRAP (70 kDa меченого флуоресцеином декстрана) не отличались существенно от таковой в среде Kubota; измерения коэффициента диффузии, выполненные на всех вариантах сред, показаны в таблице 3. Величина ошибки: 95% доверительный интервал измерений.
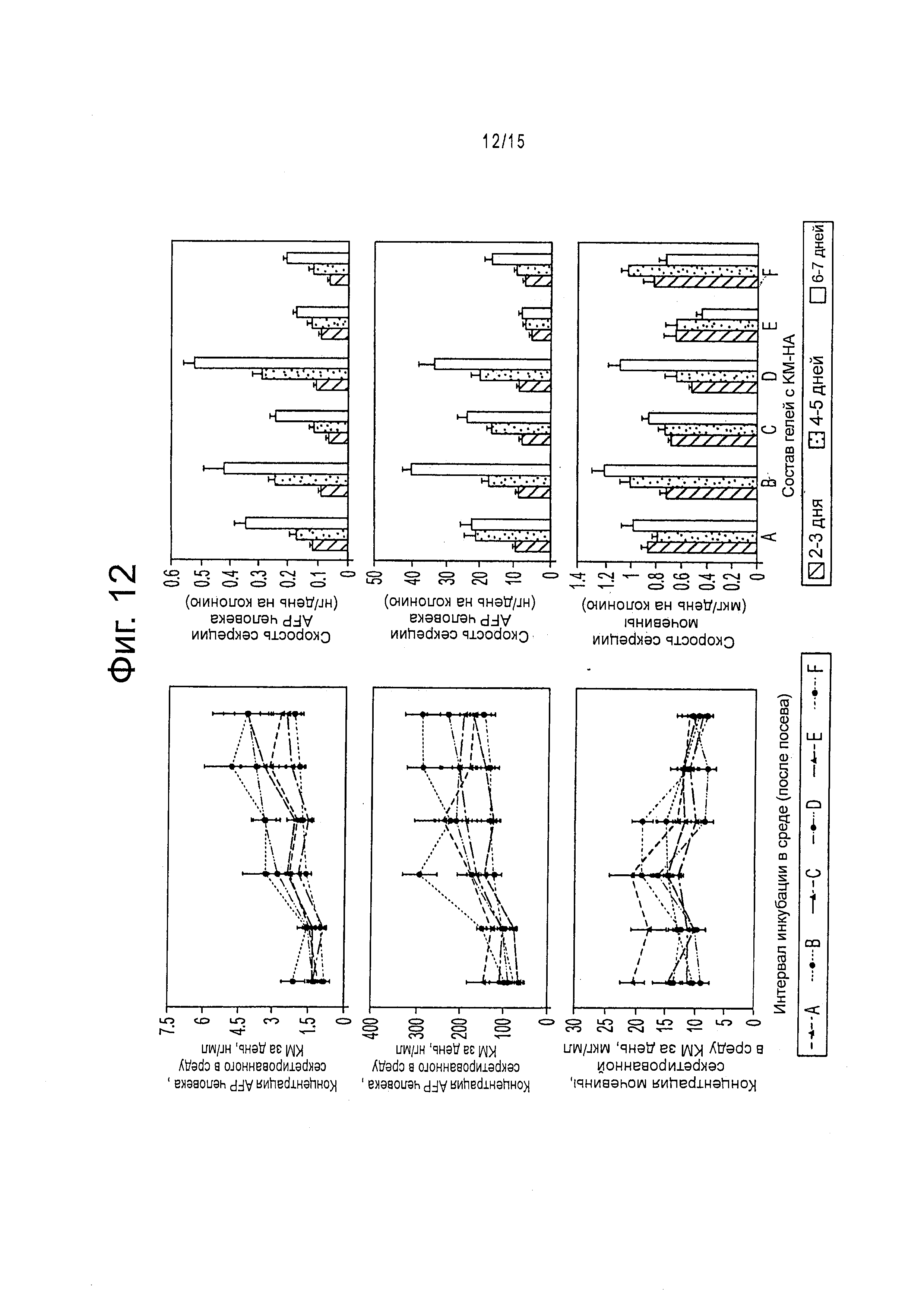
Фигура 12 демонстрирует секрецию человеческого флуоресцентного белка AFP, альбумина и мочевины клетками hHpSC, культивированных в KM-HA. Колонии hHpSC в KM-HA проявляют некоторые функции печени с ростом концентраций человеческих AFP и альбумина, найденных в культуральной среде (KM) и уравновешении синтеза мочевины на 7-й день от начала культивирования. Скорости метаболической секреции человеческого AFP, человеческого альбумина и мочевины к 7-му дню от начала культивирования в вариантах сред KM-HA различны с минимальными скоростями для AFP, альбумина, сниженным синтезом мочевины в KM-HAs с 1.6% CMHA-S и 0.4% PEGDA (вариант среды Е, таблица 3). Левая колонка: концентрация метаболита в культуральной среде, собираемой ежедневно после 24 часов инкубации в каждой из обозначенных буквами сред (таблица 3). Правая колонка: скорость секреции метаболитной массы на колонию hHpSC в культуральной среде после 24-часов инкубации; полную метаболитную массу в среде нормировали на количество функциональных колоний hHpSC в каждом интервале, рассчитанном путем изучения выживания по восстановлению AlamarBlue (приблизительное число колоний, в образце: 12). Все приведенные данные - среднее ± стандартная ошибка.
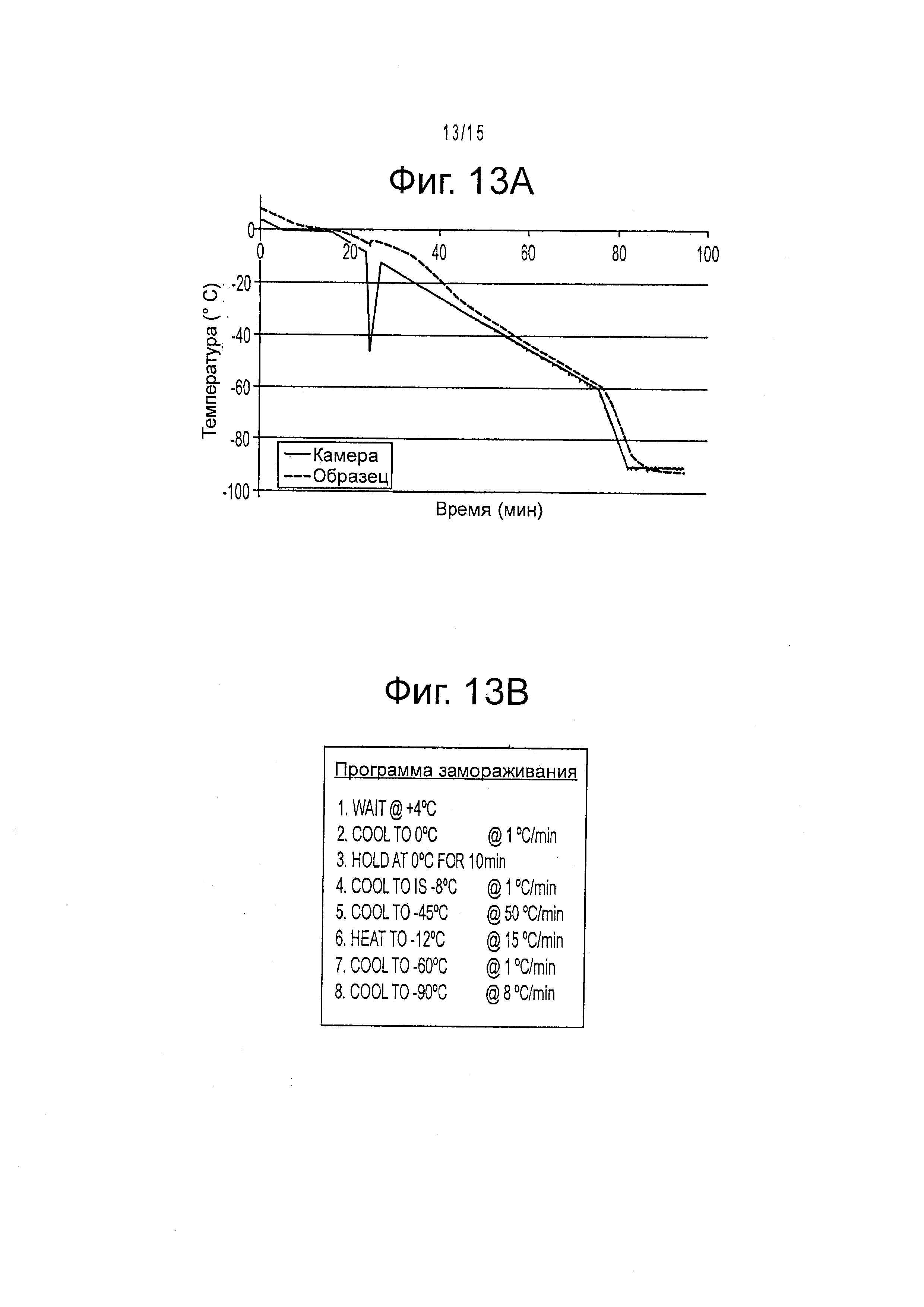
Фигура 13 показывает, что программа замораживания с контролируемой скоростью минимизирует фазовую энтропию жидкость-лед, предотвращая повреждение образующимся внутри льдом и позволяя повторное замораживание. А) График показывает связь температуры в камере и температуры образца (10% DMSO). В) программа замораживания, используемая для системы Cryomed 1010.
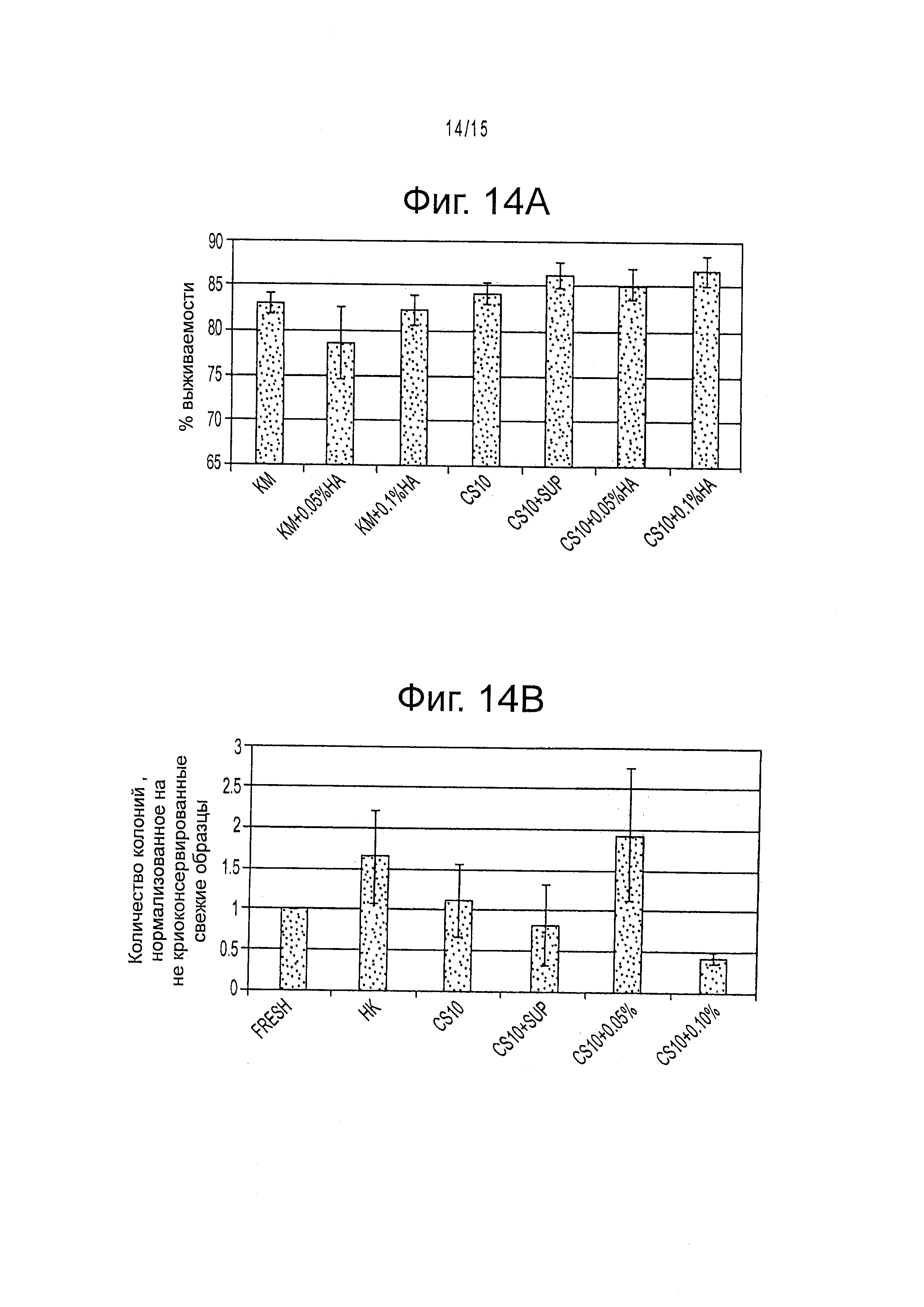
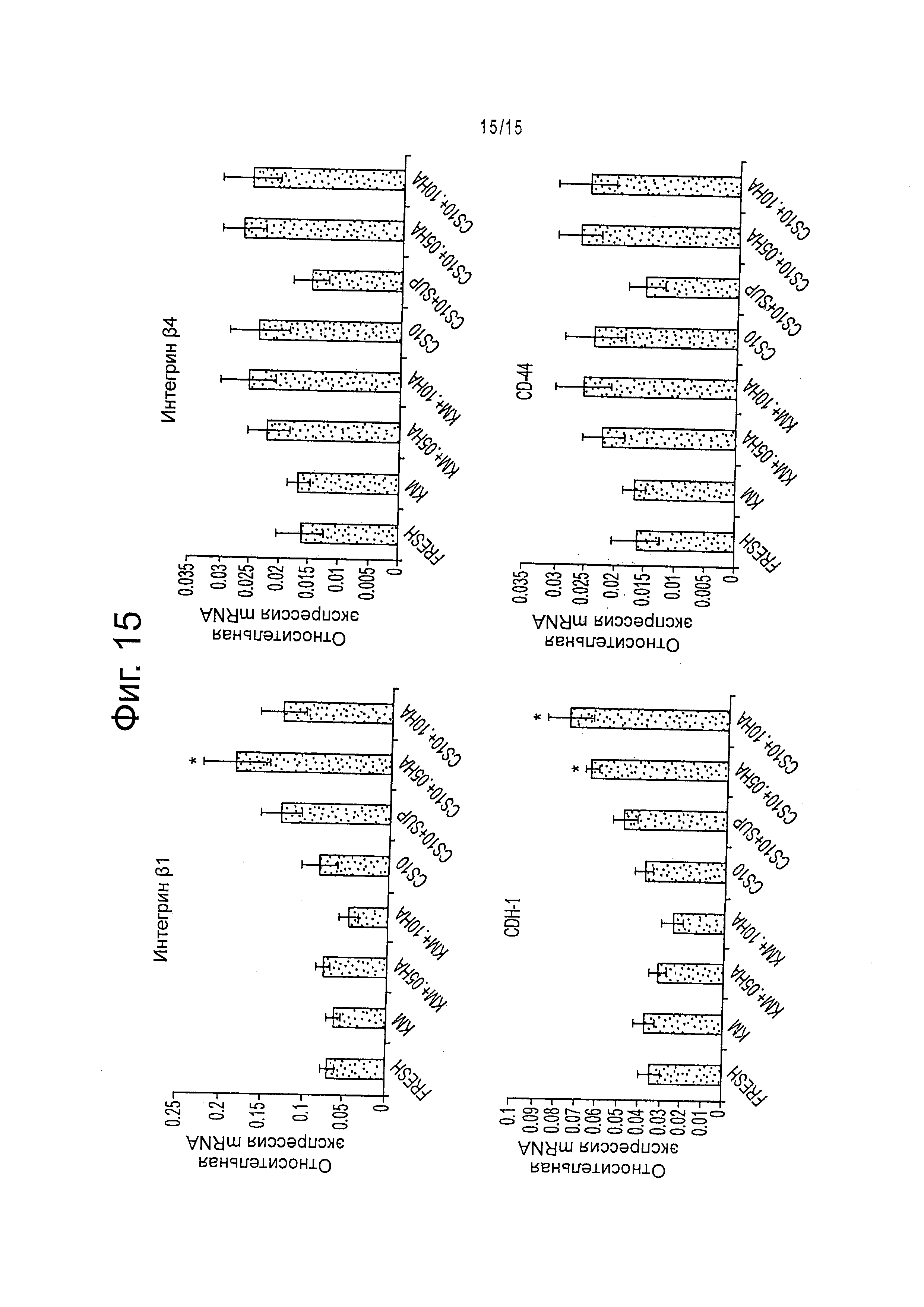
Фигура 14 демонстрирует (А) % выживаемости криоконсервированных клеток эмбриональной печени после оттаивания и (В) число колоний после 3 недель культивирования для разных условий, нормированное на свежие образцы. Результаты приведены как среднее ± стандартная ошибка среднего. KM = Среда Kubota с 10% DMSO и 10% FBS. CS10-криоконсервант, CS10+sup-криоконсервант 10 с добавлением KM. 0,05% и 0,10% относятся к % добавленной гиалуроновой кислоты в каждом образце.
Фигура 15 демонстрирует относительную экспрессию mRNA, нормированную на экспрессию GAPDH. Среднее ± стандартная ошибка среднего. Достоверность отличия от свежих образцов *р>0,05. KM = среда Kubota с 10% DMSO и 10% FBS. CS10 = криоконсервант, CS10+sup = криоконсервант 10 с добавлением KM. 0,05% and 0,10% относятся к % добавленной гиалуроновой кислоты в каждом образце.
Осуществление изобретения
В настоящее время пересадку клеток, включая клетки, полученные из плотных органов, обычно выполняют через сосудистый путь, и результаты, как правило, поставляют огромное количество свидетельств неэффективной трансплантации, обычно порядка 20-30% для зрелых клеток и менее 5% для стволовых клеток. Различная приживаемость связана с их размерами, которые в печени малы у стволовых клеток (обычно меньше 10 мкм) и больше у зрелых клеток (обычно >18 мкм). Наши исследования подтвердили это наблюдение. Например, в одном исследовании стволовые клетки печени человека (hHpSC) и гепатобласты (hHBs) вводили мышам с иммунной недостаточностью путем и нъекции клеток в селезенку. Поскольку селезенка непосредственно связана с печенью, клетки переносятся в печень, где они, как ожидается, приживаются. Однако большая часть клеток погибала до приживания или формировала агломераты не в тех тканях, которые предназначались быть тканью-мишенью (эктопические области).
Даже в тех случаях, когда клетки действительно выполняют свое предназначение, их превращению в полностью функциональные клетки препятствует отсутствие васкуляризации, отсутствие роста (при трансплантации зрелых клеток) и высоко иммуногенные свойства клеток при использовании зрелых клеток и необходимость долговременной иммуносупрессии. Другие препятствия включают поиск источников, высококачественных клеток клинического уровня и необходимость использовать свежевыделенные клетки из-за сложностей с криоконсервированием.
Помимо отмеченных неэффективности и сложностей трансплантация клеток из плотных органов через сосудистый путь, опасна. На поверхности клеток из плотных органов находятся молекулы (адгезивные клеточные молекулы, белки жесткой связи), которые заставляют клетки быстро связываться друг с другом и усиливать агрегацию. Этот процесс образования клеточных сгустков может привести к угрожающей жизни легочной эмболии.
В связи с некоторыми из этих препятствий и осложнений настоящее изобретение направлено на разработку техники трансплантации, включающей доставку трансплантатируемых клеток в виде агрегатов, прикрепленных внутри или к поверхности подложек, которые могут быть помещены в поврежденную ткань для обеспечения необходимой пролиферации и трансплантации. Таким образом, данное изобретение учитывает не только тип трансплантатируемых клеток, но также тип клеток в комбинации с соответствующими биоматериалами и способом пересадки для наиболее эффективной и успешной трансплантационной терапии. Техники трансплантации по настоящему изобретению применимы для терапевтического использования у больных и предлагают альтернативный способ лечения в области регенеративной медицины для регенерации поврежденной или дисфункциональной ткани.
Источники клеток
Согласно данному изобретению необходимые клеточные популяции могут быть получены непосредственно от донора, имеющего «нормальную», «здоровую» ткань и/или клетки, имея в виду любую ткань или любые клетки, не пораженную/ые болезнью или дисфункцией. Разумеется, такая клеточная популяция может быть получена от лица, страдающего от поврежденного или не функционирующего органа или даже от части органа, находящегося в таком состоянии. Клетки могут быть получены из любой подходящей ткани млекопитающего независимо от возраста, включая эмбриональную, ткань новорожденного, ребенка и взрослого. Если требуется создать экспериментальные модели болезни, можно использовать в трансплантатах поврежденные клетки, которые должны быть пересажены соответствующему экспериментальному животному.
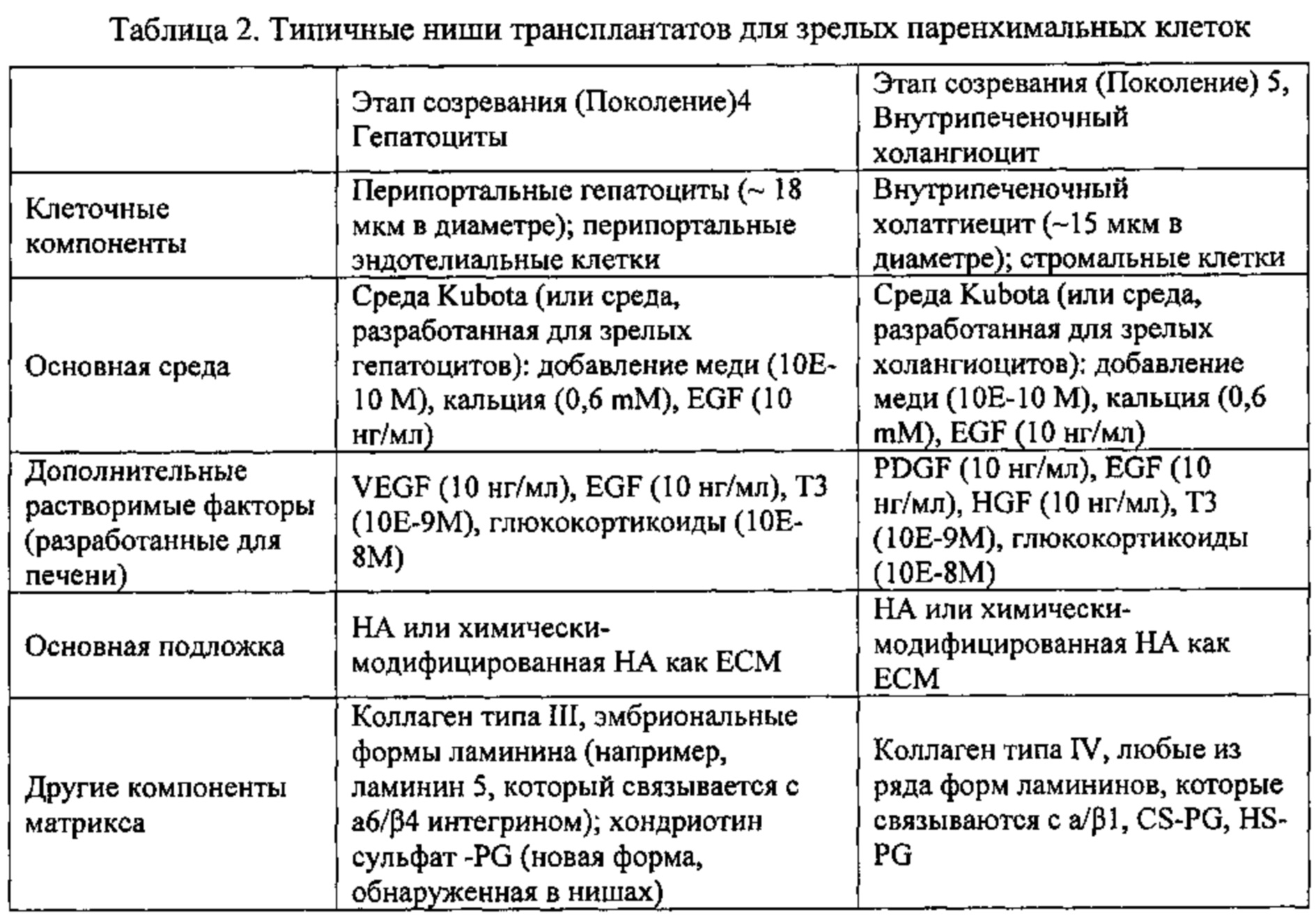
Более конкретно, клетки для различных видов терапии могут быть получены из «популяций клеточных поколений» на основании терапевтических потребностей. Например, «зрелые» клетки на поздних стадиях развития могут быть предпочтительными в тех случаях, когда имеется необходимость быстрого получения функций, проявляемых только на поздних стадиях развития клеток, или если реципиент содержит зависящий от стадии развития вирус, инфицирующий предпочтительно стволовые клетки и/или клетки-предшественники, что происходит в случае гепатита С или вируса папилломы. В любом случае» клетки-предшественники» могут использоваться для стабилизации любого из клеточных поколений соответствующих тканей.
Обсуждение популяций клеточной линии клеток печени и способа их выделения приведено в патентных заявках US NN 11/560,049 и 12/213100, описание которой полностью включено в данную заявку в виде ссылки. Вкратце, внутри печени имеется по меньшей мере, восемь поколений клеток. Ниже описаны эти поколения и приведены относящиеся к ним краткие комментарии:
Этап созревания (Поколение) 1: Стволовые клетки печени человека (hHpSC) являются мультипотентными клетками, локализованными в дуктальных пластах печени эмбриона и новорожденного и в каналах Геринга печени детей и взрослых. Эти клетки обычно имеют от 7 до 10 мкм в диаметре и характеризуются высокими значениями отношения ядро/цитоплазма. Они устойчивы к ишемии, могут быть найдены в кадаверной печени более чем через 48 часов, после систолической смерти и образуют колонии hHpSC, способные дифференцироваться до зрелых клеток. Эти клетки составляют приблизительно 0,5-2% паренхимы печени доноров всех возрастов.
Этап созревания (Поколение) 2: Гепатобласты (hHB) являются непосредственными потомками hHpSC и вероятными клетками-усилителями печени. Они локализованы вне соответствующей ниши стволовых клеток. Эти клетки имеют больший размер (10-12 мкм), содержат более высокие количества цитоплазмы и распределены in vivo по всей паренхиме в печени эмбрионов и новорожденных и вблизи концов или по соседству с каналами Геринга в печени детей и взрослых. С возрастом число гепатобластов уменьшается до <0,01% паренхиматозных клеток в постнатальной печени. Было показано, что эта популяция клеток увеличивается во время регенеративных процессов, особенно связанных с определенными заболеваниями, такими как цирроз. Гепатобласты созревают, превращаясь либо в гепатоциты (Н), либо в холангиоциты, называемые также желчным эпителием (В):
Этапы созревания (Поколения) 3H и 3B: В печени обнаружены детерминированные (унипотентные) предшественники гепатоцитов (3H) и предшественники желчных холангиоцитов (3B). Эти унипотентные предшественники превращаются только в один тип взрослых клеток и больше не экспрессируют гены стволовых клеток (например, для них характерен низкий уровень или отсутствие экспрессии CD133/1, белков хеджехог (Sonic/Indian), но они экспрессируют гены, типичные для клеток в эмбриональных тканях.
Этапы созревания (Поколения) 4H и 4B: Перипортальные взрослые паренхиматические клетки включают относительно мелкие гепатоциты (4H) и внутрипеченочный желчный эпителий (4B). Гепатоциты диплоидны, имеют приблизительно 18 мкм в диаметре и экспрессируют множество факторов/ферментов, связанных с глюконеогенезом, такими как PEPCK, коннексины 26 и 32.
Холангиоциты этого поколения (4B) диплоидны, имеют приблизительно 6-7 мкм в диаметре, ограничивают часть каналов Геринга и экспрессируют различные гены, включая гены аквапорина 1 и 4, MDR1, рецептора секретина, но не CL-/HC03- обменника или рецептора соматостатина.
Этапы созревания (Поколения) 5H и 5B: Клетки этого поколения включают относительно крупные диплоидные гепатоциты (5H) и холангиоциты (5B). Величина гепатоцитов приблизительно 22-25 мкм в диаметре, и они найдены в мидацинарной зоне. Мидацинарные гепатоциты экспрессируют высокие уровни альбумина и тирозин аминотрансферазы (ТАТ); особенно характерно то, что они экспрессируют трансферрин как белок (поколения 1-4, напротив, экспрессируют его только как mRNA).
Этап созревания (Поколение) 5B Холангиоциты имеют около 14 мкм в диаметре, локализованы во внутриглобулярных протоках и экспрессируют трансмембранный регулятор муковисцидоза (CFTR), рецептор секретина, рецептор соматостатина, MDR1 и MDR3, и обменник CL-/HCO3-.
Этап созревания (Поколение) 6H: Диплоидные перицентральные гепатоциты поколения 6 могут образовывать в культуре колонии, но обладают ограниченной способностью распространяться и существенно не способны к субкультивированию. Их процентное содержание уменьшается с возрастом (параллельно с увеличением процентного содержания тетраплоидных перицентральных клеток). Кроме альбумина, ТАТ и трансферрина, они также интенсивно экспрессируют ряд белков Р450, таких как Р450-3А, глутамин синтетазу (GT), гепарин протеогликаны и гены, связанные с образованием мочевины.
Этап созревания (Поколение) 7H: Этот этап включает тетраплоидные перицентральные паренхиматозные клетки, которые больше не способны подвергаться полному клеточному делению. Они могут осуществлять синтез DNA, но обладают ограниченной способностью к цитокинезу. Эти гораздо большие клетки (>30 мкм в диаметре), экспрессируют большие количества генов, которые становятся доступными на этапах созревания 5-6.
Этап созревания 8: Апоптотические клетки: экспрессируют различные маркеры апоптоза и демонстрируют фрагментацию DNA.
Дополнительно к клеткам, требуемым для обеспечения собственно «функций» поврежденных или дисфункциональных внутренних органов, трансплантат предпочтительно включает дополнительные клеточные компоненты, которые предпочтительно имитируют категории клеток, определяющие эпителиально-мезенхимальное клеточное отношение, клеточную основу всех тканей. Эпителиально-мезенхимальные клеточные отношения, различны на каждом этапе развития. Эпителиальные стволовые клетки взаимодействуют с мезенхимальными стволовыми клетками, и их созревание взаимно координируется по мере созревания с образованием зрелых типов клеток в ткани. Взаимодействия между двумя типами клеток опосредованы паракринными сигналами, включающими растворимые сигналы (например, факторы роста) и компоненты внеклеточного матрикса.
Например, в печени стволовые клетки печени (HpSC) приводят к образованию гепатоцитов и холангиоцитов. Мезенхимальные партнеры HpSC - это ангиобласты. Имеются свидетельства, указывающие на превращение ангиобластов в предшественников эндотелиальных клеток и в предшественников звездчатых клеток в печени, мезенхимальных партнеров внутрипеченочных клеток паренхимы на этапе 2, гепатобластов (НВ). Предшественники эндотелиальных клеток созревают на последующих этапах до клеток эндотелия, которые становятся мезенхимальными партнерами этапов развития гепатоцитов. Предшественники звездчатых клеток превращаются в звездчатые клетки и затем в клетки стромы, а затем в, мезенхимальные партнеры холангиоцитов, миофибробласты.
Формирование печени, называемое гепатогенезом, регулируется с помощью сигналов из ангиобластов в эмбриональной мезенхиме, связанной с сердцем. На начальных стадиях развития печени факторы роста фибробластов (FGF) выделяются из прекардиальной мезодермы, в то время как костные морфогенетические белки (BMPs) образуются из мезенхимы. Эти вновь образованные клетки печени затем отделяются и мигрируют в окружающую мезенхиму и взаимодействуют с предшественниками с образованием как эндотелия, так и стромы. Мезенхимальные клетки остаются в контакте с клетками печени в процессе развития.
Стволовые клетки печени человека (hHpSC) для выживания требуют контакта с мезенхимальными клетками. Они будут самореплицироваться, оставаясь hHpSCs на фидерах ангиобластов. Их развитие ограничивается гепатобластами при культивировании на средах для звездчатых клеток печени. Они развиваются до зрелых гепатоцитов при культивировании на зрелом эндотелии и до холангиоцитов при культивировании на зрелой строме (например, звездчатых клетках или миофибробластах). Было показано, что контроль за судьбой стволовых клеток фидерами определяется точными комбинациями паракринных сигналов, образующимися в каждом из эпителиально-мезенхимальных клеточных отношений в процессе развития.
Согласно одному воплощению, изобретения для оптимизации трансплантата необходимо взаимодействие популяции изолированных клеток с известными паракринными сигналами (описанными ниже) и с «нативными» эпителиально-мезенхимальными партнерами. Таким образом, трансплантат будет включать эпителиальные стволовые клетки, стволовые клетки печени, смешанные с их нативными мезенхимальными партнерами, ангиобластами. Для создания временной усиливающей клеточной ниши трансплантата гепатобласты могут взаимодействовать со звездчатыми клетками печени и с предшественниками эндотелиальных клеток. В некоторых трансплантатах для оптимизации приживления клеток печени в ткани хозяина можно создать смесь из двух наборов клеток: стволовых клеток печени, гепатобластов, ангиобластов, предшественников эндотелиальных клеток, предшественников звездчатых клеток печени. Микроокружение трансплантата, в которое засевают клетки, будет включать паракринные сигналы, матрикс и растворимые сигнальные вещества, производимые на соответствующих этапах развития, используемых для трансплантата.
Трансплантаты могут быть также сформированы для лечения патологического состояния. Например, чтобы минимизировать зависящие от этапа развития эффекты вирусов (например, некоторых вирусов гепатита), которые инфицируют ранние этапы развития и затем созревают параллельно с клетками хозяина, можно приготовить трансплантаты из клеток более поздних этапов развития (например, гепатоцитов и их нативных партнеров, эндотелиальных клеток синуса), не проницаемых для вирусной инфекции. Трансплантаты можно использовать также для создания модели заболевания с помощью поврежденных клеток в трансплантате, переносимом в/на орган-мишень в экспериментальной животной модели.
Пример трансплантата стволовых клеток с использованием в качестве модели терапии клетками печени включает стволовые клетки печени, ангиобласты и предшественники звездчатых клеток печени. Напротив, трансплантат «зрелых» клеток печени будет содержать гепатоциты, зрелые эндотелиальные клетки и пенрициты, являющиеся зрелыми звездчатыми клетками. Обсуждение отношения эпителиально-мезенхимального отношения в печени приведено в патентной заявке US no. 11/753,326, описание которой полностью включено в данную заявку в качестве ссылки
Образование системы сосудов играет важную роль для всех трансплантатов, и поэтому они должны быть имплантированы в место, благоприятное для васкуляризации (например, в печень). Для большинства патологий трансплантаты из стволовых клеток предпочтительны, благодаря их способности к росту, способности дифференцироваться до зрелых типов клеток, их устойчивости к ишемии, что позволяет получать их из кадаверных тканей, и их минимальной иммуногенности, если она существует.
Материалы трансплантатов
Использование гель-образующих биоматериалов по настоящему изобретению обеспечивает образование подложки для поддержки клеток и сигналов, способствующих успешной трансплантации и процессам регенерации. Поскольку ткань плотных органов подвергается постоянной перестройке, диссоциированные клетки стремятся переформировать свои исходные структуры под влиянием условий окружающей среды. Клетки могут взаимодействовать с одной или несколькими питательными средами (например, RPM 1640), с сигнальными молекулами (например, инсулином, трансферрином, VEGF) и с одним или несколькими компонентами внеклеточного матрикса (например, гиалуронанами, коллагенами, нидогеном, протеогликанами).
Во всех тканях паракринные сигналы включают как растворимые (мириады факторов роста и гормонов), так и нерастворимые (внеклеточные матричные (ЕСМ) сигналы. Синэргичные эффекты между растворимыми и (нерастворимыми) матричными факторами могут определять ростовую и дифференцирующую реакции на трансплантируемые клетки. Компоненты матрикса являются основными детерминантами прикрепления, выживания, клеточной формы (а также организации цитоскелета) и стабилизации требуемых рецепторов на клеточной поверхности, которые обеспечивают реакцию клеток на специфические внеклеточные сигналы.
Известно, что внеклеточный матрикс ЕСМ регулирует морфологию клетки, рост и экспрессию клеточных генов. Тканеспецифичная химия подобная той, которая наблюдается in vivo, может достигаться ex vivo при использовании очищенных ЕСМ компонент. Многие из них коммерчески доступны и способствуют поведению клеток, подобному наблюдаемому in vivo.
Подходящие компоненты внеклеточного матрикса включают коллагены, адгезионные молекулы (например, клеточные адгезионные молекулы (САМ), жесткие связи ((кадгерины), базальные адгезионные молекулы (ламинины, фибронектины), белки, соединяющие промежутки (коннексины), эластины и сульфатированные углеводы, образующие протеогликаны (PG) и гликозамингликаны (GAG). Каждая из этих категорий определяет происхождение молекул. Например, существует по меньшей мере 25 типов коллагена, каждый из которых кодируется отдельным геном и обладает уникальной регуляцией и функциями. Дополнительные биоматериалы включают неорганические натуральные материалы типа хитозана и алгината, а также множество синтетических, биодеградируемых и биосовместимых полимеров. Эти материалы часто являются «уплотненными» (например, включены в гель или нерастворимый материал) с помощью способов, включающих термическое желирование, поперечное сшивание под действием света или химическое поперечное сшивание или экспозицию к микроокружению (например, высокой концентрации соли), что приводит к нерастворимости материалов. Однако при каждом способе необходимо оценить повреждение клеток (например, от избыточных значений температуры, экспозиции к ультрафиолету). Для более детального обсуждения биоматериалов, особенно для использования гиалуроновых гидрогелей, см. патентную заявку US No. 12/073,420, описание которой включено полностью в настоящую заявку в виде ссылки.
Особый выбор, с помощью которого можно получать компоненты матрикса, с помощью градиентов in vivo, например, переход от компонентов, найденных в связи с компартментом стволовых клеток, к компонентам, связанным со стволовыми клетками на поздних этапах развития. Биоматериалы для трансплантата предпочтительно воспроизводят химию матрикса определенных этапов развития, требуемых для трансплантата. Эффективность выбранной смеси компонентов матрикса может быть подвергнута оценке в исследованиях ex vivo, с помощью очищенных компонентов матрикса и растворимых сигналов, многие из которых коммерчески доступны, согласно протоколу «Правила организации производства и контроля качества лекарственных средств (GMP).» Биоматериалы, выбранные для трансплантата, предпочтительно вызывают соответствующий рост, и реакцию дифференцировки, необходимую для успешной трансплантации клеток.
Что касается печени, химические соединения матрикса, связанные с клетками паренхимы печени, и, вне стволовых клеток и переходными усиливающими клеточными нишами, присутствуют в пространстве Disse, на площади, локализованной между паренхимой, эндотелием или другими формами мезенхимальных клеток. Помимо изменения созревания клеток в разных зонах печени, наблюдается также изменение химии матрикса. Химический состав матрикса перипортально в зоне 1 аналогичен таковому, найденному в эмбриональной печени и включает коллагены типа 111 и типа 1V, гиалуронаны (НА), ламинины, и формы протеогликанов хондриотина сульфата. Эти зональные переходы к другой химии матрикса в перицентральной зоне 3, содержащей коллаген типа 1, фибронектин и уникальные формы протеогликанов гепарина и гепаран сульфата.
Ниша стволовых клеток печени была частично охарактеризована, и было обнаружено, что она содержит гиалуронаны, формы ламинина (например, ламинин 5), которые связываются с альфа 6-бета 4 интегрином, коллагеном типа 111 и уникальными формами минимально сульфатированных протеогликанов хондриотин сульфата (CS-PG). В этой нише имеются ограниченные количества коллагена типа IV и нет коллагена типа 1.
Химия матрикса этой ниши преобразуется в связанную с переходным усиливающим клеточным компартментом и состоит из коллагена типа IV, форм ламинина, который связывается с другими интегринами (αβ1), и формами GAG и PG, которые включают формы CS-PG с большим сульфатированием, дерматан сульфат-PGs и специфические формы гепаран-сульфата-PG (HS-PGS).
Переходной усиливающий клеточный компартмент переходит к более поздним этапам дифференцировки, и с каждым следующим этапом химия матрикса становится более стабильной (например, содержит более стабильные коллагены), меньше подвержена превращениям и содержит больше высоко сульфатированные формы GAG и PG. Наиболее зрелые клетки связаны с формами гепарин-PG (HP-PG), свидетельствуя о том, что множество белков (например, факторы роста и гормоны, факторы свертывания, различные ферменты) могут связываться с матриксом и сохранять стабильность благодаря связыванию с дискретными и специфическими сульфатированными структурами в GAG. Таким образом, химия матрикса переходит от начальной точки в нише стволовых клеток, обладающей лабильной химией матрикса, связанной с высокой изменяемостью и минимальным сульфатированием (и поэтому минимальным связыванием с сигналами в стабильном состоянии вблизи от клеток), к стабильной химии матрикса с повышенным сульфатированием (и соответственно все более высокими значениями связывания с сигналами и удерживания их вблизи от клеток).
Следовательно, настоящее изобретение учитывает, что химический состав молекул матрикса изменяется при созревании клеток в процессе увеличения возраста организма-хозяина и по мере увеличения этапа развития. Трансплантация подходящего материала должна оптимизировать приживание трансплантируемых клеток в ткани, предотвращать рассеивание клеток по эпитопам, минимизировать проблемы эмболизации и увеличить способность клеток как можно быстрее интегрироваться в ткани. Кроме того, факторы в трансплантате могут быть выбраны так, чтобы свести к минимуму проблемы иммуногенности.
Клетки печени человека можно культивировать в среде, не содержащей сыворотки. Стволовые клетки печени человека или гепатобласты (hHpSC или hHB) могут быть пересажены сами по себе или в комбинации с ангиобластами/предшественниками эндотелиальных клеток и предшественниками звездчатых клеток. Клетки можно суспендировать в тиолированной и химически модифицированной НА (CMHA-S, или гликозил, гликозан BioSystems, Salt Lake City, UT), содержащей среде (HA-M) и в KM (Среде Kubota) и помещать их в один из шприцов набора парных шприцов. Второй шприц может быть заполнен кросс-линкером, например, диакрилатом поли(этилен гликоля) или PEGDA, приготовленном в KM (или в условиях, требуемых для достижения нерастворимости биоматериалов). Шприцы соединены с помощью иглы, которая разветвляется на два наконечника люэра. Таким образом, клетки в гидрогеле, и кросс-линкер могут подаваться через одну иглу, чтобы обеспечить быструю поперечную связь CMHA-S в геле при инъекции (или обеспечить нерастворимость биоматериалов другими способами).
Клеточная суспензия в CMHA-S и кросс-линкер могут быть введены либо непосредственно, либо трансплантированы в печень с помощью ткани сальника с образованием кармана. В другом варианте клетки могут быть инкапсулированы без использования кросслинкера PEGDA, позволяя суспензии оставаться в течение ночи на воздухе, что приводит к образованию дисульфидных поперечных связей с пластичным вязким гидрогелем. Кроме того, могут быть добавлены тиол-модифицированные макромономеры, например, желатин-DTPH, гепарин-DTPH, хондриотин сульфат-DTPH, чтобы получить ковалентную сеть, имитирующую химический состав матрикса особых ниш in vivo. В другом проявлении полипептиды, содержащие цистеиновые или тиоловые остатки, могут быть сопряжены с PEGDA перед добавлением PEGDA к Glycosil, позволяя специфическим полипептидным сигналам встраиваться в гидрогель. В альтернативном варианте любой полипептид, фактор роста или компонент матрикса, такой как изоформа коллагена, ламинин, витронектин, фибронектин, и т.д., может быть добавлен к гликозилу и клеточному раствору перед поперечным связыванием, позволяя осуществлять пассивный захват важных полипептидных компонентов в гидрогеле.
Гиалуронаны: Гиалуронаны (HAs) являются членами одного из 6 больших гликозаминогликановых (GAG) семейств углеводов, которые являются полимерами уроновой кислоты и аминосахарами. [1-3]. Другие семейства содержат хондриотин сульфаты (CS, [глюкуроновая кислота-галоктозамин]X), дерматан сульфаты (DS, более высоко сульфатированые [глюкуроновая кислота-галоктозамин]X), гепаран сульфаты (HS, [глюкуроновая кислота-галоктозамин]X), гепарины (HP, более высоко сульфатированные [глюкуроновая кислота-галоктозамин]X) и кератан сульфаты (KS, [галактоза-N-ацетилглюкозамин]X).
НА составлены из дисахаридных единиц глюкозамина и глурониевой кислоты, соединенных с помощью связей β1-4, β1-3. Биологически полимерный гликан состоит из линейно повторяющихся от нескольких сот до 20000 или большего числа дисахаридных единиц. HAs имеют молекулярные массы обычно в интервале от 100000 Da в сыворотке и 2000000 в синовиальной жидкости до 8000000 в пупочных канатиках и стекловидном теле. Благодаря высокой плотности своего отрицательного заряда НА привлекает положительные ионы, локализованные в воде. Эта гидратация позволяет НА выдерживать очень значительные нагрузки. НА локализованы во всех тканях и жидкостях организма, и больше всего их в пластичных соединительных тканях, и способность к переносу воды приводит к предположению об их другой роли, включая влияние на формирование и функционирование ткани. Он найден во внеклеточном матриксе, на поверхности клеток и внутри клеток.
Нативные формы химии НА разнообразны. Наиболее общей переменной является длина цепи. Некоторые обладают высоким молекулярным весом благодаря длинным углеводным цепям (например, таким, как в куриных гребешках и в пупочных канатиках), а другие имеют низкий молекулярный вес вследствие коротких цепей (например, из бактериальных культур). Длина цепи HAs играет ключевую роль в установившихся биологических функциях. Низкий молекулярный вес НА (меньше 3,5×104 килодальтон) может индуцировать цитокинную активность, связанную с преобразованием матрикса и, как известно, имеет отношение к воспалению в ткани. Высокий молекулярный вес (выше 2×105 килодальтон) может ингибировать клеточную пролиферацию. Показано, что малые фрагменты НА между 1 и 4 килодальтон, усиливают ангиогенез.
Нативные формы НА модифицировали для приобретения ими желаемых свойств (например, модификация НА для приобретения тиоловых групп, что позволяет использовать тиол для связывания других компонентов матрикса или гормонов или новых форм кросс-линкинга). Кроме того существуют природные формы кросс-линкинга (например, регулируемые кислородом) и другие, вводимые искусственно путем обработки нативных и модифицированных НА определенными реагентами (например, алкилирующими агентами) или, как указывалось выше, путем установки модифицированных НА, что делает их проницаемыми к определенным формам кросс-линкинга (например, образование дисульфидных мостиков в тилол-модифицированных НА).
Согласно настоящему изобретению, предпочтительны тиол-модифицированные НА и in situ полимеризуемые техники, применяемые для них. Эти техники включают образование дисульфидных мостиков между тиолированными карбоксиметилированными НА, известными как CMHA-S или гликозил. Для исследований in vivo можно использовать НА с меньшим молекулярным весом, например, 70-250 килодальтон, поскольку при кросслинкинге дисульфидами или PEGDA образуется гидрогель с очень высокими размерами молекул. Тиоловый реактив - линкер, диакрилат полиэтилен гликоля (PEGDA) пригоден как для инкапсулирования, так и для инъекций in vivo. Такой комбинированный гликозил-PEGDA материал сшивается в ковалентной реакции, и в течение минут обеспечивает биосовместимость, клеточный рост и пролиферацию.
Гидрогелевый материал Glycosil имеет свойства геля, подходящие для конструирования ткани из стволовых клеток in vivo. Гликозил является частью техники полусинтетического внеклеточного матрикса (sECM), доступной из Glycosan Biosciences в Salt Lake City, UT. Множество продуктов торговых линий Extracel и HyStem коммерчески доступны. Эти материалы биосовместимы, биодеградируемы и не иммуногены.
Кроме того, гликозил и экстралинк могут быть легко скомбинированы с другими ЕСМ материалами для задач конструирования ткани. НА может быть получен из многих коммерческих источников, предпочтительно, для бактериального ферментирования с использованием либо штаммов Streptomyces (например, Genzyme, LifeCore, NovaMatrix, и другие), либо для процесса бактериального ферментирования с использованием Bacillus subtilis в качестве хозяина в процессе ISO 9001:2000 (исключительно для Novozymes).
Идеальные отношения клеточных популяций должны повторять отношения in vivo в суспензиях клеток ткани. Смесь клеток обеспечивает созревание клеток-предшественников и/или сохранение зрелых клеточных типов, сопровождающее развитие необходимой васкуляризации. Таким образом, достигается сложная микросреда, использующая гиалуронаны как основу комплекса, содержащего множество компонентов матрикса и растворимых сигнальных факторов и предназначенного для имитирования специфических ниш микроокружения, состоящих из специфических наборов паракринных сигналов от эпителиальной клетки и мезенхимальной клетки на специфическом этапе развития. Ниже приведены примеры:
Микроокружение ниши стволовой клетки в печени состоит из паракринных сигналов между стволовой клеткой печени и ангиобластами. Оно состоит из гиалуронанов, коллагена типа III, специфических форм ламинина (например, ламинина 5), уникальной формы хондриотин сульфат протеогликана (CS-PG), который почти не содержит сульфатов, а отношение растворимого сигнала к составу среды близко или в точности соответствует отношению для среды Kubota, разработанной для клеток-предшественников печени. Нет жесткой потребности в других факторах, хотя при снабжении фактором стволовых клеток, лейкемическим ингибирующим фактором (LIF) и/или некоторыми интерлейкинами (например, IL6, IL11 и TGF-β1) могут наблюдаться эффекты. Ниша стволовой клетки формы CS-PG пока недоступна.
Микроокружение транзитной усиливающей клетки в печени морфологически находится между микроокружением гепатобластов и звездчатых клеток печени. Компоненты этого микроокружения включают гиалуронаны, коллагены типа IV специфические формы ламининов, которые связываются с β1 интегрином, более сульфатированные CS-PG, формы гепаран сульфат протеогликанов (HS-PG), и растворимые сигналы, которые включают среду Kubota, дополненную фактором роста эпидермиса (EGF), фактором роста гепатоцитов (HGF), фактором роста клеток стромального происхождения (SGF) и ретиноидами (например, витамином А).
Способы трансплантации
В зависимости от типа ткани может быть выбран соответствующий способ трансплантации. Для тканей, где трансплантаты должны заместить поврежденные или недостающие ткани (например, костные), подходит имплантируемый трансплантат. Затем в зависимости от выбранного способа могут быть выбраны соответствующие биоматериалы для улучшения способа. Могут потребоваться разные способы. Например, в примере с костью плотный матрикс позволяет засеять в матрикс клетки с необходимыми факторами роста и после культивирования имплантировать его пациенту, фигура 1.
Преимущество инъецируемых трансплантатов заключается в том, что они могут заполнить любой дефицит формы или расстояния (например, в поврежденных органах или тканях). В соответствии с этим способом клетки совместно культивируют и вводят в суспензию клеток, внедренную в желируемые биоматериалы, которые уплотняют in situ с помощью разных способов кросслинкинга. Смесь может быть непосредственно инъецирована в ткань или орган хозяина (например, в печень), инъецирована под капсулу органа, под любую оболочку ткани; инъецирована внутрь кармана, при образовании складки над частью сальника и приклеивании ее с образованием кармана; или при образовании кармана с использованием хирургического клея для прикрепления другого материала (например, паутины паука) к поверхности органа и введении в него смеси..
Непосредственная инъекция может заключаться в инъекции под Glisson капсулу печени и в паренхиму в нескольких местах, но в возможно меньшем количестве, чтобы избежать гидростатического давления со стороны гидрогеля, способного повредить ткань печени. Инъекцию трансплантатов ниши стволовых клеток в печень осуществляют с помощью двойного цилиндрического шприца, как было описано выше в данной заявке. Вкратце, смесь клеток с матриксом и средой загружают в одну часть шприца с иглой, присоединенной к другому шприцу, содержащему кросс-линкер PEGDA. Смесь может вводиться через иглу номером 25 непосредственно в печень и сразу подвергаться поперечному сшиванию для образования гидрогеля. Использование CMHA-S с PEGDA при рН 7,4 способствует инкапсулированию клеток так же как при инъекции in vivo, поскольку реакция поперечного сшивания происходит за несколько минут или менее, чем за to 10-20 мин, в зависимости от концентрации кросс-линкера.
Неорганические природные материалы типа хитозана, алгината, гиалуроновой кислоты, фибрина, желатина, а также многие синтетические полимеры могут удовлетворять требованиям к биоматериалам для инъекций. Эти материалы часто уплотняют с помощью способов, включающих термическое желирование, поперечное сшивание фото- и химическими методами. В суспензию клеток добавляют растворимые сигнальные вещества или специфические компоненты матрикса. Поскольку эти трансплантаты можно относительно легко вводить в желаемую область, нет необходимости (или она минимальна) в инвазивной хирургии, что уменьшает стоимость, дискомфорт пациента, риск инфекции и образование шрамов. Можно использовать также СМНА для инъектируемого материала для формирования ткани благодаря его длительному эффекту при сохранении биосовместимости. Методы кросс-линкинга также сохраняют биосовместимость материала, и его присутствие на больших регенерирующих поверхностях или в нишах стволовых клеток/клеток-предшественников делает его материалом, привлекательным для инъекций.
В некоторых воплощениях трансплантат может быть предназначен для помещения на поверхности органа или ткани; в этом случае трансплантат будет удерживаться на месте с биосовместимым и биодеградируемым покрытием («лейкопластырь»). Для некоторых абдоминальных органов это покрытие может быть получено из аутологичных тканей. Например, трансплантацию клеток печени (например клеток-предшественников гепатоцитов) на поверхность печени можно осуществлять, используя сальник хозяина для формирования инъекционного кармана. Сальник поднимают от места его локализации в брюшной полости и наклеивают на печень с помощью хирургического клея (например, фибринового клея, кожного протеза) для образования кармана для материала трансплантата. Двухцилиндровый шприц может быть вновь использован для введения матриксного материала в карман на поверхности печени.
Кроме того, трансплантат может быть сформирован в кармане сальника независимо от ткани-мишени. Например, вместо имплантирования трансплантата внутрь или на поверхность ткани-мишени, можно использовать способ имплантирования в эктопические участки. Трансплантат мог быть установлен внутрь кармана сальника, который мог бы быть сформирован с помощью фибринового клея (или его эквивалента). Этот подход может быть особенно применим для трансплантатов печени, когда печень хозяина слишком покрыта рубцами или имеет некоторые параметры, которые препятствуют успешному приживанию трансплантата в ткани как таковой. Другой пример относится к эндокринным клеткам (например, островковым), для которых в первую очередь требуется способность осуществлять кровоснабжение. Трансплантация эндокринных клеток, таких как островковые, могла бы осуществляться в кармане сальника.
Авторы настоящего изобретения показали, что жесткость, вязкоэластичные свойства и вязкость гидрогелей KM-HA могут зависеть от содержания CMHA-S и PEGDA. Гидрогели KM-HA, например, поддерживают постоянную жесткость в широком интервале частот возмущающей силы, причем демонстрируют постоянно эластичное поведение (фигура 2a) и истоньшение сдвига, при котором их вязкость снижается с ростом частоты возмущающей силы, (фигура 2b). Эти KM-HA гидрогели могут привести к модулю сдвига в интервале от 11 до 3500 Па с разными концентрациями PEGDA и CMHA-S при смешивании в забуфференной дистиллированной воде, но эти значения могут быть модулированы с помощью использования разных основных сред типа среды Kubota (фигура 2 и фигура 11).
Механические свойства ЕСМ, в которые засеваются трансплантируемые клетки, могут оказывать значительные эффекты на передачу сигналов, на транспорт и на способность клеток реагировать на механические силы с помощью механизмов, которые все вместе известны как механотрансдукция. Например, клетки-предшественники печени человека, такие как стволовые клетки печени, могут дифференцироваться при засевании в механически жесткие трансплантаты, такие как жесткие НА гидрогели с результирующим модулем сдвига в интервале от 11 до 3500 Па с разными концентрациями PEGDA и CMHA-S при смешивании в забуференной дистиллированной воде (фигура 2).
Колонии стволовых клеток печени имеют различную метаболическую активность в соответствии с составом содержащего их гидрогеля KM-HA. Абсолютная секреция в средах KM-HA сравнима с показателями функции печени (AFP, альбумин и мочевина) в процессе культивирования; однако абсолютная секреция, сопряженная с метаболической эффективностью, изображает процесс отбора, который зависит от содержания НА. (фигура 12). В этом процессе скорости секреции возрастают под давлением метаболизма для гидрогелей KM-HA с содержанием CMHA-S, меньшим, чем 1.2%; напротив, скорости секреции сравнительно невелики в гидрогелях KM-HA с большим содержанием CMHA-S (1.6%) и большими метаболическими функциями или даже повышенной жизнеспособностью, как в среде Е (фигура 3d). Поскольку hHpSCs и hHBs демонстрируют разные метаболические возможности, гидрогели KM-HA могут выбрать экспансию или дифференцирование клеток-предшественников гепатоцитов.
Анализ экспрессии маркеров дифференцирования в клетках-предшественниках гепатоцитов подтверждает, что дифференцирование происходит в гидрогелях KM-HA, о чем свидетельствует повышенная полная экспрессия генов ЕрСАМ по сравнению с установленными значениями для колоний на пластиковых плашках (фигура 5), а также гетерогенная экспрессия NCAM в колониях относительно внешних границ и на апикальной поверхности внешних клеток (фигура 4). Было показано, что CD44 экспрессирован на hHpSCs и hHBs на уровне экспрессии mRNA (фигура 5). В отличие от NCAM, большая экспрессия CD44 наблюдалась в гидрогелях KM-HA при содержании CMHA-S около 1.2% или меньше (фигура 4).
Уровни экспрессии mRNA зависят от жесткости гидрогелей KM-HA (фигура 5), причем эта зависимость от жесткости определяет два режима (один при низких жесткостях трансплантата, когда экспрессия снижается с увеличением жесткости, и другой при восстановлении экспрессии генов при высоких жесткостях трансплантата |G*|>200 Па). Эффект еще более значительный для Е-кадаверина: экспрессия белка отсутствует после точек бифуркаций вокруг |G*|=200 Па, несмотря на высокую экспрессию mRNA, которая соответствует тем из более мягких гидрогелей, в которых наблюдается экспрессия белка Е-кадаверина (фигура 4). Клетки, которые непосредственно подвержены действию внешних механических сил, таким образом, способны передавать сигналы соседним клеткам на внешней поверхности колонии.
Таким образом, продемонстрировав, что трансляционный контроль экспрессии Е-кадаверина зависит от жесткости окружающей среды, можно связать сигнальные механизмы в hHpSCs с их способностью коллективно приспосабливаться к жесткости их субстрата. Поэтому процессы превращения ген-белок в hHpSC определяются зависящим от жесткости бифуркационным критерием.
Изменения экспрессии генов колониями hHpSC, культивируемыми в гидрогелях KM-HA, предполагают постепенное дифференцирование внутри этих трехмерных сред. Особенно часто дифференцирование в данной культуральной модели может происходить в отсутствие биохимических добавок. Эти результаты показывают, что hHpSC, встроенные в различные гидрогели KM-HA, обнаруживают дифференцирование до промежуточных этапов hHB за 1 неделю статической культуры.
Криоконсервирование
В другом воплощении настоящего изобретения гели НА могут быть использованы с помощью обычных методов криоконсервирования, позволяющих получить лучшую сохранность и выживаемость после оттаивания. Обзор этого процесса показан на фигуре 6. Не придерживаясь теории и не связываясь с ней, считают, что включение НА улучшает сохранность с помощью стимуляции адгезионных механизмов (например, экспрессии Интегрина β1), облегчающих культивирование клеток и сохранение функции после оттаивания. Предпочтительно, концентрация НА находится в интервале от 0,01 до 1 весового процента, и более предпочтительно, от 0,5 до 0,10%.
Если не определено иное, все используемые здесь технические и научные термины имеют то же значение, которое обычно понимают средними специалистами в той области, куда относится данное изобретение. Все публикации, патентные заявки, патенты и другие упомянутые здесь ссылки включены полностью в виде ссылок. Кроме того, материалы, методы и примеры являются только иллюстративными и не предназначаются для ограничения.
Ниже изобретение будет описано в основном с помощью следующих иллюстративных примеров; однако рамки данного изобретения не предназначены для ограничения и не могут быть ограничены приводимыми ниже воплощениями.
Пример 1
Клетки-предшественники печени мыши выделяли из мыши-хозяина C57/BL6 (4-5 недель) согласно опубликованным протоколам. Для исследования трансплантатов вводили GFP датчик в клетки-предшественники печени. Затем клетки смешивали с гиалуронановыми (НА) гидрогелями, и НА поперечно сшивали с диакрилатом поли (этилен гликоля) - (PEG-DA) перед тем, как ввести исследуемой мыши. Для введения /трансплантации мышь анестезировали кетамином (90-120 мг/кг) и ксилазином (10 мг/кг), и вскрывали брюшину. Затем клетки с НА или без нее медленно вводили в, переднюю долю печени. Разрез зашивали, и животные получали 0,1 мг/кг бупренорфина каждые 12 часов в течение 48 часов. Через 48 часов животных усыпляли, и ткань удаляли, фиксировали и готовили срезы для гистологии.
Для определения локализации клеток в мышиной модели «контрольные» клетки-предшественники печени инфицировали в течение 4 часов при 37°C экспрессирующим люциферазу аденовирусным вектором при 50 POI. Прижизненную операцию выполняли как описано выше, и клетки (1-1,5Е6) вводили непосредственно в печеночную долю с НА или без НА. Непосредственно перед получением изображения мышам вводили подкожно люциферин, вызывая в трансплантированных клетках появление люминесцентного сигнала. Определяли локализацию клеток в организме мыши с помощью Кинетического оптического формирователя изображений IVIS.
Результаты
Через 24 часа «контрольные» клетки, введенные без трансплантирования с НА, обнаруживаются как в печени, так и в легких. Однако через 72 часа большая часть клеток не может быть локализована, только небольшое количество идентифицируемых клеток остается в печени. Напротив, трансплантированные по настоящему изобретению клетки наблюдались в виде группы клеток, успешно интегрированных в печень как через 24, так и через 72 часа, где они и остаются еще через 2 недели. Клетки, трансплантированные через нишу стволовых клеток, были также локализованы почти исключительно в ткани печени и не были найдены в других тканях при исследовании рандомизированных гистологических образцов (фигура 7).
Пример 2
Клетки-предшественники печени человека выделяли из эмбриональной ткани печени (16-20 недель) согласно приведенным протоколам. В клетки-предшественники вводили экспрессирующий люциферазу аденовирусный вектор. Затем клетки смешивали с тиол-модифицированной карбоксиметил НА (CMHA-S) в присутствии кросс-линкера диакрилата поли (этилен гликоля) - (PEG-DA) перед введением исследуемой мыши. Более конкретно, конструировали гидрогель, растворяя сухие реагенты НА в KM для получения 2.0% раствора (вес/объем) и растворяли кросс-линкер в KM для получения 4.0% раствора (вес/объем). Затем образцы инкубировали на 37°C водяной бане до полного растворения. Коллаген III и ламинин готовили при концентрации 1,0 мг/мл и смешивали с кросслинкером/гидрогелем в отношении 1:4.
Для введения /трансплантации мышей анестезировали кетамином (90-120 мг/кг) и ксилазином (10 мг/кг), и вскрывали брюшную полость. Затем клетки с НА или без нее медленно вводили в переднюю долю печени. Полость зашивали, и животные получали 0,1 мг/кг бупренорфина каждые 12 часов в течение 48 часов. Для моделей поврежденной печени вводили внутрибрюшинно однократную дозу 0,6 мкл/г. Через 48 часов животных усыпляли, ткани удаляли, фиксировали и готовили срезы для гистологии.
Для определения локализации клеток в мышиных моделях «контрольные» клетки-предшественники печени инфицировали в течение 4 часов при 37°C с экспрессирующим люциферазу аденовирусным вектором при 50 POI. Прижизненную операцию осуществляли, как было описано выше, и клетки (1-1,5Е6) вводили непосредственно в долю печени с НА или без нее. Сразу перед получением изображения мышам внутрибрюшинно вводили К соль люциферина (150 мг/кг), получая люминесцентный сигнал от трансплантированных клеток. Используя кинетический оптический формирователь изображений IVIS, определяли через 10-15 минут локализацию клеток в организме мыши (фигура 7).
Для определения функционирования трансплантированных клеток-предшественников печени человека оценивали значения концентрации секретированного альбумина человека в сыворотке мыши на 7 день. Образование альбумина измеряли с помощью ELISA с пероксидазой хрена, конъюгированной с флуоресцентными зондами, определяя оптическое поглощение при 450 нм (фигура 8). На 7 день удаляли из организма мыши пробы ткани, фиксировали их 2 дня в 4% PFA и хранили в 70% этаноле. Окрашивали срезы толщиной 5 мкм для гистологического исследования.
Результаты
На 7 день образцы крови, и ткани удаляли и фиксировали для гистологии. Наблюдалось небольшое увеличение сывороточного альбумина в модели повреждения по сравнению со здоровой моделью, и методы НА-трансплантации также показали увеличение по сравнению с результатами, полученными с суспензиями клеток без НА (фигура 8).
Ткань из мышей, обработанных CCl4, окрашивали на альбумин человека. Было показано, что клетки, трансплантированные способами, использующими НА, были сгруппированы и поддерживают большие клеточные массы трансплантированных клеток среди клеток хозяина. Однако клетки, трансплантированные с помощью клеточной суспензии образуют малые агрегаты по всей печени.
Пример 3
Клетки-предшественники поджелудочной железы человека выделяли из ткани поджелудочной железы. В клетки-предшественники вводили экспрессирующий люциферазу аденовирусный вектор. Затем клетки смешивали с тиол-модифицированной карбоксиметил НА (CMHA-S) в присутствии кросс-линкера диакрилата поли (этилен гликоля) - (PEG-DA) как описано в примере 2.
Для введения /трансплантации мышей анестезировали кетамином (90-120 мг/кг) и ксилазином (10 мг/кг), и вскрывали брюшную полость. Затем клетки с НА или без нее медленно вводили в переднюю долю печени. Полость зашивали, и животные получали 0,1 мг/кг бупренорфина каждые 12 часов в течение 48 часов. Для моделей поврежденной печени вводили внутрибрюшинно однократную дозу 0,6 мкл/г. Через 48 часов животных усыпляли, и ткани удаляли, фиксировали и готовили срезы для гистологии.
Для определения локализации клеток в мышиных моделях «контрольные» клетки-предшественники печени инфицировали в течение 4 часов при 37°C с экспрессирующим люциферазу аденовирусным вектором при 50 POL Прижизненную операцию осуществляли как было описано выше, и клетки (1-1,5Е6) вводили непосредственно в поджелудочную железу с НА или без нее. Сразу перед получением изображения мышам внутрибрюшинно вводили К соль люциферина (150 мг/кг), получая люминесцентный сигнал от трансплантированных клеток. Используя IVIS кинетический оптический формирователь изображений, определяли через 10-15 минут локализацию клеток в организме мыши.
Результаты
Через 24 часа «контрольные» клетки, введенные без трансплантирования с НА, обнаруживаются в поджелудочной железе среди прочих органов. Однако через 72 часа большая часть клеток не может быть локализована, и только небольшое количество идентифицируемых клеток остается в поджелудочной железе. Напротив, трансплантированные по настоящему изобретению клетки наблюдаются в виде группы клеток, успешно интегрированных в поджелудочную железу как через 24, так и через 72 часа и остаются еще через 2 недели.
Пример 4
Выполняли исследования для оценки жизнеспособности и функционирования стволовых клеток печени, засеянных в гидрогели. Жизнеспособность оценивали в культурах с помощью набора Molecular Probes Calcein AM live cell viability kit (Molecular Probes, Eugene Oregon). Проникающий через мембрану кальцеин AM расщеплялся в живых клетках эстеразами с образованием зеленой флуоресценции в цитоплазме. В течение 1 недели измеряли значения концентрации секретированного альбумина, трансферрина и мочевины в культуральной среде. Вкратце, собирали супернатант среды и хранили его замороженным при -20°C до анализа. Образование альбумина измеряли с помощью ELISA, используя количественные наборы ELISA для альбумина. Образование мочевины анализировали с помощью колориметрических реагентов для определения азота мочевины в крови. Все исследования проводили индивидуально на цитофлуориметрическом многоячеистом плашечном ридере Spectramax 250.
Результаты
Результаты представлены на фигурах 9 и 10. Через 3 недели культивирования в клетках определяли генетическую экспрессию. Значения экспрессии mRNA нормировали на GAPDH. Все измерения выражены в кратностях изменения по сравнению с исходными колониями стволовых клеток печени перед трехмерной культурой в гидрогелях гиалуронана. В обоих экспериментальных условиях гиалуронановой культуры (НА и НА + коллаген III + ламинин), наблюдается значительное возрастание ЕрСАМ (7,72±1,42, 9,04±1,82) и альбумина (5,57±0,73, 4,84±0,84) по сравнению с исходной экспрессией колонии. В обоих случаях наблюдалось также значительное снижение маркера дифференцирования гепатобласта AFP (0,55±0,11, 0,17±0,03). Кроме того, в условиях HA+CIII+Lam наблюдалось значительное снижение экспрессии AFP по сравнению с базовой НА культурой.
Пример 5
Оценивали эффекты механических свойств гидрогелей НА с разными концентрациями НА и PEGDA на встроенные hHpSCs, культивируемые в среде, не содержащей сыворотки. Используемые варианты сред суммированы в приведенной ниже таблице 3
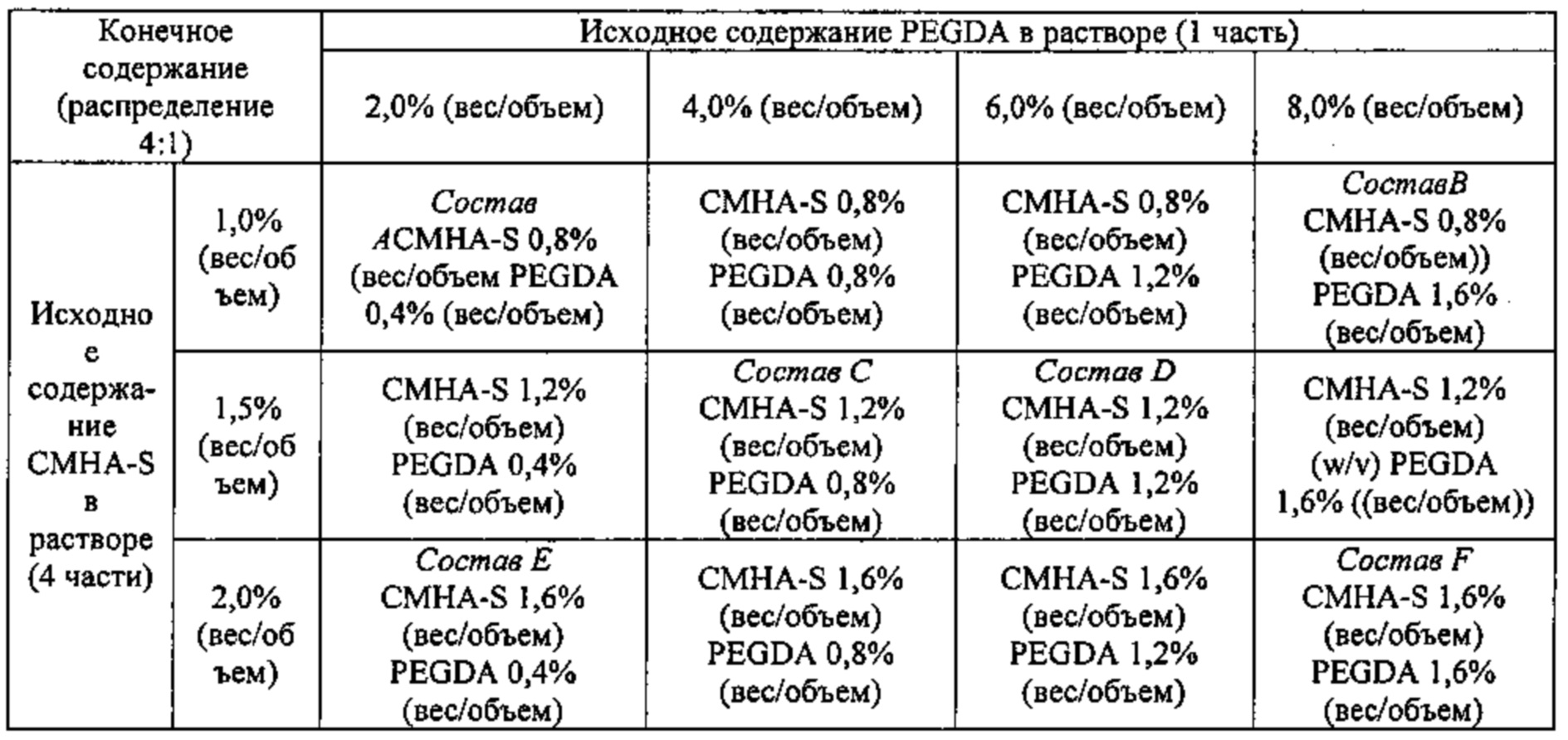
Конечную композицию гидрогеля KM-HA для каждого варианта среды получали смешиванием растворов тиол-модифицированной карбоксиметиловой НА (CMHA-S) и полиэтилен гликоль)-бис-акрилата (PEGDA) в отношении 4:1. Специфические концентрации сухих реагентов CMHA-S и PEGDA по отдельности смешивали в KM при рН 7,4 при специфической концентрации CMHA-S и PEGDA, и нагревали в течение 30 минут при 37°C, чтобы увеличить растворение сухих реагентов. Максимальный кросс-линкинг гидрогеля происходил без дополнительной среды в течение 1 часа в стерильных условиях в инкубаторе при 5% смеси CO2/air и при 37°C. Затем к гидрогелям добавляли 2,5 мл среды HK и инкубировали в течение ночи перед тестированием.
Для изучения коэффициента диффузии гидрогелевые среды гомогенизировали с помощью вортекса и формировали пластинки толщиной ~1 мм. Гидрогели инкубировали без дополнительных сред в течение 1 часа в стерильных условиях в инкубаторе со смесью 5% CO2/воздух и при 37°C, чтобы осуществить максимальный кросс-линкинг после смешивания. Образцы затем были дополнены равными объемами дополнительной KM с 2,5 мг/мл (0,036 мМ) конъюгированных с флуоресцеином 70-кDa молекул декстрана. Молекулы декстрана могли диффундировать в образцы в течение ночи перед тестированием.
Коэффициенты диффузии гидрогелей НА измеряли с помощью системы восстановления флуоресценции после фотовыцветания (FRAP) system. Тестирование в ячейках на образцах осуществляли после уравновешивания с комнатной температурой для получения изображений без предварительного засасывания KM, дополненного D70. В каждом образце исследовали всего 5 индивидуальных 30-секундных пятен фотовыцветания (13,5-мватт 458/488 нм возбуждения аргоновым лазером, геометрия выцветания: кружок диаметром 35-мкм), одно однонаправленное сканированное изображение до выцветания и, одно однонаправленное сканированное изображение после прекращения выцветания и 28 однонаправленных сканированных изображений с интервалами 4,0-секунд после этого (размер рамки 256×256 пикселей, разрешение 0,9 мкм/пиксель) требовались для последующей обработки через одиночный зеленый канал (эмиссия LP 505 нм).
Результаты
Жесткость, вязкоупругие свойства и вязкость гидрогелей KM-HA зависят от содержания CMHA-S и PEGDA. Гидрогели KM-HA поддерживают постоянную жесткость в широком интервале частот возмущающей силы, обнаруживая в то же время вполне упругое поведение и истоньшение сдвига, поскольку вязкость уменьшается с увеличением частоты возмущающей силы. Содержание CMHA-S и PEGDA контролировали механические свойства гидрогелей KM-HA (фигура 11a). Напротив, диффузионные свойства гидрогелей KM-HA оптимальны, поскольку они сравнимы со свойствами среды Kubota's без добавок (фигура 11b).
Колонии стволовых клеток печени смешивали с гидрогелями KM-HA и начинали превращать их плоскую конфигурацию в агломерацию сфероидных структур или свертывание в 3D структуры, причем то и другое является признаками дифференцирования. После 1 недели культивирования морфология клеток становится разнообразной, и некоторые клетки увеличиваются до приблизительно 15 мкм в диаметре, что характерно для hHB. Иммуноокрашивание антителами с целью маркирования клеточной поверхности на hHpSC и hHB, как и на ЕрСАМ, CD44 и CDH1, подтверждало дифференцирование.
В процессе культивирования hHpSC во всех проверенных композициях KM-HA гидрогели секретировали AFP и альбумин в возрастающих концентрациях, в то время как синтез мочевины уравнивался до сравнимых значений во всех KM-HA гидрогелях к седьмому дню (фигура 12). После 1 недели культивирования значения экспрессии mRNA ЕрСАМ в колонии клеток hHpSC, посеянных в гидрогели KM-HA, были значительно выше, чем в 2D-выращенных hHpSC колониях или свежевыделенных hHB. Значения экспрессии mRNA NCAM, AFP и Е-кадаверина (CDH1) для hHpSC в гидрогелях KM-HA также значительно отличались от значений в 2D-выращенных hHpSC колониях (фигура 5).
Количественные измерения экспрессии генов маркеров дифференцирования для hHpSCs (NCAM, AFP, CDH1) и маркеров, общих для hHpSC и hHB (CD44, ЕрСАМ), проявляли постепенное снижение с ростом жесткости гидрогеля KM-HA для |G*|<200 Па и последующего восстановления (фигура 5). Клетки из всех типов гидрогеля экспрессировали белки ЕрСАМ, NCAM и CD44; однако, обогащенный CD44 возникал, в составе KM-HA, содержащем 1.2% CMHA-S или меньше, в то время как NCAM оставался богатым во всех вариантах гидрогелей KM-HA (фигура 4).
Пример 6
Исследовали влияние HA на улучшение сохранности механизмов адгезии, способные облегчить культивирование клеток и сохранение их функционирования после оттаивания. Свежевыделенные hHpSC и гепатобласты выделяли из эмбриональной печени и криоконсервировали в одном из нескольких различных буферов для криоконсервирования с добавлением 0,5 или 0,10% гиалуронанов (НА). или без него. Более конкретно, образцы замораживали при концентрации 2×106 клеток/мл в растворе для криоконсервирования, содержащем либо культуральную среду с добавлением 10% DMSO, либо CryoStorTM-CS10 (Biolife Solutions), и 0,05, или 0,10% НА гидрогеля по весу. Клеткам позволяли уравновешиваться с растворе для криоконсервирования в течение 10 мин при 4°C перед контролируемым замораживанием в НА без поперечных связей, как показано на фигуре 13.
После оттаивания клетки наносили на плашки для культуры ткани, покрытые коллагеном III при 1 мкг/см для облегчения прикрепления стволовых клеток.
Результаты
Все проверенные буферы свидетельствовали о высоких значениях выживаемости (80-90%) после оттаивания (фигура 14). Однако добавление НА демонстрировало значительное улучшение способности консервированных клеток прикрепляться к поверхности(ям) культуры ткани и культивированию. Наилучшие результаты наблюдались для клеток, криоконсервированных в изотонической среде CS10 с добавлением небольших количеств гиалуронанов (0,05 или 0,10%). Полученные результаты обнаруживают улучшенные способы криоконсервирования свежевыделенных предшественников клеток печени человека в условиях без сыворотки, предлагая более эффективные способы для хранения стволовых клеток как для исследовательских, так и для потенциально терапевтических целей.
Определяли экспрессию межклеточных факторов адгезии и факторов адгезии клеток к матриксу. Результаты профилей генетической экспрессии молекул адгезии клеток в криоконсервированных образцах можно видеть на фигуре 15. Наибольшая экспрессия интегрина β1 была видна в образцах, замороженных в CS10+0.05% НА (0,130±0,028, n=28). Это существенно отличается от экспрессии, наблюдаемой в свежих образцах (0,069±0,007, n=24, р<0.01). Кроме того, экспрессия CDH-1 (Е-кадаверина) в клетках, замороженных в CS10+0,1% НА (0,049±0,006, n=20) и CS10+0,05% HA (0.064±0,003, n=16) демонстрировала значительное увеличение по сравнению со свежими образцами (0,037±,005, n=36, р<0,05).
Несмотря на то, что изобретение было описано в связи с его специфическими воплощениями, следует иметь в виду, что оно способно к дальнейшим модификациям, и данная заявка должна охватить все варианты, применения или изменения предлагаемого ниже изобретения. В целом, принципы данного изобретения, включая такие отклонения от настоящего изложения, которые проявляются в пределах известной или общепринятой практики в области, к которой относится изобретение и которая может быть применена к приведенным выше существенным характеристикам, представлены в рамках приложенной формулы.
Реферат
Группа изобретений относится к медицине, а именно к трансплантологии, и может быть использована для трансплантации клеток печени субъекту, имеющему заболевание или дисфункцию печени. Для этого непосредственно в или на печень субъекта вводят смесь, содержащую клетки печени и один или несколько биоматериалов, полученных из модифицированной тиолом карбоксиметил НА (CMHA-S), причем клетки печени содержат одну или несколько комбинаций одной или нескольких эпителиальных клеток и одного или нескольких из мезенхимальных линейных клеточных партнеров. Также предложен способ введения в или на печень субъекта смеси, содержащей клетки печени и один или несколько биоматериалов, причем клетки печени содержат один или несколько предшественников клеток печени, и по меньшей мере один или несколько биоматериалов произведены из модифицированной тиолом карбоксиметил НА (CMHA-S), при этом смесь получают как гидрогель, содержащий клетки, смешивая CMHA-S, полиэтиленгликольдиакрилат (PEG-DA) и клетки с последующим сшиванием посредством PEG-DA. Группа изобретений позволяет обеспечить необходимую пролиферацию и трансплантацию поврежденной ткани за счет доставки трансплантируемых клеток в виде агрегатов, прикрепленных внутри или к поверхности подложек, которые могут быть помещены в поврежденную ткань. 2 н. и 22 з.п. ф-лы, 3 табл., 15 ил., 6 пр.

Комментарии