Биоразрушаемые трехблочные сополимеры сложного полиэфира и полиэтиленгликоля, имеющие низкую молекулярную массу и обратимые термические желатинирующие свойства - RU2232779C2
Код документа: RU2232779C2
Чертежи


Описание
Настоящее изобретение относится к водорастворимым, термочувствительным, биоразрушаемым блок-сополимерам с низкой молекулярной массой, имеющим высокий массовый процент (по меньшей мере 50 процентов) гидрофобного блока(ов), и их использование для парентерального, глазного, местного, чрескожного, вагинального, трансбуккального введения, введения через слизистую оболочку, легочного, трансуретального, ректального, назального, перорального или ушного введения лекарственных средств. Данное изобретение стало возможным благодаря использованию термочувствительных биоразрушаемых трехблочных полимеров, основанных на блоках биоразрушаемого сложного полиэфира и полиэтиленгликоля (ПЭГ), которые описываются подробно в дальнейшем. Система основана на открытии, что только выбранная подгруппа таких блок-сополимеров с относительно низкой молекулярной массой и относительным высоким содержанием гидрофобного блок-полимера существует в виде прозрачных растворов при температуре или приблизительно при температуре от 5 до 25°С в воде, но, когда температура повышается приблизительно до температуры тела (обычно 37°С для людей), они самопроизвольно взаимодействуют с образованием полутвердых гидрогелей (то есть гелей), которые содержат высокий процент воды, уловленной в сетчатой структуре геля, и все же по существу являются не растворимыми в воде.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ И КРАТКОЕ ИЗЛОЖЕНИЕ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
За последнее время многие пептидные/белковые лекарственные средства, эффективные для различных терапевтических применений, стали коммерчески доступными благодаря успехам в генной инженерии и других технологиях. Однако полипептиды или белки с их высокой молекулярной массой, разрушением ферментами желудочно-кишечного тракта и коротким полупериодом существования в организме ограничены для парентерального введения такими путями, как внутривенная или внутримышечная и подкожная инъекция. Многие пептидные лекарственные средства имеют ограниченную растворимость и/или стабильность в общепринятых жидких носителях и, следовательно, их трудно применять для приготовления и введения. Кроме того, во многих случаях для достижения терапевтического действия в течение продолжительного периода времени требуются многочисленные введения. Долговременная регулируемая доставка таких полипептидов или белков является существенной для обеспечения практического применения этих лекарственных средств и для использования лекарственных средств, полученных усовершенствованной биотехнологией. Другой проблемой является согласие пациента на предписанный режим. Обычно трудно встретить пациента, который следовал бы прописанной схеме приема лекарственных средств, особенно, когда лекарственная пропись предназначается для лечения хронического заболевания и лекарственное средство имеет острое побочное действие. Следовательно, очень желательно обеспечить систему для доставки лекарственных средств, в частности полипептидных и белковых лекарственных средств, при регулируемой скорости в течение продолжительного периода времени без вышеуказанных проблем, чтобы оптимизировать терапевтическую эффективность, минимизировать побочное действие и токсичность и, таким образом, повысить эффективность лечения и повысить степень согласия пациента с предписанным режимом.
Нагруженные лекарственным средством полимерные устройства и лекарственные формы были исследованы в течение продолжительного периода времени при терапевтическом лечении различных заболеваний. Важным свойством полимера является биоразрушаемость, означающая, что данный полимер может разрушаться или расщепляться в организме с образованием нетоксичных компонентов либо с сопутствующим высвобождением лекарственного средства, либо после того, как произошло высвобождение всего лекарственного средства. Кроме того, способы, операции, растворители и другие добавки, используемые для изготовления устройства и загрузки лекарственного средства, должны привести к получению лекарственных форм, которые безопасны для пациента, минимизируют раздражение окружающей ткани и должны быть совместимой средой для лекарственного средства. В настоящее время биоразрушаемые имплантируемые устройства с регулируемым высвобождением лекарственного средства изготовляют из твердых полимеров, таких как полигликолевая кислота, полимолочная кислота или сополимеры гликолевой и молочной кислот. Вследствие гидрофобных свойств этих полимеров загрузка лекарственного средства и изготовление устройства с использованием этих материалов требуют органических растворителей, например метиленхлорида, хлороформа, уксусной кислоты или диметилформамида. Вследствие токсичной природы некоторых растворителей после этого процесса обычно требуется экстенсивная сушка для удаления избыточного растворителя. В большинстве случаев конечное полимерное устройство изготовляют в виде отдельной твердой формы (например, сферы, полоски или палочки), требующей процедуры имплантации, которая часто приводит к травмам ткани.
В настоящее время имеется несколько синтетических или природных полимерных материалов, которые можно использовать для регулируемой доставки лекарственных средств, в том числе пептидных и белковых лекарственных средств, вследствие строгих регулирующих требований соблюдения режима и схемы лечения, таких как биосовместимость, явно определенный путь разложения и безопасность продуктов разложения. Наиболее широко исследованными и усовершенствованными биоразрушаемыми полимерами в отношении приемлемых токсикологических и клинических данных являются алифатические поли-(α-гидроксикислоты), такие как поли-(D,L- или L-молочная кислота) (ПМК) и полигликолевая кислота (ПГК) и их сополимеры (ПМГК). Эти полимеры коммерчески доступны и в настоящее время используются в качестве биорассасываемых шовных материалов. Одобренная FDA (Администрация по пищевым продуктам и лекарственным средствам) система для регулируемого высвобождения ацетата лейпролида, Lupron DepotTM, также основана на сополимерах ПМГК. Lupron DepotTM состоит из инъецируемых микросфер, которые высвобождают ацетат лейпролида на протяжении пролонгированного периода времени (например, на протяжении приблизительно 30 дней) для лечения рака простаты. На основании этой истории использования, сополимеры ПМГК были наилучшими материалами в первоначальной разработке парентеральных систем доставки с регулируемым высвобождением лекарственных средств с использованием биоразрушаемого носителя.
Даже несмотря на достижение некоторых ограниченных успехов, эти полимеры имеют проблемы, связанные с их физико-химическими свойствами и способами изготовления. Гидрофильные макромолекулы, такие как полипептиды, не могут легко диффундировать через гидрофобные матрицы или мембраны полилактидов. Загрузка лекарственного средства и изготовление устройства с использованием ПМК и ПМГК часто требуют применения токсичных органических растворителей, и твердая лекарственная форма может механически индуцировать раздражение ткани.
A.S.Sawhney and J.A. Hubbell, J. Biomed. Mat. Res., 24, 1197-1411 (1990), синтезировали терполимеры D,L-лактида, гликолида и ε-капролактона, которые быстро разрушаются in vitro. Например, композиция терполимера из 60% гликолида, 30% лактида и 10% ε-капролактона, имела полупериод существования 17 дней. Гидрофильность данного материала повышали сополимеризацией с поверхностно-активным веществом полоксамером (pluronic F-68). Полоксамер представляет собой блок-сополимер, включающий приблизительно 80 мас.% относительно гидрофобного поли(оксипропиленового) блока и 20 мас.% гидрофильного поли(оксиэтиленового) блока. Сополимеризация с полоксамером приводила к образованию более прочного и частично кристаллического материала, который был механически стабилен при физиологических температурах (например, 37°С) в воде. Полупериод существования данного сополимера слегка повышался по сравнению с базовым полимером. Однако известно, что поверхностно-активные вещества типа полоксамера не являются биоразрушаемыми материалами.
Оптимальный материал для использования в качестве инъецируемого или имплантируемого полимерного устройства для доставки лекарственного средства должен быть биоразрушаемым, совместимым с гидрофильными или гидрофобными лекарственными средствами и должен позволить проводить изготовление с простыми, безопасными растворителями, такими как вода, и не требует дополнительной полимеризации или других, образующих ковалентные связи реакций после введения.
Одна система, которую можно изготовить в водном растворе, представляет собой класс блок-сополимеров, указанных выше и продаваемых под товарным знаком pluronicTM. Эти сополимеры состоят из двух разных полимерных блоков, т.е. гидрофильных поли(оксиэтиленовых) блоков и гидрофобных поли(оксипропиленовых) блоков, которые составляют трехблочный сополимер поли(оксиэтилен)-поли(оксипропилен)-поли(оксиэтилен). Такие трехблочные сополимеры абсорбируют воду с образованием гелей, которые проявляют свойства обратимого термического желатинирования. Однако система pluronicTM не является биоразрушаемой и, как доказано, свойства ее геля (растворимого в воде геля) и кинетика высвобождения лекарственного средства (очень быстрое высвобождение) из таких гелей не пригодны и требуют существенного усовершенствования такой системы.
Существует значительная потребность в гидрофильных биоразрушаемых материалах, которые можно использовать для введения растворимых в воде полипептидных лекарственных средств в растворе. A.S. Sawhney et al., Macromolecules, vol 26, №4, 581-589 (1993), синтезировали макромеры, имеющие в качестве центрального блока полиэтиленгликоль, удлиненный олигомерами α-гидроксикислот, такими как олиго-(D,L-молочная кислота) или олиго(гликолевая кислота), и имеющий на концах акрилатные группы. С использованием нетоксичных фотоинициаторов эти макромеры можно быстро полимеризовать с использованием видимого света. Вследствие полифункциональности макромеров полимеризация приводит к образованию сшитых гелей. Гели разрушаются при гидролизе областей олиго-(α-гидроксикислот) с образованием полиэтиленгликоля, α -гидроксикислоты и олиго(акриловой кислоты), и скорости их разрушения можно задать посредством подходящего выбора олиго(α-гидроксикислоты) от менее чем 1 дня вплоть до 4 месяцев. Однако в этой системе используют дополнительный компонент, фотоинициатор, а также дополнительную, образующую ковалентную связь фотосшивающую реакцию. С таким подходом можно получить очень изменчивую от индивидуума к индивидууму эффективность вследствие различий между индивидуумами в толщине и непрозрачности кожи.
Okada et al., патент Японии 2-78629 (1990), синтезировали биоразрушаемые блок-сополимерные материалы переэтерификацией поли(молочной кислоты) (ПМК) или полимера поли(молочная кислота)/гликолевая кислота (ПМГК) и полиэтиленгликоля (ПЭГ). Диапазон молекулярной массы был для ПМГК от 400 до 5000 и для ПЭГ - от 200 до 2000. Смесь нагревали при температуре от 100 до 250°С в течение от 1 до 20 часов в атмосфере азота. Продукт был смешиваемым с водой и образовывал гидрогель; однако он осаждался в воде при температуре, выше комнатной. Другими словами, растворимость в воде и взаимодействие интерполимерных цепей изменялись с температурой. Данный полимер аналогичен полимерам, описанным в патентах Churchill, обсужденных ниже, его используют в виде водной суспензии или сформованного твердого блока для имплантации. Не существует указания на то, что данный полимер проявляет свойства обратимого термического желатинирования, и поэтому он должен быть введен инъекцией в виде раствора вместо коллоидальной суспензии полимера.
L. Matsuda, ASAIO Journal, M512-M517 (1993), использовал биоразрушаемый полимерный гель для доставки сильнодействующего пептидилсодержащего антипролиферативного агента, ангиопептина, для профилактики миоинтимальной гиперплазии, которая имеет место, когда больной сосуд заменяют на искусственный трансплантат или обрабатывают внутрисосудистым устройством. Очень вязкую жидкость блок-сополимера, состоящего из блок-сегментов поли(молочной кислоты) и полиэтиленгликоля (ПМК-ПЭГ), использовали в качестве in situ покрываемого носителя лекарственного средства. Такие материалы поставлялись Taki Chemical Co., Ltd., Hyogo, Japan. Пролонгированное медленное высвобождение ангиопептина из геля полимера, состоящего из 0,5 г ПМК-ПЭГ и 0,5 мг ангиопептина, наблюдали in vitro на протяжении нескольких недель, когда гель сохраняли в буферном растворе, в котором поддерживали 37°С. Никакого преждевременного высвобождения ангиопептина типа выброса не наблюдали. На основании этих результатов теоретически было показано, что локальное продолжительное высвобождение ангиопептина из биоразрушаемого полимерного геля, который был нанесен на поврежденный сосуд in vivo, является эффективным.
L. Martini et al., J. Chem. Soc., Faraday Trans., 90 (13), 1961-1966 (1994), синтезировали трехблочные сополимеры типа АВА с очень низкой молекулярной массой введением гидрофобного поли-(ε-капролактона), который, как известно, подвергается разрушению in vivo гидролитическим расщеплением цепей, включающих сложноэфирные связи, и описали свойства раствора блок-сополимеров ПМК-ПЭГ-ПМК. Визуально наблюдали помутнение, когда водный раствор блок-сополимеров медленно нагревали. Точки помутнения 2% по массе водных растворов сополимеров были 65 и 55°С для ПМК-ПЭГ-ПМК (450:4000:450) и ПМК-ПЭГ-ПМК (680:4000:680), соответственно. Обратимое желатинирование при охлаждении растворов ПМК-ПЭГ-ПМК (680:4000:680) наблюдали при критических концентрациях и температурах, составляющих от 13% при 25° С до 30% при 80°С. Превращение слабый гель/золь не наблюдали при дальнейшем охлаждении растворов до 0°С. Скорость разрушения in vitro ПМК-ПЭГ-ПМК (680:4000:680) была очень медленной. Только приблизительно 20%-ное понижение в молярной массе (данные ГПХ, гель-проникающая хроматография) наблюдали на протяжении периода 16 недель. Такое медленное разрушение недостаточно для практического наполнителя, доставляющего лекарственное средство.
Churchill et al., патенты США 4526938 и 4745160, описали сополимеры, которые либо являются самодиспергируемыми либо могут быть сделаны самодиспергируемыми в водных растворах. Эти сополимеры являются АВА-трехблочными или АВ-блочными сополимерами, состоящими из гидрофобных А-блоков, таких как полилактид (ПМК) или поли(лактид-согликолид) (ПМГК), причем функциональными являются массы меньше чем 5000. Кроме того, не имеется примеров полимеров типа АВА, кроме большой молекулы, полученных без использования органических растворителей и гидрофильных В-блоков, таких как полиэтиленгликоль (ПЭГ) или поливинилпирролидон. Чтобы самодиспергироваться в воде без использования органических растворителей, предпочтительно, эти полимеры должны содержать более чем 50 мас.% гидрофильного (В-блок) компонента по сравнению с гидрофобным (блок А) компонентом, или должны быть сополимерами, у которых гидрофобный компонент (блок А) имеет среднюю молекулярную массу меньше чем 5000. Хотя указываются полимеры, имеющие среднюю молекулярную массу только 1000, не имеется прямого указания об использовании таких полимеров или полимеров типа АВА, имеющих гидрофобное содержание по меньшей мере 50 мас.%. Не имеется указания на то, что без использования органических растворителей эти блок-сополимеры растворимы в водных растворах при любой температуре, не имеется какого-либо указания на то, что лекарственное средство/полимеры можно вводить в виде раствора. Вернее описывается введение в виде коллоидальной суспензии полимера или указывается, что дисперсии лекарственное средство/полимер сушат вымораживанием с образованием порошка и обрабатывают прямым прессованием с образованием твердого вещества, пригодного для использования в качестве готовой препаративной формы в виде имплантируемого депо. Водные суспензии или дисперсии лекарственное средство/полимер являются двухфазными системами, в которых фаза диспергированного полимера суспендирована в непрерывной водной фазе. Такие дисперсии не пригодны для использования в ситуациях, когда требуются способы стерильного фильтрования для удаления бактериальных или других токсичных частиц, так как любой такой способ может также удалить частицы лекарственное средство/полимер и может привести к субтерапевтическим дозам. Блок-сополимеры типа АВА, которые являются водорастворимыми и которые желатинируются при нагревании, не включаются в патенты Churchill et al.
На основании вышеуказанного обсуждения можно обнаружить, что известные термически обратимые гели (например, pluronicsTM) по существу не пригодны в качестве систем для доставки лекарственных средств. Хотя имеются блок-сополимеры, которые обладают свойствами обратимого термического желатинирования, эти гели не имеют критических характеристик, необходимых для регулирования высвобождения лекарственного средства на протяжении длительного периода времени, и представляют противоречивые результаты токсичности или биосовместимости вследствие отсутствия у них биоразрушаемости. Таким образом, хотя свойства обратимого термического желатинирования широко признаны как уникально и потенциально исключительно полезные в области доставки лекарственных средств, все же необходимо разработать систему, которая обладает свойствами, необходимыми для жизнеспособной системы.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предоставление систем трехблочных сополимеров с низкой молекулярной массой для доставки лекарственного средства, которые являются биоразрушаемыми, обладают свойствами обратимого термического желатинирования, то есть существуют в виде водного раствора при низких температурах, обратимо образуют гели при физиологически подходящих температурах и обеспечивают хорошие характеристики высвобождения лекарственного средства.
Следующей задачей настоящего изобретения является предоставление системы доставки лекарственного средства для парентерального введения гидрофильных и гидрофобных лекарственных средств, пептидных и белковых лекарственных средств, гормонов, генов/нуклеиновых кислот, олигонуклеотидов и противораковых средств.
Еще одной задачей настоящего изобретения является предоставление способа парентерального введения лекарственных средств в биоразрушаемой полимерной матрице, приводящего к образованию гелевого депо в теле, из которого лекарственные средства высвобождаются при регулируемой скорости.
Данные и другие задачи изобретения достигаются при помощи биоразрушаемого блок-сополимера типа АВА или ВАВ, имеющего среднюю молекулярную массу приблизительно между 2000 и 4990 и содержащего приблизительно от 51 до 83 мас.% гидрофобного полимерного блока А, включающего биоразрушаемый сложный полиэфир, и приблизительно от 17 до 49 мас.% гидрофильного полимерного блока В, состоящего из полиэтиленгликоля (ПЭГ). Биоразрушаемый сложный полиэфир, предпочтительно, синтезируют из мономеров, выбранных из группы, состоящей из D,L-лактида, D-лактида, L-лактида, D,L-молочной кислоты, D-молочной кислоты, L-молочной кислоты, гликолида, гликолевой кислоты, ε-капролактона, ε-гидроксигексановой кислоты, γ-бутиролактона, γ-гидроксимасляной кислоты, δ -валеролактона, δ-гидроксивалериановой кислоты, гидроксимасляных кислот, яблочной кислоты и их сополимеров. Более предпочтительно, биоразрушаемый сложный полиэфир синтезируют из мономеров, выбранных из группы, состоящей из D,L-лактида, D-лактида, L-лактида, D,L-молочной кислоты, D-молочной кислоты, L-молочной кислоты, гликолида, гликолевой кислоты, ε-капролактона, ε -гидроксигексановой кислоты и их сополимеров. Очень предпочтительно, биоразрушаемый сложный полиэфир синтезируют из мономеров, выбранных из группы, состоящей из D,L-лактида, D-лактида, L-лактида, D, L-молочной кислоты, D-молочной кислоты, L-молочной кислоты, гликолида, гликолевой кислоты и их сополимеров.
Полиэтиленгликоль (ПЭГ) иногда называют также поли(этиленоксидом) (ПЭО) или поли(оксиэтиленом), и данные термины можно использовать взаимозаменяемо для задач настоящего изобретения.
В гидрофобном А-блоке содержание лактата составляет приблизительно от 20 до 100, предпочтительно приблизительно от 20 до 80 мол.% и очень предпочтительно приблизительно от 50 до 80 мол.%. Содержание гликолята составляет приблизительно от 0 до 80 мол.%, предпочтительно приблизительно от 20 до 80 мол.% и очень предпочтительно приблизительно от 20 до 50 мол.%.
Дополнительные задачи и преимущества данного изобретения станут очевидны из следующего краткого и подробного описания различных примеров осуществления, составляющих данное изобретение.
Используемые здесь следующие термины будут иметь установленные значения:
“Парентеральное” будет означать внутримышечное, внутрибрюшинное, внутрибронхиальное, подкожное и, если осуществимо, внутривенное и интраартериальное введение.
“Температура желатинирования” означает температуру, при которой биоразрушаемый блок-сополимер подвергается обратимому термическому желатинированию, т.е. температура, ниже которой блок-сополимер растворим в воде и выше которой блок-сополимер подвергается фазовому превращению с повышением вязкости или образованием полутвердого геля.
Термины “температура желатинирования” и “температура обратимого термического желатинирования” или тому подобное будут использоваться взаимозаменяемо в названии температуры желатинирования.
“Раствор полимера”, “водный раствор” и тому подобное, когда их используют для обозначения биоразрушаемого блок-сополимера, содержащегося в таком растворе, будут означать раствор на водной основе, имеющий такой блок-сополимер, растворенный в нем при функциональной концентрации, и сохраняющийся при температуре ниже температуры желатинирования блок-сополимера.
“Обратимое термическое желатинирование” представляет собой феномен, посредством которого самопроизвольно повышается вязкость раствора блок-сополимера и во многих случаях раствор превращается в полутвердый гель, когда температура раствора повышается выше температуры желатинирования сополимера. Для задач данного изобретения термин “гель” включает как состояние полутвердого геля, так и состояние высокой вязкости, которое существует при температуре выше температуры желатинирования. При охлаждении ниже температуры желатинирования происходит самопроизвольное обращение геля с образованием снова раствора с более низкой вязкостью. Этот цикл между раствором и гелем можно повторять ad infinitum, поскольку превращение золь/гель не включает никакого изменения в химическом составе полимерной системы. Все взаимодействия для создания геля являются физическими по природе и не включают образования или разрушения ковалентных связей.
Термины “жидкость для доставки лекарственного средства” или “жидкость для доставки лекарственного средства, имеющая свойства обратимого термического желатинирования” будут означать раствор полимера, который содержит лекарственное средство (лекарственное средство per se может быть либо растворенным, либо коллоидальным), пригодное для введения теплокровному животному, и который образует гелеобразное депо лекарственного средства, когда температура повышается до температуры желатинирования блок-сополимера или выше.
“Депо” означает жидкость для доставки лекарственного средства после введения теплокровному животному, которая образовала гель при температуре, которая повысилась до температуры желатинирования или выше.
“Гель” означает полутвердую фазу, которая самопроизвольно образуется, когда температура “раствора полимера” или “жидкости для доставки лекарственного средства” повышается до температуры желатинирования блок-сополимера или выше.
“Водная композиция полимера” означает либо жидкость для доставки лекарственного средства, либо гель, состоящий из водной фазы, имеющей равномерно содержащееся в ней лекарственное средство и биоразрушаемый блок-сополимер. При температуре ниже температуры желатинирования, сополимер может быть растворим в водной фазе и композиция может быть раствором. При температурах, являющихся температурой желатинирования или выше такой температуры, сополимер будет отверждаться с образованием геля с водной фазой, а композиция будет гелем или полутвердой системой.
“Биоразрушаемый” означает, что блок-сополимер может химически разрушаться или расщепляться в теле с образованием нетоксичных компонентов. Скорость разрушения может быть такой же или отличной от скорости высвобождения лекарственного средства.
“Лекарственное средство” будет означать органическое или неорганическое соединение или вещество, обладающее биоактивностью и приспособленное или использованное для терапевтической цели. В более широкое определение лекарственного средства включают белки, гормоны, противораковые средства, олигонуклеотиды, ДНК, РНК и гены для терапии.
Термины “пептид”, “полипептид”, “олигопептид” и “белок” будут использоваться взаимозаменяемо при упоминании пептидных или белковых лекарственных средств и не будут ограничиваться в зависимости от любой молекулярной массы, пептидной последовательности или длины, области биоактивности или терапевтического использования, если не оговорено особо.
“Поли(лактид-со-гликолид)” или “ПМГК” будет означать сополимер, полученный сополиконденсацией молочной кислоты и гликолевой кислоты или полимеризацией с раскрытием кольца предшественников α-гидроксикислоты, таких как лактид или гликолид. Термин “лактид”, “лактат”, “гликолид” и “гликолят” используют взаимозаменяемо.
“Поли(лактид)” или “ПМК” будет означать полимер, полученный конденсацией молочной кислоты или полимеризацией с раскрытием кольца лактида. Термины “лактид” и “лактат” используют взаимозаменяемо.
“Биоразрушаемые сложные полиэфиры” относится к любым биоразрушаемым сложным полиэфирам, которые предпочтительно синтезируют из мономеров, выбранных из группы, состоящей из D,L-лактида, D-лактида, L-лактида, 0,1-молочной кислоты, D-молочной кислоты, L-молочной кислоты, гликолида, гликолевой кислоты, ε-капролактона, ε-гидроксигексановой кислоты, γ-бутиролактона, γ-гидроксимасляной кислоты, δ-валеролактона, δ-гидроксивалериановой кислоты, гидроксимасляных кислот, яблочной кислоты и их сополимеров.
Следовательно, настоящее изобретение основано на открытии блок-сополимеров АВА-или ВАВ-типа, где А-блоки являются относительно гидрофобным полимерным блоком А, включающим биоразрушаемый сложный полиэфир, и В-блоки являются относительно гидрофильным полимерным блоком В, включающим полиэтиленгликоль (ПЭГ), эти блок-сополимеры имеют содержание гидрофобной части приблизительно от 51 до 83 мас.% и общую блок-сополимерную молекулярную массу приблизительно от 2000 до 4990, обладают растворимостью в воде при низкой температуре и подвергаются обратимому термическому желатинированию при температурах физиологического тела млекопитающего. При таком высоком гидрофобном содержании неожиданно, что такие блок-сополимеры могут быть водорастворимыми. Обычно считается, что любой полимер, имеющий гидрофобное содержание, превышающее 50 мас.%, по существу не растворим в воде, и его можно сделать только заметно растворимым в водных системах, если это вообще возможно, если добавить некоторое количество органического сорастворителя.
Следовательно, основным для настоящего изобретения является использование блок-сополимера, имеющего гидрофобные или блок-сегменты “А” и гидрофильные или блок-сегменты “В”. Обычно блок-сополимером будут трехблочные сополимеры АВА-или ВАВ-типа. Однако блок-сополимер может быть также многоблочным сополимером, имеющим повторяющиеся звенья ВА или АВ, которые образуют сополимеры А(ВА)n или В(АВ)n, где n равно целому числу от 2 до 5.
Трехблочные сополимеры как АВА-, так и ВАВ-типа, можно синтезировать полимеризацией с раскрытием кольца или поликонденсацией в соответствии со схемами реакции, описанными в патенте США 5702717 и одновременно рассматриваемой заявке на патент США 08/943167, зарегистрированной 10/3/97, и 09/164865, зарегистрированной 20/1/98, полностью включенными здесь в качестве ссылки.
Блок-сополимеры, которые имеют использование, описываемое в данном изобретении, встречаются с критерием, суммированным в таблице 1, а именно, имеют композиционный состав в указанных пределах, что приводит к образованию блок-сополимеров, которые демонстрируют свойства обратимого термического желатинирования. Для целей описания параметров молекулярной массы все описанные величины молекулярных масс основаны на измерении аналитическими способами ЯМР или ГПХ (гель-проникающая хроматография). Описанные средние молекулярные массы и среднечисленные молекулярные массы определяли ГПХ и ЯМР соответственно. Указанное отношение лактид/гликолид вычисляли из данных ЯМР. Анализ ГПХ проводили на колонке со стирагелем HR-3, калиброванной ПЭГ, с использованием ИК-детектирования и хлороформа в качестве элюента или на колонках с комбинацией феногеля, смешанного слоя и феногеля, 500

Биоразрушаемый гидрофобный полимерный блок А включает сложный полиэфир, синтезированный из мономеров, выбранных из группы, состоящей из D.L-лактида, D-лактида, L-лактида, D,L-молочной кислоты, D-молочной кислоты, L-молочной кислоты, гликолида, гликолевой кислоты, ε-капролактона, ε-гидроксигексановой кислоты, γ-бутиролактона, γ-гидроксимасляной кислоты, δ-валеролактона, δ-гидроксивалериановой кислоты, гидроксимасляных кислот, яблочной кислоты и их сополимеров. На основе вычисления из величин общей молекулярной массы и массовых процентов полимерных блоков А и В, приводимых в таблице 1, и допущения, что средневесовая молекулярная масса каждого из А-блоков в трехблочном сополимере АВА или В-блоков в трехблочном сополимере ВАВ по существу одинаковые, средняя молекулярная масса полимерного А-блока находится приблизительно между 600 и 3000.
В соответствии с подобными вычислениями, гидрофильный В-блочный сегмент предпочтительно представляет собой полиэтиленгликоль (ПЭГ), имеющий среднюю молекулярную массу приблизительно между 500 и 2200.
Трехблочные сополимеры как АВА-, так и ВАВ-типа можно синтезировать полимеризацией с раскрытием кольца или поликонденсацией в соответствии со схемами реакций, описанными в патенте США 5702717 и заявке на патент США №08/943167, таким образом полностью включенными здесь в качестве ссылки. Например, В-блоки (ПЭГ) можно связывать с А-блоками (сложными эфирами) сложноэфирными или уретановыми связями и тому подобное. Способы поликонденсации и полимеризации с раскрытием кольца можно использовать, когда можно связать монофункциональный гидрофильный В-блок с любым концом дифункционального гидрофобного А-блока в присутствии связующих агентов, таких как изоцианаты. Кроме того, реакции сочетания можно проводить после активации функциональных групп активирующими агентами, такими как карбонилдиимидазол, янтарный ангидрид, N-гидроксисукцинимид и п-нитрофенилхлорформиат и тому подобное.
Гидрофильный В-блок образуется из ПЭГ с подходящей молекулярной массой. ПЭГ выбрали в качестве гидрофильного, растворимого в воде блока вследствие его необычных свойств биосовместимости, нетоксичности, гидрофильности, солюбилизации и быстрого выделения из организма пациента.
Гидрофобные А-блоки используют вследствие их свойств биоразрушаемости, биосовместимости и солюбилизации. Разрушение этих гидрофобных биоразрушаемых сложных полиэфирных А-блоков in vitro и in vivo вполне понятно, и продуктами биоразрушения являются природные соединения, которые легко метаболизируются и/или удаляются организмом пациента.
Как ни странно, общий массовый процент гидрофобного сложного полиэфирного А-блока относительно массового процента гидрофильного ПЭГ В-блока является высоким, например, приблизительно между 51 и 83 мас.% и, очень предпочтительно, приблизительно между 65 и 78 мас.%, однако, получаемый трехблочный полимер сохраняет желательную растворимость в воде и свойства обратимого термического желатинирования. Неожиданным является открытие, что блок-сополимер с таким высокой пропорцией гидрофобного компонента может быть растворим в воде при температуре, ниже нормальных комнатных температур, таких как температуры холодильника (5°С). Считается, что такая желательная характеристика растворимости становится возможной благодаря сохранению общей низкой молекулярной массы всего трехблочного сополимера между 2000 и 4990. Таким образом, получают растворимые в воде биоразрушаемые блок-сополимеры, обладающие свойствами термически обратимого желатинирования, у которых гидрофильный В-блок или блоки составляют приблизительно от 17 до 49 мас.% сополимера и гидрофобный А-блок или блоки составляют приблизительно от 51 до 83 мас.% сополимера. В предпочтительном осуществлении А-блоки (сложные эфиры) могут составлять приблизительно от 65 до 78 мас.% сополимера и ПЭГ В-блоки могут составлять приблизительно от 22 до 35 мас.% сополимера. Кроме того, предпочтительная общая средняя молекулярная масса всего трехблочного сополимера будет приблизительно от 2800 до 4990.
Концентрацию, при которой блок-сополимеры растворимы при температурах, ниже температуры желатинирования, можно рассматривать как функциональную концентрацию. Вообще говоря, концентрации блок-сополимера, начиная только с 3% и вплоть приблизительно до 50 мас.%, могут быть использованы и все еще они могут быть функциональными. Однако, предпочтительны концентрации в диапазоне приблизительно от 5 до 40% и очень предпочтительны концентрации в диапазоне приблизительно 10-30 мас.%. Для получения видимого гелевого фазового превращения сополимера требуется некоторая минимальная концентрация, например, 3 мас.%. В диапазонах более низких функциональных концентраций фазовое превращение может привести к образованию слабого геля. При более высоких концентрациях образуется сетчатая структура прочного геля.
Смесь биоразрушаемого полимера и пептидных/белковых лекарственных средств и/или других типов лекарственных средств можно получить в виде водного раствора сополимера при температуре ниже температуры желатинирования для образования жидкости для доставки лекарственного средства, где лекарственное средство может быть частично или полностью растворено. Когда лекарственное средство растворяется частично или когда лекарственное средство по существу нерастворимо, лекарственное средство существует в коллоидальном состоянии, таком как суспензия или эмульсия. Жидкость для доставки данного лекарственного средства затем вводят пациенту парентерально, местно, чрескожно, через слизистую оболочку, ингаляцией или вставкой в полость, например окулярным, вагинальным, трансуретальным, ректальным, назальным, пероральным, трансбуккальным, легочным или ушным введением, после чего она подвергается обратимому термическому желатинированию, так как температура тела будет выше температуры желатинирования.
Данная система будет вызывать минимальную токсичность и минимальное механическое раздражение окружающей ткани вследствие биосовместимости этих материалов и гибкости геля и будет полностью биоразрушаться в молочную кислоту, гликолевую кислоту и другие соответствующие мономеры в пределах определенного интервала времени. Высвобождение лекарственного средства, прочность геля, температура желатинирования и скорость разрушения можно регулировать посредством подходящей разработки и получения различных блоков сополимеров, а именно, посредством модификаций массового процента А-блоков и В-блоков, молярных процентов лактата и гликолята и молекулярной массы и полидисперсности трехблочных сополимеров АВА или ВАВ. Высвобождение лекарственного средства можно также регулировать посредством регулирования концентрации полимера в жидкости для доставки лекарственного средства.
Лекарственную форму, состоящую из раствора блок-сополимера, который содержит либо растворенное лекарственное средство, либо лекарственное средство в виде суспензии или эмульсии, вводят в тело. Такая готовая препаративная форма затем самопроизвольно желатинирует вследствие свойств обратимого термического желатинирования блок-сополимера с образованием депо лекарственного средства, когда температура готовой препаративной формы повыситься до температуры тела. Единственным ограничением в отношении того, сколько лекарственного средства можно загрузить в готовую препаративную форму, является одна из функциональностей, а именно, загрузка лекарственного средства может быть увеличена до тех пор, пока свойства термического желатинирования сополимера не будут подвергаться влиянию до неприемлемой степени или до тех пор, пока свойства готовой препаративной формы не будут обратимо подвергаться влиянию до такой степени, чтобы сделать введение готовой препаративной формы неприемлемо трудной. Вообще говоря, предполагается, что в большинстве случаев лекарственное средство будет составлять приблизительно от 0,01 до 20 мас.% готовой препаративной формы, причем очень обычными будут диапазоны приблизительно от 0,01 до 10%. Эти диапазоны загрузки лекарственного средства не являются ограничением для изобретения. При условии сохранения функциональности, загрузки лекарственного средства вне этих диапазонов находятся в пределах объема изобретения.
Особое преимущество композиций предмета данного изобретения состоит в способности блок-сополимера повышать растворимость многих лекарственных веществ. Сочетание гидрофобного А-блока(ов) и гидрофильного В-блока(ов) делает блок-сополимер амфифильным по природе. В этом отношении он функционирует в значительной степени как мыло или поверхностно-активное вещество, обладающее как гидрофильными, так и гидрофобными свойствами. Это особенно благоприятно при солюбилизации гидрофобных или плохо растворимых в воде лекарственных средств, таких как циклоспорин и паклитаксел. Неожиданной является степень солюбилизации большинства, если не всех, лекарственных средств, так как основным компонентом по содержанию блок-сополимера является гидрофобный А-блок. Однако, как обсуждалось выше, даже если гидрофобный полимерный блок(и) является основным компонентом, блок-сополимер растворим в воде, и было обнаружено, что наблюдается дополнительное повышение растворимости лекарственного средства при сочетании в водной фазе блок-сополимера.
Другое преимущество композиции изобретения состоит в способности блок-сополимера повышать химическую стабильность многих лекарственных веществ. Было отмечено, что различные механизмы разрушения лекарственных средств, которые ведут к химической нестабильности лекарственных средств, ингибируются, когда лекарственное средство находится в присутствии блок-сополимера. Например, паклитаксел и циклоспорин А значительно стабилизируются в водной полимерной композиции настоящего изобретения по сравнению с обычными водными растворами этих же лекарственных средств в присутствии органических сорастворителей. Данный эффект стабилизации паклитаксела и циклоспорина А является лишь иллюстративным эффектом, который можно достичь со многими другими лекарственными веществами.
В некоторых случаях загруженный лекарственным средством полимер можно ввести в состоянии геля вместо введения в виде раствора. Желатинирование может быть результатом повышения температуры раствора полимера, нагруженного лекарственным средством, до температуры, выше температуры желатинирования полимера, до введения или может быть вызвано повышением концентрации полимера в растворе, выше концентрации насыщения, при температуре введения, или может быть вызвано добавлением добавок к раствору полимера, которые вызывают превращение раствора в гель. В любом случае таким образом образованный гель можно ввести парентерально, местно, чрескожно, через слизистую оболочку, ингаляцией или вставкой в полость, например окулярным, вагинальным, трансбуккальным, трансуретальным, ректальным, назальным, пероральным, легочным или ушным введением.
Данное изобретение пригодно для биоактивных агентов и лекарственных средств всех типов, в том числе нуклеиновых кислот, гормонов, противораковых средств, оно предлагает необычный эффективный путь для доставки полипептидов и белков. Многие неустойчивые пептидные и белковые лекарственные средства поддаются введению в блок-сополимеры данного изобретения и могут выигрывать благодаря описанному здесь способу обратимого термического желатинирования. Хотя они конкретно не ограничиваются следующим, примеры фармацевтически пригодных полипептидов и белков можно выбрать из группы, состоящей из эритропоэтина, окситоцина, вазопрессина, адренокортикотропного гормона, эпидермального фактора роста, выделенного из тромбоцитов фактора роста (PDGF), пролактина, лулиберина, гормона, высвобождающего лютеинизирующий гормон (LHRH), агонистов LHRH, антагонистов LHRH, гормона роста (человеческого, свиного, бычьего и т.д.), фактора, высвобождающего гормон роста, инсулина, соматостатина, глюкагона, интерлейкина-2 (IL-2), α-, β- или γ -интерферона, гастрина, тетрагастрина, пентагастрина, урогастрона, секретина, кальцитонина, энкефалинов, эндорфинов, ангиотензинов, гормона, высвобождающего тиротропин (TRH), фактора некроза опухоли (TNF), фактора роста нервов (NGF), гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарного и макрофагиального колониестимулирующего фактора (GM-CSF), макрофагиального колониестимулирующего фактора (M-CSF), гепариназы, костного морфогенного белка (BMP), hANP, глюкагоноподобного пептида (GLR-1), интерлейкина-11 (IL-11), ренина, брадикинина, бацитрацинов, полимиксинов, колистинов, тироцидина, грамицидинов, циклоспоринов и их синтетических аналогов, модификаций и фармакологически активных фрагментов, ферментов, цитокинов, антител и вакцин.
Единственным ограничением для полипептидного или белкового лекарственного средства, которое можно использовать, является ограничение функциональности. В некоторых случаях функциональность или физическую стабильность полипептидов и белков можно также повысить добавлением различных добавок к водным растворам или суспензиям полипептидного или белкового лекарственного средства. Можно использовать такие добавки, как полиолы (включая сахара), аминокислоты, поверхностно-активные вещества, полимеры, другие белки и некоторые соли. Эти добавки можно легко ввести в блок-сополимеры, которые будут затем подвергаться способу обратимого термического желатинирования настоящего изобретения.
Разработки в белковой инженерии могут обеспечить возможность повышения собственной стабильности пептидов или белков. Хотя такие результирующие рекомбинантные или модифицированные белки можно рассматривать в качестве новых объектов в отношении регуляторных импликаций, это не изменяет их пригодность для использования в настоящем изобретении. Одним из типичных примеров модификации является ПЭГилирование, когда стабильность полипептидных лекарственных средств можно значительно повысить ковалентным конъюгированием растворимых в воде полимеров, таких как полиэтиленгликоль, с полипептидом. Другим примером является модификация аминокислотной последовательности в отношении идентичности или положения одного или нескольких аминокислотных остатков, посредством присоединения, делеции или замещения в концевых или внутренних положениях. Любое улучшение в стабильности дает возможность терапевтически эффективному полипептиду или белку непрерывно высвобождаться на протяжении пролонгированного периода времени после одного введения жидкости для доставки лекарственного средства пациенту.
Помимо лекарственных средств, на основе пептидов или белков можно использовать другие лекарственные средства из всех терапевтически и медицински полезных категорий. Эти лекарственные средства описываются в таких хорошо известных литературных ссылках, как Merck Index, Physcians Desk Reference и The Pharmacological Basis of Therapeutics. Краткий перечень конкретных агентов приводится только для целей иллюстрации и не должен рассматриваться в качестве ограничения: противораковые агенты, такие как митомицин, блеомицин, BCNU, карбоплатин, доксорубицин, даунорубицин, метотрексат, паклитаксел, таксотер, актиномицин D и камптотецин; антипсихотики, такие как оланзапин и зипразидон; антибактериальные средства, такие как цефокситин; антигельминты, такие как ивермектин; антивирусные средства, такие как ацикловир; иммуносупрессанты, такие как циклоспорин А (агент типа циклического полипептида), стероиды и простагландины.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
Вышеуказанные и другие задачи, признаки и преимущества данного изобретения будут очевидны из рассмотрения следующего подробного описания, представленного в связи с сопровождающим графическим материалом, в котором:
Фиг.1 представляет фазовую диаграмму, иллюстрирующую свойства желатинирования водных растворов трехблочного сополимера ПМГК-ПЭГ-ПМГК, изученные при разных концентрациях и температурах.
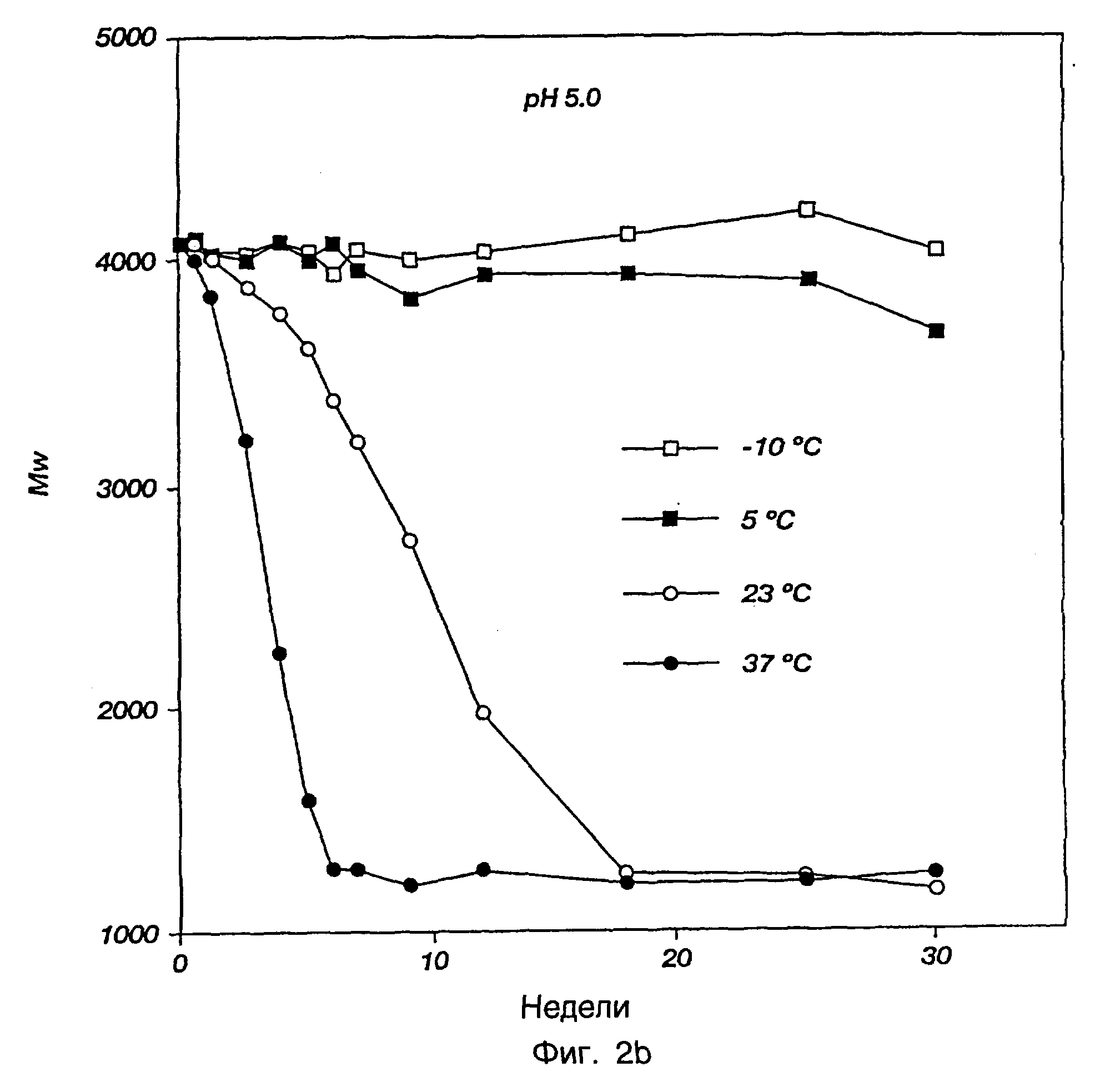
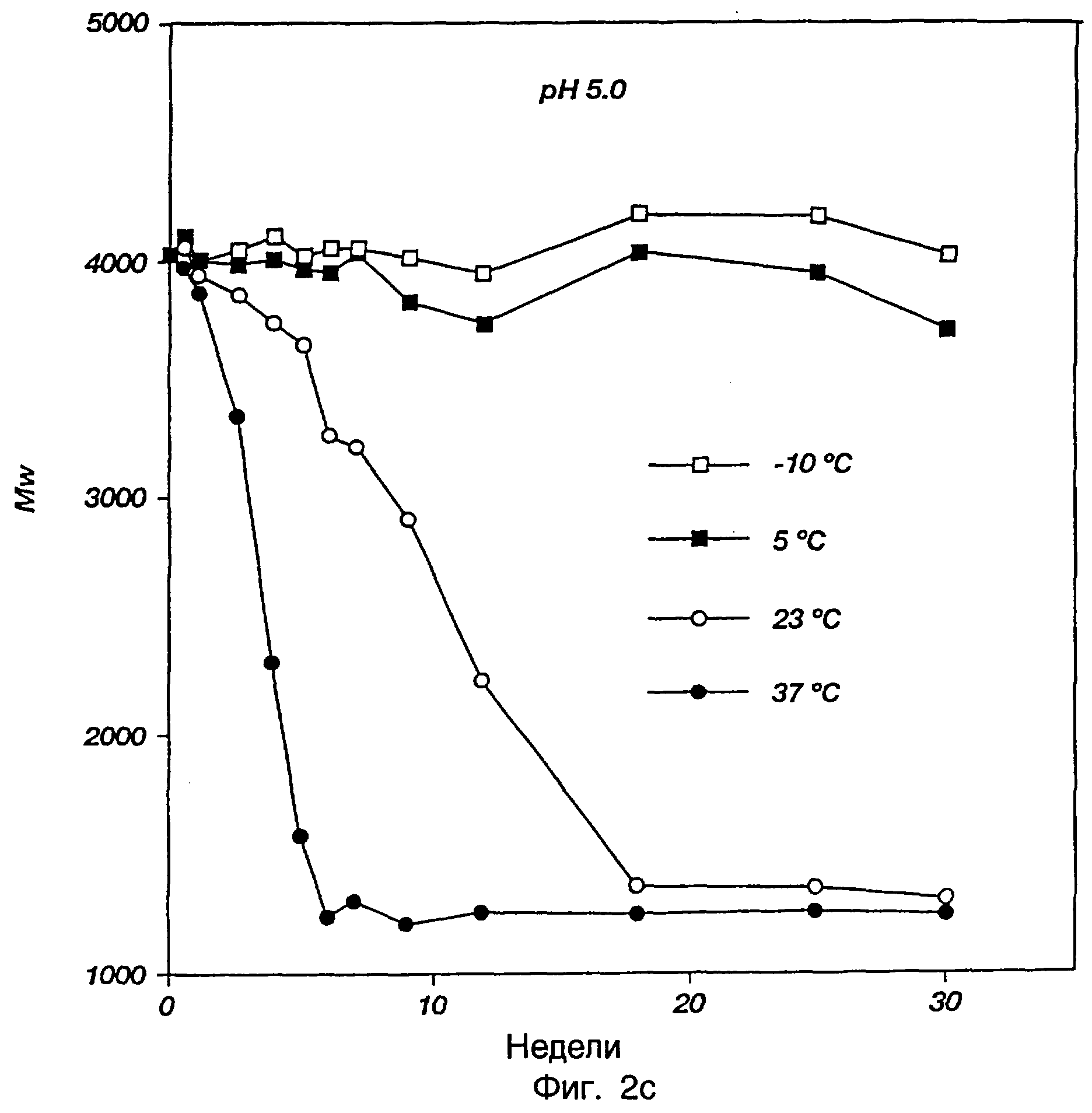
Фиг.2а-2с представляют профили разрушения, иллюстрирующие разрушение in vivo трехблочного сополимера ПМГК-ПЭГ-ПМГК, инкубированного при разных температурах и значениях рН.
Фиг.3 представляет график, иллюстрирующий непрерывное высвобождение инсулина на протяжении продолжительного периода времени из термического геля трехблочного сополимера ПМГК-ПЭГ-ПМГК.
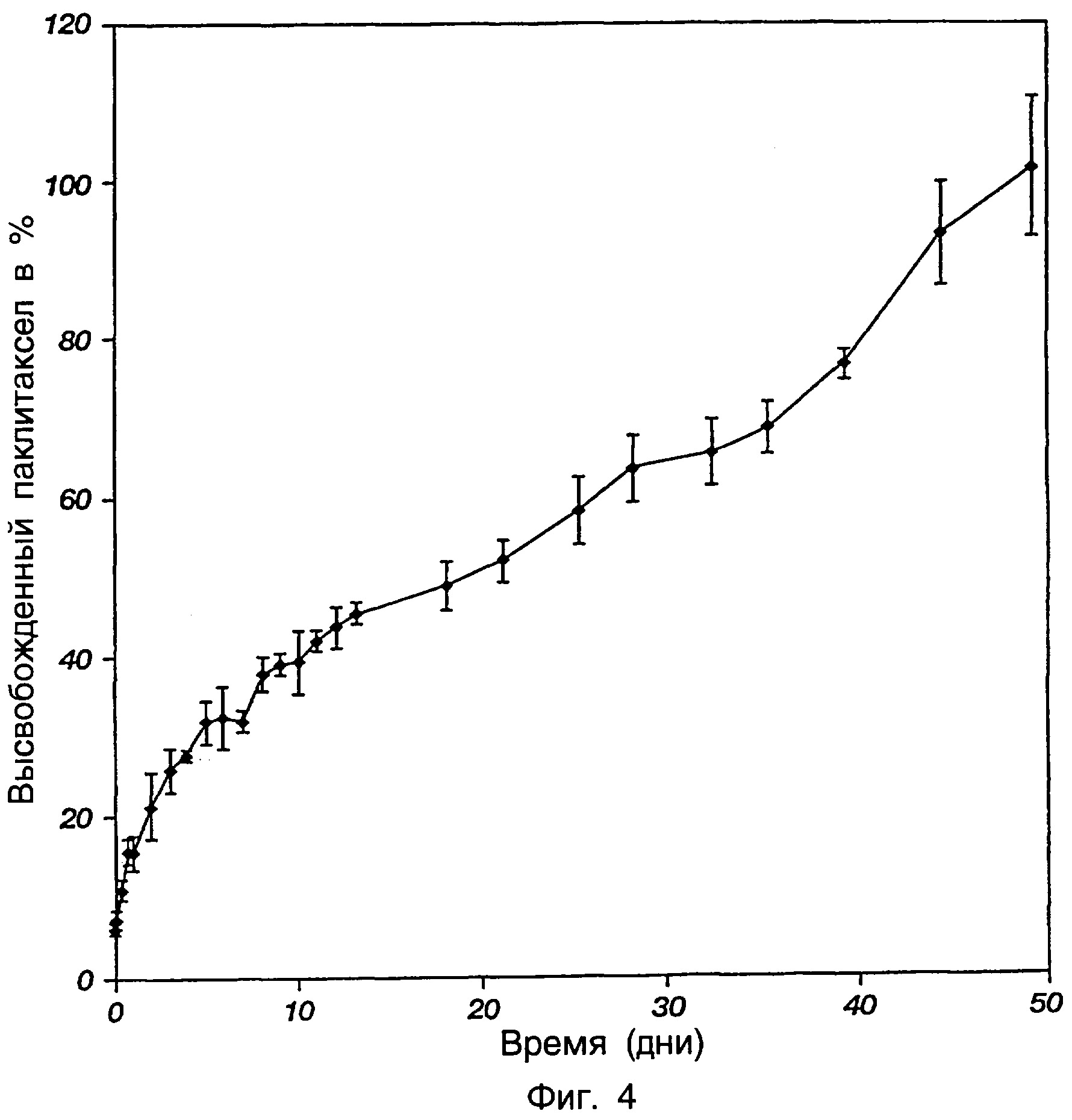
Фиг.4 представляет профиль высвобождения паклитаксела из готовой препаративной формы в виде термического геля трехблочного сополимера ПМГК-ПЭГ-ПМГК, показывающий кумулятивное регулируемое высвобождение паклитаксела в течение приблизительно 50 дней.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ДАННОГО ИЗОБРЕТЕНИЯ
С целью иллюстрации предпочтительных осуществлении данного изобретения был выполнен синтез различных блок-сополимеров АВА с низкой молекулярной массой, содержащих от 51 до 83 мас.% гидрофобных А-блоков (полиэфиров) и от 17 до 49 мас.% гидрофильных В-блоков (полиэтиленгликоль “PEG”). Целью было получение трехблочных сополимеров АВА или ВАВ, имеющих средние молекулярные массы приблизительно от 2000 до 4990 и состоящих из двух А-блоков, каждый со средней молекулярной массой приблизительно от 600 до 2000, и В-блока, имеющего среднюю молекулярную массу приблизительно от 600 до 2200. Каждый А-блок состоит приблизительно из 20-100 молярных процентов лактата и 0-80 молярных процентов гликолята.
Далее представлены примеры, которые иллюстрируют предпочтительные осуществления изобретения, но предназначаются только для репрезентативных целей.
Пример 1
Синтез трехблочного сополимера ПМГК-ПЭГ-ПМГК сополимеризацией с раскрытием кольца
По реакционной схеме, приведенной выше, ПЭГ (Mw=1000) сушили азеотропной перегонкой в колбе с толуолом (2 × 75 мл) в атмосфере азота с последующей сушкой при 130°С в вакууме (5 мм Нg). Лактидный и гликолидный мономеры (в молярных отношениях 3:1, соответственно) добавляли в колбу с последующим добавлением октаноата олова(II) (0, 1 мас.%) и реакционную смесь нагревали при 150°С в вакууме (5 мм Нд). За развитием реакции следили при помощи ГПХ (гель-проникающей хроматографии). После соответствующего времени реакцию останавливали и колбу охлаждали до комнатной температуры. Остаток растворяли в холодной воде и нагревали до 70-80°С для осаждения образованного полимера. Супернатант декантировали и полимерный остаток снова растворяли в холодной воде и нагревали для индуцирования осаждения. Данный способ растворения с последующим осаждением повторяли три раза. Наконец, полимер растворяли в минимальном количестве воды и лиофилизовали.
Получаемый сополимер ПМГК-ПЭГ-ПМГК имел среднюю молекулярную массу (Mw) 3737, среднечисленную молекулярную массу (Мn) 2928 и отношение Mw/Mn 1,3. Данный сополимер проявлял свойства обратимого термического желатинирования, как более полно подробно описывается в примере 4.
Пример 2
По основной методике, описанной в примере 1, были синтезированы другие трехблочные сополимеры с использованием того же ПЭГ (Мм = 1000), но с изменением содержания лактида и/или гликолида. Свойства этих трехблочных сополимеров указываются в следующей таблице:
Примерные блок-сополимеры АВА со свойствами обратимого термического желатинирования

Следует отметить, что все полимеры, перечисленные в вышеуказанной таблице, обладали свойствами обратимого термического желатинирования, даже когда содержание лактида (МК) изменялось от 30 до 100 мол.% и содержание гликолида (ГК) изменялось от 0 до 70 мол.%. Следовательно, в данном примере приводятся трехблочные сополимеры как ПМГК-ПЭГ-ПМГК, так и ПМК-ПЭГ-ПМК.
Пример 3
Синтез трехблочного сополимера ПМГК-ПЭГ-ПМГК сополиконденсацией
В трехгорлую колбу, снабженную вводом для азота, термометром и дистилляционной насадкой для удаления воды, помещали DL-молочную кислоту и гликолевую кислоту (молярное отношение 3:1 соответственно). Реакционную смесь нагревали при 160°С в атмосфере азота с перемешиванием при атмосферном давлении в течение трех часов и затем при пониженном давлении (5 мм Нg). За развитием реакции следили при помощи ГПХ. Реакцию останавливали в соответствующее время и образованный полимер очищали осаждением из раствора дихлорметана в большом избытке метанола. Остаток растирали с метанолом и сушили в вакууме (0,05 мм Нg) при 23°С. Олигомер ПМГК характеризовали ГПХ, ИК и ЯМР. Получаемый ПМГК имел средневесовую молекулярную массу (Mw) 9900, среднечисленную молекулярную массу (Мn) 5500 и отношение Mw/Mn 1,8.
ПМГК смешивали с ПЭГ (Mw = 1000) и нагревали в колбе при 160°С в атмосфере азота. За развитием реакции наблюдали при помощи ГПХ. Через соответствующее время реакцию останавливали и колбу охлаждали до комнатной температуры. Остаток растворяли в холодной воде, затем нагревали до 70-80°С для осаждения сополимера. Супернатант декантировали и остаток снова растворяли в холодной воде и нагревали для осаждения полимера. Этот процесс растворения и осаждения повторяли три раза. Наконец, полимер растворяли в минимальном количестве воды и лиофилизовали.
Получаемый блок-сополимер ПМГК-ПЭГ-ПМГК имел средневесовую молекулярную массу (Mw) 4043, среднечисленную молекулярную массу (Мn) 2905 и отношение Mw/Mn 1,4. Средневесовые молекулярные массы и среднечисленные молекулярные массы определяли ГПХ и ЯМР соответственно. Отношение лактид/гликолид вычисляли из данных ЯМР. Анализ ГПХ проводили на колонке со стирагелем HR-3, калиброванной ПЭГ, с использованием ИК-детектирования и хлороформа в качестве элюента. ЯМР-спектры регистрировали в CDCb на инструменте Bruker 200 МГц. Отнесения пиков ЯМР подтверждали трехблочную структуру АВА.
Пример 4
Свойства желатинирования водных растворов трехблочного сополимера АВА примера 1 изучали при разных концентрациях. Были получены растворы полимеров с концентрацией 9-30 мас.% в воде, и изменение вязкости наблюдали при температурах, составляющих от 10 до 60°С. Желатинирование определяли как физическое состояние, когда раствор полимера легко не вытекает при перевертывании колбы с раствором полимера. Фазовую диаграмму (фиг.1) полимера примера 1 строили как функцию температуры и концентрации трехблочного сополимера. Новое поведение обратимого термического желатинирования становилось несомненно очевидным и имело место, когда растворы трехблочных сополимеров нагревали. Желатинирование при физиологически подходящих температурах (например, 37°С) особенно преобладало и создавало основу для реального использования систем для медицинских целей и целей доставки лекарственных средств.
Пример 5
Разрушение in vivo трехблочного сополимера ПМГК-ПЭГ-ПМГК примера 1 определяли для раствора или геля с концентрацией 23 мас.% (1 мл) сополимера, инкубированного при разных температурах (-10, 5, 23 и 37°С) и при разных начальных значениях рН (3,0, 5,0 и 7,4) на протяжении периода 30 недель. Разрушение и биоразрушение данного трехблочного сополимера вызывали гидролизом и получали молочную кислоту, гликолевую кислоту и ПЭГ в качестве конечных продуктов разрушения.
Образцы (50 мкл) брали еженедельно. Образцы лиофилизовали, растворяли в хлороформе и молекулярные массы полимерных остатков определяли ГПХ, как описано ранее. Разрушение полимера существенно зависело от начального значения рН на протяжении диапазона рН от 3,0 до рН 7,4, что можно объяснить подкислением среды, когда полимер гидролизовался с образованием молочной кислоты и гликолевой кислоты. Свойство термического желатинирования могло зависеть также от рН на протяжении такого же самого диапазона рН. Разложение было более быстрым при более высоких температурах. Профили разложения, которые были построены, приводятся на фиг.2а, 2b и 2с.
Пример 6
Биоразложение in vivo полимера примера 1 определяли на протяжении периода четырех недель. Образец в количестве от 0,40 до 0,45 мл холодного водного раствора, содержащего 23 мас.% трехблочного сополимера, инъецировали подкожно крысам. После достижения температуры тела, которая была выше температуры желатинирования полимера, сразу происходило образование гелевой припухлости, которая была явно видимой. Образцы находили хирургическим способом и они показывали, что гель прогрессивно уменьшался как функция времени на протяжении периода двух недель. Во время между двумя неделями и четырьмя неделями физическое состояние инъецированного трехблочного полимера изменялось от геля до смеси геля в вязкой жидкости и, наконец, вязкой жидкости, не содержащей гель. Эта жидкость постепенно полностью всасывалась. В конце периода четырех недель готовая препаративная форма не была видна у места инъекции. Микроскопическим способом наблюдали маленькие мешочки вязкой жидкости, которые также всасывались полностью на протяжении периода двух недель.
Пример 7
Паклитаксел и циклоспорин А представляют собой гидрофобные лекарственные средства, которые почти совсем не растворимы в воде (растворимости были приблизительно 4 мкг/мл). Однако эти лекарственные средства проявляли значительно более высокую растворимость при растворении в водных растворах трехблочного сополимера ПМГК-ПЭГ-ПМГК. Например, в 20% по массе водном растворе сополимера (полимер примера 3) паклитаксел был растворим вплоть до 5 мг/мл и циклоспорин А был растворим вплоть до 2 мг/мл.
Паклитаксел и циклоспорин А были очень нестабильны в водных растворах сорастворителей (например, растворах вода/ацетонитрил).
Паклитаксел, содержащийся либо в 20%-ных по массе водных растворах трехблочного сополимера ПМГК-ПЭГ-ПМГК (т.е. при температуре, ниже температуры желатинирования сополимера) или соответствующих гелях (т.е. при температуре, выше температуры желатинирования сополимера), был на 85% больше интактным после 120 дней хранения (5°С и 37°С), тогда как циклоспорин А был стабилен на протяжении 100 дней (5°С).
Пример 8
Получали 28%-ный по массе водный раствор трехблочного сополимера ПМГК-ПЭГ-ПМГК примера 1. Инсулин (без цинка), парентерально вводимый белок с доказанным полезным действием при лечении сахарного диабета, суспендировали в данном водном растворе трехблочного сополимера до конечной концентрации 5 мг/мл. Приблизительно 2 мл данной композиции помещали на часовое стекло, уравновешенное до 37°С. Композиция сразу желатинировалась и прилипала к часовому стеклу, после чего ее помещали в 10 мМ забуференный фосфатом физиологический раствор, рН 7,4, 37°С, и проводили мониторинг кинетики высвобождения инсулина из геля при помощи ВЭЖХ (высокоэффективная жидкостная хроматография) с обращенной фазой с использованием УФ-детектирования и градиентного элюирования (подвижная фаза ТФУ/ацетонитрил/вода). Данные были графически суммированы на фиг.3. Инсулин высвобождался непрерывным образом в течение приблизительно одной недели. При помощи данного примера была четко установлена и показана эффективность термического геля трехблочного сополимера в регулируемом высвобождении белков и пептидов в течение значительного периода времени.
Пример 9
К 23%-ному по массе водному раствору трехблочного сополимера ПМГК-ПЭГ-ПМГК примера 1 добавляли достаточное количество паклитаксела для обеспечения содержания лекарственного средства приблизительно 2,0 мг/мл. Образец данного раствора 2 мл поместили на часовое стекло и уравновесили при 37°С. Так как температура была выше, чем температура желатинирования сополимера, гель образовался на часовом стекле. Часовое стекло помещали в химический стакан на 200 мл, содержащий среду для высвобождения, состоящую из 150 мл забуференного фосфатом физиологического раствора (ЗФР) (рН 7,4), содержащего 2,4 мас.% твина-80 и 4 мас.% кремофора EL, и уравновешенную при 37°С. Раствор в химическом стакане перемешивали. Верх стакана герметизировали для предотвращения испарения. Всю систему помещали в инкубатор при 37°С. Изучение высвобождения проводили в трех повторностях. В различные периоды времени была взята и анализирована на паклитаксел 5 мл аликвота среды для высвобождения. Раствор ЗФР заменяли свежим ЗФР после удаления каждой аликвоты. Образцы собирали через 1, 2, 4, 8, 18 и 24 часа и после этого через интервалы 24 часа и анализировали ВЭЖХ. Профиль высвобождения паклитаксела из геля показан на фиг.4. Гелевая готовая препаративная форма обеспечивала превосходное регулирование на протяжении высвобождения паклитаксела в течение приблизительно 50 дней.
Пример 10
Трехблочные сополимеры ВАВ синтезировали с использованием того же самого ПЭГ-В-блока на любом конце (Mw = 550), но с изменением содержания поли(лактида) и/или поли(гликолида). ПЭГ и ПМГК связывали друг с другом через сложноэфирную связь, уретановую связь или сочетание сложноэфирных и уретановых связей. Свойства этих трехблочных сополимеров приводятся в табл.3.
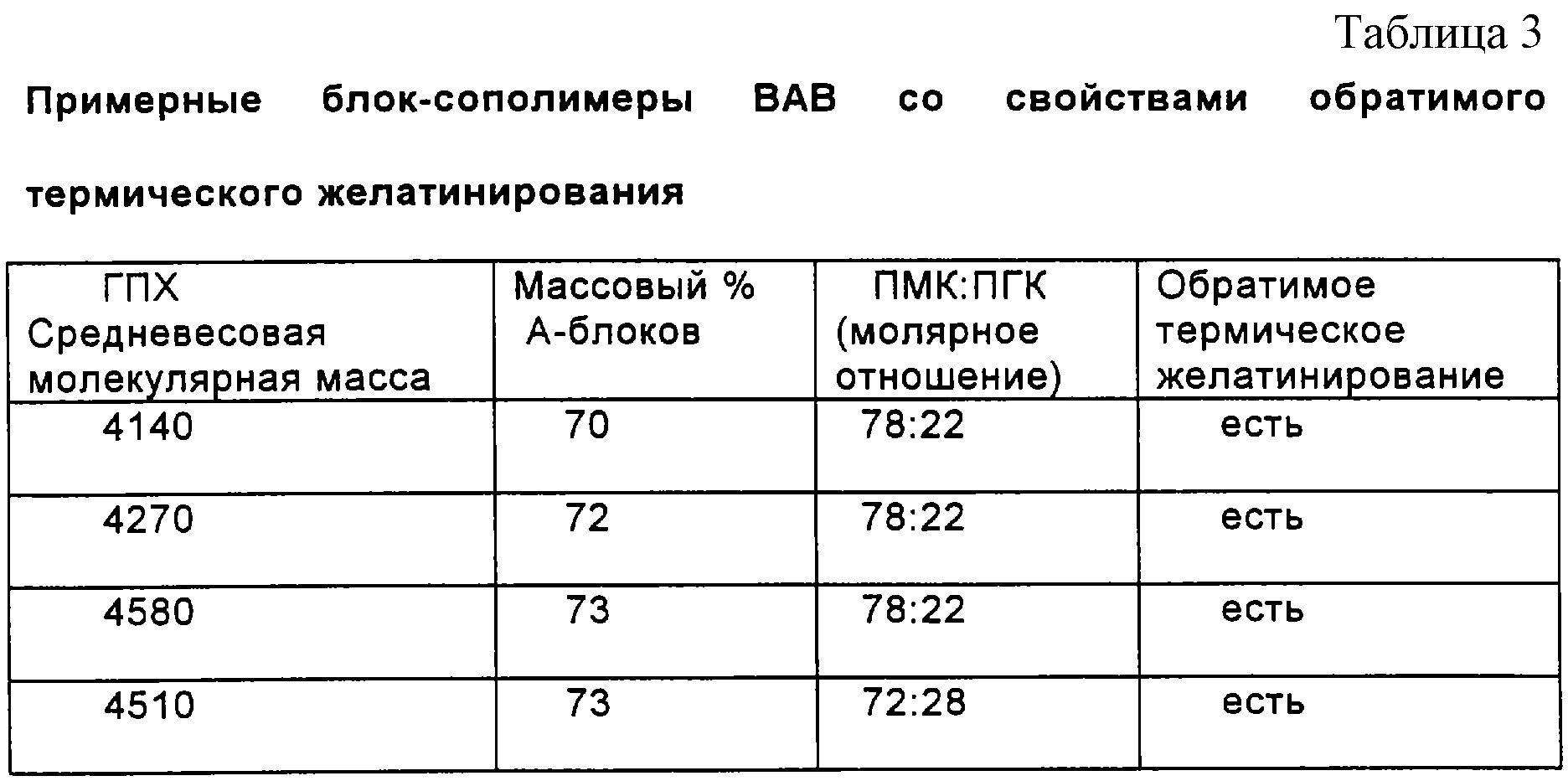
Все из трехблочных сополимеров ПЭГ-ПМГК-ПЭГ, перечисленных в вышеуказанной таблице, обладали свойствами обратимого термического желатинирования. Температуры превращения золь/гель для вышеуказанных трехблочных полимеров были 36, 34, 30 и 26°С соответственно.
Вышеприведенное описание может дать возможность специалисту в данной области синтезировать трехблочные сополимеры типа АВА (например, ПМГК-ПЭГ-ПМГК и ПМК-ПЭГ-ПМК) или ВАВ (например, ПЭГ-ПМГК-ПЭГ и ПЭГ-ПМК-ПЭГ), которые образуют водные растворы, имеющие свойства обратимого термического желатинирования, и использовать их в области доставки лекарственного средства. Хотя регулируемая доставка как общепринятого лекарственного средства (паклитаксел), так и белкового лекарственного средства (инсулин), иллюстрируется в примерах, чтобы показать функциональность гидрогелей, образованных из водных растворов трехблочных сополимеров, данные описания не предназначаются для исчерпывающего предложения всех лекарственных средств, которые можно использовать и загружать в биоразрушаемые блок-сополимеры. Несомненно, что для доставки из водных композиций трехблочных сополимеров, как описано в данном описании изобретения, хорошо подходят многочисленные другие лекарственные средства из различных классов терапевтических агентов. Также конкретно не показаны все блок-сополимеры, которые можно получить и которые демонстрируют свойства критического обратимого термического желатинирования. Однако специалисту в данной области должно быть сразу очевидно, что могут быть созданы различные модификации без отклонения от объема данного изобретения, которое ограничивается только следующей формулой изобретения и ее функциональными эквивалентами.
Реферат
Изобретение относится к растворимому в воде, биоразрушаемому трехблочному полимеру. Полимеры АВА или ВАВ содержат 51-83 мас.% гидрофобного блока А на основе сложного полиэфира и 17-49 мас.% гидрофильного блока В, представляющего собой полиэтиленгликоль. Трехблочный полимер имеет среднюю молекулярную массу 2000-4990 и обладает свойствами обратимого термического желатинирования. Водные композиции, содержащие 0,01-20% лекарственного средства и 3-50% биоразрушаемого трехблочного полимера используют для доставки лекарственного средства. Изобретение позволяет получить биоразрушаемые полимеры, обладающие свойствами термического желатинирования, то есть существуют в виде водного раствора при низких температурах, обратимо образуют гели при физиологически подходящих температурах и обеспечивают хорошие характеристики высвобождения лекарственного средства. 3 с. и 22 з.п. ф-лы, 4 ил., 3 табл.


Комментарии