Медленная внутрижелудочковая доставка - RU2452368C2
Код документа: RU2452368C2
Чертежи







Описание
Область техники, к которой относится изобретение
Данное изобретение относится к доставке средств в мозг. В частности, оно относится к диагностике, лечению и визуализации мозга.
Предпосылки изобретения
Группа метаболических расстройств, известная как лизосомальные болезни накопления (LSD), включает более 40 генетических расстройств, многие из которых включают генетические дефекты в различных лизосомальных гидролазах. Репрезентативные лизосомальные болезни накопления и связанные с ними дефективные ферменты перечислены в таблице 1.
Отличительным признаком LSD (лизосомальных болезней накопления) является патологическое накопление метаболитов в лизосомах, которое приводит к образованию больших количеств растянутых лизосом в перикарионе. Основной проблемой для лечения LSD (в отличие от лечения специфичной для печени энзимопатии) является необходимость устранения патологии лизосомального накопления во множественных отдельных тканях. Некоторые LSD можно эффективно лечить внутривенным вливанием отсутствующего фермента, известным как ферментная заместительная терапия (ERT). Например, у пациентов с болезнью Гоше 1 типа имеется лишь заболевание внутренних органов, и они благоприятно реагируют на ERT рекомбинантной глюкоцереброзидазой (Cerezyme™, Genzyme Corp.). Однако пациенты с метаболическим заболеванием, которое поражает ЦНС (например, болезнь Гоше типа 2 или 3), эффективно не реагирует на внутривенную ERT, потому что имеется препятствие поступлению заместительного фермента в мозг через гематоэнцефалический барьер (ВВВ). Кроме того, попытки ввести заместительный фермент в мозг прямой инъекцией были ограничены, частично вследствие цитотоксичности ферментов при высокой местной концентрации и ограниченных скоростях паренхиматозной диффузии в мозге (Partridge, Peptide Drug Delivery to the Brain, Raven Press, 1991).
В соответствии с базой данных UniProtKB/Swiss-Prot, ввод Р17405, дефекты в гене SMPD1, расположенном на хромосоме 11, (11р15.4-р15.1), являются причиной болезни Ниманна-Пика типа А (NPA), также именуемой классической детской формой. Болезнь Ниманна-Пика представляет собой клинически и генетически гетерогенное рецессивное расстройство. Она вызвана накоплением сфингомиелина и других метаболически связанных липидов в липосомах, приводящим к нейродегенерации, начинающейся с ранних лет жизни. У пациентов могут проявляться ксантомы, пигментация, гепатоспленомегалия, лимфаденопатия и задержка психического развития. Болезнь Ниманна-Пика чаще, чем в общей популяции, возникает среди лиц, являющихся потомками восточно-европейских евреев. NPA характеризуется очень ранним началом в раннем детском возрасте и быстро прогрессирующим течением, приводящим к смерти к возрасту трех лет. Фермент кислая сфингомиелаза (aSM) превращает сфингомиелин в церамид. aSM также обладает активностью фосфолипазы С в отношении 1,2-диацилглицеринфосфохолина и 1,2-диацилглицеринфосфоглицерина.
Сфингомиелин+Н2О → N-ацилсфингозин+холинфосфат.
В данной области все еще имеется потребность в способах лечения LSD, при которых имеется и церебральная патология, и заболевание внутренних органов. В данной области все еще имеется потребность в способах доступа к частям мозга диагностическими и терапевтическими средствами, которые нелегко проходят через гематоэнцефалический барьер.
Раскрытие изобретения
В соответствии с одним вариантом осуществления изобретения, предоставляется способ доставки средства в мозг пациента. Средство вводится пациенту через латеральный желудочек мозга с такой скоростью, что введение одной дозы занимает более чем 2 часа.
В соответствии с другим вариантом осуществления изобретения, предоставляется способ доставки средства в мозг пациента. Средство вводится пациенту через латеральный желудочек мозга с такой скоростью, что введение одной дозы занимает, по меньшей мере, 50% времени оборота спинномозговой жидкости у пациента.
В соответствии с еще одним вариантом осуществления изобретения, предоставляется способ доставки средства в мозг пациента. Оценивается время оборота спинномозговой жидкости у пациента. Скорость доставки и общее время доставки средства через латеральный желудочек мозга выбирается на основании времени оборота. Насос устанавливается для доставки средства с указанной выбранной скоростью в течение указанного общего времени доставки.
В соответствии с еще одним вариантом осуществления изобретения, предоставляется способ доставки средства в мозг пациента. Оценивается время оборота спинномозговой жидкости у пациента. Скорость доставки и общее время доставки средства через латеральный желудочек мозга выбирается на основании времени оборота. Средство доставляется пациенту с указанной выбранной скоростью в течение указанного общего времени доставки.
В соответствии с другим вариантом осуществления изобретения, предоставляется способ доставки средства в мозг пациента. Средство вводится пациенту через латеральный желудочек мозга с такой скоростью, что введение одной дозы продолжается, по меньшей мере, до тех пор, пока средство не можно будет выявить в сыворотке пациента.
В соответствии с одним вариантом осуществления изобретения, лечение получает пациент с болезнью Ниманна-Пика A, B или D. Кислая сфингомиелиназа вводится пациенту посредством внутрижелудочковой доставки в мозг в количестве, достаточном для снижения уровней сфингомиелина в указанном мозге.
Другой аспект изобретения предоставляет собой набор для лечения пациента с болезнью Ниманна-Пика A, B или D. Набор включает кислую сфингомиелиназу и катетер для доставки указанной кислой сфингомиелиназы в желудочки мозга пациента.
Еще один аспект изобретения предоставляет собой набор для лечения пациента с болезнью Ниманна-Пика A, B или D. Набор включает кислую сфингомиелиназу и насос для доставки указанной кислой сфингомиелиназы в желудочки мозга пациента.
В соответствии с изобретением, можно лечить пациента, у которого имеется лизосомальная болезнь накопления, вызванная ферментной недостаточностью, которая ведет к накоплению субстрата фермента. Фермент вводится пациенту посредством внутрижелудочковой доставки в мозг. Скорость введения такова, что введение одной дозы занимает более чем 4 часа. Посредством этого снижаются уровни субстрата в указанном мозге.
Эти и другие варианты осуществления, которые будут очевидны для специалистов в данной области по прочтении описания, предоставляют способы доставки средств в трудно достигаемые части мозга.
Краткое описание чертежей
На фиг.1 показан чертеж срезов мозга, которые анализировались на наличие сфингомиелина. S1 находится в передней части мозга, а S5 находится в задней части мозга.
На фиг.2 показано, что внутрижелудочковое введение rhASM (рекомбинантной человеческой кислой сфингомиелиназы) снижает уровни SPM (сфингомиелина) в мозге мышей ASMKO.
На фиг.3 показано, что внутрижелудочковое введение rhASM снижает уровни SPM в печени, селезенке и легких мышей ASMKO.
На фиг.4 показано окрашивание hASM (человеческой кислой сфингомиелиназы) в мозге после внутрижелудочкового вливания.
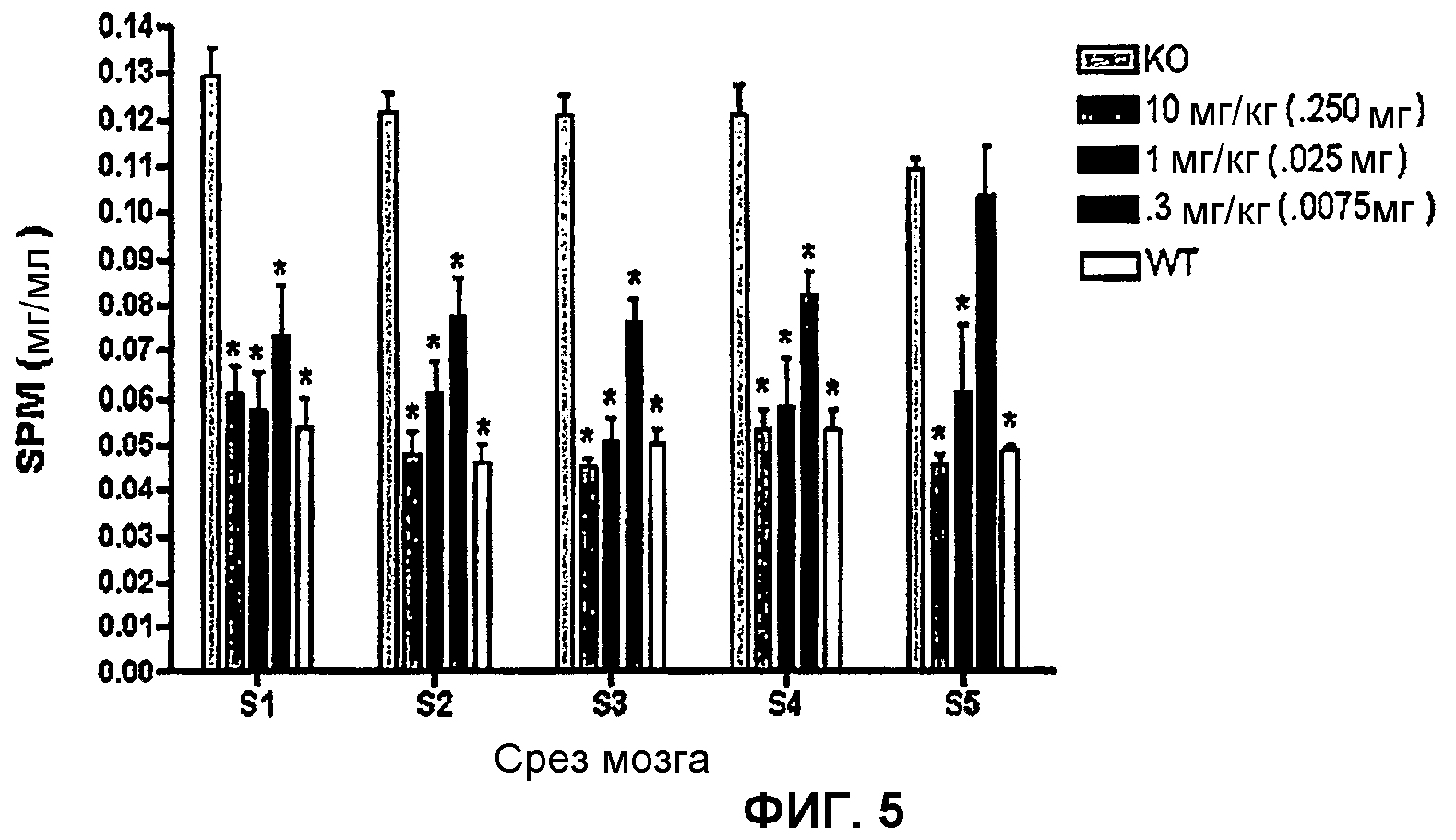
На фиг.5 показано, что внутрижелудочковое вливание rhASM в течение периода 6 ч снижает уровни SPM в мозге мышей ASMKO.
На фиг.6 показано, что внутрижелудочковое вливание rhASM в течение периода 6 ч снижает уровни SPM в печени, селезенке и легких мышей ASMKO.
На фиг.7 показаны документированные варианты hASM и их связь с заболеванием или активностью фермента.
На фиг.8 показана желудочковая система, которая омывает весь головной мозг и спинной мозг спинномозговой жидкостью.
Детальное описание изобретения
Заявители обнаружили, что внутрижелудочковая доставка средств пациентам с медленной скоростью, а не болюсная доставка, увеличивает эффективное проникновение средств в дистальные отделы мозга из участка введения. Средства, которые можно вводить таким путем, представляют собой любые средства, но включают диагностические средства, визуализирующие агенты, анестетические средства и терапевтические средства. Этот способ доставки особенно полезен для средств, которые не могут пройти через гематоэнцефалический барьер.
Заявители наблюдали, что болюсное внутрижелудочковое введение не очень эффективно, тогда как медленное вливание очень эффективно. Хотя заявители не желают быть связанными какой-либо конкретной теорией действия, считается, что медленное вливание эффективно вследствие оборота спинномозговой жидкости (CSF). Хотя оценки и расчеты в литературе варьируются, считают, что оборот спинномозговой жидкости взрослого человека происходит в пределах примерно 4, 5, 6, 7 или 8 часов. Скорость оборота может варьироваться, в зависимости от размера тела индивидуума и объема спинномозговой жидкости у индивидуума. Так, например, у детей меньше спинномозговой жидкости, чем у взрослых, и поэтому у них время оборота короче. Медленное вливание по изобретению можно отмерить таким образом, чтобы время доставки было примерно равным времени оборота CSF или больше него. Данные измерения могут представлять собой фиксированное время, например, более чем 2, 4, 6, 8 или 10 часов, или оно может быть установлено для составления фракции определенного времени оборота, например, больше чем 50%, 75%, 100%, 150%, 200%, 300% или 400%. CSF дренируется в систему венозной крови. Доставка может выполняться в течение времени, пока доставляемое средство не будет выявляться в сыворотке пациента. Можно также выявить и/или измерить количество доставленного средства в другие части ЦНС, такие как в спинной мозг и субарахноидальное пространство. Они также могут использоваться в качестве исходов доставки.
CSF секретируется со скоростью примерно от 430 до 600 мл/д или примерно от 0,35 до 0,4 мл в минуту у взрослых, и объем в каждый данный момент составляет приблизительно от 80 до 150 мл, причем весь объем замещается через каждые 6-8 часов. По оценкам, младенцы продуцируют 0,15 мл/мин CSF. Хориоидные сплетения латеральных желудочков являются самыми большими и продуцируют бóльшую часть CFS. Жидкость течет через межжелудочковые отверстия в третьем желудочке, дополняется жидкостью, образованной в сосудистом сплетении желудочка, и проходит через церебральный сильвиев водопровод в четвертый желудочек. CFS течет из 4-го желудочка в отверстие Мажанди в субарахноидальное пространство, которое окружает спинной мозг; CSF течет из 4-го желудочка через отверстие Люшка в субарахноидальное пространство, которое окружает мозг. Сосудистая оболочка выстилает субарахноидальное пространство; ворсинки паутинной оболочки являются частью оболочки. Ворсинки паутинной оболочки представляют собой насосы, которые всасывают CSF и возвращают ее в венозную циркуляцию. CSF реабсорбируется в кровь через ворсинки паутинной оболочки.
Более медленная, чем болюсная, доставка в соответствии с изобретением имеет преимущество доставки средств в отделы мозга, которые не достигаются болюсом. Средство, доставленное болюсом, накапливается в эпендимальном слое или в паренхиме, прилегающей к участку инъекции. Напротив, обнаруживается, что медленно доставляемые средства достигают областей паренхимы, расположенных дистальнее от участка инъекции (широко распространенная доставка по передне-задней оси мозга; кроме того, широко распространенная доставка дорзально и вентрально относительно эпендимального слоя), третьего желудочка, сильвиева водопровода, четвертого желудочка, отверстия Люшка, отверстия Мажанди, спинного мозга, субарахноидального пространства и сыворотки. Из сыворотки могут также достигаться периферические органы.
CSF дренируется в кровь через ворсинки паутинной оболочки и внутричерепные сосудистые синусы, доставляя, посредством этого, ферменты во внутренние органы. Внутренние органы, которые часто поражаются при болезни Ниманна-Пика, представляют собой легкие, почки и печень. Медленное внутрижелудочковое вливание обеспечивает уменьшенные количества субстрата, по меньшей мере, в этих внутренних органах.
Происходит резкое снижение количества субстрата, накопленного в мозге, легких, селезенке, почках, и/или печени. Можно достичь снижения более чем на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%. Достигаемое снижение необязательно равномерно от пациента к пациенту или даже от органа к органу у одного пациента.
Средства для доставки могут представлять собой любые средства, которые известны в данной области, для лечения и визуализации мозга. Средства для визуализации могут быть радиоактивными, рентгеноконтрастными, флюоресцентными и т.д. Терапевтические средства могут представлять собой любые средства, которые можно применять для лечения неврологических или других заболеваний мозга. Анестетики можно применять для лечения хронической или острой боли, например, лидокаин гидрохлорид и морфин. Примеры терапевтических средств включают ферменты, недостаточность которых имеется при лизосомальных болезнях накопления. Другие возможные средства для применения включают векторы нуклеиновых кислот, такие как плазмидные и вирусные векторы, siRNA (маленькая интерферирующая РНК), антисмысловые РНК и т.д. Другие терапевтические средства включают те, которые увеличивают или уменьшают возбуждение нейронов в мозге. Они включают агонисты или антагонисты глутамата, ГАМК и допамина. Определенные примеры включают циклосерин, карбоксифенилглицин, глутаминовую кислоту, дизоцилпин, кетамин, декстрометорфан, баклофен, мусцинол, габазин, баклофен, галоперидол и метана сульфонат. Дополнительные средства, которые можно применять, представляют собой противовоспалительные средства, в частности, нестероидные противовоспалительные средства, такие как индометацин и ингибиторы циклооксигеназы.
Нуклеиновые кислоты можно доставлять в любом желательном векторе. Они включают вирусные или не вирусные векторы, включая аденовирусные векторы, адено-ассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и плазмидные векторы. Иллюстративные типы вирусов включают HSV (вирус простого герпеса), AAV (адено-ассоциированный вирус), HIV (вирус иммунодефицита человека, ВИЧ), BIV (вирус иммунодефицита коров) и MLV (вирус мышиного лейкоза). Нуклеиновые кислоты можно вводить в любом желательном формате, который обеспечивает достаточно эффективные уровни доставки, включая доставку в вирусных частицах, в липосомах, в наночастицах и в комплексах с полимерами.
Аденовирус представляет собой безоболочечный вирус ядерной ДНК с геномом примерно 36 тысяч пар оснований, которые были хорошо охарактеризованы посредством исследований по классической генетике и молекулярной биологии (Hurwitz, M.S., Adenoviruses Virology, 3rd edition, Fields et al., eds., Raven Press, New York, 1996; Hitt, M.M. et al., Adenovirus Vectors, The Development of Human Gene Therapy, Friedman, T. ed., Cold Spring Harbor Laboratory Press, New York 1999). Вирусные гены классифицируются на ранние (обозначенные Е1-Е4) и поздние (обозначенные L1-L5) транскрипционные единицы, относящиеся к поколению двух временных классов вирусных белков. Демаркацией этих явлений является репликация вирусной ДНК. Человеческие аденовирусы делятся на многочисленные серотипы (приблизительно 47, соответственно пронумерованные и классифицированные на 6 групп: A, B, C, D, E и F) на основании свойств, включающих гемагглютинацию эритроцитов, онкогенность, аминокислотные составы и гомологии ДНК и белка и антигенные связи.
Рекомбинантные аденовирусные векторы имеют несколько преимуществ для применения в качестве носителей генной доставки, включая тропизм и к делящимся, и к не делящимся клеткам, минимальный патогенный потенциал, способность к репликации до высокого титра для получения запасов векторов и потенциал наличия больших вставок (Berkner, K.L., Curr. Top. Micro. Immunol. 158: 39-66, 1992; Jolly, D., Cancer Gene Therapy 1: 51-64 1994). Аденовирусные векторы с делециями различных аденовирусных генных последовательностей, такие как псевдоаденовирусные векторы (PAV), и аденовирусные векторы с частичными делециями (именуемые “DeAd”), были сконструированы для использования преимущества желательных признаков аденовируса, которые делают его подходящим носителем для доставки нуклеиновых кислот в клетки-реципиенты.
В частности, псевдоаденовирусные векторы (PAV), также известные как «бескишечный аденовирус» (хелпер-зависимый) или мини-аденовирусные векторы, представляют собой аденовирусные векторы, полученные из генома аденовируса, которые содержат минимальные цис-действующие нуклеотидные последовательности, требуемые для репликации и упаковки генома вектора, и которые могут содержать один или более трансгенов (см. патент США №5882877, который раскрывает псевдоаденовирусные векторы (PAV) и способы получения PAV, включенный в настоящий документ посредством ссылки на него). PAV были сконструированы для использования преимущества желательных признаков аденовируса, которые делают его подходящим носителем для доставки гена. Хотя аденовирусные векторы могут в целом нести вставки размером до 8 тысяч пар оснований путем делеции областей, которые несущественны для вирусного роста, максимальной несущей способности можно достичь использованием аденовирусных векторов, содержащих делеции большинства вирусных кодирующих последовательностей, включая PAV. См патент США №5882877, выданный Gregory et al.; Kochanek et al., Proc. Natl. Acad.Sci. USA 93:5731-5735, 1996; Parks et al., Proc. Natl. Acad.Sci. USA 93:13565-13570, 1996; Lieber et al., J. Virol. 70:8944-8960, 1996; Fisher et al., Virology 217:11-22, 1996; U.S. патент №5670488; PCT публикация № WO 96/33280, опубликованная октябрь 24, 1996; PCT публикация № WO 96/40955, опубликованная декабрь 19, 1996; PCT публикация № WO 97/25446, опубликованная июль 19, 1997; PCT публикация № WO 95/29993, опубликованная ноябрь 9 1995; PCT публикация № WO 97/00326, опубликованная январь 3, 1997; Morral et al., Hum. Gene Ther. 10:2709-2716, 1998. Такие PAV, которые могут вместить примерно до 36 тысяч пар оснований инородной нуклеиновой кислоты, имеют преимущество, потому что оптимизируется несущая способность вектора при одновременном снижении иммунных ответов хозяина или генерировании компетентных в отношении репликации вирусов. Векторы PAV содержат 5' инвертированный концевой повтор (ITR) и нуклеотидные последовательности 3' ITR, которые содержат происхождение репликации, и цис-действующую нуклеотидную последовательность, требуемую для упаковки генома PAV, и могут вмещать один или более трансгенов с соответствующими регуляторными элементами, например, промоторами, генами-усилителями и т.д.
Другие аденовирусные векторы с частичной делецией предоставляют аденовирусный вектор с частичной делецией (именуемый “DeAd”), в котором большинство аденовирусных ранних генов, требуемых для вирусной репликации, подвергнуты делеции из вектора и помещены внутрь хромосомы продуцирующей клетки под контролем условного промотора. Подвергаемые делеции аденовирусные гены, которые помещены в продуцирующую клетку, включают EIA/EIB. E2, E4 (только ORF6 и ORF6/7 должны помещаться в клетку), pIX и pIVa2. Е3 может также быть подвергнут делеции из вектора, но поскольку он не требуется для продукции вектора, его можно не включать в продуцирующую клетку. Аденовирусные поздние гены, обычно находящиеся под контролем основного позднего промотора (MLP), присутствуют в векторе, но MLP может быть замещен условным промотором.
Условные промоторы, подходящие для использования в векторах DeAd и линиях продуцирующих клеток, включают промоторы со следующими характеристиками: низкая основная экспрессия в не индуцированном состоянии, так что цитотоксические или цитостатические аденовирусные гены не экспрессированы на уровнях, вредных для клетки; и высокий уровень экспрессии в индуцированном состоянии, так что продуцируются достаточные количества вирусных белков для поддержания репликации и сборки вектора. Предпочтительные условные промоторы, подходящие для использования в векторах DeAd и в линиях продуцирующих клеток, включают систему регуляции гена-димеризатора на основании иммуносуппрессивных агентов FK506 и рапамицина, систему регуляции гена экдизона и систему регуляции гена тетрациклина. В настоящем изобретении можно также использовать технологию GeneSwitch™ (Valentis, Inc., Woodlabds, TX), описанную в документе Abruzzese et al., Hum. Gene Ther. 1999 10: 1499-507, описание которого включено в настоящий документ посредством ссылки на него. Аденовирусная система экспрессии с частичной делецией, кроме того, описана в документе WO 99/57296, описание которого включено в настоящий документ посредством ссылки на него.
Адено-ассоциированный вирус (AAV) представляет собой парвовирус однонитевой человеческой ДНК, геном которого содержит 2 основных гена: ген rep, который кодирует rep протеины (Rep 76, Rep 68, Rep 52, и Rep 40) и ген cap, который кодирует репликацию, спасение, транскрипцию и интеграцию AAV, в то время как cap протеины образуют вирусную частицу AAV. Название AAV происходит из его зависимости от аденовируса или другого хелперного вируса (например, вируса герпеса) для снабжения существенными генными продуктами, которые обеспечивают возможность подвергнуть AAV продуктивной инфекции, т.е. воспроизвести себя в клетке-хозяине. В отсутствие хелперного вируса, AAV интегрируется в виде провируса в хромосому клетки-хозяина до тех пор, пока он не будет спасен суперинфекцией клетки-хозяина хелперным вирусом, обычно аденовирусом (Muzyczka, N., Curr. Top. Micor. Immunol. 158: 97-127, 1992).
Интерес к AAV в качестве вектора генного переноса возник в результате нескольких необычных признаков его биологии. На обоих концах генома AAV имеется нуклеотидная последовательность, известная как инвертированный концевой повтор (ITR), который содержит цис-действующие нуклеотидные последовательности, требуемые для репликации, спасения, упаковки и интеграции вируса. Интеграционная функция ITR, опосредованная rep протеином в трансконфигурации, позволяет геному AAV интегрироваться в клеточную хромосому после инфекции, в отсутствие хелперного вируса. Это необычное свойство вируса имеет отношение к применению AAV при генном переносе, поскольку это обеспечивает возможность интеграции рекомбинантного AAV, содержащего представляющий интерес ген, в клеточный геном. Поэтому, устойчивую генетическую трансформацию, идеальную для многих целей генного переноса, можно достичь использованием векторов rAAV. Кроме того, сайт интеграции AAV хорошо установлен, и его локализация была продемонстрирована в хромосоме 19 людей (Kotin et al., Proc. Natl. Acad. Sci. 87: 2211-2215, 1990). Эта прогнозируемость интеграции сайта снижает опасность случайных инсерционных явлений в клеточный геном, которые могут активировать или инактивировать гены хозяина или прервать кодирующие последовательности, следствия, которые могут ограничить использование векторов, чья интеграция AAV, удаление этого гена в конструкции векторов rAAV может привести к измененным типам интеграции, которые наблюдались при векторах rAAV (Ponnazhagan et al., Hum Gene Ther. 8: 275-284, 1997).
Имеются другие преимущества использования AAV для генного переноса. Диапазон хозяев AAV широк. Более того, в отличие от ретровирусов, AAV может инфицировать и находящиеся в покое, и делящиеся клетки. Кроме того, AAV не был связан с заболеваниями человека, избегая многих беспокойств, которые возникли при использовании векторов генного переноса, полученных из ретровирусов.
Стандартные подходы к генерированию векторов рекомбинантного rAAV требовали координации серии внутриклеточных явлений: трансфекции клетки-хозяина геномом вектора rAAV, содержащим представляющий интерес трансген, фланкированный последовательностями ITR AAV, трансфекции клетки-хозяина плазмидой, кодирующей гены для rep и cap протеинов AAV, которые требуются в трансконфигурации, и инфекции тресфецированной клеткой хелперным вирусом для обеспечения не-AAV хелперными функциями, требуемыми в трансконфигурации (Muzyczka, N., Curr. Top. Micor. Immunol. 158: 97-127, 1992). Аденовирусные (или другого хелперного вируса) протеины активируют транскрипция rep гена AAV, и затем rep протеины активируют транскрипцию cap генов AAV. Затем cap протеины утилизируют последовательности ITR для упаковки генома rAAV в вирусную частицу rAAV. Поэтому эффективность упаковки частично определяется доступностью адекватных количеств структурных протеинов, а также доступностью любых цис-действующих упаковочных последовательностей, требуемых в геноме вектора rAAV.
Ретровирусные векторы представляют собой обычный инструмент для доставки гена (Miller, Nature (1992) 357:455-460). Способность ретровирусных векторов доставлять не подвергнутый перестройке ген одиночной копии в широкий диапазон соматических клеток грызунов, приматов и людей делает ретровирусные векторы достаточно подходящими для переноса генов в клетку.
Ретровирусы представляют собой вирусы РНК, где вирусный геном представляет собой РНК. Когда клетка-хозяин инфицирована ретровирусом, геномная РНК подвергнута обращенной транскрипции в промежуточный продукт ДНК, который очень эффективно интегрируется в хромосомную ДНК инфицированных клеток. Этот интегрированный промежуточный продукт ДНК именуется провирусом. Транскрипция провируса и сборка в инфекционный вирус происходит в присутствии соответствующего хелперного вируса или в клеточной линии, содержащей соответствующие последовательности, обеспечивающие инкапсуляцию без сопутствующей продукции заражающего хелперного вируса. Хелперный вектор не требуется для продукции рекомбинантного ретровируса, если последовательности для инкапсуляции предоставляются совместной трансфекцией соответствующими векторами.
Ретровирусный геном и провирусная ДНК имеют 3 гена: gag, pol, env, которые фланкированы последовательностями двух длинных концевых повторов (LTR). Gag ген кодирует внутренние структурные (матричный, капсидный и нуклеокапсидный) протеины; pol ген кодирует направленную на РНК ДНК полимеразу (обратную транскриптазу), и env ген кодирует вирусные оболочечные гликопротеины. 5' и 3' LTR служат для содействия транскрипции и полиаденилированию РНК вириона. LTR содержит все другие цис-действующие последовательности, необходимые для вирусной репликации. Лентивирусы имеют дополнительные гены, включающие vit vpr, tat, rev, vpu, nef, и vpx (в HIV-1, HIV-2 и/или SIV). С 5' LTR соседствуют последовательности, необходимые для обратной транскрипции генома (сайт связывания затравки тРНК) и для эффективной инкапсуляции вирусной РНК в частицы (сайт Psi). Если последовательности, необходимые для инкапсуляции (или упаковки ретровирусной РНК в инфекционный вирион), отсутствуют в вирусном геноме, то результатом является цис-дефект, который предотвращает инкапсуляцию геномной РНК. Однако полученный мутант еще способен направлять синтез всех протеинов вириона.
Лентивирусы представляют собой сложные ретровирусы, которые, в дополнение к обычным ретровирусным генам gag, pol и env, содержат другие гены с регуляторной или структурной функцией. Более высокая сложность обеспечивает возможность лентивирусу модулировать его жизненный цикл, как это происходит в течение латентной инфекции. Типичный лентивирус представляет собой вирус иммунодефицита человека (HIV), этиологический агент СПИДа. In vivo, HIV может инфицировать терминально дифференцированные клетки, которые редко делятся, такие как лимфоциты и макрофаги. In vitro, HIV может инфицировать первичные культуры происходящих из моноцитов макрофагов (MDM), а также HeLa-Cd4 или Т-лимфоидные клетки, остановленные в клеточном цикле обработкой афидиколином или гамма облучением. Инфекция клеток зависит от активного ядерного импорта преинтеграционных комплексов ВИЧ через ядерные поры клеток-мишеней. Это происходит взаимодействием множественных, частично избыточных молекулярных детерминант в комплексе с механикой ядерного импорта клетки-мишени. Идентифицированные детерминанты включают функциональный сигнал ядерной локализации (NLS) в матричном (МА) gag протеине, кариофильный протеин, связанный с вирионом, и С-концевой фосфотирозиновый остаток в gag протеине МА. Использование ретровирусов для генной терапии описано, например, в патенте США №6013516 и в патенте США №5994136, описания которых включены в настоящий документ посредством ссылки на них.
Заявители обнаружили, что внутрижелудочковая доставка лизосомальных ферментов гидролазы пациентам с недостаточностью ферментов ведет к улучшению метаболического статуса и мозга, и пораженных внутренних (не относящихся к ЦНС) органов. Это особенно справедливо, когда скорость доставки медленная относительно болюсной доставки. Один особенно полезный фермент для лечения болезни Ниманна-Пика А*, В или D представляет собой кислую сфингомиелиназу (aSM), такую как кислая сфингомиелиназа, показанная в SEQ ID NO: 1. (Остатки 1-46 составляют сигнальную последовательность, которая расщепляется после секреции.)
Хотя конкретная аминокислотная последовательность показана в SEQ ID NO: 1, также можно использовать нормальные варианты в человеческой популяции, которые сохраняют активность. Обычно, эти нормальные варианты отличаются лишь одним или двумя остатками от последовательности, показанной в SEQ ID NO: 1. Подлежащие использованию варианты должны быть, по меньшей мере, на 95%, 96%, 97%, 98%, 99% идентичны SEQ ID NO: 1. Варианты, которые связаны с заболеванием или сниженной активностью, не следует использовать. Обычно должна доставляться зрелая форма фермента. Она начнется с остатка 47, как показано в SEQ ID NO: 1. Варианты, которые связаны с заболеванием, показаны на фиг.7.
Наборы в соответствии с настоящим изобретением представляют собой сборки отдельных компонентов. Хотя они могут быть упакованы в один контейнер, они могут также упаковываться отдельно. Даже один контейнер может быть разделен на отсеки. Обычно, комплект инструкций должен сопровождать набор и предоставлять инструкции по внутрижелудочковой доставке диагностических, терапевтических или анестезирующих средств, таких как лизосомальные ферменты гидролазы. Инструкции могут быть в напечатанном виде, в электронном виде, в виде инструкционного видео или DVD, или компактного диска, на дискетке, на сайте интернета с адресом, предоставленным в упаковке, или в виде комбинации этих средств. В дополнение к средству могут быть предоставлены другие компоненты, такие как разбавители, буферы, растворители, лента, винты и инструменты технического обслуживания, одна или более канюль или катетеров и/или насос. Печатный материал или другие инструкционные материалы могут коррелировать объем CSF, время оборота CSF, массу пациента, возраст пациента, скорость доставки, время доставки и/или другие параметры. Насосы могут быть калиброваны для доставки с определенными скоростями на основании объема и/или времени оборота CSF, и/или возраста пациента, и/или массы пациента.
Популяции, получавшие лечение способами по изобретению, включают, без ограничения, пациентов, имеющих нейрометаболическое расстройство (или имеющих риск его развития), например, LSD, таких как заболевания, перечисленные в таблице 1, в частности, если такое заболевание поражает ЦНС и внутренние органы. В иллюстративном варианте осуществления, заболевание представляет собой болезнь Ниманна-Пика типа А. Если была определена генетическая склонность к заболеванию, то лечение можно начинать пренатально. Другие заболевания или состояния, которые можно лечить, включают без ограничения нейрохирургических пациентов, пациентов с инсультом, болезнь Хантингтона, болезнь Паркинсона, болезнь Лу Герига, болезнь Альцгеймера.
Средство, такое как лизосомальный фермент гидролаза, может быть включено в фармацевтическую композицию. Композицию можно использовать для диагностики, обезболивания или лечения, например, ингибирования, ослабления, предотвращения или облегчения состояния, характеризуемого недостаточным уровнем активности лизосомальной гидролазы. Фармацевтическую композицию можно ввести субъекту, страдающему недостаточностью лизосомальной гидролазы или индивидууму с риском развития указанной недостаточности. Композиции должны содержать эффективное диагностическое, анестезирующее, терапевтическое или профилактическое количество средства в фармацевтически приемлемом носителе. Фармацевтический носитель может представлять собой любое совместимое, нетоксичное вещество, подходящее для доставки полипептидов пациенту. В качестве носителя можно использовать стерильную воду, спирт, жиры и воски. В фармацевтические композиции могут также быть включены фармацевтически приемлемые адъюванты, буферные агенты, диспергирующие агенты и им подобные. Носитель можно объединять с агентом в любой форме, подходящей для введения внутрижелудочковой инъекцией или вливанием (также возможно внутривенное или подоболочечное введение) или другим образом. Подходящие носители включают, например, физиологический солевой раствор, бактериостатическую воду, Cremophor EL.TM (BASF, Parsippany, N.J.) или солевой раствор с фосфатным буфером (PBS), другие солевые растворы, растворы декстрозы, растворы глицерина, водные и масляные эмульсии, такие как эмульсии, изготовленные с маслами нефтяного, животного, растительного или синтетического происхождения (арахисовое масло, масло соевых бобов, минеральное масло или кунжутное масло). В качестве носителя можно использовать искусственную CSF. Носитель должен предпочтительно быть стерильным и лишенным пирогенов. Концентрация агента в фармацевтической композиции может широко варьироваться, т.е., по меньшей мере, примерно от 0,01% масс. до 0,1% масс., до примерно от 1% масс. до величины, достигающей 20% масс. или более.
Для внутрижелудочкового введения, композиция должна быть стерильной и жидкой. Она должна быть устойчивой в условиях изготовления и хранения и должна быть защищена от заражающего действия микроорганизмов, таких как бактерии и грибы. Предотвращение действия микроорганизмов можно достичь различными антибактериальными и противогрибковыми средствами, например парабенами, хлорбутанолом, фенолом, аскорбиновой кислотой, томерисалом и им подобными. Во многих случаях, будет предпочтительно включение в композицию изотонических агентов, например сахаров, полиспиртов, таких как маннит, сорбит, хлорид натрия.
Дозировка любого агента, или aSM, или другого лизосомального фермента гидролазы может в некоторой степени варьироваться от индивидуума к индивидууму, в зависимости от конкретного агента или фермента и его удельной активности in vivo, пути введения, медицинского состояния, возраста, массы тела или пола пациента, чувствительности пациента к агенту aSM или компонентам носителя, и другим факторам, которые сможет легко учесть лечащий врач. Хотя дозировки могут варьироваться в зависимости от заболевания и пациента, фермент в целом вводится пациенту в количествах от примерно 0,1 до примерно 1000 мг на 50 кг массы тела пациента в месяц, предпочтительно, от примерно 1 до примерно 500 мг на 50 кг массы тела пациента в месяц.
Одним способом обеспечения медленного вливания является использование насоса. Такие насосы имеются в продаже, например, от компаний Alzet (Cupertino, CA) или Medtronic (Minneapolis, MN). Насос может быть имплантируемым или внешним. Другим удобным способом введения ферментов является использование канюли или катетера. Канюлю или катетер можно использовать для множественных введений, разделенных во времени. Канюли и катетеры можно имплантировать стереотаксически. Предусматривается, что множественные введения будут использоваться для лечения типичного пациента с лизосомальной болезнью накопления. Катетеры и насосы можно использовать отдельно или в комбинации. Катетеры можно вводить хирургически, как известно в данной области. Наборы могут включать средство и катетер и/или насос. Насос может иметь установки, подходящие для скоростей доставки, основанных на объеме CSF у индивидуума.
В приведенном выше описании в целом раскрыто настоящее изобретение. Все ссылки, приведенные в настоящем документе, специально включены в него посредством ссылки на них. Более полное представление можно получить со ссылкой на следующие определенные примеры, которые приведены в настоящем документе лишь в целях иллюстрации и не предназначены для ограничения объема изобретения.
Пример 1
Экспериментальная модель
Мыши ASMKO представляют собой принятую модель болезни Ниманна-Пика типа А и В (Horinouchi et al. (1995) Nat. Genetics, 10: 288-293; Jin et al. (2002) J.Clin. Invest., 109: 1183-1191; и Otterbach (1995) Cell, 81: 1053-1061). Болезнь Ниманна-Пика (NPD) классифицируется как лизосомальная болезнь накопления и представляет собой наследственное нейрометаболическое расстройство, характеризуемое генетической недостаточностью кислой сфингомиелиназы (ASM; сфингомиелин-холинфосфогидролаза, ЕС 3.1.3.12). Отсутствие функционального протеина ASM приводит к накоплению субстрата сфингомиелина внутри лизосом нейронов и глии по всему мозгу. Это ведет к образованию больших количеств растянутых лизосом в перикарионе, которые представляют собой отличительный признак и первичный клеточный фенотип NPD типа А. Присутствие растянутых лизосом коррелируется с потерей нормальной клеточной функции и прогрессирующим нейродегенеративным течением, которое ведет к смерти пораженного индивидуума в раннем детском возрасте (The Metabolic and Molecular Bases of Inherited Diseases, eds. Scriver et al., McGraw-Hill, New York, 2001, pp.3589-3610). Вторичные клеточные фенотипы (например, дополнительные метаболические аномалии) также связаны с этим заболеванием, особенно, высокий уровень накопления холестерина в лизосомальном компартменте. Сфингомиелин имеет сильное сродство с холестерином, что приводит к секвестрации больших количеств холестерина в лизосомах мышей ASMKO и людей-пациентов (Leventhal et al. (2001) J. Biol. Chem., 276: 44983; Slotte (1997) Subcell. Biochem., 28: 277-293; и Viana et al. (1990) J. Med. Genet., 27: 499-504).
Пример 2
«Внутрижелудочковое вливание rhASM у мышей ASMKO II»
Цель: Определить, какой эффект оказывает внутрижелудочковое вливание rhASM на патологию накопления (т.е. накопление сфингомиелина и холестерина) в мозге мышей ASMKO.
Методы: Мышам ASMKO в возрасте от 12 до 13 недель стереотаксически имплантировали постоянную направляемую канюлю. В возрасте 14 недель мышам вливали 0,250 мг hASM (n=5) в течение 24-часового периода (~0,01 мг/ч) в течение четырех последовательных дней (всего вводили 1 мг), используя инфузионный зонд (подгоняется внутрь направляемой канюли), который соединен с насосом. Лиофилизированный hASM перед вливанием растворяли в искусственной спинномозговой жидкости (aCSF). Мышей умерщвляли через 3 дня после вливания. При умерщвлении мышам вводили избыточную дозу эвтазола (>150 мг/кг) и затем перфузировали PBS или 4% парформальдегидом. Мозг, печень, легкие и селезенку удаляли и анализировали для определения содержания сфингомиелина (SPM). Ткань мозга делили на 5 срезов перед анализом SPM (S1= передняя часть мозга, S5= задняя часть мозга; см. фиг.1).
Обобщение результатов: Внутрижелудочковое вливание hASM в дозе 0,250 мг/24 ч в течение 4 последовательных дней (всего 1 мг) привело к окрашиванию hASM и выведению филипина (т.е. накопления холестерина) по всему мозгу мышей ASMKO. Биохимический анализ показал, что внутрижелудочковое вливание hASM также привело к глобальному снижению уровней SPM по всему мозгу. Уровни SPM были снижены до уровней у мышей дикого типа (WT). Значительное снижение уровней SPM также наблюдалось в печени и селезенке (тенденция к снижению наблюдалась в легких).
Пример 3
«Внутрижелудочковая доставка rhASM у мышей ASMKO III»
Цель: определить самую низкую эффективную дозу в течение 6-часового периода вливания.
Методы: Мышам ASMKO в возрасте от 12 до 13 недель стереотаксически имплантировали постоянную направляемую канюлю. В возрасте 14 недель мышам вливали hASM в течение 6-часового периода в одной из следующих доз: 10 мг/кг (0,250 мг; n=12), 3 мг/кг (0,0750 мг; n=7), 1 мг/кг (0,025 мг; n=7), 0,3 мг/кг (0,0075 мг; n=7), или aCSF (искусственную спинномозговую жидкость; n=7). У двух мышей из каждого уровня дозы проводили перфузию 4% парформальдегидом, которая немедленно следовала за 6-часовым вливанием, для оценки распределения фермента в мозге (у них также брали кровь для определения уровней hASM в сыворотке). Остальных мышей из каждой группы умерщвляли через 1 неделю после вливания. Ткань мозга, печени и легких этих мышей анализировали для определения содержания сфингомиелина, как в исследовании 05-0208.
Обобщение результатов: Внутрижелудочковое вливание hASM в течение 6-часового периода привело к значительному снижению уровней SPM по всему мозгу, независимо от дозы. Уровни SPM у мышей, получавших лечение дозами >0,025 мг, были снижены до уровней у мышей WT. Уровни SPM во внутренних органах были также значительно снижены (но не до уровней у мышей WT) зависимым от дозы образом. В подтверждение этих данных, протеин hASM был также выявлен в сыворотке мышей ASMKO после инфузии протеина hASM. Гистологический анализ показал, что протеин hASM был широко распределен по всему мозгу (от S1 до S5) после внутрижелудочкового введения hASM.
Пример 4
«Внутрижелудочковая доставка rhASM у мышей ASMKO IV»
Цель: определить (1) время, затрачиваемое на повторное накопление SPM внутри мозга (и спинного мозга) после 6-часового вливания hASM (доза = 0,025 мг); (2) имеются ли половые различия в реакции на внутрижелудочковое введение hASM (предыдущие эксперименты демонстрируют, что имеются половые различия накопления субстрата в печени; неизвестно, происходит ли это в мозге).
Методы: Мышам ASMKO в возрасте от 12 до 13 недель стереотаксически имплантировали постоянную направляемую канюлю. В возрасте 14 недель мышам вливали hASM в дозе 0,025 мг в течение 6-часового периода. После внутрижелудочковой доставки hASM мышей умерщвляли или через 1 неделю вливания (n=7 самцов, 7 самок), или через - недели после вливания (n=7 самцов, 7 самок). После умерщвления, мозг, спинной мозг, печень и легкие удаляли для анализа SPM.
Образцы ткани получали для анализа SPM.
Пример 5
«Влияние внутрижелудочкового вливания rhASM на когнитивную функцию у мышей ASMKO»
Цель: определить, облегчает ли внутрижелудочковое вливание rhASM вызванные заболеванием когнитивные дефекты у мышей ASMKO.
Методы: Мышам ASMKO в возрасте от 9 до 10 недель будет стереотаксически имплантирована постоянная направляемая канюля. В возрасте 13 недель мышам будет проведено вливание hASM в дозе 0,025 мг в течение 6-часового периода. В возрасте 14 и 16 недель мыши будут подвергнуты тестированию когнитивной функции с использованием лабиринта Барнса.
Пример 6
«Распределение протеина hASM внутри ЦНС мышей ASMKO после внутрижелудочкового вливания»
Цель: определить распределение протеина hASM (как функцию времени) внутри мозга и спинного мозга мышей ASMKO после внутрижелудочкового вливания
Методы: Мышам ASMKO в возрасте от 12 до 13 недель будет стереотаксически имплантирована постоянная направляемая канюля. В возрасте 14 недель мышам будет проведено вливание hASM в дозе 0,025 мг в течение 6-часового периода. После процедуры вливания мыши будут умерщвлены или немедленно, или через 1, 2 или 3 недели.
Ссылки
Описание каждой из приведенных ссылок специально включено в настоящий документ.

Реферат
Изобретение относится к области медицины, а именно к способам доставки лекарственного средства в организм больного. При лечении метаболических расстройств средство вводят пациенту через латеральный желудочек мозга с такой скоростью, чтобы введение одной дозы занимало более чем 2 часа. Скорость введения также может быть выбрана на основании общего времени оборота спинномозговой жидкости. При этом скорость устанавливают такой, чтобы она занимала по меньшей мере 50% времени от ее оборота или пока средство не будет выявляться в сыворотке крови пациента. Способ расширяет арсенал средств для доставки лекарственного препарата в организм пациента. 5 н. и 48 з.п. ф-лы, 4 табл., 8 ил., 6 пр.

Комментарии