Способ получения сохраняющих форму агрегатов частиц геля и их применение - RU2395276C2
Код документа: RU2395276C2
Чертежи


























Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области органической химии, физической химии, химии полимеров, фармацевтической химии, медицины и материаловедения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Следующее обсуждение представлено, как предпосылки в помощь специалисту в понимании настоящего изобретения и не предусмотрены, и не должны расцениваться как предшествующая область техники изобретения.
Гель представляет собой трехмерную полимерную сетку, которая абсорбирует жидкость с формированием стабильной, обычно мягкой и гибкой композиции, имеющей ненулевую жесткость при сдвиге. Когда жидкостью, поглощаемой гелем, является вода, гель называют гидрогелем. Вода может составлять значительный массовый процент гидрогеля. Это, а также тот факт, что множество полимеров, образующих гидрогель, являются биологически инертными, делает гидрогели особенно применимыми в биомедицине.
Например, гидрогели широко используют в мягких контактных линзах. Их также используют как повязки при ожогах и ранах с или без включения лекарственных средств, которые могут высвобождаться из матрицы геля для помощи процессам заживления (например, см. Патенты США №№ 3063685 и 4272518). Гидрогели используют как оболочки для улучшения смачиваемости поверхностей медицинских устройств, таких как кровяные фильтры (патент № США 5582794). Также они нашли применение как устройства для замедленного высвобождения биологически активных веществ. Например, патент США № 5292515 описывает способ получения устройства для доставки лекарственного средства с гидрофильным резервуаром. Патент № 5292515 описывает, что скорость высвобождения лекарственного средства может регулироваться изменением содержания воды в подкожном имплантате гидрогеля, что непосредственно влияет на его коэффициент проницаемости.
Во всех вышеуказанных заявках гель или гидрогель представлен в объемном виде, то есть это аморфная масса вещества с отсутствием различимой регулярной внутренней структуры. Объемные гидрогели имеют медленную скорость набухания из-за большого внутреннего объема по отношению к площади поверхности, через которую должна абсорбироваться вода. Более того, вещество, растворенное или супендированное в абсорбируемой воде, будет диффундировать из геля со скоростью, которая зависит от расстояния, которое оно должно преодолеть, чтобы достичь поверхности геля. То есть молекулы около поверхности гидрогеля будут выделяться быстро, тогда как молекулам глубже в матрице потребуется гораздо больше времени, чтобы достичь наружной поверхности геля. Такая ситуация может быть облегчена в некоторой степени с использованием геля из частиц, если каждая частица достаточно небольшая, вещества, диспергированные в частицах, будут диффундировать к поверхности и высвобождаться через приблизительно одинаковое время.
Частицы геля могут быть получены рядом методик, таких как прямая или обратная полимеризация эмульсии (Landfester, et al., Macromolecules, 2000, 33:2370) или они могут быть получены из рыхлых гелей сушкой геля и затем измельчением полученного ксерогеля до частиц желаемого размера. Затем частицы могут быть снова растворены для получения геля из частиц. Частицы, имеющие размер в диапазоне диаметра от микро (10-6 метров (м)) до нано (10-9 м), могут быть получены такими средствами. Молекулы вещества, поглощенного частицами в таком диапазоне размеров, все будут иметь примерно одинаковое расстояние до достижения наружной поверхности частицы и будут проявлять кинетику высвобождения около нулевого порядка. Однако гели из частиц имеют некоторые проблемы. Например, трудно регулировать распространение частиц и расположение их в выбранном целевом участке. Более того, тогда как рыхлые гидрогели могут казаться удерживающими форму, что делает их применимыми в качестве биоматериалов во множестве медицинских применений, доступными в настоящее время гели из частиц не могут.
Совместно рассматриваемая патентная заявка США серийный № 10/289756 описывает сохраняющий форму агрегат, полученный из частиц гидрогеля, таким образом комбинируя удержание формы рыхлых гидрогелей с регуляцией высвобождения вещества из частиц геля. Заявка № 10/289756 описывает способ получения агрегатов, включающий получение суспензии частиц гидрогеля в воде и концентрирование суспензии до объединения частиц в сохраняющие форму агрегаты, скрепленные физическими силами нековалентных связей, включая, но не ограничиваясь, гидрофобные/гидрофильные взаимодействия и водородные связи.
Будет лучше иметь способ получения сохраняющих форму агрегатов геля in situ так, чтобы форма агрегата определялась формой места нанесения. Это будет особенно применимо, когда место применения находится in vivo, например биомедицинское применение, такое как восстановление суставов, заживление ран, доставка лекарственных средств и косметическая хирургия. Настоящее изобретение обеспечивает такой способ.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следовательно, одним из аспектов настоящего изобретения является способ получения сохраняющих форму агрегатов частиц геля, включающий получение суспензионной системы, включающей множество частиц геля, диспергированных в полярной жидкости или смеси двух или более смешиваемых жидкостей, по меньшей мере одна из которых является полярной, где частицы геля имеют первый абсолютный электрохимический потенциал; и внесение суспензионной системы через воронку с выбранной скоростью внесения в получающую среду, где частицы геля приобретают второй абсолютный электрохимический потенциал, который меньше (близкий к нулю), чем первый абсолютный электрохимический потенциал, вследствие чего частицы геля объединяются в сохраняющие форму агрегаты, скрепляемые физическим силами нековалентных связей, включающих гидрофобные-гидрофильные взаимодействия и водородные связи.
В аспекте настоящего изобретения частицы геля находятся в концентрации от около 1 до около 500 мг сырого веса/мл в суспензионной системе.
В аспекте настоящего изобретения частицы геля находятся в концентрации от около 25 до около 250 мг сырого веса/мл в суспензионной системе.
В аспекте настоящего изобретения множество частиц геля имеют один размер, один или более химический состав и узкую полидисперсность.
В аспекте настоящего изобретения множество частиц геля имеют два или более различных размеров, композиция каждого отдельного размера такая же или отличная от композиции каждого из других различных размеров, все размеры имеют узкую полидисперсность.
В аспекте настоящего изобретения множество частиц геля имеет один или более химический состав и широкую полидисперсность.
В аспекте настоящего изобретения множество частиц геля находятся в такой концентрации в суспензионной системе, которая приводит к формированию сгустков.
В аспекте настоящего изобретения концентрация частиц геля в суспензионной системе составляет от около 300 мг сырого веса/мл до около 500 мг сырого веса/мл.
В аспекте настоящего изобретения получение суспензионной системы включает
получение полимеризующей системы, включающей мономер, или два или более различных мономера, где мономер или по меньшей мере один из двух или более мономеров включает(ют) одну или более гидрокси и/или одну или более эфирных групп, в полярной жидкости или смеси полярных жидкостей, где полярная жидкость или, по меньшей мере, одна из двух или более полярных жидкостей включает(ют) одну или более гидроксигрупп;
добавление от 0,01 до 10 моль процентов поверхностно-активного вещества к полимеризующей системе; и,
полимеризацию мономера(ов) с получением множества частиц геля, где каждая частица включает множество цепей полимера.
В аспекте настоящего изобретения получение суспензионной системы включает смешивание заранее полученных сухих частиц геля, жидкости(ей) и поверхностно-активного вещества.
В аспекте настоящего изобретения воронка включает полую иглу.
В аспекте настоящего изобретения полую иглу выбирают из группы, состоящей из игл размера 10-30.
В аспекте настоящего изобретения полую иглу выбирают из игл 15-27 размера.
В аспекте настоящего изобретения выбранная скорость внесения составляет от около 0,05 мл/минуту до около 15 мл/минуту.
В аспекте настоящего изобретения выбранная скорость внесения составляет от около 0,25 мл/минуту до около 10 мл/минуту.
В аспекте настоящего изобретения получающей средой является среда in vivo.
В аспекте настоящего изобретения среда in vivo включает ткань организма.
В аспекте настоящего изобретения ткань организма выбирают из группы, состоящей из эпителия, соединительной ткани, мышц и нервов.
В аспекте настоящего изобретения соединительную ткань выбирают из группы, состоящей из крови, кости и хряща.
В аспекте настоящего изобретения мономер(ы) выбирают из группы, состоящей из 2-алкеновой кислоты, гидрокси(2C-4C)алкил 2-алкеноата, гидрокси(2C-4C)алкокси(2C-4C)алкил 2-алкеноата, (1С-4C)алкокси(2C-4C)алкокси(2C-4C)алкил 2-алкеноата и вицинилэпокси(1С-4C)алкил 2-алкеноата и комбинации двух или более из них.
В аспекте настоящего изобретения мономер(ы) выбирают из группы, состоящей из акриловой кислоты, метакриловой кислоты, 2-гидроксиэтилакрилата, 2-гидроксиэтилметакрилата, моноакрилата диэтиленгликоля, монометакрилата диэтиленгликоля, 2-гидроксипропилакрилата, 2-гидроксипропилметакрилата, 3-гидроксипропилакрилата, 3-гидроксипропилметакрилата, моноакрилата дипропиленгликоля, монометакрилата дипропиленгликоля, гилцидилметакрилата, 2,3-дигидроксипропилметакрилата, глицидилакрилата и глицидилметакрилата и комбинации двух или более из них.
В аспекте настоящего изобретения мономер(ы) выбирают из группы, включающей 2-гидроксиэтилметакрилат, 2-гидроксипропилметакрилат, 3-гидроксипропилметакрилат и комбинации двух или более из них.
В аспекте настоящего изобретения жидкость(и) выбирают из группы, состоящей из (1С-10C)спирта, (2C-8C)полиола, (1С-4C)алкилового эфира (2C-8C)полиола, эфира (1С-4C)кислоты (2C-8C)полиола; полиэтиленоксида с концевыми гидроксигруппами, полиалкиленгликоля и гидрокси(2C-4C)алкилового эфира моно, ди- или трикарбоновой кислоты.
В аспекте настоящего изобретения жидкость (и) выбирают из группы, состоящей из воды, метанола, этанола, изопропилового спирта, этиленгликоля, диэтиленгликоля, триэтиленгликоля, полиэтиленгликоля 200-600, пропиленгликоля, дипропиленгликоля, 1,4-бутандиола, 2,3-бутандиола, 1,6-гександиола, 2,5-гександиола, монометилового эфира этиленгликоля, моноэтилового эфира этиленгликоля, эфира метилцеллюлозы, моноацетата этиленгликоля, монометилового эфира пропиленгликоля, глицерина, моноацетата глицерина, три(2-гидроксиэтил)цитрата, ди(гидроксипропил)оксалата, глицерина, моноацетата глицерина, диацетата глицерина, монобутирата глицерина и сорбита.
В аспекте настоящего изобретения жидкостью является вода.
В аспекте настоящего изобретения способ, кроме того, включает добавление от около 0,1 до около 15 моль процентов сшивающего агента к полимеризующей системе, что приводит к сшивке цепей полимера.
В аспекте настоящего изобретения сшивающий агент выбирают из группы, состоящей из диакрилата этиленгликоля, диметилакрилата этиленгликоля, диметакрилата 1,4-дигидроксибутана, диметакрилата диэтиленгликоля, диметакрилата пропиленгликоля, диметакрилата диэтилгликоля, диметакрилата дипропиленгликоля, диакрилата диэтиленгликоля, диакрилата дипропиленгликоля, дивинилбензола, дивинилтолуола, диаллаилтартрата, диаллилималата, дивинилтартрата, триаллилмеламина, N,N'-метиленбисакриламида, диаллилмалеата, дивинилового эфира, 1,3-диаллил 2-(2-гидроксиэтил)цитрата, винилаллилцитрата, аллилвинилмалеата, диаллилитаконата, ди(2-гидроксиэтил)итаконата, дивинилсульфона, гексагидро-1,3,5-триаллилтриазина, триаллилфосфита, диаллилбензолфосфоната, триаллилаконитата, дивинилцитраконата, триметакрилата триметилопропана и диаллилфумарата.
В аспекте настоящего изобретения сшивающее вещество выбирают из группы, состоящей из сложных эфиров α-гидроксикислот.
В аспекте настоящего изобретения сшитые цепи полимера имеют среднюю молекулярную массу от около 3000 до около 2000000.
В аспекте настоящего изобретения способ, кроме того, включает добавление одного или более рабочих веществ(а) к полярной жидкости(ям) полимеризующей системы перед полимеризацией, где после полимеризации часть жидкости, содержащей рабочие веществ(а) поглощается частицами геля для получения частиц геля, содержащих рабочее вещество.
В аспекте настоящего изобретения частицы геля, содержащие рабочее вещество, содержат от около 0,1 до около 90 мас.% жидкости, содержащей рабочее вещество.
В аспекте настоящего изобретения способ, кроме того, включает добавление одного или более рабочих веществ(а) к суспензионной системе.
В аспекте настоящего изобретения после образования сохраняющего форму агрегата от около 0,1 до около 90 мас.% жидкости, содержащей рабочие вещества(о), улавливается сохраняющим форму агрегатом.
В аспекте настоящего изобретения способ, кроме того, включает:
добавление одного или более рабочих веществ(а) к полимеризующей системе для получения первой жидкости, содержащей рабочее вещество, где после полимеризации часть первой жидкости, содержащей рабочее вещество, поглощают частицы геля;
добавление одного или более второго рабочего веществ(а) к суспензионной системе для получения второй жидкости, содержащей рабочее вещество, где после образования сохраняющего форму агрегата часть второй жидкости, содержащей рабочее вещество, улавливается сохраняющим форму агрегатом, где первое рабочее вещество(а) может быть таким же или отличаться от второго рабочего веществ(а) и жидкость, содержащая первое рабочее вещество может быть такой же или отличаться от жидкости, содержащей второе рабочее вещество.
В аспекте настоящего изобретения от 0,1 до 90 мас.% жидкости(ей), содержащей первое рабочее вещество(а), поглощается множеством частиц гидрогеля и от 0,1 до 90 мас.% жидкости(ей), содержащей второй рабочее вещество, улавливается сохраняющим форму агрегатом.
В аспекте настоящего изобретения рабочее вещество(а) включает одно или более биомедицинское средство(а), которое может быть одинаковым или различным.
В аспекте настоящего изобретения одно или более биомедицинское средство(а) включает одно или более фармацевтическое средство(а).
В аспекте настоящего изобретения фармацевтическое средство, кроме того, включает одно или более фармацевтически приемлемое вспомогательное вещество(а).
В аспекте настоящего изобретения фармацевтический агент включает пептид или белок.
В аспекте настоящего изобретения фармацевтический агент(ы) является(ются) применимым для лечения рака.
В аспекте настоящего изобретения фармацевтический агент(ы) является(ются) применимым для лечения ишемической болезни сердца.
В аспекте настоящего изобретения фармацевтический агент(ы) является(ются) применимым для лечения респираторных заболеваний.
В аспекте настоящего изобретения фармацевтический агент(ы) является(ются) применимым для лечения инфекционных заболеваний.
В аспекте настоящего изобретения фармацевтический агент(ы) является(ются) применимым для лечения заболеваний глаз.
В аспекте настоящего изобретения фармацевтический агент(ы) являются факторами роста.
В аспекте настоящего изобретения биомедицинский агент(ы) включает одно или более веществ, поддерживающих рост тканей.
В аспекте настоящего изобретения биомедицинский агент(ы) включает косметические вещества, усиливающие ткани.
В аспекте настоящего изобретения размер множества частиц геля составляет от около 10 до около 75000 нанометров в диаметре.
В аспекте настоящего изобретения размер множества частиц геля составляет от около 10 до около 800 нанометров в диаметре.
В аспекте настоящего изобретения частицы геля являются разлагаемыми.
В аспекте настоящего изобретения сохраняющий форму агрегат является разлагаемым.
В аспекте настоящего изобретения частицы геля являются разлагаемыми, и сохраняющий форму агрегат является разлагаемым.
В аспекте настоящего изобретения сохраняющий форму агрегат является эластичным.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Краткое описание таблиц
Табл.1 показывает эффект концентрации реагента на размер и полидисперсность частиц.
Табл.2 показывает эффект скорости внесения, размера воронки и концентрации частиц на образование агрегата.
Табл.3 показывает эффект размера частиц на агрегацию с использованием суспензий частиц pHEMA, варьирующихся размером в диапазоне от 45 мкм до 150 мкм.
Табл.4 показывает эффект типа полимера на скорость разложения агрегатов, состоящих из частиц гидрогеля, образованных при различном соотношении HEMA к MAA.
Табл.5 показывает эффект концентрации частиц на образование сгустков частиц.
Табл.6 показывает электрохимический потенциал на частицах геля различного размера.
Табл.7 показывает эффект ионной силы на электрохимический потенциал и на размер с абсорбированной водой частиц гидрогеля pHEMA.
Табл.8 показывает эффект добавления ацетона к водной дисперсии частиц pHEMA на размер частиц.
Табл.9 показывает эффект добавления этанола к водной дисперсии частиц pHEMA на размер частиц.
Табл.10 показывает эффект концентрации частиц на электрохимический потенциал и размер частиц в водной дисперсии частиц pHEMA.
Табл.11 показывает эффективность нагрузки и пиковое высвобождение FITC-BSA и FITC-декстрана из агрегатов, полученных из дисперсий частиц различных размеров, когда суспензирующая система включает воду отдельно и воду плюс 5% желатина.
Краткое описание чертежей
Фиг. 1 представляет собой график, показывающий взаимоотношения диаметра частиц в дисперсии к максимальной концентрации сырого веса частиц в суспензии до начала образования агрегата. Подписи к чертежу: SDS частицы показаны как -■-. DDS частицы показаны как -•-.
Фиг. 2 представляет собой фотографию агрегата частиц pHEMA, образованного in vivo с использованием способа настоящего изобретения. Агрегат частиц pHEMA показан через семь (7) дней после инъекции. Имплантат на фотографии представляет собой белый диск в форме полумесяца вверху в центре открытой ткани мыши.
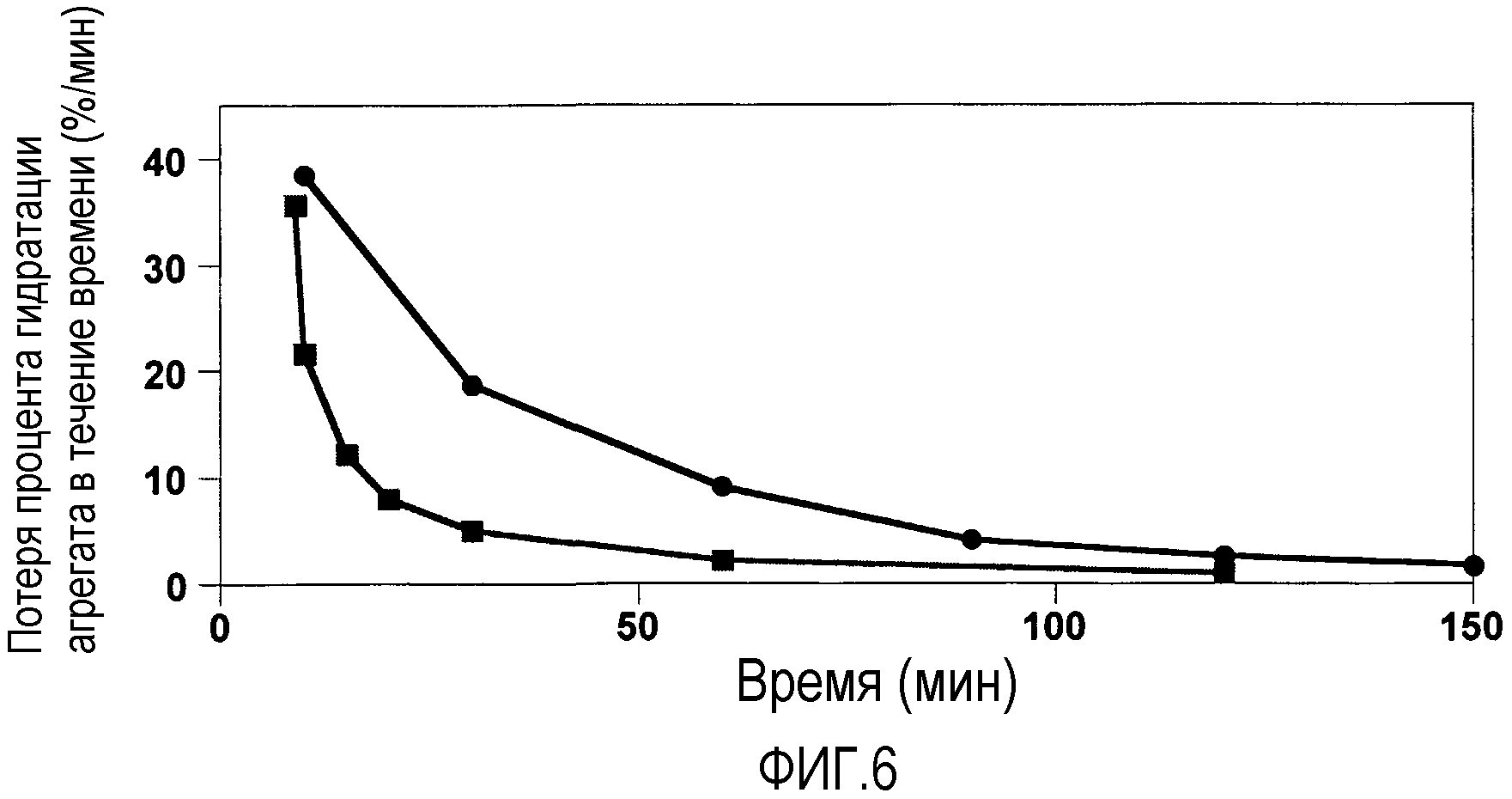
Фиг. 3-9 показывают графики первых производных, рассчитанных из угла наклона в различные временные точки кривой, образованной измерением потери воды в увеличивающееся время агрегатами частиц геля при их преобразовании от исходного соединения до конечной формы, сохраняющей форму. Первая производная обеспечивает скорость потери воды в единицу времени в точках измерений.
Фиг. 3 показывает вышеуказанный график для агрегатов, состоящих из частиц различного размера, введенных в фосфатный буферный раствор при комнатной температуре. Она показывает графически первую производную потери воды из вводимых агрегатов; Tween (80) в PBS при комнатной температуре. Подписи к чертежу: -•- показывает 735 нм частицы %/время; -■- показывает 600 нм частицы %/время; и -♦- показывает 480 нм частицы %/время.
Фиг. 4 показывает вышеуказанный график для агрегатов, состоящих из частиц различного размера, вводимых в фосфатный буферный раствор при комнатной температуре и 37°C. Она показывает графически первую производную потери воды из вводимых агрегатов; Tween (80) в PBS при 37°C или и при комнатной температуре. Подписи к чертежу: -•- показывает 735 нм при 37°C PBS; -■- показывает 600 нм при 37°C PBS; -o- показывает 735 нм при 25°C PBS; и -□- показывает 600 нм при 25°C PBS.
Фиг. 5 показывает вышеуказанный график для агрегатов, состоящих из частиц различного размера, вводимых в бычью сыворотку при комнатной температуре. Она показывает графически первую производную потери воды из вводимых агрегатов; Tween (80) в бычьей сыворотке при комнатной температуре. Подписи к чертежу: -•- показывает 735 нм частицы; -■- показывает 600 нм частицы; и -♦- показывает 480 нм частицы.
Фиг. 6 показывает вышеуказанный график для агрегатов, состоящих из частиц, вводимых в гипертонический солевой раствор и PBS при комнатной температуре. Она показывает графически первую производную потери воды из вводимых агрегатов; Tween (80) в PBS или гипертоническом солевом растворе. Подписи к чертежу: -•- показывает 735 нм частицы в PBS; и -■- показывает 735 нм частицы в гипертоническом солевом растворе.
Фиг. 7 показывает вышеуказанный график для агрегатов, состоящих из частиц, вводимых в PBS при комнатной температуре. Она показывает графически первую производную потери воды из вводимых агрегатов; pHEMA по сравнению с pHPMA в PBS при комнатной температуре. Подписи к чертежу: -•- показывает 465 нм наночастицы pHPMA; и -■- показывает 480 нм наночастицы pHEMA.
Фиг. 8 показывает вышеуказанный график для агрегатов pHEMA с поверхностно-активным веществом или SDS или DSS при комнатной температуре и 37°C. Она показывает графически первую производную потери воды из вводимых агрегатов; эффект поверхностно-активного вещества. Подписи к чертежу: -•- показывает DSS при 25°C; -■- показывает DSS при 37°C; -o- показывает SDS при 25°C; и -□- показывает SDS при 37°C.
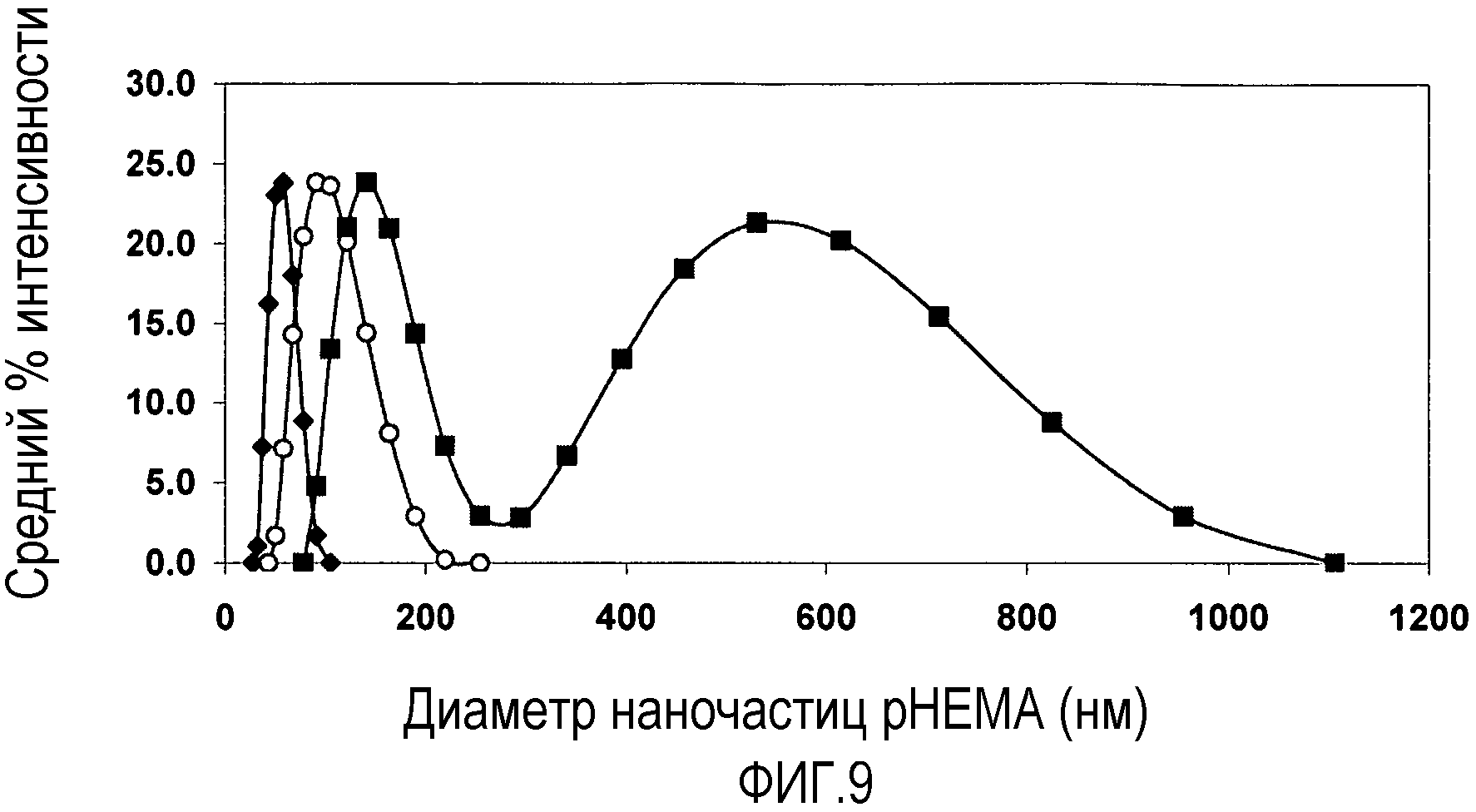
Фиг. 9 представляет собой график, показывающий взаимоотношения между образованием сгустков частиц и сыром весом полимера в суспензии. Он графически показывает распределение размера наночастиц pHEMA определяемое LLS в течение TFF концентрирования частиц из сырого веса [36 мг/мл]i до [424 мг/мл]f. Подписи к чертежу: -♦- показывает концентрацию сырого веса 36 мг/мл; -о- показывает концентрацию сырого веса 241 мг/мл; и -■- показывает концентрацию сырого веса 424 мг/мл.
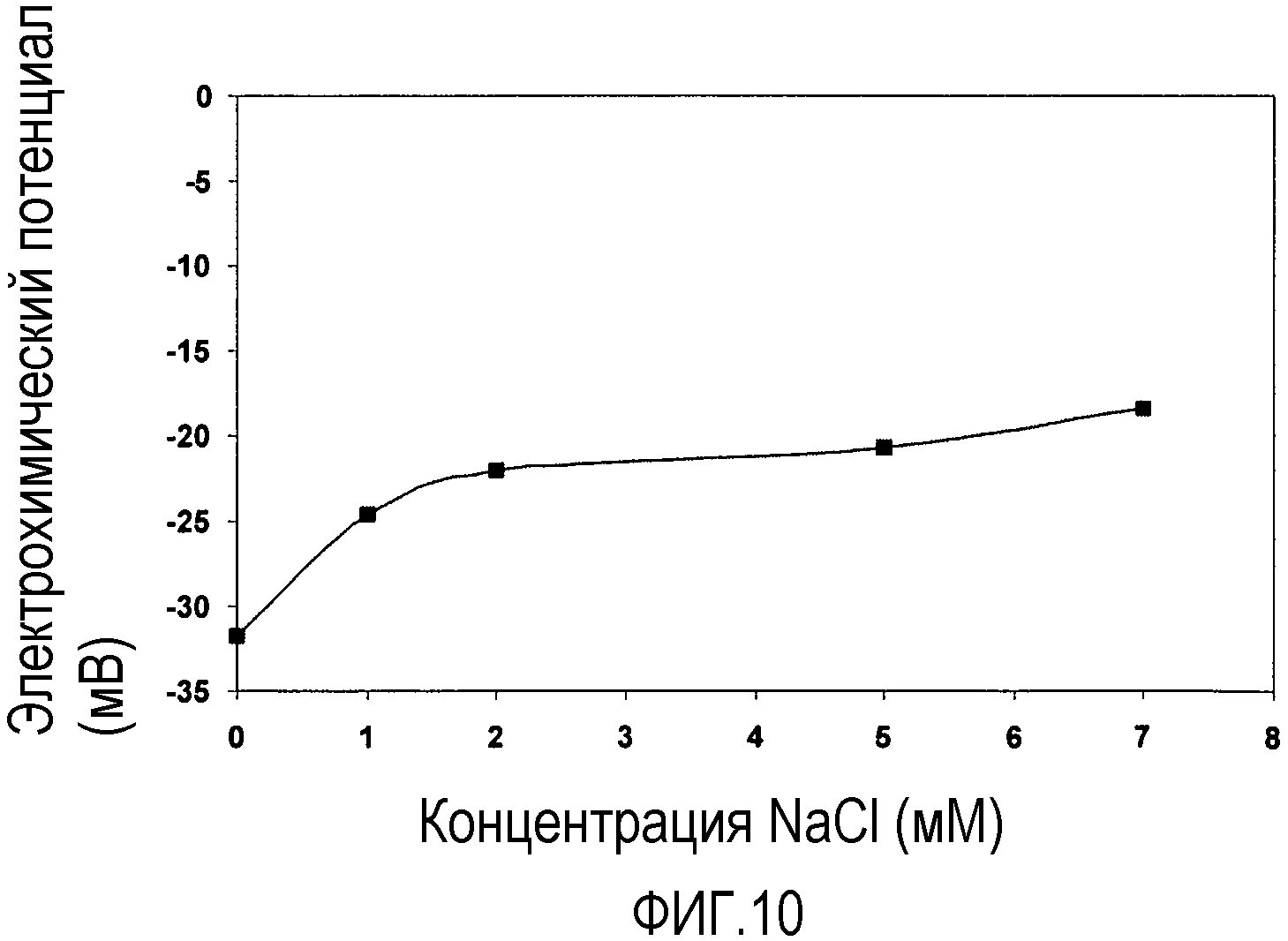
Фиг. 10 представляет собой график, показывающий эффект ионной силы на электрохимический потенциал частиц pHEMA, стабилизированных SDS. Он графически показывает эффект ионной силы на электрохимический потенциал наночастиц pHEMA, стабилизированных SDS. Подписи к чертежу: -■- показывает электрохимический потенциал наночастиц pHEMA.
Фиг. 11 представляет собой график, показывающий высвобождение бромокрезолового зеленого красителя из агрегатов, составленных из частиц pHEMA узкой полидисперсности, вводимых в PBS при комнатной температуре. Он графически показывает бромокрезоловый зеленый, высвобождаемый из наночастиц, стабилизированных Tween (80). Подписи к чертежу: -•- показывает 725 нм; -■- показывает 600 нм; и -о- показывает 480 нм.
Фиг. 12 представляет собой график, показывающий высвобождение бромокрезолового зеленого красителя из агрегатов, состоящих из частиц pHEMA широкой полидисперсности, вводимых в PBS при комнатной температуре. Он графически показывает бромокрезоловый зеленый, высвобождаемый из наночастиц, стабилизированных Tween (80). Подписи к чертежу: -•- показывает смесь 50:50 при 725 нм: 600 нм; -■- показывает 50:50 смесь при 725 нм: 480 нм; и -о- показывает 50:50 смесь при 600 нм: 480 нм.
Фиг.13 представляет собой график, показывающий высвобождение 10 мг FITC-BSA (72 кДа) из ряда 500 мг агрегатов, полученных из частиц pHEMA различного диаметра. Он графически показывает профили высвобождения для 10 мг FITC-BSA (72 кДа) из 500 мг депо агрегатов наночастиц pHEMA, образованных при введении в PBS при температуре 37°C. Подписи к чертежу: -♦- показывает 10 мг FITC-BSA_475 нм pHEMA; -▲- показывает 10 мг FITC-BSA_300 нм pHEMA; -*- показывает 10 мг FITC-BSA_200 нм pHEMA; и -|- показывает 10 мг FITC-BSA_175 нм pHEMA.
Фиг. 14 представляет собой график, показывающий высвобождение 5 мг FITC-BSA (72 кДа) из ряда 500 мг агрегатов, состоящих из частиц pHEMA различного диаметра, вводимых в PBS при комнатной температуре. Он графически показывает профили высвобождения для 5 мг FITC-BSA (72 кДа) из 500 мг депо агрегатов наночастиц pHEMA, полученные при инъекции в PBS при температуре 37°C. Подписи к чертежу: -■- показывает 5 мг FITC-BSA_475 нм pHEMA; -о- показывает 5 мг FITC-BSA_300 нм pHEMA; -•- показывает 5 мг FITC-BSA_200 нм pHEMA; и -o- показывает 5 мг FITC-BSA_175 нм pHEMA.
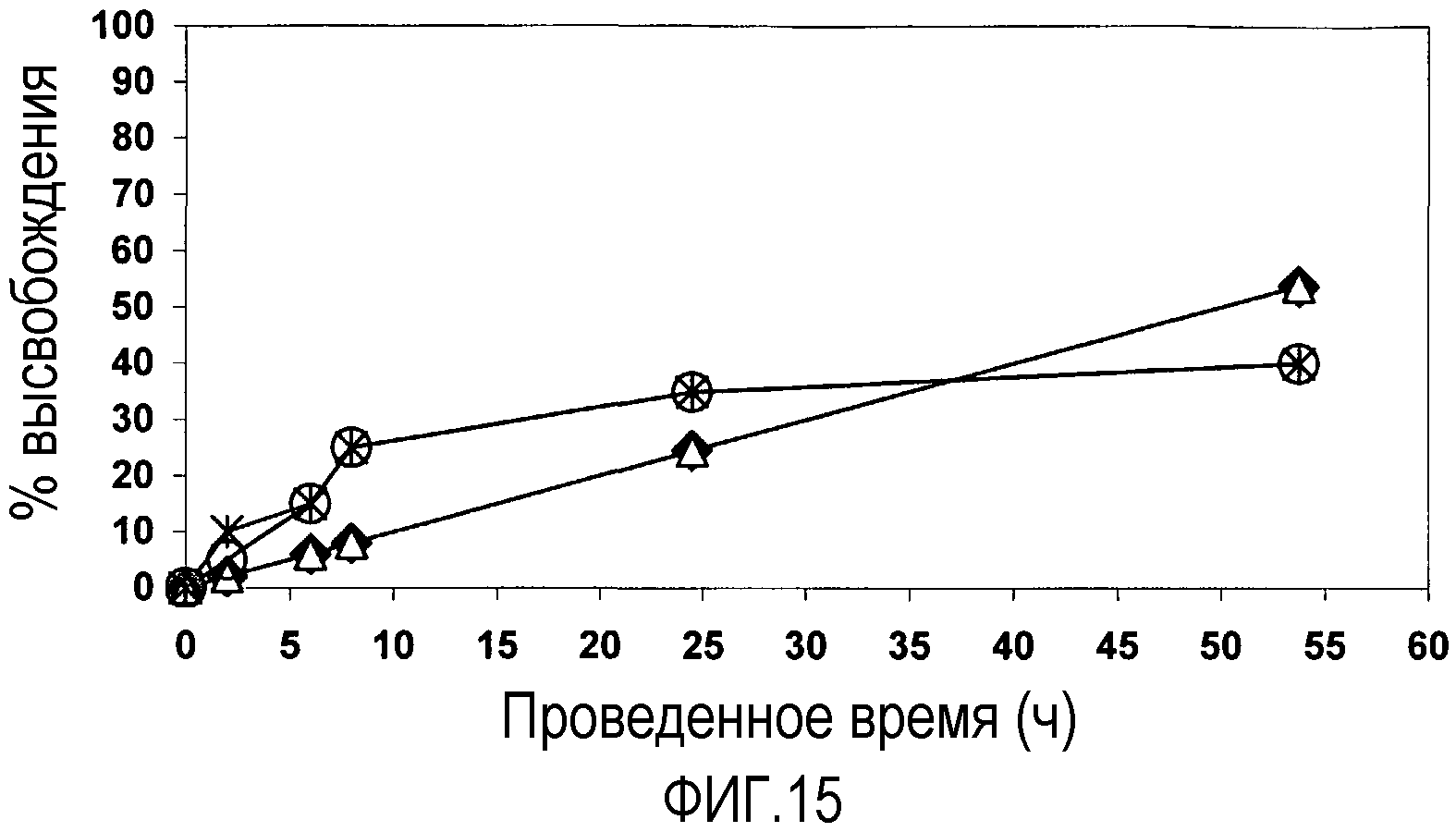
Фиг. 15 представляет собой график, показывающий профили высвобождения 10 мг FITC-декстрана (2000 кДа) из ряда 500 мг депо агрегатов наночастиц pHEMA, полученные при введении в PBS при 37°C. Подписи к чертежу: -♦- показывает 10 мг FITC-Dex_475 нм pHEMA; -Δ- показывает 10 мг FITC-Dex_300 нм pHEMA; -*- показывает 10 мг FITC-Dex_200 нм pHEMA; и -о- показывает 10 мг FITC-Dex_175 нм pHEMA.
Фиг. 16 представляет собой график, показывающий профили высвобождения 20 мг FITC-Dextran (2000 кДа) из ряда 500 мг депо агрегатов наночастиц pHEMA, полученные при введении в PBS при 37°C. Подписи к чертежу: -о- показывает 20 мг FITC-Dex_475 нм pHEMA; -■- показывает 20 мг FITC-Dex_300 нм pHEMA; -о- показывает 20 мг FITC-Dex_200 нм pHEMA; и -•- показывает 20 мг FITC-Dex_175 нм pHEMA.
Фиг. 17 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг агрегатов наночастиц pHEMA, полученных из дисперсий частиц, стабилизированных SDS различного размера, вводимых в PBS при 23°C. Подписи к чертежу: -▲- показывает 175 нм pHEMA нч; и -♦- показывает 475 нм pHEMA нч.
Фиг. 18 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг агрегатов наночастиц pHEMA, полученных из частиц, стабилизированных SDS, различного размера, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 175 нм pHEMA нч; и -♦- показывает 475 нм pHEMA нч.
Фиг. 19 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг агрегатов наночастиц pHEMA, полученных из дисперсий частиц, стабилизированных DSS, различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 265 нм pHEMA нч; и -♦- показывает 500 нм pHEMA нч.
Фиг. 20 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг агрегатов наночастиц pHEMA полученных из дисперсий частиц, стабилизированных DSS различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -■-: показывает 265 нм pHEMA нч; и -♦- показывает 500 нм pHEMA нч.
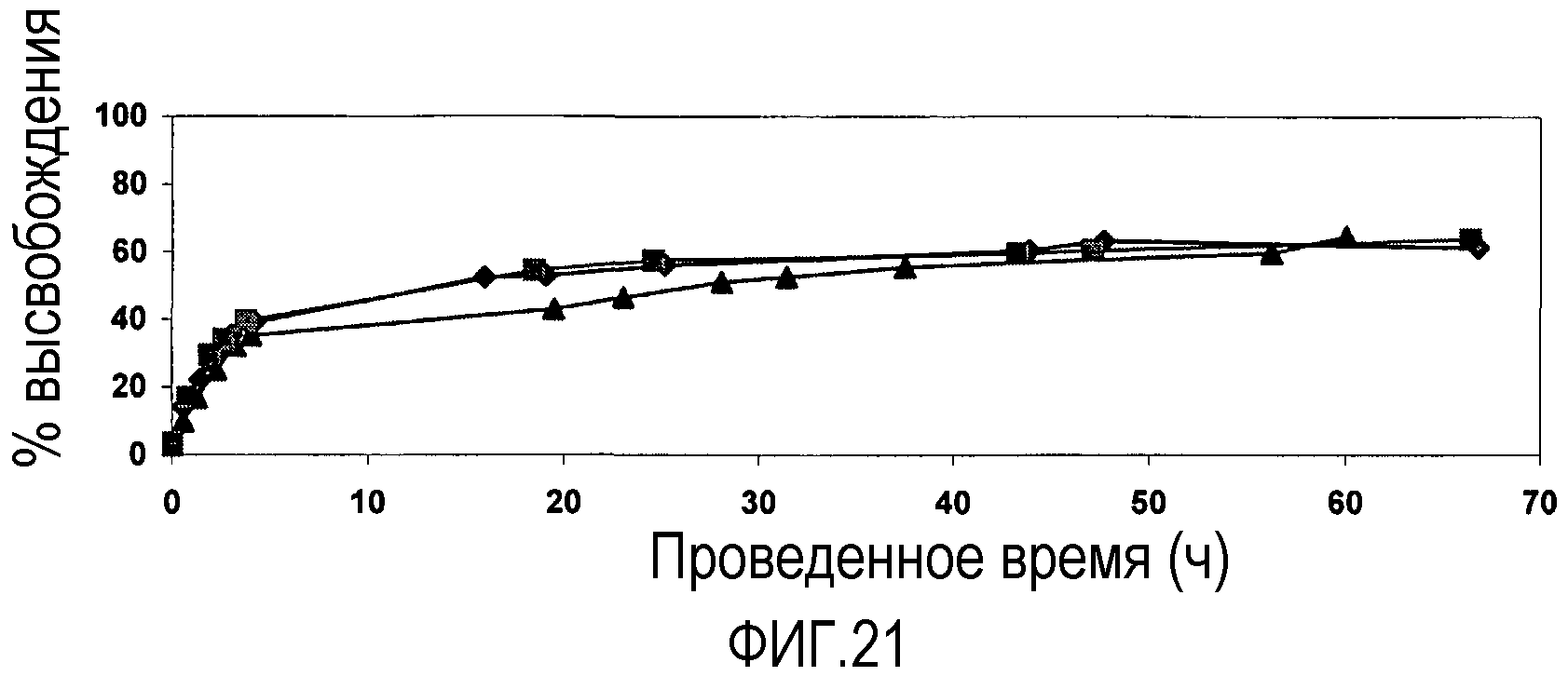
Фиг. 21 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг (смешанного размера частиц) агрегатов наночастиц pHEMA полученных из дисперсий частиц pHEMA, стабилизированных SDS различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -▲- показывает 20/80: 475 нм/175 нм pHEMA нч; -♦- показывает 40/60:475 нм/175 нм pHEMA нч; и -■- показывает 60/40:475 нм/175 нм pHEMA нч.
Фиг. 22 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг (смешанного размера частиц) агрегатов наночастиц pHEMA, полученных из дисперсий частиц pHEMA, стабилизированных SDS различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -▲- показывает 20/80:475 нм/175 нм pHEMA нч; -♦- показывает 40/60:475 нм/175 нм pHEMA нч; и -■- показывает 60/40:475 нм/175 нм pHEMA нч.
Фиг. 23 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг агрегатов наночастиц pHEMA (смешанного размера частиц), полученных из дисперсий частиц pHEMA, стабилизированных DSS различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -▲- показывает 20/80:500 нм/265 нм pHEMA нч; -♦- показывает 40/60:500 нм/265 нм pHEMA нч; и - ■- показывает 60/40:500 нм/265 нм pHEMA нч.
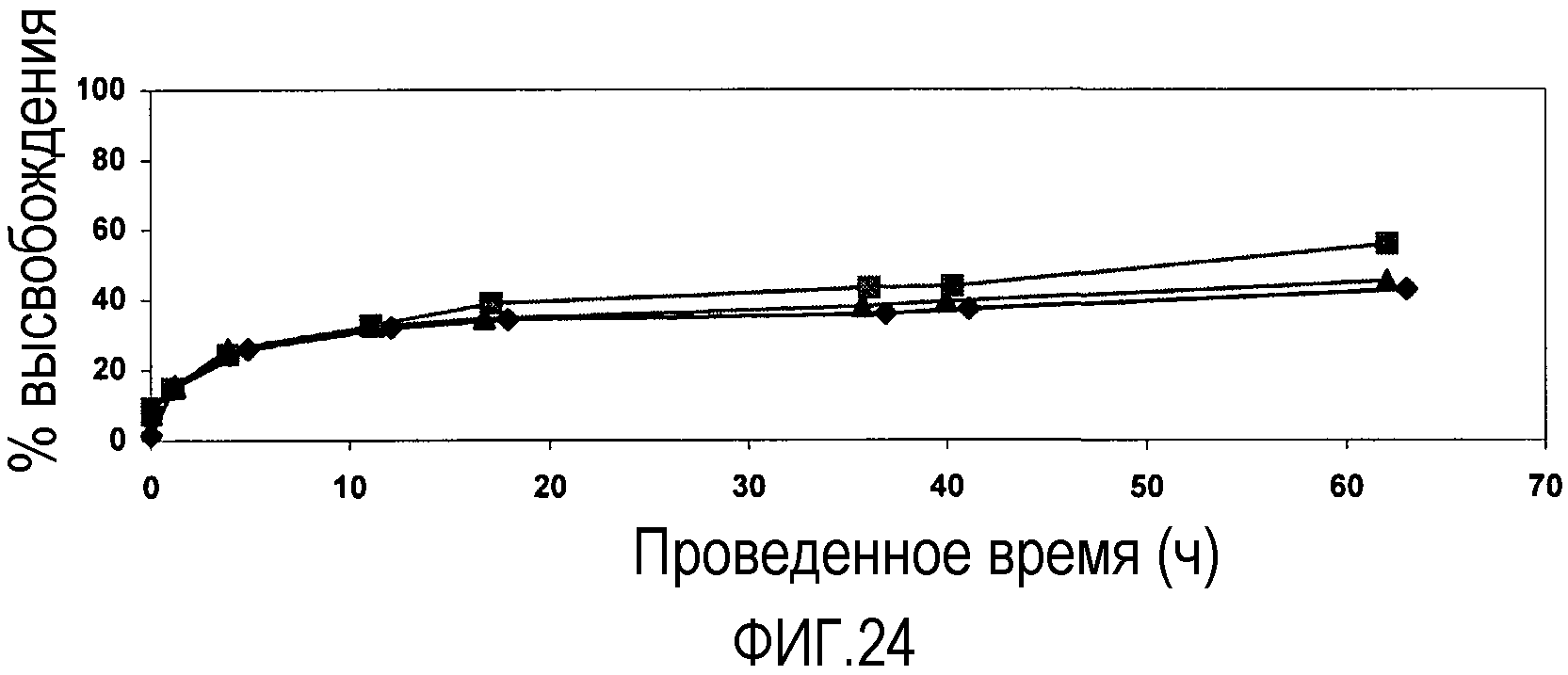
Фиг. 24 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг агрегатов наночастиц pHEMA (смешанного размера частиц), полученных из дисперсий частиц pHEMA, стабилизированных DSS, различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 20/80:500 нм/265 нм pHEMA нч; -♦- показывает 40/60:500 нм/265 нм pHEMA нч; и -▲- показывает 60/40:500 нм/265 нм pHEMA нч.
Фиг. 25 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг агрегатов наночастиц pHEMA (смешанного размера частиц), полученных из дисперсий частиц pHEMA, стабилизированных SDS различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 20/80:170 нм/75 нм pHEMA нч; -♦- показывает 40/60:170 нм/75 нм pHEMA нч; и -▲- показывает 60/40:170 нм/75 нм pHEMA нч.
Фиг. 26 представляет собой график, показывающий высвобождение FITC-Dextran (2000 кДа) из 500 мг агрегатов наночастиц pHEMA (смешанного размера частиц), полученных из дисперсий частиц pHEMA, стабилизированных SDS различных размеров, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 20/80:170 нм/75 нм pHEMA нч; - ♦- показывает 40/60:170 нм/75 нм pHEMA нч; и -■- показывает 60/40:170 нм/75 нм pHEMA нч.
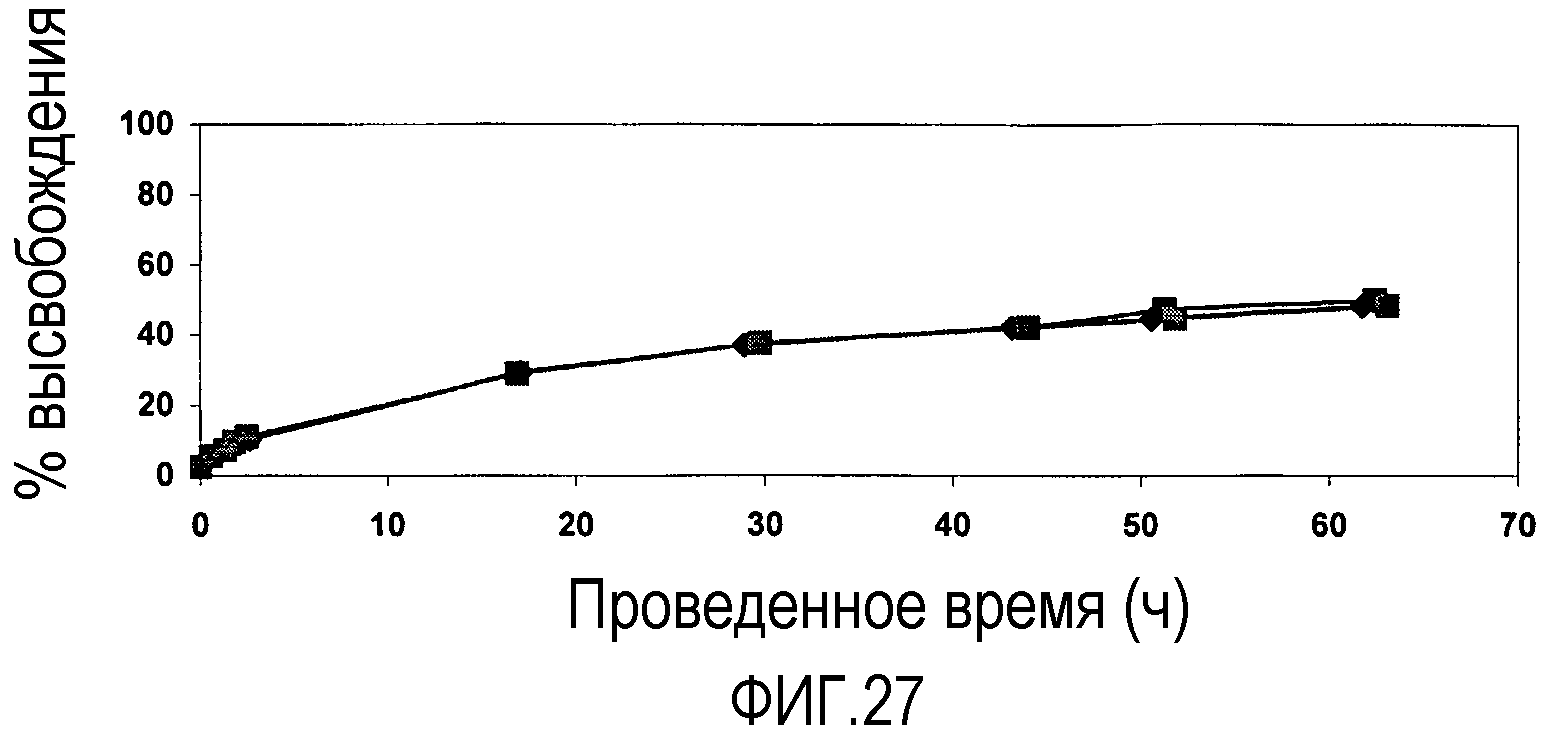
Фиг. 27 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг агрегатов наночастиц pHEMA (смешанного размера частиц), полученных из дисперсий частиц pHEMA, стабилизированных SDS, различных размеров, содержащих 20 мас.% полиэтиленгликоля 400, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 20/80:170 нм/75 нм pHEMA нч; -♦- показывает 40/60:170 нм/75 нм pHEMA нч; и -■- показывает 60/40:170 нм/75 нм pHEMA нч.
Фиг. 28 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг агрегатов наночастиц pHEMA (смешанного размера частиц), полученных из дисперсий частиц pHEMA, стабилизированных SDS различных размеров, содержащих 20 мас.% полиэтиленгликоля 400, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 20/80:170 нм/75 нм pHEMA нч; -♦- показывает 40/60:170 нм/75 нм pHEMA нч; и -■- показывает 60/40:170 нм/75 нм pHEMA нч.
Фиг. 29 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг агрегатов наночастиц pHEMA полученных из дисперсий частиц pHEMA, стабилизированных SDS различных размеров, содержащих 5 мас.% желатина, вводимых в PBS при 23°C. Подписи к чертежу: -■- показывает 95% 175 нм pHEMA нч:5% желатина; и -♦- показывает 95% 475 нм pHEMA нч:5% желатина.
Фиг. 30 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг агрегатов наночастиц pHEMA, содержащих 5 мас.% желатина, вводимых в PBS при 23°C. Подписи к чертежу: - ♦- показывает 95% 175 нм pHEMA нч:5% желатина; и - ■- показывает 95% 60/40:475 нм /175 нм pHEMA нч:5% желатина.
Фиг. 31 представляет собой график, показывающий высвобождение FITC-BSA (72 кДа) из 500 мг разлагаемых агрегатов наночастиц pHEMA, вводимых в PBS при 23°C. Подписи к чертежу: -▲- показывает 95% 175 нм pHEMA:5% 100 нм (95:5) pHEMA:pMAA; -♦- показывает 95% 475 нм pHEMA:5% 100 нм (95:5) pHEMA:pMAA; и -■- показывает 95% 60/40 475 нм/175 нм pHEMA:5% 100 нм (95:5) pHEMA:pMAA.
Фиг. 32 представляет собой график, показывающий высвобождение FITC-декстрана (2000 кДа) из 500 мг разлагаемых агрегатов наночастиц pHEMA, вводимых в PBS при 23°C. Подписи к чертежу: -♦- показывает 95% 175 нм pHEMA:5% 100 нм (95:5) pHEMA:pMAA; -■- показывает 95% 475 нм pHEMA:5% 100 нм (95:5) pHEMA:pMAA; и -▲- показывает 95% 60/40 475 нм/175 нм pHEMA:5% 100 нм (95:5) pHEMA:pMAA.
Фиг. 33 представляет собой схему, показывающую образование агрегата частиц гидрогеля.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В настоящем описании термин "гель" относится к трехмерной полимерной структуре, которая сама по себе является нерастворимой в определенной жидкости, но которая способна абсорбировать и удерживать большие количества жидкости с образованием стабильной, часто мягкой и гибкой, но всегда, в одной или другой степени сохраняющей форму, структуры. Когда жидкостью является вода, гель называют гидрогель. Если широко не указано иначе, термин "гель" будет использоваться на всем протяжении настоящей заявки для обозначения и полимерных структур, которые абсорбировали жидкость, иную, чем вода и к полимерным структурам, которые абсорбировали воду, специалисту в области техники из контекста очевидно, где полимерная структура является просто "гелем" или "гидрогелем".
Термин "полярная жидкость" в настоящем описании имеет значение, обычно понимаемое специалистом в области техники химии. Вкратце, полярной жидкостью является жидкость, в которой электроны неравномерно распределены среди атомов ее молекул и, следовательно, создает электрический диполь. Чтобы быть полярной молекула должна содержать по меньшей мере один атом, который является более электроотрицательным, чем другие атомы в молекуле. Примеры полярных жидкостей включают, без ограничения, воду, где атом кислорода несет частичный отрицательный заряд и атомы водорода частичный положительный заряд, и спирты, где O-H компонент подобным образом поляризован.
В настоящем описании "частицы геля" относится к микроскопическому или суб-микроскопическому количеству геля дискретной формы, обычно, но необязательно, сферической или практически такой. В настоящем описании "частица геля” включает небольшие сгустки отдельных частиц, собранных вместе физическими силами нековалентных связей, таких как гидрофильные/гидрофобные взаимодействия и водородные связи, где сгустки не влияют отрицательно на стабильность суспензии частиц геля (суспензионной системы), содержащей их или введение суспензионной системы в способах по настоящему изобретению. Сгустки возникают в результате изменений концентрации частиц геля в суспензии. То есть в более высоких концентрациях, более вероятно, что отдельные частицы сблизятся друг с другом достаточно для сил нековалентных связей, которые в конечном счете держат вместе сохраняющий форму агрегат по настоящему изобретению, чтобы вызвать их слияние.
В настоящем описании "суспензия" относится к равномерно распределенной стабильной дисперсии твердого вещества в жидкости, в которой твердое вещество нерастворимо. Поверхностно-активное вещество может быть добавлено к жидкости для стабилизации дисперсии. В настоящем описании "суспензионная система" относится к суспензии, где частицы геля по настоящему изобретению представляют собой диспергированное твердое вещество. "Стабильный" обозначает, что твердое вещество остается равномерно распределенным в течение по меньшей мере 24 часов, если не подвергается разрушению внешними силами, такими как, без ограничения, центрифугирование или фильтрация.
В настоящем описании "поверхностно-активное вещество" имеет значение, обычно понимаемое специалистом в области техники химии. То есть поверхностно-активное вещество представляет собой растворимое соединение, которое может быть анионным, катионным, цвиттерионным, амфотерным или нейтральным по заряду и которое уменьшает поверхностное натяжение жидкости, в которой оно растворено, или которое уменьшает натяжение на границе фаз между двумя жидкостями или жидкостью и твердым веществом.
В настоящем описании термин " сохраняющий форму агрегат" относится к структуре, состоящей из большого количества частиц геля, удерживаемых вместе силами между частицами и частицами-жидкостью, такими как, без ограничения, гидрофильные/гидрофобные взаимодействия и водородные связи, где структура сохраняется бесконечно долго, она может быть порезана, отлита или, в предпочтительном в настоящее время варианте осуществления настоящего изобретения, приспособлена при введении in vivo, если только агрегат или частицы, составляющие его, специально не созданы как разлагаемые.
В настоящем описании "разлагаемый" сохраняющий форму агрегат относится к агрегату, который разлагается на отдельные частицы геля (или сгустки частиц) при контакте с выбранным физическим или химическим условием, таким как, без ограничения, температура, трение, pH, ионная сила, электрическое напряжение и/или ток, кислотность, основность, эффекты растворителей и подобные.
В настоящем описании "разлагаемые" частицы геля относятся к частицам геля, которые разлагаются на отдельные цепи полимеров или даже частичные цепи и которые теряют сферическую или другую определенную форму при контакте с выбранным физическим или химическим условием, таким как, без ограничения, температура, трение, pH, ионная сила, электрическое напряжение и/или ток, кислотность, основность, эффекты растворителей и подобные.
В настоящем описании термин "получающая среда" относится к любой среде, в которую вводят суспензионную систему по настоящему изобретению и в которой образуется сохраняющий форму агрегат по изобретению. Для целей настоящего изобретения, получающей средой является среда, в которой абсолютный электрохимический потенциал отдельных частиц геля снижен до уровня, который приводит к слиянию частиц и в конечном счете образованию сохраняющего форму агрегата по настоящему изобретению.
В настоящем описании термины "эластомерный," "эластичность" и "эластичный" относятся к сохраняющему форму агрегату, который может быть растянут внешними силами до, по меньшей мере, 150% его исходного размера в любом направлении и при устранении силы немедленно возвращается к своему приблизительному исходному размеру.
В настоящем описании термин "мономер" имеет значение, понимаемое специалистом в области техники химии. То есть мономер представляет собой небольшое химическое соединение, которое способно образовывать макромолекулу из своих повторяющихся единиц, т.е. полимер. Два или более различных мономера могут реагировать с образованием полимера, в котором каждый из мономеров повторяется несколько раз, полимер называют как сополимер для отражения факта, что он состоит из более чем одного мономера.
В настоящем описании "размер", когда используется для описания частиц геля по настоящему изобретению, относится к объему по существу сферических частиц, что представлено их диаметром, который, конечно, непосредственно связан с их объемом. В отношении множества частиц геля размер относится к среднему объему частиц во множестве, что представлено их средним диаметром.
В настоящем описании термин "полидисперсность" относится к диапазону размеров частиц в суспензионной системе. "Узкая полидисперсность" относится к суспензионной системе, в которой размер отдельных частиц, который представлен их диаметрами, отклоняется на 10% или менее от среднего диаметра частиц в системе. Если два или более множеств частиц в суспензионной системе оба установлены как узкой полидисперсности, что обозначает, что существует две отдельных группы частиц, где частицы в каждой группе варьируются в диаметре не более чем на 10% от среднего диаметра частиц в этой группе и два средних отчетливо различны. Неограничивающим примером такой суспензионной системы будет таковая, включающая первую группу частиц, в которой каждая частица имеет диаметр 20 нм ± 10% и вторую группу частиц, в которой каждая частица имеет диаметр 40 нм ± 10%.
В настоящем описании термин "широкая полидисперсность" относится к суспензионной системе, в которой размер отдельных частиц группы частиц отклоняется более чем на 10% от среднего размера частиц группы.
В настоящем описании термин "множество" просто относится к более чем одному, т.е. двум или более.
В настоящем описании "химическая композиция", когда относится к частицам геля по настоящему изобретению, относится к химическому составу мономеров, которые полимеризуются с получением цепей полимера частиц, к химическому составу и соотношениям различных мономеров, если два или более мономера используются для получения цепей полимера частиц, и/или химическому составу и количеству любого сшивающего агента(ов), которые используются для взаимосвязи цепей частиц.
В настоящем описании "цепь частицы" относится к отдельной молекуле полимера или, если система, в которой существует цепь, содержит сшивающий агент, двум или более взаимосвязанным молекулам полимера. Среднее количество цепей полимера, которые будут сшиты, и среднее количество сшивок между любыми двумя цепями полимера в определенной частице геля будет зависеть от количества сшивок в системе и концентрации цепей полимера.
В настоящем описании "сырой вес" относится к массе частицы геля после того, как она абсорбировала максимальное количество жидкости, которое она способна абсорбировать. Когда установлено, что частица включает от около 0,1 до около 99 мас.% жидкости, содержащей рабочее вещество, что обозначает, что жидкость, содержащая рабочее вещество составляет от около 0,1 до около 99% массы частицы после заключения жидкости, содержащей вещество.
В настоящем описании "рабочее вещество" относится к любому веществу, которое поглощено частицей геля или улавливается сохраняющим форму агрегатом по настоящему изобретению. Примеры рабочих веществ, без ограничения, включают биомедицинские средства; биологически активные вещества, такие как фармацевтические агенты, гены, белки, факторы роста, моноклональные антитела, фрагменты антител, антигены, полипептиды, ДНК, РНК и рибозимы; сельскохозяйственные агенты (гербициды, фунгициды, инсектициды, гормоны роста растений и др.); рентгеноконтрастные вещества; радиоактивные вещества, пигменты; красители; металлы; полупроводники; легирующие примеси, химические промежуточные вещества; кислоты; и основания.
В настоящем описании фраза "фармацевтическое средство" относится и к небольшой молекуле и к макромолекулярным соединениям, используемым в качестве лекарственных средств. Среди первых находятся, без ограничения, антибиотики, химиотерапевтические средства (в частности соединения платины и таксол и его производные), обезболивающие, антидепрессанты, противоаллергические, противоаритмические, противовоспалительные соединения, стимуляторы ЦНС, снотворные, антихолинергические, противоатеросклеротические и подобные. Макромолекулярные соединения включают, без ограничения, моноклональные антитела (mAb), Fabs, белки, пептиды, клетки, антигены, нуклеиновые кислоты, ферменты, факторы роста и подобные. Фармацевтическое средство может быть предназначено для местного или системного применения.
В настоящем описании "металл" относится к элементу в Периодической Таблице Элементов, который характеризуется блеском, ковкостью, проводимостью и способностью образовывать положительные ионы. В частности, металл для целей настоящего изобретения относится к переходному элементу, т.е. Группам IB, IIB, IIIB (включая редкоземельные и актинидные металлы), IVB, VB, VIB, VIIB и VIII Периодической Таблицы.
В настоящем описании "благородный металл" относится к золоту, серебру, платине, палладию, рутению, родию и иридию.
В настоящем описании "сплав" относится к веществу, обладающему металлическими свойствами и состоящему из двух или более элементов, по меньшей мере, один из которых должен быть металлом. Примеры сплавов включают, но не ограничиваются, бронзу, латунь и нержавеющую сталь.
В настоящем описании термин "степень окисления" относится к заряду иона металла, который является результатом потери электронов атомом элемента. "Нулевая степень окисления" или "основное состояние" представляет собой металл как таковой с полным составом электронов. "Степень окисления один", т.е. обычно обозначаемая как M+1, где M относится к металлу, обозначает одиночный положительный заряд, равный заряду протона и возникший в результате потери одного электрона, "степень окисления два," или "M+2" обозначает положительный заряд, равный таковому двух протонов и возникающий в результате потери двух электронов и так далее.
В настоящем описании "полупроводник" относится к кристаллическому элементу или химическому соединению, имеющему значения удельного сопротивления, промежуточные между таковыми диэлектриков и таковыми металлов (проводников); т.е. от около 10-2 до 109Ом/см. Полупроводники будут проводить электричество в одних условиях, но не в других. Наиболее известным полупроводниковым элементом является диоксид кремния. Другие примеры полупроводниковых элементов включают, но не ограничиваются, сурьму, мышьяк, бор, углерод, германий, селен, серу и теллур. Примеры, без ограничения, полупроводниковых соединений включают арсенид галлия, антимонид индия и оксиды большинства металлов.
В настоящем описании "гидрокси" относится к -OH группе.
В настоящем описании "простой эфир" относится к химическому соединению, содержащему по меньшей мере один структурный компонент -C-O-C-.
В настоящем описании термин "алкил" относится к насыщенному алифатическому углеводороду с линейной или разветвленной цепью, т.е. соединению, состоящему только из углерода и водорода. Размер алкила в отношении, сколько атомов углерода он содержит, указан формулой (aC-bC)алкил, где a и b являются целыми числами. Например, (1С-4C)алкил относится к алкилу с линейной или разветвленной цепью, состоящей из 1, 2, 3 или 4 атомов углерода. Алкильная группа может быть замещенной или незамещенной.
В настоящем описании фраза "пустоты между частицами гидрогеля" относится к открытому пространству, полученному, когда, по существу, сферические частицы геля касаются окружностями при образовании сохраняющих форму агрегатов по настоящему изобретению. Объем пустот может быть расценен как 0,414 раз среднего радиуса сфер.
В настоящем описании "сшивающий агент" относится к ди-, три-, или тетра-функциональным химическим веществам, которые способны образовывать ковалентные связи с функциональными группами на цепях полимера, приводя к трехмерной структуре.
"Водородная связь" относится к электронному притяжению между атомами водорода, ковалентно связанными с высокоэлектроотрицательным атомом и другим электроотрицательным атомом, имеющим по меньшей мере одну единственную пару электронов. Сила водородной связи около 23 кДж (килоджоулей) моль-1 находится между таковой ковалентной связи, около 500 кДж моль-1, и притяжением ван дер Ваальса, около 1,3 кДж моль-1. Водородные связи имеют заметный эффект на физические характеристики композиции, способной их образовывать. Например, этанол имеет атом водорода, ковалентно связанный с атомом кислорода, который также имеет пару неразделенных (т.е. "неподеленную пару") электронов и, следовательно, этанол способен к образованию водородных связей сам с собой. Этанол имеет температуру кипения 78°C. В общем, ожидают, что соединения сходной молекулярной массы имеют сходные температуры кипения. Однако диметиловый эфир, который имеет точно такую же молекулярную массу, как этанол, но который не способен образовывать водородные связи между своими молекулами, имеет температуру кипения -24°C, почти на 100 градусов ниже, чем этанол. Образование водородных связей между молекулами этанола способствует тому, что этанол действует как будто он имеет существенно большую молекулярную массу.
В настоящем описании "заряженные" частицы геля относятся к частицам, которые имеют локализованный положительный или отрицательный заряд из-за ионного содержания мономеров, образующих цепи полимера частиц, и окружению, в котором такие частицы обнаруживают сами себя. Например, без ограничения, частицы гидрогеля, включающие акриловую кислоту в виде со-мономера, будут в щелочных условиях существовать в состоянии, в котором некоторые или все кислотные группы ионизированы, т.е. -COOH становится -COO-. Другим примером является амино (-NH2) группа, которая в кислом окружении будет образовывать ион аммония (-NH3+).
В настоящем описании "электрохимический потенциал" имеет значение, обычно понимаемое специалистом в области химии. Вкратце, когда заряженную частицу суспендируют в электролитном растворе, на поверхности частицы образуется слой противоионов (ионов заряда, противоположного частицы). Такой слой частиц сильно прилипает к поверхности частицы и называется слоем Штерна. Затем образуется второй диффузный слой ионов того же заряда как частица (и противоположный заряду противоионов, которые образуют слой Штерна, часто называемых как со-ионы) вокруг сильно абсорбированного внутреннего слоя. Прикрепленные противоионы в слое Штерна и заряженную атмосферу в диффузном слое называют "двойным слоем", толщина которого зависит от типа и концентрации ионов в растворе. Двойной слой образуется для нейтрализации заряда частицы. Это вызывает электрокинетический потенциал между поверхностью частицы и любой точкой суспендирующей жидкости. Разность потенциалов, которая составляет порядка милливольт (мВ), называется поверхностным потенциалом. Потенциал уменьшается практически линейно в слое Штерна и затем экспоненциально в диффузном слое.
Заряженная частица будет двигаться с фиксированной скоростью в поле напряжения, феномен, который называется электрофорезом. Ее подвижность пропорциональна электрическому потенциалу на границе между движущейся частицей и окружающей жидкостью. Так как слой Штерна тесно связан с частицей и диффузный слой не связан, предшествующую границу обычно определяют как границу между слоем Штерна и диффузным слоем, часто называемую плоскостью отдельности. Электрический потенциал в связи со слоем Штерна и диффузным слоем связан с подвижностью частицы. Тогда как потенциал на плоскости отдельно является промежуточным значением, простота его измерения посредством, без ограничения, электрофорезом, и его прямое взаимоотношение со стабильностью делает его идеальным характеризующим признаком диспергированных частиц в суспензии. Этот потенциал называется электрохимическим потенциалом. Электрохимический потенциал может быть положительным или отрицательным в зависимости от исходного заряда частицы. Термин "абсолютный электрохимический потенциал" относится к электрохимическому потенциалу частицы, не имеющей признаков заряда. То есть фактический электрохимический потенциал, например +20 мВ и -20 мВ, оба будут иметь абсолютный электрохимический потенциал 20.
Заряженные частицы, суспендированные в жидкости, имеют тенденцию оставаться стабильно диспергированными или слипаться в зависимости преимущественно от баланса между двумя противоположными силами, электростатическим отталкиванием, которое способствует стабильной дисперсии, и притяжением ван дер Ваальса, которое способствует слипанию частиц или "образованию хлопьев" как иногда называют, когда частицы исходно соединяются. Электрохимический потенциал диспергированных частиц связан с силой электростатического отталкивания, так большой абсолютный электрохимический потенциал способствует стабильной суспензии. Следовательно, частицы с абсолютным электрохимическим потенциалом, равным или большим чем около 30 мВ, имеют тенденцию к образованию стабильных дисперсий, так как на таком уровне электростатическое отталкивание достаточно для сохранения частиц отдельными. С другой стороны, когда абсолютное значение электрохимического потенциала составляет меньше чем около 30, тогда силы ван дер Вальса являются достаточно сильными, чтобы преодолеть электростатическое отталкивание, и частицы склонны слипаться.
Электрохимический потенциал частицы определенной композиции в определенном растворителе может регулироваться модификацией, без ограничения, pH жидкости, температуры жидкости, ионной силы жидкости, типов ионов в растворе жидкости и присутствием, если есть, типа и концентрации поверхностно-активного веществ(а) в жидкости.
В настоящем описании "вспомогательное вещество" относится к инертному веществу, добавляемому к фармацевтической композиции для облегчения ее введения. Примеры, без ограничения, вспомогательных веществ, включают карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. "Фармацевтически приемлемое вспомогательное вещество" относится к вспомогательному веществу, которое не вызывает существенного раздражения организма и не устраняет биологическую активность и свойства вводимого соединения.
В настоящем описании фраза "применимое в лечении” обозначает, что известно, что фармацевтическое средство или прямо или непрямо ингибирует, предпочтительно разрушает или дезактивирует указанный вызывающий агент заболевания или по меньшей мере облегчает, предпочтительно, устраняет, симптомы такого заболевания. В отношении рака известно, что агент по меньшей мере увеличивает среднюю продолжительность жизни пораженных пациентов.
В настоящем описании термин "рак" относится к злокачественным новообразованиям, которые, в свою очередь, относятся к большой группе заболеваний, которые могут развиться практически в любой ткани, состоящей из потенциально делящихся клеток. Основными особенностями рака является передаваемая аномалия клеток, которая проявляется сниженной регуляцией роста и функции, приводящим к серьезным угрожающим жизни эффектам в организме-хозяине посредством инвазивного роста и метастазирования.
В настоящем описании "ишемическая болезнь сердца" относится к сужению коронарных артерий, вызванному атеросклерозом, которое, при достаточной тяжести, ограничивает или в своей наиболее тяжелой форме полностью перекрывает ток крови в миокарде (сердечной мышце).
В настоящем описании "респираторное заболевание" относится к заболеванию, при котором легкие работают неправильно, так что затрудняется дыхание. Примеры респираторных заболеваний включают, без ограничения, астму, туберкулез, муковисцидоз и пневмонию. Примеры фармацевтических агентов, применимых в лечении респираторных заболеваний, включаются без ограничения.
В настоящем описании "заболевания глаз" относияся к заболеваниям, при которых глаза не функционируют соответствующим образом, так что снижается зрение. Примеры заболеваний глаз включают, без ограничения, глаукому, дегенерацию макулы, диабетическую ретинопатию и катаракту. Примеры фармацевтических агентов, применимых в лечении заболеваний глаз, включаются без ограничения.
В настоящем описании "инфекционное заболевание" относится к любому заболеванию, передаваемому микроорганизмом, таким как, без ограничения, бактерия, вирус, прион, грибы, амеба или простейшее. В общем, инфекционные заболевания являются передаваемыми по природе и могут передаваться от одного пациента к другому и способны вызывать серьезные заболевания у других пациентов. Примеры фармацевтических агентов, применимых в лечении инфекционных заболеваний, включаются без ограничения.
Сохраняющие форму агрегаты по настоящему изобретению могут быть созданы с использованием настоящего описания так, чтобы они могли поглощать и/или улавливать по существу любое фармацевтическое средство, известное в настоящее время, или которые могут стать известными специалисту в области техники как эффективные в лечении и/или профилактике любого из вышеуказанных заболеваний, и все эти фармацевтические средства находятся в рамках настоящего изобретения.
В настоящем описании термин "около" обозначает ± 15% значения, модифицированного термином.
В настоящем описании термин "ex vivo" относится к любому процессу или процедуре, проводимой вне живого организма, например, без ограничения, в чашке Петри, в почве, в поверхностной воде, в жидкой органической среде и подобное.
В настоящем описании термин "in vivo" относится к любому процессу или процедуре, проводимым(ой) в живом организме, которым может быть растение или животное, в частности человек.
В настоящем описании термин "гидрофильные/гидрофобные взаимодействия" относится к между- или внутримолекулярным связям химических веществ посредством физических сил, посредством которых гидрофильные соединения или гидрофильные участки соединений стремятся соединиться с другими гидрофильными соединениями или гидрофильными участками соединений, и гидрофобные соединения или гидрофобные участки соединений, которые стремятся соединиться с другими гидрофобными соединениями или гидрофобными участками соединений.
В настоящем описании "воронка" имеет значение, обычно понимаемое специалистом в области техники, то есть отверстие, в частности в отношении настоящего изобретения отверстие, посредством которого суспензионная система по настоящему изобретению может быть пропущена для регуляции ее скорости внесения в другую среду.
В настоящем описании термин "размер" имеет общепринятое значение для специалиста в области медицинской техники; то есть он относится к наружному диаметру полой иглы, где наружный диаметр непосредственно связан с диаметром просвета иглы. Чем больше размер, т.е. чем больше число, например, "размер 38," тем меньше наружный диаметр иглы и, следовательно, меньше просвет.
В настоящем описании термин "поглощает" имеет значение, обычно понимаемое специалистом в области химии, то есть абсорбировать и удерживать вещество в течение некоторого периода времени. В отношении настоящего изобретения, вещества могут быть абсорбированы и удерживаются частицами геля по настоящему изобретению во время их образования.
В настоящем описании термин "уловленный" относится к удержанию в течение некоторого периода времени вещества в пустотах между частицами геля, составляющими сохраняющие форму агрегаты по настоящему изобретению.
В настоящем описании термин "средняя молекулярная масса" относится к массе отдельных цепей полимера или сшитых цепей полимера по настоящему изобретению. Для целей настоящего изобретения среднюю молекулярную массу определяют гель-проникающей хроматографией с определением рассеяния лазерного излучения.
В настоящем описании "факторы роста" относятся к определенным полипептидам, которые при связывании с рецепторами факторов роста на поверхности клеток стимулируют рост и деление клеток. Рецепторы факторов роста специфичны для каждого фактора роста, так что только клетки, которые экспрессируют определенный рецептор для определенного фактора роста, будут стимулироваться этим фактором роста. Примеры факторов роста включают, без ограничения, сосудистый эндотелиальный фактор роста (VEGF), инсулиноподобный фактор роста (IGF), фактор роста фибробластов (FGF), эпидермальный фактор роста (EGF), фактор роста гепатоцитов (HGF) и фактор роста тромбоцитов (PDGF).
В настоящем описании "поддержка тканей" относится к высокопористой искусственной трехмерной внеклеточной матрице, которую используют in vivo в качестве сетки, к которой могут прикрепиться клетки и расти для регенерации тканей, потерянных вследствие повреждения или заболевания.
В настоящем описании "косметическое усиление ткани" относится к любому восстановлению или усилению органов тела, таких как, без ограничения, восстановление или увеличение груди, увеличение губ, устранение морщин, восстановление тканей лица и др.
Обсуждение
Сохраняющие форму агрегаты по настоящему изобретению образуются получением суспензионной системы, включающей отдельные частицы геля, растворенные в жидкости или смеси смешиваемых жидкостей, где частицы имеют абсолютный электрохимический потенциал, и затем введением суспензионной системы в получающую среду, в которой абсолютный электрохимический потенциал частиц уменьшается до точки, в которой дисперсия частиц в суспензии дестабилизируется и частицы слипаются в агрегаты частиц. Для достижения уменьшения электрохимического потенциала до точки, когда возникает агрегация, получающая среда может иметь отличную ионную силу или отличный уровень рН от суспензионной системы, и/или она может разбавлять эффект поверхностно-активного вещества, добавленного к суспензионной системе, чтобы способствовать стабилизации суспензии. Тогда как изменение электрохимического потенциала приводит к начальному слиянию частиц геля по настоящему изобретению, эти их уникальные физические и химические характеристики способствуют их удержанию вместе в сохраняющем форму агрегате. Так что частицы по настоящему изобретению, при слиянии, удерживаются вместе сильными взаимодействиями между частицами и частицами и жидкостью, такими как, без ограничения, гидрофобные-гидрофильные взаимодействия и водородные связи, последние посредством того, что по меньшей мере один из мономеров, которые используются для создания цепей полимера, которые составляют частицы геля по настоящему изобретению, должен включать одну или более гидроксигрупп и/или одну или более эфирных групп, и, по меньшей мере, одна из жидкости(ей), используемых в суспензионной системе, должна включать по меньшей мере одну гидроксигруппу.
Химический состав полимеров, составляющих отдельные частицы геля, можно обработать так, чтобы полученные агрегаты были стабильными и не разрушались легко в широком спектре окружения или физиологических состояний. С другой стороны, химический состав частиц или химическое окружение агрегатов может быть таким, что частицы или агрегат или оба будут разлагаться в выбранных условиях предсказуемым и регулируемым образом. Например, без ограничения, с выбором соответствующего состава частиц геля, могут быть получены агрегаты, которые разлагаются при определенной температуре, рН, ионной силе, электрическом токе и подобном. Или добавки могут быть захвачены в матрицу агрегата при его образовании так, что полученные агрегаты будут разлагаться при изменении структуры, состава и/или реакционной способности добавки при воздействии различных условий окружения и/или физиологических условий.
Частицы геля получают в полимеризующей системе, которая состоит из одного или более мономеров, выбираемых обычно из мономеров, которые при полимеризации обеспечивают полимер, которые способен образовывать водородные связи. Обычные классы мономеров, которые обладают такой способностью, включают, без ограничения, гидроксиалкил 2-алкеноаты, такие как гидрокси(2C-4C)алкилметакрилаты и гидрокси(2C-4C)алкилакрилаты; гидрокси((2C-4C)алкокси(2C-4C)алкил)алкеноаты, такие как 2-гидроксиэтоксиэтилакрилат и метакрилат; (1С-4C)алкокси(1С-4C)алкилметакрилаты, например этоксиэтилметакрилат; 2-алкеновые кислоты, такие как акриловая и метакриловая кислота; (1С-4C)алкокси(2C-4C)алкокси(2C-4C)алкил)алкеноаты, такие как этоксиэтоксиэтилакрилат и метакрилат; N-винилпирролидоны, такие как N-моно- и ди-(1С-4C)алкилвинилпирролидоны; 2-алкенамиды, такие как N-(1C-4C) алкил-2-алкенамиды и N,N-ди(1C-4C)алкил-2-алкенамиды, например N-(1C-4C)алкилакриламиды, N-(1C-4C)алкилметакриламиды, N,N-ди(1C-4C)алкилакриламиды и N,N-ди(1C-4C)алкилметакриламиды; диалкиламиноалкил 2-алкеноаты, например диэтиламиноэтилакрилат и метакрилат; винилпиридины; вицинал-эпоксиалкил 2-алкеноаты, такие как вицинал-эпокси(1С-4C)алкил)метакрилаты и вицинал-эпокси(1С-4C)алкилакрилаты, и их комбинации.
Предпочтительные в настоящее время мономеры включают 2-гидроксиэтилакрилат, 2-гидроксиэтилметакрилат, моноакрилат диэтиленгликоля, монометакрилат диэтиленгликоля, 2-гидропропилакрилат, 2-гидроксипропилметакрилат, 3-гидроксипропилакрилат, 3-гидроксипропилметакрилат, монометакрилат дипропиленгликоля, моноакрилат дипропиленгликоля, метакрилат глицидила, 2,3-дигидроксипропилметакрилат, N,N-диметиламиноэтилметакрилат N,N-диметиламиноэтилакрилат, и их смеси. Особенно предпочтительным в настоящее время мономером является 2-гидроксиэтилметакрилат (НЕМА).
Сомономеры, которые не способны образовывать водородные связи, могут быть добавлены к полимеризующей системе для модификации физических и химических характеристик полученных частиц геля. Примерами сомономеров, которые могут быть использованы в сочетании с вышеуказанными мономерами, являются, без ограничения, акриламид, N-метилметакриламид, N,N-диметакриламид, метилвинилпирролидон, N,N-диметиламиноэтилметакрилат, N,N-диметиламиноэтилакрилат, акриловая кислота и метакриловая кислота.
Кроме того, неполимеризующие добавки, такие как, без ограничения, алкилалканоаты, что проиллюстрировано метилбутиратом, бутилацетатом и др., могут быть добавлены к полимеризующей реакционной смеси для дальнейшей модификации физических и химических характеристик полученных частиц геля. Сшивающий агент также может быть добавлен к полимеризующей системе для усиления трехмерной структуры оставшихся частиц геля. Сшивающий агент может быть неразлагаемым, таким как, без ограничения, диакрилат или диметакрилат этиленгликоля, 1,4-бутилендиметакрилат, диметакрилат диэтиленгликоля, диметакрилат пропиленгликоля, диметакрилат диэтиленгликоля, диметакрилат дипропиленгликоля, диакрилат диэтиленгликоля, диакрилат дипропиленгликоля, дивинилбензол, дивинилтолуол, триаллилмеламин, N,N'-метиленбисакриламид, диаллилмалеат, дивиниловый эфир, цитрат диаллилмоноэтиленгликоля, винилаллилцитрат, аллилвинилмалеат, дивинилсульфон, гексагидро-1,3,5-триаллилтриазин, триаллилфосфит, диаллилбензолфосфонат, полиэфир малеинового ангидрида с триэтиленгликолем, диаллилаконитрат, дивинилцитраконат, триметилопропантриметакрилат и диаллилфумарат. Другие неразлагаемые сшивающие агенты станут очевидны специалисту в области техники на основании настоящего описания и находятся в рамках настоящего изобретения.
С другой стороны, может быть выбран сшивающий агент, который разлагается в выбранных условиях, таким образом обеспечивая средства получения разлагаемых частиц геля; так что при разложении сшивающего агента стабильность цепей полимера, создающих матрицу геля, нарушается до точки, в которой частицы просто рассыпаются. Примеры разлагаемых сшивающих агентов включают, без ограничения, диаллилтартрат, аллилпируват, аллилмалеат, дивинилтартрат, диаллилитаконат и диэфир этиленгликоля и итаконовой кислоты.
Предпочтительные в настоящее время разлагаемые сшивающие агенты представлены в совместно поданной Патентной Заявке США №09/338404, которая включена в виде ссылки, включая любые чертежи. Такие сшивающие агенты представляют собой мономеры или олигомеры, состоящие из молекулы, имеющей, по меньшей мере, две карбоксильные группы и, по меньшей мере, две сшивающие функциональные группы. Между по меньшей мере одной из сшивающих функциональных групп и одной из карбоксильных групп находится биоразлагаемая последовательность поли(сложный эфир гидроксиалкильной кислоты) из 1-6 повторов.
В другом варианте осуществления настоящего изобретения, скорее не при получении частиц геля по настоящему изобретению ab initio, то есть полимеризацией мономера(ов) в соответствующих условиях, сохраняющие форму агрегаты могут быть получены из блочных полимеров. Блочные полимеры могут быть коммерческими полимерами или они могут быть получены обычными методиками полимеризации, такими как, без ограничения, полимеризацией в растворе, суспензии и воде. В последнем случае затем полимер может быть обработан для удаления остатка мономера и любых других нежелательных веществ перед сушкой. Полученный или коммерческий сухой, хрупкий полимер затем разрушают измельчением, микропульверизацией и подобными, и фрагменты просеивают с использованием методик, известных в области техники для разделения частиц различного размера. Частицы желаемого диапазона размеров перемешивают в выбранной жидкости или комбинации жидкостей с или без добавления поверхностно-активного вещества до того, как они не абсорбируют столько жидкости, сколько могут, то есть они достигнут сырого веса. Затем частицы готовы для внесения в получающую среду для получения сохраняющего форму агрегата по настоящему изобретению.
Предпочтительной в настоящее время жидкостью для применения и в полимеризующей системе и в суспензионной системе по настоящему изобретению является вода, в таком случае частицы являются частицами гидрогеля.
Определенные органические жидкости также могут быть использованы в способах по настоящему изобретению. В общем, предпочтительно, чтобы они имели температуру кипения выше около 60°C, предпочтительно выше около 200°C. Применение таких жидкостей приводит к образованию сложных крепких агрегатов. Органические жидкости, которые являются предпочтительными в получении агрегатов по настоящему изобретению, представляют собой смешиваемые с водой полимеры оксиалкилена, например полиалкиленгликоли, особенно характеризующиеся множеством единиц оксиэтилена (-OCH2CH2-) в молекуле и температурой кипения около 200°C.
Предпочтительные в настоящее время органические жидкости, которые могут быть использованы в способах по настоящему изобретению, являются биологически инертными, нетоксичными, полярными, смешиваемыми с водой органическими жидкостями, такими как, без ограничения, этиленгликоль, пропиленгликоль, дипропиленгликоль, бутандиол-1,3, бутандиол-1,4, гександиол-2,5, 2-метил-2,4-пентандиол, гептандиол-2,4, 2-этил-1,3-гександиол, диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоли, и высшие полиэтиленгликоли и другие водорастворимые гомополимеры и сополимеры оксиалкилена, имеющие молекулярную массу до около 2000, предпочтительно до около 1600. Например, без ограничения, полимеры этиленоксида с концевыми гидроксигруппами, имеющие среднюю молекулярную массу 200-1000, водорастворимые полимеры оксиэтиленоксипропиленполиола (особенно гликоля), имеющие молекулярную массу до около 1500, предпочтительно до около 1000, моноэтиловый эфир пропиленгликоля, моноацетин, глицерин, три(гидроксиэтил)цитрат, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, ди(гидроксипропил)оксалат, гидроксипропилацетат, глицерилтриацетат, глицерилтрибутират, жидкие аддукты этиленоксида сорбита, жидкие аддукты этиленоксида глицерина, монометиловый эфир диэтиленгликоля, моноэтиловый эфир диэтиленгликоля и диацетат этиленгликоля, могут быть использованы.
В варианте осуществления настоящего изобретения, частицы гидрогеля, имеющие номинальный размер в диапазоне от 10-9 м до 10-6 м, получают окислением-восстановлением, свободно-радикальной или фото-индуцированной полимеризацией в воде, содержащей поверхностно-активное вещество. Таким образом могут быть получены частицы относительно узкой полидисперсности. Если для определенного применения, такого как, без ограничения, желательно высвобождение биологически активного вещества в течение длительного периода времени, могут быть образованы частицы широкой полидисперсности.
Если, с другой стороны, задачей является последовательное высвобождение лекарственного средства или пик высвобождения в различные моменты времени, а не непрерывное высвобождение, могут быть использованы две или более групп частиц различных размеров, но с узкой полидисперсностью для каждого размера. Например, без ограничения, частицы геля различного размера, но узкой полидисперсности могут быть получены с использованием методик, описанных в настоящем описании, в отдельных полимеризующих системах, которые содержат определенное биологически активное вещество. Затем частицы, содержащие вещество, могут быть скомбинированы в одну суспензионную систему. Из-за различий в размере частиц биологически активное вещество будет высвобождаться с пиками в различные моменты времени. Применение такой же методики, но с добавлением первого биологически активного вещества к одной из полимеризующих систем и другого биологически активного вещества ко второй полимеризующей системе приведет к суспензионной системе, которая содержит частицы, которые будут высвобождать их определенное активное вещество в различные моменты времени, т.е. последовательному высвобождению.
Перед введением суспензионной системы в получающую среду желательно обработать суспензионную систему, чтобы удалить непрореагировавший мономер(ы), поверхностно-активное вещество и не захваченное биологически активное вещество из жидкости суспензионной системы и/или удалить непрореагировавший мономер(ы) и поверхностно-активное вещество из воды, поглощенной частицами. Методики, такие как, без ограничения, диализ, экстракция или проточная фильтрация вдоль потока, могут быть использованы для очистки частиц и суспензионной системы. Затем суспензионная система может быть концентрирована, если требуется, перед образованием агрегата. В настоящее время предпочтительно, чтобы концентрация частиц в суспензионной системе, готовой для внесения в получающую систему, была в диапазоне от около 1 до около 500 мг/мл, более предпочтительно от около 25 до 150 мг/мл. Вместо удаления поверхностно-активного вещества из суспензионной системы возможна замена его на фармацевтически приемлемое вещество, которое используется во время полимеризации и образования исходной суспензионной системы.
Суспензию очищенных частиц, содержащих биологически активное вещество(а), затем вносят в среду, в которой абсолютный электрохимический потенциал частиц уменьшается в результате того, что частицы сливаются с образованием сохраняющего форму агрегата по настоящему изобретению, форма агрегата соответствует форме локализации, где обнаружена среда, в которую вносят суспензионную систему.
В общем, для применений in vivo, таких как доставка лекарственных средств, куда вносят суспензионную систему, в которой они находятся, будет ткань тела, которая включает жидкость организма, например, без исключения, плазму, внеклеточную, внесосудистую, дентин, интерстициальную, внутриглазную, межклеточную и синовиальную жидкость, кровь, сыворотку и подобные. Тогда как возможно измерить электрохимический потенциал частиц, предназначенных для определенного применения в характерном образце жидкости организма из места такого применения, чтобы быть уверенным, что частицы объединятся в сохраняющий форму агломерат, такое обычно не является необходимым. То есть суспензионную систему по настоящему изобретению обычно получают стабильной в определенных условиях хранения, но при воздействии физиологических условий ионной силы, pH и подобного возникает снижение электрохимического потенциала и последующее слияние и агрегация.
Многочисленные факторы влияют на химические и физические характеристики агрегатов по настоящему изобретению. Одним является молекулярная масса полимера, используемого для получения отдельных частиц гидрогеля. Было обнаружено, что частицы гидрогеля, состоящие из низкомолекулярных полимеров, обычно не образуют стабильные крепкие агрегаты. Следовательно, полимеры с более высокой молекулярной массой являются в настоящее время предпочтительными. Тогда как применение сшивающих веществ может облегчить некоторые проблемы, связанные с низкомолекулярными полимерами, слишком большое количество сшивающего вещества может быть вредным. Если частицы гидрогеля содержат большое количество сшивающего вещества и/или сшивающий агент является высокогидрофобным, полученная полимерная сеть может не допускать оптимального поглощения жидкости, приводя к менее желательным агрегатам. В настоящее время предпочтительно, чтобы полимеры, которые составляют частицы геля по настоящему изобретению, имели молекулярную массу в диапазоне от около 3000 до около 2000000 Да. Это может быть достигнуто выбором соответствующего коммерческого полимера, использованием полимеризующей системы, которая дает полимеры желаемого диапазона молекулярной массы или включением сшивающего вещества в полимеризующую систему для объединения коротких цепей полимера для достижения желаемого диапазона молекулярной массы.
Размер частиц также влияет на характеристики агрегатов. Определили, что более мелкие частицы геля обычно легче поглощают жидкость и дают более эластичную матрицу. Частицы геля, имеющие размеры, что определяется по их среднему диаметру, в диапазоне от около 10 до около 75000 нм, более предпочтительно от около 10 до около 800 нм, являются в настоящее время предпочтительными.
Если используется сшивающее вещество, его химический состав и используемое количество, т.е. полученная плотность сшивки, будут влиять на характеристики частиц, как обсуждалось ранее, и таким образом будут влиять на характеристики образующихся агрегатов. Количество сшивающего вещества, используемого при получении частиц геля по настоящему изобретению, составляет предпочтительно в диапазоне от около 0,001 до около 10, предпочтительно от около 0,1 до около 2 моль процентов мономера.
Молекулярная масса и химический состав используемых жидкостей суспензии также будут влиять на полученные агрегаты, так как некоторое количество жидкости поглощается частицами и некоторое количество улавливает агрегат. Например, как отмечено ранее, вода является предпочтительной в настоящее время жидкостью и для полимеризующей системы и для суспензионной системы. Если 5% глицерина или 20% полиэтиленгликоля добавляют к воде, скорость высвобождения заключенных или захваченных FITC-BSA и FITC-Dex существенно изменяется, как показано в Примерах ниже.
Концентрация частиц геля в суспензионной системе будет влиять на характеристики полученного агрегата, преимущественно за счет факта, что при более высокой концентрации частицы геля стремятся слиться в сгустки частиц, которые затем объединяются в сохраняющие форму агрегаты. Как отмечено выше, предпочтительная в настоящее время концентрация частиц геля в суспензионной системе составляет от около 1 до около 500, более предпочтительно от 25 до 150 мг/мл.
Химический состав и количество используемого поверхностно-активного вещества будут влиять на физические и химические характеристики агрегатов по настоящему изобретению. Например, фиг. 8 показывает эффект выбора поверхностно-активного вещества на скорость агрегации, которая в свою очередь будет влиять на включение рабочего вещества в агрегаты и последующую величину пика высвобождения заключенного вещества.
Размер воронки и скорость внесения через нее суспензионной системы в получающую систему также будет влиять на физические характеристики полученного агрегата. В общем, использование медленной скорости внесения и большого отверстия приведет к немедленному образованию плотного гибкого агрегата с небольшим связанным образованием сгустков. Предпочтительными в настоящее время средствами внесения суспензионной системы в получающую среду является использование полой иглы размера от 10 до 30, предпочтительно размера от 15 до 27, в качестве отверстия и внесение суспензионной системы в получающую среду со скоростью от около 0,05 до около 15 мл/мин, более предпочтительно в настоящее время от около 0,25 до около 10 мл/мин.
Различные параметры, обсуждаемые выше, являются, конечно, взаимозависимыми. Например, без ограничения, физические характеристики агрегата непосредственно пропорциональны концентрации частиц гидрогеля в суспензии при заданной скорости внесения и размере отверстия. Частицы гидрогеля в более высокой концентрации дают плотный, немедленно образующийся агрегат при внесении в среду для агрегации по сравнению с более низкой концентрацией частиц гидрогеля в суспензии, которые дают более диффузный агрегат с ассоциированными сгустками. Однако слишком высокая концентрация может уменьшать производительность, так как частицы могут перестать быть однородно суспендированными. Также, поддержание концентрации и размера частиц гидрогеля в суспензионной системе, степени скорости внесения и размера отверстия постоянными, типа и количества используемого поверхностно-активного вещества влияют на время агрегации и качество полученного агрегата.
В предпочтительном в настоящее время варианте осуществления настоящего изобретения, частицы гидрогеля получают полимеризацией неионных мономеров в воде, содержащей поверхностно-активное вещество. Суспензию частиц гидрогеля обрабатывают для удаления непрореагировавшего мономера и других загрязнений. Затем образовываются агрегаты путем введения суспензии в получающую среду более высокой ионной силы, например PBS, сыворотки или другой жидкости организма, так что абсолютный электрохимический потенциал частиц снижается, и частицы самостоятельно организуются в компактный сохраняющий форму агрегат. Если среда находится в in vivo, тогда, если это жидкость организма, сохраняющий форму агрегат приобретает и сохраняет форму участка организма, в который его вводят. Если получающая среда находится ex vivo, он может быть, без ограничения, далее прессован, экструдирован или отлит в желаемую форму, которую он будет удерживать так долго, сколько агрегат поддерживается в гидратированном состоянии.
В другом варианте осуществления настоящего изобретения, мономеры, имеющие различную степень ионной характеристики, со-полимеризуют с неионными мономерами для получения частиц гидрогеля, которые затем сливаются к агрегатам, как указано выше. Такие агрегаты будут разлагаться в соответствующих условиях окружения, желаемая характеристика для определенных применений, таких как системы доставки лекарственных средств in vivo, которые разлагаются и выводятся через почки. Так что ионная характеристика отдельных частиц гидрогеля делает их чувствительными к разложению в зависимости от pH, температуры, ионной силы, электрического тока и др. их непосредственного окружения. Распад отдельных частиц приводит к разложению или по меньшей мере потере структурной целостности агрегатов.
Распад отдельных частиц геля и, следовательно, распад агрегата также может быть осуществлен с использованием разлагаемых сшивающих веществ в формировании частиц геля. Полученный агрегат разлагается на части в условиях окружающей среды, которые вызывают разложение сшивающего вещества. Могут быть получены сшивающие вещества, которые разлагаются в выбранных условиях без ограничения pH, температуры, ионной силы, электрического тока, электромагнитного излучения, радиации и в жидкостях организма.
Агрегаты по настоящему изобретению имеют множество применений, включая, без ограничения, доставку биологически активного вещества или веществ в заранее определенное место. Применение может быть сельскохозяйственным, таким как, без ограничения, доставка фунгицида, инсектицида или гербицида к коммерческой сельскохозяйственной культуре, например кукурузе, хлопку, сое, пшенице и др. Или целью может быть среда роста, например почва, в которой растет культура, и может включать доставку питательных веществ и подобных. Целью могут быть загрязнители окружающей среды в почве, такие загрязнители могут регулируемо разлагаться с использованием агрегатов по настоящему изобретению. Цель может быть ветеринарной, включая доставку лекарственных препаратов животным, таким как рептилии, млекопитающие и птицы. В частности, целью может быть человек, включающий регулируемую непосредственную доставку фармацевтического агента пациенту.
В варианте осуществления настоящего изобретения, биологически активное вещество растворяют или супендируют в водной суспензии гидратированных частиц гидрогеля, которые затем вводят в получающую среду более высокой ионной силы для уменьшения электрохимического потенциала и создания агрегата. Тогда как водорастворимое вещество является предпочтительным в настоящее время для обеспечения гомогенности порции жидкости перед введением, такое не является обязательным. Добавки, такие как поверхностно-активные вещества, могут быть добавлены, чтобы сделать суспензию биологически активного вещества с ограниченной растворимостью, относительно однородной. Когда суспензию вводят в получающую среду и образуется агрегат, биологически активное вещество улавливается жидкостью, которая заполняет пустоты между частицами агрегата. При получении ex vivo полученный гибкий сохраняющий форму агрегат может быть промыт для удаления любого биологически активного вещества, свободно приклеившегося к его поверхности. Затем агрегат может быть дополнительно формован для предназначенного применения, при желании. Например, без ограничения, если предусмотренным применением является лечение инфекции, агрегат может быть формован, чтобы подходил непосредственно к ране и высвобождал в ней антибиотик. Подобно, если применением является доставка химиотерапевтического средства, такого как, без ограничения, паклитаксел или цисплатин, к целевому органу пациента с раком, агрегат может быть формован, чтобы облегчить имплантацию в пораженный участок.
Если агрегат получают in vivo, определенное количество биологически активного вещества будет уловлено в зависимости от его типа и размера и скорости образования агрегата. Скорость образования агрегата является функцией размера и концентрации частиц в суспензионной системе, абсолютного электрохимического потенциала частиц в суспензионной системе и после внесения в получающую среду, типа и количества поверхностно-активного вещества или комбинации используемых поверхностно-активных веществ, получающей среды, температуры получающей системы, скорости введения суспензионной системы в получающую среду и размера отверстия устройства, через которое суспензионную систему вводят в получающую среду.
Если применением in vivo является доставка фармацевтического средства человеку или животному, предпочтительным в настоящее время способом введения суспензионной системы в получающую среду, то есть ткань организма, включающую жидкость организма, является инъекция с использованием подкожной иглы. Размер отверстия иглы может варьироваться и связан со скоростью инъекции. Предпочтительный в настоящее время размер иглы составляет от 10 до 30, более предпочтительно от 15 до 27, и скорость инъекции составляет от около 0,05 до около 15 миллилитров (мл)/минуту (мин), более предпочтительно от около 0,25 до около 10 мл/мин.
Вышеуказанная методика приводит к образованию сохраняющего форму агрегата в месте введения, сохраняющий форму агрегат улавливает фармацевтическое средство при образовании и затем высвобождает его с течением времени в зависимости от свойств агрегата и активного соединения.
Другой вариант осуществления настоящего изобретения включает растворение или суспендирование биологически активного вещества в полимеризующей системе перед полимеризацией. При протекании реакции полимеризации и образовании частиц гидрогеля жидкость, содержащая биологически активное вещество, поглощается образующимися частицами. Непоглощенное биологически активное вещество затем удаляют при обработке частиц для удаления избытка мономера и поверхностно-активного вещества. Затем суспензия частиц, содержащих биологически активное вещество, может быть введена или ex vivo или in vivo, в последнем случае введением предпочтительно является инъекция в получающую среду, после чего частицы слипаются в сохраняющий форму агрегат.
Комбинация вышеуказанных подходов представляет собой вариант осуществления настоящего изобретения. Так что, скорее чем удаление биологически активного вещества с избытком мономера и поверхностно-активного вещества перед введением в получающую среду, биологически активное вещество может быть оставлено в суспензионной жидкости или снова введено в суспензионную систему, тогда как мономер и поверхностно-активное вещество удалены, так что, при введении в получающую среду дополнительное активное вещество будет улавливаться в пустоты между частицами, образующими сохраняющий форму агрегат.
Также вариантом осуществления настоящего изобретения является удаление непоглощенного биологически активного вещества из суспензионной системы вместе с избытком мономера и с поверхностно-активным веществом и затем добавление полностью отличного биологически активного вещества к суспензионной среде перед образованием агрегата так, чтобы уловить последний во время образования агрегата. Вещество, уловленное в пустоты в агрегате, будет в норме высвобождаться со скоростью, отличной от вещества, поглощенного частицами. Таким образом может быть достигнут широкий диапазон скорости доставки. Многообразие профилей доставки также может быть достигнуто путем варьирования химического состава отдельных частиц гидрогеля агрегата.
Если не включают химических модификаций, индуцирующих разложение на отдельные частицы геля, и не включают добавки, активируемые окружающей средой, образующийся агрегат будет по существу невосприимчивым к нормальным условиям окружающей среды. Такой тип агрегата обычно проявляет скорость высвобождения, подобную монолитным матричным устройствам, то есть за исходным выбросом средства следует экспоненциальное падение со временем. Однако, если частицы геля созданы так, что они разлагаются в условиях окружающей среды, с которыми сталкиваются в месте доставки, и если биологически активное вещество будет высвобождаться из агрегата только после разложения частиц, возможен очень тонкий контроль скорости доставки. Высвобождение активного вещества только при разложении частиц геля может быть достигнуто с использованием частиц размера, который даст агрегаты, имеющие поры, слишком маленькие для перемещения уловленного активного вещества, когда агрегат интактен. Подобным образом отдельные частицы могут быть получены так, что активное вещество, поглощенное ими, не может выйти, если только частицы не разлагаются.
В добавление к вышеуказанному, другие водорастворимые вещества могут быть добавлены к суспензии частиц гидрогеля по настоящему изобретению для изменения скорости агрегации и разложения сохраняющего форму агрегата, образующегося при введении в получающую среду и, следовательно, количество и последующая скорость высвобождения активного вещества могут быть еще более регулируемыми. Частицы, содержащие катионные и/или анионные заряды, могут быть смешаны с неионными частицами гидрогеля для получения регулируемого разложения агрегата во множестве условий, включая ионный тип окружения или существование внешнего электрического заряда. Включение заряженных видов также может увеличивать эффективность агрегации из-за взаимодействий электрических зарядов.
С использованием одной или более из вышеуказанных методик, нулевая или по меньшей мере псевдонулевая скорость высвобождения должна быть достижима для широкого диапазона биологически активных веществ.
Тип и количество вещества, которое может быть поглощено частицами геля или уловлено сохраняющим форму агрегатом по настоящему изобретению, зависит от множества факторов. Во-первых и в главных, вещество не может мешать из-за его размера, поверхностного заряда, полярности, стерических взаимодействий и др. образованию отдельных частиц геля или слиянию частиц геля в сохраняющий форму агрегат после введения в получающую среду, каждое из которых может повредить целям настоящего изобретения. Так как определено, что вышеуказанное не является проблемой, размер частиц гидрогеля наиболее прямо влияет на количество вещества, которое может быть включено. Размер частиц как таковых будет определять максимальное количество вещества, которое может быть поглощено, тогда как полидисперсность частиц в суспензионном растворе будет влиять на размер пор агрегата. Относительно небольшие вещества, такие как отдельные молекулы антибиотика, могут быть уловлены агрегатами, образованными из небольших частиц геля, тогда как существенно более крупные вещества, такие как моноклональные антитела, белки, пептиды и другие макромолекулы потребуют агрегатов, полученных из более крупных частиц.
С использованием способов в настоящем описании, может быть достигнута четкая регуляция кинетики доставки. То есть частицы геля различных размеров и химического состава могут быть нагружены определенным веществом, и в зависимости от характеристик различных частиц вещество может высвобождаться в течение фактически любого желаемого промежутка времени. Кроме того, некоторые вещества могут быть поглощены частицами геля, и некоторые могут быть уловлены в пустоты между частицами сохраняющего форму агрегата для получения еще большей гибкости доставки.
С использованием вышеуказанных способов различные вещества, даже обычно несовместимые вещества, могут быть нагружены в частицы геля по настоящему изобретению и высвобождаться последовательно или одновременно. Последовательное высвобождение предотвратит столкновение друг с другом несовместимых веществ. Одновременное высвобождение позволит доставлять два или более неактивных или минимально биоактивных веществ, которые при комбинации образуют сильное лекарственное средство. Таким образом, образование активных видов может быть отложено до того, как агрегат, содержащий предшественники, образуется в месте предназначенной активности лекарственного средства, таким образом минимизируя побочные эффекты.
В другом аспекте настоящего изобретения, частицы геля двух или более различных размеров и узкой полидисперсности в отношении каждого отличного используют в концентрации с суспензионной системой около 400 мг сырого веса/мл для получения сохраняющих форму агрегатов по настоящему изобретению. Эффективность захвата веществ и их последующая скорость высвобождения по существу отличаются от таковых агрегатов, образованных с использованием частиц узкой полидисперсности отдельного размера. Без связи с какой-либо определенной теорией считают, что при концентрации дисперсии частиц геля от около 300 до около 500 мг сырого веса/мл, предпочтительно от около 400 до около 500 мг сырого веса/мл, частицы стремятся сблизиться друг с другом достаточно, чтобы силы, обеспечивающие слияние, преодолели силы, обеспечивающие дисперсию. Сгустки частиц образуют вторичную структуру, которая является все еще относительно стабильной суспензией. Когда первую суспензионную систему, включающую вторичную структуру сгустков частиц первого размера, смешивают с другой суспензионной системой вторичной структуры, образованной из частиц другого размера, и смесь вносят в получающую среду, образуется сложный и комплексный сохраняющий форму агрегат. Образованный таким образом сохраняющий форму агрегат, вероятно, способен захватывать вещества более эффективно, чем агрегаты, полученные из частиц геля одного размера. Без связи с какой-либо определенной теорией считают, что это может быть из-за возможности, что во время агрегации в присутствии вещества, которое должно захватиться, пустоты между частицами, составляющими агрегат, более эффективно заполняются частицами смешанной полидисперсности, предотвращая преждевременное вытекание. Следующие примеры демонстрируют, что для специфического вещества заданного размера размер и соотношение размеров частиц, составляющих агрегат, существенно влияют на эффективность образующегося агрегата в захвате вещества и его последующей скорости высвобождения. С использованием такого подхода скорость высвобождения определенного вещества может быть приспособлена к подходу, кинетики псевдонулевого порядка с использованием соответствующих размеров частиц и соотношения размеров.
Следовательно, настоящее изобретение обеспечивает существенно гибкую систему доставки веществ, в частности, в отношении доставки биологически активных веществ и наиболее часто в отношении доставки фармацевтических средств. Фармацевтическое средство или комбинация средств могут быть доставлены непрерывно в течение продолжительного периода времени, с пиками в установленные интервалы времени, одновременно после предварительно определенного времени задержки так, чтобы два или более вещества могли взаимодействовать синергично только после помещения агрегата, содержащего их, в желаемое целевое место, или последовательно, так, чтобы один агент мог действовать в целевом месте до высвобождения следующего агента или так, чтобы два или более агентов могли синергически взаимодействовать.
Другим вариантом осуществления настоящего изобретения является применение сохраняющих форму агрегатов по настоящему изобретению в ортопедических применениях, таких как поддержка тканей. Макропористая структура сохраняющих форму агрегатов по настоящему изобретению обеспечивает композицию, которая позволит реальное врастание, свойство, не обнаруженное у типичных микропористых рыхлых гидрогелей. Кроме того, агрегаты по настоящему изобретению проявляют физические свойства, такие как модули эластичности, сдвига и рыхлости, которые существенно улучшены по сравнению с таковыми обычных рыхлых гидрогелей и которые в некоторых случаях дают свойства искусственного хряща. Способность агрегатов литься и слоиться по настоящему изобретению может быть использована для оптимизации высвобождения факторов роста в специфических локализациях при поддержке тканей. Возможное ортопедическое применение способов по настоящему изобретению включает, без ограничения, восстановление хряща и кости, восстановление/замену мениска, искусственные позвоночные диски, искусственные сухожилия и связки и заполнители дефектов кости.
Свойство сохранения формы агрегатов по настоящему изобретению и их способность образовываться в и удерживать воду предполагают множество других применений in vivo. Например, пропитанный или непропитанный лекарственными средствами агрегат может быть отлит в мягкую контактную линзу. Мягкое, гибкое, биосовместимое устройство для доставки лекарственных средств для лечения тяжелых заболеваний глаз может быть образовано введением суспензионной системы частиц гидрогеля, в которых захвачено глазное фармацевтическое средство, за глаз. Повязки на рану или повязки на донорские участки кожи с или без включенных антибиотиков или других лекарственных средств могут быть получены ex vivo или созданы in vivo непосредственно инъекцией в или на рану с использованием сохраняющего форму агрегата и способов по настоящему изобретению. Сохраняющий форму агрегат может быть образован в периодонтальном мешке инъекцией суспензионной системы частиц гидрогеля, в которых фактор роста кости поглощен в частицы или уловлен образующимся агрегатом. Также агрегат может иметь включенный или захваченный антибиотик для регуляции инфекции продолжительной доставкой антибиотика при стимуляции регенерации кости посредством регулируемого высвобождения фактора роста кости. В качестве дополнительного преимущества мягкий, биосовместимый сохраняющий форму агрегат обеспечит комфорт на месте из-за его присущей мягкости и приспособляемости. Агрегат может быть сформирован в действующий катетер или стент, пропитанный или непропитанный лекарственным средством.
Другие применения сохраняющих форму агрегатов, полученных способами по настоящему изобретению, включают применение смеси частиц, некоторые из которых будут разлагаться в течение заранее определенного периода времени, в применениях, которые требуют изменений структуры вещества с течением времени. Также, агрегаты, состоящие из смеси частиц геля с другими типами частиц, такими как металлы, полупроводники, полимеры, не образующие гель, керамика, сахара, крахмалы, целлюлозы и подобные, также могут быть получены, следуя способам по настоящему изобретению.
Агрегаты по настоящему изобретению, полученные его способами, могут быть использованы как носители для множества веществ, иных, чем биомедицинские средства. Например, без ограничения, металлы могут быть поглощены частицами геля, уловлены агрегатом или обоими. Металлы будут придавать различную степень проводимости агрегатам, которые смогут иметь множество применений. Металлы также могут быть включены как ионы, то есть металлы с валентностью, иной, чем ноль. Такие ионы также будут придавать степени проводимости агрегатам. В частицы геля или агрегаты по настоящему изобретению могут быть внедрены полупроводниковые металлы или соединения. Полупроводящие сохраняющие форму агрегаты или даже агрегаты, состоящие из некоторых полупроводящих частиц геля и некоторых проводящих частиц, должны найти применение как MEMS (МикроЭлектро-Механические Системы) и NEMS (НаноЭлектроМеханические Системы) устройства. Поглощение и/или захват магнитных материалов или частиц магнитных металлов может дать трехмерные устройства компьютерной памяти. Агрегат, содержащий поглощенные и/или захваченные металлические материалы или ионы металлов, может быть использован в качестве протон-обменных мембран для применения в топливных элементах. Поглощение полинуклеотидных сегментов в частицы агрегата может обеспечить трехмерные матричные аналитические средства для применения в биотехнологической области. Такие и возможно другие применения сохраняющих форму агрегатов по настоящему изобретению будут очевидными специалисту в области техники на основании настоящего описания. Такие применения находятся в рамках изобретения.
Примеры
Пример 1: Получение частиц гидрогеля с использованием поверхностно-активного вещества Tween 80
Основной раствор Tween 80 в Milli-Q H2O получали растворением 27 г Tween (80) с 100 г Milli-Q H2O. Основной раствор персульфата калия получали растворением 2 г в 30 мл Milli-Q H2O. В 1 л колбу для среды, снабженную мешалкой, загружали 1,74 г мономера НЕМА, содержащего 3,6 мг диметакрилата этиленгликоля, 1,07 г основного раствора Tween 80, 571 мл Milli-Q H2O, продутого N2 и 0,952 мл основного раствора персульфата калия. Раствор перемешивали до растворения всего твердого вещества. Колбу закрывали фольгой и погружали в баню 65°C в течение 16 часов. Полученная суспензия частиц гидрогеля имела молочно-белую - мутно-синюю опалесцирующую мутность и частицы имели средний диаметр 466 нм, что определяли по динамическому рассеянию света. Суспензию концентрировали и очищали проточной фильтрацией вдоль потока и обнаружили, что она стабильна в отношении образования хлопьев в концентрации сырого веса, приближающейся к 70 мг/мл.
Пример 2: Получение частиц гидрогеля с использованием поверхностно-активного вещества сукцината диоктилнатрия
В 500 мл колбу для среды, снабженную мешалкой, загружали 4,25 г мономера НЕМА, содержащего 8,8 мг диметакрилата этиленгликоля, 290,18 мг сукцината диоктилнатрия (DSS), 135 мг персульфата калия и 500 мл N2-продутого Milli-Q H2O. Колбу закрывали, и раствор перемешивали в течение 3 часов при комнатной температуре. Колбу переносили на водяную баню 50°C и инкубировали в течение 12 часов. Полученная суспензия частиц гидрогеля имела опалесцирующий синий цвет. Частицы анализировали динамическим рассеянием света и обнаружили, что они имеют средний диаметр 241 нм. Суспензия частиц содержала 25 мг гидратированного полимера на 1 мл раствора. Суспензию концентрировали и очищали с использованием проточной фильтрации вдоль потока и обнаружили, что она стабильна в отношении выпадения хлопьев при концентрации сырого веса, приближающейся к 150 мг/мл.
Пример 3: Получение частиц гидрогеля с использованием поверхностно-активного вещества додецилсульфата натрия
1000 мл колбу для среды, снабженную мешалкой, заполняли 4,25 г мономера НЕМА, содержащего 8,8 мг димеакрилата этиленгликоля, 267,91 мг додецилсульфата натрия (SDS), 135 мг персульфата калия и 500 мл N2-продутого Milli-Q Н2O. Колбу закрывали и раствор перемешивали в течение 3 часов при комнатной температуре. Колбу переносили на водяную баню 50°С и инкубировали в течение 12 часов. Полученная суспензия частиц гидрогеля имела опалесцирующий синий цвет.Частицы анализировали динамическим рассеянием света и обнаружили, что они имели средний диаметр 110 нм. Суспензия частиц содержала 78 мг гидратированного полимера на 1 мл раствора. Суспензию концентрировали и очищали с использованием проточной фильтрации вдоль потока и обнаружили, что она стабильна в отношении выпадения хлопьев при концентрации сырого веса, достигающей 200 мг/мл.
Пример 4: Вариации размера частиц с изменением концентрации мономера
Изменения концентрации реагентов в растворе влияют на размер и полидисперсность частиц. Для частиц, синтезированных в соответствии с методикой в Примере 2, размер и полидисперсность частиц варьировали изменением объема раствора во время полимеризации, как показано в Таблице 1:
Вышеуказанная тенденция показала, что для заданного соотношения мономера НЕМА к поверхностно-активному веществу DSS во время синтеза частиц размер и полидисперсность частиц снижались при увеличении объема раствора.
Пример 5: Смена поверхностно-активного вещества и концентрации
Суспензию отдельных частиц со средним диаметром 110 нм, содержащих сырой вес 33 мг/мл и концентрацию SDS 0,535 мг/мл, подвергали проточной фильтрации вдоль потока с использованием мембраны для проточной фильтрации вдоль потока Millipore Pellicon® Biomax с отсечкой 300000 Дальтон. Фильтрацию проводили с постоянным объемом с использованием 5% (мас./об.) раствора Tween 80 в Milli-Q H2O в качестве подпитки. Всего 6×500 мл объемов фильтрата собирали во время фильтрации для замены поверхностно-активного вещества SDS на Tween 80. Суспензия частиц имела средний диаметр 318 нм после замены поверхностно-активного вещества и в течение периода 6 месяцев показала минимальные признаки оседания и агрегации. Частицы концентрировали с использованием проточной фильтрации вдоль потока удалением установленного объема фильтрата при удержании частиц.
Пример 6: Определение максимальной концентрации частиц, дающей стабильные дисперсии, как функции размера частиц
Образовывались две группы частиц: 1) частицы, стабилизированные SDS, полученные в соответствии с Примером 3, с диаметром 100, 265, и 500 нм соответственно, и 2) частицы, стабилизированные DSS, полученные в соответствии с Примером 2, с диаметром 125, 300, 475, и 550 нм соответственно. Исходную массу гидратированного полимера каждого образца определяли взвешиванием образца после центифугирования. 6 мл каждой дисперсии помещали в 15 мл градуированные центрифужные пробирки. С использованием аналитического испарителя поток газа Аргона пропускали над поверхностью дисперсий в каждой центрифужной пробирке при поддержании температуры 37°C с использованием водяной бани. Образец осматривали в отношении начала агрегации диспергированных частиц при увеличении их концентрации. Изменение объема образца при начале агрегации записывали и рассчитывали новую концентрацию. Эффект размера частиц на концентрацию, в которой каждая дисперсия начинает агрегировать в частицы различных размеров с использованием поверхностно-активных веществ SDS и DSS, графически представлено на фиг. 1.
Пример 7: Эффект скорости введения, размера иглы и концентрации частиц на образование агрегата
Части основной дисперсии частиц геля, синтезированных в соответствии с Примерами 1-3 и концентрированных в соответствии с Примером 3 до концентрации сырого веса 109 мг/мл, загружали в 20 отдельных 3 мл одноразовых шприцев. Четное количество шприцев было снабжено иглами размеров 27, 26, 23 и 18. Один миллилитр из каждого шприца вводили в 10 мл фосфатного буферного раствора. Скорость тока от 0,1 мл/мин до 2 мл/мин регулировали шприцевым насосом Harvard Apparatus (Model # 4400). Проводили качественные наблюдения после каждой инъекции и полученные агрегаты классифицировали на четыре типа, как показано в Таблице 2. Несколько разведений вышеуказанной основной дисперсии получали со сниженной концентрацией и изучали с использованием такой же методики.

Пример 8: Типы агрегации с использованием более крупных частиц.
Рыхлый, сухой pHEMA измельчали и просеивали в трех различных диапазонах частиц: менее чем 45 мкм, более чем 45 мкм но менее чем 75 мкм и более чем 75 мкм, но менее чем 150 мкм. Суспензии для каждого типа частиц получали с использованием воды Milli-Q, содержащей 0,015 мас.% DSS в качестве суспендирующей среды. Каждую суспензию получали так, чтобы сырой вес частиц составлял 150 мг/мл. Один миллилитр каждой суспензии вводили в 15 мл PBS с использованием 3 мл одноразовых шприцев, снабженных иглами размера 18. Скорость тока каждой инъекции составила приблизительно 1 мл/мин. Качественные наблюдения проводили для каждой инъекции и агрегаты классифицировали на различные типы, как показано в Таблице 3.
Пример 9: Образование сохраняющего форму агрегата in vivo
Частицы гидрогеля суспендировали в растворе изотоничной глюкозы. Суспензия содержала 110 мг/мл гидратированного полимера. Одна суспензия (A) содержала чистые частицы pHEMA. Вторая суспензия (B) содержала смесь 50:50 pHEMA:(95:5 pHEMA:MAA) по массе. Инъекции, которые содержали 100 мг гидратированного полимера, проводили подкожно над спинной фасцией мышей. Животных умерщвляли через 24 часа и 7 дней. Имплантаты иссекали и изучали. Оба имплантата присутствовали под местом инъекции через 1 и 7 дней после имплантации. Оба имплантата образовывали круглые диски эластичного материала гидрогеля и проявляли небольшие признаки местного раздражения. Масса имплантата была немного выше, чем центрифугированная гидратированная масса полимера; такая более высокая масса, вероятно, была из-за инфильтрации ткани в основу агрегата. Имплантат, содержащий смесь частиц pHEMA и 95:5 pHEMA:MAA, был более мутный, чем чистый pHEMA имплантат, и проявлял выраженную инфильтрацию тканей через 7 дней. На фиг. 2 показан агрегат, образованный таким образом in vivo. Имплантаты, образованные in vivo с использованием частиц pHEMA, диспергированных в растворе поверхностно-активного вещества Tween 80 и поверхностно-активного вещества сульфата диоктилнатрия (DSS), не показали признаков раздражения или разъедания в течение 14 дней.
Пример 10: Потеря массы абсорбированной воды во время агрегации для различных размеров частиц
Введение частиц в раствор, в котором частицы имеют меньшую степень набухания, такой как раствор с более высокой ионной силой, образует агрегат частиц гидрогеля. Скорость образования агрегата может быть определена количественно посредством определения потери массы воды для агрегата в течение времени после инъекции. Для заданного поверхностно-активного вещества в заданной концентрации частицы pHEMA, диспергированные в воде в заданной концентрации, показывают различную скорость образования агрегата при введении в фосфатный буферный раствор при физиологическом pH и ионной силе при комнатной температуре. В типичном эксперименте 2 мл дисперсии частиц гидрогеля 680 нм в диаметре в водном растворе 0,5 мас.% поверхностно-активного вещества Tween 80 с центрифугированным сырым весом полимера 37 мг/мл, определенным центрифугированием, вводили в 100 мл PBS. Полученному агрегату позволяли образовываться, не тревожа, в течение 10-15 минут и впоследствии фильтровали через сито, взвешивали и возвращали в раствор PBS. Массу указывали как процент центрифугированного сырого веса полимера, который показывает количество воды и внутри, и между частицами, составляющими агрегат, при его разрушении. Фиг. 3 показывает график скорости агрегации в течение времени от исходного введения до точки, в которой агрегат достигает массы стационарного состояния. График показывает, что более крупные частицы проявляют более быстрое исходное изменение скорости агрегации, однако, оба размера достигали равновесного содержания гидратации между 150 и 200 минутами. Более крупные частицы с таким же поверхностным зарядом как и более мелкие частицы имели различное соотношение Гауссова заряда к площади поверхности, которое дает меньшую стабильность даже при совпадении общего заряда. Так как частицы являются немного менее стабильными, даже с одинаковыми электрохимическими потенциалами, они достигают стационарного состояния агрегата быстрее, чем соответствующие более мелкие частицы. Это показывает, что вариации в размере частиц с одинаковой концентрацией поверхностно-активного вещества и частиц приводят к различной скорости образования агрегата.
Пример 11: Потеря массы абсорбированной воды во время агрегации при различной температуре
Температура оказывает эффект на скорость образования агрегата для заданной суспензии. В типичном эксперименте, 2 мл дисперсии частиц гидрогеля 735 нм в диаметре в водном растворе 0,5 мас.% поверхностно-активного вещества Tween 80 с сырым весом полимера 37 мг/мл, что определяли центрифугированием, вводили в 100 мл PBS при 37°C. Полученному агрегату позволяли образовываться, не тревожа в течение 10-15 минут, и впоследствии фильтровали через сито, взвешивали и возвращали в раствор PBS. Массу указывают как процент от массы центрифугированного сырого полимера, которая показывает количество воды и внутри, и между частицами, составляющими агрегат, при его сморщивании. Сравнение скорости потери массы агрегата в течение времени для дисперсий частиц, вводимых в PBS при 25° и 37°С, показало, что скорость образования агрегата выше при более высокой температуре. На фиг. 4 показана скорость агрегации в течение времени от исходного введения до точки, в которой агрегат достигает равновесной массы в PBS при двух различных температурах. Данные показывают, что для заданного размера частиц скорость образования агрегата, показанная потерей массы в течение времени, является большей исходно при более высокой температуре.
Пример 12: Потеря массы абсорбированной воды во время агрегации в сыворотке
Агрегаты частиц образовывались в бычьей сыворотке. В типичном эксперименте 2 мл дисперсии частиц гидрогеля в водном растворе 0,5 мас.% поверхностно-активного вещества Tween 80 с мокрой массой полимера 37 мг/мл, что определяли центрифугированием, вводили в 100 мл бычьей сыворотки при 25°C. Полученному агрегату позволяли образовываться, не тревожа в течение 10-15 минут, и впоследствии фильтровали через сито, взвешивали и возвращали в раствор PBS. Массу указывали как процент центрифугированной мокрой массы полимера, который показывает количество жидкости и внутри, и между частицами, составляющими агрегат, при его разрушении. На фиг. 5 показана скорость агрегации в течение времени после исходной инъекции до точки, в которой агрегат достигает массы стабильного состояния в сыворотке. Также, более крупные частицы с таким же поверхностным зарядом, как и более мелкие частицы, имеют различный Гауссов заряд к площади поверхности, что дает меньшую стабильность, хотя общий заряд одинаковый. Так как частицы только немного менее стабильны, даже при одинаковом электрохимическом потенциале, они достигают стабильного состояния агрегата быстрее, чем соответствующие более мелкие частицы.
Пример 13: Потеря массы абсорбированной воды во время агрегации в гипертоническом солевом растворе
Агрегаты частиц образовывались в гипертоническом солевом растворе. В типичном эксперименте 2 мл дисперсии частиц гидрогеля 680 нм в диаметре в водном растворе 0,5 мас.% поверхностно-активного вещества Tween 80 с сырым весом полимера 37 мг/мл, что определяли центрифугированием, вводили в 100 мл насыщенного раствора хлорида натрия. Полученный агрегат образовывался немедленно на поверхности раствора и его возвращали в раствор PBS. Массу указывали как процент центрифугированного сырого веса полимера, который показывает количество воды и внутри, и между частицами, составляющими агрегат, при его разрушении. Фиг. 6 показывает график скорости агрегации в течение времени от исходного введения до точки, в которой агрегат достигает массы стабильного состояния. График показывает более быстрое начальное изменение скорости агрегации, однако, оба агрегата, состоящие из частиц различных размеров, достигали стабильного состояния между 150 и 200 минутами. Это показывает, что изменение ионной силы раствора оказывает эффект на скорость агрегации и что изменение электрохимического потенциала может быть показано в растворах с различной ионной силой.
Пример 14: Потеря массы абсорбированной воды во время агрегации частиц гидрогеля с различным химическим составом
Композиция полимера частиц гидрогеля обладает эффектом на скорость образования агрегата в заданном растворе. В типичном эксперименте 2 мл дисперсии частиц гидрогеля с сырым весом полимера 37 мг/мл, что определяли центрифугированием, которые имели состав или поли(2-гидроксиэтилметакрилата) или поли(2-гидроксипропилметакрилата) со средним диаметром 480 или 465 нм соответственно, вводили в 100 мл фосфатного буферного раствора при комнатной температуре. Полученному агрегату позволяли образовываться, не тревожа в течение 2 минут, для частиц p(HPMA) или 10-15 минут для частиц p(HEMA), и впоследствии фильтровали через сито, взвешивали и возвращали в раствор PBS. Массу указывали как процент центрифугированного сырого веса полимера, который показывает количество воды и внутри и между частицами, составляющими агрегат, при его разрушении. Сравнение скорости потери массы агрегата с течением времени для дисперсий частиц, вводимых в PBS при 25°С, показало, что скорость образования агрегата выше для частиц pHPMA заданного размера. Это означает, что даже при одинаковом поверхностно-активном веществе и поверхностном заряде внесение частиц различного химического состава в различную ионную силу приводит к различной скорости агрегации, что также является непрямым определением стабильности электрохимического потенциала. На фиг. 7 показана скорость агрегации с течением времени от исходного введения до точки, в которой агрегат достигает массы стабильного состояния в PBS при двух различных температурах. Данные показывают, что для заданного размера частиц скорость образования агрегата, показанная потерей массы воды в течение времени, выше исходно для pHPMA, чем для pHEMA.
Пример 15: Потеря массы абсорбированной воды во время агрегации частиц гидрогеля с различными поверхностно-активными веществами
Поверхностно-активное вещество, используемое для стабилизации частиц гидрогеля, оказывает эффект на скорость образования агрегата в заданном растворе. В типичном эксперименте, 2 мл дисперсии частиц pHEMA с сырым весом полимера 37 мг/мл, что определяли центрифугированием, со средними диаметрами 175 нм и стабилизированными или 0,5 мас./об.% поверхностно-активными веществами SDS или DSS вводили в 25 мл PBS при комнатной температуре или 37°C. Полученному агрегату позволяли образовываться, не тревожа в течение 2 минут, на протяжении 10-15 минут и впоследствии фильтровали через сито, взвешивали и возвращали в раствор PBS. Массу указывали как процент центрифугированного сырого веса полимера, который показывает количество воды и внутри и между частицами, составляющими агрегат, при его разрушении. Сравнение скорости потери массы агрегата с течением времени для дисперсий частиц, вводимых в PBS при 25°С, показало, что скорость образования агрегата была выше для частиц, стабилизированных DSS. На фиг. 8 показана скорость агрегации в течение времени от исходного введения до точки, в которой агрегат достигает массы стабильного состояния в PBS при двух различных температурах. Данные показывают, что для заданного размера частиц скорость образования агрегата, показанная по потере массы воды с течением времени, выше исходно для частиц, стабилизированных DSS, чем для стабилизированных SDS.
Пример 16: Образование агрегатов частиц, которые подвергаются разрушению или частичному разрушению
Введение частиц, состоящих из сополимеров НЕМА и метакриловой кислоты (MAA) в растворе с физиологическим рН и ионной силой, приводит или к образованию агрегата, который медленно разлагается или вообще не образуется. В типичном эксперименте 2 мл суспензии частиц 95:5 pHEMA:MAA с диаметром 155 нм, содержащих 110 мг/мл гидратированного полимера, вводили в фосфатный буферный раствор. Агрегат показал исходную потерю массы воды, подобную агрегатам в Примере 12. После исходной агрегации агрегат постепенно разлагается при ионизации части метакриловой кислоты сополимера частиц. Таблица 4 показывает время разложения после исходной агрегации для частиц с различным количеством MAA в сополимере HEMA:MAA.
Пример 17: Образование сгустков частиц
При концентрации сырого веса более чем 50 мг/мл отдельные частицы pHEMA имеют предрасположенность к объединению в более крупные, но все еще дисперсные сгустки. Процесс образования сгустков документирован взятием образцов аликвот дисперсии во время очистки TFF и мониторинга размера и полидисперсности частиц при концентрировании 2 л дисперсии 53 нм (PDI 0,098) частиц pHEMA, имеющих концентрацию сырого веса 36,2 мг/мл до объема 235 мл и окончательной концентрации сырого веса 424 мг/мл Результаты представлены в Таблице 5:

Вышеуказанная тенденция демонстрирует, что средний пиковый размер частиц pHEMA увеличивается после того, как концентрация сырого веса полимера превосходит 50 мг/мл. Также наблюдали увеличение вязкости дисперсии (приближающейся к таковой истинной соли без агрегации в массу твердого вещества). Также наблюдали изменения формы или распределения пика размеров частиц около среднего значения пика, а также изменения модальности пика и исходной ширины распределений около среднего пика. Изменения распределений от отдельных частиц pHEMA до сгустков pHEMA показаны на фиг. 9.
Пример 18: Изменение электрохимического потенциала удалением поверхностно-активного вещества вызывает агрегацию частиц
Дисперсию частиц получали, как описано в Примере 3 для получения частиц 60 нм в диаметре. 100 мл дисперсии подвергали проточной фильтрации вдоль потока для удаления поверхностно-активного вещества SDS. Фильтрацию проводили при постоянном объеме с использованием Milli-Q H2O в качестве основы. Определение электрохимического потенциала и анализ размера проводили в образце после получения 100 мл, 150 мл и 200 мл фильтрата. При удалении поверхностно-активного вещества величина электрохимического потенциала частиц снижалась, вызывая образование сгустков частиц. Это показано в Таблице 6. После получения 250 мл фильтрата в образце возникала агрегация частиц.
Пример 19: Эффект изменения ионной силы (концентрации соли) диспергирующей среды на размер частиц pHEMA, стабилизированных SDS
Частицы pHEMA с диаметром около 92 нм получали с использованием поверхностно-активного вещества SDS, как описано в Примере 1. Концентрация сырого веса дисперсии составила приблизительно 30 мг/мл. Пять капель (105 мкл) дисперсий частиц pHEMA помещали в 3 мл воды Milli-Q и в 3 мл солевых растворов NaCl 1, 2, 3, 4, 5, 6, 7 и 10 мМ. Размеры и электрохимические потенциалы частиц определяли с использованием Malvern Instrument, Nano ZS Zetasizer. Результаты показывают, что при увеличении ионной силы суспендирующей среды электрохимический потенциал частиц снижается с сопутствующим снижением размера частиц. Когда концентрация соли составляет ниже 2 мМ NaCl, частицы все еще остаются относительно стабильными, так как абсолютный поверхностный заряд все еще существенен и частицы стремятся оттолкнуться друг от друга. Однако при увеличении ионной силы абсолютный поверхностный заряд начинает снижаться и частицы стремятся образовывать сгустки для уменьшения площади поверхности, подвергаемой воздействию суспендирующей жидкости, и будут продолжать образовывать сгустки до выпадения более крупных агломератов частиц и наконец оседать в твердый агрегат.
Пример 20: Эффект изменения ионной силы диспергирующей среды на размер отдельных частиц pHEMA, стабилизированных SDS
Частицы pHEMA (с диаметрами приблизительно 60, 92, 250 нм) получали с использованием поверхностно-активного вещества SDS, как описано ранее. Концентрация сырого веса каждой дисперсии составила около 30 мг/мл. Пять капель (105 мкл) 92 и 250 нм, дисперсий частиц pHEMA помещали в каждый из 3 мл растворов 2 мМ NaCl. Определяли размер и электрохимический потенциал суспендированных частиц. После таких измерений среду разводили 1 объемным эквивалентом воды Milii-Q для снижения содержания соли на 50% таким образом, что проводили серийное разведение для получения значений электрохимического потенциала и размера в растворах 2, 1, 0,5, 0,25, 0,125 мМ NaCl. Результаты показаны в Таблице 7 ниже.
Таблица 7 показывает, что для каждого размера частиц pHEMA (приблизительно 250, 100, и 60 нм соответственно) при снижении содержания соли (т.е. снижении ионной силы суспендирующей среды) соответствующие диаметры частиц увеличиваются. При снижении ионной силы суспендирующей среды абсолютное значение электрохимического потенциала частиц увеличивается. Результаты также показаны на фиг. 10.
Пример 21: Изменение размера частиц с разведением дисперсионной среды с использованием смешиваемого дополнительного диспергирующего вещества
Отдельные частицы pHEMA в стабильной водной дисперсии могут подвергнуться изменению размера и могут образовать сгустки, когда водный раствор разводят неводной, смешиваемой со-диспергирующей средой. В типичном примере дисперсию частиц pHEMA с концентрацией сырого веса 63 мг/мл и с диаметром 68 нм разводили ацетоном. Соотношение Milli-Q к ацетону в окончательном растворе варьировали от 100% до 5%. Размер частиц исходно уменьшали добавлением со-диспергирующей среды, а позже увеличивали при возникновении агрегации, и образовывались множество пиков размеров частиц. Результаты показаны в Таблице 8.
Сходный эксперимент проводили на той же группе частиц с использованием этанола в качестве со-диспергирующего вещества. Этанол представляет собой растворитель, который обеспечивает некоторую растворимость для pHEMA. Результаты эксперимента со-диспергирования показаны в Таблице 9.
Вышеуказанные результаты демонстрируют, что природа со-диспергирующей среды может влиять на стабильность дисперсии частиц и начало агрегации, также изменением величины электрохимического потенциала на частицах.
Пример 22: Образование гелеобразного агрегата введением гидрофобного растворителя в дисперсию частиц
Стабильная водная дисперсия отдельных частиц проявляет уникальные свойства при смешивании несмешиваемого растворителя с диспергирующей средой. В типичном примере дисперсию частиц pHEMA с концентрацией сырого веса 63 мг/мл и диаметром 68 нм комбинируют с эквивалентным объемом гексана. Прозрачный слой гексана не показал смешивания с мутной дисперсией частиц в течение 5 дней при комнатной температуре. Тщательное перемешивание раствора приводило к образованию гелеобразной массы, суспендированной над водной дисперсией частиц. Отделение одного раствора от гидрофобного слоя от водной дисперсии частиц с последующим выпариванием в вакууме гексана приводило к образованию стабильного агрегата частиц.
Пример 23: Разведение дисперсии частиц pHEMA
Отдельные частицы pHEMA в стабильной водной дисперсии подвергались очень ограниченным изменениям размера и электрохимического потенциала при разведении диспергирующей средой и не агрегировали. В типичном примере дисперсию частиц pHEMA с концентрацией сырого веса 63 мг/мл и диаметром 68 нм разводили Milli-Q H2O в серийном разведении. Эффекты разведения на размер частиц и электрохимический потенциал показаны в Таблице 10.
При очень низкой концентрации частиц (≤2 мг/мл) электрохимический потенциал частиц был ниже предела определения прибора.
Пример 24: Захват и высвобождение мелких молекул из агрегатов частиц
Введение дисперсии частиц с мелкими молекулами, растворенными в суспендирующей среде, образует агрегат, который улавливает некоторые мелкие молекулы. В типичном эксперименте 1 мг бромокрезолового зеленого красителя растворяли в 2 мл суспензии частиц pHEMA, стабилизированных Tween 80 (725 нм в диаметре), с массой гидратированного полимера 36 мг/мл. Диспергированные частицы и красители вводили в фосфатный буферный раствор. Через 10 минут агрегации раствор встряхивали при 10 циклах в секунду для обеспечения адекватного перемешивания. Получали образцы 2 мл надосадочной жидкости и характеризовали спектроскопией поглощения видимого УФ. Фиг. 11 показывает процент бромокрезолового зеленого, высвободившегося в раствор с течением времени из агрегатов, образованных из отдельных частиц. Фиг. 12 показывает процент бромокрезолового зеленого высвобожденного в раствор с течением времени из смеси 50:50 по массе двух различных размеров частиц. В обоих случаях большинство мелких частиц высвобождается в течение первых 3-5 часов, однако эффект пика меньше в смешанных системах агрегатов.
Пример 25: Ускорение образования агрегата со-диспергирующим веществом
50 мг поли(этиленгликоля) (Мм=400 г/моль) в качестве со-диспергирующего вещества добавляли к 1 мл дисперсии частиц 300 нм НЕМА 115 мг/мл. Дисперсию тщательно перемешивали и помещали в 1 мл шприц. Дисперсию вводили в 15 мл PBS со скоростью около 4 мл в минуту с использованием иглы размера 27. Вводимый материал быстро сжимался в агрегат с очень небольшим образованием хлопьев.
Когда 1 мл дисперсии частиц 300 нм НЕМА 115 мг/мл без добавления поли(этиленгликоля) вводили в 15 мл PBS со скоростью около 4 мл в минуту с иглой размера 27, возникало образование хлопьев. Однако агрегат образовывался через около 30 минут. Обоим агрегатам позволяли стоять в PBS в течение 24 часов. Агрегат, образованный из системы со-диспергирующего вещества PEG, казался плотнее и механически прочнее, чем агрегат, образованный без со-диспергирующего вещества.
Пример 26: Эффективность нагрузки и высвобождение BSA, меченного FITC, и декстрана, меченного FITC, из агрегатов частиц pHEMA, состоящих из различных размеров частиц и количеств меченого соединения
Частицы pHEMA, имеющие диаметры 475, 300, 200 и 175 нм, использовали для получения агрегатов частиц pHEMA. Эффект нагрузки и высвобождения макромолекул двух различных размеров; т.е. FITC-BSA (72 кДа) и FITC-декстрана (2000 кДа) оценивали как функцию размера частиц. С использованием шприцевого насоса Harvard Model 4400, 10 мл шприца, иглы размера 16 при скорости введения 2 мл/мин получали 2 группы 8-500 мг стандартов агрегатов частиц pHEMA, содержащих 10, 7, 5, 3, 2, 1, 0,5 и 0 мг FITC-BSA (Стандартная группа 1) и 20, 15, 10, 6, 4, 2, 1 и 0 мг FITC-Dex (Стандартная группа 2). Пять миллилитров дисперсии частиц 475 нм pHEMA смешивали с предварительной взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре. При введении в PBS дисперсии отдельных частиц агрегировали и захватывали макромолекулу. Надосадочную жидкость удаляли, и метка FITC обеспечивала градиент желтого цвета для каждого агрегата, содержащего две макромолекулы в различных концентрациях, давая контраст наблюдаемого цвета по сравнению со стандартом к таковому образца, полученного подобным образом.
Образцы агрегатов по пятьсот миллиграмм получали введением аликвоты 5 мл (100 мг/мл) каждой из вышеуказанных дисперсий частиц, содержащих или 5 или 10 мг FITC-BSA или 10 или 20 мг FITC-Dex в PBS при 37,4°C. Профили нагрузки и высвобождения макромолекул определяли сравнением наблюдаемого цвета в заданное время с таковым стандартной группы агрегатов. Такие результаты показаны на фиг. 13-26.
Нагрузка для обеих макромолекул была очень эффективной (т.е. >95%). При 10 мг FITC-BSA (приблизительно 2 мас.% агрегата), большой пик высвобождения (около 40%) наблюдали в течение первых 5 часов, особенно в агрегатах, состоящих из более мелких частиц. Это не наблюдали в такой же степени при более низкой нагрузке (5 мг FITC-BSA). Агрегаты, состоящие из двух более мелких размеров частиц (200 и 175 нм), проявили высвобождение около нулевого порядка в течение первых двадцати часов.
Следовательно, более крупные макромолекулы диффундировали из агрегатов с более медленной скоростью, как показано в профилях высвобождения для двух макромолекул. Также, профили высвобождения из агрегатов, полученных с использованием увеличивающихся количеств более мелких частиц, показали более медленное высвобождение, чем из агрегатов, полученных из более крупных частиц.
Пример 27: Высвобождение макромолекул из агрегатов частиц pHEMA, состоящих из частиц 175 и 475 нм, полученных с использованием SDS
Подробное исследование проводили для наблюдения за высвобождением макромолекул из агрегатов частиц pHEMA как функции размера макромолекул. Частицы pHEMA (с диаметром 475 нм и 175 нм) получали с использованием поверхностно-активного вещества SDS, как описано ранее. С использованием шприцевого насоса Harvard Model 4400, 10 мл шприца, иглы 22-размера, скорости введения 1 мл/мин получали 500 мг агрегатов частиц pHEMA, содержащие или 10 мг FITC-BSA или 10 мг FITC-Dex. Пять миллилитров дисперсии частиц pHEMA 100 мг/мл (475 нм или 175 нм) смешивали с предварительно отвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре. Скорость высвобождения макромолекул, меченных FITC, определяли с использованием анализа UV-Vis (FITC-BSA Amax 486 нм, FITC-Dex Amax 492 нм). Концентрации FITC определяли относительно стандартных калибровочных кривых Beers Law для FITC-BSA и FITC-Dex. Результаты показаны на фиг. 18 и 19.
FITC-BSA показал пиковый выброс 30% и 40% из агрегатов, состоящих из частиц pHEMA 475 и 175 нм. После исходного пикового выброса оба агрегата, состоящие из частиц 475 нм и 175 нм, проявляли медленное высвобождение макромолекул после высвобождения приблизительно 50% FITC-BSA.
Большая из двух макромолекул показала гораздо меньшее пиковое высвобождение. Также было обнаружено, что агрегаты, состоящие из более мелких частиц, более эффективны в захвате и продолжительном высвобождении, чем полученные из более крупных частиц. Пиковый выброс из агрегата 175 нм был <25% через 5 часов, тогда как агрегат, состоящий из частиц 475 нм, показал пиковый выброс 35% загруженного FITC-Dex в течение такого же периода времени. Это показывает корреляцию между размерами частиц, используемыми для составления агрегатов, относительно размера макромолекулы, которая впоследствии высвобождается.
Пример 28: Высвобождение макромолекул из агрегатов частиц pHEMA, состоящих из частиц 265 и 500 нм, полученных с использованием DSS
Частицы pHEMA (с диаметрами 500 нм и 265 нм) получали с использованием поверхностно-активного вещества DSS, как описано ранее. С использованием шприцевого насоса Harvard Model 4400, шприца 10 мл, иглы 22-размера, скорости инфузии 1 мл/мин, получали 500 мг агрегатов частиц pHEMA, содержащих или 10 мг FITC-BSA или 10 мг FITC-Dex. Пять миллилитров дисперсии частиц pHEMA 100 мг/мл (500 нм или 265 нм) смешивали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре. Скорость высвобождения макромолекулы, меченной FITC, определяли с использованием анализа UV-Vis и концентрации определяли, как указано выше. Результаты показаны на фиг. 19 и 20. Более крупные макромолекулы высвобождались с меньшей скоростью и агрегат, полученный с использованием частиц 265 нм, показал высвобождение псевдо-нулевого порядка с немного более сильным выбросом, чем наблюдаемый для агрегата, состоящего из частиц 175 нм, описанного ранее. FITC-BSA показывает выброс около 40% из каждой системы в течение первых 5 часов. Это показывает, что такая определенная макромолекула является очень чувствительной к размеру частиц, используемых в агрегате, и, следовательно, может потребоваться значительно более мелкий диаметр частиц.
Пример 29: Высвобождение макромолекул из агрегатов частиц pHEMA, состоящих из смеси частиц 175 и 475 нм, полученных с использованием SDS
Агрегаты частиц pHEMA получали из смесей частиц pHEMA 475 нм и 175 нм. Частицы получали с использованием поверхностно-активного вещества SDS, как описано ранее. С использованием шприцевого насоса Harvard Model 4400, шприца 10 мл, иглы 22-размера, скорости введения 1 мл/мин получали 500 мг агрегатов частиц pHEMA с композициями 20/80, 40/60 и 60/40:частиц pHEMA 475 нм и 175 нм (соответственно), содержащих или 10 мг FITC-BSA, или 10 мг FITC-Dex. Пять миллилитров дисперсии частиц pHEMA 100 мг/мл смешивали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре. Скорость высвобождения и концентрации макромолекул, меченных FITC, определяли, как указано выше. Результаты показаны на фиг. 21 и 22.
FITC-Dex проявил различия в профилях высвобождения относительно трех смесей частиц, используемых в получении агрегатов гидрогеля. Относительная скорость высвобождения для этой макромолекулы составила, в нисходящем порядке, 60/40>40/60>20/80. Скорость высвобождения FITC-Dex из агрегата, состоящего из смеси частиц pHEMA 20/80, была медленнее, чем таковая, наблюдаемая для агрегатов частиц pHEMA, полученных с использованием одного размера частиц, как показано на фиг. 23 и 25. Каждый из агрегатов, полученных с использованием смесей частиц, показанных на фиг. 22, проявлял более медленный профиль высвобождения для FITC-Dex, чем более мелкий FITC-BSA. Фиг. 21 показывает большой пиковый выброс для FITC-BSA, несмотря на смесь частиц, используемых для получения агрегатов, и существует небольшие отличия в профиле высвобождения между тремя используемыми смесями, показывающими, что размер частиц, используемых в получении агрегатов, был слишком крупным для такой определенной макромолекулы.
Пример 30: Высвобождение макромолекул из агрегатов частиц pHEMA, состоящих из смеси частиц 265 и 500 нм, полученных с использованием DSS
Агрегаты частиц pHEMA получали из смесей частиц 500 нм и 265 нм pHEMA. Частицы получали с использованием поверхностно-активного вещества DSS, как описано ранее. С использованием шприцевого насоса Harvard Model 4400, 10 мл шприца, иглы 22-размера, скорости введения 1 мл/мин получали 500 мг агрегатов частиц pHEMA с композициями 20/80, 40/60 и 60/40 500 нм и 265 нм частиц pHEMA, содержащих или 10 мг FITC-BSA, или 10 мг FITC-Dex. Пять миллилитров смеси дисперсий частиц pHEMA 100 мг/мл (500 нм или 265 нм) комбинировали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре. Скорость высвобождения и концентрации для макромолекул, меченных FITC, определяли, как описано выше. Результаты показаны на фиг. 23 и 24.
Профиль высвобождения для FITC-BSA показал небольшие отличия одного агрегата от другого. Все три смеси, используемые в агрегате, давали 40% пиковое выделение FITC-BSA в течение первых 5-6 часов и затем замедлялась до высвобождения псевдо-нулевого порядка от 20 до 60 часов. Также, FITC-Dex высвобождался с более медленной скоростью, чем FITC-BSA.
Пример 31: Высвобождение макромолекул из агрегатов частиц pHEMA, состоящих из смеси частиц pHEMA 170 нм и 75 нм, полученных с использованием SDS
Агрегаты частиц pHEMA получали их смесей частиц pHEMA 170 нм и 75 нм. Частицы получали с использованием поверхностно-активного вещества SDS, как описано ранее. С использованием шприцевого насоса Harvard Model 4400, 10 мл шприца, иглы 22-размера, скорости введения 0,5 мл/мин получали 500 мг агрегатов частиц pHEMA с составом 20/80, 40/60 и 60/40: 170 нм и 75 нм частиц pHEMA, содержащих или 10 мг FITC-BSA, или 10 мг FITC-Dex. Шесть и восемь десятых миллилитров смесей дисперсий частиц pHEMA 74 мг/мл (170 нм или 75 нм) комбинировали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре. Скорость высвобождения макромолекул, меченных FITC, определяли с использованием анализа UV-Vis, и концентрации определяли, как описано выше. Результаты показаны на фиг. 27 и 28.
FITC-BSA показал различия в профиле высвобождения относительно трех смесей частиц, используемых для получения агрегатов. Относительные скорости высвобождения для таких макромолекул составляют, в нисходящем порядке, 20/80>40/60>60/40. Скорость высвобождения FITC-BSA из агрегата, состоящего из 60/40 смеси частиц pHEMA 170 нм и 75 нм, более медленная, чем таковая, наблюдаемая для агрегатов частиц pHEMA, полученных с использованием одного размера частиц, как показано на фиг. 14 (т.е. 175 нм частиц). Кроме того, пиковое высвобождение в течение первых шести часов было меньше и профиль высвобождения был более медленный из агрегатов, состоящих из смеси частиц 170 нм и 75 нм, чем пиковое высвобождение и профили высвобождения из агрегатов, полученных с использованием смеси частиц 475 и 175 нм и смеси частиц 500 и 265 нм, показанных на фиг. 19 и 20 соответственно. Подобным образом, FITC-Dex проявляет более медленное пиковое высвобождение (Таблица 11) и более медленный профиль высвобождения из агрегатов, состоящих из смеси относительно мелкого размера частиц по сравнению с агрегатами, полученными с использованием смесей более крупных частиц. Однако скорость высвобождения следует различной тенденции по отношению к массовым соотношениям композиций относительных размеров, используемых в получении инъекционных дисперсий, чем ранее (Пример 29).
Пример 32: Высвобождение макромолекул из агрегатов частиц pHEMA, содержащих полиэтиленгликоль 400
Агрегаты частиц pHEMA получали с 20 мас.% полиэтиленгликоля 400 в дисперсиях частиц перед введением. Частицы получали с использованием поверхностно-активного вещества SDS, как описано ранее. С использованием шприцевого насоса Harvard Model 4400, 10 мл шприца, иглы 16-размера, скорости введения 0,5 мл/мин получали 500 мг агрегатов частиц pHEMA, состоящих из 20/80, 40/60 и 60/40 170 нм и 75 нм частиц pHEMA, содержащих или 10 мг FITC-BSA, или 10 мг FITC-Dex и 100 мг полиэтиленгликоля 400. Шесть и восемь десятых миллилитра смесей дисперсии частиц pHEMA 74 мг/мл (170 нм или 75 нм) комбинировали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и полиэтиленгликоля 400, и дисперсию вводили в PBS при комнатной температуре. Скорость высвобождения макромолекул, меченных FITC, определяли с использованием анализа UV-VIS, и концентрации определяли, как описано выше. Результаты показаны на фиг. 27 и 28.
Агрегаты, содержащие полиэтиленгликоль, показали гораздо меньшее пиковое высвобождение FITC-BSA и FITC Dex (<12%) в течение первых шести часов по сравнению с другими агрегатами, содержащими водорастворимую добавку, показанную в следующем примере. FITC-Dex высвобождался с более медленной скоростью, чем FITC-BSA. Однако очень небольшую разницу в скорости высвобождения для обоих FITC-BSA и FITC-Dex наблюдали для каждой группы агрегатов, состоящих из различных соотношений двух размеров частиц.
Пример 33: Высвобождение макромолекул из агрегатов частиц pHEMA, состоящих из 5% желатина и частиц 175 и 475 нм, полученных с использованием SDS
Агрегаты частиц pHEMA получали с использованием 5 мас.% желатина в суспензионной системе. Частицы получали с использованием поверхностно-активного вещества SDS, как описано ранее. Пять миллилитров смеси дисперсий частиц pHEMA 100 мг/мл (475 нм или 175 нм) и 25 мг (5 мас.% желатина) комбинировали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре с фиксированной скоростью. Скорость высвобождения и концентрации макромолекул, меченных FITC, определяли, как описано выше. Результаты показаны на фиг. 30 и 31.
Агрегат, содержащий водорастворимый желатин, давал большое пиковое высвобождение FITC-BSA (>45%) в первые пять часов. FITC-Dex высвобождался с более медленной скоростью, чем FITC-BSA, однако скорость высвобождения FITC-Dex была гораздо быстрее, чем наблюдаемая у агрегатов, которые не содержали водорастворимых добавок.
Пример 34: Высвобождение макромолекул из частично разлагаемых агрегатов, состоящих из частиц 175 и 475 нм, полученных с использованием SDS
Получали агрегаты, состоящие из смеси 95% частиц pHEMA и 5% pHEMA/pMAA. MAA ионизируется при физиологическом pH, и заряженные частицы отталкивались друг от друга и отделялись от агрегата с течением времени. Скорость частичного разложения является функцией количества ионизирующих групп, присутствующих в агрегате. Во время частичного разложения агрегат становится более пористым, что действует на скорость высвобождения захваченной макромолекулы. Частицы получали с использованием поверхностно-активного вещества SDS, как описано ранее. Пять миллилитров смеси дисперсий частиц pHEMA 100 мг/мл комбинировали с предварительно взвешенной аликвотой макромолекулы, меченной FITC, и дисперсию вводили в PBS при комнатной температуре с фиксированной скоростью. Скорость высвобождения и концентрации для макромолекул, меченных FITG, определяли, как описано выше. Результаты показаны на фиг. 32 и 33.
И FITC-BSA и FITC-Dex проявляли более быстрые профили высвобождения из частично разлагаемых агрегатов, чем из неразлагаемых агрегатов. Также, FITC-Dex высвобождался с более медленной скоростью из-за его размера. Все профили высвобождения для обоих FITC-BSA и FITC-Dex проявляли кинетику высвобождения псевдонулевого порядка.
Пример 35: Эффективность нагрузки и пиковое высвобождение из макромолекул, включенных с агрегаты частиц, как функция состава агрегата
Изменения композиции дисперсий частиц влияет на то, как макромолекулы впоследствии высвобождаются из образованных в дальнейшем агрегатов. Было обнаружено, что скорость высвобождения макромолекул из агрегатов частиц зависит от размера макромолекулы, размера частиц перед образованием агрегатов, размера частиц, используемых в получении, присутствия добавок, которые изменяют пористость агрегата, поверхностно-активного вещества, присутствующего в дисперсии перед введением, так как оно влияет на скорость, с которой образуется агрегат, и является ли агрегат разлагаемым. Каждый из вышеуказанных параметров и любая их комбинация будет оказывать значительный вклад на высвобождение таких веществ. Таблица 11 суммирует результаты предшествующих примеров.
Таблица 11 показывает сравнение относительной эффективности нагрузки, наблюдаемой с различными агрегатами частиц pHEMA, а также исходное пиковое высвобождение в течение первых 6 часов. В общем, более крупные макромолекулы проявляют корреляцию между размером и профилем высвобождения для заданных систем относительно размеров частиц, используемых в исследовании. Было обнаружено, что FITC-BSA высвобождается быстрее из агрегатов, полученных с использованием различных размеров частиц, и это показывает, что для соединений с более низкой молекулярной массой должны использоваться более мелкие частицы для достижения более длительных профилей высвобождения.
ЗАКЛЮЧЕНИЕ
Специалист в области техники понимает, что тогда как описаны специфические варианты осуществления и примеры, могут быть сделаны различные модификации и изменения без отклонения от рамок настоящего изобретения.
Например, очевидно, что настоящее изобретение относится к способам получения сохраняющих форму агрегатов и к применению образованных таким образом агрегатов. Способы включают комплексные взаимодействия широкого множества факторов, которые могут влиять на химические и физические характеристики образующихся сохраняющих форму агрегатов. В добавление к таким факторам, широко обсуждаемым в настоящем описании, другие такие факторы могут быть очевидны специалисту в области техники на основании настоящего описания. Применение таких дополнительных факторов, вариантов факторов и комбинаций факторов находятся в рамках настоящего изобретения.
Подобным образом способы по настоящему изобретению будут иметь широкое множество применений. Тогда как ряд таких применений описаны выше, другие применения будут очевидны специалисту в области техники на основании настоящего описания. Все такие применения, которые включают способы по настоящему изобретению для получения сохраняющего форму гелеобразного агрегата, находятся в рамках настоящего изобретения.
Другие варианты осуществления содержатся в следующей формуле изобретения.
Реферат
Изобретение относится к области медицины, более конкретно к способу получения сохраняющих форму агрегатов частиц геля, в котором агрегаты удерживаются вместе физическими силами нековалентных связей, такими как гидрофобно-гидрофильные взаимодействия и водородные связи. Способ получения сохраняющих форму агрегатов частиц геля включает введение предварительно полученной суспензии частиц геля в полярной жидкости, где частицы геля имеют абсолютный электрохимический потенциал, в получающую среду, в которой абсолютный электрохимический потенциал частиц геля снижается, приводя к слиянию частиц геля в сохраняющий форму агрегат. Изобретение позволяет получать сохраняющие форму агрегаты геля in situ так, что форма агрегата определяется местом нанесения. 48 з.п. ф-лы, 11 табл., 33 ил.
Формула
получение суспензионной системы, включающей множество частиц геля, имеющих средний диаметр от около 10 до около 800 нм, где частицы геля имеют первый абсолютный электрохимический потенциал и получены в полимеризационной системе путем добавления от 0,1 до 10 мол.% поверхностно-активного вещества к мономеру или двум или более различным мономерам, где мономер(ы) выбраны из группы, состоящей из 2-алкеновой кислоты, гидрокси(2С-4С)алкил 2-алкеноата, гидрокси(2С-4С)алкокси(2С-4С)алкил 2-алкеноата, (1С-4С)алкокси(2С-4С)алкокси(2С-4С)алкил 2-алкеноата и вицинилэпокси(1С-4С)алкил 2-алкеноата и комбинации двух или более из них, в полярной жидкости или смеси полярных жидкостей, где полярная жидкость или по меньшей мере одна или более полярных жидкостей включают одну или более гидроксигрупп; и,
введение суспензионной системы в получающую среду, где после введения частицы геля приобретают второй абсолютный электрохимический потенциал, который меньше (ближе к нулю), чем первый абсолютный электрохимический потенциал, вследствие чего частицы геля сливаются в сохраняющий форму агрегат, удерживаемый вместе физическими силами нековалентной связи, включающими гидрофобно-гидрофильные взаимодействия и водородные связи.
добавление одного или более первого рабочего веществ(а) к полимеризующей системе для получения жидкости, содержащей первое рабочее вещество, где:
после полимеризации часть жидкости, содержащей первое рабочее вещество, захватывается частицами геля;
добавление одного или более второго рабочего веществ(а) к суспензионной системе для получения жидкости, содержащей второе рабочее вещество, где:
после образования сохраняющего форму агрегата жидкость, содержащая второе рабочее вещество, захватывается сохраняющим форму агрегатом, где:
первое рабочее вещество(а) может быть одинаковым или отличаться от второго рабочего веществ(а) и жидкая часть жидкости, содержащей первое рабочее вещество, может быть такой же или отличаться от жидкой части жидкости, содержащей второе рабочее вещество(а).
от 0,1 до 90 мас.% жидкости(ей), содержащей первое рабочее вещество(а), поглощено множеством частиц гидрогеля и
от 0,1 до 90 мас.% жидкости(ей), содержащей второе рабочее вещество(а), улавливается сохраняющим форму агрегатом.

Комментарии