Частицы, конъюгированные с пептидом - RU2685186C2
Код документа: RU2685186C2
Чертежи









































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































Описание
Настоящее изобретение выполнено при государственной поддержке, грант R01 EB013198 Национальных институтов здравоохранения. Государство имеет определенные права на настоящее изобретение.
Смежные заявки
Изобретение испрашивает приоритет по предварительной заявке на патент США №61/865,389, поданной 13 августа 2013 г., предварительной заявке на патент США №61/869,279, поданной 23 августа 2013 г., и предварительной заявке на патент США №61/887,112, поданной 4 октября 2013 г. Настоящая заявка также связана с заявкой на договор о патентной кооперации (PCT) №PCT/US2013/047079, поданной 21 июня 2013 г., которая испрашивает приоритет по предварительной заявке на патент США №61/662,687, поданной 21 июня 2012 г. Содержание каждого из этих документов полностью включено в настоящий документ путем ссылки.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
Содержание текстового файла, поданного в электронном виде, полностью включено в настоящий документ путем ссылки: экземпляр списка последовательностей в машиночитаемом формате (имя файла: COUR-002_01US_Seqlist.txt, дата записи: 13 августа 2013 г., размер файла 1,17 Мбайт).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Воспалительные заболевания и расстройства представляют собой состояния, при которых патологический или иной нерегулируемый воспалительный ответ вносит свой вклад в этиологию или тяжесть заболевания. Примеры включают в себя аутоиммунные заболевания, такие как диабет I типа и целиакия.
Многие из этих заболеваний характеризуются инфильтрацией мононуклеарных клеток в месте повреждения ткани или иной травмы. Примеры мононуклеарных клеток, обнаруженных в этих инфильтратах, включают в себя лимфоциты, в частности Т-лимфоциты, и клетки системы мононуклеарных фагоцитов (клетки MPS), такие как моноциты, макрофаги, дендритные клетки, клетки микроглии и другие.
Многие из клеток, обнаруженных в инфильтратах мононуклеарных клеток, возможно, участвуют в этих патологических воспалительных ответах. Например, известно, что при заболеваниях, таких как рассеянный склероз, Т-клетки CD4+играют центральную роль в патологическом аутоиммунном ответе. На более раннем этапе активации Т-клеток дендритные клетки и другие клетки MPS могут быть ответственны за активацию Т-клеток CD4+. Клетки MPS также могут стимулировать воспаление посредством фагоцитоза, хотя по отношению к по меньшей мере некоторым воспалительным заболеваниям остается неясным, способны ли такие клетки вносить вклад в воспаление в отсутствие Т-клеток CD4+.
Моноциты периферической крови можно отнести к одной из двух групп в зависимости от того, экспрессируются ли определенные молекулы на поверхности клеток или нет. В частности, считается, что «резидентные моноциты» или «зрелые моноциты» человека имеют фенотип CD14loCD16+(мышиный аналог - CX3CR1hiCCR2-Gr1-). Считается, что другая группа клеток, «воспалительные моноциты» или «незрелые моноциты», имеет фенотип CD14+CD16- (мышиный аналог - CX3CR1loCCR2+Gr1+) (Geissmann F. et al. 2003 Immunity 19: 71–82).
Важно, что, хотя последние считаются «воспалительными» в том смысле, что наблюдается их миграция в воспаленную ткань из периферических кровяных клеток костномозгового происхождения, не показано, что они вызывают воспаление напрямую или через воздействие на другие клетки. Для различных клеток MPS, которые могут образовываться при дифференцировке этих клеток, также дополнительно не показано, что они вызывают воспаление.
Традиционные клинические стратегии долговременной иммунной супрессии при расстройствах, связанных с нежелательным иммунным ответом, основаны на длительном введении иммуносупрессорных лекарственных средств широкого спектра действия, например блокаторов сигнала 1, таких как циклоспорин A (CsA), FK506 (такролимус) и кортикостероиды. Длительное применение высоких доз таких лекарственных средств может приводить к токсическим побочным эффектам. Более того, даже у пациентов, способных переносить эти лекарственные средства, необходимость пожизненной терапии иммуносупрессорными лекарственными средствами связана с существенной опасностью тяжелых побочных эффектов, включая опухоли, серьезные инфекции, нефротоксичность и метаболические расстройства.
Разработаны способы индукции антиген-специфической толерантности, включающие связывание с клетками антигена или пептида. Например, в одном способе индуцированная пептидом клеточная толерантность включала сбор, выделение и обработку клеток периферической крови специфичными для заболевания аутоантигенами и связующим реагентом этиленкарбодиимидом (ECDI) в стерильных условиях с последующим обратным введением донору/пациенту. Этот процесс является дорогостоящим, должен проводиться в жестко контролируемых условиях опытными медработниками и ограничен количеством центров, способных проводить такую процедуру. Использование эритроцитов крови в качестве донорского типа клеток расширяет возможные источники и включает сюда аллогенных доноров, что значительно увеличивает обеспечение исходными клетками и потенциально расширяет сферу предоставления такого лечения до любых учреждений, сертифицированных для переливания крови. Такие подходы имеют существенные ограничения в плане обеспечения исходными клетками и обязательной гистосовместимости для сведения к минимуму иммунного ответа на донорские клетки. Кроме того, местная обработка клеток для присоединения аутоантигенов посредством EDCI создает существенную проблему для контроля качества. Более того, для таких подходов также необходимы по меньшей мере некоторые знания патологического антигена, для которого нужно выработать толерантность.
В последнее время были описаны связанные с пептидом частицы, которые устраняют необходимость в запасе исходных клеток и обходят требование гистосовместимости, характерное для предыдущих подходов, см. WO 2010/085509, полностью включенную в настоящий документ путем ссылки. Однако использование антигенов, связанных с наружной поверхностью частиц, ассоциируется с повышенной анафилактической реакцией и создает существенные проблемы в плане химического взаимодействия, производства и контроля. Неожиданно было обнаружено, что этих неблагоприятных явлений можно избежать в том случае, когда антиген инкапсулирован внутрь частицы. Еще более неожиданно было то, что размер и заряд частиц можно изменять, улучшая толерантность к определенным антигенам.
Антиген-специфическая толерантность обычно не является идеальной, поскольку в заболеваниях человека конкретные эпитопы/антигены по существу неизвестны. Более того, антигены у разных субъектов могут слишком варьироваться, чтобы антиген-специфический подход был эффективен, и, следовательно, было бы необходимо определять, какие антигены будут обнаруживаться у конкретного пациента, или потребовалось бы перед введением соединять с частицами библиотеку возможных пептидов. Синтез и индивидуальное связывание таких пептидов требует времени и является дорогостоящим. Следовательно, существует потребность в терапии, решающей эти проблемы и таким образом устраняющей необходимость в источнике гистосовместимых клеток.
Изложение сущности изобретения
В некоторых вариантах осуществления в настоящем изобретении предложены композиции (например, для индукции антиген-специфической толерантности), содержащие частицу-носитель (например, PLG-частицу), соединенную с антигенным пептидом. В определенных вариантах осуществления частица-носитель представляет собой частицу сополимера лактида и гликолида (PLG). В других вариантах осуществления частица-носитель представляет собой стабилизированную при помощи PLURIONICS® частицу полипропиленсульфида.
В некоторых вариантах осуществления в настоящем изобретении предложены композиции, содержащие антиген, связанный с частицей-носителем, обладающей отрицательным дзета-потенциалом. В некоторых вариантах осуществления дзета-потенциал частицы составляет от около -100 мВ до около 0 мВ. В некоторых вариантах осуществления дзета-потенциал частицы составляет от около -50 мВ до около -40 мВ. В некоторых вариантах осуществления частица представляет собой сополимер, имеющий молярное соотношение от около 50:50, 80:20 до около 100:0. В некоторых вариантах осуществления соотношение сополимеров может составлять, без ограничений, полистирол: поли(винилкарбоксилат)/80:20, полистирол: поли(винилкарбоксилат)/90:10, поли(винилкарбоксилат): полистирол/80:20, поли(винилкарбоксилат): полистирол/90:10, полимолочная кислота: полигликолевая кислота/80:20, полимолочная кислота: полигликолевая кислота/90: 10 или полимолочная кислота: полигликолевая кислота/50: 50. В других вариантах осуществления частица представляет собой частицу полистирола, частицу карбоксилированного полистирола, частицу стабилизированного при помощи PLURIONICS® пропиленсульфида или частицу сополимера молочной и гликолевой кислот.В некоторых вариантах осуществления частица представляет собой частицу сополимера молочной и гликолевой кислот.
В некоторых вариантах осуществления средний диаметр частицы составляет от около 0,1 мкм до около 10 мкм. В некоторых вариантах осуществления средний диаметр частицы составляет от 0,2 мкм до приблизительно 2 мкм. В некоторых вариантах осуществления диаметр частицы составляет от около 0,3 мкм до около 5 мкм. В некоторых вариантах осуществления диаметр частицы составляет от около 0,5 мкм до около 3 мкм. В некоторых вариантах осуществления диаметр частицы составляет от около 0,5 мкм до около 1 мкм. В некоторых вариантах осуществления диаметр частицы составляет около 0,5 мкм.
В дополнительных вариантах осуществления антиген содержит по меньшей мере часть аутоиммунного антигена, антигена, экспрессированного на ткани для трансплантации субъекту, фермента или аллергена. В некоторых вариантах осуществления антиген содержит по меньшей мере часть основного белка миелина, ацетилхолинового рецептора, эндогенного антигена, миелин-олигодендроцитарного гликопротеина, антигена бета-клеток поджелудочной железы, инсулина, проинсулина, специфичного для островков белка, связанного с каталитической субъединицей глюкозо-6-фосфатазы (IGRP), глутаматдекарбоксилазы (GAD), коллагена 11 типа, gp39 человеческого хряща, fp130-RAPS, протеолипидного белка, фибрилларина, малого ядрышкового белка, рецептора тиреотропного фактора, гистонов, гликопротеина gp70, пируватдегидрогеназа-дигидролипоамидацетилтрансферазы (PCD-E2), антигена волосяных фолликулов, аквапорина 4, десмоглеина 1, десмоглеина 3, никотинового ацетилхолинового рецептора, A-глиадина и человеческого тропомиозина изоформы 5, пыльцы гречки заметной (BaGP), аллергена персика Pru p 3, аллергена молока альфа-s1-казеина, аллергена сельдерея Api g 1, аллергена бразильского ореха Bere1, аллергена молока B-лактоглобулина, бычьего сывороточного альбумина, аллергена фундука Cor a 1.04, аллергена яиц овальбумина, антигемофилического фактора, адвата, когената, элоктата, слитного белка рекомбинантного фактора VIII и Fc, рефакто, Novo VIIa, рекомбинантного фактора VII, эптакога альфа, геликсата, монанина, фактора коагуляции IX, вилата, цередазы, аглюцеразы, церезима, имиглюцеразы, Elelso, талиглюцеразы альфа, фабразима, агалсидазы бета, альдуразима, альфа-L-идуронидазы, миозима, кислой глюкозидазы, элапразы, идуронат-2-сульфатазы, наглазим арилсульфатазы B или N-ацетилгалактозамин-4-сульфатазы, белковых препаратов, использованных при замене фермента или фактора коагуляции, например миозима, аглюцеразы, имиглюцеразы, талиглюцеразы, агалзидазы бета, L-идуронидазы, кислой глюкозидазы, идуронат-2-сульфатазы, N-ацетилгалактозамин-4-сульфатазы, антигемофилического фактора, фактора VII, эптакога альфа, фактора IX, миглустата, ромипластима, эпотетина альфа, белка C, ларонидазы, люмизима или фактора VIII.
В дополнительных вариантах осуществления антиген содержит аутоиммунный антиген, антиген, экспрессированный на ткани для трансплантации субъекту, фермент или аллерген. В не имеющих ограничительного характера вариантах осуществления антиген содержит, например, основной белок миелина, ацетилхолиновый рецептор, эндогенный антиген, миелин-олигодендроцитарный гликопротеин, антиген бета-клеток поджелудочной железы, инсулин, глутаматдекарбоксилазу (GAD), коллаген 11 типа, gp39 человеческого хряща, fp130-RAPS, протеолипидный белок фибрилларин, малый ядрышковый белок, рецептор тиреотропного фактора, гистоны, гликопротеин gp70, пируватдегидрогеназа-дегидролипоамидацетилтрансферазу (PCD-E2), антиген волосяных фолликулов, аквапорин 4, десмоглеин 1, десмоглеин 3, никотиновый ацетилхолиновый рецептор, A-глиадин и человеческий тропомиозин изоформы 5, пыльцу гречки заметной (BaGP), аллерген персика Pru p 3, аллерген молока альфа-s1-казеин, аллерген сельдерея Api g 1, аллерген бразильского ореха Bere1, аллерген молока B-лактоглобулин, бычий сывороточный альбумин, аллерген фундука Cor a 1.04, инсулин, проинсулин, специфичный для островков белок, связанный с каталитической субъединицей глюкозо-6-фосфатазы (IGRP), аллерген яиц овальбумин, белковые препараты, использованные при замене фермента или фактора коагуляции, например миозима, аглюцеразы, имиглюцеразы, талиглюцеразы, агалзидазы бета, L-идуронидазы, кислой глюкозидазы, идуронат-2-сульфатазы, N-ацетилгалактозамин-4-сульфатазы, антигемофилического фактора, фактора VII, эптакога альфа, фактора IX, миглустата, ромипластима, эпотетина альфа, белка C, ларонидазы, люмизима или фактора VIII.
В дополнительных вариантах осуществления частицы связаны с антигеном, содержащим один или более эпитопов. В дополнительном варианте осуществления эпитоп связан с аллергией, аутоиммунным заболеванием, ферментом, используемым в ферментозаместительной терапии, болезнью лизосомального накопления или воспалительным заболеванием или расстройством. В одном варианте осуществления эпитоп связан с диабетом I типа, рассеянным склерозом, системной волчанкой, оптиконевромиелитом, идиопатической тромбоцитопенической пурпурой, тромботической тромбоцитопенической пурпурой, мембранной нефропатией, буллезным пемфигоидом, пемфигус вульгарис, миастенией гравис, болезнью накопления мукополисахарида, ганглиозидозом, щелочной гипофосфатазией, болезнью накопления холестериновых эфиров, гиперурикемией, дефицитом гормона роста, почечной анемией, болезнью Гоше, болезнью Фабри, болезнью Гурлера, болезнью Хантера, болезнью Марото - Лами, гемофилией A, гемофилией B, болезнью фон Виллебранда, венозным тромбозом, пурпурой фульминанс, мукополисахаридозом VI, болезнью Помпе, целиакией или воспалительным заболеванием кишечника, включая болезнь Крона или колит, например язвенный колит.В дополнительном варианте осуществления эпитопы находятся в белковых терапевтических средствах, используемых при замещении ферментов или факторов коагуляции, таких как миозим, аглюцераза, имиглюцераза, талиглюцераза, агалзидаза бета, L-идуронидаза, кислая глюкозидаза, идуронат-2-сульфатаза, N-ацетилгалактозамин-4-сульфатаза, антигемофилический фактор, фактор VII, эптаког альфа, фактор IX, миглустат, ромипластим, эпотетин альфа, белок C, ларонидаза, лумизим, фактор VIII. В дополнительном варианте осуществления эпитоп представляет собой эпитоп, описанный в таблице 2 или 3. В одном варианте осуществления частицы соединены с антигенами, содержащими только один эпитоп, связанный с одним заболеванием и/или расстройством. В дополнительном варианте осуществления антигены содержат более одного эпитопа, которые связаны с одним и тем же заболеванием и/или расстройством. В дополнительном варианте осуществления антигены содержат более одного эпитопа, которые связаны с разными заболеваниями и/или расстройствами.
В некоторых вариантах осуществления антиген связан с упомянутой частицей конъюгатной молекулой. В некоторых вариантах осуществления антиген связан с упомянутой частицей линкером. В некоторых вариантах осуществления конъюгатная молекула представляет собой этиленкарбодиимид (ECDI). В определенных вариантах осуществления антиген связан с комплексом стрептавидин-биотин. В некоторых вариантах осуществления линкеры включают в себя, без ограничений, различные бифункциональные агенты для соединения белков, такие как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (таких как диметиладипимидат HCL), активных сложных эфиров (таких как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидные соединения (такие как бис-(п-азидобензоил)гександиамид), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и соединения с двумя активными фторными группами (такие как 1,5-дифтор-2,4-динитробензол). Конкретные соединительные агенты включают в себя N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP), образующие дисульфидную связь.
В некоторых вариантах осуществления антиген связан с наружной поверхностью частицы, обладающей отрицательным дзета-потенциалом. В некоторых вариантах осуществления антиген инкапсулируется в частицу, обладающую отрицательным дзета-потенциалом. В некоторых вариантах осуществления частица является биоразлагаемой. В некоторых вариантах осуществления частица является поверхностно-функционализированной. В некоторых вариантах осуществления частица является карбоксилатной поверхностно-функционализированной.
В некоторых вариантах осуществления настоящего изобретения предложены способы индукции у субъекта антиген-специфической толерантности, включающие введение упомянутому субъекту эффективного количества композиции, содержащей связанную с антигеном частицу, причем упомянутая частица имеет отрицательный дзета-потенциал, и при этом упомянутая частица и антиген индуцируют толерантность к упомянутому антигену у упомянутого субъекта. В некоторых вариантах осуществления введение выполняют с целью лечения или предотвращения заболевания или состояния. В некоторых вариантах осуществления введение проводят до или после начала заболевания или состояния, вызванного упомянутым антигеном. В некоторых вариантах осуществления заболевание или состояние выбирают из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания, аллергии, отторжения трансплантата, болезни лизосомального накопления, ферментативной недостаточности, воспалительного ответа и гипериммунного ответа. В некоторых вариантах осуществления заболевание или состояние выбирают из группы, состоящей из рассеянного склероза, диабета I типа, астмы, пищевой аллергии, аллергии на факторы окружающей среды, целиакии, воспалительного заболевания кишечника, включая болезнь Крона или язвенный колит, и состояния, вызванного упомянутым антигеном у упомянутого субъекта для уменьшения чрезмерной реакции на упомянутый антиген. В некоторых вариантах осуществления способы дополнительно включают повторение упомянутого введения упомянутой композиции упомянутому субъекту.
В дополнительном варианте осуществления введение частиц приводит к активации индуцированной гибели эффекторных Т-клеток.
В дополнительном варианте осуществления введение частиц приводит к анергии эффекторных Т-клеток.
В дополнительном варианте осуществления введение частиц приводит к апоптозу эффекторных Т-клеток.
В дополнительном варианте осуществления введение частиц приводит к превращению эффекторных Т-клеток в регуляторные Т-клетки.
В дополнительном варианте осуществления введение частиц приводит к индукции и экспансии как антиген-специфических, так и неспецифических регуляторных Т-клеток. В дополнительном варианте осуществления введение частиц приводит к выделению эффекторных Т-клеток в лимфоузлах и селезенке с ингибированием их способности к перемещению на периферию и вызову воспаления.
В дополнительном варианте осуществления введение частиц приводит к уменьшению зависимой от Т-клеток продукции антител.
В определенных вариантах осуществления в настоящем изобретении предложены способы лечения целиакии у субъекта, включающие введение упомянутому субъекту эффективного количества композиции, содержащей связанную с антигеном частицу, причем частица имеет отрицательный дзета-потенциал. В определенных вариантах осуществления антиген представляет собой глиадин или эпитоп глиадина. В некоторых вариантах осуществления антиген представляет собой один или более антигенов, которые выбирают из группы, состоящей из SEQ ID NO: 1295–1724, SEQ ID NO: 1726–1766 и SEQ ID NO: 4986–5140. В некоторых вариантах осуществления антиген представляет собой глиадин, а связанная с антигеном частица имеет средний размер после синтеза около 600–1500 нанометров и средний заряд после синтеза от около -30 до около -80 мВ. В некоторых вариантах осуществления частица имеет средний размер после синтеза около 600–1200 нанометров и средний заряд после синтеза от около -40 до около -70 мВ. В определенных вариантах осуществления частица имеет средний размер после синтеза около 600 мкм и средний заряд после синтеза около -50 мВ. В дополнительных вариантах осуществления частица представляет собой частицу полистирола, частицу карбоксилированного полистирола, частицу стабилизированного при помощи PLURIONICS пропиленсульфида или частицу сополимера молочной и гликолевой кислот.
В некоторых вариантах осуществления в настоящем изобретении предложены способы лечения диабета у субъекта, включающие введение упомянутому субъекту эффективного количества композиции, содержащей связанную с антигеном частицу, причем частица имеет отрицательный дзета-потенциал. В некоторых вариантах осуществления диабет представляет собой диабет I типа. В некоторых вариантах осуществления диабет представляет собой диабет II типа.
В некоторых вариантах осуществления антиген представляет собой инсулин, проинсулин, специфичный для островков белок, связанный с каталитической субъединицей глюкозо-6-фосфатазы (IGRP), или эпитопы, производные от инсулина, проинсулина или IGRP. В некоторых вариантах осуществления антиген представляет собой один или более антигенов, которые выбирают из группы, состоящей из ID NO: 1767–1840, SEQ ID NO: 1842–1962, SEQ ID NO: 1964–2027, SEQ ID NO: 2029–2073, SEQ ID NO: 2075–2113, SEQ ID NO: 2115–2197, SEQ ID NO: 2199–2248, SEQ ID NO: 2250–2259, SEQ ID NO: 2261–2420, SEQ ID NO: 2422–2486 и SEQ ID NO: 2489–2505. В некоторых вариантах осуществления антиген представляет собой инсулин, а связанная с антигеном частица имеет средний размер после синтеза около 300–800 нанометров и средний заряд после синтеза от около -30 до около -70 мВ. В некоторых вариантах осуществления частица имеет средний размер после синтеза около 350–600 нанометров и средний заряд после синтеза от около -40 до около -60 мВ. В некоторых вариантах осуществления частица имеет средний размер после синтеза около 500 нанометров и средний заряд после синтеза около -50 мВ. В некоторых вариантах осуществления антиген представляет собой проинсулин, а связанная с антигеном частица имеет средний размер после синтеза около 300–800 нанометров и средний заряд после синтеза от около -30 до около -70 мВ. В определенных вариантах осуществления частица имеет средний размер после синтеза около 400–600 нанометров и средний заряд после синтеза от около -40 до около -60 мВ. В некоторых вариантах осуществления частица имеет средний размер после синтеза около 570 нанометров и средний заряд после синтеза около -45 мВ. В некоторых вариантах осуществления антиген представляет собой IGRP, а связанная с антигеном частица имеет средний размер после синтеза около 300–800 нанометров и средний заряд после синтеза от около -30 до около -70 мВ. В некоторых вариантах осуществления частица имеет средний размер после синтеза около 400–700 нанометров и средний заряд после синтеза от около -40 до около -60 мВ. В некоторых вариантах осуществления частица имеет средний размер после синтеза около 600 нанометров и средний заряд после синтеза около -40 мВ. В определенных вариантах осуществления частица представляет собой частицу полистирола, частицу карбоксилированного полистирола, частицу стабилизированного при помощи PLURIONICS пропиленсульфида или частицу сополимера молочной и гликолевой кислот.
В некоторых вариантах осуществления в настоящем изобретении предложены способы лечения субъекта при помощи ферментозаместительной терапии, включающие введение упомянутому субъекту эффективного количества композиции, содержащей связанную с антигеном частицу, причем частица имеет отрицательный дзета-потенциал. В некоторых вариантах осуществления субъекта подвергают ферментозаместительной терапии для лечения заболевания, выбранного из группы, состоящей из гемофилии, гемофилии A, гемофилии B, болезни фон Виллебранда, болезни накопления мукополисахаридов, ганглиозидоза, щелочной гипофосфатазии, болезни накопления холестериновых эфиров, гиперурикемии, дефицита гормона роста, почечной анемии, болезни Гоше, болезни Фабри, болезни Гурлера, болезни Помпе, болезни Хантера и болезни Марото - Лами. В некоторых вариантах осуществления связанная с антигеном частица содержит один или более ферментов, которые выбирают из группы, состоящей из адвата, антигемофилического фактора, когената, элоктата, слитного белка рекомбинантного фактора VIII и Fc, рефакто, Novo VIIa, рекомбинантного фактора VII, эптакога альфа, геликсата, монанина, фактора коагуляции IX, вилата, цередазы, аглюцеразы, церезима, имиглюцеразы, Elelso, талиглюцеразы альфа, фабразима, агалсидазы бета, альдуразима, альфа-L-идуронидазы, миозима, кислой глюкозидазы, элапразы, идуронат-2-сульфатазы, наглазим арилсульфатазы B и N-ацетилгалактозамин-4-сульфатазы. В некоторых вариантах осуществления частица представляет собой частицу полистирола, частицу карбоксилированного полистирола, частицу стабилизированного при помощи PLURIONICS пропиленсульфида или частицу сополимера молочной и гликолевой кислот.В определенных вариантах осуществления частица представляет собой сополимер, имеющий молярное соотношение от около 80: 20 до около 100: 0. В определенных вариантах осуществления частица представляет собой частицу полистирола, частицу карбоксилированного полистирола, частицу стабилизированного при помощи PLURIONICS пропиленсульфида или частицу сополимера молочной и гликолевой кислот.В других вариантах осуществления частица представляет собой частицу сополимера молочной и гликолевой кислот с соотношением полимолочная кислота: полигликолевая кислота в сополимере около 50: 50. В некоторых вариантах осуществления частица представляет собой частицу сополимера молочной и гликолевой кислот с соотношением полимолочная кислота: полигликолевая кислота в сополимере около 50: 50.
В дополнительном варианте осуществления введение частиц изобретения предотвращает накопление у субъекта нейтрофилов и других гранулоцитов. В дополнительном варианте осуществления частицы изобретения вводят субъекту с раковым заболеванием.
В одном варианте осуществления введение частиц изобретения усиливает регенерацию поврежденной ткани. В дополнительном варианте осуществления частицы усиливают регенерацию эпителиальных клеток. В другом дополнительном варианте осуществления частицы усиливают ремиелинизацию нейронов. В другом варианте осуществления у субъекта имеется аутоиммунное заболевание. В еще одном варианте осуществления у субъекта имеется воспалительное заболевание кишечника, включая язвенный колит и/или болезнь Крона. В еще одном варианте осуществления у субъекта имеется рассеянный склероз.
В некоторых вариантах осуществления композицию вводят внутривенно. В некоторых вариантах осуществления композицию вводят подкожно, перорально, внутримышечно, в лимфатические узлы, внутрипортально или в виде аэрозоля. В одном варианте осуществления введение отрицательно заряженных частиц индуцирует антиген-специфическую толерантность у субъекта. В одном варианте осуществления частицы, индуцирующие антиген-специфическую толерантность, содержат один или более эпитопов, связанных с аллергией, аутоиммунным заболеванием и/или воспалительным заболеванием. В одном варианте осуществления эпитопы выбирают из описанных в таблице 2 или 3. В одном варианте осуществления отрицательно заряженные частицы представляют собой частицы полистирола, алмаза, стабилизированного при помощи PLURONICS® полипропиленсульфида или сополимера молочной и гликолевой кислот. В одном варианте осуществления частицы карбоксилированы. В одном варианте осуществления дзета-потенциал частиц составляет менее чем приблизительно -100 мВ. В одном варианте осуществления дзета-потенциал частиц находится в диапазоне от около -75 мВ до 0 мВ, например от -50 мВ до 0 мВ, или от -100 мВ до -50 мВ, или от -75 мВ до -50 мВ, или от -50 мВ до -40 мВ. В одном варианте осуществления средний диаметр частиц составляет от около 0,1 мкм до около 10 мкм, например от около 0,2 мкм до около 2 мкм, или от около 0,3 мкм до около 5 мкм, или от около 0,5 мкм до около 3 мкм, или от около 0,5 мкм до около 1 мкм.
В одном варианте осуществления у субъекта имеется аутоиммунное заболевание. В одном варианте осуществления аутоиммунное заболевание представляет собой рассеянный склероз, склеродермию, диабет I типа, ревматоидный артрит, тиреоидит, системную красную волчанку, синдром Рейно, синдром Шегрена, аутоиммунный увеит, аутоиммунный миокардит, воспалительное заболевание кишечника, боковой амиотрофический склероз (БАС), системную волчанку, оптиконевромиелит, идиопатическую тромбоцитопеническую пурпуру, тромботический тромбоцитопеническую пурпуру, мембранную нефропатию, буллезный пемфигоид, пемфигус вульгарис, миастению гравис, целиакию, язвенный колит или болезнь Крона. В одном варианте осуществления частица содержит полноразмерный полипептид или его фрагмент. В одном варианте осуществления частица содержит один или более эпитопов основного белка миелина. В одном варианте осуществления эпитоп основного белка миелина взят из SEQ ID NO: 4975 или SEQ ID NO: 4976. В одном варианте осуществления частицы содержат один или более эпитопов миелин-олигодендроцитарного гликопротеина. В одном варианте осуществления эпитоп миелин-олигодендроцитарного гликопротеина взят из SEQ ID NO: 1 или SEQ ID NO: 4978. В одном варианте осуществления частица содержит один или более инсулиновых эпитопов. В одном варианте осуществления один или более инсулиновых эпитопов взят из SEQ ID NO: 4981. В одном варианте осуществления частица содержит один или более эпитопов глутаматдекарбоксилазы. В одном варианте осуществления один или более эпитоп глутаматдекарбоксилазы взят из SEQ ID NO: 4982. В одном варианте осуществления частица содержит один или более эпитопов протеолипидного белка. В одном варианте осуществления эпитоп протеолипидного белка взят из SEQ ID NO: 4977. В одном варианте осуществления частица содержит один или более эпитопов глиадина. В одном варианте осуществления эпитопы глиадина содержат SEQ ID NO: 4983–4985.
В некоторых вариантах осуществления в настоящем изобретении дополнительно предложен способ получения иммуномодифицированной частицы с отрицательным дзета-потенциалом, включающий этап, на котором обеспечивают взаимодействие предшественника иммуномодифицированной частицы с буферным раствором в условиях, способствующих образованию иммуномодифицированной частицы с отрицательным дзета-потенциалом. В некоторых вариантах осуществления предшественник иммуномодифицированной частицы получают путем сополимеризации. В некоторых вариантах осуществления буферный раствор имеет щелочной pH. В некоторых вариантах осуществления буферный раствор представляет собой бикарбонат натрия, бикарбонат калия, бикарбонат лития, дигидрофосфат калия, дигидрофосфат натрия или дигидрофосфат лития.
В некоторых вариантах осуществления в настоящем изобретении предложена композиция, содержащая антиген, инкапсулированный внутрь ядра поверхностно-функционализированной липосомы. В дополнительном варианте осуществления липосома содержит фосфатидилхолин: фосфатидилглицерин: холестерин в соотношении 30: 30: 40. В еще одном дополнительном варианте осуществления упомянутый антиген содержит аутоиммунный антиген, антиген, экспрессированный на ткани для трансплантации субъекту, или аллерген. В некоторых вариантах осуществления частица представляет собой частицу сополимера молочной и гликолевой кислот с соотношением полимолочная кислота: полигликолевая кислота в сополимере около 50: 50. В некоторых вариантах осуществления частицы содержат PEMA. В некоторых вариантах осуществления PEMA присутствует в концентрации от около 0,1% до около 2,0%.
Краткое описание рисунков
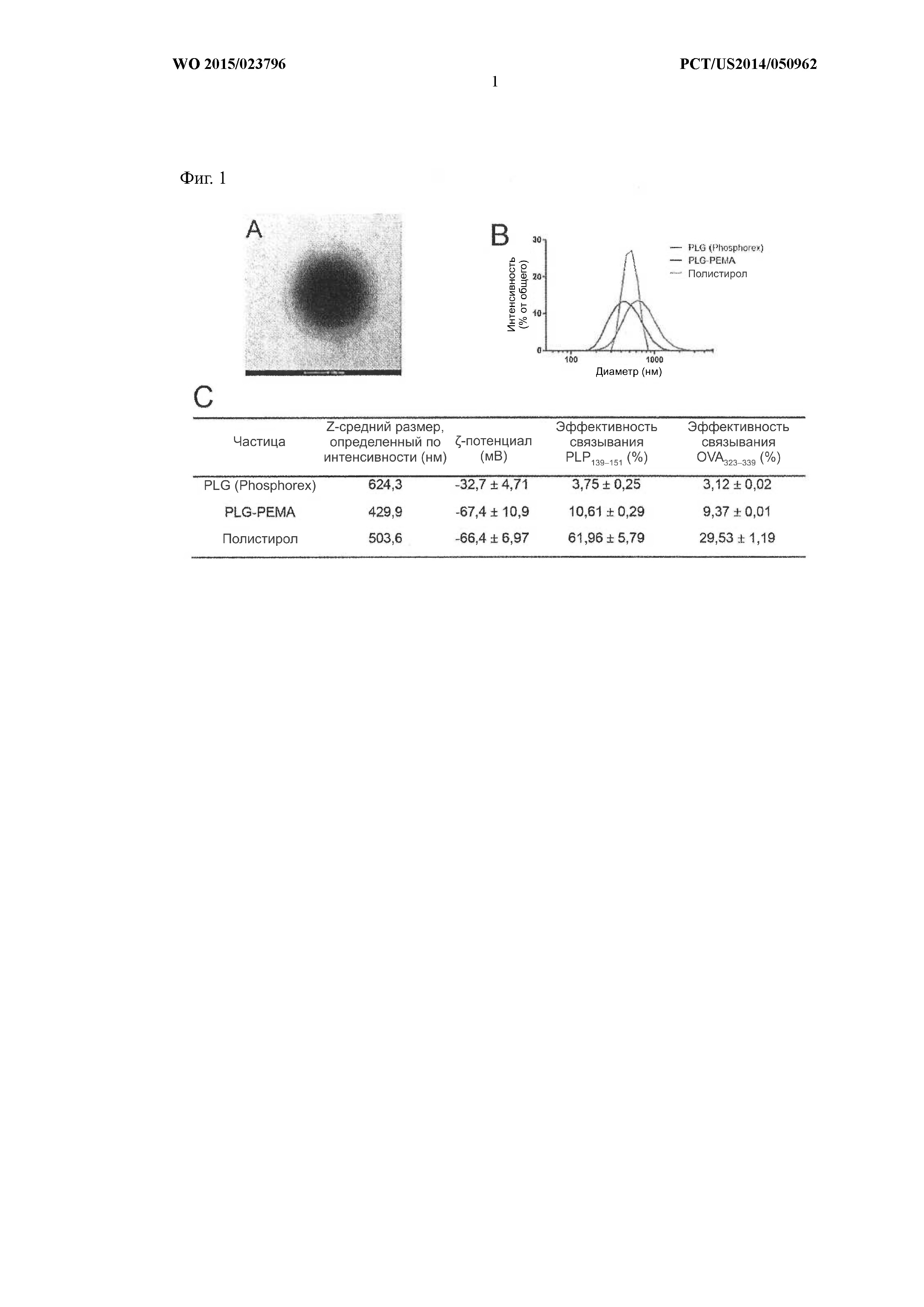
На Фиг.1 показан (A) микрофаг частицы сополимера лактида и гликолида (PLG). B и C демонстрируют характеризацию частиц сополимера лактида и гликолида с функционализированной поверхностью при помощи динамического рассеяния света, включая анализ распределения размеров частиц, среднего размера (нм), ζ-потенциала (мВ) и эффективности связывания пептида (%) OVA323–339 и PLP139–151 с частицами PLG-PEMA. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 2,5 x 105 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида варьировалась в пределах 5–15% на партию, но по существу имела Z-средний диаметр 567 нм, максимальный диаметр 670 нм и коэффициент полидисперсности 0,209.
На Фиг.2 показано, что PLG-наночастицы индуцируют антиген-специфическую толерантность. Иммунодоминантный эпитоп протеолипидного белка PLP139–151 (PLG-PLP139–151) использовали для индукции толерантности с целью предотвращения рецидива экспериментального аутоиммунного энцефалита (R-EAE). Мыши получали PLP139–151-PLGA (N=5), или OVA323–339-PLGA (N=5), или неконъюгированные PLGA (N=5) на -7-е сутки относительно времени иммунизации (0-е сутки). Пик заболевания, как правило, наблюдали приблизительно на 12–14-е сутки и у мышей проводили балльную оценку клинической картины заболевания. Частицы без пептида или частицы, модифицированные контрольным пептидом OVA323–339, не предотвращали индукцию заболевания. Однако балл клинической оценки PLGA-частиц, модифицированных PLP139–151, составлял 0 (отсутствие заболевания) во всех случаях, за исключением того, что в период между 20-ми и 30-ми сутками наблюдали низкий балл клинической оценки менее 1.
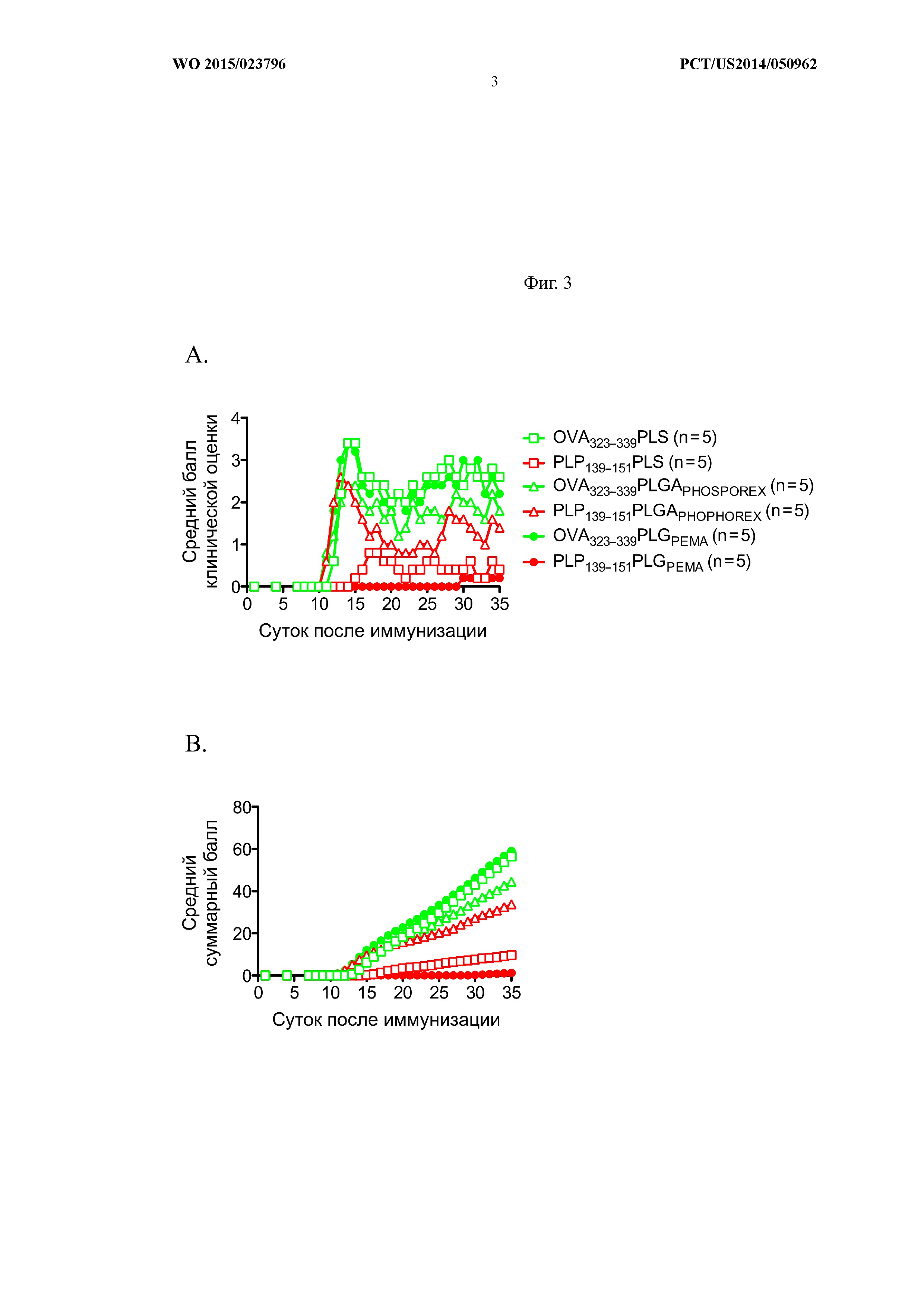
На Фиг.3 показано, что тип введенной частицы влиял на развитие EAE в мышиной модели. A) показывает средний балл клинической оценки и B) показывает средний суммарный балл у животных с EAE. Мыши получали OVA323–339-PLS (N=5), OVA323–339-PLGAPHOSPOREX (N=5), OVA323–339-PLGAPEMA (N=5), PLP139–151-PLA (N=5), PLP139–151-PLGAPHOSPOREX (N=5) или PLP139–151-PLGPEMA (N=5) на -7-е сутки относительно времени иммунизации (0-е сутки). Пик заболевания, как правило, наблюдали приблизительно на 12–14-е сутки и у мышей проводили балльную оценку клинической картины заболевания. Частицы любой композиции, модифицированные контрольным пептидом OVA323–339, не предотвращали индукцию заболевания. Однако связанные с PLP139–151 PLG-гранулы более эффективно снижали индукцию R-EAE, чем связанные с PLP139–151 коммерческие PLG-частицы (phosphorex) или частицы полистирола.
На Фиг.4 показано, что у мышей, получавших растворимый OVA, на 28-е сутки наблюдалось снижение температуры по сравнению с животными, получавшими частицы OVA–PLG. В течение 1 часа после введения частиц не наблюдалось никакого снижения температуры тела.
На Фиг.5 показано, что введение частиц PLP-PLG в ходе ремиссии не вызывает смертности, ассоциированной с анафилактической реакцией. EAE индуцировали у самок мышей линии SJL/J возрастом шесть - восемь недель путем подкожной инъекции PLP139–151в полном адъюванте Фрейнда (CFA) и отслеживали и регистрировали развитие клинических признаков заболевания (B). На 21-е сутки после индукции заболевания мышам делали внутривенные инъекции растворимого PLP139–151(белые квадраты),растворимого OVA323–339(белые круги) или тех же самых пептидов, связанных с PLG-наночастицами (заштрихованы). Температуру животных отслеживали и регистрировали каждые 10 минут в течение 1 часа после инъекции (A).
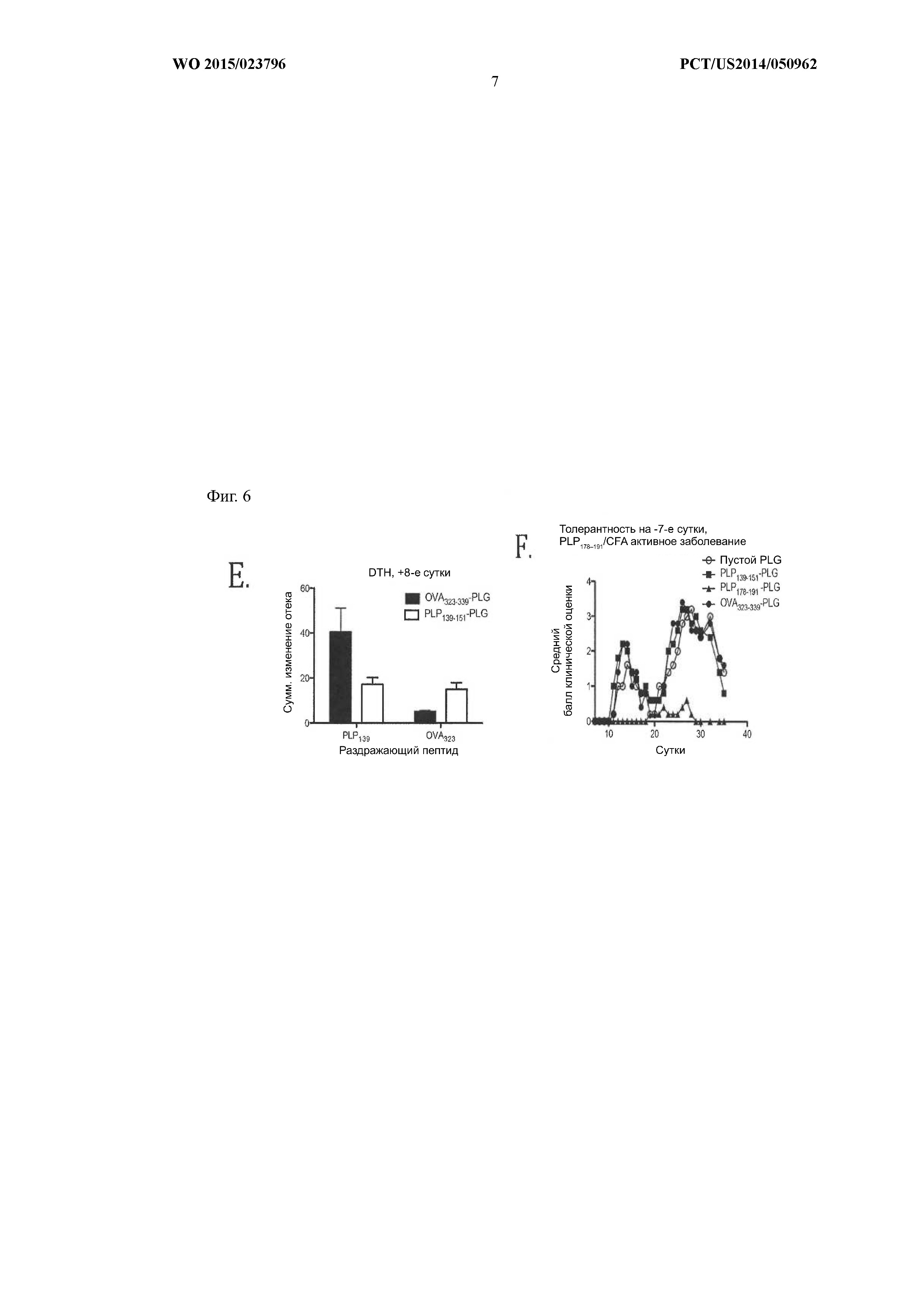
На Фиг.6 показано введение оптимальной дозы PLP139–151-PLG за семь суток перед индукцией заболевания. Развитие клинических признаков заболевания измеряли в сравнении с мышами SJL/J, получавшими OVA323–339-PLG (A). Самкам мышей SJL/J в возрасте шести - восьми недель внутривенно вводили PLG-наночастицы, связанные либо с PLP139–151(квадраты), либо с OVA323–339(круги). EAE индуцировали путем подкожной инъекции PLP139–151в CFA через 7 суток (B), 25 суток (C) или 50 суток (D). У животных из панели B отслеживали клинические признаки заболевания в течение 100 суток. На 8-е сутки после индукции заболевания у субпопуляции мышей, показанных на панели В, проводили реакцию гиперчувствительности замедленного типа (DTH) (E). Избранным типичным животным из панели B, праймированным при помощи PLP139–151/CFA (OVA323–339-PLG и PLP139–151-PLG), наносили на ухо в качестве раздражителя праймирующий эпитоп PLP139–151 и контрольный пептид OVA323–339. Через 24 ч определяли набухание уха в качестве показателя DTH, с вычитанием ответов, наблюдавшихся перед раздражением. Самкам мышей SJL/J в возрасте шести - восьми недель вводили внутривенно PLG-наночастицы, связанные с PLP178–191(треугольник),OVA323–339(круг) илиPLP139–151(квадрат) или только несвязанные частицы (пустой круг) (F). EAE индуцировали через 7 суток после этого путем внутривенного введения PLP178–191в CFA и отслеживали признаки заболевания в показанных временных точках.
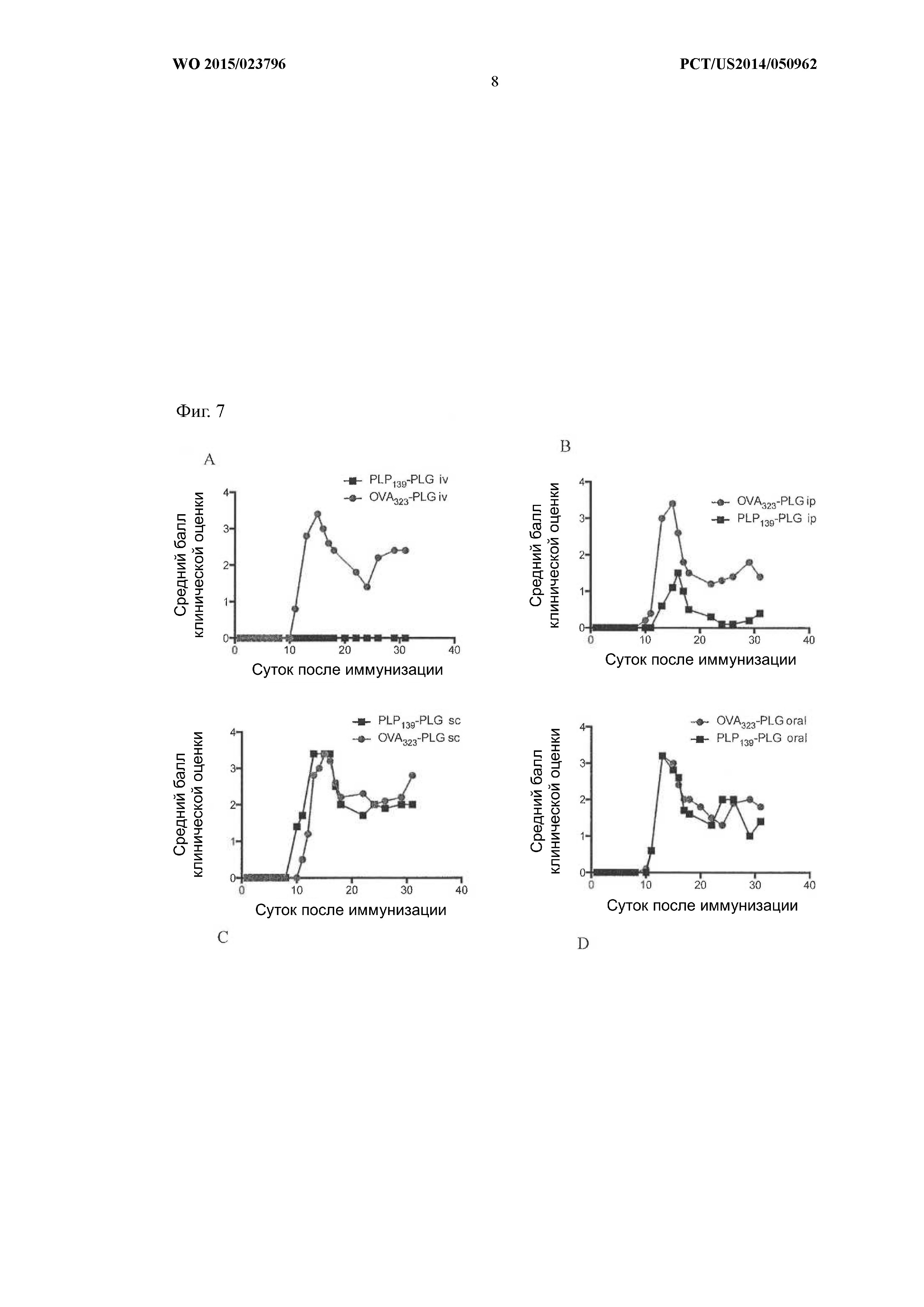
На Фиг.7A–D показано, что профилактическая толерантность была наиболее эффективна при внутривенном или внутрибрюшинном введении частиц PLG-PLP139–151. У животных, получавших PLP139–151-PLG внутривенно, заболевание не развивалось, и в большинстве временных точек средний балл клинической оценки был равен 0.
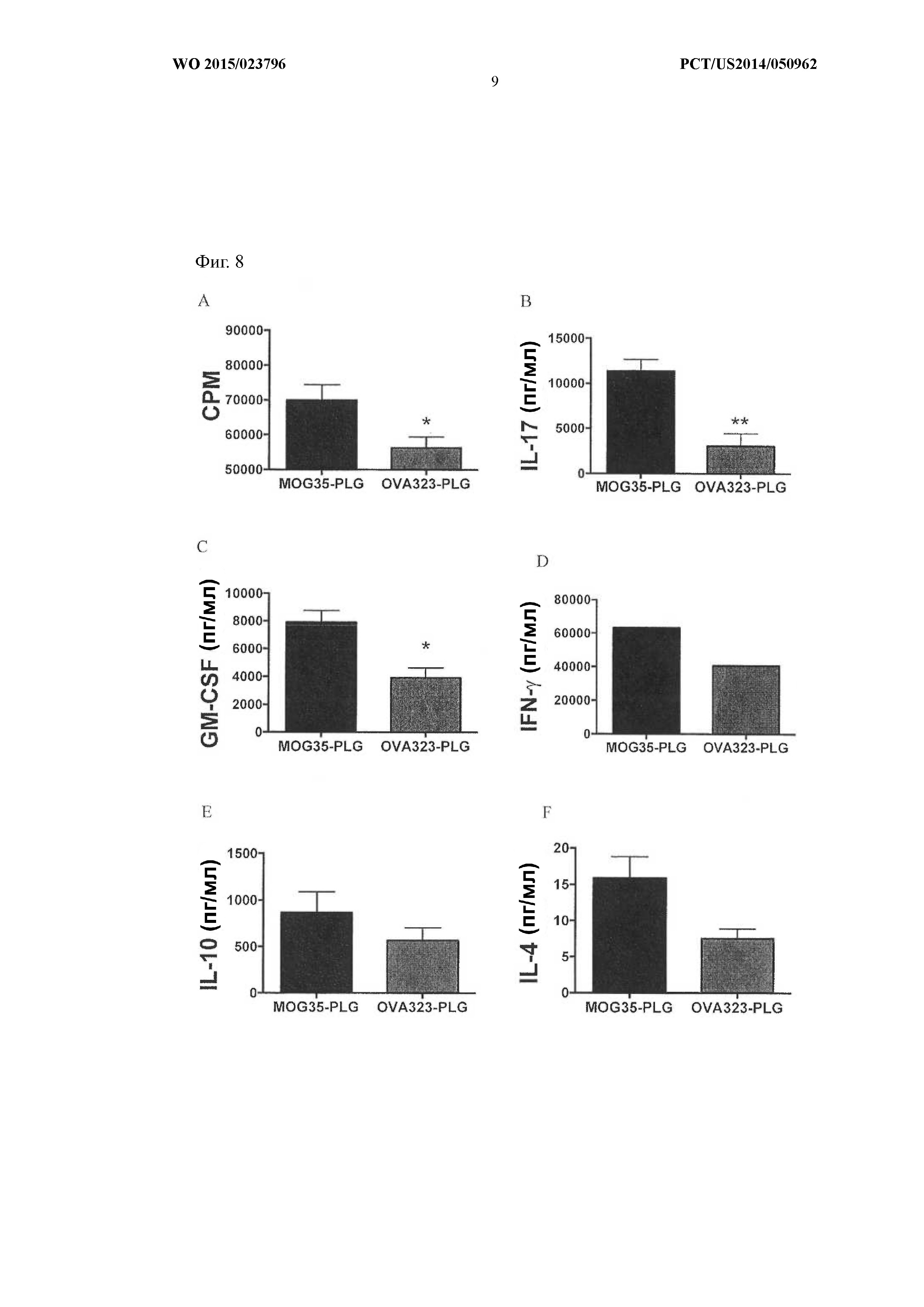
На Фиг.8A–F показано, что введение частиц OVA323–339-PLG ингибировало ответы Th1 и Th17 у получавших лечение животных.
На Фиг.9A–C показано снижение инфильтрации иммунных клеток в спинной мозг у животных, получавших PLP139–151-PLG, которая была более сходна с нормальной тканью, чем с тканью животных, получавших OVA323–339-PLG. У животных, получавших OVA323–339-PLG, наблюдалось положительное окрашивание на CD45, CD4 и CD11b; тогда как у животных, получавших PLP139–151-PLG, окрашивание на эти факторы было минимальным.
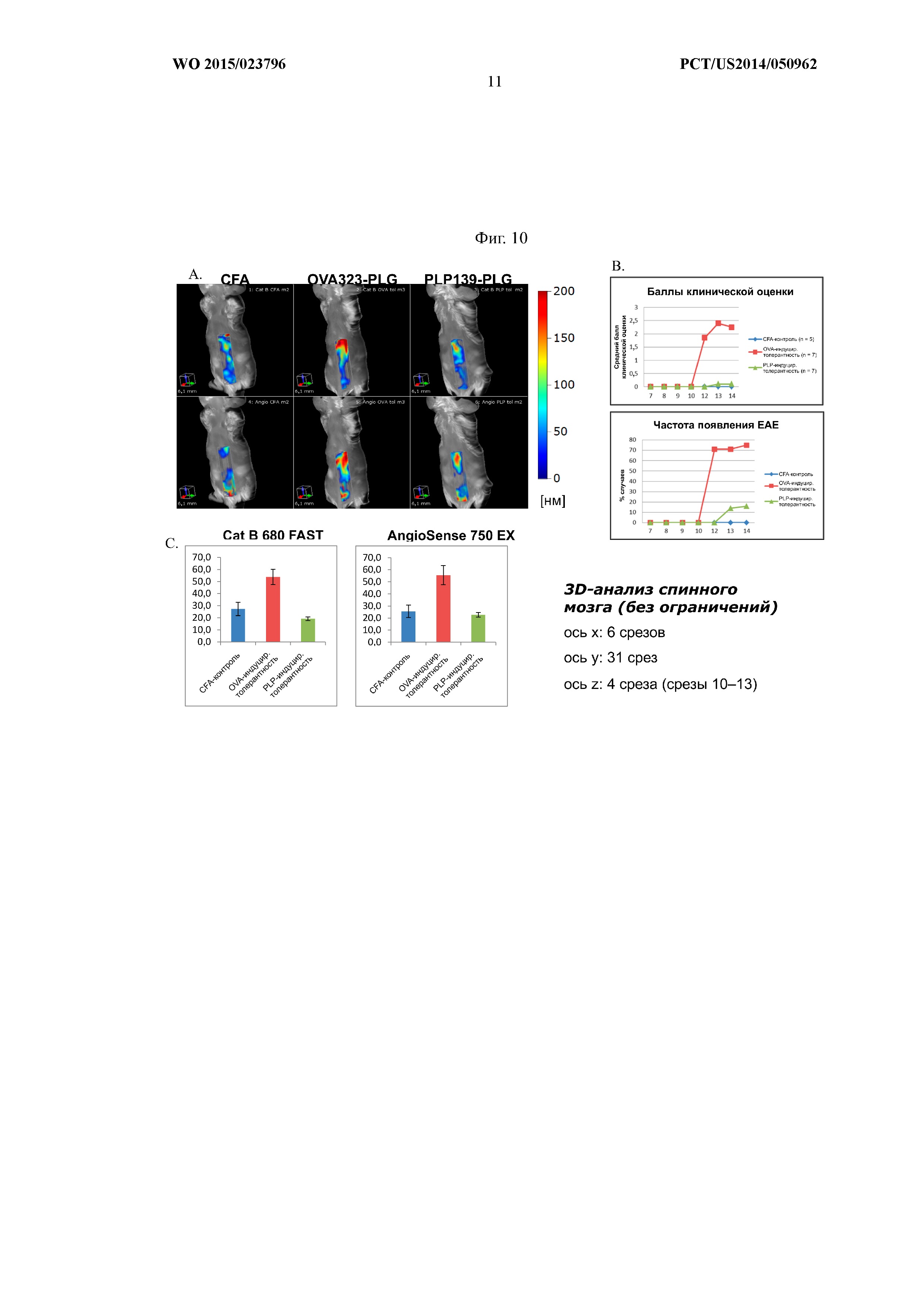
На Фиг.10A–C показано, что введение частиц PLP139–151-PLG уменьшает нарушение гематоэнцефалического барьера (ГЭБ) и активацию макрофагов в спинном мозге получавших лечение мышей. Животные получали либо полный адъювант Фрейнда (CFA), либо частицы OVA323–339-PLG, либо частицы PLP139–151-PLG. Определяли баллы клинической оценки клинических признаков и процентную долю возникновения EAE (B), а спинной мозг контролировали при помощи метода визуализации in vivo (A и C).
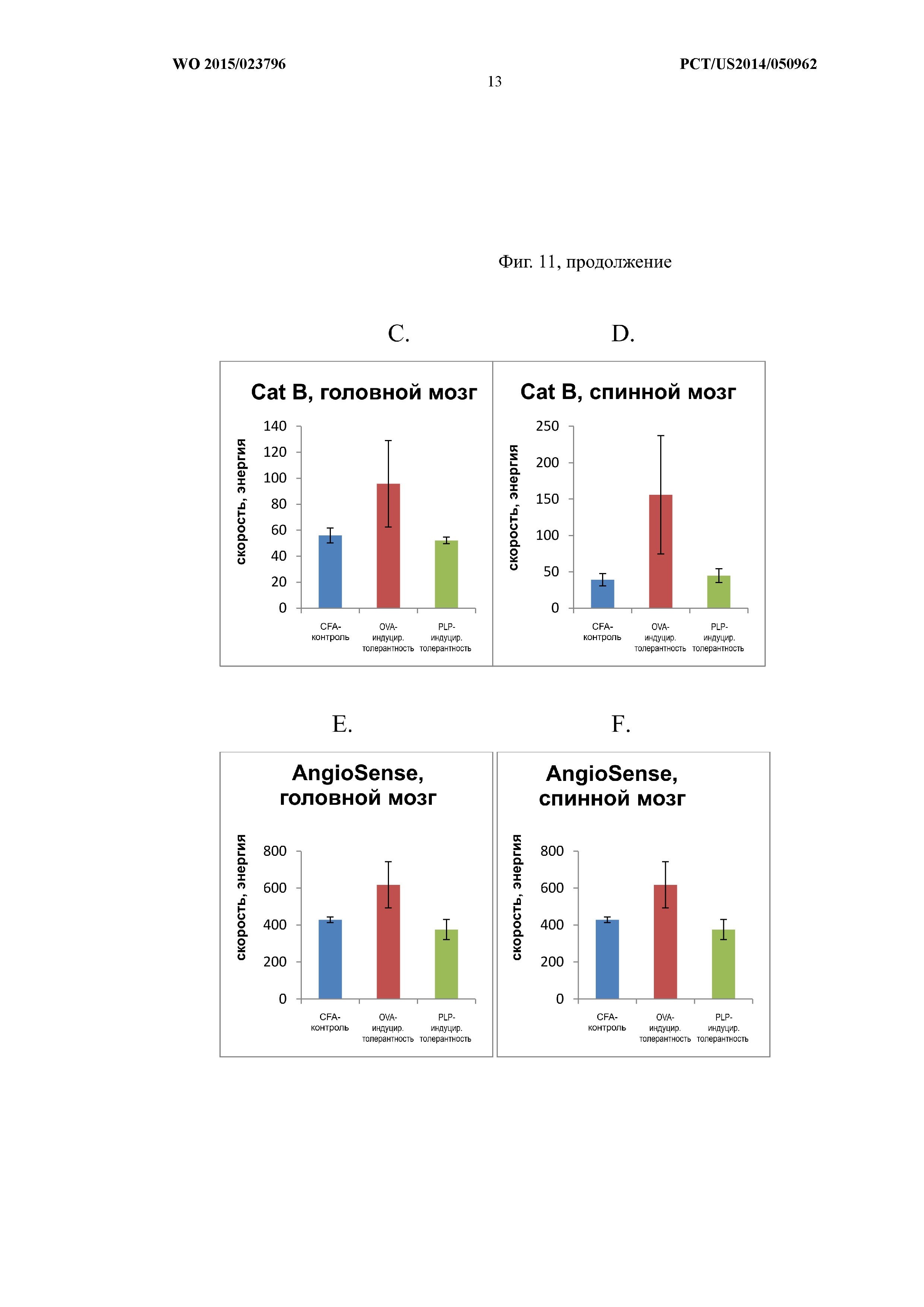
На Фиг.11A и B показан спинной мозг получавших лечение мышей с использованием визуализации in vivo. Панели C–F представляют собой графики, показывающие количественную оценку данных визуализации.
На Фиг.12 показано, что введение PLG-частиц с инкапсулированным в них пептидом PLP139–151 ингибировало индукцию R-EAE у мышей. Возможность инкапсуляции аутоантигенов предусматривает использование сложных смесей белков или даже гомогенатов органов, что невозможно при поверхностном связывании, и позволяет обеспечить большее покрытие антигеном и, таким образом, более эффективное распределение эпитопов.
На Фиг.13 показано, что животные, получавшие частицы PLP139–151-PLG и антитело к CD25, демонстрировали временами больший средний балл клинической оценки, чем животные, получавшие частицы PLP139–151-PLG и контрольное антитело IgG.
На Фиг.14 показана терапевтическая толерантность, индуцированная частицами PLP139–151-PLG, при активном и адоптивном EAE. Адоптивный EAE индуцировали у самок мышей SJL/J возрастом шесть-восемь недель путем адоптивного переноса 2,5 x 106 бластных клеток, активированных при помощи PLP139–151. Мыши получали внутривенно пептид PLP139–151(квадраты) или OVA323–339(круги), связанный с PLG-наночастицами размером 500 нм, через 2 суток (A), 14 суток (C), 18 суток (E) или 21 сутки (F) после индукции заболевания. Балльную клиническую оценку заболевания определяли в сравнении с таковой после обработки спленоцитами, связанными с антигеном (A). У мышей с толерантностью, вызванной PLP139–151или OVA323–339, на 42-е сутки отбирали головной и спинной мозг для гистологического анализа. Срезы, взятые у мышей из панели A, окрашивали на белок PLP и на CD45 (B). Срезы спинного мозга, взятые у мышей из панели (C), окрашивали красителем Luxol Fast Blue (D). Зоны демиелинизации и инфильтрации клеток показаны стрелками.
На Фиг.15 представлены графики, показывающие средние баллы клинической оценки у мышей с активным EAE и адоптивным EAE после лечения спленоцитами (SP) или PLG-частицами, конъюгированными с OVA323–339 или PLP139–151. Мыши получали внутривенно PLP139–151-SP, PLP139–151-PLG, или OVA323–339-SP, или OVA323–339-PLG,причем пептид был связан с наночастицами размером 500 нм, через 10 суток (A) или через 2 суток (B) после индукции заболевания, и определяли средний балл клинической оценки. В обоих случаях частицы PLP139–151-PLG индуцировали у мышей толерантность.
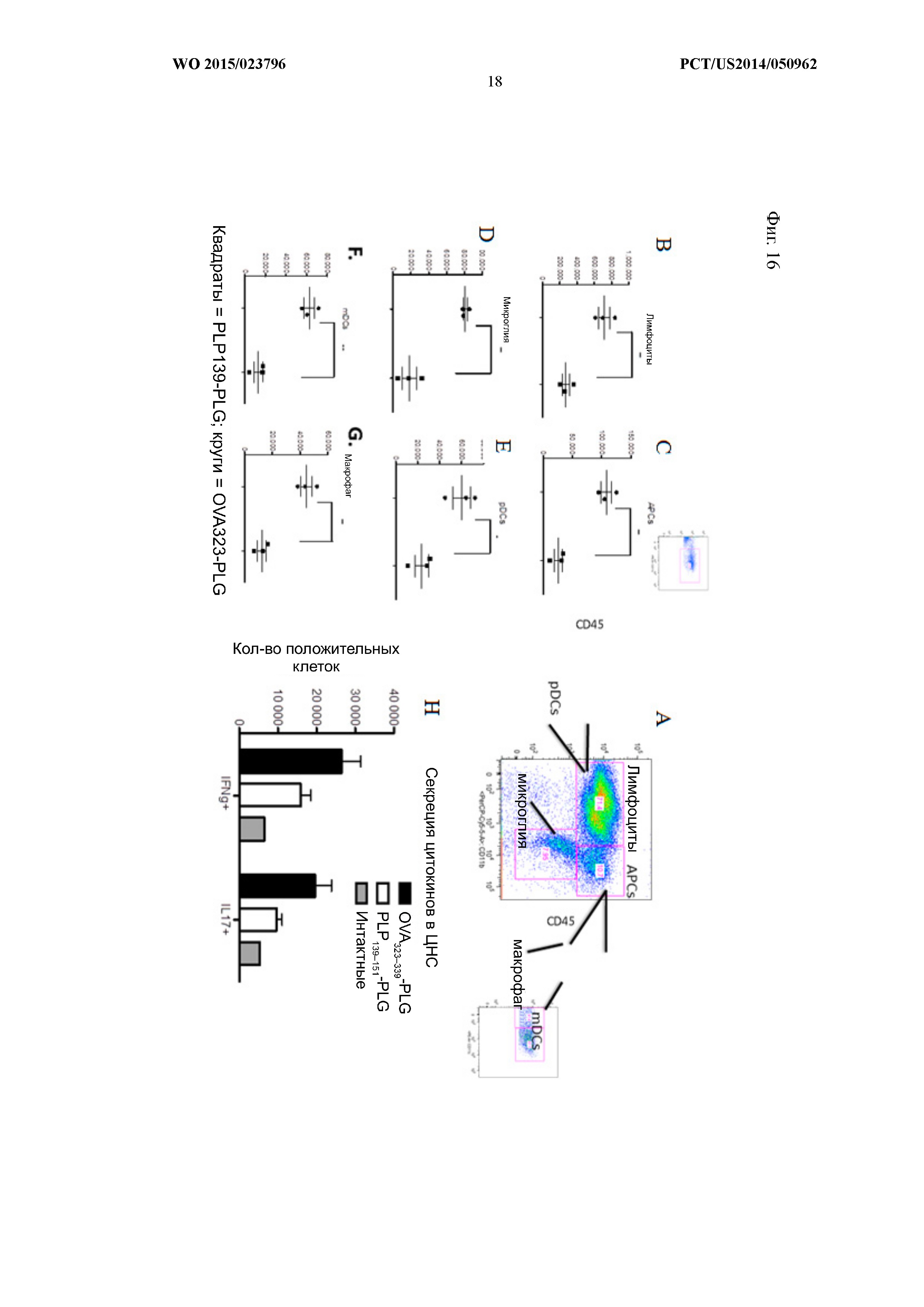
На Фиг.16 показано, что инфильтрация клеток в центральную нервную систему также существенно снижалась у мышей с толерантностью, вызванной PLP-PLG. SJL/J-мышам внутривенно вводили PLG-наночастицы размером 500 нм, связанные с PLP139–151 (квадраты) или OVA323–339(круги),через 2 суток после индукции EAE методом адоптивного переноса. На пике заболевания (14-е сутки) забирали головной и спинной мозг и методом проточной цитометрии определяли количество лимфоцитов (B), антигенпредставляющих клеток (АПК) (C), микроглии (D), периферических дендритных клеток (E), миелоидных дендритных клеток (F) и макрофагов (G). Стратегия дискриминации этих популяций показана в (A). Препараты клеток ЦНС стимулировали форболмеристатацетатом (PMA) и иономицином за 5 ч перед внутриклеточным окрашиванием на IL-17A и IFN-γ (H).
На Фиг.17 показано, что введение пептида PLP139–151, инкапсулированного в PLG-частицу, индуцирует толерантность при введении частицы с PBS. Однако введение антитела к PD-1 уменьшает эту толерантность.
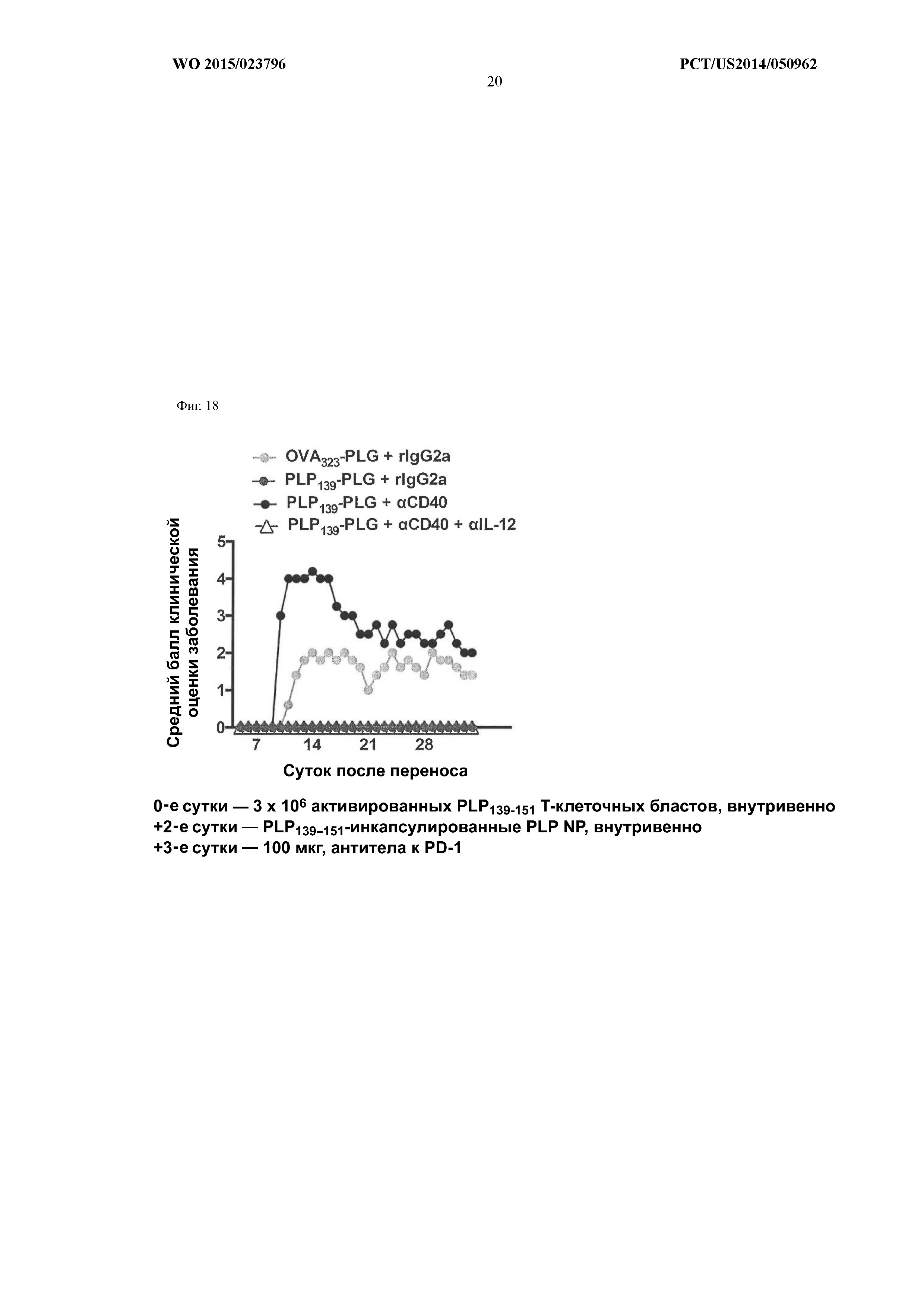
На Фиг.18 показано, что введение пептида PLP139–151, инкапсулированного в PLG-частицу, индуцирует толерантность при введении частицы с PBS. Введение антитела к CD40 уменьшает эту толерантность, но уменьшение толерантности обращается при добавлении антитела к IL-12.
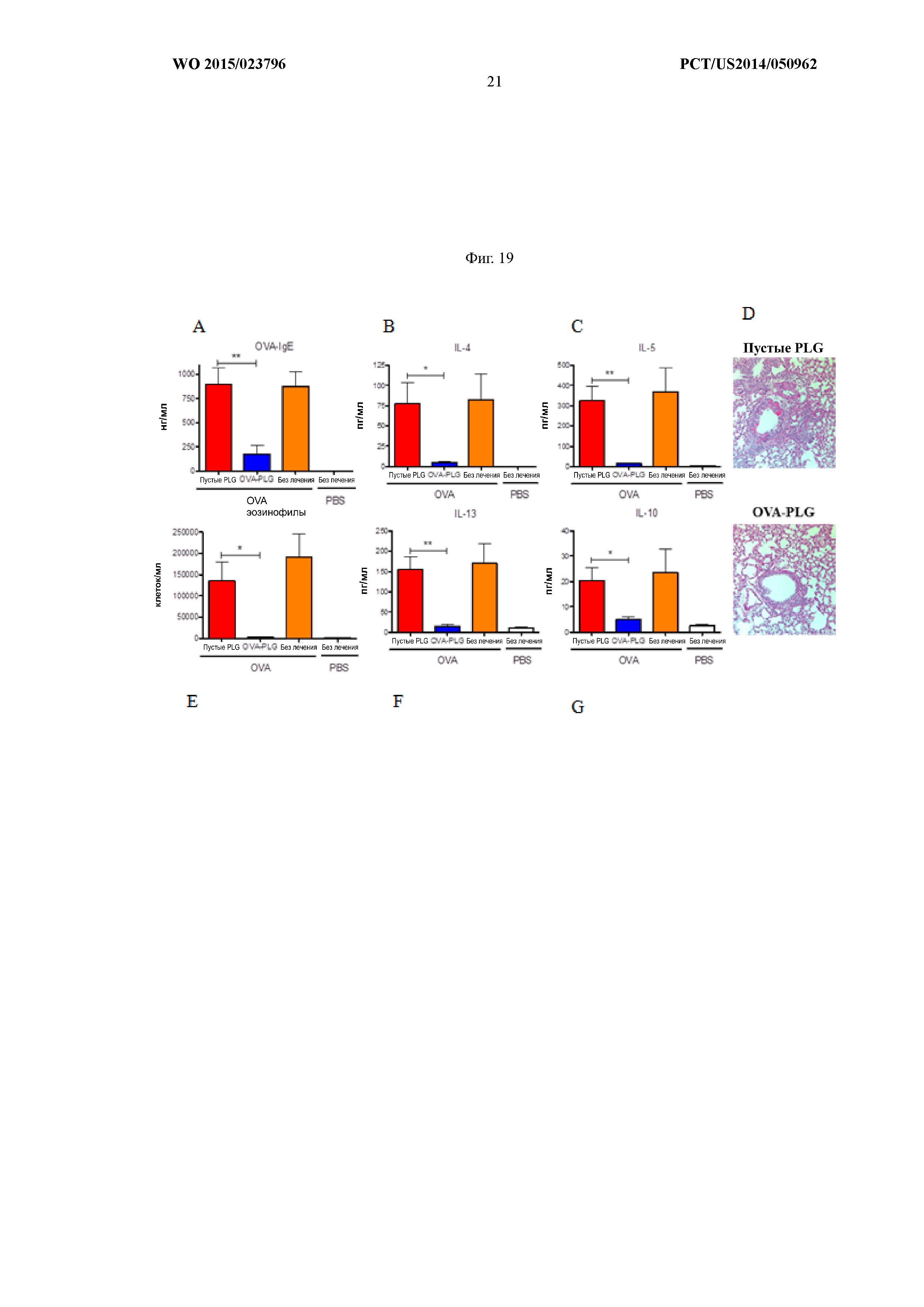
На Фиг.19A–G показано, что профилактическое введение OVA-PLG уменьшало секрецию IL-4, IL-5, IL-13 и IL-10 и снижало уровни сывороточного OVA IgE и эозинофилов в легком.
На Фиг.20 показано, что пептид OVA, инкапсулированный в частицы PLG, при профилактическом введении ингибирует OVA-специфический вторичный иммунный ответ in vitro в медиастинальных лимфоузлах. Пролиферация в лимфоузлах, наблюдавшаяся после повторной стимуляции 25 мкг OVA, снижается у животных, получавших OVA-PLG (A). Более того, введение OVA-PLG снижает выброс цитокинов после повторной стимуляции OVA. Уровни IL-4, IL-5, IL-13 и IL-10 снижаются у мышей, получавших OVA-PLG (B).
На Фиг.21A и В показано, что терапевтическое введение OVA-PLG уменьшает секрецию IL-4, IL-5, IL-13 и IL-10 и снижает уровни сывороточного OVA IgE и эозинофилов в легком.
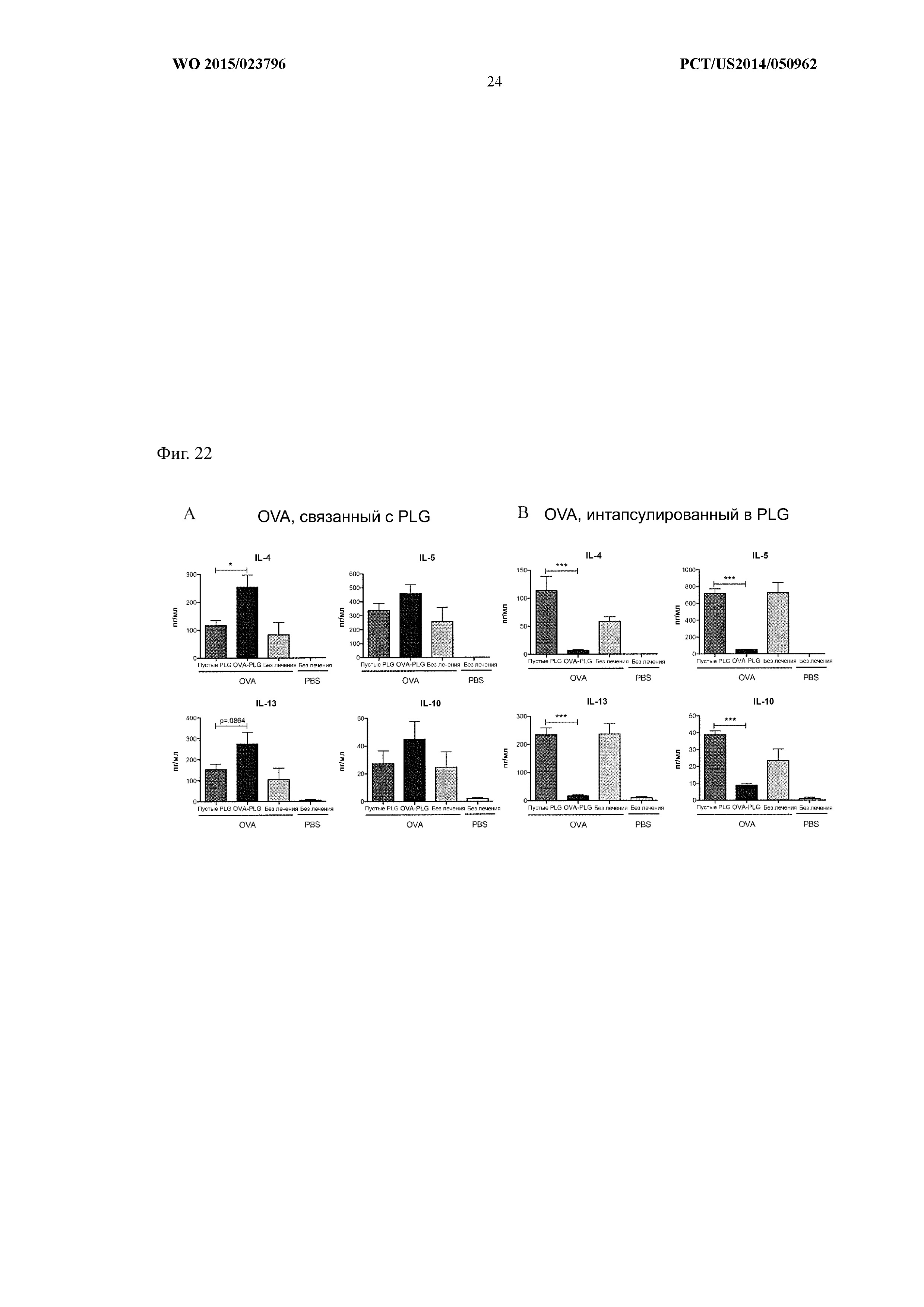
На Фиг.22 показано, что пептид OVA, инкапсулированный в частицы PLG, при терапевтическом введении снижает уровень OVA-специфических Th2-цитокинов в бронхоальвеолярном лаваже (BAL) лучше, чем PLG-частицы, связанные с OVA. Мышам внутрибрюшинно вводили OVA/Alum в дозе 10 мкг/мышь на 0-е сутки и на 14е сутки. Мышам внутривенно вводили либо OVA, связанный с PLG-частицами, либо OVA, инкапсулированный в PLG-частицы, на 28-е сутки и на 42-е сутки. В период с 56-х по 58-е сутки мышам трижды вводили аэрозольный OVA. На графиках показана секреция цитокинов при введении животным OVA, связанного с PLG-частицами (A), либо OVA, инкапсулированного в PLG-частицы (B).
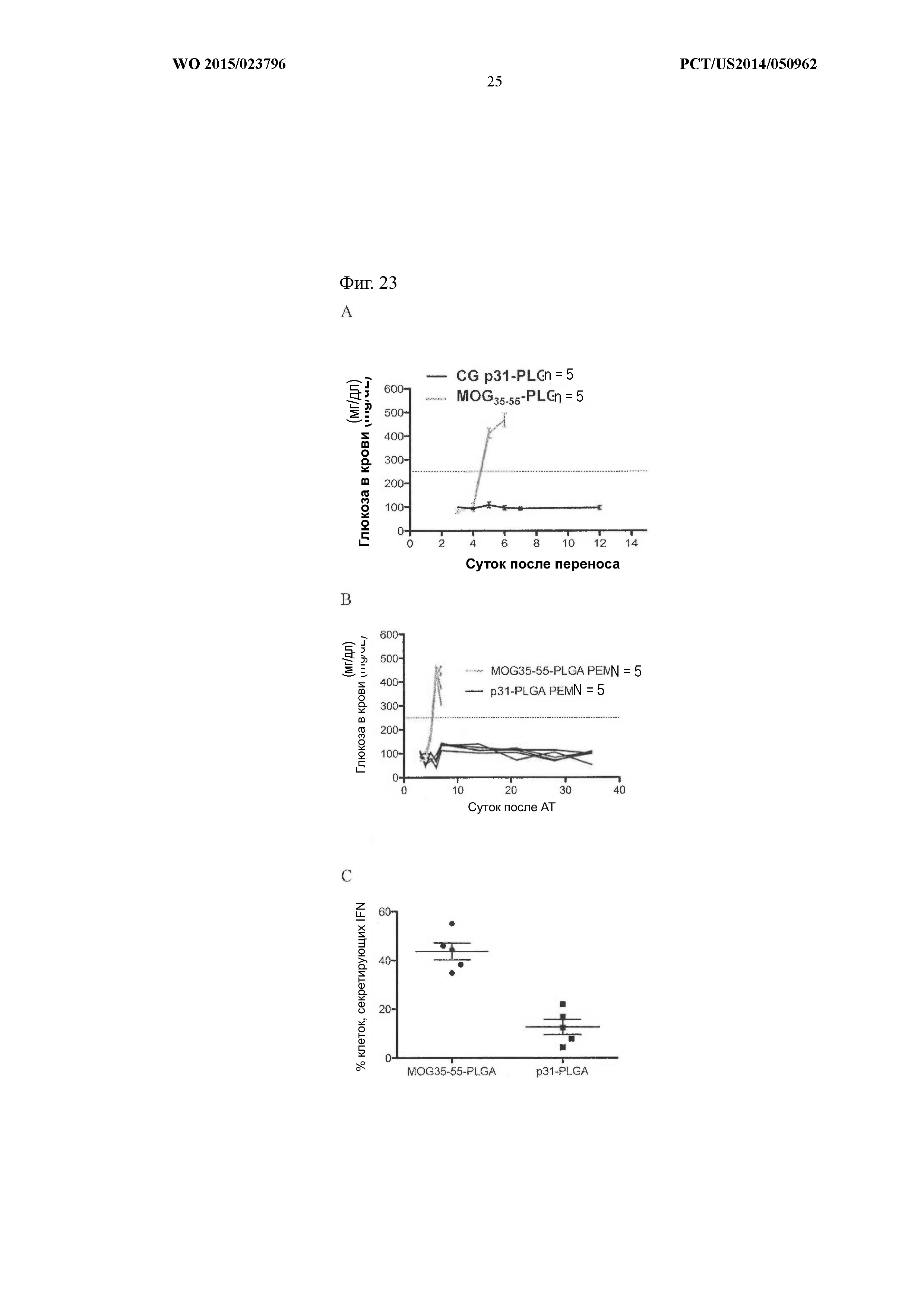
На Фиг.23 показан уровень глюкозы в крови животных с диабетом I типа после введения частиц p31-PLG. Введение наночастиц PLG, связанных с пептидом p31, приводило к снижению уровня глюкозы в крови по сравнению с уровнем, наблюдавшимся при введении частиц, связанных с пептидом MOG35–55 (A и B). Наблюдавшаяся у животных процентная доля клеток, секретирующих IFNγ, также снижалась у мышей, получавших p31-PLG, по сравнению с мышами, получавшими частицы MOG35–55-PLG (C).
На Фиг.24A–B показано, что для индуцируемой p31-PLG толерантности необходимы клетки Treg. Диабет I типа индуцировали методом адоптивного переноса. Через два часа после переноса активированных клеток мышам NOD.SCID у мышей вызывали толерантность либо частицами p31-PLG, либо частицами MOG35–55-PLG. Уменьшение численности клеток Treg нарушало толерантность, вызванную введением частиц p31-PLG.
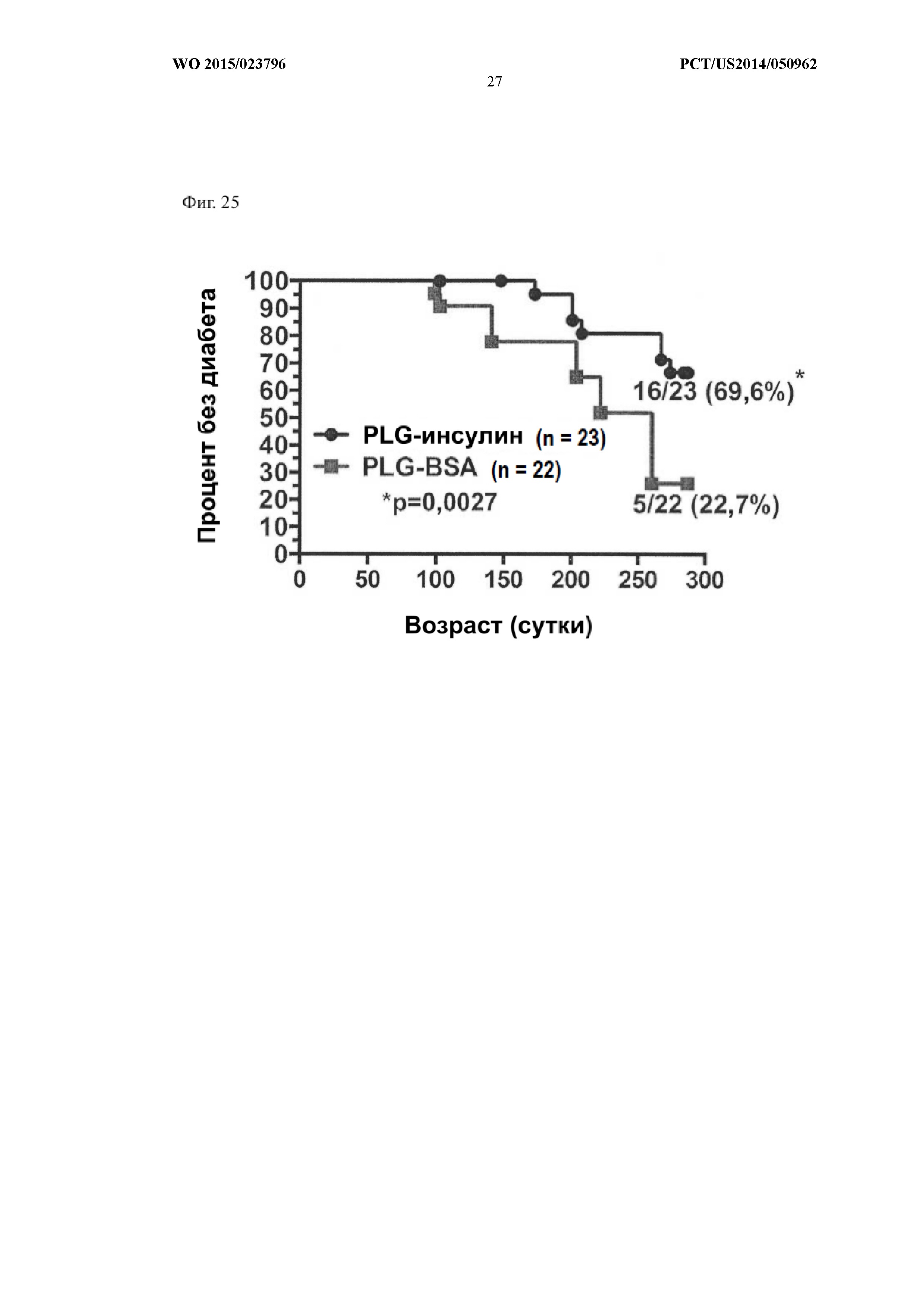
На Фиг.25 показано, что введение связанных с инсулином PLG-частиц существенно увеличивало долю мышей, у которых диабет не развивался в течение более чем 300 суток (69,6% по сравнению с 22,7%; p=0,0027). NOD-мышам в возрасте 6, 8 и 10 недель посредством внутривенного введения вводили PLG-частицы, связанные либо с BSA (N=22), либо с инсулином (N=23). Проводили оценку развития диабета у мышей.
На Фиг.26 показана процентная доля донорских клеток CD45.1, наблюдавшаяся у мыши-реципиента. У самок мышей CD45.2 толерантность вызывали введением OVA-PLG или Dby-PLG на -7-е сутки. На -1-е сутки мыши получали дозу облучения 200 рад, а затем им трансплантировали 1 x 106, 5 x 106 или 1 x 107 клеток костного мозга самцов мышей CD45.1 на 0-е сутки. Толерантность у мышей-реципиентов вызывали при помощи OVA-PLG, Dby-SP или Dby-PLG на 1-е сутки и отбирали кровь для анализа химеризма методом FACS.
На Фиг.27 показана процентная доля донорских клеток CD45.1 у мышей-реципиентов после вызова толерантности при помощи OVA-PLG, Dby-SP или Dby-PLG на 1-е сутки. У одной мыши из группы положительного контроля не наблюдали значимого приживления (~ 10%). Ни у одной мыши отрицательного контроля не наблюдали приживленных донорских клеток. У одной мыши из группы Dby-SP не наблюдали значимого приживления (~ 10%). У двух мышей OVA-PLG донорские клетки прижились (~ 10%): у одной произошло полное отторжение к 16-й неделе. У одной мыши Dby-PLG отторжение началось на 12-й неделе и к 16-й неделе дошло до 10%. У группы Dby-PLG приживление находилось в диапазоне 10–56% к 16-й неделе. У мышей OVA-PLG наблюдали: 1) спонтанное приживление, 2) гомологию последовательности между OVA323 и Dby или 3) толерогенные свойства частиц. Частицы Dby-PLG обеспечивали большее приживление, чем Dby-SP и OVA-PLG.
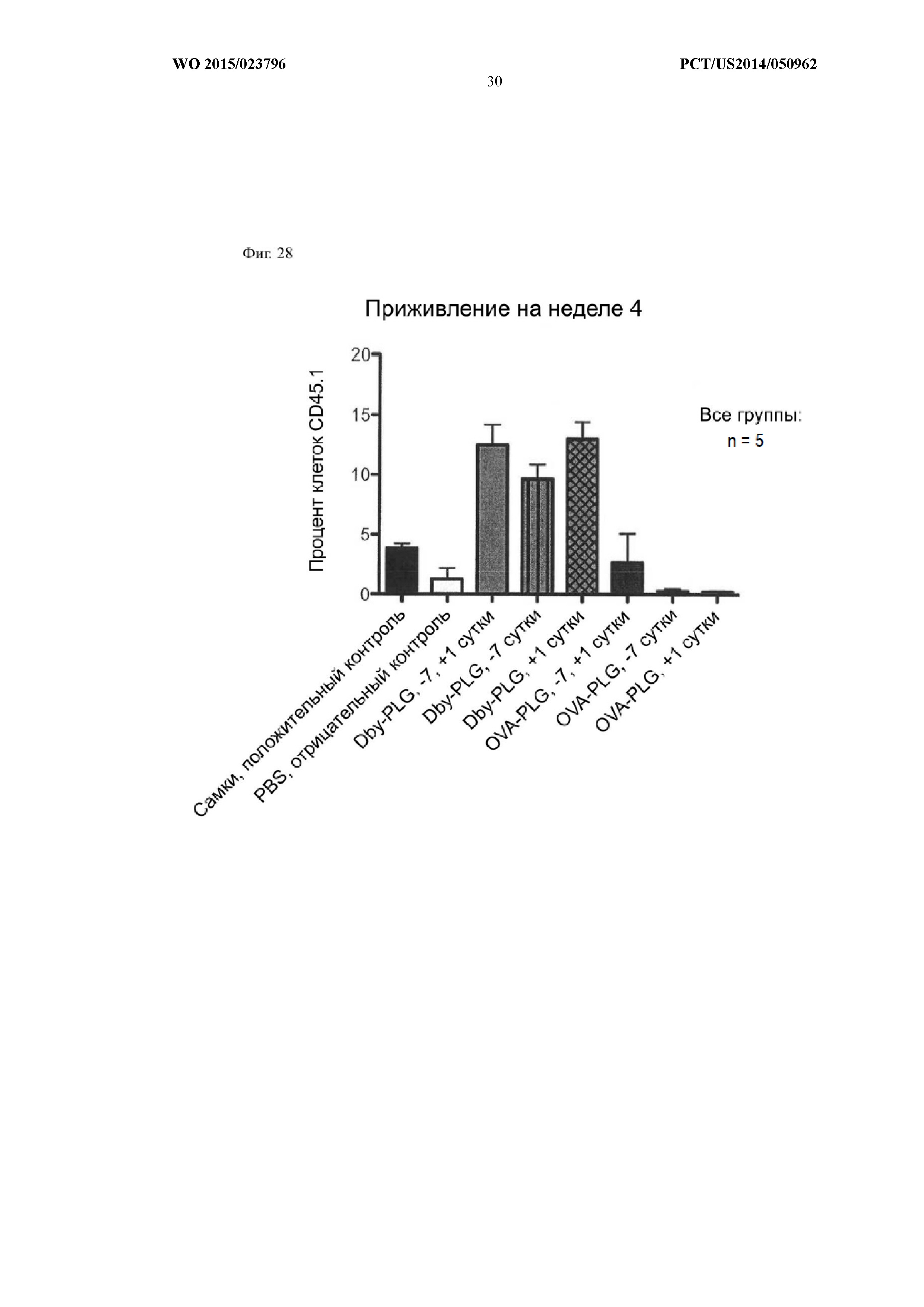
На Фиг.28 показано, что время вызова толерантности влияет на процентную долю клеток CD45.1 у мыши-реципиента. В группе положительного контроля наблюдали меньшее приживление (~ 4%), чем ожидалось (~ 10%). Одна мышь из группы отрицательного контроля имела 5% приживление. Из всех 3 групп OVA-PLG приживление демонстрировала одна мышь в группе -7-е сутки, +1-е сутки (12%). Толерантность на 1-е сутки имеет большую клиническую значимость, чем толерантность на -7-е сутки.
На Фиг.29 показано, что меченные кумарином-6 PLGA-частицы, связанные или не связанные с антигеном, отслеживали через 3 часа после введения, но не через 24 часа после введения. Частицы отслеживали через 3 часа после введения, но не через 24 часа после введения. Срезы селезенки (левый столбец), печени (средний столбец) и легкого (правый столбец) от интактных мышей без инъекций (верхний ряд) и от мышей, получавших внутривенно флуоресцентные микрочастицы PLGA/PEMA, взятые через 3 ч после инъекции (средний ряд) и через 24 ч после инъекции (нижний ряд), с контрастным окрашиванием DAPI.
На Фиг.30 показано, что PLGA-частицы через 6 и 15 часов колокализуются с клетками F4/80+в печени.
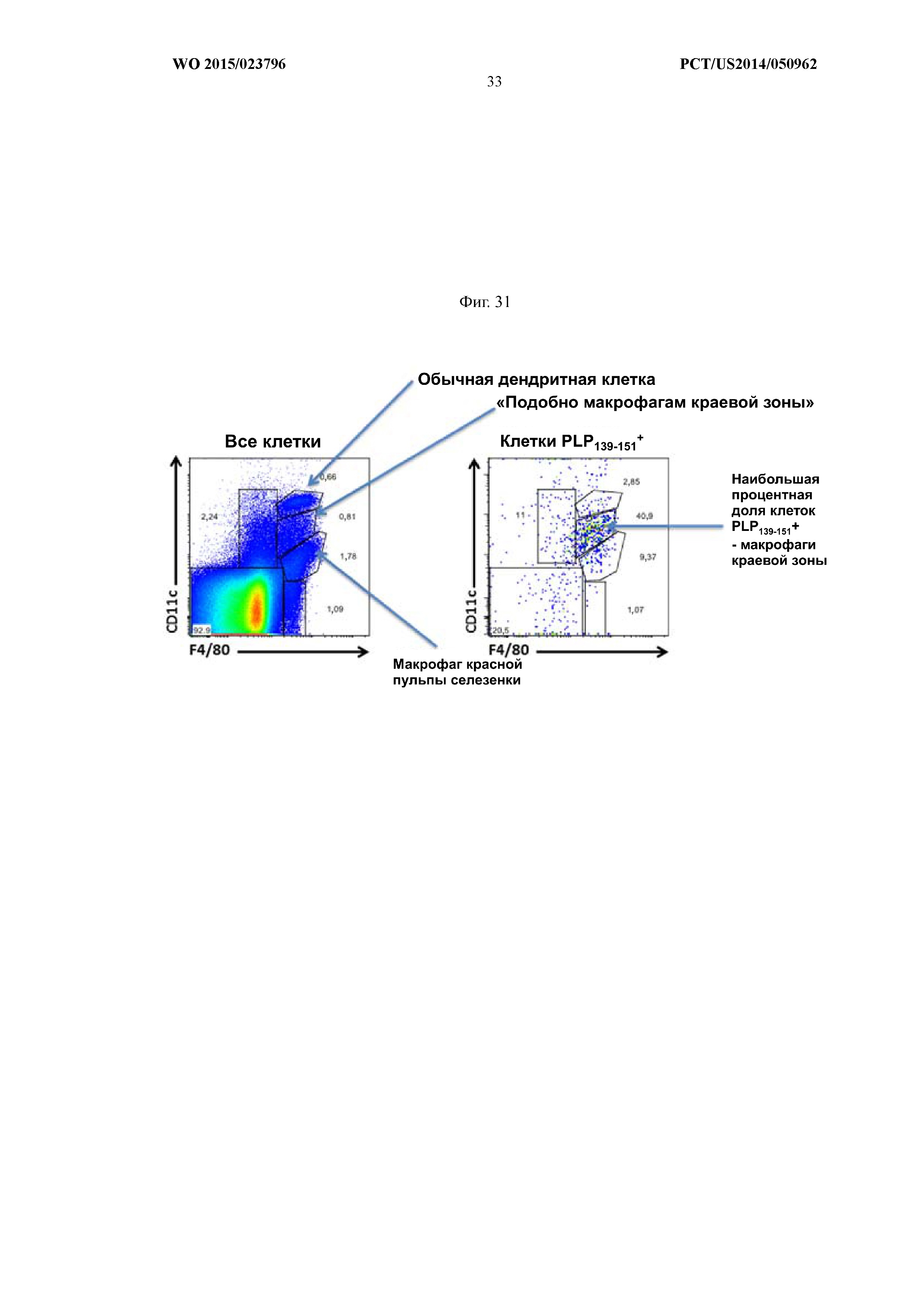
На Фиг.31 показано, что макрофаги краевой зоны преимущественно захватывают меченные TAMRA частицы, связанные с PLP139–151, через 24 часа после внутривенной инфузии. Наибольшая процентная доля клеток PLP139–151+представляет собой макрофаги краевой зоны.
На Фиг.32 показана зависимость ежедневного среднего балла клинической оценки от количества суток после праймирования PLP139–151/CFA. R-EAE, индуцированный PLP139–151/CFA, ингибируется у мышей SJL/J путем индукции иммунологической толерантности с помощью поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своем ядре растворимый PLP139–151.
На Фиг.33 показано, что мыши, получавшие инкапсулированный OVA-PLG, демонстрировали наибольшее снижение накопления эозинофилов.
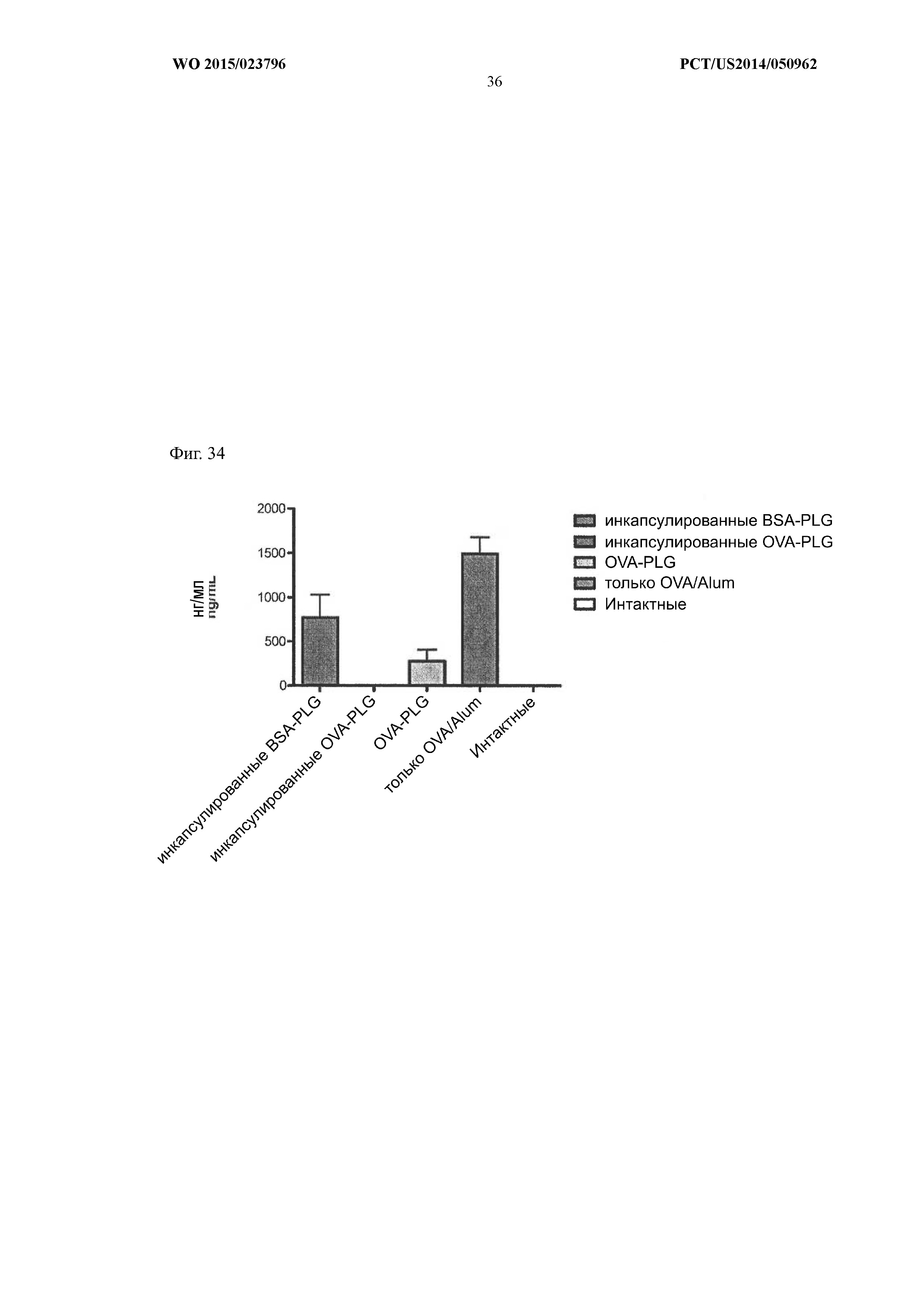
На Фиг.34 показано, что мыши, получавшие инкапсулированный OVA-PLG, демонстрировали наибольшее снижение уровня IgE в сыворотке по сравнению с не получавшими лечение или контрольными получавшими лечение животными.
На Фиг.35 показана характеризация поверхностно-функционализированных частиц, содержащих в своих ядрах растворимый PLP139–151, сополимера лактида и гликолида посредством анализа динамического светорассеяния. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 1,792 x 105 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела Z-средний диаметр 584 нм, максимальный диаметр 679 нм и коэффициент полидисперсности 0,162. Эти результаты являются типичными для 6 партий частиц, синтезированных в соответствии с описанным выше протоколом.
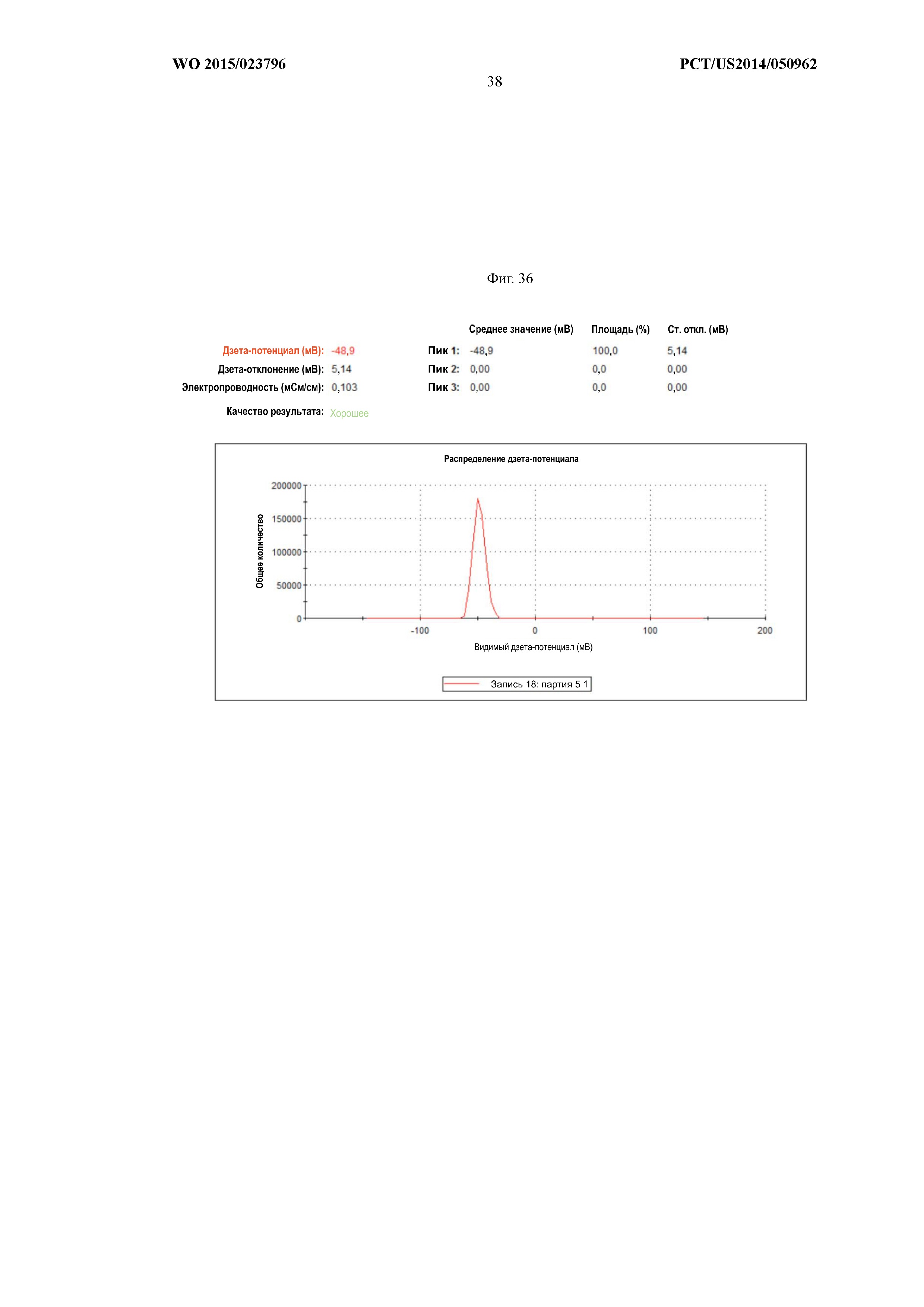
На Фиг.36 показана характеризация поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый PLP139–151, посредством измерения ζ-потенциала. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 6,67 x 104 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела максимальный ζ-потенциал -48,9 мВ и ζ-отклонение 5,14 мВ. Эти результаты являются типичными для 6 партий частиц, синтезированных в соответствии с описанным выше протоколом.
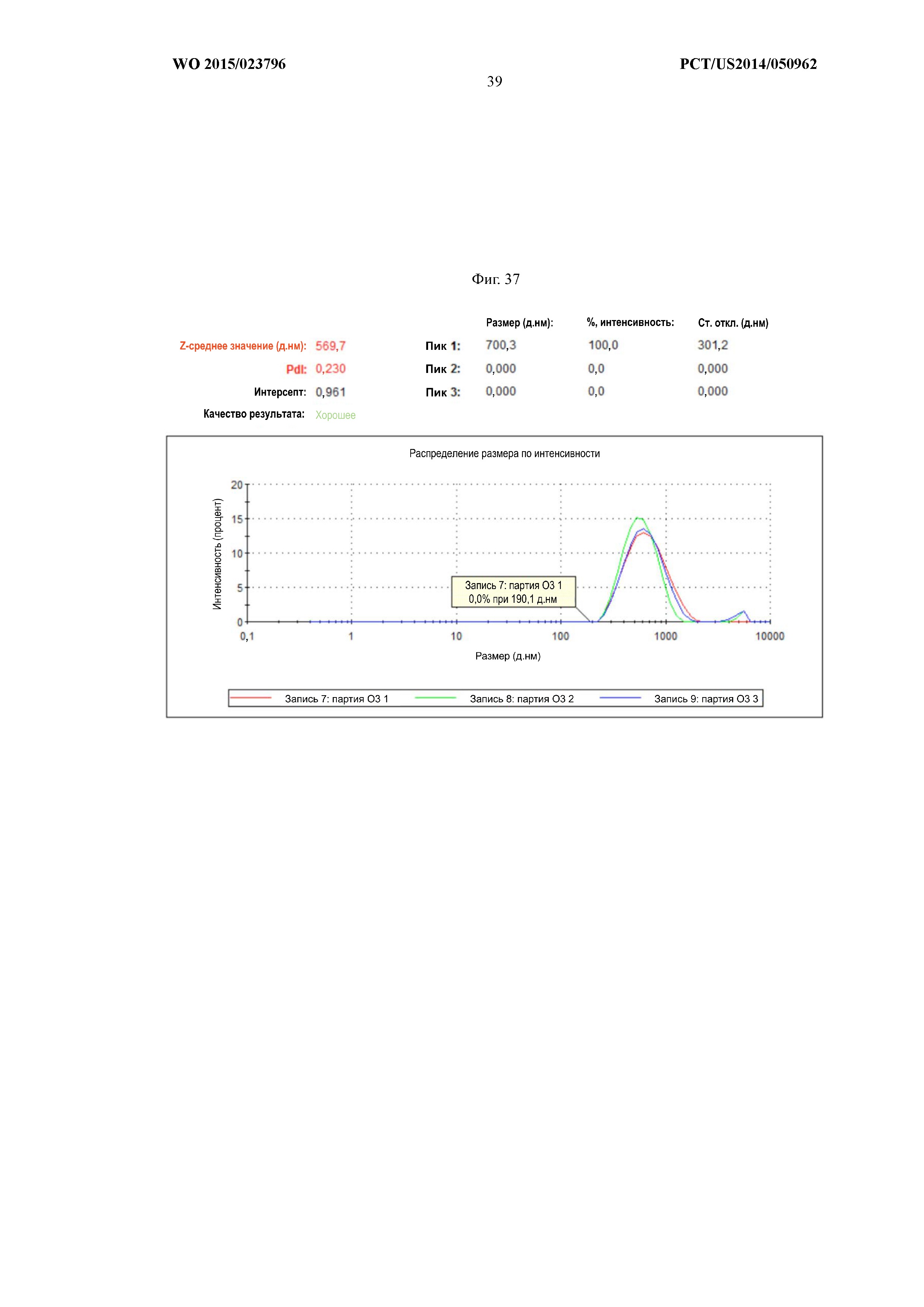
На Фиг.37 показана характеризация поверхностно-функционализированных частиц, содержащих в своих ядрах растворимый овальбумин, сополимера лактида и гликолида посредством анализа динамического светорассеяния. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 1,822 x 105 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела Z-средний диаметр 569,7 нм, максимальный диаметр 700,3 нм и коэффициент полидисперсности 0,230. Эти результаты являются типичными для 3 партий частиц, синтезированных в соответствии с описанным выше протоколом.
На Фиг.38 показана характеризация поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый овальбумин, посредством измерения ζ-потенциала. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 2,67 x 104 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела максимальный ζ-потенциал -52,2 мВ и ζ-отклонение 5,38 мВ. Эти результаты являются типичными для 3 партий частиц, синтезированных в соответствии с описанным выше протоколом.
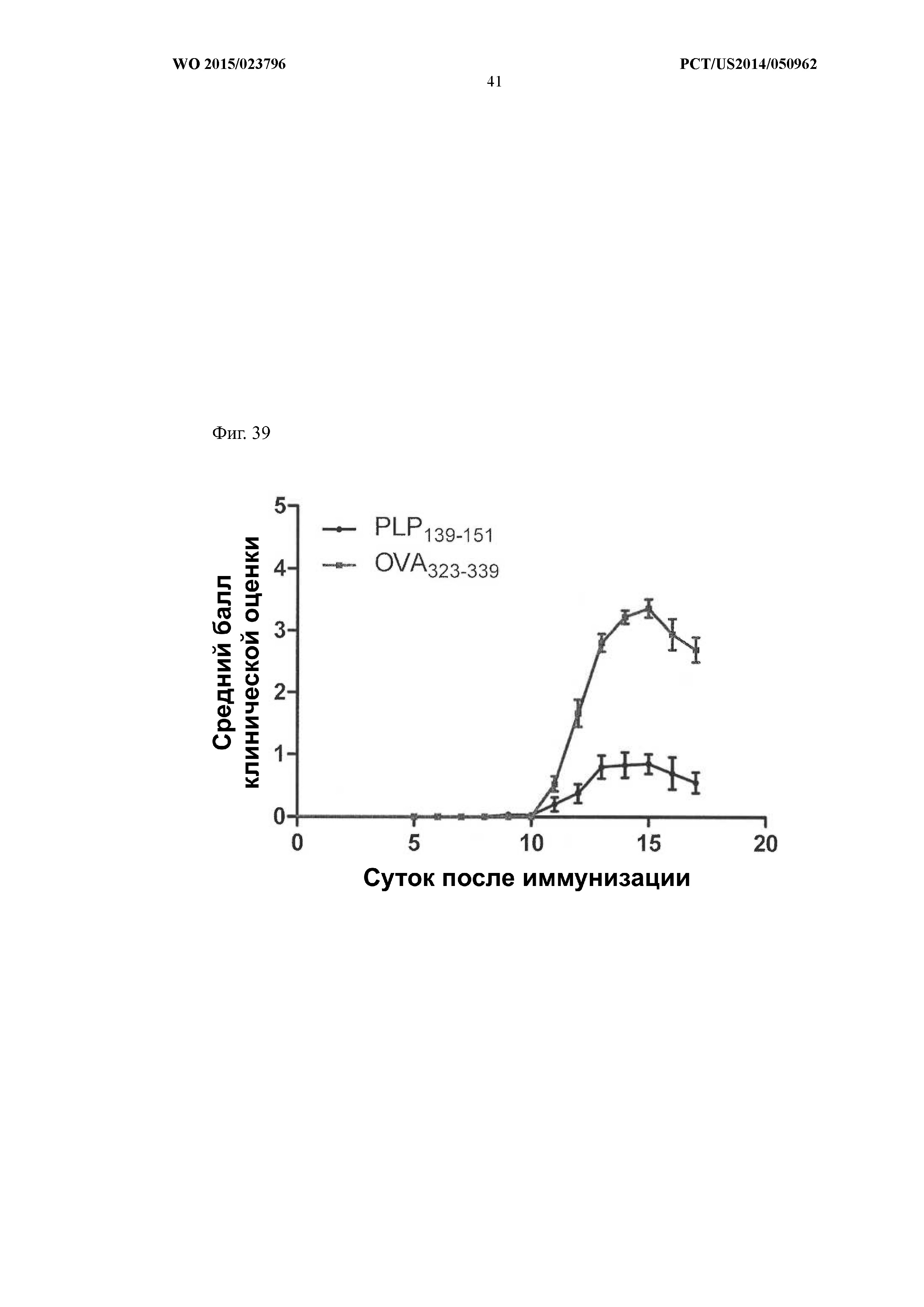
На Фиг.39 представлен график, демонстрирующий, что поверхностно-функционализированные липосомы, содержащие в своих ядрах растворимый пептид PLP139–151, индуцируют иммунологическую толерантность на мышиной модели рассеянного склероза. Животные получали либо поверхностно-функционализированные липосомы, содержащие в своих ядрах растворимый пептид PLP139–151 (круги), либо поверхностно-функционализированные липосомы, содержащие в своих ядрах растворимый пептид OVA323–339 (квадраты). Средний балл клинической оценки животных, получавших липосомы с пептидом PLP139–151, был ниже, чем у животных, получавших липосомы с пептидом OVA323–339.
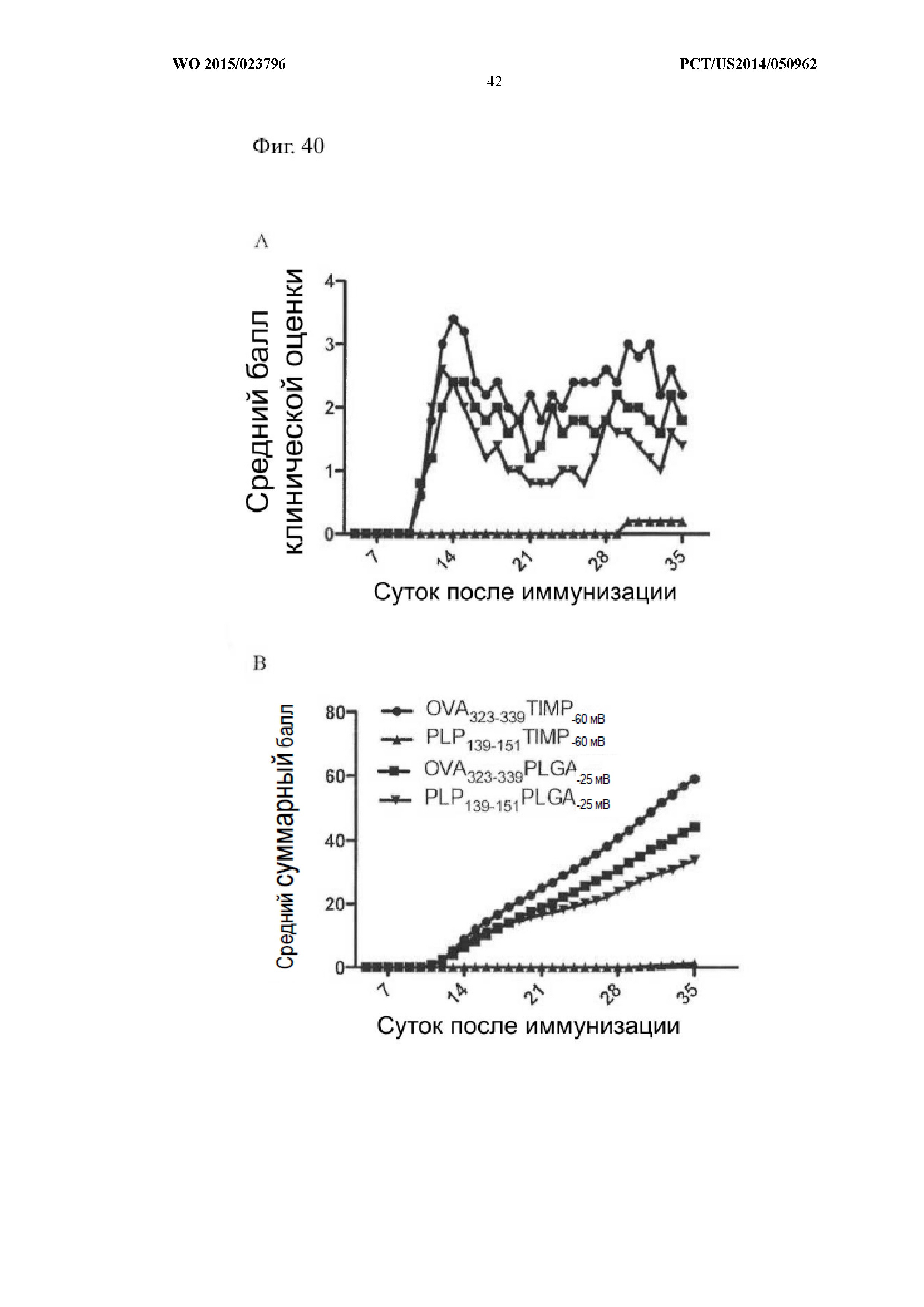
На Фиг.40 показано, что заряд введенной частицы влиял на развитие EAE в мышиной модели. Панель (A) показывает средний балл клинической оценки, а панель (B) показывает средний суммарный балл у животных с EAE. Мыши получали TIMP (толерогенные иммуномодифицирующие частицы) с зарядом -60 мВ или -25 мВ, конъюгированные с антигеном. Мышам вводили OVA323–339-TIMP-60 мв, OVA323–339-PLGA-25 мв, PLP139–151-TIMP-60 мв или PLP139–151-PLGA-25 мв и определяли балльную клиническую оценку заболевания. Более отрицательно заряженные частицы TIMP-60 мв индуцировали толерантность более эффективно, чем частицы PLGA-25 мв.
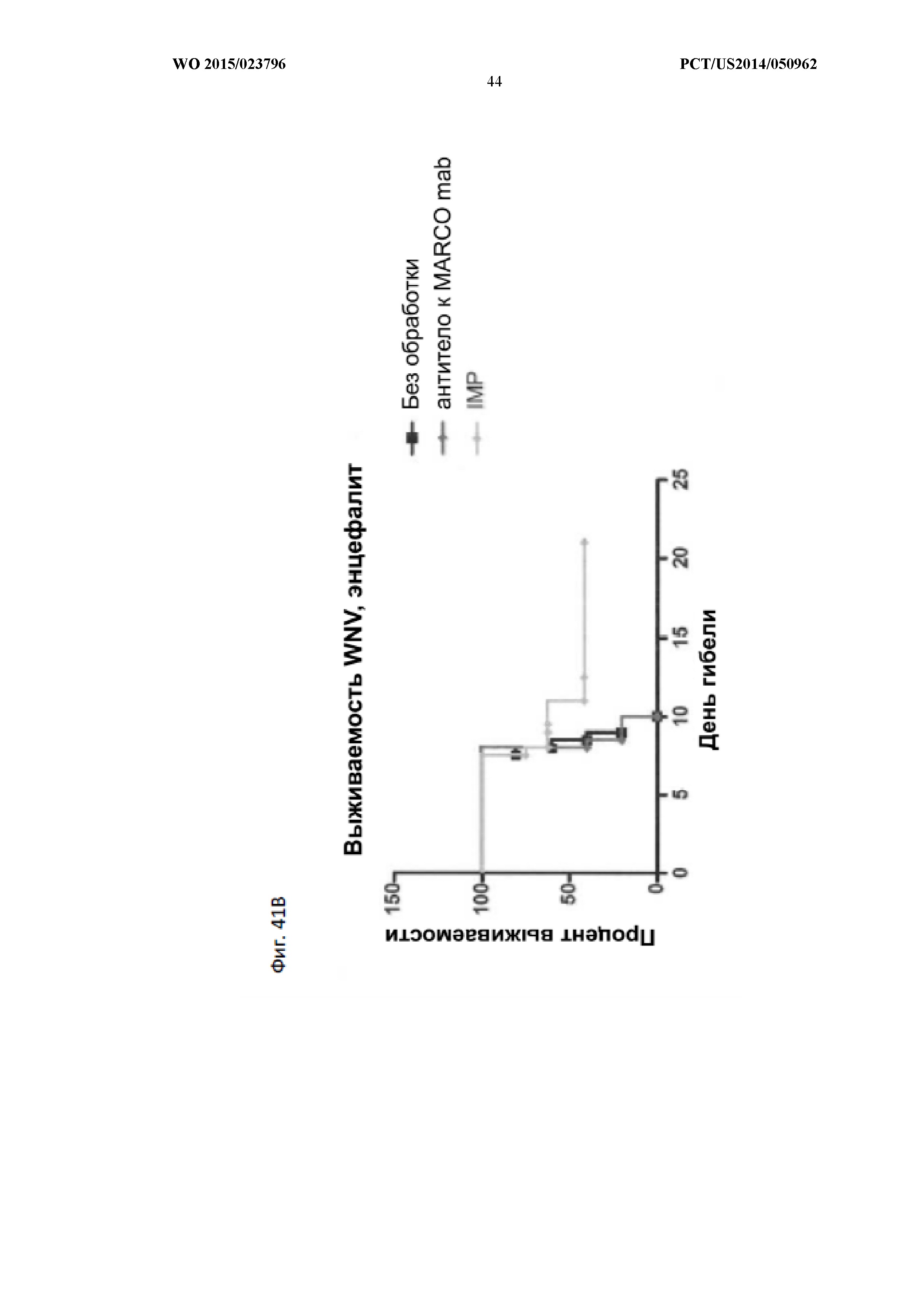
На Фиг.41 показано, что заряд иммуномодифицирующей частицы важен для направления иммуномодифицирующей частицы к антигенпредставляющей клетке. Животным дикого типа или животным MARCO -/+вводили либо PS-IMP, либо носитель. Результаты показывают, что частицы со сниженным отрицательным зарядом имеют меньшую эффективность из-за меньшего взаимодействия с фагоцитарным рецептором MARCO (A). Антитело к MARCO само по себе не способно обеспечить эффективность, аналогичную PLGA IMP (B).
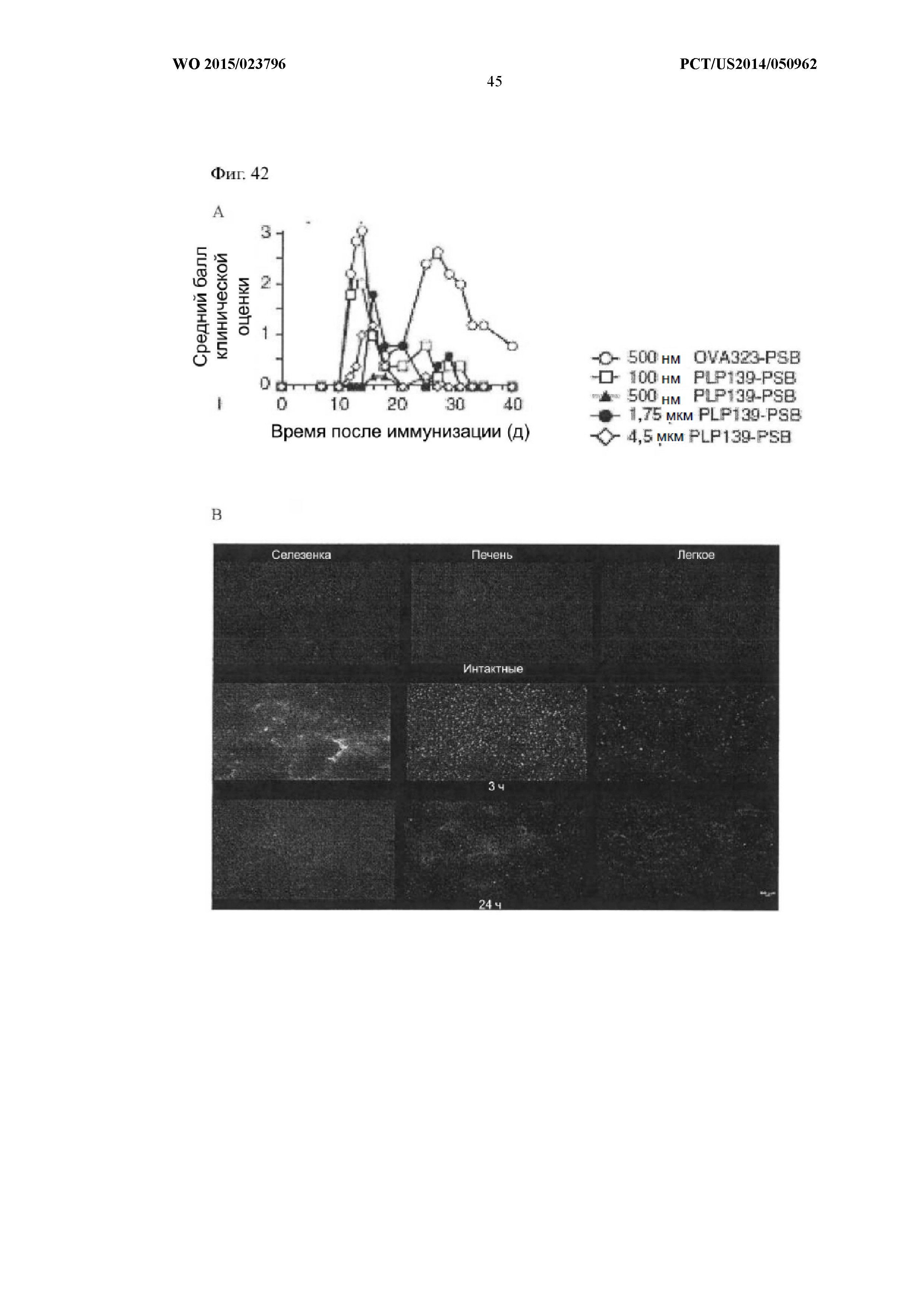
На Фиг.42 показаны основные параметры частиц, необходимые для толерантности в мышиной модели EAE. На панели (A) показано, что наиболее эффективным является средний размер частиц 500 нм. Мышам вводили 500 нм частицы OVA323–339-PSB, 100 нм частицы PLP139–151-PSB, 500 нм частицы PLP139–151-PSB, 1,75 мкм частицы PLP139–151-PSB или 4,5 мкм частицы PLP139–151-PSB и определяли балльную клиническую оценку заболевания. На панели (B) показано, что через 24 часа после внутривенной инфузии флуоресцентно-меченые частицы с соотношением 50: 50 лактид: гликолид практически выводились из селезенки, печени и легкого.
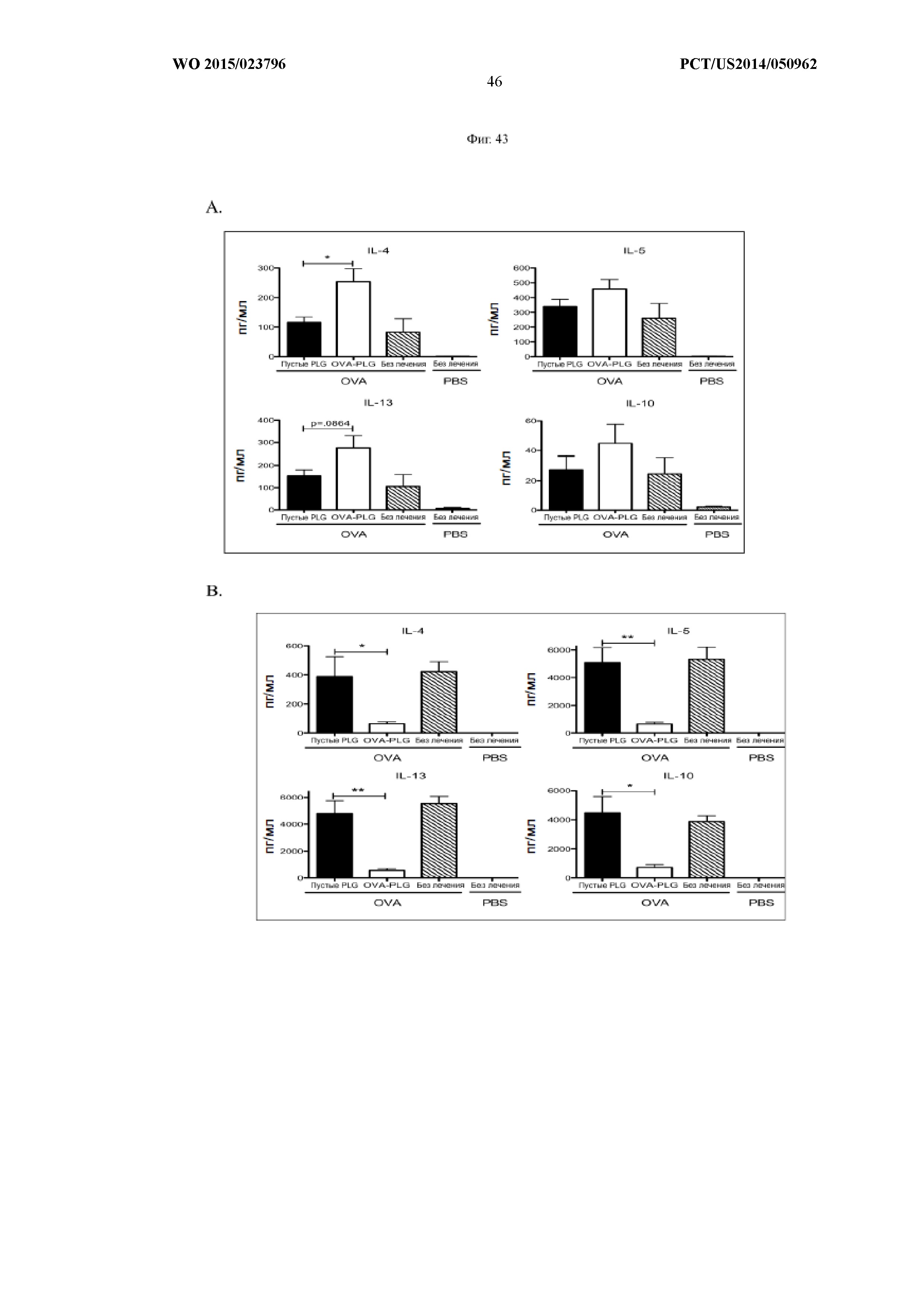
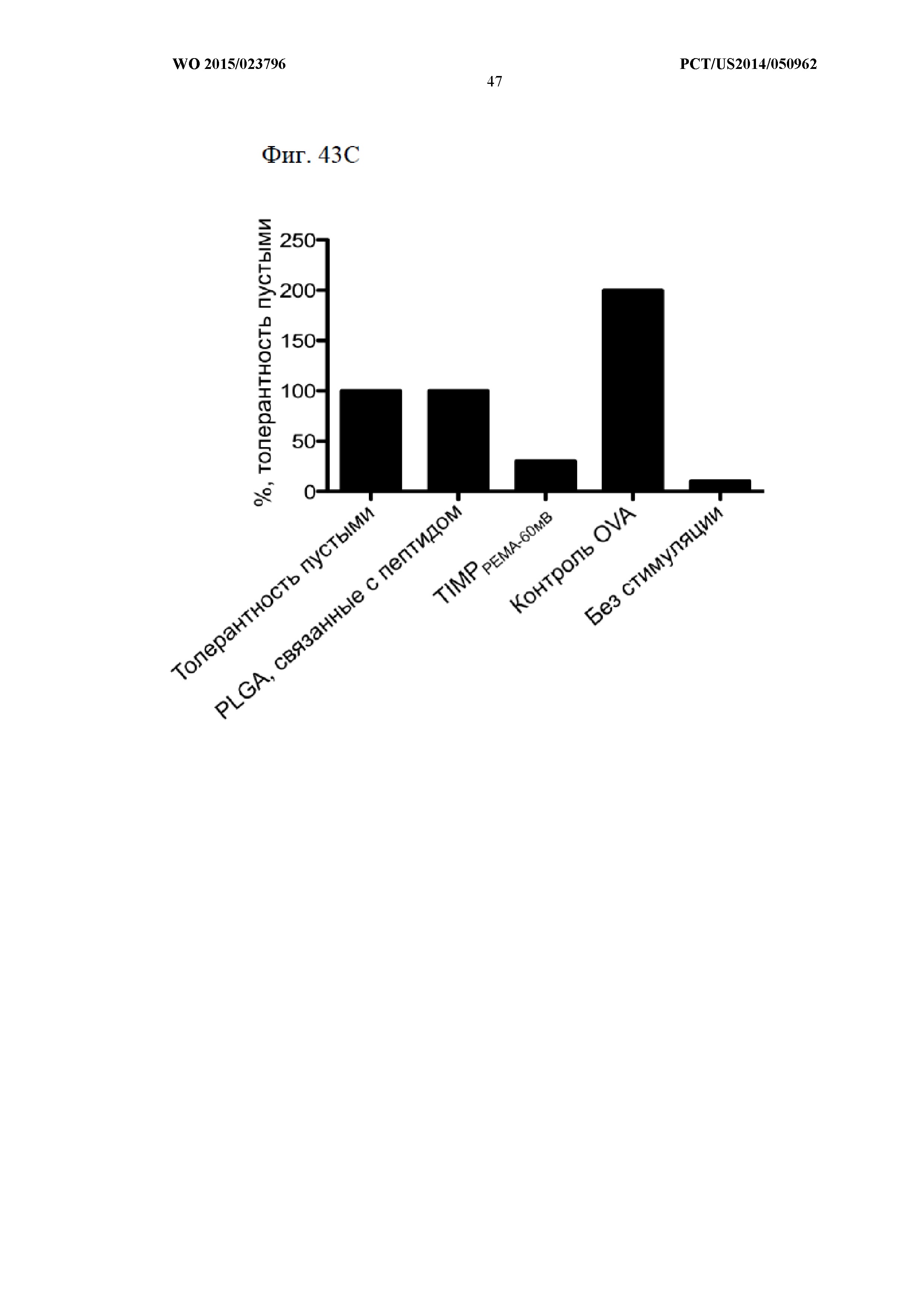
На Фиг.43 показано, что TIMP с инкапсулированными антигенами являются более эффективными, чем связанные с пептидом частицы. В мышиной модели аллергии на животных воздействовали OVA в качестве антигена, а затем вводили пустые частицы PLG, не вводили ничего, вводили PLGA-частицы с OVA, связанным с наружной поверхностью частицы (A), или вводили PLGA-частицы с OVA, инкапсулированным внутрь частицы (TIMP) (B). На панели (A) показано, что частицы OVA-PLG с присоединенным к поверхности пептидом не снижают TH2-ответ. На панели (B) показано, что частицы TIMPPEMA-60 мв(OVA инкапсулирован внутрь частицы) ингибируют TH2-ответ.На панели (C) показано, что частицы TIMPPEMA-60 мв(OVA инкапсулирован внутрь частицы) ингибируют вторичный иммунный ответ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что наночастицы, связанные с антигеном, могут индуцировать толерантность к аутоиммунному заболеванию и снижать иммунный ответ. Эти частицы могут индуцировать толерантность независимо от того, связаны они с поверхностью частицы или инкапсулированы внутри нее. Следовательно, эти частицы могут подходить для лечения любого заболевания или состояния, которое характеризуется чрезмерным воспалительным иммунным ответом, такого как аутоиммунные заболевания или аллергии.
В настоящем документе термин «частица» относится к очень малому количеству любой композиции веществ нетканевого происхождения, это может быть сфера или сферический элемент, гранула или липосома. Термин «частица», термин «иммуномодифицирующая частица», термин «частица-носитель» и термин «гранула» могут использоваться на взаимозаменяемой основе в зависимости от контекста. Кроме того, термин «частица» также может охватывать гранулы и сферы.
Термин «отрицательно заряженная частица» в настоящем документе означает частицы, модифицированные таким образом, чтобы иметь суммарный заряд поверхности меньше нуля.
«Карбоксилированные частицы», или «карбоксилированные гранулы», или «карбоксилированные сферы» включают в себя любую частицу, модифицированную таким образом, чтобы на ее поверхности находилась карбоксильная группа. В некоторых вариантах осуществления добавление карбоксильной группы усиливает поглощение частиц фагоцитами/моноцитами из системы кровообращения, например, посредством взаимодействия с фагоцитарными рецепторами, такими как MARCO. Карбоксилирование частиц можно произвести с помощью любого соединения, которое вводит карбоксильные группы, включая, без ограничений, поли(этилен-малеиновый ангидрид) (PEMA).
В настоящем документе «антигенный фрагмент» относится к фрагменту, например пептиду, который обнаруживается иммунной системой хозяина. Примеры антигенных фрагментов включают в себя, без ограничений, ферменты, аутоантигены и/или бактериальные или вирусные белки, пептиды, лекарственные средства или компоненты. Без связи с какой-либо теорией, притом что карбоксилированные гранулы сами по себе могут обнаруживаться иммунной системой, в целях изобретения карбоксилированные гранулы, к которым ничего больше не присоединено, не считаются «антигенным фрагментом».
В настоящем документе «свободные гранулы», или «свободные частицы», или «свободные сферы» относятся к гранулам, частицам или сферам, которые не были карбоксилированы.
В настоящем документе «провоспалительные медиаторы» или «провоспалительные полипептиды» относятся к полипептидам или их фрагментам, которые вызывают, поддерживают или продлевают воспаление у субъекта. Примеры провоспалительных медиаторов включают в себя, без ограничений, цитокины и хемокины.
В настоящем документе термин «воспалительный моноцит» относится к любой миелоидной клетке, экспрессирующей любую комбинацию CD14/CD26 и CCR2.
В настоящем документе термин «ингибиторный нейтрофил» относится к нейтрофилам и/или супрессорным клеткам моноцитарного происхождения.
В настоящем документе термин «Th-клетка» или «хелперная Т-клетка» относится к клеткам CD4+. Т-клетки CD4+помогают другим белым клеткам крови осуществлять иммунологические процессы, включая созревание В-клеток в плазматические клетки и В-клетки памяти и активацию цитотоксических Т-клеток и макрофагов. T-клетки активируются, когда пептидные антигены представляются молекулами MHC класса II, экспрессированными на поверхности антигенпредставляющих клеток (АПК).
В настоящем документе термин «клетка Th1» относится к субпопуляции Th-клеток, продуцирующей провоспалительные медиаторы. Клетки Th1 секретируют цитокины, усиливающие иммунный ответ и играющие роль в защите хозяина от патогенов, отчасти путем привлечения нейтрофилов и макрофагов к инфицированным тканям. Клетки Th1 секретируют такие цитокины, как IFN-гамма, IL2, IL-10 и ФНО-альфа/бета, координируя защиту от внутриклеточных патогенов, таких как вирусы и некоторые бактерии.
В настоящем документе термин «клетки Th2» относится к субпопуляции Th-клеток, которая участвует в активации и поддержании опосредуемого антителами иммунного ответа против внеклеточных паразитов, бактерий, аллергенов и токсинов. Клетки Th2 участвуют в реализации этих функций, продуцируя различные цитокины, такие как IL-4, IL-5, IL-6, IL-9, IL-13 и IL-17E (IL-25), ответственные за продукцию антител, активацию эозинофилов и ингибирование некоторых функций макрофагов, тем самым обеспечивая независимые от фагоцитов защитные ответы.
В настоящем документе термин «клетка Th17» относится к субпопуляции Th-клеток. Клетки Th17 секретируют цитокины, усиливающие иммунный ответ и играющие роль в защите хозяина от патогенов путем привлечения нейтрофилов и макрофагов к инфицированным тканям. Клетки Th17 секретируют такие цитокины, как IL17, IL21, IL22, IL24, IL26 и ФНО-альфа, координируя защиту от внеклеточных патогенов, включая грибы и бактерии.
Термин «связанный» в настоящем документе относится к антигену, связанному с наружной поверхностью частицы или инкапсулированному внутри частицы. Таким образом, термин «антиген, связанный с частицей», включает в себя как связывание с поверхностью, так и инкапсулирование внутрь частицы.
Термин IMP в настоящем документе означает иммуномодифицирующие частицы, которые не связаны с антигеном. Термин TIMP в настоящем документе означает толерогенные иммуномодифицирующие частицы, которые связаны с антигеном. В некоторых вариантах осуществления антиген прикрепляется к поверхности TIMP. В других вариантах осуществления антиген инкапсулирован внутри TIMP.
Частицы могут быть любой формы или конформации. Однако в некоторых вариантах осуществления предпочтительным является применение частиц, которые менее склонны к агрегации in vivo. В этих вариантах осуществления приведены примеры частиц, которые имеют сферическую форму.
Другой аспект изобретения относится к композиции, содержащей иммуномодифицированную частицу, имеющую отрицательный дзета-потенциал и не содержащую антигенных фрагментов. В дополнительном варианте осуществления в изобретении предложены композиции, содержащие иммуномодифицированную частицу с отрицательным дзета-потенциалом, связанную с антигеном. В дополнительном варианте осуществления антиген связан с наружной поверхностью частицы. В предпочтительном варианте осуществления антиген инкапсулирован внутри частицы.
Еще один аспект изобретения относится к способу получения иммуномодифицированной частицы, имеющей отрицательный дзета-потенциал и не содержащей антигенных фрагментов. Способ включает обеспечение взаимодействия предшественника иммуномодифицированной частицы с буферным раствором в условиях, способствующих образованию иммуномодифицированной частицы с отрицательным дзета-потенциалом. В некоторых вариантах осуществления изобретения предшественник иммуномодифицированной частицы получают посредством сополимеризации. Микроструктура частицы может зависеть от способа сополимеризации.
В некоторых вариантах осуществления молекула антигенного пептида связывается с частицей-носителем (например, иммуномодифицированной частицей) при помощи конъюгатной молекулы и/или линкерной группы. В некоторых вариантах осуществления связывание антигенного пептида и/или апоптотической сигнальной молекулы с носителем (например, PLG-частицей) включает одно или более ковалентных и/или нековалентных взаимодействий. В некоторых вариантах осуществления антигенный пептид прикрепляется к поверхности частицы-носителя с отрицательным дзета-потенциалом. В некоторых вариантах осуществления антигенный пептид инкапсулируется внутрь частицы-носителя с отрицательным дзета-потенциалом.
В одном варианте осуществления буферный раствор, контактирующий с иммуномодифицированной частицей, может иметь щелочной pH. Подходящий щелочной pH для щелочного раствора включает в себя 7,1; 7,5; 8,0; 8,5; 9,5; 10,0; 10,5; 11,0; 11,5; 12,0; 12,5; 13,0 и 13,5. Буферный раствор также может состоять из любого подходящего основания и его конъюгата. В некоторых вариантах осуществления изобретения буферный раствор может включать в себя, без ограничений, бикарбонат натрия, бикарбонат калия, бикарбонат лития, дигидрофосфат калия, дигидрофосфат натрия или дигидрофосфат лития и их конъюгаты.
В одном варианте осуществления изобретения иммуномодифицированные частицы содержат сополимеры. Эти сополимеры могут иметь различное молярное соотношение. Подходящее соотношение сополимеров иммуномодифицированных частиц, представленных в настоящем изобретении, может составлять 25: 75, 30: 70, 35: 65, 40: 60, 45: 55, 50: 50, 55: 45, 60: 40, 65: 35, 70: 30, 75: 25, 80: 20, 81: 19, 82: 18, 83: 17, 84: 16, 85: 15, 86: 14, 87: 13, 88: 12, 89: 11, 90: 10, 91: 9, 92: 8, 93: 7, 94: 6, 95: 5, 96: 4, 97: 3, 98: 2, 99: 1 или 100: 0. В другом варианте осуществления сополимер может представлять собой периодические, статистические, линейные, разветвленные сополимеры (включая звездообразные, щеткообразные или гребнеобразные сополимеры). В некоторых вариантах осуществления соотношение сополимеров может составлять, без ограничений, полистирол: поли(винилкарбоксилат)/80: 20, полистирол: поли(винилкарбоксилат)/90: 10, поли(винилкарбоксилат): полистирол/80: 20, поли(винилкарбоксилат): полистирол/90: 10, полимолочная кислота: полигликолевая кислота/50: 50, полимолочная кислота: полигликолевая кислота/80: 20 или полимолочная кислота: полигликолевая кислота/90: 10.
В одном варианте осуществления частицы изобретения получают путем добавления композиции, содержащей полимер (например, PLGA) к раствору поли(этилен-малеинового ангидрида) (PEMA). Концентрация PEMA в растворе может составлять от около 0,1% до около 10%. В одном варианте осуществления концентрация PEMA в растворе составляет от около 0,2% до около 5%. В другом варианте осуществления концентрация PEMA в растворе составляет от около 0,1% до 4%. В другом варианте осуществления концентрация PEMA в растворе составляет от около 0,1% до 2%. В другом варианте осуществления концентрация PEMA в растворе составляет от около 0,5% до 1%. В одном варианте осуществления процентная доля PEMA в растворе составляет 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5% или 10%. В одном варианте осуществления процентная доля PEMA в растворе составляет около 0,5%. В другом варианте осуществления процентная доля PEMA в растворе составляет около 1,0%. Другие соединения, которые можно использовать, включают в себя, без ограничений, поли(этилен-альт-малеиновый ангидрид), поли(изобутилен-со-малеиновая кислота), поли(метилвиниловый эфир-альт-малеиновая кислота), поли(метилвиниловый эфир-альт-малеиновой кислоты моноэтиловый эфир), поли(метилвиниловый эфир-альт-малеиновый ангидрид), поли(метилвиниловый эфир-альт-малеиновый ангидрид), сшитый с 1,9-декадиеновым порошком и/или поли(стирол-альт-малеиновой кислоты) натриевая соль.
В одном варианте осуществления частица представляет собой липосому. В дополнительном варианте осуществления частица представляет собой липосому, содержащую следующие липиды в следующих молярных соотношениях - 30: 30: 40 фосфатидилхолин: фосфатидилглицерин: холестерин. В еще одном варианте осуществления антиген инкапсулирован внутри липосомы.
Необязательно, чтобы все частицы были одного размера, хотя частицы, как правило, должны иметь размер, достаточный для изолирования в селезенке или печени и запуска фагоцитоза или захвата посредством рецепторного или нерецепторного механизма антигенпредставляющей клеткой, включая эндотелиальную клетку или другую клетку системы мононуклеарных фагоцитов (MPS). Предпочтительно частицы имеют микроскопический или наноскопический размер для усиления растворимости, предотвращения возможных осложнений, вызванных агрегацией in vivo, и содействия пиноцитозу. Размер частиц может представлять собой фактор, влияющий на поглощение из интерстициального пространства в области созревания лимфоцитов. Частица со средним диаметром от около 0,1 мкм до около 10 мкм способна запускать фагоцитоз. Таким образом, в одном варианте осуществления диаметр частицы находится в этих пределах. В другом варианте осуществления средний диаметр частицы составляет от около 0,3 мкм до около 5 мкм. В еще одном варианте осуществления средний диаметр частицы составляет от около 0,5 мкм до около 3 мкм. В другом варианте осуществления средний диаметр частицы составляет от около 0,2 мкм до около 2 мкм. В дополнительном варианте осуществления средний размер частицы составляет около 0,1 мкм или около 0,2 мкм, или около 0,3 мкм, или около 0,4 мкм, или около 0,5 мкм, или около 1,0 мкм, или около 1,5 мкм, или около 2,0 мкм, или около 2,5 мкм, или около 3,0 мкм, или около 3,5 мкм, или около 4,0 мкм, или около 4,5 мкм, или около 5,0 мкм. В конкретном варианте осуществления частица имеет средний размер 0,5 мкм. В некоторых вариантах осуществления общая масса частиц составляет менее около 10 000 кДа, менее около 5000 кДа или менее около 1000 кДа, 500 кДа, 400 кДа, 300 кДа, 200 кДа, 100 кДа, 50 кДа, 20 кДа, 10 кДа. Частицы в композиции необязательно должны быть одинакового диаметра. В качестве примера, фармацевтический состав может содержать множество частиц, некоторые из которых имеют размер около 0,5 мкм, а другие - около 1,0 мкм. Любое сочетание размеров частиц в этих указанных диапазонах будет подходящим.
Частицы настоящего изобретения могут обладать определенным дзета-потенциалом. В определенных вариантах осуществления дзета-потенциал является отрицательным. В одном варианте осуществления дзета-потенциал составляет менее чем приблизительно -100 мВ. В одном варианте осуществления дзета-потенциал составляет менее чем приблизительно -50 мВ. В определенных вариантах осуществления дзета-потенциал частиц находится в диапазоне от -100 мВ до 0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -75 мВ до 0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -60 мВ до 0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -50 мВ до 0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -40 мВ до 0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -30 мВ до 0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -20 мВ до+0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -10 мВ до -0 мВ. В дополнительном варианте осуществления дзета-потенциал частиц находится в диапазоне от -100 мВ до -50 мВ. В другом конкретном варианте осуществления дзета-потенциал частиц находится в диапазоне от -75 мВ до 50 мВ. В конкретном варианте осуществления дзета-потенциал частиц находится в диапазоне от -50 мВ до -40 мВ.
В некоторых вариантах осуществления заряд носителя (например, положительный, отрицательный, нейтральный) выбирают для придания специфичных для применения полезных свойств (например, физиологической совместимости, благоприятных взаимодействий пептида с поверхностью и т.п.). В некоторых вариантах осуществления носитель имеет суммарный нейтральный или отрицательный заряд (например, для уменьшения неспецифического связывания с клеточной поверхностью, которая обычно несет суммарный отрицательный заряд). В некоторых вариантах осуществления носители могут быть конъюгированы, прямо или опосредованно, с антигеном, для которого желательно выработать толерантность (который в настоящем документе также именуется антиген-специфическим пептидом, антигенным пептидом, аутоантигеном, индуцирующим антигеном или антигеном для индукции толерантности). В некоторых случаях носитель имеет множество сайтов связывания (например, 2, 3, 4, 5, 6, 7, 8, 9, 10… 20… 50… 100 или более), чтобы существовало множество экземпляров антиген-специфического пептида или множества разных пептидов, экспонированных на поверхности (например, для повышения вероятности толерогенного ответа). В некоторых вариантах осуществления носитель экспонирует один тип антигенного пептида. В некоторых вариантах осуществления носитель экспонирует на поверхности множество разных антигенных пептидов. В некоторых вариантах осуществления поверхность носителя имеет функциональные группы для ковалентного прикрепления выбранных фрагментов (например, антигенных пептидов). В некоторых вариантах осуществления функциональные группы на поверхности носителя предоставляют сайты для нековалентного взаимодействия с выбранными фрагментами (например, антигенными пептидами). В некоторых вариантах осуществления носитель имеет поверхность, на которой конъюгируемые фрагменты могут абсорбироваться без образования химических связей.
Размер и заряд частиц является критичным для индукции толерантности. Хотя частицы будут отличаться по размеру и заряду в зависимости от инкапсулированного в них антигена (см. таблицу 1, где представлены примеры конкретных частиц), в целом частицы настоящего изобретения эффективно индуцируют толерантность, если имеют размер от около 100 нанометров до около 1500 нанометров и имеют заряд от 0 до около -70 мВ, а также являются наиболее эффективными для индуцирования толерантности, если имеют размер 400–800 мкм и заряд от около -25 мВ до -70 мВ. Кроме того, как показано в таблице 1, отчасти из-за концентрации частиц и присутствия сахарозы и D-маннита в процессе лиофилизации, средний размер и заряд частиц могут немного изменяться в ходе лиофилизации, и, следовательно, приводятся средние размеры как после синтеза, так и после лиофилизации. В настоящем документе термины «размер после синтеза» и «заряд после синтеза» относятся к размеру и заряду частиц перед лиофилизацией. Термины «размер после лиофилизации» и «заряд после лиофилизации» относятся к размеру и заряду частиц после лиофилизации.
ТАБЛИЦА 1. АНАЛИЗ ТИПИЧНЫХ ЧАСТИЦ
В некоторых вариантах осуществления частица является неметаллической. В этих вариантах осуществления частица может быть образована из полимера. В предпочтительном варианте осуществления частица биологически разлагается в организме субъекта. В этом варианте осуществления частицы могут вводиться субъекту во множестве доз, при этом не происходит накопление частиц в организме субъекта. Примеры подходящих частиц включают в себя частицы полистирола, PLGA-частицы, частицы стабилизированного при помощи PLURIONICS полипропиленсульфида и частицы алмаза.
Предпочтительно поверхность частицы образована из материала, минимизирующего неспецифические или нежелательные биологические взаимодействия. Взаимодействия между поверхностью частицы и интерстициальной тканью могут влиять на лимфатическое поглощение. Поверхность частиц может быть покрыта материалом для предотвращения или уменьшения неспецифических взаимодействий. Пространственная стабилизация путем покрытия частиц гидрофильными слоями, такими как поли(этиленгликоль) (ПЭГ) и его сополимеры, такими как PLURONICS® (включая сополимеры поли(этиленгликоля)-блок-поли(пропиленгликоля)-блок-поли(этиленгликоля)), может уменьшать неспецифические взаимодействия с белками интерстициальной ткани, что демонстрируется улучшенным лимфатическим поглощением после подкожных инъекций. Все эти факты указывают на важность физических свойств частиц для лимфатического поглощения. Биоразлагаемые полимеры можно использовать для получения всех или некоторых из полимеров и/или частиц и/или слоев. Биоразлагаемые полимеры могут подвергаться разложению, например, в результате взаимодействия функциональных групп с водой в растворе. В настоящем документе термин «разложение» означает обретение растворимости путем снижения молекулярной массы или превращения гидрофобных групп в гидрофильные группы. Полимеры со сложноэфирными группами по существу подвержены спонтанному гидролизу, например полилактиды и полигликолиды.
Частицы настоящего изобретения также могут содержать дополнительные компоненты. Например, носители могут иметь визуализирующие агенты, введенные в носитель или конъюгированные с ним. Пример наносфер носителя с визуализирующим агентом, который в настоящее время доступен в продаже, представляет собой наносферы Kodak X-sight. Неорганические квантово-размерные люминесцентные нанокристаллы, известные как квантовые точки (КТ), оказались идеальными донорами для методик резонансного переноса энергии флуоресценции (FRET): их высокий квантовый выход и настраиваемые размерозависимые стоксовы сдвиги позволяют частицам с различными размерами излучать в диапазонах от синего до инфракрасного, причем их возбуждение происходит на одной длине волны в ультрафиолетовом диапазоне. (Bruchez, et al., Science, 1998, 281, 2013; Niemeyer, C. M Angew. Chem. Int. Ed. 2003, 42, 5796; Waggoner, A. Methods Enzymol. 1995, 246, 362; Brus, L. E. J. Chem. Phys. 1993, 79, 5566). Квантовые точки, такие как гибридные органические/неорганические квантовые точки, основанные на классе полимеров, известных как дендримеры, можно использовать при биологическом мечении, визуализации и в оптических биосенсорных системах (Lemon, et al., J. Am. Chem. Soc. 2000, 122, 12886). В отличие от традиционного синтеза неорганических квантовых точек, синтез наночастиц гибридных квантовых точек не требует высоких температур или высокотоксичных нестабильных реагентов (Etienne, et al., Appl. Phys. Lett. 87, 181913, 2005).
Частицы могут быть образованы из широкого диапазона материалов. Частица предпочтительно образована из материала, подходящего для биологического применения. Например, частицы могут быть образованы из стекла, кремнезема, сложных полиэфиров гидроксикарбоновых кислот, полиангидридов дикарбоновых кислот или сополимеров гидроксикарбоновых кислот и дикарбоновых кислот. В более общем случае частицы-носители могут быть образованы из сложных полиэфиров с линейной цепью или разветвленных, замещенных или незамещенных, насыщенных или ненасыщенных, линейных или поперечносшитых алканила, галогеналкила, тиоалкила, аминоалкила, арила, аралкила, алкенила, аралкенила, гетероарила или алкоксигидроксикислот, или полиангидридов с линейной цепью или разветвленных, замещенных или незамещенных, насыщенных или ненасыщенных, линейных или поперечносшитых алканила, галогеналкила, тиоалкила, аминоалкила, арила, аралкила, алкенила, аралкенила, гетероарила или алкоксидикарбоновых кислот. Кроме того, частицы-носители могут представлять собой квантовые точки или быть образованы из квантовых точек, например частицы полистирола со свойствами квантовых точек (Joumaa et al. (2006) Langmuir 22: 1810–6). Также можно использовать частицы-носители, включая сочетания сложноэфирных и ангидридных связей (например, сополимеры гликолевой и себациновой кислот). Например, частицы-носители могут содержать материалы, включая полимеры полигликолевой кислоты (PGA), полимеры полимолочной кислоты (PLA), полимеры полисебациновой кислоты (PSA), сополимеры молочной и гликолевой кислот (PLGA или PLG, термины являются взаимозаменяемыми), сополимеры молочной и себациновой кислот (PLSA), сополимеры гликолевой и себациновой кислот (PGSA), полимеры полипропиленсульфида, поли(капролактон), хитозан и т.п. Другие биосовместимые биоразлагаемые полимеры, подходящие для применения в настоящем изобретении, включают в себя полимеры или сополимеры капролактонов, карбонатов, амидов, аминокислот, сложных ортоэфиров, ацеталей, цианоакрилатов и разлагаемых уретанов, а также их сополимеры с линейной цепью или разветвленными, замещенными или незамещенными алканилом, галогеналкилом, тиоалкилом, аминоалкилом, алкенилом или ароматическими гидрокси- или дикарбоновыми кислотами. Кроме того, биологически важные аминокислоты с реакционноспособными группами боковой цепи, такие как лизин, аргинин, аспарагиновая кислота, глутаминовая кислота, серин, треонин, тирозин и цистеин или их энантиомеры, могут быть включены в сополимеры с любым из перечисленных выше материалов, чтобы обеспечить наличие реакционноспособных групп для конъюгации с антигенными пептидами и белками или конъюгирующими фрагментами. Биоразлагаемые материалы, подходящие для применения в настоящем изобретении, включают в себя алмаз, PLA, PGA, полипропиленсульфид и полимеры PLGA. Биосовместимые, но биологически неразлагаемые материалы также могут использоваться в частицах-носителях изобретения. Например, могут использоваться биологически неразлагаемые полимеры акрилатов, этиленвинилацетатов, ацилзамещенных ацетатов целлюлозы, неразлагаемых уретанов, стиролов, винилхлоридов, винилфторидов, винилимидазолов, хлорсульфонированных олефинов, этиленоксидов, виниловых спиртов, TEFLON® (DuPont, г.Уилмингтон, штат Делавэр) и нейлонов.
Частицы настоящего изобретения можно производить любым способом, хорошо известным в данной области. Примеры способов производства частиц включают в себя, без ограничений, полимеризацию в микроэмульсии, полимеризацию на границе раздела фаз, полимеризацию осаждением, выпаривание в эмульсионной среде, диффузию в эмульсионной среде, замещение растворителя и высаливание (Astete and Sabliov, J. Biomater. Sci. Polymer Edn., 17: 247–289(2006)). Посредством преобразования способа производства PLGA-частиц можно регулировать свойства частиц (например, размер, распределение по размеру, дзета-потенциал, морфологию, гидрофобность/гидрофильность, фиксацию полипептидов и т.п.). На размер частицы влияет ряд факторов, включая, без ограничений, концентрацию PLGA, используемый при производстве частиц растворитель, свойства органической фазы, используемые при производстве поверхностно-активные вещества, вязкость диспергирующей и дисперсной фаз, свойства используемого растворителя, температуру используемой воды, ультразвуковую обработку, скорость выпаривания, добавки, напряжение сдвига, стерилизацию и свойства любого инкапсулированного антигена или полипептида.
Размер частиц зависит от концентрации полимера; чем выше концентрации полимеров, тем больше размер образованных частиц. Например, если в качестве растворителя используется пропиленкарбонат, повышение концентрации PLGA с 1% до 4% (вес./об.) может увеличить средний размер частиц с около 205 нм до около 290 нм. Альтернативно, в этилацетате и 5% Pluronic F-127 повышение концентрации PLGA с 1% до 5% (вес./об.) увеличивает средний размер частиц с 120 нм до 230 нм.
Вязкость диспергирующей и дисперсной фаз также является важным параметром, влияющим на процесс диффузии, ключевой этап образования частиц меньшего размера. Размер частиц увеличивается с повышением вязкости дисперсной фазы, причем размер частиц уменьшается с повышением вязкости диспергирующей фазы. Как правило, чем ниже фазовое отношение органического растворителя к водному, тем меньше размер частиц.
Скорость гомогенизатора и характер перемешивания также влияют на размер частиц; как правило, повышение скорости и интенсивности перемешивания приводит к уменьшению размера частиц, но существует точка, в которой дополнительное повышение скорости и интенсивности перемешивания больше не приводит к уменьшению размера частиц. Положительное воздействие на уменьшение размера оказывает гомогенизация эмульсии с помощью гомогенизатора высокого давления по сравнению с простым перемешиванием. Например, при фазовом отношении 20% в 5% ПВС средний размер частиц при перемешивании составляет 288 нм, а при гомогенизации (высокое давление 30 МПа (300 бар)) средний размер частиц составляет 231 нм.
Значительного уменьшения размера частиц можно достичь путем варьирования температуры воды, добавляемой для улучшения диффузии растворителя. Средний размер частиц уменьшается с повышением температуры воды.
Свойства полипептида, инкапсулированного в частице, также влияет на размер частиц. Как правило, инкапсуляция гидрофобных полипептидов приводит к образованию частиц меньшего размера по сравнению с инкапсуляцией более гидрофильных полипептидов. В способе двойной эмульсии фиксация более гидрофильных полипептидов улучшается за счет использования высокомолекулярного PLGA и высокомолекулярного первого поверхностно-активного вещества, повышающего внутрифазовую вязкость. Взаимодействие между растворителем, полимером и полипептидом влияет на эффективность включения полипептида в частицу.
Молекулярная масса PLGA влияет на конечный средний размер частиц. Как правило, чем больше молекулярная масса, тем больше средний размер частиц. Например, при изменении композиции и молекулярной массы PLGA (например, 12–48 кДа для 50: 50 PLGA; 12–98 кДа для 75: 25 PLGA) средний размер частиц будет варьироваться (около 102–154 нм; около 132–152 нм соответственно). Даже когда частицы имеют одинаковую молекулярную массу, их композиция может влиять на средний размер частиц; например, частицы с соотношением 50: 50 по существу образуют частицы меньшего размера, чем частицы с соотношением 75: 25. Концевые группы полимера также влияют на размер частиц. Например, полученные частицы со сложноэфирными концевыми группами образуют частицы со средним размером 740 нм (индекс полидисперсности (PI)=0,394) по сравнению со средним размером PLGA-частиц с кислотными концевыми группами, который составляет 240 нм (PI=0,225).
Используемый растворитель также может влиять на размер частиц: растворители, снижающие поверхностное натяжение раствора, также уменьшают размер частиц.
Органический растворитель удаляют путем выпаривания в вакууме, чтобы предотвратить повреждение полимера и полипептида и стимулировать уменьшение конечного размера частиц. Выпаривание органического растворителя в вакууме является более эффективным при получении частиц меньшего размера. Например, выпаривание в вакууме позволяет получить частицы со средним размером частиц, который приблизительно на 30% меньше среднего размера частиц, полученных при выпаривании в обычном режиме.
Амплитуда длины волны при ультразвуковой обработке также влияет на характеристики частиц. Для образования стабильных миниэмульсий без дальнейшего изменения размера капли амплитуда длины волны должна составлять более 20% при ультразвуковой обработке длительностью 600–800 с. Однако главным недостатком ультразвуковой обработки является потеря монодисперсности образованной эмульсии.
Органические фазы, которые можно использовать при производстве частиц изобретения, включают в себя, без ограничений, этилацетат, метилэтилкетон, пропиленкарбонат и бензиловый спирт. Диспергирующие фазы, которые можно использовать, включают в себя, без ограничений, поверхностно-активное вещество полоксамер 188.
При производстве частиц изобретения можно использовать различные поверхностно-активные вещества. Поверхностно-активное вещество может быть анионным, катионным или неионным. Для синтеза частиц широко используются поверхностно-активные вещества семейства полоксамера и полоксаминов. Поверхностно-активные вещества, которые можно использовать, включают в себя, без ограничений, ПЭГ, Tween-80, желатин, декстран, плюроник L-63, ПВС, метилцеллюлозу, лецитин и DMAB. Кроме того, биоразлагаемые и биосовместимые поверхностно-активные вещества включают в себя, без ограничений, витамина E TPGS (сукцинат D-α-токоферилполиэтиленгликоля 1000). В определенных вариантах осуществления необходимы два поверхностно-активных вещества (например, при выпаривании способом двойной эмульсии). Эти два поверхностно-активных вещества могут включать в себя гидрофобное поверхностно-активное вещество для первой эмульсии и гидрофобное поверхностно-активное вещество для второй эмульсии.
Растворители, которые можно использовать при производстве частиц изобретения, включают в себя, без ограничений, ацетон, тетрагидрофуран (ТГФ), хлороформ и члены семейства продуктов хлорирования, метилхлорид. При выборе органических растворителей необходимо руководствоваться двумя критериями: полимер должен быть растворим в этом растворителе, и растворитель должен быть совершенно не смешивающимся с водной фазой.
Соли, которые можно использовать при производстве частиц изобретения, включают в себя, без ограничений, гексагидрат хлорида магния, тетрагидрат ацетата магния.
Распространенные высаливающие агенты включают в себя, без ограничений, электролиты (например, хлорид натрия, ацетат магния, хлорид магния) или неэлектролиты (например, сахарозу).
Стабильность и размер частиц изобретения можно улучшить путем добавления соединений, включающих в себя, без ограничений, жирные кислоты или короткие углеродные цепи. Добавление более длинных углеродных цепей лауриновой кислоты соотносится с улучшением характеристик частиц. Более того, добавление гидрофобных добавок может улучшить размер частиц, включение полипептида в частицу и профиль высвобождения. Композиции частиц можно стабилизировать посредством лиофилизации. Добавление криозащитного агента, такого как трегалоза, может уменьшить агрегацию частиц после лиофилизации.
Подходящие гранулы, которые в настоящее время доступны в продаже, включают в себя гранулы полистирола, такие как FluoSpheres (Molecular Probes, г.Юджин, штат Орегон).
В некоторых вариантах осуществления в настоящем изобретении предложена система, содержащая: (a) каркас для доставки, выполненный с возможностью доставки химических и/или биологических агентов субъекту; и (b) связанные с антигеном частицы сополимера лактида и гликолида для индукции антиген-специфической толерантности. В некоторых вариантах осуществления по меньшей мере часть упомянутого каркаса для доставки является микропористой. В некоторых вариантах осуществления связанные с антигеном частицы сополимера лактида и гликолида инкапсулированы в упомянутый каркас. В некоторых вариантах осуществления химические и/или биологические агенты выбирают из группы, состоящей из белка, пептида, низкомолекулярных соединений, нуклеиновых кислот, клеток и частиц. В некоторых вариантах осуществления химические и/или биологические агенты содержат клетки, а упомянутые клетки содержат островковые клетки поджелудочной железы.
Физические свойства также связаны с функциональностью наночастицы после ее поглощения и удержанием в областях с незрелыми лимфоцитами. Они включают в себя механические свойства, такие как жесткость или высокая эластичность. В некоторых вариантах осуществления за основу берется каучукообразное ядро, например ядро из поли(пропиленсульфида) (ППС) с наружным слоем, например наружным гидрофильным слоем, как в ПЭГ или системе ППС-ПЭГ, недавно разработанной и описанной для системной (но не направленной или иммунной) доставки. Каучукообразное ядро является противоположностью по существу жесткого ядра, как в системе полистирольных или металлических наночастиц. Термин «каучукообразный» относится к определенным эластичным материалам, помимо натуральных или синтетических каучуков, причем этот термин известен специалистам в области полимеров. Например, для получения гидрофобного каучукообразного ядра можно использовать поперечносшитый ППС. ППС представляет собой полимер, который в окислительных условиях разлагается до полисульфоксида и конечного продукта полисульфона, превращаясь из гидрофобного каучука в гидрофильный водорастворимый полимер. Для использования можно адаптировать другие сульфидные полимеры, причем термин «сульфидный полимер» относится к полимеру, у которого в основной цепи единицы повтора присутствует сера. Другие каучукообразные полимеры, которые можно использовать, представляют собой сложные полиэфиры с температурой стеклования в гидратированных условиях менее чем приблизительно 37°C. Гидрофобное ядро можно преимущественно использовать в сочетании с гидрофильным наружным слоем, поскольку ядро и наружный слой не будут иметь тенденцию смешиваться, т.е. наружный слой будет стремиться пространственно вытягиваться в направлении от ядра. Ядро означает частицу с нанесенным на нее слоем. Слой означает материал, покрывающий по меньшей мере часть ядра. Слой может быть абсорбированным или ковалентно связанным. Частица или ядро могут быть сплошными или полыми. Каучукообразные гидрофобные ядра являются предпочтительными по сравнению с жесткими гидрофобными ядрами, такими как кристаллические или стеклообразные (как в случае полистирола) ядра, поскольку частицы с каучукообразными гидрофобными ядрами могут переносить большее количество гидрофобных лекарственных средств.
Другим физическим свойством является гидрофильность поверхности. Растворимость гидрофильного материала (несшитого) в воде может составлять по меньшей мере 1 грамм на литр. Пространственная стабилизация частиц с помощью гидрофильных полимеров может улучшить их поглощение из интерстициальной ткани вследствие уменьшения неспецифических взаимодействий; однако возросшая невидимость частицы также может уменьшать ее интернализацию фагоцитарными клетками в областях с незрелыми лимфоцитами. Однако проблему баланса между этими конкурирующими особенностями удалось решить, и в настоящей заявке описано создание наночастиц для эффективной лимфатической доставки в дендритные клетки (DC) и другие АПК в лимфатических узлах. Некоторые варианты осуществления включают в себя гидрофильный компонент, например слой гидрофильного материала. Примеры подходящих гидрофильных материалов представляют собой один или более из полиалкиленоксидов, полиэтиленоксидов, полисахаридов, полиакриловых кислот и полиэфиров. Молекулярную массу полимеров в слое можно скорректировать для обеспечения подходящей степени пространственной изоляции in vivo, например, от около 1000 до около 100 000 или более; специалистам в данной области будет сразу понятно, что следует учитывать все диапазоны и значения, находящиеся в рамках явно обозначенных диапазонов, например, между 10 000 и 50 000.
Наночастицы могут содержать функциональные группы для дополнительного взаимодействия. Функциональные группы для дополнительного взаимодействия включают в себя электрофилы или нуклеофилы; они подходят для взаимодействия с другими молекулами. Примерами нуклеофилов являются первичные амины, тиолы и гидроксилы. Примерами электрофилов являются сложные сукцинимидилэфиры, альдегиды, изоцианаты и малеинимиды.
Для того чтобы конъюгировать антигенные белки и пептиды с носителями, можно использовать множество средств, хорошо известных в данной области. Эти способы включают в себя все стандартные химические способы, которые не разрушают или серьезно не ограничивают биологическую активность антигенных пептидов и белков и которые позволяют значительному числу антигенных пептидов и белков конъюгировать с носителем в ориентации, позволяющей антигенному пептиду или белку взаимодействовать с имеющим сродство рецептором T-клеток. По существу предпочтительными являются способы, в которых с носителем конъюгируют C-концевые области антигенного пептида или белка или C-концевые области слитного белка, содержащего антигенный пептид или белок. Точные химические реакции будут, несомненно, зависеть от характера материала носителя, наличия или отсутствия C-концевых соединений с антигенным пептидом или белком и/или наличия или отсутствия конъюгирующих фрагментов.
Если это необходимо для доступности, функциональные группы могут быть размещены на частице. Одним местом размещения могут быть боковые или концевые группы на центральном полимере, или полимерах, которые покрывают центральный полимер, или полимерах, иным образом связанных с частицей. Например, в настоящий документ включены примеры, которые описывают ПЭГ, стабилизирующий наночастицы, который легко можно функционализировать для направления к определенным клеткам или для доставки белкового и пептидного лекарственного средства.
Для фиксации пептидов или белков на поверхности носителя можно использовать конъюгаты, такие как этиленкарбодиимид (ECDI), гексаметилендиизоцианат, диглицидиловый эфир пропиленгликоля, который содержит 2 эпоксиостатка, и эпихлоргидрин. Без связи с какой-либо теорией предполагается, что ECDI выполняет две основные функции для индукции толерантности: (a) он химически связывает белок/пептиды с клеточной поверхностью посредством катализирования формирования пептидной связи между свободной аминной и свободной карбоксильной группами; и (b) он индуцирует имитацию носителем апоптозной клеточной смерти, так что они захватываются в селезенке антигенпредставляющими клетками хозяина (которые могут включать в себя эндотелиальные клетки) и индуцируют толерантность. Именно такое неиммуногенное представление Т-клеткам хозяина приводит к прямой индукции анергии в аутореакционных клетках. Кроме того, ECDI служит сильным стимулом для индукции специфичных регуляторных Т-клеток.
В одном ряде вариантов осуществления антигенные пептиды и белки связываются с носителем посредством ковалентной химической связи. Например, реакционноспособная группа или фрагмент рядом с C-концом антигена (например, C-концевая карбоксильная группа или гидроксил, тиол или аминогруппа из аминокислотной боковой цепи) могут быть конъюгированы путем прямой химической реакции непосредственно с реакционноспособной группой или фрагментом на поверхности носителя (например, гидроксильной или карбоксильной группой PLA или PGA полимера, концевой аминной или карбоксильной группой дендримера или гидроксильной, карбоксильной или фосфатной группой фосфолипида). Альтернативно может использоваться конъюгационный фрагмент, который ковалентно конъюгирует как с антигенными пептидами и белками, так и с носителем, таким образом связывая их вместе.
Реакционноспособные карбоксильные группы на поверхности носителя могут быть присоединены к свободным аминам (например, из остатков Lys) на антигенном пептиде или белке при их взаимодействии, например, с 1-этил-3-[3,9-диметиламинопропил] карбодиимидгидрохлоридом (EDC) или N-гидроксисукцинимидным эфиром (NHS). Аналогично, такую же химическую реакцию можно использовать для того, чтобы конъюгировать свободные амины на поверхности носителя со свободными карбоксилами (например, из С-конца или из остатков Asp или Glu) на антигенном пептиде или белке. Альтернативно, свободные аминные группы на поверхности носителя могут быть ковалентно связаны с антигенными пептидами и белками или со слитными белками, содержащими антигенные пептиды или белки, с использованием химической реакции сульфо-SIAB, по существу как описано Arano et al. (1991) Chem. 2: 71–6.
В другом варианте осуществления антиген с носителем может конъюгироваться нековалентной связью между лигандом, связанным с антигенным пептидом или белком, и антилигандом, присоединенным к носителю. Например, к С-концу антигенного пептида или белка можно присоединить метку с последовательностью, распознаваемой биотинлигазой, и эта метка может быть биотинилирована с помощью биотинлигазы. Затем биотин может выступать в качестве лиганда для нековалентного конъюгирования антигенного пептида или белка с авидином или стрептавидином, который адсорбируется или иным способом связывается с поверхностью носителя как антилиганд. Альтернативно, при антигенных пептидах и белках, как описано выше, слитых с иммуноглобулиновым доменом, несущим Fc-область, Fc-домен может действовать как лиганд, а белок A, ковалентно или нековалентно связанный с поверхностью носителя, может выступать в качестве антилиганда и нековалентно конъюгировать антигенный пептид или белок с носителем. В данной области хорошо известны другие средства, которые можно применять для нековалентного конъюгирования антигенных пептидов и белков с носителями, включая технологии хелатирования ионов металлов (например, с использованием полигистидиновой метки к С-концу антигенного пептида или белка, или слитного белка, содержащего антигенный пептид или белок, и Ni+-покрытого носителя), и данные способы могут заменить способы, описанные в настоящем документе.
Конъюгация фрагмента нуклеиновой кислоты с несущей молекулой может быть выполнена любым числом способов, обычно включая один или более поперечносшивающих агентов и функциональных групп на фрагменте нуклеиновой кислоты и несущей молекуле. Связующие группы добавляют к несущим молекулам с использованием стандартных методик синтетической химии. Связующие группы можно добавить к фрагментам нуклеиновой кислоты с использованием стандартных методик синтетической химии. У медработника есть возможность выбора антигенов для применения в комбинациях настоящего изобретения. Присутствующий в комбинации индуцирующий антиген влияет на специфичность индуцируемого толерогенного ответа. Он может совпадать или не совпадать с антигеном-мишенью, который представляет собой антиген, присутствующий у получающего лечение субъекта или вводимый ему, который является мишенью для нежелательного иммунологического ответа и для которого желательна толерантность.
Индуцирующий антиген настоящего изобретения может представлять собой полипептид, полинуклеотид, углевод, гликолипид или другую молекулу, выделенную из биологического источника, или же он может представлять собой химически синтезированную малую молекулу, полимер или производное биологического материала при условии, что он в соответствии с настоящим описанием обладает способностью индуцировать толерантность при комбинации со связывающимся со слизистой компонентом.
В некоторых вариантах осуществления в настоящем изобретении предложен носитель (например, иммуномодифицирующая частица), связанный с одним или более пептидами, полипептидами и/или белками. В некоторых вариантах осуществления носитель (например, PLG-носитель), такой как описанный в настоящем документе, эффективен для индуцирования антиген-специфической толерантности и/или предотвращения начала заболевания, связанного с иммунной системой, (такого как EAE в мышиной модели) и/или уменьшения тяжести ранее существовавшего заболевания, связанного с иммунной системой. В некоторых вариантах осуществления композиции и способы настоящего изобретения могут вызывать в Т-клетках начало ранних событий, связанных с активацией Т-клеток, но не позволяют Т-клеткам приобретать эффекторную функцию. Например, введение композиций настоящего изобретения может приводить к получению Т-клетками квазиактивированного фенотипа, такого как повышение регуляции CD69 и/или CD44, но без проявления эффекторной функции, на что указывает отсутствие синтеза IFN-γ или IL-17. В некоторых вариантах осуществления введение композиций настоящего изобретения приводит к приобретению Т-клетками квазиактивированного фенотипа без конверсии интактных антиген-специфических Т-клеток в регуляторный фенотип, например в клетки, имеющие фенотипы CD25+/Foxp3+.
В некоторых вариантах осуществления поверхность носителя (например, частицы) содержит химические фрагменты и/или функциональные группы, которые позволяют присоединять к носителю (например, ковалентно, нековалентно) антигенные пептиды и/или другие функциональные элементы. В некоторых вариантах осуществления число, ориентация, пространственное расположение и т.д. химических фрагментов и/или функциональных групп на носителе (например, частице) варьируется в соответствии с химическим составом носителя, желаемым применением и т.п.
В некоторых вариантах осуществления носитель содержит один или более биологических или химических агентов, прикрепленных, адсорбированных, инкапсулированных и/или содержащихся по всему носителю. В некоторых вариантах осуществления химический или биологический агент инкапсулирован внутри и/или содержится по всему веществу частиц. Настоящее изобретение не ограничено характером химических или биологических агентов. Такие агенты включают в себя, без ограничений, белки, молекулы нуклеиновых кислот, низкомолекулярные лекарственные средства, липиды, углеводы, клетки, компоненты клеток и т.п. В некоторых вариантах осуществления на носитель или внутрь него помещают два или более (например, 3, 4, 5 и т.п.) разных химических или биологических агента. В некоторых вариантах осуществления агенты предусматривают определенную скорость высвобождения. В некоторых вариантах осуществления множество разных агентов предусматривают разные скорости высвобождения. Например, первый агент может высвобождаться в течение нескольких часов, а второй агент может высвобождаться в течение более длительного времени (например, суток, недель, месяцев и т.д.). В некоторых вариантах осуществления носитель или его часть выполнены с возможностью медленного высвобождения биологических или химических агентов. В некоторых вариантах осуществления медленное высвобождение обеспечивает высвобождение биологически активных количеств агента в течение периода времени по меньшей мере 30 суток (например, 40 суток, 50 суток, 60 суток, 70 суток, 80 суток, 90 суток, 100 суток, 180 суток и т.п.). В некоторых вариантах осуществления носитель или его часть выполнены достаточно пористыми, чтобы клетки могли врастать в поры. Размер пор можно выбрать с учетом конкретных интересующих типов клеток и/или требуемой величины врастания. В некоторых вариантах осуществления частицы содержат интересующий антиген без других непептидных активных агентов, таких как лекарственные средства или иммуномодуляторы. Более того, в некоторых вариантах осуществления частицы изобретения не содержат иммуностимуляторных или иммуносупрессорных пептидов помимо интересующего антигена. Кроме того, в некоторых вариантах осуществления частицы не содержат других белков или пептидов (например, костимуляторных молекул, молекул MHC, иммуностимуляторных пептидов или иммуносупрессорных пептидов), ни на поверхности, ни инкапсулированных внутри частиц.
Неожиданно было обнаружено, что инкапсулирование антигена, биологических и/или химических агентов в частицу изобретения индуцирует иммунологическую толерантность и имеет несколько преимуществ. Во-первых, инкапсулированные частицы вызывают более медленный цитокиновый ответ. Во-вторых, при использовании множества антигенов, биологических и/или химических агентов инкапсулирование устраняет конкуренцию между этими различными молекулами, которая может возникать, если агенты прикреплены к поверхности частицы. В-третьих, инкапсулирование позволяет заключать в частицу большее количество антигенов, биологических и/или химических агентов. В-четвертых, инкапсулирование позволяет упростить использование сложных белковых антигенов или гомогенатов органов (например, гомогената поджелудочной железы для диабета I типа или экстракта арахиса при аллергии на арахис). Наконец, инкапсулирование антигенов, биологических и/или химических агентов внутрь частицы вместо конъюгации к поверхности частицы сохраняет суммарный отрицательный заряд на поверхности частицы. Инкапсуляция антигена, биологических и/или химических агентов в частицы изобретения можно выполнить любым способом, известным в данной области. В одном варианте осуществления полипептидные антигены инкапсулированы в частицы при помощи двойного эмульсионного процесса. В дополнительном варианте осуществления полипептидные антигены являются водорастворимыми.
В другом варианте осуществления полипептидные антигены инкапсулированы в частицы при помощи одинарного эмульсионного процесса. В дополнительном варианте осуществления полипептидные антигены являются более гидрофобными. Иногда двойной эмульсионный процесс приводит к образованию крупных частиц, что может приводить к утечке активного гидрофильного компонента и снижать эффективность захватывания. Слияние и Оствальдовское созревание представляют собой два механизма, которые могут дестабилизировать каплю двойной эмульсии, а диффузия гидрофильного активного компонента через органическую фазу представляет собой основной механизм, ответственный за низкий уровень захватывания активного компонента. В некоторых вариантах осуществления благоприятным может быть уменьшение размера наночастиц. Одной из стратегий достижения этой цели является применение второй сильной скорости сдвига. Эффект утечки можно уменьшить, используя высокую концентрацию полимера и высокую молекулярную массу полимера, в сочетании с увеличением вязкости внутренней водной фазы и с увеличением молекулярной массы поверхностно-активного вещества.
В определенных вариантах осуществления в настоящем изобретении предложены носители, имеющие на своей поверхности (или внутри) клетки или другие биологические или химические агенты. Если используются клетки, носители не ограничены определенным типом клеток. В некоторых вариантах осуществления носители содержат на себе островковые клетки поджелудочной железы. В некоторых вариантах осуществления микропористые носители дополнительно содержат на себе белки внеклеточного матрикса (ECM) и/или экзендин-4. Носители не имеют ограничений по типу. В некоторых вариантах осуществления носитель имеет области с разной пористостью (например, с разным размером пор, глубиной пор и/или плотностью пор). В некоторых вариантах осуществления содержат на себе (или внутри себя) фармацевтические агенты, ДНК, РНК, белки внеклеточного матрикса, экзендин-4 и т.п.В определенных вариантах осуществления в настоящем изобретении предложены способы трансплантации островковых клеток поджелудочной железы с такими носителями. В некоторых вариантах осуществления изобретения индуцирующий антиген представляет собой одну выделенную или полученную рекомбинантным способом молекулу. Для лечения состояний, при которых антиген-мишень распределяется по разным местам организма хозяина, по существу необходимо, чтобы индуцирующий антиген был идентичен или иммунологически связан с антигеном-мишенью. К примерам таких антигенов относится большинство полинуклеотидных антигенов и некоторые углеводные антигены (например, антигены группы крови).
В сфере настоящего изобретения можно использовать любые подходящие антигены. В некоторых вариантах осуществления индуцирующий антиген влияет на специфичность индуцируемого толерогенного ответа. Индуцирующий антиген может совпадать или не совпадать с антигеном-мишенью, который является антигеном, присутствующим у получающего лечение пациента или вводимым ему, который является мишенью для нежелательной иммунологической реакции и для которого желательна толерантность.
Если антиген предпочтительно экспрессируется на конкретном органе, клетке или типе клеток, медработник имеет возможность использовать индуцирующий антиген, идентичный или иммунологически связанный с антигеном-мишенью. Однако также есть дополнительная возможность использовать антиген, посторонний для мишени. Это антиген, который может быть не связан иммунологически с антигеном-мишенью, но предпочтительно экспрессируется в ткани, в которой экспрессируется антиген-мишень. Рабочая теория по вопросу эффективности подавления посторонним агентом состоит в том, что супрессия является активным процессом, опосредованным клетками, который снижает активность эффекторной части иммунного ответа в клетках-мишенях. Супрессорные клетки специфично стимулируются индуцирующим антигеном на поверхности слизистой и двигаются в зону ткани, где предпочтительно экспрессируется посторонний антиген. Посредством интерактивного или опосредованного цитокинами механизма локализованные супрессорные клетки далее снижают активность эффекторных клеток (или индукторов эффекторных клеток) в ближайшем окружении, независимо от того, на что они реагируют. Если эффекторные клетки специфичны к мишени, отличной от индуцирующего антигена, результатом будет эффект постороннего агента. За дополнительной информацией о реакции на посторонний агент и списком толерогенных пептидов, оказывающих такое действие, читателю предлагается обратиться к международной патентной публикации WO 93/16724. Подразумеваемым следствием теории постороннего агента является то, что для практического использования настоящего изобретения специалисту не нужно идентифицировать или выделять конкретный антиген-мишень, для которого желательно выработать толерантность. Медработнику необходимо лишь получить по меньшей мере одну молекулу, предпочтительно экспрессирующуюся в целевой зоне, для использования в качестве индуцирующего антигена.
В некоторых вариантах осуществления изобретения индуцирующий антиген имеет форму, не идентичную антигену, экспрессированному у получающего лечение субъекта, но является фрагментом или производным этого антигена. Индуцирующие агенты настоящего изобретения содержат пептиды, основанные на молекуле соответствующей специфичности, но адаптированной посредством фрагментации, замены остатков, мечения, конъюгации и/или слияния с пептидами, имеющими другие функциональные свойства. Адаптацию можно проводить для любых желательных целей, включая, без ограничений, устранение любого нежелательного свойства, такого как токсичность или иммуногенность, или для усиления любого желательного свойства, такого как связывание со слизистой оболочкой, проникновение в слизистую или стимуляция толерогенной ветви иммунного ответа. Термины «пептид инсулина», «пептид коллагена», «пептид основного белка миелина» в настоящем документе относятся не только к интактной субъединице, но также к аллотипическим и синтетическим вариантам, фрагментам, слитным пептидам, конъюгатам и другим производным, содержащим область, гомологичную (предпочтительно на 70% идентичную, более предпочтительно на 80% идентичную, а еще более предпочтительно - на 90% идентичную на уровне аминокислот) по меньшей мере 10, а предпочтительно 20 последовательным аминокислотам соответствующей молекулы, аналогом которой она является, причем гомологичная область производного соединения имеет общую с родительской молекулой способность индуцировать толерантность к антигену-мишени.
Известно, что толерогенные области индуцирующего антигена часто отличаются от иммунодоминантных эпитопов для стимуляции образования антител. Толерогенные области по существу представляют собой области, которые могут представляться в конкретных клеточных взаимодействиях с участием Т-клеток. Толерогенные области могут представляться и могут быть способны индуцировать толерантность при представлении интактного антигена. Некоторые антигены содержат скрытые толерогенные области в том смысле, что обработка и представление исходного антигена в обычных условиях не приводит к толерантности. Описание скрытых антигенов и их идентификацию можно найти в международной патентной публикации WO 94/27634.
В некоторых вариантах осуществления настоящего изобретения используется два, три или большее количество индуцирующих антигенов. Эти варианты осуществления может быть желательно реализовать при наличии множества антигенов-мишеней или для создания множества посторонних для мишени агентов. Например, для лечения диабета со связывающимся со слизистой компонентом можно смешивать как инсулин, так и глюкагон. Также может быть желательно создать коктейль антигенов для охвата нескольких возможных альтернативных мишеней. Например, коктейль фрагментов антигенов гистосовместимости можно использовать для вызова толерантности у субъекта, которому планируется в будущем сделать пересадку аллотрансплантата неизвестного фенотипа. Алловариантные области человеческих лейкоцитарных антигенов известны в данной области: например, Immunogenetics 29:231, 1989. В другом примере смесь аллергенов может выступать в качестве индуцирующего антигена для лечения атопии.
Индуцирующие антигены можно получить с помощью ряда методик, известных в данной области, в зависимости от характера молекулы. Полинуклеотидные, полипептидные или углеводные антигены можно выделить из тех клеток вида, который планируется лечить, в которых содержится большое количество этих антигенов. Короткие пептиды удобно получать методом синтеза из аминокислот. Более длинные пептиды с известной последовательностью можно получать путем синтеза кодирующей последовательности или ПЦР-амплификации кодирующей последовательности из природного источника или вектора с последующим экспрессированием кодирующей последовательности в подходящей бактериальной или эукариотической клетке-хозяине.
В некоторых вариантах осуществления настоящего изобретения комбинация содержит сложную смесь антигенов, полученных из клетки или ткани, одна или более которых выступают в качестве индуцирующего антигена. Антигены могут иметь форму целых клеток, интактных или обработанных фиксирующим агентом, например формальдегидом, глутаровым альдегидом или спиртом. Антигены могут иметь форму лизата клеток, созданного путем солюбилизации детергентом или механического разрушения клеток или ткани с последующей очисткой. Антигены также можно получать при помощи субклеточного фракционирования, в частности путем обогащения плазматической мембраны с помощью таких методик, как дифференциальное центрифугирование, необязательно с последующей солюбилизацией детергентом и диализом. Также подходящими являются другие методики разделения, такие как аффинная и ионообменная хроматография солюбилизированных мембранных белков.
В одном варианте осуществления антигенный пептид или белок представляет собой аутоантиген, аллоантиген или трансплантационный антиген. В еще одном конкретном варианте осуществления аутоантиген выбирают из группы, состоящей из основного белка миелина, коллагена или их фрагментов, ДНК, ядерных и ядрышковых белков, митохондриальных белков и белков β-клеток поджелудочной железы.
Изобретение предусматривает индукцию толерантности к аутоантигену для лечения аутоиммунных заболеваний путем введения антигена, для которого желательно выработать толерантность. Например, аутоантитела к основному белку миелина (MBP) наблюдаются у пациентов с рассеянным склерозом, и, соответственно, антигенные пептиды или белки MBP можно использовать в рамках изобретения и доставлять их с использованием композиций настоящего изобретения для лечения и предотвращения рассеянного склероза.
В качестве еще одного не имеющего ограничительного характера примера, у субъекта, являющегося кандидатом на трансплантацию не от идентичного близнеца, может развиться отторжение трансплантированных клеток, тканей или органов, поскольку трансплантированные антигены являются чужеродными для реципиента. Предварительная выработка толерантности субъекта-реципиента к предполагаемому трансплантату устраняет или уменьшает последующее отторжение. При практическом использовании настоящего изобретения можно добиться уменьшения или избавления от препятствующей отторжению терапии. В другом примере многие аутоиммунные заболевания характеризуются клеточным иммунным ответом на эндогенный или собственный антиген. Толерантность иммунной системы к эндогенному антигену является желательной для борьбы с заболеванием.
В дополнительном примере сенсибилизация субъекта к промышленному загрязняющему агенту или химическому соединению, которая может встречаться в трудовой деятельности, может создавать опасность иммунной реакции. Предварительная выработка толерантности иммунной системы субъекта к химическому веществу, в частности, в той форме, в которой химическое вещество реагировало с эндогенными белками субъекта, может быть желательна для предотвращения последующего развития иммунного ответа на рабочем месте.
Аллергены представляют собой другие антигены, для которых также желательной является выработка толерантности иммунного ответа. В одном варианте осуществления антиген представляет собой глиадин. В дополнительном варианте осуществления антиген представляет собой A-глиадин.
Следует отметить, что даже при заболеваниях, при которых патогенный аутоантиген неизвестен, можно индуцировать супрессию посторонним агентом с использованием антигенов близкого анатомического расположения. Например, при ревматоидном артрите наблюдаются аутоантитела к коллагену, и, соответственно, ген, кодирующий коллаген, можно использовать в качестве экспрессирующего антиген генного модуля при лечении ревматоидного артрита (см., например, Choy (2000) Curr Opin Investig Drugs 1: 58–62). Кроме того, выработку толерантности к аутоантигенам бета-клеток можно использовать для предотвращения развития диабета I типа (см., например, Bach and Chatenoud (2001) Ann Rev Immunol 19: 131–161).
В качестве другого примера, аутоантитела к миелин-олигодендроцитарному гликопротеину (MOG) наблюдаются при аутоиммунном энцефаломиелите и при многих других заболеваниях ЦНС, а также при рассеянном склерозе (см., например, Iglesias et al. (2001) Glia 36: 22–34). Соответственно, использование конструктов, экспрессирующих антиген MOG, в настоящем изобретении позволяет проводить лечение рассеянного склероза, в также родственных ему аутоиммунных заболеваний центральной нервной системы.
Другие примеры потенциальных антигенов для применения при лечении аутоиммунных заболеваний включают в себя антигены бета-клеток поджелудочной железы, инсулин и GAD для лечения инсулинзависимого сахарного диабета; коллаген 11 типа, гликопротеин человеческого хряща gp 39 (HCgp39) и gpl30-RAPS для лечения ревматоидного артрита; основной белок миелина (MBP), протеолипидный белок (PLP) и миелин-олигодендроцитарный гликопротеин (MOG, см. выше) для лечения рассеянного склероза; фибрилларин и малый ядрышковый белок (snoRNP) для лечения склеродермы; рецептор тиреотропного фактора (TSH-R) для лечения болезни Грейвса; ядерные антигены, гистоны, гликопротеин gp70 и рибосомальные белки для лечения системной красной волчанки; пируватдегидрогеназа-дегидролипоамидацетилтрансферазу (PCD-E2) для лечения первичного билиарного цирроза печени; антигены волосяного фолликула для лечения очаговой алопеции; человеческий тропомиозин и изоформу 5 (hTM5) для лечения язвенного колита.
В одном варианте осуществления частицы изобретения связаны с антигенами, содержащими один или более эпитопов, связанных с аллергиями, аутоиммунными заболеваниями и/или воспалительными заболеваниями или расстройствами. Антигены могут содержать один или более экземпляров эпитопа. В одном варианте осуществления антигены содержат один эпитоп, связанный с одним заболеванием или расстройством. В дополнительном варианте осуществления антигены содержат более одного эпитопа, которые связаны с одним и тем же заболеванием или расстройством. В другом дополнительном варианте осуществления антигены содержат более одного эпитопа, которые связаны с разными заболеваниями или расстройствами. В дополнительном варианте осуществления антигены содержат один или более эпитопов, связанных с одним или более видами аллергии. В дополнительном варианте осуществления антигены содержат один или более эпитопов, связанных с рассеянным склерозом, диабетом I типа, целиакией и/или воспалительным заболеванием кишечника, включая болезнь Крона или язвенный колит.В одном варианте осуществления эпитопы взяты от основного белка миелина (например, SEQ ID NO: 4975 и 4976), протеолипидного белка (например, SEQ ID NO: 4977), миелин-олигодендроцитарного гликопротеина (например, SEQ ID NO: 1 и 4978), аквапорина (например, SEQ ID NO: 4979), гликопротеина, связанного с миелином (например, SEQ ID NO: 4980), инсулина (например, SEQ ID NO: 4981), глутаматдекарбоксилазы (например, SEQ ID NO: 4982), глиадина (например, SEQ ID NO: 4983–4985 или 5136–5140), α3-цепи коллагена IV типа (например, SEQ ID NO: 5017) или их фрагментов, гомологов или изоформ. В дополнительном варианте осуществления эпитопы взяты от клейковины, включая глиадин и/или глютенин. В одном варианте осуществления эпитопы взяты от гомологов инсулина, таких как описанные в патенте США №8,476,228, содержание которого полностью включено в настоящий документ для всех целей. В одном варианте осуществления эпитопы глиадина представляют собой SEQ ID NO: 13, 14, 16, 320 или 321 в заявке на патент США №20110293644, содержание которой полностью включено в настоящий документ для всех целей.
В таблицах 2 и 3 описаны дополнительные не имеющие ограничительного характера примеры эпитопов, связанных с различными аутоиммунными заболеваниями и/или воспалительными заболеваниями или расстройствами, которые рассматриваются в настоящем изобретении.
Таблица 2. Типичные линейные эпитопы
Не все эпитопы являются линейными; эпитопы также могут быть прерывистыми, конформационными эпитопами. Известен ряд прерывистых эпитопов, связанных с аутоиммунными заболеваниями или воспалительными заболеваниями и/или расстройствами. Не имеющие ограничительного характера примеры прерывистых эпитопов приведены в таблице 3.
Таблица 3. Типичные прерывистые эпитопы
Комбинации антигенов и/или эпитопов можно тестировать на способность обеспечивать толерантность путем проведения экспериментов с выделенными клетками или на животных моделях.
В некоторых вариантах осуществления индуцирующие толерантность композиции настоящего изобретения содержат апоптотическую сигнальную молекулу (например, в дополнение к антигенному пептиду или иной антигенной молекуле). В некоторых вариантах осуществления апоптотическая сигнальная молекула связана и/или ассоциирована с поверхностью носителя. В некоторых вариантах осуществления апоптотические сигнальные молекулы позволяют антигенпредставляющим клеткам хозяина, таким как клетки ретикуло-эндотелиальной системы, воспринимать носитель как апоптозное тело; это позволяет представлять связанные пептидные эпитопы так, чтобы индуцировалась толерантность. Без связи с какой-либо теорией предполагается, что это предотвращает повышение активации молекул, участвующих в стимуляции иммунных клеток, таких как молекулы MHC классов I/II и костимуляторные молекулы. Такие апоптотические сигнальные молекулы также могут выступать в качестве маркеров фагоцитоза. Например, апоптотические сигнальные молекулы, подходящие для настоящего изобретения, описаны в заявке на патент США №20050113297, которая полностью включена в настоящий документ путем ссылки. Молекулы, подходящие для настоящего изобретения, включают в себя молекулы, направляющие фагоциты, включая макрофаги, дендритные клетки, моноциты, гранулоциты и нейтрофилы.
В некоторых вариантах осуществления молекулы, подходящие для использования в качестве апоптотических сигнальных молекул, обеспечивают эффект выработки толерантности к связанным пептидам. Кроме того, носитель, связанный с апоптотической сигнальной молекулой, может связываться с Clq в ходе распознавания апоптозных клеток (Paidassi et al., (2008) J. Immunol. 180: 2329–2338; полностью включено в настоящий документ путем ссылки). Например, молекулы, которые могут использоваться в качестве апоптотических сигнальных молекул, включают в себя фосфатидилсерин, аннексин-1, аннексин-5, глобулярный EGF-фактор 8 молочного жира (MFG-E8) или семейство тромбоспондинов (например, тромбоспондин-1 (TSP-1)). Различные молекулы, подходящие для использования в качестве апоптотических сигнальных молекул в настоящем изобретении, описаны, например, в заявке на патент США 2012/0076831, которая полностью включена в настоящий документ путем ссылки).
В некоторых вариантах осуществления апоптотическая сигнальная молекула может быть конъюгирована с антиген-специфическим пептидом. В некоторых вариантах апоптотическую сигнальную молекулу конъюгируют с антиген-специфическим пептидом путем создания слитного белка. Например, слитный белок может содержать по меньшей мере один антиген-специфический пептид (или его фрагмент или вариант), соединенный по меньшей мере с одной апоптотической сигнальной молекулой (или ее фрагментом или вариантом). В отношении создания слитных белков термины «слитный белок», «слитный пептид», «слитный полипептид» и «химерный пептид» используются на взаимозаменяемой основе. Подходящие фрагменты антиген-специфического пептида включают в себя любой фрагмент полноразмерного пептида, который сохраняет функцию генерации требуемой антиген-специфической толерантности настоящего изобретения. Слитный белок можно создать различными способами, известными в данной области (например, с помощью генетической химеризации, химической конъюгации и т.п.). Два белка могут быть слиты непосредственно или при помощи аминокислотного линкера. Полипептиды, образующие слитный белок, обычно соединяют C-концом к N-концу, однако они также могут быть соединены C-концом к C-концу, N-концом к N-концу или N-концом к С-концу. Полипептиды в слитном белке могут находиться в любом порядке. Можно использовать пептидную линкерную последовательность для разделения первого и второго полипептидного компонента на расстояние, достаточное для того, чтобы каждый полипептид сворачивался в свою вторичную и третичную структуры. Аминокислотные последовательности, которые можно с пользой применять в качестве линкеров, включают в себя последовательности, описанные в публикации Maratea et. al., Gene 40: 39–46 (1985); Murphy et al., Proc. Natl. Acad. Sci. USA 83: 8258–8262 (1986); патенте США №4,935,233 и патенте США 4,751,180, которые полностью включены в настоящий документ путем ссылки. Линкерная последовательность может по существу иметь длину от 1 до около 50 аминокислот.В некоторых вариантах осуществления линкерные последовательности не требуются и/или не используются, например, когда первый и второй полипептиды содержат области с N-концевыми неосновными аминокислотами, которые можно использовать для разделения функциональных доменов и предотвращения пространственных влияний.
Индикатором толерогенной активности является способность интактного антигена или фрагмента стимулировать выработку соответствующего цитокина в целевой зоне. Предполагается, что иммунорегуляторные цитокины, высвобождаемые супрессорными T-клетками в целевой зоне, представляют собой TGF-β (Miller et al., Proc. Natl. Acad. Sci. USA 89:421, 1992). Другими факторами, которые могут вырабатываться в условиях толерантности, являются цитокины IL4 и IL-10, а также медиатор PGE. И наоборот, лимфоциты в тканях, которые подвергаются активному иммунному разрушению, секретируют такие цитокины, как IL-I, IL-2, IL-6 и γ-IFN. Следовательно, эффективность потенциального индуцирующего антигена можно оценить посредством измерения ее способности к стимуляции соответствующего типа цитокинов.
С учетом вышесказанного быстрый скрининг-тест для определения толерогенных эпитопов индуцирующего антигена, эффективных связывающихся со слизистой компонентов, эффективных комбинаций или эффективных способов и режимов введения через слизистую оболочку можно проводить с использованием сингенных животных в качестве доноров для клеточных анализов in vitro. Животным вводят тестовую композицию через поверхность слизистой оболочки и через некоторое время проводят стимуляцию посредством парентерального введения антигена-мишени в полном адъюванте Фрейнда. Клетки селезенки выделяют и культивируют in vitro в присутствии антигена-мишени в концентрации около 50 мкг/мл. Антиген-мишень можно заменять потенциальными белками или подфрагментами для картирования местоположения толерогенных эпитопов. Секрецию цитокинов в среде можно количественно определить посредством стандартного иммунологического анализа.
Способность клеток подавлять активность других клеток можно определить, используя клетки, выделенные из иммунизированного целевым антигеном животного, или создав клеточную линию, чувствительную к антигену-мишени (Ben-Nun et al., Eur. J. Immunol. 11: 195, 1981; полностью включено в настоящий документ путем ссылки). В одном варианте настоящего эксперимента популяцию супрессорных клеток подвергают мягкому облучению (около 1000–1250 рад) для предотвращения пролиферации, супрессоры выращивают совместно с клетками-респондерами, а затем используют введение меченного тритием тимидина (MTT) для количественного определения пролиферативной активности клеток-респондеров. В другом варианте популяцию супрессорных клеток и популяцию клеток-респондеров культивируют на верхнем и нижнем уровнях двухкамерной системы культивирования Transwell (Costar, г.Кембридж, штат Массачусетс), которая позволяет совместно инкубировать популяции клеток, находящиеся на расстоянии не более 1 мм друг от друга и разделенные поликарбонатной мембраной (WO 93/16724). При таком подходе необязательно облучать популяцию супрессорных клеток, поскольку пролиферативную активность клеток-респондеров можно измерить отдельно.
В вариантах осуществления изобретения, в которых антиген-мишень уже присутствует у субъекта, нет необходимости выделять антиген или заранее сочетать его с связывающимся со слизистой компонентом. Например, антиген может определенным образом экспрессироваться у субъекта как следствие патологического состояния (например, воспалительного заболевания кишечника или целиакии) или как следствие потребления пищевого аллергена. Тестирование проводят подавая связывающийся со слизистой компонент в одной или более дозах или составах и определяют способность вызывать выработку толерантности к антигену in situ.
Также можно разработать эффективные композиции и способы введения для лечения конкретного заболевания с помощью соответствующих животных моделей заболевания. Способность лечения уменьшать или задерживать симптоматику заболевания отслеживают по уровню циркулирующих биохимических и иммунологических показателей заболевания, результатам иммуногистологического исследования поврежденной ткани и основным клиническим признакам, соответствующим используемой модели. Не имеющие ограничительного характера примеры животных моделей, которые можно применять для тестирования, представлены в следующем разделе.
В настоящем изобретении рассматривается модуляция толерантности посредством модуляции ответа TH1, ответа TH2, ответа TH17 или комбинации этих ответов. Модуляция ответа TH1 охватывает изменение экспрессии, например, гамма-интерферона. Модуляция ответа TH2 охватывает изменение экспрессии, например, любой комбинации IL-4, IL-5, IL-10 и IL-13. Как правило, усиление (ослабление) ответа TH2 будет содержать увеличение (уменьшение) экспрессии по меньшей мере одного из IL-4, IL-5, IL-10 или IL-13; чаще усиление (ослабление) ответа TH2 будет содержать увеличение экспрессии по меньшей мере двух из IL-4, IL-5, IL-10 или EL-13, наиболее часто усиление (ослабление) ответа TH2 будет содержать увеличение экспрессии по меньшей мере трех из DL-4, IL-5, IL-10 или IL-13, в идеальном случае усиление (ослабление) ответа TH2 будет содержать увеличение (уменьшение) экспрессии каждого из IL-4, IL-5, IL-10 и IL-13. Модулирование TH17 охватывает изменение экспрессии, например, TGF-бета, IL-6, IL-21 и IL23 и влияет на уровни IL-17, IL-21 и IL-22.
Другие подходящие способы оценки эффективности композиций и способов настоящего изобретения известны в данной области, как описано, например, в заявке на патент США 2012/0076831 (полностью включена в настоящий документ путем ссылки).
Некоторые варианты осуществления настоящего изобретения относятся к праймированию иммунной толерантности у субъекта, ранее не подвергавшегося индукции толерантности путем терапевтического вмешательства. Эти варианты осуществления по существу включают в себя множество введений комбинации антигена и связывающегося со слизистой компонента. Для обеспечения долгосрочного результата во время праймирования, как правило, выполняют по меньшей мере три введения, часто по меньшей мере четыре введения, а иногда по меньшей мере шесть введений, хотя толерантность может проявляться у субъекта на ранней стадии курса лечения. Наиболее часто каждую дозу дают в виде болюсного введения, но для использования также подходят составы длительного введения, способные к высвобождению в слизистую оболочку. Если выполняется множество введений, время между введениями по существу составляет от 1 суток до 3 недель и, как правило, от около 3 суток до 2 недель. По существу используют один и тот же антиген и связывающийся со слизистой компонент в одинаковой концентрации и введение проводят на одну и ту же поверхность слизистой оболочки, но возможны и варианты коррекции любых из этих параметров в ходе курса лечения.
Другие варианты осуществления настоящего изобретения относятся к поддержанию или продлению ранее выработанной иммунной толерантности. Эти варианты осуществления по существу относятся к одному введению или краткому курсу лечения в то время, когда сформированная толерантность снижается или может снижаться. Поддержание по существу выполняют через период от 1 месяца до 1 года и, как правило, от 2 до 6 месяцев после праймирования или предыдущего поддержания. Настоящее изобретение также включает в себя варианты осуществления, которые используют регулярное поддержание толерантности со схемой введений, производимых два раза в неделю, раз в неделю, раз в две недели или по любому другому регулярному расписанию.
Частицы настоящего изобретения можно вводить в любой дозе, эффективной для подавления воспалительного иммунного ответа у нуждающегося в лечении субъекта или для лечения бактериальной или вирусной инфекции у нуждающегося в лечении субъекта. В определенных вариантах осуществления субъекту обеспечивают введение от около 102 до около 1020 частиц. В дополнительном варианте осуществления обеспечивают введение от около 103 до около 1015 частиц. В другом дополнительном варианте осуществления обеспечивают введение от около 106 до около 1012 частиц. В еще одном дополнительном варианте осуществления обеспечивают введение от около 108 до около 1010 частиц. В предпочтительном варианте осуществления предпочтительная доза составляет 0,1% твердых частиц/мл. Соответственно, для гранул 0,5 мкм предпочтительная доза составляет около 4 x 109 гранул, для гранул 0,05 мкм предпочтительная доза составляет около 4 x 1012 гранул, для гранул 3 мкм предпочтительная доза составляет 2 x 107 гранул. Однако любая доза, которая является эффективной для лечения конкретного состояния, подлежащего лечению, включена в настоящее изобретение.
Настоящее изобретение подходит для лечения расстройств, связанных с иммунной системой, таких как аутоиммунные заболевания, отторжение трансплантата, ферментативные недостаточности и аллергические реакции. Замещение системы синтетических биосовместимых частиц для индуцирования иммунной толерантности позволяет упростить производство, расширить доступность терапевтических агентов, повысить единообразие образцов, увеличить количество возможных участков лечения и значительно снизить вероятность аллергических ответов на клетку-носитель.
В настоящем документе термин «иммунный ответ» включает в себя иммунные ответы, опосредованные Т-клетками и/или В-клетками. Примеры иммунных ответов включают в себя ответы Т-клеток, например, выработку цитокинов и клеточноопосредованную цитотоксичность. Кроме того, термин «иммунный ответ» включает в себя иммунные ответы, на которые косвенно влияет активация Т-клеток, например выработка антител (гуморальные ответы), и активация цитокинчувствительных клеток, например макрофагов. Иммунные клетки, участвующие в иммунном ответе, включают в себя лимфоциты, такие как B-клетки и T-клетки (клетки CD4+, CD8+, Th1 и Th2); антигенпредставляющие клетки (например, профессиональные антигенпредставляющие клетки, такие как дендритные клетки, макрофаги, B-лимфоциты, клетки Лангерганса, и непрофессиональные антигенпредставляющие клетки, такие как кератиноциты, эндотелиальные клетки, астроциты, фибробласты, олигодендроциты); естественные клетки-киллеры; миелоидные клетки, такие как макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты. В некоторых вариантах осуществления модифицированные частицы настоящего изобретения эффективно уменьшают миграцию воспалительных клеток к месту воспаления.
В настоящем документе термин «анергия», «толерантность» или «антиген-специфическая толерантность» относится к нечувствительности Т-клеток к стимуляции, опосредованной рецепторами Т-клеток. Такая нечувствительность по существу является антиген-специфической и сохраняется после прекращения воздействия антигенного пептида. Например, у Т-клеток анергия характеризуется недостаточной выработкой цитокина, например IL-2. Анергия Т-клеток возникает, когда Т-клетки подвергаются воздействию антигена и получают первый сигнал (сигнал, опосредованный Т-клеточным рецептором или CD-3) при отсутствии второго сигнала (костимулирующий сигнал). В этих условиях повторное воздействие того же антигена на клетки (даже если повторное воздействие происходит в присутствии костимулирующей молекулы) приводит к невозможности выработки цитокинов и в дальнейшем к невозможности пролиферации. Таким образом, невозможность выработки цитокинов предотвращает пролиферацию. Однако анергичные Т-клетки могут пролиферировать, если они культивируются с цитокинами (например, IL-2). Например, анергия Т-клеток также может наблюдаться при недостаточной выработке IL-2 Т-лимфоцитами, как показывают измерения способом ИФА или посредством анализа пролиферации с использованием индикаторной клеточной линии. Альтернативно можно использовать репортерный генный конструкт. Например, анергичные Т-клетки не могут инициировать транскрипцию генов DL-2, индуцируемую гетерологичным промотором под контролем энхансера гена 5' IL-2 или мультимером с последовательностью API, который может находиться в энхансере (Kang et al. 1992 Science. 257: 1134).
В настоящем документе термин «иммунологическая толерантность» относится к способам, которые подействовали на часть субъектов, получавших лечение, в сравнении с субъектами, не получавшими лечения, когда наблюдается: a) снижение уровня специфического иммунного ответа (считается, что он по меньшей мере частично опосредован антиген-специфическими эффекторными Т-лимфоцитами, B-лимфоцитами, антителом или их эквивалентами); b) задержка наступления или прогрессирования специфического иммунного ответа; или c) снижение риска наступления или прогрессирования специфического иммунного ответа. «Специфическая» иммунологическая толерантность возникает, когда иммунологическая толерантность действует преимущественно в отношении определенных антигенов, в сравнении с другими. «Неспецифическая» иммунологическая толерантность возникает, когда иммунологическая толерантность не ограничена антигенами, приводящими к воспалительному иммунному ответу. «Квазиспецифическая» иммунологическая толерантность возникает, когда иммунологическая толерантность действует частично избирательно в отношении антигенов, приводящих к патогенному иммунному ответу, но не действует в отношении тех, которые приводят к защитному иммунному ответу.
Толерантность к аутоантигенам и аутоиммунному заболеванию достигается за счет различных механизмов, включая негативную селекцию аутореакционных Т-клеток в тимусе, и механизмов периферической толерантности для тех аутореакционных Т-клеток, которые избежали делеции в тимусе и обнаруживаются на периферии. Примеры механизмов, обеспечивающих толерантность периферических Т-клеток, включают «игнорирование» собственных антигенов, анергию или невосприимчивость к аутоантигену, иммунное отклонение цитокинов и индуцируемую активацией гибель аутореакционных Т-клеток. Кроме того, было показано, что регуляторные Т-клетки участвуют в опосредовании периферической толерантности. См., например, Walker et al. (2002) Nat. Rev. Immunol. 2: 11–19; Shevach et al. (2001) Immunol. Rev. 182: 58–67. В некоторых ситуациях утрачивается (или нарушается) периферическая толерантность к аутоантигену и следует аутоиммунный ответ. Например, было показано, что в животной модели EAE активация антигенпредставляющих клеток (АПК) посредством рецепторов врожденного иммунитета TLR нарушает аутотолерантность и индуцирует EAE (Waldner et al. (2004) J. Clin. Invest. 113: 990–997).
Соответственно, в некоторых вариантах осуществления в изобретении предложены способы повышения представления антигенов наряду с подавлением или понижением стимуляции клеток, зависимых от TLR7/8, TLR9 и/или TLR7/8/9. Как описано в настоящем документе, введение конкретных модифицированных частиц приводит к представлению антигенов клетками DC или АПК наряду с подавлением ответов клеток, зависимых от TLR7/8, TLR9 и/или TLR7/8/9, которые связаны с иммуностимулирующими полинуклеотидами. Такое подавление может включать в себя снижение уровней одного или более цитокинов, связанных с TLR.
Как было описано выше, в настоящем изобретении представлены новые соединения с биологическими свойствами, подходящими для лечения опосредованных Mac-1 и LFA-1 расстройств.
Соответственно, в другом аспекте настоящего изобретения представлены фармацевтические композиции, которые содержат иммуномодифицирующие частицы и необязательно содержат фармацевтически приемлемый носитель. В определенных вариантах осуществления такие композиции необязательно дополнительно содержат один или более дополнительных терапевтических агентов. Альтернативно, модифицированные частицы настоящего изобретения могут вводиться нуждающемуся в лечении пациенту в комбинации с введением одного или более терапевтических агентов. Например, дополнительные терапевтические агенты для совместного введения или включения в фармацевтическую композицию с соединением настоящего изобретения могут представлять собой разрешенный противовоспалительный агент или любой из ряда агентов, проходящих процедуру получения разрешения в Управлении США по контролю за продуктами и лекарствами, который в конечном счете будет разрешен для лечения любого расстройства, характеризуемого неконтролируемым воспалительным иммунным ответом, или бактериальной или вирусной инфекции. Также следует понимать, что некоторые из модифицированных частиц настоящего изобретения могут существовать в свободной форме для лечения или, в соответствующих случаях, в виде их фармацевтически приемлемого производного.
Фармацевтические композиции настоящего изобретения дополнительно содержат фармацевтически приемлемый носитель, который в настоящем изобретении включает в себя все без исключения растворители, разбавители или другой жидкий носитель, вспомогательные вещества для получения дисперсии или суспензии, поверхностно-активные вещества, изотонические агенты, загустители или эмульгаторы, консерванты, твердые связующие вещества, смазывающие вещества и т.п., которые можно использовать для получения конкретной требуемой дозированной формы. В справочнике Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описаны различные носители, которые используются при составлении фармацевтических композиций, и известные методики их получения. За исключением случаев, когда та или иная общеизвестная несущая среда оказывается несовместимой с соединениями изобретения, например, по причине продуцирования любого нежелательного биологического эффекта или иного неблагоприятного взаимодействия с любым (-и) другим (-и) компонентом (-ами) фармацевтической композиции, его применение считается частью объема настоящего изобретения. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают в себя, без ограничений, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошковый трагакант; солод; желатин; тальк; эксципиенты, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксические совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния. По усмотрению специалиста, составляющего рецептуру, в композиции также могут присутствовать красители, высвобождающие агенты, покрывающие агенты, подсластители, вкусовые добавки, ароматизаторы, консерванты и антиоксиданты.
Жидкие дозированные формы для перорального введения включают в себя, без ограничений, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Кроме активных соединений жидкие дозированные формы могут содержать инертные разбавители, которые обычно используются в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана, а также их смеси. В дополнение к инертным разбавителям композиции для перорального введения могут также включать в себя адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, ароматизаторы и отдушки.
Частицы настоящего изобретения можно вводить перорально, назально, внутривенно, внутримышечно, интраокулярно, чрескожно, внутрибрюшинно или подкожно. В одном варианте осуществления частицы изобретения вводят внутривенно.
Эффективное количество и способ введения настоящего изобретения для модуляции иммунного ответа могут варьировать в зависимости от субъекта, излечиваемого состояния и других факторов, известных специалистам в данной области. К факторам, которые следует учитывать, относятся способ введения и количество вводимых доз. Такие факторы известны в данной области, и специалисты в данной области могут успешно определять их без ненужного экспериментирования. Подходящим диапазоном доз является диапазон, обеспечивающий желаемую регуляцию иммунного ответа. Подходящий диапазон доз носителя, указанный в количестве полученного носителя, может представлять собой любой из следующих: от 0,5 до 10 мг/кг, от 1 до 9 мг/кг, от 2 до 8 мг/кг, от 3 до 7 мг/кг, от 4 до 6 мг/кг, 5 мг/кг, от 1 до 10 мг/кг, от 5 до 10 мг/кг. Альтернативно, дозировка может определяться на основе количества частиц. Например, подходящий диапазон доз носителя, указанный в количестве полученного носителя, может представлять собой, например, около 106, 107, 108, 109, 1010 или большее количество частиц на дозу. Абсолютное количество, выдаваемое каждому пациенту, зависит от фармакологических свойств, таких как биодоступность, клиренс и способ введения. Подробная информация о фармацевтически приемлемых носителях, разбавителях и эксципиентах, а также способах получения фармацевтических композиций и составов представлена в публикации Remmingtons Pharmaceutical Sciences 18thEdition, 1990, Mack Publishing Co., Easton, Pa., USA., полностью включенной в настоящий документ путем ссылки.
Эффективное количество и способ введения конкретного состава носителя может варьироваться в зависимости от конкретного пациента, желаемого результата и/или типа расстройства, стадии заболевания и других факторов, очевидных для специалиста в данной области. Способ (-ы) введения, которые могут применяться в конкретной области применения, очевидны для специалиста в данной области. Способы введения включают в себя, без ограничений, местный, дермальный, трансдермальный, трансмукозальный, эпидермальный, парентеральный, желудочно-кишечный, носоглоточный и легочный, включая трансбронхиальный и трансальвеолярный способ. Подходящим диапазоном доз является диапазон, который обеспечивает доставку композиции иммунорегулирующих частиц, достаточной для достижения концентрации в ткани около 1–50 мкM, измеряемой по уровню в крови. Абсолютное количество, выдаваемое каждому пациенту, зависит от фармакологических свойств, таких как биодоступность, клиренс и способ введения.
В настоящем изобретении предложены составы носителя, подходящие для местного применения, включая, без ограничений, физиологически приемлемые имплантаты, мази, кремы, ополаскиватели и гели. К примерам способов дермального введения относятся способы, менее инвазивные, чем трансдермальная передача, эпидермальное введение и подкожная инъекция.
Трансдермальное введение проводят путем нанесения крема, ополаскивателя, геля и т.п., способного обеспечить проникновение носителя через кожу и попадание в кровяное русло. Композиции, подходящие для трансдермального введения, включают в себя, без ограничений, фармацевтически приемлемые суспензии, масла, кремы и мази, наносимые непосредственно на кожу или заключаемые в защитный носитель, такой как трансдермальное устройство (так называемый «пластырь»). Примеры подходящих кремов, мазей и т.п.можно найти, например, в настольном справочнике врача. Трансдермальная передача также может осуществляться посредством ионтофореза, например, с использованием доступных в продаже пластырей, непрерывно подающих содержащийся в них продукт через неповрежденную кожу в течение нескольких суток или более. Применение этого способа позволяет проводить контролируемую передачу фармацевтических композиций в относительно высоких концентрациях, позволяет вводить комбинации лекарственных средств и позволяет одновременно применять промотор абсорбции.
Парентеральный способ введения включает в себя, без ограничений, электрический способ (ионтофорез) или способ прямой инъекции, такой как прямая инъекция в центральную систему внутривенного вливания, внутривенная, внутримышечная, внутрибрюшинная, внутрикожная или подкожная инъекция. Составы носителя, подходящие для парентерального введения, по существу готовят в соответствующей требованиям Фармакопеи США (USP) воде или в воде для инъекций, и они могут дополнительно содержать буферы pH, солевые наполнители, консерванты и другие фармацевтически приемлемые эксципиенты. Иммунорегуляторный полинуклеотид для парентерального введения можно приготовить в фармацевтически приемлемых стерильных изотонических растворах, таких как физраствор или фосфатно-солевой буфер для инъекций.
Желудочно-кишечные способы введения включают в себя, без ограничений, пищевой и ректальный способы, и в данном случае может подразумеваться применение, например, фармацевтически приемлемых порошков, пилюль или жидкостей для перорального введения и суппозиториев для ректального введения.
Носоглоточный и легочный способ введения осуществляют путем ингаляции, и в данном случае могут подразумеваться такие способы доставки, как интраназальный, трансбронхиальный и трансальвеолярный способ. Изобретение включает в себя составы носителя, подходящие для введения путем ингаляции, включая, без ограничений, жидкие суспензии для создания аэрозолей, а также порошковые формы для систем доставки путем ингаляции сухого порошка. Устройства, подходящие для введения составов носителя путем ингаляции, включают в себя, без ограничений, распылители, испарители, небулайзеры и системы доставки путем ингаляции сухого порошка.
Препараты для инъекций, например стерильные водные или масляные суспензии для инъекций, можно готовить в соответствии с известными в данной области принципами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций также может представлять собой стерильный раствор для инъекций, суспензию или эмульсию в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, например в виде раствора в 1,3-бутандиоле. Приемлемые носители и растворители, которые можно использовать, представляют собой воду, раствор Рингера и изотонический раствор хлорида натрия фармацевтической чистоты (согласно Фармакопее США). Кроме того, в качестве растворителя или суспендирующей среды традиционно используют стерильные нелетучие масла. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для получения препаратов для инъекций применяют жирные кислоты, такие как олеиновая кислота.
Составы для инъекций можно стерилизовать, например, путем фильтрования через задерживающий бактерии фильтр или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые перед применением можно растворять или диспергировать в стерильной воде или другой стерильной среде для инъекций.
Для продления действия лекарственного средства часто желательно замедлить всасывание лекарственного средства при подкожной или внутримышечной инъекции. Этого можно добиться за счет применения жидкой суспензии или кристаллического или аморфного материала с низкой растворимостью в воде. При этом скорость всасывания лекарственного средства зависит от скорости его растворения, которая в свою очередь может зависеть от размеров кристаллов и кристаллической формы. Альтернативно, пролонгированное всасывание парентерально введенной формы лекарственного средства обеспечивается растворением или суспендированием лекарственного средства в масляном носителе. Формы депо для инъекций получают путем формирования микрокапсулированных матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. Варьируя соотношение количеств лекарственного средства и полимера и свойства конкретного использованного полимера, можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают в себя сложные поли(ортоэфиры) и поли(ангидриды). Составы депо для инъекций также готовят включением лекарственного средства в липосомы или микроэмульсии, совместимые с тканями тела.
В некоторых вариантах осуществления синтетические биоразлагаемые частицы настоящего изобретения обеспечивают простоту производства, широкую доступность терапевтических агентов и увеличение участка лечения. В конкретных вариантах осуществления биоразлагаемые частицы сополимера лактида и гликолида с функционализированной поверхностью, имеющие высокую плотность карбоксильных групп на поверхности, синтезированные с использованием поверхностно-активного вещества поли(этилен-альт-малеинового ангидрида), позволяют получить носитель, обладающий многими преимуществами по отношению к другим частицам-носителям и/или поверхностям. Эксперименты, проведенные при разработке вариантов осуществления настоящего изобретения, продемонстрировали конъюгацию пептидов (например, пептида PLP139–151) с этими частицами. Было показано, что такие связанные с пептидом частицы являются эффективными для предотвращения развития заболевания и индукции иммунологической толерантности (например, при R-EAE, мышиной модели рассеянного склероза, индуцированного у мышей SJL/J при помощи PLP139–151/CFA). Связанные с пептидом носители настоящего изобретения обладают многими преимуществами по отношению к другим структурам, индуцирующим толерантность. В некоторых вариантах осуществления частицы являются биоразлагаемыми и, следовательно, не будут присутствовать в теле в течение длительного времени. Время полного разложения можно контролировать. В некоторых вариантах осуществления частицы функционализируют для облегчения их интернализации без активации клеток (например, загрузка фосфатидилсерина в микросферы из PLG). В некоторых вариантах осуществления в частицы встраивают лиганды, наводящие их на определенную популяцию клеток. В некоторых вариантах осуществления на поверхность или внутрь частиц включают противовоспалительные цитокины, такие как IL-10 и TGF-β, чтобы ограничить активацию типа клеток, интернализировавшего частицы, и облегчить индукцию толерантности посредством энергии и/или уничтожения, а также активацию регуляторных Т-клеток. Было обнаружено, что композиция частиц влияет на длительность нахождения частиц в теле, а для индукции толерантности необходимы быстрый захват частиц и быстрый клиренс/разложение. Поскольку соотношение лактид: гликолид свыше 50: 50 уменьшает скорость разложения, в частицах изобретения соотношение лактид: гликолид составляет около 50: 50 или менее. В одном варианте осуществления в частицах изобретения соотношение D,L-лактид: гликолид составляет около 50: 50.
Твердые дозированные формы для перорального введения включают в себя капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах модифицированные частицы смешивают с по меньшей мере одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфатом и/или а) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, манит и кремниевая кислота, b) связующими веществами, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, c) увлажняющими веществами, такими как глицерин, d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедлителями растворения, такими как парафин, f) ускорителями всасывания, такими как четвертичные аммониевые соединения, g) смачивающими агентами, такими как, например, цетиловый спирт и глицеринмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, а также их смесями. В случае капсул, таблеток и пилюль дозированная форма также может содержать буферные агенты.
Твердые композиции аналогичного типа также можно использовать в качестве наполнителей в мягко- и твердонаполненных желатиновых капсулах с применением таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и т.п.Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул можно готовить с использованием покрытий и оболочек, таких как энтеросолюбильные и другие покрытия, хорошо известные в области приготовления фармацевтических композиций. Они могут необязательно содержать опалесцирующие агенты и также могут иметь композицию, обеспечивающую высвобождение только активного (-ых) компонента (-ов) или преимущественно в определенной части пищеварительного тракта, необязательно в замедленной форме. Примеры возможных для применения инкапсулирующих композиций включают в себя полимерные вещества и воски. Твердые композиции аналогичного типа также можно использовать в качестве наполнителей в мягко- и твердонаполненных желатиновых капсулах с применением таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и т.п.
Модифицированные частицы также можно получить в микроинкапсулированной форме с одним или более перечисленными выше эксципиентами. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул можно получить с использованием покрытий и оболочек, таких как энтеросолюбильные покрытия, покрытия с контролем высвобождения и другие покрытия, хорошо известные в области приготовления фармацевтических композиций. В таких твердых дозированных формах активное соединение можно смешивать с по меньшей мере одним инертным разбавителем, например сахарозой, лактозой и крахмалом. В соответствии с принятой практикой такие дозированные формы также могут содержать дополнительные вещества, помимо инертных разбавителей, например смазывающие вещества для таблетирования и другие вспомогательные вещества для таблетирования, такие как стеарат магния и микрокристаллическую целлюлозу. В случае капсул, таблеток и пилюль дозированные формы могут также содержать буферные агенты. Они могут необязательно содержать опалесцирующие агенты, а также могут иметь композицию, обеспечивающую высвобождение только модифицированных частиц или преимущественно в определенной части пищеварительного тракта, необязательно в замедленной форме. Примеры возможных для применения инкапсулирующих композиций включают в себя полимерные вещества и воски.
Настоящее изобретение включает в себя фармацевтически приемлемые составы для местного применения из модифицированных частиц, обладающие признаками изобретения. В настоящем документе термин «фармацевтически приемлемый состав для местного применения» означает любой состав, который является фармацевтически приемлемым для внутрикожного введения модифицированных микрочастиц изобретения посредством нанесения соединения на эпидермис. В некоторых вариантах осуществления настоящего изобретения состав для местного применения содержит систему носителя. Фармацевтически эффективные носители включают в себя, без ограничений, растворители (например, спирты, полимерные спирты, воду), кремы, лосьоны, мази, масла, пластыри, липосомы, порошки, эмульсии, микроэмульсии и буферные растворы (например, гипотонический или буферный физраствор) или любой другой носитель, известный в данной области как используемый для введения лекарственных препаратов для местного применения. Более полный список известных в данной области носителей представлен путем ссылки в стандартной справочной литературе, например, Remington's Pharmaceutical Sciences, 16th Edition, 1980 и 17th Edition, 1985, оба выпущены издательством Mack Publishing Company, г.Истон, штат Пенсильвания, описания которых полностью включены в настоящий документ путем ссылки. В некоторых других вариантах осуществления составы изобретения для местного применения могут содержать эксципиенты. Для получения фармацевтически приемлемых составов для местного применения, обладающих признаками изобретения, могут использоваться любые известные в данной области фармацевтически приемлемые эксципиенты. Примеры эксципиентов, которые могут быть включены в составы для местного применения изобретения, включают в себя, без ограничений, консерванты, антиоксиданты, увлажнители, умягчители, буферные агенты, солюбилизирующие агенты, другие агенты, усиливающие проницаемость, средства защиты кожи, поверхностно-активные вещества и пропелленты и/или дополнительные терапевтические агенты, используемые в комбинации с модифицированными частицами. Подходящие консерванты включают в себя, без ограничений, спирты, четвертичные амины, органические кислоты, парабены и фенолы. Подходящие антиоксиданты включают в себя, без ограничений, аскорбиновую кислоту и ее сложные эфиры, бисульфит натрия, бутилированный гидрокситолуол, бутилированный гидроксианизол, токоферолы и хелатирующие агенты, такие как ЭДТА и лимонная кислота. Подходящие увлажнители включают в себя, без ограничений, глицерин, сорбит, полиэтиленгликоли, мочевину и пропиленгликоль. Подходящие буферные агенты для применения в изобретении включают в себя, без ограничений, буферы на основе лимонной, соляной и молочной кислот. Подходящие солюбилизирующие агенты включают в себя, без ограничений, четвертичные хлориды аммония, циклодекстрины, бензилбензоат, лецитин и полисорбаты. Подходящие средства защиты кожи, которые могут использоваться в составах для местного применения изобретения, включают в себя, без ограничений, масло, содержащее витамин Е, аллантоин, диметикон, глицерин, вазелин и оксид цинка.
В определенных вариантах осуществления фармацевтически приемлемые составы для местного применения изобретения содержат по меньшей мере модифицированные частицы изобретения и агент, усиливающий проницаемость. Выбор состава для местного применения будет зависеть от нескольких факторов, включая подлежащее лечению состояние, физико-химические характеристики соединения, обладающего признаками изобретения, и других присутствующих эксципиентов, их стабильность в составе, доступное производственное оборудование, а также ценовых ограничений. В настоящем документе термин «агент, усиливающий проницаемость» означает агент, способный транспортировать фармакологически активное соединение через роговой слой в эпидермис или дерму, предпочтительно с незначительной системной абсорбцией или ее отсутствием. Широкое разнообразие соединений оценивали относительно их эффективности по усилению скорости проникновения лекарственных средств через кожный покров. См., например, Percutaneous Penetration Enhancers, Maibach H. I. and Smith H. E. (eds.), CRC Press, Inc., Boca Raton, Fla. (1995), где оценивается применение и тестирование различных усилителей проницаемости кожи, а также Buyuktimkin et al., Chemical Means of Transdermal Drug Permeation Enhancement in Transdermal and Topical Drug Delivery Systems, Gosh T. K., Pfister W. R., Yum S. I. (Eds.), Interpharm Press Inc., Buffalo Grove, Ill. (1997). В некоторых примерах осуществления агенты, усиливающие проницаемость, для применения в настоящем изобретении включают в себя, без ограничений, триглицериды (например, соевое масло), композиции алоэ (например, гель алоэ вера), этиловый спирт, изопропиловый спирт, октолифенилполиэтиленгликоль, олеиновую кислоту, полиэтиленгликоль 400, пропиленгликоль, N-децилметилсульфоксид, сложные эфиры жирных кислот (например, изопропилмиристат, метиллаурат, моноолеат глицерина и моноолеат пропиленгликоля) и N-метилпирролидон.
В определенных вариантах осуществления композиции могут быть представлены в виде мазей, паст, кремов, лосьонов, гелей, порошков, растворов, аэрозолей, средств для ингаляции или пластырей. В некоторых примерах вариантов осуществления составы композиций в соответствии с изобретением представляют собой кремы, которые могут дополнительно содержать насыщенные или ненасыщенные жирные кислоты, такие как стеариновая кислота, пальмитиновая кислота, олеиновая кислота, пальмитоолеиновая кислота, цетиловый или олеиловый спирты, причем, в частности, предпочтительной является стеариновая кислота. Кремы изобретения могут также содержать неионное поверхностно-активное вещество, например полиокси-40-стеарат.В определенных вариантах осуществления активный компонент в стерильных условиях смешивают с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферными растворами. Считается, что офтальмологические составы, ушные капли и глазные капли также входят в объем изобретения. Кроме того, настоящее изобретение предусматривает применение трансдермальных пластырей, которые обладают дополнительным преимуществом обеспечения контролируемой доставки соединения в тело. Такие дозированные формы получают растворением или диспергированием соединения в соответствующей среде. Как описано выше, агенты для усиления проницаемости также можно применять для увеличения потока соединения через кожу. Скоростью проницаемости можно управлять с помощью либо обеспечения мембраны, регулирующей скорость проницаемости, либо диспергирования соединения в полимерной матрице или геле.
Модифицированные частицы можно вводить посредством аэрозоля. Это достигается путем получения водного аэрозоля, липосомного препарата или твердых частиц, содержащих модифицированные частицы. Можно применять безводную суспензию (например, фторуглеродный пропеллент).
Обычно водный аэрозоль получают путем введения в состав водного раствора или суспензии агента вместе с обычными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы варьируются в зависимости от требований к определенному соединению, но обычно включают в себя неионогенные поверхностно-активные вещества (Tweens, Pluronics® или полиэтиленгликоль), нетоксичные белки, такие как сывороточный альбумин, сложные эфиры сорбита, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахарные спирты. Аэрозоли по существу получают на основе изотонических растворов.
Следует также понимать, что модифицированные частицы и фармацевтические композиции настоящего изобретения могут быть получены и использованы в видах комбинированной терапии, т.е. соединения и фармацевтические композиции могут быть введены в состав в смеси с, или введены одновременно с, перед или после одного или более других требуемых терапевтических средств или медицинских процедур. При выборе конкретной терапевтической комбинации (терапевтических средств или процедур) с целью использования в комбинированной схеме лечения будет приниматься во внимание совместимость требуемых терапевтических средств и/или процедур и желаемый для достижения терапевтический эффект. Следует также понимать, что используемые терапевтические средства могут достичь желаемого эффекта в отношении одного и того же расстройства (например, соединение, обладающее признаками изобретения, можно вводить одновременно с другим противовоспалительным средством), или они могут достигать различных эффектов (например, контроль каких-либо неблагоприятных побочных эффектов).
В определенных вариантах осуществления фармацевтические композиции, содержащие модифицированные частицы настоящего изобретения, дополнительно содержат один или более дополнительных терапевтически активных компонентов (например, противовоспалительных и/или паллиативных компонентов). Для целей изобретения термин «паллиативный» относится к лечению, которое фокусируется на облегчении симптомов заболевания и/или побочных эффектов схемы лечения, но не является лечебным. Например, паллиативное лечение включает в себя болеутоляющие, противорвотные лекарственные средства и лекарственные средства против тошноты.
В изобретении представлены способы регулирования иммунного ответа у субъекта, предпочтительно млекопитающего, более предпочтительно - человека, включающие введение субъекту модифицированных частиц, описанных в настоящем документе. Способы иммунорегуляции, представленные в настоящем изобретении, включают в себя те, которые подавляют и/или ингибируют врожденный иммунный ответ или адаптивный иммунный ответ, включая, без ограничений, иммунный ответ, стимулированный иммуностимулирующими полипептидами или вирусными или бактериальными компонентами.
Модифицированные частицы вводят в количестве, достаточном для регулирования иммунного ответа. Как описано в настоящем документе, регулирование иммунного ответа может быть гуморальным и/или клеточным и измеряется с использованием стандартных методик, известных в данной области и описанных в настоящем документе.
В некоторых вариантах осуществления композиции, описанные в настоящем документе, вводят вместе (например, одновременно, перед или после) с имплантатом (например, устройством) и/или трансплантатом (например, тканью, клетками, органом) для опосредования, нейтрализации, регуляции и/или уменьшения соответствующего иммунного ответа.
В определенных вариантах осуществления субъект страдает от расстройства, связанного с нежелательной иммунной активацией, такого как аллергическое заболевание или состояние, аллергия и астма. Субъект с аллергическим заболеванием или астмой представляет собой субъект с обнаруживаемым симптомом существующего аллергического заболевания или астмы. У такого субъекта толерантность можно индуцировать, например, при помощи частиц в комплексе с определенными пищевыми продуктами (например, белками арахиса и т.п.), вводимыми путем инъекции белками (например, белками пчелиного яда и т.п.) или вводимыми путем ингаляции веществами (например, белками пыльцы амброзии, белками, содержащимися в клетках кожи домашних животных, и т.п.), которые вызывают аллергическую реакцию.
В определенных вариантах осуществления субъект страдает от расстройства, связанного с нежелательной иммунной активацией, такого как аутоиммунное заболевание и воспалительное заболевание. Субъект с аутоиммунным заболеванием или воспалительным заболеванием представляет собой субъект с обнаруживаемым симптомом существующего аутоиммунного заболевания или воспалительного заболевания. У такого субъекта толерантность можно выработать, например, при помощи частиц в комплексе с соответствующими аутоантигенами, обуславливающими конкретное аутоиммунное заболевание.
В определенных вариантах осуществления субъект страдает от расстройства, связанного с ферментозаместительной терапией. У такого субъекта толерантность можно вызвать, например, частицами в комплексе с ферментами, которые пациенты с генетической недостаточностью не способны продуцировать, чтобы предотвратить у них образование нейтрализующих антител на рекомбинантные ферменты, вводимые для лечения данной недостаточности, например толерантности к человеческому фактору VIII у пациентов с гемофилией, обусловленной генетической недостаточностью способности к продукции фактора VIII. Другой пример может включать в себя замещение фермента при таких состояниях, как болезнь накопления мукополисахаридов, ганглиозидоз, щелочная гипофосфатазия, заболевание накопления эфиров холестерина, гиперурикемия, дефицит гормона роста, почечная анемия, или с болезнями лизосомального накопления, включая болезнь Фабри, болезнь Гоше, болезнь Гурлера, болезнь Хантера, болезнь Марото - Лами, болезнь Ниманна - Пика, болезнь Тея - Сакса и болезнь Помпе.
В определенных вариантах осуществления субъект страдает от сильного или иным образом неблагоприятного иммунного ответа в отношении агента, вводимого для лечения заболевания, что фактически или потенциально ставит под угрозу здоровье пациента или его лечение. Кроме того, новые соединения, предлагаемые в изобретении, могут быть предоставлены субъектам, у которых не проявляется иммунный ответ на агент, но у которых он может потенциально проявиться в будущем. В определенных вариантах осуществления субъект получает ферментозаместительную терапию. В определенных вариантах осуществления терапевтические агенты включают в себя, без ограничений, пептиды или агенты на белковой основе, ДНК-вакцины, миРНК, олигомеры, переключающие сайт сплайсинга, и наночастицы на основе РНК. В некоторых вариантах осуществления терапевтические агенты включают в себя, без ограничений, адват, антигемофилический фактор, когенат, элоктат, слитный белок рекомбинантного фактора VIII и Fc, рефакто, Novo VIIa, рекомбинантный фактор VII, эптаког альфа, геликсат, монанин, фактор коагуляции IX, вилат, цередазу, аглюцеразу, церезим, имиглюцеразу, Elelso, талиглюцеразу альфа, фабразим, агалсидазу бета, альдуразим, альфа-L-идуронидазу, миозим, кислую глюкозидазу, элапразу, идуронат-2-сульфатазу, наглазим арилсульфатазу B и N-ацетилгалактозамин-4-сульфатазу. В некоторых вариантах осуществления субъекту вводят терапевтические агенты, применяемые для лечения заболеваний, включая, без ограничений, гемофилию, гемофилию A, гемофилию B, болезнь фон Виллебранда, болезнь Гоше, болезнь Фабри, болезнь Гурлера, болезнь Помпе, болезнь Хантера, болезнь накопления мукополисахаридов, ганглиозидоз, щелочную гипофосфатазию, заболевание накопления эфиров холестерина, гиперурикемию, дефицит гормона роста, почечную анемию и болезнь Марото-Лами.
В определенных вариантах осуществления субъект страдает от орфанного аутоиммунного состояния. Такие состояния включают в себя, без ограничений, идиопатическую тромбоцитопеническую пурпуру, мембранную нефропатию, буллезный пемфигоид, пемфигус вульгарис и миастению гравис.
В определенных вариантах осуществления субъект страдает от расстройства, связанного с терапией заболевания. В случае рекомбинантных антител толерантность индуцируют, например, к гуманизированному антителу, применяемому в терапевтическом контексте, для предотвращения выработки у пациента нейтрализующих антител к терапевтическим антителам, например, индуцируют толерантность к гуманизированному антителу, устраняющему иммунную субпопуляцию, или к антителу к цитокину, используемому для лечения аутоиммунного заболевания.
Аутоиммунные заболевания можно разделить на две широкие категории: органоспецифические и системные. Аутоиммунные заболевания включают в себя, без ограничений, ревматоидный артрит (РА), системную красную волчанку (СКВ), сахарный диабет I типа, сахарный диабет II типа, рассеянный склероз (РС), иммуноопосредованное бесплодие, такое как преждевременная недостаточность яичников, склеродермию, болезнь Шегрена, витилиго, алопецию (облысение), полигландулярную недостаточность, болезнь Грейвса, гипотиреоз, полимиозит, пузырчатку обыкновенную, пузырчатку листовидную, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, аутоиммунный гепатит, включая связанный с вирусом гепатита В (ВГВ) и вирусом гепатита С (ВГC), гипопитуитаризм, болезнь «трансплантат против хозяина» (GvHD), миокардит, болезнь Аддисона, аутоиммунные заболевания кожи, увеит, злокачественную анемию, целиакию, гипопаратиреоз, оптикомиелит, мембранозную нефропатию, буллезный пемфигоид, обыкновенную пузырчатку, миастению гравис.
Аутоиммунные заболевания могут также включать в себя, без ограничений, тиреоидит Хашимото, аутоиммунные полигландулярные синдромы I типа и II типа, паранеопластическую пузырчатку, буллезную пузырчатку, герпетиформный дерматит, линейный IgA дерматоз, буллезный приобретенный эпидермолиз, узелковую эритему, пемфигоид беременных, рубцовый пемфигоид, эссенциальную криоглобулинемию смешанного типа, хроническую буллезную болезнь детского возраста, гемолитическую анемию, тромбоцитопеническую пурпуру, синдром Гудпасчера, аутоиммунную нейтропению, миастению гравис, миастенический синдром Итона - Ламберта, синдром мышечной скованности, острый рассеянный энцефаломиелит, синдром Гийена - Барре, хроническую воспалительную демиелинизирующую полирадикулонейропатию, мультифокальную моторную нейропатию с блоком проводимости, хроническую нейропатию с моноклональной гаммапатией, опсоклонический-миоклонический синдром, мозжечковую дегенерацию, энцефаломиелит, ретинопатию, первичный билиарный склероз, склерозирующий холангит, глютензависимую энтеропатию, анкилозирующий спондилит, реактивные артриты, полимиозит/дерматомиозит, смешанное заболевание соединительной ткани, синдром Бехчета, псориаз, узелковый полиартериит, аллергический ангиит и гранулематоз (болезнь Черджа - Стросса), синдром полиангиита «с перекрытием», аллергический васкулит, гранулематоз Вегенера, височный артериит, артериит Такаясу, болезнь Кавасаки, выделенный васкулит центральной нервной системы, облитерирующий тромбангиит, саркоидоз, гломерулонефрит и криопатии. Эти состояния хорошо известны в медицинских областях и описаны, например, в Harrison's Principles of Internal Medicine, 14th ed., Fauci A S et al., eds., New York: McGraw-Hill, 1998.
Животные модели для изучения аутоиммунного заболевания известны в данной области. Например, модели с использованием животных, наиболее схожие с аутоиммунными заболеваниями человека, включают в себя линии животных, у которых спонтанно развивается определенное заболевание с высокой частотой. Примеры таких моделей включают в себя, без ограничений, мышей с диабетом без ожирения (NOD), у которых развивается заболевание, аналогичное диабету I типа, а также животных, подверженных заболеванию, сходному с системной красной волчанкой, таких как новозеландские гибридные, MRL-Faslpr и BXSB-мыши. Животные модели с индуцированным аутоиммунным заболеванием включают в себя, без ограничений, модель экспериментального аутоиммунного энцефаломиелита (ЕАЕ), которая представляет собой модель рассеянного склероза, коллаген-индуцированного артрита (CIA), которая представляет собой модель ревматоидного артрита, трансгенных мышей с Т-клетками, специфичными к десмоглеину 3, используемых в качестве экспериментальной модели пемфигус вульгарис, и модель экспериментального аутоиммунного увеита (EAU), которая представляет собой модель увеита. Животные модели аутоиммунного заболевания также были созданы с помощью генетических манипуляций и включают в себя, например, нокаутных мышей по IL-2/IL-10 для моделирования воспалительного заболевания кишечника, нокаутных мышей по Fas или Fas-лиганду для моделирования СКВ и нокаутных мышей по антагонисту к рецептору IL-I для моделирования ревматоидного артрита.
В определенных вариантах осуществления субъект страдает бактериальной или вирусной инфекцией. Субъект с бактериальной или вирусной инфекцией представляет собой субъект с обнаруживаемым симптомом существующей бактериальной или вирусной инфекции.
Не имеющий ограничительного характера список вирусных инфекций, поддающихся лечению модифицированными частицами настоящего изобретения, включает в себя инфекции, вызываемые вирусом простого герпеса, инфекции, вызываемые вирусом гепатита, инфекции, вызываемые вирусом лихорадки Западного Нила, инфекции, вызываемые флавивирусом, инфекции, вызываемые вирусом гриппа, риновирусные инфекции, папилломавирусные инфекции, паромиксовирусные инфекции, инфекции, вызываемые вирусом парагриппа, и ретровирусные инфекции. Предпочтительными вирусами являются вирусы, инфицирующие центральную нервную систему субъекта. Наиболее предпочтительными вирусами являются вирусы, что вызывают геморрагическую лихорадку, энцефалит или менингит.
Не имеющий ограничительного характера список бактериальных инфекций, поддающихся лечению модифицированными частицами настоящего изобретения, включает в себя стафилококковые инфекции, стрептококковые инфекции, микобактериальные инфекции, инфекции, вызываемые бациллами, инфекции, вызываемые сальмонеллой, инфекции, вызываемые вибрионом, инфекции, вызываемые спирохетой, и инфекции, вызываемые нейссериями. Предпочтительными являются бактерии, которые инфицируют центральную нервную систему субъекта. Наиболее предпочтительными являются те бактерии, которые вызывают энцефалит или менингит.
В некоторых вариантах осуществления изобретение относится к применению композиций настоящего изобретения перед началом заболевания. В других вариантах осуществления изобретение относится к применению композиций настоящего изобретения для ингибирования текущего заболевания. В некоторых вариантах осуществления изобретение относится к облегчению заболевания у субъекта. Облегчение заболевания у субъекта означает обеспечение лечения, предотвращения или подавления заболевания у субъекта.
В некоторых вариантах осуществления изобретение относится к предотвращению рецидива заболевания. Например, нежелательный иммунный ответ может развиться к одной области пептида (например, к антигенной детерминанте). Рецидив заболевания, связанный с нежелательным иммунным ответом, может развиться в связи с возникновением иммунного ответа на другую область пептида. Поскольку иммуномодифицирующие частицы настоящего изобретения не имеют присоединенных к ним пептидов или антигенных фрагментов, частицы будут эффективны против множества эпитопов. При некоторых расстройствах иммунного ответа, включая РС и другие Th1/17-опосредованные аутоиммунные заболевания, Т-клеточные ответы могут быть динамичными и развиваться в ходе возвратно-ремиттирующего и/или хронического прогрессирующего заболевания. Динамический характер Т-клеточного репертуара имеет последствия для лечения некоторых заболеваний, поскольку по мере прогрессирования заболевания может меняться мишень. Ранее для прогнозирования прогрессирования болезни было необходимо предварительное знание характера иммунных ответов. В настоящем изобретении предложены композиции, которые могут предотвратить эффект динамического изменения заболевания, зависящего от феномена «распространения эпитопа». Известной моделью рецидива заболевания является иммунная реакция на протеолипидный белок (PLP), выступающая в качестве модели рассеянного склероза (РС). Первоначальный иммунный ответ может произойти в ответ на PLP139–15. Последующее начало заболевания может стать результатом рецидива иммунного ответа на PLP[pi]s-iβi.
Другие варианты осуществления настоящего изобретения относятся к трансплантации. Это относится к переносу образца ткани или трансплантата от субъекта-донора субъекту-реципиенту и часто осуществляется на реципиентах-людях, которые нуждаются в ткани для восстановления физиологической функции, обеспечиваемой тканью. Трансплантируемые ткани включают в себя (без ограничений) целые органы, такие как почки, печень, сердце, легкое; компоненты органов, такие как кожные трансплантаты и роговица глаза; и клеточные суспензии, такие как клетки костного мозга и культуры клеток, отобранных и размноженных из костного мозга или циркулирующей крови, и переливания цельной крови.
Серьезное потенциальное осложнение любой трансплантации происходит из-за антигенных различий между реципиентом-хозяином и трансплантируемой тканью. В зависимости от характера и степени различий возможен риск иммунологической атаки организма хозяина на трансплантат, или трансплантата на хозяина, или того и другого. Степень риска определяется по результатам наблюдения за характером ответа в популяции субъектов аналогичного фенотипа, получивших сходное лечение, и на основании корреляции различных возможных влияющих факторов, в соответствии с принятыми клиническими процедурами. Иммунологическая атака может быть результатом уже существующего иммунного ответа (например, в случае предварительно образованного антитела) или ответа, который инициируется в ближайшее время после трансплантации (например, генерация Th-клеток). Антитело, Th-клетки или Tc-клетки могут участвовать в иммунном ответе в любой комбинации друг с другом и с разнообразными эффекторными молекулами и клетками. Однако антигены, которые участвуют в иммунном ответе, по существу неизвестны, поэтому существуют сложности в разработке антиген-специфических видов терапии или индукции антиген-специфической толерантности.
Некоторые варианты осуществления изобретения относятся к снижению риска реакции «хозяин против трансплантата» при заболевании, ведущей к отторжению тканевого трансплантата реципиентом. Лечение можно осуществлять для предотвращения или снижения эффекта гиперострого, острого или хронического ответа отторжения трансплантата. Лечение предпочтительно начинать достаточно заблаговременно до трансплантации, так что толерантность уже будет достигнута к моменту пересадки трансплантата; но в тех случаях, когда это невозможно, лечение можно начать одновременно с трансплантацией или после нее. Независимо от времени начала лечение по существу продолжают через определенные промежутки времени по меньшей мере в течение первого месяца после трансплантации. Последующие дозы могут не требоваться, если происходит достаточное приживление трансплантата, но лечение можно возобновить в том случае, если имеются какие-либо признаки отторжения или воспаления трансплантата. Конечно, процедуры, направленные на формирование толерантности в соответствии с настоящим изобретением, могут комбинироваться с другими формами иммуносупрессии для достижения даже более низкой степени риска.
Некоторые варианты осуществления изобретения относятся к снижению или иным способом ослабления воспалительного ответа, индуцированного как ответ на хирургическое вмешательство. В одном варианте осуществления изобретения иммуномодифицирующие частицы вводят перед хирургическим вмешательством. В дополнительном варианте осуществления изобретения иммуномодифицирующие частицы вводят одновременно или в ходе хирургического вмешательства. В еще одном дополнительном варианте осуществления изобретения иммуномодифицирующие частицы вводят после хирургического вмешательства.
Частицы настоящего изобретения также можно применять для лечения абсцессов или эмпием для уменьшения воспалительного ответа, формируемого у субъекта после воздействия инфекционных агентов, таких как бактерии или паразиты. В одном варианте осуществления изобретения иммуномодифицирующие частицы вводят в сочетании с антибактериальной и/или антипаразитарной терапией, известными в данной области.
Частицы изобретения также можно применять для уменьшения или иным способом ослабления воспалительного ответа, индуцированного как ответ на физическую травму или повреждение, включая, без ограничений, спортивную травму, рану, травму спинного мозга, травму головного мозга и/или травму мягких тканей. В одном варианте осуществления изобретения иммуномодифицирующие частицы вводят после перенесения субъектом травмы или повреждения.
Частицы изобретения также можно применять для уменьшения воспалительного ответа, связанного с развитием и/или ростом раковых клеток. Раковые заболевания, которые подвергаются лечению, включают в себя, без ограничений, рак центральной нервной системы, базально-клеточную карциному, раковые опухоли головного мозга, лимфому Беркитта, лимфому, рак шейки матки, рак яичников, рак яичек, рак печени, немелкоклеточный и мелкоклеточный рак легких, меланому, рак мочевого пузыря, рак молочной железы, рак ободочной кишки и рак прямой кишки, рак эндометрия, рак почек (паренхимы почек), лейкоз, неходжкинскую лимфому, рак поджелудочной железы, рак предстательной железы, меланому и рак щитовидной железы. В одном варианте осуществления подкожная инъекция частиц изобретения предотвращает накопление ингибиторных нейтрофилов, таким образом уменьшая иммунный ответ у пациента, страдающего раковым заболеванием.
Частицы изобретения также могут подходить для регенерации поврежденной ткани. В одном варианте осуществления введение частиц пациенту усиливает регенерацию поврежденных эпителиальных клеток пищеварительного тракта. В дополнительном варианте осуществления пациент страдает от колита, болезни Крона или воспалительного заболевания кишечника. В другом варианте осуществления введение пациенту частиц изобретения увеличивает ремиелинизацию нейронов. В дополнительном варианте осуществления пациент страдает от рассеянного склероза.
В некоторых вариантах осуществления композиции настоящего изобретения (например, носитель PLG, соединенный с антигенной молекулой) могут использоваться с одним или более каркасами, матрицами и/или системами доставки (см., например, заявку на патент США №2009/0238879; патент США №7,846,466; патент США №7,427,602; патент США №7,029,697; патент США №6,890,556; патент США №6,797,738; патент США №6,281,256, которые полностью включены в настоящий документ путем ссылки). В некоторых вариантах осуществления частицы (например, связанные с антигеном PLG-частицы) связаны, адсорбированы, встроены, конъюгированы и т.п.с каркасом, матрицей и/или системой доставки (например, для доставки субъекту химического/биологического материала, клетки, ткани и/или органа). В некоторых вариантах осуществления каркас, матрица и/или система доставки (например, для доставки субъекту химического/биологического материала, клетки, ткани и/или органа) содержат и/или состоят из материалов, описанных в настоящем документе (например, PLG, конъюгированного с одним или более антигенными пептидами).
В некоторых вариантах осуществления предложены микропористые каркасы (например, для трансплантации биологического материала (например, клеток, тканей и т.п.) субъекту). В некоторых вариантах осуществления предложены микропористые каркасы, на которых присутствуют агенты (например, белки внеклеточного матрикса, экзендин-4) и биологический материал (например, островковые клетки поджелудочной железы). В некоторых вариантах осуществления каркасы применяют для лечения заболеваний (например, диабета I типа) и родственных способов (например, диагностических способов, исследовательских способов, скринингового поиска лекарственных средств). В некоторых вариантах осуществления предложены каркасы с описанными в настоящем документе носителями, конъюгированными с антигеном, которые находятся на каркасе и/или внутри него. В некоторых вариантах осуществления каркасы получают из материалов, конъюгированных с антигенами (например, конъюгированного с антигенами PLG).
В некоторых вариантах осуществления каркас и/или система доставки содержит один или более слоев и/или содержит один или более химических и/или биологических объектов/агентов (например, белков, конъюгированных с пептидом частиц, низкомолекулярных соединений, клеток, тканей и т.п.), см., например, заявку на патент США 2009/0238879, которая полностью включена в настоящий документ путем ссылки. В некоторых вариантах осуществления связанные с антигеном частицы вводят совместно с каркасной системой доставки для того, чтобы вызвать иммунологическую толерантность к каркасу и связанным с ним материалам. В некоторых вариантах осуществления микропористый каркас вводят субъекту с описанными в настоящем документе частицами, находящимися на каркасе или внутри него. В некоторых вариантах осуществления связанные с антигеном частицы соединены с каркасной системой доставки. В некоторых вариантах осуществления каркасная система доставки содержит связанные с антигеном частицы.
Специалистам в данной области будут очевидны различные модификации, рекомбинации и вариации описанных элементов и вариантов осуществления без выхода за рамки сущности и объема изобретения. Хотя описаны конкретные варианты осуществления, следует понимать, что заявленное изобретение не должно чрезмерно ограничиваться такими вариантами осуществления. Действительно, подразумевается, что различные модификации описанных схем и вариантов осуществления, очевидные специалистам в данной области, входят в объем приведенной ниже формулы изобретения. Например, в заявках на патенты США 2012/0076831, 2002/0045672, 2005/0090008, 2006/0002978 и 2009/0238879 (каждая из которых полностью включена в настоящий документ путем ссылки) и патентах США №№7,846,466; 7,427,602; 7,029,697; 6,890,556; 6,797,738; и 6,281,256 (каждый из которых полностью включен в настоящий документ путем ссылки) указана конкретная информация, модификации и вариации, которые находят применение в различных вариантах осуществления, описанных в настоящем документе.
Все публикации и патенты, упомянутые в настоящей заявке и/или перечисленные ниже, полностью включены в настоящий документ путем ссылки.
ПРИМЕРЫ
Следующие примеры предоставлены для дополнительной иллюстрации преимуществ и элементов изобретения, но не предназначены для ограничения объема настоящего описания.
Материалы и способы
Получение химерных мышей
Мышей B6.SJL-PtprcaPep3b/BoyJ (CD45.1) возрастом шесть - восемь недель облучали однократно дозой 950 рад. Через двенадцать часов мышам вводили 107 клеток костного мозга от доноров C57BL/6-7.2fms-EGFP. Мышам давали сульфаметоксазол (Sigma Aldrich) и триметоприм (Sigma Aldrich) с питьевой водой в течение 10 суток после облучения. Мышей заражали WNV через шесть недель после облучения, как описано выше. Химеризм контролировали с помощью проточной цитометрии, и он неизменно составлял 96–99% клеток донорского происхождения, как было показано ранее (Getts et al., J Neurochem. 103: 1019, 2007).
Иммуногистология
Мышам проводили анестезию и перфузировали 50 мл стерильного PBS. За исключением сердца, которое обрабатывали с заключением в парафиновые блоки (Getts et al., J. Neurochem 103: 10919–1030, 2007), все органы выделяли и замораживали небольшими фрагментами в среде Optimum Cutting Temperature Compound (OCT; Tissue-Tek, г.Токио, Япония). Срезы ткани толщиной восемь мкм нарезали с помощью криостатического микротома, высушивали на воздухе в течение ночи и хранили при 80°С до использования. Замороженные срезы оттаивали и проводили гистологическое (стандартное окрашивание гематоксилином и эозином) или иммуногистохимическое исследование (Getts et al., J. Exp Med 205: 2319–2337, 2008). Антитела к MARCO, SIGN-R1 и SIGLEC-1 (R&D Systems, штат Миннесота США), CD68 (Abcam, штат Массачусетс, США) и Ki67 (Abcam) использовали в соответствии с указаниями. Изображения были получены с использованием микроскопа Olympus BX-51 с камерой DP-70 и программного обеспечения DP manager 2.2.1 (Olympus, г.Токио, Япония).
Микроскопия и регистрация изображений
Изображения были получены с использованием микроскопа Olympus BX-51 (Olympus, Япония) с камерой DP-70 и программного обеспечения DP manager 2.2.1 (Olympus).
Выделение лейкоцитов из головного мозга и печени
Как описано ранее (Getts et al, J Exp Med. 29: 2319, 2007), лейкоциты получали из головного мозга перфузируемых с помощью PBS мышей путем расщепления мозговой ткани в течение 60 минут при 37°C в PBS дезоксирибонуклеазой (0,005 г/мл; Sigma Aldrich) и коллагеназой IV (0,05 г/мл; Sigma Aldrich). Расщепление останавливали при помощи 10% FCS и гомогенат пропускали через нейлоновое сито с ячейками 70 мкм (Becton Dickinson, штат Нью-Джерси, США). Осадок, полученный после центрифугирования в течение 10 мин при 340 x g, повторно суспендировали в 30% Percoll (Amersham, Норвегия) и покрывали слоем 80% Percoll. Лейкоциты собирали с поверхности раздела 30%/80% раствора после центрифугирования при 1140 x g в течение 25 минут при комнатной температуре. Тот же протокол использовали для получения лейкоцитов из печени со взвешиванием ткани перед обработкой.
Выделение лейкоцитов из селезенки, крови и костного мозга
Для анализа путем проточной цитометрии правое бедро рассекали и клетки костного мозга вымывали с помощью шприцев с PBS. Для выделения костномозговых предшественников использовали бедренные и большеберцовые кости по меньшей мере 4 мышей. Клеточную суспензию, полученную после промывки, фильтровали через клеточное сито 70 мкм и центрифугировали в течение 5 мин при 340 g. Эритроциты в полученном осадке лизировали лизирующим буфером для эритроцитов на основе NH4Cl (BD Pharm Lyse™; BD Pharmingen), после чего центрифугировали в течение 5 мин при 340 x g. В случае периферической крови ее собирали через прокол сердца и немедленно переносили в цитратный буфер (mMol, Sigma Alrich). Полученную суспензию расслаивали на 70% Percoll и центрифугировали при 1140 x g в течение 20 минут при комнатной температуре при отключенном тормозе. Поверхность раздела отбирали и клетки промывали однократно в PBS, центрифугировали при 340 x g. Для выделения лейкоцитов селезенки ее пропускали через клеточное сито 7070 мкм и центрифугировали в течение 5 мин при 340 g. Эритроциты в полученном осадке лизировали лизирующим буфером для эритроцитов на основе NH4Cl (BD Pharm Lyse™; BD Pharmingen), после чего центрифугировали в течение 5 мин при 340 x g.
Проточная цитометрия
Клетки, собранные (как описано выше) из головного мозга, печени, крови и костного мозга, промывали в PBS и блокировали антителами к CD16/CD32 (Biolegend). Жизнеспособные клетки подсчитывали способом вытеснения трипанового синего, который, как правило, показывал жизнеспособность>95% клеток.
Измеряли экспрессию молекул на поверхности клеток и проводили сортировку на приборе FACS ARIA (Becton Dickinson), оснащенном аргоновым ионным и HeNe-лазером. Жизнеспособные популяции выделяли с помощью прямого и бокового светорассеяния с последующей оценкой степени их флуоресценции посредством прямого выделения. Сортировку проводили с использованием специальных параметров флуоресценции и рассеяния, идентифицирующих интересующую популяцию. Строгость сортировки была установлена на требуемую чистоту >98% для популяций клеток костного мозга.
Полученные FACS файлы с данными анализировали с помощью программы для анализа результатов проточной цитометрии Flow Jo (FlowJo, Ashland, штат Орегон, США). Количества интересующих клеточных популяций рассчитывали на основании процентных показателей, полученных при анализе данных проточной цитометрии, а также абсолютных подсчетов клеток из каждого органа.
Адоптивный перенос
При разработке вариантов осуществления настоящего изобретения проводили эксперименты для исследования второй модели активного заболевания, называемой адоптивным переносом. Вместо иммунизации животных пептидом лимфоциты из селезенки мышей с активным заболеванием переносили реципиенту, у которого вследствие этого развивалось заболевание. При разработке вариантов осуществления настоящего изобретения проводили эксперименты, чтобы охарактеризовать способность PLG-наночастиц деактивировать адоптивно перенесенные активированные эффекторные клетки. У мышей, получавших частицы или спленоциты, связанные с контрольным пептидом, наблюдалось увеличение балла клинической оценки, начиная с 4-х суток. Мыши, получавшие частицы PLG-PLP139–151 на 2-е сутки, имели средний балл клинической оценки 0 во всех временных точках вплоть до 40х суток, кроме двух, а средний балл клинической оценки в этих других временных точках составлял 0,25.
Мультиплексный ИФА
Мультиплексный планшетный твердофазный ИФА-анализ выполняли в соответствии с инструкциями производителя (Quansys Biosciences, г.Логан, штат Юта, США). Вкратце, ткань головного мозга, селезенки и печени гомогенизировали в PBS, очищали центрифугированием при 1000 x g и хранили при -20 °C до выполнения анализа. Также использовали образцы сыворотки. Оттаявшие образцы и стандарты разбавляли предоставленным буфером и по 30 мкл каждого образца наносили в каждую лунку, содержащую 16 пятен, каждое из которых содержало захватное антитело для определенного растворимого белка. Затем планшеты инкубировали в течение 1 часа на орбитальном шейкере при 120 об/мин. Планшеты промывали 3 раза, в каждую лунку добавляли по 30 мкл антител для отслеживания и инкубировали в течение еще одного часа. После 3 промывок добавляли стрептавидин-HRP и инкубировали в течение дополнительных 15 минут. Затем планшеты промывали 6 раз и добавляли субстратную смесь. Планшеты немедленно сканировали на сканере CCD (Kodak, г.Рочестер, штат Нью-Йорк, США). Изображения с планшета анализировали с использованием программного обеспечения Quansys Q-view (Quansys Biosciences).
Индукция и оценка экспериментального аутоиммунного энцефалита (EAE)
Мышам подкожно вводили эмульсию, содержащую 0,1 мг пептида MOG (MEVGWYRSPFSRVVHLYRNGK (SEQ ID NO: 1); Auspep, г.Парквилл, Виктория, Австралия;>95%, очищение методом ВЭЖХ) и полный адъювант Фрейнда, содержащий 2 мг/мл Mycobacterium tuberculosis (Sigma Aldrich). Через двое суток мышам вводили 500 мкл коклюшного токсина (Sigma Aldrich) внутрибрюшинно. У мышей отслеживали прогрессирование заболевания и оценивали его по следующей шкале: 1, потеря тонуса хвоста и/или слабость 1 задней лапы; 2, слабость более чем одной задней лапы, нарушение походки; 3, паралич 1 конечности; 4, паралич более чем одной конечности, недержание; 5, агония.
Статистические данные
Строили графики и проводили компьютерный статистический анализ в программах GraphPad Prism и InStat соответственно (обе программы производства GraphPad, г.Сан-Диего, штат Калифорния, США). В зависимости от данных проводили непарный двусторонний т-тест Стьюдента или однофакторный дисперсионный анализ с пост-тестом Тьюки - Крамера, значение P<0,05 считали достоверным.
Для анализа корреляции между такими параметрами, как потеря веса, инфильтрация и титр вируса, использовали нелинейную регрессию (аппроксимацию кривой) полиномиальной функцией второго порядка (Y=A+B*X+C*X^2).
Пример 1
Получение отрицательно заряженных иммуномодифицирующих частиц (IMP)
К раствору поли(этилен-малеинового ангидрида) (PEMA) в D2O (4 мл, 1% вес./об.) добавляли по каплям раствор сополимера лактида и гликолевой кислоты (PLG) в дихлорметане (ДХМ) (2 мл, 20% вес./об.). Смесь обрабатывали ультразвуком на льду при 16 Вт в течение 30 с с использованием ультразвукового процессора VC 30. Полученный сырой гомогенат затем выливали в раствор D2O (200 мл, содержащий 0,5% вес./об. PEMA). Гомогенизированной суспензии позволяли перемешиваться в течение ночи с установкой режима скорости 3.5 с использованием магнитной мешалки Bellco Glass, Inc., Bellstir Multi-stir 9 (10 Вт в течение 10 с, 16 Вт в течение 10 с, 16 Вт в течение 30 с).
Результаты
После трех часов перемешивания проводили анализы размера частиц с использованием динамического светорассеяния в одноразовых кюветах из полистирола:
a.10 Вт, 10 с – Z-средний=499,9 нм – PdI=0,23, пик=634,5 нм;
b.16 Вт, 10 с – Z-средний=528,9 нм – PdI=0,227, пик=657,5 нм;
c.16 Вт, 30 с – Z-средний=471,6 нм – PdI=0,228, пик=580,5 нм;
d.16 Вт, 60 с – Z-средний=491,1 нм – PdI=0,275, пик=600,8 нм.
После завершения реакции полученную сырую суспензию очищали.
Очистка
Свежие D2O и 10 x буферный раствор бикарбоната натрия охлаждали в течение ночи до 4°C. Используя клеточный фильтр с величиной пор 40 мкм, 36 мл суспензии частиц отфильтровывали из каждой партии в соответственно меченную центрифужную пробирку объемом 50 мл, содержащую 4 мл охлажденного 10 x буферного раствора бикарбоната натрия. Из каждого лабораторного стакана получали приблизительно 6 таких пробирок. Все пробирки центрифугировали в течение около 15 минут при 7 ООО g и 4°C и аспирировали супернатант. Получение суспензии повторяли с использованием упомянутой выше процедуры, при этом максимально возможное количество осажденных частиц суспендировали в 1 мл охлажденной D2O.
Повторно суспендированные частицы переносили в новую пробирку, содержащую 4 мл охлажденного 10 x буферного раствора бикарбоната натрия. (Этап 1)
Повторное суспендирование частиц повторяли до успешного повторного суспендирования всех осажденных частиц. (Этап 2)
Затем содержимое 6 центрифужных пробирок объединяли в одну центрифужную пробирку (пробирка объемом 50 мл) и эту пробирку заполняли оставшимся объемом 40 мл охлажденной D2O. (Промывка 1)
Пробирку центрифугировали в течение 20 минут при 7 ООО g и 4 °C и аспирировали супернатант.
Этапы 1 и 2 и промывку 1 полученных частиц каждый раз повторяли по меньшей мере еще два раза. Наконец, полученные осажденные частицы затем подвергали мгновенной заморозке в жидком азоте и лиофилизировали досуха в коллекторе с получением отрицательно заряженных IMP.
На Фиг.1 показана характеризация поверхностно-функционализированных частиц сополимера лактида и гликолида посредством анализа динамического светорассеяния. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 2,5 x 105 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела Z-средний диаметр 567 нм, максимальный диаметр 670 нм и коэффициент полидисперсности 0,209.
В таблице 4 приведены результаты измерений для поверхностно-функционализированных частиц PLG-PEMA. Данные в таблице являются типичными, поскольку каждая партия несколько отличается от других. Однако числовые данные в таблице основаны на комбинировании нескольких партий частиц. Измерения, выполняемые для частиц двойной эмульсии, аналогичны приведенным в таблице 2.
Таблица 4. Параметры поверхностно-функционализированных частиц PLG-PEMA
Пример 2
Введение связанных с антигеном PLGA-гранул предотвращает рецидив экспериментального аутоиммунного энцефалита
PLG-наночастицы исследовали с использованием иммунодоминантного эпитопа протеолипидного белка PLP139–151 (PLG-PLP139–151), который применяли для индукции толерантности для предотвращения рецидива экспериментального аутоиммунного энцефалита (R-EAE). Мышей R-EAE готовили, как описано выше.
Пептиды, вводимые животным, были соединены с частицами со средним диаметром 500 нм. Мыши получали PLP139–151-PLGA (N=5), или OVA323–339-PLGA (N=5), или неконъюгированные PLGA (N=5) на -7-е сутки относительно времени иммунизации (0-е сутки). Пик заболевания, как правило, наблюдали приблизительно на 12–14-е сутки и у мышей проводили балльную оценку клинической картины заболевания. Частицы без пептида или частицы, модифицированные контрольным пептидом OVA323–339, не предотвращали индукцию заболевания. Однако PLGA-частицы, модифицированные PLP139–151, давали 0 баллов клинической оценки (отсутствие заболевания) во всех случаях, за исключением низких баллов клинической оценки менее 1, наблюдавшихся в период между 20-ми и 30-ми сутками (Фиг.2). Предшествующие исследования с немодифицированными PLG-частицами или с использованием частиц полистирола не приводили к такому эффективному ослаблению заболевания, причем частицы полистирола обычно вызывали анафилактическую реакцию.
Кроме того, специфическая инактивация миелин-специфических Т-клеток CD4+отражалась в отсутствии реакции гиперчувствительности замедленного типа (DTH) в ответ на оба иммунизирующих эпитопа PLP139–151. Таким образом, профилактическое лечение PLG-PLP139–151 на -7-е сутки специфически предотвращало развитие EAE, что указывает на повышение способности частиц предотвращать заболевание. Балльная оценка, полученная при использовании частиц, была такой же хорошей или даже лучше оценки, полученной с использованием связанных с антигеном спленоцитов.
Тип вводимой частицы также влиял на развитие EAE в мышиной модели. Мыши получали OVA323–339-PLS (N=5), OVA323–339-PLGAPHOSPOREX (N=5), OVA323–339-PLGAPEMA (N=5), PLP139–151-PLA (N=5), PLP139–151-PLGAPHOSPOREX (N=5) или PLP139–151-PLGPEMA (N=5) на -7-е сутки относительно времени иммунизации (0-е сутки). Пик заболевания, как правило, наблюдали приблизительно на 12–14-е сутки и у мышей проводили балльную оценку клинической картины заболевания. Частицы любой композиции, модифицированные контрольным пептидом OVA323–339, не предотвращали индукцию заболевания. Однако связанные с PLP139–151 PLG-гранулы более эффективно снижали индукцию R-EAE, чем связанные с PLP139–151 коммерческие PLG-частицы (Phosphorex) или частицы полистирола (Фиг.3A и 3B).
Пример 3
Внутривенная инфузия связанных с антигеном PLG-частиц не вызывала падения температуры, вызванного анафилактической реакцией, у животных, предварительно сенситизированных OVA/Alum
Из-за наличия активного заболевания анафилактическая реакция на антигены является проблемой, которая может привести к немедленной гибели, и это было описано применительно к частицам, связанным с полистиролом. Анафилактическая реакция связана с существенным падением температуры тела. Чтобы проверить, вызовет ли внутривенное введение OVA-PLG падение температуры, вызванное анафилактической реакцией, у сенсибилизированных животных, мышей иммунизировали на 0-е сутки путем внутрибрюшинной инъекции 10 мкг OVA/Alum. На 14-е сутки мышей снова иммунизировали путем внутрибрюшинного введения 10 мкг OVA/Alum и затем вызывали толерантность при помощи внутривенного введения OVA-PLG на 21-е сутки. На 28-е сутки у мышей вызывали толерантность путем внутривенного введения либо частиц OVA-PLG, либо OVA.
Как показано на Фиг.4, у мышей, получавших растворимый OVA, на 28-е сутки наблюдалось снижение температуры по сравнению с животными, получавшими частицы OVA-PLG. В течение 1 часа после введения частиц не наблюдалось никакого снижения температуры тела.
На Фиг.5 показано, что введение частиц PLP-PLG в ходе ремиссии не вызывает смертности, ассоциированной с анафилактической реакцией. EAE индуцировали у самок мышей линии SJL/J возрастом шесть - восемь недель путем подкожной инъекции PLP139–151в полном адъюванте Фрейнда (CFA) и отслеживали и регистрировали развитие клинических признаков заболевания (Фиг.5B). На 21-е сутки после индукции заболевания мышам делали внутривенные инъекции растворимого PLP139–151 (белые квадраты), растворимого OVA323–339(белые круги) или тех же самых пептидов, связанных с PLG-наночастицами (заштрихованы). Температуру животных контролировали и регистрировали каждые 10 минут в течение 1 часа после инъекции (Фиг.5A).
Пример 4
Профилактическое лечение введением частиц PLP-PLG вызывало длительную антиген-специфическую толерантность
Оптимальную дозировку определяли путем внутривенного введения увеличивающихся концентраций PLP139–151-PLG за семь суток до индукции заболевания и отслеживали развитие клинической картины в сравнении с мышами SJL/J, получавшими OVA323–339-PLG (Фиг.6A). Самкам мышей SJL/J в возрасте шести - восьми недель внутривенно вводили PLG-наночастицы, связанные либо с PLP139–151 (квадраты), либо с OVA323–339 (круги). EAE индуцировали путем подкожной инъекции PLP139–151в CFA через 7 суток (Фиг.6B), 25 суток (Фиг.6C) или 50 суток (Фиг.6D). У животных из панели B отслеживали клинические признаки заболевания в течение 100 суток. На Фиг.6E показано, что на 8-е сутки после индукции заболевания у субпопуляции мышей с панели В проводили реакцию гиперчувствительности замедленного типа (DTH). Избранным типичным животным из панели B, праймированным при помощи PLP139–151/CFA (OVA323–339-PLG и PLP139–151-PLG), наносили на ухо в качестве раздражителя праймирующий эпитоп PLP139–151 и контрольный пептид OVA323–339. Через 24 ч определяли набухание уха в качестве показателя DTH, с вычитанием ответов, наблюдавшихся перед раздражением. На Фиг.6F показано, что самкам мышей SJL/J в возрасте шести - восьми недель вводили внутривенно PLG-наночастицы, связанные с PLP178–191(треугольник),OVA323–339(круг) илиPLP139–151(квадрат) или только несвязанные частицы (пустой круг) (F). EAE индуцировали через 7 суток после этого путем внутривенного введения PLP178–191 в CFA и отслеживали признаки заболевания в показанных временных точках.
Пример 5
Лечение рецидива экспериментального аутоиммунного энцефалита связанными с антигеном частицами
При разработке вариантов осуществления настоящего изобретения проводили эксперименты для исследования способности частиц PLG-PLP139–151лечить, а не предотвращать заболевание, а также для определения того, влияет ли способ введения на развитие заболевания. Мышей иммунизировали в 0-е сутки, используя PLP139–151 и адъювант. Обычно максимальный балл клинической оценки у мышей отмечался на 12–14-е сутки. В этой модели мыши получали на 10-е сутки частицы PLG-PLP139–151 или контрольные частицы PLG-OVA323–339,вводимые внутривенно, внутрибрюшинно, подкожно или перорально. Как показано на Фиг.7, профилактическая толерантность была наиболее эффективна при внутривенном или внутрибрюшинном введении частиц PLG-PLP139–151. У животных, получавших PLP139–151-PLG внутривенно, заболевание не развивалось, и в большинстве временных точек средний балл клинической оценки был равен 0. Эти животные отличались от животных, получавших частицы полистирола с PLP139–151, среди которых наблюдалась гибель от анафилактической реакции у >70% животных.
Пример 6
Толерантность, вызванная связанными с антигеном частицами, ингибирует индукцию антиген-специфических ответов клеток Th1 и Th17 при активном рецидиве экспериментального аутоиммунного энцефалита
Чтобы определить, ингибирует ли введение связанных с антигеном частиц индукцию хелперных Т-клеток, мышам BALB/c на -7-е сутки вводили внутривенно MOG35–55-PLG или OVA323–339-PLG. На 0-е сутки мышам подкожно вводили частицы OVA323–339-PLG и полный адъювант Фрейнда (CFA). На 10-е сутки животных повторно стимулировали либо частицами MOG35–55-PLG, либо частицами OVA323–339-PLG и выделяли клетки дренирующих лимфоузлов. На 10-е сутки измеряли CPM и уровни IL-17, GM-CSF, IFN-γ, IL-10 и IL-4. Как показано на Фиг.8, введение частиц OVA323–339-PLG ингибировало у получавших лечение животных ответы Th1 и Th17.
Пример 7
Толерантность индуцировали PLGA-частицами, связанными с PLP-139–151
Дополнительную терапевтическую стратегию толерантности осуществляли путем введения мышам PLP139–151-PLG или OVA323–339-PLG. Гистологический анализ показал, что введение частиц PLP139–151-PLG ингибирует воспаление и демиелинизацию шейного отдела спинного мозга. Мышам вводили PLP-PLG или OVA323–339-PLG и ткань отбирали на 40-е сутки. Выделяли шейный отдел спинного мозга и делали срезы для исследования иммунного ответа в ЦНС, который лежит в основе патологии R-EAE и рассеянного склероза. На Фиг.9 показано снижение инфильтрации иммунных клеток в спинной мозг у животных, получавших PLP139–151-PLG, которая была более сходна с нормальной тканью, чем с тканью животных, получавших OVA323–339-PLG. У животных, получавших OVA323–339-PLG, наблюдалось положительное окрашивание на CD45, CD4 и CD11b; тогда как у животных, получавших PLP139–151-PLG, окрашивание на эти факторы было минимальным.
Введение частиц PLP139–151-PLG также уменьшает нарушение гематоэнцефалического барьера (ГЭБ) и активацию макрофагов в спинном мозге получавших лечение мышей. Животные получали полный адъювант Фрейнда (CFA), частицы OVA323–339-PLG или частицы PLP139–151-PLG. Определяли баллы клинической оценки и процентную долю возникновения EAE (Фиг.10B), а спинной мозг контролировали посредством метода визуализации in vivo (Фиг.10A и 11). Система Angiosense измеряет сосудистую утечку в ЦНС, а система Prosense измеряет активированные макрофаги (активация катепсина приводит к расщеплению репортера, дающего флуоресцентный сигнал). На гистограммах силе сигналов, наблюдаемых на изображениях головного и спинного мозга, присвоены числовые значения.
Толерантность также можно индуцировать частицами с инкапсулированным антигеном. На Фиг.12 показано, что введение PLG-частиц с инкапсулированным в них пептидом PLP139–151 ингибировало индукцию R-EAE у мышей. Возможность инкапсуляции аутоантигенов предусматривает использование сложных смесей белков или даже гомогенатов органов и позволяет обеспечить большее покрытие антигеном и, таким образом, более эффективное распределение эпитопов.
Пример 8
Толерантность, индуцированная PLGA-частицами, связанными с PLP-139–151, частично зависит от экспансии/активации регуляторных Т-клеток
Мышам SJL/J на -9-е сутки вводили антитела к CD25, обычный маркер регуляторных T-клеток (Treg), а затем на -7-е сутки вводили либо частицы OVA323–339-PLG и антитело к CD25, либо частицы OVA323–339-PLG и контрольное антитело IgG, частицы PLP139–151-PLG и антитело к CD25, или частицы PLP139–151-PLG и контрольное антитело IgG. Как показано на Фиг.13, животные, получавшие частицы PLP139–151-PLG и антитело к CD25, демонстрировали временами больший средний балл клинической оценки, чем животные, получавшие частицы PLP139–151-PLG и контрольное антитело IgG. Это подтверждает, что клетки Treg, или по меньшей мере Т-клетки, экспрессирующие CD25, участвуют в индукции толерантности.
Пример 9
Терапевтическая толерантность индуцируется частицами PLP139–151-PLG, при активном и адоптивном EAE
Сравнивали терапевтическую толерантность, индуцированную частицами PLP139–151-PLG, при активном и адоптивном EAE. Адоптивный EAE индуцировали у самок мышей SJL/J возрастом шесть-восемь недель путем адоптивного переноса 2,5 x 106 бластных клеток, активированных при помощи PLP139–151. Мыши получали внутривенно пептид PLP139–151(квадраты) или OVA323–339(круги), связанный с PLG-наночастицами размером 500 нм, через 2 суток (Фиг.14A), 14 суток (Фиг.14C), 18 суток (Фиг.14E) или 21 сутки (Фиг.14F) после индукции заболевания. Балльную клиническую оценку заболевания определяли в сравнении с оценкой после обработки спленоцитами, связанными с антигеном (Фиг.14A). У мышей с толерантностью, вызванной PLP139–151 или OVA323–339, на 42-е сутки отбирали головной и спинной мозг для гистологического анализа. Срезы, взятые у мышей из панели A, окрашивали на белок PLP и на CD45 (Фиг.14B). Срезы спинного мозга, взятые у мышей из панели C, окрашивали красителем Luxol Fast Blue (Фиг.14D). Зоны демиелинизации и инфильтрации клеток показаны стрелками. Результаты показывают, что толерантность индуцируется частицами PLP139–151-PLG у мышей с адоптивным EAE.
На Фиг.15 представлены графики, показывающие средние баллы клинической оценки у мышей с активным EAE и адоптивным EAE после лечения спленоцитами (SP) или PLG-частицами, конъюгированными с OVA323–339 или PLP139–151. Мыши получали внутривенно PLP139–151-SP, PLP139–151-PLG, или OVA323–339-SP, или OVA323–339-PLG,причем пептид был связан с наночастицами размером 500 нм, через 10 суток (Фиг.15A) или через 2 суток (Фиг.15B) после индукции заболевания, и определяли средний балл клинической оценки. В обоих случаях частицы PLP139–151-PLG ослабляли заболевание, что указывает на индукцию толерантности.
Инфильтрация клеток в центральную нервную систему также существенно снижалась у мышей с толерантностью, вызванной PLP-PLG. SJL/J-мышам внутривенно вводили PLG-наночастицы размером 500 нм, связанные с PLP139–151 (квадраты) или OVA323–339(круги), через 2 суток после индукции EAE методом адоптивного переноса. На пике заболевания (14-е сутки) забирали головной и спинной мозг и методом проточной цитометрии определяли количество лимфоцитов (Фиг.16B), антигенпредставляющих клеток (АПК) (Фиг.16C), микроглии (Фиг.16D), периферических дендритных клеток (Фиг.16E), миелоидных дендритных клеток (Фиг.16F) и макрофагов (Фиг.16G). Стратегия дискриминации этих популяций показана на Фиг.16A. Препараты клеток ЦНС стимулировали PMA и иономицином за 5 ч перед внутриклеточным окрашиванием на IL-17A и IFN-γ (Фиг.16H).
Пример 10
Введение моноклонального антитела к PD-1 нарушает индукцию толерантности PLG-наночастицами, инкапсулирующими PLP139–151, при EAE с адоптивным переносом
Чтобы проверить влияние введения антитела к PD-1 на индуцированную PLP139–151 толерантность у мышей с адоптивным EAE, на 0-е сутки мышам посредством внутривенного введения вводили 3 x 106 активированных PLP139–151 T-клеточных бластов. На 2-е сутки они получали внутривенно PLP139–151 или OVA323–339, инкапсулированный в PLG-частицы либо с PBS, либо с антителом к PD-1. На 4, 6, 8, 10 и 12-е сутки все животные получали либо 250 мкг антитела к PD-1, либо PBS.
Как показано на Фиг.17, введение пептида PLP139–151, инкапсулированного в PLG-частицу, индуцировало толерантность при введении частицы с PBS. Однако введение антитела к PD-1 уменьшает эту толерантность.
Пример 11
Введение агонистического моноклонального антитела к CD40 нарушает индукцию толерантности PLG-наночастицами, инкапсулирующими PLP139–151, при EAE с адоптивным переносом, зависимым от IL-12 способом
Чтобы проверить влияние введения агонистического антитела к CD40 на индуцированную PLP139–151 толерантность у мышей с адоптивным EAE, на 0-е сутки мышам посредством внутривенного введения вводили 3 x 106 активированных PLP139–151 T-клеточных бластов. На 2-е сутки мыши посредством внутривенного введения получали пептид PLP139–151 или OVA323–339, инкапсулированный в PLG-частицы. На 3-и сутки животные получали контрольное антитело IgG2a, антитело к CD40 или антитело к CD40 и антитело к IL-12.
На Фиг.18 показано, что введение пептида PLP139–151, инкапсулированного в PLG-частицу, индуцирует толерантность при введении частицы с PBS. Введение агонистического антитела к CD40 уменьшало эту толерантность, но уменьшение толерантности обращалось при добавлении антитела к IL-12.
Пример 12
Пептид OVA, инкапсулированный в PLG-частицы, при профилактическом введении ингибирует аллергическое воспаление дыхательных путей и OVA-специфические Th2-ответы in vivo
Для оценки профилактического эффекта OVA, инкапсулированного в PLG-частицы, на воспаление дыхательных путей мышам внутривенно вводили OVA-PLG на -7-е сутки. На 0-е сутки мыши получали внутрибрюшинные инъекции OVA/Alum в дозе 10 мкг/мышь. На 7-е сутки мышам снова внутривенно вводили OVA-PLG, а на 14е сутки вводили еще одну внебрюшинную инъекцию 10 мкг/мышь OVA/Alum. В период с 28-х по 30-е сутки мышам трижды вводили аэрозольный OVA.
Как показано на Фиг.19, профилактическое введение OVA-PLG уменьшало секрецию IL-4, IL-5, IL-13 и IL-10 и снижало уровни сывороточного OVA IgE и эозинофилов в легком.
Пептид OVA, инкапсулированный в PLG-частицы, при профилактическом введении ингибирует OVA-специфический вторичный иммунный ответ in vitro в медиастинальных лимфоузлах. Как показано на Фиг.20А, пролиферация в лимфоузлах, наблюдавшаяся после повторной стимуляции 25 мкг OVA, снижается у животных, получавших OVA-PLG. Более того, введение OVA-PLG снижает выброс цитокинов после повторной стимуляции OVA. На Фиг.20B показано, что уровни IL-4, IL-5, IL-13 и IL-10 снижаются у мышей, получавших OVA-PLG.
Пример 13
Пептид OVA, инкапсулированный в PLG-частицы, при терапевтическом введении ингибирует аллергическое воспаление дыхательных путей и OVA-специфические Th2-ответы in vivo
Для оценки терапевтического эффекта OVA, инкапсулированного в PLG-частицы, на воспаление дыхательных путей мышам внутрибрюшинно вводили OVA/Alum в дозе 10 мкг/мышь на 0-е сутки и на 14-е сутки. Мышам внутривенно вводили OVA-PLG на 28-е и 42-е сутки. В период с 56-х по 58-е сутки мышам трижды вводили аэрозольный OVA.
Как показано на Фиг.21, терапевтическое введение OVA-PLG уменьшало секрецию IL-4, IL-5, IL-13 и IL-10 и снижало уровни сывороточного OVA IgE и эозинофилов в легком.
На Фиг.22 показано, что пептид OVA, инкапсулированный в PLG-частицы, при терапевтическом введении снижает уровень OVA-специфических Th2-цитокинов в BAL лучше, чем PLG-частицы, связанные с OVA. Животные получали лечение, как описано выше, за исключением того, что на 28-е и 42-е сутки мышам вводили либо OVA, инкапсулированный в PLG-частицы, либо OVA, связанный с PLG-частицами. Неожиданно было обнаружено, что инкапсулированный пептид OVA ингибировал секрецию цитокинов Th2 больше, чем пептид OVA, связанный с поверхностью PLG-частицы.
Пример 14
Толерантность, индуцированная PLG-частицами с пептидом p31 хромогранина A, ингибирует диабет I типа
Диабет I типа индуцировали у мышей BDC2.5, выделяя клетки из селезенки, подмышечных, плечевых, паховых и панкреатических лимфоузлов у мышей возрастом 3 недели. Выделенные клетки культивировали и активировали in vitro путем инкубации 2 x 106 клеток/мл с 0,5 мкM пептида p31 в течение 96 часов. 5 x 106 клеток трансфицировали путем внутривенного введения мышам NOD.SCID (6–8 недель) в момент времени 0. Толерантность у мышей индуцировали путем внутривенного введения пептида p31 или MOG35–55, связанного с SP или PLG, по истечении периода времени от 2 часов до 3 суток.
На Фиг.23A и 23B показаны уровни глюкозы в крови животных после лечения. Введение частиц PLG, связанных с пептидом p31, приводило к снижению уровня глюкозы в крови по сравнению с уровнем, наблюдавшимся при введении частиц, связанных с пептидом MOG35–55. На Фиг.23С показано, что наблюдавшаяся у животных процентная доля клеток, секретирующих IFNγ, также снижалась у мышей, получавших p31-PLG, по сравнению с мышами, получавшими частицы MOG35–55-PLG.
Для индуцируемой p31-PLG толерантности необходимы клетки Treg. Диабет I типа индуцировали у мышей, как описано выше, а через 2 часа после переноса активированных клеток мышам NOD.SCID у мышей вызывали толерантность либо частицами p31-PLG, либо частицами MOG35–55-PLG. Как показано на Фиг.24, уменьшение численности клеток Treg нарушало толерантность, вызванную введением частиц p31-PLG.
Пример 15
Толерантность, вызванная PLG-частицами, связанными с инсулином, ингибирует развитие спонтанного диабета I типа у мышей NOD
NOD-мышам в возрасте 6, 8 и 10 недель посредством внутривенного введения вводили PLG-частицы, связанные либо с BSA (N=22), либо с инсулином (N=23). Затем у мышей оценивали развитие диабета, который определяли как уровень глюкозы в крови>250 мг/дл. Как показано на Фиг.25, введение связанных с инсулином PLG-частиц существенно увеличивало долю мышей, у которых диабет не развивался в течение более чем 300 суток (69,6% по сравнению с 22,7%; p=0,0027).
Пример 16
Кинетика приживления
У самок мышей CD45.2 индуцировали толерантность, используя либо OVA-PLG, либо контрольный пептид Dby-PLG (основной антиген H-Y, экспрессирующийся у самцов мышей C57BL/6) на -7-е сутки. На -1-е сутки мыши получали дозу облучения 200 рад, а затем им трансплантировали 1 x 106, 5 x 106 или 1 x 107 клеток костного мозга самцов мышей CD45.1 на 0-е сутки. Толерантность у мышей-реципиентов вызывали при помощи OVA-PLG, Dby-SP или Dby-PLG на 1-е сутки и отбирали кровь для анализа химеризма методом FACS. На Фиг.26 показана процентная доля донорских клеток CD45.1, наблюдавшаяся у мыши-реципиента.
На Фиг.27 показана процентная доля донорских клеток CD45.1 у мышей-реципиентов после вызова толерантности при помощи OVA-PLG, Dby-SP или Dby-PLG на 1-е сутки. У одной мыши из группы положительного контроля не наблюдали значимого приживления (~ 10%). Ни у одной мыши отрицательного контроля не наблюдали приживленных донорских клеток. У одной мыши из группы Dby-SP не наблюдали значимого приживления (~ 10%). У двух мышей OVA-PLG донорские клетки прижились (~ 10%): у одной произошло полное отторжение к 16-й неделе. У одной мыши Dby-PLG отторжение началось на 12-й неделе и к 16-й неделе дошло до 10%. У группы Dby-PLG приживление находилось в диапазоне 10–56% к 16-й неделе. У мышей OVA-PLG наблюдали: 1) спонтанное приживление, 2) гомологию последовательности между OVA323 и Dby, или 3) толерогенные свойства частиц. Частицы Dby-PLG обеспечивали большее приживление, чем Dby-SP и OVA-PLG.
На Фиг.28 показано, что время вызова толерантности влияет на процентную долю клеток CD45.1 у мыши-реципиента. В группе положительного контроля наблюдали меньшее приживление (~ 4%), чем ожидалось (~ 10%). Одна мышь из группы отрицательного контроля имела 5% приживление. Из всех 3 групп OVA-PLG приживление демонстрировала одна мышь в группе -7-е сутки,+1-е сутки (12%). Толерантность на 1-е сутки имеет большую клиническую значимость, чем толерантность на -7-е сутки.
Пример 17
Окрашенные кумарином-6 PLGA-частицы не отслеживаются через 24 часа после введения
Мышам вводили окрашенные кумарином-6 PLGA-частицы, которые имели или не имели связанного антигена. Как показано на Фиг.29, частицы отслеживали через 3 часа после введения, но не через 24 часа после введения. Срезы селезенки (левый столбец), печени (средний столбец) и легкого (правый столбец) от интактных мышей без инъекций (верхний ряд) и от мышей, получавших внутривенно флуоресцентные микрочастицы PLGA/PEMA, взятые через 3 ч после инъекции (средний ряд) и через 24 ч после инъекции (нижний ряд), с контрастным окрашиванием DAPI.
Пример 18
Наночастицы ассоциируются in vivo с макрофагами
Анализ печени через 6 часов и 15 часов после введения показывает, что PLGA-частицы колокализованы с клетками F4/80+в печени (Фиг.30).
Макрофаги краевой зоны преимущественно захватывают меченные TAMRA частицы, связанные с PLP139–151, через 24 часа после внутривенной инфузии. Как показано на Фиг.31, наибольшая процентная доля клеток PLP139–151+представляет собой макрофаги краевой зоны.
Пример 19
Ингибирование R-EAE у мышей SJL/J с использованием поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый PLP139–151
Группам мышей SJL/J вводили внутривенно 2,5 мг поверхностно-функционализированных частиц сополимера лактида и гликолида размером 500–700 нм, содержащих в ядрах растворимый пептид PLP139–151, на -7-е сутки и 1е сутки относительно праймирования при помощи PLP139–151/CFA на 0-е сутки. Контрольных мышей праймировали на 0-е сутки, но они не получали частицы на 7е сутки или -1-е сутки. У мышей отслеживали клинические признаки R-EAE в течение дополнительных 20 суток.
Результаты, представленные на Фиг.32, показывают зависимость ежедневного среднего балла клинической оценки от количества суток после праймирования PLP139–151/CFA. R-EAE, индуцированный PLP139–151/CFA, ингибируется у мышей SJL/J путем индукции иммунологической толерантности с помощью поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своем ядре растворимый PLP139–151.
Пример 20
Ингибирование аллергического воспаления дыхательных путей при помощи поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих растворимый овальбумин
У мышей индуцировали аллергическое воспаление дыхательных путей (AIA). Группам мышей Balb/c вводили внутривенно 2,5 мг поверхностно-функционализированных частиц сополимера лактида и гликолида размером 500–700 нм, содержащих в ядрах растворимый овальбумин или растворимый бычий сывороточный альбумин (контроль), на -7-е сутки и+7-е сутки относительно праймирования при помощи овальбумина/alum на 0-е сутки и+14-е сутки. У мышей проводили раздражение аэрозольным овальбумином на+28–30-е сутки. Затем мышей усыпляли и собирали жидкость бронхоальвеолярного лаважа. Также измеряли уровни овальбумин-специфических IgE в сыворотке.
Количество эозинофилов в бронхоальвеолярном лаваже указывает на тяжесть AAI - чем больше количество, тем тяжелее заболевание. Уровни IgE в сыворотке указывают на тяжесть AAI - чем выше уровни, тем тяжелее заболевание.
На Фиг.33 показано, что мыши, получавшие инкапсулированный OVA-PLG, демонстрировали наибольшее снижение накопления эозинофилов. На Фиг.34 показано, что мыши, получавшие инкапсулированный OVA-PLG, демонстрировали наибольшее снижение уровня IgE в сыворотке по сравнению с не получавшими лечение или контрольными получавшими лечение животными.
Индуцированное комбинацией овальбумин/alum аллергическое воспаление дыхательных путей у мышей Balb/c ингибировали путем индукции иммунологической толерантности с помощью поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый овальбумин.
Пример 21
Синтез поверхностно-функционализированных частиц сополимера лактида и гликолида с инкапсулированным антигеном
В настоящем примере подробно описан состав и частично охарактеризованы биоразлагаемые частицы сополимера лактида и гликолида, которые были поверхностно-функционализированы при помощи высокой плотности карбоксильных групп и которые содержат в своих ядрах растворимый антиген, причем ядра окружены оболочкой из сополимера лактида и гликолида, причем частицы применяют для индукции толерантности при аутоиммунных заболеваниях и для лечения аллергий.
Высокая плотность карбоксильных групп достигалась в результате использования поли(этилен-альт-малеинового ангидрида) (PEMA), полимера с карбоксильными группами, встроенными в основную цепь, в качестве поверхностно-активного вещества для процесса эмульгирования.
Как описано выше, биоразлагаемые частицы сополимера лактида и гликолида, содержащие в своих ядрах растворимый PLP139–151 и поверхностно-функционализированные высокой плотностью карбоксильных групп, эффективно индуцируют иммунологическую толерантность у мышей SJL/J с R-EAE, индуцированным PLP139–151/CFA, мышиной модели рассеянного склероза. Кроме этого, биоразлагаемые частицы сополимера лактида и гликолида, содержащие в своих ядрах растворимый овальбумин и поверхностно-функционализированные высокой плотностью карбоксильных групп, эффективно индуцируют иммунологическую толерантность у мышей Balb/c с AAI, индуцированным сочетанием овальбумин/Alum, мышиной модели аллергической астмы.
Частицы сополимера лактида и гликолида, содержащие в своих ядрах растворимый овальбумин или бычий сывороточный альбумин, поверхностно-функционализированные высокой плотностью карбоксильных групп, синтезировали методом «двойная эмульсия - выпаривание растворителя» следующим образом.
1. 150 мкл раствора 200 мг/мл овальбумина или бычьего сывороточного альбумина в очищенной от эндотоксинов воде добавляли по каплям к 2 мл 20% вес./об. раствора сополимера лактида и гликолида в дихлорметане в сцинтилляционном флаконе объемом 20 мл.
2. Полученную смесь помещали на лед и обрабатывали ультразвуком в течение 30 секунд при мощности 10 Вт с использованием соникатора с зондом.
3. Добавляли 10 мл 1% вес./об. раствора поли(этилен-альт-малеинового ангидрида) в воде.
4. Полученную смесь помещали на лед и обрабатывали ультразвуком в течение 30 секунд при мощности 16 Вт с использованием соникатора с зондом.
5. Полученную эмульсию выливали в 200 мл 0,5% вес./об. раствора поли(этилен-альт-малеинового ангидрида) в лабораторном стакане объемом 600 мл и перемешивали в течение ночи, чтобы частицы затвердели.
6. Отвержденные частицы очищали центрифугированием и 3 раза промывали бикарбонатным буфером pH 9,6.
7. Очищенные частицы повторно суспендировали в растворе, содержащем 4% вес./об. сахарозы и 3% вес./об. D-маннита в воде, быстро замораживали жидким азотом и лиофилизировали досуха.
На Фиг.35 показана характеризация поверхностно-функционализированных частиц, содержащих в своих ядрах растворимый PLP139–151, сополимера лактида и гликолида посредством анализа динамического светорассеяния. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 1,792 x 105 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела Z-средний диаметр 584 нм, максимальный диаметр 679 нм и коэффициент полидисперсности 0,162. Эти результаты являются типичными для 6 партий частиц, синтезированных в соответствии с описанным выше протоколом.
На Фиг.36 показана характеризация поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый PLP139–151, посредством измерения ζ-потенциала. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 6,67 x 104 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела максимальный ζ-потенциал -48,9 мВ и ζ-отклонение 5,14 мВ. Эти результаты являются типичными для 6 партий частиц, синтезированных в соответствии с описанным выше протоколом.
На Фиг.37 показана характеризация поверхностно-функционализированных частиц, содержащих в своих ядрах растворимый овальбумин, сополимера лактида и гликолида посредством анализа динамического светорассеяния. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 1,822 x 105 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела Z-средний диаметр 569,7 нм, максимальный диаметр 700,3 нм и коэффициент полидисперсности 0,230. Эти результаты являются типичными для 3 партий частиц, синтезированных в соответствии с описанным выше протоколом.
На Фиг.38 показана характеризация поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый овальбумин, посредством измерения ζ-потенциала. Поверхностно-функционализированные частицы сополимера лактида и гликолида анализировали на приборе Malvern Zetasizer Nano ZS (Malvern Instruments, г.Уэстборо, штат Массачусетс) со скоростью счета 2,67 x 104 импульсов в секунду в воде 18,2 MОм. Популяция поверхностно-функционализированных частиц сополимера лактида и гликолида имела максимальный ζ-потенциал -52,2 мВ и ζ-отклонение 5,38 мВ. Эти результаты являются типичными для 3 партий частиц, синтезированных в соответствии с описанным выше протоколом.
Пример 22
Поверхностно-функционализированные липосомы, содержащие внутри своих ядер растворимый PLP139–151, индуцируют иммунологическую толерантность в мышиной модели рассеянного склероза
Авторы настоящего изобретения также обнаружили, что биоразлагаемые липосомальные средства доставки, поверхностно-функционализированные высокой плотностью отрицательно заряженных групп и содержащие в своих ядрах растворимый антиген, индуцируют иммунологическую толерантность при R-EAE, мышиной модели рассеянного склероза.
Липосомы, использованные в исследовании, состояли из следующих липидов в следующих молярных соотношениях - 30: 30: 40 фосфатидилхолин: фосфатидилглицерин: холестерин. Группам мышей SJL/J внутривенно вводили поверхностно-функционализированные липосомы размером 200 нм (10 мкмоль общего липида на мышь), содержащие в своих ядрах растворимый пептид PLP139–151, на -7-е сутки относительно праймирования PLP139–151/CFA на 0-е сутки. Контрольных мышей праймировали на 0-е сутки, на -7-е сутки вводили им поверхностно-функционализированные липосомы размером 500–700 нм (10 мкмоль общего липида на мышь), содержащие в своих ядрах растворимый пептид OVA323–339. У мышей отслеживали клинические признаки R-EAE в течение дополнительных 17 суток.
В результатах показана зависимость ежедневного среднего балла клинической оценки от количества суток после праймирования PLP139–151/CFA. Как показано на Фиг.39, животные, получавшие поверхностно-функционализированные липосомы, содержащие в своих ядрах растворимый пептид PLP139–151, имели более низкий балл клинической оценки, чем животные, получавшие поверхностно-функционализированные липосомы, содержащие растворимый пептид OVA323–339.
Результаты исследования показывают, что биоразлагаемые липосомы, содержащие в своих ядрах PLP139–151 и поверхностно-функционализированные высокой плотностью отрицательно заряженных групп, эффективно индуцируют иммунологическую толерантность у мышей SJL/J с R-EAE, индуцированным PLP139–151/CFA, мышиной моделью рассеянного склероза.
Толерантность, индуцированная частицами, связанными с антигеном или инкапсулирующими антиген, является антиген-специфической, дозозависимой и долгосрочной (>150 суток). Толерантность лучше всего индуцируется внутривенным введением связанной с антигеном частицы диаметром от 500 нм до 1 мкм с дзета-потенциалом <-5 мВ. Индукция толерантности зависит от захвата частиц фагоцитарным рецептором MARCO, который «видит» полианионные поверхности (например, карбоксилированные частицы PS/PLG). Толерантность индуцируется и поддерживается посредством комбинации анергии (частично обращается антителами к PD-1 и агонистическими антителами к CD40) и iTreg (частично обращается антителами к CD25). Частицы изобретения накапливаются преимущественно в печени и макрофагах краевой зоны (CD11bhi CD11clo MARCO+Sign-R1+Siglec-1-).
Существует множество преимуществ использования связанных с антигеном частиц для лечения аутоиммунных заболеваний по сравнению с использованием возбужденных или направленных антигеном незрелых толерогенных дендритных клеток или полученных инженерными методами антиген-специфических Treg-клеток. Быстрота и простота получения и индукции толерогена с использованием готового универсального толерогенного носителя, пригодного для производства в соответствии с надлежащей производственной практикой (GMP); не нужно выделять и размножать незрелые дендритные клетки или Treg-клетки ex vivo; не нужно беспокоиться, что незрелые дендритные клетки активируются при манипуляциях ex vivo и превратятся в стимуляторные, а не толерогенные, или о превращении клеток Treg в Th1/17 после переноса; поскольку незрелые АПК краевой зоны хозяина обрабатывают и представляют антиген толерогенным способом, АПК хозяина могут отбирать нужные иммунодоминантные аутоэпитопы из PLG-частиц, инкапсулирующих интактные аутоантигены или тканевые экстракты (например, OVA, инкапсулированные в PLG-частицы, предотвращают AAD, индуцированный OVA/Alum); и протокол является антиген-специфическим, без подавления посторонним агентом, безопасным, высокоэффективным и может индуцировать иммунологическую толерантность как у эффекторных Т-клеток (Th1, Th2, Th17 и CD8), так и у интактных Т-клеток, вовлеченных в распространение эпитопа.
Синтетические биоразлагаемые частицы и липосомы могут обеспечить простоту производства, широкую доступность терапевтических агентов и увеличение числа возможных участков лечения. С этой целью специально разработаны поверхностно-функционализированные биоразлагаемые частицы сополимера лактида и гликолида с высокой плотностью поверхностных карбоксильных групп с использованием поверхностно-активного вещества поли(этилен-альт-малеинового ангидрида).
Также разработаны поверхностно-функционализированные липосомы с использованием фосфатидилхолина: фосфатидилглицерина: холестерина в соотношении 30: 30: 40.
Дополнительно разработаны такие частицы, содержащие в своих ядрах растворимый овальбумин, чтобы преодолеть проблемы, связанные с химическим загрязнением и чистотой, которые могут возникать при поверхностном конъюгировании пептида или белка. Эти поверхностно-функционализированные частицы сополимера лактида и гликолида, содержащие в своих ядрах растворимый овальбумин, эффективно предотвращают развитие заболевания и, следовательно, индуцируют иммунологическую толерантность в AAI, индуцированном у мышей Balb/c сочетанием овальбумин/Alum, мышиной модели аллергической астмы. Пептид или белок, конъюгированный с функционализированными при помощи карбоксильных групп частицами сополимера лактида и гликолида с использованием EDC, прикрепляется беспорядочным образом, в результате чего образуются агрегаты антигена и агрегаты частица - антиген - частица, которые трудно охарактеризовывать и очищать для получения гомогенных популяций.
Получена гомогенная популяция поверхностно-функционализированных частиц сополимера лактида и гликолида, содержащих в своих ядрах растворимый овальбумин, которые не требуют поверхностной конъюгации с антигеном.
Дополнительно показано, что биоразлагаемые липосомы, содержащие в своих ядрах PLP139–151 и поверхностно-функционализированные высокой плотностью отрицательно заряженных групп, эффективно индуцируют иммунологическую толерантность у мышей SJL/J с R-EAE, индуцированным PLP139–151/CFA, мышиной моделью рассеянного склероза.
Липосомы и частицы сополимера лактида и гликолида настоящего изобретения имеют много преимуществ. Преимущества заключаются в следующем.
1) Биоразлагаемые частицы не присутствуют длительное время в теле, а время полного разложения можно контролировать.
2) Частицы и липосомы можно функционализировать для облегчения интернализации без активации клеток. Для этой цели в микросферы PLG был введен фосфатидилсерин.
3) Частицы и липосомы также можно выполнить так, чтобы они включали лиганды, нацеливающие на конкретную популяцию клеток.
4) Также можно включить в них противовоспалительные цитокины, такие как IL-10 и TGF-β, чтобы ограничить активацию типа клеток, интернализировавшего частицы, и облегчить индукцию толерантности посредством анергии и/или уничтожения, а также активацию регуляторных Т-клеток.
Такая комбинированная функция частицы или липосомы может обеспечить многосторонний подход к индукции толерантности, так что конфигурация частиц является существенным продвижением по сравнению с частицами полистирола. Потенциальные клинические сферы применения данной технологии индукции толерантности включают в себя:
(1) аутоиммунные заболевания, опосредованные T-клетками и антителами (такие как рассеянный склероз, диабет I типа, ревматоидный артрит, системная волчанка и т.п.), - толерантность можно индуцировать частицами в комплексе со значимыми аутоантигенами, лежащими в основе конкретного аутоиммунного заболевания;
(2) пищевые и легочные аллергии, кожные аллергии и астма - толерантность можно индуцировать частицами в комплексе с конкретными пищевыми (например, белками арахиса и т.п.), впрыскиваемыми (белки пчелиного яда и т.п.) или вдыхаемыми веществами (например, белками пыльцы амброзии, белками, содержащимися в клетках кожи домашних животных, и т.п.), которые вызывают аллергическую реакцию;
(3) отторжение трансплантата - можно индуцировать толерантность к антигенам трансплантата на донорских органах или клетках перед трансплантацией для предотвращения отторжения трансплантата реципиентом;
(4) ферментозаместительная терапия - можно индуцировать толерантность к ферментам, которые не продуцируются у пациентов с генетической недостаточностью, чтобы предотвратить образование нейтрализующих антител к рекомбинантным ферментам, вводимым для лечения конкретной недостаточности.
Пример 23
Частицы, наиболее эффективно индуцирующие толерантность, имеют отрицательный заряд и средний диаметр 500 нм
Основными параметрами частицы с точки зрения индукции толерантности являются размер и заряд композиции. Как показано на Фиг.40A и B, заряд частицы влияет на эффективность индукции толерантности. Сравнение мышей с EAE, получавших конъюгированные с OVA частицы с зарядом -25 мВ или -60 мВ, показало, что композиции, содержащие частицы с зарядом -60 мВ, индуцируют толерантность более эффективно, чем частицы с зарядом -25 мВ. Мышам вводили TIMP (толерогенные иммуномодифицирующие частицы) с зарядом -60 мВ или -25 мВ. Мышам вводили OVA323–339-TIMP-60 мв, OVA323–339-PLGA-25 мв, PLP139–151-TIMP-60 мв или PLP139–151-PLGA-25 мв (все антигены являются инкапсулированными) и определяли балльную клиническую оценку. Панель (A) показывает средний балл клинической оценки, а панель (B) показывает средний суммарный балл у животных с EAE.
Отрицательный заряд частицы влияет на способность частицы взаимодействовать с фагоцитарным рецептором MARCO. На Фиг.41 показано, что заряд иммуномодифицирующей частицы важен для направления иммуномодифицирующей частицы к антигенпредставляющей клетке. Животным дикого типа или животным MARCO -/+вводили либо PS-IMP, либо носитель. Результаты показывают, что частицы со сниженным отрицательным зарядом имеют меньшую эффективность из-за меньшего взаимодействия с фагоцитарными рецепторами, такими как MARCO, которые имеют положительно заряженные коллагенподобные домены.
Помимо заряда на индукцию толерантности влияет размер и композиция биоразлагаемых TIMP. Как показано на Фиг.42A, наиболее эффективными для индукции толерантности в модели ЕАЕ были частицы со средним диаметром около 500 нм. Мышам вводили 500 нм частицы OVA323–339-PSB, 100 нм частицы PLP139–151-PSB, 500 нм частицы PLP139–151-PSB, 1,75 мкм частицы PLP139–151-PSB или 4,5 мкм частицы PLP139–151-PSB и определяли балльную клиническую оценку заболевания. Носители PLGA имели медленную кинетику высвобождения в течение 1 месяца, и изменение соотношения полимеров может влиять на высвобождение частиц. Для индукции толерантности необходимы быстрый захват частиц и быстрый клиренс/разложение. Поскольку соотношение лактид: гликолид свыше 50: 50 уменьшает скорость разложения, в частицах изобретения в одном варианте осуществления соотношение лактид: гликолид составляет 50: 50. На Фиг.42B показано, что частицы быстро разрушаются.
Помимо заряда и среднего диаметра TIMP инкапсулирование антигенов внутрь частицы является более эффективным в модели аллергии, чем связывание частиц с антигеном. В модели аллергии у связанных с антигеном частиц имелась предрасположенность к индукции анафилактической реакции, и они не являлись эффективным средством терапии. Напротив, как показано на Фиг.43, TIMP с зарядом 60 мВ являются терапевтически эффективными в мышиной модели аллергии. Животных подвергали воздействию OVA в качестве аллергена и затем воздействовали пустыми PLG- или TIMP-частицами, PLG- или TIMP-частицами с OVA, или не вводили ничего. На панели (A) показано, что частицы OVA-PLG не уменьшают TH2-ответ при аллергии. На панели (B) показано, что TIMPPEMA-60 мВ ингибируют TH2-ответ.На панели (C) показано, что TIMPPEMA-60 мВ ингибируют вторичные иммунные ответы.
Пример 24
Одноэмульсионный синтез поверхностно-функционализированных частиц сополимера лактида и гликолида с инкапсулированным антигеном
Полипептидные антигены можно встраивать в частицы сополимера лактида и гликолида с использованием двойного эмульсионного процесса (см. пример 21), однако авторы настоящего изобретения обнаружили, что при встраивании более гидрофобных частиц, таких как глиадин, лучше встраивать антиген в частицу при помощи одноэмульсионного процесса с использованием растворителей.
Для создания частиц, содержащих глиадин, использовали сополимер лактида и гликолида с карбоксильными концевыми группами, соотношением D,L-лактид: гликолид 50: 50 и удельной вязкостью 0,18 дл/г в гексафтор-2-пропаноле. Частицы сополимера лактида и гликолида, содержащие в своих ядрах глиадин, поверхностно-функционализированные высокой плотностью карбоксильных групп, синтезировали методом «одинарная эмульсия - выпаривание растворителя» следующим образом.
1. Пять миллиграмм глиадина и 200 мг PLG растворяли в 50 мкл трифторуксусной кислоты (TFA) и 700 мкл диметилсульфоксида и 1250 мкл дихлорметана (ДХМ).
2. Полученную смесь по каплям добавляли в 4 мл 1% вес./об. водного раствора PEMA и обрабатывали ультразвуком в течение 30 с при амплитуде 100%.
3. Полученную эмульсию выливали в 200 мл 0,5% вес./об. водного раствора PEMA и перемешивали в течение 12 часов для полного испарения ДХМ.
4. Затем частицы трижды промывали в 0,1 M буфере карбоната натрия/бикарбоната натрия, pH 9,6. Альтернативно для промывки частиц можно использовать дважды дистиллированную H2O.
5. Очищенные частицы повторно суспендировали в растворе, содержащем 4% вес./об. сахарозы и 3% вес./об. D-маннита в воде, быстро замораживали до -80°C и лиофилизировали досуха.
Хотя в настоящем документе описаны и проиллюстрированы конкретные варианты осуществления изобретения, такие варианты осуществления следует рассматривать только как иллюстрирующие изобретение, но не как ограничивающие изобретение в соответствии с прилагаемой формулой изобретения.
Все патенты, заявки и другие публикации, процитированные в настоящем документе, полностью включены в него путем ссылки.
Реферат
Данное изобретение относится к медицине. Предложены композиции биоразлагаемых частиц, содержащих эффективное количество глиадина или одного или более антигенных эпитопов глиадина, инкапсулированных внутри ядра частицы, причем частица имеет отрицательный дзета-потенциал от -30 мВ до -80 мВ, и при этом диаметр упомянутой частицы составляет от 200 до 2000 нанометров. Также предложены способы лечения целиакии посредством введения нуждающемуся в этом субъекту упомянутых композиций. Композиции по настоящему изобретению способны индуцировать иммунологическую толерантность к глиадину. 6 н. и 21 з.п. ф-лы, 43 ил., 24 пр.

Комментарии