Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты и их применение - RU2707251C2
Код документа: RU2707251C2
Чертежи







Описание
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка подана вместе со списком последовательностей в электронном формате. Файл списка последовательностей под названием M009SQLST.txt был создан 3 октября 2012 года и имеет размер 9859 байт. Информация списка последовательностей в электронном формате включена в настоящее описание в качестве ссылки в полном объеме.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет временной патентной заявки США № 61/542533, поданной 3 октября 2011 года, под названием "Modified Nucleosides, Nucleotides and Nucleic Acids, and Uses Thereof", содержание которой включено в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам, в которых используются модифицированные нуклеиновые кислоты для модулирования функции клеток. Модифицированные нуклеиновые кислоты по изобретению могут кодировать пептиды, полипептиды или множество белков. Кодируемые молекулы можно использовать в качестве терапевтических средств и/или диагностических средств.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Встречающиеся в природе РНК синтезируются из четырех основных рибонуклеотидов: ATP, CTP, UTP и GTP, однако они могут содержать посттранскрипционно модифицированные нуклеотиды. Кроме того, в РНК идентифицировано приблизительно сто различных модификаций нуклеозидов (Rozenski, J, Crain, P, and McCloskey, J. (1999). The RNA Modification Database: 1999 update. Nucl Acids Res 27: 196-197). Однако роль модификаций нуклеозидов в иммуностимулирующем потенциале и в эффективности трансляции РНК неизвестна.
Предшествующие методологии обеспечения экспрессии белков имеют множество проблем. Например, гетерологичная ДНК, введенная в клетку, может наследоваться дочерними клетками (независимо от того, встроилась ли гетерологичная ДНК в хромосому) или потомками. Введенная ДНК может встраиваться в геномную ДНК клетки-хозяина с некоторой частотой, что приводит к изменениям и/или повреждению геномной ДНК клетки-хозяина. Кроме того, до получения белка необходимо осуществить множество стадий. После проникновения в клетку ДНК должна транспортироваться в ядро, где она транскрибируется в РНК. Затем РНК, транскрибированная с ДНК, должна проникнуть в цитоплазму, где она транслируется в белок. Эта необходимость множества стадий процессинга обеспечивает латентный период перед тем, как будет получен представляющий интерес белок. Кроме того, трудно достигнуть экспрессии ДНК в клетках; часто ДНК проникает в клетки, но не экспрессируется или экспрессируется на недостаточных уровнях или в недостаточных концентрациях. Особенно это может быть проблемой, когда ДНК вводят в клетки, такие как первичные клетки или модифицированные клеточные линии.
В данной области существует потребность в биологических средствах для осуществления модулирования внутриклеточной трансляции нуклеиновых кислот.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании представлены, среди прочих, модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, которые могут демонстрировать сниженный врожденный иммунный ответ при введении в популяцию клеток, как in vivo, так и ex vivo.
Настоящее изобретение относится к полинуклеотидам, которые могут быть выделенными или очищенными. Эти полинуклеотиды могут кодировать один или несколько представляющих интерес полипептидов и содержат последовательность ряда связанных нуклеозидов или нуклеотидов, содержащих по меньшей мере один модифицированный нуклеозид или нуклеотид по сравнению с химической структурой нуклеозида или нуклеотида A, G, U или C. Полинуклеотиды также могут содержать 5’-UTR, содержащую по меньшей мере одну последовательность Козака, 3’-UTR и по меньшей мере одну структуру 5′-кэпа. Кроме того, выделенные полинуклеотиды могут содержать концевую часть поли-A и могут быть очищенными.
Выделенные полинуклеотиды по изобретению также содержат по меньшей мере одну структуру 5′-кэпа, выбранную из группы, состоящей из кэпа 0, кэпа 1, ARCA, инозина, N1-метилгуанозина, 2′фторгуанозина, 7-деазагуанозина, 8-оксогуанозина, 2-аминогуанозина, LNA-гуанозина и 2-азидогуанозина.
Модификации полинуклеотидов по изобретению могут быть осуществлены на нуклеозидном основании и/или сахарной части нуклеозидов, которые содержатся в полинуклеотиде.
В некоторых вариантах осуществления модификацию осуществляют на основании нуклеиновой кислоты и она выбрана из группы, состоящей из псевдоуридина или N1-метилпсевдоуридина.
В некоторых вариантах осуществления модифицированный нуклеозид не является псевдоуридином (ψ) или 5-метилцитидином (m5C).
В некоторых вариантах осуществления множество модификаций включены в модифицированную нуклеиновую кислоту или в один или несколько индивидуальных нуклеозидов или нуклеотидов. Например, модификации нуклеозида могут включать одну или несколько модификаций оснований нуклеиновой кислоты и сахара.
В некоторых вариантах осуществления предусматриваются новые структурные элементы, например нуклеозиды и нуклеотиды, для получения модифицированных полинуклеотидов и способ их синтеза и производства.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим модифицированные полинуклеотиды, описанные в настоящем описании. Также они могут дополнительно включать один или несколько фармацевтически приемлемых эксципиентов, выбранных из растворителя, водного растворителя, неводного растворителя, диспергирующей среды, разбавителя, дисперсии, суспендирующей добавки, поверхностно-активного вещества, изотонического агента, загустителя или эмульгатора, консерванта, липида, липидоидов, липосомы, липидной наночастицы, наночастиц типа сердцевина-оболочка, полимера, липоплексного пептида, белка, клетки, гиалуронидазы и их смесей.
Также предусматриваются способы, в которых используются полинуклеотиды и модифицированные нуклеиновые кислоты по изобретению. В этом случае полинуклеотиды можно составлять любыми способами, известными в данной области, или можно вводить любым из нескольких путей, включающих инъекцию внутрикожным, подкожным или внутримышечным способом.
Введение модифицированных нуклеиновых кислот по изобретению может быть осуществлено посредством двух или более равных или неравных разделенных доз. В некоторых вариантах осуществления уровень полипептида, продуцируемого у индивидуума при введении разделенных доз полинуклеотида, превышает уровни, продуцируемые путем введения той же общей суточной дозы полинуклеотида в качестве однократного введения.
Обнаружение модифицированных нуклеиновых кислот или кодируемых полипептидов можно проводить в жидкости организма индивидуума или пациента, где жидкость организма выбрана из группы, состоящей из периферической крови, сыворотки, плазмы, асцитной жидкости, мочи, цереброспинальной жидкости (CSF), мокроты, слюны, костного мозга, синовиальной жидкости, внутриглазной жидкости, амниотической жидкости, ушной серы, грудного молока, жидкости бронхоальвеолярного лаважа, семенной жидкости, жидкости предстательной железы, куперовой жидкости или предэякулята, пота, фекальных масс, волос, слез, жидкости кисты, плевральной и перитонеальной жидкости, перикардиальной жидкости, лимфы, химуса, хилуса, желчи, интерстициальной жидкости, менструальных жидкостей, гноя, кожного сала, рвотной массы, вагинальных секретов, секретов слизистых оболочек, жидкости стула, сока поджелудочной железы, жидкостей лаважа из полостей пазух, бронхолегочной аспирированной жидкости, жидкости полости бластоцеля и пуповинной крови.
В некоторых вариантах осуществления введение проводят в соответствии с режимом дозирования, который выполняют в течение периода нескольких часов, суток, недель, месяцев или лет, и оно может быть осуществлено с использованием одного или нескольких устройств, выбранных из многоигольных инъекционных систем, катетера или люминальных систем, и ультразвуковых, электрических или излучающих систем.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. В настоящем описании описаны способы и материалы для применения в рамках настоящего изобретения; также можно использовать другие пригодные способы и материалы, известные в данной области. Материалы, способы и примеры являются только иллюстративными и не являются ограничивающими. Все публикации, патентные заявки, патенты, последовательности, регистрационные записи баз данных и другие ссылки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. В случае противоречий настоящее описание, включая определения, будет решающим.
Другие признаки и преимущества настоящего изобретения будут очевидны из представленного ниже подробного описания и фигур, и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Представленные выше и другие задачи, признаки и преимущества будут очевидны из представленного ниже описания конкретных вариантов осуществления изобретения, как проиллюстрировано на прилагаемых чертежах, в которых на различных изображениях условные обозначения относятся к одинаковым частям. Чертежи не обязательно представлены в масштабе, вместо этого внимание обращено на иллюстрацию принципов различных вариантов осуществления изобретения.
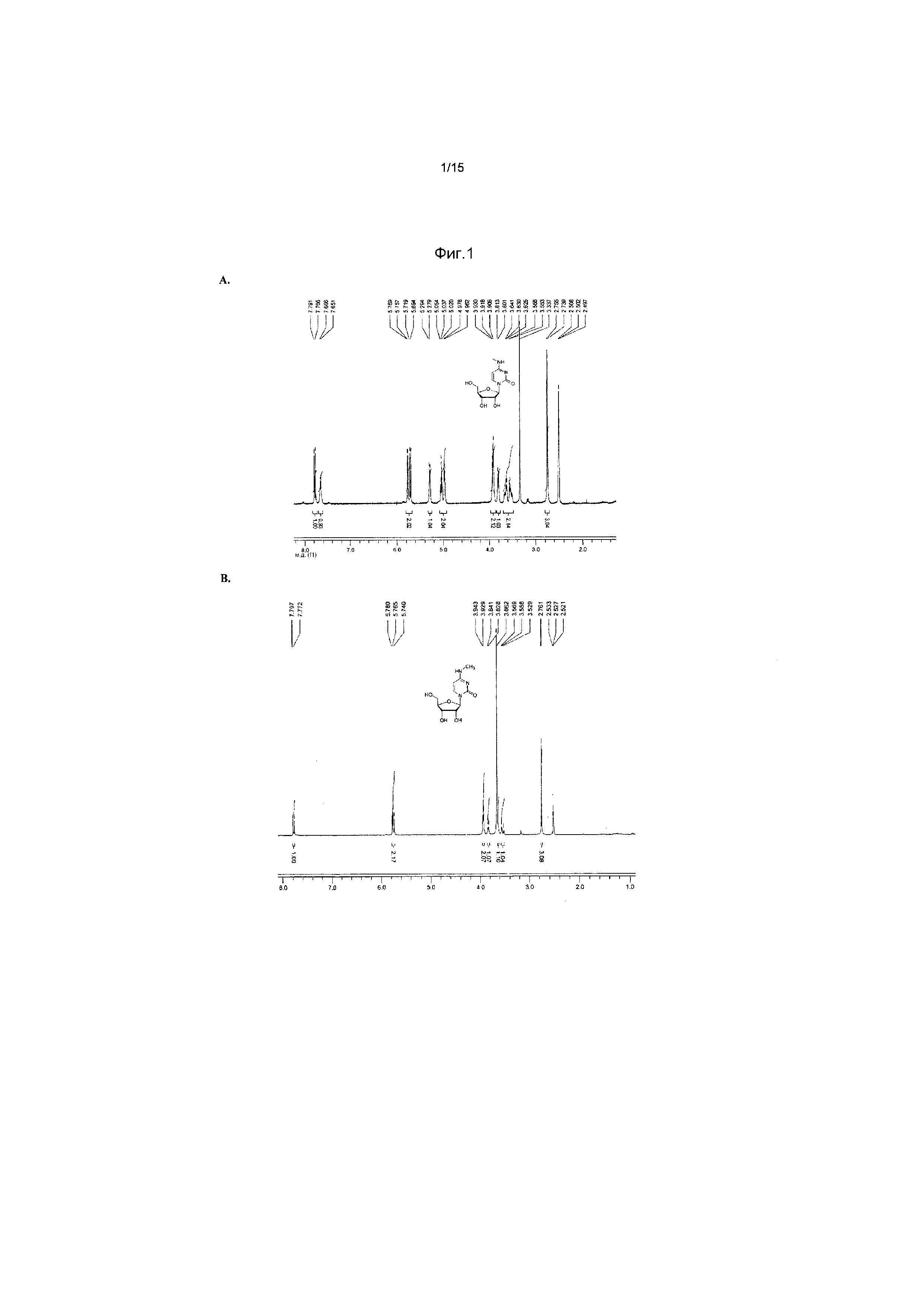
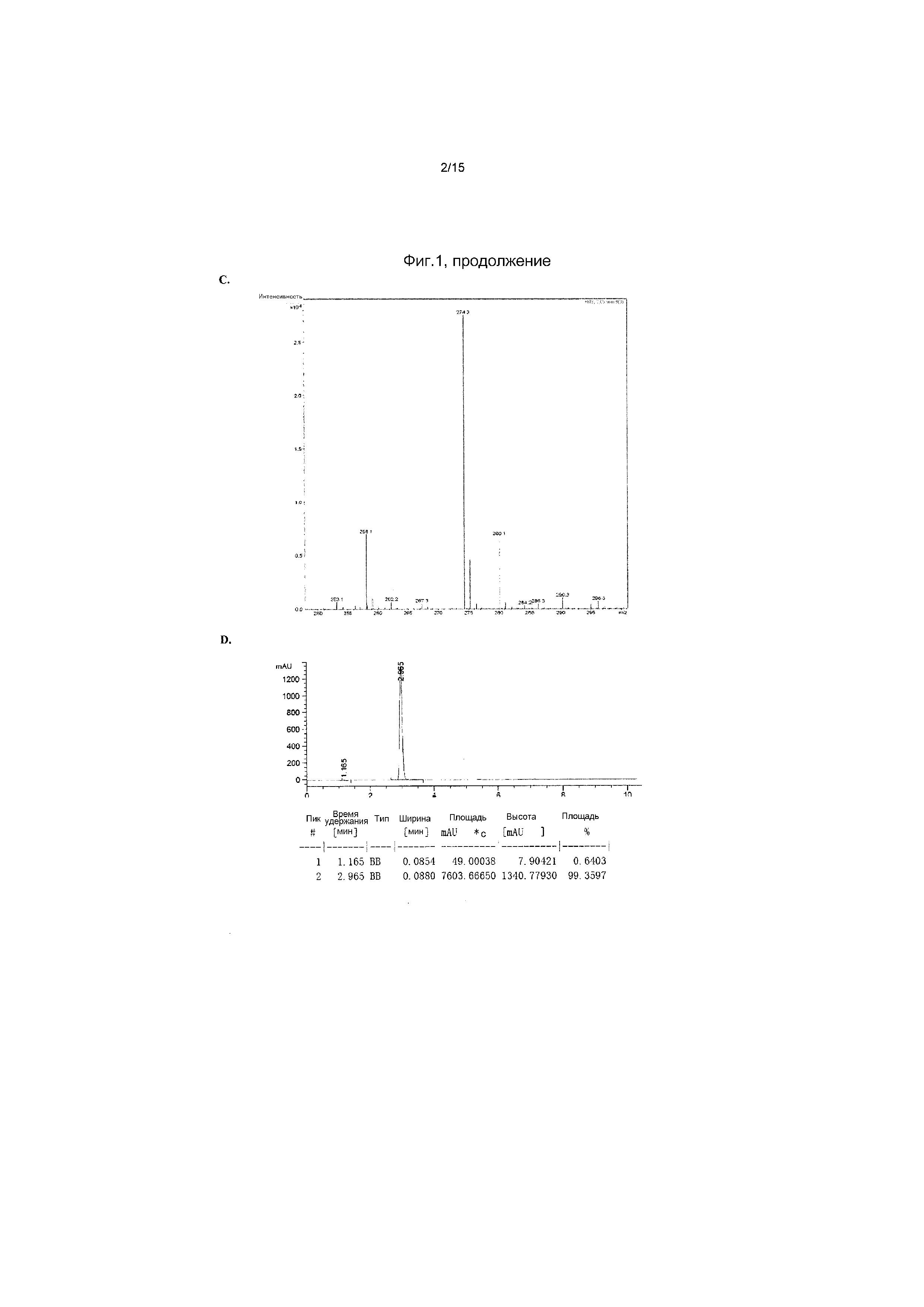
На фиг.1 представлен спектр и графики аналитических результатов для N4-Me-CTP (NTP соединения 1). На фиг.1A представлен спектр ядерного магнитного резонанса (ЯМР) в DMSO и на фиг.1B представлен спектр ЯМР в D2O, на фиг.1C представлены результаты масс-спектрометрии (MS), и на фиг.1D представлены результаты высокоэффективной жидкостной хроматографии (ВЭЖХ) для N4-метилцитидина (N4-Me-цитидин, соединение 1).
На фиг.2 представлены результаты ВЭЖХ для N4-Me-CTP (NTP соединения 1).
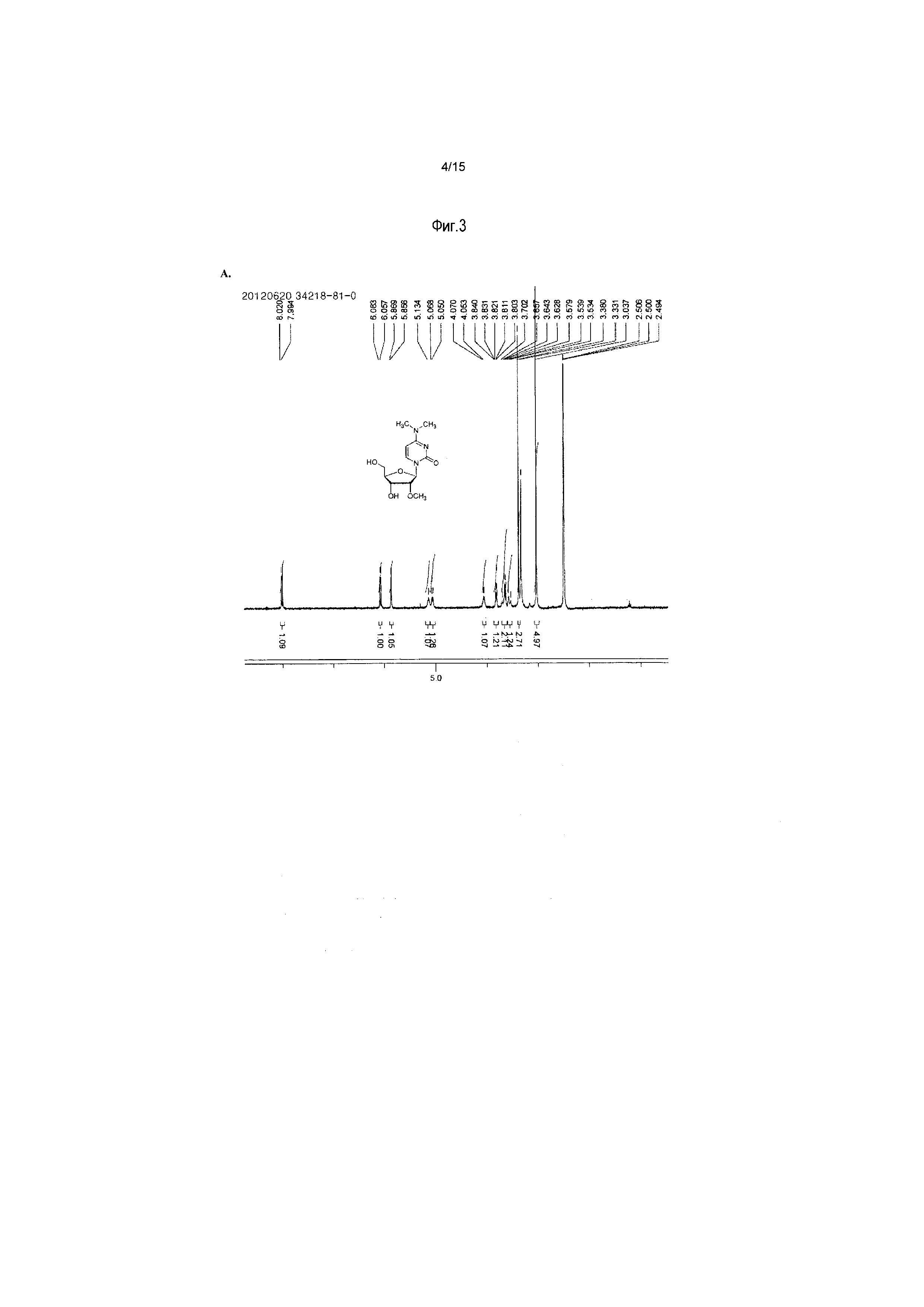
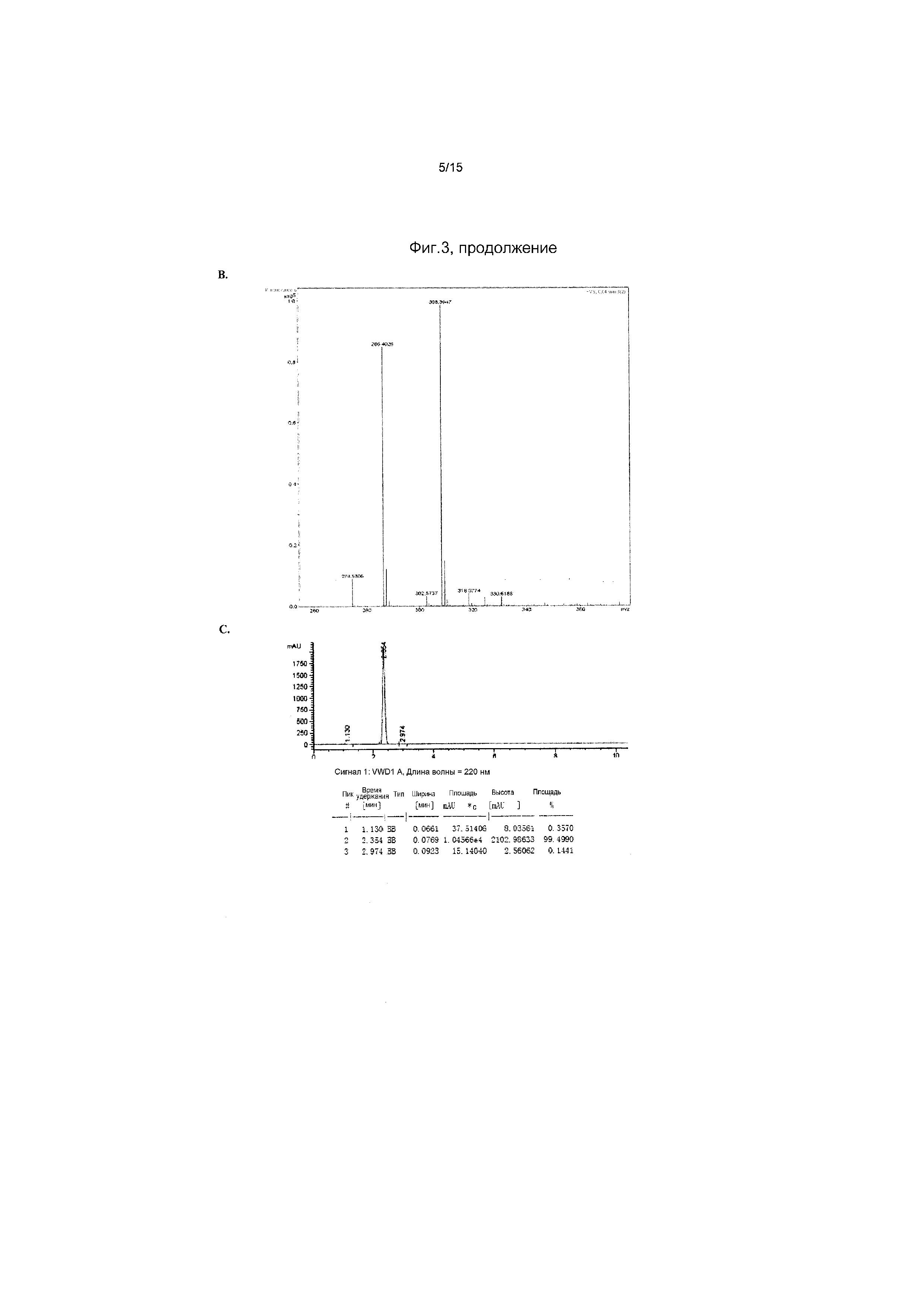
На фиг.3 представлены аналитические результаты для 2’-OMe-N, N-ди-Me-CTP (NTP соединения 2). На фиг.3A представлен спектр ЯМР. На фиг.3B представлены результаты MS. На фиг.3C представлены результаты ВЭЖХ для 2’-O-метил-N4,N4-диметилцитидина (2’-OMe-N,N-ди-Me-цитидин, соединение 2).
На фиг.4 представлены результаты ВЭЖХ для 2’-OMe-N, N-ди-Me-CTP (NTP соединения 2).
На фиг.5 представлены результаты ВЭЖХ для 5-метоксикарбонилметокси-UTP (NTP соединения 3).
На фиг.6 представлены аналитические результаты для 3-метилпсевдоуридина (соединение 4). На фиг.6A представлен спектр ЯМР для 3-метилпсевдоуридина (соединение 4) и на фиг.6B представлены результаты ВЭЖХ для 3-метилпсевдоуридина (соединение 4).
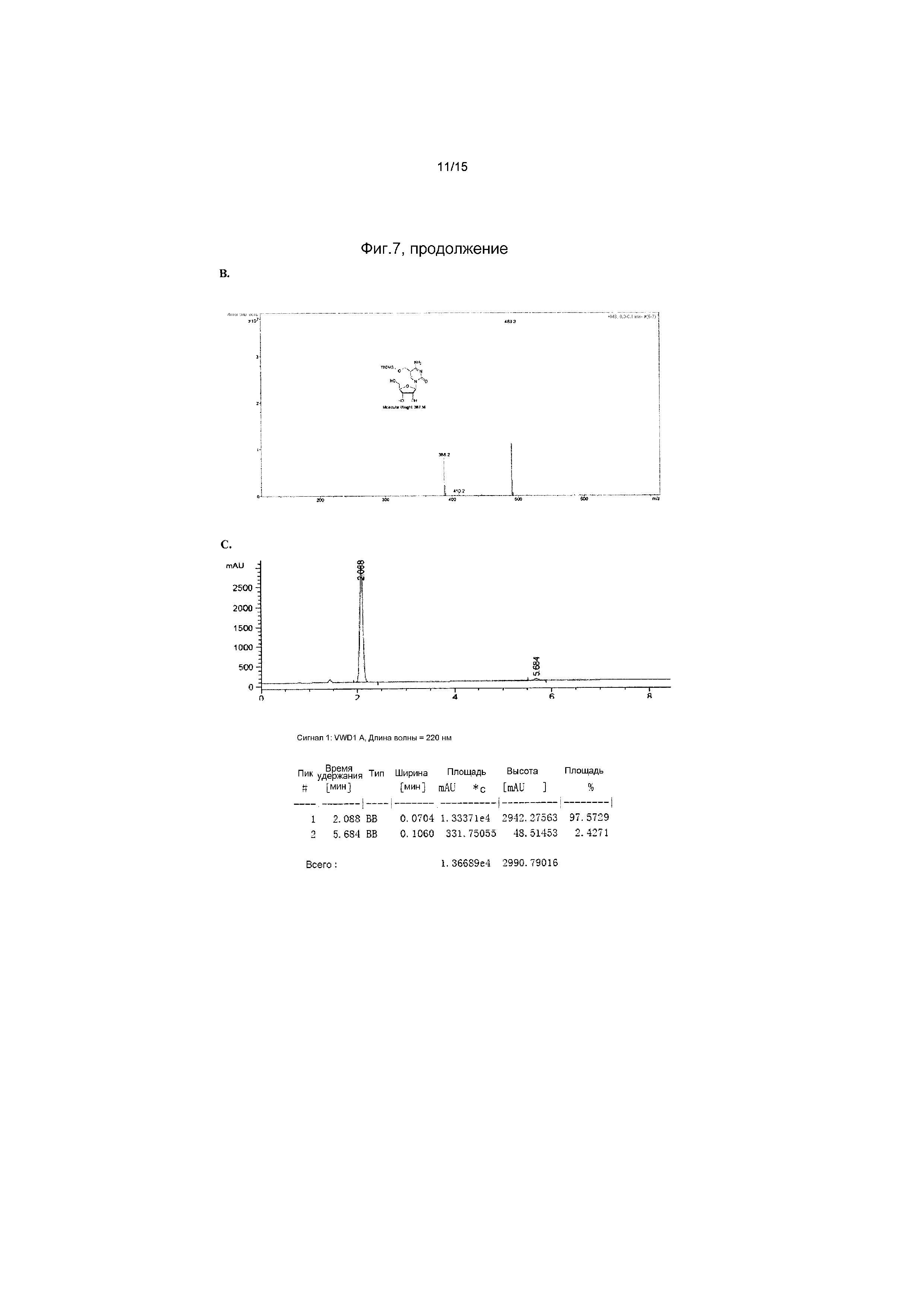
На фиг.7 представлены аналитические результаты для 5-TBDMS-OCH2-цитидина (соединение 6). На фиг.7A представлен спектр ЯМР, на фиг.7B представлены результаты MS, и на фиг.7C представлены результаты ВЭЖХ для 5-TBDMS-OCH2-цитидина (соединение 6).
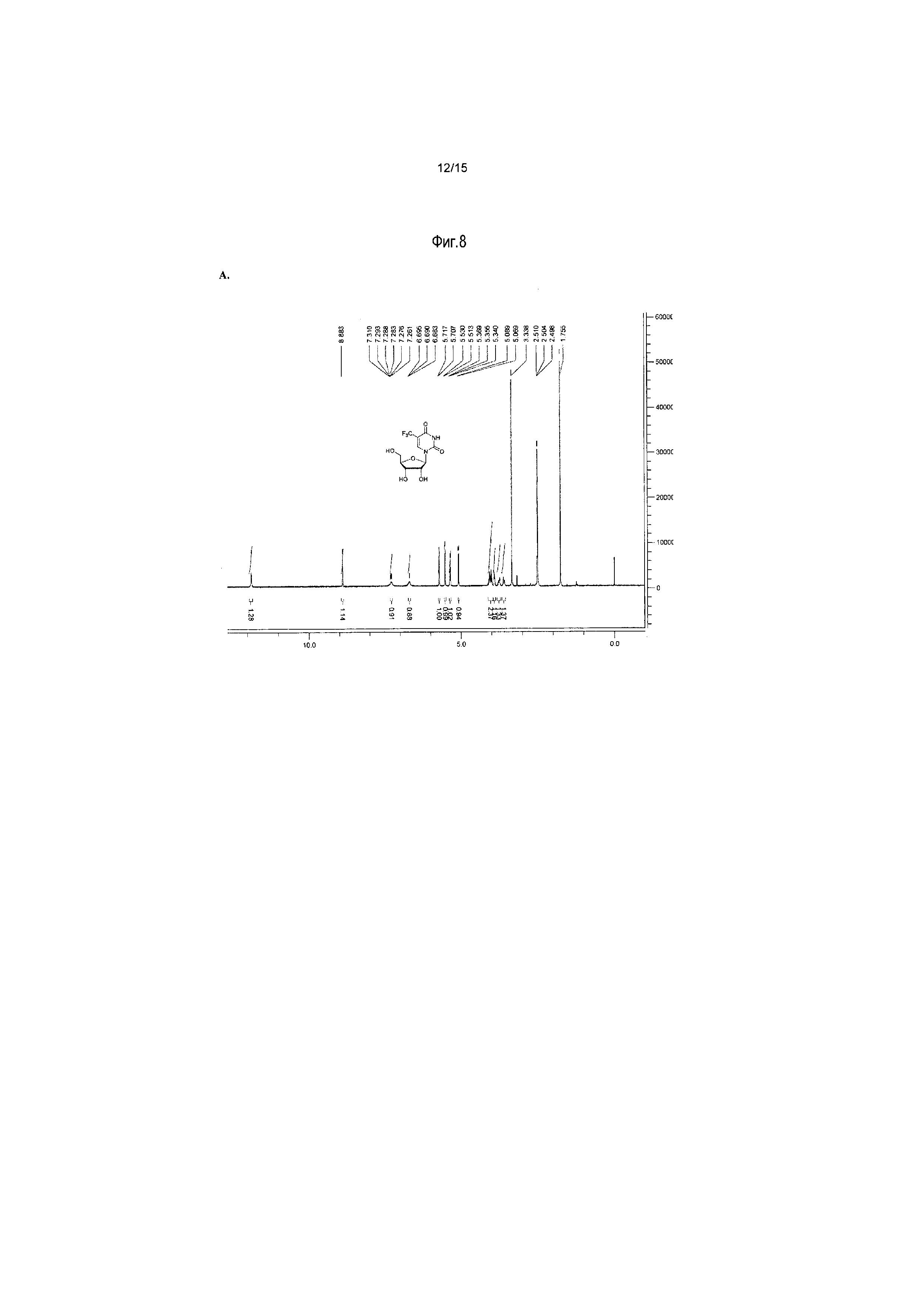
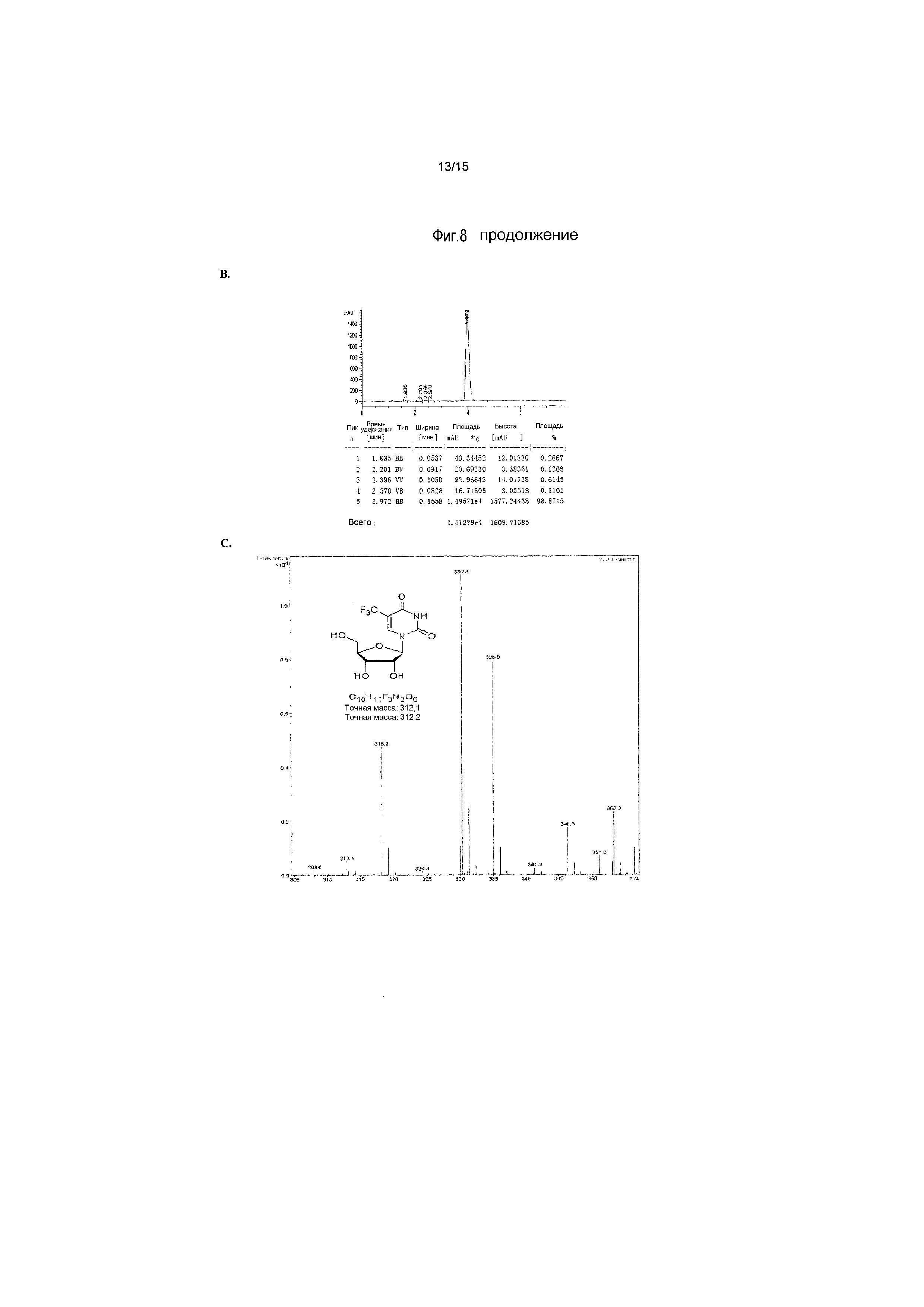
На фиг.8 представлены аналитические результаты для 5-трифторметилуридина (соединение 8). На фиг.8A представлен спектр ЯМР, на фиг.8B представлены результаты MS, и на фиг.8C представлены результаты ВЭЖХ для 5-трифторметилуридина (соединение 8).
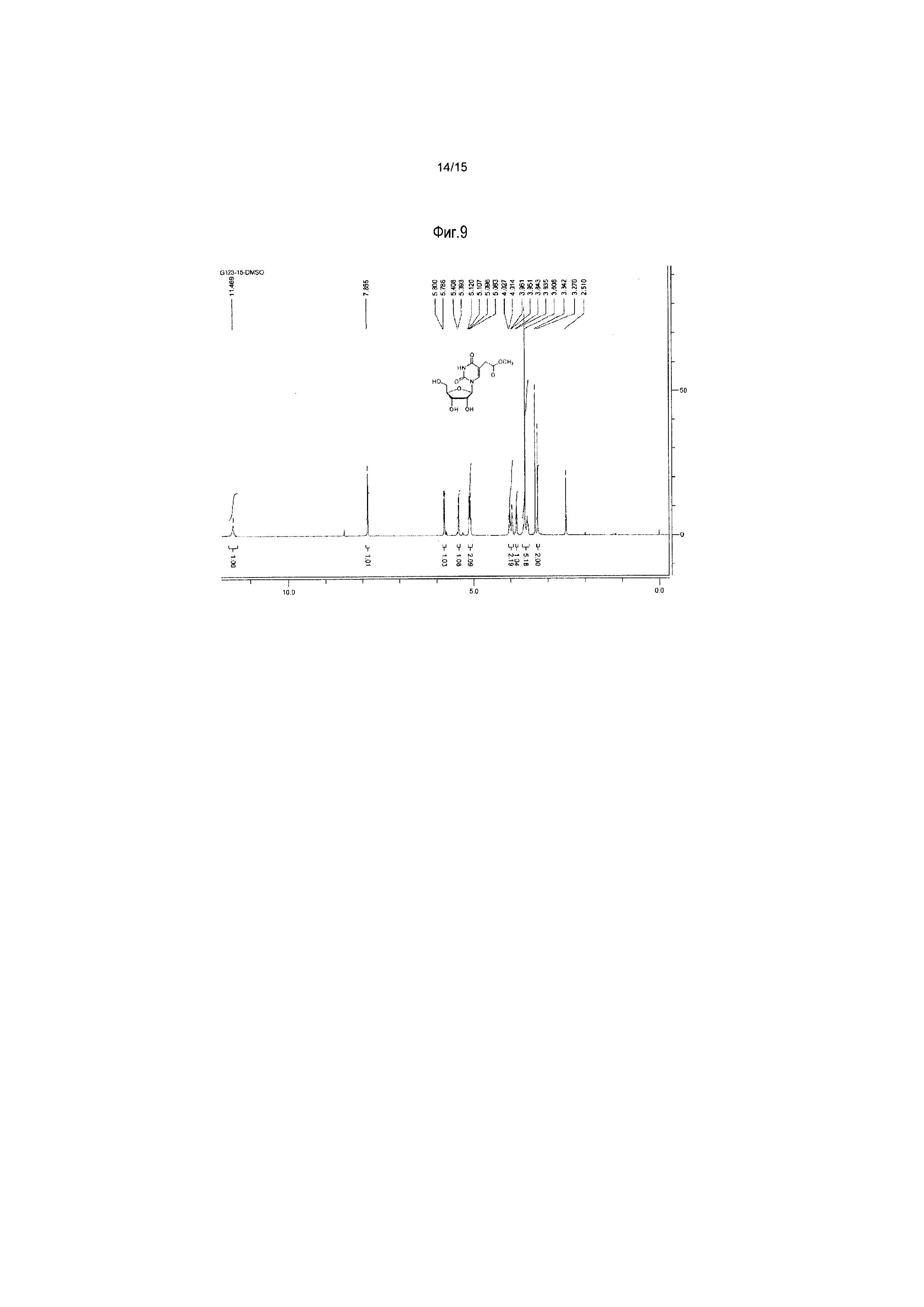
На фиг.9 представлены результаты спектра ЯМР для 5-(метоксикарбонил)метилуридина (соединение 9).
На фиг.10 представлен график, на котором показана вариабельность экспрессии белков (GCSF; дорожка B) и цитокинов (интерферон-альфа (IFNa); дорожка A, и фактор некроза опухоли-альфа (TNFa); дорожка C) в зависимости от процентной модификации.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится, среди прочего, к модифицированным нуклеозидам, модифицированным нуклеотидам и модифицированным нуклеиновым кислотам, которые проявляют улучшенные терапевтические свойства, включая, но не ограничиваясь ими, сниженный врожденный иммунный ответ при введении в популяцию клеток.
Поскольку в данной области остается потребность в терапевтических средствах, направленных на множество препятствий эффективному модулированию внутриклеточной трансляции и процессинга нуклеиновых кислот, кодирующих полипептиды или их фрагменты, авторы изобретения показали, что определенные модифицированные последовательности мРНК обладают потенциалом в качестве терапевтических средств с преимуществами, выходящими за пределы только ускользания от, избегания или уменьшения иммунного ответа.
Настоящее изобретение удовлетворяет эту потребность путем предоставления соединений на основе нуклеиновой кислоты или полинуклеотидов, которые кодируют представляющий интерес полипептид (например, модифицированную мРНК) и которые обладают структурными и/или химическими признаками, которые устраняют одну или несколько проблем уровня техники, например, признаками, которые пригодны для оптимизации терапевтических средств на основе нуклеиновых кислот при одновременном сохранении структурной и функциональной целостности, преодолении порога экспрессии, повышении уровней экспрессии, времени полужизни и/или концентраций белка, оптимизации локализации белка и избегании вредоносных биологических ответов, таких как иммунный ответ и/или пути деградации.
В рамках настоящего изобретения предусматриваются, частично, полинуклеотиды, кодирующие представляющие интерес полипептиды, которые химически модифицированы для повышения одного или нескольких из стабильности и/или клиренса в тканях, рецепторного захвата и/или кинетики, доступа композиций к клеткам, вовлечения аппарата транскрипции, времени полужизни мРНК, эффективности трансляции, ускользания от иммунной системы, способности к продуцированию белка, эффективности секреции (когда это применимо), доступности для кровообращения, времени полужизни белка и/или модулирования статуса, функции и/или активности клеток.
Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты по изобретению, включающие комбинацию модификаций, описанных в настоящем описании, имеют улучшенные свойства, что делает их более пригодными в качестве терапевтических средств.
Было определено, что модель уровня техники "все или ничего" является совершенно недостаточной для описания биологических явлений, ассоциированных с терапевтической применимостью модифицированной мРНК. Авторы настоящего изобретения определили, что для повышения продукции белка можно учитывать природу модификации или комбинации модификаций, процентную модификацию и исследовать более одного цитокина или показателя для определения эффективности и профиля риска конкретной модифицированной мРНК.
В одном аспекте изобретения способы определения эффективности модифицированной по сравнению с немодифицированной мРНК вовлекают измерение и анализ одного или нескольких цитокинов, экспрессия которых запускается путем введения экзогенной нуклеиновой кислоты по изобретению. Эти величины сравнивают с введением немодифицированной нуклеиновой кислоты или со стандартным показателем, таким как ответ цитокинов, поли-IC, R-848, или другим стандартом, известным в данной области.
Одним примером стандартного показателя, разработанного в рамках настоящего изобретения, является показатель соотношения уровня или количества кодируемого полипептида (белка), продуцируемого в клетке, ткани или организме, и уровня или количества одного или нескольких (или панели) цитокинов, экспрессия которых запускается в клетке, ткани или организме в результате введения или контакта с модифицированной нуклеиновой кислотой. Такие соотношения обозначают в настоящем описании как соотношение белок:цитокин или соотношение "PC". Чем более высоким является соотношение PC, тем более эффективной является модифицированная нуклеиновая кислота (полинуклеотид, кодирующий измеренный белок). Предпочтительные соотношения PC, на цитокин, по настоящему изобретению могут составлять более 1, более 10, более 100, более 1000, более 10000 или более. Модифицированные нуклеиновые кислоты, имеющие более высокие соотношения PC, чем модифицированная нуклеиновая кислота с отличающейся или немодифицированной конструкцией, являются предпочтительными.
Далее, соотношение PC можно определять по процентной модификации полинуклеотида. Например, можно определять нормализованную к 100% модифицированной нуклеиновой кислоте продукцию белка в качестве функции уровня цитокина (или риска) или профиля цитокинов.
В одном варианте осуществления настоящее изобретение относится к способу определения, посредством химических соединений, цитокинов или процентной модификации, относительной эффективности любого конкретного модифицированного полинуклеотида путем сравнения соотношения PC для модифицированной нуклеиновой кислоты (полинуклеотида).
В другом варианте осуществления химически модифицированная мРНК является по существу нетоксичной и немутагенной.
В одном варианте осуществления модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты могут быть химически модифицированными на поверхности большой бороздки, тем самым нарушая взаимодействия с основными партнерами по связыванию большой бороздки, которые могут вызвать врожденные иммунные ответы. Кроме того, эти модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты можно использовать для доставки груза, например, поддающегося обнаружению или терапевтического средства, к биологической мишени. Например, нуклеиновые кислоты можно ковалентно связывать с грузом, например, поддающимся обнаружению или терапевтическим средством, через линкер, присоединенный к нуклеиновому основанию или сахарной части. Композиции и способы, описанные в настоящем описании, можно использовать, in vivo и in vitro, как внеклеточно, так и внутриклеточно, а также в анализах, таких как бесклеточные анализы.
В некоторых вариантах осуществления настоящее изобретение относится к соединениям, содержащим нуклеотид, который нарушает связывание взаимодействующего, например, связывающегося, с большой бороздкой партнера с нуклеиновой кислотой, где нуклеотид обладает сниженной аффинностью связывания с взаимодействующими с большой бороздкой партнерами.
В другом аспекте настоящее изобретение относится к нуклеотидам, которые содержат химические модификации, где нуклеотид обладает измененным связыванием с взаимодействующими с большой бороздкой партнерами.
В некоторых вариантах осуществления химические модификации расположены на обращенной к большой бороздке поверхности основания нуклеиновой кислоты, и где химические модификации могут включать замену или замещение атома пиримидина нуклеинового основания амином, SH, алкилом (например, метилом или этилом) или галогеном (например, хлором или фтором).
В другом аспекте настоящее изобретение относится к химическим модификациям, расположенным на сахарной части нуклеотида.
В другом аспекте настоящее изобретение относится к химическим модификациям, расположенным на фосфатном остове нуклеиновой кислоты.
В некоторых вариантах осуществления химические модификации изменяют электрохимию поверхности большой бороздки нуклеиновой кислоты.
В другом аспекте настоящее изобретение относится к нуклеотидам, которые содержат химические модификации, где нуклеотид снижает врожденный клеточный иммунный ответ по сравнению с врожденным клеточным иммунным ответом, индуцируемым соответствующей немодифицированной нуклеиновой кислотой.
В другом аспекте настоящее изобретение относится к последовательностям нуклеиновой кислоты, содержащим по меньшей мере два нуклеотида, причем последовательность нуклеиновой кислоты содержит нуклеотид, который нарушает связывание взаимодействующего с большой бороздкой партнера с последовательностью нуклеиновой кислоты, где нуклеотид обладает сниженной аффинностью связывания со связывающимся с большой бороздкой партнером.
В другом аспекте настоящее изобретение относится к композициям, содержащим соединение, как описано в настоящем описании. В некоторых вариантах осуществления композиция представляет собой реакционную смесь. В некоторых вариантах осуществления композиция представляет собой фармацевтическую композицию. В некоторых вариантах осуществления композиция представляет собой клеточную культуру. В некоторых вариантах осуществления композиция дополнительно содержит РНК-полимеразу и кДНК-матрицу. В некоторых вариантах осуществления композиция дополнительно содержит нуклеотид, выбранный из группы, состоящей из аденозина, цитозина, гуанозина и урацила.
В следующем аспекте настоящее изобретение относится к способам получения фармацевтического состава, содержащего физиологически активный секретируемый белок, включающим трансфекцию первой популяции клеток человека фармацевтической нуклеиновой кислотой, полученной способами, описанными в настоящем описании, где секретируемый белок является активным в отношении второй популяции клеток человека.
В некоторых вариантах осуществления секретируемый белок способен взаимодействовать с рецептором на поверхности по меньшей мере одной клетки, присутствующей во второй популяции.
В некоторых вариантах осуществления секретируемый белок представляет собой гранулоцитарный колониестимулирующий фактор (G-CSF).
В некоторых вариантах осуществления вторая популяция содержит миелобластные клетки, которые экспрессируют рецептор G-CSF.
В определенных вариантах осуществления в рамках настоящего изобретения предусматриваются комбинированные терапевтические средства, содержащие одну или несколько модифицированных нуклеиновых кислот, содержащих транслируемые области, которые кодируют белок или белки, которые усиливают иммунитет млекопитающего, вместе с белком, который индуцирует антителозависимую клеточную токсичность. Например, в рамках настоящего изобретения предусматриваются терапевтические средства, содержащие одну или несколько нуклеиновых кислот, которые кодируют трастузумаб и гранулоцитарный колониестимулирующий фактор (G-CSF). В частности, такие комбинированные лекарственные средства пригодны у пациентов с раком молочной железы Her2+, у которых развилась индуцированная устойчивость к трастузумабу (см., например, Albrecht, Immunotherapy. 2(6):795-8 (2010)).
В одном варианте осуществления подразумевается, что соединения по настоящему изобретению являются стабильными. Кроме того, понятно, что определенные признаки настоящего изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, также могут быть предоставлены в комбинации в одном варианте осуществления. Напротив, различные признаки настоящего изобретения, которые, для краткости, описаны в контексте одного варианта осуществления, также могут быть предоставлены по отдельности или в любой подходящей подкомбинации.
Модифицированные нуклеотиды, нуклеозиды и полинуклеотиды по изобретению
В настоящем описании в нуклеотиде, нуклеозиде или полинуклеотиде (таком как нуклеиновые кислоты по изобретению, например, молекула мРНК) термины "модификация" или, в соответствующих случаях, "модифицированный" относятся к модификации в отношении рибонуклеотидов A, G, U или C. Главным образом, в настоящем описании не подразумевают, что эти термины относятся к модификациям рибонуклеотидов во встречающихся в природе 5′-концевых частях кэпа мРНК. В полипептиде термин "модификация" относится к модификации части по сравнению с каноническим набором из 20 аминокислот.
Модификации могут представлять собой различные отличающиеся модификации. В некоторых вариантах осуществления, где нуклеиновая кислота представляет собой мРНК, кодирующая область, фланкирующие области и/или концевые области могут содержать одну, две или более (необязательно отличающихся) нуклеозидных или нуклеотидных модификаций. В некоторых вариантах осуществления модифицированный полинуклеотид, введенный в клетку, может проявлять сниженную деградацию в клетке по сравнению с немодифицированным полинуклеотидом.
Полинуклеотиды могут включать любую полезную модификацию, такую как модификация сахара, основания нуклеиновой кислоты или межнуклеозидной связи (например,связывающего фосфата/фосфодиэфирной связи/фосфодиэфирного остова). Например, большая бороздка полинуклеотида или обращенная к большой бороздке поверхность основания нуклеиновой кислоты могут содержать одну или несколько модификаций. Один или несколько атомов пиримидинового основания нуклеиновой кислоты (например, на поверхности большой бороздки) могут быть заменены или замещены необязательно замещенным амино, необязательно замещенным тиолом, необязательно замещенным алкилом (например, метилом или этилом) или галогеном (например, хлором или фтором). В определенных вариантах осуществления модификации (например, одна или несколько модификаций) присутствуют в каждом из сахара и межнуклеозидной связи. Модификации в соответствии с настоящим изобретением могут представлять собой модификации рибонуклеиновых кислот (РНК), дезоксирибонуклеиновых кислот (ДНК), например, замена 2’-OH рибофуранизильного кольца на 2’-H, нуклеиновые кислоты с треозой (TNA), нуклеиновые кислоты с гликолем (GNA), пептидные нуклеиновые кислоты (PNA), замкнутые нуклеиновые кислоты (LNA) или их гибриды). Дополнительные модификации описаны в настоящем описании.
Как описано в настоящем описании, полинуклеотиды по изобретению по существу не индуцируют врожденный иммунный ответ в клетке, в которую введен полинуклеотид (например, мРНК). Признаки индуцированного врожденного иммунного ответа включают 1) увеличенную экспрессию провоспалительных цитокинов, 2) активацию внутриклеточных PRR (RIG-I, MDA5 и т.д.), и/или 3) терминацию или снижение трансляции белка.
В определенных вариантах осуществления может быть желательным, чтобы модифицированная молекула нуклеиновой кислоты, введенная в клетку, деградировалась внутриклеточно. Например, деградация модифицированной молекулы нуклеиновой кислоты может быть предпочтительной, если является желательным точный период времени продуцирования белка. Таким образом, в некоторых вариантах осуществления изобретение относится к модифицированной молекуле нуклеиновой кислоты, содержащей домен деградации, который способен действовать направленным образом в клетке. В другом аспекте настоящее изобретение относится к полинуклеотидам, содержащим нуклеозид или нуклеотид, которые могут нарушать связывание взаимодействующего, например, связывающегося, с большой бороздкой партнера с полинуклеотидом (например, где модифицированный нуклеотид обладает сниженной аффинностью связывания с взаимодействующим с большой бороздкой партнером по сравнению с немодифицированным нуклеотидом).
Полинуклеотиды необязательно могут включать другие агенты (например, индуцирующие РНК-i агенты, агенты РНК-i, миРНК (siRNA), кшРНК (shRNA), микроРНК (miRNA), антисмысловые РНК, рибозимы, каталитические ДНК, тРНК, РНК, которые индуцируют образование тройной спирали, аптамеры, векторы и т.д.). В некоторых вариантах осуществления полинуклеотиды могут включать одну или несколько матричных РНК (мРНК), имеющих один или несколько модифицированных нуклеозидов или нуклеотидов (т.е. модифицированные молекулы мРНК). Подробно описание этих полинуклеотидов следуют далее.
Полинуклеотиды
Полинуклеотиды по изобретению включают первую область связанных нуклеозидов, кодирующую представляющий интерес полипептид, первую фланкирующую область, расположенную на 5′-конце первой области, и вторую фланкирующую область, расположенную на 3′-конце первой области.
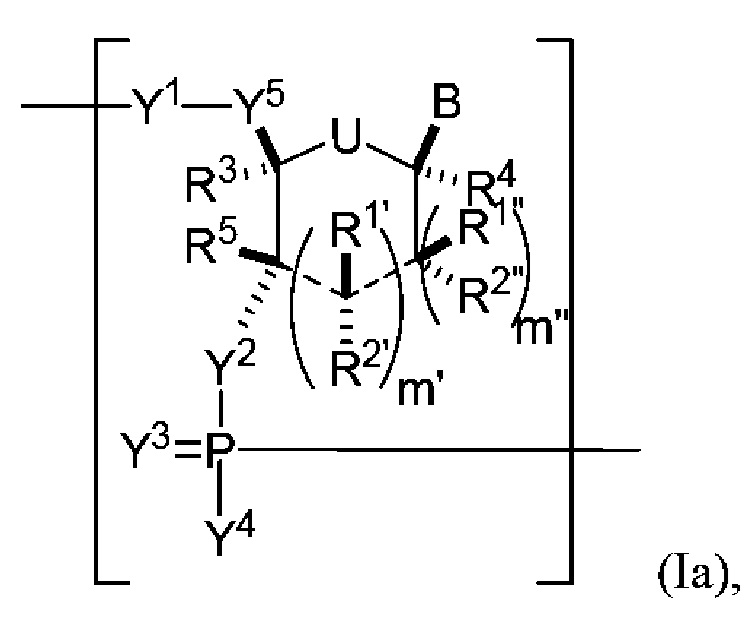
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ia) или формулу (Ia-1):
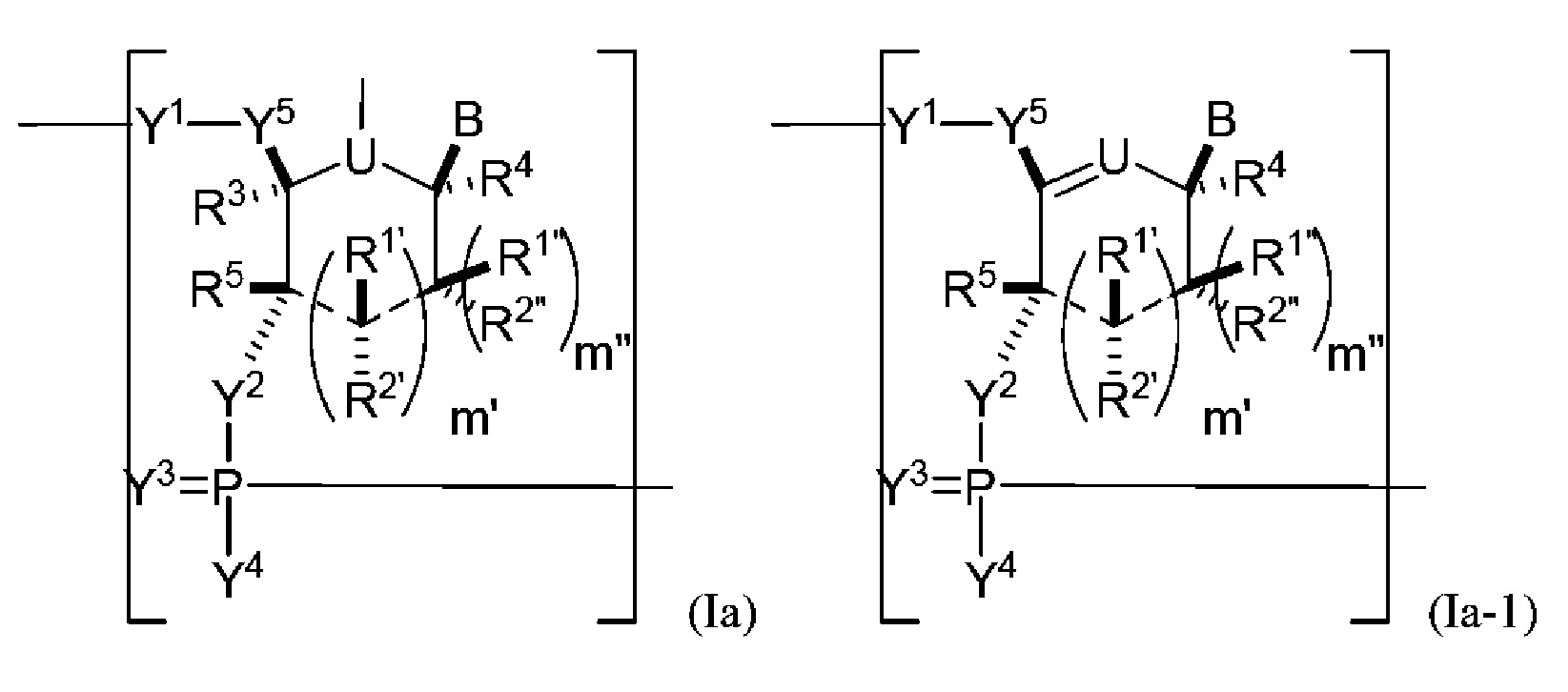
или формулу их фармацевтически приемлемых солей или их стереоизомеров, где U представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2, и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
каждый из R1’, R2’, R1", R2", R1, R2, R3, R4 и R5, если присутствует, независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, или отсутствует; где комбинация R3 с одним или несколькими из R1’, R1", R2’, R2" или R5(например, комбинация R1’ и R3, комбинация R1" и R3, комбинация R2’ и R3, комбинация R2" и R3 или комбинация R5 и R3), связанных вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или трициклический гетероциклил); где комбинация R5 с одним или несколькими из R1’, R1", R2’ или R2" (например, комбинация R1’ и R5, комбинация R1" и R5, комбинация R2′ и R5 или комбинация R2" и R5), связанных вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил); и где комбинация R4 с одним или несколькими из R1’, R1", R2’, R2", R3 или R5, связанных вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил);
каждый из m’ и m" независимо представляет собой целое число от 0 до 3 (например, от 0 до 2, от 0 до 1, от 1 до 3 или от 1 до 2);
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, -NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил или отсутствует;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
каждый Y5 независимо представляет собой O, S, Se, необязательно замещенный алкилен (например метилен) или необязательно замещенный гетероалкилен;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные), где комбинация B и R1’, комбинация B и R2’, комбинация B и R1" или комбинация B и R2", взятые вместе с атомами углерода, к которым они присоединены, необязательно могут образовывать бициклическую группу (например, бициклический гетероциклил) или где комбинация B, R1" и R3 или комбинация B, R2" и R3 необязательно могут образовывать трициклическую или тетрациклическую группу (например, трициклический или тетрациклический гетероциклил, такой как в формуле (IIo)-(IIp) настоящего описания).
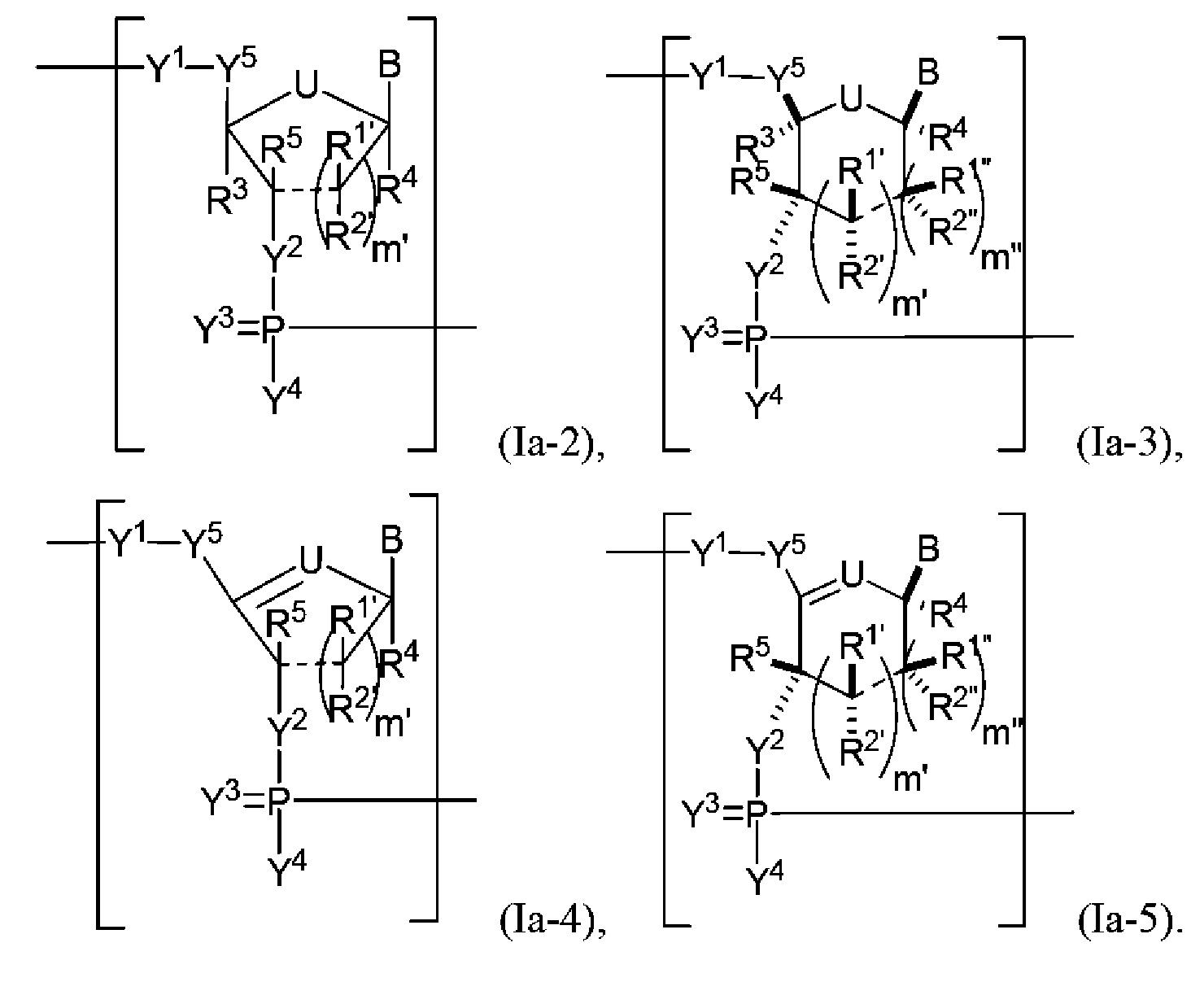
В некоторых вариантах осуществления полинуклеотид включает модифицированную рибозу. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ia-2)-(Ia-5) или формулу их фармацевтически приемлемой соли или их стереоизомера.
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ib) или формулу (Ib-1):

или формулу их фармацевтически приемлемой соли или их стереоизомера, где
U представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
каждый из R1, R3’, R3" и R4 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или отсутствует; и где комбинация R1 и R3’ или комбинация R1 и R3", взятые вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен (например, образуя замкнутую нуклеиновую кислоту);
каждый R5 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси или отсутствует;
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты.
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ic):
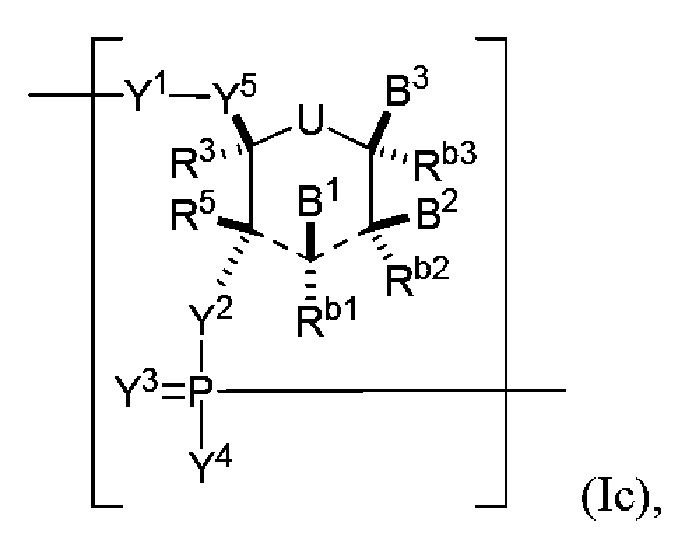
U представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
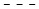
каждый из B1, B2 и B3 независимо представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные, как описано в настоящем описании), H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил, где один и только один из B1, B2 и B3 представляет собой основание нуклеиновой кислоты;
каждый из Rb1, Rb2, Rb3, R3 и R5 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил;
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, -NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
каждый Y5 независимо представляет собой O, S, Se, необязательно замещенный алкилен (например, метилен) или необязательно замещенный гетероалкилен;
n представляет собой целое число от 1 до 100000; и
где кольцо, включающее U, может включать одну или несколько двойных связей.
В конкретных вариантах осуществления кольцо, включающее U, не имеет двойной связи между U-CB3Rb3 или между CB3Rb3-CB2Rb2.
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Id):
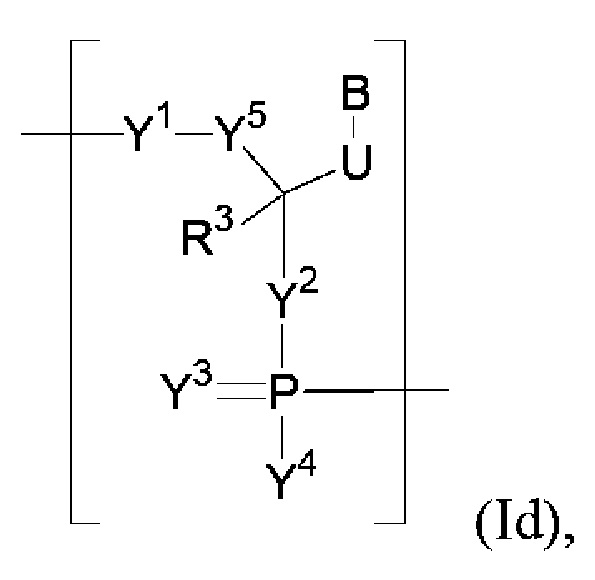
каждый R3 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил;
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, -NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
каждый Y5 независимо представляет собой O, S, необязательно замещенный алкилен (например, метилен) или необязательно замещенный гетероалкилен;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные).
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (Ie):
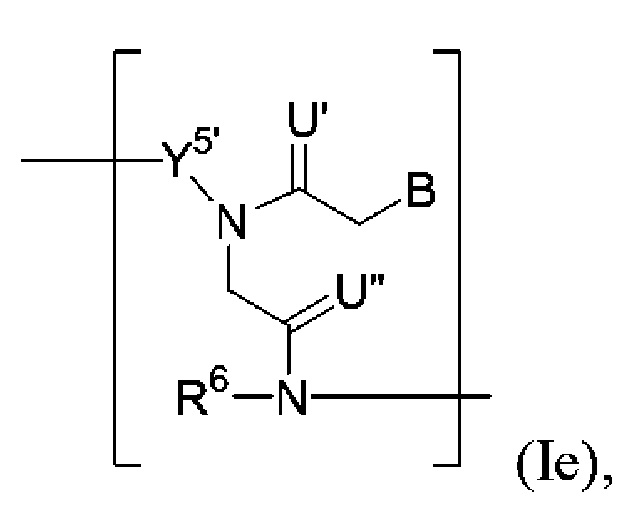
где каждый из U’ и U" независимо представляет собой O, S, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил;
каждый R6 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил;
каждый Y5’ независимо представляет собой O, S, необязательно замещенный алкилен (например, метилен или этилен) или необязательно замещенный гетероалкилен;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные).
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (If) или (If-1):
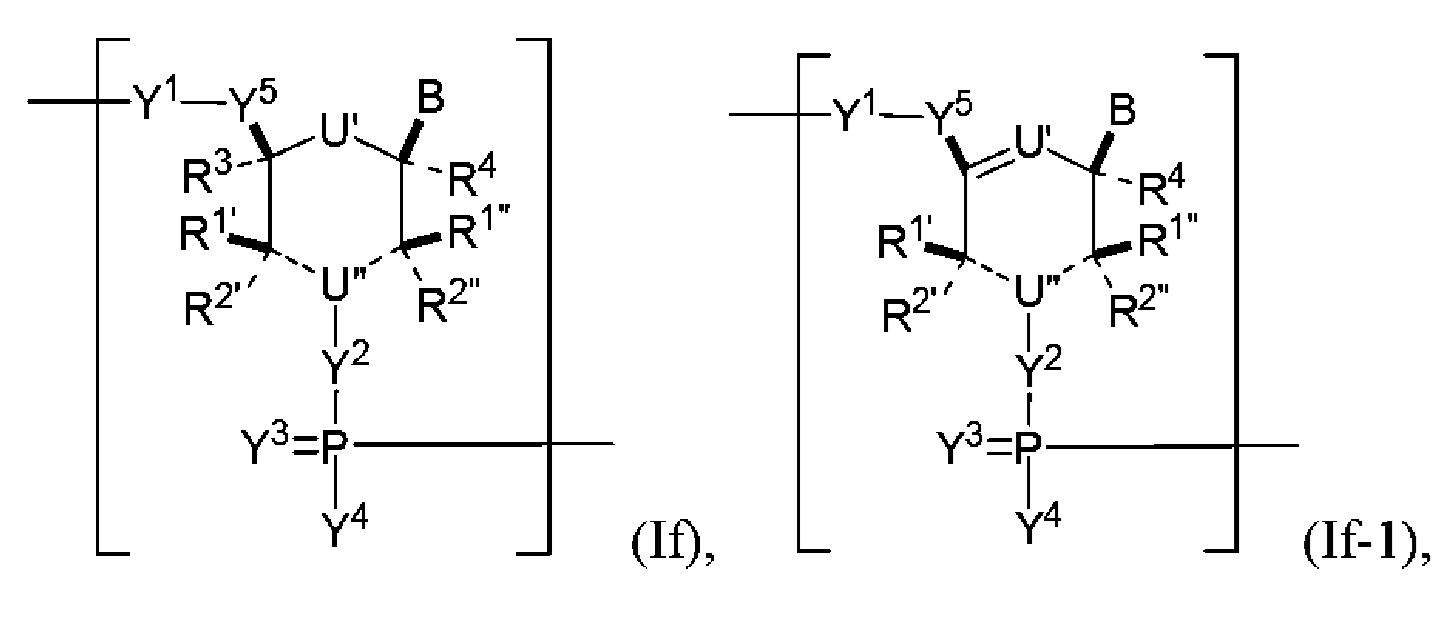
или формулу их фармацевтически приемлемой соли или их стереоизомера,
где каждый из U’ и U" независимо представляет собой O, S, N, N(RU)nu или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил (например, U’ представляет собой O и U" представляет собой N);
каждый из R1’, R2’, R1", R2", R3 и R4 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или отсутствует; и где R1’ в комбинации с R3, R1" в комбинации с R3, R2’ в комбинации с R3 или R2" в комбинации с R3, взятые вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен (например, образуя замкнутую нуклеиновую кислоту); каждый из m’ и m" независимо представляет собой целое число от 0 до 3 (например, от 0 до 2, от 0 до 1, от 1 до 3 или от 1 до 2);
каждый из Y1, Y2 и Y3 независимо представляет собой O, S, Se, -NRN1-, необязательно замещенный алкилен или необязательно замещенный гетероалкилен, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный арил или отсутствует;
каждый Y4 независимо представляет собой H, гидрокси, тиол, боранил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино;
каждый Y5 независимо представляет собой O, S, Se, необязательно замещенный алкилен (например, метилен) или необязательно замещенный гетероалкилен;
n представляет собой целое число от 1 до 100000; и
B представляет собой основание нуклеиновой кислоты (например, пурин, пиримидин или их производные).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) кольцо, включающее U, имеет одну или две двойных связи.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) каждый из R1, R1’ и R1", если присутствует, представляет собой H. В следующих вариантах осуществления каждый из R2, R2’ и R2", если присутствует, независимо представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси. В конкретных вариантах осуществления алкоксиалкокси представляет собой -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил. В некоторых вариантах осуществления s2 равно 0, s1 равно 1 или 2, s3 равно 0 или 1, и R’ представляет собой C1-6алкил.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)), каждый из R2, R2’ и R2", если присутствует, представляет собой H. В следующих вариантах осуществления каждый из R1, R1’ и R1", если присутствует, независимо представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси. В конкретных вариантах осуществления алкоксиалкокси представляет собой -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил. В некоторых вариантах осуществления s2 равно 0, s1 равно 1 или 2, s3 равно 0 или 1, и R’ представляет собой C1-6 алкил.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) каждый из R3, R4 и R5 независимо представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси. В конкретных вариантах осуществления R3 представляет собой H, R4 представляет собой H, R5 представляет собой H, или все из R3, R4 и R5 представляют собой H. В конкретных вариантах осуществления R3 представляет собой C1-6 алкил, R4 представляет собой C1-6 алкил, R5 представляет собой C1-6 алкил, или все из R3, R4 и R5 представляют собой C1-6 алкил. В конкретных вариантах осуществления оба из R3 и R4 представляют собой H, и R5 представляет собой C1-6 алкил.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) R3 и R5, связанные вместе, образуют необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил, такой как транс-3’,4’-аналоги), где R3 и R5, связанные вместе, образуют гетероалкилен (например, -(CH2)b1O(CH2)b2O(CH2)b3-, где каждый из b1, b2 и b3 независимо представляет собой целое число от 0 до 3).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) R3 и один или несколько из R1’, R1", R2′, R2" или R5, связанные вместе, образуют необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил), R3 и один или несколько из R1’, R1", R2′, R2" или R5, связанные вместе, образуют гетероалкилен (например, -(CH2)b1O(CH2)b2O(CH2)b3-, где каждый из b1, b2 и b3 независимо представляет собой целое число от 0 до 3).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) R5 и один или несколько из R1’, R1", R2′ или R2", связанные вместе, образуют необязательно замещенный алкилен или необязательно замещенный гетероалкилен и, взятые вместе с атомами углерода, к которым они присоединены, обеспечивают необязательно замещенный гетероциклил (например, бициклический, трициклический или тетрациклический гетероциклил), R5 и один или несколько из R1’, R1", R2′ или R2", связанные вместе, образуют гетероалкилен (например, -(CH2)b1O(CH2)b2O(CH2)b3-, где каждый из b1, b2 и b3 независимо представляет собой целое число от 0 до 3).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) каждый Y2 независимо представляет собой O, S или -NRN1-, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил. В конкретных вариантах осуществления Y2 представляет собой NRN1-, где RN1 представляет собой H или необязательно замещенный алкил (например, C1-6 алкил, такой как метил, этил, изопропил или н-пропил).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) каждый Y3 независимо представляет собой O или S.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) R1 представляет собой H; каждый R2 независимо представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси (например, -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, такой, где s2 равно 0, s1 равно 1 или 2, s3 равно 0 или 1 и R’ представляет собой C1-6 алкил); каждый Y2 независимо представляет собой O или -NRN1-, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил (например, где RN1 представляет собой H или необязательно замещенный алкил (например, C1-6 алкил, такой как метил, этил, изопропил или н-пропил)); и каждый Y3 независимо представляет собой O или S (например, S). В следующих вариантах осуществления R3 представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси. В следующих вариантах осуществления каждый Y1 независимо представляет собой O или -NRN1-, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил (например, где RN1 представляет собой H или необязательно замещенный алкил (например, C1-6 алкил, такой как метил, этил, изопропил или н-пропил)); и каждый Y4 независимо представляет собой H, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) каждый R1 независимо представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси (например, -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, такой, где s2 равно 0, s1 равно 1 или 2, s3 равно 0 или 1, и R’ представляет собой C1-6 алкил); R2 представляет собой H; каждый Y2 независимо представляет собой O или -NRN1-, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил (например, где RN1 представляет собой H или необязательно замещенный алкил (например, C1-6 алкил, такой как метил, этил, изопропил или н-пропил)); и каждый Y3 независимо представляет собой O или S (например, S). В следующих вариантах осуществления R3 представляет собой H, галоген (например, фтор), гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси (например, метокси или этокси) или необязательно замещенный алкоксиалкокси. В следующих вариантах осуществления каждый Y1 независимо представляет собой O или -NRN1-, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил (например, где RN1 представляет собой H или необязательно замещенный алкил (например, C1-6 алкил, такой как метил, этил, изопропил или н-пропил)); и каждый Y4 независимо представляет собой H, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный тиоалкокси, необязательно замещенный алкоксиалкокси или необязательно замещенный амино.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) кольцо, включающее U, находится в конфигурации β-D (например, β-D-рибо).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) кольцо, включающее U, находится в конфигурации α-L (например, α-L-рибо).
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)) один или несколько B не являются псевдоуридином (ψ) или 5-метилцитидином (m5C).
В некоторых вариантах осуществления от приблизительно 10% до приблизительно 100% от числа n оснований нуклеиновой кислоты B не являются ψ или m5C (например, от 10% до 20%, от 10% до 35%, от 10% до 50%, от 10% до 60%, от 10% до 75%, от 10% до 90%, от 10% до 95%, от 10% до 98%, от 10% до 99%, от 20% до 35%, от 20% до 50%, от 20% до 60%, от 20% до 75%, от 20% до 90%, от 20% до 95%, от 20% до 98%, от 20% до 99%, от 20% до 100%, от 50% до 60%, от 50% до 75%, от 50% до 90%, от 50% до 95%, от 50% до 98%, от 50% до 99%, от 50% до 100%, от 75% до 90%, от 75% до 95%, от 75% до 98%, от 75% до 99% и от 75% до 100% от числа n B не являются ψ или m5C). В некоторых вариантах осуществления B не является ψ или m5C.
В некоторых вариантах осуществления полинуклеотидов (например, формулы (Ia)-(Ia-5), (Ib)-(If-1), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr)), когда B представляет собой немодифицированное основание нуклеиновой кислоты, выбранное из цитозина, гуанина, урацила и аденина, тогда по меньшей мере один из Y1, Y2 или Y3 не является O.
В некоторых вариантах осуществления полинуклеотид включает модифицированную рибозу. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIa)-(IIc):

или формулу их фармацевтически приемлемой соли или их стереоизомера. В конкретных вариантах осуществления U представляет собой O или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил (например, U представляет собой -CH2- или -CH-). В других вариантах осуществления каждый из R1, R2, R3, R4 и R5 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или отсутствует (например, каждый R1 и R2 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил или необязательно замещенный алкокси; каждый R3 и R4 независимо представляет собой H или необязательно замещенный алкил; и R5 представляет собой H или гидрокси), и
В конкретных вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIb-1)-(IIb-2):

или формулу их фармацевтически приемлемой соли или их стереоизомера. В некоторых вариантах осуществления U представляет собой O или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил (например, U представляет собой -CH2- или -CH-). В других вариантах осуществления каждый из R1 и R2независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или отсутствует (например, каждый из R1 и R2 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил или необязательно замещенный алкокси, например, H, галоген, гидрокси, алкил или алкокси). В конкретных вариантах осуществления R2 представляет собой гидрокси или необязательно замещенный алкокси (например, метокси, этокси или любой алкокси, описанный в настоящем описании).
В конкретных вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIc-1)-(IIc-4):
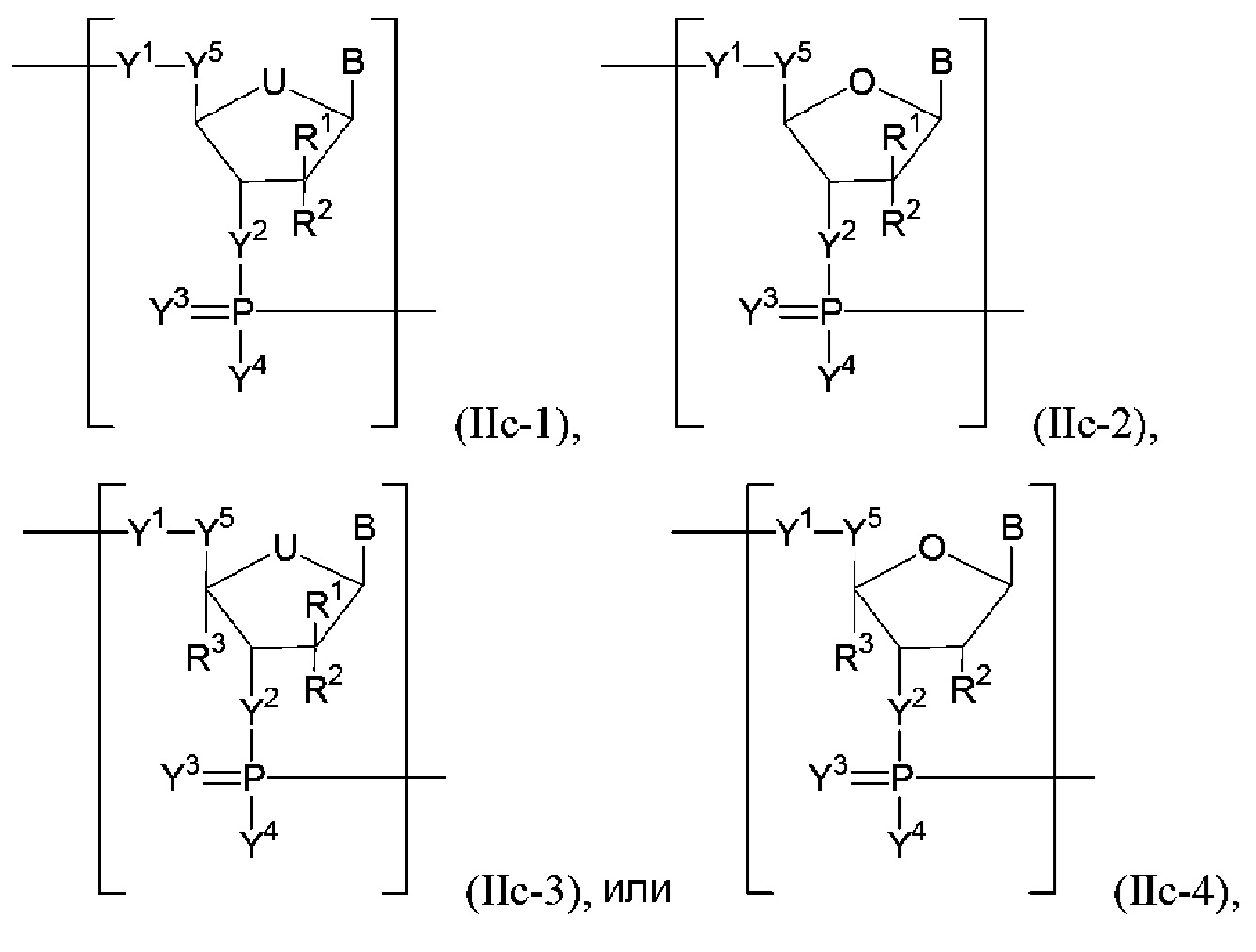
или формулу их фармацевтически приемлемой соли или их стереоизомера.
В некоторых вариантах осуществления U представляет собой O или C(RU)nu, где nu представляет собой целое число от 0 до 2 и каждый RU независимо представляет собой H, галоген или необязательно замещенный алкил (например, U представляет собой -CH2- или -CH-). В некоторых вариантах осуществления каждый из R1, R2 и R3 независимо представляет собой H, галоген, гидрокси, тиол,необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный гидроксиалкокси, необязательно замещенный амино, азидо, необязательно замещенный арил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или отсутствует (например, каждый R1 и R2 независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил или необязательно замещенный алкокси, например, H, галоген, гидрокси, алкил или алкокси; и каждый R3 независимо представляет собой H или необязательно замещенный алкил). В конкретных вариантах осуществления R2 представляет собой необязательно замещенный алкокси (например, метокси или этокси, или любой алкокси, описанный в настоящем описании). В конкретных вариантах осуществления R1 представляет собой необязательно замещенный алкил, и R2 представляет собой гидрокси. В других вариантах осуществления R1 представляет собой гидрокси, и R2 представляет собой необязательно замещенный алкил. В следующих вариантах осуществления R3 представляет собой необязательно замещенный алкил.
В некоторых вариантах осуществления полинуклеотид включает ациклическую модифицированную рибозу. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IId)-(IIf):
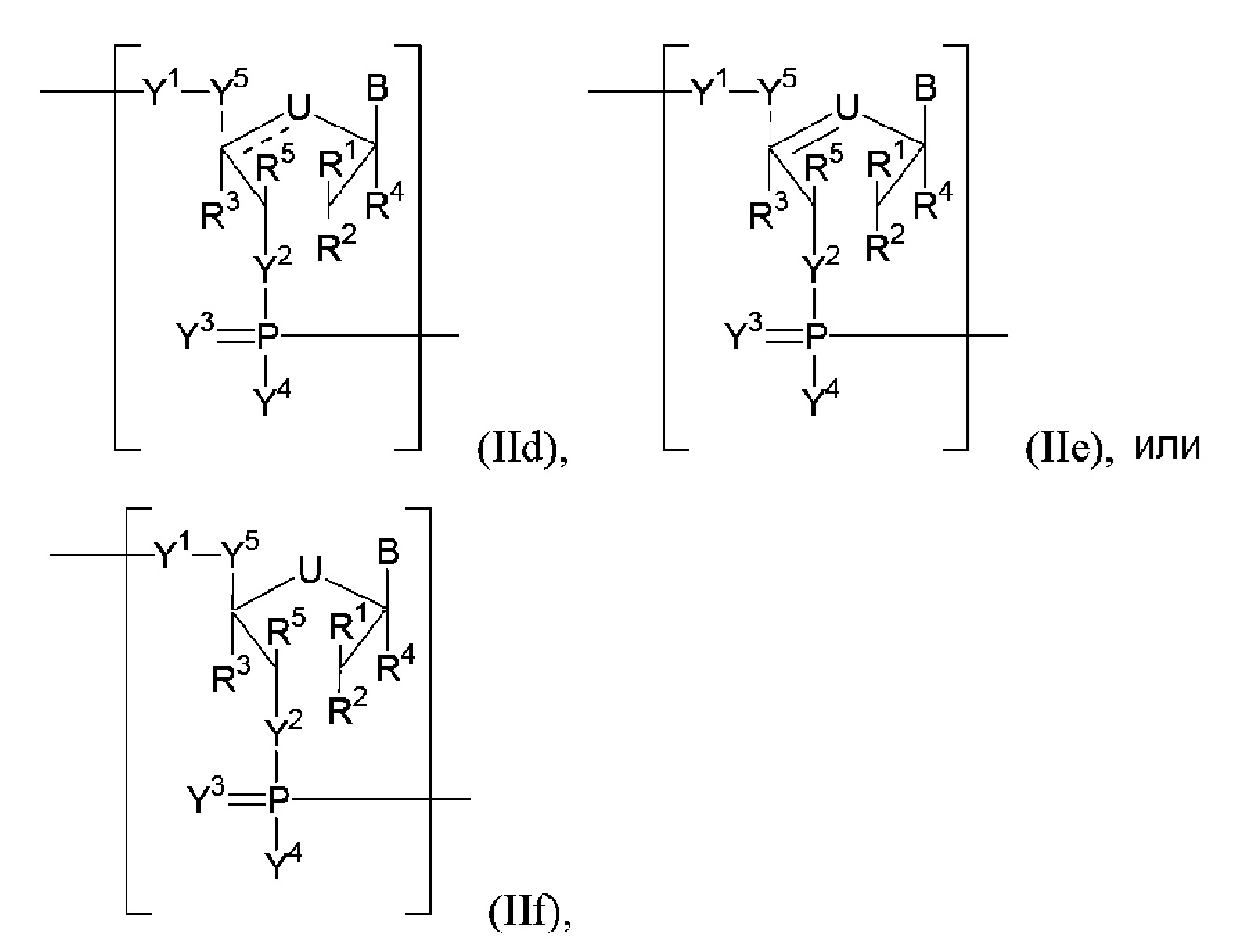
или формулу их фармацевтически приемлемой соли или их стереоизомера.
В некоторых вариантах осуществления полинуклеотид включает ациклический модифицированный гексит. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIg)-(IIj):
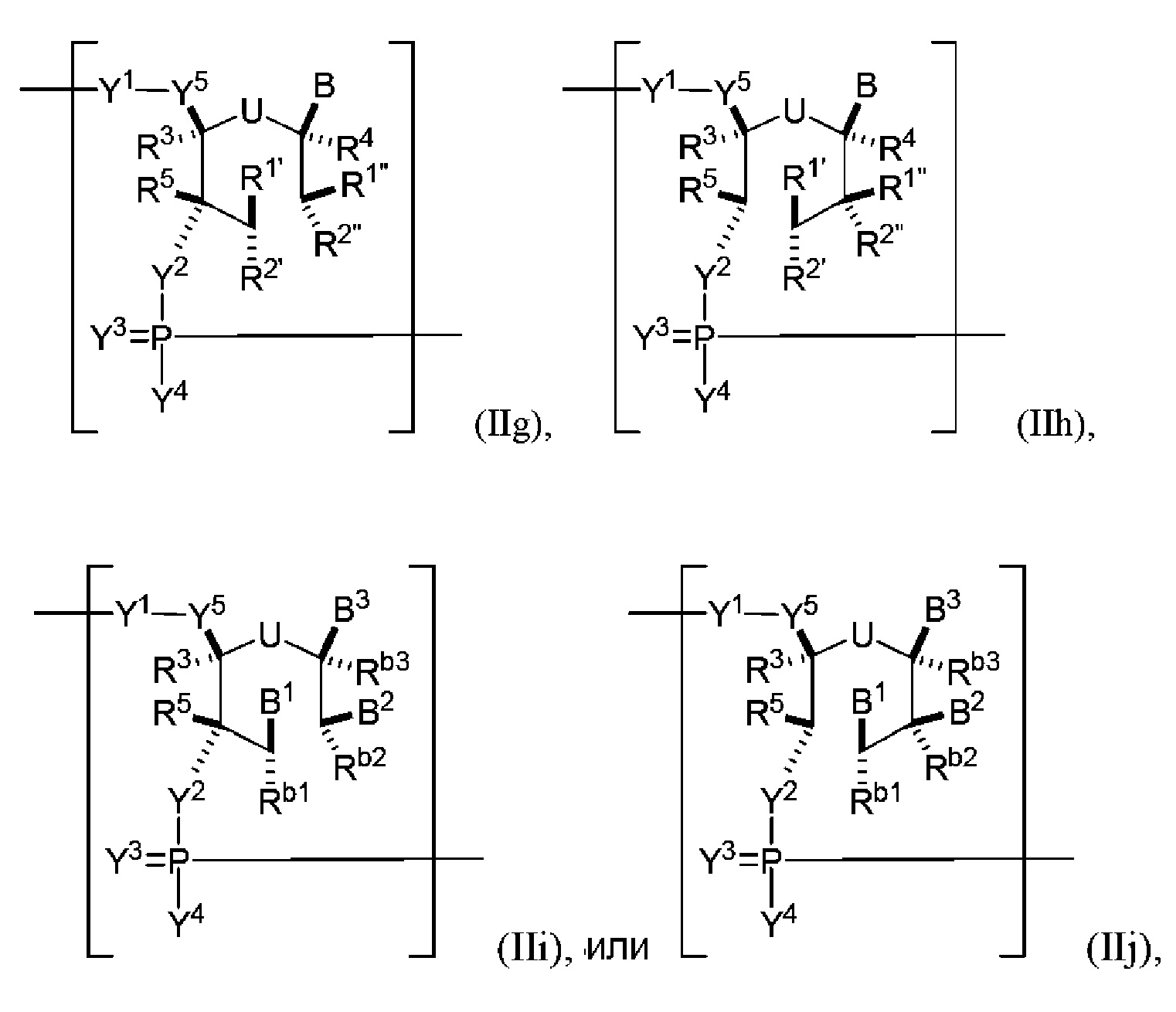
или формулу их фармацевтически приемлемой соли или их стереоизомера.
В некоторых вариантах осуществления полинуклеотид включает сахарную часть, имеющую уменьшенное или расширенное кольцо рибозы. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIk)-(IIm):
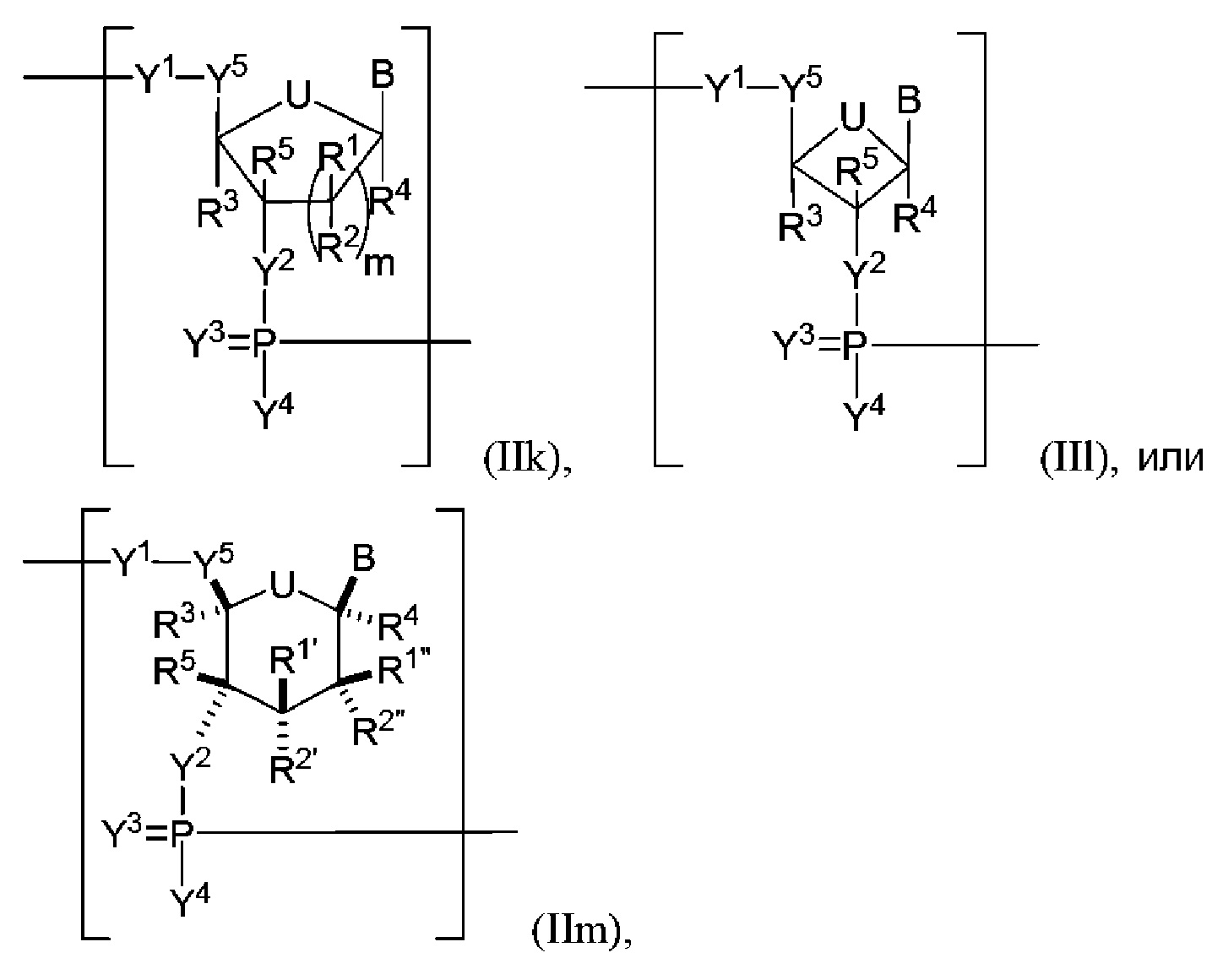
или формулу их фармацевтически приемлемой соли или их стереоизомера, где каждый из R1’, R1", R2’ и R2" независимо представляет собой H, галоген, гидрокси, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси или отсутствует; и где R2’ в комбинации с R3 или R2" в комбинации с R3, взятые вместе, могут образовывать необязательно замещенный алкилен или необязательно замещенный гетероалкилен.
В некоторых вариантах осуществления полинуклеотид включает замкнутую модифицированную рибозу. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIn):
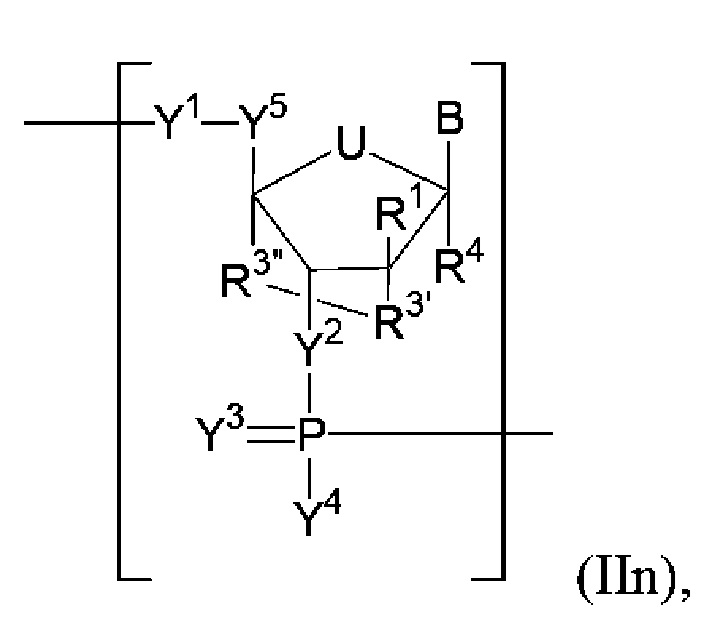
В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIn-1)-(II-n2):
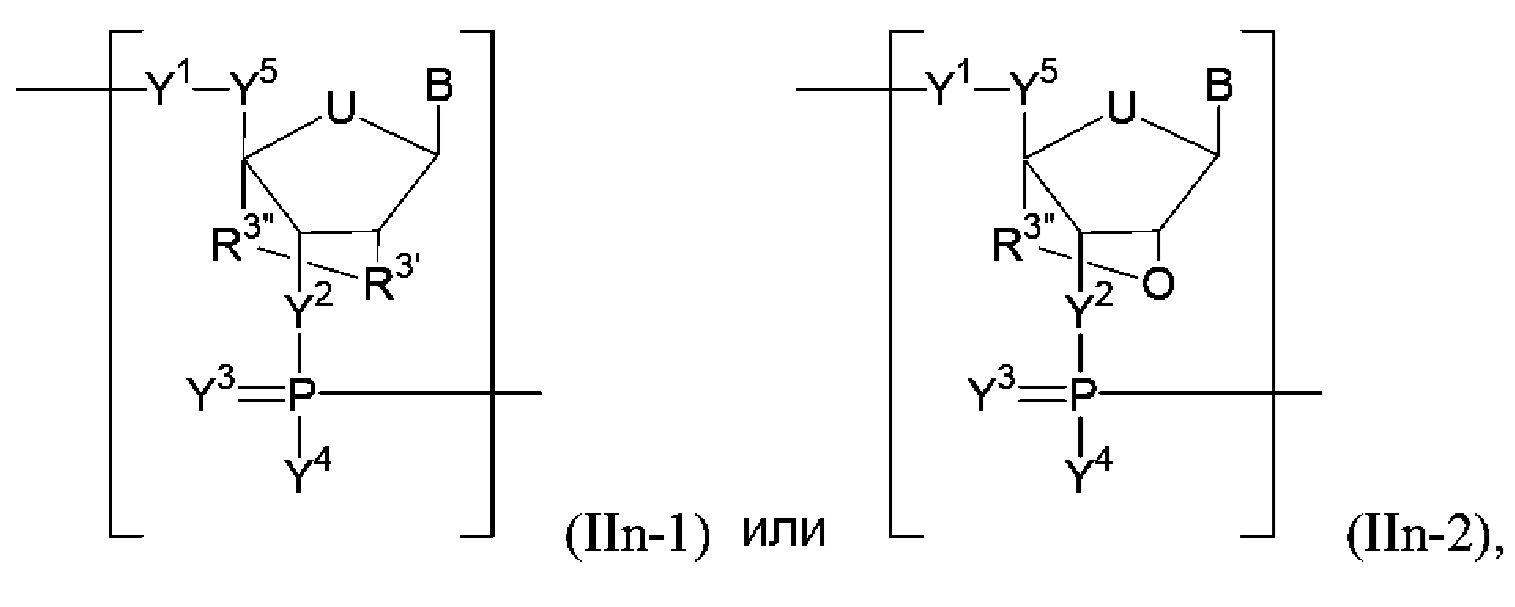
или формулу их фармацевтически приемлемой соли или их стереоизомера, где R3’ представляет собой O, S или -NRN1-, где RN1 представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный арил, и R3" представляет собой необязательно замещенный алкилен (например -CH2-, -CH2CH2- или -CH2CH2CH2-) или необязательно замещенный гетероалкилен (например -CH2NH-, -CH2CH2NH-, -CH2OCH2- или -CH2CH2OCH2-) (например, R3’ представляет собой O и R3" представляет собой необязательно замещенный алкилен (например -CH2-, -CH2CH2- или -CH2CH2CH2-)).
В некоторых вариантах осуществления полинуклеотид включает замкнутую модифицированную рибозу, которая образует тетрациклический гетероциклил. В некоторых вариантах осуществления полинуклеотид (например, первая область, первая фланкирующая область или вторая фланкирующая область) включает число n связанных нуклеозидов, имеющих формулу (IIo):
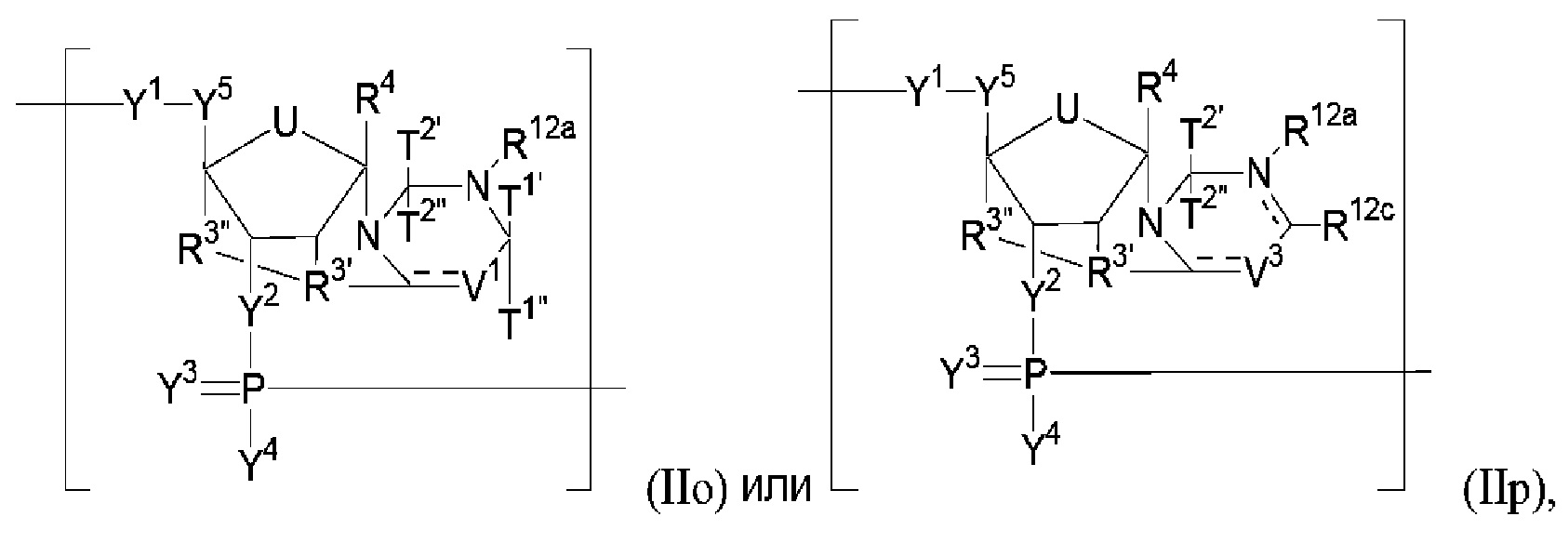
или формулу их фармацевтически приемлемой соли или их стереоизомера, где R12a, R12c, T1’, T1", T2’, T2", V1 и V3 являются такими, как описано в настоящем описании.
Любая из формул для полинуклеотидов может включать одно или несколько оснований нуклеиновой кислоты, описанных в настоящем описании (например, формулы (b1)-(b43)).
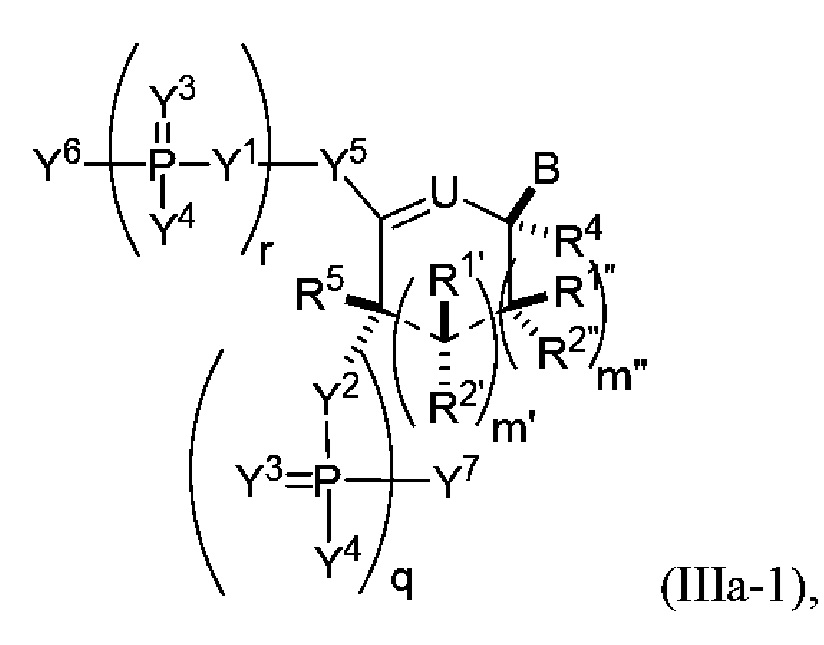
В одном варианте осуществления настоящее изобретение относится к способам получения полинуклеотида, содержащего по меньшей мере один нуклеотид, который нарушает связывание взаимодействующего с большой бороздкой партнера с нуклеиновой кислотой, где полинуклеотид содержит число n нуклеозидов, имеющих формулу (Ia), как определено в настоящем описании:
причем способ включает реакцию соединения формулы (IIIa), как определено в настоящем описании:
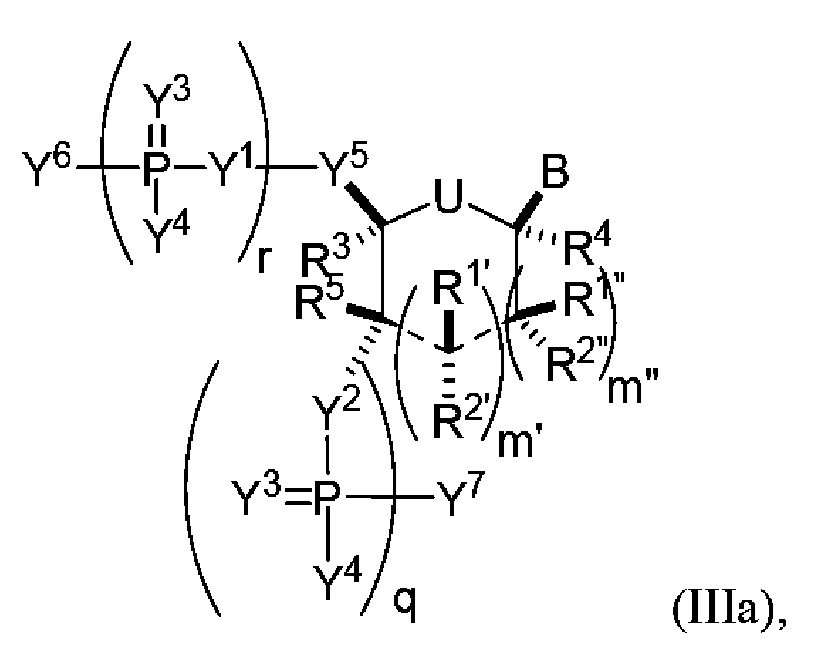
с РНК-полимеразой и кДНК-матрицей.
В следующем варианте осуществления настоящее изобретение относится к способам амплификации полинуклеотида, содержащего по меньшей мере один нуклеотид, который нарушает связывание связывающегося с большой бороздкой партнера с полинуклеотидной последовательностью, причем способ включает: реакцию соединения формулы (IIIa), как определено в настоящем описании, с праймером, кДНК-матрицей и РНК-полимеразой.
В одном варианте осуществления настоящее изобретение относится к способам получения полинуклеотида, содержащего по меньшей мере один нуклеотид, который нарушает связывание взаимодействующего с большой бороздкой партнера с нуклеиновой кислотой, где полинуклеотид содержит число n нуклеозидов, имеющих формулу (Ia-1), как определено в настоящем описании:
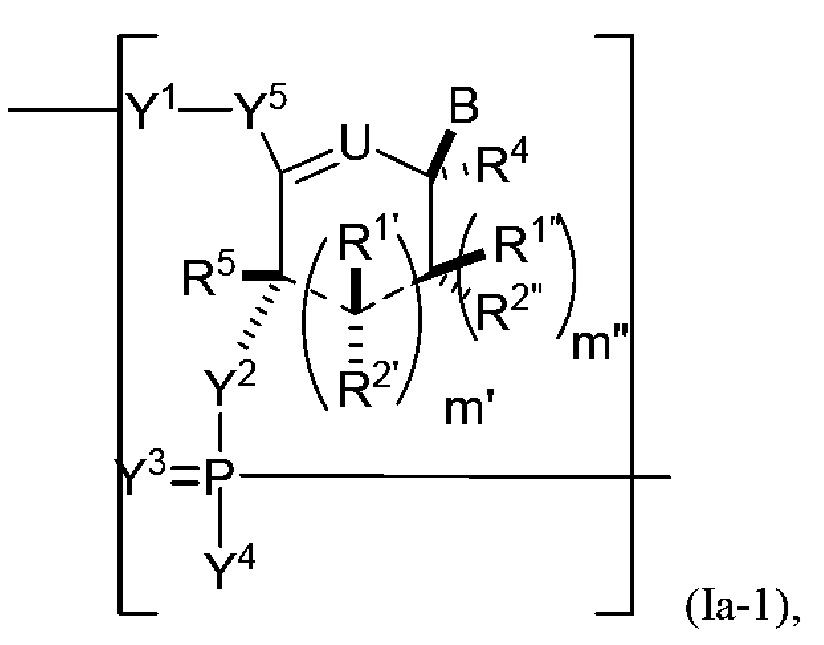
В следующем варианте осуществления настоящее изобретение относится к способам амплификации полинуклеотида, содержащего по меньшей мере один нуклеотид (например, модифицированную молекулу мРНК), который нарушает связывание связывающегося с большой бороздкой партнера с полинуклеотидной последовательностью, причем способ включает: реакцию соединения формулы (IIIa-1), как определено в настоящем описании, с праймером, кДНК-матрицей и РНК-полимеразой.
В одном варианте осуществления настоящее изобретение относится к способам получения полинуклеотида, содержащего по меньшей мере один нуклеотид, который нарушает связывание взаимодействующего с большой бороздкой партнера с последовательностью нуклеиновой кислоты, где полинуклеотид содержит число n нуклеозидов, имеющих формулу (Ia-2), как определено в настоящем описании:

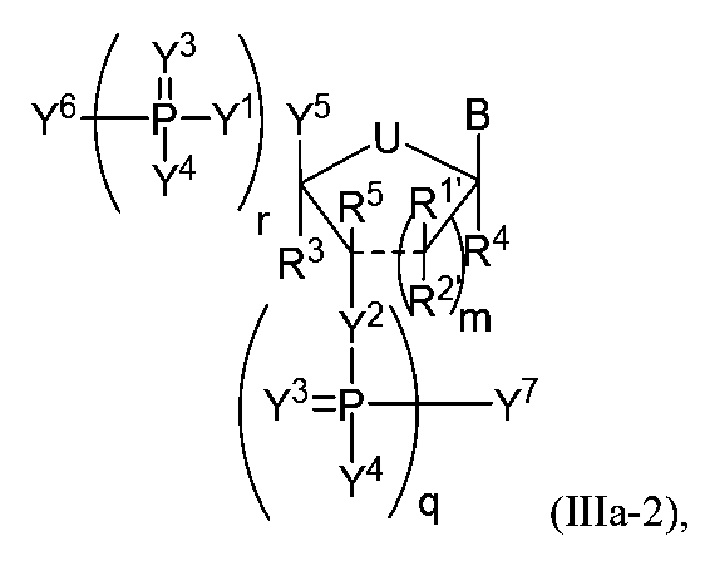
В следующем варианте осуществления настоящее изобретение относится к способам амплификации полинуклеотида, содержащего по меньшей мере один нуклеотид (например, модифицированную молекулу мРНК), который нарушает связывание связывающегося с большой бороздкой партнера с полинуклеотидом, причем способ включает реакцию соединения формулы (IIIa-2), как определено в настоящем описании, с праймером, кДНК-матрицей и РНК-полимеразой.
В некоторых вариантах осуществления реакцию можно повторять от 1 до приблизительно 7000 раз. В любом из вариантов осуществления, описанных в настоящем описании, B может представлять собой основание нуклеиновой кислоты формулы (b1)-(b43).
Полинуклеотиды необязательно могут включать 5′- и/или 3′-фланкирующие области, которые описаны в настоящем описании.
Модифицированные нуклеотиды и нуклеозиды
Настоящее изобретение также включает структурные элементы, например, модифицированные рибонуклеозиды, модифицированные рибонуклеотиды, полинуклеотидов, например, модифицированных молекул РНК (или мРНК). Например, эти структурные элементы могут быть пригодными для получения полинуклеотидов по изобретению.
В некоторых вариантах осуществления структурный элемент имеет формулу (IIIa) или (IIIa-1):
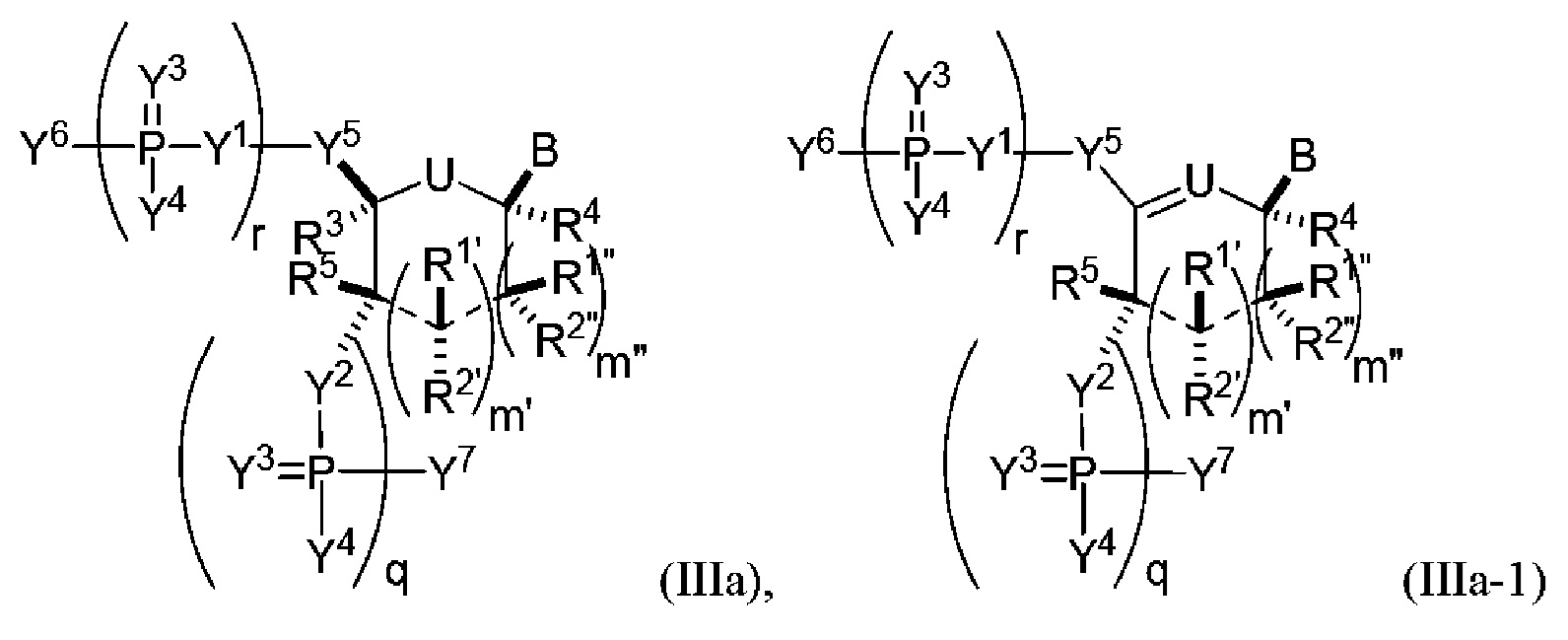
или формулу его фармацевтически приемлемой соли или его стереоизомера, где заместители являются такими, как описано в настоящем описании (например, для формулы (Ia) и (Ia-1)), и где когда B представляет собой немодифицированное основание нуклеиновой кислоты, выбранное из цитозина, гуанина, урацила и аденина, тогда по меньшей мере один из Y1, Y2 или Y3 не является O.
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (IVa)-(IVb):
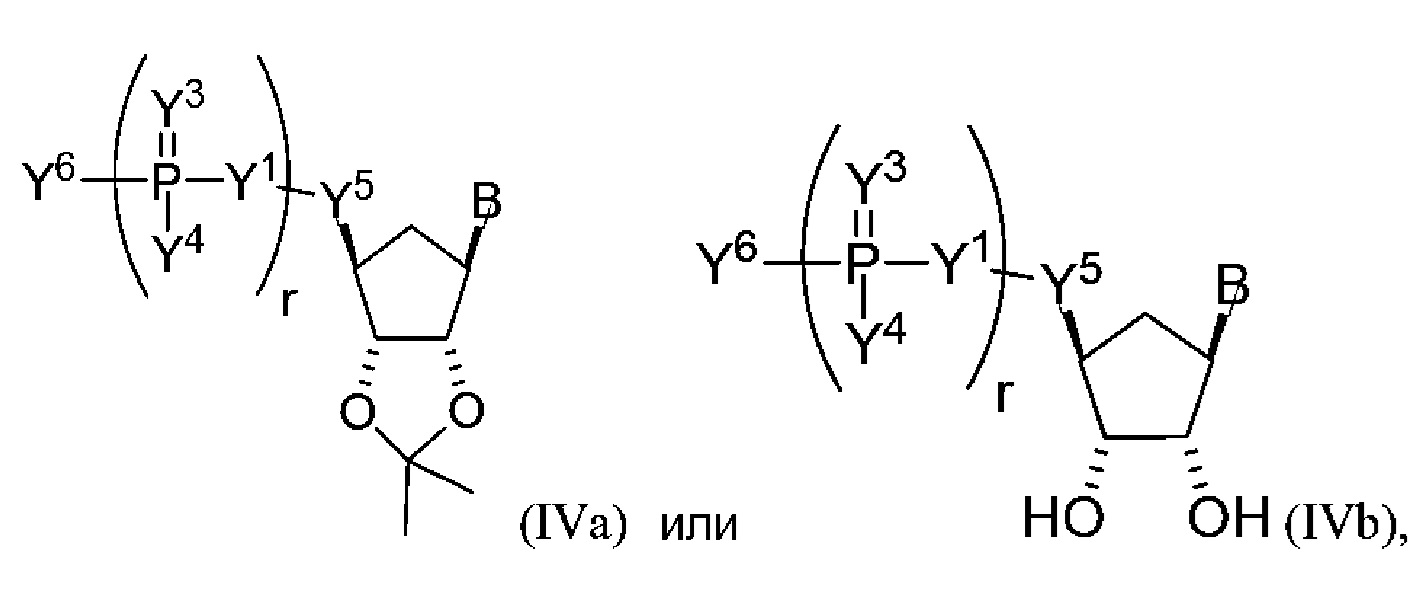
или формулу их фармацевтически приемлемой соли или их стереоизомера, где B является таким, как описано в настоящем описании (например, любой из (b1)-(b43)).
В конкретных вариантах осуществления формулу (IVa) или (IVb) комбинируют с модифицированным урацилом (например, любой из формул (b1)-(b9), (b21)-(b23) и (b28)-(b31), такой как формулы (b1), (b8), (b28), (b29) или (b30)). В конкретных вариантах осуществления формулу (IVa) или (IVb) комбинируют с модифицированным цитозином (например, любой из формул (b10)-(b14), (b24), (b25) и (b32)-(b36), такой как формула (b10) или (b32)). В конкретных вариантах осуществления формулу (IVa) или (IVb) комбинируют с модифицированным гуанином (например, любой из формул (b15)-(b17) и (b37)-(b40)). В конкретных вариантах осуществления формулу (IVa) или (IVb) комбинируют с модифицированным аденином (например, любой из формул (b18)-(b20) и (b41)-(b43)).
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (IVc)-(IVk):
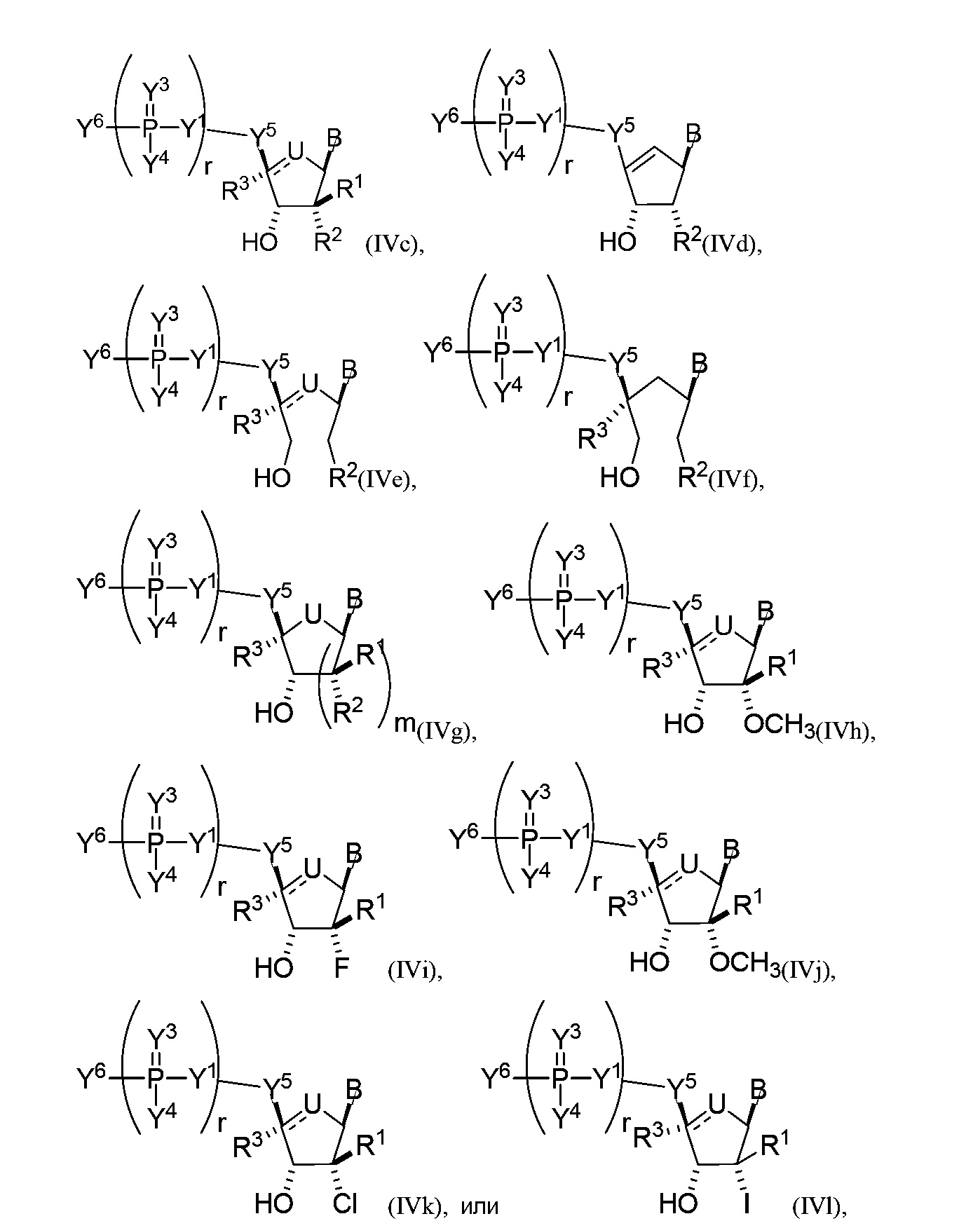
или формулу их фармацевтически приемлемой соли или их стереоизомера, где B является таким, как описано в настоящем описании (например, любой из (b1)-(b43)).
В конкретных вариантах осуществления одно из соединений формул (IVc)-(IVk) комбинируют с модифицированным урацилом (например, любая из формул (b1)-(b9), (b21)-(b23) и (b28)-(b31), такая как формула (b1), (b8), (b28), (b29) или (b30)).
В конкретных вариантах осуществления одно из соединений формул (IVc)-(IVk) комбинируют с модифицированным цитозином (например, любая из формул (b10)-(b14), (b24), (b25) и (b32)-(b36), такая как формула (b10) или (b32)).
В конкретных вариантах осуществления одно из соединений формул (IVc)-(IVk) комбинируют с модифицированным гуанином (например, любая из формул (b15)-(b17) и (b37)-(b40)).
В конкретных вариантах осуществления одно из соединений формул (IVc)-(IVk) комбинируют с модифицированным аденином (например, любая из формул (b18)-(b20) и (b41)-(b43)).
В других вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (Va) или (Vb):
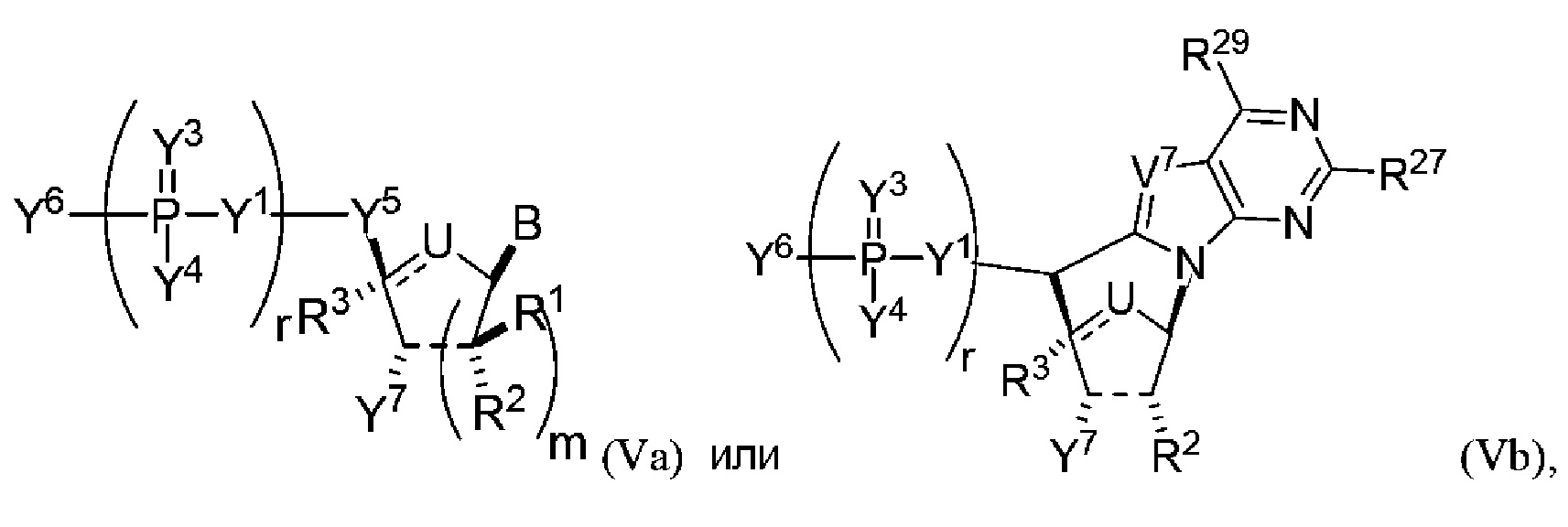
или формулу их фармацевтически приемлемой соли или их стереоизомера, где B является таким, как описано в настоящем описании (например, любой из (b1)-(b43)).
В других вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (IXa)-(IXd):
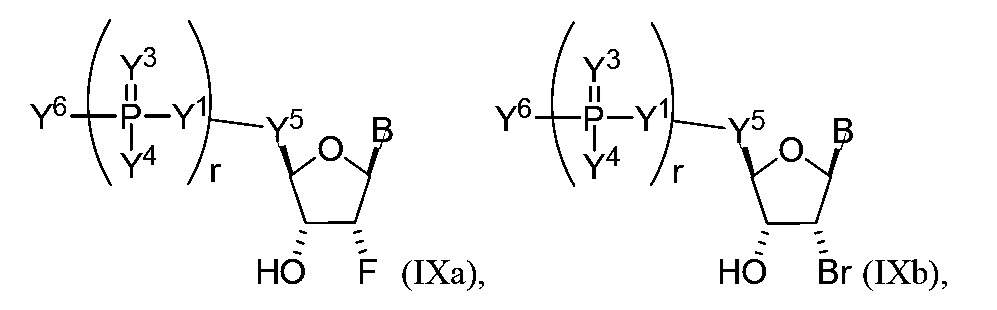
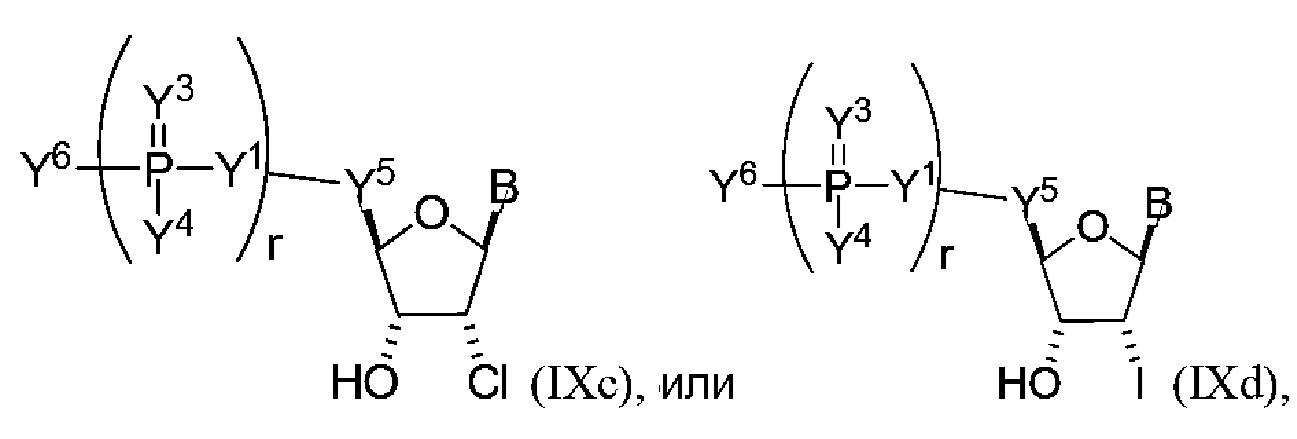
или формулу их фармацевтически приемлемой соли или их стереоизомера, где B является таким, как описано в настоящем описании (например, любой из (b1)-(b43)).
В конкретных вариантах осуществления любое из соединений формул (IXa)-(IXd) комбинируют с модифицированным урацилом (например, любая из формул (b1)-(b9), (b21)-(b23) и (b28)-(b31), такая как формула (b1), (b8), (b28), (b29) или (b30)). В конкретных вариантах осуществления одно из соединений формул (IXa)-(IXd) комбинируют с модифицированным цитозином (например, любая из формул (b10)-(b14), (b24), (b25) и (b32)-(b36), такая как формула (b10) или (b32)).
В конкретных вариантах осуществления одно из соединений формул (IXa)-(IXd) комбинируют с модифицированным гуанином (например, любая из формул (b15)-(b17) и (b37)-(b40)).
В конкретных вариантах осуществления одно из соединений формул (IXa)-(IXd) комбинируют с модифицированным аденином (например, любая из формул (b18)-(b20) и (b41)-(b43)).
В других вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (IXe)-(IXg):

или формулу их фармацевтически приемлемой соли или их стереоизомера, где B является таким, как описано в настоящем описании (например, любой из (b1)-(b43)).
В конкретных вариантах осуществления одно из соединений формул (IXe)-(IXg) комбинируют с модифицированным урацилом (например, любая из формул (b1)-(b9), (b21)-(b23) и (b28)-(b31), такая как формула (b1), (b8), (b28), (b29) или (b30)).
В конкретных вариантах осуществления одну из формул (IXe)-(IXg) комбинируют с модифицированным цитозином (например, любая из формул (b10)-(b14), (b24), (b25) и (b32)-(b36), такая как формула (b10) или (b32)).
В конкретных вариантах осуществления одно из соединений формулы (IXe)-(IXg) комбинируют с модифицированным гуанином (например, любая из формул (b15)-(b17) и (b37)-(b40)).
В конкретных вариантах осуществления одно из соединений формул (IXe)-(IXg) комбинируют с модифицированным аденином (например, любая из формул (b18)-(b20) и (b41)-(b43)).
В других вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (IXh)-(IXk):
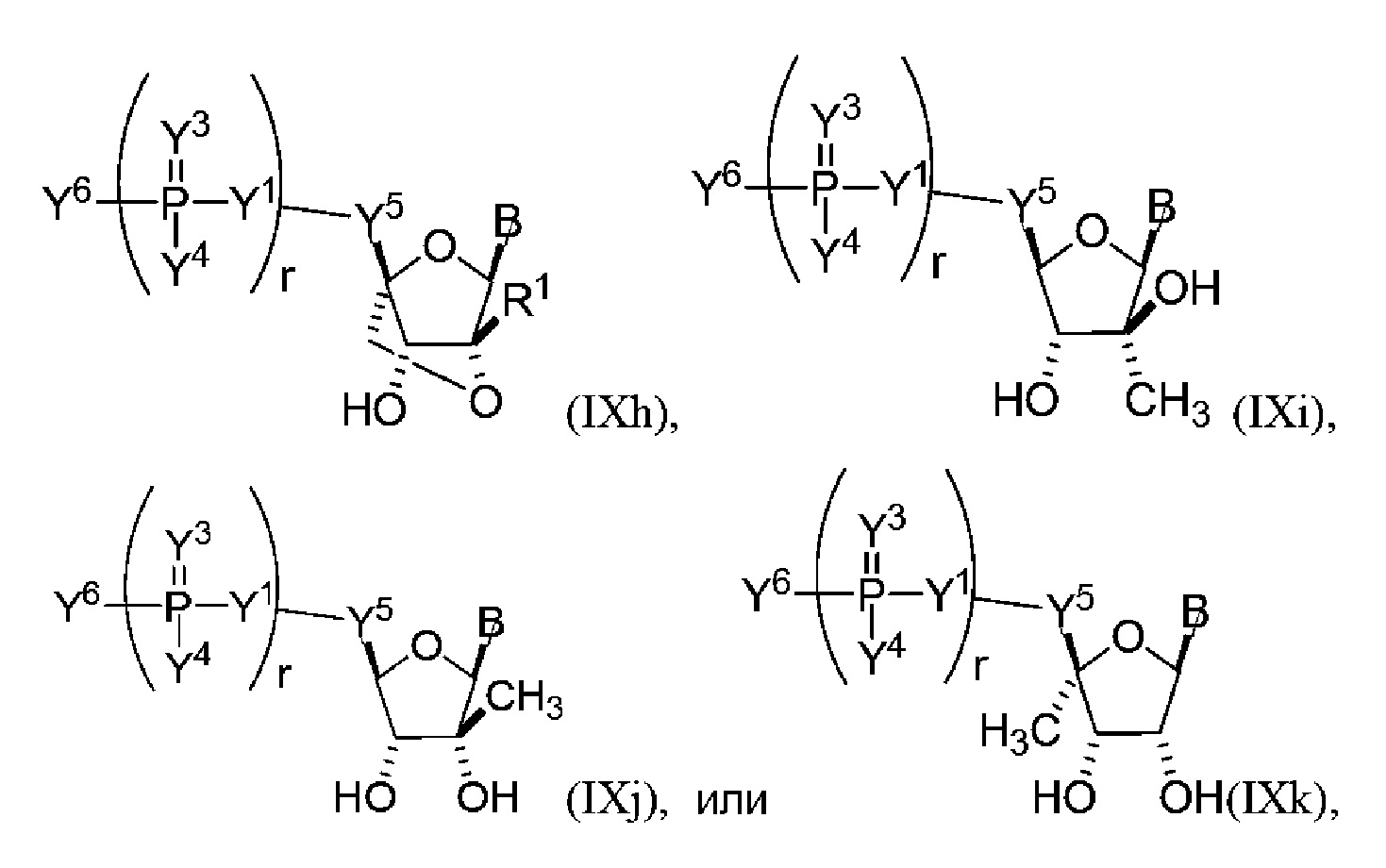
или формулу их фармацевтически приемлемой соли или их стереоизомера, где B является таким, как описано в настоящем описании (например, любая из (b1)-(b43)). В конкретных вариантах осуществления одно из соединений формул (IXh)-(IXk) комбинируют с модифицированным урацилом (например, любая из формул (b1)-(b9), (b21)-(b23) и (b28)-(b31), такая как формула (b1), (b8), (b28), (b29) или (b30)). В конкретных вариантах осуществления одно из соединений формул (IXh)-(IXk) комбинируют с модифицированным цитозином (например, любая из формул (b10)-(b14), (b24), (b25) и (b32)-(b36), такая как формула (b10) или (b32)).
В конкретных вариантах осуществления одно из соединений формул (IXh)-(IXk) комбинируют с модифицированным гуанином (например, любая из формул (b15)-(b17) и (b37)-(b40)). В конкретных вариантах осуществления одно из соединений формул (IXh)-(IXk) комбинируют с модифицированным аденином (например, любая из формул (b18)-(b20) и (b41)-(b43)).
В других вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, имеет формулу (IXl)-(IXr):
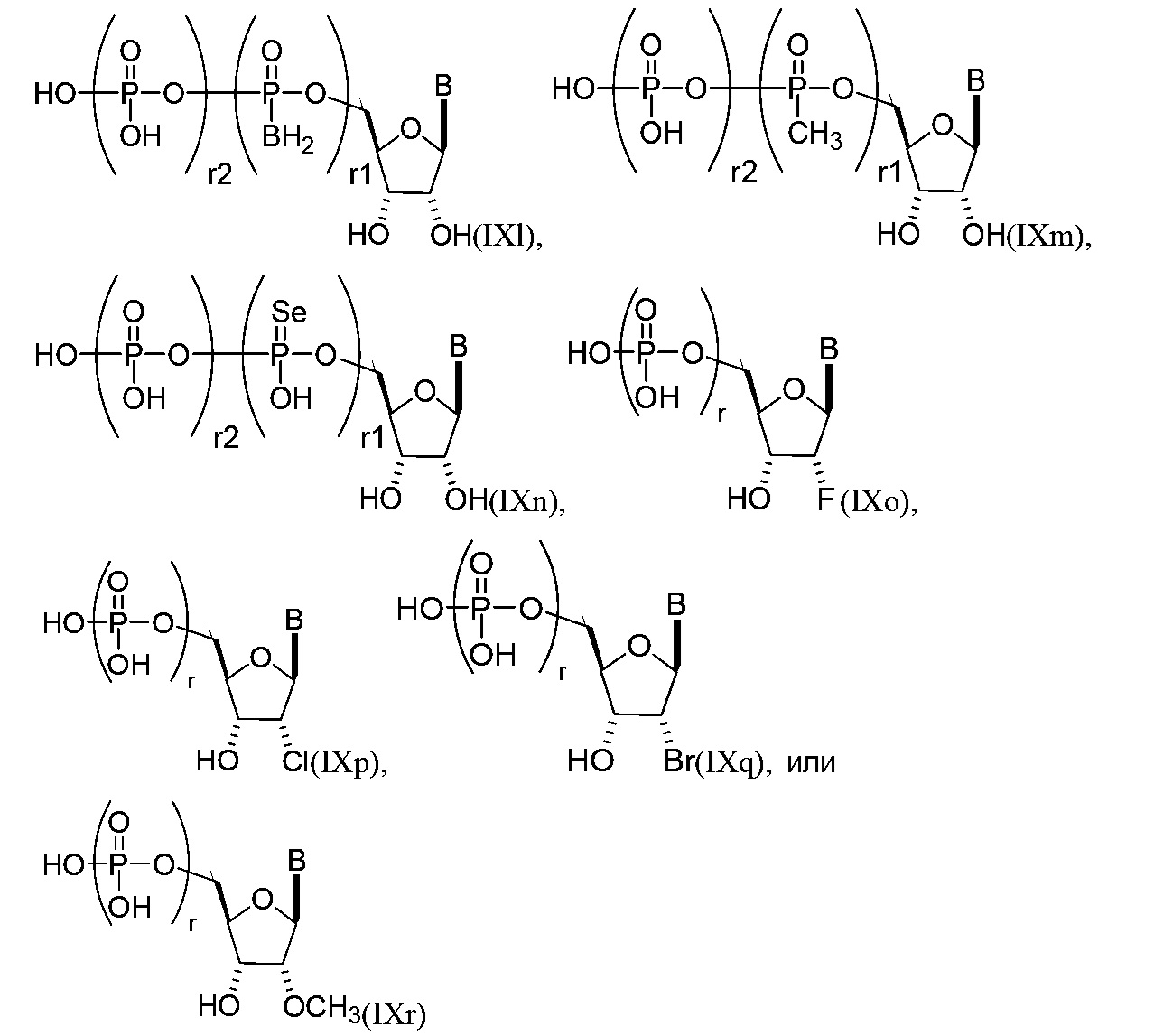
или формулу их фармацевтически приемлемой соли или их стереоизомера, где каждый r1 и r2 независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5) и B является таким, как описано в настоящем описании (например, любой из (b1)-(b43)).
В конкретных вариантах осуществления одно из соединений формул (IXl)-(IXr) комбинируют с модифицированным урацилом (например, любая из формул (b1)-(b9), (b21)-(b23) и (b28)-(b31), такая как формула (b1), (b8), (b28), (b29) или (b30)).
В конкретных вариантах осуществления одно из соединений формул (IXl)-(IXr) комбинируют с модифицированным цитозином (например, любая из формул (b10)-(b14), (b24), (b25) и (b32)-(b36), такая как формула (b10) или (b32)).
В конкретных вариантах осуществления одно из соединений формул (IXl)-(IXr) комбинируют с модифицированным гуанином (например, любая из формул (b15)-(b17) и (b37)-(b40)). В конкретных вариантах осуществления одно из соединений формул (IXl)-(IXr) комбинируют с модифицированным аденином (например, любая из формул (b18)-(b20) и (b41)-(b43)).
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, может быть выбрана из группы, состоящей из:

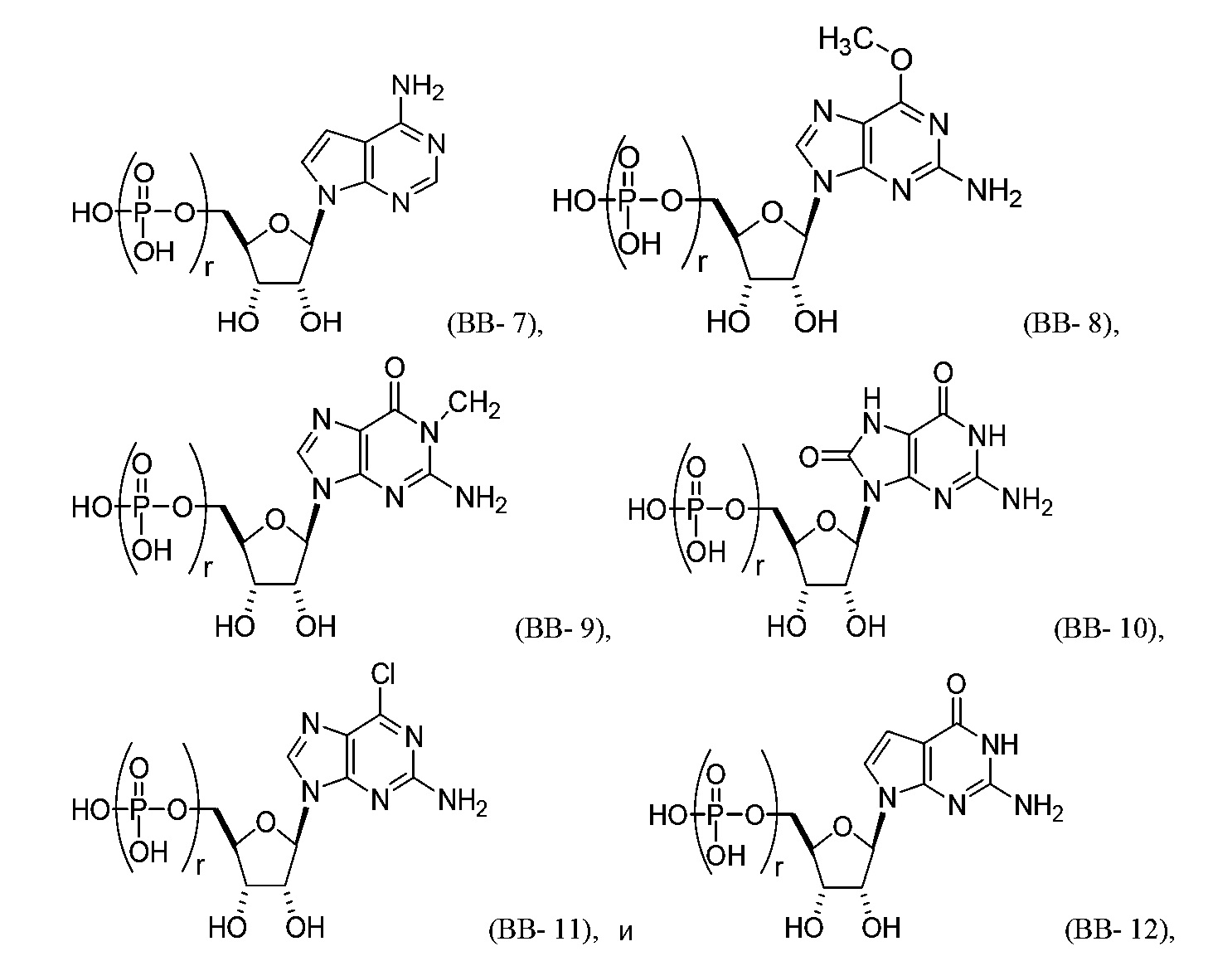
или их фармацевтически приемлемой соли или их стереоизомера, где каждый r независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5).
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, может быть выбрана из группы, состоящей из:
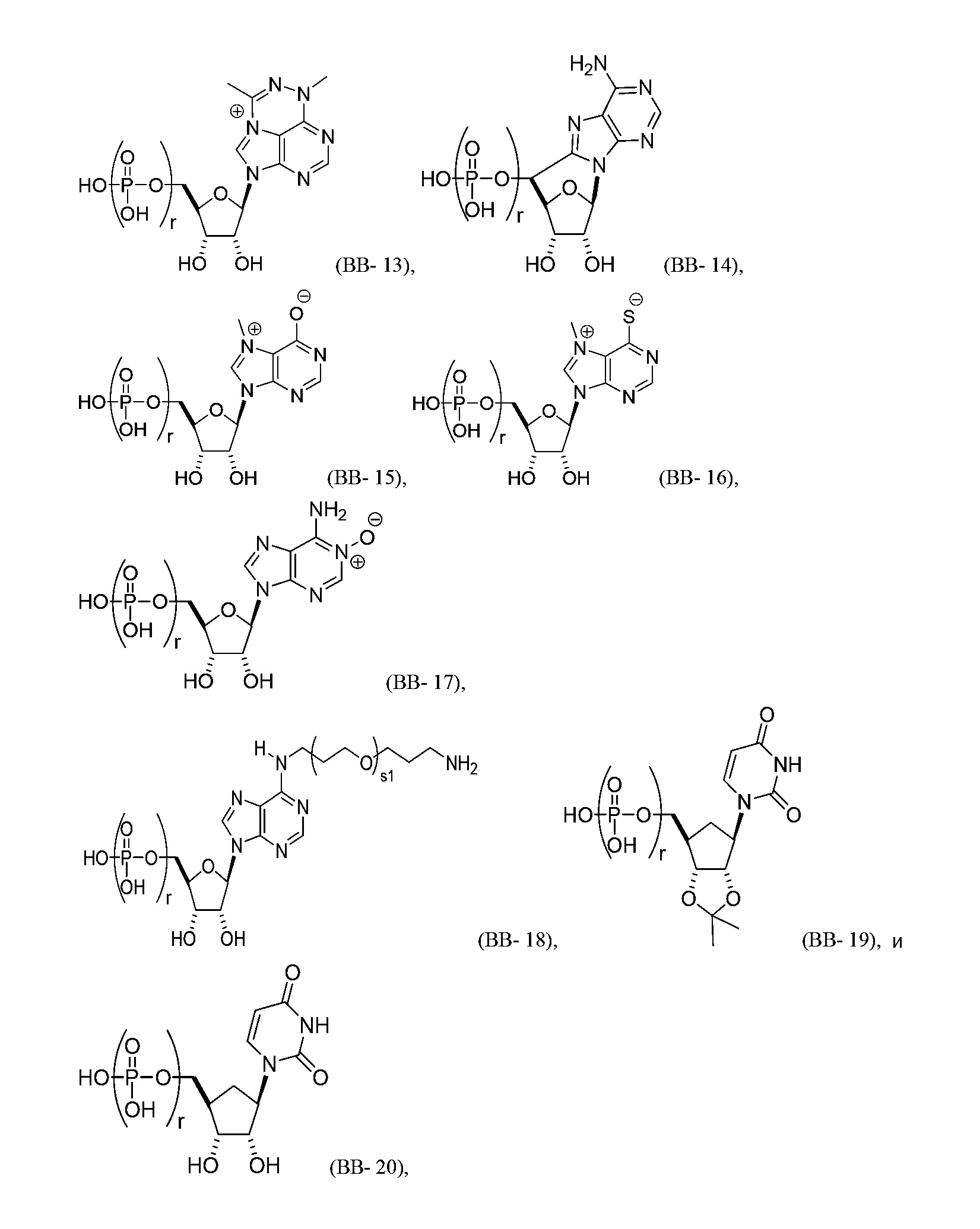
или их фармацевтически приемлемой соли или их стереоизомера, где каждый r независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5) и s1 является таким, как описано в настоящем описании.
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в нуклеиновую кислоту (например, РНК, мРНК, полинуклеотид), представляет собой модифицированный уридин (например, выбранный из группы, состоящей из:
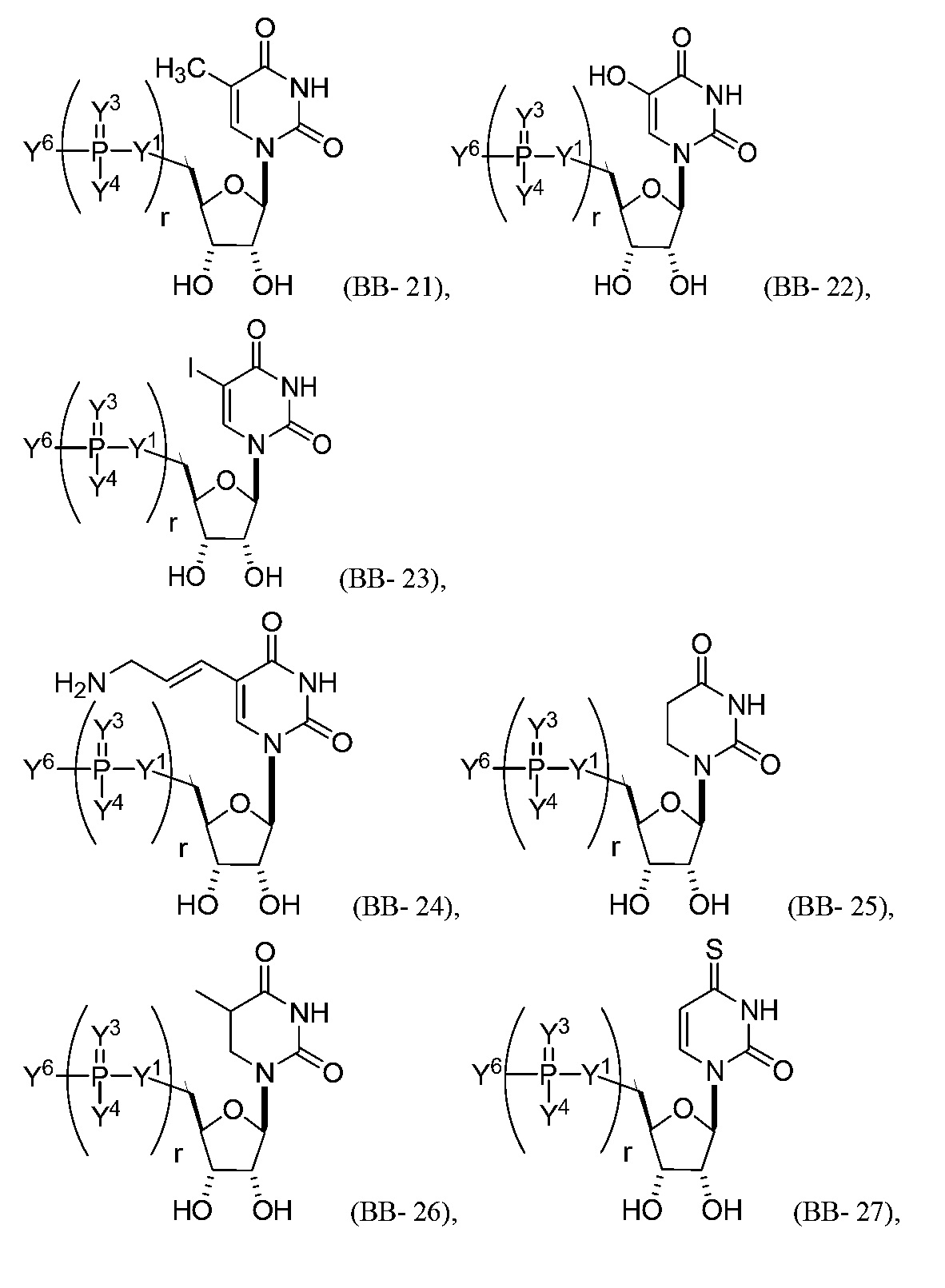
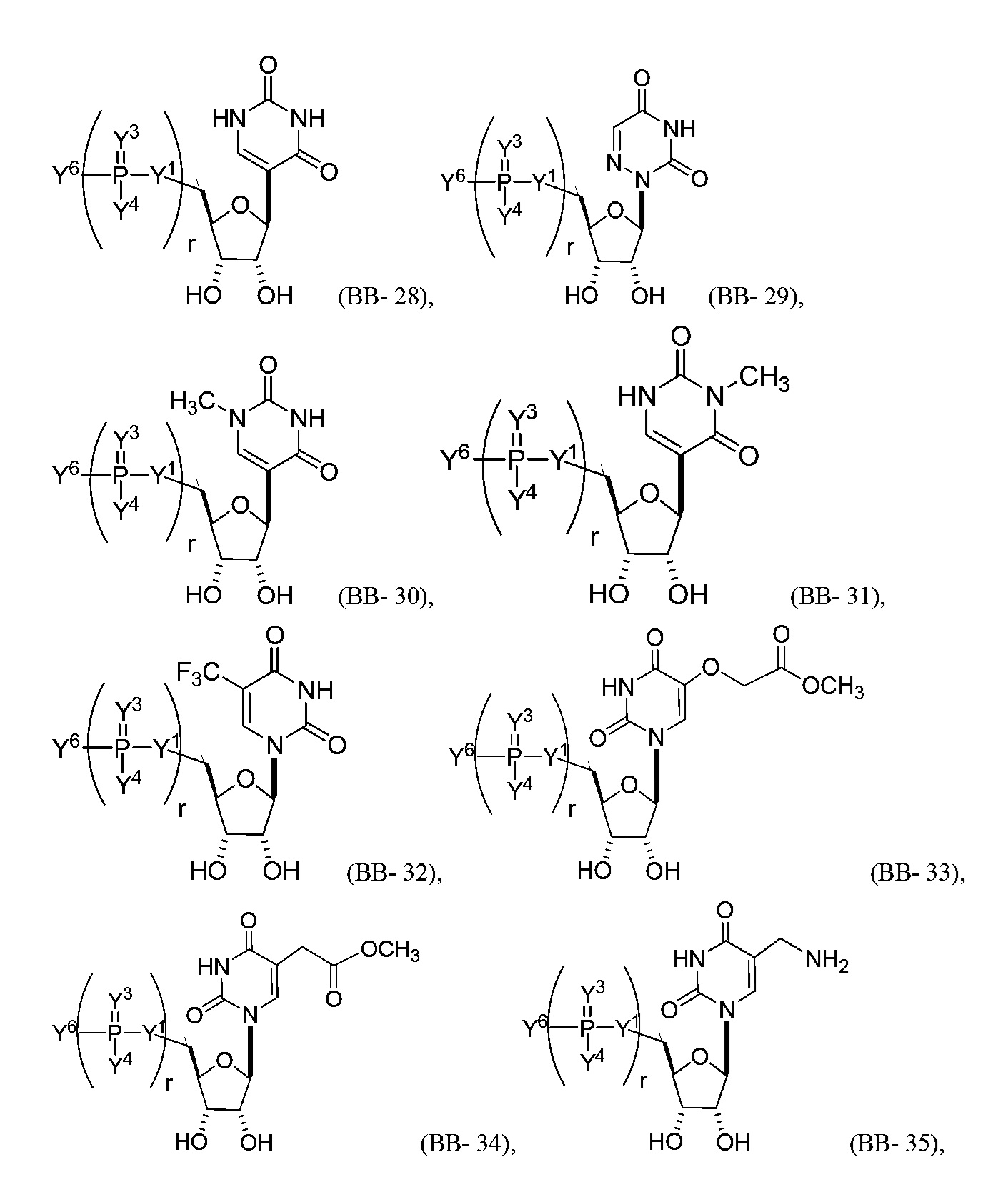
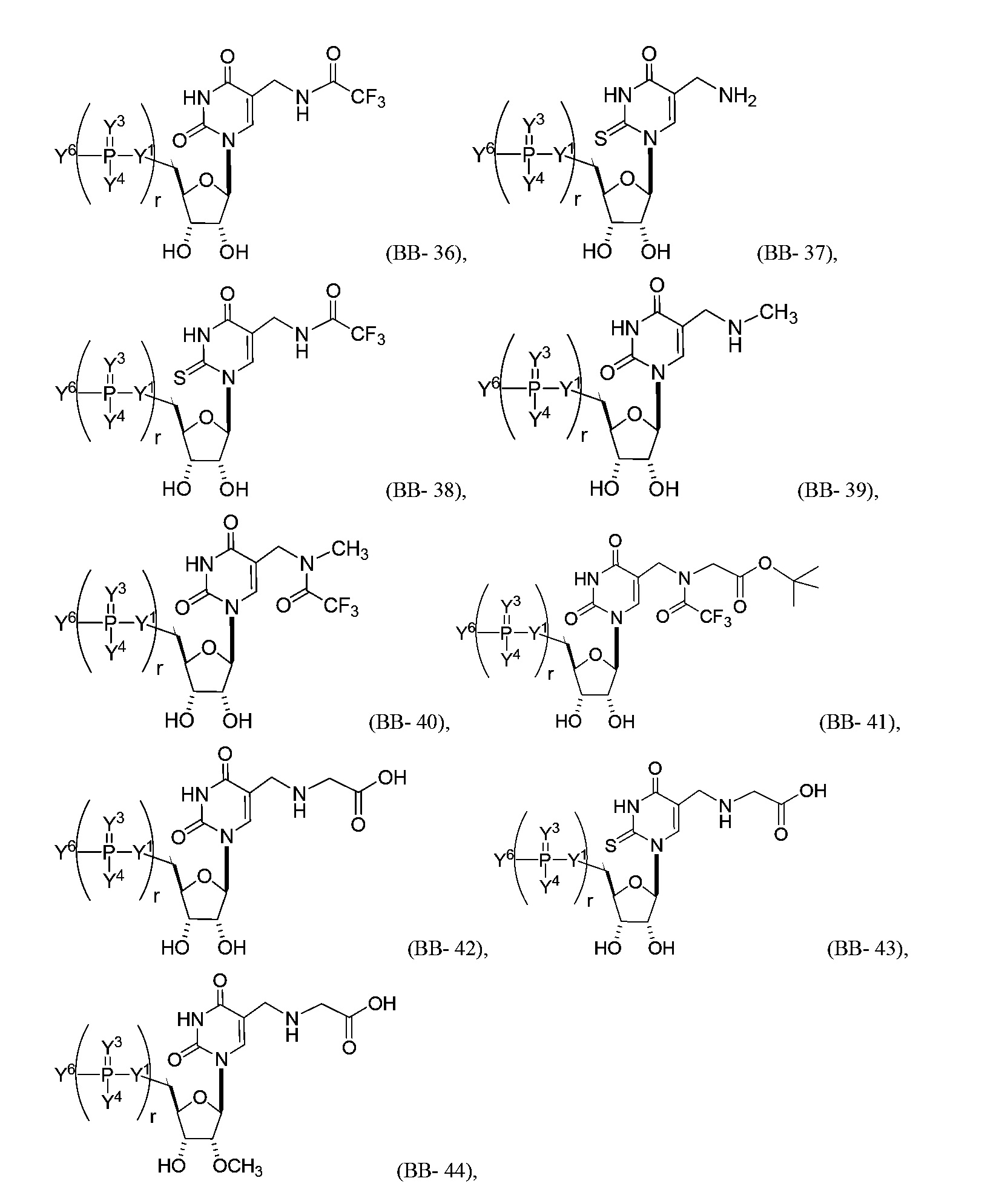
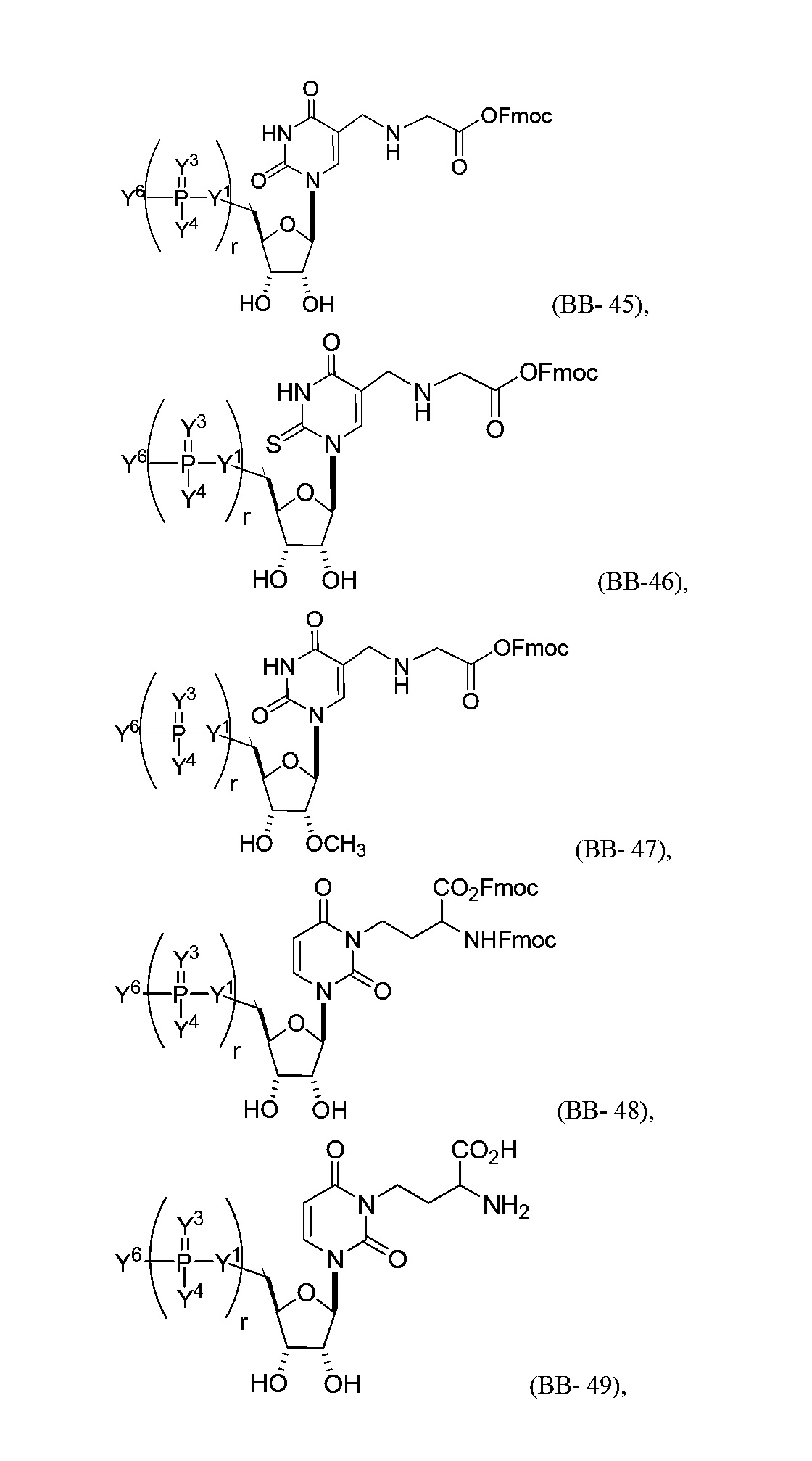
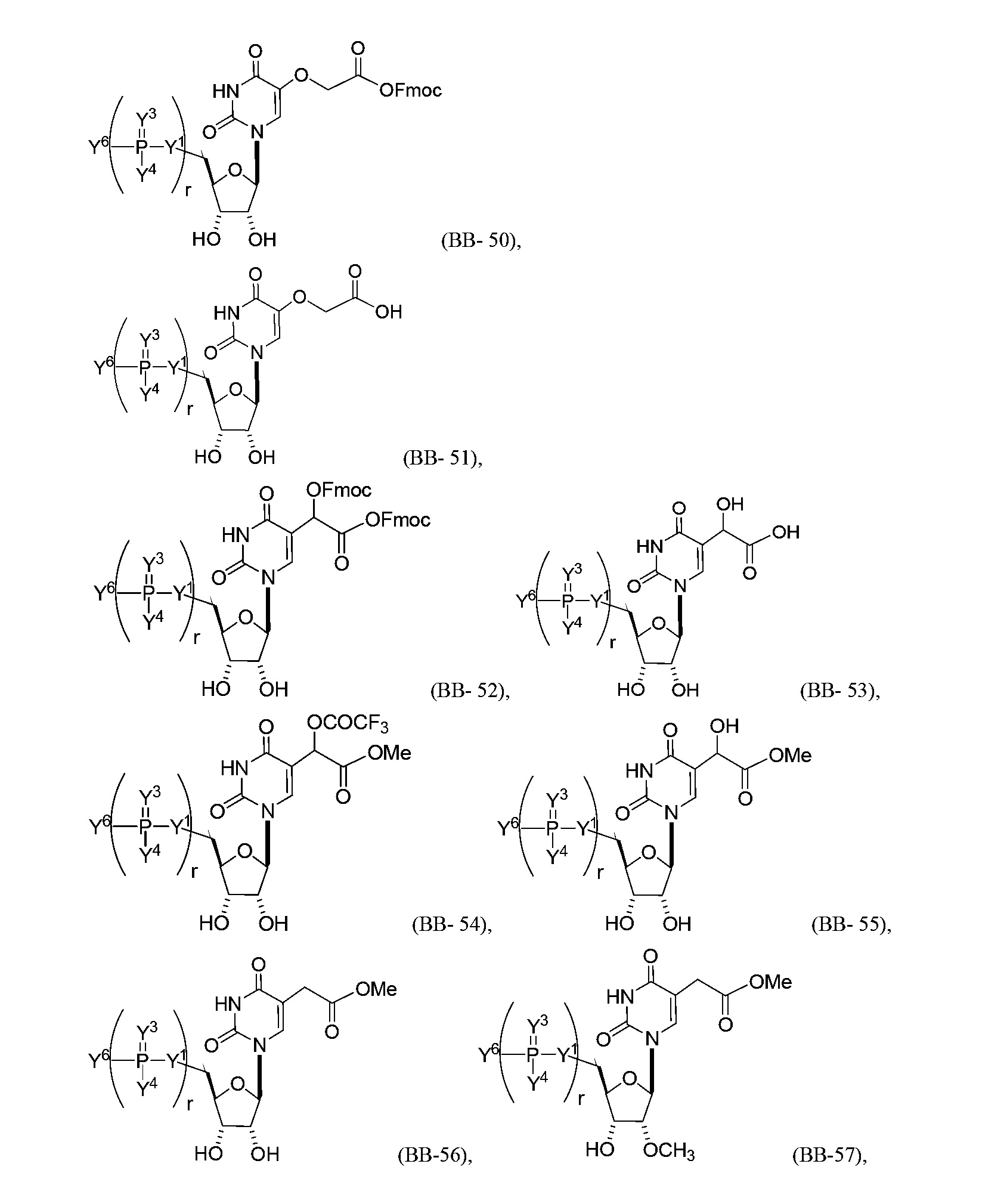
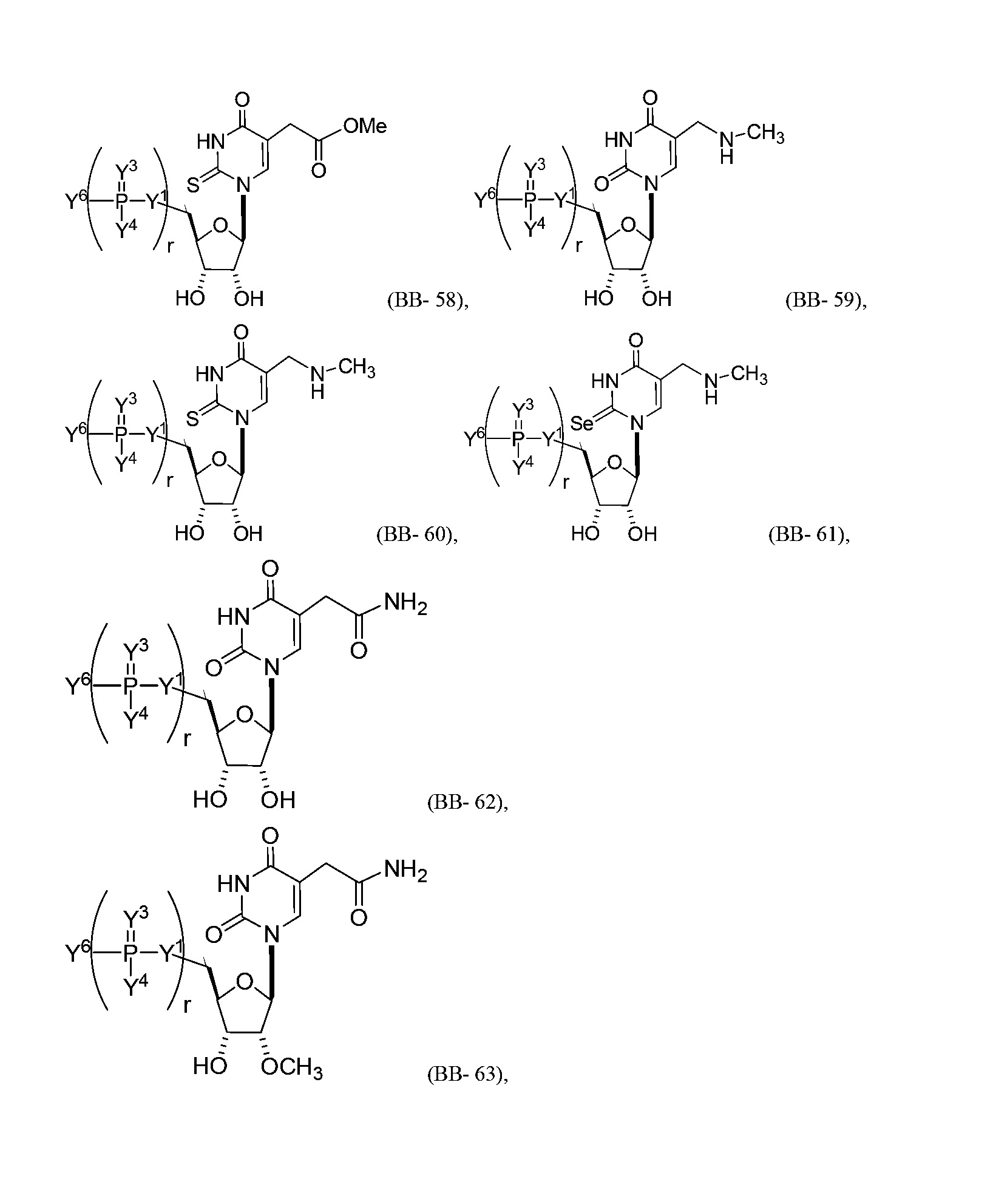

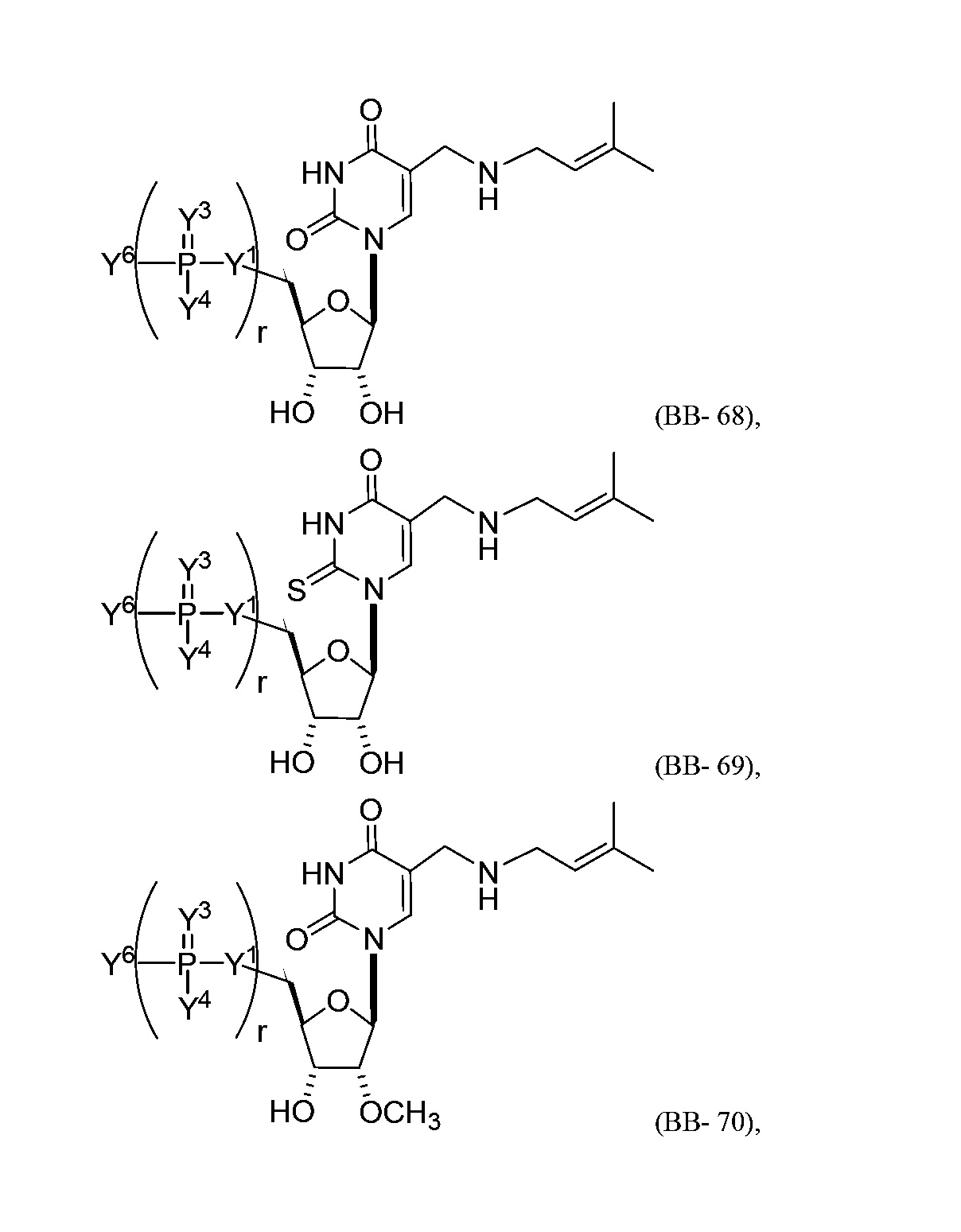
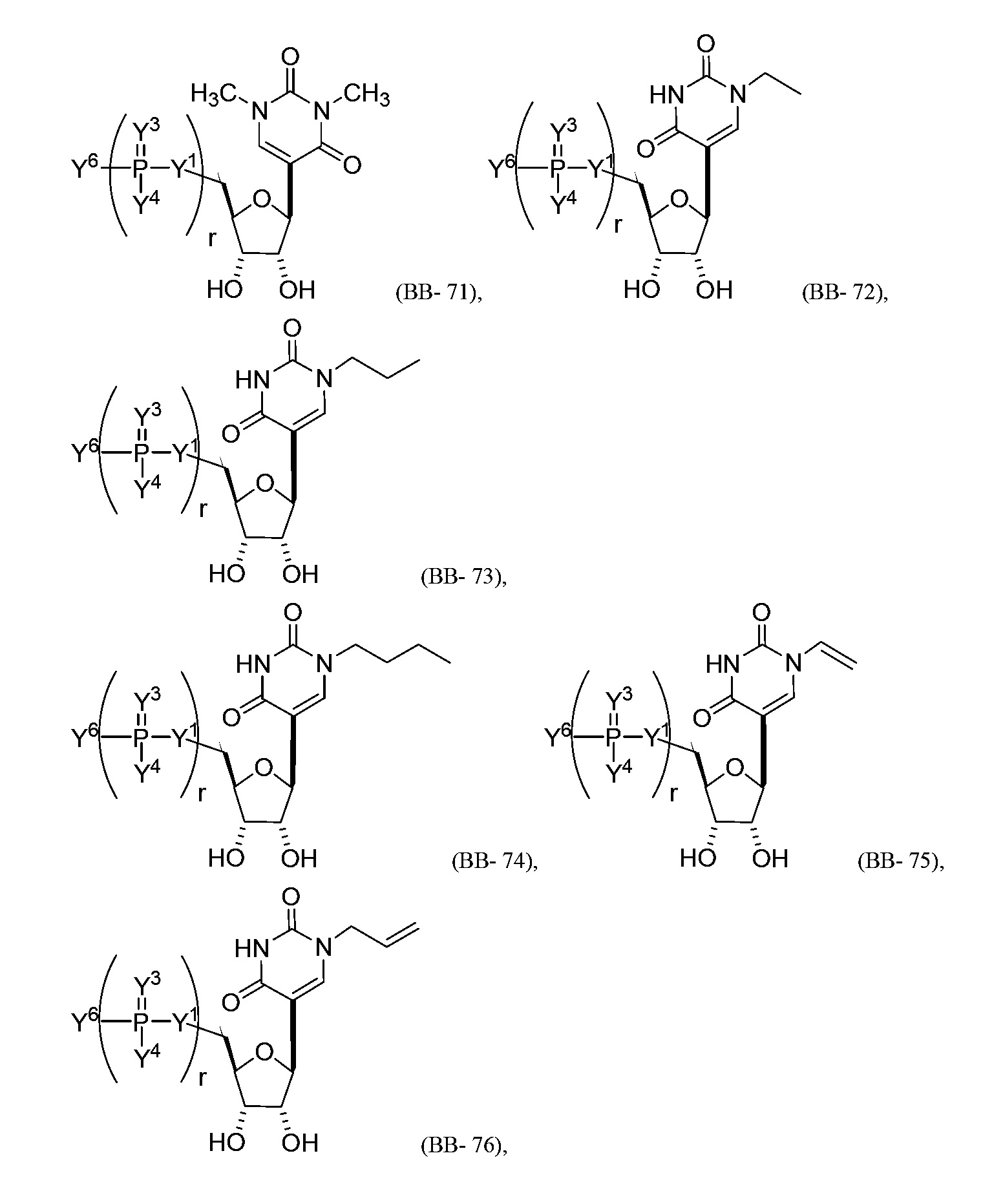
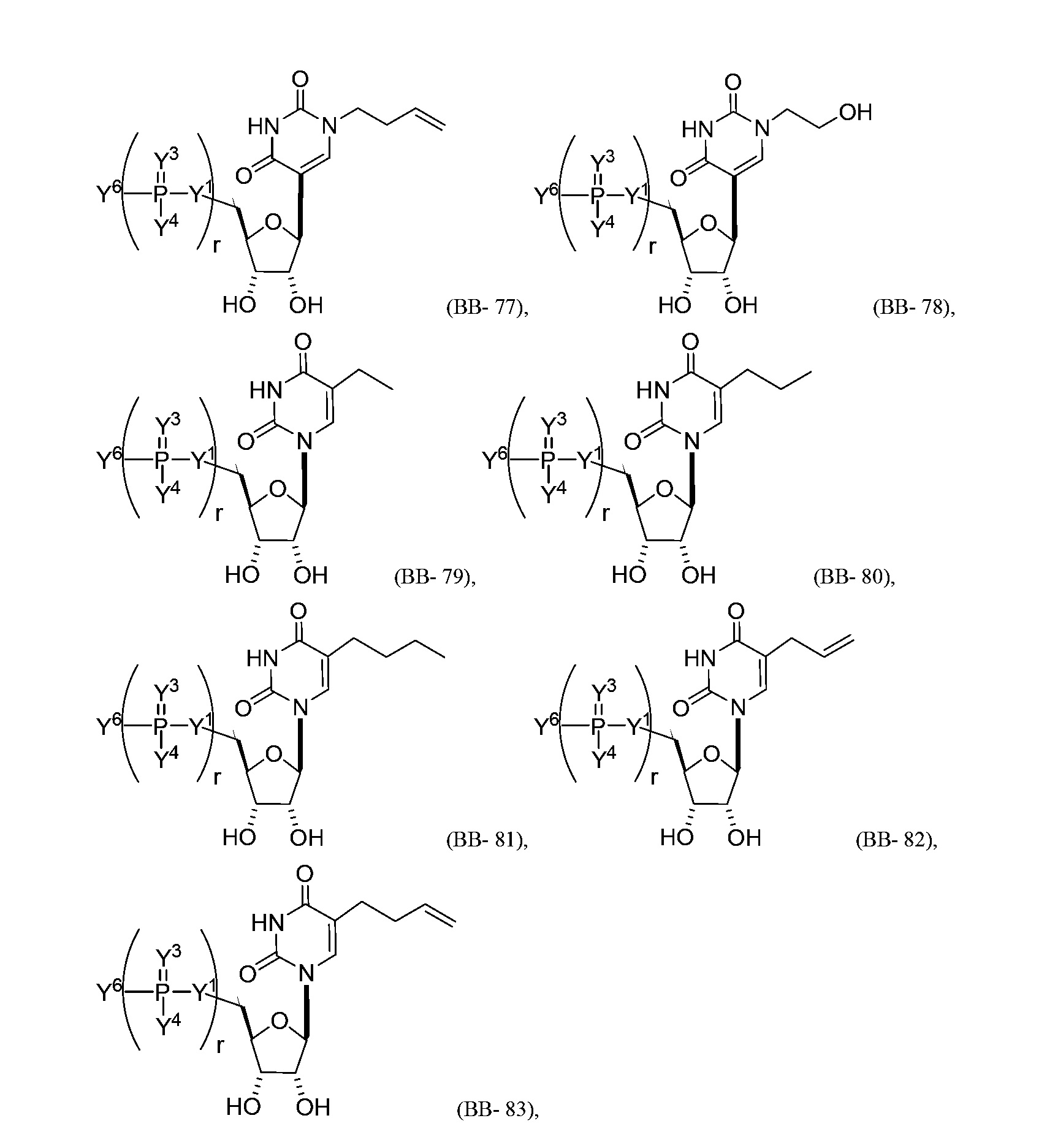
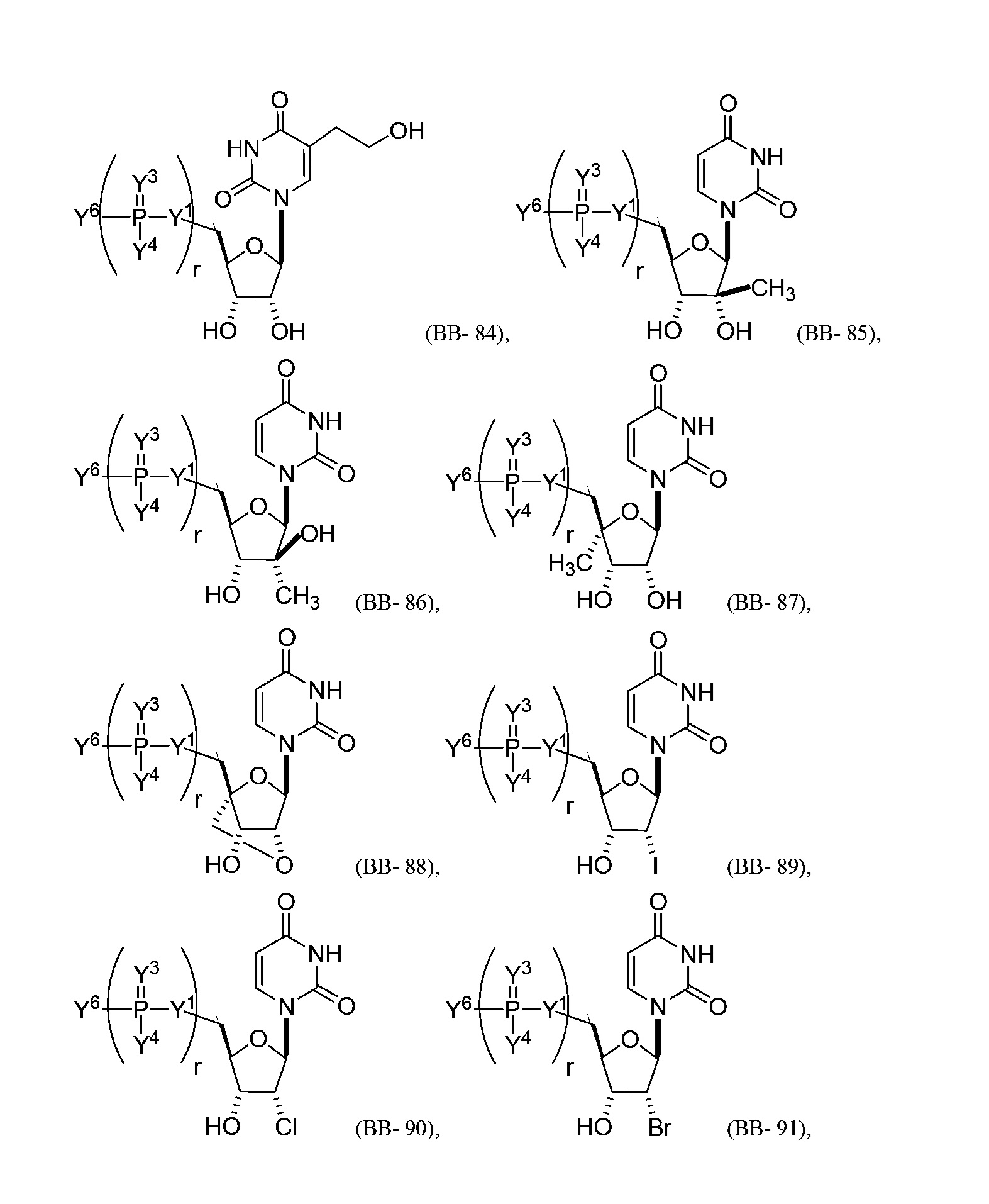
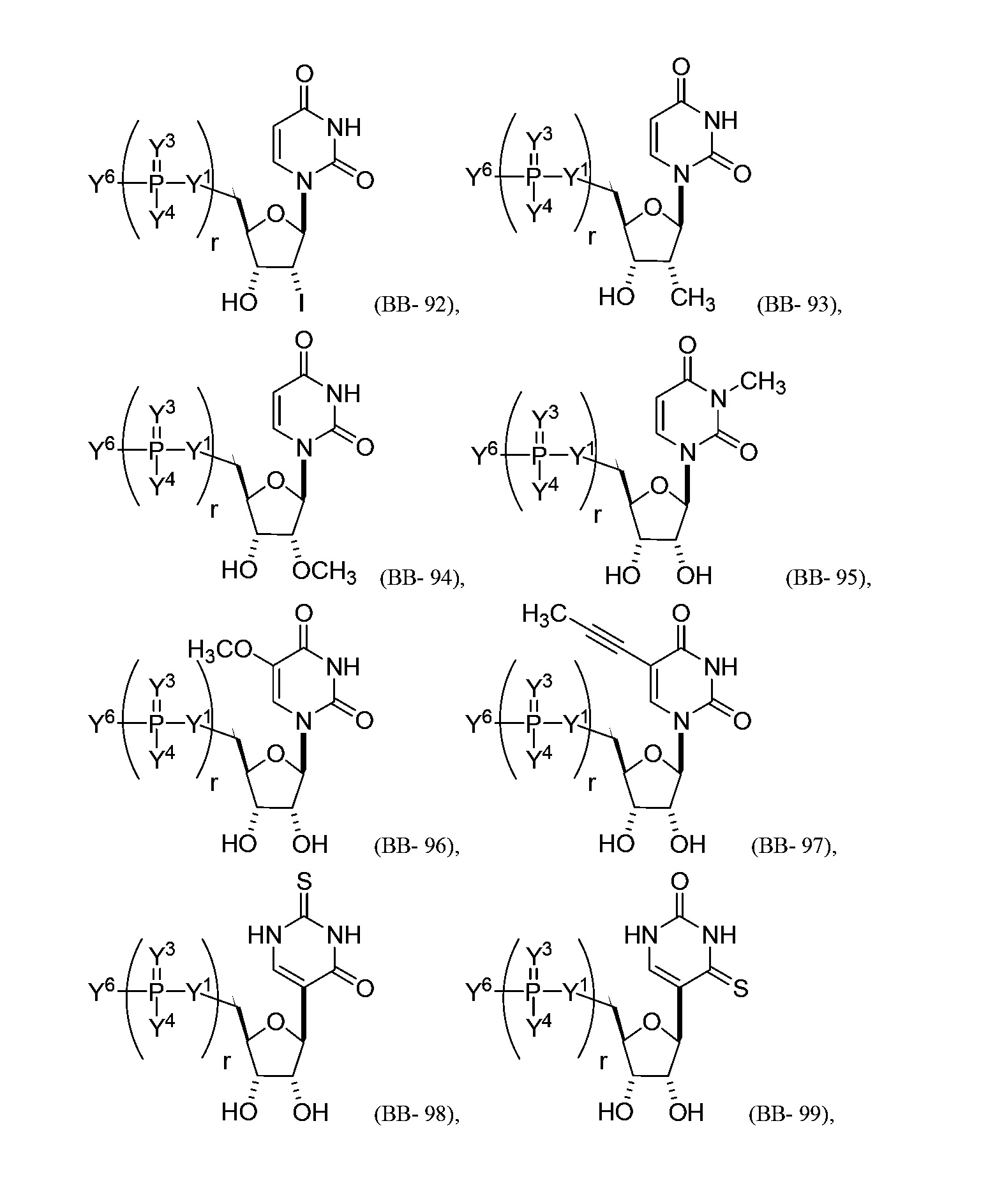
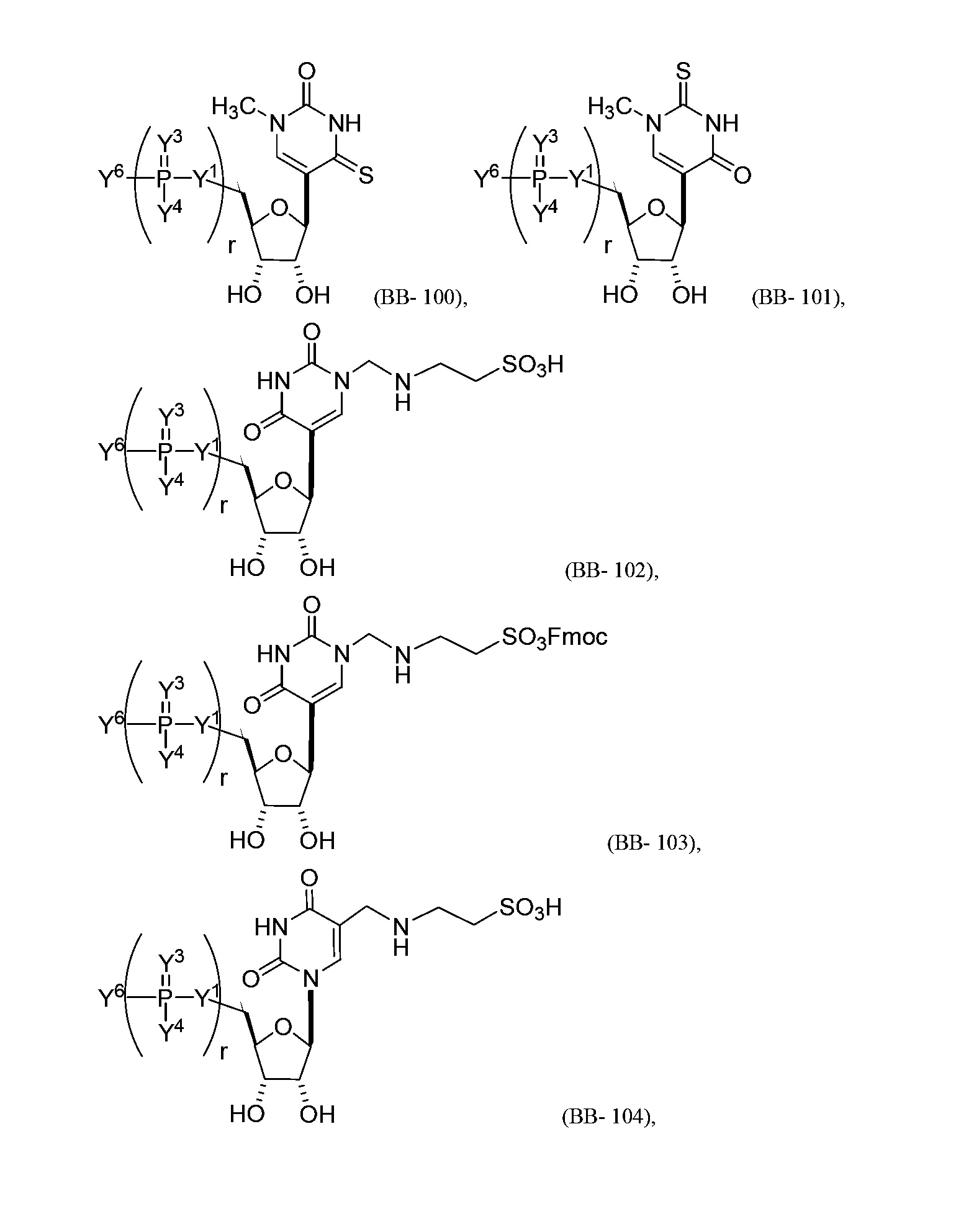
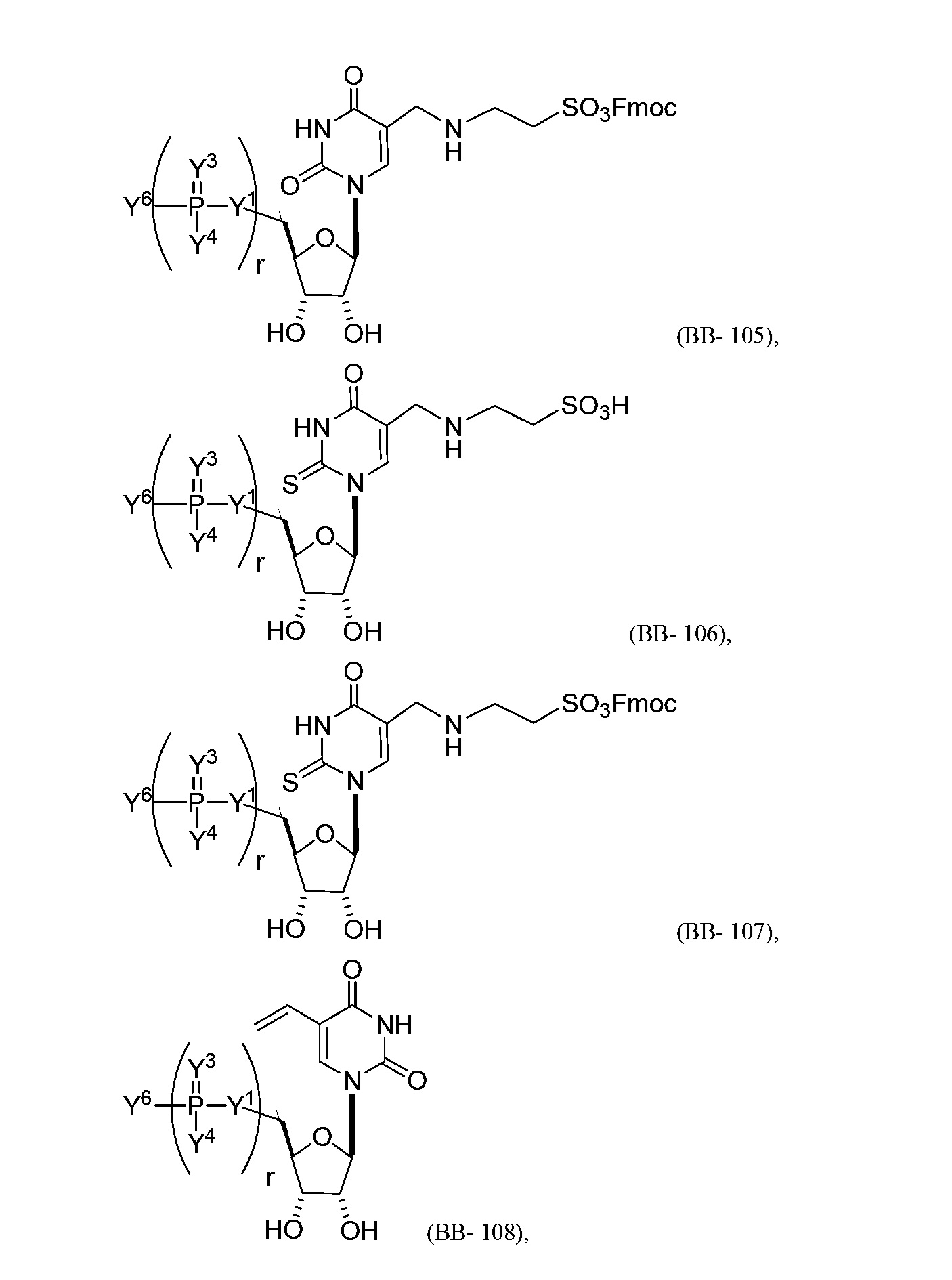
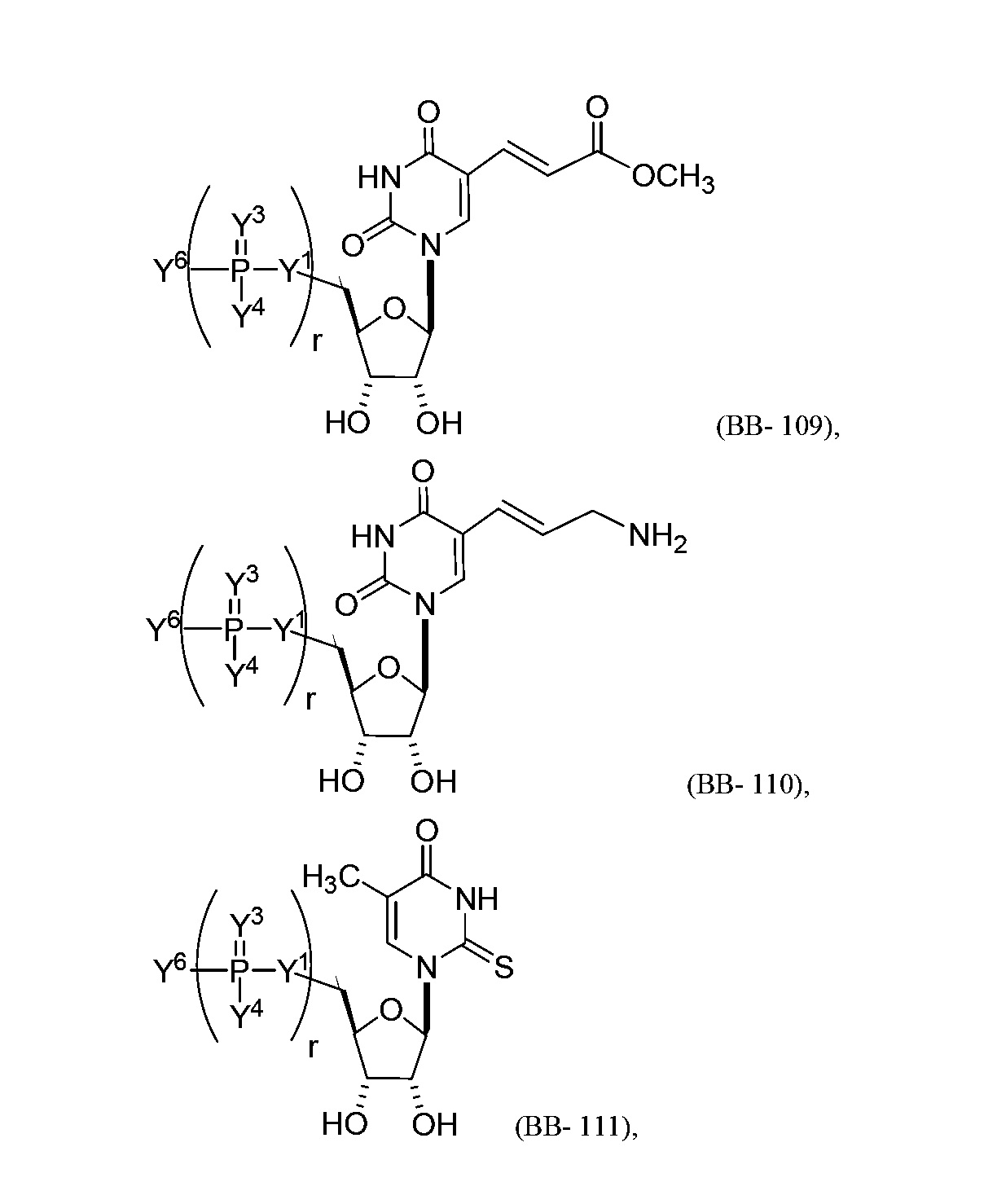

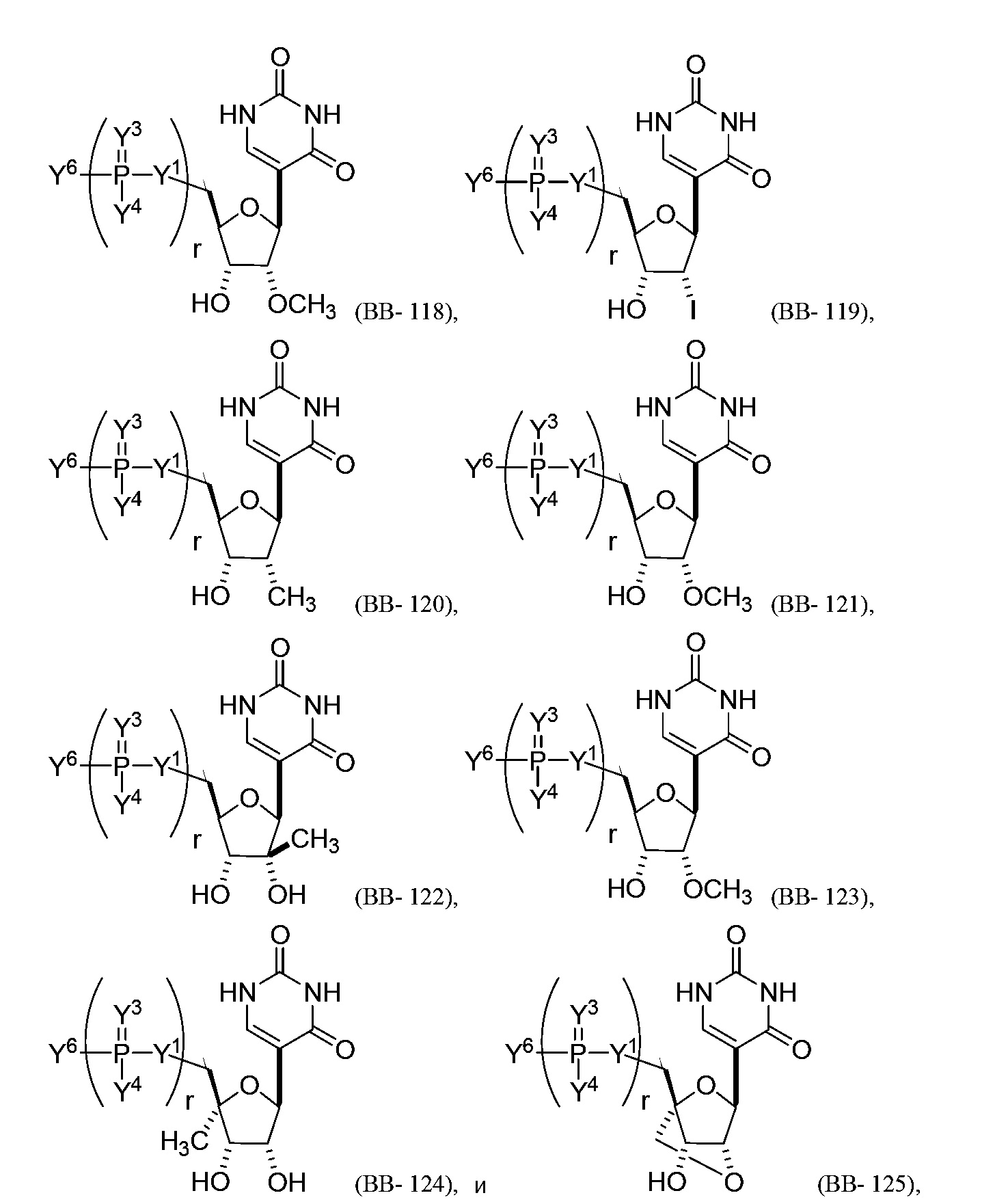
или их фармацевтически приемлемой соли или их стереоизомера, где Y1, Y3, Y4, Y6 и r являются такими, как описано в настоящем описании (например, каждый r независимо представляет собой целое число от 0 до 5, такое как от 0 до 3, от 1 до 3 или от 1 до 5)).
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, представляет собой модифицированный цитидин (например, выбранный из группы, состоящей из:



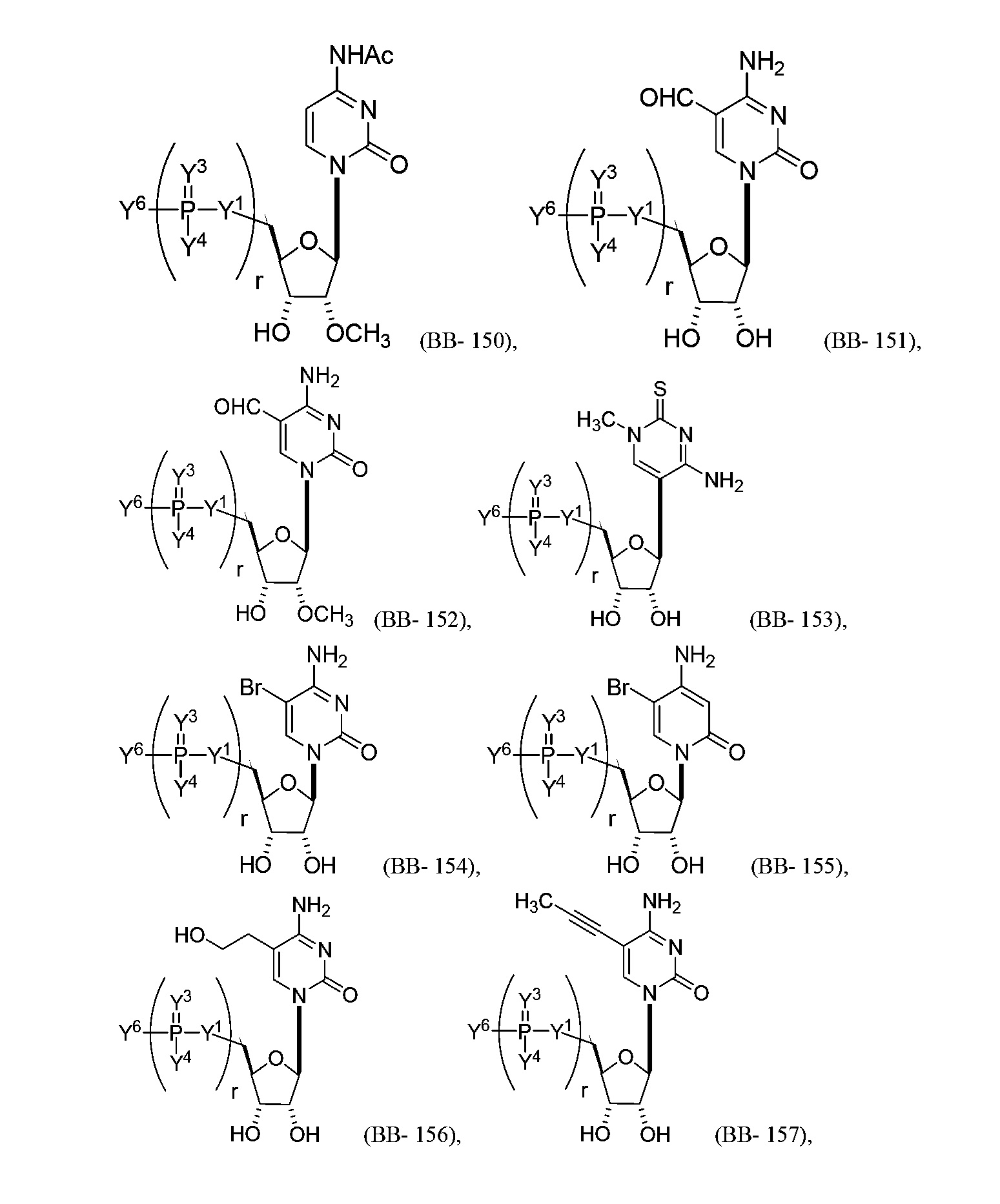
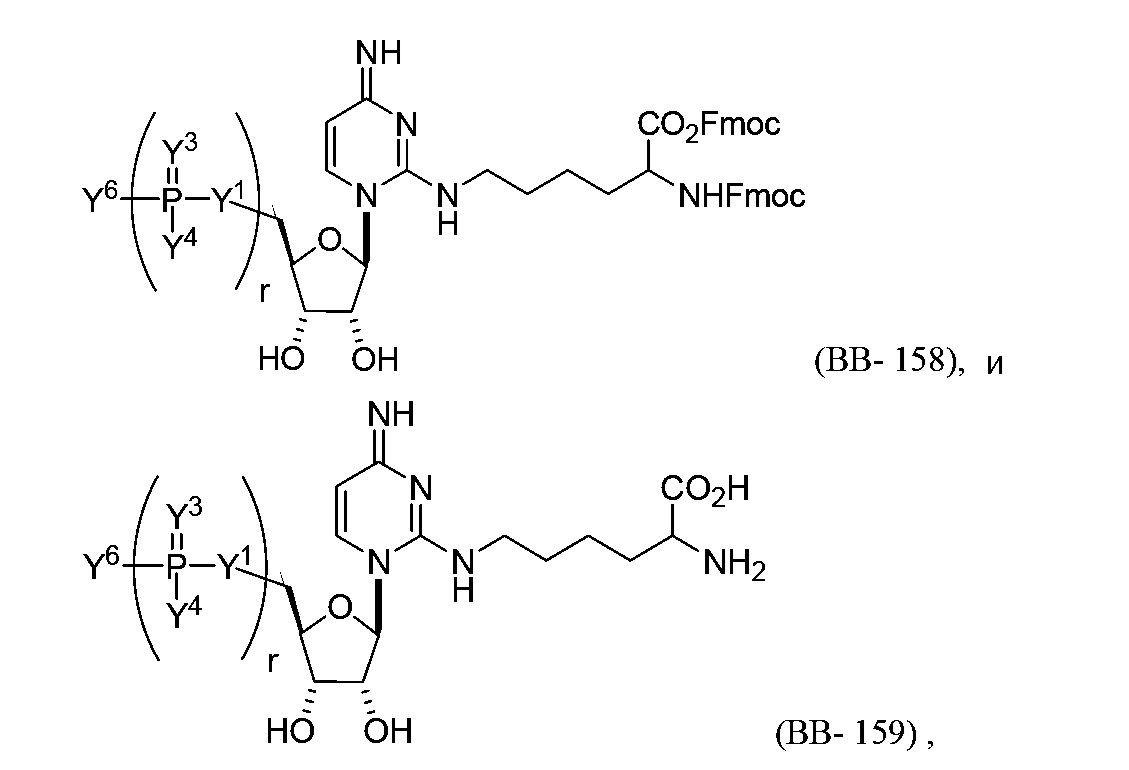
или их фармацевтически приемлемой соли или их стереоизомера, где Y1, Y3, Y4, Y6 и r являются такими, как описано в настоящем описании (например, каждый r независимо представляет собой целое число от 0 до 5, такое как от 0 до 3, от 1 до 3 или от 1 до 5)). Например, молекула структурного элемента, которая может быть включена в полинуклеотид, может представлять собой:
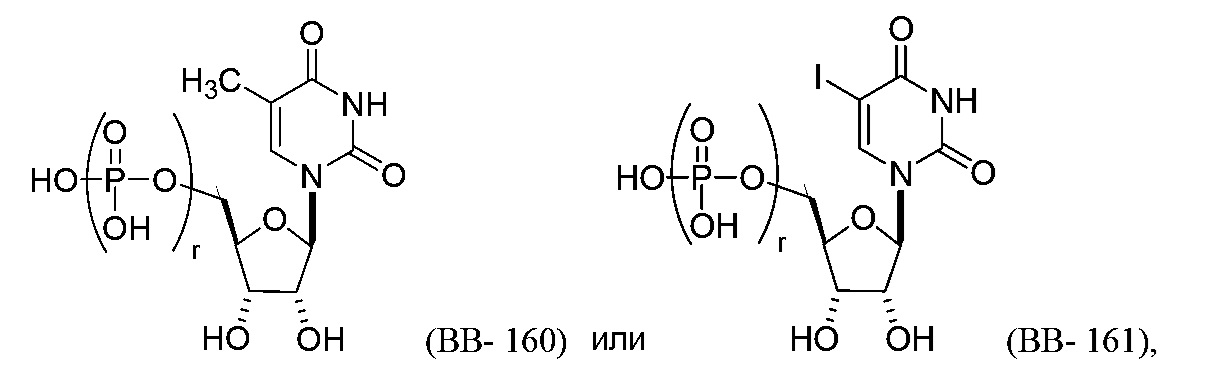
или их фармацевтически приемлемую соль или их стереоизомер, где каждый r независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5).
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, представляет собой модифицированный аденозин (например, выбранный из группы, состоящей из:
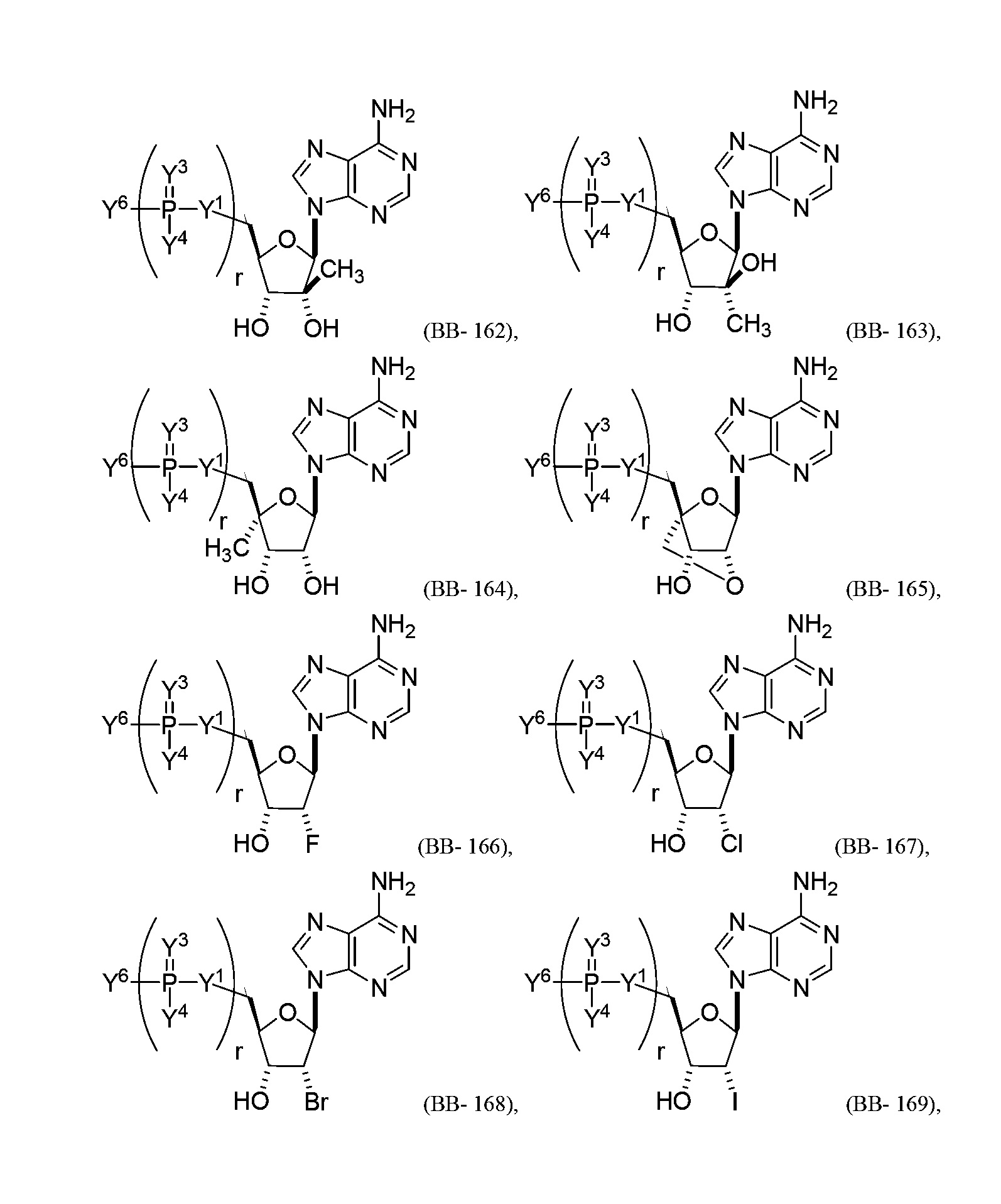
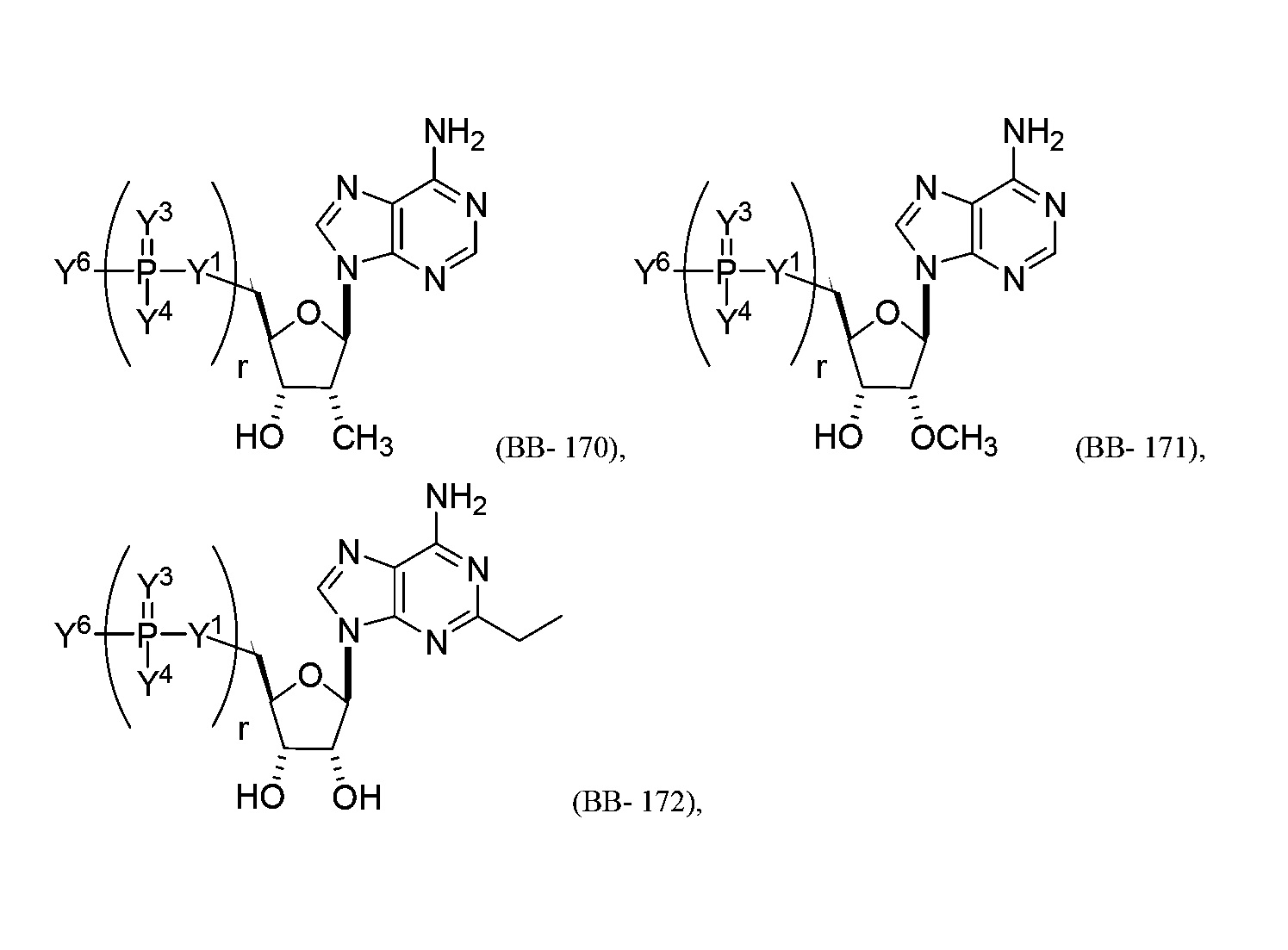
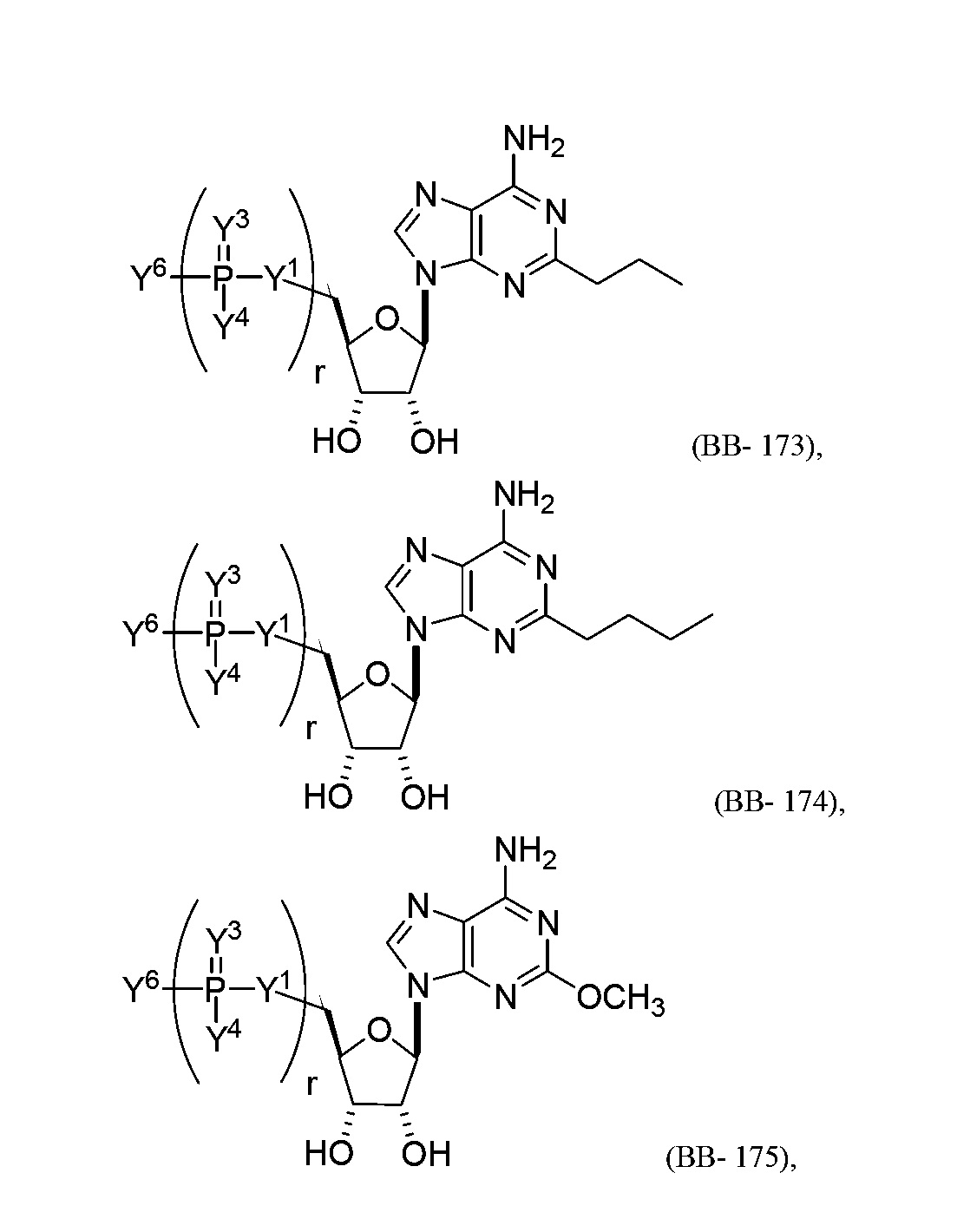
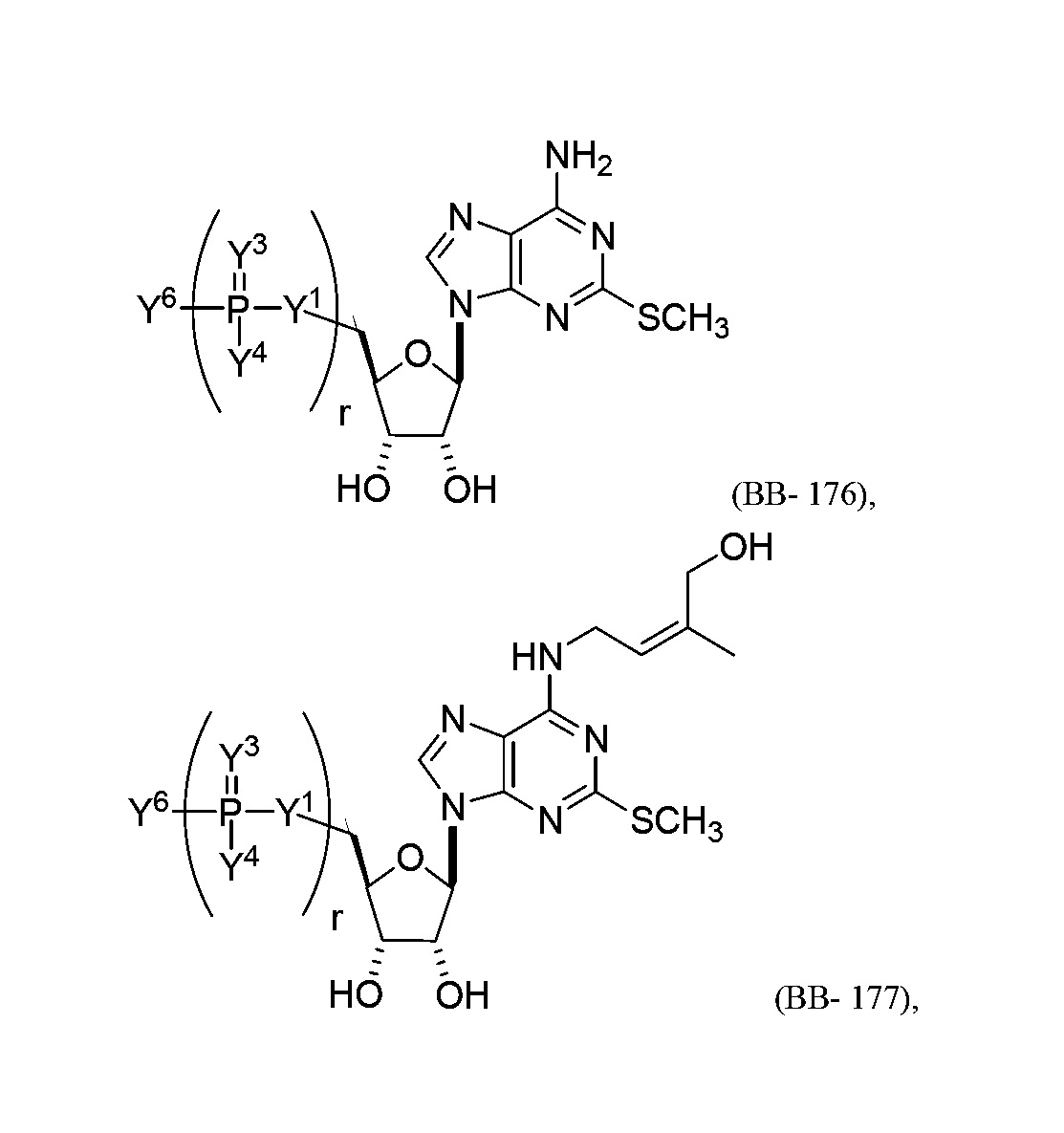


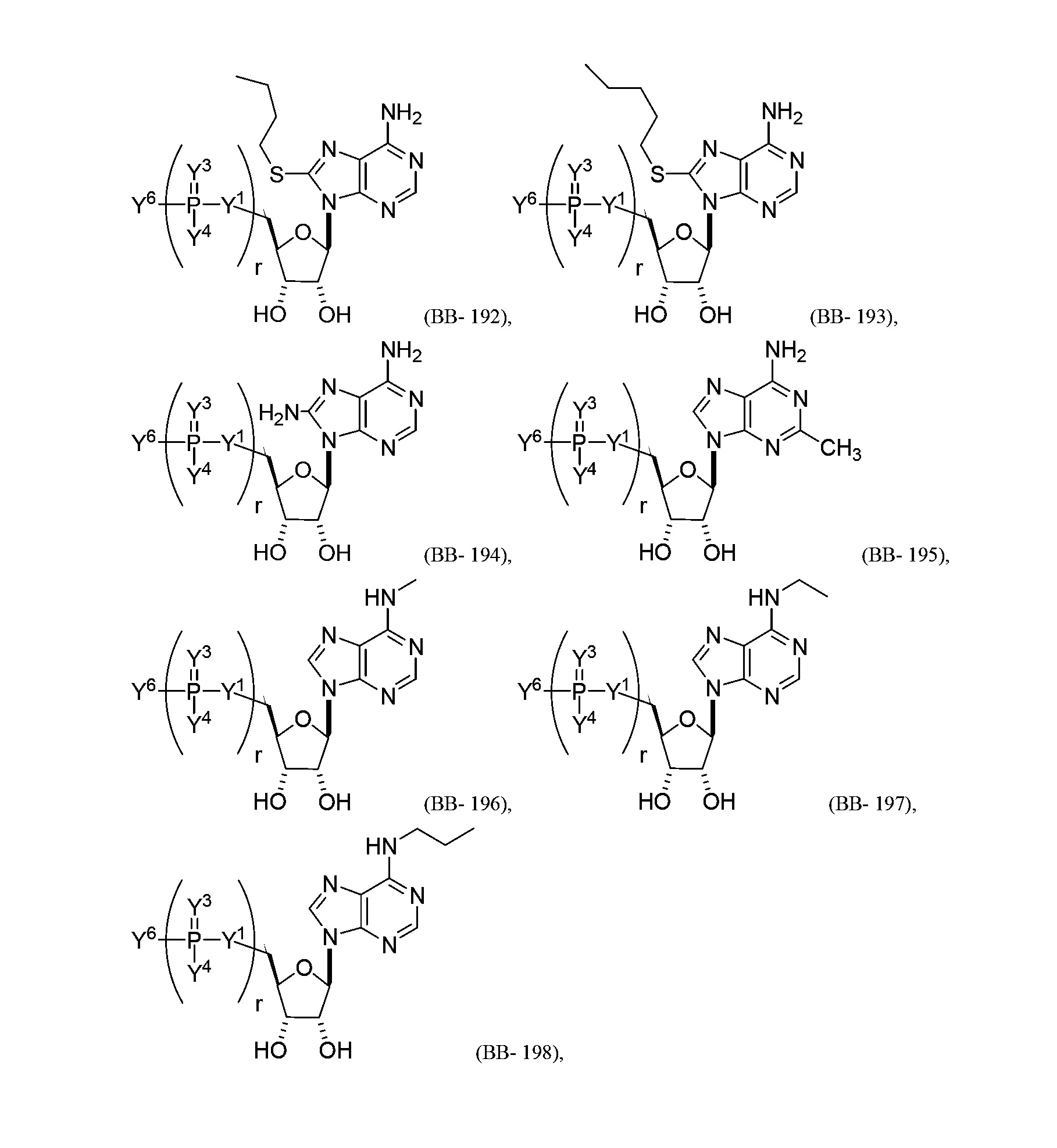

или их фармацевтически приемлемой соли или их стереоизомера, где Y1, Y3, Y4, Y6 и r являются такими, как описано в настоящем описании (например, каждый r независимо представляет собой целое число от 0 до 5, такое как от 0 до 3, от 1 до 3 или от 1 до 5)).
В некоторых вариантах осуществления молекула структурного элемента, которая может быть включена в полинуклеотид, представляет собой модифицированный гуанозин (например, выбранный из группы, состоящей из:
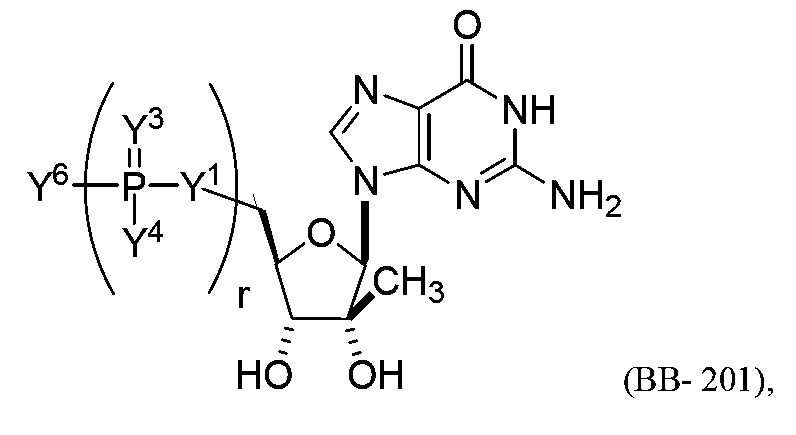
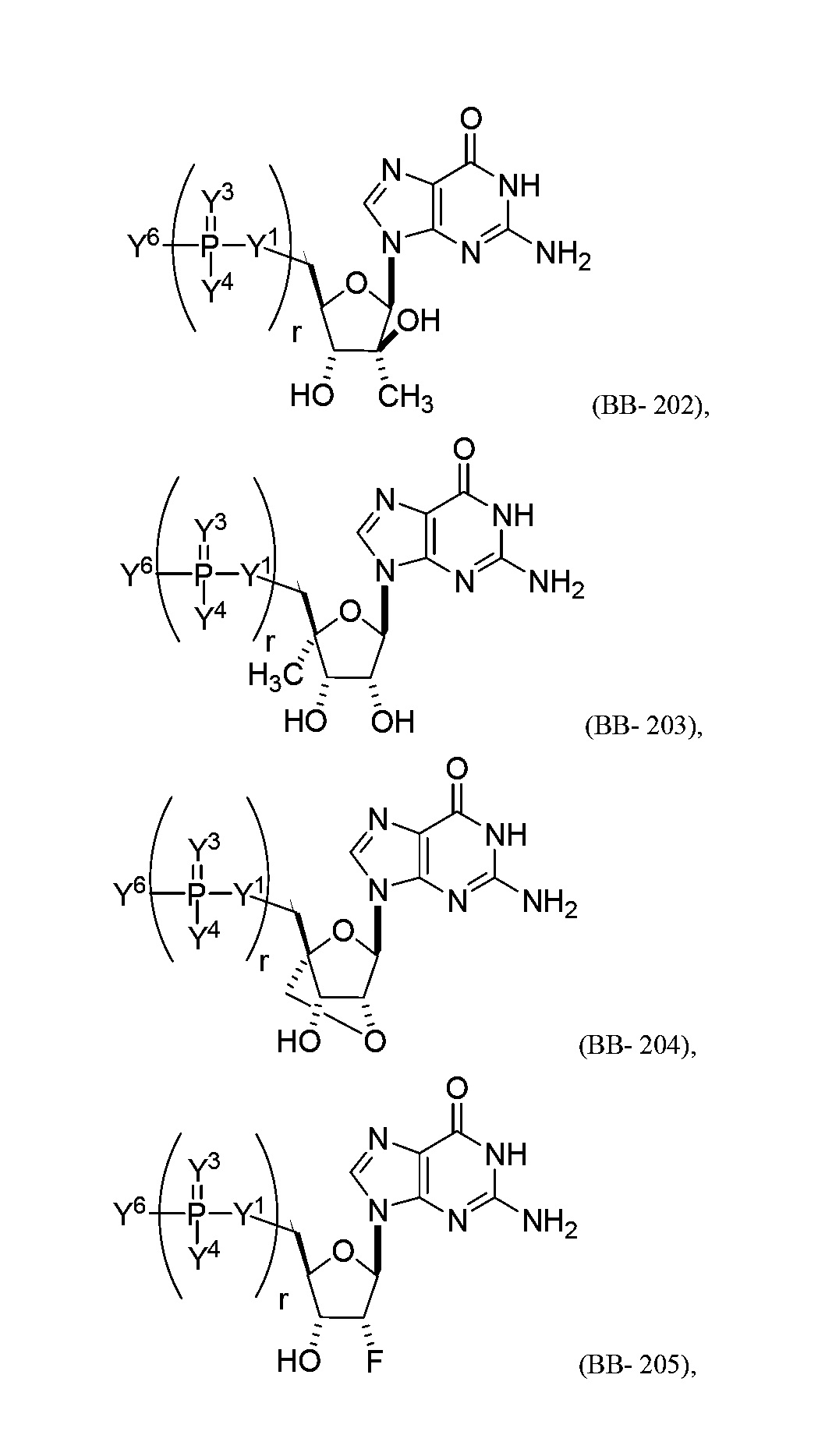
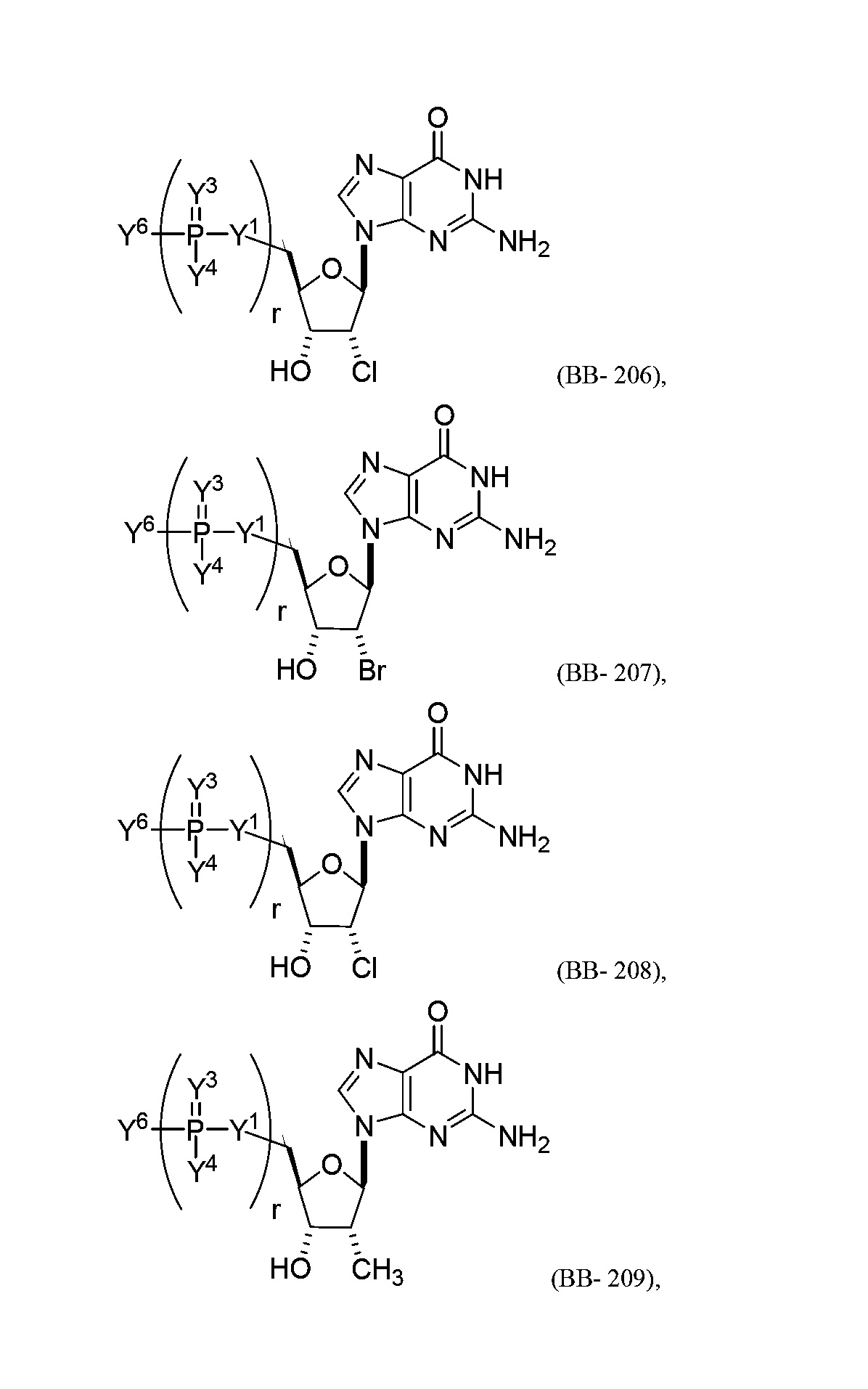
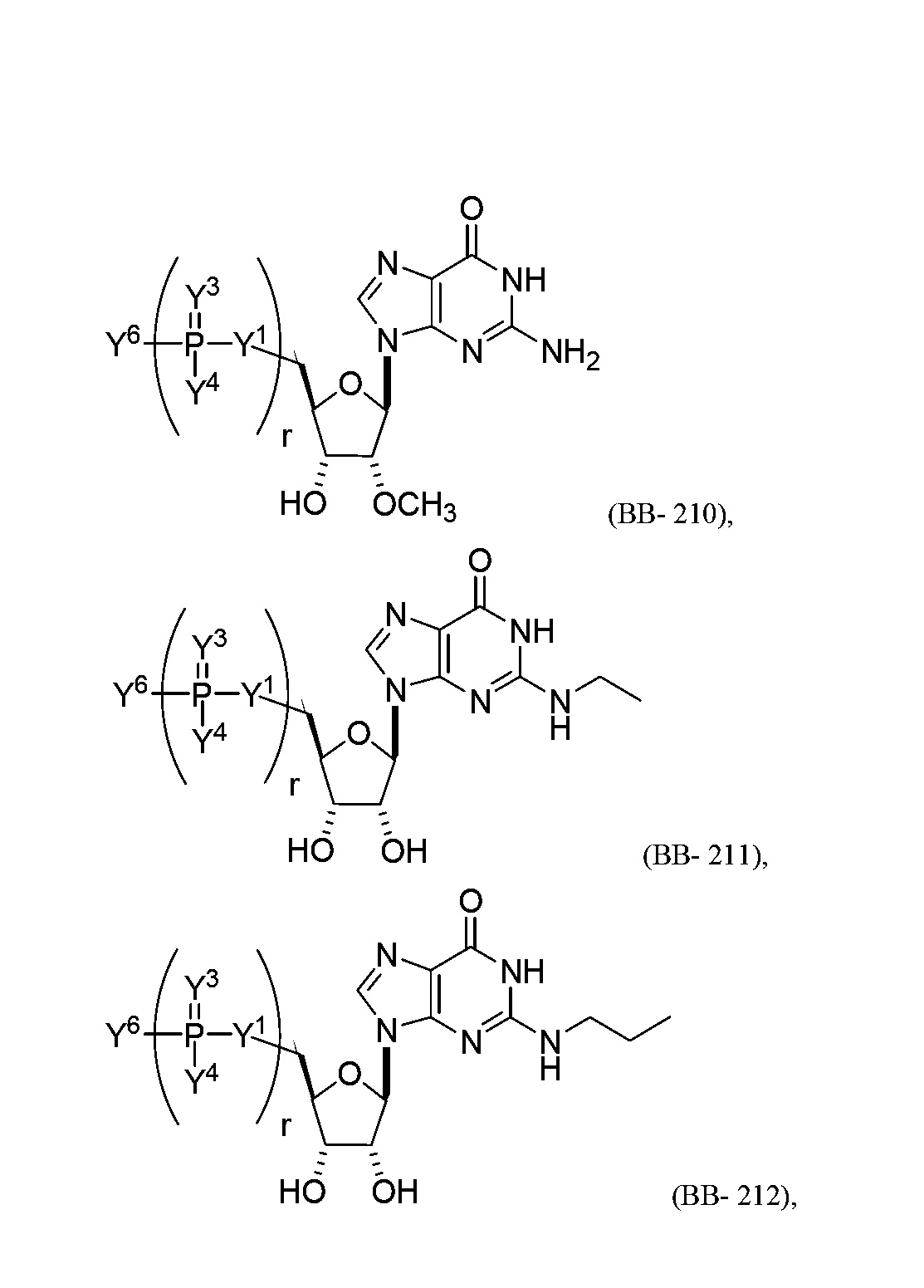
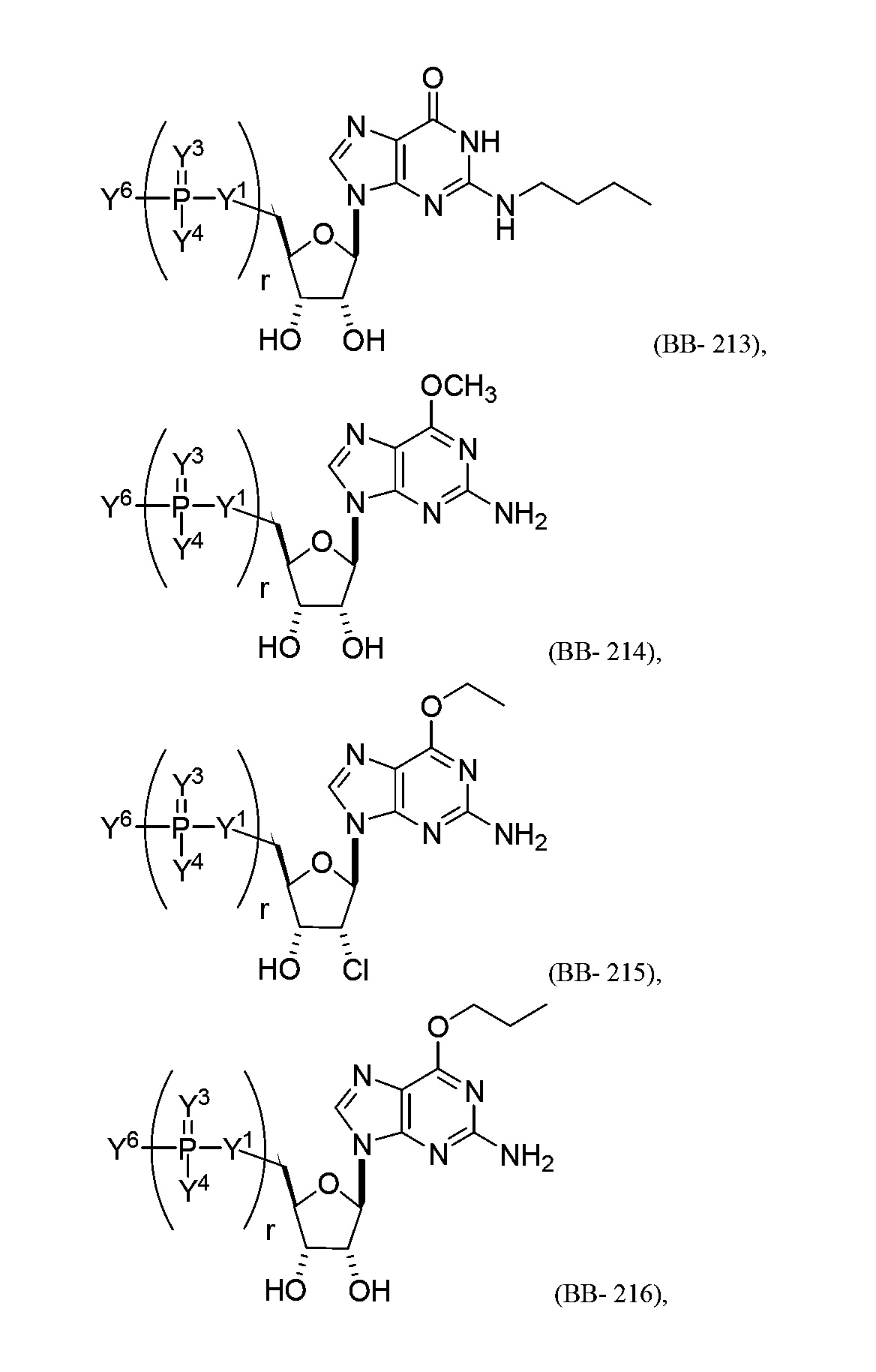


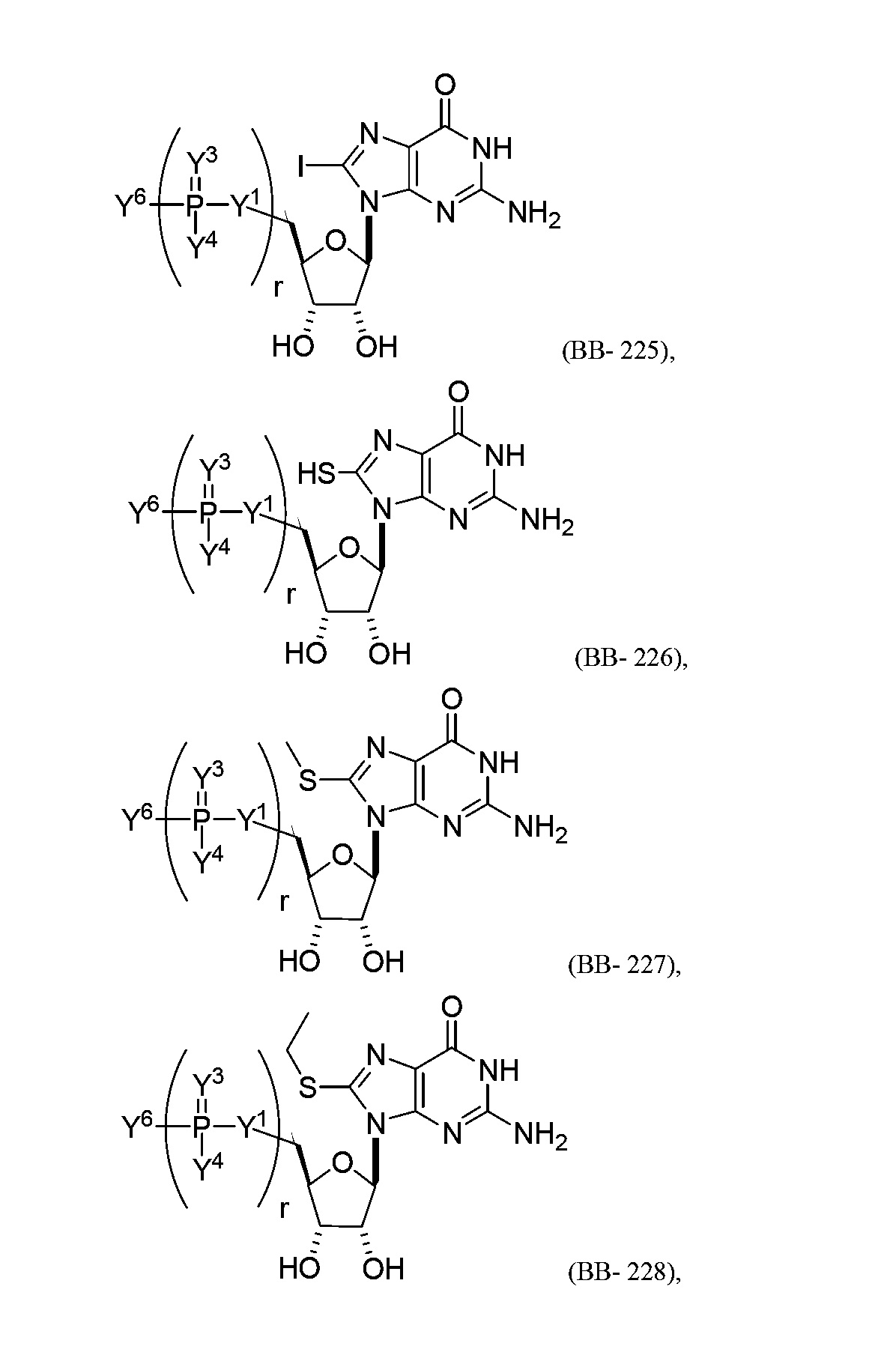
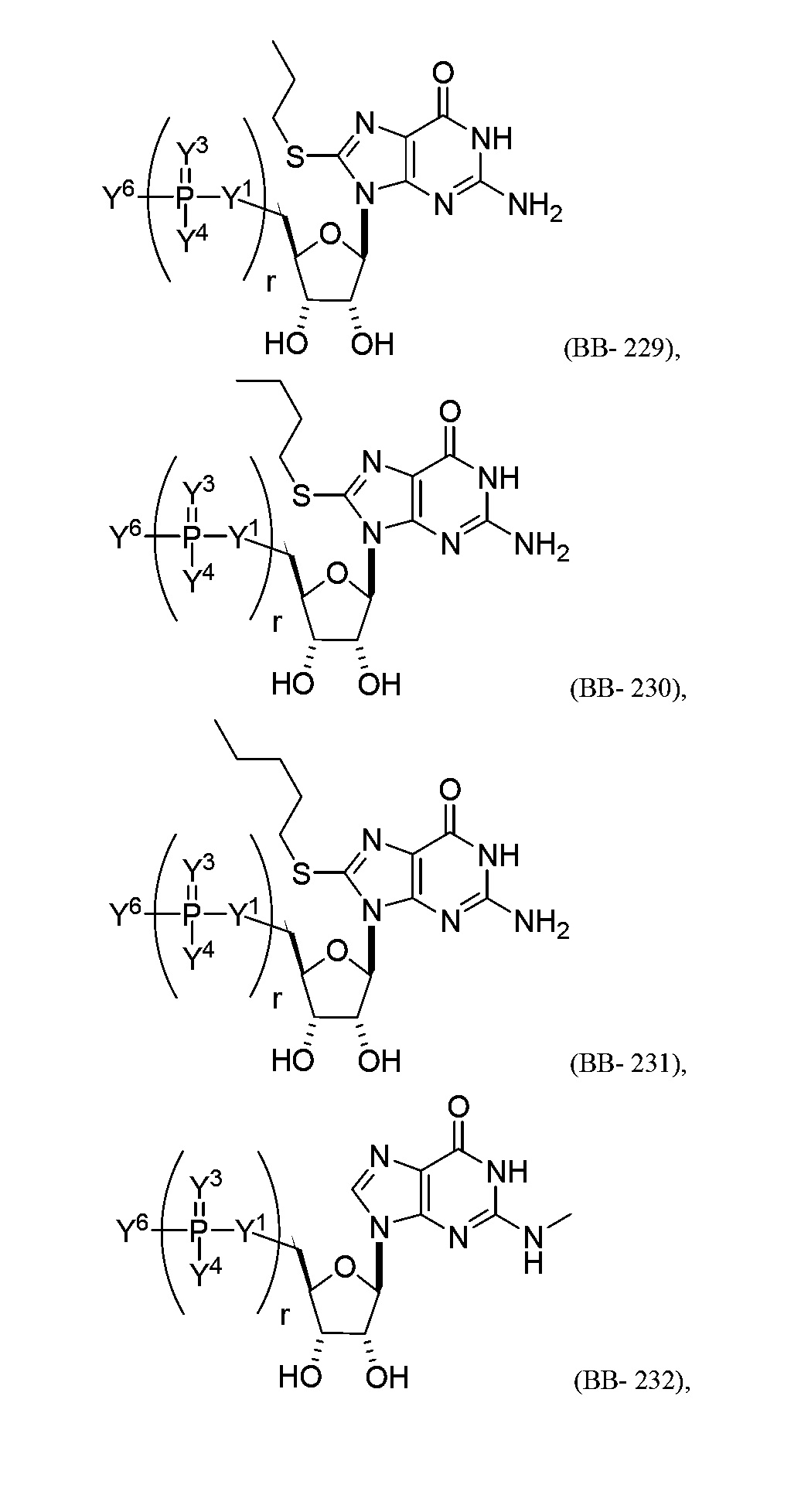
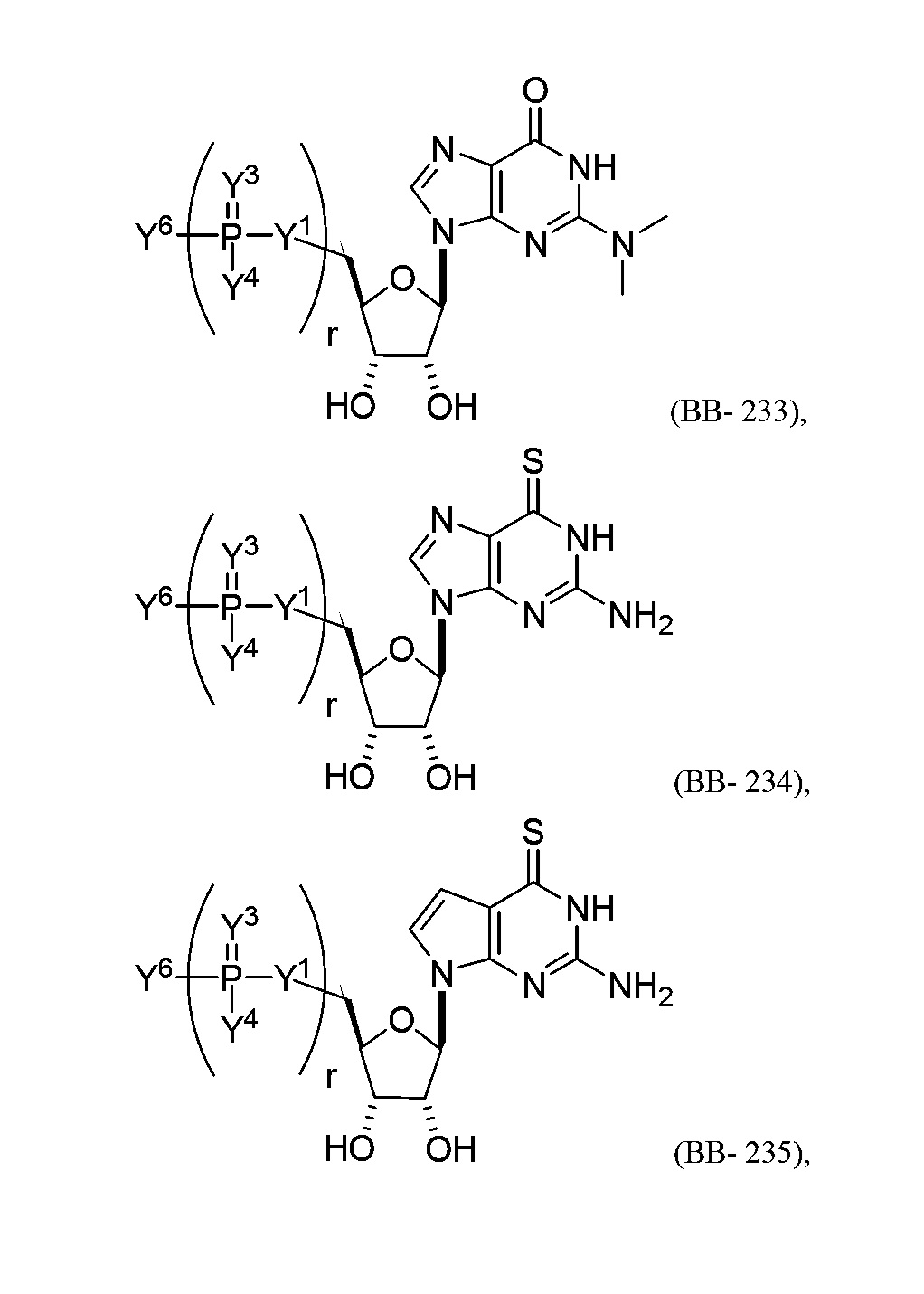

или их фармацевтически приемлемой соли или их стереоизомера, где Y1, Y3, Y4, Y6 и r являются такими, как описано в настоящем описании (например, каждый r независимо представляет собой целое число от 0 до 5, такое как от 0 до 3, от 1 до 3 или от 1 до 5)).
В некоторых вариантах осуществления химическая модификация большой бороздки может включать замену C-группы в положении C-5 кольца (например, для пиримидинового нуклеозида, такого как цитозин или урацил) на N (например, замена группы >CH в C-5 на группу >NRN1, где RN1 представляет собой H или необязательно замещенный алкил). Например, молекула структурного элемента, которая может быть включена в полинуклеотид, может представлять собой:
или их фармацевтически приемлемую соль или их стереоизомер, где каждый r независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5).
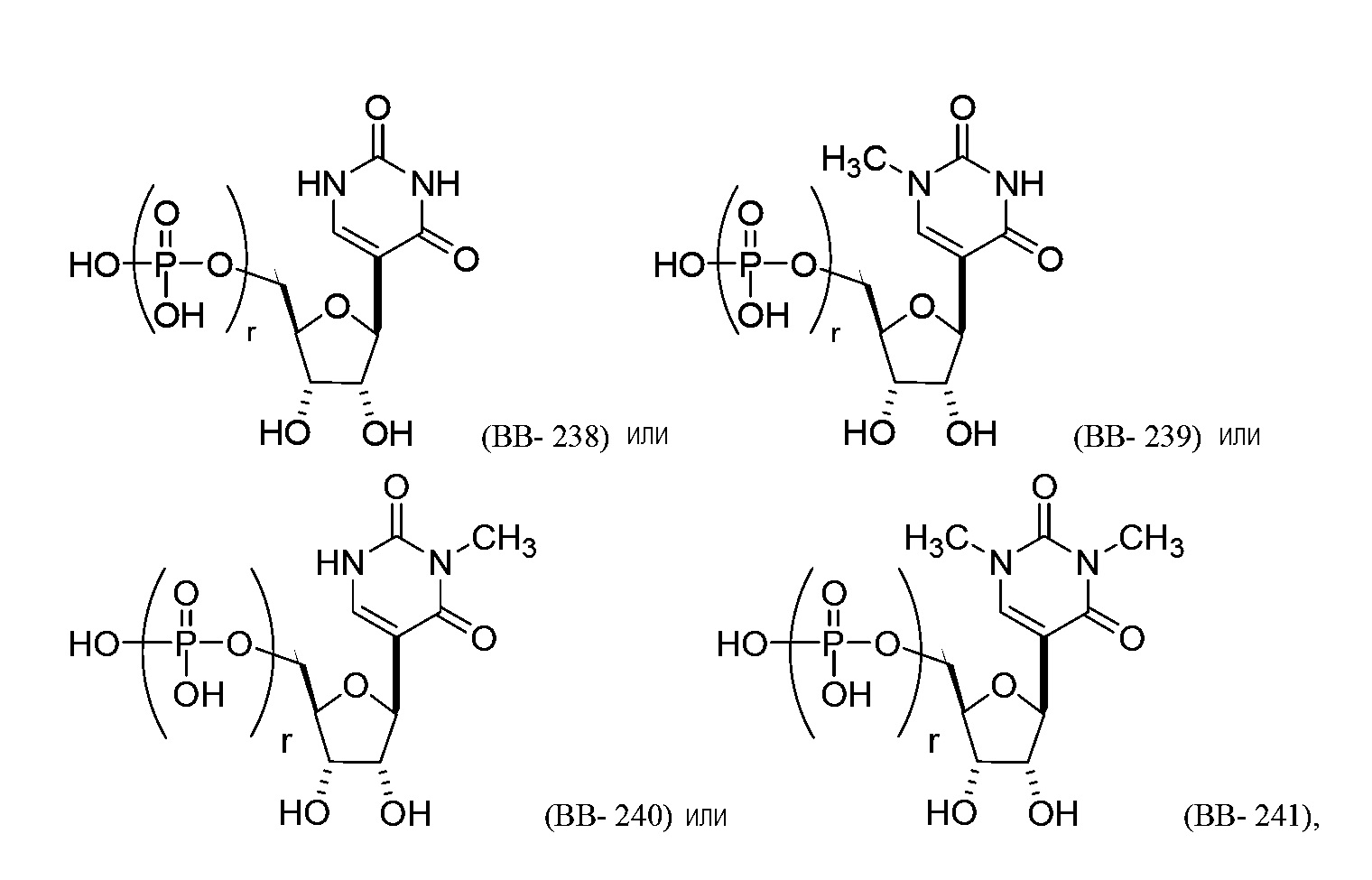
В другом варианте осуществления химическая модификация большой бороздки может включать замену водорода в положении C-5 цитозина на галоген (например, Br, Cl, F или I) или необязательно замещенный алкил (например, метил). Например, молекула структурного элемента, которая может быть включена в полинуклеотид, может представлять собой:
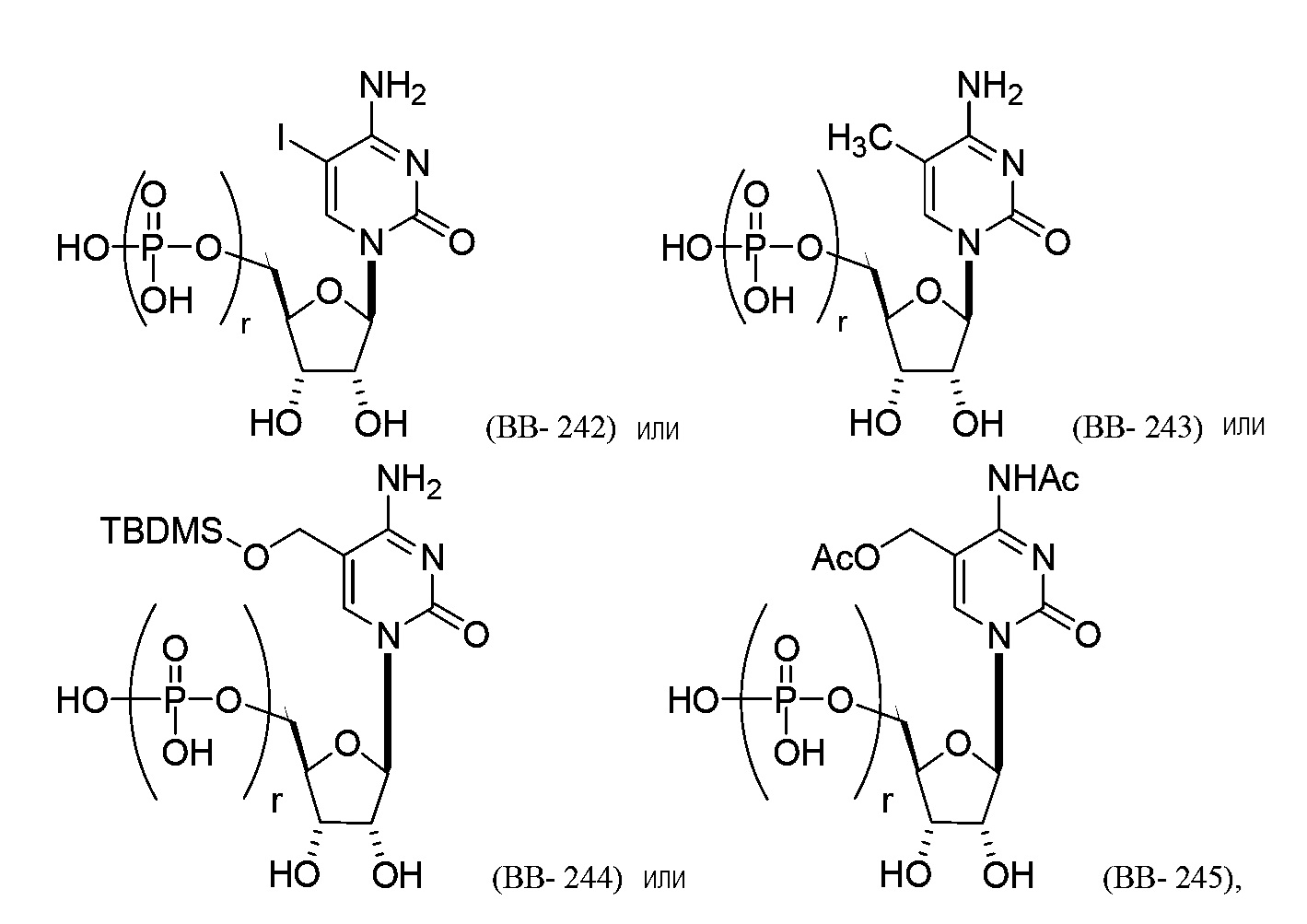
или их фармацевтически приемлемую соль или их стереоизомер, где каждый r независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5).
В другом варианте осуществления химическая модификация большой бороздки может включать конденсированное кольцо, которое образовано NH2 в положении C-4 и атомом углерода в положении C-5. Например, молекула структурного элемента, которая может быть включена в полинуклеотид, может представлять собой:
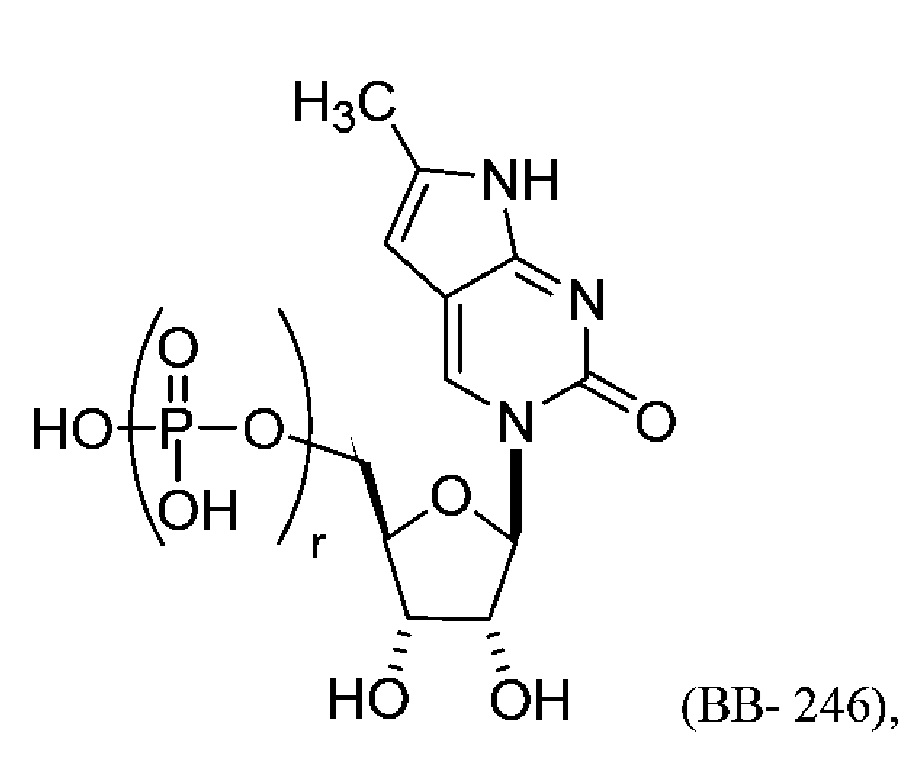
или его фармацевтически приемлемую соль или его стереоизомер, где каждый r независимо представляет собой целое число от 0 до 5 (например, от 0 до 3, от 1 до 3 или от 1 до 5).
Модификации сахара
Модифицированные нуклеозиды и нуклеотиды (например, молекулы структурных элементов), которые могут быть включены в полинуклеотид (например, РНК или мРНК, как описано в настоящем описании), могут быть модифицированы по сахару рибонуклеиновой кислоты. Например, 2′-гидроксильная группа (OH) может быть модифицирована или заменена рядом различных заместителей. Иллюстративные замены в 2′-положении включают, но не ограничиваются ими, H, галоген, необязательно замещенный C1-6 алкил; необязательно замещенный C1-6 алкокси; необязательно замещенный C6-10 арилокси; необязательно замещенный C3-8 циклоалкил; необязательно замещенный C3-8 циклоалкокси; необязательно замещенный C6-10 арилокси; необязательно замещенный C6-10 арил-C1-6 алкокси, необязательно замещенный C1-12 (гетероциклил)окси; сахар (например, рибоза, пентоза или любой сахар, описанный в настоящем описании); полиэтиленгликоль (PEG), -O(CH2CH2O)nCH2CH2OR, где R представляет собой H или необязательно замещенный алкил, и n представляет собой целое число от 0 до 20 (например, от 0 до 4, от 0 до 8, от 0 до 10, от 0 до 16, от 1 до 4, от 1 до 8, от 1 до 10, от 1 до 16, от 1 до 20, от 2 до 4, от 2 до 8, от 2 до 10, от 2 до 16, от 2 до 20, от 4 до 8, от 4 до 10, от 4 до 16 и от 4 до 20); "замкнутые" нуклеиновые кислоты (LNA), в которых 2′-гидроксил связан через C1-6 алкиленовый или C1-6 гетероалкиленовый мостик с 4’-углеродом того же рибозного сахара, где иллюстративные мостики включают метиленовые, пропиленовые, простые эфирные или амино мостики; аминоалкил, как определено в настоящем описании; аминоалкокси, как определено в настоящем описании; амино, как определено в настоящем описании, и аминокислоту, как определено в настоящем описании.
Как правило, РНК включает группу сахара рибозы, которая представляет собой 5-членное кольцо, имеющее кислород. Иллюстративные неограничивающие модифицированные нуклеотиды включают замену кислорода в рибозе (например, на S, Se или алкилен, такой как метилен или этилен); внесение двойной связи (например, для замены рибозы циклопентенилом или циклогексенилом); уменьшение кольца рибозы (например, с образованием 4-членного кольца циклобутана или оксетана); расширение кольца рибозы (например, с образованием 6- или 7-членного кольца, имеющего дополнительный атом углерода или гетероатом, такой как в случае ангидрогексита, альтрита, маннита, циклогексанила, циклогексенила и морфолино, который также имеет фосфорамидатный остов); полициклические формы (например, трицикло; и "разомкнутые" формы, такие как нуклеиновая кислота с гликолем (GNA) (например, R-GNA или S-GNA, где рибоза заменена элементами гликоля, связанными с фосфодиэфирными связями), нуклеиновая кислота с треозой (TNA, где рибоза заменена α-L-треофуранозилом-(3′→2′)) и пептидная нуклеиновая кислота (PNA, где 2-аминоэтилглициновые связи заменяют рибозу и фосфодиэфирный остов). Группа сахара также может содержать один или несколько атомов углерода, которые обладают противоположной стереохимической конфигурацией относительно конфигурации соответствующего атома углерода в рибозе. Таким образом, полинуклеотидная молекула может включать нуклеотиды, содержащие, например, арабинозу, в качестве сахара.
Модификации основания нуклеиновой кислоты
Настоящее изобретение относится к модифицированным нуклеозидам и нуклеотидам. Как описано в настоящем описании. "нуклеозид" определяют как соединение, содержащее молекулу сахара (например, пентозу или рибозу) или ее производное в комбинации с органическим основанием (например, пурином или пиримидином) или его производным (также обозначаемым в настоящем описании как "основание нуклеиновой кислоты"). Как описано в настоящем описании, "нуклеотид" определяют как нуклеозид, включающий фосфатную группу. В некоторых вариантах осуществления нуклеозиды и нуклеотиды, описанные в настоящем описании, обычно являются химически модифицированными на поверхности большой бороздки. Иллюстративные неограничивающие модификации включают аминогруппу, тиольную группу, алкильную группу, группу галогена или любую группу, описанную в настоящем описании. Модифицированные нуклеотиды можно синтезировать любым подходящим способом, как описано в настоящем описании (например, химическими, ферментативными или рекомбинантными способами для включения одного или нескольких модифицированных или неприродных нуклеозидов).
Модифицированные пары нуклеотидных оснований охватывают не только стандартные пары оснований аденозин-тимин, аденозин-урацил или гуанозин-цитозин, но также пары оснований, образованные между нуклеотидами и/или модифицированными нуклеотидами, содержащими нестандартные или модифицированные основания, где расположение доноров водородных связей и акцепторов водородных связей позволяет образование водородных связей между нестандартным основанием и стандартным основанием или между двумя комплементарными нестандартными структурами оснований. Одним примером таких нестандартных пар оснований являются пары оснований между модифицированным нуклеотидом инозином и аденином, цитозином или урацилом.
Модифицированные нуклеозиды и нуклеотиды могут включать модифицированное основание нуклеиновой кислоты. Примеры оснований нуклеиновой кислоты, встречающихся в РНК, включают, но не ограничиваются ими, аденин, гуанин, цитозин и урацил. Примеры оснований нуклеиновой кислоты, встречающихся в ДНК, включают, но не ограничиваются ими, аденин, гуанин, цитозин и тимин. Эти основания нуклеиновых кислоты можно модифицировать или полностью заменять для обеспечения полинуклеотидных молекул, обладающих улучшенными свойствами, например, устойчивостью к нуклеазам, стабильностью, и эти свойства могут проявляться нарушением связывания связывающегося с большой бороздкой партнера. Например, нуклеозиды и нуклеотиды, описанные в настоящем описании, могут быть химически модифицированы на поверхности большой бороздки. В некоторых вариантах осуществления химические модификации большой бороздки могут включать аминогруппу, тиольную группу, алкильную группу или группу галогена.
В таблице 1 ниже представлены химические поверхности каждого канонического нуклеотида. Окружностями указаны атомы, составляющие соответствующие химические области.
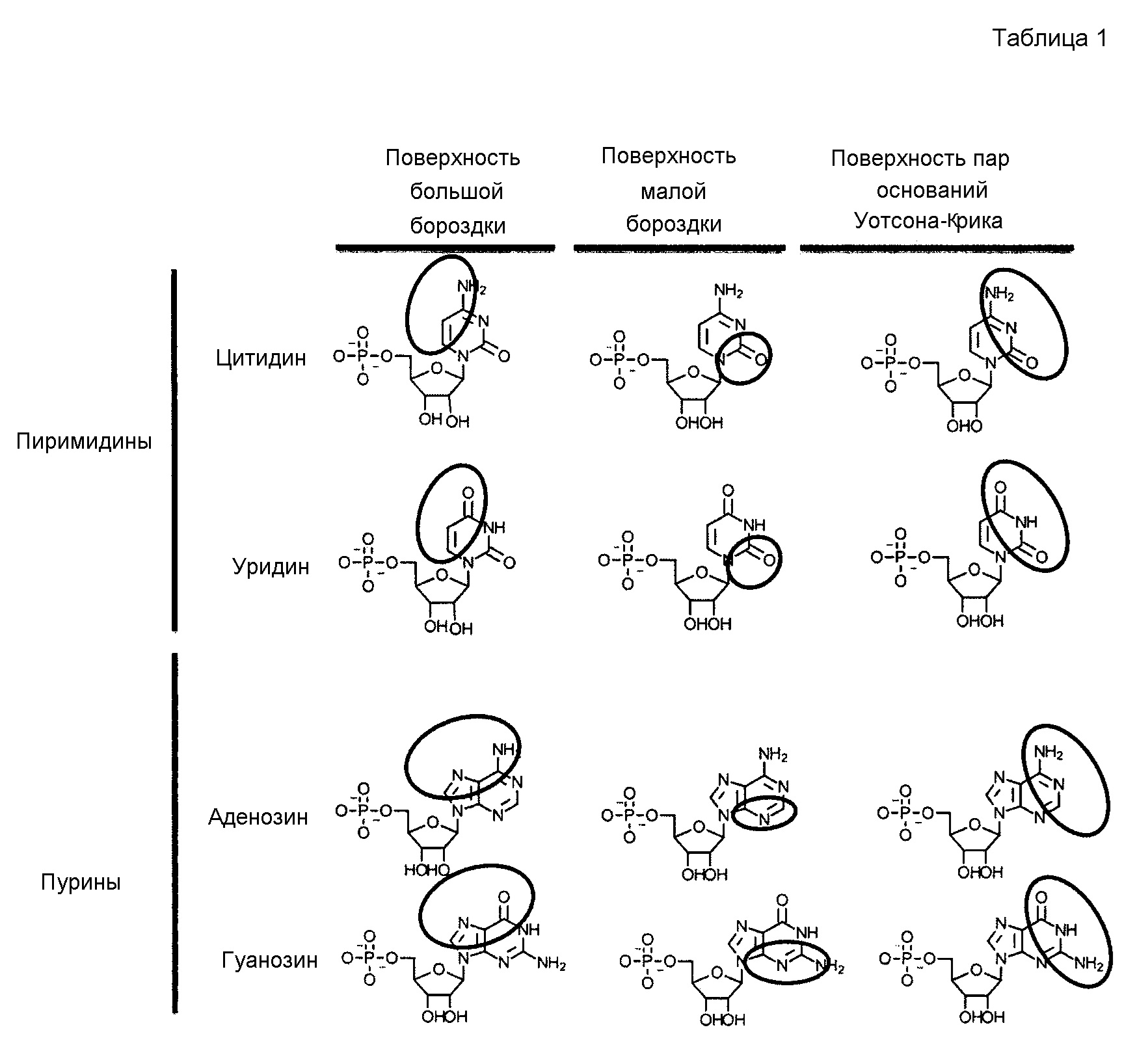
В некоторых вариантах осуществления B представляет собой модифицированный урацил. Иллюстративные модифицированные соединения урацила включают соединения формулы (b1)-(b5):
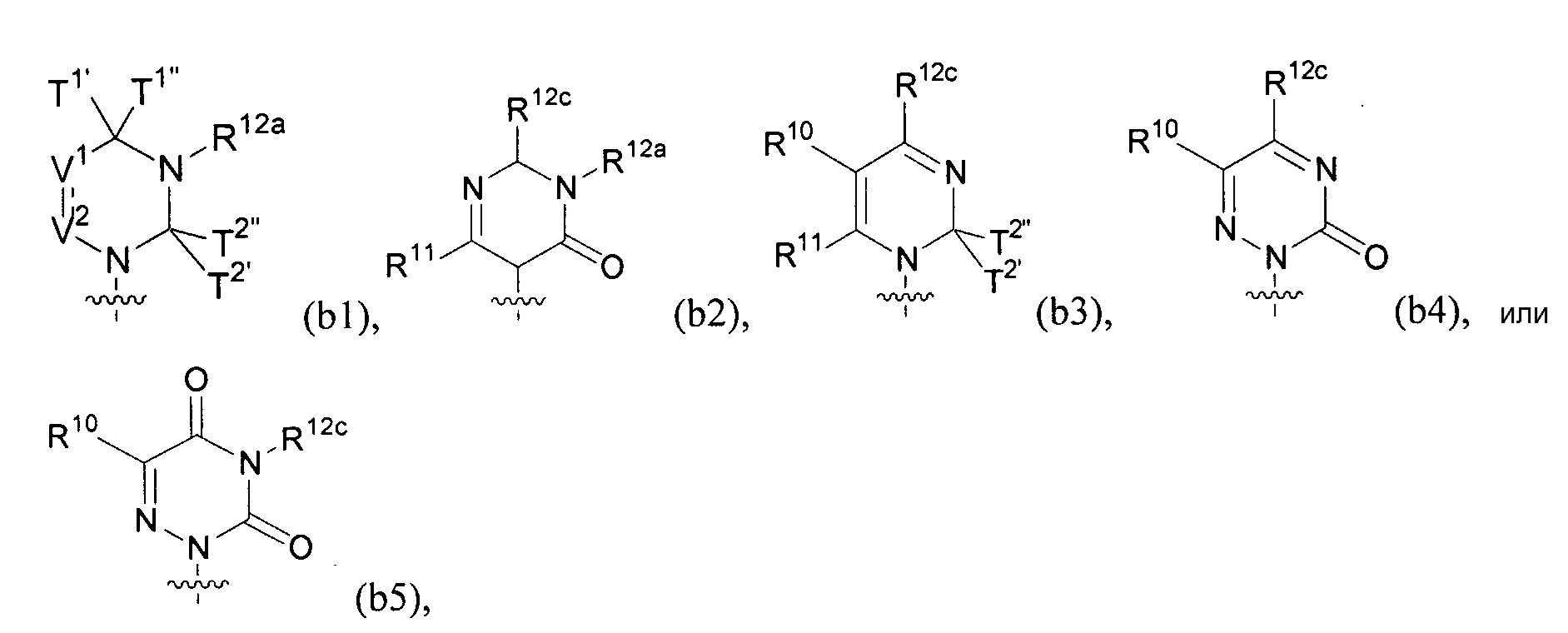
или их фармацевтически приемлемую соль или их стереоизомер, где

каждый из T1’, T1", T2′ и T2" независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкокси или необязательно замещенный тиоалкокси, или комбинация T1’ и T1" или комбинация T2′ и T2", связанных вместе (например, как в T2), образуют O (оксо), S (тио) или Se (селено);
каждый из V1 и V2 независимо представляет собой O, S, N(RVb)nv или C(RVb)nv, где nv представляет собой целое число от 0 до 2 и каждый RVb независимо представляет собой H, галоген, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный галогеналкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил), необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный ациламиноалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил), необязательно замещенный алкоксикарбонилалкил, необязательно замещенный алкоксикарбонилалкенил, необязательно замещенный алкоксикарбонилалкинил или необязательно замещенный алкоксикарбонилалкокси (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таким как заместители, выбранные из (1)-(21) для алкила);
R10 представляет собой H, галоген, необязательно замещенную аминокислоту, гидрокси, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный аминоалкил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный алкокси, необязательно замещенный алкоксикарбонилалкил, необязательно замещенный алкоксикарбонилалкенил, необязательно замещенный алкоксикарбонилалкинил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиалкил или необязательно замещенный карбамоилалкил;
R11 представляет собой H или необязательно замещенный алкил;
R12a представляет собой H, необязательно замещенный алкил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил, необязательно замещенный карбоксиалкил (например, необязательно замещенный гидрокси), необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиаминоалкил или необязательно замещенный карбамоилалкил; и
R12c представляет собой H, галоген, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный тиоалкокси, необязательно замещенный амино, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил.
Другие иллюстративные модифицированные соединения урацила включают соединения, имеющие формулу (b6)-(b9):
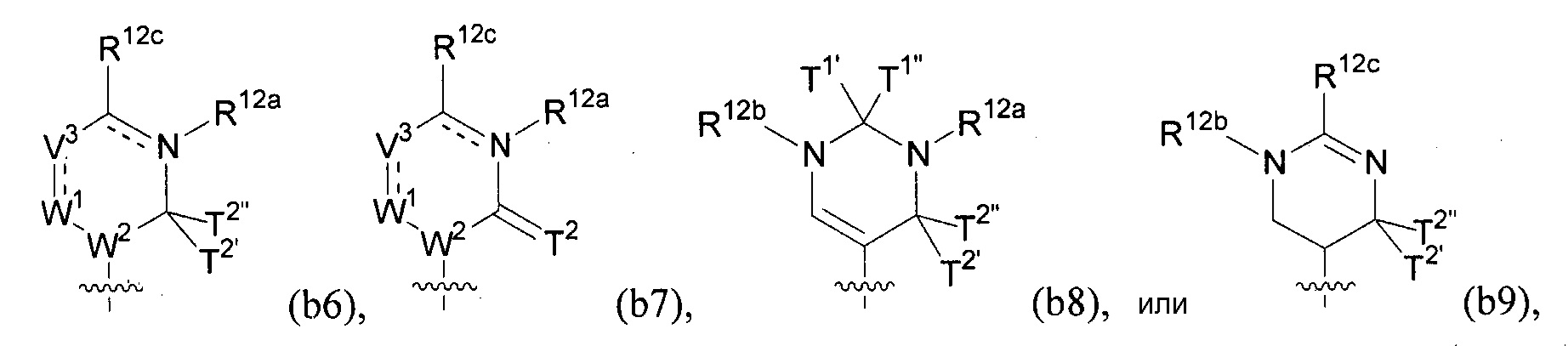
или их фармацевтически приемлемую соль или их стереоизомер, где

каждый из T1’, T1", T2′ и T2" независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкокси или необязательно замещенный тиоалкокси, или комбинация T1’ и T1", связанных вместе (например, как в T1), или комбинация T2′ и T2", связанных вместе (например, как в T2), образуют O (оксо), S (тио) или Se (селено), или каждый T1 и T2 независимо представляет собой O (оксо), S (тио) или Se (селено);
каждый W1 и W2 независимо представляет собой N(RWa)nw или C(RWa)nw, где nw представляет собой целое число от 0 до 2 и каждый RWa независимо представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
каждый V3 независимо представляет собой O, S, N(RVa)nv или C(RVa)nv, где nv представляет собой целое число от 0 до 2 и каждый RVa независимо представляет собой H, галоген, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил, необязательно замещенный алкокси, необязательно замещенный алкенилокси или необязательно замещенный алкинилокси, необязательно замещенный аминоалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил или сульфоалкилом), необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный ациламиноалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил), необязательно замещенный алкоксикарбонилалкил, необязательно замещенный алкоксикарбонилалкенил, необязательно замещенный алкоксикарбонилалкинил, необязательно замещенный алкоксикарбонилацил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный карбоксиалкил (например, необязательно замещенный гидрокси и/или O-защитной группой), необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиаминоалкил или необязательно замещенный карбамоилалкил (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таким как заместители, выбранные из (1)-(21) для алкила), и где RVa и R12c, взятые вместе с атомами углерода, к которым они присоединены, могут образовывать необязательно замещенный циклоалкил, необязательно замещенный арил или необязательно замещенный гетероциклил (например, 5- или 6-членное кольцо);
R12a представляет собой H, необязательно замещенный алкил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный карбоксиалкил (например, необязательно замещенный гидрокси и/или O-защитной группой), необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиаминоалкил, необязательно замещенный карбамоилалкил или отсутствует;
R12b представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный алкарил, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил, необязательно замещенную аминокислоту, необязательно замещенный алкоксикарбонилацил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный алкоксикарбонилалкил, необязательно замещенный алкоксикарбонилалкенил, необязательно замещенный алкоксикарбонилалкинил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный карбоксиалкил (например, необязательно замещенный гидрокси и/или O-защитной группой), необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиаминоалкил или необязательно замещенный карбамоилалкил,
где комбинация R12b и T1’ или комбинация R12b и R12c, связанных вместе, могут образовывать необязательно замещенный гетероциклил; и
R12c представляет собой H, галоген, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный тиоалкокси, необязательно замещенный амино, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил.
Кроме того, иллюстративные модифицированные соединения урацила включают соединения, имеющие формулу (b28)-(b31):
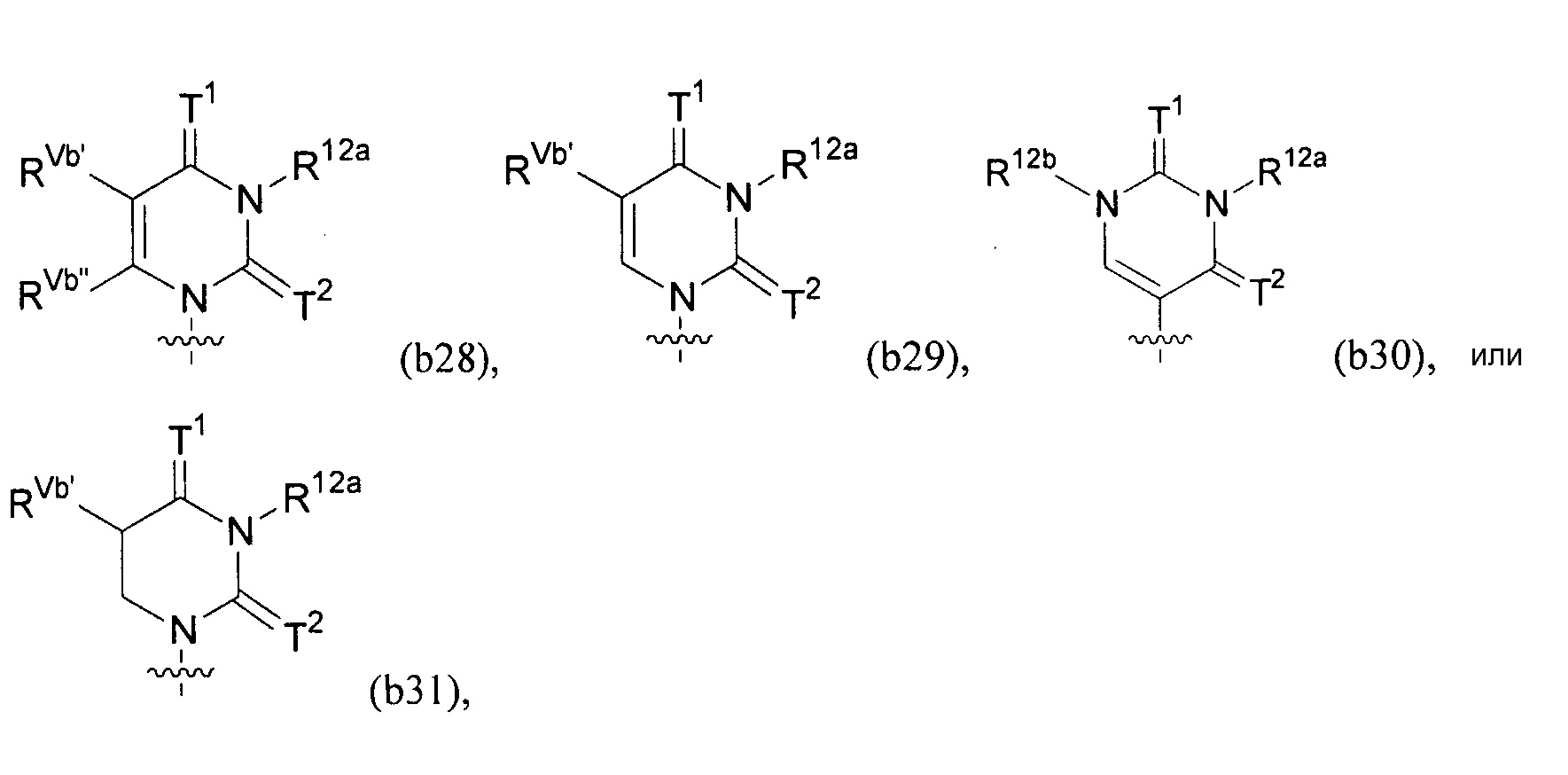
или их фармацевтически приемлемую соль или их стереоизомер, где
каждый из T1и T2 независимо представляет собой O (оксо), S (тио) или Se (селено);
каждый RVb’ и RVb" независимо представляет собой H, галоген, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный галогеналкил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил или сульфоалкил), необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный ациламиноалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил), необязательно замещенный алкоксикарбонилалкил, необязательно замещенный алкоксикарбонилалкенил, необязательно замещенный алкоксикарбонилалкинил, необязательно замещенный алкоксикарбонилацил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный карбоксиалкил (например, необязательно замещенный гидрокси и/или O-защитной группой), необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиаминоалкил или необязательно замещенный карбамоилалкил (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таким как заместители, выбранные из (1)-(21) для алкила) (например, RVb’ представляет собой необязательно замещенный алкил, необязательно замещенный алкенил или необязательно замещенный аминоалкил, например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил или сульфоалкил);
R12a представляет собой H, необязательно замещенный алкил, необязательно замещенный карбоксиаминоалкил, необязательно замещенный аминоалкил (например, например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил или сульфоалкил), необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил; и
R12b представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил (например, например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил или сульфоалкил), необязательно замещенный алкоксикарбонилацил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный алкоксикарбонилалкил, необязательно замещенный алкоксикарбонилалкенил, необязательно замещенный алкоксикарбонилалкинил, необязательно замещенный алкоксикарбонилалкокси, необязательно замещенный карбоксиалкокси, необязательно замещенный карбоксиалкил или необязательно замещенный карбамоилалкил.
В конкретных вариантах осуществления T1представляет собой O (оксо), и T2 представляет собой S (тио) или Se (селено). В других вариантах осуществления T1представляет собой S (тио), и T2 представляет собой O (оксо) или Se (селено). В некоторых вариантах осуществления RVb’ представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси.
В других вариантах осуществления каждый R12a и R12b независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил или необязательно замещенный гидроксиалкил. В конкретных вариантах осуществления R12a представляет собой H. В других вариантах осуществления как R12a, так и R12b представляют собой H.
В некоторых вариантах осуществления каждый RVb’ в R12b независимо представляет собой необязательно замещенный аминоалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например, трифторацетил или сульфоалкил), необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил или необязательно замещенный ациламиноалкил (например, замещенный N-защитной группой, такой как любая из защитных групп, описанных в настоящем описании, например трифторацетил). В некоторых вариантах осуществления амино и/или алкил необязательно замещенного аминоалкила замещен одним или несколькими из необязательно замещенного алкила, необязательно замещенного алкенила, необязательно замещенного сульфоалкила, необязательно замещенного карбокси (например, замещенного O-защитной группой), необязательно замещенного гидрокси (например, замещенного O-защитной группой), необязательно замещенного карбоксиалкила (например, замещенного O-защитной группой), необязательно замещенного алкоксикарбонилалкила (например, замещенного O-защитной группой) или N-защитной группы. В некоторых вариантах осуществления необязательно замещенный аминоалкил замещен необязательно замещенным сульфоалкилом или необязательно замещенным алкенилом. В конкретных вариантах осуществления как R12a, так и RVb" представляют собой H. В конкретных вариантах осуществления T1представляет собой O (оксо), и T2 представляет собой S (тио) или Se (селено).
В некоторых вариантах осуществления RVb’ представляет собой необязательно замещенный алкоксикарбонилалкил или необязательно замещенный карбамоилалкил.
В конкретных вариантах осуществления необязательный заместитель для R12a, R12b, R12c или RVa представляет собой группу полиэтиленгликоля (например, -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил); или группу амино-полиэтиленгликоля (например, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил).
В некоторых вариантах осуществления B представляет собой модифицированный цитозин. Иллюстративные модифицированные соединения цитозина включают соединения формулы (b10)-(b14):
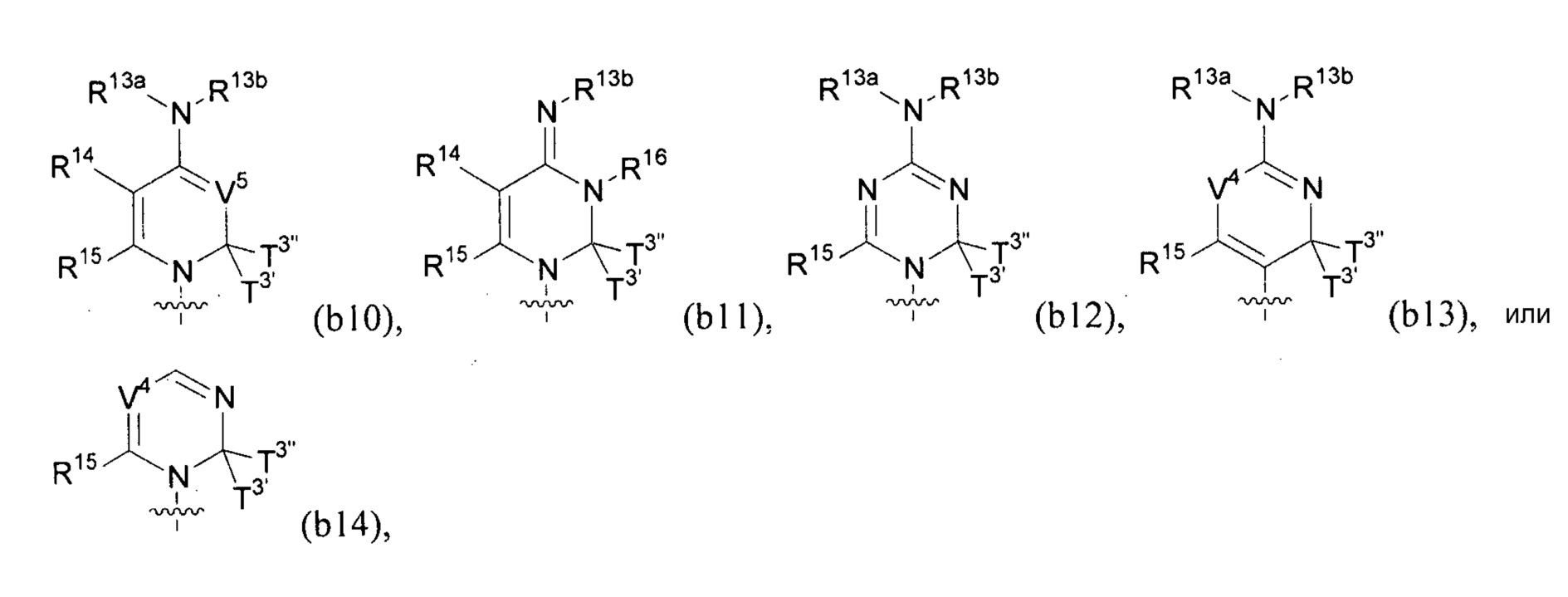
или их фармацевтически приемлемую соль или их стереоизомер, где
каждый из T3′ и T3" независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкокси или необязательно замещенный тиоалкокси, или комбинация T3′ и T3", связанных вместе (например, как в T3), образует O (оксо), S (тио) или Se (селено);
каждый V4 независимо представляет собой O, S, N(RVc)nv или C(RVc)nv, где nv представляет собой целое число от 0 до 2 и каждый RVc независимо представляет собой H, галоген, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил или необязательно замещенный алкинилокси (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таким как заместители, выбранные из (1)-(21) для алкила), где R13b в комбинации с RVc могут быть взяты вместе с образованием необязательно замещенного гетероциклила;
каждый V5 независимо представляет собой N(RVd)nv, или C(RVd)nv, где nv представляет собой целое число от 0 до 2 и каждый RVd независимо представляет собой H, галоген, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил или необязательно замещенный алкинилокси (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таким как заместители, выбранные из (1)-(21) для алкила) (например, V5 представляет собой -CH или N);
каждый из R13a и R13b независимо представляет собой H, необязательно замещенный ацил, необязательно замещенный ацилоксиалкил, необязательно замещенный алкил или необязательно замещенный алкокси, где R13b в комбинации с R14, взятые вместе, могут образовывать необязательно замещенный гетероциклил;
каждый R14 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный ацил, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный галогеналкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил (например, замещенный O-защитной группой), необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный ацилоксиалкил, необязательно замещенный амино (например, -NHR, где R представляет собой H, алкил, арил или фосфорил), азидо, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил; и
каждый из R15 и R16 независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил или необязательно замещенный алкинил.
Кроме того, иллюстративные модифицированные соединения цитозина включают соединения, имеющие формулу (b32)-(b35):

или их фармацевтически приемлемую соль или их стереоизомер, где
каждый из T1 и T3 независимо представляет собой O (оксо), S (тио) или Se (селено);
каждый из R13a и R13b независимо представляет собой H, необязательно замещенный ацил, необязательно замещенный ацилоксиалкил, необязательно замещенный алкил или необязательно замещенный алкокси, где R13b в комбинации R14, взятые вместе, могут образовывать необязательно замещенный гетероциклил;
каждый R14 независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный ацил, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный галогеналкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил (например, замещенный O-защитной группой), необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный ацилоксиалкил, необязательно замещенный амино (например, -NHR, где R представляет собой H, алкил, арил или фосфорил), азидо, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил, необязательно замещенный аминоалкил (например, гидроксиалкил, алкил, алкенил или алкинил), необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил; и
каждый из R15 и R16 независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил или необязательно замещенный алкинил (например, R15 представляет собой H, и R16 представляет собой H или необязательно замещенный алкил).
В некоторых вариантах осуществления R15 представляет собой H, и R16 представляет собой H или необязательно замещенный алкил. В конкретных вариантах осуществления R14 представляет собой H, ацил или гидроксиалкил. В некоторых вариантах осуществления R14 представляет собой галоген. В некоторых вариантах осуществления как R14, так и R15 представляют собой H. В некоторых вариантах осуществления как R15, так и R16 представляют собой H. В некоторых вариантах осуществления каждый из R14, и R15, и R16 представляет собой H. В следующих вариантах осуществления каждый из R13a и R13b независимо представляет собой H или необязательно замещенный алкил.
Следующие неограничивающие примеры модифицированных соединений цитозина включают соединения формулы (b36):

или их фармацевтически приемлемую соль или их стереоизомер, где
каждый R13b независимо представляет собой H, необязательно замещенный ацил, необязательно замещенный ацилоксиалкил, необязательно замещенный алкил или необязательно замещенный алкокси, где R13b в комбинации с R14b, взятые вместе, могут образовывать необязательно замещенный гетероциклил;
каждый R14a и R14b независимо представляет собой H, галоген, гидрокси, тиол, необязательно замещенный ацил, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный галогеналкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил (например, замещенный O-защитной группой), необязательно замещенный гидроксиалкенил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси, необязательно замещенный аминоалкокси, необязательно замещенный алкоксиалкокси, необязательно замещенный ацилоксиалкил, необязательно замещенный амино (например, -NHR, где R представляет собой H, алкил, арил, фосфорил, необязательно замещенный аминоалкил или необязательно замещенный карбоксиаминоалкил), азидо, необязательно замещенный арил, необязательно замещенный гетероциклил, необязательно замещенный алкгетероциклил, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил или необязательно замещенный аминоалкинил; и
каждый R15 независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил или необязательно замещенный алкинил.
В конкретных вариантах осуществления R14b представляет собой необязательно замещенную аминокислоту (например, необязательно замещенный лизин). В некоторых вариантах осуществления R14a представляет собой H.
В некоторых вариантах осуществления B представляет собой модифицированный гуанин. Иллюстративные модифицированные соединения гуанина включают соединения формулы (b15)-(b17):
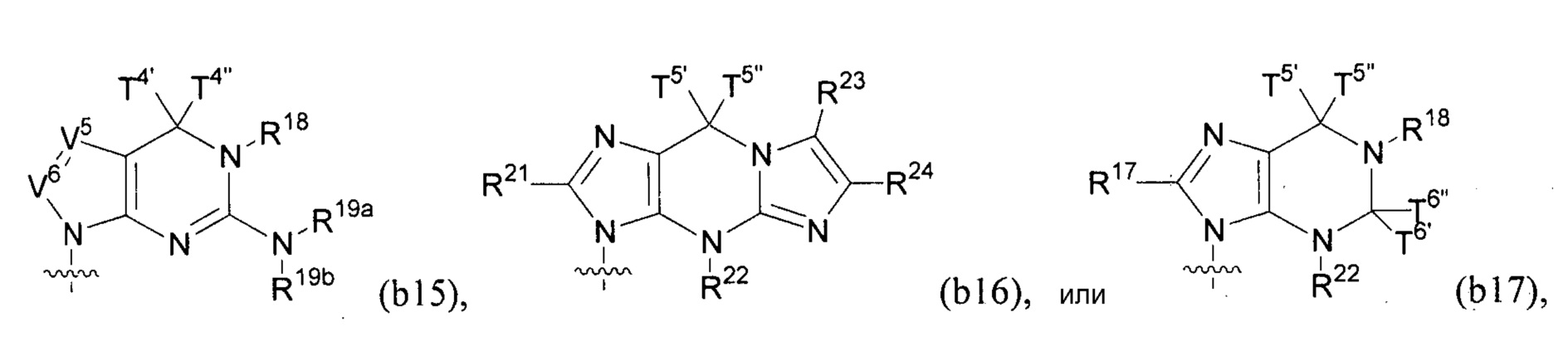
или их фармацевтически приемлемую соль или их стереоизомер, где
каждый из T4’,T4", T5′, T5", T6’ и T6" независимо представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси, и где комбинация T4’ и T4" (например, как в T4) или комбинация T5′ и T5" (например, как в T5) или комбинация T6’ и T6", связанных вместе (например, как в T6), образует O (оксо), S (тио) или Se (селено);
каждый из V5 и V6 независимо представляет собой O, S, N(RVd)nv или C(RVd)nv, где nv представляет собой целое число от 0 до 2 и каждый RVd независимо представляет собой H, галоген, тиол, необязательно замещенную аминокислоту, циано, амидин, необязательно замещенный аминоалкил, необязательно замещенный аминоалкенил, необязательно замещенный аминоалкинил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси, необязательно замещенный алкинилокси (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таком как заместитель, выбранный из (1)-(21) для алкила), необязательно замещенный тиоалкокси или необязательно замещенный амино; и
каждый из R17, R18, R19a, R19b, R21, R22, R23 и R24 независимо представляет собой H, галоген, тиол, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный тиоалкокси, необязательно замещенный амино или необязательно замещенную аминокислоту.
Иллюстративные модифицированные соединения гуанозина включают соединения формулы (b37)-(b40):
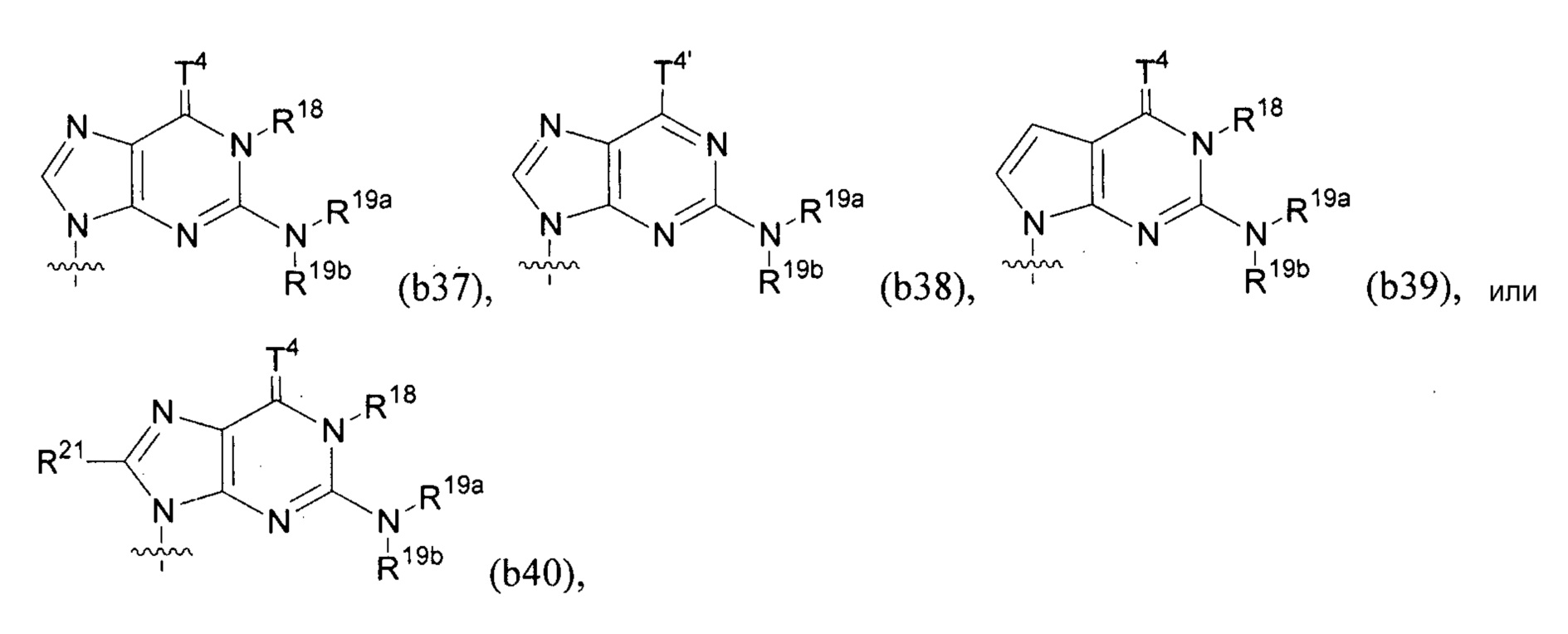
или их фармацевтически приемлемую соль или их стереоизомер, где
каждый из T4’ независимо представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси, и каждый T4 независимо представляет собой O (оксо), S (тио) или Se (селено);
каждый из R18, R19a, R19b и R21 независимо представляет собой H, галоген, тиол, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный тиоалкокси, необязательно замещенный амино или необязательно замещенную аминокислоту.
В некоторых вариантах осуществления R18 представляет собой H или необязательно замещенный алкил. В следующих вариантах осуществления T4 представляет собой оксо. В некоторых вариантах осуществления каждый из R19a и R19b независимо представляет собой H или необязательно замещенный алкил.
В некоторых вариантах осуществления B представляет собой модифицированный аденин. Иллюстративные модифицированные соединения аденина включают соединения формулы (b18)-(b20):

или их фармацевтически приемлемую соль или их стереоизомер, где
каждый V7 независимо представляет собой O, S, N(RVe)nv или C(RVe)nv, где nv представляет собой целое число от 0 до 2 и каждый RVe независимо представляет собой H, галоген, необязательно замещенную аминокислоту, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный алкенилокси или необязательно замещенный алкинилокси (например, необязательно замещенный любым заместителем, описанным в настоящем описании, таким как заместители, выбранные из (1)-(21) для алкила);
каждый R25 независимо представляет собой H, галоген, тиол, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный тиоалкокси или необязательно замещенный амино;
каждый из R26a и R26b независимо представляет собой H, необязательно замещенный ацил, необязательно замещенную аминокислоту, необязательно замещенный карбамоилалкил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный алкокси или группу полиэтиленгликоля (например, -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил); или группу амино-полиэтиленгликоля (например, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил);
каждый R27 независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный тиоалкокси или необязательно замещенный амино;
каждый R28 независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил или необязательно замещенный алкинил; и
каждый R29 независимо представляет собой H, необязательно замещенный ацил, необязательно замещенную аминокислоту, необязательно замещенный карбамоилалкил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный алкокси или необязательно замещенный амино.
Иллюстративные модифицированные соединения аденина включают соединения формулы (b41)-(b43):

или их фармацевтически приемлемую соль или их стереоизомер, где
каждый R25 независимо представляет собой H, галоген, тиол, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный тиоалкокси или необязательно замещенный амино;
каждый из R26a и R26b независимо представляет собой H, необязательно замещенный ацил, необязательно замещенную аминокислоту, необязательно замещенный карбамоилалкил, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный гидроксиалкил, необязательно замещенный гидроксиалкенил, необязательно замещенный гидроксиалкинил, необязательно замещенный алкокси или группу полиэтиленгликоля (например, -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил); или группу амино-полиэтиленгликоля (например, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил); и
каждый R27 независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный алкинил, необязательно замещенный алкокси, необязательно замещенный тиоалкокси или необязательно замещенный амино.
В некоторых вариантах осуществления R26a представляет собой H, и R26b представляет собой необязательно замещенный алкил. В некоторых вариантах осуществления каждый из R26a и R26b независимо представляет собой необязательно замещенный алкил. В конкретных вариантах осуществления R27 представляет собой необязательно замещенный алкил, необязательно замещенный алкокси или необязательно замещенный тиоалкокси. В других вариантах осуществления R25 представляет собой необязательно замещенный алкил, необязательно замещенный алкокси или необязательно замещенный тиоалкокси.
В конкретных вариантах осуществления необязательный заместитель для R26a, R26bили R29 представляет собой группу полиэтиленгликоля (например, -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил); или группу амино-полиэтиленгликоля (например, -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил).
В некоторых вариантах осуществления B может иметь формулу (b21):

В некоторых вариантах осуществления B может иметь формулу (b22):

В некоторых вариантах осуществления B может иметь формулу (b23):
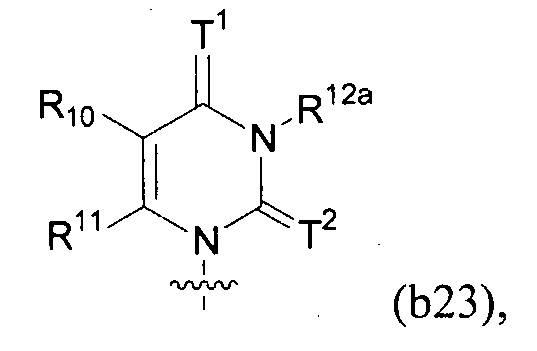
В некоторых вариантах осуществления B может иметь формулу (b24):
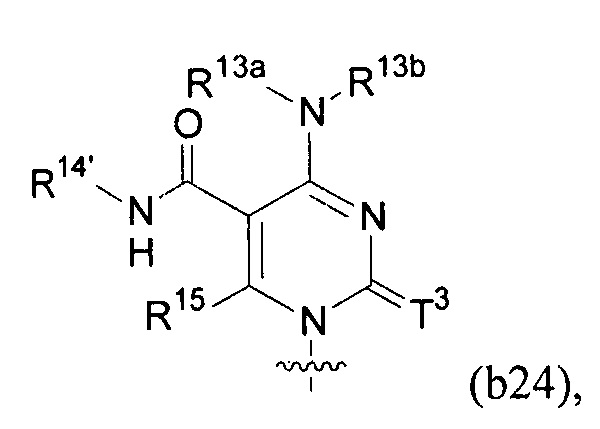
В некоторых вариантах осуществления B может иметь формулу (b25):
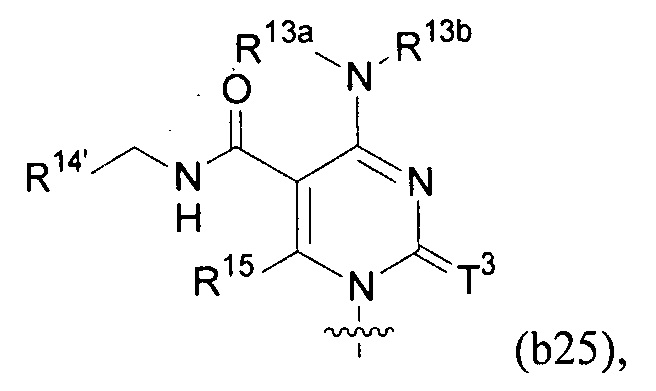
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты, выбранное из группы, состоящей из цитозина, гуанина, аденина и урацила. В некоторых вариантах осуществления B может представлять собой:
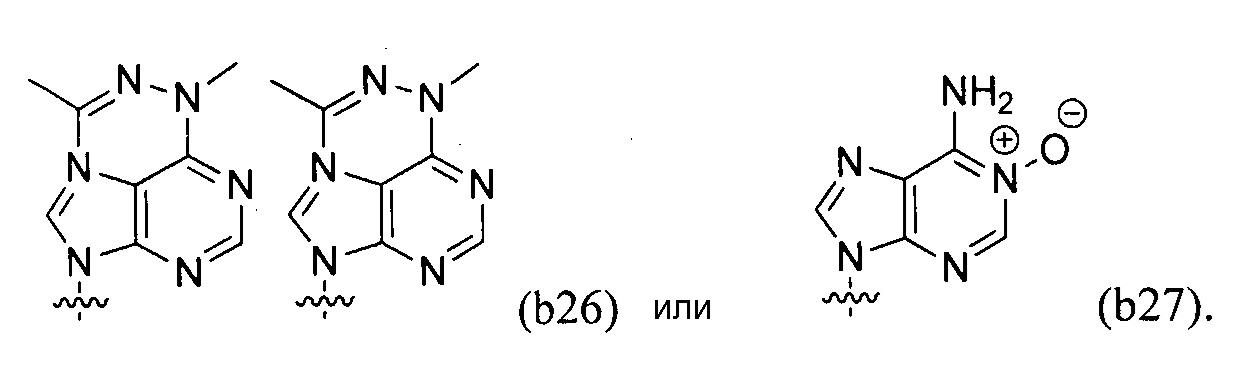
В некоторых вариантах осуществления модифицированное основание нуклеиновой кислоты представляет собой модифицированный урацил. Иллюстративные основания нуклеиновой кислоты и нуклеозиды, имеющие модифицированный урацил, включают псевдоуридин (ψ), пиридин-4-он-рибонуклеозид, 5-азауридин, 6-азауридин, 2-тио-5-азауридин, 2-тиоуридин (s2U), 4-тиоуридин (s4U), 4-тиопсевдоуридин, 2-тиопсевдоуридин, 5-гидроксиуридин (ho5U), 5-аминоаллилуридин, 5-галогенуридин (например, 5-йодуридин или 5-бромуридин), 3-метилуридин (m3U), 5-метоксиуридин (mo5U), уридин-5-оксиуксусную кислоту (cmo5U), метиловый эфир уридин-5-оксиуксусной кислоты (mcmo5U), 5-карбоксиметилуридин (cm5U), 1-карбоксиметилпсевдоуридин, 5-карбоксигидроксиметилуридин (chm5U), метиловый эфир 5-карбоксигидроксиметилуридина (mchm5U), 5-метоксикарбонилметил-уридин (mcm5U), 5-метоксикарбонилметил-2-тиоуридин (mcm5s2U), 5-аминометил-2-тиоуридин (nm5s2U), 5-метиламинометилуридин (mnm5U), 5-метиламинометил-2-тиоуридин (mnm5s2U), 5-метиламинометил-2-селеноуридин (mnm5se2U), 5-карбамоилметилуридин (ncm5U), 5-карбоксиметиламинометилуридин (cmnm5U), 5-карбоксиметиламинометил-2-тиоуридин (cmnm5s2U), 5-пропинилуридин, 1-пропинилпсевдоуридин, 5-тауринометилуридин (τm5U), 1-тауринометилпсевдоуридин, 5-тауринометил-2-тиоуридин(τm5s2U), 1-тауринометил-4-тиопсевдоуридин, 5-метилуридин (m5U, т.е. имеющий основание нуклеиновой кислоты дезокситимин), 1-метилпсевдоуридин (m1ψ), 5-метил-2-тиоуридин (m5s2U), 1-метил-4-тиопсевдоуридин (m1s4ψ), 4-тио-1-метилпсевдоуридин, 3-метилпсевдоуридин (m3ψ), 2-тио-1-метилпсевдоуридин, 1-метил-1-деазапсевдоуридин, 2-тио-1-метил-1-деазапсевдоуридин, дигидроуридин (D), дигидропсевдоуридин, 5,6-дигидроуридин, 5-метилдигидроуридин (m5D), 2-тиодигидроуридин, 2-тиодигидропсевдоуридин, 2-метоксиуридин, 2-метокси-4-тиоуридин, 4-метоксипсевдоуридин, 4-метокси-2-тиопсевдоуридин, N1-метилпсевдоуридин, 3-(3-амино-3-карбоксипропил)уридин (acp3U), 1-метил-3-(3-амино-3-карбоксипропил)псевдоуридин (acp3ψ), 5-(изопентениламинометил)уридин (inm5U), 5-(изопентениламинометил)-2-тиоуридин (inm5s2U), α-тиоуридин, 2′-O-метилуридин (Um), 5,2′-O-диметилуридин (m5Um), 2′-O-метилпсевдоуридин (ψm), 2-тио-2′-O-метилуридин (s2Um), 5-метоксикарбонилметил-2′-O-метилуридин (mcm5Um), 5-карбамоилметил-2′-O-метилуридин (ncm5Um), 5-карбоксиметиламинометил-2′-O-метилуридин (cmnm5Um), 3,2′-O-диметилуридин (m3Um) и 5-(изопентениламинометил)-2′-O-метилуридин (inm5Um) 1-тиоуридин, дезокситимидин, 2'-F-арауридин, 2ʹ-F-уридин, 2ʹ-OH-арауридин, 5-(2-карбометоксивинил)уридин и 5-[3-(1-Е-пропениламино)уридин].
В некоторых вариантах осуществления модифицированное основание нуклеиновой кислоты представляет собой модифицированный цитозин. Иллюстративные основания нуклеиновой кислоты и нуклеозиды, имеющие модифицированный цитозин, включают 5-азацитидин, 6-азацитидин, псевдоизоцитидин, 3-метилцитидин (m3C), N4-ацетилцитидин (ac4C), 5-формилцитидин (f5C), N4-метилцитидин (m4C), 5-метилцитидин (m5C), 5-галогенцитидин (например, 5-йодцитидин), 5-гидроксиметилцитидин (hm5C), 1-метилпсевдоизоцитидин, пирролоцитидин, пирролопсевдоизоцитидин, 2-тиоцитидин (s2C), 2-тио-5-метилцитидин, 4-тиопсевдоизоцитидин, 4-тио-1-метилпсевдоизоцитидин, 4-тио-1-метил-1-деазапсевдоизоцитидин, 1-метил-1-деазапсевдоизоцитидин, зебуларин, 5-азазебуларин, 5-метилзебуларин, 5-аза-2-тиозебуларин, 2-тиозебуларин, 2-метоксицитидин, 2-метокси-5-метилцитидин, 4-метоксипсевдоизоцитидин, 4-метокси-1-метилпсевдоизоцитидин, лизидин (k2C), α-тиоцитидин, 2′-O-метилцитидин (Cm), 5,2′-O-диметилцитидин (m5Cm), N4-ацетил-2′-O-метилцитидин (ac4Cm), N4,2′-O-диметилцитидин (m4Cm), 5-формил-2′-O-метилцитидин (f5Cm), N4,N4,2′-O-триметилцитидин (m42Cm), 1-тиоцитидин, 2ʹ-F-арацитидин, 2ʹ-F-цитидин и 2ʹ-OH-арацитидин.
В некоторых вариантах осуществления модифицированное основание нуклеиновой кислоты представляет собой модифицированный аденин. Иллюстративные основания нуклеиновой кислоты и нуклеозиды, имеющие модифицированный аденин, включают 2-аминопурин, 2,6-диаминопурин, 2-амино-6-галогенпурин (например, 2-амино-6-хлорпурин), 6-галогенпурин (например, 6-хлорпурин), 2-амино-6-метилпурин, 8-азидоаденозин, 7-деазааденин, 7-деаза-8-азааденин, 7-деаза-2-аминопурин, 7-деаза-8-аза-2-аминопурин, 7-деаза-2,6-диаминопурин, 7-деаза-8-аза-2,6-диаминопурин, 1-метиладенозин (m1A), 2-метиладенин (m2A), N6-метиладенозин (m6A), 2-метилтио-N6-метиладенозин (ms2m6A), N6-изопентениладенозин (i6A), 2-метилтио-N6-изопентениладенозин (ms2i6A), N6-(цис-гидроксиизопентенил)аденозин (io6A), 2-метилтио-N6-(цис-гидроксиизопентенил)аденозин (ms2io6A), N6-глицинилкарбамоиладенозин (g6A), N6-треонилкарбамоиладенозин (t6A), N6-метил-N6-треонилкарбамоиладенозин (m6t6A), 2-метилтио-N6-треонилкарбамоиладенозин (ms2g6A), N6,N6-диметиладенозин (m62A), N6-гидроксинорвалилкарбамоиладенозин (hn6A), 2-метилтио-N6-гидроксинорвалилкарбамоиладенозин (ms2hn6A), N6-ацетиладенозин (ac6A), 7-метиладенин, 2-метилтиоаденин, 2-метоксиаденин, α-тиоаденозин, 2′-O-метиладенозин (Am), N6,2′-O-диметиладенозин (m6Am), N6,N6,2′-O-триметиладенозин (m62Am), 1,2′-O-диметиладенозин (m1Am), 2′-O-рибозиладенозин (фосфат) (Ar(p)), 2-амино-N6-метилпурин, 1-тиоаденозин, 8-азидоаденозин, 2ʹ-F-арааденозин, 2ʹ-F-аденозин, 2ʹ-OH-арааденозин и N6-(19-аминопентаоксанонадецил)аденозин.
В некоторых вариантах осуществления модифицированное основание нуклеиновой кислоты представляет собой модифицированный гуанин. Иллюстративные основания нуклеиновых кислот и нуклеозиды, имеющие модифицированный гуанин, включают инозин (I), 1-метилинозин (m1I), виозин (imG), метилвиозин (mimG), 4-деметилвиозин (imG-14), изовиозин (imG2), вибутозин (yW), пероксивибутозин (o2yW), гидроксивибутозин (OHyW), недостаточно модифицированный гидроксивибутозин (OHyW*), 7-деазагуанозин, квеуозин (Q), эпоксиквеуозин (oQ), галактозилквеуозин (galQ), маннозилквеуозин (manQ), 7-циано-7-деазагуанозин (preQ0), 7-аминометил-7-деазагуанозин (preQ1), археозин (G+), 7-деаза-8-азагуанозин, 6-тиогуанозин, 6-тио-7-деазагуанозин, 6-тио-7-деаза-8-азагуанозин, 7-метилгуанозин (m7G), 6-тио-7-метилгуанозин, 7-метилинозин, 6-метоксигуанозин, 1-метилгуанозин (m1G), N2-метилгуанозин (m2G), N2,N2-диметилгуанозин (m22G), N2,7-диметилгуанозин (m2,7G), N2,N2,7-диметилгуанозин (m2,2,7G), 8-оксогуанозин, 7-метил-8-оксо-гуанозин, 1-метил-6-тиогуанозин, N2-метил-6-тиогуанозин, N2,N2-диметил-6-тиогуанозин, α-тиогуанозин, 2′-O-метилгуанозин (Gm), N2-метил-2′-O-метилгуанозин (m2Gm), N2,N2-диметил-2′-O-метилгуанозин (m22Gm), 1-метил-2′-O-метилгуанозин (m1Gm), N2,7-диметил-2′-O-метилгуанозин (m2,7Gm), 2′-O-метилинозин (Im), 1,2′-O-диметилинозин (m1Im), 2′-O-рибозилгуанозин (фосфат) (Gr(p)), 1-тиогуанозин, О6-метилгуанозин, 2ʹ-F-арагуанозин и 2ʹ-F-гуанозин.
В некоторых вариантах осуществления нуклеотид может быть модифицирован на поверхности большой бороздки. Например, такие модификации включают замену водорода в положении C-5 урацила или цитозина алкилом (например, метилом) или галогеном.
Основание нуклеиновой кислоты нуклеотида может быть независимо выбрано из пурина, пиримидина, аналога пурина или пиримидина. Например, каждое основание нуклеиновой кислоты может быть независимо выбрано из аденина, цитозина, гуанина, урацила или гипоксантина. В другом варианте осуществления основание нуклеиновой кислоты также может включать, например, встречающиеся в природе и синтетические производные основания, включая пиразолo[3,4-d]пиримидины, 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-пропинилурацил и цитозин, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген (например, 8-бром), 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, деазагуанин, 7-деазагуанин, 3-деазагуанин, деазааденин, 7-деазааденин, 3-деазааденин, пиразоло[3,4-d]пиримидин, имидазо[1,5-a]1,3,5-триазиноны, 9-деазапурины, имидазо[4,5-d]пиразины, тиазолo[4,5-d]пиримидины, пиразин-2-оны, 1,2,4-триазин, пиридазин; и 1,3,5-триазин.Когда нуклеотиды представлены с использованием краткого обозначения A, G, C, T или U, каждая буква относится к репрезентативному основанию и/или его производным, например, A включает аденин или аналоги аденина, например, 7-деазааденин).
В некоторых вариантах осуществления модифицированный нуклеотид представляет собой соединение формулы XI:
где:

U представляет собой O, S, -NRa- или -CRaRb-, когда


Z представляет собой H, C1-12 алкил или C6-20 арил, или Z отсутствует, когда

Z может представлять собой -CRaRb- и образует связь с A;
A представляет собой H, OH, NHR, где R = алкил или арил, или фосфорил, сульфат, -NH2, N3, азидо, -SH, N представляет собой аминокислоту, или пептид, содержащий 1-12 аминокислот;
D представляет собой H, OH, NHR, где R = алкил или арил, или фосфорил, -NH2, -SH, аминокислоту, пептид, пептид, содержащий 1-12 аминокислот, или группу формулы XII:

или A и D вместе с атомами углерода, с которыми они связаны, образуют 5-членное кольцо;
X представляет собой O или S;
каждый из Y1 независимо выбран из -ORa1, -NRa1Rb1 и -SRa1;
каждый из Y2 и Y3 независимо выбран из O, -CRaRb-, NRc, S или линкера, содержащего один или несколько атомов, выбранных из группы, состоящей из C, O, N и S;
n равно 0, 1, 2 или 3;
m равно 0, 1, 2 или 3;
B представляет собой основание нуклеиновой кислоты;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил;
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля;
каждый из Ra1 и Rb1 независимо представляет собой H или противоион; и
-ORc1 представляет собой OH при pH приблизительно 1 или -ORc1 представляет собой O- при физиологических значениях pH;
при условии, что кольцо, охватывающее переменные A, B, D, U, Z, Y2 и Y3, не может представлять собой рибозу.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты, выбранное из группы, состоящей из цитозина, гуанина, аденина и урацила.
В некоторых вариантах осуществления основание нуклеиновой кислоты представляет собой пиримидин или его производное.
В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение формулы XI-a:
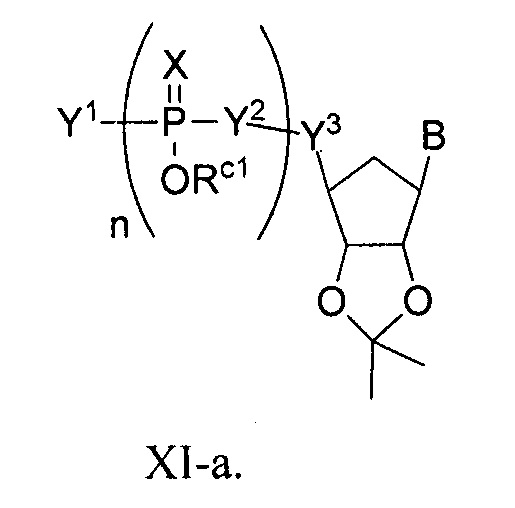
В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение формулы XI-b:

В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение формулы XI-c1, XI-c2 или XI-c3:
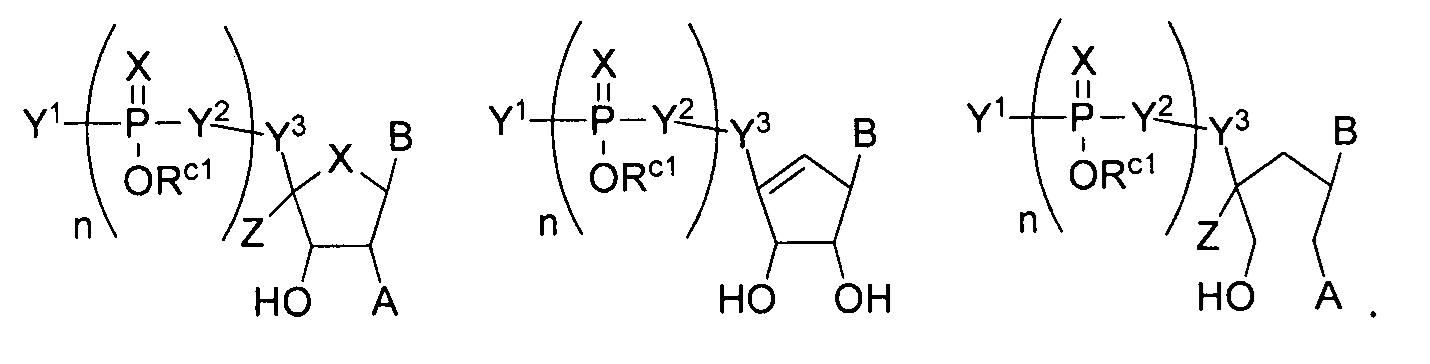
В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение формулы XI:
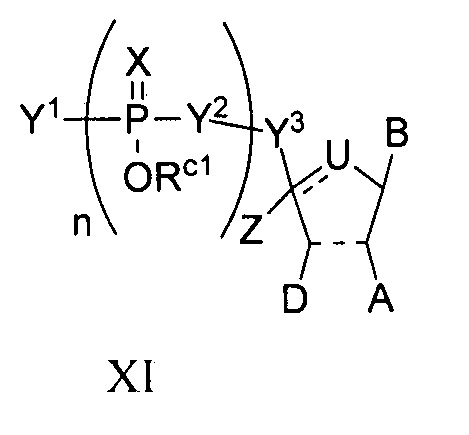
где:

U представляет собой O, S, -NRa- или -CRaRb-, когда


Z представляет собой H, C1-12 алкил или C6-20 арил, или Z отсутствует, когда

Z может представлять собой -CRaRb- и образует связь с A;
A представляет собой H, OH, сульфат, -NH2, -SH, аминокислоту или пептид, содержащий 1-12 аминокислот;
D представляет собой H, OH, -NH2, -SH, аминокислоту, пептид, содержащий 1-12 аминокислот, или группу формулы XII:
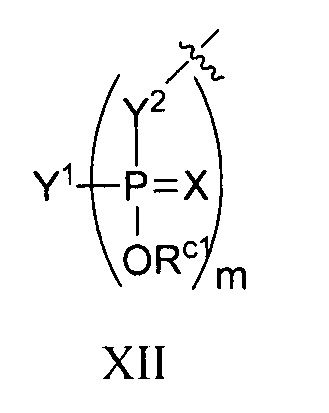
или A и D, вместе с атомами углерода, к которым они присоединены, образуют 5-членное кольцо;
X представляет собой O или S;
каждый из Y1 независимо выбран из -ORa1, -NRa1Rb1 и -SRa1;
каждый из Y2 и Y3 независимо выбран из O, -CRaRb-, NRc, S или линкера, содержащего один или несколько атомов, выбранных из группы, состоящей из C, O, N и S;
n равно 0, 1, 2 или 3;
m равно 0, 1, 2 или 3;
B представляет собой основание нуклеиновой кислоты формулы XIII:
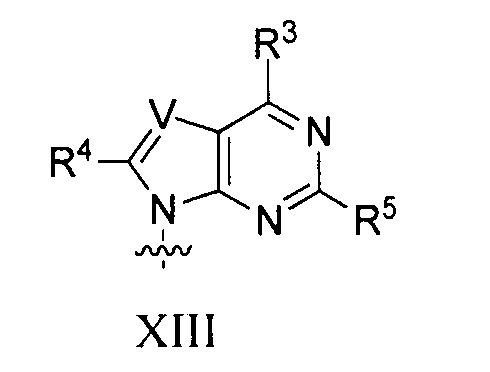
где:
V представляет собой N или положительно заряженный NRc;
R3 представляет собой NRcRd, -ORa или -SRa;
R4 представляет собой H или необязательно может образовывать связь с Y3;
R5 представляет собой H, -NRcRd или -ORa;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил;
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля;
каждый из Ra1 и Rb1 независимо представляет собой H или противоион; и
-ORc1 представляет собой OH при pH приблизительно 1 или -ORc1 представляет собой O- при физиологических значениях pH.
В некоторых вариантах осуществления B представляет собой:
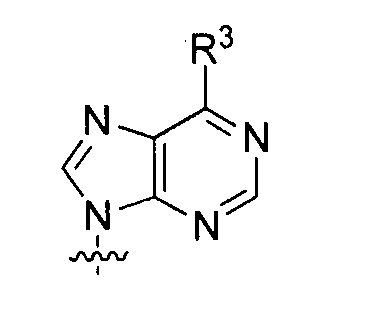
где R3 представляет собой -OH, -SH или
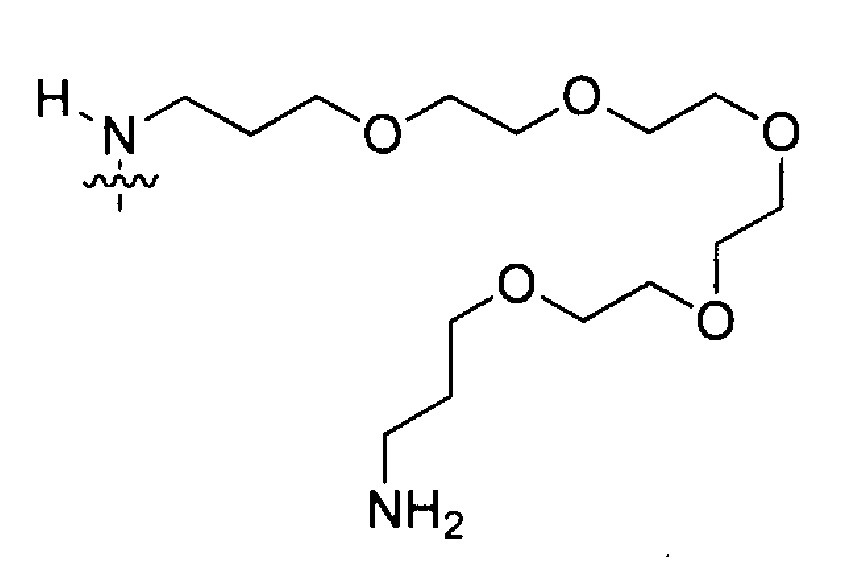
В некоторых вариантах осуществления B представляет собой:
В некоторых вариантах осуществления B представляет собой:
В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение формулы I-d:
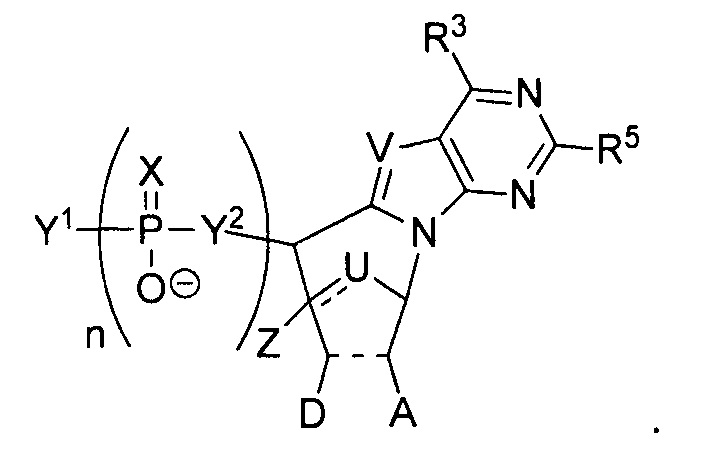
В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение, выбранное из группы, состоящей из:
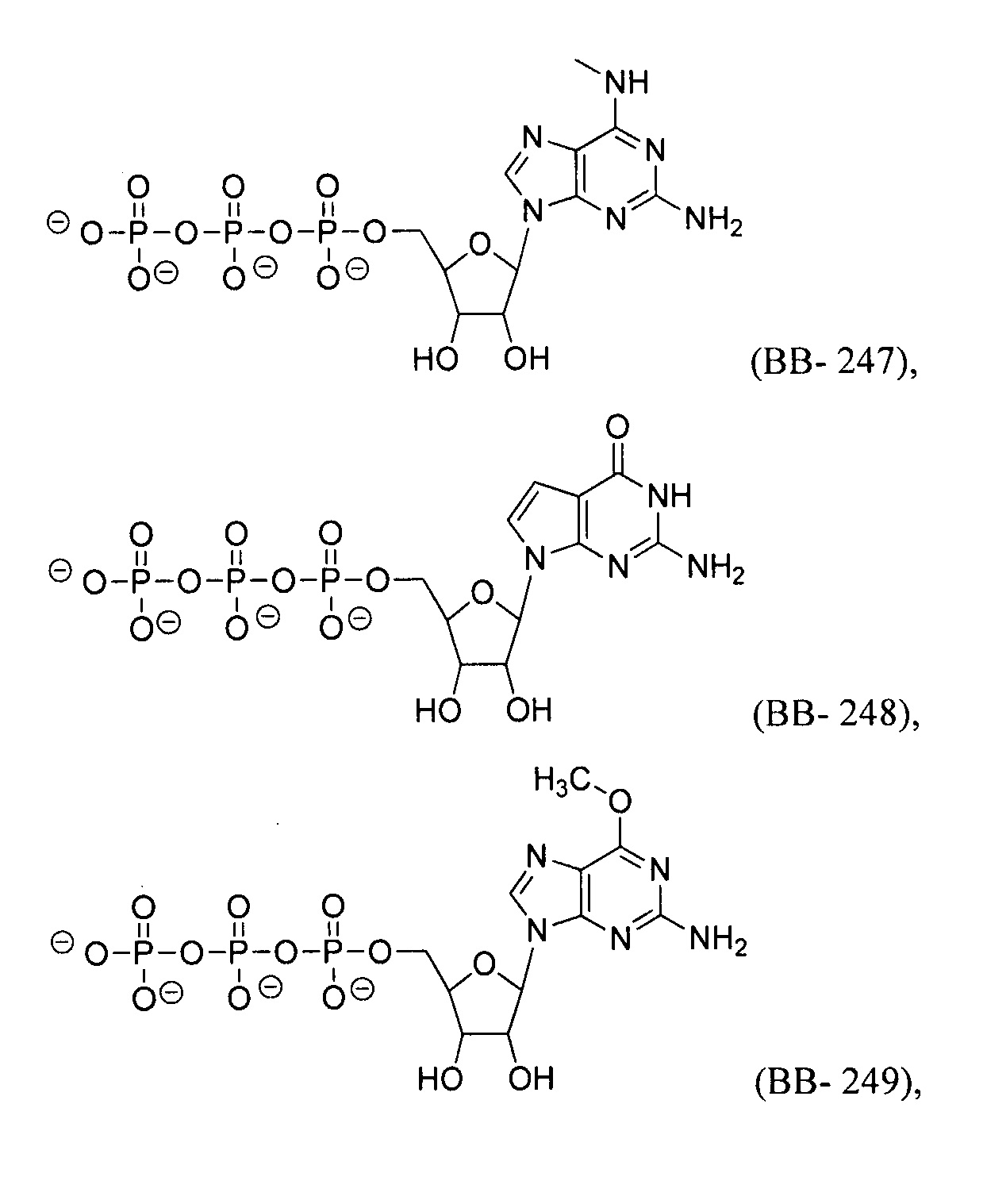

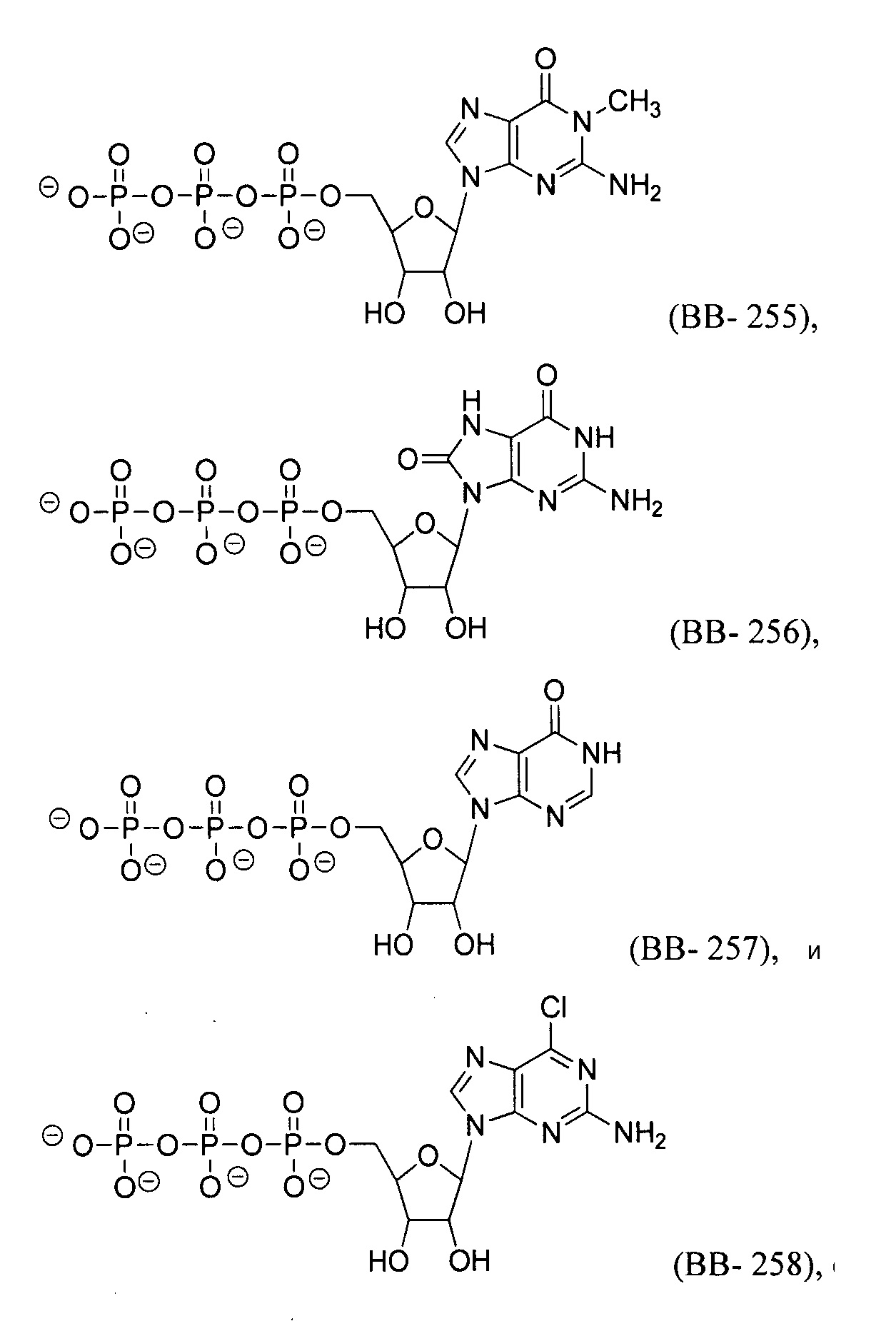
или их фармацевтически приемлемую соль.
В некоторых вариантах осуществления модифицированные нуклеотиды представляют собой соединение, выбранное из группы, состоящей из:
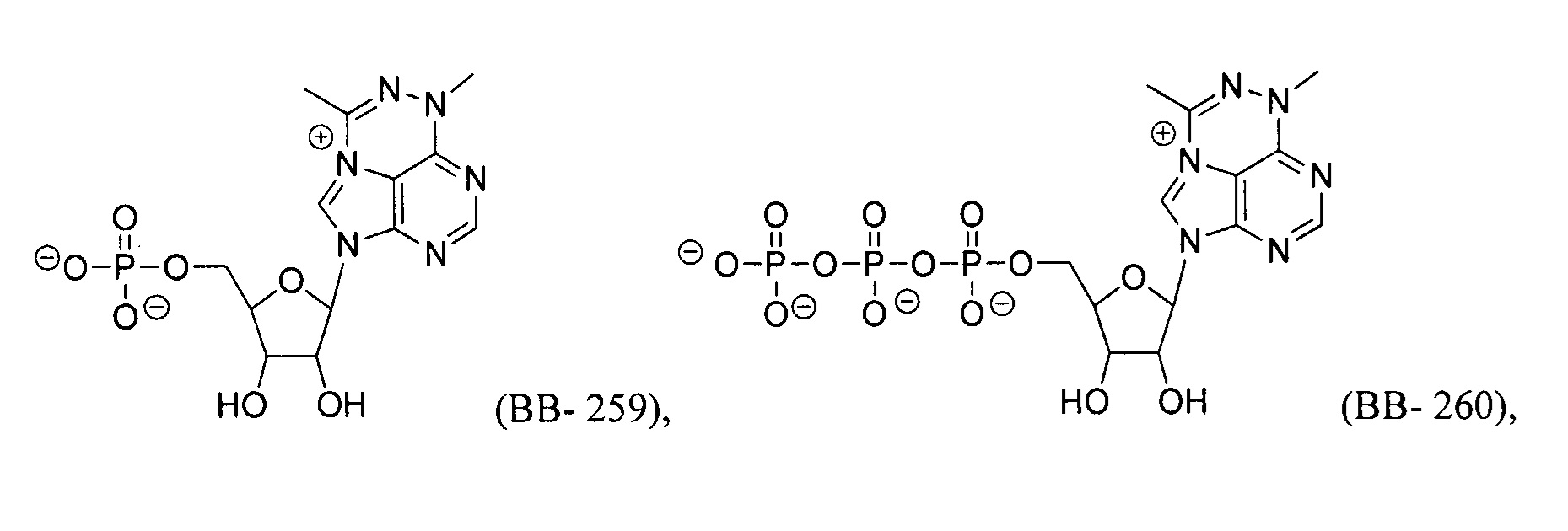
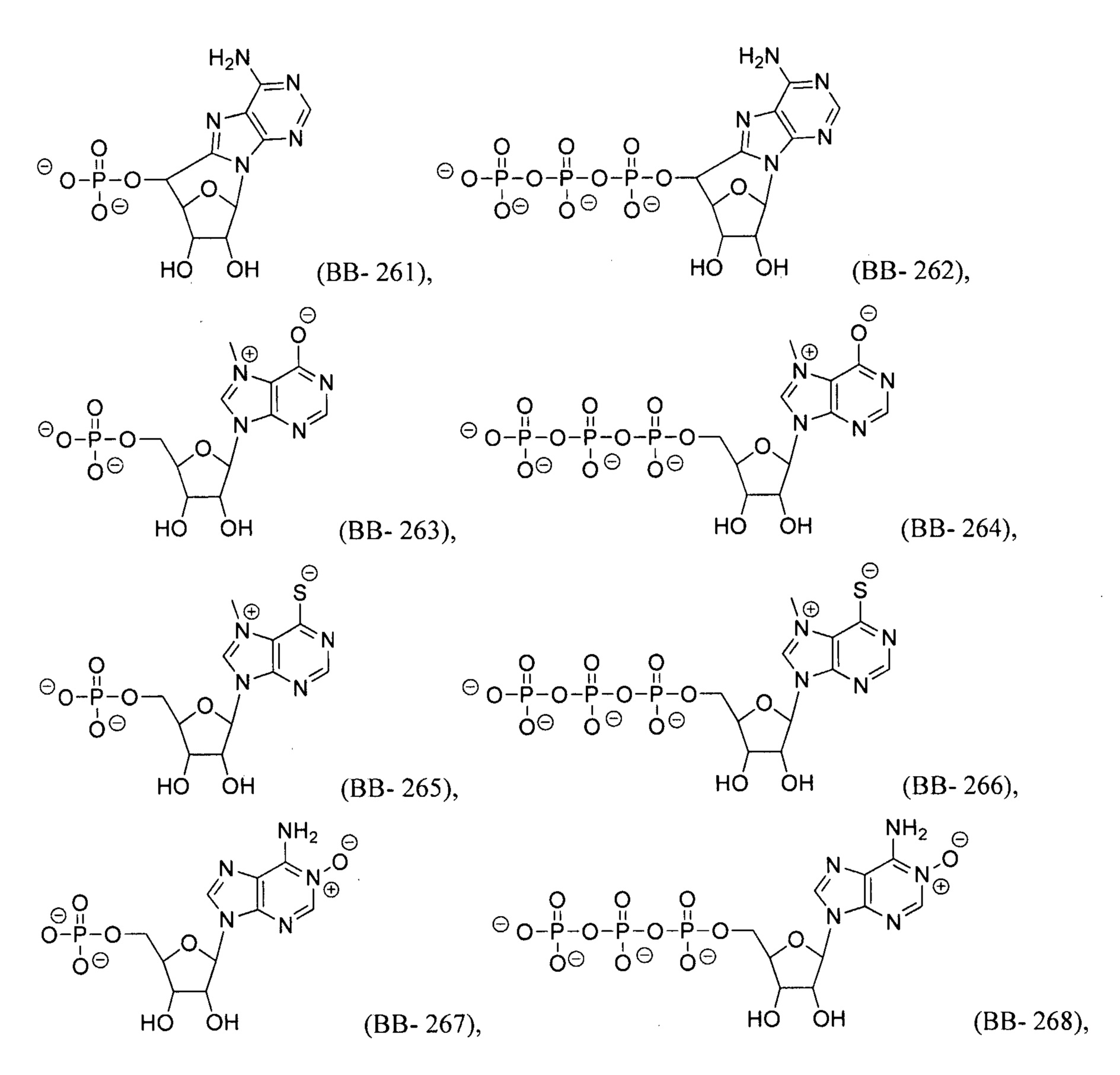
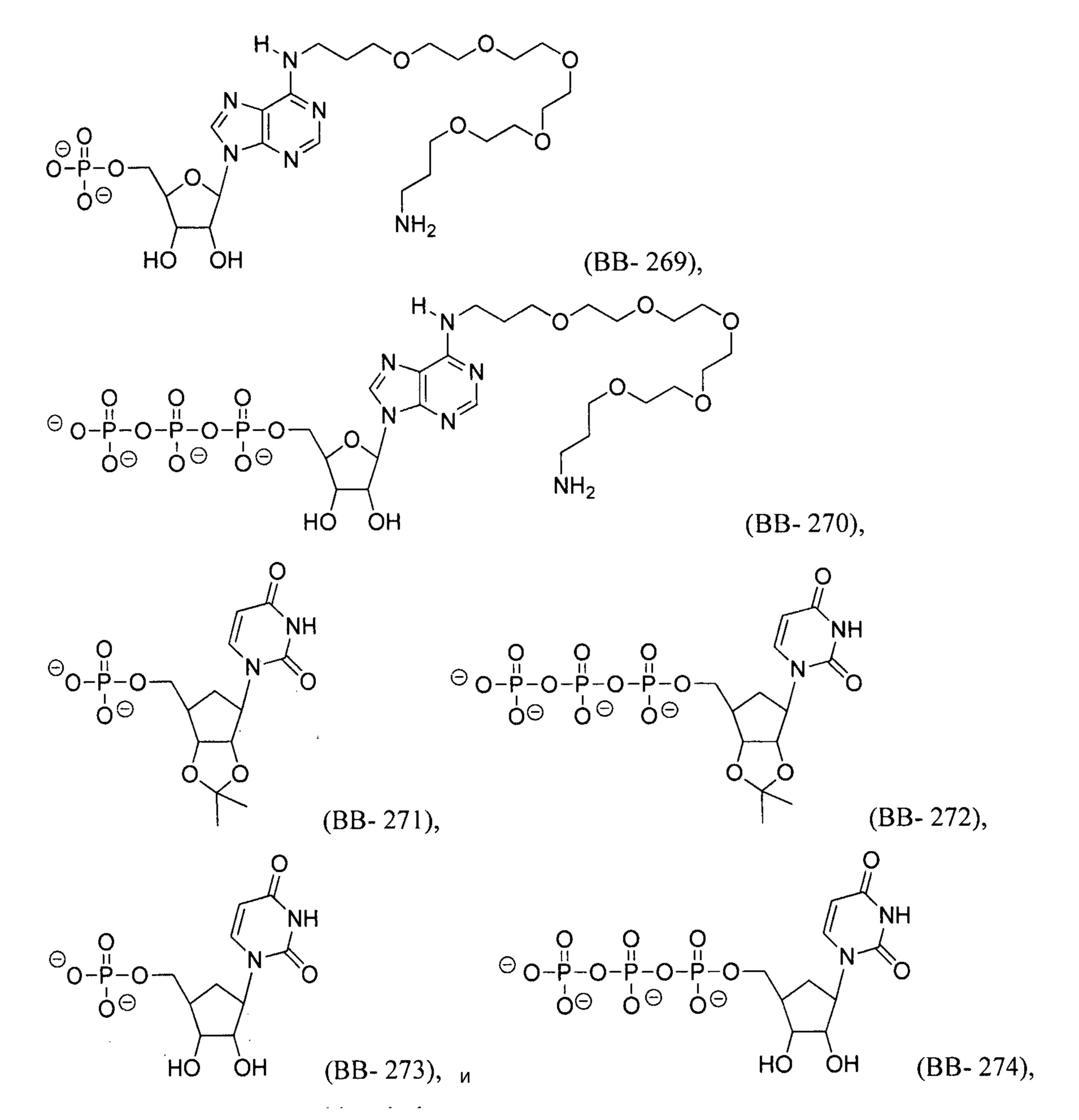
или их фармацевтически приемлемую соль.
Модификации межнуклеотидной связи
Модифицированные нуклеотиды, которые могут быть включены в полинуклеотидную молекулу, могут быть модифицированными по межнуклеозидной связи (например, фосфатный остов). В настоящем описании, в контексте полинуклеотидного остова, выражения "фосфатный" и "фосфодиэфирный" используют взаимозаменяемо. Фосфатные группы основной цепи можно модифицировать путем замены одного или нескольких атомов кислорода отличающимся заместителем. Кроме того, модифицированные нуклеозиды и нуклеотиды могут включать полную замену немодифицированной фосфатной части другой межнуклеозидной частью, как описано в настоящем описании. Примеры модифицированных фосфатных групп включают, но не ограничиваются ими, фосфоротиоат, фосфороселенаты, боранофосфаты, боранофосфатные сложные эфиры, гидрофосфонаты, фосфорамидаты, фосфородиамидаты, алкил- или арилфосфонаты и фосфотриэфиры. В фосфородитиоатах оба несвязывающих атома кислорода заменены серой. Фосфатный линкер также может быть модифицирован путем замены связывающего кислорода азотом (мостиковые фосфорамидаты), серой (мостиковые фосфоротиоаты) и углеродом (мостиковые метиленфосфонаты).
α-тио-замещенную фосфатную часть вносят для сообщения стабильности полимерам РНК и ДНК через неприродные фосфоротиоатные связи остова. Фосфоротиоатная ДНК и РНК имеют повышенную устойчивость к нуклеазам и, следовательно, более длительное время полужизни в клеточном окружении. Без связи с теорией, ожидается, что связанные фосфоротиоатом полинуклеотидные молекулы также уменьшают врожденный иммунный ответ через более слабое связывание/активацию молекул врожденного клеточного иммунитета.
В конкретных вариантах осуществления модифицированный нуклеозид включает альфа-тионуклеозид (например, 5′-O-(1-тиофосфат)аденозин, 5′-O-(1-тиофосфат)цитидин (α-тиоцитидин), 5′-O-(1-тиофосфат)гуанозин, 5′-O-(1-тиофосфат)уридин или 5′-O-(1-тиофосфат)псевдоуридин).
Другие межнуклеозидные связи, которые можно использовать в соответствии с настоящим изобретением, включая межнуклеозидные связи, которые не содержат атома фосфора, описаны в настоящем описании ниже.
Комбинации модифицированных сахаров, оснований нуклеиновых кислот и межнуклеозидных связей
Полинуклеотиды по изобретению могут включать комбинацию модификаций сахара, основания нуклеиновой кислоты и/или межнуклеозидной связи. Эти комбинации могут включать любую одну или несколько модификаций, описанных в настоящем описании. Например, любые из нуклеотидов, описанных в настоящем описании в формулах (Ia), (Ia-1)-(Ia-3), (Ib)-(If), (IIa)-(IIp), (IIb-1), (IIb-2), (IIc-1)-(IIc-2), (IIn-1), (IIn-2), (IVa)-(IVl) и (IXa)-(IXr), можно комбинировать с любым из оснований нуклеиновой кислоты, описанных в настоящем описании (например, в формулах (b1)-(b43) или любых других формулах, описанных в настоящем описании).
Синтез полинуклеотидных молекул
Полинуклеотидные молекулы для применения в соответствии с изобретением можно получать в соответствии с любым пригодным способом, как описано в настоящем описании. Модифицированные нуклеозиды и нуклеотиды, используемые в синтезе полинуклеотидных молекул, описанных в настоящем описании, можно получать из легкодоступных исходных материалов с использованием следующих общих способов и методик. Когда предоставлены типичные или предпочтительные условия процесса (например, температуры реакции, время, молярные соотношения реагентов, растворители, давление и т.д.), квалифицированный специалист может быть способен оптимизировать и разработать дополнительные условия процесса. Оптимальные условия реакции могут варьировать, в зависимости от конкретных используемых реагентов и растворителей, однако такие условия могут быть определены специалистом в данной области с помощью методик стандартного оптимизирования.
Мониторинг способов, описанных в настоящем описании, можно проводить любым подходящим способом, известным в данной области. Например, мониторинг образования продукта можно проводить спектроскопическими способами, такими как ядерная магнитно-резонансная спектроскопия (например,1H или13C), инфракрасная спектроскопия, спектрофотометрия (например, УФ-видимая) или масс-спектрометрия, или хроматографией, такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография.
Получение полинуклеотидных молекул по настоящему изобретению может вовлекать внесение и удаление защитной группы на различные химические группы. Специалист в данной области может без труда определить потребность во внесении и удалении защитных групп и может выбрать подходящие защитные группы. Химия защитных групп описана, например, в Greene, et al., Protective Groups in Organic Synthesis, 2nd Ed., Wiley & Sons, 1991, которая включена в настоящее описание в качестве ссылки в полном объеме.
Реакции процессов, описанных в настоящем описании, можно проводить в подходящих растворителях, которые может без труда выбрать специалист в области органического синтеза. Подходящие растворители могут быть по существу нереакционноспособными в отношении исходных материалов (реагентов), промежуточных соединений или продуктов при температурах, при которых проводят реакции, т.е. при температурах, которые могут находиться от температуры замерзания растворителя до температуры кипения растворителя. Конкретную реакцию можно проводить в растворителе или смеси более чем одного растворителя. В зависимости от конкретной стадии реакции, можно выбирать подходящие растворители.
Разделение рацемических смесей модифицированных полинуклеотидов или нуклеиновых кислот (например, полинуклеотиды или модифицированные молекулы мРНК) можно проводить любым из многочисленных способов, известных в данной области. Иллюстративный способ включает фракционную перекристаллизацию с использованием "хиральной разделяющей кислоты", которая является оптически активной солеобразующей органической кислотой. Подходящие разделяющие агенты для способов фракционной перекристаллизации представляют собой, например, оптически активные кислоты, такие как D- и L-формы виннокаменной кислоты, диацетилвиннокаменной кислоты, дибензоилвиннокаменной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различных оптически активных камфорсульфоновых кислот. Разделение рацемических смесей также можно проводить путем элюирования на колонке, упакованной оптически активным разделяющим агентом (например, динитробензоилфенилглицин). Специалист в данной области может определить подходящую композицию растворителей для элюирования.
Модифицированные нуклеозиды и нуклеотиды (например, молекулы структурных элементов) можно получать в соответствии со способами синтеза, описанными в Ogata et al., J. Org. Chem. 74:2585-2588 (2009); Purmal et al., Nucl. Acids Res. 22(1):72-78, (1994); Fukuhara et al., Biochemistry, 1(4):563-568 (1962); и Xu et al., Tetrahedron, 48(9):1729-1740 (1992), каждая из которых включена в настоящее описание в качестве ссылки в полном объеме.
Полинуклеотиды по изобретению могут быть или могут не быть единообразно модифицированными вдоль всей длины молекулы. Например, один или несколько или все типы нуклеотидов (например, пурин или пиримидин, или любой один или несколько или все из A, G, U, C) могут быть единообразно модифицированными в полинуклеотиде по изобретению, или в его данной области с заданной последовательностью. В некоторых вариантах осуществления все нуклеотиды X в полинуклеотиде по изобретению (или в его данной области последовательности) являются модифицированными, где X может представлять собой любые из нуклеотидов A, G, U, C, или любую из комбинаций A+G, A+U, A+C, G+U, G+C, U+C, A+G+U, A+G+C, G+U+C или A+G+C.
Различные модификации сахаров, модификации нуклеотидов и/или межнуклеозидных связей (например, структур остова) могут существовать в различных положениях в полинуклеотиде. Специалисту в данной области будет понятно, что нуклеотидные аналоги или другая модификация(и) могут быть расположены в любом положении(ях) полинуклеотида, так чтобы функция полинуклеотида существенно не снижалась. Модификация также может представлять собой 5′- или 3′-концевую модификацию. Полинуклеотид может содержать от приблизительно 1% до приблизительно 100% модифицированных нуклеотидов (либо в отношении общего содержания нуклеотидов, либо в отношении одного или нескольких типов нуклеотидов, т.е. любого одного или нескольких из A, G, U или C) или любой промежуточный процент (например, от 1% до 20%, от 1% до 25%, от 1% до 50%, от 1% до 60%, от 1% до 70%, от 1% до 80%, от 1% до 90%, от 1% до 95%, от 10% до 20%, от 10% до 25%, от 10% до 50%, от 10% до 60%, от 10% до 70%, от 10% до 80%, от 10% до 90%, от 10% до 95%, от 10% до 100%, от 20% до 25%, от 20% до 50%, от 20% до 60%, от 20% до 70%, от 20% до 80%, от 20% до 90%, от 20% до 95%, от 20% до 100%, от 50% до 60%, от 50% до 70%, от 50% до 80%, от 50% до 90%, от 50% до 95%, от 50% до 100%, от 70% до 80%, от 70% до 90%, от 70% до 95%, от 70% до 100%, от 80% до 90%, от 80% до 95%, от 80% до 100%, от 90% до 95%, от 90% до 100% и от 95% до 100%).
В некоторых вариантах осуществления полинуклеотид включает модифицированный пиримидин (например, модифицированный урацил/уридин/U или модифицированный цитозин/цитидин/C). В некоторых вариантах осуществления урацил или уридин (как правило: U) в полинуклеотидной молекуле может быть заменен посредством от приблизительно 1% до приблизительно 100% модифицированного урацила или модифицированного уридина (например, от 1% до 20%, от 1% до 25%, от 1% до 50%, от 1% до 60%, от 1% до 70%, от 1% до 80%, от 1% до 90%, от 1% до 95%, от 10% до 20%, от 10% до 25%, от 10% до 50%, от 10% до 60%, от 10% до 70%, от 10% до 80%, от 10% до 90%, от 10% до 95%, от 10% до 100%, от 20% до 25%, от 20% до 50%, от 20% до 60%, от 20% до 70%, от 20% до 80%, от 20% до 90%, от 20% до 95%, от 20% до 100%, от 50% до 60%, от 50% до 70%, от 50% до 80%, от 50% до 90%, от 50% до 95%, от 50% до 100%, от 70% до 80%, от 70% до 90%, от 70% до 95%, от 70% до 100%, от 80% до 90%, от 80% до 95%, от 80% до 100%, от 90% до 95%, от 90% до 100% и от 95% до 100% модифицированного урацила или модифицированного уридина). Модифицированный урацил или уридин могут быть заменены соединением, имеющим одну уникальную структуру, или множеством соединений, имеющих различных структуры (например, 2, 3, 4 или более уникальных структур, как описано в настоящем описании). В некоторых вариантах осуществления цитозин или цитидин (в общем: C) в полинуклеотидной молекуле может быть заменен модифицированным цитозином или модифицированным цитидином на от приблизительно 1% до приблизительно 100% (например, от 1% до 20%, от 1% до 25%, от 1% до 50%, от 1% до 60%, от 1% до 70%, от 1% до 80%, от 1% до 90%, от 1% до 95%, от 10% до 20%, от 10% до 25%, от 10% до 50%, от 10% до 60%, от 10% до 70%, от 10% до 80%, от 10% до 90%, от 10% до 95%, от 10% до 100%, от 20% до 25%, от 20% до 50%, от 20% до 60%, от 20% до 70%, от 20% до 80%, от 20% до 90%, от 20% до 95%, от 20% до 100%, от 50% до 60%, от 50% до 70%, от 50% до 80%, от 50% до 90%, от 50% до 95%, от 50% до 100%, от 70% до 80%, от 70% до 90%, от 70% до 95%, от 70% до 100%, от 80% до 90%, от 80% до 95%, от 80% до 100%, от 90% до 95%, от 90% до 100% и от 95% до 100% модифицированного цитозина или модифицированного цитидина). Модифицированный цитозин или цитидин могут быть заменены соединением, имеющим одну уникальную структуру, или множеством соединений, имеющих различные структуры (например, 2, 3, 4 или более уникальных структур, как описано в настоящем описании).
В некоторых вариантах осуществления настоящее изобретение относится к способам синтеза полинуклеотида (например, первая область, первая фланкирующая область или вторая фланкирующая область), включающего число n связанных нуклеозидов, имеющих формулу (Ia-1):
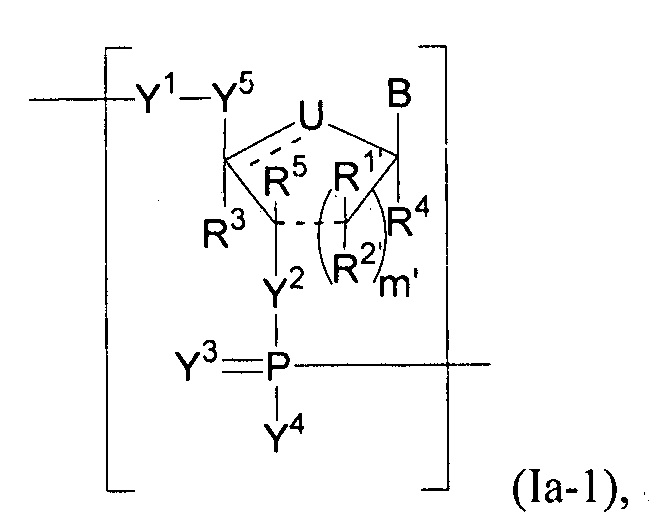
a) реакцию нуклеотида формулы (IV-1):
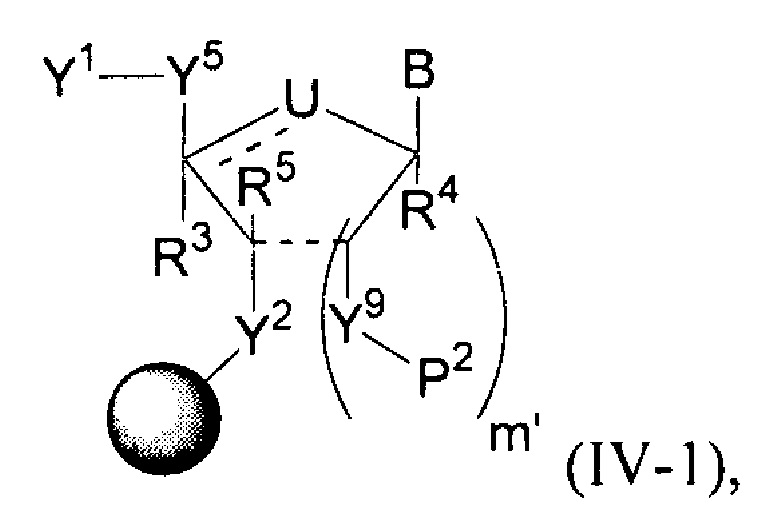
с фосфорамидитом соединения формулы (V-1):
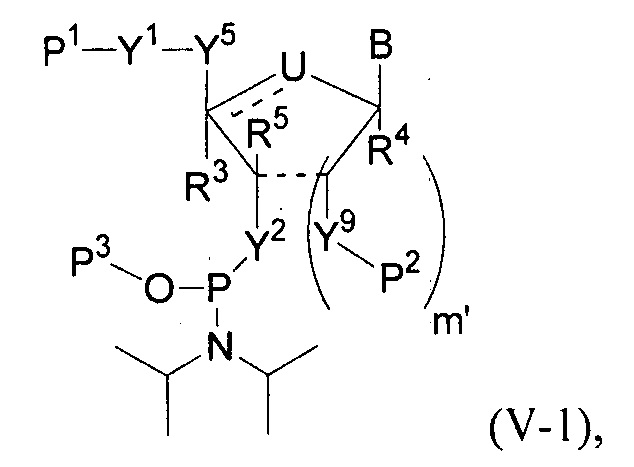
где Y9 представляет собой H, гидрокси, фосфорил, пирофосфат, сульфат, амино, тиол, необязательно замещенную аминокислоту или пептид (например, включающий от 2 до 12 аминокислот); и каждый P1, P2 и P3 независимо представляет собой подходящую защитную группу; и

с получением полинуклеотида формулы (VI-1):
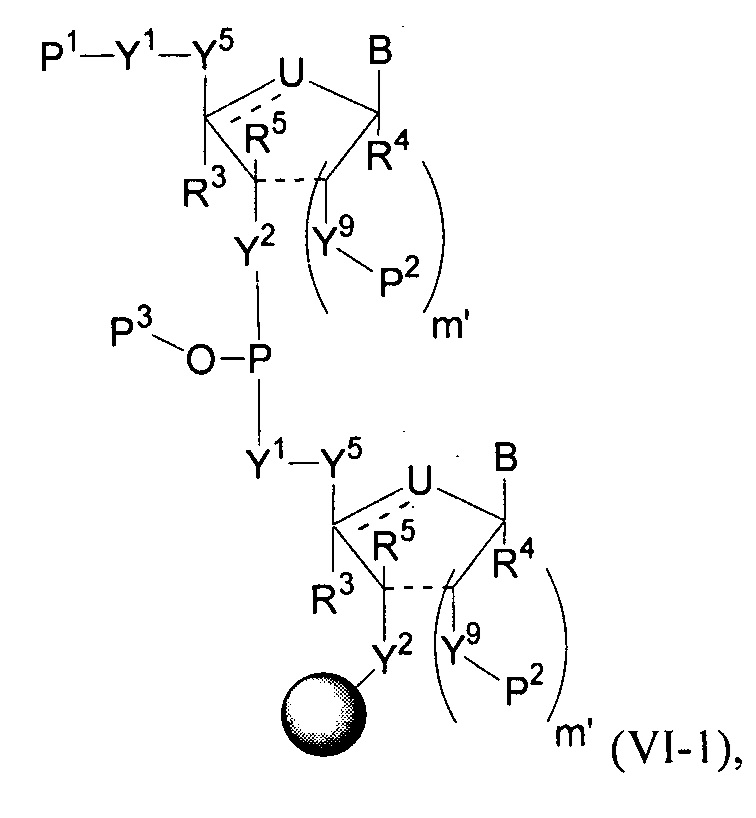
b) окисление или сульфуризацию полинуклеотида формулы (V) с получением полинуклеотида формулы (VII-1):
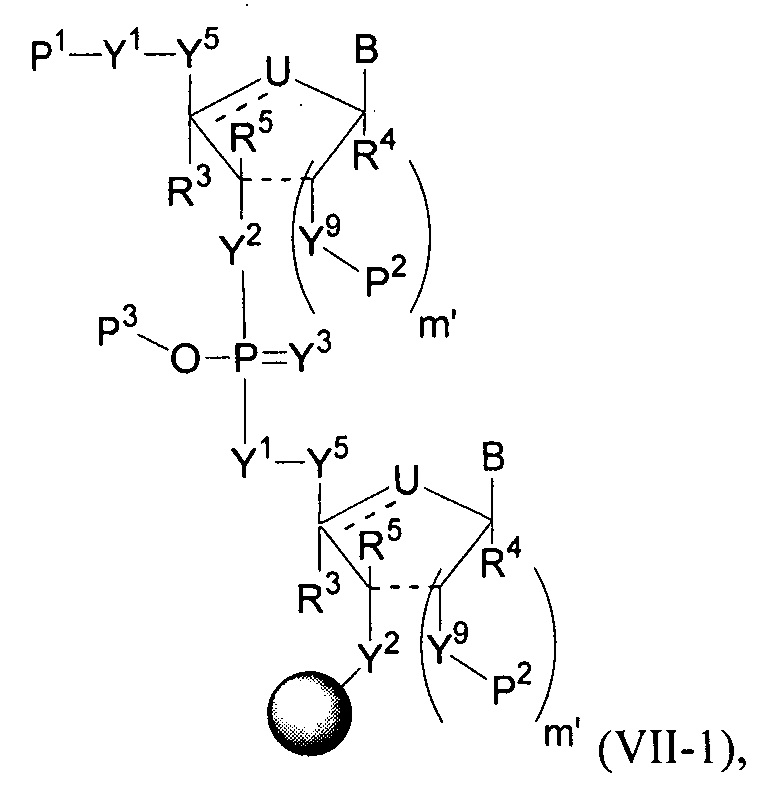
c) удаление защитных групп с получением полинуклеотида формулы (Ia).
В некоторых вариантах осуществления стадии a) и b) повторяют от 1 до приблизительно 10000 раз. В некоторых вариантах осуществления способы, кроме того, включают нуклеотид, выбранный из группы, состоящей из A, C, G и U: аденозина, цитозина, гуанозина и урацила. В некоторых вариантах осуществления основание нуклеиновой кислоты может представлять собой пиримидин или его производное. В некоторых вариантах осуществления полинуклеотид является транслируемым.
Другие компоненты полинуклеотидов являются необязательными и в некоторых вариантах осуществления являются пригодными. Например, предусматривается 5′-нетранслируемая область (UTR) и/или 3′UTR, где любой или оба из них могут независимо содержать одну или несколько различных нуклеотидных модификаций. В таких вариантах осуществления нуклеотидные модификации также могут присутствовать в транслируемой области. Также предусматриваются полинуклеотиды, содержащие последовательность Козака.
Комбинации нуклеотидов
Следующие примеры модифицированных нуклеотидов и комбинаций модифицированных нуклеотидов представлены ниже в таблице 2. Эти комбинации модифицированных нуклеотидов можно использовать для получения полинуклеотидов по изобретению. Если нет иных указаний, модифицированные нуклеотиды могут полностью заменять природные нуклеотиды полинуклеотидов по изобретению. В качестве неограничивающего примера, природный нуклеотид уридин может быть заменен модифицированным нуклеозидом, описанным в настоящем описании. В другом неограничивающем примере природный нуклеотид уридин может быть частично заменен (например, приблизительно 0,1%, 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99,9%) по меньшей мере одним из модифицированных нуклеозидов, описанных в настоящем описании.
Определенные модифицированные нуклеотиды и комбинации нуклеотидов исследованы авторами настоящего изобретения. Эти данные описаны во временной заявке США № 61/404413, поданной 1 октября 2010 года, под названием Engineered Nucleic Acids and Methods of Use Thereof, патентной заявке США № 13/251840, поданной 3 октября 2011 года, под названием Modified Nucleotides, and Nucleic Acids, and Uses Thereof, в настоящее время аннулированной, патентной заявке США № 13/481127, поданной 25 мая 2012 года, под названием Modified Nucleotides, and Nucleic Acids, and Uses Thereof, международной публикации патента № WO2012045075, поданной 3 октября 2011 года, под названием Modified Nucleotides, and Nucleic Acids, and Uses Thereof, публикации патента США № US20120237975, поданной 3 октября 2011 года, под названием Engineered Nucleic Acids and Method of Use Thereof, и международной публикации патента № WO2012045082, которые включены в качестве ссылок в полном объеме.
Следующие примеры комбинаций модифицированных нуклеотидов представлены в таблице 3 ниже. Эти комбинации модифицированных нуклеотидов можно использовать для получения полинуклеотидов по изобретению.
В некоторых вариантах осуществления по меньшей мере 25% остатков цитозина заменено соединением формулы (b10)-(b14), (b24), (b25) или (b32)-(b35) (например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%, например, соединения формулы (b10) или (b32)).
В некоторых вариантах осуществления по меньшей мере 25% остатков урацила заменено соединением формулы (b1)-(b9), (b21)-(b23) или (b28)-(b31) (например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%, например, соединения формулы (b1), (b8), (b28), (b29) или (b30)).
В некоторых вариантах осуществления по меньшей мере 25% остатков цитозина заменено соединением формулы (b10)-(b14), (b24), (b25) или (b32)-(b35) (например, формулы (b10) или (b32)), и по меньшей мере 25% остатков урацила заменено соединением формулы (b1)-(b9), (b21)-(b23) или (b28)-(b31) (например формулы (b1), (b8), (b28), (b29) или (b30)) (например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%).
Модификации, включающие линкер и груз
Нуклеотидное основание может быть ковалентно связано в любом химически подходящем положении с грузом, например, поддающимся обнаружению агентом или лекарственным средством. Например, основание нуклеиновой кислоты может представлять собой деазааденозин или деазагуанозин, и линкер может быть присоединен в положениях C-7 или C-8 деазааденозина или деазагуанозина. В других вариантах осуществления основание нуклеиновой кислоты может представлять собой цитозин или урацил, и линкер может быть присоединен к положениям N-3 или C-5 цитозина или урацила. На схеме 1 ниже представлен иллюстративный модифицированный нуклеотид, где основание нуклеиновой кислоты, аденин, связано с линкером по углероду C-7 7-деазааденина. Кроме того, на схеме 1 представлен модифицированный нуклеотид с линкером и грузом, например, поддающимся обнаружению агентом, встроенным на 3’-конец мРНК. Расщепление дисульфидной связи и 1,2-присоединение тиольной группы к пропаргиловому сложному эфиру высвобождает поддающийся обнаружению агент. Остальная структура (представленная, например, в качестве pApC5Parg на схеме 1) представляет собой ингибитор. Принципом структуры модифицированных нуклеотидов является то, что присоединенный ингибитор пространственно препятствует способности полимеразы включать второе основание. Таким образом, важно, чтобы связь была достаточной длинной, чтобы обеспечить эту функцию и чтобы ингибитор был в стереохимической ориентации, которая ингибирует или препятствует присоединению второго и последующих нуклеотидов к растущей полинуклеотидной цепи.
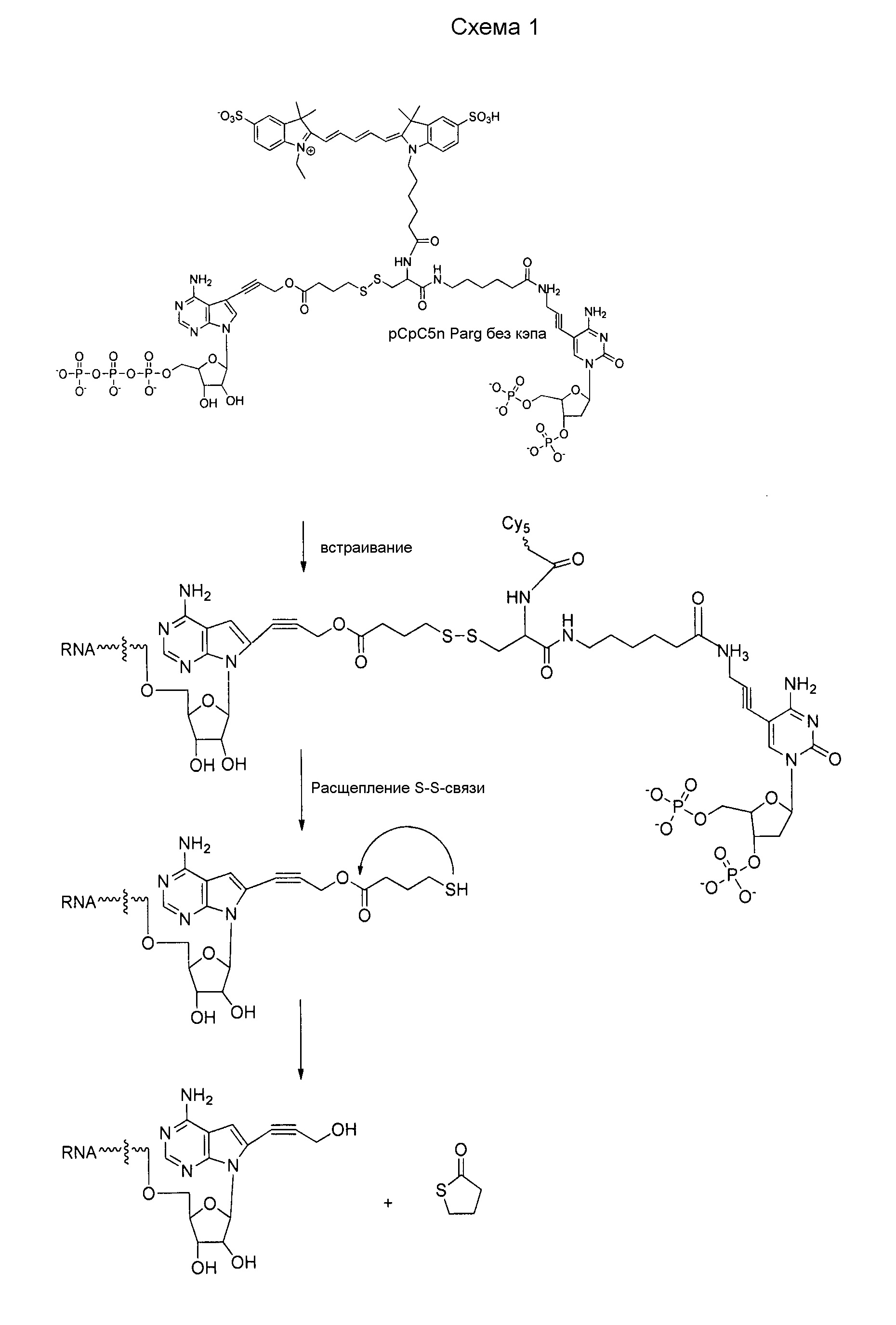
Линкер
Термин "линкер", как используют в рамках изобретения, относится к группе атомов, например, 10-1000 атомов, и он может включать атомы или группы, такие как, но не ограничиваясь ими, углерод, амино, алкиламино, кислород, сера, сульфоксид, сульфонил, карбонил и имин. Линкер может быть присоединен к модифицированному нуклеозиду или нуклеотиду по основанию нуклеиновой кислоты или части сахара на первом конце, и к грузу, например, поддающемуся обнаружению агенту или терапевтическому средству, на втором конце. Линкер имеет достаточную длину, чтобы она не препятствовала встраиванию в последовательность нуклеиновой кислоты.
Примеры химических групп, которые можно включать в линкер, включают, но не ограничиваются ими, алкильную, алкеновую, алкиновую, амидо, простую эфирную, простую тиоэфирную или сложноэфирную группу. Цепь линкера также может содержать часть насыщенного, ненасыщенного или ароматического кольца, включая полициклические и гетероароматические кольца, где гетероароматическое кольцо представляет собой арильную группу, содержащую от одного до четырех гетероатомов N, O или S. Конкретные примеры линкеров включают, но не ограничиваются ими, ненасыщенные алканы, полиэтиленгликоли и полимеры декстрана.
Например, линкер может включать мономерные элементы этилена или пропиленгликоля, например, диэтиленгликоль, дипропиленгликоль, триэтиленгликоль, трипропиленгликоль, тетраэтиленгликоль или тетраэтиленгликоль. В некоторых вариантах осуществления линкер может включать двухвалентную алкильную, алкенильную и/или алкинильную часть. Линкер может включать сложноэфирную, амидную или простую эфирную часть.
Другие примеры включают расщепляемые части в линкере, например, такие как дисульфидная связь (-S-S-) или азосвязь (-N=N-), которые могут быть расщеплены с использованием восстановителя или фотолиза. Расщепляемая связь, включенная в линкер и присоединенная к модифицированному нуклеотиду при расщеплении, приводит, например, к короткому "остатку" или химической модификации на нуклеотиде. Например, после расщепления полученный остаток на нуклеотидном основании, который образовал часть модифицированного нуклеотида и встроился в полинуклеотидную цепь, является нереакционноспособным и не должен быть химически нейтрализован. Это увеличивает легкость, с которой последующий нуклеотид может встраиваться в процессе секвенирования полимерной матрицы нуклеиновой кислоты. Например, условия включают использование трис(2-карбоксиэтил)фосфина (TCEP), дитиотреитола (DTT) и/или других восстановителей для расщепления дисульфидной связи. Селективно расщепляемая связь, которая включает амидосвязь, может расщепляться, например, при использовании TCEP или других восстановителей и/или фотолиза. Селективно расщепляемая связь, которая включает сложноэфирную связь, может расщепляться, например, кислым или основным гидролизом.
Груз
Способы и композиции, описанные в настоящем описании, пригодны для доставки груза к биологической мишени. Груз можно использовать, например, для мечения (например, поддающийся обнаружению агент, такой как флуорофор) или для терапевтических целей (например, цитотоксин или другое лекарственное средство).
Груз: терапевтические средства
В некоторых вариантах осуществления груз представляет собой лекарственное средство, такое как цитотоксин, радиоактивный ион, химиотерапевтическое или другое терапевтическое средство. Цитотоксин или цитотоксический агент включает любой агент, который является вредоносным для клеток. Примеры включают таксол, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидрокси антрацин дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, майтанзиноиды, например, майтанзинол (см. патент США № 5208020), CC-1065 (см. патенты США №№ 5475092, 5585499, 5846545) и их аналоги или гомологи. Радиоактивные ионы включают, но не ограничиваются ими, йод (например, йод 125 или йод 131), стронций 89, фосфор, палладий, цезий, иридий, фосфат, кобальт, иттрий 90, самарий 153 и празеодимий. Другие лекарственные средства включают, но не ограничиваются ими, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацилдекарбазин), алкилирующие средства (например, мехлорэтамин, тиотепу, хлорамбуцил, CC-1065, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин C и цис-дихлордиаминплатину(II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (AMC)) и антимитотические средства (например, винкристин, винбластин, таксол и майтанзиноиды).
Груз: поддающиеся обнаружению агенты
Примеры поддающихся обнаружению веществ включают различные органические низкомолекулярные соединения, неорганические соединения, наночастицы, ферменты или субстраты ферментов, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы, хемилюминесцентные материалы, радиоактивные материалы и контрастные вещества. Такие оптически обнаруживаемые метки включают, например, но не ограничиваются ими, 4-ацетамидо-4'-изотиоцианатстилбен-2,2'-дисульфоновую кислоту; акридин и производные: акридин, акридинизотиоцианат; 5-(2'-аминоэтил)аминонафталин-1-сульфоновую кислоту (EDANS); 4-амино-N-[3-винилсульфонил)фенил]нафталимид-3,5-дисульфонат; N-(4-анилино-1-нафтил)малеинимид; антраниламид; BODIPY; бриллиантовый желтый; кумарин и производные; кумарин, 7-амино-4-метилкумарин (AMC, Coumarin 120), 7-амино-4-трифторметилкоулуарин (Coumaran 151); цианиновые красители; цианозин; 4',6-диаминидино-2-фенилиндол (DAPI); 5',5"-дибромпирогаллолсульфонафталеин (бромпирогаллоловый красный); 7-диэтиламино-3-(4'-изотиоцианатофенил)-4-метилкумарин; диэтилентриамин пентаацетат; 4,4'-диизотиоцианатодигидро-стилбен-2,2'-дисульфоновую кислоту; 4,4'-диизотиоцианатостиблен-2,2'-дисульфоновую кислоту; 5-[диметиламино]-нафталин-1-сульфонилхлорид (DNS, дансилхлорид); 4-диметиламинофенилазофенил-4'-изотиоцианат (DABITC); эозин и производные; эозин, эозин изотиоцианат, эритрозин и производные; эритрозин B, эритрозин, изотиоцианат; этидий; флуоресцеин и производные; 5-карбоксифлуоресцеин (FAM), 5-(4,6-дихлортриазин-2-ил)аминофлуоресцеин (DTAF), 2',7'-диметокси-4'5'-дихлор-6-карбоксифлуоресцеин, флуоресцеин, флуоресцеин изотиоцианат, QFITC, (XRITC); флуорескамин; IR144; IR1446; малахитовый зеленый изотиоцианат; 4-метилумбеллиферонортокрезолфталеин; нитротирозин; парарозанилин; феноловый красный; B-фикоэритрин; o-фталдиальдегид; пирен и производные: пирен, пирен бутират, сукцинимидил-1-пирен; бутиратные квантовые точки; реактивный красный 4 (CibacronTM Brilliant Red 3B-A), родамин и производные: 6-карбокси-X-родамин (ROX), 6-карбоксиродамин (R6G), лиссамин родамин B, сульфонилхлорид родамин (Rhod), родамин B, родамин 123, родамин X изотиоцианат, сульфородамин B, сульфородамин 101, сульфонилхлоридное производное сульфородамина 101 (техасский красный); N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA); тетраметилродамин; тетраметилродамин изотиоцианат (TRITC); рибофлавин; розоловую кислоту; хелатные производные тербия; цианин-3 (Cy3); цианин-5 (Cy5); цианин-5,5 (Cy5.5), цианин-7 (Cy7); IRD 700; IRD 800; Alexa 647; La Jolta Blue; фталоцианин; и нафталоцианин. В некоторых вариантах осуществления поддающейся обнаружению меткой является флуоресцентный краситель, такой как Cy5 и Cy3.
Примеры люминесцентного материала включают люминол; примеры биолюминесцентных материалов включают люциферазу, люциферин и экворин.
Примеры подходящего радиоактивного материала включают18F,67Ga,81mKr,82Rb,111In,123I,133Xe,201Tl,125I,35S,14C или3H,99mTc (например, пертехнетат (техненат(VII), TcO4-), либо прямо, либо непрямо, или другие радиоизотопы, обнаруживаемые путем прямого подсчета радиоактивного излучения или сцинтилляционного подсчета.
Кроме того, можно использовать контрастные агенты, например, контрастные агенты для MRI или ЯМР, для рентгенограммы, CT, визуализации Рамана, оптической когерентной томографии, визуализации по поглощению, ультразвуковой визуализации или термической визуализации. Иллюстративные контрастные агенты включают золото (например, золотые наночастицы), гадолиний (например, хелатированный Gd), оксиды железа (например, суперпарамагнитный оксид железа (SPIO), наночастицы монокристаллического оксида железа (MION) и сверхмалые частицы суперпарамагнитного оксида железа (USPIO)), хелаты марганца (например, Mn-DPDP), сульфат бария, йодированные контрастные среды (иогексол), микропузырьки или перфторуглероды.
В некоторых вариантах осуществления поддающийся обнаружению агент представляет собой не поддающийся обнаружению предшественник, который становится поддающимся обнаружению при активации. Примеры включают флуорогенные конструкции тетразин-флуорофор (например, тетразин-BODIPY FL, тетразин-Oregon Green 488 или тетразин-BODIPY TMR-X) или активируемые ферментом флуорогенные агенты (например, PROSENSE (VisEn Medical)).
Когда соединения являются ферментативно меченными, например, пероксидазой хрена, щелочной фосфатазой или люциферазой, ферментативную метку обнаруживают путем определения преобразования соответствующего субстрата в продукт.
Анализы in vitro, в которых можно использовать эти композиции, включают твердофазные иммуноферментные анализы (ELISA), иммунопреципитацию, иммунофлуоресценцию, ферментный иммуноанализ (EIA), радиоиммунный анализ (RIA) и анализ с использованием вестерн-блоттинга.
Настоящим изобретением предусматриваются метки, отличные от меток, описанных в настоящем описании, включая другие оптически обнаруживаемые метки. Метки можно присоединять к модифицированному нуклеотиду по настоящему изобретению в любом положении с использованием стандартных химических реакций, так чтобы метка удалялась из основания, к которому она присоединена, при расщеплении поддающегося расщеплению линкера.
Груз: проникающие в клетку грузы
В некоторых вариантах осуществления модифицированные нуклеотиды и модифицированные нуклеиновые кислоты также могут включать груз, который может представлять собой проникающую в клетку часть или агент, который повышает внутриклеточную доставку композиций. Например, композиции могут включать проникающую в клетку пептидную последовательность, которая облегчает доставку во внутриклеточное пространство, например, происходящий из ВИЧ пептид TAT, пенетратины, транспортаны, или происходящие из hCT проникающие в клетку пептиды, см., например, Caron et al., (2001) Mol Ther. 3(3):310-8; Langel, Cell-Penetrating Peptides: Processes and Applications (CRC Press, Boca Raton FL 2002); El-Andaloussi et al., (2005) Curr Pharm Des. 11(28):3597-611; и Deshayes et al., (2005) Cell Mol Life Sci. 62(16):1839-49. Композиции также можно составлять так, чтобы они включали проникающий в клетку агент, например в липосомах, который усиливает доставку композиции во внутриклеточное пространство.
Груз: биологические мишени
Модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать для доставки груза к любой биологической мишени, для которой существует или может быть получен специфический лиганд. Лиганд может связываться с биологической мишенью либо ковалентно, либо нековалентно.
Иллюстративные биологические мишени включают биополимеры, например, антитела, нуклеиновые кислоты, такие как РНК и ДНК, белки, ферменты; иллюстративные белки включают ферменты, рецепторы и ионные каналы. В некоторых вариантах осуществления мишенью является тканеспецифический или специфичный к типу клеток маркер, например, белок, который специфически экспрессируется на выбранной ткани или типе клеток. В некоторых вариантах осуществления мишенью является рецептор, такой как, но не ограничиваясь ими, рецепторы плазматической мембраны и ядерные рецепторы; более конкретные примеры включают сопряженные с G-белком рецепторы, белки клеточных пор, белки-переносчики, экспрессируемые на поверхности антитела, белки HLA, белки MHC и рецепторы факторов роста.
Синтез модифицированных нуклеотидов
Модифицированные нуклеозиды и нуклеотиды, описанные в настоящем описании, можно получать из легкодоступных исходных материалов с использованием следующих общих способов и методик. Понятно, что когда приведены типичные или предпочтительные условия процессов (т.е. температура реакции, время, молярное соотношение реагентов, растворители, давление и т.д.), также можно использовать другие условия процесса, если нет иных указаний. Оптимальные условия реакции могут варьировать, в зависимости от конкретных используемых реагентов или растворителей, однако такие условия могут быть определены специалистом в данной области с помощью стандартных методик оптимизации.
Мониторинг процессов, описанных в настоящем описании, можно проводить любым подходящим способом, известным в данной области. Например, мониторинг образования продуктов можно проводить спектроскопическими способами, такими как ядерная магнитно-резонансная спектроскопия (например,1H или13C), инфракрасная спектроскопия, спектрофотометрия (например, УФ-видимая) или масс-спектрометрия, или хроматографией, такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография.
Получение модифицированных нуклеозидов или нуклеотидов может вовлекать внесение и удаление защитной группы на различные химические группы. Специалист в данной области может без труда определить потребность во внесении и удалении защитных групп и может выбрать подходящие защитные группы. Химия защитных групп описана, например, в Greene, et al., Protective Groups in Organic Synthesis, 2nd Ed., Wiley & Sons, 1991, которая включена в настоящее описание в качестве ссылки в полном объеме.
Реакции процессов, описанных в настоящем описании, можно проводить в подходящих растворителях, которые может без труда выбрать специалист в области органического синтеза. Подходящие растворители могут быть по существу нереакционноспособными в отношении исходных материалов (реагентов), промежуточных соединений или продуктов при температурах, при которых проводят реакции, т.е. при температурах, которые могут находиться от температуры замерзания растворителя до температуры кипения растворителя. Конкретную реакцию можно проводить в растворителе или смеси более чем одного растворителя. В зависимости от конкретной стадии реакции, можно выбирать подходящие растворители.
Разделение рацемических смесей модифицированных нуклеозидов и нуклеотидов можно проводить любым из многочисленных способов, известных в данной области. Иллюстративный способ включает фракционную перекристаллизацию с использованием "хиральной разделяющей кислоты", которая является оптически активной солеобразующей органической кислотой. Подходящие разделяющие агенты для способов фракционной перекристаллизации представляют собой, например, оптически активные кислоты, такие как D- и L-формы виннокаменной кислоты, диацетилвиннокаменной кислоты, дибензоилвиннокаменной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различных оптически активных камфорсульфоновых кислот. Разделение рацемических смесей также можно проводить путем элюирования на колонке, упакованной оптически активным разделяющим агентом (например, динитробензоилфенилглицин). Специалист в данной области может определить подходящую композицию растворителей для элюирования.
Иллюстративные способы синтеза модифицированных нуклеотидов, которые включены в полинуклеотиды, например, РНК или мРНК, представлены ниже на схемах с 2 по 12. На схеме 2 представлен общий способ фосфорилирования нуклеозидов, включая модифицированные нуклеозиды.
Для контроля реакции можно использовать различные защитные группы. Например, на схеме 3 представлено использование множества стадий внесения и удаления защитных групп для обеспечения фосфорилирования в 5′-положении сахара, а не 2′- и 3′-гидроксильных групп.
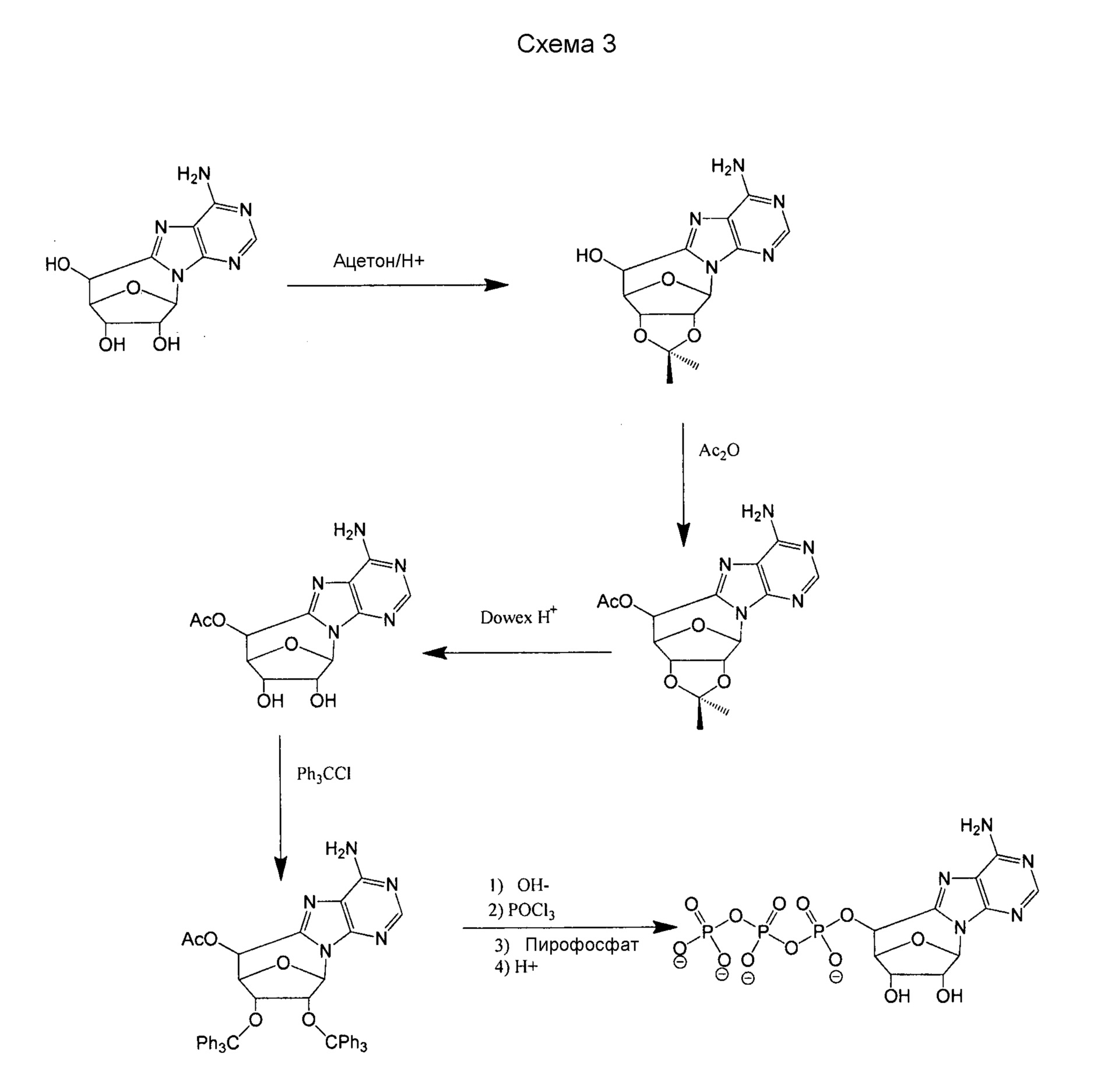
Модифицированные нуклеотиды можно синтезировать любым подходящим способом. На схемах 4, 5 и 8 представлены иллюстративные способы синтеза модифицированных нуклеотидов, имеющих модифицированное пуриновое основание нуклеиновой кислоты; и на схемах 6 и 7 представлены иллюстративные способы синтеза модифицированных нуклеотидов, имеющих модифицированный псевдоуридин или псевдоизоцитидин, соответственно.
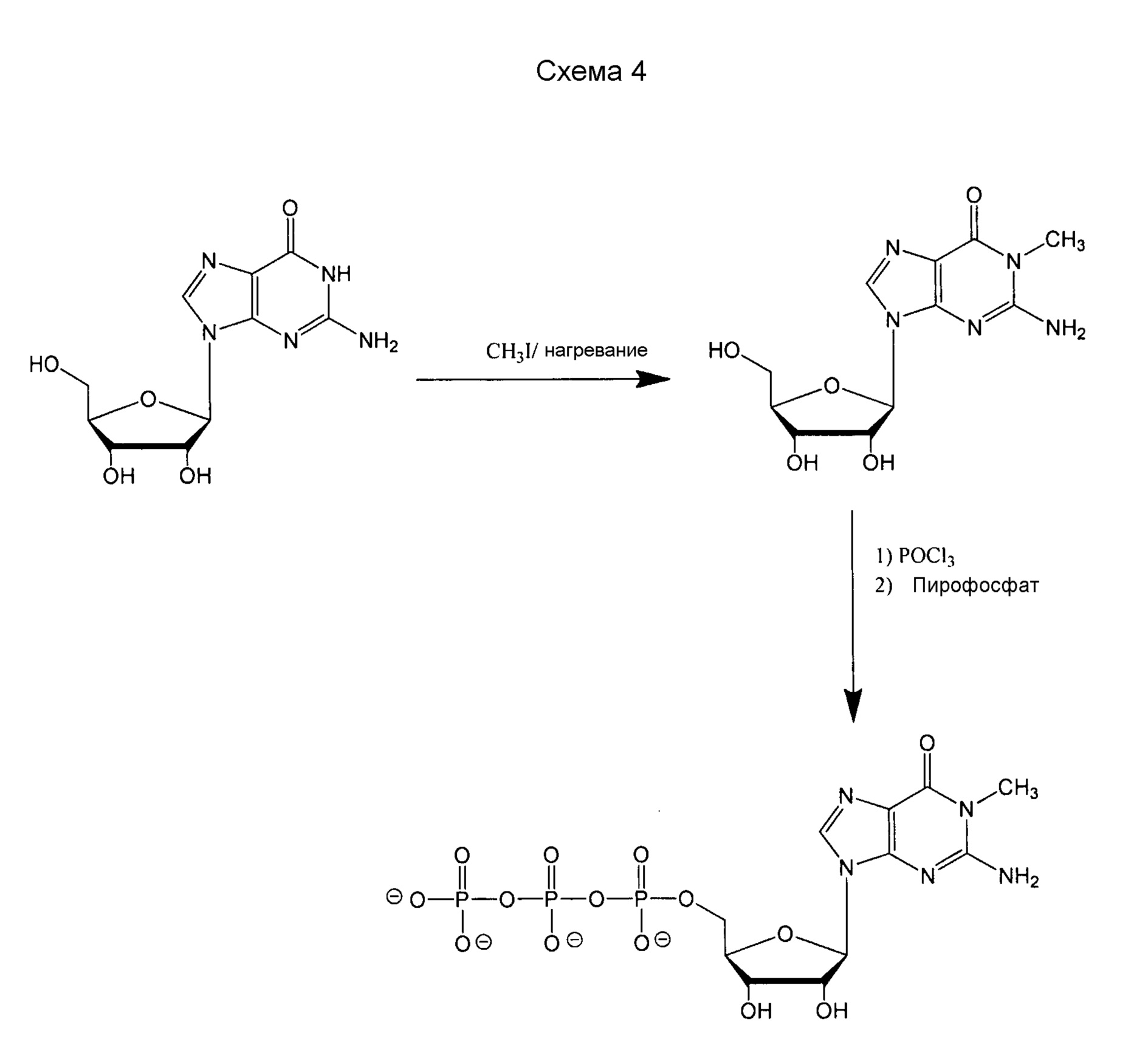
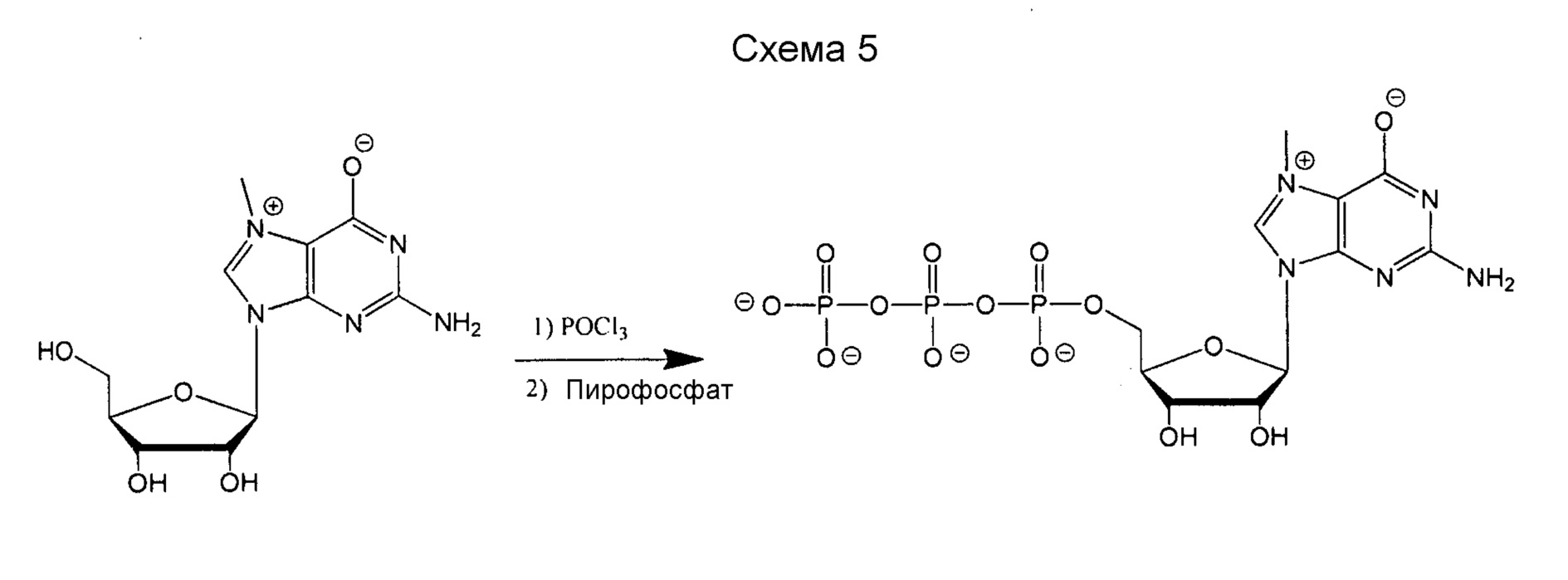
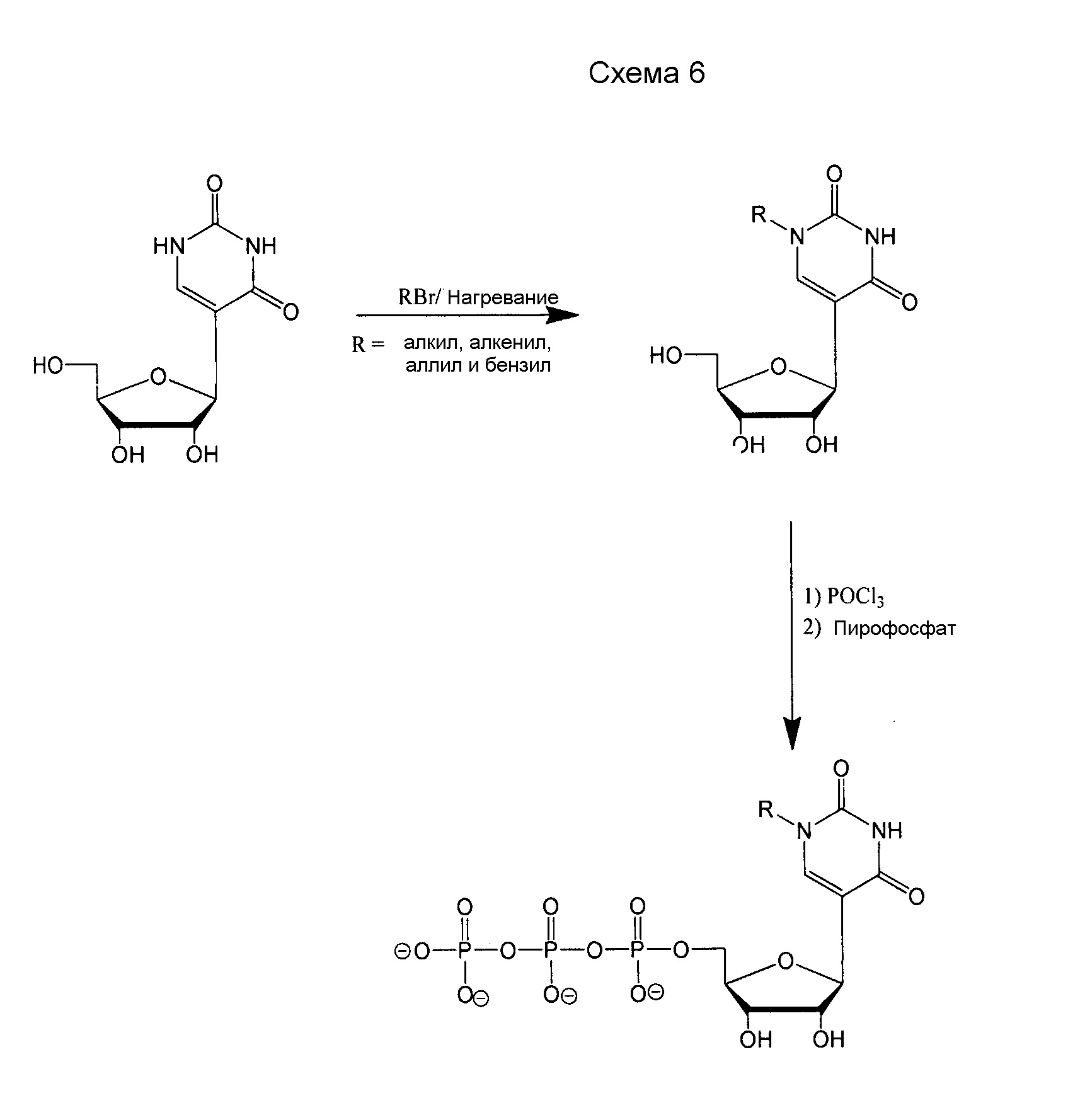

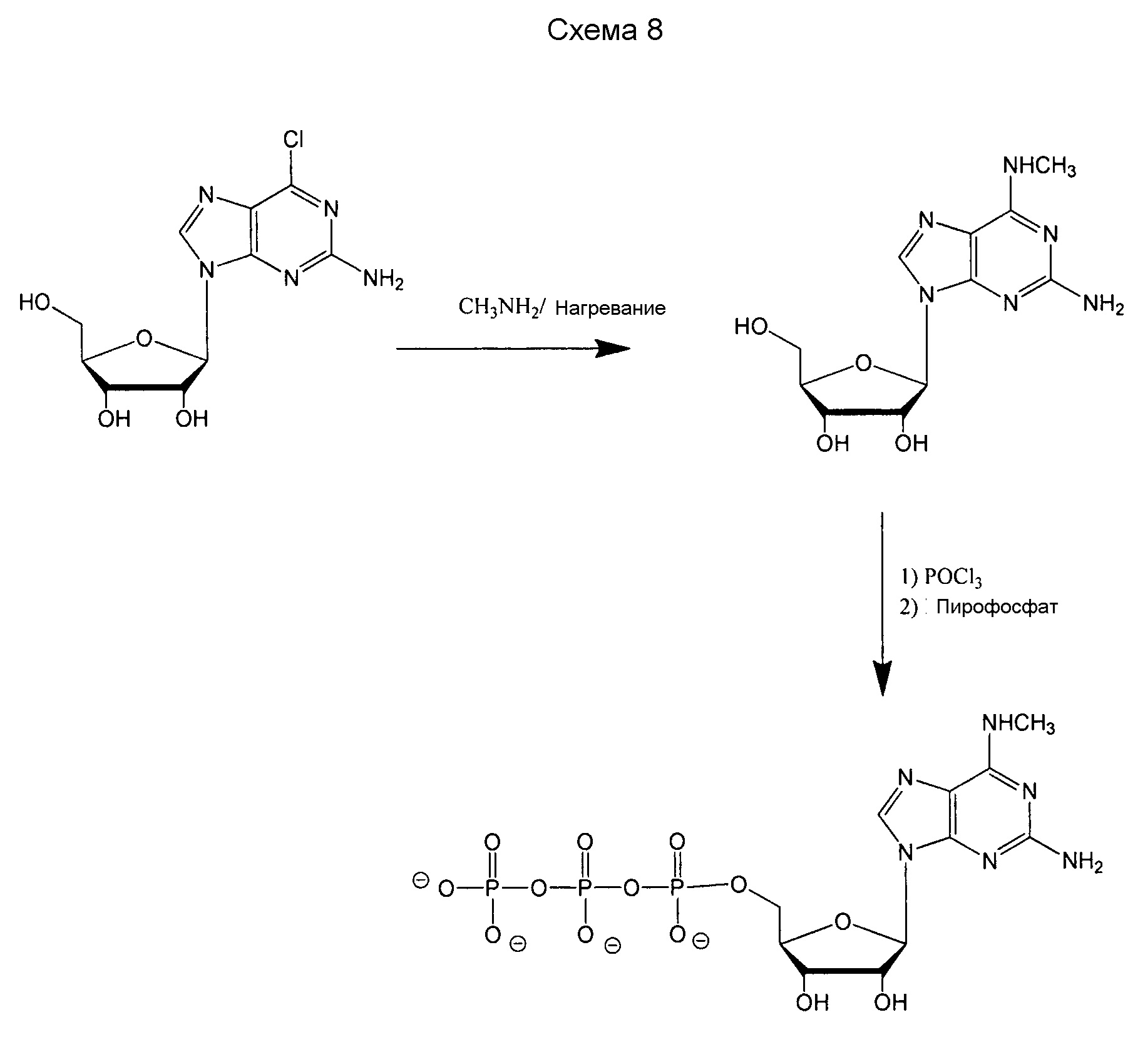
На схемах 9 и 10 представлены иллюстративные способы синтеза модифицированных нуклеотидов. На схеме 11 представлен неограничивающий биоаналитический способ получения нуклеотидов.

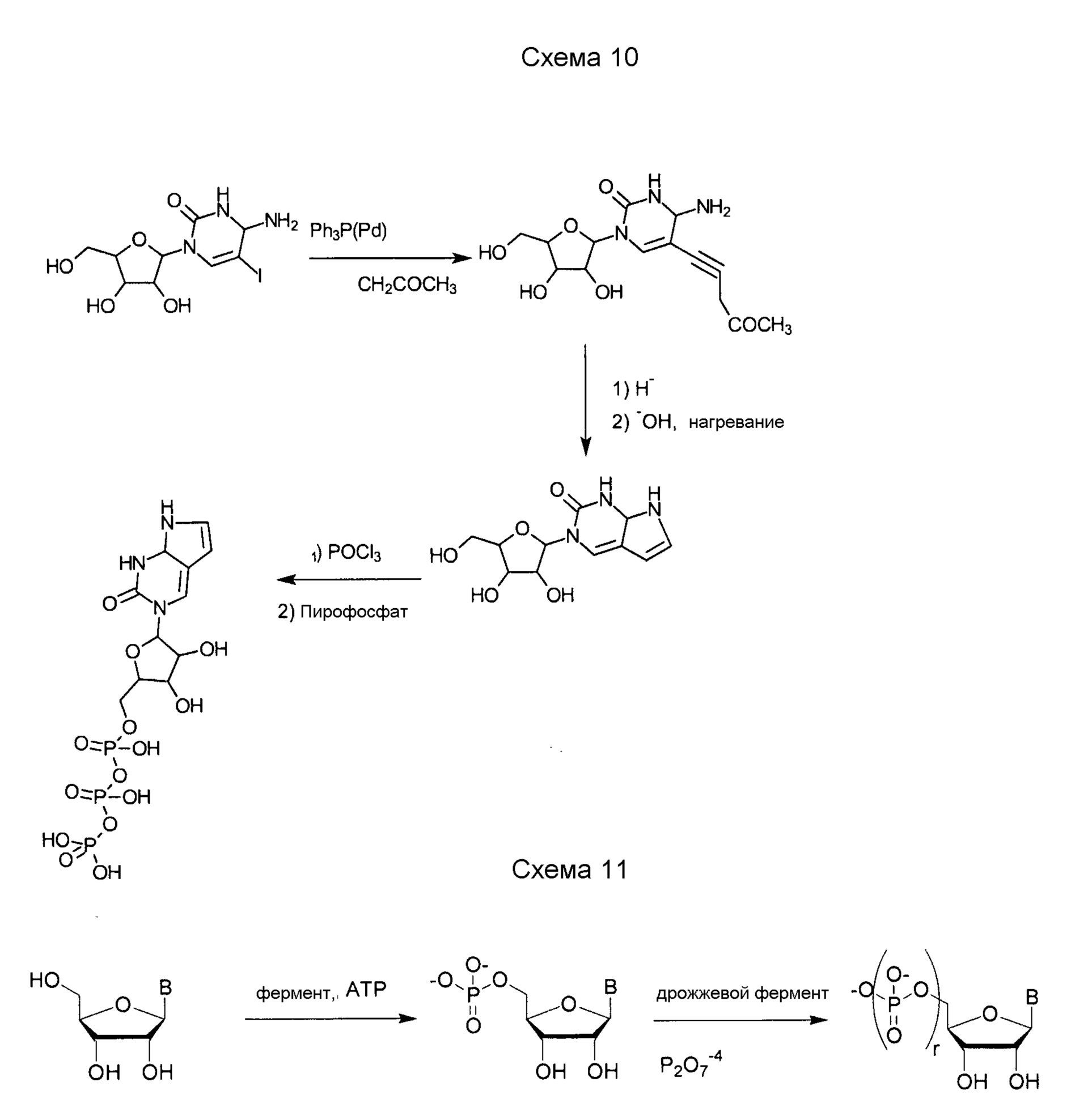
На схеме 12 представлен иллюстративный синтез модифицированного урацила, где положение N1 на поверхности большой бороздки модифицировано посредством R12b, как описано в настоящем описании, и 5′-положение рибозы является фосфорилированным. T1, T2, R12a, R12b и r являются такими, как описано в настоящем описании. Этот синтез, а также его оптимизированную версию, можно использовать для модификации поверхности большой бороздки других пиримидиновых оснований нуклеиновой кислоты и пуриновых оснований нуклеиновой кислоты (см. например, формулы (b1)-(b43)) и/или для внесения одной или нескольких фосфатных групп (например, в 5′-положении сахара). Эту реакцию алкилирования также можно использовать для включения одной или нескольких необязательно замещенных алкильных групп в любую реакционноспособную группу (например, аминогруппу) в любом основании нуклеиновой кислоты, описанном в настоящем описании (например, аминогруппы на поверхности пар оснований Уотсона-Крика для цитозина, урацила, аденина и гуанина).
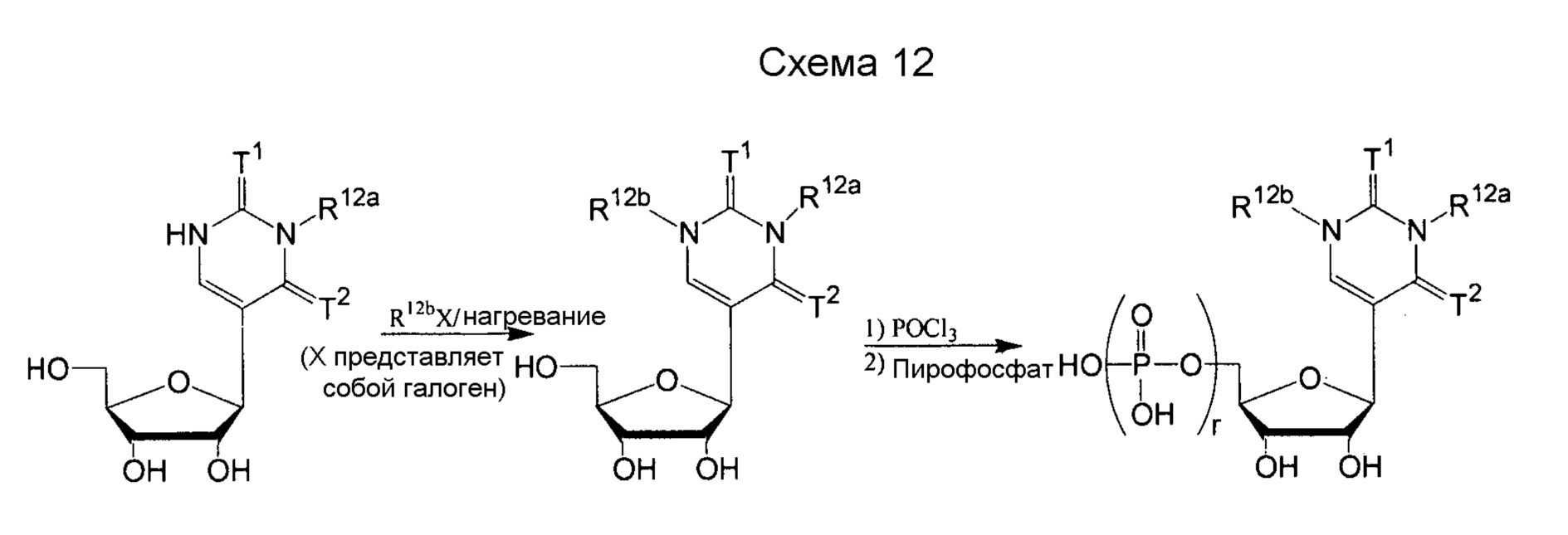
Модифицированные нуклеозиды и нуклеотиды также можно получать в соответствии со способами синтеза, описанными в Ogata et al. Journal of Organic Chemistry 74:2585-2588, 2009; Purmal et al. Nucleic Acids Research 22(1):72-78, 1994; Fukuhara et al. Biochemistry 1(4):563-568, 1962; и Xu et al. Tetrahedron 48(9):1729-1740, 1992, каждый из которых включен в качестве ссылки в полном объеме.
Модифицированные нуклеиновые кислоты
Настоящее изобретение относится к нуклеиновым кислотам (или полинуклеотидам), включающим РНК, такие как мРНК, которые содержат один или несколько модифицированных нуклеозидов (называемые "модифицированными нуклеиновыми кислотами") или нуклеотидов, как описано в настоящем описании, которые обладают пригодными свойствами, включая отсутствие значительной индукции врожденного иммунного ответа клетки, в которую введена мРНК. Поскольку эти модифицированные нуклеиновые кислоты повышают эффективность продукции белка, внутриклеточное удержание нуклеиновых кислот и жизнеспособность клеток, контактировавших с ними, а также обладают сниженной иммуногенностью, эти нуклеиновые кислоты, обладающие этими свойствами, также называют в настоящем описании "улучшенными нуклеиновыми кислотами".
Кроме того, настоящее изобретение относится к нуклеиновым кислотам, которые обладают сниженной аффинностью связывания со взаимодействующим, например, связывающимся, с большой бороздкой партнером. Например, нуклеиновые кислоты содержат по меньшей мере один нуклеотид, который химически модифицирован на обращенной к большой бороздке поверхности, как описано в настоящем описании.
Термин "нуклеиновая кислота" в его наиболее широком значении включает любое соединение и/или вещество, которое представляет собой или может быть включено в олигонуклеотидную цепь. В этом контексте термин "нуклеиновая кислота" используют синонимично с полинуклеотидом. Иллюстративные нуклеиновые кислоты для применения в соответствии с настоящим изобретением включают, но не ограничиваются ими, одну или несколько ДНК, РНК, включая матричную мРНК (мРНК), их гибридов, индуцирующих РНК-i агентов, агентов РНК-i, миРНК (siRNA), кшРНК (shRNA), микроРНК (miRNA), антисмысловых РНК, рибозимов, каталитических ДНК, РНК, которые индуцируют образование тройной спирали, аптамеров, векторов и т.д., подробно описанных в настоящем описании.
Предусматриваются модифицированные нуклеиновые кислоты, содержащие транслируемую область и одну, две или более двух различных нуклеозидных модификаций. В некоторых вариантах осуществления модифицированная нуклеиновая кислота проявляет сниженную деградацию в клетке, в которую введена нуклеиновая кислота, относительно соответствующей немодифицированной нуклеиновой кислоты. Иллюстративные нуклеиновые кислоты включают рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), нуклеиновые кислоты с треозой (TNA), нуклеиновые кислоты с гликолем (GNA) или их гибрид. В предпочтительных вариантах осуществления модифицированная нуклеиновая кислота включает матричные РНК (мРНК). Как описано в настоящем описании, нуклеиновые кислоты по настоящему изобретению по существу не индуцируют врожденный иммунный ответ клетки, в которую мРНК введена.
В определенных вариантах осуществления является желательной внутриклеточная деградация модифицированной нуклеиновой кислоты, введенной в клетку, например, если является желательным точный период времени продуцирования белка. Таким образом, настоящее изобретение относится к модифицированной нуклеиновой кислоте, содержащей домен деградации, которая способна действовать направленным образом в клетке.
Другие компоненты нуклеиновой кислоты являются необязательными и в некоторых вариантах осуществления являются пригодными. Например, предусматривается 5’-нетранслируемая область (UTR) и/или 3’UTR, где любая или обе из них независимо могут содержать одну или несколько отличающихся нуклеозидных модификаций. В таких вариантах осуществления нуклеозидные модификации также могут присутствовать в транслируемой области. Также предусматриваются нуклеиновые кислоты, содержащие последовательность Козака.
Кроме того, предусматриваются нуклеиновые кислоты, содержащие одну или несколько интронных нуклеотидных последовательностей, которые могут вырезаться из нуклеиновой кислоты.
Кроме того, предусматриваются нуклеиновые кислоты, содержащие участок внутренней посадки рибосомы (IRES). IRES может выступать в качестве единственного участка связывания рибосом, или он может служить в качестве одного из множества участков связывания рибосом в мРНК. мРНК, содержащая более одного функционального участка связывания рибосом, может кодировать несколько пептидов или полипептидов, которые транслируются рибосомами независимо ("полицистронная мРНК"). Когда нуклеиновые кислоты предоставляются с IRES, кроме того, необязательно предоставляется вторая транслируемая область. Примеры последовательностей IRES, которые можно использовать в соответствии с настоящим изобретением, включают, но не ограничиваются ими, последовательности из пикорнавирусов (например, FMDV), вирусов паразитов (CFFV), вирусов полиомиелита (PV), вирусов энцефаломиокардита (ECMV), вируса ящура (FMDV), вирусов гепатита C (HCV), вирусов классической свиной лихорадки (CSFV), вируса лейкоза мышей (MLV), вирусов иммунодефицита обезьян (SIV) или вирусов паралича сверчков (CrPV).
В другом аспекте настоящее изобретение относится к последовательностям нуклеиновых кислот, содержащим по меньшей мере два нуклеотида, последовательности нуклеиновой кислоты, содержащей нуклеотид, который нарушает связывание связывающегося с большой бороздкой партнера с последовательностью нуклеиновой кислоты, где нуклеотид обладает сниженной аффинностью связывания со связывающимся с большой бороздкой партнером.
В некоторых вариантах осуществления нуклеиновая кислота представляет собой соединение формулы XI-a:
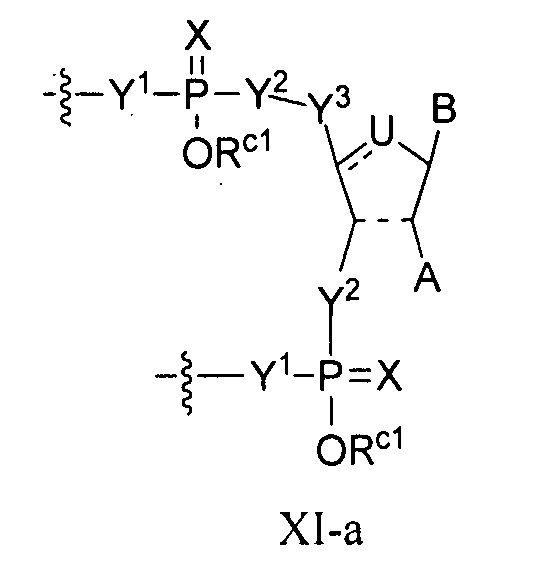
где:

U представляет собой O, S, -NRa- или -CRaRb-, когда


A представляет собой H, OH, фосфорил, пирофосфат, сульфат, -NH2, -SH, аминокислоту, пептид, содержащий 2-12 аминокислот;
X представляет собой O или S;
каждый Y1 независимо выбран из -ORa1, -NRa1Rb1 и -SRa1;
каждый из Y2 и Y3 независимо выбран из O, -CRaRb-, NRc, S или линкера, содержащего один или несколько атомов, выбранных из группы, состоящей из C, O, N и S;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил;
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля;
каждый из Ra1 и Rb1 независимо представляет собой H или противоион;
-ORc1 представляет собой OH при pH приблизительно 1, или -ORc1 представляет собой O- при физиологических значениях pH; и
B представляет собой основание нуклеиновой кислоты;
при условии, что кольцо, охватывающее переменные A, B, D, U, Z, Y2 и Y3, не может представлять собой рибозу.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XII-a, XII-b или XII-c:
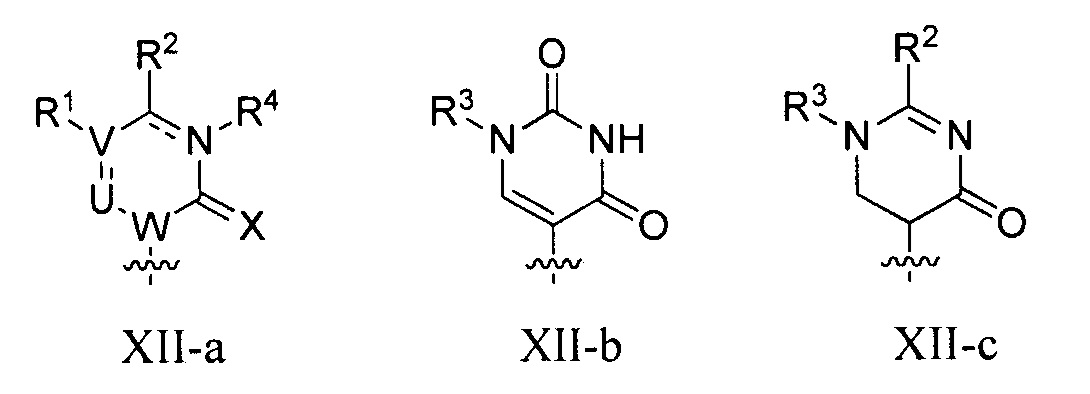
где:

X представляет собой O или S;
каждый из U и W независимо представляет собой C или N;
V представляет собой O, S, C или N;
где когда V представляет собой C, тогда R1 представляет собой H, C1-6 алкил, C1-6 алкенил, C1-6 алкинил, галоген или -ORc, где каждый из C1-20 алкила, C2-20алкенила, C2-20 алкинила необязательно замещен посредством -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc или -NHC(O)ORc;
и где когда V представляет собой O, S или N, тогда R1 отсутствует;
R2 представляет собой H, -ORc, -SRc, -NRaRb или галоген;
или когда V представляет собой C, тогда R1 и R2 вместе с атомами углерода, к которым они присоединены, могут образовывать 5- или 6-членное кольцо, необязательно замещенное 1-4 заместителями, выбранными из галогена, -OH, -SH, -NRaRb, C1-20 алкила, C2-20 алкенила, C2-20 алкинила, C1-20 алкокси или C1-20 тиоалкила;
R3 представляет собой H или C1-20 алкил;
R4 представляет собой H или C1-20 алкил; где когда

каждый из Ra и Rb независимо представляет собой H, C1-20 алкил, C2-20 алкенил, C2-20 алкинил или C6-20 арил; и
Rc представляет собой H, C1-20 алкил, C2-20 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XII-a1, XII-a2, XII-a3, XII-a4 или XII-a5:

В некоторых вариантах осуществления основание нуклеиновой кислоты представляет собой пиримидин или его производное.
В некоторых вариантах осуществления нуклеиновая кислота содержит множество структурно уникальных соединений формулы XI-a.
В некоторых вариантах осуществления по меньшей мере 25% остатков цитозина заменены соединением формулы XI-a (например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%).
В некоторых вариантах осуществления по меньшей мере 25% остатков урацила заменены соединением формулы XI-a (например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%).
В некоторых вариантах осуществления по меньшей мере 25% остатков цитозина и 25% остатков урацила заменены соединением формулы XI-a (например, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%).
В некоторых вариантах осуществления нуклеиновая кислота является транслируемой.
В некоторых вариантах осуществления, когда нуклеиновая кислота включает нуклеотид, модифицированный линкером и грузом, например, как описано в настоящем описании, нуклеотид, модифицированный линкером и грузом, находится на 3’-конце нуклеиновой кислоты.
Взаимодействующие с большой бороздкой партнеры
Как описано в настоящем описании, выражение "взаимодействующий с большой бороздкой партнер" относится к распознающим РНК рецепторам, которые обнаруживают и отвечают на РНК-лиганды через взаимодействия, например, связывание, с обращенной к большой бороздке поверхностью нуклеотида или нуклеиновой кислоты. Соответственно, у РНК-лигандов, содержащих модифицированные нуклеотиды или нуклеиновые кислоты, как описано в настоящем описании, снижены взаимодействия со связывающимися с большой бороздкой партнерами, и, таким образом, снижен врожденный иммунный ответ, или экспрессия и секреция провоспалительных цитокинов, или и то, и другое.
Пример взаимодействующих, например, связывающихся, с большой бороздкой партнеров включают, но не ограничиваются ими, следующие нуклеазы и хеликазы. В мембранах TLR (Toll-подобные рецепторы) 3, 7 и 8 могут отвечать на одноцепочечные и двухцепочечные РНК. В цитоплазме представители суперсемейства 2 хеликаз класса DEX(D/H) и ATP-азы могут распознавать РНК для инициации противовирусных ответов. Эти хеликазы включают RIG-I (индуцируемый ретиноевой кислотой ген I) и MDA5 (ассоциированный с дифференцировкой меланомы ген 5). Другие примеры включают ген Laboratory of genetics and physiology 2 (LGP2), содержащие домен HIN-200 белки или содержащие хеликазный домен белки.
Предупреждение или снижение врожденного клеточного иммунного ответа
Термин "врожденный иммунный ответ" включает клеточный ответ на экзогенные одноцепочечные нуклеиновые кислоты, как правило, вирусного или бактериального происхождения, который вовлекает индукцию экспрессии цитокинов и высвобождение, в частности, интерферонов, и гибель клетки. Синтез белка также снижается в ходе врожденного иммунного ответа. Хотя является преимущественным устранение иммунного ответа в клетке, который запускается введением экзогенных нуклеиновых кислот, настоящее изобретение относится к модифицированным нуклеиновым кислотам, таким как мРНК, которые существенно снижают иммунный ответ, включая передачу сигнала интерферонами, без полного устранения такого ответа. В некоторых вариантах осуществления иммунный ответ снижен на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99%, 99,9% или более чем на 99,9% по сравнению с иммунным ответом, индуцируемым соответствующей немодифицированной нуклеиновой кислотой. Такое снижение можно измерять по уровню экспрессии или активности интерферонов типа 1 или экспрессии регулируемых интерфероном генов, таких как toll-подобные рецепторы (например, TLR7 и TLR8). Снижение или отсутствие индукции врожденного иммунного ответа также можно измерять по уменьшению гибели клеток после одного или нескольких введений модифицированных РНК в клеточную популяцию; например, клеточная гибель на 10%, 25%, 50%, 75%, 85%, 90%, 95% или более чем 95% меньше, чем частота гибели клеток, наблюдаемая в случае соответствующей немодифицированной нуклеиновой кислоты. Более того, гибель клеток может произойти в менее чем 50%, 40%, 30%, 20%, 10%, 5%, 1%, 0,1%, 0,01% или менее 0,01% клеток, с которыми контактировали модифицированные нуклеиновые кислоты.
В некоторых вариантах осуществления модифицированные нуклеиновые кислоты, включая полинуклеотиды и/или молекулы мРНК, модифицированы таким образом, чтобы не индуцировать или только минимально индуцировать иммунный ответ в рецепиентной клетке или организме. Такой запуск или активация ускользания от или избегания иммунного ответа является новым признаком модифицированных полинуклеотидов по настоящему изобретению.
Настоящее изобретение относится к повторяющемуся введению (например, трансфекции) модифицированных нуклеиновых кислот в популяцию клеток-мишеней, например, in vitro, ex vivo или in vivo. Стадию контактирования клеточной популяции можно повторять один или несколько раз (как, например, два, три, четыре, пять или более пяти раз). В некоторых вариантах осуществления стадию контактирования клеточной популяции с модифицированными нуклеиновыми кислотами повторяют то количество раз, которое является достаточным для достижения заданной эффективности трансляции белка в клеточной популяции. Учитывая сниженную цитотоксичность популяции клеток-мишеней, обеспечиваемую модификациями нуклеиновых кислот, такие повторяющиеся трансфекции достижимы в разнообразном наборе типов клеток in vitro и/или in vivo.
Варианты полипептидов
Предусматриваются нуклеиновые кислоты, которые кодируют варианты полипептидов, которые обладают определенной идентичностью с эталонной полипептидной последовательностью. Термин "идентичность", как известно в данной области, относится к взаимосвязи между последовательностями двух или более пептидов при определении путем сравнения последовательностей. В данной области "идентичность" также означает степень родственности последовательностей между пептидами при определении по количеству совпадений между цепями из двух или более аминокислотных остатков. "Идентичность" определяет процент идентичных совпадений для меньшей из двух или более последовательностей с выравниванием пропусков (при их наличии), осуществляемым с помощью конкретной математической модели или компьютерной программы (т.е. "алгоритмов"). Идентичность родственных пептидов можно без труда вычислять известными способами. Такие способы включают, но не ограничиваются ими, способы, описанные в Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991; и Carillo et al., SIAM J. Applied Math. 48, 1073 (1988).
В некоторых вариантах осуществления вариант полипептида имеет такую же или сходную активность с эталонным полипептидом. Альтернативно, вариант имеет измененную активность (например, увеличенную или сниженную) относительно эталонного полипептида. Как правило, варианты конкретного полинуклеотида или полипептида по настоящему изобретению имеют по меньшей мере приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичность последовательности с последовательностью конкретного эталонного полинуклеотида или полипептида при определении с помощью программ выравнивания последовательностей и параметров, описанных в настоящем описании и известных специалистам в данной области.
Как понятно специалистам в данной области, фрагменты белков, функциональные белковые домены и гомологичные белки также считаются находящимися в объеме настоящего изобретения. Например, в рамках настоящего изобретения предусматривается любой белковый фрагмент эталонного белка (что означает полипептидную последовательность, по меньшей мере на один аминокислотный остаток более короткую, чем эталонная полипептидная последовательность, но в остальном идентичную), имеющий длину 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более 100 аминокислот. В другом примере любой белок, который включает цепь из приблизительно 20, приблизительно 30, приблизительно 40, приблизительно 50 или приблизительно 100 аминокислот, которые приблизительно на 40%, приблизительно на 50%, приблизительно на 60%, приблизительно на 70%, приблизительно на 80%, приблизительно на 90%, приблизительно на 95% или приблизительно на 100% идентичны любой из последовательностей, описанных в настоящем описании, можно использовать в соответствии с настоящем изобретением. В определенных вариантах осуществления белковая последовательность, подлежащая применению в соответствии с настоящим изобретением, включает 2, 3, 4, 5, 6, 7, 8, 9, 10 или более мутаций, как показано в любой из последовательностей, представленных или упоминаемых в настоящем описании.
Библиотеки полипептидов
Также предусматриваются библиотеки полинуклеотидов, содержащие нуклеозидные модификации, где полинуклеотиды индивидуально содержат первую последовательность нуклеиновой кислоты, кодирующую полипептид, такой как антитело, связывающий белок партнер, каркасный белок и другие полипептиды, известные в данной области. Предпочтительно, полинуклеотиды представляют собой мРНК в форме, пригодной для прямого введения в заданную клетку-хозяина, которая в свою очередь синтезирует кодируемый полипептид.
В определенных вариантах осуществления несколько вариантов белка, каждый с отличающейся аминокислотной модификацией(ями), получают и исследуют для определения наилучшего варианта с точки зрения фармакокинетики, стабильности, биосовместимости и/или биологической активности, или биофизического свойства, такого как уровень экспрессии. Такая библиотека может содержать 10, 102, 103, 104, 105, 106, 107, 108, 109 или более 109 возможных вариантов (включая замены, делеции одного или нескольких остатков, и инсерцию одного или нескольких остатков).
Комплексы полипептид-нуклеиновая кислота
Надлежащая трансляция белка вовлекает физическую агрегацию ряда полипептидов и нуклеиновых кислот, ассоциированных с мРНК. Настоящее изобретение предусматривает комплексы белок-нуклеиновая кислота, содержащие транслируемую мРНК, имеющую одну или несколько нуклеозидных модификаций (например, по меньшей мере две различных нуклеозидных модификации) и один или несколько полипептидов, связанных с мРНК. Как правило, белки предоставляют в количестве, эффективном для предупреждения или снижения врожденного иммунного ответа клетки, в которую введен комплекс.
Нетранслируемые модифицированные нуклеиновые кислоты
Как описано в настоящем описании, предусматриваются мРНК, имеющие последовательности, которые являются по существу нетранслируемыми. Такие мРНК являются эффективными в качестве вакцины при введении млекопитающему.
Также предусматриваются модифицированные нуклеиновые кислоты, которые содержат одну или несколько некодирующих областей. Такие модифицированные нуклеиновые кислоты обычно являются нетранслируемыми, но способны связываться и изолировать один или несколько компонентов аппарата трансляции, таких как рибосомальный белок или транспортная РНК (тРНК), тем самым эффективно снижая экспрессию белка в клетке. Модифицированная нуклеиновая кислота может содержать малую ядерную РНК (мя-РНК), микро-РНК (микроРНК), малую интерферирующую РНК (миРНК) или Piwi-взаимодействующую РНК (pi-РНК).
Синтез модифицированных нуклеиновых кислот
Нуклеиновые кислоты для применения в соответствии с настоящим изобретением можно получать любым доступным способом, включая, но не ограничиваясь ими, химический синтез, ферментативный синтез, который обычно называют транскрипцией in vitro, ферментативное или химическое расщепление более длинного предшественника и т.д. Способы синтеза РНК известны в данной области (см., например, Gait, M.J. (ed.) Oligonucleotide synthesis: a practical approach, Oxford [Oxfordshire], Washington, DC: IRL Press, 1984; и Herdewijn, P. (ed.) Oligonucleotide synthesis: methods and applications, Methods in Molecular Biology, v. 288 (Clifton, N.J.) Totowa, N.J.: Humana Press, 2005; которые обе включены в настоящее описание в качестве ссылок).
Модифицированные нуклеиновые кислоты не должны быть единообразно модифицированными по всей длине молекулы. В различных положениях нуклеиновой кислоты могут существовать различные нуклеотидные модификации и/или структуры остова. Специалисту в данной области будет понятно, что нуклеотидные аналоги или другая модификация(и) могут быть расположены в любом положении(ях) нуклеиновой кислоты, так что функция нуклеиновой кислоты по существу не снижается. Модификация также может представлять собой 5’- или 3’-концевую модификацию. Нуклеиновые кислоты могут содержать минимум один и максимум 100% модифицированных нуклеотидов, или любой процент между ними, такой как по меньшей мере 5% модифицированных нуклеотидов, по меньшей мере 10% модифицированных нуклеотидов, по меньшей мере 25% модифицированных нуклеотидов, по меньшей мере 50% модифицированных нуклеотидов, по меньшей мере 80% модифицированных нуклеотидов или по меньшей мере 90% модифицированных нуклеотидов. Например, нуклеиновые кислоты могут содержать модифицированный пиримидин, такой как урацил или цитозин. В некоторых вариантах осуществления по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 50%, по меньшей мере 80%, по меньшей мере 90% или 100% урацила в нуклеиновой кислоте заменено модифицированным урацилом. Модифицированный урацил может быть заменен соединением, имеющим одну уникальную структуру, или он может быть заменен множеством соединений, имеющих различные структуры (например, 2, 3, 4 или более уникальных структур). В некоторых вариантах осуществления по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 25%, по меньшей мере 50%, по меньшей мере 80%, по меньшей мере 90% или 100% цитозина в нуклеиновой кислоте заменено модифицированным цитозином. Модифицированный цитозин может быть заменен соединением, имеющим одну уникальную структуру, или он может быть заменен множеством соединений, имеющих различные структуры (например, 2, 3, 4 или более уникальных структур).
Как правило, наиболее короткой длиной модифицированной мРНК по настоящему изобретению может быть длина последовательности мРНК, которая является достаточной для кодирования дипептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования трипептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования тетрапептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования пентапептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования гексапептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования гептапептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования октапептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования нонапептида. В другом варианте осуществления длина последовательности мРНК является достаточной для кодирования декапептида.
Примеры дипептидов, которые могут кодировать модифицированные последовательности нуклеиновых кислот, включают, но не ограничиваются ими, карнозин и ансерин.
В следующем варианте осуществления мРНК имеет длину более 30 нуклеотидов. В другом варианте осуществления молекула РНК имеет длину более 35 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 40 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 45 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 55 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 60 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 80 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 90 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 100 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 120 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 140 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 160 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 180 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 200 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 250 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 300 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 350 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 400 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 450 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 500 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 600 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 700 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 800 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 900 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1000 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1100 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1200 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1300 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1400 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1500 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1600 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 1800 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 2000 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 2500 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 3000 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 4000 нуклеотидов. В другом варианте осуществления длина составляет по меньшей мере 5000 нуклеотиды, или более 5000 нуклеотидов.
Например, модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно получать с использованием способов, которые известны специалистам в области синтеза нуклеиновых кислот.
В некоторых вариантах осуществления настоящее изобретение относится к способам, например, ферментативным, получения последовательности нуклеиновой кислоты, содержащей нуклеотид, который нарушает связывание связывающегося с большой бороздкой партнера с последовательностью нуклеиновой кислоты, где последовательность нуклеиновой кислоты содержит соединение формулы XI-a:
где:
нуклеотид имеет сниженную аффинность связывания со связывающимся с большой бороздкой партнером;

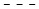
U представляет собой O, S, -NRa- или -CRaRb-, когда


A представляет собой H, OH, фосфорил, пирофосфат, сульфат, -NH2, -SH, аминокислоту, пептид, содержащий 2-12 аминокислот;
X представляет собой O или S;
каждый Y1 независимо выбран из -ORa1, -NRa1Rb1 и -SRa1;
каждый из Y2 и Y3 независимо выбран из O, -CRaRb-, NRc, S или линкера, содержащего один или несколько атомов, выбранных из группы, состоящей из C, O, N и S;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил;
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля;
каждый из Ra1 и Rb1 независимо представляет собой H или противоион;
-ORc1 представляет собой OH при pH приблизительно 1, или -ORc1 представляет собой O- при физиологических значениях pH; и
B представляет собой основание нуклеиновой кислоты;
при условии, что кольцо, охватывающее переменные A, B, D, U, Z, Y2 и Y3, не может представлять собой рибозу, причем способ включает реакцию соединения формулы XIII:

с РНК-полимеразой и кДНК-матрицей.
В некоторых вариантах осуществления реакцию повторяют от 1 до приблизительно 7000 раз.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XII-a, XII-b или XII-c:
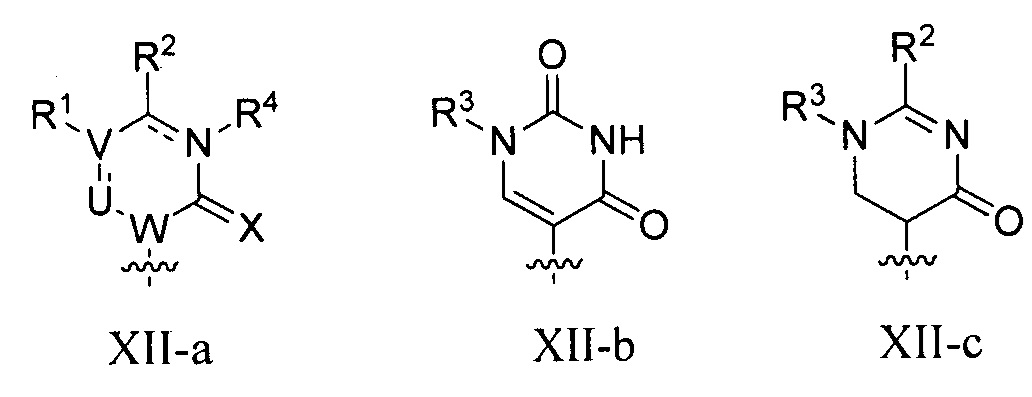
где:

X представляет собой O или S;
каждый из U и W независимо представляет собой C или N;
V представляет собой O, S, C или N;
где когда V представляет собой C, тогда R1 представляет собой H, C1-6 алкил, C1-6 алкенил, C1-6 алкинил, галоген или -ORc, где каждый из C1-20 алкила, C2-20алкенила, C2-20 алкинила необязательно замещен -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc или -NHC(O)ORc;
и где когда V представляет собой O, S или N, тогда R1 отсутствует;
R2 представляет собой H, -ORc, -SRc, -NRaRb или галоген;
или когда V представляет собой C, тогда R1 и R2 вместе с атомами углерода, к которым они присоединены, могут образовывать 5- или 6-членное кольцо, необязательно замещенное 1-4 заместителями, выбранными из галогена, -OH, -SH, -NRaRb, C1-20 алкила, C2-20 алкенила, C2-20 алкинила, C1-20 алкокси или C1-20 тиоалкила;
R3 представляет собой H или C1-20 алкил;
R4 представляет собой H или C1-20 алкил; где когда

каждый из Ra и Rb независимо представляет собой H, C1-20 алкил, C2-20 алкенил, C2-20 алкинил или C6-20 арил; и
Rc представляет собой H, C1-20 алкил, C2-20 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XII-a1, XII-a2, XII-a3, XII-a4 или XII-a5:
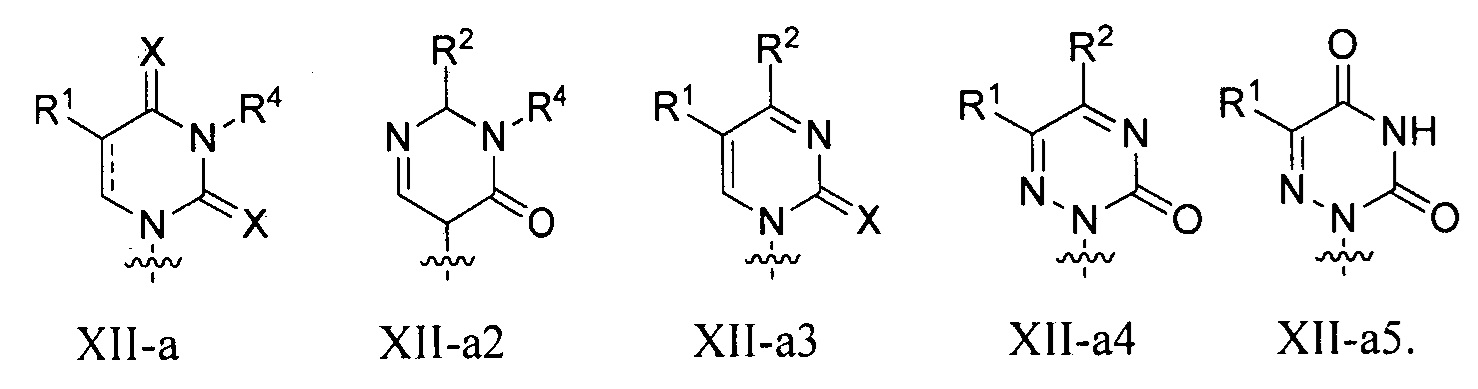
В некоторых вариантах осуществления способы, кроме того, включают нуклеотид, выбранный из группы, состоящей из аденозина, цитозина, гуанозина и урацила.
В некоторых вариантах осуществления основание нуклеиновой кислоты представляет собой пиримидин или его производное.
В другом аспекте настоящее изобретение относится к способам амплификации последовательности нуклеиновой кислоты, содержащей нуклеотид, который нарушает связывание связывающегося с большой бороздкой партнера с последовательностью нуклеиновой кислоты, причем способ включает:
реакцию соединения формулы XI-d:

где:
нуклеотид имеет сниженную аффинность связывания со связывающимся с большой бороздкой партнером;

U представляет собой O, S, -NRa- или -CRaRb-, когда


Z представляет собой H, C1-12 алкил или C6-20 арил, или Z отсутствует, когда

Z может представлять собой -CRaRb- и образует связь с A;
A представляет собой H, OH, фосфорил, пирофосфат, сульфат, -NH2, -SH, аминокислоту или пептид, содержащий 1-12 аминокислот;
X представляет собой O или S;
каждый Y1 независимо выбран из -ORa1, -NRa1Rb1 и -SRa1;
каждый из Y2 и Y3 независимо выбран из O, -CRaRb-, NRc, S или линкера, содержащего один или несколько атомов, выбранных из группы, состоящей из C, O, N и S;
n равно 0, 1, 2 или 3;
m равно 0, 1, 2 или 3;
B представляет собой основание нуклеиновой кислоты;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил;
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля;
каждый из Ra1 и Rb1 независимо представляет собой H или противоион; и
-ORc1 представляет собой OH при pH приблизительно 1, или -ORc1 представляет собой O- при физиологических значениях pH;
при условии, что кольцо, охватывающее переменные A, B, D, U, Z, Y2 и Y3, не может представлять собой рибозу, с праймером, кДНК-матрицей и РНК-полимеразой.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XII-a, XII-b или XII-c:
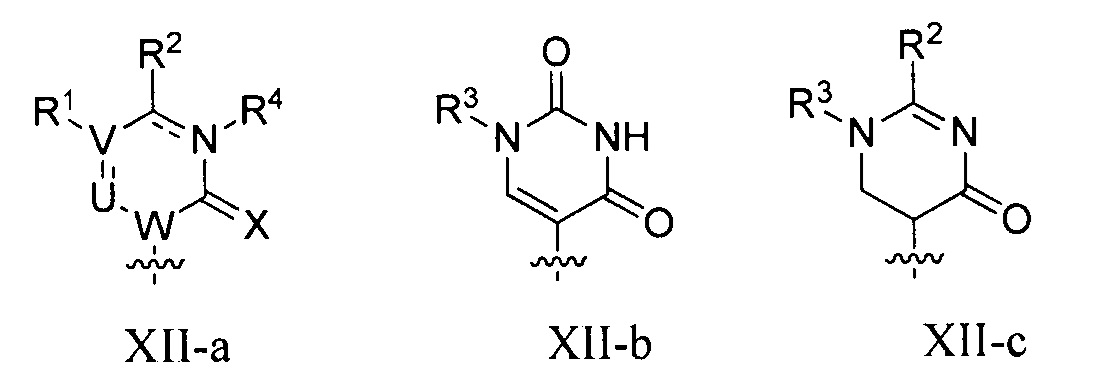
где:

X представляет собой O или S;
каждый из U и W независимо представляет собой C или N;
V представляет собой O, S, C или N;
где когда V представляет собой C, тогда R1 представляет собой H, C1-6 алкил, C1-6 алкенил, C1-6 алкинил, галоген или -ORc, где каждый из C1-20 алкила, C2-20алкенила, C2-20 алкинила необязательно замещен -OH, -NRaRb, -SH, -C(O)Rc, -C(O)ORc, -NHC(O)Rc или -NHC(O)ORc;
и где когда V представляет собой O, S или N, тогда R1 отсутствует;
R2 представляет собой H, -ORc, -SRc, -NRaRb или галоген;
или когда V представляет собой C, тогда R1 и R2 вместе с атомами углерода, к которым они присоединены, могут образовывать 5- или 6-членное кольцо, необязательно замещенное 1-4 заместителями, выбранными из галогена, -OH, -SH, -NRaRb, C1-20 алкила, C2-20 алкенила, C2-20 алкинила, C1-20 алкокси или C1-20 тиоалкила;
R3 представляет собой H или C1-20 алкил;
R4 представляет собой H или C1-20 алкил; где когда

каждый из Ra и Rb независимо представляет собой H, C1-20 алкил, C2-20 алкенил, C2-20 алкинил или C6-20 арил; и
Rc представляет собой H, C1-20 алкил, C2-20 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XII-a1, XII-a2, XII-a3, XII-a4 или XII-a5:
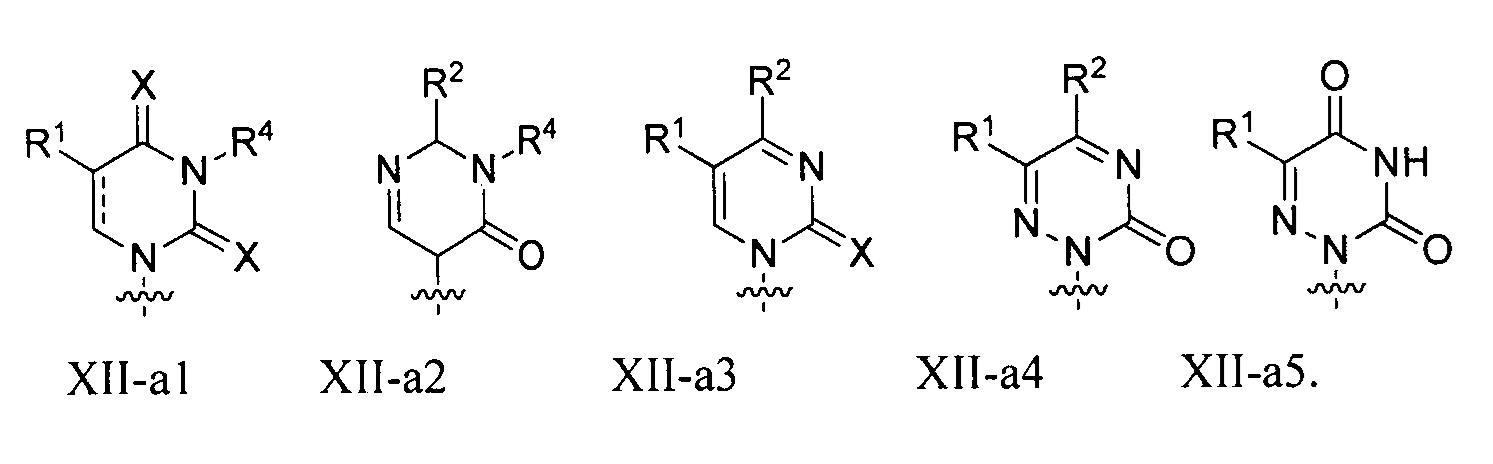
В некоторых вариантах осуществления способы дополнительно включают нуклеотид, выбранный из группы, состоящей из аденозина, цитозина, гуанозина и урацила.
В некоторых вариантах осуществления основание нуклеиновой кислоты представляет собой пиримидин или его производное.
В некоторых вариантах осуществления настоящее изобретение относится к способам синтеза фармацевтической нуклеиновой кислоты, включающим стадии:
a) предоставления комплементарной дезоксирибонуклеиновой кислоты (кДНК), которая кодирует представляющий интерес фармацевтический белок;
b) выбора нуклеотида, о котором известно, что он нарушает связывание связывающегося с большой бороздкой партнера с нуклеиновой кислотой, где нуклеотид обладает сниженной аффинностью связывания со связывающимся с большой бороздкой партнером; и
c) контактирования предоставленной кДНК и выбранного нуклеотида с РНК-полимеразой в таких условиях, чтобы синтезировалась фармацевтическая нуклеиновая кислота.
В следующих вариантах осуществления фармацевтическая нуклеиновая кислота представляет собой рибонуклеиновую кислоту (РНК).
В следующем аспекте настоящего изобретения модифицированные нуклеиновые кислоты можно получать с использованием способов твердофазного синтеза.
В некоторых вариантах осуществления настоящее изобретение относится к способам синтеза нуклеиновой кислоты, включающей соединение формулы XI-a:
где:

U представляет собой O, S, -NRa- или -CRaRb-, когда


A представляет собой H, OH, фосфорил, пирофосфат, сульфат, -NH2, -SH, аминокислоту, пептид, содержащий 2-12 аминокислот;
X представляет собой O или S;
каждый Y1 независимо выбран из -ORa1, -NRa1Rb1 и -SRa1;
каждый из Y2 и Y3 независимо выбран из O, -CRaRb-, NRc, S или линкера, содержащего один или несколько атомов, выбранных из группы, состоящей из C, O, N и S;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил;
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля;
каждый из Ra1 и Rb1 независимо представляет собой H или противоион;
-ORc1 представляет собой OH при pH приблизительно 1, или -ORc1 представляет собой O- при физиологических значениях pH; и
B представляет собой основание нуклеиновой кислоты;
при условии, что кольцо, охватывающее переменные A, B, U, Z, Y2 и Y3, не может представлять собой рибозу;
включающим:
a) реакцию нуклеотида формулы XIII-a:
с фосфорамидитным соединением формулы XIII-b:
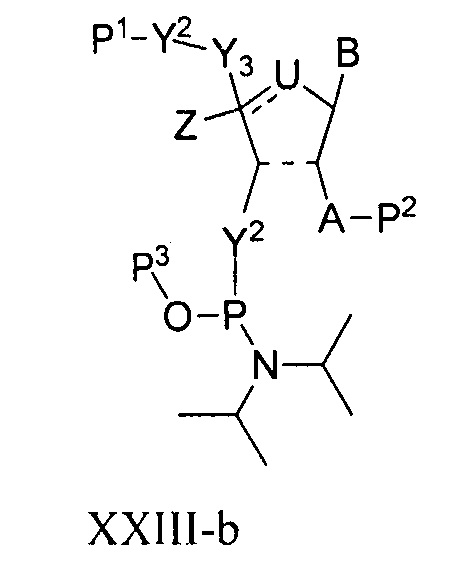
где:

каждый из P1, P2 и P3 независимо представляет собой подходящие защитные группы;
с получением нуклеиновой кислоты формулы XIV-a:
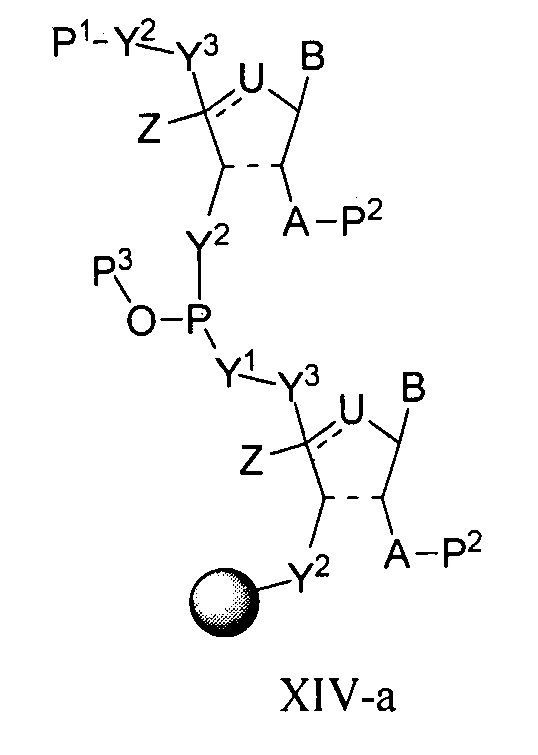
и b) окисление или сульфуризацию нуклеиновой кислоты формулы XIV-a с получением нуклеиновой кислоты формулы XIVb:
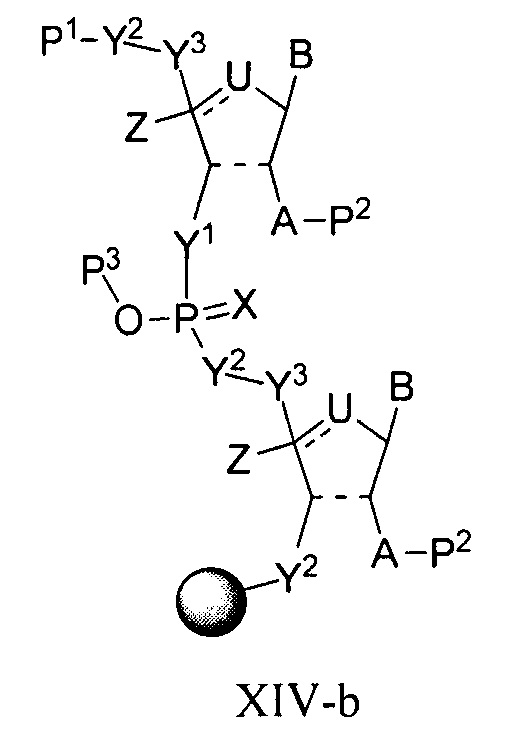
и c) удаление защитных групп с получением нуклеиновой кислоты формулы XI-a.
В некоторых вариантах осуществления способы, кроме того, включают нуклеотид, выбранный из группы, состоящей из аденозина, цитозина, гуанозина и урацила.
В некоторых вариантах осуществления B представляет собой основание нуклеиновой кислоты формулы XIII:

где:
V представляет собой N или положительно заряженную NRc;
R3 представляет собой NRcRd, -ORa или -SRa;
R4 представляет собой H или необязательно может образовывать связь с Y3;
R5 представляет собой H, -NRcRd или -ORa;
каждый из Ra и Rb независимо представляет собой H, C1-12 алкил, C2-12 алкенил, C2-12 алкинил или C6-20 арил; и
Rc представляет собой H, C1-12 алкил, C2-12 алкенил, фенил, бензил, группу полиэтиленгликоля или группу амино-полиэтиленгликоля.
В некоторых вариантах осуществления стадии a) и b) повторяют от 1 до приблизительно 10000 раз.
Применение модифицированных нуклеиновых кислот
Терапевтические средства
Модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать в качестве лекарственных средств. Например, модифицированную нуклеиновую кислоту, описанную в настоящем описании, можно вводить животному или индивидууму, где модифицированная нуклеиновая кислота транслируется in vivo с образованием терапевтического пептида у животного или индивидуума. Таким образом, в рамках настоящего изобретения предусматриваются композиции, способы, наборы и реагенты для лечения или предупреждения заболевания или состояний у человека и других млекопитающих. Активные лекарственные средства по настоящему изобретению включают модифицированные нуклеиновые кислоты, клетки, содержащие модифицированные нуклеиновые кислоты или полипептиды, транслируемые с модифицированных нуклеиновых кислот, полипептиды, транслируемые с модифицированных нуклеиновых кислот, клетки, с которыми контактировали модифицированные нуклеиновые кислоты, или полипептиды, транслированные с модифицированных нуклеиновых кислот, ткани, содержащие клетки, содержащие модифицированные нуклеиновые кислоты, и органы, содержащие ткани, содержащие клетки, содержащие модифицированные нуклеиновые кислоты.
Предусматриваются способы индукции трансляции синтетического или рекомбинантного полинуклеотида для продукции полипептида в популяции клеток с использованием модифицированных нуклеиновых кислот, описанных в настоящем описании. Такая трансляция может быть in vivo, ex vivo, in culture или in vitro. Популяцию клеток подвергают контакту с эффективным количеством композиции, содержащей нуклеиновую кислоту, которая имеет по меньшей мере одну нуклеозидную модификацию и транслируемую область, кодирующую полипептид. Популяцию подвергают контакту в таких условиях, чтобы нуклеиновая кислота была локализована в одной или нескольких клетках клеточной популяции и рекомбинантный полипептид транслировался в клетке с нуклеиновой кислоты.
Эффективное количество композиции предоставляют, исходя из, по меньшей мере частично, ткани-мишени, типа клеток-мишени, средств введения, физических характеристик нуклеиновой кислоты (например, размер и степень модифицированных нуклеозидов) и других определяющих факторов. Как правило, эффективное количество композиции обеспечивает белковую продукцию в клетке предпочтительно более эффективно, чем композиция, содержащая соответствующую немодифицированную нуклеиновую кислоту. Увеличенная эффективность может быть продемонстрирована по увеличенной клеточной трансфекции (т.е. проценту клеток, трансфицированных нуклеиновой кислотой), увеличенной трансляции белка с нуклеиновой кислоты, сниженной деградации нуклеиновой кислоты (как продемонстрировано, например, по увеличению продолжительности трансляции белка с модифицированной нуклеиновой кислоты), или сниженному врожденному иммунному ответу клетки-хозяина или повышенной терапевтической применимости.
Аспекты настоящего изобретения относятся к способам индукции трансляции in vivo рекомбинантного полипептида у млекопитающего, нуждающегося в этом. В этом отношении, эффективное количество композиции, содержащей нуклеиновую кислоту, которая имеет по меньшей мере одну нуклеозидную модификацию и транслируемую область, кодирующую полипептид, вводят индивидууму с использованием способов доставки, описанных в настоящем описании. Нуклеиновую кислоту предоставляют в количестве и с учетом других условий так, чтобы нуклеиновая кислота была локализована в клетке или клетках индивидуума и рекомбинантный полипептид транслировался в клетке с нуклеиновой кислоты. На клетку, в которой локализована нуклеиновая кислота или ткань, в которой присутствует клетка, можно осуществлять нацеливание посредством одного или более одного раундов введения нуклеиновой кислоты.
Другие аспекты настоящего изобретения относятся к трансплантации клеток, содержащих модифицированные нуклеиновые кислоты, млекопитающему. Введение клеток млекопитающему известно средним специалистам в данной области, такое как местная имплантация (например, местное или подкожное введение), доставка в орган или системная инъекция (например, внутривенная инъекция или ингаляция) как есть состава клеток в фармацевтически приемлемом носителе. Композиции, содержащие модифицированные нуклеиновые кислоты, составляют для введения внутримышечно, трансартериально, внутрибрюшинно, внутривенно, интраназально, подкожно, эндоскопически, трансдермально или интратекально. В некоторых вариантах осуществления композицию составляют для длительного высвобождения.
Индивидуум, которому вводят лекарственное средство, страдает или имеет риск развития заболевания, нарушения или болезнетворного состояния. Предусматриваются способы идентификации, диагностики и классификации индивидуумов на этом основании, которые могут включать клинический диагноз, уровни биомаркеров, полногеномные исследования ассоциации (GWAS) и другие способы, известные в данной области.
В определенных вариантах осуществления введенная модифицированная нуклеиновая кислота направляет продукцию одного или нескольких рекомбинантных полипептидов, которые обеспечивают функциональную активность, которая по существу отсутствует в клетке, в которую транслирован рекомбинантный полипептид. Например, отсутствующая функциональная активность по природе может быть ферментативной, структурной или регулирующей гены.
В других вариантах осуществления введенная модифицированная нуклеиновая кислота направляет продукцию одного или нескольких рекомбинантных полипептидов, которые заменяют полипептид (или множество полипептиды), которые по существу отсутствуют в клетке, в которой рекомбинантный полипептид транслируется. Такое отсутствие может быть следствием генетической мутации кодирующего гена или его регуляторного каскада. В других вариантах осуществления введенная модифицированная нуклеиновая кислота направляет продукцию одного или нескольких рекомбинантных полипептидов для дополнения количества полипептида (или множества полипептидов), который присутствует в клетке, в которой рекомбинантный полипептид транслируется. Альтернативно, рекомбинантный полипептид функционирует, осуществляя антагонизм активности эндогенного белка, присутствующего в клетке или на поверхности клетки или секретируемого из клетки. Обычно активность эндогенного белка является вредоносной для индивидуума, например, вследствие мутации эндогенного белка, приводящей к измененной активности или локализации. Кроме того, рекомбинантный полипептид осуществляет антагонизм, прямо или непрямо, активности биологической части, присутствующей в клетке, на поверхности клетки или секретируемой из клетки. Примеры подлежащих антагонизму биологических частей включают липиды (например, холестерин), липопротеин (например, липопротеин низкой плотности), нуклеиновую кислоту, углевод или низкомолекулярный токсин.
Рекомбинантные белки, описанные в настоящем описании, конструируют для локализации в клетке, потенциально в конкретном компартменте, таком как ядро, и их конструируют для секреции из клетки или транслокации на плазматическую мембрану клетки.
Как описано в настоящем описании, пригодным признаком модифицированных нуклеиновых кислот по настоящему изобретению является способность снижать, ускользать от, избегать или устранять врожденный иммунный ответ клетки на экзогенную нуклеиновую кислоту. Предусматриваются способы проведения титрования, снижения или устранения иммунного ответа в клетке или популяции клеток. В некоторых вариантах осуществления клетку подвергают контакту с первой композицией, которая содержит первую дозу первой экзогенной нуклеиновой кислоты, включающей транслируемую область и по меньшей мере одну нуклеозидную модификацию, и определяют уровень врожденного иммунного ответа клетки на первую экзогенную нуклеиновую кислоту. Затем клетку подвергают контакту со второй композицией, которая включает вторую дозу первой экзогенной нуклеиновой кислоты, вторую дозу, содержащую меньшее количество первой экзогенной нуклеиновой кислоты по сравнению с первой дозой. Альтернативно, клетку подвергают контакту с первой дозой второй экзогенной нуклеиновой кислоты. Вторая экзогенная нуклеиновая кислота может содержать один или несколько модифицированных нуклеозидов, которые могут быть одинаковыми или отличаются от первой экзогенной нуклеиновой кислоты, или, альтернативно, вторая экзогенная нуклеиновая кислота может не содержать модифицированные нуклеозиды. Стадии контактирования клетки с первой композицией и/или второй композицией можно повторять один или несколько раз. Кроме того, необязательно определяют эффективность продукции белка (например, трансляции белка) в клетке, и клетку можно вновь неоднократно трансфицировать первой и/или второй композицией до тех пор, пока не будет достигнута заданная эффективность продукции белка.
Терапевтические средства от заболеваний и состояний
Предусматриваются способы лечения или предупреждения симптома заболевания, характеризующегося отсутствующей или аберрантной активностью белка, путем восстановления отсутствующей активности белка или устранения аберрантной активности белка. Вследствие быстрой инициации белковой продукции после введения модифицированных мРНК по сравнению с вирусными ДНК-векторами, соединения по настоящему изобретению являются особенно преимущественными в отношении лечения острых заболеваний, таких как сепсис, инсульт и инфаркт миокарда. Более того, отсутствие регуляции транскрипции модифицированных мРНК по настоящему изобретению является преимущественным в том, что достижимо точное титрование при продуцировании белка. Многие заболевания характеризуются отсутствующей (или по существу сниженной, так что надлежащая функция белка не выполняется) активностью белка. Такие белки могут не присутствовать, присутствуют в очень низких количествах или по существу являются нефункциональными. Настоящее изобретение относится к способу лечения таких состояний или заболеваний у индивидуума путем введения нуклеиновой кислоты или терапевтических средств на основе клеток, содержащих модифицированные нуклеиновые кислоты, предусматриваемые в рамках настоящего изобретения, где модифицированные нуклеиновые кислоты кодируют белок, который восстанавливает активность белка, отсутствующую в клетках-мишенях индивидуума.
Заболевания, характеризующиеся дисфункциональной или аберрантной активностью белка, включают, но не ограничиваются ими, злокачественную опухоль и пролиферативные заболевания, генетические заболевания (например, кистозный фиброз), аутоиммунные заболевания, диабет, нейродегенеративные заболевания, сердечно-сосудистые заболевания и метаболические заболевания. Настоящее изобретение относится к способу лечения таких состояний или заболеваний у индивидуума путем введения нуклеиновой кислоты или терапевтических средств на основе клеток, содержащих модифицированные нуклеиновые кислоты, предусматриваемые в рамках настоящего изобретения, где модифицированные нуклеиновые кислоты кодируют белок, который осуществляет антагонизм или иным образом устраняет нарушенную активность белка, присутствующую в клетке индивидуума.
Конкретными примерами дисфункционального белка являются варианты с миссенс-мутациями и нонсенс-мутациями гена регулятора трансмембранной проводимости при кистозном фиброзе (CFTR), которые продуцируют дисфункциональный или нефункциональный, соответственно, вариант белка CFTR, который вызывает кистозный фиброз.
Таким образом, предусматриваются способы лечения кистозного фиброза у млекопитающего путем контакта клетки индивидуума с модифицированной нуклеиновой кислотой, имеющей транслируемую область, которая кодирует функциональный полипептид CFTR, в таких условиях, чтобы в клетке присутствовало эффективное количество полипептида CTFR. Предпочтительными клетками-мишенями являются эпителиальные клетки, такие как клетки легкого, и способы введения определяются с учетом ткани-мишени; т.е. для доставки в легкое молекулы РНК составляют для введения путем ингаляции.
В другом варианте осуществления настоящее изобретение относится к способу лечения гиперлипидемии у индивидуума путем введения в клеточную популяцию индивидуума модифицированной молекулы мРНК, кодирующей сортилин, белок, недавно охарактеризованный с помощью геномных исследований, тем самым смягчая гиперлипидемию у индивидуума. Ген SORT1 кодирует трансмембранный белок транс-сети Гольджи (TGN), называемый сортилином. Генетические исследования показали, что один из пяти индивидуумов имеет однонуклеотидный полиморфизм, rs12740374, в локусе 1p13 гена SORT1, который предрасполагает их к наличию низких уровней липопротеина низкой плотности (LDL) и липопротеина очень низкой плотности (VLDL). Каждая копия минорного аллеля, присутствующего приблизительно у 30% людей, изменяет уровень холестерина LDL на 8 мг/дл, в то время как две копии минорного аллеля, присутствующие приблизительно у 5% популяции, снижают холестерин LDL на 16 мг/дл. Было показано, что носители минорного аллеля имеют на 40% сниженный риск инфаркта миокарда. В функциональных исследованиях на мышах in vivo описано, что сверхэкспрессия SORT1 в ткани печени мыши приводила к значительно более низким уровням LDL-холестерина, вплоть до на 80% более низким, и что подавление SORT1 увеличивало уровень холестерина LDL приблизительно на 200% (Musunuru K et al. From noncoding variant to phenotype via SORT1 at the 1p13 cholesterol locus. Nature 2010; 466:714-721).
Способы клеточной доставки нуклеиновой кислоты
Способы по настоящему изобретению усиливают доставку нуклеиновой кислоты в популяцию клеток in vivo, ex vivo или in culture. Например, клеточную культуру, содержащую множество клеток-хозяев (например, эукариотические клетки, такие как клетки дрожжей или млекопитающих), подвергают контакту с композицией, которая содержит улучшенную нуклеиновую кислоту, имеющую по меньшей мере одну нуклеозидную модификацию и, необязательно, транслируемую область. Композиция также обычно содержит реагент для трансфекции или другое соединение, которое увеличивает эффективность захвата улучшенной нуклеиновой кислоты в клетки-хозяева. Улучшенная нуклеиновая кислота проявляет увеличенное удержание в популяции клеток относительно соответствующей немодифицированной нуклеиновой кислоты. Удержание улучшенной нуклеиновой кислоты превышает удержание немодифицированной нуклеиновой кислоты. В некоторых вариантах осуществления оно по меньшей мере приблизительно на 50%, 75%, 90%, 95%, 100%, 150%, 200% или более чем на 200% превышает удержание немодифицированной нуклеиновой кислоты. Такое преимущество удержания может обеспечиваться одним раундом трансфекции улучшенной нуклеиновой кислоты, или оно может быть достигнуто после повторных раундов трансфекции.
В некоторых вариантах осуществления улучшенную нуклеиновую кислоту доставляют в популяцию клеток-мишеней с одной или несколькими дополнительными нуклеиновыми кислотами. Такая доставка может происходить одновременно, или улучшенную нуклеиновую кислоту доставляют перед доставкой одной или нескольких дополнительных нуклеиновых кислот. Дополнительные одна или несколько нуклеиновых кислот могут представлять собой модифицированные нуклеиновые кислоты или немодифицированные нуклеиновые кислоты. Понятно, что исходное присутствие улучшенных нуклеиновых кислот по существу не индуцирует врожденный иммунный ответ клеточной популяции, и, более того, что врожденный иммунный ответ не будет активироваться посредством последующего присутствия немодифицированных нуклеиновых кислот. В этом отношении, улучшенная нуклеиновая кислота сама по себе может не содержать транслируемую область, если белок, присутствие которого является желательным в популяции клеток-мишеней, транслируется с немодифицированных нуклеиновых кислот.
Нацеливающие части
В вариантах осуществления настоящего изобретения модифицированные нуклеиновые кислоты предоставляют для экспрессии связывающего белок партнера или рецептора на поверхности клетки, который функционирует, нацеливая клетку на конкретную область ткани или взаимодействуя с конкретным соединением, либо in vivo, либо in vitro. Подходящие связывающие белок партнеры включают антитела и их функциональные фрагменты, каркасные белки или пептиды. Кроме того, модифицированные нуклеиновые кислоты можно использовать для направления синтеза и внеклеточной локализации липидов, углеводов или других биологических соединений.
Постоянное подавление экспрессии генов
Способ эпигенетического подавления экспрессии генов у млекопитающего, включающий нуклеиновую кислоту, где транслируемая область кодирует полипептид или полипептиды, способные направлять специфическое к последовательности метилирование гистона H3 для инициации образования гетерохроматина и снижения транскрипции гена в области конкретных генов для подавления гена. Например, мутация с приобретением функции в гене Janus-киназы 2 ответственна за группу миелопролиферативных заболеваний.
Доставка поддающегося обнаружению или терапевтического средства к биологической мишени
Модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать в ряде различных сценариев, в которых является желательной доставка вещества ("груза") к биологической мишени, например, доставка поддающихся обнаружению веществ для обнаружения мишени, или доставка лекарственного средства. Способы обнаружения могут включать способы визуализации как in vitro, так и in vivo, например, иммуногистохимию, биолюминесцентную визуализацию (BLI), магнитно-резонансную томографию (MRI), позитронно-эмиссионную томографию (PET), электронную микроскопию, рентгеновскую компьютерную томографию, визуализацию Рамана, оптическую когерентную томографию, визуализацию по поглощению, термическую визуализацию, визуализацию по отражению флуоресценции, флуоресцентную микроскопию, флуоресцентную молекулярно-томографическую визуализацию, ядерную магнитно-резонансную томографию, рентгеновскую визуализацию, ультразвуковую визуализацию, фотоакустическую визуализацию, лабораторные анализы, или в любой ситуации, где требуется мечение/окрашивание/визуализация.
Например, модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать для перепрограммирования индуцированных плюрипотентных стволовых клеток (клеток iPS), которые затем можно использовать для прямого отслеживания клеток, которые трансфицированы, по сравнению со всеми клетками в кластере. В другом примере лекарственное средство, которое связано с модифицированной нуклеиновой кислотой через линкер и является флуоресцентно меченным, можно использовать для отслеживания лекарственного средства in vivo, например, внутриклеточно. Другие примеры включают использование модифицированной нуклеиновой кислоты для обратимой доставки лекарственного средства в клетки.
Модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать при внутриклеточном нацеливании груза, например, поддающегося обнаружению или лекарственного средства, в конкретную органеллу. Иллюстративные внутриклеточные мишени могут включать ядерную локализацию для улучшенного процессинга мРНК, или последовательность ядерной локализации (NLS), связанную с мРНК, содержащей ингибитор.
Кроме того, модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать для доставки лекарственных средств в клетки или ткани, например, у живых животных. Например, модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в настоящем описании, можно использовать для доставки высокополярных химиотерапевтических средств для уничтожения клеток злокачественной опухоли. Модифицированные нуклеиновые кислоты, связанные с лекарственным средством через линкер, могут способствовать его проникновению, позволяя лекарственному средству проникать в клетку для достижения внутриклеточной мишени.
В другом примере модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты можно связывать с вирусным ингибиторным пептидом (VIP) через расщепляемый линкер. Расщепляемый линкер будет высвобождать VIP и краситель в клетку. В другом примере модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты можно присоединять через линкер к ADP-рибозилату, который ответственен за действие некоторых бактериальных токсинов, таких как холерный токсин, дифтерийный токсин и коклюшный токсин. Эти белки токсинов представляют собой ADP-рибозилтрансферазы, которые модифицируют белки-мишени в клетках человека. Например, холерный токсин осуществляет ADP-рибозилирование G-белков, обеспечивая массивную секрецию жидкости из выстилки тонкого кишечника, что приводит к опасной для жизни диарее.
Фармацевтические композиции
Настоящее изобретение относится к белкам, полученным из модифицированных мРНК. Фармацевтические композиции необязательно могут содержать одно или несколько дополнительных терапевтически активных веществ. В соответствии с некоторыми вариантами осуществления предусматривается способ введения фармацевтических композиций, содержащих модифицированную нуклеиновую кислоту, кодирующую один или несколько белков, подлежащих доставке индивидууму, нуждающемуся в этом. В некоторых вариантах осуществления композиции вводят человеку. Для целей настоящего изобретения выражение "активный ингредиент", как правило, относится к белку, кодирующему белок или содержащему белок комплексу, как описано в настоящем описании.
Хотя описание фармацевтических композиций, предусматриваемых в рамках настоящего изобретения, главным образом, направлено на фармацевтические композиции, которые пригодны для введения человеку, квалифицированному специалисту будет понятно, что такие композиции обычно пригодны для введения животным всех видов. Модификация фармацевтических композиций, пригодных для введения человеку для того, чтобы сделать композиции пригодными для введения различным животным, хорошо понятна, и обычный квалифицированный ветеринар-фармацевт может спланировать и/или выполнить такую модификацию с использованием только обычного, или даже без него, экспериментирования. Индивидуумы, предусматриваемые для введения фармацевтических композиций, включают, но не ограничиваются ими, человека и/или других приматов; млекопитающих, включая имеющих коммерческое значение млекопитающих, таких как крупный рогатый скот, свиньи, лошади, овцы, коты, собаки, мыши и/или крысы; и/или птицы, включая имеющих коммерческое значение птиц, таких как куры, утки, гуси и/или индейки.
Составы фармацевтических композиций, описанных в настоящем описании, можно получать любым способом, который известен или будет разработан в будущем в области фармакологии. Как правило, такие способы получения включают стадию объединения активного ингредиента с эксципиентом и/или одним или несколькими другими вспомогательными ингредиентами, а затем, если необходимо и/или желательно, придание формы и/или упаковывание продукта в желаемую единицу для однократного дозирования или многократного дозирования.
Фармацевтическую композицию в соответствии с настоящим изобретением можно получать, упаковывать и/или продавать в общей массе, в качестве единичной дозы и/или в качестве множества единичных доз. Как используют в рамках изобретения, "единичная доза" представляет собой определенное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозировке активного ингредиента, которую вводят индивидууму, и/или удобной части такой дозировки, например, такой как половина или треть такой дозировки.
Относительные количества активного ингредиента, фармацевтически приемлемого эксципиента и/или любых дополнительных ингредиентов в фармацевтической композиции в соответствии с настоящим изобретением варьирует, в зависимости от особенностей, размера и/или состояния индивидуума, подвергаемого лечению, и, кроме того, в зависимости от пути введения композиции. В качестве примера, композиция может содержать от 0,1% до 100% (масс./масс.) активного ингредиента.
Кроме того, фармацевтические составы могут содержать фармацевтически приемлемый эксципиент, который, как используют в рамках изобретения, включает любые и все растворители, дисперсионные среды, разбавители или другие жидкие носители, диспергирующие или суспендирующие добавки, поверхностно-активные вещества, обеспечивающие изотоничность вещества, загустители или эмульгаторы, консерванты, твердые связующие вещества, смазывающие вещества и т.п., пригодные для конкретной желаемой дозированной формы. В Remington’s The Science and Practice of Pharmacy, 21st Edition, A. R. Gennaro (Lippincott, Williams & Wilkins, Baltimore, MD, 2006; включенная в настоящее описание в качестве ссылки) описаны различные эксципиенты, используемые для составления фармацевтических композиций, и известные способы их получения. За исключением случаев, когда общепринятый эксципиент несовместим с веществом или его производными, как, например, вследствие возникновения какого-либо нежелательного биологического эффекта или иного вредоносного взаимодействия с любым другим компонентом(ами) фармацевтической композиции, его применение предусматривается в объеме настоящего изобретения.
В некоторых вариантах осуществления фармацевтически приемлемый эксципиент является чистым по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100%. В некоторых вариантах осуществления эксципиент одобрен для применения у человека и для ветеринарного применения. В некоторых вариантах осуществления эксципиент одобрен United States Food and Drug Administration. В некоторых вариантах осуществления эксципиент представляет собой эксципиент фармацевтической категории. В некоторых вариантах осуществления эксципиент удовлетворяет стандартам United States Pharmacopoeia (USP), European Pharmacopoeia (EP), British Pharmacopoeia и/или International Pharmacopoeia.
Фармацевтически приемлемые эксципиенты, используемые для изготовления фармацевтических композиций, включают, но не ограничиваются ими, инертные разбавители, диспергирующие и/или гранулирующие агенты, поверхностно-активные вещества и/или эмульгаторы, дезинтегрирующие вещества, связующие вещества, консерванты, буферные вещества, смазывающие вещества и/или масла. Такие эксципиенты необязательно могут быть включены в фармацевтические составы. В композиции могут присутствовать эксципиенты, такие как масло какао и воск для суппозиториев, красители, покровные вещества, подсластители, вкусовые добавки и/или отдушки, в зависимости от мнения составителя.
Иллюстративные разбавители включают, но не ограничиваются ими, карбонат кальция, карбонат натрия, фосфат кальция, дикальций фосфат, сульфат кальция, гидрофосфат кальция, лактозу натрия фосфата, сахарозу, целлюлозу, микрокристаллическую целлюлозу, каолин, маннит, сорбит, инозитол, хлорид натрия, сухой крахмал, кукурузный крахмал, порошковый сахар и т.д. и/или их комбинацию.
Иллюстративные гранулирующие и/или диспергирующие агенты включают, но не ограничиваются ими, картофельный крахмал, кукурузный крахмал, тапиоковый крахмал, натрия крахмала гликолят, глины, альгиновую кислоту, гуаровую камедь, цитрусовую пульпу, агар, бентонит, целлюлозу и древесные продукты, природную губку, катионообменные смолы, карбонат кальция, силикаты, карбонат натрия, сшитый поли(винилпирролидон) (кросповидон), натрий карбоксиметилкрахмал (натрия крахмала гликолят), карбоксиметилцеллюлозу, сшитую натрий-карбоксиметилцеллюлозу (кроскармеллозу), метилцеллюлозу, преджелатинизированный крахмал (крахмал 1500), микрокристаллический крахмал, нерастворимый в воде крахмал, кальций-карбоксиметилцеллюлозу, алюмосиликат магния (Veegum), лаурилсульфат натрия, четвертичные соединения аммония, и т.д. и/или их комбинации.
Иллюстративные поверхностно-активные вещества и/или эмульгаторы включают, но не ограничиваются ими, природные эмульгаторы (например, гуммиарабик, агар, альгиновая кислота, альгинат натрия, трагакант, хондрукс, холестерин, ксантан, пектин, желатин, яичный желток, казеин, ланолин, холестерин, воск и лецитин), коллоидные глины (например бентонит [силикат алюминия] и Veegum® [алюмосиликат магния]), производные аминокислот с длинной цепью, высокомолекулярные спирты (например, стеариловый спирт, цетиловый спирт, олеиловый спирт, триацетинмоностеарат, дистеарат этиленгликоля, глицерилмоностеарат и моностеарат пропиленгликоля, поливиниловый спирт), карбомеры (например, карбоксиполиметилен, полиакриловая кислота, полимер акриловой кислоты и карбоксивиниловый полимер), каррагинан, производные целлюлозы (например, натрийкарбоксиметилцеллюлоза, порошковая целлюлоза, гидроксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза), сложные эфиры сорбитана и жирных кислот (например, полиоксиэтилен сорбитан монолаурат [Tween®20], полиоксиэтилен сорбитан [Tween®60], полиоксиэтилен сорбитан моноолеат [Tween®80], сорбитан монопальмитат [Span®40], сорбитан моностеарат [Span®60], сорбитан тристеарат [Span®65], глицерил моноолеат, сорбитан моноолеат [Span®80]), сложные эфиры полиоксиэтилена (например, полиоксиэтилен моностеарат [Myrj®45], полиоксиэтилен гидрогенизированный касторовое масло, полиэтоксилированное касторовое масло, полиоксиметилен стеарат и Solutol®), сложные эфиры сахарозы и жирных кислот, сложные эфиры полиэтиленгликоля и жирных кислот (например, Cremophor®), простые эфиры полиоксиэтилена (например, лауриловый эфир полиоксиэтилена [Brij®30]), поли(винилпирролидон), монолаурат диэтиленгликоля, триэтаноламинолеат, олеат натрия, олеат калия, этилолеат, олеиновую кислоту, этиллаурат, лаурилсульфат натрия, Pluronic®F 68, Poloxamer®188, бромид цетримония, хлорид цетилпиридиния, хлорид бензалкония, докузат натрий, и т.д. и/или их комбинации.
Иллюстративные связующие вещества включают, но не ограничиваются ими, крахмал (например, кукурузный крахмал и крахмальная паста); желатин; сахара (например, сахароза, глюкоза, декстроза, декстрин, меласса, лактоза, лактит, маннит); природные и синтетические камеди (например, гуммиарабик, альгинат натрия, экстракт ирландского мха, камедь кассии, гхатти камедь, клейковину лузги, карбоксиметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, ацетат целлюлозы, поли(винилпирролидон), алюмосиликат магния (Veegum®) и арабиногалактан лиственницы); альгинаты; оксида полиэтилен; полиэтиленгликоль; неорганические соли кальция; кремниевую кислоту; полиметакрилаты; воск; воду; спирт; и т.д.; и их комбинации.
Иллюстративные консерванты могут включать, но не ограничиваются ими, антиоксиданты, хелатирующие агенты, противомикробные консерванты, противогрибковые консерванты, спиртовые консерванты, кислотные консерванты и/или другие консерванты. Иллюстративные антиоксиданты включают, но не ограничиваются ими, альфа-токоферол, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин, метабисульфит калия, пропионовую кислоту, пропилгаллат, аскорбат натрия, бисульфит натрия, метабисульфит натрия и/или сульфит натрия. Иллюстративные хелатирующие агенты включают этилендиаминтетрауксусную кислоту (EDTA), моногидрат лимонной кислоты, динатрий эдетат, дикалий эдетат, эдетовую кислоту, фумаровую кислоту, яблочную кислоту, фосфорную кислоту, эдетат натрия, виннокаменную кислоту и/или тринатрий эдетат. Иллюстративные противомикробные консерванты включают, но не ограничиваются ими, хлорид бензалкония, хлорид бензэтония, бензиловый спирт, бронопол, цетримид, хлорид цетилпиридиния, хлоргексидин, хлорбутанол, хлоркрезол, хлорксиленол, крезол, этиловый спирт, глицерин, гексетидин, имидмочевину, фенол, феноксиэтанол, фенилэтиловый спирт, нитрат фенилртути, пропиленгликоль и/или тимеросал. Иллюстративные противогрибковые консерванты включают, но не ограничиваются ими, бутилпарабен, метилпарабен, этилпарабен, пропилпарабен, бензойную кислоту, гидроксибензойную кислоту, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия и/или сорбиновую кислоту. Иллюстративные спиртовые консерванты включают, но не ограничиваются ими, этанол, полиэтиленгликоль, фенол, фенольные соединения, бисфенол, хлорбутанол, гидроксибензоат и/или фенилэтиловый спирт. Иллюстративные кислотные консерванты включают, но не ограничиваются ими, витамин A, витамин C, витамин E, бета-каротин, лимонную кислоту, уксусную кислоту, дегидроуксусную кислоту, аскорбиновую кислоту, сорбиновую кислоту и/или фитиновую кислоту. Другие консерванты включают, но не ограничиваются ими, токоферол, ацетат токоферола, детероксим мезилат, цетримид, бутилиованный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), этилендиамин, лаурилсульфат натрия (SLS), сульфат натрий-лаурилового эфира (SLES), бисульфит натрия, метабисульфит натрия, сульфит калия, метабисульфит калия, Glydant Plus®, Phenonip®, метилпарабен, Germall®115, Germaben®II, NeoloneTM, KathonTM и/или Euxyl®.
Иллюстративные буферные средства включают, но не ограничиваются ими, цитратные буферные растворы, ацетатные буферные растворы, фосфатные буферные растворы, хлорид аммония, карбонат кальция, хлорид кальция, цитрат кальция, глубионат кальция, глуцептат кальция, глюконат кальция, d-глюконовую кислоту, глицерофосфат кальция, лактат кальция, пропионовую кислоту, левулинат кальция, пентановую кислоту, двухосновный фосфат кальция, фосфорную кислоту, трехосновный фосфат кальция, фосфат-гидроксид кальция, ацетат калия, хлорид калия, глюконат калия, смеси калия, двухосновный фосфат калия, одноосновный фосфат калия, смеси фосфата калия, ацетат натрия, бикарбонат натрия, хлорид натрия, цитрат натрия, лактат натрия, двухосновный фосфат натрия, одноосновный фосфат натрия, смеси фосфата натрия, трометамин, гидроксид магния, гидроксид алюминия, альгиновую кислоту, не содержащую пирогенов воду, изотонический солевой раствор, раствор Рингера, этиловый спирт, и т.д. и/или их комбинации.
Иллюстративные смазывающие вещества включают, но не ограничиваются ими, стеарат магния, стеарат кальция, стеариновую кислоту, диоксид кремния, тальк, солод, глицерилбегенат, гидрогенизированные растительные масла, полиэтиленгликоль, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, лаурилсульфат магния, лаурилсульфат натрия и т.д. и их комбинации.
Иллюстративные масла включают, но не ограничиваются ими, миндальное масло, масло из косточек абрикоса, масло авокадо, масло бабассу, масло бергамота, масло семян черной смородины, масло огуречника, можжевеловое масло, масло ромашки, масло канолы, масло тмина, масло карнаубы, касторовое масло, коричное масло, масло какао, кокосовое масло, жир печени трески, масло кофе, кукурузное масло, хлопковое масло, жир эму, эвкалиптовое масло, масло первоцвета вечернего, рыбий жир, льняное масло, гераниол, тыквенное масло, масло из виноградных косточек, масло лесного ореха, масло иссопа, изопропилмиристат, масло жожобы, масло из плодов лакового дерева, лавандин, масло лаванды, масло лимона, масло кубебы, масло австралийского ореха, масло просвирник, масло из семян манго, масло из семян пенника лугового, норковый жир, масло мускатного ореха, оливковое масло, масло апельсина, масло исландского берикса, пальмовое масло, пальмоядровое масло, масло из персиковых косточек, арахисовое масло, маковое масло, масло семян тыквы, рапсовое масло, масло из рисовых отрубей, розмариновое масло, сафлоровое масло, сандаловое масло, масло сасанквы, масло чабера, облепиховое масло, кунжутное масло, масло из семян дерева ши, кремниевое масло, соевое масло, подсолнечное масло, масло чайного дерева, масло чертополоха, масло цубаки, масло ветивер, масло грецкого ореха и масло зародышей пшеницы. Иллюстративные масла включают, но не ограничиваются ими, бутилстеарат, каприловый триглицерид, каприновый триглицерид, циклометикон, диэтилсебакат, диметикон 360, изопропилмиристат, минеральное масло, октилдодеканол, олеиловый спирт, кремниевое масло и/или их комбинации.
Жидкие дозированные формы для перорального и парентерального введения включают, но не ограничиваются ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и/или эликсиры. В дополнение к активным ингредиентам, жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области, например, такие как вода или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое масло, арахисовое масло, кукурузное, масло зародышей, оливковое масло, касторовое масло и кунжутные масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и их смеси. Помимо инертных разбавителей пероральные композиции могут включать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие вещества, подсластители, вкусовые добавки и/или отдушки. В определенных вариантах осуществления для парентерального введения композиции смешивают с солюбилизаторами, такими как Cremophor®, спирты, масла, модифицированные масла, гликоли, полисорбаты, циклодекстрины, полимеры и/или их комбинации.
Инъецируемые препараты, например, стерильные инъецируемые водные или масляные суспензии, можно составлять в соответствии с уровнем техники с использованием подходящих диспергирующих средств, смачивающих веществ и/или суспендирующих веществ. Стерильные инъецируемые препараты могут представлять собой стерильные инъецируемые растворы, суспензии и/или эмульсии в нетоксичных парентерально приемлемых разбавителях и/или растворителях, например, в качестве раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, находятся вода, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. В качестве растворителя или суспендирующей среды обычно используют стерильные жирные масла. Для этой цели можно использовать любое легкое жирное масло, включая синтетические моно- или диглицериды. Для получения инъецируемых препаратов можно использовать жирные кислоты, такие как олеиновая кислота.
Инъецируемые составы можно стерилизовать, например, путем фильтрации через удерживающий бактерии фильтр, и/или путем включения стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной инъецируемой среде перед применением.
Для продления эффекта активного ингредиента часто является желательным замедление всасывания активного ингредиента при подкожной или внутримышечной инъекции. Это можно осуществлять с использованием жидкой суспензии кристаллического или аморфного материала с низкой растворимостью в воде. В этом случае скорость всасывания лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, осуществляют замедленное всасывание парентерально вводимой лекарственной формы путем растворения или суспендирования лекарственного средства в масляном носителе. Инъецируемые депо-формы получают путем формирования микроинкапсулированных матриц лекарственного средства в биодеградируемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера и природы конкретного используемого полимера, можно контролировать скорость высвобождения лекарственного средства. Примеры других биодеградируемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Депо-инъецируемые составы получают путем заключения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения, как правило, представляют собой суппозитории, которые можно получать путем смешения композиций с подходящими не вызывающими раздражения эксципиентами, такими как масло какао, полиэтиленгликоль или воск суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела и, таким образом, плавятся в прямой кишке или вагинальной полости и высвобождают активный ингредиент.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активный ингредиент смешан по меньшей мере с одним инертным фармацевтически приемлемым эксципиентом, таким как цитрат натрия или дикальций фосфат, и/или наполнителями или разбавителями (например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота), связующими веществами (например карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и гуммиарабик), увлажнителями (например, глицерин), дезинтегрирующими веществами (например, агар, карбонат кальция, картофель или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия), задерживающими растворение средствами (например, парафин), ускоряющими всасывание средствами (например, четвертичные соединения аммония), смачивающими веществами (например, цетиловый спирт и моностеарат глицерина), сорбентами (например, каолин и бентонитовая глина) и смазывающими веществами (например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия) и их смесями. В случае капсул, таблеток и пилюль дозированная форма может содержать буферные средства.
Твердые композиции сходного типа можно использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсул с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые дозированные формы таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как энтеросолюбильное покрытие и другие покрытия, хорошо известные в области составления фармацевтических препаратов. Они необязательно могут содержать замутняющие агенты и могут иметь такую композицию, что они высвобождают активный ингредиент(ы) только, или предпочтительно, в определенной части кишечного тракта, необязательно замедленным образом. Примеры композиции для погружения, которые можно использовать, включают полимерные вещества и воск. Твердые композиции сходного типа можно использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, таких как высокомолекулярные полиэтиленгликоли и т.п.
Дозированные формы для местного и/или трансдермального введения композиции могут включать мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалируемые средства и/или пластыри. Как правило, активный ингредиент смешивают в стерильных условиях с фармацевтически приемлемым эксципиентом и/или любыми необходимыми консервантами и/или буферами, в зависимости от обстоятельств. Кроме того, в настоящем описании предусматривается использование трансдермальных пластырей, которые часто имеют дополнительное преимущество обеспечения контролируемой доставки соединения в организм. Такие дозированные формы можно получать, например, путем растворения и/или диспергирования соединения в надлежащей среде. Альтернативно или дополнительно, скорость можно контролировать посредством либо предоставления контролирующей скорость мембраны и/либо диспергирования соединения в полимерной матрице и/или геле.
Подходящие устройства для применения в целях доставки внутрикожных фармацевтических композиций, описанных в настоящем описании, включают короткоигольные устройства, такие как устройства, описанные в патентах США 4886499; 5190521; 5328483; 5527288; 4270537; 5015235; 5141496 и 5417662. Внутрикожные композиции можно вводить с помощью устройств, которые ограничивают эффективную длину проникновения иглы в кожу, таких как устройства, описанные в публикации PCT WO 99/34850, и их функциональные эквиваленты. Пригодными являются устройства для струйного инжектирования, которые доставляют жидкие композиции в кожу через устройство для струйного инжектирования жидкостей и/или через иглу, которая проходит через роговой слой и обеспечивает струю, которая достигает слоя дермы. Устройства для струйного инжектирования описаны, например, в патентах США 5480381; 5599302; 5334144; 5993412; 5649912; 5569189; 5704911; 5383851; 5893397; 5466220; 5339163; 5312335; 5503627; 5064413; 5520639; 4596556; 4790824; 4941880; 4940460; и публикациях PCT WO 97/37705 и WO 97/13537. Пригодными являются баллистические устройства для доставки порошка/частиц, в которых используется сжатый газ для ускорения вакцины в порошковой форме через наружные слои кожи в слой дермы. Альтернативно или дополнительно, общепринятые шприцы можно использовать в классическом способе внутрикожного введения Манту.
Составы, пригодные для местного введения, включают, но не ограничиваются ими, жидкие и/или полужидкие препараты, такие как мази, лосьоны, эмульсии типа "масло в воде" и/или "вода в масле", такие как кремы, мази и/или пасты, и/или растворы и/или суспензии. Составы для местного введения могут содержать, например, от приблизительно 1% до приблизительно 10% (масс./масс.) активного ингредиента, хотя концентрация активного ингредиента может достигать предела растворимости активного ингредиента в растворителе. Составы для местного введения, кроме того, могут содержать один или несколько дополнительных ингредиентов, описанных в настоящем описании.
Фармацевтическую композицию можно получать, упаковывать и/или продавать в составе, пригодном для легочного введения через полость рта. Такой состав может содержать сухие частицы, которые содержат активный ингредиент и которые имеют диаметр в диапазоне от приблизительно 0,5 нм до приблизительно 7 нм или от приблизительно 1 нм до приблизительно 6 нм. Удобно, чтобы такие композиции имели форму сухих порошков для введения с использованием устройства, содержащего емкость с сухим порошком, в который может быть направлен поток пропеллента для диспергирования порошка и/или с использованием распределяющего контейнера с самодвижущимся растворителем/порошком, таким как устройство, содержащее активный ингредиент, растворенный и/или суспендированный в пропелленте с низкой температурой кипения в закрытом контейнере. Такие порошки содержат частицы, где по меньшей мере 98% частиц по массе имеют диаметр более 0,5 нм и по меньшей мере 95% частиц по количеству имеют диаметр менее 7 нм. Альтернативно, по меньшей мере 95% частиц по массе имеют диаметр более 1 нм и по меньшей мере 90% частиц по количеству имеют диаметр менее 6 нм. Композиции в виде сухого порошка могут включать твердый разбавитель в виде тонкоизмельченного порошка, такого как сахар, и удобным образом предоставляются в единичной дозированной форме.
Пропелленты с низкой температурой кипения включают жидкие пропелленты, имеющие температуру кипения ниже 65°F (18°С) при атмосферном давлении. Как правило, пропеллент может составлять 50%-99,9% (масс./масс.) композиции, и активный ингредиент может составлять 0,1%-20% (масс./масс.) композиции. Кроме того, пропеллент может содержать дополнительные ингредиенты, такие как жидкое неионное и/или твердое анионное поверхностно-активное вещество и/или твердый разбавитель (который может иметь размер частиц того же порядка, что и частицы, содержащие активный ингредиент).
Фармацевтические композиции, составленные для легочной доставки, могут обеспечивать активный ингредиент в форме капель раствора и/или суспензии. Такие составы можно получать, упаковывать и/или продавать в качестве водных и/или разбавленных спиртовых растворов и/или суспензий, необязательно стерильных, содержащих активный ингредиент, и их можно удобным образом вводить с использованием любого устройства для распыления и/или пульверизации. Такие составы, кроме того, могут содержать один или несколько дополнительных ингредиентов, включая, но не ограничиваясь ими, вкусовую добавку, такую как сахарин натрий, летучее масло, буферное вещество, поверхностно-активное вещество и/или консервант, такой как метилгидроксибензоат. Капли, предоставляемые этим путем введения, могут иметь средний диаметр в диапазоне от приблизительно 0,1 нм до приблизительно 200 нм.
Составы, описанные в настоящем описании в качестве пригодных для легочной доставки, пригодны для интраназальной доставки фармацевтической композиции. Другой состав, пригодный для интраназального введения, представляет собой грубый порошок, содержащий активный ингредиент и имеющий средний размер частиц приблизительно от 0,2 мкм до 500 мкм. Такой состав вводят подобно тому, как нюхают табак, т.е. путем быстрой ингаляции через носовой канал из контейнера порошка, удерживаемого вблизи носа.
Составы, пригодные для назального введения могут содержать, например, от приблизительно только 0,1% (масс./масс.) и вплоть до 100% (масс./масс.) активного ингредиента, и могут содержать один или несколько дополнительных ингредиентов, описанных в настоящем описании. Фармацевтическую композицию можно получать, упаковывать и/или продавать в составе, пригодном для буккального введения. Такие составы могут быть, например, в форме таблеток и/или пастилок, изготовленных с использованием общепринятых способов, и могут содержать, например, от 0,1% до 20% (масс./масс.) активного ингредиента, остальную часть, содержащую перорально растворимую и/или деградируемую композицию и, необязательно, один или несколько дополнительных ингредиентов, описанных в настоящем описании. Альтернативно, составы, пригодные для буккального введения, могут содержать порошок и/или аэрозолированный и/или распыленный раствор и/или суспензию, содержащую активный ингредиент. Такие порошковые, аэрозолированные и/или аэрозолированные составы, в дисперсном состоянии, могут иметь средний размер частиц и/или размер капель в диапазоне от приблизительно 0,1 нм до приблизительно 200 нм, и, кроме того, могут содержать один или несколько каких-либо дополнительных ингредиентов, описанных в настоящем описании.
Фармацевтическую композицию можно получать, упаковывать и/или продавать в составе, пригодном для офтальмологического введения. Такие составы могут быть, например, в форме глазных капель, включающих, например, раствор и/или суспензию 0,1/1,0% (масс./масс.) активного ингредиента в водном или масляном жидком эксципиенте. Такие капли, кроме того, могут содержать буферные вещества, соли и/или один или несколько других из каких-либо дополнительных ингредиентов, описанных в настоящем описании. Другие офталомологически вводимые составы, которые являются пригодными, включают составы, которые содержат активный ингредиент в микрокристаллической форме и/или в липосомальном препарате. Предусматривается, что ушные капли и/или глазные капли находятся в объеме настоящего изобретения.
Общие принципы составления и/или изготовления фармацевтических средств могут быть найдены, например, в Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005 (включенная в настоящее описание в качестве ссылки).
Введение
Настоящее изобретение относится к способам, включающим введение белков или комплексов в соответствии с настоящим изобретением индивидууму, нуждающемуся в этом. Белки или комплексы, или их фармацевтические, визуализирующие, диагностические или профилактические композиции, можно вводить индивидууму с использованием любого количества и пути введения, эффективного для профилактики, лечения, диагностики или визуализации заболевания, нарушения и/или состояния (например, заболевание, нарушение и/или состояние, связанное с дефицитом кратковременной памяти). Точное требуемое количество будет варьировать от индивидуума к индивидууму, в зависимости от вида, возраста и общего состояния индивидуума, тяжести заболевания, конкретной композиции, ее пути введения, ее режима и т.п. Композиции в соответствии с настоящим изобретением, как правило, составляют в единичной дозированной форме для простоты введения и единообразия дозировки. Однако будет понятно, что общее суточное применение композиций по настоящему изобретению будет определяться лечащим врачом в соответствии с его профессиональным мнением. Конкретный терапевтически эффективный, профилактически эффективный или соответствующим образом визуализирующий уровень дозы для любого конкретного пациента будет зависеть от различных факторов, включающих подвергаемое лечению нарушение и тяжесть нарушения; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, путь введения и скорость экскреции конкретного используемого соединения; длительность лечения; лекарственные средства, используемые в комбинации или по совпадению с конкретным используемым соединением; и сходные факторы, хорошо известные в области медицины.
Белки, подлежащие доставке и/или их фармацевтические, профилактические, диагностические или визуализирующие композиции можно вводить животным, таким как млекопитающие (например, люди, домашние животные, кошки, собаки, мыши, крысы и т.д.). В некоторых вариантах осуществления их фармацевтические, профилактические, диагностические или визуализирующие композиции вводят человеку.
Белки, подлежащие доставке, и/или их фармацевтические, профилактические, диагностические или визуализирующие композиции по настоящему изобретению можно вводить любым путем. В некоторых вариантах осуществления белки и/или их фармацевтические, профилактические, диагностические или визуализирующие композиции вводят одним или несколькими из множества путей, включающих пероральный, внутривенный, внутримышечный, внутриартериальный, внутрикостномозговой, интратекальный, подкожный, внутрижелудочковый, чрескожный, внутрикожный, ректальный, интравагинальный, внутрибрюшинный, местный (например, посредством порошков, мазей, кремов, гелей, лосьонов и/или капель), через слизистую оболочку, назальный, буккальный, энтеральный, витреальный, внутриопухолевый, сублингвальный; путем внутритрахеального вливания, бронхиального вливания и/или ингаляции; такой как пероральный спрей, назальный спрей и/или аэрозоль, и/или через катетер в портальной вене. В некоторых вариантах осуществления белки или комплексы и/или их фармацевтические, профилактические, диагностические или визуализирующие композиции вводят путем системной внутривенной инъекции. В конкретных вариантах осуществления белки или комплексы и/или их фармацевтические, профилактические, диагностические или визуализирующие композиции можно вводить внутривенно и/или перорально. В конкретных вариантах осуществления белки или комплексы и/или их фармацевтические, профилактические, диагностические или визуализирующие композиции можно вводить так, чтобы позволить белку или комплексу пройти через гематоэнцефалический барьер, сосудистый барьер или другой эпителиальный барьер.
Однако настоящее изобретение охватывает доставку белков или комплексов и/или их фармацевтических, профилактических, диагностических или визуализирующих композиций любым подходящим путем, учитывая возможные достижения науки в области доставки лекарственных средств.
Как правило, наиболее подходящий путь введения будет зависеть от различных факторов, включающих природу белка или комплекса, содержащего белки, связанные по меньшей мере с одним средством, подлежащим доставке (например, его стабильность в условиях желудочно-кишечного тракта, в кровотоке и т.д.), состояние пациента (например, то, способен ли пациент переносить конкретные пути введения) и т.д. Настоящее изобретение охватывает доставку фармацевтических, профилактических, диагностических или визуализирующих композиций любым подходящим путем, учитывая возможные достижения науки в области доставки лекарственных средств.
В определенных вариантах осуществления композиции по настоящему изобретению можно вводить на уровнях доз, достаточных для доставки от приблизительно 0,0001 мг/кг до приблизительно 100 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 50 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 40 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 30 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг или от приблизительно 1 мг/кг до приблизительно 25 мг/кг массы тела индивидуума в сутки, один или несколько раз в сутки, для достижения желаемого терапевтического, диагностического, профилактического или визуализирующего эффекта. Желаемую дозировку можно доставлять три раза в сутки, два раза в сутки, один раз в сутки, раз в двое суток, раз в трое суток, раз в неделю, каждые две недели, каждые три недели и каждые четыре недели. В определенных вариантах осуществления желаемую дозировку можно доставлять с использованием множества введений (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати или более введений).
Белки или комплексы можно использовать в комбинации с одним или несколькими другими терапевтическими, профилактическими, диагностическими или визуализирующими средствами. Под "в комбинации с" подразумевают, что средства необходимо вводить в одно и то же время и/или составлять для доставки вместе, хотя эти способы доставки находятся в пределах объема настоящего изобретения. Композиции можно вводить одновременно, до или после одного или нескольких других желаемых терапевтических средств или медицинских процедур. Как правило, каждое средство можно вводить в дозе и/или по расписанию, установленному для этого средства. В некоторых вариантах осуществления настоящее изобретение охватывает доставку фармацевтических, профилактических, диагностических или визуализирующих композиций в комбинации со средствами, которые повышают их биодоступность, снижают и/или модифицируют их метаболизм, ингибируют их экскрецию и/или модифицируют их распределение в организме.
Кроме того, понятно, что терапевтические, профилактические, диагностические или визуализирующие активные вещества, используемые в комбинации, можно вводить вместе в одной композиции или их можно вводить по отдельности в различных композициях. Как правило, ожидается, что средства, используемые в комбинации, можно использовать на уровнях, которые не превышают уровней, при которых их используют по отдельности. В некоторых вариантах осуществления уровни, используемые в комбинации, будут более низкими, чем уровни, используемые по отдельности.
Для конкретной комбинации способов терапии (терапевтических средств или процедур) для применения в комбинированном режиме, учитывается совместимость желаемых терапевтических средств и/или процедур и желаемый терапевтический эффект, которого намереваются достигнуть. Также будет понятно, что используемые способы терапии могут обеспечивать желаемый эффект для одного и того же нарушения (например, композицию, пригодную для лечения злокачественной опухоли по настоящему изобретению можно вводить одновременно с химиотерапевтическим средством), или они могут обеспечивать различные эффекты (например, контроль каких-либо неблагоприятных явлений).
Наборы
Настоящее изобретение относится к различным наборам для удобного и/или эффективного осуществления способов по настоящему изобретению. Как правило, наборы содержат достаточные количества и/или численность компонентов, чтобы позволить пользователю осуществить многократное введение индивидууму(ам) и/или провести многократные эксперименты.
В одном аспекте изобретение относится к наборам для продуцирования белка, включающим первую выделенную нуклеиновую кислоту, содержащую транслируемую область и модификацию нуклеиновой кислоты, где нуклеиновая кислота способна ускользать от или избегать индукции врожденного иммунного ответа в клетке, в которую введена первая выделенная нуклеиновая кислота, и упаковку и инструкции.
В одном аспекте изобретение относится к наборам для продуцирования белка, включающим: первую выделенную модифицированную нуклеиновую кислоту, содержащую транслируемую область, предоставленную в количестве, эффективном для продуцирования желаемого количества белка, кодируемого транслируемой областью при введении в клетку-мишень; вторую нуклеиновую кислоту, содержащую ингибиторную нуклеиновую кислоту, предоставленную в количестве, эффективном для существенного ингибирования врожденного иммунного ответа в клетке; и упаковку и инструкции.
В одном аспекте изобретение относится к наборам для продуцирования белка, включающим первую выделенную нуклеиновую кислоту, содержащую транслируемую область и нуклеозидную модификацию, где нуклеиновая кислота проявляет сниженную деградацию клеточной нуклеазой, и упаковку и инструкции.
В одном аспекте изобретение относится к наборам для продуцирования белка, включающим первую выделенную нуклеиновую кислоту, содержащую транслируемую область и по меньшей мере две различных нуклеозидных модификации, где нуклеиновая кислота проявляет сниженную деградацию клеточной нуклеазой, и упаковку и инструкции.
В одном аспекте изобретение относится к наборам для продуцирования белков, включающим первую выделенную нуклеиновую кислоту, содержащую транслируемую область и по меньшей мере одну нуклеозидную модификацию, где нуклеиновая кислота проявляет сниженную деградацию клеточной нуклеазой; вторую нуклеиновую кислоту, содержащую ингибиторную нуклеиновую кислоту; и упаковку и инструкции.
В некоторых вариантах осуществления первая выделенная нуклеиновая кислота содержит матричную РНК (мРНК). В некоторых вариантах осуществления мРНК содержит по меньшей мере один нуклеозид, выбранный из группы, состоящей из пиридин-4-онрибонуклеозида, 5-азауридина, 2-тио-5-азауридина, 2-тиоуридина, 4-тиопсевдоуридина, 2-тиопсевдоуридина, 5-гидроксиуридина, 3-метилуридина, 5-карбоксиметилуридина, 1-карбоксиметилпсевдоуридина, 5-пропинилуридина, 1-пропинил-псевдоуридина, 5-тауринометилуридина, 1-тауринометилпсевдоуридина, 5-тауринометил-2-тиоуридина, 1-тауринометил-4-тиоуридина, 5-метилуридина, 1-метилпсевдоуридина, 4-тио-1-метилпсевдоуридина, 2-тио-1-метилпсевдоуридина, 1-метил-1-деаза-псевдоуридина, 2-тио-1-метил-1-деазапсевдоуридина, дигидроуридина, дигидропсевдоуридина, 2-тиодигидроуридин, 2-тиодигидропсевдоуридина, 2-метоксиуридина, 2-метокси-4-тиоуридина, 4-метокси-псевдоуридина, 4-метокси-2-тиопсевдоуридина или любого нуклеозида, описанного в настоящем описании.
В некоторых вариантах осуществления мРНК содержит по меньшей мере один нуклеозид, выбранный из группы, состоящей из 5-азацитидина, псевдоизоцитидина, 3-метилцитидина, N4-ацетилцитидина, 5-формилцитидина, N4-метилцитидина, 5-гидроксиметилцитидина, 1-метилпсевдоизоцитидина, пирролоцитидина, пирролопсевдоизоцитидина, 2-тиоцитидина, 2-тио-5-метилцитидина, 4-тио-псевдоизоцитидина, 4-тио-1-метилпсевдоизоцитидина, 4-тио-1-метил-1-деазапсевдоизоцитидина, 1-метил-1-деаза-псевдоизоцитидина, зебуларина, 5-азазебуларина, 5-метилзебуларина, 5-аза-2-тиозебуларина, 2-тиозебуларина, 2-метоксицитидина, 2-метокси-5-метилцитидина, 4-метоксипсевдоизоцитидина, 4-метокси-1-метилпсевдоизоцитидина или любого нуклеозида, описанного в настоящем описании.
В некоторых вариантах осуществления мРНК содержит по меньшей мере один нуклеозид, выбранный из группы, состоящей из 2-аминопурина, 2,6-диаминопурина, 7-деазааденина, 7-деаза-8-азааденина, 7-деаза-2-аминопурина, 7-деаза-8-аза-2-аминопурина, 7-деаза-2,6-диаминопурина, 7-деаза-8-аза-2,6-диаминопурина, 1-метиладенозина, N6-метиладенозина, N6-изопентениладенозина, N6-(цис-гидроксиизопентенил)аденозина, 2-метилтио-N6-(цис-гидроксиизопентенил)аденозина, N6-глицинилкарбамоиладенозина, N6-треонилкарбамоиладенозина, 2-метилтио-N6-треонилкарбамоиладенозина, N6,N6-диметиладенозина, 7-метиладенина, 2-метилтиоаденина, 2-метоксиаденина или любого нуклеозида, описанного в настоящем описании.
В некоторых вариантах осуществления мРНК содержит по меньшей мере один нуклеозид, выбранный из группы, состоящей из инозина, 1-метилинозина, виозина, вибутозина, 7-деазагуанозина, 7-деаза-8-азагуанозина, 6-тиогуанозина, 6-тио-7-деазагуанозина, 6-тио-7-деаза-8-азагуанозина, 7-метилгуанозина, 6-тио-7-метилгуанозина, 7-метилинозина, 6-метоксигуанозина, 1-метилгуанозина, N2-метилгуанозина, N2,N2-диметилгуанозина, 8-оксогуанозина, 7-метил-8-оксогуанозина, 1-метил-6-тиогуанозина, N2-метил-6-тиогуанозина, N2,N2-диметил-6-тиогуанозина или любого нуклеозида, описанного в настоящем описании.
В другом аспекте изобретение относится к композициям для продуцирования белка, содержащим первую выделенную нуклеиновую кислоту, содержащую транслируемую область и нуклеозидную модификацию, где нуклеиновая кислота проявляет сниженную деградацию клеточной нуклеазой, и клетку млекопитающих, пригодную для трансляции транслируемой области первой нуклеиновой кислоты.
Определения
В различных разделах настоящего описания заместители соединений по настоящему изобретения описаны в качестве групп или диапазонов. В частности, подразумевается, что настоящее изобретение включает каждую индивидуальную подкомбинацию представителей таких групп и диапазонов. Например, в частности подразумевается, что термин "C1-6 алкил" индивидуально обозначает метил, этил, C3 алкил, C4 алкил, C5 алкил и C6алкил.
Приблизительно: Как используют в рамках изобретения, термин "приблизительно" означает +/- 10% от указанной величины.
Введенный в комбинации: Как используют в рамках изобретения, термин "введенный в комбинации" или "комбинированное введение" означает, что два или более средств вводят индивидууму в одно и то же время или в пределах такого интервала, чтобы могло существовать перекрывание эффекта каждого средства у пациента. В некоторых вариантах осуществления их можно вводить в пределах 60, 30, 15, 10, 5 или 1 минуты друг от друга. В некоторых вариантах осуществления интервалы между введениями средств являются настолько малыми, чтобы обеспечивать комбинаторный (например, синергический) эффект.
Животное: Как используют в рамках изобретения, термин "животное" относится к любому представителю царства животных. В некоторых вариантах осуществления "животное" относится к человеку на любой стадии развития. В некоторых вариантах осуществления "животное" относится к не являющимся человеком животным на любой стадии развития. В определенных вариантах осуществления не являющимся человеком животным является млекопитающее (например, грызун, мышь, крыс, кролик, обезьяна, собака, кошка, овца, крупный рогатый скот, примат или свинья). В некоторых вариантах осуществления животные включают, но не ограничиваются ими, млекопитающих, птиц, пресмыкающихся, земноводных, рыб и червей. В некоторых вариантах осуществления животное представляет собой трансгенное животное, полученное способами генной инженерии животное или клон.
Представляющие интерес антигены или желаемые антигены: Как используют в рамках изобретения, термины "представляющие интерес антигены" или "желаемые антигены" включают белки и другие биомолекулы, предусматриваемые в рамках настоящего изобретения, которые иммуноспецифическим образом связываются антителами, и их фрагменты, мутанты, варианты и изменения, описанные в настоящем описании. Примеры представляющих интерес антигенов включают, но не ограничиваются ими, инсулин, инсулиноподобный фактор роста, hGH, tPA, цитокины, такие как интерлейкины (IL), например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, интерферон (IFN) альфа, IFN-бета, IFN-гамма, IFN-омега или IFN-тау, фактор некроза опухоли (TNF), такой как TNF-альфа и TNF-бета, TNF-гамма, TRAIL; G-CSF, GM-CSF, M-CSF, MCP-1 и VEGF.
Приблизительно: Как используют в рамках изобретения, термин "приблизительно" или "примерно", применяемый к одной или нескольким представляющим интерес величинам, относится к величине, которая сходна с указанной эталонной величиной. В определенных вариантах осуществления термин "приблизительно" или "примерно" относится к диапазону величин, который находится в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любом направлении (более или менее) от указанной эталонной величины, если нет иных указаний или иное не очевидно из контекста (за исключением случаев, когда такое количество превышает 100% от возможной величины).
Ассоциированный с: Как используют в рамках изобретения, термины "ассоциированный с", "конъюгированный", "соединенный", "присоединенный" и "связанный" при использовании в отношении двух или более частей означает, что части физически ассоциированы или соединены друг с другом либо прямо, либо через одну или несколько дополнительных частей, которые служат в качестве линкерного агента, с образованием структуры, которая является достаточно стабильной, чтобы части оставались физически ассоциированными в условиях, в которых структуру используют, например, физиологических условиях. "Ассоциация" не должна осуществляться строго через прямое образование ковалентных химических связей. Также это может указывать на образование ионных или водородных связей или связанность на основе гибридизации, достаточно стабильную, чтобы "ассоциированные" элементы оставались физическим ассоциированными.
Биологически совместимый: Как используют в рамках изобретения, термин "биологически совместимый" означает совместимый с живыми клетками, тканями, органами или системами, что обеспечивает небольшой риск или отсутствие риска повреждения, токсичности или отторжения иммунной системой.
Биоразлагаемый: Как используют в рамках изобретения, термин "биоразлагаемый" означает способный распадаться на нетоксичные продукты под действием живых организмов.
Биологически активный: Как используют в рамках изобретения, выражение "биологически активный" относится к характеристике любого вещества, которое обладает активностью в биологической системе и/или организме. Например, вещество, которое при введении в организм обладает биологическим эффектом на этот организм, считают биологически активным. В конкретных вариантах осуществления полинуклеотид по настоящему изобретению можно считать биологически активным, если часть полинуклеотида является биологически активной или имитирует активность, считающуюся биологически значимой.
Химические термины: Ниже предоставлено определение различных химических терминов от "ацила" до "тиола".
Термин "ацил", как используют в рамках изобретения, обозначает водород или алкильную группу (например, галогеналкильную группу), как определено в настоящем описании, которая связана с исходной молекулярной группой через карбонильную группу, как определено в настоящем описании, и иллюстрируется формилом (т.е. карбоксиальдегидная группа), ацетилом, трифторацетилом, пропионилом, бутаноилом и т.п. Иллюстративные незамещенные ацильные группы включают от 1 до 7, от 1 до 11 или от 1 до 21 атомов углерода. В некоторых вариантах осуществления алкильная группа, кроме того, замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании.
Термин "ациламино", как используют в рамках изобретения, обозначает ацильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через аминогруппу, как определено в настоящем описании (т.е. -N(RN1)-C(O)-R, где R представляет собой H или необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу (например, галогеналкил) и RN1 является таким, как определено в настоящем описании). Иллюстративные незамещенные ациламиногруппы включают от 1 до 41 атомов углерода (например, от 1 до 7, от 1 до 13, от 1 до 21, от 2 до 7, от 2 до 13, от 2 до 21 или от 2 до 41 атомов углерода). В некоторых вариантах осуществления алкильная группа дополнительно замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании, и/или аминогруппа представляет собой -NH2 или -NHRN1, где RN1 независимо представляет собой OH, NO2, NH2, NRN22, SO2ORN2, SO2RN2, SORN2, алкил, арил, ацил (например, ацетил, трифторацетил или другие группы ациламино, описанные в настоящем описании) или алкоксикарбонилалкил, и каждый RN2может представлять собой H, алкил или арил.
Термин "ациламиноалкил", как используют в рамках изобретения, обозначает ацильную группу, как определено в настоящем описании, связанную с аминогруппой, которая в свою очередь связана с исходной молекулярной группой через алкильную группу, как определено в настоящем описании (т.е. -алкил-N(RN1)-C(O)-R, где R представляет собой H или необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу (например, галогеналкил) и RN1 является таким, как определено в настоящем описании). Иллюстративные незамещенные ациламиногруппы включают от 1 до 41 атомов углерода (например, от 1 до 7, от 1 до 13, от 1 до 21, от 2 до 7, от 2 до 13, от 2 до 21 или от 2 до 41 атомов углерода). В некоторых вариантах осуществления алкильная группа дополнительно замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании, и/или аминогруппа представляет собой -NH2 или -NHRN1, где RN1 независимо представляет собой OH, NO2, NH2, NRN22, SO2ORN2, SO2RN2, SORN2, алкил, арил, ацил (например, ацетил, трифторацетил или другие ацильные группы, описанные в настоящем описании) или алкоксикарбонилалкил, и каждый RN2 может представлять собой H, алкил или арил.
Термин "ацилокси", как используют в рамках изобретения, обозначает ацильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через атом кислорода (т.е. -O-C(O)-R, где R представляет собой H или необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу). Иллюстративные незамещенные ацилоксигруппы включают от 1 до 21 атомов углерода (например, от 1 до 7 или от 1 до 11 атомов углерода). В некоторых вариантах осуществления алкильная группа дополнительно замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании.
Термин "ацилоксиалкил", как используют в рамках изобретения, обозначает ацильную группу, как определено в настоящем описании, связанную с атомом кислорода, который в свою очередь связан с исходной молекулярной группой через алкильную группу (т.е. -алкил-O-C(O)-R, где R представляет собой H или необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу). Иллюстративные незамещенные ацилоксиалкильные группы включают от 1 до 21 атомов углерода (например, от 1 до 7 или от 1 до 11 атомов углерода). В некоторых вариантах осуществления алкильная группа независимо дополнительно замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании.
Термин "алкарильный", как используют в рамках изобретения, обозначает арильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через группу алкилена, как определено в настоящем описании. Иллюстративные незамещенные алкарильные группы имеют от 7 до 30 атомов углерода (например, от 7 до 16 или от 7 до 20 атомов углерода, такие как C1-6 алк-C6-10 арил, C1-10 алк-C6-10 арил или C1-20 алк-C6-10 арил). В некоторых вариантах осуществления каждый из алкилена и арила может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании для соответствующих групп. Другие группы, которым предшествует приставка "алк-", определяют аналогичным образом, где "алк" относится к C1-6 алкилену, если нет иных указаний, и присоединенная химическая структура является такой, как определено в настоящем описании.
Термин "алкциклоалкил" обозначает циклоалкильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через алкиленовую группу, как определено в настоящем описании (например, алкиленовая группа из от 1 до 4, от 1 до 6, от 1 до 10 или от 1 до 20 атомов углерода). В некоторых вариантах осуществления каждый из алкилена и циклоалкила может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании для соответствующей группы.
Термин "алкенил", как используют в рамках изобретения, обозначает одновалентные прямые или разветвленные группы, если нет иных указаний, из от 2 до 20 атомов углерода (например, от 2 до 6 или от 2 до 10 атомов углерода), содержащие одну или несколько углерод-углеродных двойных связей и иллюстрируемые этенилом, 1-пропенилом, 2-пропенилом, 2-метил-1-пропенилом, 1-бутенилом, 2-бутенилом и т.п. Алкенилы включают как цис-, так и транс-изомеры. Алкенильные группы необязательно могут быть замещены 1, 2, 3 или 4 группами заместителей, которые независимо выбраны из амино, арила, циклоалкила или гетероциклила (например, гетероарил), как определено в настоящем описании, или любой из иллюстративных алкильных групп заместителей, описанных в настоящем описании.
Термин "алкенилокси" обозначает химический заместитель формулы -OR, где R представляет собой C2-20 алкенильную группу (например, C2-6 или C2-10 алкенил), если нет иных указаний. Иллюстративные алкенилоксигруппы включают этенилокси, пропенилокси и т.п. В некоторых вариантах осуществления алкенильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании (например, гидроксигруппа).
Термин "алкгетероарил" относится к гетероарильной группе, как определено в настоящем описании, связанной с исходной молекулярной группой через алкиленовую группу, как определено в настоящем описании. Иллюстративные незамещенные алкгетероарильные группы имеют от 2 до 32 атомов углерода (например, от 2 до 22, от 2 до 18, от 2 до 17, от 2 до 16, от 3 до 15, от 2 до 14, от 2 до 13 или от 2 до 12 атомов углерода, такие как C1-6 алк-C1-12 гетероарил, C1-10 алк-C1-12 гетероарил или C1-20 алк-C1-12 гетероарил). В некоторых вариантах осуществления каждый из алкилена и гетероарила может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании для соответствующей группы. Алкгетероарильные группы представляют собой подгруппу алкгетероциклильных групп.
Термин "алкгетероциклил" обозначает гетероциклильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через алкиленовую группу, как определено в настоящем описании. Иллюстративные незамещенные алкгетероциклильные группы имеют от 2 до 32 атомов углерода (например, от 2 до 22, от 2 до 18, от 2 до 17, от 2 до 16, от 3 до 15, от 2 до 14, от 2 до 13 или от 2 до 12 атомов углерода, такие как C1-6 алк-C1-12 гетероциклил, C1-10 алк-C1-12 гетероциклил или C1-20 алк-C1-12 гетероциклил). В некоторых вариантах осуществления каждый из алкилена и гетероциклила может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании для соответствующей группы.
Термин "алкокси" обозначает химический заместитель формулы -OR, где R представляет собой C1-20 алкильную группу (например, C1-6 или C1-10 алкил), если нет иных указаний. Иллюстративные алкоксигруппы включают метокси, этокси, пропокси (например, н-пропокси и изопропокси), трет-бутокси и т.п. В некоторых вариантах осуществления алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании (например, гидрокси или алкокси).
Термин "алкоксиалкокси" обозначает алкоксигруппу, которая замещена алкоксигруппой. Иллюстративные незамещенные алкоксиалкоксигруппы включают от 2 до 40 атомов углерода (например, от 2 до 12 или от 2 до 20 атомов углерода, такие как C1-6 алкокси-C1-6 алкокси, C1-10 алкокси-C1-10 алкокси или C1-20 алкокси-C1-20 алкокси). В некоторых вариантах осуществления каждая алкоксигруппа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании.
Термин "алкоксиалкил" обозначает алкильную группу, которая замещена алкоксигруппой. Иллюстративные незамещенные алкоксиалкильные группы включают от 2 до 40 атомов углерода (например, от 2 до 12 или от 2 до 20 атомов углерода, такие как C1-6 алкокси-C1-6 алкил, C1-10 алкокси-C1-10 алкил или C1-20 алкокси-C1-20 алкил). В некоторых вариантах осуществления каждый из алкила и алкокси может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании для соответствующей группы.
Термин "алкоксикарбонил", как используют в рамках изобретения, обозначает алкокси, как определено в настоящем описании, связанный с исходной молекулярной группой через атом карбонила (например, -C(O)-OR, где R представляет собой H или необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу). Иллюстративный незамещенный алкоксикарбонил включает от 1 до 21 атомов углерода (например, от 1 до 11 или от 1 до 7 атомов углерода). В некоторых вариантах осуществления алкоксигруппа дополнительно замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании.
Термин "алкоксикарбонилацил", как используют в рамках изобретения, обозначает ацильную группу, как определено в настоящем описании, которая замещена алкоксикарбонильной группой, как определено в настоящем описании (например, -C(O)-алкил-C(O)-OR, где R представляет собой необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу). Иллюстративный незамещенный алкоксикарбонилацил включает от 3 до 41 атомов углерода (например, от 3 до 10, от 3 до 13, от 3 до 17, от 3 до 21 или от 3 до 31 атомов углерода, такие как C1-6 алкоксикарбонил-C1-6 ацил, C1-10 алкоксикарбонил-C1-10 ацил или C1-20 алкоксикарбонил-C1-20 ацил). В некоторых вариантах осуществления каждая алкокси и алкильная группа дополнительно независимо замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании (например, гидроксигруппой) для каждой группы.
Термин "алкоксикарбонилалкокси", как используют в рамках изобретения, обозначает алкоксигруппу, как определено в настоящем описании, которая замещена алкоксикарбонильной группой, как определено в настоящем описании (например, -O-алкил-C(O)-OR, где R представляет собой необязательно замещенную C1-6, C1-10 или C1-20 алкильную группу). Иллюстративный незамещенный алкоксикарбонилалкокси включает от 3 до 41 атомов углерода (например, от 3 до 10, от 3 до 13, от 3 до 17, от 3 до 21 или от 3 до 31 атомов углерода, такие как C1-6 алкоксикарбонил-C1-6 алкокси, C1-10 алкоксикарбонил-C1-10 алкокси или C1-20 алкоксикарбонил-C1-20 алкокси). В некоторых вариантах осуществления каждая алкоксигруппа дополнительно независимо замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании (например, гидроксигруппой).
Термин "алкоксикарбонилалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, которая замещена алкоксикарбонильной группой, как определено в настоящем описании (например, -алкил-C(O)-OR, где R представляет собой необязательно замещенную C1-20, C1-10 или C1-6 алкильную группу). Иллюстративный незамещенный алкоксикарбонилалкил включает от 3 до 41 атомов углерода (например, от 3 до 10, от 3 до 13, от 3 до 17, от 3 до 21 или от 3 до 31 атомов углерода, таких как C1-6 алкоксикарбонил-C1-6 алкил, C1-10 алкоксикарбонил-C1-10 алкил или C1-20 алкоксикарбонил-C1-20 алкил). В некоторых вариантах осуществления каждая алкильная и алкоксигруппа дополнительно независимо замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании (например, гидроксигруппой).
Термин "алкоксикарбонилалкенил", как используют в рамках изобретения, обозначает алкенильную группу, как определено в настоящем описании, которая замещена алкоксикарбонильной группой, как определено в настоящем описании (например, -алкенил-C(O)-OR, где R представляет собой необязательно замещенную C1-20, C1-10 или C1-6 алкильную группу). Иллюстративный незамещенный алкоксикарбонилалкенил включает от 4 до 41 атомов углерода (например, от 4 до 10, от 4 до 13, от 4 до 17, от 4 до 21 или от 4 до 31 атомов углерода, такие как C1-6 алкоксикарбонил-C2-6 алкенил, C1-10 алкоксикарбонил-C2-10 алкенил или C1-20 алкоксикарбонил-C2-20 алкенил). В некоторых вариантах осуществления каждая алкильная, алкенильная и алкоксигруппа дополнительно независимо замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании (например, гидроксигруппой).
Термин "алкоксикарбонилалкинил", как используют в рамках изобретения, обозначает алкинильную группу, как определено в настоящем описании, которая замещена алкоксикарбонильной группой, как определено в настоящем описании (например, -алкинил-C(O)-OR, где R представляет собой необязательно замещенную C1-20, C1-10 или C1-6 алкильную группу). Иллюстративный незамещенный алкоксикарбонилалкинил включает от 4 до 41 атомов углерода (например, от 4 до 10, от 4 до 13, от 4 до 17, от 4 до 21 или от 4 до 31 атомов углерода, такой как C1-6 алкоксикарбонил-C2-6 алкинил, C1-10 алкоксикарбонил-C2-10 алкинил или C1-20 алкоксикарбонил-C2-20 алкинил). В некоторых вариантах осуществления каждая алкильная, алкинильная и алкоксигруппа дополнительно независимо замещена 1, 2, 3 или 4 заместителями, как описано в настоящем описании (например, гидроксигруппой).
Термин "алкил", как используют в рамках изобретения, включает как неразветвленные, так и разветвленные насыщенные группы из от 1 до 20 атомов углерода (например, от 1 до 10 или от 1 до 6), если нет иных указаний. Примерами алкильных групп являются метил, этил, н- и изопропил, н-, втор-, изо- и трет-бутил, неопентил и т.п., и необязательно могут быть замещены одной, двумя, тремя или, в случае алкильных групп из двух атомов углерода или более, четырьмя заместителями, независимо выбранными из группы, состоящей из: (1) C1-6 алкокси; (2) C1-6 алкилсульфинила; (3) амино, как определено в настоящем описании (например, незамещенный амино (т.е. -NH2) или замещенный амино (т.е. -N(RN1)2, где RN1 является таким, как определено для амино); (4) C6-10 арил-C1-6 алкокси; (5) азидо; (6) галогена; (7) (C2-9гетероциклил)окси; (8) гидрокси, необязательно замещенный O-защитной группой; (9) нитро; (10) оксо (например, карбоксиальдегид или ацил); (11) C1-7 спироциклила; (12) тиоалкокси; (13) тиола; (14) -CO2RA’, необязательно замещенного O-защитной группой и где RA’ выбран из группы, состоящей из (a) C1-20 алкила (например C1-6 алкил), (b) C2-20 алкенила (например, C2-6 алкенил), (c) C6-10 арила, (d) водорода, (e) C1-6 алк-C6-10 арила, (f) амино-C1-20 алкила, (g) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; (15) -C(O)NRB’RC’, где каждый из RB’ и RC’ независимо выбран из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила, и (d) C1-6 алк-C6-10 арила; (16) -SO2RD’, где RD’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) C1-6 алк-C6-10 арила, и (d) гидрокси; (17) -SO2NRE’RF’, где каждый из RE’ и RF’ независимо выбран из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (18) -C(O)RG’, где RG’ выбран из группы, состоящей из (a) C1-20 алкила (например, C1-6 алкил), (b) C2-20 алкенила (например, C2-6 алкенил), (c) C6-10 арила, (d) водорода, (e) C1-6 алк-C6-10 арила, (f) амино-C1-20 алкила, (g) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; (19) -NRH’C(O)RI’, где RH’ выбран из группы, состоящей из (a1) водорода и (b1) C1-6 алкила, и RI’ выбран из группы, состоящей из (a2) C1-20 алкила (например, C1-6 алкил), (b2) C2-20 алкенила (например, C2-6 алкенил), (c2) C6-10 арила, (d2) водорода, (e2) C1-6 алк-C6-10 арила, (f2) амино-C1-20 алкила, (g2) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h2) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; (20) -NRJ’C(O)ORK’, где RJ’ выбран из группы, состоящей из (a1) водорода и (b1) C1-6 алкила, и RK’ выбран из группы, состоящей из (a2) C1-20 алкила (например, C1-6 алкил), (b2) C2-20 алкенила (например, C2-6 алкенил), (c2) C6-10 арила, (d2) водорода, (e2) C1-6 алк-C6-10 арила, (f2) амино-C1-20 алкила, (g2) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h2) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; и (21) амидина. В некоторых вариантах осуществления каждая из этих групп может быть дополнительно замещенной, как описано в настоящем описании. Например, алкиленовая группа C1-алкарил может быть дополнительно замещена оксогруппой для получения соответствующего арилоильного заместителя.
Термин "алкилен" и приставка "алк-", как используют в рамках изобретения, обозначает насыщенную двухвалентную углеводородную группу, образованную из прямого или разветвленного насыщенного углеводорода путем удаления двух атомов водорода, и ее примером являются метилен, этилен, изопропилен и т.п. Термин "Cx-y алкилен" и приставка "Cx-y алк-" обозначает алкиленовые группы, имеющие от x до y атомов углерода. Иллюстративными значениями для x являются 1, 2, 3, 4, 5 и 6, и иллюстративными значениями для y являются 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18 или 20 (например, C1-6, C1-10, C2-20, C2-6, C2-10 или C2-20 алкилен). В некоторых вариантах осуществления алкилен может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании для алкильной группы.
Термин "алкилсульфинил", как используют в рамках изобретения, обозначает алкильную группу, связанную с исходной молекулярной группой через группу -S(O)-. Иллюстративные незамещенные алкилсульфинильные группы имеют от 1 до 6, от 1 до 10 или от 1 до 20 атомов углерода. В некоторых вариантах осуществления алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании.
Термин "алкилсульфинилалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную алкилсульфинильной группой. Иллюстративные незамещенные алкилсульфинилалкильные группы имеют от 2 до 12, от 2 до 20 или от 2 до 40 атомов углерода. В некоторых вариантах осуществления каждая алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании.
Термин "алкинил", как используют в рамках изобретения, обозначает одновалентные прямые или разветвленные группы из от 2 до 20 атомов углерода (например, от 2 до 4, от 2 до 6 или от 2 до 10 атомов углерода), содержащие тройную углерод-углеродную связь, и их примером являются этинил, 1-пропинил и т.п. Алкинильные группы могут быть необязательно замещены 1, 2, 3 или 4 группами заместителей, которые независимо выбраны из арила, циклоалкила или гетероциклила (например, гетероарила), как определено в настоящем описании, или любой из иллюстративных алкильных групп заместителя, описанных в настоящем описании.
Термин "алкинилокси" обозначает химический заместитель формулы -OR, где R представляет собой C2-20 алкинильную группу (например, C2-6 или C2-10 алкинил), если нет иных указаний. Иллюстративные алкинилоксигруппы включают этинилокси, пропинилокси и т.п. В некоторых вариантах осуществления алкинильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании (например, гидроксигруппой).
Термин "амидин", как используют в рамках изобретения, обозначает группу -C(=NH)NH2.
Термин "амино", как используют в рамках изобретения, обозначает -N(RN1)2, где каждый RN1 независимо представляет собой H, OH, NO2, N(RN2)2, SO2ORN2, SO2RN2, SORN2, N-защитную группу, алкил, алкенил, алкинил, алкокси, арил, алкарил, циклоалкил, алкциклоалкил, карбоксиалкил (например, необязательно замещенный O-защитной группой, такой как необязательно замещенные арилалкоксикарбонильные группы или любые O-защитные группы, описанные в настоящем описании), сульфоалкил, ацил (например, ацетил, трифторацетил или другие ацилы, описанные в настоящем описании), алкоксикарбонилалкил (например, необязательно замещенный O-защитной группой, такой как необязательно замещенный арилалкоксикарбонильными группами или любыми O-защитными группами, описанными в настоящем описании), гетероциклил (например, гетероарил) или алкгетероциклил (например, алкгетероарил), где каждая из этих указанных групп RN1 может быть необязательно замещенной, как определено в настоящем описании для каждой группы; или два RN1, взятые вместе, образуют гетероциклил или N-защитную группу, и где каждый RN2независимо представляет собой H, алкил или арил. Аминогруппы могут представлять собой незамещенный амино (т.е. -NH2) или замещенный амино (т.е. -N(RN1)2). В предпочтительном варианте осуществления амино представляет собой -NH2 или -NHRN1, где RN1 независимо представляет собой OH, NO2, NH2, N(RN2)2, SO2ORN2, SO2RN2, SORN2, алкил, карбоксиалкил, сульфоалкил, ацил (например, ацетил, трифторацетил или другие ацилы, описанные в настоящем описании), алкоксикарбонилалкил (например, трет-бутоксикарбонилалкил) или арил, и каждый RN2может представлять собой H, C1-20 алкил (например, C1-6 алкил) или C6-10 арил.
Термин "аминокислота", как описано в настоящем описании, относится к молекуле, имеющей боковую цепь, аминогруппу и кислотную группу (например, карбоксигруппу -CO2H или сульфогруппу -SO3H), где аминокислота связана с исходной молекулярной группой через боковую цепь, аминогруппу или кислотную группу (например, боковую цепь). В некоторых вариантах осуществления аминокислота связана с исходной молекулярной группой через карбонильную группу, где боковая цепь или аминогруппа связана с карбонильной группой. Иллюстративные боковые цепи включают необязательно замещенный алкил, арил, гетероциклил, алкарильный, алкгетероциклил, аминоалкил, карбамоилалкил и карбоксиалкил. Иллюстративные аминокислоты включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, гидроксинорвалин, изолейцин, лейцин, лизин, метионин, норвалин, орнитин, фенилаланин, пролин, пирролизин, селеноцистеин, серин, таурин, треонин, триптофан, тирозин и валин. Аминокислотные группы могут быть необязательно замещены одной, двумя, тремя или, в случае аминокислотных групп двумя атомами углерода или более, четырьмя заместителями, независимо выбранными из группы, состоящей из: (1) C1-6 алкокси; (2) C1-6 алкилсульфинила; (3) амино, как определено в настоящем описании (например, незамещенный амино (т.е. -NH2) или замещенный амино (т.е. -N(RN1)2, где RN1 является таким, как определено для амино); (4) C6-10 арил-C1-6 алкокси; (5) азидо; (6) галогена; (7) (C2-9гетероциклил)окси; (8) гидрокси; (9) нитро; (10) оксо (например, карбоксиальдегид или ацил); (11) C1-7 спироциклила; (12) тиоалкокси; (13) тиола; (14) -CO2RA’, где RA’ выбран из группы, состоящей из (a) C1-20 алкила (например, C1-6 алкил), (b) C2-20 алкенила (например, C2-6 алкенил), (c) C6-10 арила, (d) водорода, (e) C1-6 алк-C6-10 арила, (f) амино-C1-20 алкила, (g) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; (15) -C(O)NRB’RC’, где каждый из RB’ и RC’ независимо выбран из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (16) -SO2RD’, где RD’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) C1-6 алк-C6-10 арила и (d) гидрокси; (17) -SO2NRE’RF’, где каждый из RE’ и RF’ независимо выбран из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (18) -C(O)RG’, где RG’ выбран из группы, состоящей из (a) C1-20 алкила (например, C1-6 алкил), (b) C2-20 алкенила (например, C2-6 алкенил), (c) C6-10 арила, (d) водорода, (e) C1-6 алк-C6-10 арила, (f) амино-C1-20 алкила, (g) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; (19) -NRH’C(O)RI’, где RH’ выбран из группы, состоящей из (a1) водорода и (b1) C1-6 алкила, и RI’ выбран из группы, состоящей из (a2) C1-20 алкила (например, C1-6 алкил), (b2) C2-20 алкенила (например, C2-6 алкенил), (c2) C6-10 арила, (d2) водорода, (e2) C1-6 алк-C6-10 арила, (f2) амино-C1-20 алкила, (g2) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h2) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; (20) -NRJ’C(O)ORK’, где RJ’ выбран из группы, состоящей из (a1) водорода и (b1) C1-6 алкила, и RK’ выбран из группы, состоящей из (a2) C1-20 алкила (например, C1-6 алкил), (b2) C2-20 алкенила (например, C2-6 алкенила), (c2) C6-10 арила, (d2) водорода, (e2) C1-6 алк-C6-10 арила, (f2) амино-C1-20 алкила, (g2) полиэтиленгликоля -(CH2)s2(OCH2CH2)s1(CH2)s3OR’, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и R’ представляет собой H или C1-20 алкил, и (h2) амино-полиэтиленгликоля -NRN1(CH2)s2(CH2CH2O)s1(CH2)s3NRN1, где s1 представляет собой целое число от 1 до 10 (например, от 1 до 6 или от 1 до 4), каждый из s2 и s3 независимо представляет собой целое число от 0 до 10 (например, от 0 до 4, от 0 до 6, от 1 до 4, от 1 до 6 или от 1 до 10), и каждый RN1 независимо представляет собой водород или необязательно замещенный C1-6 алкил; и (21) амидина. В некоторых вариантах осуществления каждая из этих групп может быть дополнительно замещена, как описано в настоящем описании.
Термин "аминоалкокси", как используют в рамках изобретения, обозначает алкоксигруппу, как определено в настоящем описании, замещенную аминогруппой, как определено в настоящем описании. Каждый из алкила и амино может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для соответствующей группы (например, CO2RA’, где RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода и (d) C1-6 алк-C6-10 арила, например, карбокси).
Термин "аминоалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную аминогруппой, как определено в настоящем описании. Каждый из алкила и амино может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для соответствующей группы (например, CO2RA’, где RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода и (d) C1-6 алк-C6-10 арила, например, карбокси, и/или N-защитной группы).
Термин "аминоалкенил", как используют в рамках изобретения, обозначает алкенильную группу, как определено в настоящем описании, замещенную аминогруппой, как определено в настоящем описании. Каждый из алкенила и амино может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для соответствующей группы (например, CO2RA’, где RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода, и (d) C1-6 алк-C6-10 арила, например, карбокси и/или N-защитной группы).
Термин "аминоалкинил", как используют в рамках изобретения, обозначает алкинильную группу, как определено в настоящем описании, замещенную аминогруппой, как определено в настоящем описании. Каждый из алкинила и амино может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для соответствующей группы (например, CO2RA’, где RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода и (d) C1-6 алк-C6-10 арила, например, карбокси и/или N-защитной группы).
Термин "арил", как используют в рамках изобретения, обозначает моноциклическую, бициклическую или полициклическую карбоциклическую кольцевую систему, имеющую одно или два ароматических кольца, и его примером является фенил, нафтил, 1,2-дигидронафтил, 1,2,3,4-тетрагидронафтил, антраценил, фенантренил, флуоренил, инданил, инденил и т.п., и он может быть необязательно замещен 1, 2, 3, 4 или 5 заместителями, независимо выбранными из группы, состоящей из: (1) C1-7 ацила (например, карбоксиальдегид); (2) C1-20 алкила (например, C1-6 алкил, C1-6 алкокси-C1-6 алкил, C1-6 алкилсульфинил-C1-6 алкил, амино-C1-6 алкил, азидо-C1-6 алкил, (карбоксиальдегид)-C1-6 алкил, галоген-C1-6 алкил (например, перфторалкил), гидрокси-C1-6 алкил, нитро-C1-6 алкил или C1-6 тиоалкокси-C1-6 алкил); (3) C1-20 алкокси (например, C1-6 алкокси, такой как перфторалкокси); (4) C1-6 алкилсульфинила; (5) C6-10 арила; (6) амино; (7) C1-6 алк-C6-10 арила; (8) азидо; (9) C3-8 циклоалкила; (10) C1-6 алк-C3-8 циклоалкила; (11) галогена; (12) C1-12 гетероциклила (например, C1-12 гетероарил); (13) (C1-12 гетероциклил)окси; (14) гидрокси; (15) нитро; (16) C1-20 тиоалкокси (например, C1-6 тиоалкокси); (17) -(CH2)qCO2RA’, где q представляет собой целое число от нуля до четырех, и RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода и (d) C1-6 алк-C6-10 арила; (18) -(CH2)qCONRB’RC’, где q представляет собой целое число от нуля до четырех, и где RB’ и RC’ независимо выбраны из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (19) -(CH2)qSO2RD’, где q представляет собой целое число от нуля до четырех, и где RD’ выбран из группы, состоящей из (a) алкила, (b) C6-10 арила, и (c) алк-C6-10 арила; (20) -(CH2)qSO2NRE’RF’, где q представляет собой целое число от нуля до четырех, и где каждый из RE’ и RF’ независимо выбран из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (21) тиола; (22) C6-10 арилокси; (23) C3-8 циклоалкокси; (24) C6-10 арил-C1-6 алкокси; (25) C1-6 алк-C1-12 гетероциклила (например, C1-6 алк-C1-12 гетероарил); (26) C2-20 алкенила; и (27) C2-20 алкинила. В некоторых вариантах осуществления каждая из этих групп может быть дополнительно замещена, как описано в настоящем описании. Например, алкиленовая группа C1-алкарила или C1-алкгетероциклила может быть дополнительно замещена оксогруппой с получением соответствующей арилоильной и (гетероциклил)оильной группы заместителя.
Термин "арилалкокси", как используют в рамках изобретения, обозначает алкарильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через атом кислорода. Иллюстративные незамещенные арилалкоксигруппы включают от 7 до 30 атомов углерода (например, от 7 до 16 или от 7 до 20 атомов углерода, такие как C6-10 арил-C1-6 алкокси, C6-10 арил-C1-10 алкокси или C6-10 арил-C1-20 алкокси). В некоторых вариантах осуществления арилалкоксигруппа может быть замещена 1, 2, 3 или 4 заместителями, как определено в настоящем описании.
Термин "арилалкоксикарбонил", как используют в рамках изобретения, обозначает арилалкоксигруппу, как определено в настоящем описании, связанную с исходной молекулярной группой через карбонил (например, -C(O)-O-алкиларил). Иллюстративные незамещенные арилалкоксигруппы включают от 8 до 31 атомов углерода (например, от 8 до 17 или от 8 до 21 атомов углерода, такие как C6-10 арил-C1-6 алкоксикарбонил, C6-10 арил-C1-10 алкоксикарбонил или C6-10 арил-C1-20 алкоксикарбонил). В некоторых вариантах осуществления арилалкоксикарбонильная группа может быть замещена 1, 2, 3 или 4 заместителями, как определено в настоящем описании.
Термин "арилокси" обозначает химический заместитель формулы -OR′, где R′ представляет собой арильную группу из от 6 до 18 атомов углерода, если нет иных указаний. В некоторых вариантах осуществления арильная группа может быть замещена 1, 2, 3 или 4 заместителями, как определено в настоящем описании.
Термин "арилоил", как используют в рамках изобретения, обозначает арильную группу, как определено в настоящем описании, которая связана с исходной молекулярной группой через карбонильную группу. Иллюстративные незамещенные арилоильные группы имеют от 7 до 11 атомов углерода. В некоторых вариантах осуществления арильная группа может быть замещена 1, 2, 3 или 4 заместителями, как определено в настоящем описании.
Термин "азидо" обозначает группу -N3, которая также может быть изображена как -N=N=N.
Термин "бициклический", как используют в рамках изобретения, относится к структуре, имеющей два кольца, которые могут быть ароматическими или неароматическими. Бициклические структуры включают спироциклильные группы, как определено в настоящем описании, и два кольца, которые имеют один или несколько мостиков, где такие мостики могут включать один атом или цепь, включающую два, три или более атомов. Иллюстративные бициклические группы включают бициклическую карбоциклильную группу, где первое и второе кольца представляют собой карбоциклильные группы, как определено в настоящем описании; бициклические арильные группы, где первое и второе кольца представляют собой арильные группы, как определено в настоящем описании; бициклические гетероциклильные группы, где первое кольцо представляет собой гетероциклильную группу и второе кольцо представляет собой карбоциклильную группу (например, арил) или гетероциклильную группу (например, гетероарил); и бициклические гетероарильные группы, где первое кольцо представляет собой представляет собой гетероарильную группу и второе кольцо представляет собой карбоциклильную группу (например, арил) или гетероциклильную группу (например, гетероарил). В некоторых вариантах осуществления бициклическая группа может быть замещена 1, 2, 3 или 4 заместителями, как определено в настоящем описании для циклоалкильных, гетероциклильных и арильных групп.
Термин "боранил", как используют в рамках изобретения, обозначает -B(RB1)3, где каждый RB1 независимо выбран из группы, состоящей из H и необязательно замещенного алкила. В некоторых вариантах осуществления боранильная группа может быть замещена 1, 2, 3 или 4 заместителями, как определено в настоящем описании для алкила.
Термины "карбоциклический" и "карбоциклильный", как используют в рамках изобретения, относятся к необязательно замещенной C3-12 моноциклической, бициклической или трициклической структуре, в которой кольца, которые могут быть ароматическими или неароматическими, образованы атомами углерода. Карбоциклические структуры включают циклоалкильные, циклоалкенильные и арильные группы.
Термин "карбамоил", как используют в рамках изобретения, обозначает -C(O)-N(RN1)2, где значение каждого RN1 указано в определении "амино", представленном в настоящем описании.
Термин "карбамоилалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную карбамоильной группой, как определено в настоящем описании. Алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании.
Термин "карбамил", как используют в рамках изобретения, относится к карбаматной группе, имеющей структуру -NRN1C(=O)OR или -OC(=O)N(RN1)2, где значение каждого RN1 указано в определении "амино", представленном в настоящем описании, и R представляет собой алкил, циклоалкил, алкциклоалкил, арил, алкарил, гетероциклил (например, гетероарил) или алкгетероциклил (например, алкгетероарил), как определено в настоящем описании.
Термин "карбонил", как используют в рамках изобретения, обозначает группу C(O), которая также может быть обозначена как C=O.
Термин "карбоксиальдегид" обозначает ацильную группу, имеющую структуру -CHO.
Термин "карбокси", как используют в рамках изобретения, означает -CO2H.
Термин "карбоксиалкокси", как используют в рамках изобретения, обозначает алкоксигруппу, как определено в настоящем описании, замещенную карбоксигруппой, как определено в настоящем описании. Алкоксигруппа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для алкильной группы, и карбоксигруппа может быть необязательно замещена одним или несколькими O-защитными группами.
Термин "карбоксиалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную карбоксигруппой, как определено в настоящем описании. Алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании, и карбоксигруппа может быть необязательно замещена одной или несколькими O-защитными группами.
Термин "карбоксиаминоалкил", как используют в рамках изобретения, обозначает аминоалкильную группу, как определено в настоящем описании, замещенную карбокси, как определено в настоящем описании. Каждый из карбокси, алкила и амино может быть дополнительно замещен 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для соответствующей группы (например, CO2RA’, где RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода, и (d) C1-6 алк-C6-10 арила, например, карбокси и/или N-защитной группы и/или O-защитной группы).
Термин "циано", как используют в рамках изобретения, обозначает группу -CN.
Термин "циклоалкокси" обозначает химический заместитель формулы -OR, где R представляет собой C3-8 циклоалкильную группу, как определено в настоящем описании, если нет иных указаний. Циклоалкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании. Иллюстративные незамещенные циклоалкоксигруппы имеют от 3 до 8 атомов углерода. В некоторых вариантах осуществления циклоалкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании.
Термин "циклоалкил", как используют в рамках изобретения, обозначает одновалентную насыщенную или ненасыщенную неароматическую циклическую углеводородную группу из от трех до восьми атомов углерода, если нет иных указаний, и ее примером является циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, бициклический гептил и т.п. Когда циклоалкильная группа включает углерод-углеродную двойную связь, циклоалкильная группа может быть обозначена как "циклоалкенильная" группа. Иллюстративные циклоалкенильные группы включают циклопентенил, циклогексенил и т.п. Циклоалкильные группы по настоящему изобретению необязательно могут быть замещены: (1) C1-7 ацилом (например, карбоксиальдегид); (2) C1-20 алкилом (например, C1-6 алкил, C1-6 алкокси-C1-6 алкил, C1-6 алкилсульфинил-C1-6 алкил, амино-C1-6 алкил, азидо-C1-6 алкил, (карбоксиальдегид)-C1-6 алкил, галоген-C1-6 алкил (например, перфторалкил), гидрокси-C1-6 алкил, нитро-C1-6 алкил или C1-6тиоалкокси-C1-6 алкил); (3) C1-20 алкокси (например, C1-6 алкокси, такой как перфторалкокси); (4) C1-6 алкилсульфинилом; (5) C6-10 арилом; (6) амино; (7) C1-6 алк-C6-10 арилом; (8) азидо; (9) C3-8 циклоалкилом; (10) C1-6 алк-C3-8 циклоалкилом; (11) галогеном; (12) C1-12 гетероциклилом (например, C1-12 гетероарил); (13) (C1-12 гетероциклил)окси; (14) гидрокси; (15) нитро; (16) C1-20 тиоалкокси (например, C1-6 тиоалкокси); (17) -(CH2)qCO2RA’, где q представляет собой целое число от нуля до четырех, и RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода и (d) C1-6 алк-C6-10 арила; (18) -(CH2)qCONRB’RC’, где q представляет собой целое число от нуля до четырех, и где RB’ и RC’ независимо выбран из группы, состоящей из (a) водорода, (b) C6-10 алкила, (c) C6-10 арила, и (d) C1-6 алк-C6-10 арила; (19) -(CH2)qSO2RD’, где q представляет собой целое число от нуля до четырех, и где RD’ выбран из группы, состоящей из (a) C6-10 алкила, (b) C6-10 арила и (c) C1-6 алк-C6-10 арила; (20) -(CH2)qSO2NRE’RF’, где q представляет собой целое число от нуля до четырех, и где каждый из RE’ и RF’ независимо выбран из группы, состоящей из (a) водорода, (b) C6-10 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (21) тиола; (22) C6-10 арилокси; (23) C3-8 циклоалкокси; (24) C6-10 арил-C1-6 алкокси; (25) C1-6 алк-C1-12 гетероциклила (например, C1-6 алк-C1-12 гетероарил); (26) оксо; (27) C2-20 алкенила; и (28) C2-20 алкинила. В некоторых вариантах осуществления каждая из этих групп может быть дополнительно замещена, как описано в настоящем описании. Например, алкиленовая гурппа C1-алкарила или a C1-алкгетероциклила может быть дополнительно замещена оксогруппой для получения соответствующей арилоильной и (гетероциклил)оильной группы заместителя.
Термин "диастереомер", как используют в рамках изобретения, означает стереоизомеры, которые не являются зеркальными отображениями друг друга и не налагаются друг на друга.
Термин "эффективное количество" средства, как используют в рамках изобретения, представляет собой количество, достаточное для обеспечения благоприятных или желательных результатов, например, клинических результатов, и, фактически, "эффективное количество" зависит от контекста, в котором его применяют. Например, в контексте введения средства, которое осуществляет лечение злокачественной опухоли, эффективное количество средства представляет собой, например, количество, достаточное для обеспечения лечения, как определено в настоящем описании, злокачественной опухоли по сравнению с ответом, полученным без введения средства.
Термин "энантиомер", как используют в рамках изобретения, означает каждую оптически активную форму соединения по изобретению, имеющую оптическую чистоту или избыток энантиомера (как определяют способами, стандартными в данной области) по меньшей мере 80% (т.е. по меньшей мере 90% одного энантиомера и не более 10% другого энантиомера), предпочтительно по меньшей мере 90% и более предпочтительно по меньшей мере 98%.
Термин "галоген", как используют в рамках изобретения, обозначает галоген, выбранный из брома, хлора, йода или фтора.
Термин "галогеналкокси", как используют в рамках изобретения, обозначает алкоксигруппу, как определено в настоящем описании, замещенную группой галогена (т.е. F, Cl, Br или I). Галогеналкокси может быть замещен одной, двумя, тремя или, в случае алкильных групп из двух или более атомов углерода, четырьмя галогенами. Галогеналкоксигруппы включают перфторалкокси (например -OCF3), -OCHF2, -OCH2F, -OCCl3, -OCH2CH2Br, -OCH2CH(CH2CH2Br)CH3 и -OCHICH3. В некоторых вариантах осуществления галогеналкоксигруппа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для алкильных групп.
Термин "галогеналкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную группой галогена (т.е. F, Cl, Br или I). Галогеналкил может быть замещен одним, двумя, тремя или, в случае алкильных групп из двух атомов углерода или более, четырьмя галогенами. Галогеналкильные группы включают перфторалкилы (например, -CF3), -CHF2, -CH2F, -CCl3, -CH2CH2Br, -CH2CH(CH2CH2Br)CH3 и -CHICH3. В некоторых вариантах осуществления галогеналкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для алкильных групп.
Термин "гетероалкилен", как используют в рамках изобретения, относится к алкиленовой группе, как определено в настоящем описании, в которой каждый из одного или двух составляющих атомов углерода заменены азотом, кислородом или серой. В некоторых вариантах осуществления группа гетероалкилена может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании для алкиленовых групп.
Термин "гетероарил", как используют в рамках изобретения, обозначает подгруппу гетероциклилов, как определено в настоящем описании, которые являются ароматическими: т.е. они содержат 4n+2 pi-электроны в моноциклической или полициклической кольцевой системе. Иллюстративные незамещенные гетероарильные группы имеют от 1 до 12 (например, от 1 до 11, 1 до 10, от 1 до 9, от 2 до 12, от 2 до 11, от 2 до 10 или от 2 до 9) атомов углерода. В некоторых вариантах осуществления гетероарил замещен 1, 2, 3 или 4 группами заместителей, как определено для гетероциклильной группы.
Термин "гетероциклил", как используют в рамках изобретения обозначает 5-, 6- или 7-членное кольцо, если нет иных указаний, содержащее один, два, три или четыре гетероатома, независимо выбранных из группы, состоящей из азота, кислорода и серы. 5-Членное кольцо имеет от нуля до двух двойных связей, и 6- и 7-членные кольца имеют от нуля до трех двойных связей. Иллюстративные незамещенные гетероциклильные группы имеют от 1 до 12 (например, от 1 до 11, 1 до 10, от 1 до 9, от 2 до 12, от 2 до 11, от 2 до 10 или от 2 до 9) атомов углерода. Термин "гетероциклил" также обозначает гетероциклическое соединение, имеющее мостиковую полициклическую структуру, в которой один или несколько атомов углерода и/или гетероатомов соединяют мостиковой связью два не являющихся соседними члена моноциклического кольца, например, хинуклидинильную группу. Термин "гетероциклил" включает бициклические, трициклические и тетрациклические группы, в которых любое из описанных выше гетероциклических колец является конденсированным с одним, двумя или тремя карбоциклическими кольцами, например, арильным кольцом, циклогексановым кольцом, циклогексеновым кольцом, циклопентановым кольцом, циклопентеновым кольцом или другим моноциклическим гетероциклическим кольцом, таким как индолил, хинолил, изохинолил, тетрагидрохинолил, бензофурил, бензотиенил и т.п. Примеры конденсированных гетероциклилов включают тропаны и 1,2,3,5,8,8a-гексагидроиндолизин. Гетероциклические группы включают пирролил, пирролинил, пирролидинил, пиразолил, пиразолинил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, пиперидинил, гомопиперидинил, пиразинил, пиперазинил, пиримидинил, пиридазинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, морфолинил, тиоморфолинил, тиазолил, тиазолидинил, изотиазолил, изотиазолидинил, индолил, индазолил, хинолил, изохинолил, хиноксалинил, дигидрохиноксалинил, хиназолинил, циннолинил, фталазинил, бензимидазолил, бензотиазолил, бензоксазолил, бензотиадиазолил, фурил, тиенил, тиазолидинил, изотиазолил, триазолил, тетразолил, оксадиазолил (например, 1,2,3-оксадиазолил), пуринил, тиадиазолил (например, 1,2,3-тиадиазолил), тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, дигидротиенил, дигидроиндолил, дигидрохинолил, тетрагидрохинолил, тетрагидроизохинолил, дигидроизохинолил, пиранил, дигидропиранил, дитиазолил, бензофуранил, изобензофуранил, бензотиенил и т.п., включая их дигидро- и тетрагидроформы, где одна или несколько двойных связей восстановлены или заменены атомами водорода. Другие иллюстративные гетероциклилы включают: 2,3,4,5-тетрагидро-2-оксооксазолил; 2,3-дигидро-2-оксо-1H-имидазолил; 2,3,4,5-тетрагидро-5-оксо-1H-пиразолил (например, 2,3,4,5-тетрагидро-2-фенил-5-оксо-1H-пиразолил); 2,3,4,5-тетрагидро-2,4-диоксо-1H-имидазолил (например, 2,3,4,5-тетрагидро-2,4-диоксо-5-метил-5-фенил-1H-имидазолил); 2,3-дигидро-2-тиоксо-1,3,4-оксадиазолил (например, 2,3-дигидро-2-тиоксо-5-фенил-1,3,4-оксадиазолил); 4,5-дигидро-5-оксо-1H-триазолил (например, 4,5-дигидро-3-метил-4-амино-5-оксо-1H-триазолил); 1,2,3,4-тетрагидро-2,4-диоксопиридинил (например, 1,2,3,4-тетрагидро-2,4-диоксо-3,3-диэтилпиридинил); 2,6-диоксопиперидинил (например, 2,6-диоксо-3-этил-3-фенилпиперидинил); 1,6-дигидро-6-оксопиримидинил; 1,6-дигидро-4-оксопиримидинил (например, 2-(метилтио)-1,6-дигидро-4-оксо-5-метилпиримидин-1-ил); 1,2,3,4-тетрагидро-2,4-диоксопиримидинил (например, 1,2,3,4-тетрагидро-2,4-диоксо-3-этилпиримидинил); 1,6-дигидро-6-оксо-пиридазинил (например, 1,6-дигидро-6-оксо-3-этилпиридазинил); 1,6-дигидро-6-оксо-1,2,4-триазинил (например, 1,6-дигидро-5-изопропил-6-оксо-1,2,4-триазинил); 2,3-дигидро-2-оксо-1H-индолил (например, 3,3-диметил-2,3-дигидро-2-оксо-1H-индолил и 2,3-дигидро-2-оксо-3,3′-спиропропан-1H-индол-1-ил); 1,3-дигидро-1-оксо-2H-изоиндолил; 1,3-дигидро-1,3-диоксо-2H-изоиндолил; 1H-бензопиразолил (например, 1-(этоксикарбонил)-1H-бензопиразолил); 2,3-дигидро-2-оксо-1H-бензимидазолил (например, 3-этил-2,3-дигидро-2-оксо-1H-бензимидазолил); 2,3-дигидро-2-оксобензоксазолил (например, 5-хлор-2,3-дигидро-2-оксобензоксазолил); 2,3-дигидро-2-оксобензоксазолил; 2-оксо-2H-бензопиранил; 1,4-бензодиоксанил; 1,3-бензодиоксанил; 2,3-дигидро-3-оксо-4H-1,3-бензотиазинил; 3,4-дигидро-4-оксо-3H-хиназолинил (например, 2-метил-3,4-дигидро-4-оксо-3H-хиназолинил); 1,2,3,4-тетрагидро-2,4-диоксо-3H-хиназолил (например, 1-этил-1,2,3,4-тетрагидро-2,4-диоксо-3H-хиназолил); 1,2,3,6-тетрагидро-2,6-диоксо-7H-пуринил (например, 1,2,3,6-тетрагидро-1,3-диметил-2,6-диоксо-7H-пуринил); 1,2,3,6-тетрагидро-2,6-диоксо-1H-пуринил (например, 1,2,3,6-тетрагидро-3,7-диметил-2,6-диоксо-1H-пуринил); 2-оксобенз[c,d]индолил; 1,1-диоксо-2H-нафт[1,8-c,d]изотиазолил; и 1,8-нафтилендикарбоксамидо. Дополнительные гетероциклические группы включают 3,3a,4,5,6,6a-гексагидропирроло[3,4-b]пиррол-(2H)-ил и 2,5-диазабицикло[2.2.1]гептан-2-ил, гомопиперазинил (или диазепанил), тетрагидропиранил, дитиазолил, бензофуранил, бензотиенил, оксепанил, тиепанил, азоканил, оксеканил и тиоканил. Гетероциклические группы также включают группы формулы
E′ выбран из группы, состоящей из -N- и -CH-; F′ выбран из группы, состоящей из -N=CH-, -NH-CH2-, -NH-C(O)-, -NH-, -CH=N-, -CH2-NH-, -C(O)-NH-, -CH=CH-, -CH2-, -CH2CH2-, -CH2O-, -OCH2-, -O- и -S-; и G′ выбран из группы, состоящей из -CH- и -N-. Любая из гетероциклильных групп, упомянутых в настоящем описании, необязательно может быть замещена одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из группы, состоящей из: (1) C1-7 ацила (например, карбоксиальдегид ); (2) C1-20 алкила (например, C1-6 алкил, C1-6 алкокси-C1-6 алкил, C1-6 алкилсульфинил-C1-6 алкил, амино-C1-6 алкил, азидо-C1-6 алкил, (карбоксиальдегид)-C1-6 алкил, галоген-C1-6 алкил (например, перфторалкил), гидрокси-C1-6 алкил, нитро-C1-6 алкил или C1-6 тиоалкокси-C1-6 алкил); (3) C1-20 алкокси (например, C1-6 алкокси, такой как перфторалкокси); (4) C1-6 алкилсульфинила; (5) C6-10 арила; (6) амино; (7) C1-6 алк-C6-10 арила; (8) азидо; (9) C3-8 циклоалкила; (10) C1-6 алк-C3-8 циклоалкила; (11) галогена; (12) C1-12 гетероциклила (например, C2-12 гетероарил); (13) (C1-12 гетероциклил)окси; (14) гидрокси; (15) нитро; (16) C1-20 тиоалкокси (например, C1-6 тиоалкокси); (17) -(CH2)qCO2RA’, где q представляет собой целое число от нуля до четырех, и RA’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила, (c) водорода и (d) C1-6 алк-C6-10 арила; (18) -(CH2)qCONRB’RC’, где q представляет собой целое число от нуля до четырех, и где RB’ и RC’ независимо выбраны из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (19) -(CH2)qSO2RD’, где q представляет собой целое число от нуля до четырех, и где RD’ выбран из группы, состоящей из (a) C1-6 алкила, (b) C6-10 арила и (c) C1-6 алк-C6-10 арила; (20) -(CH2)qSO2NRE’RF’, где q представляет собой целое число от нуля до четырех, и где каждый из RE’ и RF’ независимо выбран из группы, состоящей из (a) водорода, (b) C1-6 алкила, (c) C6-10 арила и (d) C1-6 алк-C6-10 арила; (21) тиола; (22) C6-10 арилокси; (23) C3-8 циклоалкокси; (24) арилалкокси; (25) C1-6 алк-C1-12 гетероциклила (например, C1-6 алк-C1-12 гетероарил); (26) оксо; (27) (C1-12 гетероциклил)имино; (28) C2-20 алкенила; и (29) C2-20 алкинила. В некоторых вариантах осуществления каждая из этих групп может быть дополнительно замещена, как описано в настоящем описании. Например, алкиленовая группа C1-алкарила или C1-алкгетероциклила может быть дополнительно замещена оксогруппой с получением соответствующей арилоильной и (гетероциклил)оильной группы заместителя.
Термин "(гетероциклил)имино", как используют в рамках изобретения, обозначает гетероциклильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через иминогруппу. В некоторых вариантах осуществления гетероциклильная группа может быть замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании.
Термин "(гетероциклил)окси", как используют в рамках изобретения, обозначает гетероциклильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через атом кислорода. В некоторых вариантах осуществления гетероциклильная группа может быть замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании.
Термин "(гетероциклил)оил", как используют в рамках изобретения, обозначает гетероциклильную группу, как определено в настоящем описании, связанную с исходной молекулярной группой через карбонильную группу. В некоторых вариантах осуществления гетероциклильная группа может быть замещена 1, 2, 3 или 4 группами заместителей, как определено в настоящем описании.
Термин "углеводород", как используют в рамках изобретения, обозначает группу, состоящую только из атомов углерода и водорода.
Термин "гидрокси", как используют в рамках изобретения, обозначает группу -OH. В некоторых вариантах осуществления гидроксигруппа может быть замещена 1, 2, 3 или 4 группами заместителей (например, O-защитные группы), как определено в настоящем описании для алкила.
Термин "гидроксиалкенил", как используют в рамках изобретения, обозначает алкенильную группу, как определено в настоящем описании, замещенную посредством от одной до трех гидроксигрупп при условии, что не более одной гидроксигруппы может быть связано с одним атомом углерода алкильной группы, и его примером является дигидроксипропенил, гидроксиизопентенил и т.п. В некоторых вариантах осуществления гидроксиалкенильная группа может быть замещена 1, 2, 3 или 4 группами заместителей (например, O-защитными группами), как определено в настоящем описании для алкила.
Термин "гидроксиалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную посредством от одной до трех гидроксигрупп при условии, что не более одной гидроксигруппы может быть связано с одним атомом углерода алкильной группы, и его примером является гидроксиметил, дигидроксипропил и т.п. В некоторых вариантах осуществления гидроксиалкильная группа может быть замещена 1, 2, 3 или 4 группами заместителей (например, O-защитных групп), как определено в настоящем описании для алкила.
Термин "гидроксиалкинил", как используют в рамках изобретения, обозначает алкинильную группу, как определено в настоящем описании, замещенную посредством от одной до трех гидроксигрупп, при условии, что не более одной гидроксигруппы может быть связано с одним атомом углерода алкильной группы. В некоторых вариантах осуществления гидроксиалкинильная группа может быть замещена 1, 2, 3 или 4 группами заместителей (например, O-защитными группами), как определено в настоящем описании для алкила.
Термин "изомер", как используют в рамках изобретения, означает любой таутомер, стереоизомер, энантиомер или диастереомер любого соединения по изобретению. Понятно, что соединения по изобретению могут иметь один или несколько хиральных центров и/или двойных связей и, таким образом, существуют в качестве стереоизомеров, таких как изомеры по двойной связи (т.е. геометрические изомеры E/Z) или диастереомеры (например, энантиомеры (т.е. (+) или (-)) или цис/транс изомеры). В соответствии с изобретением химические структуры, представленные в настоящем описании, и, таким образом, соединения по изобретению охватывают все соответствующие стереоизомеры, т.е. как стереомерно чистую форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую), так и энантиомерные и стереоизомерные смеси, например, рацематы. Энантиомерные и стереоизомерные смеси соединений по изобретению, как правило, можно разделять на их составляющие энантиомеры или стереоизомеры хорошо известными способами, такими как хиральная фазовая газовая хроматография, хиральная фазовая высокоэффективная жидкостная хроматография, кристаллизация соединения в качестве хирального солевого комплекса или кристаллизация соединения в хиральном растворителе. Энантиомеры и стереоизомеры также можно получать из стереоизомерно или энантиомерно чистых промежуточных соединений, реагентов и катализаторов хорошо известными способами асимметричного синтеза.
Термин "N-защищенный амино", как используют в рамках изобретения, относится к аминогруппе, как определено в настоящем описании, с которой связана одна или две N-защитных группы, как определено в настоящем описании.
Термин "N-защитная группа", как используют в рамках изобретения, обозначает группы, предназначенные для защиты аминогруппы от нежелательных реакций в процессе синтеза. Широко используемые N-защитные группы описаны в Greene, "Protective Groups in Organic Synthesis", 3rd Edition (John Wiley & Sons, New York, 1999), которая включена в настоящее описание в качестве ссылки. N-защитные группы включают ацильные, арилоильные или карбамильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, o-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и хиральные вспомогательные реагенты, такие как защищенные или незащищенные D,L- или D,L-аминокислоты, такие как аланин, лейцин, фенилаланин и т.п.; сульфонилсодержащие группы, такие как бензолсульфонил, п-толуолсульфонил и т.п.; образующие карбамат группы, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, α,α-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2,-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и т.п., алкарильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п., и силильные группы, такие как триметилсилил и т.п. Предпочтительные N-защитные группы представляют собой формил, ацетил, бензоил, пивалоил, трет-бутилацетил, аланил, фенилсульфонил, бензил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz).
Термин "нитро", как используют в рамках изобретения, обозначает группу -NO2.
Термин "O-защитная группа", как используют в рамках изобретения, обозначает группы, предназначенные для защиты кислородсодержащих групп (например, фенол, гидроксил или карбонил) от нежелательных реакций в процессе синтеза. Широко используемые O-защитные группы описаны в Greene, "Protective Groups in Organic Synthesis", 3rd Edition (John Wiley & Sons, New York, 1999), которая включена в настоящее описание в качестве ссылки. Иллюстративные O-защитные группы включают ацильные, арилоильные или карбамильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, o-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, трет-бутилдиметилсилил, три-изопропилсилилоксиметил, 4,4'-диметокситритил, изобутирил, феноксиацетил, 4-изопропилфеноксиацетил, диметилформамидино и 4-нитробензоил; алкилкарбонильные группы, такие как ацил, ацетил, пропионил, пивалоил и т.п.; необязательно замещенные арилкарбонильные группы, такие как бензоил; силильные группы, такие как триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), три-изопропилсилилоксиметил (TOM), триизопропилсилил (TIPS) и т.п.; группы, образующие с гидроксилом простой эфир, такие как метил, метоксиметил, тетрагидропиранил, бензил, п-метоксибензил, тритил и т.п.; алкоксикарбонилы, такие как метоксикарбонил, этоксикарбонил, изопропоксикарбонил, н-изопропоксикарбонил, н-бутилоксикарбонил, изобутилоксикарбонил, втор-бутилоксикарбонил, трет-бутилоксикарбонил, 2-этилгексилоксикарбонил, циклогексилоксикарбонил, метилоксикарбонил и т.п.; алкоксиалкоксикарбонильные группы, такие как метоксиметоксикарбонил, этоксиметоксикарбонил, 2-метоксиэтоксикарбонил, 2-этоксиэтоксикарбонил, 2-бутоксиэтоксикарбонил, 2-метоксиэтоксиметоксикарбонил, аллилоксикарбонил, пропаргилоксикарбонил, 2-бутеноксикарбонил, 3-метил-2-бутеноксикарбонил и т.п.; галогеналкоксикарбонилы, такие как 2-хлорэтоксикарбонил, 2-хлорэтоксикарбонил, 2,2,2-трихлорэтоксикарбонил и т.п.; необязательно замещенные арилалкоксикарбонильные группы, такие как бензилоксикарбонил, п-метилбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2,4-динитробензилоксикарбонил, 3,5-диметилбензилоксикарбонил, п-хлорбензилоксикарбонил, п-бромбензилоксикарбонил, флуоренилметилоксикарбонил и т.п.; и необязательно замещенные арилоксикарбонильные группы, такие как феноксикарбонил, п-нитрофеноксикарбонил, o-нитрофеноксикарбонил, 2,4-динитрофеноксикарбонил, п-метилфеноксикарбонил, м-метилфеноксикарбонил, o-бромфеноксикарбонил, 3,5-диметилфеноксикарбонил, п-хлорфеноксикарбонил, 2-хлор-4-нитрофеноксикарбонил и т.п.); замещенные алкильные, арильные и алкарильные простые эфиры (например, тритил; метилтиометил; метоксиметил; бензилоксиметил; силоксиметил; 2,2,2,-трихлорэтоксиметил; тетрагидропиранил; тетрагидрофуранил; этоксиэтил; 1-[2-(триметилсилил)этокси]этил; 2-триметилсилилэтил; трет-бутиловый простой эфир; п-хлорфенил, п-метоксифенил, п-нитрофенил, бензил, п-метоксибензил и нитробензил); силиловые простые эфиры (например, триметилсилил; триэтилсилил; триизопропилсилил; диметилизопропилсилил; трет-бутилдиметилсилил; трет-бутилдифенилсилил; трибензилсилил; трифенилсилил и дифенилметилсилил); карбонаты (например, метил, метоксиметил, 9-флуоренилметил; этил; 2,2,2-трихлорэтил; 2-(триметилсилил)этил; винил, аллил, нитрофенил; бензил; метоксибензил; 3,4-диметоксибензил; и нитробензил); карбонил-защитные группы (например, ацетальные и кетальные группы, такие как диметилацеталь, 1,3-диоксолан и т.п.; ацилальные группы; и дитиановые группы, такие как 1,3-дитианы, 1,3-дитиолан и т.п.); защитные группы карбоновых кислот (например, сложноэфирные группы, такие как метиловый сложный эфир, бензиловый сложный эфир, трет-бутиловый сложный эфир, сложные ортоэфиры и т.п.; и группы оксазолина.
Термин "оксо", как используют в рамках изобретения, обозначает =O.
Термин "перфторалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, где каждый водородный радикал, связанный с алкильной группой, заменен фторидным радикалом. Примерами перфторалкильных групп являются трифторметил, пентафторэтил и т.п.
Термин "перфторалкокси", как используют в рамках изобретения, обозначает алкоксигруппу, как определено в настоящем описании, где каждый водородный радикал, связанный с алкоксигруппой, заменен фторидным радикалом. Примерами перфторалкоксигрупп являются трифторметокси, пентафторэтокси и т.п.
Термин "спироциклил", как используют в рамках изобретения, обозначает C2-7 алкиленовый дирадикал, оба конца которого связаны с одним и тем же атомом углерода исходной группы с образованием спироциклической группы, и также C1-6 гетероалкиленовый дирадикал, оба конца которого связаны с одним и тем же атомом. Гетероалкиленовый радикал, образующий спироциклильную группу, может содержать один, два, три или четыре гетероатома, независимо выбранных из группы, состоящей из азота, кислорода и серы. В некоторых вариантах осуществления спироциклильная группа включает от одного до семи атомов углерода, исключая атом углерода, с которым связан дирадикал. Спироциклильные группы по изобретению необязательно могут быть замещены 1, 2, 3 или 4 заместителями, представленными в настоящем описании в качестве необязательных заместителей для циклоалкильных и/или гетероциклильных групп.
Термин "стереоизомер", как используют в рамках изобретения, относится ко всем возможным различным изомерным, а также конформационным формам, которыми может обладать соединение (например, соединение любой формулы, описанной в настоящем описании), в частности, всем возможным стереохимически и конформационно изомерным формам, всем диастереомерам, энантиомерам и/или конформерам основной молекулярной структуры. Некоторые соединения по настоящему изобретению могут существовать в различных таутомерных формах, причем все из них включены в объем настоящего изобретения.
Термин "сульфоалкил", как используют в рамках изобретения, обозначает алкильную группу, как определено в настоящем описании, замещенную сульфогруппой -SO3H. В некоторых вариантах осуществления алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании, и сульфогруппа может быть дополнительно замещена одной или несколькими O-защитными группами (например, как описано в настоящем описании).
Термин "сульфонил", как используют в рамках изобретения, обозначает группу -S(O)2-.
Термин "тиоалкарильный", как используют в рамках изобретения, обозначает химический заместитель формулы -SR, где R представляет собой алкарильную группу. В некоторых вариантах осуществления алкарильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании.
Термин "тиоалкгетероциклил", как используют в рамках изобретения, обозначает химический заместитель формулы -SR, где R представляет собой алкгетероциклильную группу. В некоторых вариантах осуществления алкгетероциклильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании.
Термин "тиоалкокси", как используют в рамках изобретения, обозначает химический заместитель формулы -SR, где R представляет собой алкильную группу, как определено в настоящем описании. В некоторых вариантах осуществления алкильная группа может быть дополнительно замещена 1, 2, 3 или 4 группами заместителей, как описано в настоящем описании.
Соединение: Как используют в рамках изобретения, термин "соединение" включает все стереоизомеры, геометрические изомеры, таутомеры и изотопы представленных структур.
Соединения, описанные в настоящем описании, могут быть асимметричными (например, имеющими один или несколько стереоцентров). Подразумеваются все стереоизомеры, такие как энантиомеры и диастереомеры, если нет иных указаний. Соединения по настоящему изобретению, которые содержат асимметрично замещенные атомы углерода, можно выделять в оптически активных и рацемических формах. Способы получения оптически активных форм из оптических активных исходных материалов известны в данной области, такие как разделение рацемических смесей или стереоселективный синтез. В соединениях, описанных в настоящем описании, также может присутствовать множество геометрических изомеров олефинов, двойных связей C=N и т.п., и все такие стабильные изомеры предусматриваются в рамках настоящего изобретения. Цис- и транс-геометрические изомеры соединений по настоящему изобретению описаны и их можно выделять в качестве смеси изомеров или в качестве разделенных изомерных форм.
Соединения по настоящему изобретению также включают таутомерные формы. Таутомерные формы являются результатом обмена между одинарной связью и соседней двойной связью и одновременной миграции протона. Таутомерные формы включают прототропные таутомеры, которые представляют собой изомерные состояния протонирования, имеющие одинаковую эмпирическую формулу и общий заряд. Примеры прототропных таутомеров включают кето-енольные пары, пары амид-имидная кислота, пары лактам-лактим, пары амид-имидная кислота, пары енамин-имин и кольцевые формы, где протон может занимать два или более положений в гетероциклической системе, такие как 1H- и 3H-имидазол, 1H-, 2H- и 4H-1,2,4-триазол, 1H- и 2H-изоиндол и 1H- и 2H-пиразол. Таутомерные формы могут находиться в равновесии или могут быть пространственно запертыми в одну форму путем подходящей замены.
Соединения по настоящему изобретению также включают все изотопы атомов, встречающихся в промежуточном соединении или конечных соединениях. "Изотопы" относятся к атомам, имеющим одно и то же атомное число, но разные массовые числа вследствие отличающегося количества нейтронов в ядрах. Например, изотопы водорода включают тритий и дейтерий.
Соединения и соли по настоящему изобретению можно получать в комбинации с молекулами растворителя или воды, образующими сольваты и гидраты, обычными способами.
Консервативный: Как используют в рамках изобретения, термин "консервативный" относится к нуклеотидным или аминокислотным остаткам полинуклеотидной последовательности или полипептидной последовательности, соответственно, которые представляют собой остатки, которые являются неизмененными в одном и том же положении двух или более сравниваемых последовательностей. Нуклеотиды или аминокислоты, которые являются относительно консервативными, представляют собой нуклеотиды и аминокислоты, которые являются консервативными среди более родственных последовательностей, чем нуклеотиды или аминокислоты, встречающиеся где-либо в последовательностях.
В некоторых вариантах осуществления две или более последовательностей называют "полностью консервативными", если они на 100% идентичны друг другу. В некоторых вариантах осуществления две или более последовательностей называют "высококонсервативными", если они по меньшей мере на 70% идентичны, по меньшей мере на 80% идентичны, по меньшей мере на 90% идентичны или по меньшей мере на 95% идентичны друг другу. В некоторых вариантах осуществления две или более последовательности называют "высококонсервативными", если они приблизительно на 70% идентичны, приблизительно на 80% идентичны, приблизительно на 90% идентичны, приблизительно на 95%, приблизительно на 98% или приблизительно на 99% идентичны друг другу. В некоторых вариантах осуществления две или более последовательностей называют "консервативными", если они по меньшей мере на 30% идентичны, по меньшей мере на 40% идентичны, по меньшей мере на 50% идентичны, по меньшей мере на 60% идентичны, по меньшей мере на 70% идентичны, по меньшей мере на 80% идентичны, по меньшей мере на 90% идентичны или по меньшей мере на 95% идентичны друг другу. В некоторых вариантах осуществления две или более последовательностей называют "консервативными", если они приблизительно на 30% идентичны, приблизительно на 40% идентичны, приблизительно на 50% идентичны, приблизительно на 60% идентичны, приблизительно на 70% идентичны, приблизительно 80% идентичны, приблизительно на 90% идентичны, приблизительно на 95% идентичны, приблизительно на 98% идентичны или приблизительно на 99% идентичны друг другу. Консервативность последовательности может применяться в отношении всей длины последовательности олигонуклеотида или полипептида, или она может применяться к ее части, области или характерному элементу.
Циклический или циклизованный: Как используют в рамках изобретения, термин "циклический" относится к присутствию непрерывной петли. Циклические молекулы не должны быть кольцевыми, связанными только с образованием непрерывной цепи субъединиц. Циклические молекулы, такие как мРНК по настоящему изобретению, могут представлять собой отдельные элементы или мультимеры или содержат один или несколько компонентов комплекса или структуры более высокого порядка.
Цитостатический: Как используют в рамках изобретения, "цитостатический" относится к ингибированию, снижению, подавлению роста, деления или увеличения количества клеток (например, клеток млекопитающих (например, клеток человека)), бактерий, вирусов, грибов, простейших, паразитов, прионов или их комбинаций.
Цитотоксический: Как используют в рамках изобретения, "цитотоксический" относится к уничтожению или обеспечению повреждающего, токсического или гибельного эффекта на клетку (например, клетку млекопитающего (например, клетку человека)), бактерию, вирус, гриб, простейшее, паразита, прион или их комбинацию.
Доставка: Как используют в рамках изобретения, "доставка" относится к акту или способу доставки соединения, вещества, элемента, части, транспортируемого вещества или груза.
Средство для доставки: Как используют в рамках изобретения, "средство для доставки" относится к любому веществу, которое облегчает, по меньшей мере частично, доставку in vivo полинуклеотида к клеткам-мишеням.
Дестабилизированный: Как используют в рамках изобретения, термин "дестабилизированный", "дестабилизировать" или "дестабилизирующая область" означает область или молекулу, которая менее стабильна, чем исходная форма дикого типа или нативная форма той же области или молекулы.
Поддающаяся обнаружению метка: Как используют в рамках изобретения, "поддающаяся обнаружению метка" относится к одному или нескольким маркерам, сигналам или частям, которые присоединены, включены или ассоциированы с другим элементом, который легко обнаруживается способами, известными в данной области, включая радиографию, флуоресценцию, хемилюминесценцию, ферментативную активность, поглощение и т.п. Поддающиеся обнаружению метки включают радиоизотопы, флуорофоры, хромофоры, ферменты, красители, ионы металлов, лиганды, такие как биотин, авидин, стрептавидин и гаптены, квантовые точки и т.п. Поддающиеся обнаружению метки могут быть расположены в любом положении в пептидах или белках, описанных в настоящем описании. Они могут располагаться в аминокислотах, пептидах или белках, или расположены на N- или C-концах.
Расщеплять: Как используют в рамках изобретения, термин "расщеплять" означает разрушать на мелкие фрагменты или компоненты. При указании на полипептиды или белки, расщепление приводит к продуцированию пептидов.
Дистальный: Как используют в рамках изобретения, термин "дистальный" означает расположенный вдали от центра или вдали от представляющей интерес точки или области.
Кодируемый сигнал расщепления белка: Как используют в рамках изобретения, "кодируемый сигнал расщепления белка" относится к нуклеотидной последовательности, которая кодирует сигнал расщепления белка.
Полученный способами инженерии: Как используют в рамках изобретения, варианты осуществления изобретения являются "полученными способами инженерии", когда они сконструированы так, чтобы иметь признак или свойство, структурные или химические, которые варьируют относительно исходной молекулы дикого типа или нативной молекулы.
Экспрессия: Как используют в рамках изобретения, "экспрессия" последовательности нуклеиновой кислоты относится к одному или нескольким из следующих явлений: (1) продуцирование РНК-матрицы с последовательности ДНК (например, путем транскрипции); (2) процессинг РНК-транскрипта (например, путем сплайсинга, редактирования, образования 5′-кэпа и/или процессинга 3′-конца); (3) трансляция РНК в полипептид или белок; и (4) посттрансляционная модификация полипептида или белка.
Признак: Как используют в рамках изобретения, "признак" относится к характеристике, свойству или отличительному элементу.
Состав: Как используют в рамках изобретения, "состав" включает по меньшей мере полинуклеотид и средство для доставки.
Фрагмент: "Фрагмент", как используют в рамках изобретения, относится к части. Например, фрагменты белков могут содержать полипептиды, полученные путем расщепления полноразмерного белка, выделенного из культивируемых клеток.
Функциональный: Как используют в рамках изобретения, "функциональная" биологическая молекула представляет собой биологическую молекулу в форме, в которой она проявляет свойство и/или активность, которые ее характеризуют.
Гомология: Как используют в рамках изобретения, термин "гомология" относится к общей родственности между полимерными молекулами, например, между молекулами нуклеиновых кислот (например, молекулы ДНК и/или молекулы РНК) и/или между полипептидными молекулами. В некоторых вариантах осуществления полимерные молекулы считаются "гомологичными" друг другу, если их последовательности являются по меньшей мере на 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% идентичными или сходными. Термин "гомологичный" неизбежно относится к сравнению по меньшей мере двух последовательностей (полинуклеотидные или полипептидные последовательности). В соответствии с изобретением, две полинуклеотидные последовательности считаются гомологичными, если полипептиды, которые они кодируют, идентичны по меньшей мере приблизительно на 50%, 60%, 70%, 80%, 90%, 95% или даже 99% на протяжении по меньшей мере одного участка по меньшей мере приблизительно из 20 аминокислот. В некоторых вариантах осуществления гомологичные полинуклеотидные последовательности характеризуются способностью кодировать участок из по меньшей мере 4-5 уникальных заданных аминокислот. Для полинуклеотидных последовательностей длиной менее 60 нуклеотидов гомологию определяют по способности кодировать участок из по меньшей мере 4-5 уникальных заданных аминокислот. В соответствии с изобретением две белковых последовательности считаются гомологичными, если белки по меньшей мере приблизительно на 50%, 60%, 70%, 80% или 90% идентичны на протяжении по меньшей мере одного участка из по меньшей мере приблизительно 20 аминокислот.
Идентичность: Как используют в рамках изобретения, термин "идентичность" относится к общей родственности между полимерными молекулами, например, между олигонуклеотидными молекулами (например, молекулами ДНК и/или молекулами РНК) и/или между полипептидными молекулами. Вычисление процентной идентичности двух полинуклеотидных последовательностей, например, можно проводить путем выравнивания двух последовательностей для целей оптимального сравнения (например, пропуски можно вносить в одну или обе из первой и второй последовательностей нуклеиновой кислоты для оптимального выравнивания и неидентичными последовательностями можно пренебрегать для целей сравнения). В определенных вариантах осуществления длина последовательности, выравниваемой для целей сравнения, составляет по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или 100% от длины эталонной последовательности. Затем сравнивают нуклеотиды в соответствующих положениях нуклеотидов. Когда положение в первой последовательности занято тем же нуклеотидом, что и соответствующее положение во второй последовательности, тогда молекулы идентичны в этом положении. Процентная идентичность между двумя последовательностями является функцией количества идентичных положений, являющихся общими для последовательностей, с учетом количества пропусков и длины каждого пропуска, который необходимо вносить для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процентной идентичности между двумя последовательностями можно осуществлять с использованием математического алгоритма. Например, процентную идентичность между двумя нуклеотидными последовательностями можно определять с использованием таких способов, как способы, описанные в Computational Molecular Biology,Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics и Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Computer Analysis of Sequence Data, Part I, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; каждая из которых включена в настоящее описание в качестве ссылки. Например, процентную идентичность между двумя нуклеотидными последовательностями можно определять с использованием алгоритма Meyers и Miller (CABIOS, 1989, 4:11-17), который включен в программу ALIGN (версия 2.0) с использованием таблицы веса остатков PAM120, штрафа за продолжение пропуска 12 и штрафа за пропуск 4. Альтернативно, процентную идентичность между двумя нуклеотидными последовательностями можно определять с использованием программы GAP в пакете программ GCG с использованием матрицы NWSgapdna.CMP. Способы, обычно используемые для определения процентной идентичности между последовательностями, включают, но не ограничиваются ими, способы, описанные в Carillo, H., and Lipman, D., SIAM J Applied Math., 48:1073 (1988); включенной в настоящее описание в качестве ссылки. Способы определения идентичности закодированы в общедоступных компьютерных программах. Иллюстративное компьютерное программное обеспечение для определения гомологии между двумя последовательностями включают, но не ограничиваются ими, пакет программ GCG, Devereux, J., et al., Nucleic Acids Research, 12(1), 387 (1984), BLASTP, BLASTN and FASTA Altschul, S. F. et al., J. Molec. Biol., 215, 403 (1990).
Ингибировать экспрессию гена: Как используют в рамках изобретения, выражение "ингибировать экспрессию гена" означает обеспечивать уменьшение количества продукта экспрессия гена. Продукт экспрессии может представлять собой РНК, транскрибируемую с гена (например, мРНК), или полипептид, транслируемый с мРНК, транскрибируемой с гена. Как правило, снижение уровня мРНК приводит к снижению уровня полипептида, транслируемого с него. Уровень экспрессии можно определять с использованием стандартных способов измерения мРНК или белка.
In vitro: Как используют в рамках изобретения, термин "in vitro" относится к явлениям, которые происходят в искусственной среде, например, в пробирке или реакционной емкости, в культуре, в чашке Петри и т.д., а не в организме (например, животном, растении или микроорганизме).
In vivo: Как используют в рамках изобретения, термин "in vivo" относится к явлениям, которые происходят в организме (например, животном, растении или микроорганизме или их клетке или ткани).
Выделенный: Как используют в рамках изобретения, термин "выделенный" относится к веществу или элементу, который отделен от по меньшей мере некоторых компонентов, с которыми он был ассоциирован (либо в природе, либо в экспериментальных условиях). Выделенные вещества могут иметь различные уровни чистоты относительно веществ, с которыми они были ассоциированы. Выделенные вещества и/или элементы могут быть отделены от по меньшей мере приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или более других компонентов, с которыми они были первоначально ассоциированы. В некоторых вариантах осуществления выделенные вещества являются более чем приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 91%, приблизительно на 92%, приблизительно на 93%, приблизительно на 94%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99% или более чем приблизительно на 99% чистыми. Как используют в рамках изобретения, вещество является "чистым", если оно по существу свободно от других компонентов. По существу выделенный: Под "по существу выделенным" подразумевают, что соединение по существу отделено от среды, в которой оно было образовано или обнаружено. Частичное выделение может включать, например, композицию, обогащенную соединением по настоящему изобретению. Выделение по существу может включать композиции, содержащие по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97% или по меньшей мере приблизительно 99% по массе соединения по настоящему изобретению или его соли. Способы выделения соединений и их солей являются общепринятыми в данной области.
Линкер: Как используют в рамках изобретения, линкер относится к группе атомов, например, 10-1000 атомов, и он может состоять из атомов или групп, таких как, но не ограничиваясь ими, углерод, амино, алкиламино, кислород, сера, сульфоксид, сульфонил, карбонил и имин. Линкер может быть связан с модифицированным нуклеозидом или нуклеотидом на основании нуклеиновой кислоты или части сахара на первом конце и с грузом, например, поддающимся обнаружению, или терапевтическим средством, на втором конце. Линкер может быть достаточной длины, чтобы не препятствовать включению в последовательность нуклеиновой кислоты. Линкер можно использовать для любой подходящей цели, как, например, для образования мультимеров (например, посредством связывания двух или более полинуклеотидов) или конъюгатов, а также для введения груза, как описано в настоящем описании. Примеры химических групп, которые могут быть включены в линкер, включают, но не ограничиваются ими, алкил, алкенил, алкинил, амидо, амино, простой эфир, простой тиоэфир, сложный эфир, алкилен, гетероалкилен, арил или гетероциклил, каждый из которых может быть необязательно замещенным, как описано в настоящем описании. Примеры линкеров включают, но не ограничиваются ими, ненасыщенные алканы, полиэтиленгликоли (например, мономерные элементы этиленгликоля или пропиленгликоль, например, диэтиленгликоль, дипропиленгликоль, триэтиленгликоль, трипропиленгликоль, тетраэтиленгликоль, или тетраэтиленгликоль) и полимеры декстрана. Другие примеры включают, но не ограничиваются ими, расщепляемые части в линкере, например, такие как дисульфидная связь (-S-S-) или азосвязь (-N=N-), которая может расщепляться с использованием восстановителя или фотолиза. Неограничивающие примеры селективно расщепляемой связи включают амидосвязь, которая может быть расщеплена, например, с использованием трис(2-карбоксиэтил)фосфина (TCEP), или других восстановителей и/или фотолиза, а также сложную эфирную связь, которая может быть расщеплена, например, гидролизом кислотой или основанием.
Модифицированный: Как используют в рамках изобретения, "модифицированный" относится к измененному состоянию или структуре молекулы по изобретению. Молекулы могут быть модифицированы множеством способов, в том числе химически, структурно и функционально. В одном варианте осуществления молекулы мРНК по настоящему изобретению модифицированы путем встраивания неприродных нуклеозидов и/или нуклеотидов, например, относительно природных рибонуклеотидов A, U, G и C. Неканонические нуклеотиды, такие как структуры кэпа, не считаются "модифицированными", хотя они отличаются по химической структуре от рибонуклеотидов A, C, G, U.
Встречающийся в природе: Как используют в рамках изобретения, "встречающийся в природе" означает существующий в природе без искусственного влияния.
Не являющееся человеком позвоночное: Как используют в рамках изобретения, "не являющееся человеком позвоночное" включает всех позвоночных, за исключением Homo sapiens, включая дикие и домашние виды. Примеры не являющихся человеком позвоночных включают, но не ограничиваются ими, млекопитающих, таких как альпака, бантенг, бизон, верблюд, кошка, крупный рогатый скот, олень, собака, обезьяна, гайал, коза, морская свинка, лошадь, лама, мул, свинья, кролик, северный олень, овца, азиатский буйвол и як.
Нецелевой: Как используют в рамках изобретения, "нецелевой" относится к любому непредусмотренному эффекту в отношении любой одной или нескольких мишеней, генов или клеточных транскриптов.
Открытая рамка считывания: Как используют в рамках изобретения, "открытая рамка считывания" или "ORF" относится к последовательности, которая не содержит стоп-кодона в данной рамке считывания.
Функционально связанный: Как используют в рамках изобретения, выражение "функционально связанный" относится к функциональной взаимосвязи между двумя или более молекулами, конструкциями, транскрипциями, элементами, частями и т.п.
Паратоп: Как используют в рамках изобретения, "паратоп" относится к антигенсвязывающему центру антитела.
Пациент: Как используют в рамках изобретения, "пациент" относится к индивидууму, который может обратиться за лечением или который может нуждаться в лечении, которому требуется лечение, которому проводят лечение или которому будут проводить лечение, или индивидууму, который находится под присмотром обученного специалиста по конкретному заболеванию или состоянию.
Необязательно замещенный: В настоящем описании выражение в форме "необязательно замещенный X" (например, необязательно замещенный алкил) является эквивалентным "X, где X является необязательно замещенным" (например, "алкил, где указанный алкил является необязательно замещенным"). Оно не подразумевает значения, что признак "X" (например, алкил) сам по себе необязателен.
Пептид: Как используют в рамках изобретения, "пептид" имеет длину менее или равной 50 аминокислот, например, приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот в длину.
Фармацевтически приемлемый: Выражение "фармацевтически приемлемый" используют в настоящем описании для обозначении соединений, материалов, композиций и/или дозированных форм, которые по мнению квалифицированного медицинского специалиста пригодны для применения в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергического ответа или другой проблемы или осложнения, в соответствии с приемлемым соотношением польза/риск.
Фармацевтически приемлемые эксципиенты: Выражение "фармацевтически приемлемый эксципиент", как используют в рамках изобретения, относится к любому ингредиенту, отличному от соединений, описанных в настоящем описании (например, носитель, способный суспендировать или растворять активное соединение), и обладающему свойством являться по существу нетоксичным и не вызывающим воспаления у индивидуума. Эксципиенты могут включать, например: антиадгезивы, антиоксиданты, связующие вещества, покрытия, добавки для прессования, дезинтегрирующие агенты, красители (красящие вещества), смягчающие средства, эмульгаторы, наполнители (разбавители), пленкообразующие вещества или покрытия, вкусовые добавки, отдушки, вещества, способствующие скольжению (усилители текучести), смазывающие вещества, консерванты, печатные краски, сорбенты, суспендирующие или диспергирующие вещества, подсластители и гидратационную воду. Иллюстративные эксципиенты включают, но не ограничиваются ими: бутилированный гидрокситолуол (BHT), карбонат кальция, фосфат кальция (двухосновный), стеарат кальция, кроскармеллозу, сшитый поливинилпирролидон, лимонную кислоту, кросповидон, цистеин, этилцеллюлозу, желатин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, лактозу, стеарат магния, мальтит, маннит, метионин, метилцеллюлозу, метилпарабен, микрокристаллическую целлюлозу, полиэтиленгликоль, поливинилпирролидон, повидон, преджелатинизированный крахмал, пропилпарабен, ретинилпальмитат, шеллак, диоксид кремния, натрийкарбоксиметилцеллюлозу, цитрат натрия, натрия крахмала гликолят, сорбит, крахмал (кукурузный), стеариновую кислоту, сахарозу, тальк, диоксид титана, витамин A, витамин E, витамин C и ксилит.
Фармацевтически приемлемые соли: Также настоящее изобретение относится к фармацевтически приемлемым солям соединений, описанных в настоящем описании. Как используют в рамках изобретения, "фармацевтически приемлемые соли" относится к производным описанных соединений, где исходное соединение модифицировано путем преобразования существующей части кислоты или основания в ее солевую форму (например, путем реакции группы свободного основания с подходящей органической кислотой). Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, соли минеральных или органических кислот и основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и т.п. Репрезентативные кислотно-аддитивные соли включают ацетат, адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфоросульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептонат, гексаноат, гидробромид, гидрохлорид, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, толуолсульфонат, ундеканоат, валерат и т.п. Репрезентативные соли щелочных или щелочноземельных металлов включают соли натрия, лития, калия, кальция, магния и т.п., а также нетоксичные соли аммония, четвертичные соли аммония и катионов аминов, включая, но не ограничиваясь ими, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. Фармацевтически приемлемые соли по настоящему изобретению включают общепринятые нетоксичные соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основную или кислотную часть, общепринятыми химическими способами. Как правило, такие соли можно получать путем реакции формы свободной кислоты или основания этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе, или в смеси двух из них; как правило, предпочтительными являются неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечень подходящих солей может быть найден в Remington’s Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418, Pharmaceutical Salts: Properties, Selection, и Use, P.H. Stahl and C.G. Wermuth (eds.), Wiley-VCH, 2008, и Berge et al., Journal of Pharmaceutical Science, 66, 1-19 (1977), каждая из которых включена в настоящее описание в качестве ссылки в полном объеме.
Фармакокинетика: Как используют в рамках изобретения, "фармакокинетика" относится к любому одному или нескольким свойствам молекулы или соединения, в отношении определения судьбы вещества, введенного в живой организм. Фармакокинетику подразделяют на несколько областей, включающих степень и скорость всасывания, распределение, метаболизм и экскрецию. Это обычно обозначают как ADME, где: (A) всасывание представляет собой процесс проникновения вещества в кровоток; (D) распределение представляет собой распространение или рассеивание веществ в жидкостях и тканях организма; (M) метаболизм (или биотрансформация) представляет собой необратимую трансформацию исходных соединений в дочерние метаболиты; и (E) экскреция (или элиминация) относится к элиминации веществ из организма. В редких случаях некоторые лекарственные средства необратимо накапливаются в ткани организма.
Фармацевтически приемлемый сольват: Термин "фармацевтически приемлемый сольват", как используют в рамках изобретения, означает соединение по изобретению, где молекулы подходящего растворителя включены в кристаллическую решетку. Подходящий растворитель является физиологически переносимым в вводимой дозировке. Например, сольваты можно получать путем кристаллизации, перекристаллизации или преципитации из раствора, который включает органические растворители, воду или их смесь. Примерами подходящих растворителей являются этанол, вода (например, моно-, ди- и тригидраты), N-метилпирролидинон (NMP), диметилсульфоксид (DMSO), N,N’-диметилформамид (DMF), N,N’-диметилацетамид (DMAC), 1,3-диметил-2-имидазолидинон (DMEU), 1,3-диметил-3,4,5,6-тетрагидро-2-(1H)-пиримидинон (DMPU), ацетонитрил (ACN), пропиленгликоль, этилацетат, бензиловый спирт, 2-пирролидон, бензилбензоат и т.п. Когда вода представляет собой растворитель, сольват называют "гидратом".
Физико-химический: Как используют в рамках изобретения, "физико-химический" означает имеющий отношение или связанный с физическим и/или химическим свойством.
Предупреждение: Как используют в рамках изобретения, термин "предупреждение" относится к частично или полностью замедленному возникновению инфекции, заболевания, нарушения и/или состояния; частичному или полному замедлению возникновения одного или нескольких симптомов, признаков или клинических проявлений конкретной инфекции, заболевания, нарушения и/или состояния; частичному или полному замедлению появления одного или нескольких симптомов, признаков или проявлений конкретной инфекции, заболевания, нарушения и/или состояния; частичному или полному замедлению прогрессирования инфекции, конкретного заболевания, нарушения и/или состояния; и/или уменьшению риска развития патологии, ассоциированной с инфекцией, заболеванием, нарушением /или состоянием.
Пролекарство: Также настоящее изобретение относится к пролекарствам соединений, описанных в настоящем описании. Как используют в рамках изобретения, "пролекарства" относятся к любому веществу, молекуле или элементу, которые находятся в форме, обуславливающей действие этого вещества, молекулы или элемента в качестве терапевтического средства при химическом или физическом изменении. Пролекарства могут быть ковалентно связаны или изолированы каким-либо образом, и они высвобождаются или конвертируются в активную лекарственную часть перед, при или после введения млекопитающему. Пролекарства можно получать путем модификации функциональных групп, присутствующих в соединениях таким образом, что модифицированные группы расщепляются, либо путем стандартного манипулирования, либо in vivo, до исходных соединений. Пролекарства включают соединения, где гидроксильная, амино, сульфгидрильная или карбоксильная группы связаны с любой группой, которая, при введении млекопитающему, отщепляется с образованием свободной гидроксильной, амино, сульфгидрильной или карбоксильной группы, соответственно. Получение и применение пролекарств рассмотрено в T. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems", Vol. 14 of the A.C.S. Symposium Series, и в Bioreversible Drugs in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, обе из которых включены в настоящее описание в качестве ссылок в полном объеме.
Пролиферировать: Как используют в рамках изобретения, термин "пролиферировать" означает расти, распространяться или увеличиваться или обеспечивать быстрый рост, распространение или увеличение. "Пролиферативный" означает обладающий способностью пролиферировать. "Антипролиферативный" означает имеющий свойства, противоположные или не относящиеся к пролиферативным свойствам.
Участок расщепления белка: Как используют в рамках изобретения, "участок расщепления белка" относится к участку, в котором можно проводить контролируемое расщепление аминокислотной цепи химическими, ферментативными или фотохимическими способами.
Сигнал расщепления белка: Как используют в рамках изобретения, "сигнал расщепления белка" относится по меньшей мере к одной аминокислоте, которая метит или маркирует полипептид для расщепления.
Представляющий интерес белок: Как используют в рамках изобретения, термины "представляющие интерес белки" или "желаемые белки" включают белки, предусматриваемые в рамках настоящего изобретения, и их фрагменты, мутанты, варианты и изменения.
Проксимальный: Как используют в рамках изобретения, термин "проксимальный" означает расположенный вблизи центра или представляющей интерес точки или области.
Очищенный: Как используют в рамках изобретения, "очищать", "очищенный", "очистка" означает делать по существу чистым или очищать от нежелательных компонентов, загрязняющих материалов, примесей или дефектных материалов.
Образец: Как используют в рамках изобретения, термин "образец" или "биологический образец" относится к подгруппе его тканей, клеток или составных частей (например, жидкости организма, включая, но не ограничиваясь ими, кровь, слизь, лимфатическую жидкость, синовиальную жидкость, цереброспинальную жидкость, слюну, амниотическую жидкость, амниотическую пуповинную кровь, мочу, вагинальную жидкость и семенную жидкость). Кроме того, образец может включать гомогенат, лизат или экстракт, полученный из целого организма или подгруппы его тканей, клеток или составных частей, или их фракцию или часть, включая, но не ограничиваясь ими, например, плазму, сыворотку, спинномозговую жидкость, лимфу, поверхностные срезы кожи, дыхательных, кишечных и мочеполовых трактов, слезы, слюну, молоко, клетки крови, опухоли, органы. Кроме того, образец относится к среде, такой как питательный бульон или гель, которая может содержать клеточные компоненты, такие как белки или молекула нуклеиновой кислоты.
Сигнальные последовательности: Как используют в рамках изобретения, выражение "сигнальные последовательности" относится к последовательности, которая может направлять транспорт или локализацию белка.
Значительный или значительно: Как используют в рамках изобретения, термины "значительный" или "значительно" используют синонимично с термином "по существу".
Единичная доза: Как используют в рамках изобретения, "единичная доза" представляет собой дозу любого терапевтического средства, введенного в одной дозе/за один раз/одним путем/через одну точку контакта, т.е. событие однократного введения.
Сходство: Как используют в рамках изобретения, термин "сходство" относится к общей родственности между полимерными молекулами, например, между полинуклеотидными молекулами (например, молекулами ДНК и/или молекулами РНК) и/или между полипептидными молекулами. Вычисление процентного сходства полимерных молекул друг с другом можно проводить аналогично вычислению процентной идентичности, за исключением того, что при вычислении процентного сходства учитывают консервативные замены, как понятно в данной области.
Разделенная доза: Как используют в рамках изобретения, "разделенная доза" представляет собой разделение единичной дозы или общей суточной дозы на две или более доз.
Стабильный: Как используют в рамках изобретения "стабильный" относится к соединению, которое является достаточно прочным, чтобы выдержать выделение до подходящей степени чистоты из реакционной смеси, и предпочтительно способно к составлению в эффективное терапевтическое средство.
Стабилизированный: Как используют в рамках изобретения, термин "стабилизировать", "стабилизированный", "стабилизированная область" означает сделать или стать стабильным.
Индивидуум: Как используют в рамках изобретения, термин "индивидуум" или "пациент" относится к любому организму, которому можно вводить композицию по изобретению, например, для экспериментальных, диагностических, профилактических и/или терапевтических целей. Типичные индивидуумы включают животных (например, млекопитающих, таких как мыши, крысы, кролики, не являющиеся человеком приматы и люди) и/или растения.
По существу: Как используют в рамках изобретения, термин "по существу" относится к качественному состоянию проявления полной или практически полной степени или меры представляющей интерес характеристики или свойства. Специалисту в области биологии будет понятно, что биологические и химические явления редко, или даже никогда, достигают завершения и/или протекают до завершенности или достигают или исключают абсолютный результат. Термин "по существу", таким образом, используется в настоящем описании для охвата потенциального отсутствия завершенности, присущей многим биологическим и химическим явлениям.
По существу равный: Как используют в рамках изобретения в отношении временных различий между дозами, термин означает плюс/минус 2%.
По существу одновременно: Как используют в рамках изобретения и в отношении множества доз, термин означает в пределах 2 секунд.
Страдающий от: Индивидуум, который является "страдающим от" заболевания, нарушения и/или состояния, имеет диагностированное у него заболевание, нарушение и/или состояние или проявляет один или несколько их симптомов.
Предрасположенный: Индивидуум, который является "чувствительным" к заболеванию, нарушению и/или состоянию, не имеет диагностированного у него заболевания, нарушения и/или состояния и/или может не проявлять их симптомы, но обладает склонностью к развитию заболевания или его симптомов. В некоторых вариантах осуществления индивидуум, который является предрасположенным к заболеванию, нарушению и/или состоянию (например, злокачественная опухоль), может характеризоваться одним или несколькими из следующих: (1) генетическая мутация, ассоциированная с развитием заболевания, нарушения и/или состояния; (2) генетический полиморфизм, ассоциированный с развитием заболевания, нарушения и/или состояния; (3) увеличенная или сниженная экспрессия и/или активность белка и/или нуклеиновой кислоты, ассоциированных с заболеванием, нарушением и/или состоянием; (4) привычки и/или образ жизни, ассоциированные с развитием заболевания, нарушения и/или состояния; (5) семейный анамнез заболевания, нарушения и/или состояния; и (6) контакт и/или инфицирование микробом, ассоциированным с развитием заболевания, нарушения и/или состояния. В некоторых вариантах осуществления у индивидуума, предрасположенного к заболеванию, нарушению и/или состоянию, разовьется заболевание, нарушение и/или состояние. В некоторых вариантах осуществления у индивидуума, предрасположенного к заболеванию, нарушению и/или состоянию, не разовьется заболевание, нарушение и/или состояние.
Синтетический: Термин "синтетический" означает продуцированный, полученный и/или изготовленный человеком. Синтез полинуклеотидов или полипептидов или других молекул по настоящему изобретению может быть химическим или ферментативным.
Заданные клетки: Как используют в рамках изобретения, "заданные клетки" относятся к любой одной или нескольким представляющим интерес клеткам. Клетки могут находиться in vitro, in vivo, in situ или в ткани или органе организма. Организм может представлять собой любое животное, предпочтительно млекопитающее, более предпочтительно человека и наиболее предпочтительно пациента.
Терапевтическое средство: Термин "терапевтическое средство" относится к любому средству, которое при введении индивидууму обладает терапевтически, диагностическим и/или профилактическим эффектом и/или индуцирует желаемый биологический и/или фармакологический эффект.
Терапевтически эффективное количество: Как используют в рамках изобретения, термин "терапевтически эффективное количество" означает количество средства, подлежащего доставке (например, нуклеиновая кислота, лекарственное средство, терапевтическое средство, диагностическое средство, профилактическое средство и т.д.), которое является достаточным при введении индивидууму, страдающему или предрасположенному к инфекции, заболеванию, нарушению и/или состоянию, для лечения, улучшения симптомов, диагностики, предупреждения и/или замедления возникновения инфекции, заболевания, нарушения и/или состояния.
Терапевтически эффективный исход: Как используют в рамках изобретения, термин "терапевтически эффективный исход" означает исход, который является достаточным у индивидуума, страдающего или предрасположенного к инфекции, заболеванию, нарушению и/или состоянию, для лечения, улучшения симптомов, диагностики, предупреждения и/или замедления возникновения инфекции, заболевания, нарушения и/или состояния.
Общая суточная доза: Как используют в рамках изобретения, "общая суточная доза" представляет собой количество, введенное или назначенное за период 24 ч. Его можно вводить в качестве единичной дозы.
Фактор транскрипции: Как используют в рамках изобретения, термин "фактор транскрипции" относится к ДНК-связывающему белку, который регулирует транскрипцию ДНК в РНК, например, посредством активации или подавления транскрипции. Некоторые факторы транскрипции осуществляют регуляцию транскрипции самостоятельно, в то время как другие факторы действуют совместно с другими белками. Некоторые факторы транскрипции могут как активировать, так и подавлять транскрипцию в определенных условиях. Как правило, факторы транскрипции связывают определенную заданную последовательность или последовательности, высокосходные с определенной консенсусной последовательностью в регуляторной области гена-мишени. Факторы транскрипции могут регулировать транскрипцию гена-мишени отдельно или в комплексе с другими молекулами.
Лечение: Как используют в рамках изобретения, термин "лечение" относится к частичному или полному ослаблению, смягчению, улучшению, облегчению, замедлению возникновения, ингибированию прогрессирования, снижению тяжести и/или снижению встречаемости одного или нескольких симптомов или признаков конкретной инфекции, заболевания, нарушения и/или состояния. Например, "лечение" злокачественной опухоли может относиться к ингибированию выживания, роста и/или распространения опухоли. Лечение можно проводить индивидууму, который не проявляет признаков заболевания, нарушения и/или состояния, и/или индивидууму, который проявляет только ранние признаки заболевания, нарушения и/или состояния, для цели снижения риска развития патологии, ассоциированной с заболеванием, нарушением и/или состоянием.
Немодифицированный: Как используют в рамках изобретения, "немодифицированный" относится к любому веществу, соединению или молекуле перед изменением каким-либо образом. Немодифицированный может, но не всегда, относиться к дикому типу или нативной форме биомолекулы. Молекулы могут претерпевать серию модификаций, когда каждая модифицированная молекула может служить в качестве "немодифицированной" исходной молекулы для последующей модификации.
Эквиваленты и объем
Специалистам в данной области будет понятно или они будут способны определить с использованием не более чем стандартного экспериментирования многие эквиваленты конкретным вариантам осуществления в соответствии с изобретением, описанным в настоящем описании. Объем настоящего изобретения не ограничивается описанным выше описанием, а скорее является таким, как указано в прилагаемой формуле изобретения.
В формуле изобретения форма единственного числа может означать один или несколько, если контекст не указывает на обратное или, в ином случае, если это не очевидно из контекста. Пункты формулы изобретения или описание, включающие "или" между одним или несколькими представителями группы, считаются удовлетворенными, если один, более одного или все из группы представителей присутствуют в, используются в или иным образом имеют отношение к данному продукту или процессу, если не указано обратное, или в ином случае, если не очевидно из контекста. Изобретение включает варианты осуществления, в которых именно один представитель группы присутствует в, используется в или иным образом имеет отношение к данному продукту или процессу. Изобретение включает варианты осуществления, в которых более одного или все из группы представителей присутствуют в, используются в или иным образом имеют отношение к данному продукту или процессу.
Также следует отметить, что термин "содержащий" является открытым и позволяет, но не требует, включение дополнительных элементов или стадий. Когда в настоящем описании используют термин "содержащий", термин "состоящий из", таким образом, также охватывается и описан.
Когда приведены диапазоны, включены конечные значения. Более того, следует понимать, что если нет иных указаний или, в ином случае, если не очевидно из контекста и знаний специалиста в данной области, величины, которые выражены в качестве диапазонов, могут принимать любое конкретное значение или поддиапазон в указанном диапазоне в различных вариантах осуществления изобретения, до десятой части единицы нижней границы диапазона, если контекст явно не указывает на иное.
Кроме того, следует понимать, что любой конкретный вариант осуществления настоящего изобретения, который относится к уровню техники, может быть прямо исключен из любого одного или нескольких пунктов изобретения. Поскольку такие варианты осуществления считаются известными специалисту в данной области, они могут быть исключены, даже если исключение не указано в настоящем описании прямо. Любой конкретный вариант осуществления композиций по изобретению (например, любая нуклеиновая кислота или белок, кодируемый ей; любой способ получения; любой способ применения и т.д.) могут быть исключены из любого одного или нескольких пунктов формулы изобретения по любой причине, как связанной, так и не связанной с существованием уровня техники.
Все цитированные источники, например, ссылки, публикации, базы данных, регистрационные записи в базах данных и статьи, цитированные в настоящем описании, включены в настоящую заявку в качестве ссылок, даже если не указаны прямо в ссылке. В случае противоречия утверждений цитированного источника и настоящей заявки, утверждение в настоящей заявке будет решающим.
ПРИМЕРЫ
Настоящее изобретение дополнительно описано в представленных ниже примерах, которые не ограничивают объем изобретения, описанного в формуле изобретения.
Пример 1. Транскрипция модифицированной мРНК in vitro
A.Материалы и способы
Модифицированные мРНК по изобретению получают с использованием стандартных лабораторных способов и материалов для транскрипции in vitro, за исключением того, что смесь нуклеотидов содержит модифицированные нуклеотиды. Открытая рамка считывания (ORF) представляющего интерес гена фланкируется 5'-нетранслируемой областью (UTR), содержащей мощный сигнал инициации трансляции Козака, и 3'-UTR альфа-глобина, которая терминируется последовательностью олиго(dT) для присоединения по матрице поли-A-концевой части к мРНК, не включающим аналоги аденозина. Содержащие аденозин мРНК синтезируют без последовательности олиго(dT), чтобы обеспечить посттранскрипционное добавление поли-(A)-концевой части поли(A)-полимеразой.
Модифицированные мРНК можно модифицировать для снижения клеточного врожденного иммунного ответа. Модификации для снижения клеточного ответа могут включать псевдоуридин (ψ) и 5-метилцитидин (5meC, 5mc или m5C). (См., Kariko K et al. Immunity 23:165-75 (2005), Kariko K et al. Mol Ther 16:1833-40 (2008), Anderson B.R. et al. NAR (2010); включенную в настоящее описание в качестве ссылки).
ORF также может включать вышележащие или нижележащие вставки (такие как, но не ограничиваясь ими, β-глобин, метки и т.д.), может быть упорядочена с помощью оптимизирующей программы, такой как, но не ограничиваясь этим, ДНК2.0 (Menlo Park, CA), и может содержать множество участков клонирования, которые могут иметь участок распознавания XbaI. После получения конструкции ее можно воспроизводить и трансформировать в химически компетентные E. coli.
Для настоящего изобретения используют компетентные клетки E. coli NEB DH5-alpha. Трансформацию проводят в соответствии с инструкциями NEB с использованием 100 нг плазмиды. Протокол является следующим:
Разморозить пробирку компетентных клеток E. coli NEB 5-alpha на льду в течение 10 минут.
Добавить 1-5 мкл с 1 пг-100 нг плазмиды ДНК в клеточную культуру. Осторожно постучать по пробирке 4-5 раз для смешения клеток и ДНК. Не встряхивать.
Поместить смесь на лед на 30 минут. Не перемешивать.
Выполнить тепловой шок при 42°C в течение 30 секунд. Не перемешивать.
Поместить на лед на 5 минут. Не перемешивать.
Добавить в смесь пипеткой 950 мкл SOC комнатной температуры.
Поместить в условия при 37°C на 60 минут. Энергично встряхивать (250 об/мин) или качать.
Нагреть чашки для селекции до 37°C.
Перемешать клетки тщательно путем постукивания по пробирке и переворачивания.
Распределить 50-100 мкл каждого разведения на чашку для селекции и инкубировать в течение ночи при 37°C. Альтернативно инкубировать при 30°C в течение 24-36 часов или 25°C в течение 48 часов.
Затем единичную колонию используют для инокуляции 5 мл среды для роста LB с использованием подходящего антибиотика, а затем позволяют расти (250 об/мин, 37°C) в течение 5 часов. Затем ее используют для инокуляции 200 мл культуральной среды и позволяют расти в течение ночи в тех же условиях.
Для выделения плазмиды (вплоть до 850 мкг) проводят maxi prep с использованием набора Invitrogen PURELINK™ HiPure Maxiprep Kit (Carlsbad, CA), в соответствии с инструкциями изготовителя.
Для получения кДНК для транскрипции In Vitro (IVT), плазмиду (пример которой представлен на фиг.3) сначала линеаризуют с использованием фермента рестрикции, такого как XbaI. Типичное рестрикционное расщепление посредством XbaI будет включать следующее: 1,0 мкг плазмиды; 1,0 мкл 10x буфера; 1,5 мкл XbaI; вплоть до 10 мкл dH20; инкубируемые при 37°C в течение 1 ч. При выполнении в лабораторном масштабе (<5 мкг) реакционную смесь очищают с использованием набора Invitrogen’s PURELINK™ PCR Micro Kit (Carlsbad, CA) согласно инструкциям изготовителя. Может потребоваться очистка в большем масштабе с помощью продукта, который имеет большую нагрузочную способность, такого как стандартный набор Invitrogen PURELINK™ PCR Kit (Carlsbad, CA). После очистки линеаризованный вектор количественно определяют с использованием NanoDrop и анализируют для подтверждения линеаризации с использованием агарозного гель-электрофореза.
B. Агарозный гель-электрофорез модифицированной мРНК
Индивидуальные модифицированные мРНК (200-400 нг в объеме 20 мкл) наносят на лунку неденатурирующего 1,2% агарозного геля с Agarose E-Gel (Invitrogen, Carlsbad, CA) и разделяют в течение 12-15 минут в соответствии с протоколом изготовителя.
C. Агарозный гель-электрофорез продуктов ОТ-ПЦР
Индивидуальные обратно транскрибированные продукты ПЦР (200-400 нг) наносят на лунку неденатурирующего 1,2% агарозного геля Agarose E-Gel (Invitrogen, Carlsbad, CA) и разделяют в течение 12-15 минут в соответствии с протоколом изготовителя.
D. Количественное определение модифицированной мРНК с помощью Nanodrop и данные УФ-спектров
Модифицированные мРНК в буфере TE (1 мкл) используют для считывания поглощения в УФ области на Nanodrop для количественного определения каждой модифицированной мРНК из реакции транскрипции in vitro (кривые поглощения в УФ области не представлены).
Пример 2. Трансфекция модифицированной мРНК
A. Обратная трансфекция
Для экспериментов, проводимых в 24-луночных покрытых коллагеном планшетах для культивирования тканей, кератиноциты высевают при плотности клеток 1×105. Для экспериментов, проводимых в 96-луночных покрытых коллагеном планшетах для культивирования тканей, кератиноциты высевают при плотности клеток 0,5×105. Для каждой модифицированной мРНК, подлежащей трансфекции, модифицированную мРНК:RNAIMAXTM получают, как описано, и смешивают с клетками в многолуночном планшете в течение 6 часов после посева клеток до того, как клетки прикрепились к планшету для культивирования тканей.
B. Прямая трансфекция
В 24-луночном покрытом коллагеном планшете для культивирования тканей кератиноциты высевают при плотности клеток 0,7×105. Для экспериментов, проводимых в 96-луночном покрытом коллагеном культуральном планшете, кератиноциты высевают при плотности клеток 0,3×105. Затем кератиноциты выращивают до смыкания монослоя >70% в течение 24 часов. Для каждой модифицированной мРНК, подлежащей трансфекции, модифицированную мРНК:RNAIMAXTM получают, как описано, и трансфицируют в клетки в многолуночном планшете в течение 24 часов после посева клеток и прикрепления к планшету для культивирования тканей.
C. Скрининг трансляции модифицированной мРНК: ELISA для G-CSF
Кератиноциты выращивают в среде EpiLife с добавкой S7 от Invitrogen до смыкания монослоя >70%. Кератиноциты подвергают обратной транскрипции с 300 нг указанной химически модифицированной мРНК в комплексе с RNAIMAXTM от Invitrogen. Альтернативно, кератиноциты подвергают прямой трансфекции 300 нг модифицированной мРНК в комплексе с RNAIMAXTM от Invitrogen. Комплекс РНК:RNAIMAXTM формируют путем первоначальной инкубации РНК с средой без добавок EPILIFE® в 5X разведении по объему в течение 10 минут при комнатной температуре.
Во второй емкости реагент RNAIMAXTM инкубируют со средой без добавок EPILIFE® в 10X разведении по объему в течение 10 минут при комнатной температуре. Затем емкость с РНК смешивают с емкостью с RNAIMAXTM и инкубируют в течение 20-30 при комнатной температуре, а затем капельно добавляют к клеткам. Концентрацию секретируемого huG-CSF в культуральной среде измеряют через 18 часов после трансфекции для каждой из химически модифицированных мРНК в трех экземплярах. Секрецию гранулоцитарного колониестимулирующего фактора (G-CSF) человека из трансфицированных кератиноцитов человека количественно определяют с использованием набора для ELISA от Invitrogen или R&D Systems (Minneapolis, MN) в соответствии с инструкциями изготовителя.
D. Доза модифицированной мРНК и продолжительность: ELISA для G-CSF
Кератиноциты выращивают в среде EPILIFE® с добавкой S7 от Invitrogen при смыкании монослоя >70%. Кератиноциты подвергают обратной транскрипции с 0 нг, 46,875 нг, 93,75 нг, 187,5 нг, 375 нг, 750 нг или 1500 нг модифицированной мРНК в комплексе с RNAIMAXTM от Invitrogen. Комлекс модифицированная мРНК:RNAIMAXTM формируют так, как описано. Концентрацию секретируемого huG-CSF в культуральной среде измеряют через 0, 6, 12, 24 и 48 часов после трансфекции для каждой концентрации каждой модифицированной мРНК в трех экземплярах. Секрецию гранулоцитарного колониестимулирующего фактора (G-CSF) человека из трансфицированных кератиноцитов человека количественно определяют с использованием набора для ELISA от Invitrogen или R&D Systems в соответствии с инструкциями изготовителя.
Пример 3. Клеточный врожденный иммунный ответ на модифицированные нуклеиновые кислоты: ELISA для IFN-бета и ELISA TNF-альфа
Твердофазный иммуноферментный анализ (ELISA) для фактора некроза опухоли-α (TNF-α) человека, интерферона-β (IFN-β) человека и гранулоцитарного колониестимулирующего фактора (G-CSF) человека, секретируемого из трансфицированных invitro клеток, исследуют для обнаружения клеточного врожденного иммунного ответа.
Кератиноциты выращивают в среде EPILIFE® с добавкой для роста кератиноцитов человека без гидрокортизона от Invitrogen при смыкании монослоя >70%. Кератиноциты подвергают обратной транскрипции с 0 нг, 93,75 нг, 187,5 нг, 375 нг, 750 нг, 1500 нг или 3000 нг указанной химически модифицированный мРНК в комплексе с RNAIMAXTM от Invitrogen, как описано, в трех экземплярах. Секретируемый TNF-α в культуральной среде измеряют через 24 часа после трансфекции для каждой из химически модифицированных мРНК с использованием набора для ELISA от Invitrogen в соответствии с протоколами изготовителя.
Секретируемый IFN-β количественно определяют через 24 часа после трансфекции для каждой из химически модифицированных мРНК с использованием набора для ELISA от Invitrogen в соответствии с протоколами изготовителя. Концентрацию секретируемого hu-G-CSF измеряют через 24 часа после трансфекции для каждой из химически модифицированных мРНК. Секрецию гранулоцитарного колониестимулирующего фактора (G-CSF) человека из трансфицированных кератиноцитов человека количественно определяют с использованием набора для ELISA от Invitrogen или R&D Systems (Minneapolis, MN) в соответствии с инструкциями изготовителя. Эти данные указывают на то, какая из модифицированных мРНК способна индуцировать сниженный врожденный клеточный иммунный ответ по сравнению с природными и другими химически модифицированными полинуклеотидами или эталонными соединениями путем измерения иллюстративных цитокинов 1 типа TNF-альфа и IFN-бета.
Пример 4. Анализ пролиферации клеток, индуцированных модифицированной мРНК гранулоцитарного колониестимулирующего фактора человека
Кератиноциты человека выращивают в среде EPILIFE® с добавкой S7 от Invitrogen при смыкании монослоя >70% в 24-луночном покрытом коллагеном планшете для сокультивирования тканей TRANSWELL® (Corning, Lowell, MA). Кератиноциты подвергают обратной транскрипции с 750 нг указанной химически модифицированной мРНК в комплексе с RNAIMAXTM от Invitrogen, как описано, в трех экземплярах. Комплекс модифицированная мРНК:RNAIMAXTM формируют, как описано. Среду для кератиноцитов заменяют 6-8 часов после трансфекции. Через 42 часа после трансфекции, вкладыш в 24-луночный планшет TRANSWELL® с полупроницаемой полиэфирной мембраной с размером пор 0,4 мкм помещают в культуральный планшет, содержащий кератиноциты, трансфицированные модифицированной мРНК hu-G-CSF.
Миелобластные клетки человека, клетки Kasumi-1 или KG-1 (0,2×105 клеток), высевают в лунку с вкладышем, и пролиферацию клеток количественно определяют через 42 часа после начала сокультивирования с использованием анализа пролиферации клеток CyQuant Direct Cell Proliferation Assay (Invitrogen) в объеме 100-120 мкл в 96-луночном планшете. Пролиферацию миелобластных клеток, индуцированную hu-G-CSF, кодируемым модифицированной мРНК, выражают в качестве процентной клеточной пролиферации, нормализованной к не подвергнутым трансфекции контрольным лункам с сокультурой кертиноциты/миелобласты. Концентрацию секретируемого hu-G-CSF в лунках сокультуры кератиноцитов и миелобластов измеряют через 42 часа после начала сокультивирования для каждой модифицированной мРНК в двух экземплярах. Секрецию гранулоцитарного колониестимулирующего фактора (G-CSF) человека количественно определяют с использованием набора для ELISA от Invitrogen в соответствии с инструкциями изготовителя.
Трансфицированную модифицированную мРНК hu-G-CSF в питающих клетках кератиноцитов человека и нетрансфицированных миелобластных клетках человека выявляют способом ОТ-ПЦР. Тотальную РНК из образцов клеток экстрагируют и лизируют с использованием набора RNAEASY® (Qiagen, Valencia, CA) в соответствии с инструкциями изготовителя. Экстрагированную тотальную РНК подвергают ОТ-ПЦР для специфической амплификации модифицированной мРНК G-CSF с использованием набора PROTOSCRIPT® M-MuLV Taq RT-PCR kit (New England BioLabs, Ipswich, MA) в соответствии с инструкциями изготовителя со специфичными к hu-G-CSF праймерами. Продукты ОТ-ПЦР визуализируют электрофорезом в 1,2% агарозном геле.
Пример 5. Цитотоксичность и апоптоз
В этом эксперименте демонстрируется жизнеспособность клеток, цитотоксичность и апоптоз для различных трансфицированных модифицированной мРНК клеток кератиноцитов человека in vitro. Кератиноциты выращивают в среде EPILIFE® с добавкой для роста кератиноцитов человека без гидрокортизона от Invitrogen при смыкании монослоя >70%. Кератиноциты подвергают обратной трансфекции с 0 нг, 46,875 нг, 93,75 нг, 187,5 нг, 375 нг, 750 нг, 1500 нг, 3000 нг или 6000 нг модифицированной мРНК в комплексе с RNAIMAXTM от Invitrogen. Формируют комплекс модифицированная мРНК:RNAIMAXTM. Концентрацию секретируемого huG-CSF в культуральной среде измеряют через 0, 6, 12, 24 и 48 часов после трансфекции для каждой концентрации каждой модифицированной мРНК в трех экземплярах. Секрецию гранулоцитарного колониестимулирующего фактора (G-CSF) человека из трансфицированных кератиноцитов человека количественно определяют с использованием набора для ELISA от Invitrogen или R&D Systems в соответствии с инструкциями изготовителя. Жизнеспособность, цитотоксичность и апоптоз клеток измеряют через 0, 12, 48, 96 и 192 часа после трансфекции с использованием набора APOTOX-GLOTM от Promega (Madison, WI) в соответствии с инструкциями изготовителя.
Пример 6. Среда для сокультивирования
Модифицированная мРНК, содержащая химически отличающиеся модифицированные нуклеотиды, кодирующие гранулоцитарный колониестимулирующий фактор (G-CSF) человека, может стимулировать пролиферацию некомпетентных для трансфекции клеток в среде для сокультивирования. Сокультура включает высокотрансфицируемый тип клеток, таких как кератиноциты, и некомпетентный для трансфекции тип клеток, таких как лейкоциты (WBC). Модифицированную мРНК, кодирующую G-CSF, можно трансфицировать в высокотрансфицируемые клетки, обеспечивая продуцирование и секрецию белка G-CSF во внеклеточную среду, где G-CSF действует подобным паракринному образом, стимулируя пролиферацию лейкоцитов, экспрессирующих рецептор G-CSF. Увеличенную в количестве популяцию WBC можно использовать для лечения пациентов с иммунодефицитом или частичного восстановления популяции WBC у иммунодефицитного пациента и, таким образом, снижения риска оппортунистических инфекций.
В другом примере высокотрансфицируемую клетку, такую как фибробласт, трансфицируют определенными факторами роста для способствования и стимуляции роста, поддержания или дифференцировки слаботрансфицируемых эмбриональных стволовых клеток или индуцированных плюрипотентных стволовых клеток.
Пример 7. Кэппирование 5’-гуанозином на модифицированных нуклеиновых кислотах (модифицированных мРНК)
A. Материалы и способы
Клонирование, синтез генов и секвенирование вектора проводили с помощью DNA2.0 Inc. (Menlo Park, CA). ORF подвергали рестрикционному расщеплению с использованием XbaI и использовали для синтеза кДНК с использованием ПЦР с наращиванием концевой части или без наращивания концевой части. Продукт кДНК ПЦР с наращиванием концевой части использовали в качестве матрицы для реакции синтеза модифицированной мРНК с использованием 25 мкМ каждой смеси модифицированных нуклеотидов (все модифицированные нуклеотиды были синтезированы на заказ и приобретены от TriLink Biotech, San Diego, CA за исключением пирроло-C трифосфата, приобретенного от Glen Research, Sterling VA; немодифицированные нуклеотиды приобретали от Epicenter Biotechnologies, Madison, WI) и набора для полного синтеза мРНК CellScript MEGASCRIPT™ (Epicenter Biotechnologies, Madison, WI). Реакцию транскрипции in vitro проводили в течение 4 часов при 37°C. К модифицированным мРНК, включающим аналоги аденозина, добавляли поли(A)-концевую часть с использованием дрожжевой поли(A)-полимеразы (Affymetrix, Santa Clara, CA). В реакции ПЦР использовали HiFi PCR 2X MASTER MIX™ (Kapa Biosystems, Woburn, MA). Модифицированные мРНК подвергали посттранскрипционному кэппированию с использованием рекомбинантного фермента для кэппирования вируса коровьей оспы (New England BioLabs, Ipswich, MA) и рекомбинантной 2’-o-метилтрансферазы (Epicenter Biotechnologies, Madison, WI) для получения структуры 5’-гуанозин-кэп 1. Структуру кэпа 2 и структуры кэпа 2 можно получать с использованием дополнительных 2’-o-метилтрансфераз. Транскрибированный in vitro продукт мРНК разделяли на агарозном геле и визуализировали. Модифицированную мРНК очищали с помощью набора для очистки Ambion/Applied Biosystems (Austin, TX) MEGAClear RNA™ purification kit. В случае ПЦР использовали бор для очистки PURELINK™ PCR purification kit (Invitrogen, Carlsbad, CA). Продукт количественно определяли на устройстве NANODROP™ UV Absorbance (ThermoFisher, Waltham, MA). Качественное определение, качественное определение поглощения в УФ-области и визуализацию продукта проводили на 1,2% агарозном геле. Продукт ресуспендировали в буфере TE.
B. 5’-кэппирование структуры модифицированной нуклеиновой кислоты (мРНК)
5’-Кэппирование модифицированной РНК можно осуществлять одновременно с реакцией транскрипции in vitro с использованием следующих химических аналогов РНК-кэпа для получения структуры кэпа 5’-гуанозина в соответствии с протоколами изготовителя: 3´-0-Me-m7G(5')ppp(5')G (кэп ARCA); G(5')ppp(5')A; G(5')ppp(5')G; m7G(5')ppp(5')A; m7G(5')ppp(5')G (New England BioLabs, Ipswich, MA). 5’-Кэппирование модифицированной мРНК можно осуществлять посттранскрипционно с использованием фермента для кэппирования вируса коровьей оспы с получением структуры "кэп 0":m7G(5')ppp(5')G (New England BioLabs, Ipswich, MA). Структуру кэпа 1 можно получать с использованием как фермента для кэппирования вируса коровьей оспы, так и 2’-O-метилтрансферазы с получением: m7G(5')ppp(5')G-2’-O-метила. Структуру кэпа 2 можно получать из структуры кэпа 1 с последующим 2’-o-метилированием третьего с 5’-конца нуклеотида с использованием 2’-O-метилтрансферазы. Структуру кэпа 3 можно получать из структуры кэпа 2 с последующим 2’-o-метилированием четвертого с 5’-конца нуклеотида с использованием 2’-O-метилтрансферазы. Ферменты предпочтительно происходят из рекомбинантного источника.
После трансфекции в клетки млекопитающих модифицированные мРНК обладают стабильностью 12-18 часов или более 18 часов, например, 24, 36, 48, 60, 72 или более 72 часов.
Пример 8. Синтез N4-метилцитидина (соединение 1) и N4-метил-CTP (NTP указанного соединения)

Уридин подвергали силилированию с получением трисилилированного соединения, которое очищали на колонке, активировали посредством POCl3/триазола двойной перегонки в безводных условиях, а затем подвергали нуклеофильному замещению с 40% водным раствором метиламина. Таким образом, после хроматографической очистки получали N4-метил-2’,3’,5’-три-O-TBDMS-цитидин. Из полученного продукта удаляли защитную группу с помощью TBAF, а затем очищали с помощью системы растворителей этанол-этилацетат (3:1) с получением соединения 1. Конечный продукт охарактеризовывали с помощью ЯМР (в DMSO); MS: 258 (M+H)+, 280 (M+Na)+ и 296 (M+K)+; и ВЭЖХ: чистота 99,35% (фиг.1A-1D). Чистота при ВЭЖХ 98% (фиг.2).
Пример 9. Синтез 2’-OMe-N,N-ди-Me-цитидина (соединение 1) и 2’-OMe-N,N-ди-Me-CTP (NTP указанного соединения)
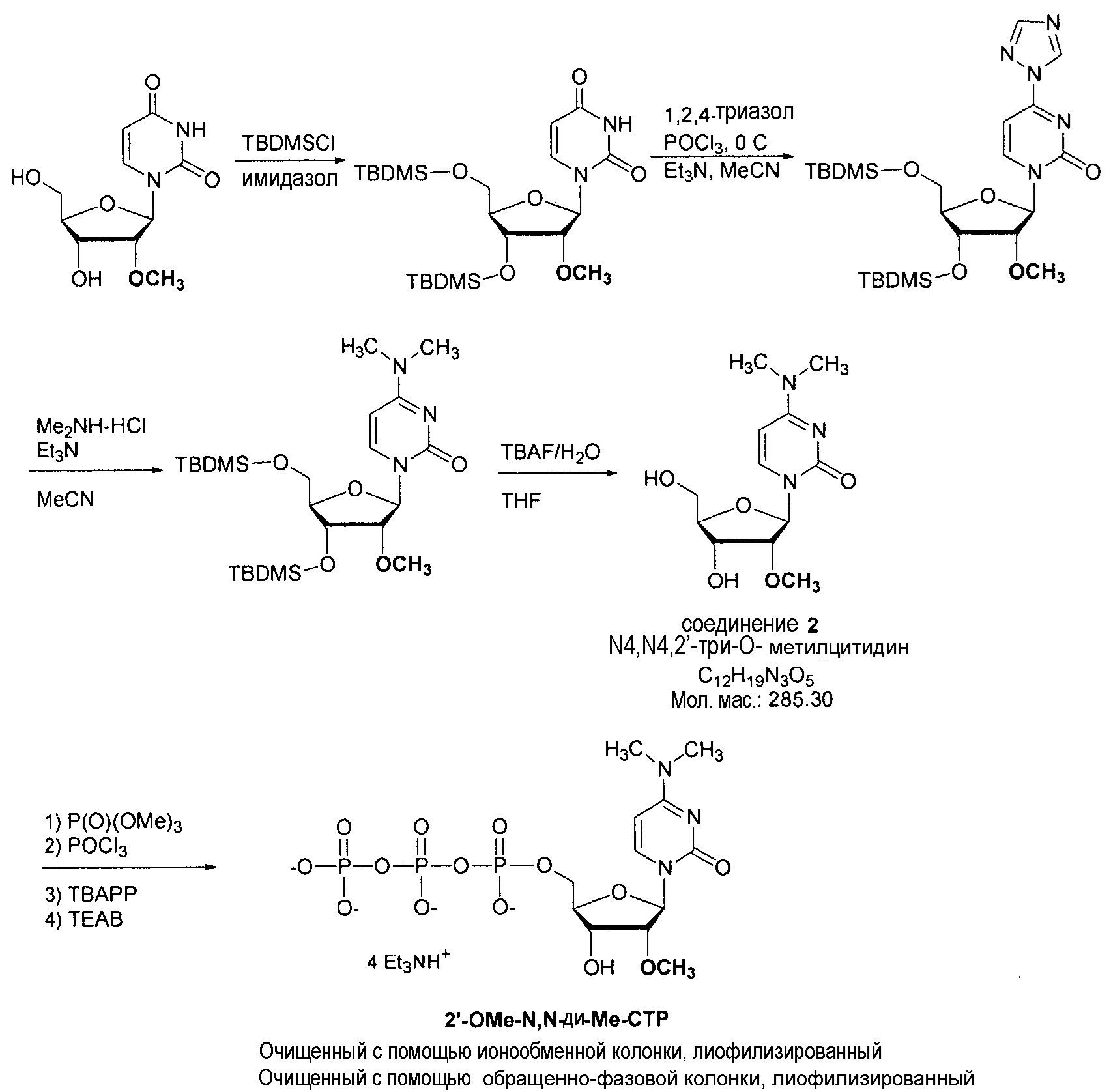
2’-O-Метилуридин подвергали силилированию с получением дисилилированного соединения. Очищенный 2’-O-метил-3’,5’-ди-O-TBDMS-уридин активировали посредством POCl3 и имидазола двойной перегонки в безводных условиях, а затем подвергали нуклеофильному замещению с гидрохлоридом диметиламина в среде с триэтиламином для улавливания HCl. Промежуточное соединение N4,N4,2’-три-O-метил-3’,5’-бис-O-TBDMS-уридин очищали флэш-хроматографией и получали в виде белого вспененного вещества. Из полученного соединения удаляли защитную группу с помощью TBAF, а затем очищали с получением ~400 мг конечного продукта соединения 2 в виде белого вспененного вещества. ES MS: m/z 308 (M+Na)+, 386 (M+H)+; ВЭЖХ: чистота 99,49% (фиг.3A-3C).
Для синтеза соответствующего NTP, 70 мг нуклеозидного соединения 2 обеспечивало 23 мг 2’-OMe-N,N-ди-Me-CTP после очистки на ионообменной и обращенно-фазовой колонках. ВЭЖХ: чистота 95% (фиг.4).
Пример 10. Синтез 5-метоксикарбонилметоксиуридина (соединение 3) и 5-метоксикарбонилметокси-UTP (NTP указанного соединения)
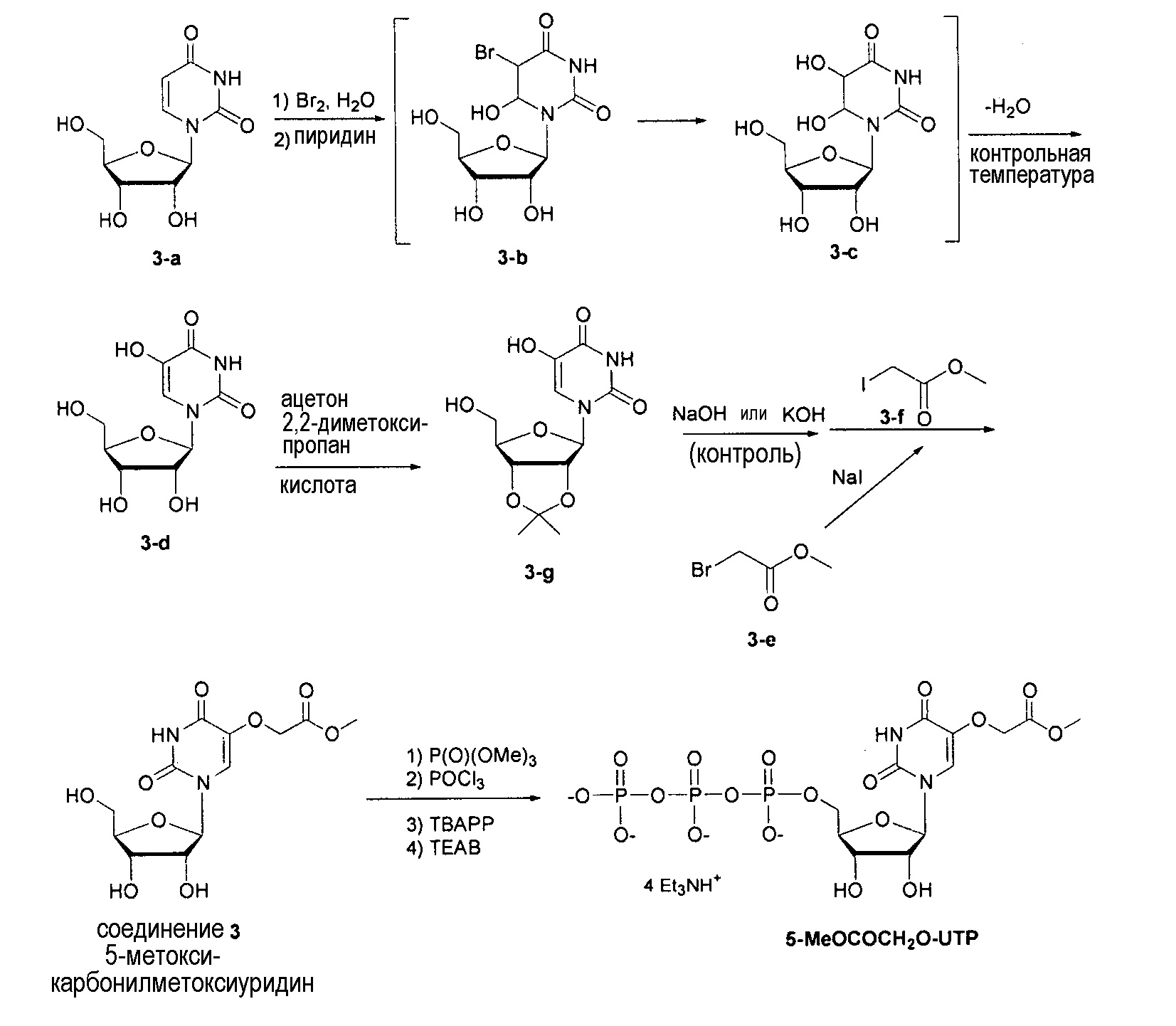
Уридин 3-a в воде обрабатывали избыточным количеством брома, а затем продували воздухом для удаления брома. Реакционную смесь обрабатывали пиридином при контролируемой скорости и температуре. В процессе реакции нестабильное промежуточное соединение с бромом 3-b постепенно преобразовывалось в промежуточное соединение с ди-гидроксилом 3-c, которое, предположительно, дегидратировалось до стабильного 5-гидроксиуридина 3-d. Затем в 5-гидроксиуридин вносили защитную 2’,3’-изопропилиденовую группу с получением соединения 3-g. Реакция с соединением 3-f обеспечивала соединение 3.
60-70 мг нуклеозида обеспечивало >21 мг желаемого трифосфата после двух стадий очистки на колонке ВЭЖХ и двух стадий лиофилизации. ВЭЖХ: чистота 98% (фиг.5).
Пример 11. Синтез 3-метилпсевдоуридина (соединение 2) и 3-метилпсевдо-UTP (NTP указанного соединения)

Псевдоуридин 4-a подвергали реакции с Ac2O с получением ацетил-защищенного псевдоуридина 4-b. Затем N1 подвергали селективной защите с помощью POM с получением соединения 4-c. Метилирование N3 с последующим удалением защитной группы обеспечило соединение 4 (~400 мг). Молекулярная формула: C10H14N2O6, молекулярная масса: 258,23 г/моль; внешний вид: белое твердое вещество; условиях хранения: хранить при 25°C; ВЭЖХ: чистота 98,51%;1H ЯМР(DMSO-d6): δ 11,17 (д, 1H, J=3,0 Гц), 7,56 (д, 1H, J=3,6 Гц), 4,91 (д, 1H, J=3,6 Гц), 4,79 (т, 1H, J=4,2 Гц), 4,70 (д, 1H, J=4,2 Гц), 4,49 (д, 1H, J=3,0 Гц), 3,82-3,88 (м, 2H), 3,66-3,67 (м, 1H), 3,57-3,61 (м, 1H), 3,40-3,47 (м, 1H), 3,09 (с, 3H); MS: 281 (M+Na)+) (фиг.6A и 6B).
Альтернативные пути можно использовать для получения соединения 4. Например, псевдоуридин можно повергать реакции с O-защитной группой (например, как описано в настоящем описании, такой как TMS) и подвергать реакции с N-защитной группой (например, как описано в настоящем описании, такой как ацетил в N1). Затем N3 основания нуклеиновой кислоты можно подвергать реакции с алкилирующим средством (например, диметиламин/диметоксиметил) с получением соединения 4, имеющего N- и O-защитные группы. Наконец, из полученного соединения можно удалять защитную группу (например, в щелочных условиях, таких как NH3/MeOH) с получением соединения 4.
Пример 12. Синтез N-Ac, 5-Ac-OCH2-цитидина(соединение 5)

В уридин 5-a вносили защитную группу с получением соединения изопропилидена 5-b, которое подвергали реакции с (CHCO)n. Уксусную кислоту с каталитическим количеством TFA использовали для получения желаемого селективно ацилированного соединения 5-f (выход 30%). Дальнейшее тритилирование группы 5’-OH приводило к желаемому ортогонально защищенному соединению 5-g.
Соединение 5-g обрабатывали POCl3 и триазолом с получением соединения 5-h вместе с деацилированным соединением 5-i. Ацетилирование этих двух соединений обеспечило деацилированное полностью защищенное соединение 5-j. Удаление защитной группы из соединения 5-j с помощью уксусной кислоты в условиях нагревания приводило к трем продуктом, одним из которых было соединение 5.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Для получения соединения 5 можно использовать альтернативные пути, такие как начиная с цитидина в качестве исходного материала. В таких случаях 5-положение можно подвергать реакции с галогеном или галогенирующим агентом (например, любым из описанных в настоящем описании, таким как I2/мета-хлорпероксибензойная кислота), который можно вытеснять алкилирующим агентом. Кроме того, такие способы могут включать использование одной или нескольких N- или O-защитных групп (например, любых из описанных в настоящем описании, как например, силилирование и ацетилирование) для защиты аминогруппы цитидина и/или гидроксильных групп части сахара.
Пример 13. Синтез 5-TBDMS-OCH2-цитидина (соединение 6)
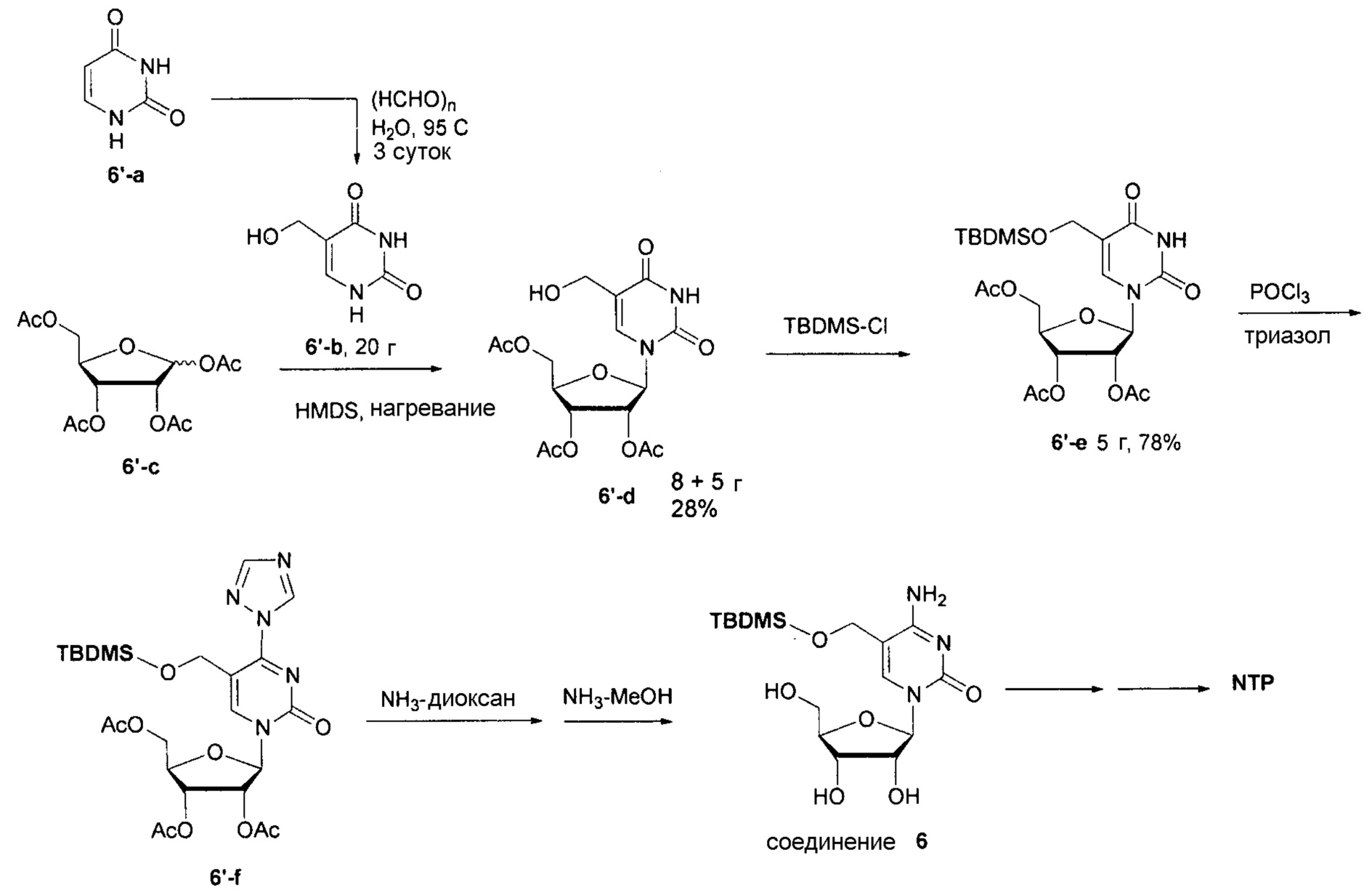
Соединение 5-гидроксиурацила ’-b гликозилировали с получением соединения 6’-d (выход 28%), которое подвергали силилированию с получением соединения 6’-e. Активация защищенного уридина обеспечивала желаемое соединение 6 после дальнейшего аминирования и удаления защитной группы (800 мг конечного соединения). Молекулярная формула: C16H29N3O6Si; молекулярная масса: 387,50 6 г/моль; внешний вид: белое твердое вещество; условия хранения: хранить при 25°C; ВЭЖХ: чистота 97,57%;1H ЯМР (CDCl3): δ 7,81 (с, 1H), 7,40 (уш.с, 1H), 6,49 (уш.с, 1H), 5,79 (д, 1H, J=2,4 Гц), 5,3-5,32 (м, 1H), 5,00-5,07 (м, 2H), 4,30-4,45 (м, 2H), 3,90-3,94 (м, 2H), 3,80-3,83 (м, 1H), 3,50-3,70 (м, 2H), 0,87 (с, 9H), 0,05 (с, 6H); MS: 388 (M+H)+, 410 (M+Na)+ (фиг.7A-7C).
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 14. Синтез 5-трифторметилцитидина (соединение 7)
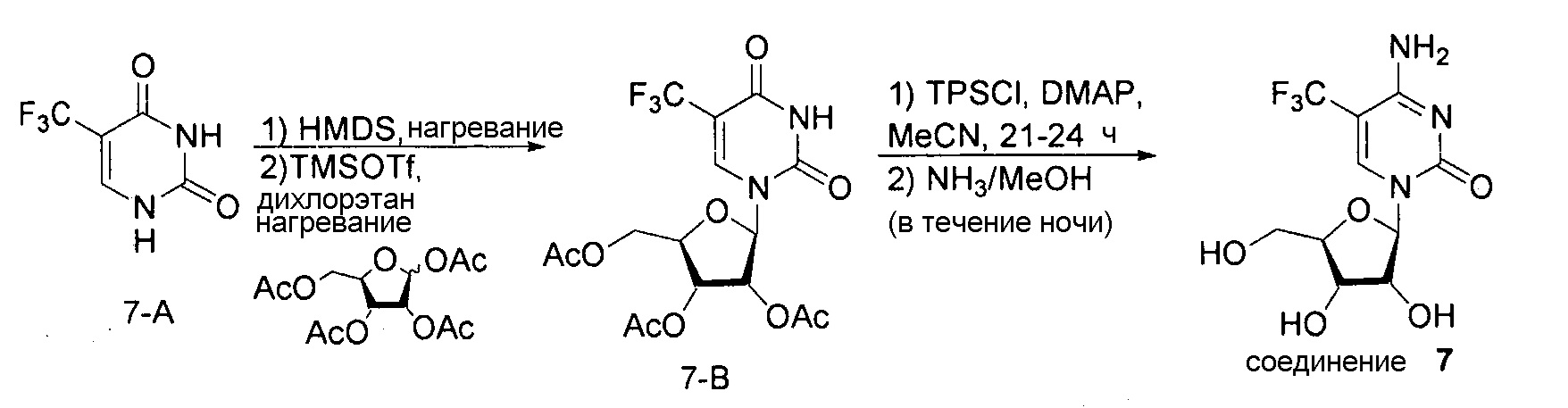
Соединение 7-A гликозилировали с получением соединения 7-B, которое обрабатывали 2,4,6-триизопропилбензолсульфонилхлоридом (TPSCl) для активации карбонильной группы и для обеспечения восстановительного аминирования. Удаление защитной группы обеспечивало соединение 7. Вместо TPSCl можно использовать альтернативные активирующие агенты, такие как 2,4,6-триметилбензолсульфонилхлорид.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 15. Синтез 5-трифторметилуридина (соединение 8)

5-Трифторметилурацил 8-A гликозилировали тетра-O-ацетилрибозой и желаемый тризащищенный 5-трифторметилуридин 8-B получали с высоким выходом. Дальнейшее удаление защитной группы обеспечило желаемое соединение 8, которое охарактеризовывали с помощью результатов ЯМР, MS и ВЭЖХ. MS: 313 (M+H)+, 335 (M+Na)+; ВЭЖХ: чистота 98,87% (фиг.8A-8C).
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 16. Синтез 5-(метоксикарбонил)метилуридина (соединение 9)

9-e
В уридин 9-a вносили защитную группу с получением соединения 9-b (выход 98%). Это соединение бромировали избытком брома в присутствии уксусного ангидрида и уксусной кислоты. Получали 5-бром-аналог 9-c (выход 60%) и далее подвергали бензоилированию с получением желаемого соединения 9-d (выход 64%). 5-Бром-соединение 9-d конденсировали с диметилмалонатом в щелочных условиях с получением арилированного малоната и полностью защищенного сложного диэфира 9-e (выход 50%). После декарбоксилирования и удаления защитной группы получали соединение 9, подтвержденное с помощью ЯМР (фиг.9).
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 17. Синтез 5-(метоксикарбонил)метил-2'-O-метилуридина (2-OMe-MCM5U) (соединение 10)
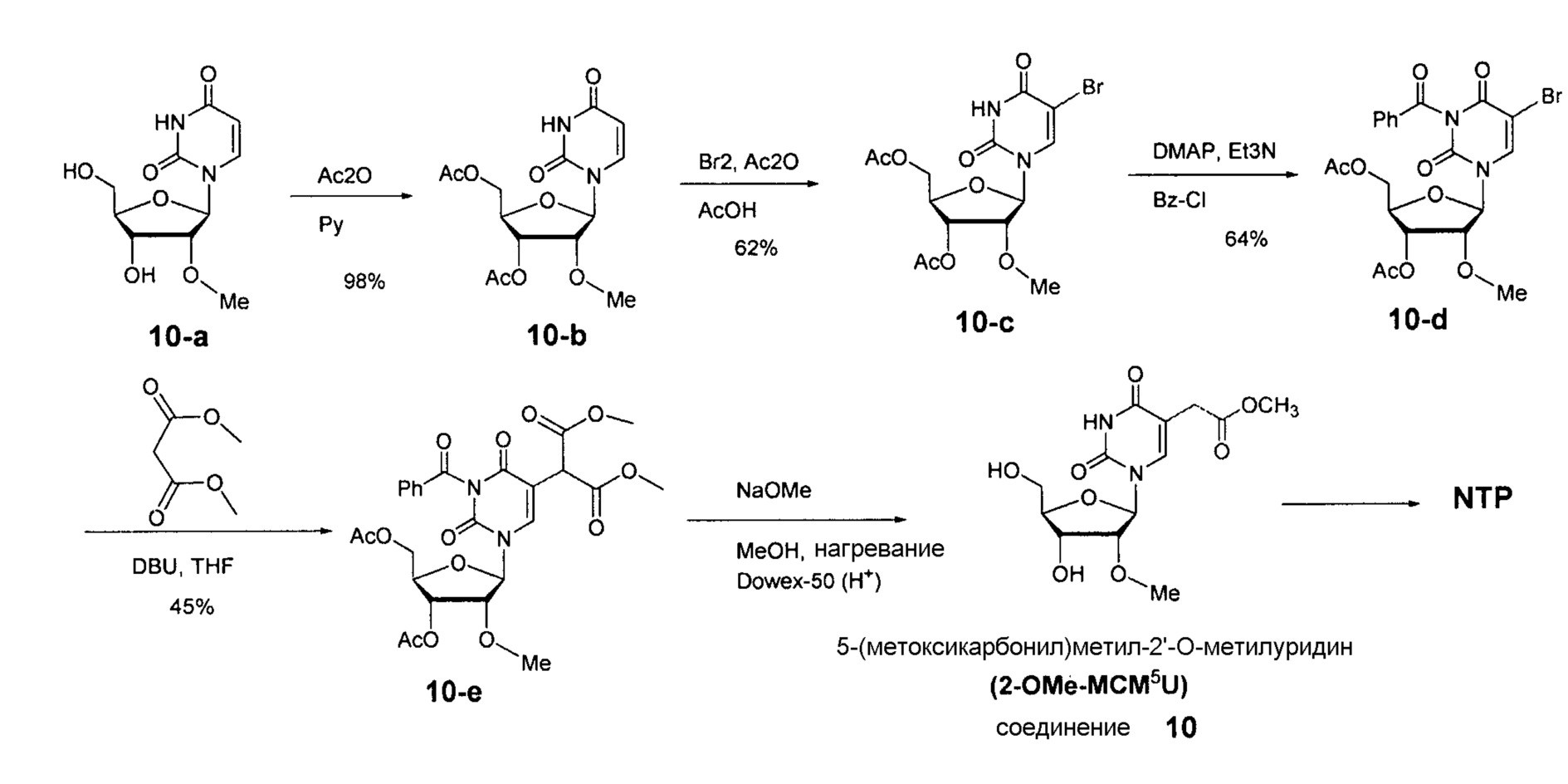
Аналогично стратегии синтеза соединения 9, выше, 2’-O-метилуридин 10-a подвергали ацилированию и бромировали с получением соединения 10-c. Дальнейшее бензоилирование обеспечило 5-бром-аналог 10-d, который конденсировали с диметилмалонатом с получением продукта 10-e (выход 45%). Декарбоксилирование и удаление защитной группы обеспечило соединение 10.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 18. Синтез 5-трифторацетиламинометил-2-тиоуридина (соединение 11)
Гликозилирование 2-тиоурацила 11-a обеспечило соединение 11-c, из которого можно удалять защитную группу с помощью любого подходящего реагента для удаления защитной группы. В частности, LiOH обеспечил желаемый продукт 11-d (выход 80-90%). Защита изопропилиденом обеспечила соединение 11-e (выход 90%). Дальнейшее 5-гидроксилметилирование обеспечивало соединение 11-f. Хлорирование, азидирование и дальнейшее восстановление обеспечило соединение метиламин 11-i, которое ацетилировали с получением соединения 11.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 19. Синтез 5-метиламинометил-2-уридина (соединение 12)

Соединение 12 можно получать любым пригодным способом (например, см. схемы (i) и (ii) выше). Например, защищенный урацил можно гликозилировать, а затем аминировать с получением соединения 12. При необходимости можно проводить дополнительные стадии внесения защитной группы, удаления защитной группы и активации. Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 20. Синтез 5-TFA-метиламинометил-2-уридина (соединение 13)
В уридин 13-a вносили защитную группу изопропилидена с получением соединения 13-b, а затем его подвергали 5-гидроксиметилированию с получением соединения 13-c. Хлорирование и последующее аминирование обеспечили соединение 13-e, в которое можно вносить защитную группу с получением 13-f. Последующее удаление защитной группы обеспечило соединение 13.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 21. Синтез 5-карбоксиметиламинометилуридина (соединение 14)
В уридин 14-a вносили защитную группу изопропилидена с получением соединения 14-b, а затем его подвергали 5-аминоалкилированию в реакции Манниха с получением соединения 14-c. Метилирование обеспечило четвертичный амин 14-d. Последующие стадии аминирования и удаления защитной группы можно использовать для получения соединения 14. Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 22. Альтернативный синтез 5-метиламинометил-2-уридина (соединение 12) и 5-карбоксиметиламинометил-2-уридина (соединение 14)
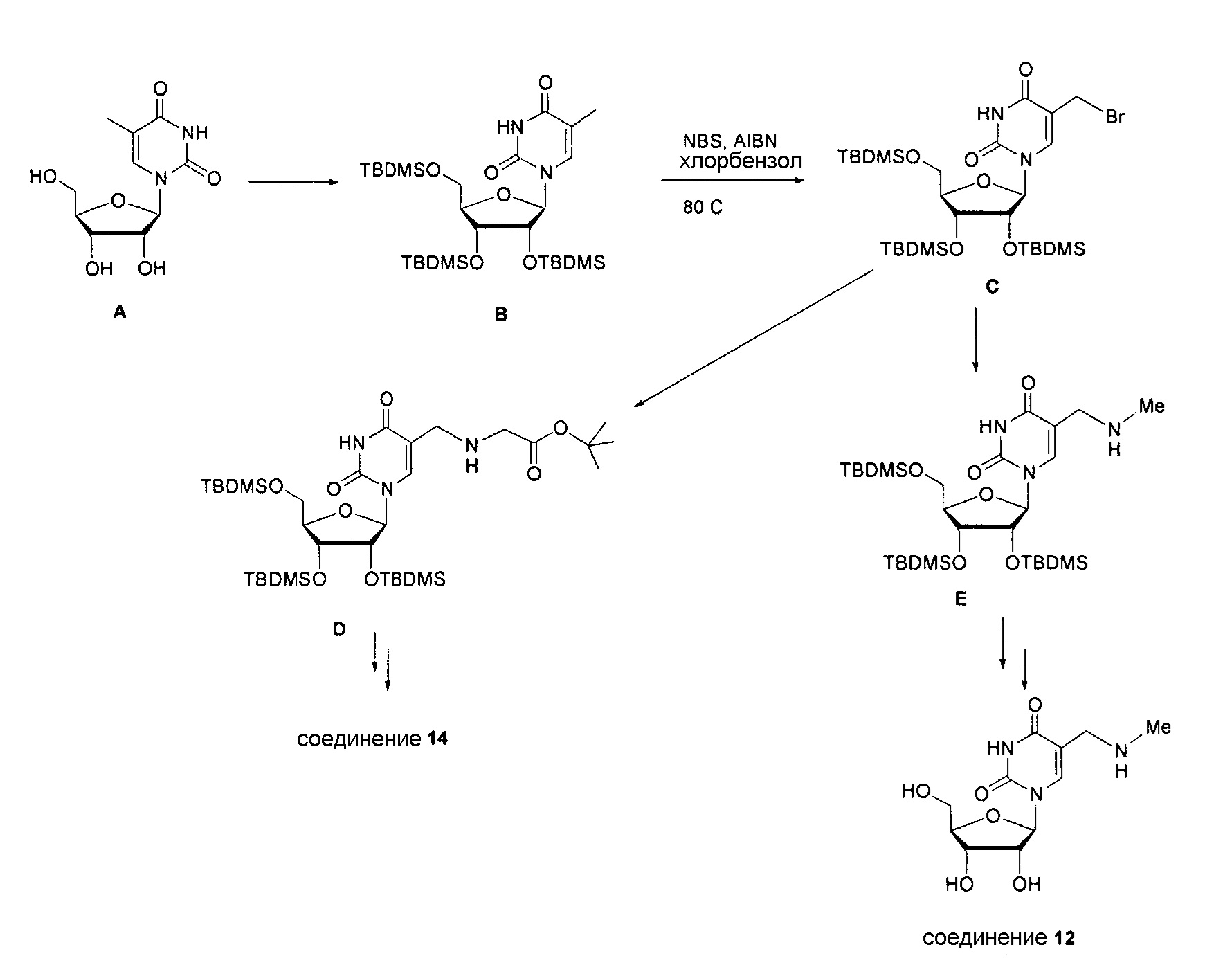
В дополнение к стратегиям, предоставленным выше для соединений 12 и 14, также можно использовать следующую стратегию. 5-Метилуридин A можно подвергать силилированию с получением соединения B. После монобромирования радикала полученное промежуточное соединение бромид C можно использовать для удаления защитной группы из аналогов соединения 12 и соединения 14. Затем алкиламинирование бромидного соединения C может обеспечить соединения D и E, из которых можно удалять защитную группу с получением соединений 14 и 12, соответственно. Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 23. Синтез диметилпсевдоуридина (соединение 15) и диметилпсевдо-UTP (NTP указанного соединения)
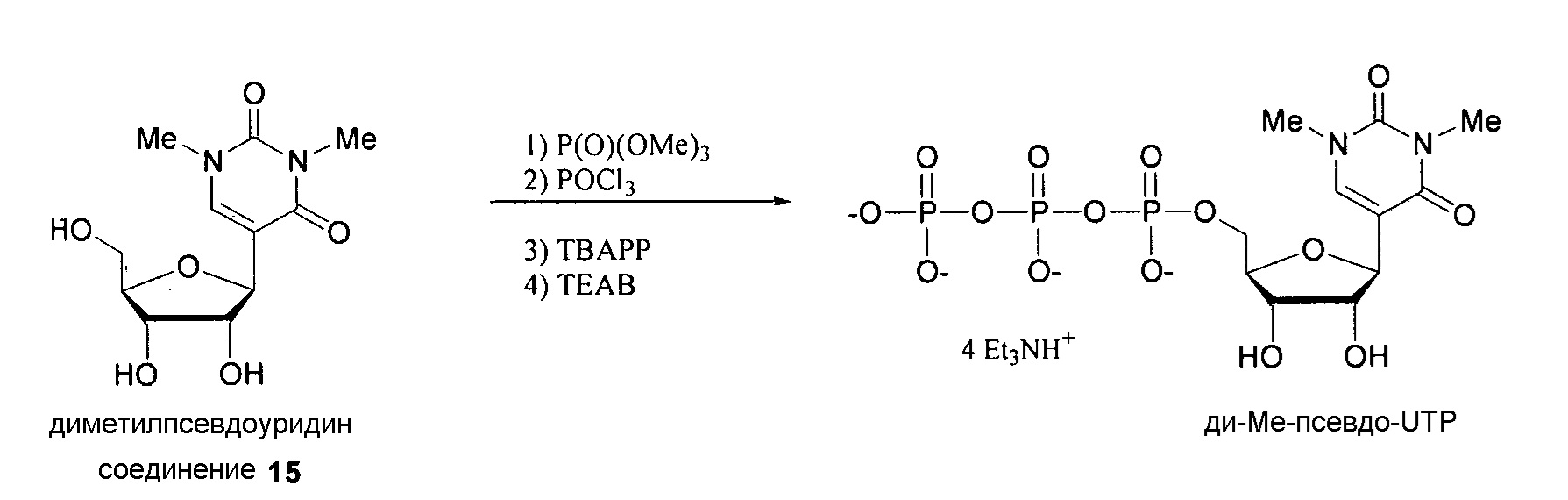
Нуклеозиды можно фосфорилировать любым пригодным способом. Например, как показано выше, нуклеозиды можно подвергать реакции с оксихлоридом фосфора, а затем обрабатывать монофосфатным промежуточным соединением с бис(трибутиламмоний)пирофосфатом (TBAPP) с получением трифосфата.
Пример 24. Синтез 2’-C-метиладенозина (соединение 16) и 2’-C-метил ATP (NTP указанного соединения)

Приблизительно 5 г соединения 16-2 получали из 5 г соединения 16-1 через реакцию с перйодинаном Десс-Мартина. Соединение 16-2 подвергали реакции с MeMgI/TiCl4/-78°C с получением соединения 16-3, и неочищенное соединение 16-3 (6 г) прямо подвергали реакции с бензилхлоридом с получением соединения 16-4. Реакция с основанием нуклеиновой кислоты и удаление защитной группы обеспечили соединение 16 (0,56 г).
Пример 25. Синтез изомеров 2’-C-метилцитидина (соединение 17 и соединение 18) и 2’-C-метил UTP (NTP указанных соединений)
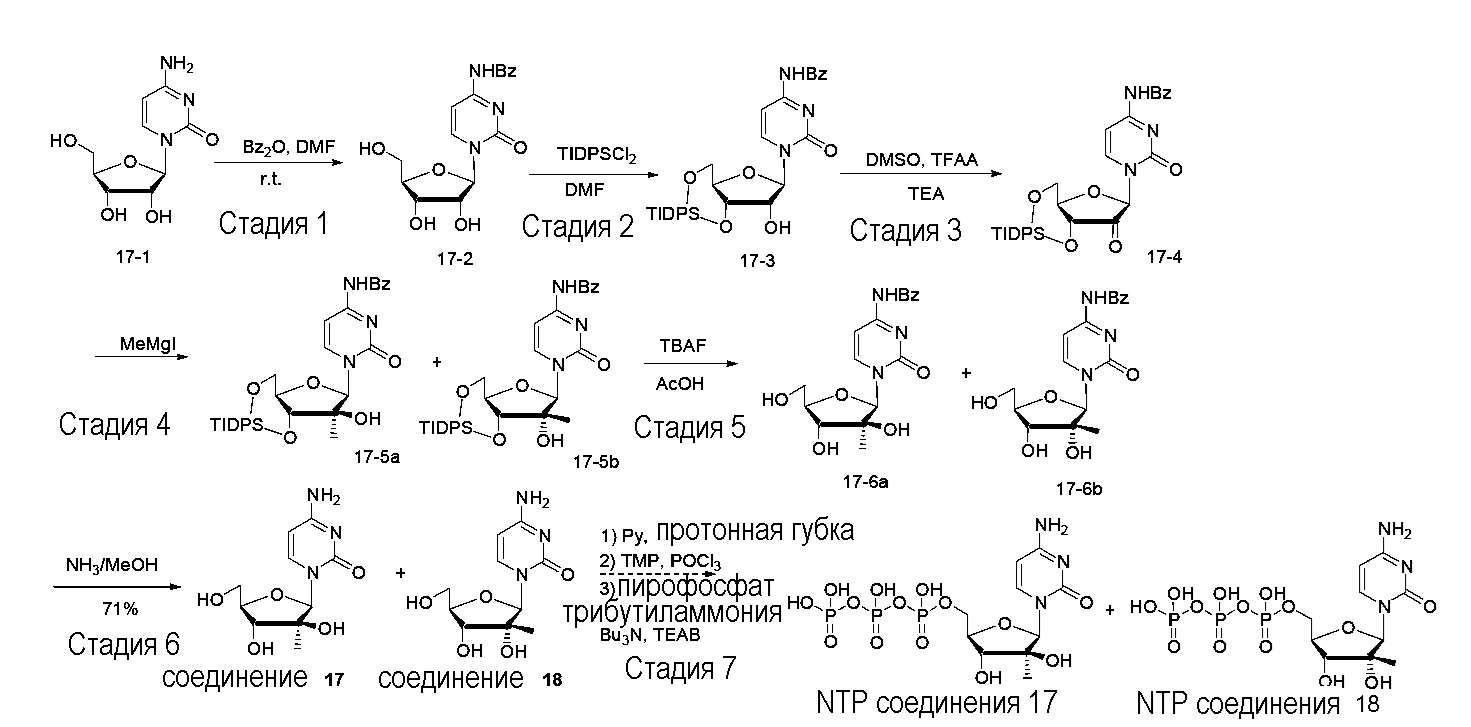
Приблизительно 17,4 г соединения 17-3 получали из 20 г соединения 17-1. Затем 2’-окисление и алкилирование MeMgI обеспечило 300 мг соединения 17-5a и 80 мг соединения 17-5b. Приблизительно 9 г соединения 17-5a (приблизительно на 90% чистое) и 2,1 г соединения 17-5b (чистое) получали из 17,4 г соединения 17-3 в 2 партиях. Удаление N- и O-защитных групп обеспечило соединения 17 и 18.
Пример 26. Синтез 2’-C-метилгуанозина (соединение 19) и 2’-C-метил GTP (NTP указанного соединения)
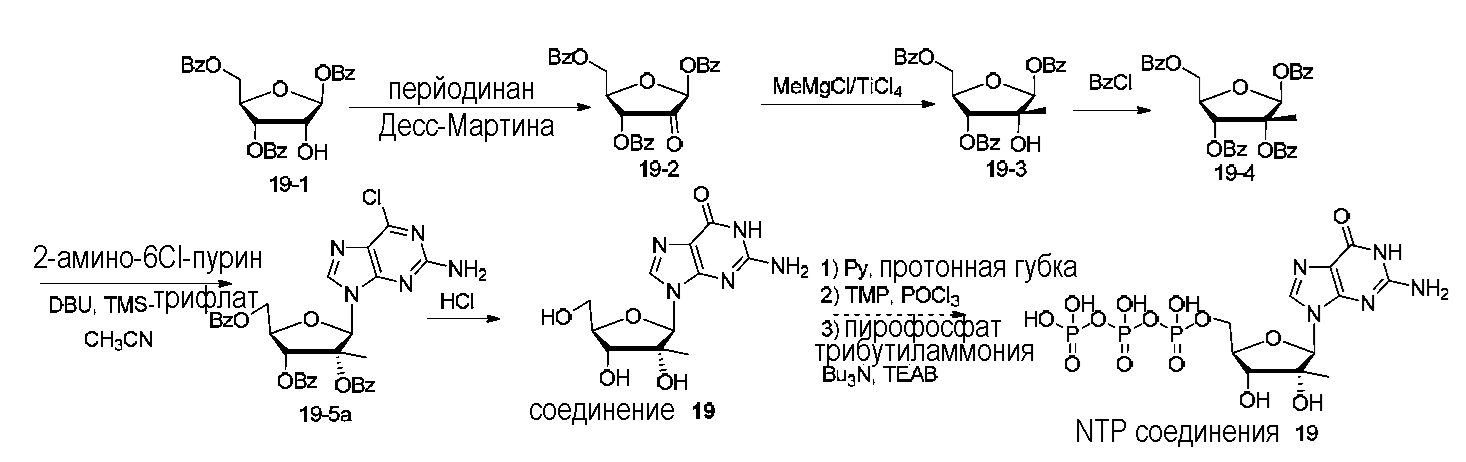
2’-Окисление защищенной рибозы 19-1 и последующее алкилирование посредством MeMgCl обеспечило соединение 19-3. В полученное соединение далее вносили защитную группу с получением соединения 19-4, и из 3,1 г соединения 19-4 получали 1,56 г соединения 19-5a. Последующее йодирование и удаление защитной группы обеспечило соединение 19 (приблизительно на 90% чистое, 50 мг).
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 27. Синтез 2’-C-метилуридина (соединение 20) и 2’-C-метил UTP (NTP указанного соединения)
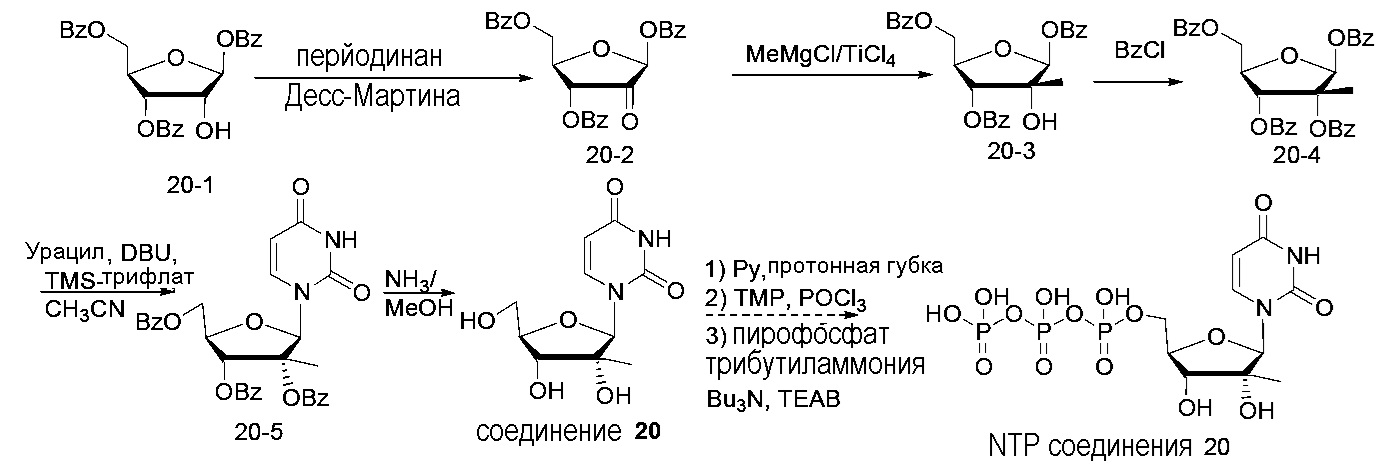
2’-Окисление защищенной рибозы 20-1 и последующее алкилирование посредством MeMgCl обеспечило соединение 20-3. В полученное соединение далее вносили защитную группу с получением соединения 20-4. Реакция с урацилом и удаление защитной группы обеспечили чистое соединение 20 (50 мг).
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 28. Синтез (S)-2’-C-метиладенозина (соединение 21) и (S)-2’-C-метил ATP (NTP указанного соединения)
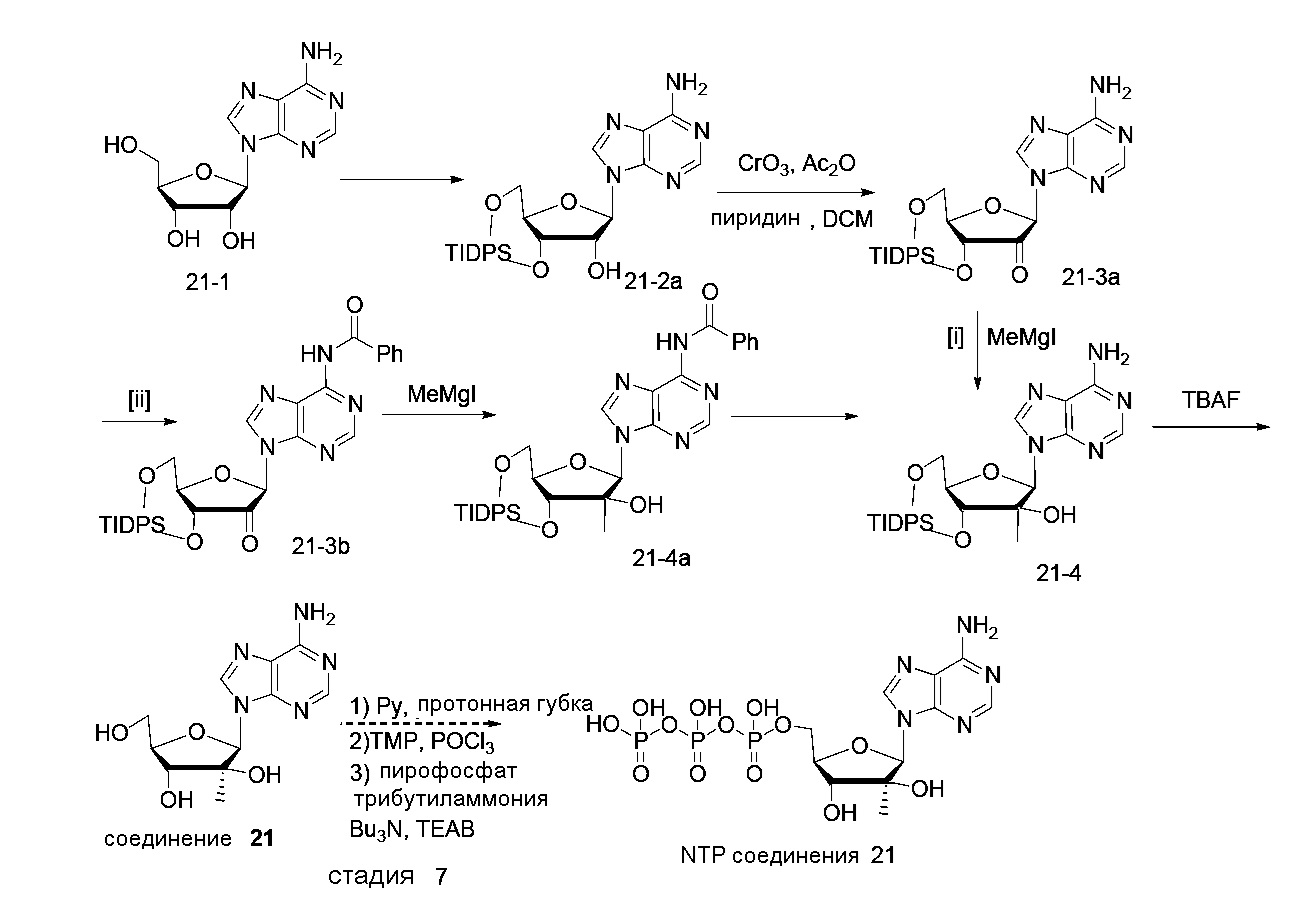
Из соединения 21-1 (5 г) удаляли защитную группу с получением соединения 21-2a, и окисление хрома обеспечило соединение 21-3a. Алкилирование через путь [i] (5 экв. MeMgI в простом эфире при -50°C) обеспечило соединение 21-4. Необязательно, выход может быть улучшен через путь [ii] посредством защиты аминогруппы с получением соединения 21-3b, а затем алкилирования в положении 2’-C с получением соединения 21-4a. Соединение 21-3a алкилировали с получением неочищенного соединения 21-4 (3 г, 20% соединения 3a в этом неочищенном продукте), где продукт можно необязательно очищать. Удаление защитной группы из соединения 21-4 обеспечило соединение 21 (выход 50%).
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 29. Синтез (S)-2’-C-метилгуанозина (соединение 22) и (S)-2’-метил-GTP (NTP указанного соединения)
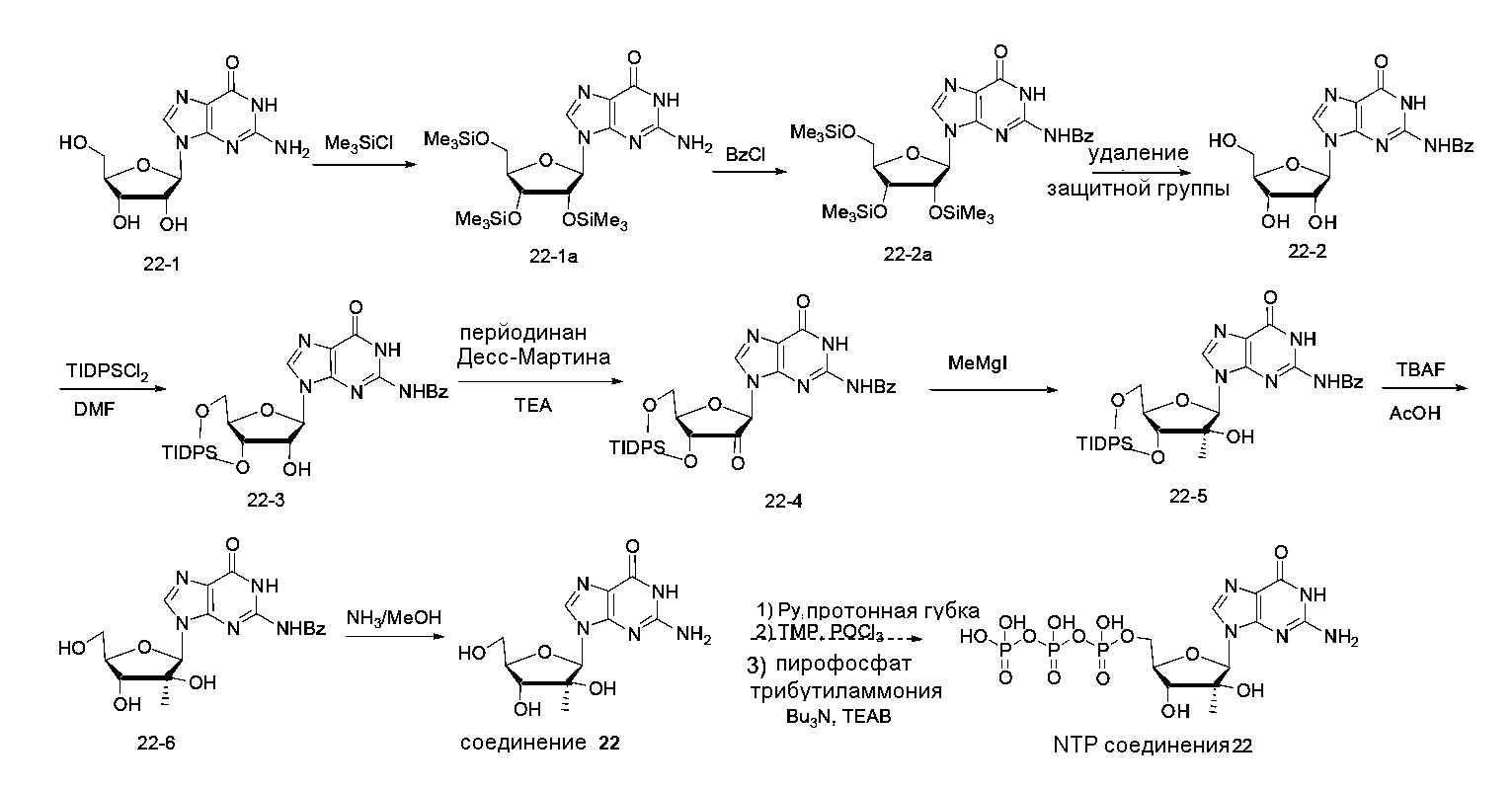
Приблизительно 30 г соединения 22-1 подвергали силилированию с получением соединения 22-2 на трех стадиях. Дальнейшее внесение защитной группы обеспечило соединение 22-3, и окисление с перйодинаном Десс-Мартина обеспечило соединение 22-4 (1,6 г) в двух партиях. 2’-C алкилирование (5 экв. MeMgI в простом эфире, от -50°C до к.т.) обеспечило соединение 22-5, и последующие стадии удаления защитной обеспечили соединение 22.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 30. Синтез (S)-2’-C-метилуридина (соединение 23) и (S)-2’-C-метил-UTP (NTP указанного соединения)

В уридин 23-1 (2,0 г) вносили защитную группу TIPDSCl2 (1,3-дихлор-1,1,3,3-тетраизопропилдисилоксан) с получением соединения 23-2. Окисление обеспечило соединение 23-3, и 2’-C алкилирование обеспечило соединение 23-4, которое можно необязательно очищать с помощью препаративной ВЭЖХ перед следующей стадией. Затем удаление защитной группы обеспечило желаемое соединение 23.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 31. Синтез 4’-C-метиладенозина (соединение 24) и 4’-C-метил-ATP (NTP указанного соединения)
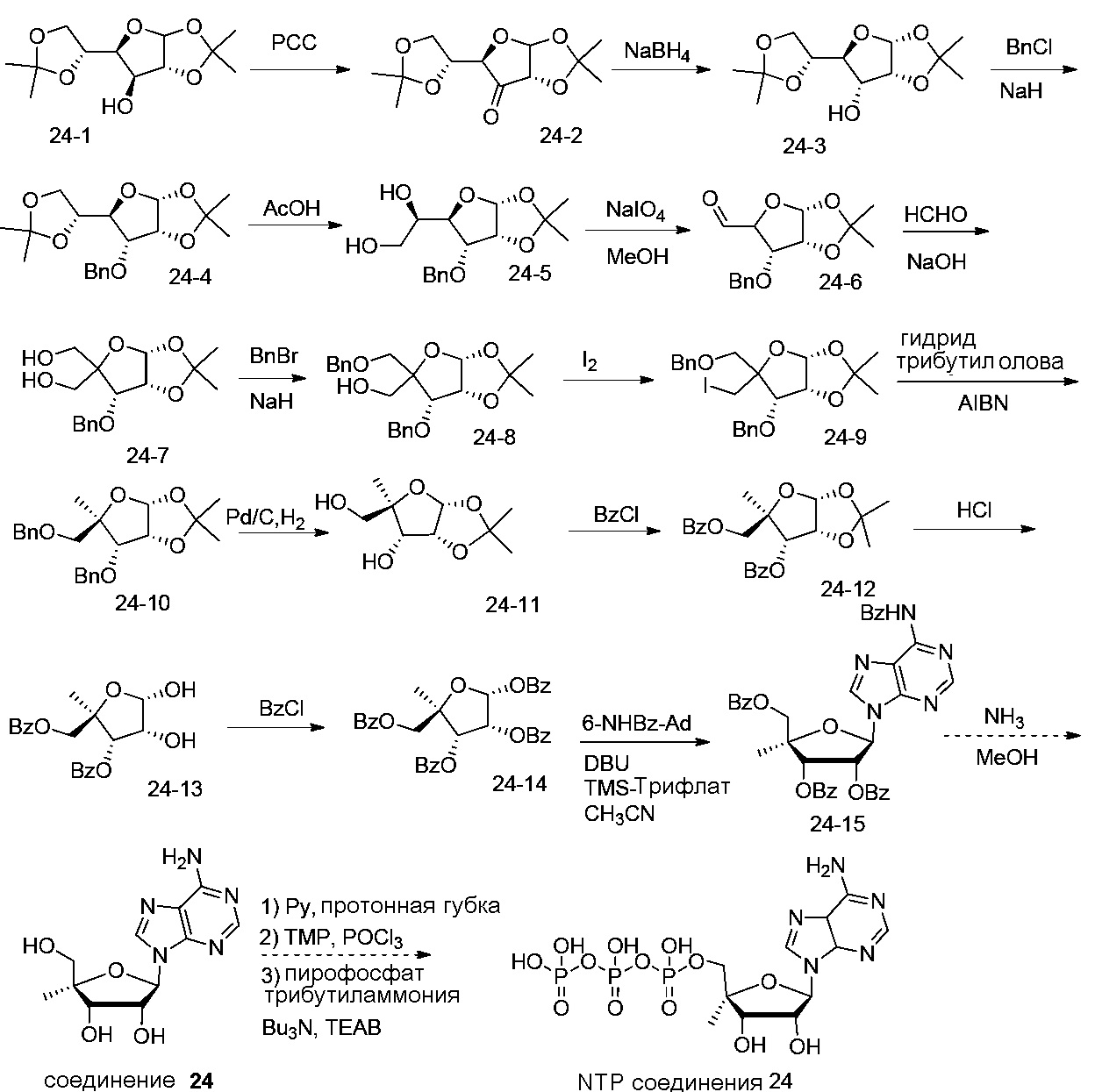
1,2:5,6-Ди-O-изопропилиден-α-D-глюкофуранозу 24-1 преобразовывали посредством последовательных стадий окисления, восстановления и внесения защитной группы с получением соединения 24-4. Первую стадию окисления с получением соединения 24-2 можно осуществлять с помощью любых подходящих реагентов, таких как 0,75 экв. дихромата пиридиния (PDC) с 1 экв. Ac2O или 1,2 экв. перйодинана Десс-Мартина. Последующее удаление защитной группы, формилирование и восстановление обеспечили соединение 24-7, после чего следовали стадии внесения защитной группы и деоксигенации с получением соединения 24-10. Посредством последовательных стадий внесения защитной группы и удаления защитной группы из 1 г соединения 24-10 получали приблизительно 0,4 г соединения 24-14. Присоединение N6-бензоиладенина и последующее удаление защитной группы обеспечили соединение 24.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 32. Синтез 4’-C-метилцитидина (соединение 25) и 4’-C-метил-CTP (NTP указанного соединения)
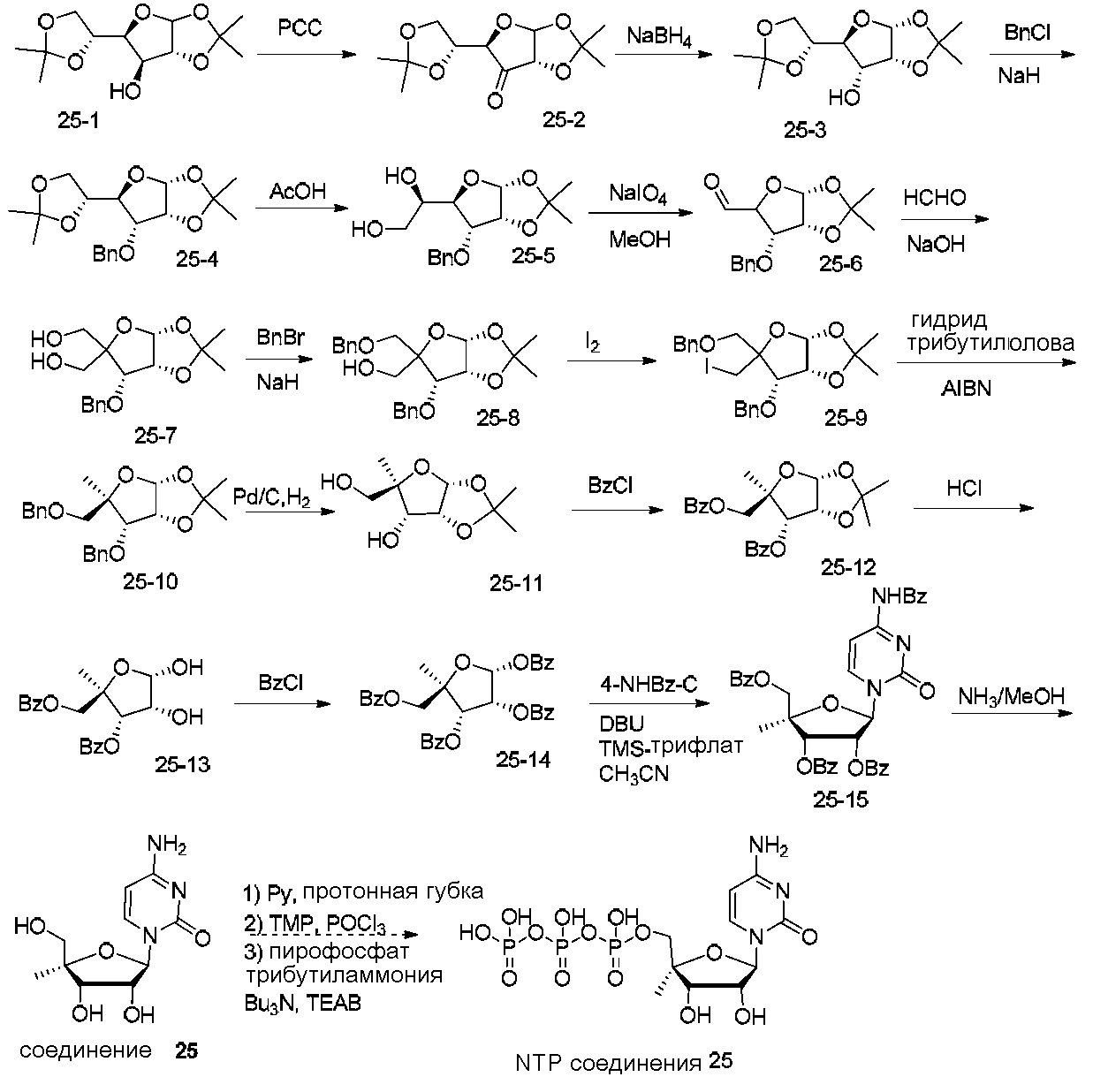
Аналогично стратегии, представленной выше для соединения 24, соединение 25-14 получали с соединением 25-1. Добавление цитидина и последующее удаление защитной группы обеспечили соединение 25.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 33. Синтез 4’-C-метилгуанозина (соединение 26) и 4’-C-метил-GTP (NTP указанного соединения)
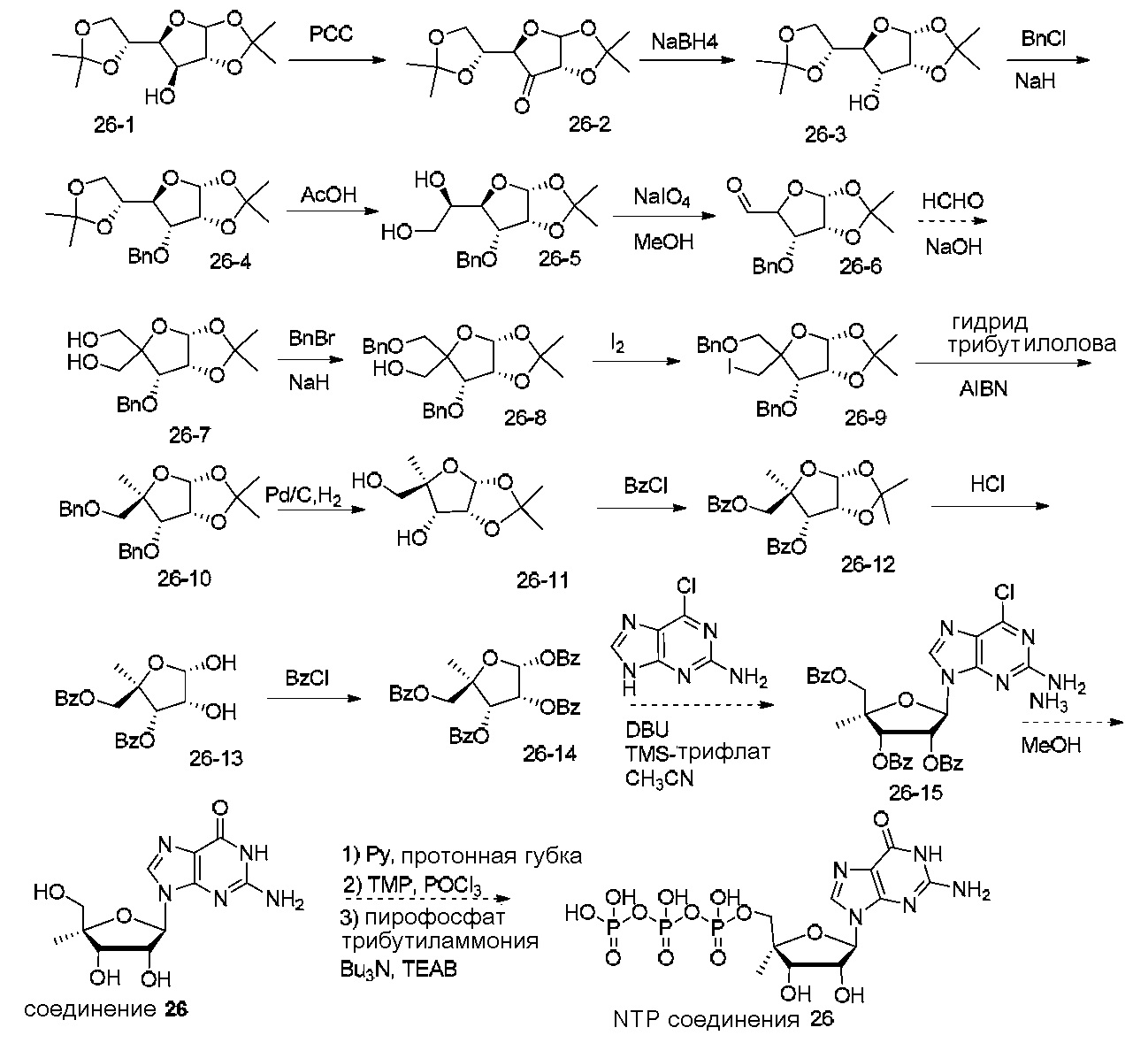
Аналогично стратегии, описанной выше для соединения 24, соединение 26-14 получали с соединением 26-1. Добавление 2-амино-6-хлорпурина, последующее окисление, а затем удаление защитной группы обеспечили соединение 26.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 34. Синтез 4’-C-метилуридина (соединение 27) и 4’-C-метил-UTP (NTP указанного соединения)
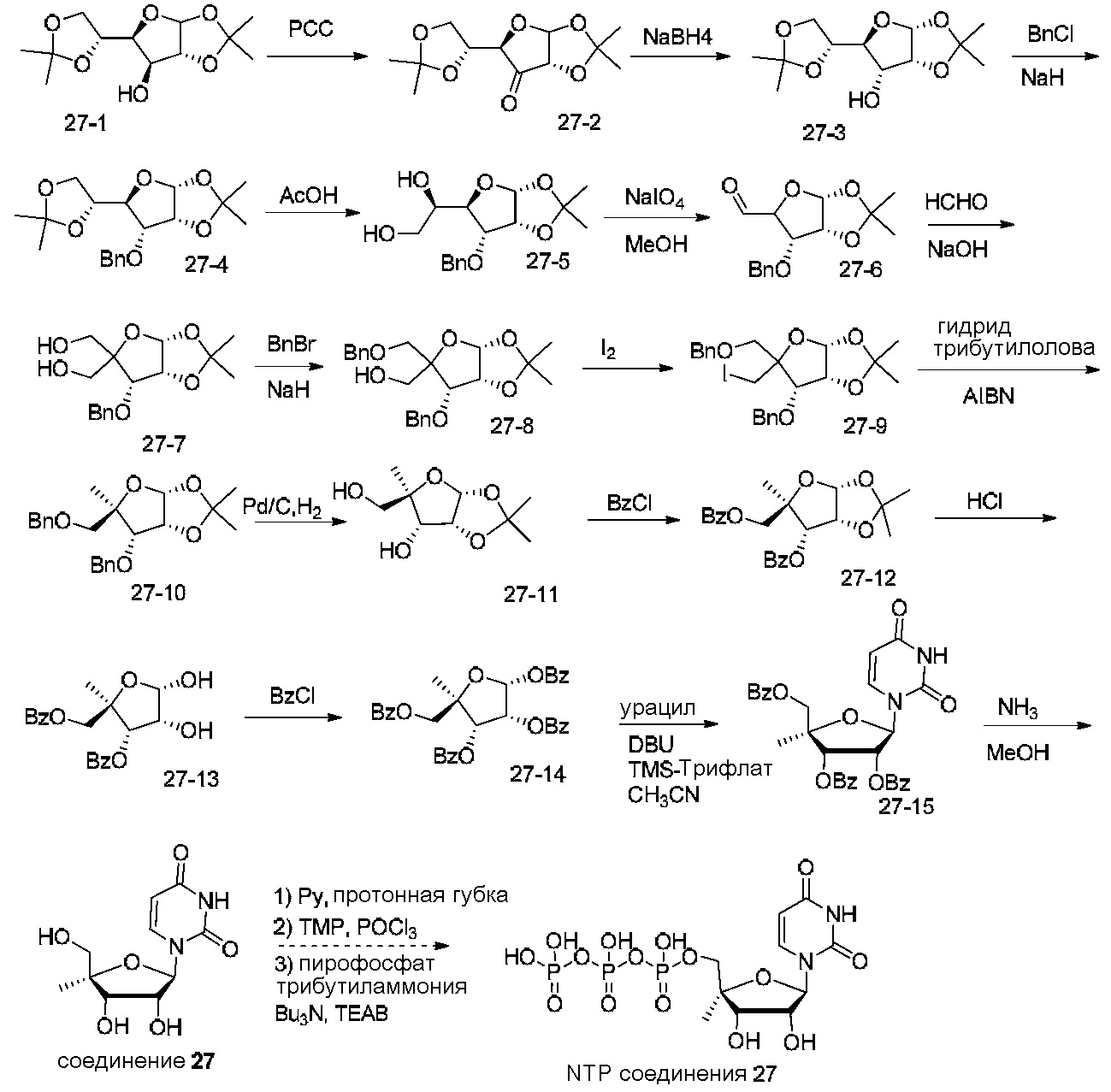
Аналогично стратегии, описанной выше для соединения 24, соединение 27-14 получали с соединением 27-1. Добавление урацила и последующее удаление защитной группы обеспечили соединение 27.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 35. Синтез 2’-O,4’-C-метиленаденозина (соединение 28) и 2’-O,4’-C-метилен-ATP (NTP указанного соединения)
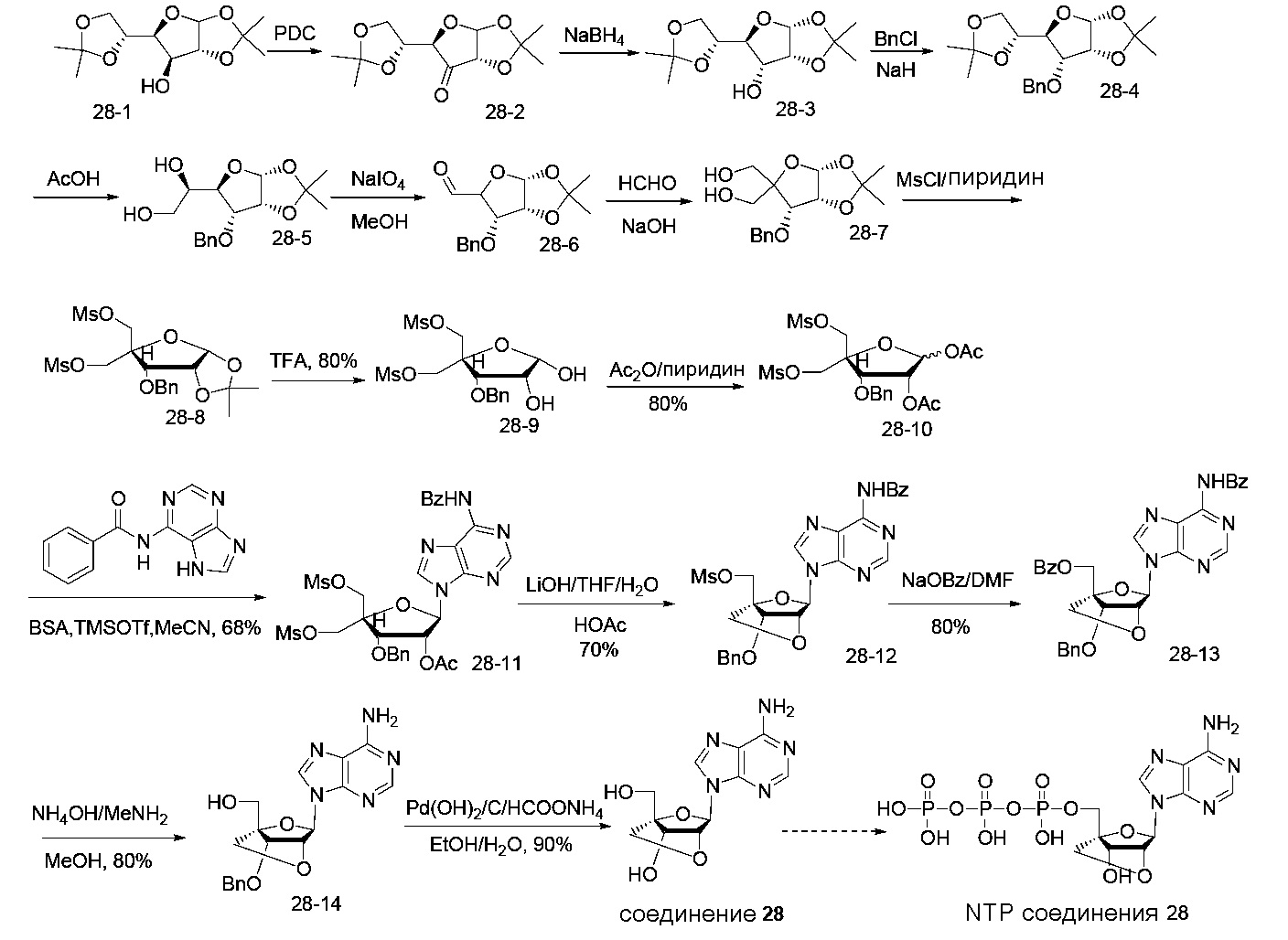
Аналогично стратегии, описанной выше для соединения 24, соединение 28-7 получали с соединением 28-1. Последующее мезилирование, удаление защитной группы и ацетилирование обеспечили соединение 28-10, после которых следовало добавление N6-бензоиладенина и последующая внутренняя циклизация. Различные стадии внесения защитной группы и удаления защитной группы обеспечили соединение 28.
Пример 36. Синтез 5-метил-2’-O,4’-C-метиленцитидина (соединение 29) и 5-метил-2’-O,4’-C-метилена-CTP (NTP указанного соединения)
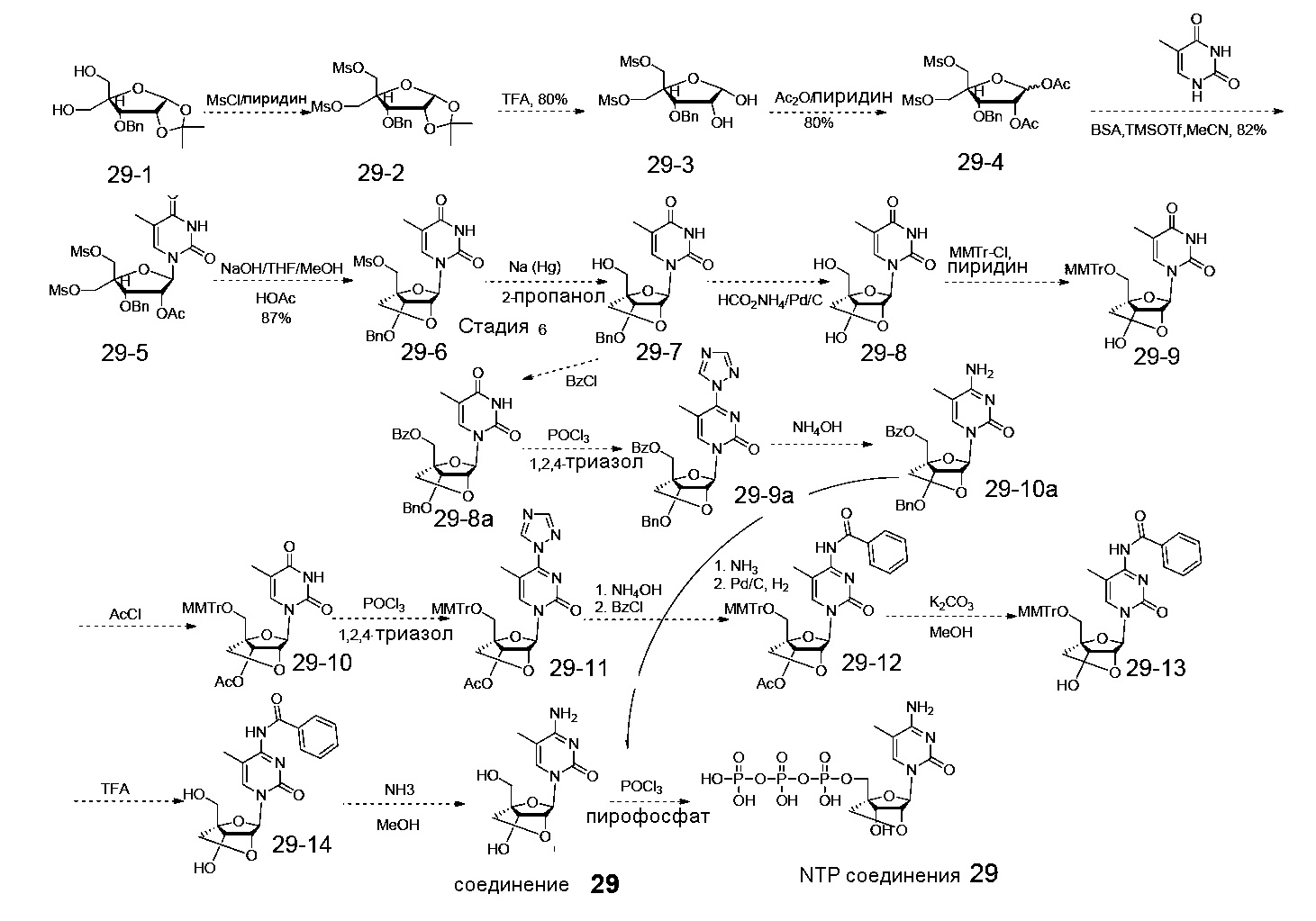
Соединение альдофуранозы 29-1 подвергали реакции посредством различных стадий внесения защитной группы, и затем добавляли 5-метилурацил с получением соединения 29-5. Последующие стадии внутренней циклизации, удаления защитной группы, внесения защитной группы и аминирования обеспечили соединение 29.
Пример 37. Синтез 2’-O,4’-C-метиленгуанозина (соединение 30) и 2’-O,4’-C-метилен-GTP (NTP указанного соединения)

Аналогично стратегии, описанной выше для соединения 29, соединение альдофуранозы 30-1 подвергали реакции посредством различных стадий внесения защитной группы, а затем добавляли 2-амино-6-хлорпурин с получением соединения 30-5. Последующие стадии внутренней циклизации, аминирования и удаления защитной группы обеспечили соединение 30.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 38. Синтез 2’-O,4’-C-метиленуридина (соединение 31) и 2’-O,4’-C-метилен-UTP (NTP указанного соединения)
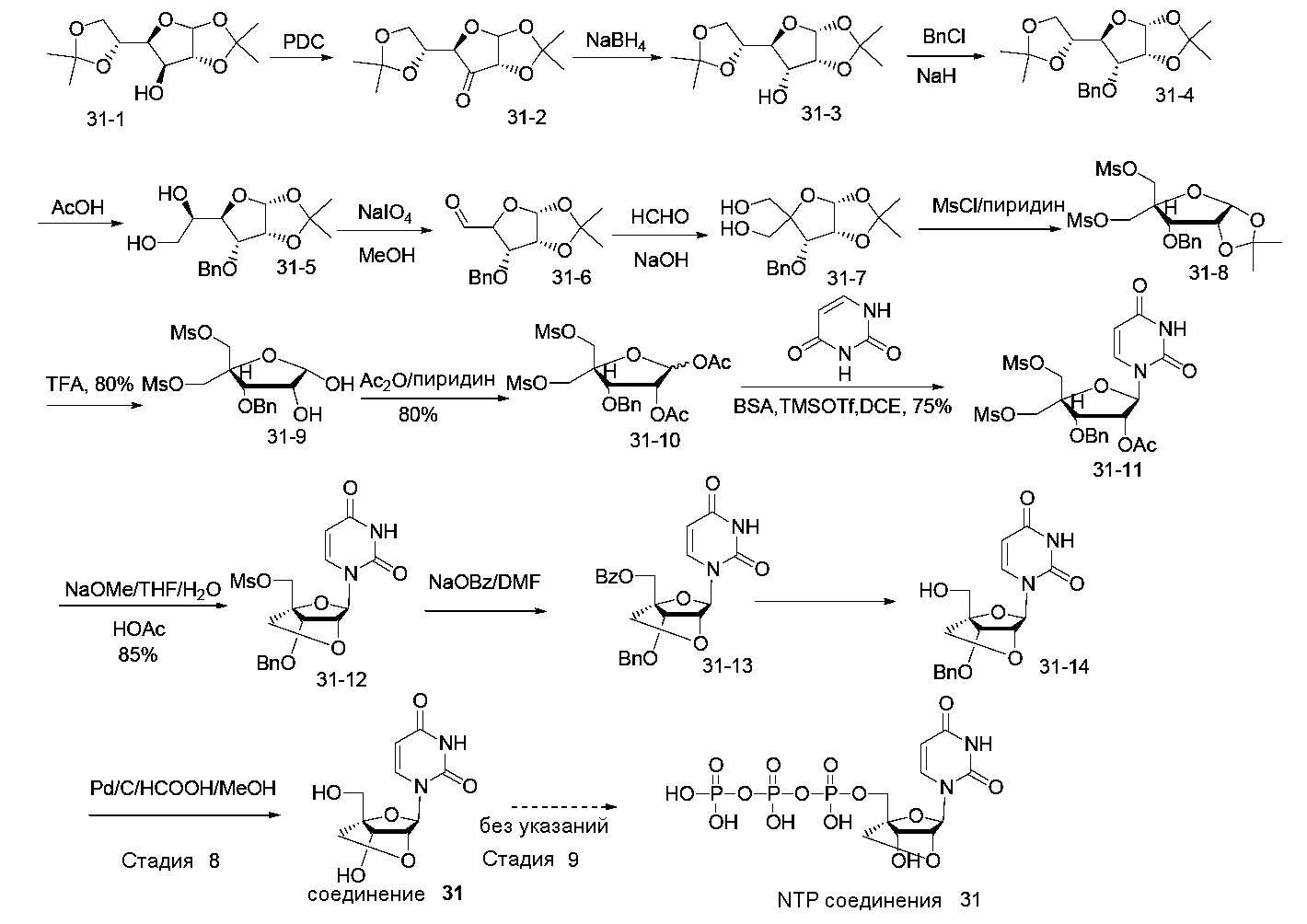
Аналогично стратегии, описанной выше для соединения 24, соединение 31-7 получали с соединением 31-1. Последующее мезилирование, удаление защитной группы и ацетилирование обеспечили соединение 30-10. Добавление урацила и последующая внутренняя циклизация обеспечили соединение 31-12, и различные стадии внесения защитной группы и удаления защитной группы обеспечили соединение 31. Последующая реакция с трифосфатом (например, как описано в настоящем описании) обеспечила NTP соединения 31, который можно необязательно очищать (например, посредством ВЭЖХ).
Пример 39. Синтез 2’-хлораденозина (соединение 32) и 2’-хлор ATP (NTP указанного соединения)
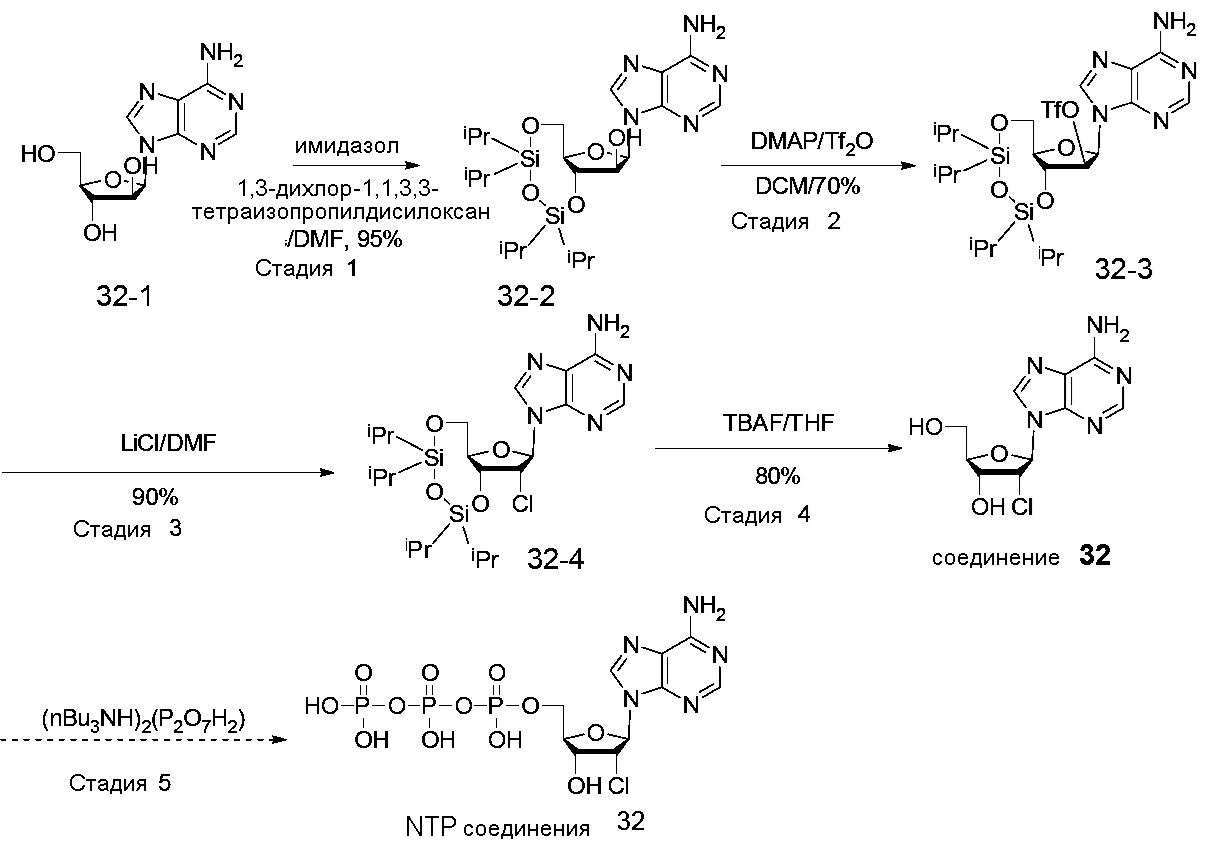
В арабиноаденозин 32-1 вносили защитную группу посредством стадий 1 и 2, а затем хлорировали с получением соединения 32-4. Последующее удаление защитной группы обеспечило соединение 32, и реакция с трифосфатом обеспечила NTP соединения 32.
Пример 40. Синтез 2’-йодаденозина (соединение 33) и 2’-йод-ATP (NTP указанного соединения)

В арабиноаденозин 33-1 вносили защитную группу посредством стадий 1 и 2, а затем йодировали с получением соединения 33-4. Последующее удаление защитной группы обеспечило соединение 33, и реакция с трифосфатом в DMF обеспечила NTP соединения 33.
Пример 41. Синтез 2’-бромцитидина (соединение 34) и 2’-бром CTP (NTP указанного соединения)
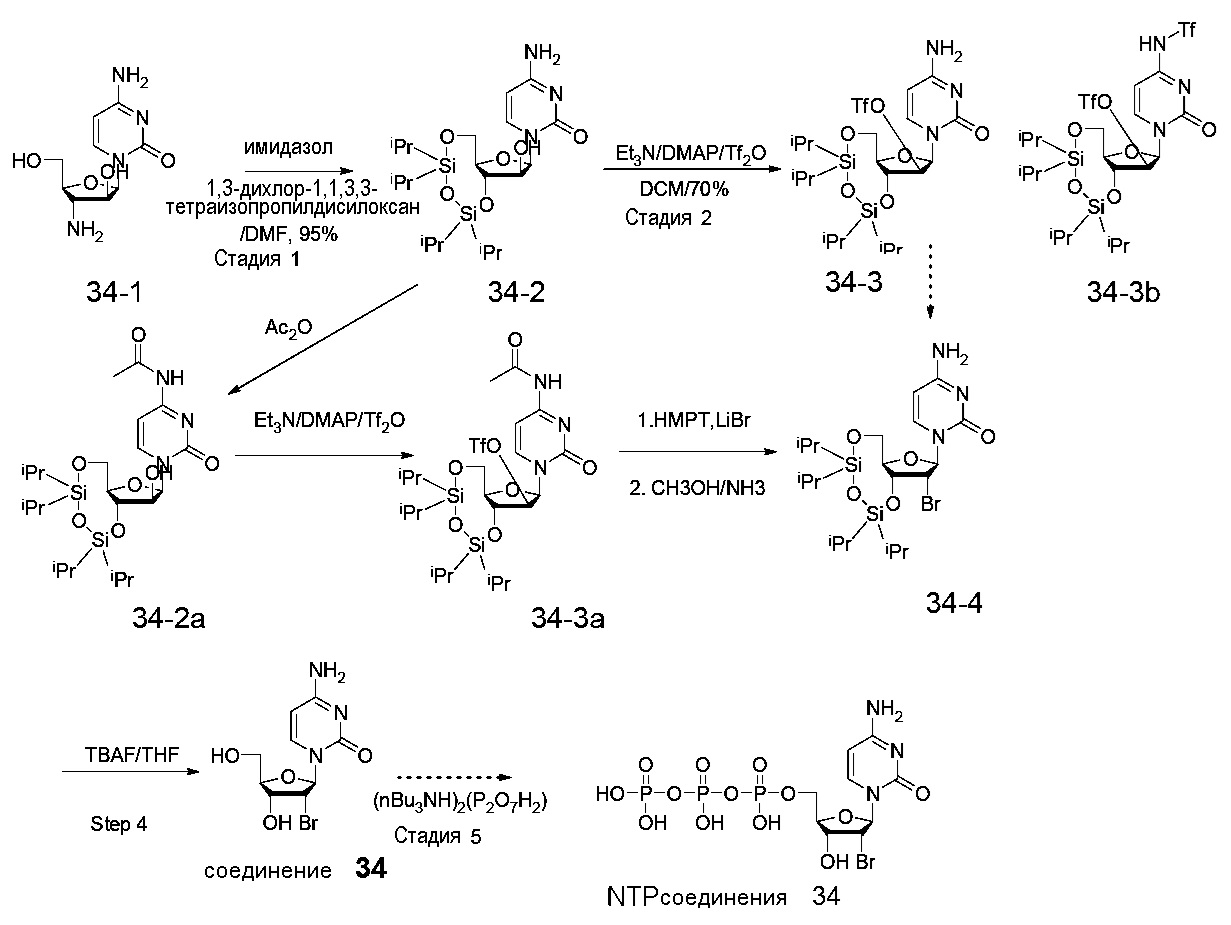
В арабиноцитидин 34-1 вносили защитную группу в различных условиях, а затем бромировали с получением соединения 34-4. Необязательно, реакция может обеспечить соединение 34-4 через соединение 34-3a в любых пригодных условиях внесения защитной группы, таких как (i) 1,5 экв. Et3N, 1 экв. DMAP, 1,2 экв. TfCl, в DCM (10 мл); (ii) 3 экв. DMAP, 1,2 экв. TfCl в DCM (15 мл); или (iii) 15 экв. DMAP, 1,5 экв. Tf2O, в DCM (15 мл) при от -10°C до 0°C в течение 2 часов. В частности, 55 мг соединения 34-3a получали в условиях реакции (iii). Последующее удаление защитной группы обеспечило соединение 34, и реакция с трифосфатом в DMF обеспечила NTP соединения 34. Неочищенный продукт 34 можно необязательно очищать перед фосфорилированием.
Пример 42. Синтез 2’-хлоргуанозин (соединение 35) и 2’-хлор GTP (NTP указанного соединения)
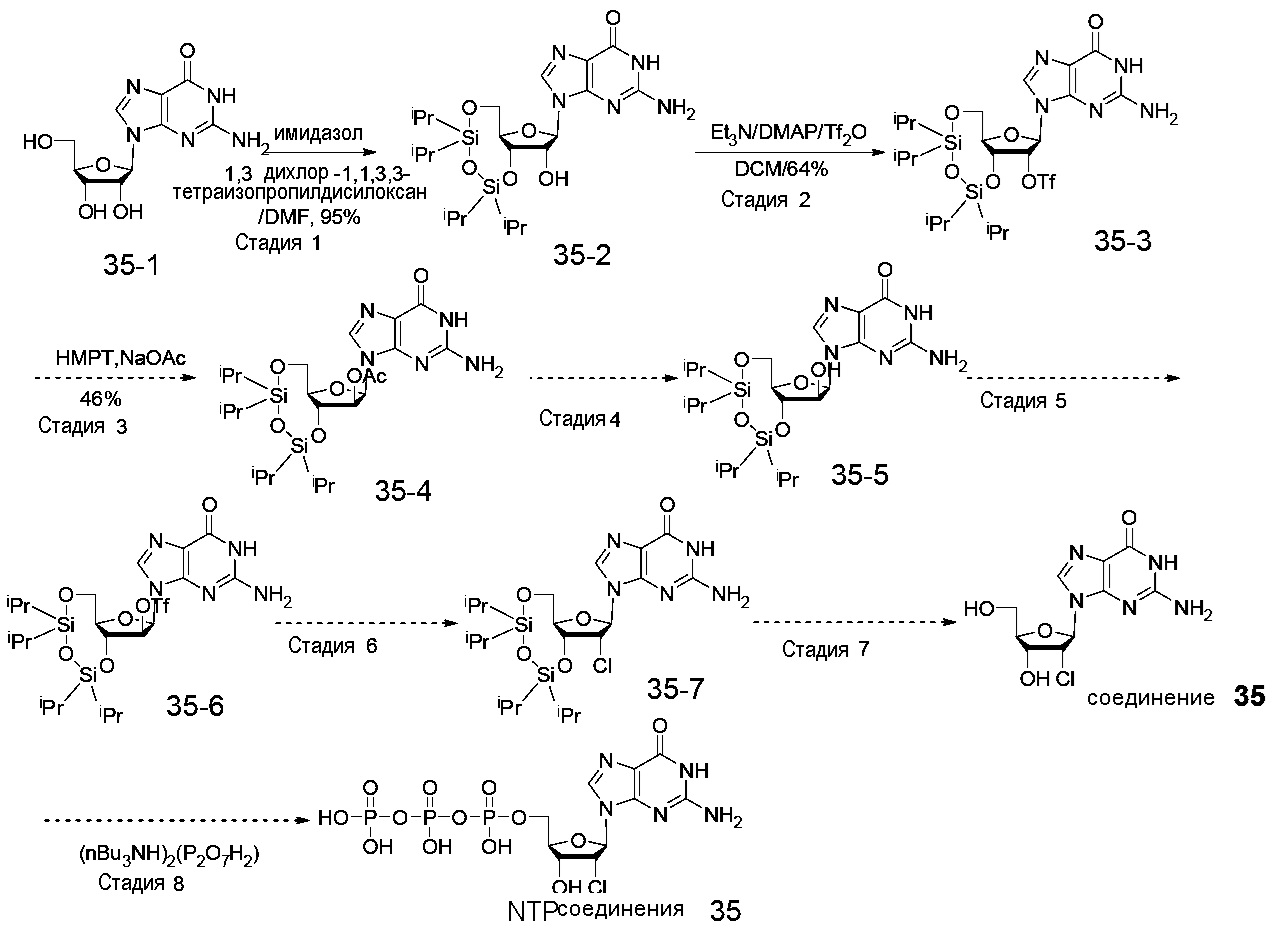
В гуанозин 35-1 вносили защитную группу в различных условиях, а затем подвергали ацетилированию с получением соединения 35-4. Реакцию из соединения 35-2 в соединение 35-3 проводили с 2 экв. DMAP, 2 экв. Et3N, 3 экв. Tf2O в 1,2-дихлорэтане (10 мл) при 40°C в течение 4 часов. После очистки получали приблизительно 55 мг соединения 35-3.
Желаемое соединение 35 можно получать любым пригодным способом. Например, как показано выше, соединение 35-4 можно обрабатывать с последующими стадиями внесения защитной группы, хлорирования и удаления защитной группы с получением соединения 35. Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 43. Синтез 2’-йодуридина (соединение 36) и 2’-йод-UTP (NTP указанного соединения)

В O2,2′-циклоуридин 36-1 вносили защитную группу с получением соединения 36-2. Последующее йодирование, необязательно опосредуемое селеном, обеспечило соединение 36. Реакцию с трифосфатом проводили для получения NTP соединения 36. Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 44. Синтез 2’-O,4’-C-метиленаденозина (соединение 37) и 2’-O,4’-C-метилен-ATP (NTP указанного соединения)
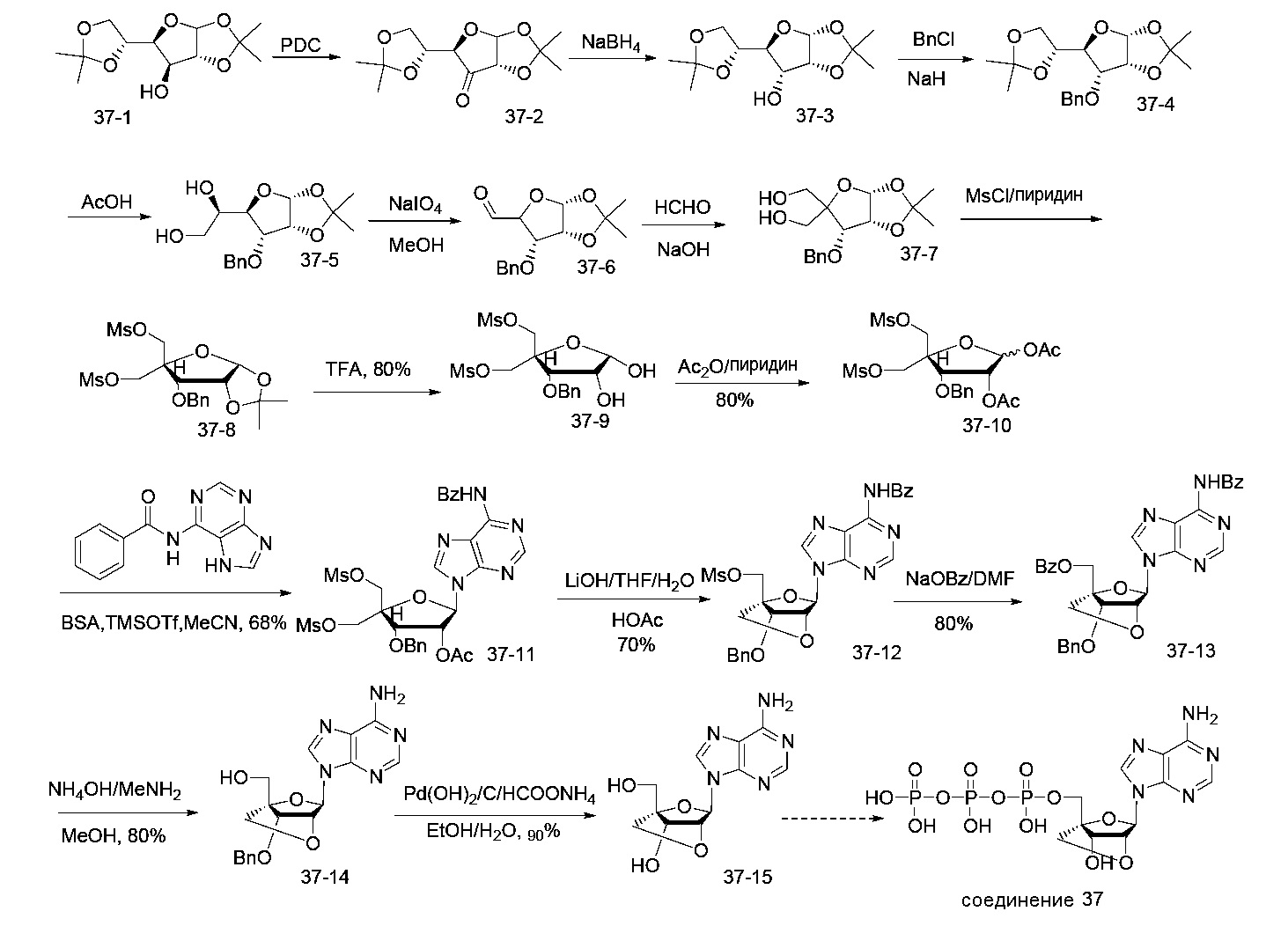
Аналогично стратегии, описанной выше для соединения 24, соединение 37-7 получали с соединением 37-1. Последующее мезилирование, удаление защитной группы и ацетилирование обеспечили соединение 37-10. Добавление урацила и последующая внутренняя циклизация обеспечили соединение 37-12. Различные стадии внесения защитной группы и удаления защитной группы обеспечили соединение 37.
Для получения соответствующего NTP можно проводить реакцию с трифосфатом (например, любым из описанных в настоящем описании). Необязательно, NTP можно очищать (например, с использованием колонки Sephadex DEAE-A25), лиофилизировать или упаривать (например, из EtOH).
Пример 45. Синтез циклопентендиолцитидина (соединение 38) и циклопентендиол-CTP (NTP указанного соединения)
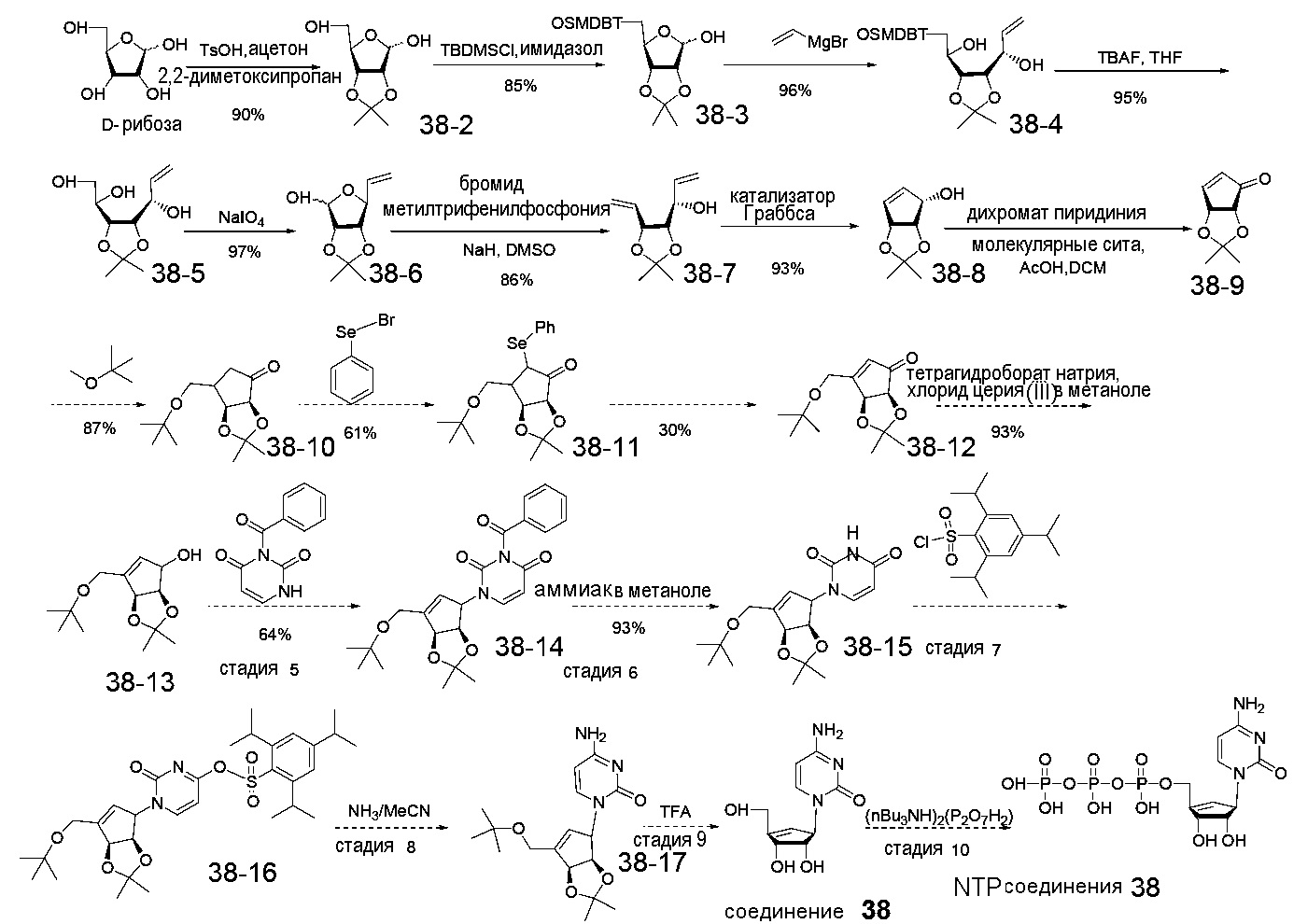
ВD-рибозу вносили защитную группу, а затем подвергали аллилированию с получением соединения 38-4, которое затем подвергали циклизации и восстанавливали с получением соединения 38-7. Обмен олефинов и последующее окисление обеспечили соединение 38-9, и последующие реакции восстановления и присоединения N-бензоилурацила обеспечили соединение 38-14. Дополнительные реакции внесения защитной группы и удаления защитной группы обеспечили соединение 38, и реакция с трифосфатом (например, в любых подходящих условиях реакции, таких как условия, описанные в настоящем описании или в патенте США № 7893227, включенном в настоящее описание в качестве ссылки) обеспечила NTP соединения 38.
Пример 46. Синтез 2’-метилуридина (соединение 39) и 2’-метил-UTP (NTP указанного соединения)
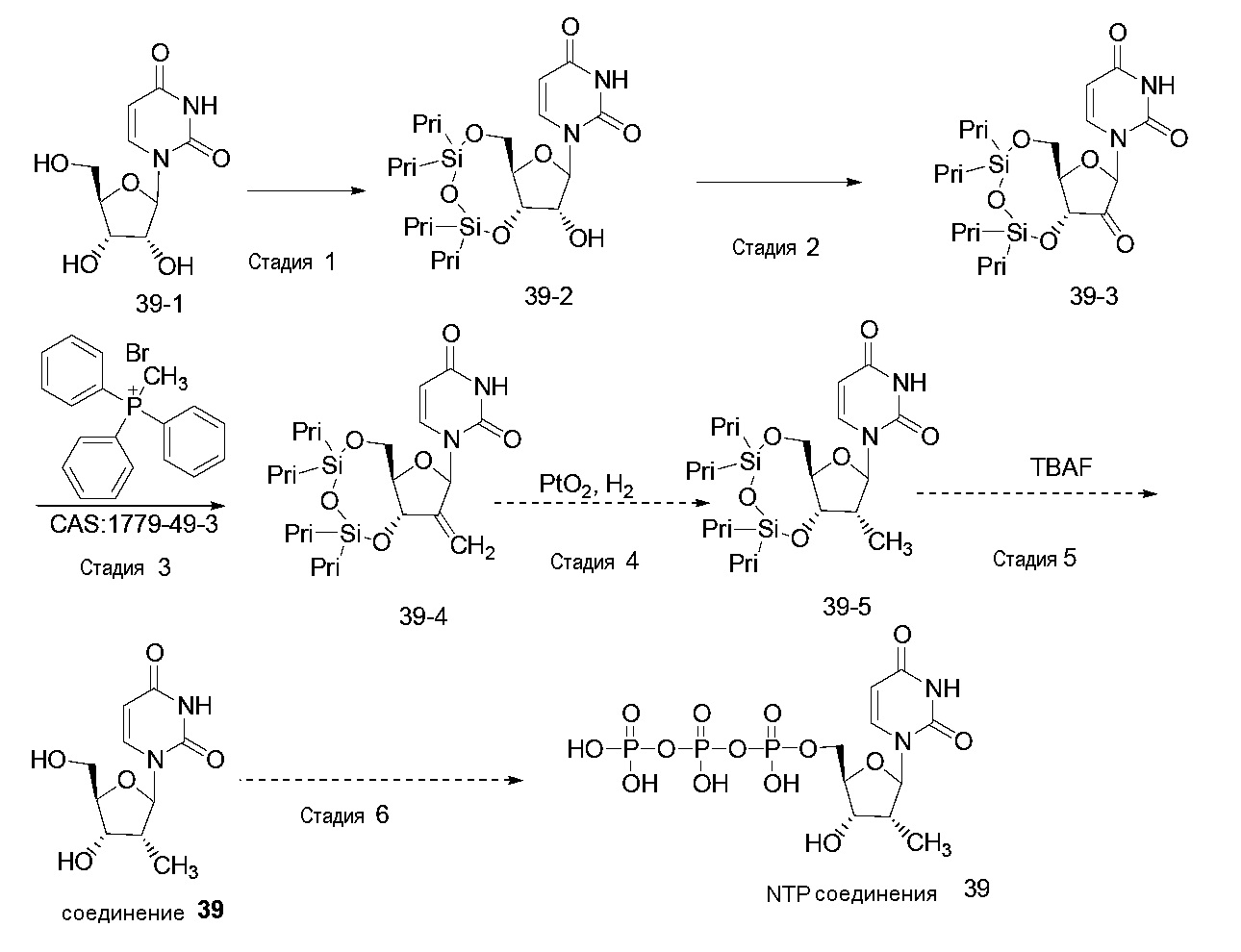
В уридин 39-1 вносили защитную группу, а затем его окисляли с помощью 2 экв. перйодинана Десс-Мартина с получением соединения 39-3. Последующие стадии реакции Виттига, гидрогенизации и удаления защитной группы обеспечили соединение 39.
Пример 47. Синтез 2’-метилцитидина (соединение 40) и 2’-метил-CTP (NTP указанного соединения)
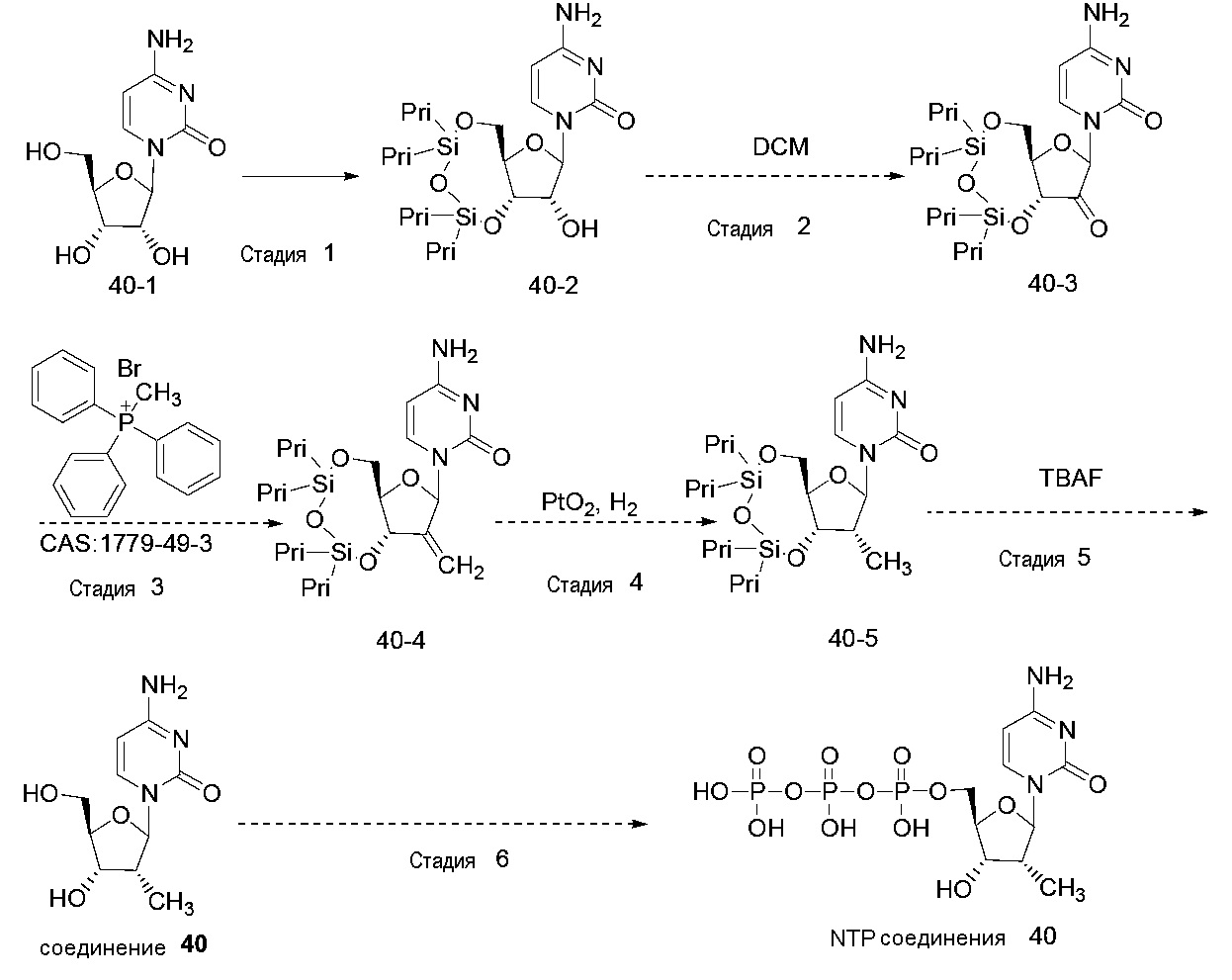
В цитидин 40-1 вносили защитную группу, а затем его окисляли с получением соединения 40-3. Последующие стадии реакции Виттига, гидрогенизации и удаления защитной группы обеспечили соединение 40.
Пример 48. Синтез N-ацетилцитидина (соединение 41) и N-ацетил-CTP (NTP указанного соединения)
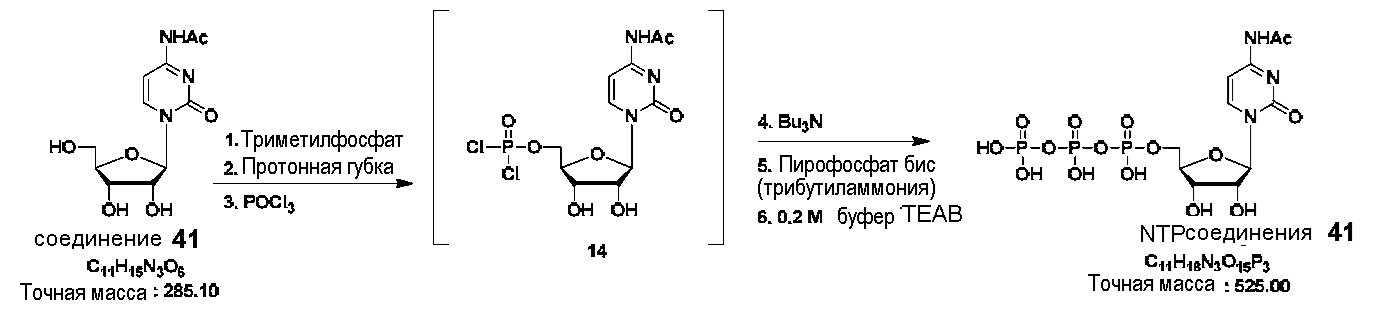
Раствор N-ацетилцитидина (соединение 41) (103,0 мг, 0,36 ммоль) добавляли к протонной губке (115,72 мг, 0,54 ммоль, 1,50 экв.) в 1,0 мл триметилфосфата (TMP) и 1,0 мл безводного тетрагидрофурана (THF). Раствор перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (67,2 мкл, 0,72 ммоль, 2,0 экв.), а затем перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (1,28 г, 2,34 ммоль, 6,5 экв.) и трибутиламина (350,0 мкл, 1,45 ммоль, 4,0 экв.) в 2,5 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 24,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, а затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 16,81-17,80 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 41. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 49. Синтез 5-метоксиуридина (соединение 42) и 5-метокси UTP (NTP указанного соединения)
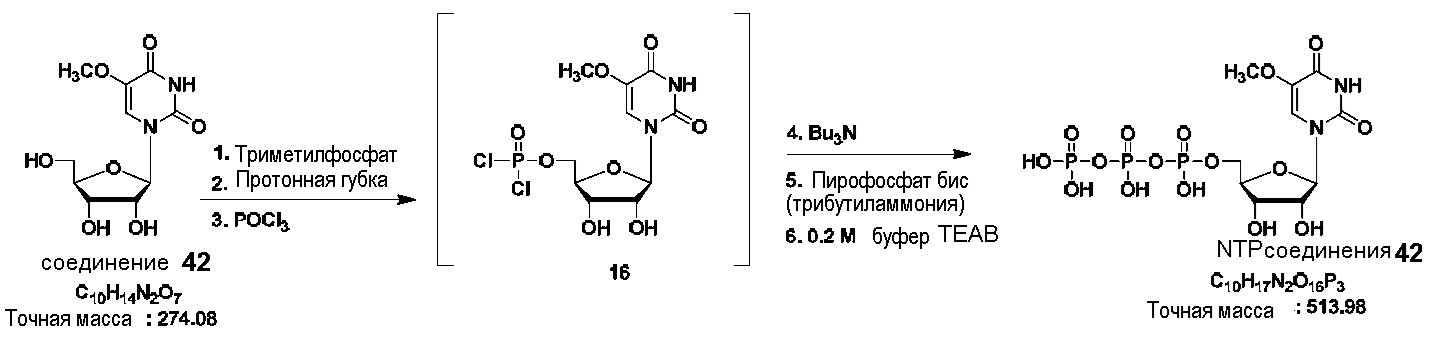
Раствор 5-метоксиуридина (соединение 42) (69,0 мг, 0,25 ммоль, вместе с нагреванием для обеспечения его растворимости) добавляли к протонной губке (80,36 мг, 0,375 ммоль, 1,50 экв.) в 0,7 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (46,7 мкл, 0,50 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (894,60 мг, 1,63 ммоль, 6,50 экв.) и трибутиламина (243,0 мкл, 1,00 ммоль, 4,0 экв.) в 2,0 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 17,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A для 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 16,57-17,51 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 42. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 50. Синтез 5-формилцитидина (соединение 43) и 5-формил CTP (NTP указанного соединения)
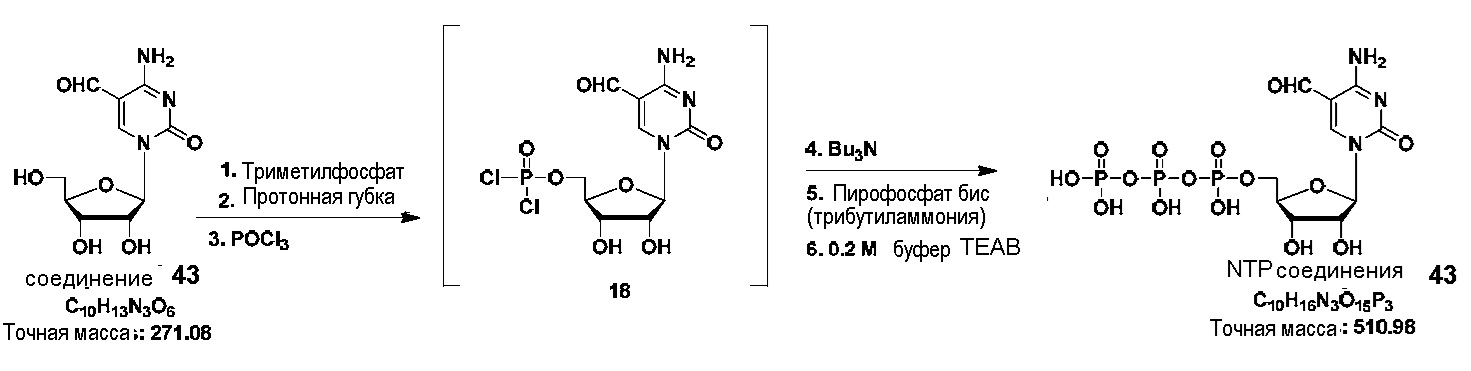
Раствор 5-формилцитидина (соединение 43) (48,4 мг, 0,18 ммоль, вместе с нагреванием, чтобы обеспечить его растворимость) добавляли к протонной губке (57,86 мг, 0,27 ммоль, 1,50 экв.) в 0,7 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (33,6 мкл, 0,36 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (642,0 мг, 1,17 ммоль, 6,50 экв.) и трибутиламина (175,0 мкл, 0,72 ммоль, 4,0 экв.) в 1,7 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 12,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 17,04-17,87 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 43. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 51. Синтез 3-метилуридина (соединение 44) и 3-метил UTP (NTP указанного соединения)
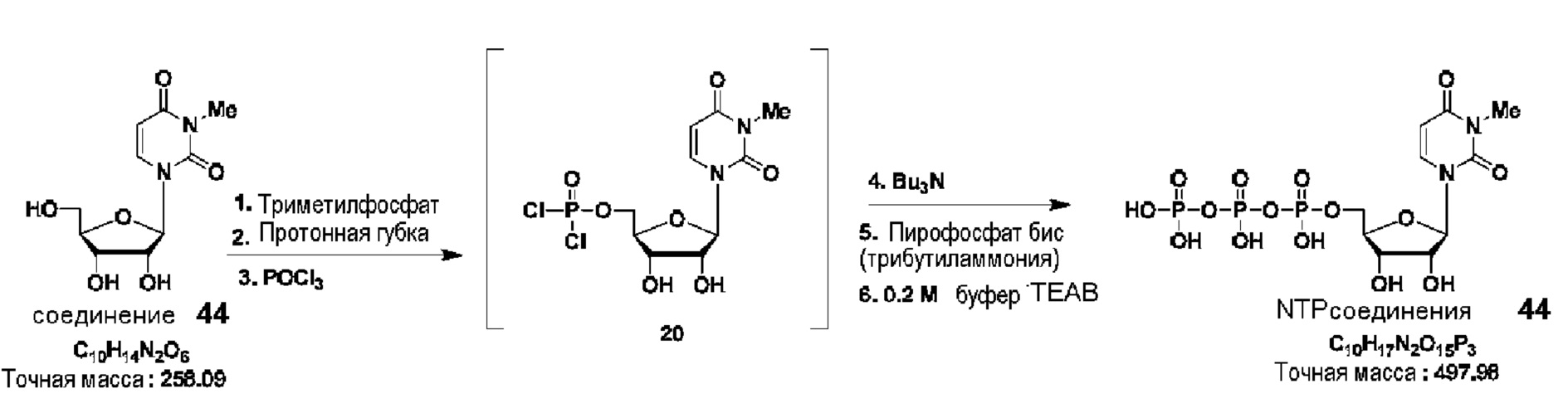
Раствор 3-метилуридина (соединение 44) (45,80 мг, 0,18 ммоль) добавляли к протонной губке (57,86 мг, 0,27 ммоль, 1,50 экв.) в 0,5 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (33,6 мкл, 0,36 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (652,0 мг, 1,19 ммоль, 6,60 экв.) и трибутиламина (175,0 мкл, 0,72 ммоль, 4,0 экв.) в 1,3 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 12,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, а затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 18,52-19,57 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 44. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 52. Синтез N1-метилпсевдоуридина (соединение 45) и N1-метилпсевдо-UTP (NTP указанного соединения)
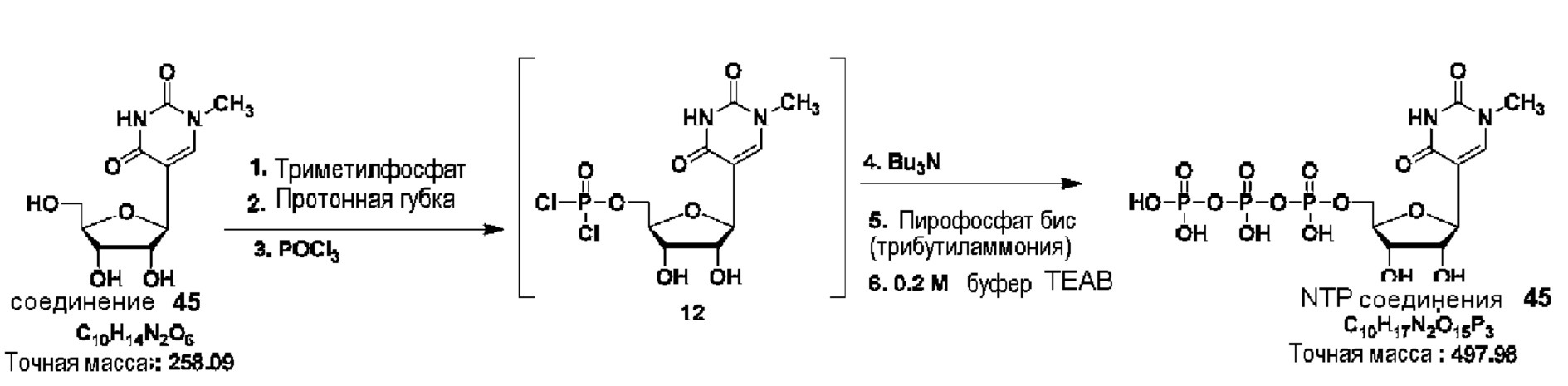
Раствор N1-метилпсевдоуридина (соединение 45) (96,6 мг, 0,374 ммоль, вместе с нагреванием, чтобы обеспечить его растворимость) добавляли к протонной губке (120,0 мг, 0,56 ммоль, 1,50 экв.) в 0,8 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (70,0 мкл, 0,75 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (1,36 г, 2,47 ммоль, 6,60 экв.) и трибутиламина (362,0 мкл, 1,5 ммоль, 4,0 экв.) в 2,5 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 17,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A для 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 15,91-17,01 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали и подвергали реакции трифосфорилирования с получением NTP соединения 45. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 53. Синтез 5-метоксикарбонилэтенилуридина (соединение 46) и 5-метоксикарбонилэтенил UTP (NTP указанного соединения)
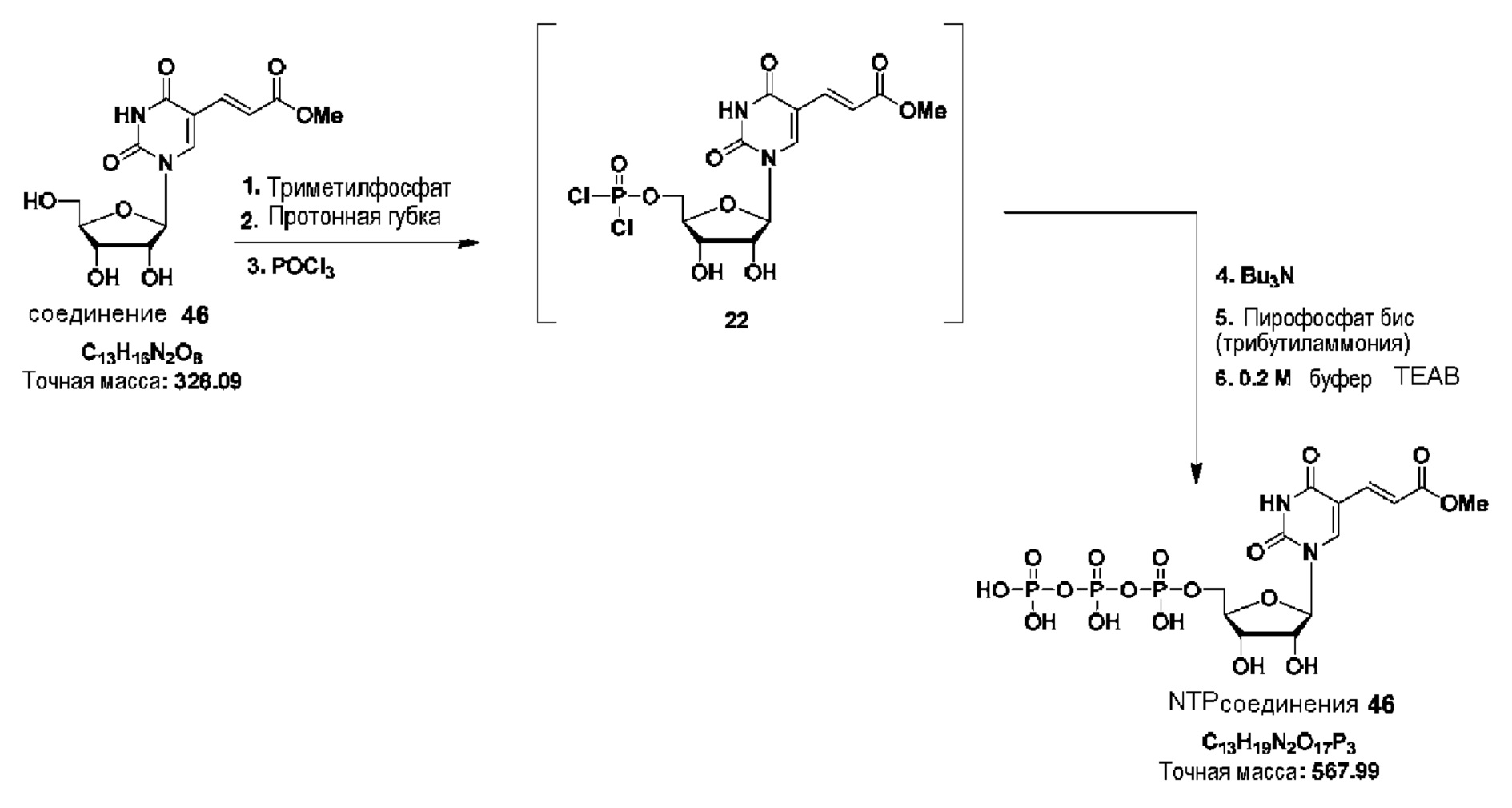
Раствор 5-метоксикарбонилэтенилуридина (соединение 46) (102,0 мг, 0,31 ммоль) добавляли к протонной губке (99,65 мг, 0,46 ммоль, 1,50 экв.) в 0,8 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (57,8 мкл, 0,62 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (1,12 г, 2,05 моль, 6,60 экв.) и трибутиламина (300,0 мкл, 1,24 ммоль, 4,0 экв.) в 2,5 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 20,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A для 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 21,56-23,21 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 46. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 54. Синтез 5-аминопропенилуридина (соединение 47) и 5-аминопропенил UTP (NTP указанного соединения)
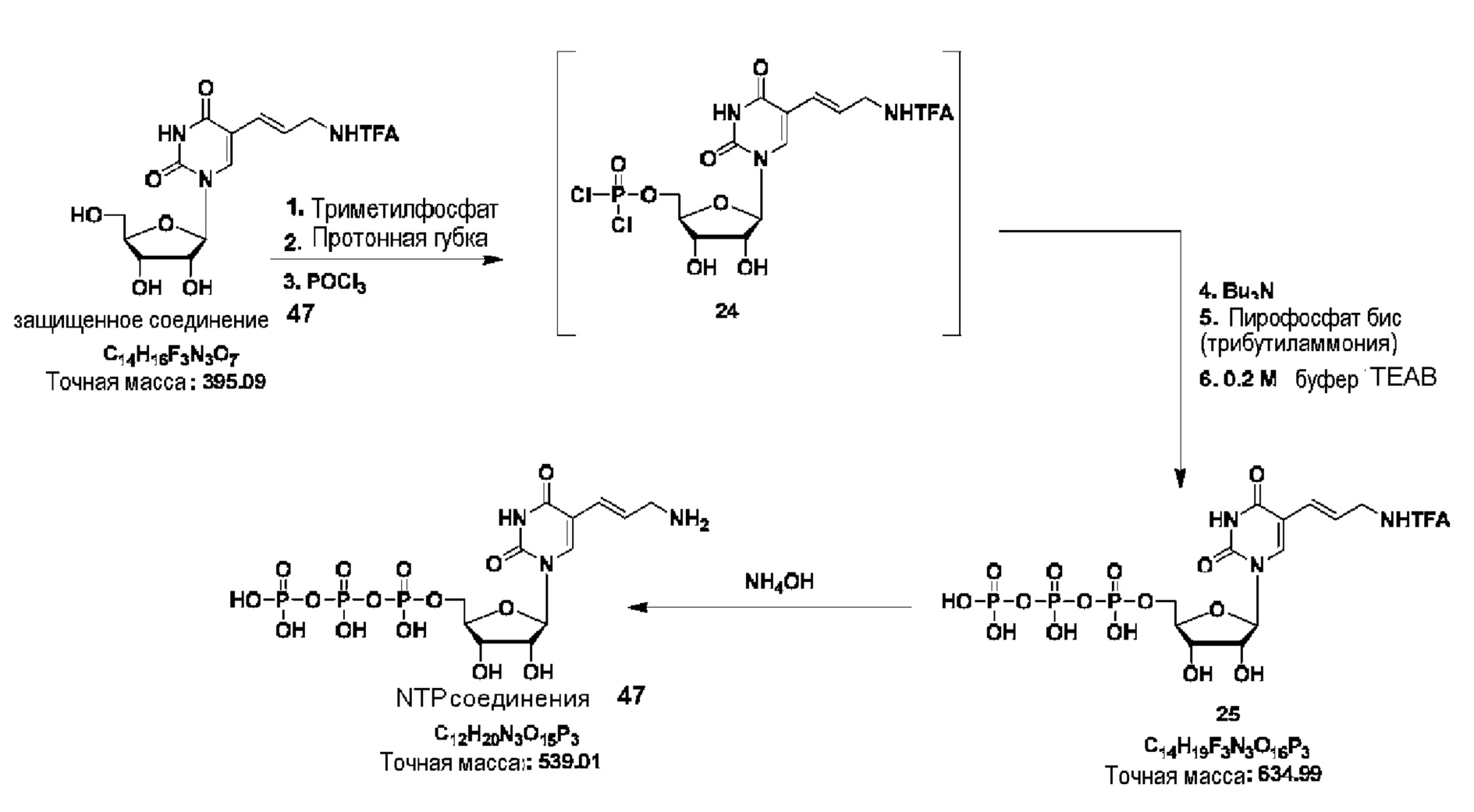
В 5-аминопропенилуридин 47 вносили защитную группу и раствор с защищенным соединением 47 (86,0 мг, 0,22 ммоль) добавляли к протонной губке (70,7 мг, 0,33 ммоль, 1,50 экв.) в 0,7 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (41,1 мкл, 0,44 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (784,6 мг, 1,43 ммоль, 6,50 экв.) и трибутиламина (213,0 мкл, 0,88 ммоль, 4,0 экв.) в 1,6 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 15,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. К реакционной смеси добавляли 18,0 мл концентрированного гидроксида аммония для удаления трифторацетильной группы. Затем ее оставляли при перемешивании в течение ночи. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 16,14-17,02 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 47. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 55. Синтез N-PEG аденозина (соединение 48) и N-PEG ATP (NTP указанного соединения)
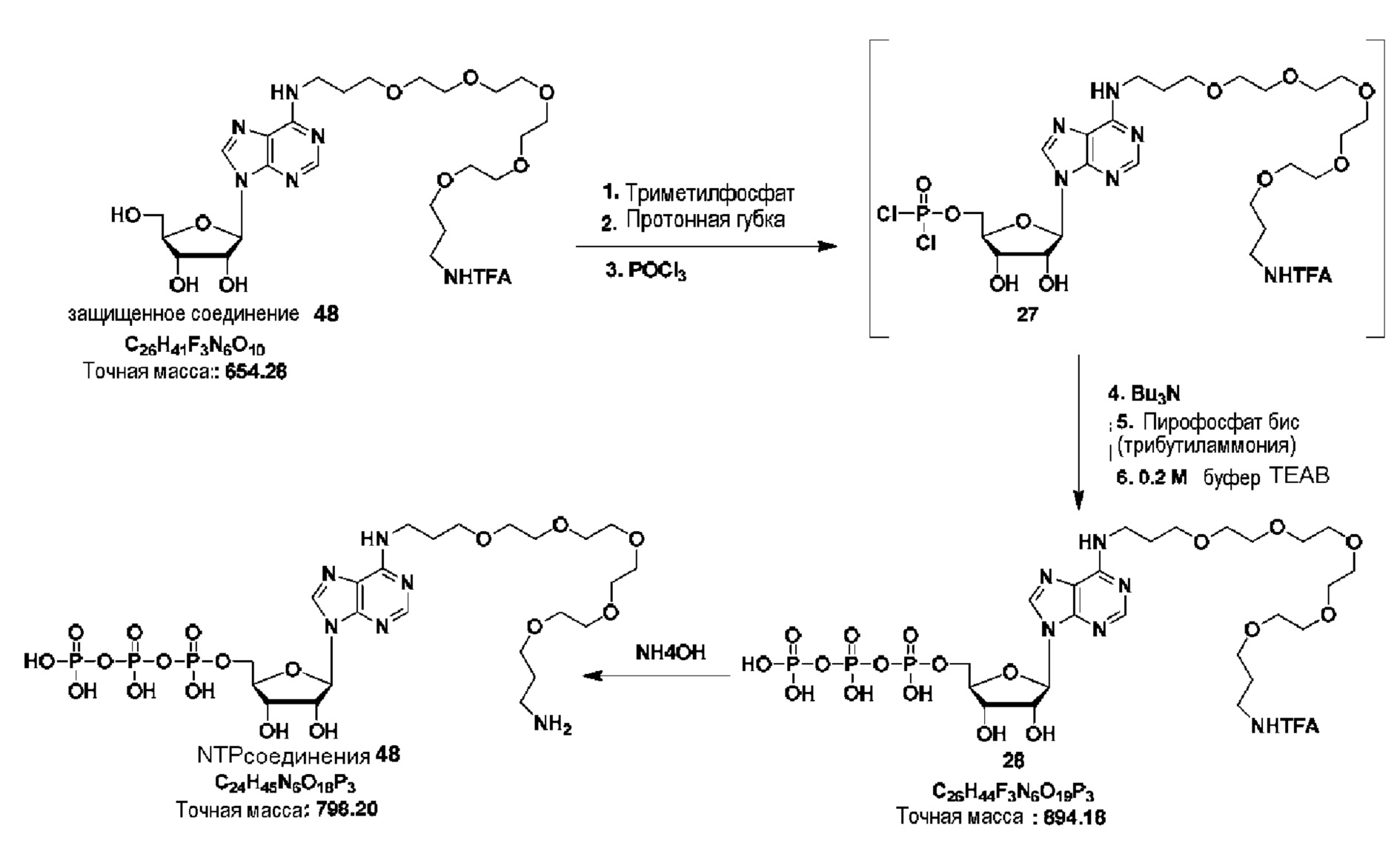
В N-PEG аденозин 48 вносили защитную группу, и раствор с защищенным соединением 48 (100,0 мг, 0,15 ммоль) добавляли к протонной губке (49,3 мг, 0,23 ммоль, 1,50 экв.) в 0,65 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (28,0 мкл, 0,3 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (537,7 мг, 0,98 ммоль, 6,50 экв.) и трибутиламина (146,0 мкл, 0,6 ммоль, 4,0 экв.) в 1,2 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 10,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. К реакционной смеси добавляли 18,0 мл концентрированного гидроксида аммония для удаления трифторацетильной группы. Затем ее оставляли при перемешивании в течение ночи. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 24,5-25,5 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 48. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 56. Синтез N-метиладенозина (соединение 49) и N-метил ATP (NTP указанного соединения)

Раствор N-метиладенозина (соединение 49) (70,0 мг, 0,25 ммоль) добавляли к протонной губке (79,29 мг, 0,37 ммоль, 1,50 экв.) в 0,7 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (46,66 мкл, 0,50 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (888,85 мг, 1,62 ммоль, 6,50 экв.) и трибутиламина (241,0 мкл, 1,0 ммоль, 4,0 экв.) в 1,3 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 16,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 19,62-20,14 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 49. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 57. Синтез N,N-диметилгуанозина (соединение 50) и N,N-диметил GTP (NTP указанного соединения)
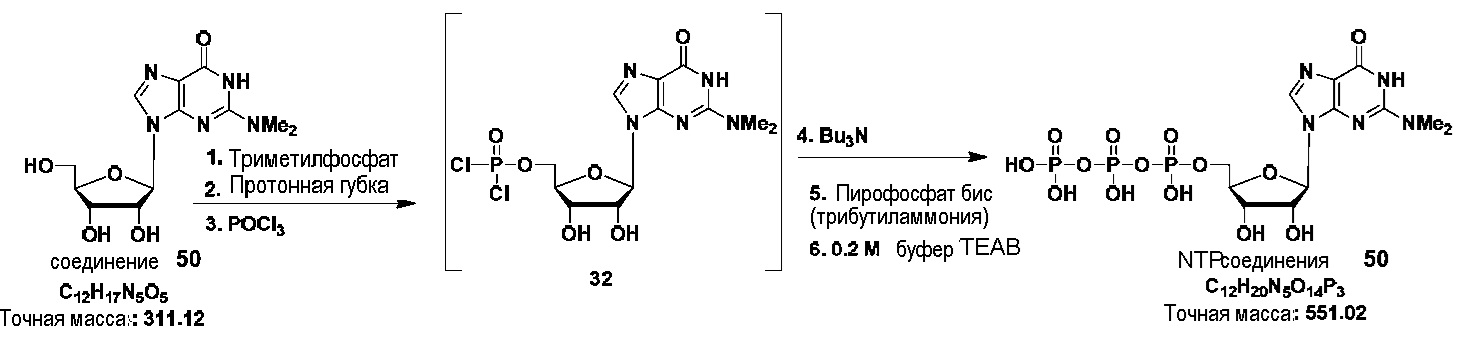
Раствор N,N-диметилгуанозина (соединение 50) (65,8 мг, 0,21 ммоль) добавляли к протонной губке (68,58 мг, 0,32 ммоль, 1,50 экв.) в 0,7 мл триметилфосфата (TMP) и перемешивали в течение 10 минут при 0°C. К раствору капельно добавляли оксихлорид фосфора (POCl3) (39,20 мкл, 0,42 ммоль, 2,0 экв.), а затем его перемешивали в течение 2 часов в атмосфере N2. Через 2 часа раствор подвергали реакции со смесью пирофосфата бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) (751,67 мг, 1,37 ммоль, 6,50 экв.) и трибутиламина (204,0 мкл, 0,84 ммоль, 4,0 экв.) в 1,5 мл диметилформамида. Приблизительно через 15 минут реакцию гасили 14,0 мл 0,2 M бикарбоната триэтиламмония (TEAB), и прозрачный раствор перемешивали при комнатной температуре в течение одного часа. Реакционную смесь лиофилизировали в течение ночи, и неочищенную реакционную смесь очищали посредством ВЭЖХ (Shimadzu, Kyoto Japan, препаративная колонка Phenomenex C18, 250×21,20 мм, 10,0 микрон; градиент: 100% A в течение 3,0 мин, затем 1% B/мин, A = 100 мМ буфер TEAB, B = ACN; скорость потока: 10,0 мл/мин; время удержания: 19,27-19,95 мин). Фракции, содержавшие желаемое соединение, объединяли и лиофилизировали с получением NTP соединения 50. Реакции трифосфорилирования проводили в колбе с двумя горлышками, высушенной пламенем, в атмосфере N2. Нуклеозиды и протонную губку сушили над P2O5в вакууме в течение ночи перед применением. Мониторинг образования монофосфатов проводили с помощью LCMS.
Пример 58. Общие способы синтеза трифосфатов NTP
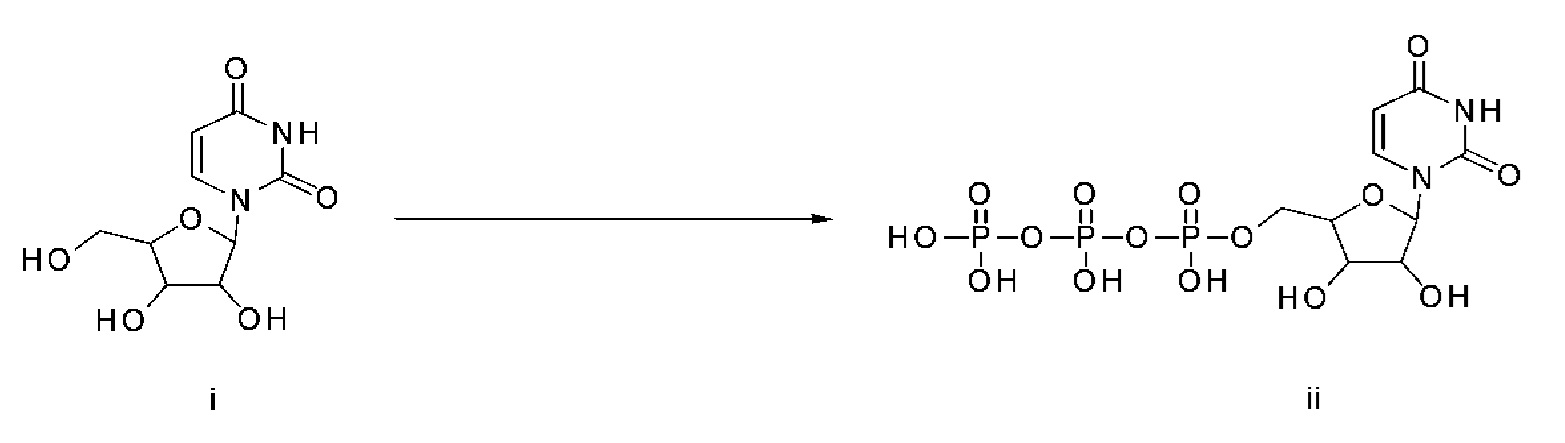
Нуклеозид i можно фосфорилировать любым подходящим способом для получения соединения трифосфата ii. Например, нуклеозид можно добавлять к протонной губке и триметилфосфату (TMP) и охлаждать (например, до -40°C). Можно капельно добавлять оксихлорид фосфора (POCl3) перед реакцией с пирофосфатом бистрибутиламмония (TBAPP или (n-Bu3NH)2H2P2O7) и трибутиламином. Затем реакцию можно быстро гасить бикарбонатом триэтиламмония (TEAB). Иллюстративные условия представлены в патенте США № 7893227, который включен в настоящее описание в качестве ссылки.
После реакции фосфорилирования реакционную смесь можно необязательно лиофилизировать, очищать (например, посредством ионообменной хроматографии и/или ВЭЖХ) или преобразовывать в соль натрия (например, путем растворения в MeOH и добавления перхлората натрия в ацетоне).
Пример 59: ПЦР для получения кДНК
Реакции ПЦР для получения кДНК проводят с использованием 2x KAPA HIFITM HotStart ReadyMix от Kapa Biosystems (Woburn, MA). Эта система включает 2x KAPA ReadyMix 12,5 мкл; прямой праймер (10 мкМ), 0,75 мкл; обратный праймер (10 мкМ), 0,75 мкл; кДНК-матрицу, 100 нг; и dH2O, разбавленную до 25,0 мкл. Условия реакции представляют собой 95°C в течение 5 мин и 25 циклов из 98°C в течение 20 сек, затем 58°C в течение 15 сек, затем 72°C в течение 45 сек, затем 72°C в течение 5 мин, а затем 4°C для терминации.
Обратный праймер по настоящему изобретению включает поли-T120 для поли-A120 в мРНК. Другие обратные праймеры с более длинными или более короткими участками поли-T можно использовать для корректирования длины поли-A-концевой части в мРНК.
Реакционнную смесь очищают с использованием набора Invitrogen’s PURELINKTM PCR Micro Kit (Carlsbad, CA) в соответствии с инструкциями изготовителя (вплоть до 5 мкг). Для реакций большего объема требуется очистка с использованием продукта с большей производительностью. После очистки кДНК количественно определяют с использованием NanoDrop и анализируют с помощью агарозного гель-электрофореза для подтверждения того, что кДНК имеет ожидаемый размер. Затем кДНК подвергают анализу с использованием секвенирования, а затем подвергают реакции транскрипции in vitro.
Пример 60. Транскрипция in vitro (IVT)
Реакция транскрипции in vitro обеспечивает образование мРНК, содержащей модифицированные нуклеотиды или модифицированную РНК. Исходную смесь нуклеотидтрифосфатов (NTP) изготавливают в собственной лаборатории с использованием природных и неприродных NTP.
Типичная реакция транскрипции in vitro включает следующее:
Инкубация при 37°C в течение 3 ч-5 ч.
Неочищенную смесь IVT можно хранить при 4°C в течение ночи для очистки на следующие сутки. Затем 1 Е не содержащей РНКазы ДНКазы используют для расщепления исходной матрицы. После инкубации в течение 15 минут при 37°C, мРНК очищают с использованием набора Ambion’s MEGACLEARTM Kit (Austin, TX) в соответствии с инструкциями изготовителей. Этот набор может очищать вплоть до 500 мкг РНК. После очистки РНК количественно определяют с использованием NanoDrop и анализируют с помощью агарозного гель-электрофореза для подтверждения того, что РНК имеет надлежащий размер и что не произошло деградации РНК.
РНК-полимераза T7 может быть выбрана из РНК-полимеразы T7, РНК-полимеразы T3 и мутантных полимераз, таких как, но не ограничиваясь ими, новые полимеразы, способные включать модифицированные NTP, а также полимеразы, описанные Liu (Esvelt et al. (Nature (2011) 472(7344):499-503 и в публикации США № 20110177495), которые распознают различные промоторы, причем в Ellington (Chelliserrykattil and Ellington, Nature Biotechnology (2004) 22(9):1155-1160) описан вариант РНК-полимеразы T7 для транскрипции 2’-O-метил РНК, и Sousa (Padilla and Sousa, Nucleic Acids Research (2002) 30(24):e128), где описан двойной мутант РНК-полимеразы T7; включенные в настоящее описание в качестве ссылок в полном объеме.
Пример 61. Ферментативное кэппирование мРНК
Кэппирование мРНК проводят следующим образом, где смесь включает: РНК IVT 60 мкг-180 мкг и dH20 вплоть до 72 мкл. Смесь инкубируют при 65°C в течение 5 минут для денатурации РНК, а затем ее сразу переносят на лед.
Затем протокол включает смешение 10x буфера для кэппирования (0,5 M Tris-HCl (pH 8,0), 60 мМ KCl, 12,5 мМ MgCl2) (10,0 мкл); 20 мМ GTP (5,0 мкл); 20 мМ S-аденозилметионина (2,5 мкл); ингибитора РНКаз (100 Е); 2′-O-метилтрансферазы (400 Е); кэппирующего фермента вируса коровьей оспы (гуанилилтрансфераза) (40 Е); dH20 (вплоть до 28 мкл); и инкубацию при 37°C в течение 30 минут для 60 мкг РНК или вплоть до 2 часов для 180 мкг РНК.
Затем мРНК очищают с использованием набора Ambion’s MEGACLEAR™ Kit (Austin, TX) в соответствии с инструкциями изготовителя. После очистки РНК количественно определяют с использованием NANODROPTM (ThermoFisher, Waltham, MA) и анализируют с помощью агарозного гель-электрофореза для подтверждения того, что РНК имеет надлежащий размер и что не произошло деградации РНК. Продукт РНК также можно секвенировать путем проведения ПЦР с обратной транскрипцией для получения кДНК для секвенирования.
Пример 62. Реакция присоединения поли-A-концевой части
Без поли-T в кДНК, реакцию присоединения поли-A-концевой части необходимо проводить до очистки конечного продукта. Это можно осуществлять путем смешения кэппированной РНК IVT (100 мкл); ингибитора РНКаз (20 Е); 10x буфера для присоединения концевой части (0,5 M Tris-HCl (pH 8,0), 2,5 M NaCl, 100 мМ MgCl2)(12,0 мкл); 20 мМ ATP (6,0 мкл); поли-A-полимеразы (20 U); dH2O вплоть до 123,5 мкл и инкубации при 37°C в течение 30 мин. Если поли-A-концевая часть уже находится в транскрипте, тогда реакцию присоединения концевой части можно пропустить и перейти прямо к очистке с помощью набора Ambion’s MEGACLEAR™ kit (Austin, TX) (вплоть до 500 мкл). Предпочтительно поли-A-полимераза является рекомбинантным ферментом, экспрессируемым в дрожжах.
Для исследований, проведенных и описанных в настоящем описании, поли-A-концевую часть кодируют в матрице IVT так, чтобы она имела длину 160 нуклеотидов. Однако следует понимать, что процессивность или целостность реакции присоединения поли-A-концевой части может не всегда приводить точно к 160 нуклеотидам. Таким образом поли-A-концевые части размером приблизительно 160 нуклеотидов, например, приблизительно 150-165, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164 или 165 нуклеотидов, находятся в объеме изобретения.
Пример 63. Способ скрининга экспрессии белка
A. Электрораспылительная ионизация
Биологический образец, который может содержать белки, кодируемые модифицированной РНК, введенной индивидууму, получают и анализируют в соответствии с протоколом изготовителя для электрораспылительной ионизации (ESI) с использованием 1, 2, 3 или 4 масс-анализаторов. Биологический образец также можно анализировать с использованием системы тандемной ESI масс-спектрометрии.
Профили белковых фрагментов или целых белков сравнивают с известными контролями для данного белка и определяют идентичность путем сравнения.
B. Лазерная десорбция/ионизация в присутствии матрицы
Биологический образец, который может содержать белки, кодируемые модифицированной РНК, введенной индивидууму, получают и анализируют в соответствии с протоколом изготовителя для лазерной десорбции/ионизации в присутствии матрицы (MALDI).
Профили белковых фрагментов или целых белков сравнивают с известными контролями для данного белка и определяют идентичность путем сравнения.
C. Жидкостная хроматография-масс-спектрометрия-масс-спектрометрия
Биологический образец, который может содержать белки, кодируемые модифицированной РНК, можно обрабатывать ферментом трипсином для расщепления белков, содержащихся в нем. Полученные пептиды анализируют жидкостной хроматографией-масс-спектрометрией-масс-спектрометрей (LC/MS/MS). Пептиды фрагментируют в масс-спектрометре с получением диагностических профилей, которые можно сопоставлять с базами данных белковой последовательности через компьютерные алгоритмы. Расщепленный образец можно разбавлять для достижения 1 нг или менее исходного материала для данного белка. Биологические образцы, содержащие простую буферную основу (например воду или летучие соли), поддаются прямому расщеплению в растворе; более комплексные основы (например детергент, нелетучие соли, глицерин) требуют дополнительной стадии очистки для облегчения анализа образца.
Профили белковых фрагментов или целых белков сравнивают с известными контролями для данного белка и идентичность определяют путем сравнения.
Пример 64. Исследование цитокинов: PBMC
A. Выделение и культивирование PBMC
50 мл крови человека от двух доноров получали от Research Blood Components (партии KP30928 и KP30931) в пробирках с гепарином натрия. Для каждого донора кровь объединяли и разбавляли до 70 мл посредством DPBS (SAFC Bioscience 59331C, партия 071M8408) и разделяли равномерно между двумя 50-мл коническими пробирками. 10 мл Ficoll Paque (GE Healthcare 17-5442-03, партия 10074400) осторожно распределяли под слой крови. Пробирки центрифугировали при 2000 об/мин в течение 30 минут при низком ускорении и торможении. Пробирки извлекали, и слои лейкоцитарных пленок PBMC осторожно переносили в свежие 50-мл конические пробирки и промывали DPBS. Пробирки центрифугировали при 1450 об/мин в течение 10 минут.
Супернатант аспирировали, и осадки с PBMC ресуспендировали и промывали в 50 мл DPBS. Пробирки центрифугировали при 1250 об/мин в течение 10 минут. Эту стадию повторяли, и осадок с PBMC ресуспендировали в 19 мл Optimem I (Gibco 11058, партия 1072088) и подсчитывали. Суспензии клеток доводили до концентрации 3,0×10^6 клеток/мл живых клеток.
Затем эти клетки высевали на 96-луночные планшеты для культивирования ткани с круглым дном (Costar 3799) на донора в количестве 50 мкл на лунку. В пределах 30 минут в каждую лунку добавляли смеси для трансфекции в объеме 50 мкл на лунку. Через 4 часа после трансфекции среду дополняли 10 мкл эмбриональной телячьей сывороткой (Gibco 10082, партия 1012368).
B. Препарат для трансфекции
Модифицированную мРНК, кодирующую G-CSF человека (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть длиной приблизительно 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) (содержащая либо (1) природные NTP, (2) 100% замещение 5-метилцитидином и псевдоуридином, или (3) 100% замещение 5-метилцитидином и N1-метилпсевдоуридином; мРНК, кодирующую люциферазу (последовательность кДНК IVT, представленная в SEQ ID NO: 2; последовательность мРНК, представленная в SEQ ID NO: 3, поли-A-концевая часть длиной приблизительно 160 нуклеотидов, не показанная в последовательности, 5’-кэп, кэп 1, полностью модифицирована 5-метилцитозином в каждом остатке цитозина и заменой на псевдоуридин в каждом участке уридина) (содержащая либо (1) природные NTP, либо (2) 100% замену на 5-метилцитидин и псевдоуридин) и агонист TLR R848 (Invivogen tlrl-r848) разбавляли до 38,4 нг/мкл в конечном объеме 2500 мкл Optimem I.
Отдельно, 110 мкл Lipofectamine 2000 (Invitrogen 11668-027, партия 1070962) разбавляли 6,76 мл Optimem I. В 96-луночном планшете девять аликвот каждой мРНК по 135 мкл, положительный контроль (R-848) или отрицательный контроль (Optimem I) добавляли к 135 мкл разбавленного Lipofectamine 2000. Планшет, содержащий материал, подлежащий переносу, инкубировали в течение 20 минут. Затем смеси для трансфекции переносили в каждый из планшетов с PBMC человека в количестве 50 мкл на лунку. Затем планшеты инкубировали при 37°C. Через 2, 4, 8, 20 и 44 часа каждый планшет извлекали из инкубатора, и супернатанты замораживали.
После удаления последнего планшета супернатанты анализировали с использованием набора для ELISA для G-CSF человека (Invitrogen KHC2032) и набора для ELISA для IFN-альфа человека (Thermo Scientific 41105-2). Каждые условия исследовали в двух экземплярах.
C. Анализ белка и врожденного иммунного ответа
Оценивали способность немодифицированной и модифицированной мРНК продуцировать кодируемый белок (продукция G-CSF) с течением времени, а также способность мРНК запускать распознавание врожденным иммунитетом при измерении по продукции интерферона-альфа. Использование культур PBMC in vitro является общепризнанным способом измерения иммуностимулирующего потенциала олигонуклеотидов (Robbins et al., Oligonucleotides 2009 19:89-102).
Результаты интерполировали относительно стандартной кривой для каждого планшета для ELISA с использованием четырехпараметрической аппроксимации логистической кривой. В таблицах 4 и 5 представлено среднее значение для 3 отдельных доноров PBMC продукции G-CSF, интерферона-альфа (IFN-альфа) и фактора некроза опухоли-альфа (TNF-альфа) с течением времени при измерении с помощью специфического для них ELISA.
В ELISA для G-CSF, для каждого момента времени вычитали фоновый сигнал для условий без обработки Lipofectamine 2000 (LF2000). Данные продемонстрировали, что специфическая продукция белка G-CSF человека мононуклеарными клетками периферической крови человека наблюдается в случае мРНК G-CSF, содержащей природные NTP, 100% замену на 5-метилцитидин и псевдоуридин, или 100% замену на 5-метилцитидин и N1-метилпсевдоуридин. Продукция G-CSF была значительно увеличена при использовании мРНК, модифицированной 5-метилцитидином и N1-метилпсевдоуридином, относительно мРНК, модифицированной 5-метилцитидином и псевдоуридином мРНК.
Что касается распознавания врожденным иммунитетом, хотя обе модифицированные химические структуры мРНК в большой степени препятствовали продукции IFN-альфа и TNF-альфа относительно положительных контролей (R848, p(I)p(C)), не существовало значимых отличий между этими химическими структурами. Модифицированная 5-метилцитидином и псевдоуридином мРНК приводила к низким, но поддающимся обнаружению уровням продукции IFN-альфа и TNF-альфа, в то время как модифицированная 5-метилцитидином и N1-метилпсевдоуридином мРНК приводила к отсутствию поддающейся обнаружению продукции IFN-альфа и TNF-альфа.
Следовательно, было определено, что, в дополнение к необходимости рассмотрения более одного цитокина-маркера активации врожденного иммунного ответа, неожиданно было обнаружено, что комбинации модификаций обеспечивают различные уровни клеточного ответа (продукция белка и активация иммунной системы). Было показано, что модификация N1-метилпсевдоуридином обеспечивает дополнительную защиту относительно стандартной комбинации 5-метилцитидин/псевдоуридин, исследованную другими исследователями, обеспечивая в два раза большее количество белка и снижение активации иммунной системы практически в 150 раз (TNF-альфа).
Учитывая, что PBMC содержат большой набор сигнализаторов распознавания РНК врожденным иммунитетом и также способны к трансляции белка, они обеспечивают пригодную систему для исследования взаимозависимости этих двух каскадов. Известно, что на трансляцию мРНК может отрицательно влиять активация таких каскадов врожденного иммунитета (Kariko et al. Immunity (2005) 23:165-175; Warren et al. Cell Stem Cell (2010) 7:618-630). С использованием PBMC в качестве системы для анализа in vitro можно установить корреляцию между трансляцией (в этом случае продукцией белка G-CSF) и продукцией цитокинов (в этом случае иллюстрируемой продукцией белков IFN-альфа и TNF-альфа). Лучшая продукция белка коррелирует с более низкой индукцией каскада активации врожденного иммунитета, и исходя из этого соотношения новые химические структуры можно оценивать положительно (таблица 6).
В этом исследовании соотношение PC для двух химических модификаций: псевдоуридина и N1-метилпсевдоуридина, в обоих случаях с 5-метилцитозином, составляло 4742/141=34 по сравнению с 9944/1=9944 для цитокина IFN-альфа. Для цитокина TNF-альфа эти две химические структуры имели соотношения PC 153 и 1243, соответственно, что указывает на то, что для любого цитокина N1-метилпсевдоуридин является лучшей модификацией. В таблицах 4 и 5 "NT" означает "не исследовали".
Пример 65. Диапазоны химических модификаций модифицированной мРНК
Было показано, что модифицированные нуклеозиды, такие как, но не ограничиваясь ими, химические модификации 5-метилцитозина и псевдоуридина снижают врожденный иммунный ответ и увеличивают экспрессию РНК в клетках млекопитающих. Неожиданно и ранее неизвестно, что эффекты этих химических модификаций могут варьировать, когда уровень химической модификации конкретного нуклеотида составляет менее 100%. Ранее полагали, что польза от химической модификации может быть получена с использованием менее чем полной замены модифицированным нуклеозидом и в опубликованных отчетах отсутствуют указания на утрату пользы до тех пор, пока уровень замещения модифицированным нуклеозидом не составит менее 50% (Kariko et al., Immunity (2005) 23:165-175).
Однако теперь было показано, что польза от химической модификации прямо коррелирует со степенью химической модификации, и ее необходимо рассматривать с учетом более чем одного показателя иммунного ответа. Такая польза включает усиленную продукцию белка или трансляцию мРНК и снижение или устранение стимуляции врожденного иммунного ответа при измерении по профилям цитокинов и показателям индуцирующих факторов иммунного ответа.
Усиленную трансляцию мРНК и снижение или отсутствие стимуляции врожденного иммунитета наблюдают в случае 100% замены модифицированным нуклеозидом. Меньшие проценты замещения приводят к меньшей трансляции и большей стимуляции врожденного иммунитета, причем немодифицированная мРНК демонстрирует более низкую трансляцию и более высокую стимуляцию врожденного иммунитета.
Исследования на PBMC in vitro: Процентная модификация
480 нг мРНК G-CSF, модифицированной 5-метилцитозином (5mC) и псевдоуридином (псевдо-U), или немодифицированной мРНК G-CSF трансфицировали с 0,4 мкл Lipofectamine 2000 в мононуклеарные клетки периферической крови (PBMC) от трех здоровых доноров крови (D1, D2 и D3). мРНК G-CSF (SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) была полностью модифицирована 5mC и псевдо-U (100% модификация), не модифицирована 5mC и псевдо-U (0% модификация) или была частично модифицирована 5mC и псевдо-U так, чтобы мРНК содержала 75% модификацию, 50% модификацию или 25% модификацию. Контрольный образец люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная посредством 5meC и псевдоU) также анализировали в отношении экспрессии G-CSF. Для TNF-альфа и IFN-альфа также анализировали контрольные образцы из Lipofectamine 2000, LPS, R-848, люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная 5mC и псевдо-U) и P(I)P(C). Супернатант собирали и анализировали с помощью ELISA через 22 часа после трансфекции для определения экспрессии белка. Экспрессия G-CSF представлена в таблице 7, и экспрессия IFN-альфа и TNF-альфа представлена в таблице 8. Экспрессия IFN-альфа и TNF-альфа может быть вторичным эффектом трансфекции мРНК G-CSF. В таблицах 7, 8 и на фиг.10 показано, что уровень химической модификации G-CSF, интерферона альфа (IFN-альфа) и фактора некроза опухоли-альфа (TNF-альфа) варьирует, когда мРНК не полностью модифицирована и тенденция к варьированию не была одинаковой для каждой мишени.
Как упоминалось выше, с использованием PBMC в качестве системы для анализа in vitro можно установить корреляцию между трансляцией (в этом случае продукции белка G-CSF) и продукцией цитокинов (в этом случае иллюстрируемой продукцией белка IFN-альфа). Лучшая продукция белка коррелирует с более низкой индукцией каскада активации врожденного иммунитета, и, исходя из этого соотношения, процентную модификацию химической структуры можно оценивать положительно (таблица 9). Как вычислено из таблиц 7 и 8 и показано в таблице 9, полная модификация на 5-метилцитидин и псевдоуридин демонстрирует значительно лучшее соотношение продукции белок/цитокин, чем без какой-либо модификации (природная мРНК G-CSF) (в 100 раз для IFN-альфа и в 27 раз для TNF-альфа). Частичная модификация демонстрирует линейную взаимосвязь с меньшей модификацией, обеспечивающей более низкое соотношение белок/цитокин.
Таблица 9
Соотношение PC и эффект процента модификации
Пример 66. Модифицированная РНК, трансфицированная в PBMC
500 нг мРНК G-CSF, модифицированной 5-метилцитозином (5mC) и псевдоуридином (псевдо-U), или немодифицированной мРНК G-CSF трансфицировали с 0,4 мкл Lipofectamine 2000 в мононуклеарные клетки периферической крови (PBMC) от трех нормальных доноров крови (D1, D2 и D3). мРНК G-CSF (SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) была полностью модифицирована 5mC и псевдо-U (100% модификация), не модифицирована 5mC и псевдо-U (0% модификация) или частично модифицирована 5mC и псевдо-U так, чтобы мРНК содержала 50% модификацию, 25% модификацию, 10% модификацию, 5% модификацию, 1% модификацию или 0,1% модификацию. Контрольный образец mCherry (последовательность мРНК, представленная в SEQ ID NO: 6; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная 5meC и псевдоуридином) и G-CSF, полностью модифицированный 5-метилцитозином и псевдоуридином (контроль G-CSF), также анализировали в отношении экспрессии G-CSF. Для фактора некроза опухоли-альфа (TNF-альфа) и интерферона-альфа (IFN-альфа) также анализировали контрольные образцы из Lipofectamine 2000, LPS, R-848, люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная 5mC и псевдо-U) и P(I)P(C). Супернатант собирали через 6 часов и 18 часов после трансфекции и анализировали с помощью ELISA для определения экспрессии белка. Экспрессия G-CSF, IFN-альфа и TNF-альфа для донора 1 представлена в таблице 10, для донора 2 представлена в таблице 11 и для донора 3 представлена в таблице 12.
Полная 100% модификация 5-метилцитидином и псевдоуридином приводила к наибольшей трансляции белка (G-CSF) и наименьшее количество цитокина продуцировалось у всех трех доноров PBMC человека. Снижение уровней модификации приводит к большей продукции цитокинов (IFN-альфа и TNF-альфа), таким образом, далее подчеркивая важность полной модификации для снижения уровня цитокинов и для увеличения трансляции белка (о чем свидетельствует в данном случае продукция G-CSF).
Пример 67. Скрининг модификации с помощью обратных мутаций способом Microames
Уровень техники и способы
Скрининг Microames является версией полного анализа с предварительной инкубацией Ames. Он обнаруживает как мутации со сдвигом рамки считывания, так и мутации с заменой пар оснований, с использованием четырех тестовых штаммов Salmonella (TA97a, TA98, TA100 и TA1535) и одного штамма Escherichia coli (WP2 uvrA pKM101). Штаммы TA97a и TA98 обнаруживают мутации со сдвигом рамки считывания, и TA100, TA1535 и WP2 uvrA pKM101 обнаруживают мутации с заменой пар оснований. В этом испытании Ames уменьшенного масштаба используется минимальное количество соединения, его проводят с метаболической активацией или без нее (фракция S9), и в нем используются многолуночные планшеты. Это испытание представляет собой анализ с помощью микробов для обнаружения мутагенного потенциала исследуемых соединений.
Скрининг microAmes для исследуемых образцов с 5-метилцитидином, псевдоуридином или N’-метилпсевдоуридином исследовали в двух экземплярах со штаммами TA97a, TA98, TA100, TA1535 и WP2 uvrA pKM101 в присутствии и в отсутствие системы метаболической активации (фракция микросом индуцированных печени крысы S9 AROCLORTM 1254) в количестве 0,25, 2,5, 12,5, 25, 75 и 250 мкг/лунка. Соединения положительного контроля использовали в 4 различных концентрациях для обеспечения того, что система анализа является чувствительной к известным мутагенным соединениям. DMSO использовали в качестве контроля в виде носителя. Положительный контроль и контроль в виде носителя дали ожидаемые результаты, что демонстрирует, что скрининг microAmes является достаточно чувствительным для обнаружения мутагенов.
Результаты
В случае 5-метилцитозина преципитатов не наблюдали в случае какого-либо тестового штамма как с метаболической активацией, так и без нее. Цитотоксичности (уменьшение фонового "газона" и/или количества ревертантов) не наблюдали ни для какого штамма, как с метаболической активацией, так и без нее. Не было увеличения количества колоний ревертантов по сравнению с контролем в виде носителя ни в одном штамме с метаболической активацией или без нее. Таким образом, 5-метилцитидин не был мутагенным вплоть до 250 мкг/лунка в штаммах TA97a, TA98, TA100, TA1535 и WP2 uvrA pKM101 с метаболической активацией или без нее в условиях скрининга microAmes.
В случае псевдоуридина преципитатов не наблюдали ни для какого тестового штамма, как с метаболической активацией, так и без нее. Цитотоксичность (уменьшение количества ревертантов) наблюдали для штамма TA100 без метаболической активации. Цитотоксичности (уменьшение фонового "газона" и/или количества ревертантов) не наблюдали ни для какого другого штамма, как с метаболической активацией, так и без нее. Не было увеличения количества колоний ревертантов по сравнению с контролем в виде носителя ни в одном штамме с метаболической активацией или без нее. Таким образом, псевдоуридин не был мутагенным в количестве вплоть до 75 мкг/лунка в штамме TA100 без метаболической активации и вплоть до 250 мкг/лунка в штаммах TA97a, TA98, TA1535 и WP2 uvrA pKM101 с метаболической активацией или без нее и в штамме TA100 без метаболической активации в условиях этого скрининга microAmes.
В случае модификации N1-метилпсевдоуридином, преципитатов не наблюдали ни для какого тестового штамма с метаболической активацией или без нее. Цитотоксичности (уменьшение фонового "газона" и/или количества ревертантов) не наблюдали ни в одном штамме, как с метаболической активацией, так и без нее. Не было увеличения количества колоний ревертантов по сравнению с каким-либо контролем в виде носителя ни в одном штамме с метаболической активацией или без нее. N1-метилпсевдоуридин не был мутагенным в количестве вплоть до 250 мкг/лунка в штаммах TA97a, TA98, TA100, TA1535 и WP2 uvrA pKM101 с метаболической активацией или без нее в условиях этого скрининга microAmes. Было обнаружено, что N1-метилпсевдоуридин является менее мутагенным, чем псевдоуридин.
Сравнение в этом испытании microAMES 5-метилцитидина, псевдоуридина и N1-метилпсевдоуридина показало, что они в основном являются немутагенными. Однако особый интерес представляло различие между псевдоуридином и N1-метилпсевдоуридином, где псевдоуридин продемонстрировал цитотоксический ответ в одном бактериальном штамме, в котором N1-метилпсевдоуридин не продемонстрировал. Эти испытания microAMES регулярно используют в качестве части доклинической оценки безопасности соединения, и они подчеркивают важное отличие между N1-метилпсевдоуридином и псевдоуридином.
Пример 68. Токсичность нуклеозидтрифосфатов (NTP)
Цитотоксичность природных и модифицированных нуклеозидтрифосфатов (NTP), отдельно или в комбинации с другими основаниями, анализировали в клетках почки эмбриона человека 293 (HEK293) в отсутствие реагента для трансфекции. Клетки HEK293 высевали на 96-луночные планшеты при плотности 30000 клеток на лунку, имеющие 0,75 мкл RNAiMAXTM (Invitrogen, Carlsbad, CA) на лунку в общем объеме лунки 100 мкл. 10 мкл NTP, приведенных в таблице 12, комбинировали с 10 мкл разведения липида и инкубировали в течение 30 минут для формирования комплекса, а затем к комплексу NTP добавляли 80 мкл суспензии клеток HEK293.
Природные и модифицированные NTP трансфицировали в концентрации 2,1 нМ, 21 нМ, 210 нМ, 2,1 мкМ, 21 мкМ, 210 мкМ или 2,1 мМ. NTP в комбинации трансфицировали в общей концентрации NTP 8,4 нМ, 84 нМ, 840 нМ, 8,4 мкМ, 84 мкМ, 840 мкМ и 8,4 мМ. В качестве контроля модифицированную мРНК G-CSF (SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная 5-метилцитозином и псевдоуридином) трансфицировали в клетки HEK293 в концентрации 8,4 нМ. Цитотоксичность NTP и модифицированной мРНК G-CSF анализировали через 4, 24, 48 и 72 часа после добавления клеток HEK293 с использованием анализа CYTO TOX-GLOTM от Promega (Madison, WI) в соответствии с протоколом изготовителя, за исключением того, что вместо встряхивания планшетов для лизиса клеток использовали пипетирование.
В таблице 13 и 14 показан процент жизнеспособных клеток для каждого из исследованных NTP, комбинаций NTP и контролей. Не наблюдали токсичности в случае индивидуальных NTP по сравнению с необработанными клетками. Эти данные демонстрируют, что введение индивидуальных NTP, включая 5-метилцитидин, псевдоуридин и N1-метилпсевдоуридин, в клетки млекопитающих не является токсичным в дозах, в 1000000 раз превышающих эффективную дозу при введении в качестве модифицированной мРНК.
Пример 69. Исследование врожденного иммунного ответа в фибробластах BJ
Первичные фибробласты крайней плоти человека (BJ fibroblasts) получали от American Type Culture Collection (ATCC) (каталожный номер # CRL-2522) и выращивали в минимальной эссенциальной среде Игла (ATCC, каталожный номер # 30-2003), дополненной 10% эмбриональной телячьей сывороткой при 37°C в 5% CO2. Фибробласты BJ высевали на 24-луночный планшет при плотности 300000 клеток на лунку в 0,5 мл культуральной среды. 250 нг модифицированной мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной 5-метилцитозином и псевдоуридином (Gen1) или полностью модифицированной 5-метилцитозином и N1-метилпсевдоуридином (Gen2), имеющей кэп 0, кэп 1 или не имеющей кэпа, трансфицировали с использованием Lipofectamine 2000 (Invitrogen, каталожный номер #11668-019) в соответствии с протоколом изготовителя. Также трансфицировали контрольные образы из поли I:C (PIC), Lipofectamine 2000 (Lipo), природной люциферазы мРНК (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) и природной мРНК G-CSF. Через 18 часов клетки собирали, тотальную РНК выделяли и обрабатывали DNASE® с использованием набора RNeasy micro kit (каталожный номер #74004) в соответствии с протоколом изготовителя. 100 нг тотальной РНК использовали для синтеза кДНК с использованием набора для высокопроизводительной обратной транскрипции кДНК (каталожный номер #4368814) в соответствии с протоколом изготовителя. Затем кДНК анализировали в отношении экспрессии генов врожденного иммунного ответа посредством количественной ПЦР в реальном времени с использованием SybrGreen на устройстве Biorad CFX 384 в соответствии с протоколом изготовителя. В таблице 15 представлен уровень экспрессии транскриптов генов врожденного иммунного ответа относительно гена домашнего хозяйства HPRT (гипоксантинфосфорибозилтрансфераза), и он выражен в качестве кратной индукции относительно HPRT. В таблице панель стандартных показателей включает: RIG-I представляет собой индуцируемый ретиноевой кислотой ген 1, IL6 представляет собой интерлейкин-6, OAS-1 представляет собой олигоаденилатсинтетазу 1, IFNb представляет собой интерферон-бета, AIM2 представляет собой отсутствующий в меланоме-2, IFIT-1 представляет собой индуцируемый интерфероном белок с тетратрикопептидными повторами 1, PKR представляет собой протеинкиназу R, TNFa представляет собой фактор некроза опухоли альфа, и IFNa представляет собой интерферон альфа.
Пример 70. Обнаружение врожденного иммунного ответа in vivo
В попытках определить важность различных химических модификаций мРНК для продукции белков и цитокинового ответа in vivo, самкам мышей BALB/C (n=5) внутримышечно инъецируют мРНК G-CSF (мРНК GCSF, немодифицированная) (мРНК последовательность, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности) с 5’-кэпом кэп 1, мРНК G-CSF, полностью модифицированной 5-метилцитозином и псевдоуридином (мРНК GCSF 5mc/pU), мРНК G-CSF, полностью модифицированной 5-метилцитозином и N1-метилпсевдоуридином (мРНК GCSF 5mc/N1pU) с или без 5’-кэпа (мРНК GCSF 5mc/N1 pU, без кэпа), или контроль в виде либо R848, либо 5% сахарозы, как описано в таблице 16.
Взятие крови проводят через 8 часов после введения. С использованием ELISA уровни белка G-CSF, TNF-альфа и IFN-альфа определяют с помощью ELISA. Через 8 часов после дозирования извлекают мышцу из области инъекции и используют количественную полимеразную цепную реакцию в реальном времени (QPCR) для определения уровней мРНК RIG-I, PKR, AIM-2, IFIT-1, OAS-2, MDA-5, IFN-бета, TNF-альфа, IL-6, G-CSF, CD45 в мышце.
Пример 71. Исследование по обнаружению врожденного иммунного ответа in vivo
Самкам мышей BALB/C (n=5) инъецировали внутримышечно мРНК G-CSF (мРНК GCSF, немодифицированая) (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности;) с 5’-кэпом кэп 1, мРНК G-CSF, полностью модифицированную 5-метилцитозином и псевдоуридином (мРНК GCSF, 5mc/pU), мРНК G-CSF, полностью модифицированную 5-метилцитозином и N1-метилпсевдоуридином (мРНК GCSF, 5mc/N1pU) с или без 5’-кэпа (мРНК GCSF, 5mc/N1 pU, без кэпа) или контроль в виде либо R848, либо 5% сахарозы, как описано в таблице 17. Взятие крови проводят через 8 часов после введения и с использованием ELISA уровни белка G-CSF и интерферона-альфа (IFN-альфа) определяют с помощью ELISA и как показано в таблице 17.
Как показано в таблице 17, немодифицированная 5mc/pU, и модифицированная 5mc/N1pU мРНК G-CSF приводила к экспрессии G-CSF человека в сыворотке мыши. Модифицированная 5mC/N1pU мРНК G-CSF без кэпа продемонстрировала отсутствие экспрессии G-CSF человека в сыворотке, подчеркивая важность наличия структуры 5’-кэпа для трансляции белка.
Как и ожидалось, в группах, в которые вводили R848, только 5% сахарозу, и в группе без обработки белок G-CSF человека не экспрессировался. Важно, что значимые отличия наблюдали в продукции цитокина при измерении по IFN-альфа мыши в сыворотке. Как и ожидалось, немодифицированная мРНК G-CSF продемонстрировала устойчивый цитокиновый ответ in vivo (больше, чем положительный контроль R848). Модифицированная 5mc/pU мРНК G-CSF продемонстрировала низкий, но поддающийся обнаружению цитокиновый ответ in vivo, в то время как модифицированная 5mc/N1pU мРНК не продемонстрировала поддающегося обнаружению IFN-альфа в сыворотке (и также как животные, которым вводили носитель, или животные без введения).
Также ответ модифицированной 5mc/N1pU мРНК был одинаковым, независимо от того, была ли она кэппирована. Эти результаты in vivo подтверждают заключение о том, 1) что немодифицированная мРНК вызывает устойчивый врожденный иммунный ответ, 2) что она снижается, но не устраняется, посредством 100% включения модификации 5mc/pU, и 3) что включение модификации 5mc/N1pU приводит к отсутствию поддающегося обнаружению цитокинового ответа.
Наконец, учитывая, что эти инъекции проводят в 5% сахарозе (которая сама по себе не имеет эффекта), этот результат должен точно отражать иммуностимулирующий потенциал этих модификаций.
Из данных очевидно, что модифицированные N1pU молекулы продуцируют больше белка, одновременно имея небольшой эффект на экспрессию IFN-альфа или не имея его. Также очевидно, что в случае этой химической модификации для продуцирования белка требуется кэппирование. Соотношение белок:цитокин, равное 748, по сравнению с соотношением PC для немодифицированной мРНК (PC=9) означает, что эта химическая модификация является лучшей в отношении эффектов или биологических последствий, ассоциированных с IFN-альфа.
Пример 72: Доставка in vivo c использованием липоплексов
A. Модифицированная РНК G-CSF человека
Состав, содержащий 100 мкг одной из двух версий модифицированной мРНК G-CSF человека (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) (G-CSF, полностью модифицированный 5-метилцитозином и псевдоуридином (G-CSF), или G-CSF, полностью модифицированный 5-метилцитозином и N1-метилпсевдоуридином (G-CSF-N1) в липоплексе с 30% по объему RNAIMAXTM и доставленный в 150 мкл внутримышечно (в/м) и в 225 мкл внутривенно (в/в) мышам C57/BL6.
В трех контрольных группах вводили либо 100 мкг модифицированной мРНК люциферазы (последовательность кДНК IVT, представленная в SEQ ID NO: 2; последовательность мРНК, представленная в SEQ ID NO: 3, поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности, 5’-кэп, кэп 1, полностью модифицированная 5-метилцитозином в каждом участке цитозина и с заменой на псевдоуридин в каждом участке уридина) внутримышечно (Luc-unsp, в/м) или 150 мкг модифицированной мРНК люциферазы внутривенно (Luc-unsp, в/м) или 150 мкл буфера для составления внутримышечно (буфер, в/м). Через 6 часов после введения состава проводили взятие сыворотки для измерения количества белка G-CSF человека в сыворотке мыши с помощью ELISA для G-CSF человека, и результаты представлены в таблице 18.
Эти результаты демонстрируют, что мРНК G-CSF человека, модифицированная 5-метилцитозином/псевдоуридином и 5-метилцитозином/N1-метилпсевдоуридином, может приводить к специфической экспрессии G-CSF человека в сыворотке при доставке посредством в/в или в/м пути введения в липоплексном составе.
B. Сравнение модифицированной РНК G-CSF человека
Состав, содержащий 100 мкг либо модифицированной мРНК G-CSF человека в липоплексе с 30% по объему RNAIMAXTMс модификацией 5-метилцитозином (5mc) и псевдоуридином (ψ) (G-CSF-ген-1-липоплекс), модифицированной мРНК G-CSF человека с модификацией 5mc и ψ в солевом растворе (G-CSF-ген 1-солевой раствор), модифицированной мРНК G-CSF с модификацией N1-5-метилцитозином (N1-5mc) и ψ в липоплексе с 30% по объему RNAIMAXTM(G-CSF-ген 2-липоплекс), модифицированной мРНК G-CSF человека с модификацией N1-5mc и ψ в солевом растворе (G-CSF-ген 2-солевой раствор), модифицированной люциферазой с модификацией 5mc и ψ в липоплексе с 30% по объему RNAIMAXTM (Luc-липоплекс), либо мРНК люциферазы, полностью модифицированной модификациями 5mc и ψ, в солевом растворе (Luc-солевой раствор) доставляли внутримышечно (в/м) или подкожно (п/к) и в контрольной группе для каждого способа введения вводили дозу 80 мкл буфера для составления (буфер F.) мышам C57/BL6. Через 13 часов после инъекции сыворотку и ткань из каждой области инъекции получали от каждой мыши и анализировали с помощью ELISA для G-CSF для сравнения уровней белка G-CSF человека. Результаты для белка G-CSF человека в сыворотке мыши после внутримышечного введения и подкожного введения представлены в таблице 19.
Эти результаты демонстрируют, что модифицированная 5-метилцитозином/псевдоуридином и 5-метилцитозином/N1-метилпсевдоуридином мРНК G-CSF человека может приводить к специфической экспрессии белка G-CSF человека в сыворотке при доставке в/м или п/к путем введения, как в составе с солевым растворе, так и в липоплексном составе. Как показано в таблице 19, модифицированная 5-метилцитозином/N1-метилпсевдоуридином мРНК G-CSF человека, как правило, демонстрирует увеличенную продукцию белка G-CSF человека относительно модифицированной 5-метилцитозином/псевдоуридином мРНК G-CSF человека.
Пример 73. Введение в несколько областей: внутримышечное и подкожное
Модифицированную мРНК G-CSF человека (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), модифицированная в качестве либо гена 1, либо гена 2 (модификация 5-метилцитозином (5mc) и псевдоуридином (ψ), G-CSF-ген 1; или модификация N1-5-метилцитозином (N1-5mc) и ψ, G-CSF-ген 2) и составленную в солевом растворе доставляли мышам посредством внутримышечной (IM) или подкожной (SC) инъекции. Проводили инъекцию четырех доз или 2x 50 мкг (две области) каждые сутки в течение трех суток (интервал 24 ч). Четвертую дозу вводили за 6 часов до взятия крови и анализа CBC. Контроли включали люциферазу (последовательность кДНК для IVT, представленная в SEQ ID NO: 2; последовательность мРНК, представленная в SEQ ID NO: 3, поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности, 5’-кэп, кэп 1, полностью модифицированная 5-метилцитозином в каждом участке цитозина и с заменой псевдоуридином в каждом участке уридина) или буфер для составления (буфер F.). У мышей проводили взятие крови через 72 часа после первой инъекции мРНК (через 6 часов после последней дозы мРНК) для определения эффекта кодируемого мРНК G-CSF человека на количество нейтрофилов. Режим дозирования представлен в таблице 20, так же как и конечные количества нейтрофилов (тысячи/мкл). В таблице 20 звездочка (*) указывает на статистическую значимость при p<0,05.
В случае внутримышечного введения данные демонстрируют четырехкратное увеличение количества нейтрофилов выше контроля на 3 сутки для мРНК гена 1 G-CSF и двукратное увеличение для мРНК G-CSF гена 2. В случае подкожного введения данные демонстрируют двукратное увеличение количества нейтрофилов выше контроля на 3 сутки для мРНК G-CSF гена 2.
Эти данные демонстрируют, что модифицированная как 5-метилцитидином/псевдоуридином, так и 5-метилцитидином/N1-метилпсевдоуридином мРНК может быть биологически активной, о чем свидетельствует специфическое увеличение количества нейтрофилов в крови.
Пример 74. Внутривенное введение
Модифицированную мРНК G-CSF человека (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), модифицированную модификацией 5-метилцитозином (5mc) и псевдоуридином (ψ) (ген 1); или не имеющую модификаций и составленную в 10% липоплексе (RNAIMAXTM) доставляли мышам в дозе 50 мкг РНК и в объеме 100 мкл посредством внутривенной инъекции (IV) на 0, 2 и 4 сутки. Нейтрофилы измеряли на 1, 5 и 8 сутки. Контроли включали неспецифическую РНК млекопитающих или буфер для составления отдельно (буфер F.). У мышей проводили взятие крови на 1, 5 и 8 сутки для определения эффекта кодируемого мРНК G-CSF человека на увеличение количества нейтрофилов. Режим дозирования представлен в таблице 21, так же как и конечные количества нейтрофилов (тысячи/мкл; K/мкл).
В случае внутривенного введения данные показали от четырех- до пятикратного увеличения количества нейтрофилов относительно контроля на 5 сутки для модифицированной мРНК G-CSF, но не для немодифицированной мРНК G-CSF или неспецифических контролей. Формула крови возвращалась к исходному уровню через четверо суток после последней инъекции. Не наблюдали других изменений в популяциях лейкоцитов.
В таблице 21 звездочкой (*) указана статистическая значимость при p<0,001 по сравнению с буфером.
Эти данные демонстрируют, что составленная в липоплексе модифицированная 5-метилцитидином/псевдоуридином мРНК может быть биологически активной при доставке в/в путем введения, на что указывает специфическое увеличение количества нейтрофилов в крови. Никакие другие подгруппы клеток не изменялись значительно. Немодифицированная мРНК G-CSF, введенная сходным образом, продемонстрировала отсутствие фармакологического эффекта на количество нейтрофилов.
Пример 75: Пути введения
Исследования проводили для изучения разделенного дозирования с использованием различных путей введения. Исследования с использованием множества путей подкожной или внутримышечной инъекции в один момент времени планировали и проводили для изучения способов увеличения экспозиции лекарственного средства на основе модифицированной мРНК и увеличения продукции белка. В дополнение к обнаружению экспрессируемого белкового продукта, также проводили оценку физиологической функции белков путем анализа образцов исследованного животного.
Неожиданно было определено, что разделенное дозирование модифицированной мРНК обеспечивает более высокое продуцирование белка и фенотипические ответы, чем в случае схем однократного дозирования или многократного дозирования.
Схема эксперимента с разделенной дозой вовлекала использование модифицированной мРНК эритропоэтина (EPO) человека (последовательность мРНК, представленная в SEQ ID NO: 5; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), или модифицированной мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), вводимой в буфере отдельно или составленной с 30% липоплексом (RNAIMAXTM). Носитель для дозирования (буфер) состоял из 150 мМ NaCl, 2 мМ CaCl2, 2 мМ Na+-фосфата (1,4 мМ одноосновного фосфата натрия; 0,6 мМ двухосновного фосфата натрия) и 0,5 мМ EDTA, pH 6,5. pH корректировали с использованием гидроксида натрия, и конечный раствор стерилизовали фильтрацией. мРНК была модифицирована 5-метил-C (5meC) в каждом участке цитозина и заменой на псевдоуридин в каждом участке уридина.
4 мышам на группу проводили введение внутримышечно (в/м), внутривенно (в/в) или подкожно (п/к) по схеме дозирования, приведенной в таблице 22. Взятие сыворотки всех мышей проводили через 13 часов после инъекции, извлекали ткань из области инъекции для групп внутримышечного и подкожного введения, и селезенку, печень и почки извлекали в случае группы внутривенного введения. Результаты группы внутримышечного введения и группы подкожного введения представлены в таблице 23.
Пример 76: Доставка in vivo с использованием различных соотношений липидов
Модифицированную мРНК доставляли мышам C57/BL6 для оценки различных соотношений липидов и конечной экспрессии белка. Составы с 100 мкг модифицированной мРНК EPO человека (последовательность мРНК, представленная в SEQ ID NO: 5; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная 5-метилцитозином и псевдоуридином) в липоплексе с 10%, 30% или 50% RNAIMAXTM, 100 мкг модифицированной мРНК люциферазы (последовательность кДНК IVT, представленная в SEQ ID NO: 2; последовательность мРНК, представленная в SEQ ID NO: 3, поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности, 5’-кэп, кэп 1, полностью модифицированная 5-метилцитозином в каждом участке цитозина и с заменой на псевдоуридин в каждом участке уридина) в липоплексе с 10%, 30% или 50% RNAIMAXTMили буфер для составления вводили внутримышечно мышам в однократной дозе объемом 70 мкл. Через 13 часов после инъекции проводили взятие сыворотку для проведения ELISA для EPO в целях определения уровня белка EPO человека у каждой мыши. Результаты ELISA для EPO человека, представленные в таблице 24, демонстрируют, что модифицированный EPO человека, экспрессируемый в мышце, секретируется в сыворотку для каждого из различных процентов RNAIMAXTM.
Пример 77: Доставка in vivo модифицированной РНК у крыс
Продукцию белка с модифицированной мРНК оценивали путем доставки модифицированной мРНК G-CSF или модифицированной мРНК фактора IX самкам крыс Sprague Dawley (n=6). Крысам инъецировали 400 мкг в 100 мкл мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной 5-метилцитозином и псевдоуридином (G-CSF, ген 1), мРНК G-CSF, полностью модифицированной 5-метилцитозином и N1-метилпсевдоуридином (G-CSF, ген 2), или мРНК фактора IX (последовательность мРНК, представленная в SEQ ID NO: 6; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной 5-метилцитозином и псевдоуридином (фактор IX, ген 1), восстановленной из лиофилизированной формы в 5% сахарозе. Взятие крови проводили через 8 часов после инъекции, и уровень белка G-CSF в сыворотке измеряли с помощью ELISA. В таблице 25 показаны уровни белка G-CSF в сыворотке через 8 часов.
Эти результаты демонстрируют, что модифицированная мРНК как G-CSF гена 1, так и G-CSF гена 2 может продуцировать белок G-CSF человека у крысы после однократной внутримышечной инъекции, и что продукция белка G-CSF человека увеличивается при использовании химической структуры гена 2 относительно химической структуры гена 1.
Пример 78. Химическая модификация: исследования in vitro
A. Скрининг в PBMC in vitro
500 нг мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной химической модификацией, указанной в таблицах 26 и 27, трансфицировали с 0,4 мкл Lipofectamine 2000 в мононуклеарные клетки периферической крови (PBMC) от трех здоровых доноров крови. Также анализировали контрольные образцы LPS, R848, P(I)P(C) и mCherry (мРНК последовательность, представленная в SEQ ID NO: 4; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности, 5’-кэп, кэп 1; полностью модифицированная 5-метилцитозином и псевдоуридином). Супернатант собирали и хранили замороженным до анализа ELISA для определения экспрессии белка G-CSF и индукции цитокинов интерферона-альфа (IFN-α) и фактора некроза опухоли альфа (TNF-α). Экспрессия белка G-CSF представлена в таблице 26, экспрессия IFN-α и TNF-α представлена в таблице 27.
Данные в таблице 26 демонстрируют, что многие, но не все, химические модификации можно использовать, чтобы продуктивно продуцировать G-CSF человека в PBMC. Следует отметить, что 100% замена на N1-метилпсевдоуридин демонстрирует наиболее высокий уровень продукции G-CSF человека (практически в 10-раз более высокий, чем сам псевдоуридин). Когда N1-метилпсевдоуридин используют в комбинации с 5-метилцитидином, также продуцируется высокий уровень белка G-CSF человека (это также выше, чем когда псевдоуридин используют в комбинации с 5-метилцитидином).
Учитывая обратную взаимосвязь между продукцией белка и продукцией цитокинов в PBMC, сходную тенденцию также наблюдают в таблице 27, где 100% замена на N1-метилпсевдоуридин приводит к отсутствию индукции цитокинов (аналогично контролям только с трансфекцией) и псевдоуридин демонстрирует поддающуюся обнаружению индукцию цитокинов, которая находится выше фонового уровня.
Другие модификации, такие как N6-метиладенозин и α-тиоцитидин, по-видимому, увеличивают стимуляцию цитокинов.
B. Скрининг в клетках HeLa in vitro
За сутки до трансфекции 20000 клеток HeLa (ATCC № CCL-2; Manassas, VA) собирали путем обработки раствором трипсин-EDTA (LifeTechnologies, Grand Island, NY) и высевали в общий объем 100 мкл среды EMEM (дополненной 10% FCS и 1x Glutamax) на лунку в 96-луночный планшет для культивирования клеток (Corning, Manassas, VA). Клетки выращивали при 37°C в атмосфере 5% CO2 в течение ночи. На следующие сутки 83 нг модифицированной РНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) с химической модификацией, описанной в таблице 28, разбавляли OPTI-MEM (LifeTechnologies, Grand Island, NY) до конечного объема 10 мкл. В качестве реагента для трансфекции использовали Lipofectamine 2000 (LifeTechnologies, Grand Island, NY) и 0,2 мкл разбавляли OPTI-MEM до конечного объема 10 мкл. После инкубации при комнатной температуре в течение 5 минут, оба раствора объединяли и инкубировали в течение дополнительных 15 минут при комнатной температуре. Затем 20 мкл объединенного раствора добавляли к 100 мкл среды для культивирования клеток, содержавшей клетки HeLa, и инкубировали при комнатной температуре.
После инкубации в течение от 18 до 22 часов клетки, экспрессирующие люциферазу, лизировали 100 мкл буфера для пассивного лизиса (Promega, Madison, WI) в соответствии с инструкциями изготовителя. Аликвоты лизатов переносили в белые непрозрачные полистироловые 96-луночные планшеты (Corning, Manassas, VA) и комбинировали с 100 мкл полного раствора для анализа люциферазы (Promega, Madison, WI). Объемы лизатов корректировали или разбавляли до тех пор, пока не обнаруживалось не более 2 относительных световых единиц (RLU) на лунку для образцов с наиболее высоким сигналом, и RLU для каждой исследованной химической структуры представлены в таблице 28. Устройство для считывания планшетов представляло собой BioTek Synergy H1 (BioTek, Winooski, VT). Фоновый сигнал планшетов без реагента составлял приблизительно 200 относительных световых единиц на лунку.
Эти результаты демонстрируют, что многие, но не все, химические модификации можно использовать для продуктивного продуцирования G-CSF человека в клетках HeLa. Следует отметить, что замена на 100% N1-метилпсевдоуридин демонстрирует наиболее высокий уровень продуцирования G-CSF человека.
C. Скрининг In vitro в лизатах ретикулоцитов кролика
мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) модифицировали химической модификацией, приведенной в таблице 29, и ее разбавляли в стерильной не содержавшей нуклеаз воде до конечного количества 250 нг в 10 мкл. Разбавленную люциферазу добавляли к 40 мкл свежеприготовленного лизата ретикулоцитов кролика, и реакцию трансляции in vitro проводили в стандартной 1,5-мл полипропиленовой реакционной пробирке (Thermo Fisher Scientific, Waltham, MA) при 30°C в сухом нагревающем блоке. Анализ трансляции проводили с набором лизата ретикулоцитов кролика (обработанного нуклеазой) (Promega, Madison, WI) в соответствии с инструкциями изготовителя. Реакционный буфер дополняли смесью один к одному из предоставленных исходных растворов аминокислот, лишенных либо лейцина, либо метионина, что обеспечивало реакционную смесь, содержавшую достаточные количества обеих аминокислот для обеспечения эффективной трансляции in vitro.
После инкубации в течение 60 минут реакцию останавливали путем помещения реакционных пробирок на лед. Аликвоты реакции трансляции in vitro, содержавшие модифицированную РНК люциферазы, переносили в белые непрозрачные полистироловые 96-луночные планшеты (Corning, Manassas, VA) и комбинировали с 100 мкл полного раствора для анализа люциферазы (Promega, Madison, WI). Объемы реакционных смесей для трансляции in vitro доводили или разбавляли до тех пор, пока не обнаруживалось не более 2 относительных световых единиц (RLU) на лунку для образцов с наиболее высоким сигналом, и RLU для каждой исследованной химической структуры представлены в таблице 29. Устройство для считывания планшетов представляло собой BioTek Synergy H1 (BioTek, Winooski, VT). Фоновый сигнал планшетов без реагента составлял приблизительно 200 относительных световых единиц на лунку.
Эти результаты бесклеточной трансляции очень точно коррелируют с результатами продукции белка в HeLa, причем одни и те же модификации обычно работают или не работают в обеих системах. Одним примечательным исключением является модифицированная 5-формилцитидином мРНК люциферазы, которая работала в бесклеточной системе трансляции, но не в системе трансфекции на основе клеток HeLa. Сходное отличие между двумя анализами также наблюдали в случае модифицированной 5-формилцитидином мРНК G-CSF.
Пример 79. Химическая модификация: исследования in vivo
А. Скрининг in vivo модифицированной мРНК G-CSF
Мышам Balb-C (n=4) внутримышечно инъецируют в каждую нижнюю конечность модифицированную мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированную химическими модификациями, указанными в таблице 30, составленную в 1xPBS. Также исследуют контроль в виде модифицированной мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1; полностью модифицированная псевдоуридином и 5-метилцитозином) и контроль в виде PBS. Через 8 часов проводят взятие сыворотки для определения уровней белка G-CSF с помощью ELISA.
В. Скрининг in vivo модифицированной мРНК люциферазы
Мышам Balb-C (n=4) подкожно инъецировали 200 мкл, содержащие от 42 до 103 мкг модифицированной мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной химическими модификациями, указанными в таблице 31, составленной в 1xPBS. Также исследовали контроль в виде PBS. Дозировки модифицированной мРНК люциферазы также указаны в таблице 31. Через 8 часов после дозирования мышей визуализировали для определения экспрессии люциферазы. За двадцать минут до визуализации мышам внутрибрюшинно инъецировали раствор D-люциферина в количестве 150 мг/кг. Затем животных подвергали анестезии, и получали изображения с помощью системы визуализации IVIS Lumina II (Perkin Elmer). Биолюминесценцию измеряли в качестве общего потока (фотоны/секунда) для всей мыши.
Как продемонстрировано в таблице 31, все химические структуры модифицированной мРНК люциферазы продемонстрировали активность in vivo, за исключением 2’-фторуридина. Кроме того, модифицированная мРНК 1-метилпсевдоуридина продемонстрировала очень высокую экспрессию люциферазы (в 5 раз более высокая экспрессия, чем в случае содержащей псевдоуридин мРНК).
Пример 80. Скрининг in vivo комбинации модифицированной мРНК люциферазы
Мышам Balb-C (n=4) подкожно инъецировали 200 мкл с 100 мкг модифицированной мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной с помощью химических модификаций, указанных в таблице 32, составленной в 1x PBS. Также исследовали контроль в виде PBS. Дозировки модифицированной мРНК люциферазы также указаны в таблице 29. Через 8 часов после дозирования мышей визуализировали для определения экспрессии люциферазы. За двадцать минут до визуализации мышам внутрибрюшинно инъецировали раствор D-люциферина в количестве 150 мг/кг. Затем животных подвергали анестезии, и изображения получали с помощью системы визуализации IVIS Lumina II (Perkin Elmer). Биолюминесценцию измеряли в качестве общего потока (фотоны/секунда) для всей мыши.
Как продемонстрировано в таблице 32, все модифицированные химические структуры мРНК люциферазы (в комбинации) продемонстрировали активность in vivo. Дополнительное присутствие N1-метилпсевдоуридина в модифицированной мРНК (с N4-ацетилцитидином или 5 метилцитидином) продемонстрировало более высокую экспрессию, чем экспрессия, когда те же комбинации исследовали с использованием псевдоуридина. Взятые вместе, эти данные демонстрируют, что содержащая N1-метилпсевдоуридин мРНК люциферазы обеспечивает увеличенную экспрессию белка in vivo, как при использовании отдельно (таблица 31), так и при использовании в комбинации с другими модифицированными нуклеотидами (таблица 32).
Пример 81. Стабильность модифицированной РНК
A. Хранение модифицированной РНК
Эксперименты по стабильности проводили для лучшего понимания условий хранения для сохранения целостности модифицированной РНК. Немодифицированную мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), мРНК G-CSF, полностью модифицированную 5-метилцитозином и псевдоуридином, и мРНК G-CSF, полностью модифицированную 5-метилцитозином и псевдоуридином в липоплексе с 0,75% по объему RNAIMAXTM, хранили при 50°C, 40°C, 37°C, 25°C, 4°C или -20°C. После хранения мРНК в течение 0 часов, 2 часов, 6 часов, 24 часов, 48 часов, 5 суток и 14 суток, мРНК анализировали гель-электрофорезом с использованием системы Bio-Rad EXPERIONTM. Модифицированную, немодифицированную и липоплексную мРНК G-CSF также хранили в RNASTABLE® (Biomatrica, Inc. San Diego, CA) при 40°C или воде при -80°C или 40°C в течение 35 суток, а затем анализировали гель-электрофорезом.
Все образцы мРНК без стабилизатора были стабильными после хранения в течение 2 недель при 4°C или -20°C. Модифицированная мРНК G-CSF с липоплексом или без него была более стабильной, чем немодифицированная G-CSF при хранении при 25°C (стабильна до 5 суток относительно 48 часов), 37°C (стабильна до 24 часов относительно 6 часов) и 50°C (стабильна до 6 часов относительно 2 часов). Немодифицированная мРНК G-CSF, модифицированная мРНК G-CSF с липоплексом или без него выдерживали 12 циклов замораживания/размораживания.
Образцы мРНК, хранившиеся в стабилизаторе при 40°C, продемонстрировали сходную стабильность с образцами мРНК, хранившимися в воде при -80°C после 35 суток, в то время как мРНК, хранившаяся в воде при 40°C, продемонстрировала значительную деградацию после 18 суток.
Пример 82. Жизнеспособность клеток в фибробластах BJ
Первичные фибробласты крайней плоти человека (BJ fibroblasts) получали от American Type Culture Collection (ATCC) (каталожный номер #CRL-2522) и выращивали в минимальной эссенциальной среде Игла (ATCC, каталожный номер # 30-2003), дополненной 10% эмбриональной телячьей сывороткой при 37°C, в 5% CO2. Фибробласты BJ высевали на 24-луночный планшет при плотности 130000 клеток на лунку в 0,5 мл культуральной среды. 250 нг модифицированной мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной 5-метилцитозином и псевдоуридином (ген 1) или полностью модифицированной 5-метилцитозином и N1-метилпсевдоуридином (ген 2), трансфицировали с использованием Lipofectamine 2000 (Invitrogen, каталожный номер # 11668-019) в соответствии с протоколом изготовителя. Также трансфицировали контрольные образцы в виде Lipofectamine 2000 (LF2000) и немодифицированной мРНК G-CSF. Образцы модифицированной мРНК или контрольные образцы трансфицировали каждые сутки в течение 4 суток. Жизнеспособность клеток после трансфекции оценивали через 6 часов и 24 часа после первой трансфекции (T1, 6 часов, или T1, 24 часов), и через 24 часа после второй (T2, 24 часа) и четвертой трансфекции (T4, 24 часа).
Для определения жизнеспособности клеток культуральную среду полностью извлекали, и клетки промывали один раз посредством 600 мкл стерильного PBS без Ca2+/Mg2+ (Gibco/Life Technologies, Manassas, VA) для смывания слабоприкрепленных клеток. PBS удаляли и выбрасывали. Очищенные фибробласты в каждой лунке обрабатывали 220 мкл разбавленного исходного раствора CELL TITER GLO® (Promega, каталожный номер #G7570) (исходный раствор CELL TITER GLO® далее разбавляли 1:1 равным количеством стерильного PBS). Для соскребания клеток с планшета и ускорения процесса лизиса использовали стерильный наконечник пипетки.
Для двух интервалов времени, T1, 24 часа, и T2, 24 часа, использовали альтернативный протокол. Клетки промывали PBS, как описано выше, а затем трипсинизировали раствором трипсин/EDTA (Gibco/Life Technologies, Manassas, VA). Клетки открепляли и собирали в 500 мкл среды, содержавшей ингибитор трипсина. Клетки собирали центрифугированием при 1200 rcf в течение 5 минут. Клеточный осадок ресуспендировали в 500 мкл PBS. Эту суспензию клеток держали на льду, и 100 мкл этой суспензии комбинировали со 100 мкл неразбавленного раствора Cell Titer Glo.
Затем все лизаты CELL TITER GLO® инкубировали при комнатной температуре в течение 20 минут. 20 мкл лизатов переносили в белый непрозрачный полистироловый 96-луночный планшет (Corning, Manassas, VA) и комбинировали с 100 мкл разбавленного раствора CELL TITER GLO®. Использованное устройство для считывания планшетов представляло собой устройство от BioTek Synergy H1 (BioTek, Winooski, VT), и абсолютные величины нормализовывали к сигналу необработанных фибробластов BJ до 100% жизнеспособности клеток. Процентная жизнеспособность для фибробластов BJ представлена в таблице 33.
Важно, что все из этих экспериментов проводят в отсутствие какого-либо интерферона или других ингибиторов цитокинов и, таким образом, они отражают точный показатель цитотоксичности различных мРНК.
Эти результаты демонстрируют, что повторяющаяся трансфекция фибробластов BJ немодифицированной мРНК приводит к утрате жизнеспособности клеток, которая заметна уже через 24 ч после первой трансфекции (T1, 24 часа) и продолжает быть заметной и более выражена в последующие моменты времени.
Также происходит утрата жизнеспособности при повторяющейся трансфекции модифицированной 5-метилцитидином и псевдоуридином мРНК, которая заметна через 24 часа после четвертой ежесуточной трансфекции (T4, 24 часа). Не наблюдали утраты жизнеспособности клеток в ходе этого эксперимента при использовании модифицированной 5-метилцитидином и N1-метилпсевдоуридином мРНК. Эти результаты демонстрируют, что содержащая 5-метилцитидин и N1-метилпсевдоуридин мРНК имеет увеличенную жизнеспособность клеток при анализе с повторяющейся трансфекцией. Способность неоднократно вводить модифицированную мРНК является важной для большинства терапевтических применений, и, соответственно, также является важной возможность этого без цитотоксичности. Без связи с теорией, полагают, что отвечающие гены после однократной трансфекции могут обеспечивать снижение продукции белка, индукцию цитокинов и в конечном итоге утрату жизнеспособности клеток. Эти результаты согласуются с содержащей N1-метилпсевдоуридин мРНК, демонстрирующей улучшенный профиль в этом отношении относительно как немодифицированной мРНК, так и модифицированной псевдоуридином мРНК.
Пример 83. Врожденный иммунный ответ в фибробластах BJ
Первичные фибробласты крайней плоти человека (BJ fibroblasts) получают от American Type Culture Collection (ATCC) (каталожный номер #CRL-2522) и выращивают в минимальной эссенциальной среде Игла (ATCC, каталожный номер # 30-2003), дополненной 10% эмбриональной телячьей сывороткой при 37°C, в 5% CO2. Фибробласты BJ высевают на 24-луночный планшет при плотности 130000 клеток на лунку в 0,5 мл культуральной среды. 250 нг модифицированной мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированной 5-метилцитозином и псевдоуридином (ген 1) или полностью модифицированной 5-метилцитозином и N1-метилпсевдоуридином (ген 2), трансфицируют с использованием Lipofectamine 2000 (Invitrogen, каталожный номер # 11668-019) в соответствии с протоколом изготовителя. Также трансфицируют контрольные образцы в виде Lipofectamine 2000 и немодифицированной мРНК G-CSF (природный G-CSF). Клетки трансфицируют в течение пяти последовательных суток. Комплексы трансфекции удаляют через четыре часа после каждого раунда трансфекции.
Культуральный супернатант анализируют в отношении секретируемого GCSF (R&D Systems, каталожный номер #DCS50), фактора некроза опухоли-альфа (TNF-альфа) и интерферона альфа (IFN-альфа) с помощью ELISA каждые сутки после трансфекции в соответствии с протоколами изготовителей. Клетки анализируют в отношении жизнеспособности с использованием CELL TITER GLO® (Promega, каталожный номер #G7570) через 6 ч и 18 ч после первого раунда трансфекции и каждые вторые сутки после этого. В то же время из собранных клеток тотальную РНК выделяют и обрабатывают DNASE® с использованием набора RNAEASY micro kit (каталожный номер #74004) в соответствии с протоколом изготовителя. 100 нг тотальной РНК используют для синтеза кДНК с использованием набора для высокопроизводительной обратной транскрипции кДНК (Applied Biosystems, каталожный номер #4368814) в соответствии с протоколом изготовителя. Затем кДНК анализируют в отношении экспрессии генов врожденного иммунного ответа способом количественной ПЦР в реальном времени с использованием SybrGreen на устройстве Biorad CFX 384 в соответствии с протоколом изготовителя.
Пример 84. Транскрипция in vitro полимеразой T7 дикого типа
мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) и мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) были полностью модифицированными различными химическими структурами и комбинациями химических структур, приведенных в таблицах 34-37, с использованием полимеразы T7 дикого типа, как описано ранее.
Выход реакций трансляции определяли посредством спектрофотометрического измерения (OD260), и выход люциферазы представлен в таблице 34, и выход G-CSF представлен в таблице 36.
Модифицированную мРНК люциферазы и G-CSF также подвергали ферментативной реакции кэппирования, и каждую реакцию кэппирования модифицированной мРНК оценивали в отношении выхода с помощью спектрофотометрического измерения (OD260), и правильный размер оценивали с использованием биоанализатора. Выход реакции кэппирования для люциферазы представлен в таблице 35 и для G-CSF в таблице 37.
Пример 85. Транскрипция in vitro с мутантной полимеразой T7
мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) и мРНК GCSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) полностью модифицировали различными химическими структурами и комбинациями химических структур, приведенными в таблицах 38-41, с использованием мутантной полимеразы T7 (набор для транскрипции Durascribe® T7 Transcription kit (каталожный номер № DS010925) (Epicentre®, Madison, WI)).
Выход реакций трансляции определяли посредством спектрофотометрического измерения (OD260), и выход для люциферазы представлен в таблице 38, и выход для G-CSF представлен в таблице 40.
Модифицированную мРНК люциферазы и G-CSF также подвергали ферментативной реакции кэппирования, и каждую реакцию кэппирования модифицированной мРНК оценивали в отношении выхода с помощью спектрофотометрического измерения (OD260), и правильный размер оценивали с использованием биоанализатора. Выход реакции кэппирования для люциферазы представлвен в таблице 39, и выход для G-CSF представлен в таблице 41.
Пример 86. 2’-O-метил- и 2’-фтор-соединения
мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) продуцировали в качестве полностью модифицированных версий с химическими структурами, представленными в таблице 42, и транскрибировали с использованием мутантной полимеразы T7 (набор для транскрипции Durascribe® T7 Transcription kit (каталожный номер № DS010925) (Epicentre®, Madison, WI). 2’-Фтор-содержащую мРНК получали с использованием Durascribe T7, однако 2’O-метил-содержащую мРНК нельзя было транскрибировать с использованием Durascribe T7.
Включение 2’O-метил-модифицированной мРНК можно проводить с использованием других мутантных полимераз T7 (Nat Biotechnol. (2004) 22:1155-1160; Nucleic Acids Res. (2002) 30:e138). Альтернативно, 2’OMe-модификации можно вносить посттранскрипционно с использованием ферментативных способов.
Внесение модификаций на 2’-группу сахара имеет множество потенциальных преимуществ. Известно, что замены 2’-OMe, такие как замены на 2’-фтор, защищают от нуклеаз, и также было показано, что они устраняют распознавание врожденной иммунной системой при включении в другие нуклеиновые кислоты, такие как миРНК и антисмысловая РНК (Crooke, ed. Antisense Drug Technology, 2nd edition; Boca Raton: CRC press, включенная в полном объеме).
Затем 2’-фтор-модифицированную мРНК трансфицировали в клетки HeLa для оценки продукции белка в клеточном контексте, и ту же мРНК также оценивали в бесклеточной системе ретикулоцитов кролика. Контроль в виде немодифицированной люциферазы (природная люцифераза) использовали для обоих экспериментов по транскрипции, также анализировали контроль в виде трансфекции без обработки и имитирующей трансфекции (Lipofectamine 2000 отдельно) для трансфекции клеток HeLa и контроль без РНК для лизатов ретикулоцитов кролика.
Для экспериментов по трансфекции HeLa, за сутки до трансфекции, 20000 клеток HeLa (ATCC № CCL-2; Manassas, VA) собирали посредством обработки раствором трипсин-EDTA (LifeTechnologies, Grand Island, NY) и высевали в общем объеме 100 мкл среды EMEM (дополненной 10% FCS и 1x Glutamax) на лунку в 96-луночном планшете для культивирования тканей (Corning, Manassas, VA). Клетки выращивали при 37°C в атмосфере 5% CO2 в течение ночи. На следующие сутки 83 нг 2’-фтор-содержащей модифицированной РНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) с химической модификацией, описанной в таблице 42, разбавляли OPTI-MEM (LifeTechnologies, Grand Island, NY) до конечного объема 10 мкл. В качестве реагента для трансфекции использовали Lipofectamine 2000 (LifeTechnologies, Grand Island, NY) и 0,2 мкл разбавляли OPTI-MEM до конечного объема 10 мкл. После инкубации при комнатной температуре в течение 5 минут, оба раствора объединяли и инкубировали в течение дополнительных 15 минут при комнатной температуре. Затем 20 мкл объединенного раствора добавляли к 100 мкл среды для культивирования клеток, содержавшей клетки HeLa, и инкубировали при комнатной температуре. После инкубации в течение от 18 до 22 часов клетки, экспрессирующие люциферазу, лизировали 100 мкл буфера для пассивного лизиса (Promega, Madison, WI) в соответствии с инструкциями изготовителя. Аликвоты лизатов переносили в белые непрозрачные полистироловые 96-луночные планшеты (Corning, Manassas, VA) и комбинировали с 100 мкл полного раствора для анализа люциферазы (Promega, Madison, WI). Объемы лизатов корректировали или разбавляли до тех пор, пока не обнаруживалось не более 2 относительных световых единиц (RLU) на лунку для образцов с наиболее высоким сигналом, и RLU для каждой исследованной химической структуры представлены в таблице 42. Устройство для считывания планшетов представляло собой BioTek Synergy H1 (BioTek, Winooski, VT). Фоновый сигнал планшетов без реагента составлял приблизительно 200 относительных световых единиц на лунку.
Для анализа лизата ретикулоцитов кролика, 2’-фтор-содержащую мРНК люциферазы разбавляли в стерильной не содержавшей нуклеаз воде до конечного количества 250 нг в 10 мкл и добавляли до 40 мкл свежеприготовленный лизат ретикулоцитов кролика, и реакцию трансляции in vitro проводили в стандартной 1,5-мл полипропиленовой реакционной пробирке (Thermo Fisher Scientific, Waltham, MA) при 30°C в сухом нагревающем блоке. Анализ трансляции проводили с набором лизата ретикулоцитов кролика (обработанного нуклеазой) (Promega, Madison, WI) в соответствии с инструкциями изготовителя. Реакционный буфер дополняли смесью один к одному предоставленных исходных растворов аминокислот, лишенных либо лейцина, либо метионина, что обеспечивало реакционную смесь, содержавшую достаточные количества обеих аминокислот для обеспечения эффективной трансляции in vitro. После инкубации в течение 60 минут реакцию останавливали путем помещения реакционных пробирок на лед.
Аликвоты реакции трансляции in vitro, содержавшие модифицированную РНК люциферазы, переносили в белые непрозрачные полистироловые 96-луночные планшеты (Corning, Manassas, VA) и комбинировали с 100 мкл полного раствора для анализа люциферазы (Promega, Madison, WI). Объемы реакционных смесей для трансляции in vitro доводили или разбавляли до тех пор, пока не обнаруживалось не более 2 относительных световых единиц (RLU) на лунку для образцов с наиболее высоким сигналом, и RLU для каждой исследованной химической структуры представлены в таблице 43. Устройство для считывания планшетов представляло собой BioTek Synergy H1 (BioTek, Winooski, VT). Фоновый сигнал планшетов без реагента составлял приблизительно 160 относительных световых единиц на лунку.
Как можно видеть из таблицы 42 и 43, множество 2’-фтор-содержащих соединений являются активными in vitro и продуцируют белок люциферазы.
Пример 87. Люцифераза в клетках HeLa с использованием комбинации модификаций
Для оценки с использованием 2’-фтор-модифицированной мРНК в комбинации с другой серией модификацированной мРНК транскрибировали с использованием либо полимеразы T7 дикого типа (не содержащие фтора соединения), либо с использованием мутантных полимераз T7 (фторсодержащие соединения), как описано в примере 86. Все модифицированные мРНК исследовали с помощью трансфекции клеток HeLa in vitro.
За сутки до трансфекции 20000 клеток HeLa (ATCC № CCL-2; Manassas, VA) собирали посредством обработки раствором трипсин-EDTA (LifeTechnologies, Grand Island, NY) и высевали в общем объеме 100 мкл среды EMEM (дополненной 10% FCS и 1x Glutamax) на лунку в 96-луночный планшет для культивирования клеток (Corning, Manassas, VA). Клетки выращивали при 37°C в атмосфере 5% CO2 в течение ночи. На следующие сутки 83 нг модифицированной РНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) с химической модификацией, описанной в таблице 44, разбавляли OPTI-MEM (LifeTechnologies, Grand Island, NY) до конечного объема 10 мкл. В качестве реагента для трансфекции использовали Lipofectamine 2000 (LifeTechnologies, Grand Island, NY) и 0,2 мкл разбавляли OPTI-MEM до конечного объема 10 мкл. После инкубации при комнатной температуре в течение 5 минут, оба раствора объединяли и инкубировали в течение дополнительных 15 минут при комнатной температуре. Затем 20 мкл объединенного раствора добавляли к 100 мкл среды для культивирования клеток, содержавшей клетки HeLa, и инкубировали при комнатной температуре.
После инкубации в течение от 18 до 22 часов клетки, экспрессирующие люциферазу, лизировали 100 мкл буфера для пассивного лизиса (Promega, Madison, WI) в соответствии с инструкциями изготовителя. Аликвоты лизатов переносили в белые непрозрачные полистироловые 96-луночные планшеты (Corning, Manassas, VA) и комбинировали с 100 мкл полного раствора для анализа люциферазы (Promega, Madison, WI). Объемы лизатов корректировали или разбавляли до тех пор, пока не обнаруживалось не более 2 относительных световых единиц (RLU) на лунку для образцов с наиболее высоким сигналом, и RLU для каждой исследованной химической структуры представлены в таблице 44. Устройство для считывания планшетов представляло собой BioTek Synergy H1 (BioTek, Winooski, VT). Фоновый сигнал планшетов без реагента составлял приблизительно 200 относительных световых единиц на лунку.
Как видно из таблицы 44, большинство комбинаций модификаций обеспечивало мРНК, которая продуцировала функциональный белок люциферазы, включая все не содержащие фтор соединения и многие из комбинаций, содержащих 2’-фтор-модификации.
Пример 88. Транскрипция G-CSF in vitro
Для оценки активности всех различных химических модификаций в контексте второй открытой рамки считывания, авторы настоящего изобретения повторили эксперименты, ранее проведенные с использованием мРНК люциферазы, для мРНК G-CSF человека. мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) полностью модифицировали химическими структурами, представленными в таблицах 45 и 46, с использованием полимеразы T7 дикого типа (для всех не содержащих фтор соединений) или мутантной полимеразы T7 (для всех фторсодержащих соединений). Мутантную полимеразу T7 приобретали из коммерческих источников (набор для транскрипции Durascribe® T7 Transcription kit (каталожный номер № DS010925) (Epicentre®, Madison, WI).
Модифицированную РНК в таблицах 45 и 46 трансфицировали in vitro в клетки HeLa или добавляли к лизатам ретикулоцитов кролика (250 нг модифицированной мРНК), как указано. Также анализировали контроль в виде имитирующей трансфекции без обработки (реагент для трансфекции отдельно), G-CSF, полностью модифицированный 5-метилцитозином и N1-метилпсевдоуридином, или контроль в виде люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1), полностью модифицированный 5-метилцитозином и N1-метилпсевдоуридином. Экспрессию белка G-CSF определяли способом ELISA, и величины представлены в таблицах 45 и 46. В таблице 45 "NT" означает "не исследовали".
Как показано в таблице 45, многие, но не все, химические модификации приводили к продукции белка G-CSF человека. Эти результаты для клеточных и бесклеточных систем трансляции коррелируют очень высоко, причем одни и те же модификации обычно работали или не работали в обеих системах. Одним примечательным исключением является модифицированная 5-формилцитидином мРНК G-CSF, которая работала в бесклеточной системе трансляции, но не в системе трансфекции на основе клеток HeLa. Сходные отличия между этими двумя анализами также наблюдали для модифицированной 5-формилцитидином мРНК люциферазы.
Как продемонстрировано в таблице 46, многие, но не все, модифицированные структуры мРНК G-CSF (при использовании в комбинации) продемонстрировали активность in vivo. Кроме того, присутствие N1-метилпсевдоуридина в модифицированной мРНК (с N4-ацетилцитидином или 5-метилцитидином) продемонстрировало более высокую экспрессию, чем когда те же комбинации исследовали с использованием псевдоуридина. Взятые вместе, эти данные демонстрируют, что содержащая N1-метилпсевдоуридин мРНК G-CSF приводит к увеличенной экспрессии белка in vitro.
Пример 89. Скрининг химических структур
В приведенных ниже таблицах (таблицы 47-49) обобщена основная часть данных скрининга in vitro и in vitro с различными соединениями, представленными в предшествующих примерах. Высокая корреляция существует между клеточными и бесклеточными анализами трансляции. Замены одними и теми же химическими структурами, как правило, демонстрируют высокое соответствие при исследовании в контексте как мРНК люциферазы, так и мРНК G-CSF. Наконец, мРНК, содержащая N1-метилпсевдоуридин, демонстрирует очень низкий уровень экспрессии белка с от небольшой до неподдающейся обнаружению стимуляцией цитокинов in vitro и in vivo, и превосходит мРНК, содержащую псевдоуридин, как in vitro, так и in vivo.
мРНК люциферазы (последовательность мРНК, представленная в SEQ ID NO: 3; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) и мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) модифицировали встречающимися в природе и не встречающимися в природе химическими структурами, описанными в таблицах 47 и 48, или комбинацией химических структур, описанных в таблице 48, и исследовали с использованием способов, описанных в настоящем описании.
В таблицах 47 и 48 "*" относится к реакции транскрипции in vitro с использованием мутантной полимеразы T7 (набор для транскрипции Durascribe® T7 Transcription kit (каталожный номер № DS010925) (Epicentre®, Madison, WI); "**" относится ко второму результату реакции транскрипции in vitro с использованием мутантной полимеразы T7 (набор для транскрипции Durascribe® T7 Transcription kit (каталожный номер № DS010925) (Epicentre®, Madison, WI); "***" относится к продукции, наблюдаемой при бесклеточной трансляции (лизаты ретикулоцитов кролика); продукция белка в HeLa оценивается как "+", "+/-" и "-"; при указании на PBMC из G-CSF "++++" означает более 6000 пг/мл G-CSF, "+++" означает более 3000 пг/мл G-CSF, "++" означает более 1500 пг/мл G-CSF, "+" означает более 300 пг/мл G-CSF, "+/-" означает 150-300 пг/мл G-CSF, и фоновый уровень составлял приблизительно 110 пг/мл; при указании на цитокин из PBMC "++++" означает более 1000 пг/мл интерферона-альфа (IFN-альфа), "+++" означает более 600 пг/мл IFN-альфа, "++" означает более 300 пг/мл IFN-альфа, "+" означает более 100 пг/мл IFN-альфа, "-" означает менее 100 пг/мл, и фоновый уровень составлял приблизительно 70 пг/мл; и "NT" означает "не исследовали". В таблице 48 продукцию белка оценивали с использованием мутантной полимеразы T7 (набор для транскрипции Durascribe® T7 Transcription kit (каталожный номер № DS010925) (Epicentre®, Madison, WI).
Пример 90. 2-фтор-химические структуры в PBMC
Способность модифицированной мРНК G-CSF (последовательность мРНК, представленная в SEQ ID NO: 1; поли-A-концевая часть приблизительно из 160 нуклеотидов, не показанная в последовательности; 5’-кэп, кэп 1) запускать врожденный иммунный ответ определяли путем измерения продукции интерферона-альфа (IFN-альфа) и фактора некроза опухоли-альфа (TNF-альфа). Использование культур PBMC in vitro является общепризнанным способом измерения иммуностимулирующего потенциала олигонуклеотидов (Robbins et al., Oligonucleotides 2009 19:89-102), и способы трансфекции описаны в настоящем описании. В таблице 50 представлено среднее значение продукции интерферона-альфа (IFN-альфа) и фактора некроза опухоли альфа (TNF-альфа) с течением времени при измерении с помощью специфической ELISA для 2 или 3 отдельных доноров PBMC. Также анализировали контроли R848, P(I)P(C), LPS и Lipofectamine 2000 (L2000).
Что касается распознавания врожденной иммунной системой, хотя обе модифицированные химические структуры мРНК в большой степени препятствовали продукции IFN-альфа и TNF-альфа относительно положительных контролей (R848, P(I)P(C)), 2-фторсоединения снижают продукцию IFN-альфа и TNF-альфа даже ниже, чем другие комбинации, и комбинации N4-ацетилцитидин повышают профиль цитокинов.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Следует понимать, что хотя настоящее изобретение описано с помощью его подробного описания, представленное выше описание предназначено для иллюстрации, но не для ограничения объема настоящего изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в объеме представленной ниже формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MODEРНК THERAPEUTICS
<120> МОДИФИЦИРОВАННЫЕ НУКЛЕОЗИДЫ, НУКЛЕОТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ И
ИХ ПРИМЕНЕНИЕ
<130> M009.20/2030.1009PCT
<140> PCT/US12/XXXXX
<141> 2012-10-03
<150> 61/542,533
<151> 2011-10-03
<160> 6
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 758
<212> РНК
<213> Homo Sapiens
<400> 1
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug gccggucccg 60
cgacccaaag ccccaugaaa cuuauggccc ugcaguugcu gcuuuggcac ucggcccucu 120
ggacagucca agaagcgacu ccucucggac cugccucauc guugccgcag ucauuccuuu 180
ugaagugucu ggagcaggug cgaaagauuc agggcgaugg agccgcacuc caagagaagc 240
ucugcgcgac auacaaacuu ugccaucccg aggagcucgu acugcucggg cacagcuugg 300
ggauucccug ggcuccucuc ucguccuguc cgucgcaggc uuugcaguug gcagggugcc 360
uuucccagcu ccacuccggu uuguucuugu aucagggacu gcugcaagcc cuugagggaa 420
ucucgccaga auugggcccg acgcuggaca cguugcagcu cgacguggcg gauuucgcaa 480
caaccaucug gcagcagaug gaggaacugg ggauggcacc cgcgcugcag cccacgcagg 540
gggcaaugcc ggccuuugcg uccgcguuuc agcgcagggc ggguggaguc cucguagcga 600
gccaccuuca aucauuuuug gaagucucgu accgggugcu gagacaucuu gcgcagccgu 660
gaagcgcugc cuucugcggg gcuugccuuc uggccaugcc cuucuucucu cccuugcacc 720
uguaccucuu ggucuuugaa uaaagccuga guaggaag 758
<210> 2
<211> 1838
<212> ДНК
<213> Homo Sapiens
<400> 2
taatacgact cactataggg aaataagaga gaaaagaaga gtaagaagaa atataagagc 60
caccatggaa gatgcgaaga acatcaagaa gggacctgcc ccgttttacc ctttggagga 120
cggtacagca ggagaacagc tccacaaggc gatgaaacgc tacgccctgg tccccggaac 180
gattgcgttt accgatgcac atattgaggt agacatcaca tacgcagaat acttcgaaat 240
gtcggtgagg ctggcggaag cgatgaagag atatggtctt aacactaatc accgcatcgt 300
ggtgtgttcg gagaactcat tgcagttttt catgccggtc cttggagcac ttttcatcgg 360
ggtcgcagtc gcgccagcga acgacatcta caatgagcgg gaactcttga atagcatggg 420
aatctcccag ccgacggtcg tgtttgtctc caaaaagggg ctgcagaaaa tcctcaacgt 480
gcagaagaag ctccccatta ttcaaaagat catcattatg gatagcaaga cagattacca 540
agggttccag tcgatgtata cctttgtgac atcgcatttg ccgccagggt ttaacgagta 600
tgacttcgtc cccgagtcat ttgacagaga taaaaccatc gcgctgatta tgaattcctc 660
gggtagcacc ggtttgccaa agggggtggc gttgccccac cgcactgctt gtgtgcggtt 720
ctcgcacgct agggatccta tctttggtaa tcagatcatt cccgacacag caatcctgtc 780
cgtggtacct tttcatcacg gttttggcat gttcacgact ctcggctatt tgatttgcgg 840
tttcagggtc gtacttatgt atcggttcga ggaagaactg tttttgagat ccttgcaaga 900
ttacaagatc cagtcggccc tccttgtgcc aacgcttttc tcattctttg cgaaatcgac 960
acttattgat aagtatgacc tttccaatct gcatgagatt gcctcagggg gagcgccgct 1020
tagcaaggaa gtcggggagg cagtggccaa gcgcttccac cttcccggaa ttcggcaggg 1080
atacgggctc acggagacaa catccgcgat ccttatcacg cccgagggtg acgataagcc 1140
gggagccgtc ggaaaagtgg tccccttctt tgaagccaag gtcgtagacc tcgacacggg 1200
aaaaaccctc ggagtgaacc agaggggcga gctctgcgtg agagggccga tgatcatgtc 1260
aggttacgtg aataaccctg aagcgacgaa tgcgctgatc gacaaggatg ggtggttgca 1320
ttcgggagac attgcctatt gggatgagga tgagcacttc tttatcgtag atcgacttaa 1380
gagcttgatc aaatacaaag gctatcaggt agcgcctgcc gagctcgagt caatcctgct 1440
ccagcacccc aacattttcg acgccggagt ggccgggttg cccgatgacg acgcgggtga 1500
gctgccagcg gccgtggtag tcctcgaaca tgggaaaaca atgaccgaaa aggagatcgt 1560
ggactacgta gcatcacaag tgacgactgc gaagaaactg aggggagggg tagtctttgt 1620
ggacgaggtc ccgaaaggct tgactgggaa gcttgacgct cgcaaaatcc gggaaatcct 1680
gattaaggca aagaaaggcg ggaaaatcgc tgtctgataa gctgccttct gcggggcttg 1740
ccttctggcc atgcccttct tctctccctt gcacctgtac ctcttggtct ttgaataaag 1800
cctgagtagg aaggcggccg ctcgagcatg catctaga 1838
<210> 3
<211> 1796
<212> РНК
<213> Homo sapiens
<400> 3
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug gaagaugcga 60
agaacaucaa gaagggaccu gccccguuuu acccuuugga ggacgguaca gcaggagaac 120
agcuccacaa ggcgaugaaa cgcuacgccc ugguccccgg aacgauugcg uuuaccgaug 180
cacauauuga gguagacauc acauacgcag aauacuucga aaugucggug aggcuggcgg 240
aagcgaugaa gagauauggu cuuaacacua aucaccgcau cguggugugu ucggagaacu 300
cauugcaguu uuucaugccg guccuuggag cacuuuucau cggggucgca gucgcgccag 360
cgaacgacau cuacaaugag cgggaacucu ugaauagcau gggaaucucc cagccgacgg 420
ucguguuugu cuccaaaaag gggcugcaga aaauccucaa cgugcagaag aagcucccca 480
uuauucaaaa gaucaucauu auggauagca agacagauua ccaaggguuc cagucgaugu 540
auaccuuugu gacaucgcau uugccgccag gguuuaacga guaugacuuc guccccgagu 600
cauuugacag agauaaaacc aucgcgcuga uuaugaauuc cucggguagc accgguuugc 660
caaagggggu ggcguugccc caccgcacug cuugugugcg guucucgcac gcuagggauc 720
cuaucuuugg uaaucagauc auucccgaca cagcaauccu guccguggua ccuuuucauc 780
acgguuuugg cauguucacg acucucggcu auuugauuug cgguuucagg gucguacuua 840
uguaucgguu cgaggaagaa cuguuuuuga gauccuugca agauuacaag auccagucgg 900
cccuccuugu gccaacgcuu uucucauucu uugcgaaauc gacacuuauu gauaaguaug 960
accuuuccaa ucugcaugag auugccucag ggggagcgcc gcuuagcaag gaagucgggg 1020
aggcaguggc caagcgcuuc caccuucccg gaauucggca gggauacggg cucacggaga 1080
caacauccgc gauccuuauc acgcccgagg gugacgauaa gccgggagcc gucggaaaag 1140
ugguccccuu cuuugaagcc aaggucguag accucgacac gggaaaaacc cucggaguga 1200
accagagggg cgagcucugc gugagagggc cgaugaucau gucagguuac gugaauaacc 1260
cugaagcgac gaaugcgcug aucgacaagg augggugguu gcauucggga gacauugccu 1320
auugggauga ggaugagcac uucuuuaucg uagaucgacu uaagagcuug aucaaauaca 1380
aaggcuauca gguagcgccu gccgagcucg agucaauccu gcuccagcac cccaacauuu 1440
ucgacgccgg aguggccggg uugcccgaug acgacgcggg ugagcugcca gcggccgugg 1500
uaguccucga acaugggaaa acaaugaccg aaaaggagau cguggacuac guagcaucac 1560
aagugacgac ugcgaagaaa cugaggggag ggguagucuu uguggacgag gucccgaaag 1620
gcuugacugg gaagcuugac gcucgcaaaa uccgggaaau ccugauuaag gcaaagaaag 1680
gcgggaaaau cgcugucuga uaagcugccu ucugcggggc uugccuucug gccaugcccu 1740
ucuucucucc cuugcaccug uaccucuugg ucuuugaaua aagccugagu aggaag 1796
<210> 4
<211> 854
<212> РНК
<213> Homo sapiens
<400> 4
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug guauccaagg 60
gggaggagga caacauggcg aucaucaagg aguucaugcg auucaaggug cacauggaag 120
guucggucaa cggacacgaa uuugaaaucg aaggagaggg ugaaggaagg cccuaugaag 180
ggacacagac cgcgaaacuc aaggucacga aagggggacc acuuccuuuc gccugggaca 240
uucuuucgcc ccaguuuaug uacgggucca aagcauaugu gaagcauccc gccgauauuc 300
cugacuaucu gaaacucagc uuucccgagg gauucaagug ggagcggguc augaacuuug 360
aggacggggg uguagucacc guaacccaag acucaagccu ccaagacggc gaguucaucu 420
acaaggucaa acugcggggg acuaacuuuc cgucggaugg gccggugaug cagaagaaaa 480
cgaugggaug ggaagcguca ucggagagga uguacccaga agauggugca uugaaggggg 540
agaucaagca gagacugaag uugaaagaug ggggacauua ugaugccgag gugaaaacga 600
cauacaaagc gaaaaagccg gugcagcuuc ccggagcgua uaaugugaau aucaaguugg 660
auauuacuuc acacaaugag gacuacacaa uugucgaaca guacgaacgc gcugagggua 720
gacacucgac gggaggcaug gacgaguugu acaaaugaua agcugccuuc ugcggggcuu 780
gccuucuggc caugcccuuc uucucucccu ugcaccugua ccucuugguc uuugaauaaa 840
gccugaguag gaag 854
<210> 5
<211> 725
<212> РНК
<213> Homo sapiens
<400> 5
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaug ggagugcacg 60
agugucccgc gugguugugg uugcugcugu cgcucuugag ccucccacug ggacugccug 120
ugcugggggc accacccaga uugaucugcg acucacgggu acuugagagg uaccuucuug 180
aagccaaaga agccgaaaac aucacaaccg gaugcgccga gcacugcucc cucaaugaga 240
acauuacugu accggauaca aaggucaauu ucuaugcaug gaagagaaug gaaguaggac 300
agcaggccgu cgaagugugg caggggcucg cgcuuuuguc ggaggcggug uugcgggguc 360
aggcccuccu cgucaacuca ucacagccgu gggagccccu ccaacuucau gucgauaaag 420
cggugucggg gcuccgcagc uugacgacgu ugcuucgggc ucugggcgca caaaaggagg 480
cuauuucgcc gccugacgcg gccuccgcgg caccccuccg aacgaucacc gcggacacgu 540
uuaggaagcu uuuuagagug uacagcaauu uccuccgcgg aaagcugaaa uuguauacug 600
gugaagcgug uaggacaggg gaucgcugau aagcugccuu cugcggggcu ugccuucugg 660
ccaugcccuu cuucucuccc uugcaccugu accucuuggu cuuugaauaa agccugagua 720
ggaag 725
<210> 6
<211> 1536
<212> РНК
<213> Homo sapiens
<400> 6
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccaccaau gcagcgcguc 60
aacaugauua uggccgaauc gccgggacuc aucacaaucu gccucuuggg uuaucucuug 120
ucggcagaau guaccguguu cuuggaucac gaaaacgcga acaaaauucu uaaucgcccg 180
aagcgguaua acuccgggaa acuugaggag uuugugcagg gcaaucuuga acgagagugc 240
auggaggaga aaugcuccuu ugaggaggcg agggaagugu uugaaaacac agagcgaaca 300
acggaguuuu ggaagcaaua cguagauggg gaccagugug agucgaaucc gugccucaau 360
gggggaucau guaaagauga caucaauagc uaugaaugcu ggugcccguu uggguuugaa 420
gggaagaacu gugagcugga ugugacgugc aacaucaaaa acggacgcug ugagcaguuu 480
uguaagaacu cggcugacaa uaagguagua ugcucgugca cagagggaua ccggcuggcg 540
gagaaccaaa aaucgugcga gcccgcaguc ccguucccuu gugggagggu gagcguguca 600
cagacuagca aguugacgag agcggagacu guauuccccg acguggacua cgucaacagc 660
accgaagccg aaacaauccu cgauaacauc acgcagagca cucaguccuu caaugacuuu 720
acgagggucg uaggugguga ggacgcgaaa cccggucagu uccccuggca ggugguauug 780
aacggaaaag ucgaugccuu uuguggaggu uccauuguca acgagaagug gauugucaca 840
gcggcacacu gcguagaaac aggagugaaa aucacgguag uggcgggaga gcauaacauu 900
gaagagacag agcacacgga acaaaagcga aaugucauca gaaucauucc acaccauaac 960
uauaacgcgg caaucaauaa guacaaucac gacaucgcac uuuuggagcu ugacgaaccu 1020
uuggugcuua auucguacgu caccccuauu uguauugccg acaaagagua uacaaacauc 1080
uucuugaaau ucggcuccgg guacguaucg ggcuggggca gaguguucca uaaggguaga 1140
uccgcacugg uguugcaaua ccucagggug ccccucgugg aucgagccac uugucugcgg 1200
uccaccaaau ucacaaucua caacaauaug uucugugcgg gauuccauga aggugggaga 1260
gauagcugcc agggagacuc aggggguccc cacgugacgg aagucgaggg gacgucauuu 1320
cugacgggaa uuaucucaug gggagaggaa ugugcgauga aggggaaaua uggcaucuac 1380
acuaaagugu cacgguaugu caauuggauc aaggaaaaga cgaaacucac gugaucagcc 1440
agcgcugccu ucugcggggc uugccuucug gccaugcccu ucuucucucc cuugcaccug 1500
uaccucuugg ucuuugaaua aagccugagu aggaag 1536
<---
Реферат
Изобретение относится к области биотехнологии. Описана композиция для экспрессии полипептида в клетке млекопитающего, содержащая эффективное количество множества липидных наночастиц, содержащих полинуклеотид, кодирующий указанный полипептид. В одном из вариантов реализации полинуклеотид содержит (a) открытую рамку считывания, кодирующую указанный полипептид, состоящий из нуклеозидов, включая 1-метилпсевдоуридин, цитидин или 5-метилцитидин, аденозин и гуанозин, (b) 5’-UTR, (c) 3’-UTR, и (d) структуру 5′-кэпа. Изобретение расширяет арсенал средств для экспрессии полипептидов в клетке млекопитающего. 7 з.п. ф-лы, 10 ил., 50 табл., 90 пр.

Комментарии