Композиция со сшитой гиалуроновой кислотой для наращивания тканей - RU2351367C2
Код документа: RU2351367C2
Чертежи






Описание
Перекрестные ссылки на родственные заявки
Эта заявка заявляет приоритет практической заявки US, зарегистрированной 22 декабря 2003 г. (номер заявки еще не приписан, номер поверенного по списку дел к слушанию 1769.2001-000), полное содержание которой включено сюда посредством ссылки.
Область техники, к которой относится изобретение
Изобретение относится к фармацевтическим композициям, содержащим сшитую гиалуроновую кислоту, способам их приготовления и применения для наращивания тканей и/или доставки лекарств.
Уровень техники
В настоящее время все наполнители для наращивания тканей, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (США), являются производными коллагена. Приблизительно 3-5% людей проявляют серьезные аллергические реакции к бычьему коллагену, нуждаясь, таким образом, в тщательном тестировании перед применением таких наполнителей для каждого конкретного субъекта.
Гиалуроновая кислота, называемая также «ГК», - это присутствующий в природе водорастворимый полисахарид, который является основным компонентом внеклеточного матрикса и который широко распространен в животных тканях. Молекулярный вес ГК природного происхождения, в основном, находится в пределах от приблизительно 6×104 до приблизительно 8×106 дальтон. Она обладает превосходной биосовместимостью и не вызывает реакции на постороннее тело или аллергической реакции при имплантации субъекту.
Способы получения коммерчески доступных гиалуронанов хорошо известны. Известны также различные способы соединения ГК и сшивания ГК для уменьшения растворимости в воде и способности к диффузии ГК и для увеличения вязкости ГК. Например, см. патенты США №№5356883 и 6013679, полный смысл которых включен сюда посредством ссылки. Далее, многие формы ГК задействованы, например, как хирургический материал для предотвращения послеоперационных адгезий тканей, как добавка к синовиальной жидкости в суставах, как жидкий заменитель и/или хирургическое воспомоществование в хирургии глаза, как каркас для конструкции тканей in vitro или направленной регенерации или наращивания тканей in vivo и т.п.
Применение таких продуктов ГК страдает несколькими недостатками, например, в частности, компромисс между свойствами in vivo и применимостью в хирургии. Например, та ГК, которая достаточно модифицирована химически или сшита, чтобы получить желаемые механические свойства и биостабильность in vivo, может быть такой вязкой, что инъекция ее через тонкие иглы затруднительна или невозможна. Напротив, ГК, пригодная для инъекций, может обладать in vivo более низкой биостабильностью или механическими свойствами.
Далее, в настоящее время имеется большой интерес к средствам доставки с постепенным освобождением биологически активных агентов, включая, например, терапевтические агенты или лекарства и биологические пробы. Наиболее сложной задачей является развитие средства доставки, которое сможет обеспечить нужный уровень биодоступности терапевтического агента в области поражения для достижения желаемого клинического результата, при наличии также желаемого равновесия между механическими свойствами и биостабильностью in vivo и применимостью в хирургии/лечении. Биодоступность лекарств зависит от природы лекарства, примененного средства доставки лекарства и пути доставки, например, орального, топикального, подкожного, через слизистую оболочку, назначение инъекции, назначение ингаляции или назначение сочетания двух или более таких путей. Биодоступность может быть низкой в результате, например, распада лекарства в процессе метаболизма, быстрого или неравномерного распада средства доставки, быстрого или неравномерного освобождения лекарства из средства доставки и т.п. Это может сопровождаться сходными проблемами частоты назначения лекарства, трудности назначения, например, затрудненности инъекции, биодеградацией и т.п. Вдобавок к трудностям, отмеченным выше, частое назначение недостаточно устойчивых средств доставки лекарств может приводить к вариациям доставки лекарства, приводящим к повышению числа случаев вредных побочных действий, снижению терапевтической пользы и т.п.
Следовательно, есть потребность в композициях с ГК, которые преодолевают или сводят к минимуму вышеперечисленные проблемы.
Раскрытие изобретения
Изобретение направлено на композиции гиалуроновой кислоты (ГК) и способы приготовления и применения композиций ГК, которые эффективны для наращивания тканей и/или доставки лекарств.
Композиция гиалуроновой кислоты (ГК) включает частицы геля сшитой нерастворимой в воде гидратированной ГК. ГК включает продукты сшивки, представленные следующей структурной формулой:
ГК′-U-R2-U-ГК′,
где каждая ГК′ - это та же самая или другая сшитая молекула ГК′, то есть сшивка может быть внутримолекулярной или межмолекулярной.
Каждое U - это независимая при необходимости замещенная о-ацил изомочевина или N-ацил мочевина.
R2 - это при необходимости замещенный алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероциклил, цикло-алифатический алкил, аралкил, гетероаралкил или гетероциклил-алкил.
Способ наращивания ткани у субъекта, нуждающегося в наращивании ткани, включает этап введения субъекту иглы в том месте, где нужно наращивание ткани, причем иглу соединяют со шприцем, заполненным композицией ГК. Включено также приложение силы к шприцу, так чтобы доставить по месту назначения не менее одной порции композиции ГК.
Способ получения композиции ГК включает формирование частиц нерастворимой в воде дегидратированной сшитой ГК, разделение частиц нерастворимой в воде дегидратированной сшитой ГК по среднему диаметру, выбор подмножества частиц по среднему диаметру и гидратирование подмножества дегидратированных частиц с помощью физиологически совместимого водного раствора, формируя, таким образом, композицию ГК.
Другой способ приготовления композиции сшитой ГК включает сшивание предшественника сшитой ГК бис-карбодиимидом в присутствии рН-буфера с рН между приблизительно 4 и приблизительно 8 и дегидратирование сшитой ГК с получением дегидратированной сшитой ГК.
Способ стабилизации сшитой ГК включает гидратирование нерастворимой в воде дегидратированной сшитой ГК с помощью физиологически совместимого водного раствора, формируя, таким образом, стабилизированную композицию ГК, где физиологически совместимый водный раствор включает не менее приблизительно 0,1% по весу местного анестетика, где величина модуля упругости G′ для стабилизированной композиции составляет не менее приблизительно 110% от величины G′ для нестабилизированной композиции при измерении при 37°С и частоте 1 Гц с применением плоской геометрии на 4 см.
Стабилизированная композиция ГК также включена.
Варианты осуществления, раскрытые здесь, эффективны для получения и применения частиц геля сшитой нерастворимой в воде гидратированной ГК, где сшивки в ГК включают связующую группу R2, которые обладают сочетанием биостабильности и механических свойств in vivo, в то же время обладая улучшенной применимостью, например улучшенной простотой введения через тонкие иглы. Например, как показано в разделе Примеры, композиции ГК обладают улучшенными значениями модулей упругости G′ и кинематической вязкостью, в то же время проявляя улучшенную биоустойчивость к ферменту гиалуронидазе in vitro и in vivo. Раскрытые осуществления эффективны для применения сшитой ГК для наращивания тканей, притом, что необходимая частота имплантации уменьшается. Осуществления также эффективны для применения сшитой ГК в качестве средства доставки лекарств, которое проявляет удивительный и неожиданный эффект увеличения биостабильности вместе со свойствами эффективного освобождения лекарства и свойствами эффективного назначения.
Краткое описание фигур
Фигура 1. Поглощение в УФ продуктов сшивки, полученных посредством взаимодействия ГК и р-фенилен-бис(этилкарбодиимида) при соотношении молярных эквивалентов 75%, 100% и 125%.
Фигура 2. Поглощение в УФ продуктов сшивки, полученных посредством взаимодействия ГК и р-фенилен-бис(этилкарбодиимида) в буфере MES при рН 5,5, 6,0 и 6,5.
Фигура 3. Влияние распределения частиц по среднему диаметру на модуль упругости (G′) геля.
Фигура 4. Влияние распределения частиц в геле по среднему диаметру на силу, необходимую для выталкивания геля из иглы калибра/размера 30.
Фигура 5. Деградация сшитого продукта ГК в присутствии фермента гиалуронидазы по сравнению с другими продуктами для наращивания тканей: Рестиланом®, Перланом® и Гилаформом®.
Фигура 6. Профиль деградации геля с разными начальными G′, полученного из сшитой ГК изобретения.
Фигура 7. Модули упругости G′ и профили деградации гелей, полученных в фосфатном буфере без лидокаина и в буфере, содержащем 0,2% лидокаина и 0,3% лидокаина.
Осуществление изобретения
Изобретение относится к композициям со сшитой ГК, их получению и способам их применения.
Несшитая ГК, например предшественник сшитой ГК изобретения, обычно включает единицы/звенья дисахарида, состоящего из D-глюкуроновой кислоты (ГлкУК) и K-ацетил-О-глюкозамина (ГлкАац), которые соединены с противоположных сторон с образованием линейного полимера. ГК часто встречается в природе в виде натриевой соли, гиалуроната натрия. ГК, гиалуронат натрия и препараты либо ГК либо гиалуроната натрия часто упоминают как гиалуронан. Как применяют здесь, термины «ГК» и «гиалуронан» относятся также к любой другой соли гиалуроновой кислоты, включая, например, гиалуронат калия, гиалуронат магния, гиалуронат кальция и т.п. Несшитая ГК, применяемая как предшественник для сшивки, обычно обладает средним молекулярным весом в интервале от приблизительно 6×104 до приблизительно 8×106Дальтон, или от 150 до 20000 повторяющихся единиц дисахарида. В качестве исходного материала можно применять ГК из любого среди разнообразия источников, включая ГК, экстрагированную из животных тканей или полученную как продукт бактериальной ферментации. С другой стороны, несшитая ГК, применяемая для получения композиций изобретения, может производиться в промышленных количествах по технологии биопроцесса, как описано в Nimrod et al., PCT Publication No. WO 86/04355, полный смысл которого включен сюда посредством ссылки.
Сшитую ГК можно получать посредством реакции несшитой ГК со сшивающим агентом при подходящих условиях реакции. Сшитую ГК получают в результате взаимодействия несшитой ГК с бис-карбодиимидом в присутствии рН-буфера, где рН буфера лежит между приблизительно 4 и приблизительно 8. Значение рН буфера может лежать между приблизительно 4 и приблизительно 7, обычно между приблизительно 5 и приблизительно 6,5 и более обычно между приблизительно 5 и приблизительно 6. В предпочтительном осуществлении рН около 5,5.
Термин «рН-буфер» может включать любое буферное вещество, известное в уровня техники, например 2-(N-морфолино)-этансульфоновую кислоту (МЭС); 2,2-бис(гидроксиметил)-2,2′,2″-нитротриэтанол; сукцинат/янтарную кислоту; KH2PO4; N-трис(гидроксиметил)-2-аминоэтансульфоновую кислоту; триэтаноламин; диэтилбарбитурат; трис(гидроксиметил)аминоэтан; N-трис(гидрокси)метилглицин и N,N-бис(2-гидроксиэтил)глицин. Буферное соединение можно применять с дополнительной кислотой или основанием, например 2-(N-морфолино)-этансульфоновую кислоту с NaOH; 2,2-бис(гидроксиметил)-2,2′,2″-нитротриэтанол с HCl; сукцинат с янтарной кислотой; KH2PO4 с бурой; N-трис(гидроксиметил)-2-аминоэтансульфоновую кислоту с NaOH; триэтаноламин с HCl, диэтилбарбитурат с HCl; трис(гидроксиметил)аминоэтан с HCl; N-трис(гидрокси)метилглицин с HCl; N,N-бис(2-гидроксиэтил)глицин с HCl. Предпочтительно, буфер включает 2-(N-морфолино)-этансульфоновую кислоту и NaOH.
Обычно буферное вещество растворяют в водной среде в концентрации между приблизительно 5 мМ и приблизительно 250 мМ, обычно между приблизительно 10 мМ и приблизительно 150 мМ, более типично между приблизительно 25 мМ и приблизительно 100 мМ и предпочтительно около 75 мМ.
Обычно несшитую ГК размешивают в водной среде, например растворе рН-буфера в концентрации между приблизительно 1 мМ и приблизительно 100 мМ, обычно между приблизительно 10 мМ и приблизительно 50 мМ, более типично, между приблизительно 25 мМ и приблизительно 50 мМ, предпочтительно около 37 мМ. Применяемые индивидуальные концентрации могут варьировать в зависимости от молекулярного веса несшитого предшественника ГК. При более низких концентрациях реакция может замедляться. При более высоких концентрациях с продуктом может быть труднее управляться из-за увеличения его вязкости. Примеры приемлемых концентраций несшитой ГК для других реакций сшивки описаны в патенте US №5356883 Kuo et al., содержание которого включено сюда посредством ссылки во всей полноте.
Реакцию можно проводить при температуре в интервале между приблизительно 0°С и приблизительно 60°С, обычно между приблизительно 10°С и приблизительно 40°С, более типично между приблизительно 15°С и приблизительно 30°С, и предпочтительно около 25°С. Примеры условий реакции можно обнаружить в Примерах 1-9.
Бис-карбодиимид можно объединять с раствором несшитой ГК сам по себе или более типично в виде раствора в смешивающемся с водой органическом растворителе, например ацетоне, метилэтил-кетоне, диметилформамиде, диметилсульфоксиде, метаноле, этаноле, 2-пропаноле, ацетонитриле, тетрагидрофуране, N-метил пирролидоне и т.п. Более типично, растворителем является ацетон и бис-карбодиимид находится в концентрации между приблизительно 0,1 мг/мл и приблизительно 100 мг/мл, обычно между приблизительно 1 мг/мл и приблизительно 50 мг/мл, более типично, между приблизительно 5 мг/мл и приблизительно 25 мг/мл, и предпочтительно, около 15 мг/мл.
Несшитую ГК и бис-карбодиимид можно соединять при любом соотношении молярных эквивалентов, например между приблизительно 1% и приблизительно 200%, типично между приблизительно 10% и приблизительно 150%, более типично между приблизительно 18% и приблизительно 125%. В различных осуществлениях соотношение молярных эквивалентов составляет приблизительно 18%, или приблизительно 38%, или приблизительно 50%, или приблизительно 75%, или приблизительно 100%, или приблизительно 125%.
Композиция ГК, сшитая с помощью бис-карбодиимида, может включать сшивки, где связующая группа R2 бис-карбодиимидного агента включена в сшивку, например связующая группа, соединяющая через группу U на каждом конце с молекулой ГК′, как показано на следующей структурной формуле:
ГК′-U-R2-U-ГК′
Каждая ГК′ в формуле выше может быть той же самой или другой молекулой ГК, то есть сшивка может быть внутримолекулярной или межмолекулярной сшивкой. Каждая U может быть такой же или другой и является при необходимости замещенной N-ацил-мочевиной или O-ацил-изомочевиной, как показано на фрагментах в скобках в следующих структурных формулах:

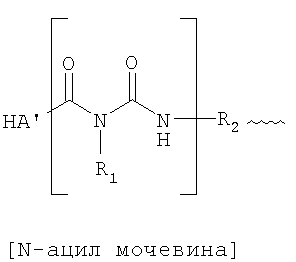
Эти сшивки можно образовывать в реакции ГК со сшивающим реагентом бис-карбодиимидом, представленным следующей структурной формулой:
R1-N=C=N-R2-N=C=N-R1,
где два карбодиимида с заместителем R1 соединены посредством связующей группы R2.
В предшествующих структурных формулах каждый R1 может быть тем же самым или отличным и является при необходимости группой-заместителем, выбранным среди водорода, алифатического углеводорода (например, алкил, алкенил, алкинил), алкокси, циклоалифатического углеводорода (например, циклоалкил, циклоалкенил и циклоалкинил), арила, гетероарила, гетероциклила, циклоалифатического алкила, аралкила, гетероаралкила, гетероциклилалкила и т.п. Подходящие возможные заместители - это такие, которые не изменяют существенно свойств образующейся композиции сшитой ГК; они описаны здесь в секции, описывающей каждую из соответствующих групп. В других осуществлениях R1 является при необходимости замещенной алифатической группой. Более предпочтительно, R1 представляет алкил, например линейный или разветвленный алкил C1-С6, например метил, этил, пропил, бутил, 2-пропил, терт-бутил и т.п. Предпочтительно, каждый R1 является этилом.
Каждый R2 - это при необходимости замещенная связующая группа, включающая одну или более алифатическую, циклоалифатическую группу, арил, гетероарил, гетероциклил, циклоалифатический алкил, аралкил, гетероаралкил, гетероциклил-алкил и т.п. Подходящие возможные заместители - это такие, которые не изменяют существенно свойств образующейся композиции сшитой ГК; они описаны здесь в секции, описывающей каждую из соответствующих групп. R2 может при необходимости включать или прерываться другой группой, например карбонил, амид, окси, сульфид, дисульфид и т.п. В других осуществлениях R2 - это циклоалифатическая, арильная, гетероарильная или гетероциклическая группа. В еще других осуществлениях R2 - это 1,6-гексаметилен, октаметилен, декаметилен, додекаметилен, ПЭГ, -CH2CH2-S-S-CH2CH2-, пара-фенилен-S-S-пара-фенилен, мета-фенилен-S-S-мета-фенилен, мета-фенилен или пара-фенилен. Более предпочтительно, R2- это фенилен. Предпочтительно, R2 - это пара-фенилен.
В одном осуществлении, бис-карбодиимид выбирают из 1,6-гексаметилен-бис(этилкарбодиимида), 1,8-октаметилен-бис(этилкарбодиимида), 1,10-декаметилен-бис(этилкарбодиимида), 1,12-додекаметилен-бис(этилкарбодиимида), ПЭГ-бис(пропил(этилкарбодиимида)), 2,2′-дитиоэтил-бис(этилкарбодиимида), 1,1′-дитио-пара-фенилен-бис(этилкарбодиимида) и 1,1′-дитио-мета-фенилен-бис (этилкарбодиимида). В предпочтительном осуществлении бис-карбодиимид - это пара-фенилен-бис(этилкарбодиимида). Способы получения бис-карбодиимидов описаны в патентах US №№6013679; 2946819; 3231610; 3502722; 3644456; 3972933; 4014935; 4066629; 4085140; 4096334; 4137386; 6548081 и 6620927, содержание которых включено сюда посредством ссылки во всей полноте.
Считается, что реакция ПС со сшивающим реагентом бис-карбодиимидом в присутствии доступного протона на первом этапе включает протонирование. Ацидо-анион/анион кислоты может затем присоединиться к атому углерода образуемого катиона, что приводит к образованию интермедиата O-ацил-изомочевины. Ацильная группа интермедиата может перемещаться от атома кислорода к атому азота с образованием производного ГК с N-ацил-изомочевиной. Считается, что переход от кислорода к азоту может быть неполным, что приводит к смеси продуктов, включающей как N-ацил-мочевину, так и O-ацил-изомочевину. Таким образом, сшивка, получающаяся при реакции бис-карбодиимида с предшественником сшитой ГК, может обычно содержать две O-ацил-изомочевины, соединенные через R2, как показано на следующей структурной формуле:

или O-ацил-изомочевину и N-ацил-мочевину, соединенные через R2, как показано на следующей структурной формуле:

или две N-ацил-мочевины, соединенные через R2, как показано на следующей структурной формуле:

Смешанные продукты можно применять по отдельности или вместе для получения композиций по осуществлениям изобретения.
Сшитую ГК можно осаждать, выливая в смешивающийся с водой органический растворитель, например ацетон, метилэтил кетон, диметилформамид, диметилсульфоксид, метанол, этанол, 2-пропанол, ацетонитрил, тетрагидрофуран, N-метил пирролидон и т.п., предпочтительно спирт, например этанол. Осадок можно собрать и высушить, например, при пониженном давлении.
Сухую сшитую ГК можно оформить в частицы любым способом, хорошо известным в этой области, например истиранием, перемалыванием, разрыванием и т.п., предпочтительно размалыванием на криогенной мельнице. С другой стороны, невысушенную сшитую ГК можно высадить при охлаждении (криопреципитировать) с образованием малых частиц, которые потом можно высушить, или невысушенную сшитую ГК можно размельчить на криогенной мельнице и получающиеся частицы затем высушить.
Как применяют здесь «нерастворимый в воде» и т.п. термины относятся к композициям, например, нерастворимые в воде дегидратированные частицы или нерастворимые в воде гидратированные частицы, которые гетерогенны при суспендировании в достаточном количестве воды при комнатной температуре. В одном осуществлении «нерастворимые в воде» означает, что при помещении частиц композиции ГК в воду при нейтральном рН и 25°С не менее чем приблизительно на две недели частицы ГК существенно нерастворимы, то есть по существу ГК из частиц не оказывается свободно растворенной в воде. В других осуществлениях «нерастворимый в воде» означает, что ГК из частиц по существу нерастворима после не менее приблизительно 4-х недель в вышеописанных условиях, обычно, после не менее приблизительно 6-ти недель, более типично, после не менее приблизительно 8 недель или предпочтительно после не менее приблизительно 12 недель. В одном осуществлении «нерастворимый в воде» означает, что ГК из частиц по существу нерастворима после не менее приблизительно 26 недель в вышеописанных условиях. Как применяют здесь, «легко растворима» означает растворение молекул ГК в воде отдельно от гидратированных набухших в воде частиц.
Более того, производные сшитой ГК могут быть гидрогелем. Как этот термин применен здесь, «гидрогель» - это сшитая макромолекулярная сеть, которая может разбухать в воде или биологических жидкостях и удерживать значительную порцию воды внутри своей структуры без растворения. Как применяют здесь, термин «набухание» относится к забору жидкости, например воды, гелем с увеличением объема обычно при приложении тепла или давления. Гидрогели обладают высоким молекулярным весом, который, обыкновенно, нельзя измерить обычными способами, и состоят из полимерной цепочки и сшивок.
Частицы сшитой ГК можно характеризовать распределением частиц по диаметру. Средний диаметр можно измерять как средний диаметр гидратированных частиц и/или средний диаметр дегидратированных частиц. Обычно средний диаметр частиц выбирают из группы, состоящей из среднего диаметра гидратированных частиц между приблизительно 20 мкм (микрометр) и приблизительно 1000 мкм и среднего диаметра дегидратированных частиц между приблизительно 10 мкм и приблизительно 500 мкм. В других вариантах осуществления средний диаметр гидратированных частиц находится между приблизительно 40 мкм (микрометр) и приблизительно 600 мкм, и средний диаметр дегидратированных частиц находится между приблизительно 20 мкм и приблизительно 300 мкм, или более предпочтительно, средний диаметр гидратированных частиц находится между приблизительно 50 мкм (микрометр) и приблизительно 500 мкм, и средний диаметр дегидратированных частиц находится между приблизительно 25 мкм и приблизительно 250 мкм.
В отдельном варианте осуществления композиция ГК состоит, по существу, из гидратированных частиц геля сшитой нерастворимой в воде ГК. Например, композицию ГК этого осуществления можно рассматривать как единственную фазу из гидратированных частиц, то есть всякая жидкость в композиции, по существу, содержится в гидратированных частицах, то есть, по существу, свободной жидкой фазы нет. В других осуществлениях, где ГК в композиции, по существу, состоит из сшитых нерастворимых в воде частиц геля, определенные формы ГК исключают из композиции, например обычно исключают частицы или молекулы ГК со средним диаметром менее приблизительно 1 мкм, более типично, исключают частицы или молекулы ГК со средним диаметром менее приблизительно 10 мкм, и предпочтительно исключают частицы или молекулы ГК со средним диаметром менее приблизительно 20 мкм.
Как применяют здесь, «подмножество» частиц со средним диаметром означает, что выборку частиц характеризуют по среднему диаметру и, по крайней мере, некоторую фракцию частиц отвергают, то есть не включают в это подмножество.
В других осуществлениях средний диаметр частиц отбирают, например, посредством просеивания или другими способами, хорошо известными в данной области, так чтобы можно было выбрать особое распределение по диаметрам для получения особых свойств конечной композиции, например, как показано в разделе Примеры. Таким образом, дегидратированные частицы можно просеивать для разделения фракций по среднему размеру, например, как в Примере 16, где собирают пять фракций по среднему диаметру частиц: 0-25 мкм, 25-75 мкм, 75-125 мкм, 125-180 мкм и 180-250 мкм.
Разные фракции по среднему диаметру частиц отдельной композиции можно задействовать для задания сочетания фракций по среднему диаметру в разных пропорциях, что приведет к особым комбинированным свойствам. Таким образом, в одном осуществлении нерастворимые в воде дегидратированные частицы можно разделять не менее чем на две фракции по среднему диаметру и фракции можно комбинировать в таком соотношении, чтобы отрегулировать свойства комбинации, например в примере 17 две фракции, содержащие частицы 125-250 мкм и 0-125 мкм, объединяют в соотношении 1:1. Получающаяся композиция обладает распределением по диаметру, отличным от исходных частиц до сортировки по размерам, например, распределение по диаметру может быть мультимодальным распределением по среднему диаметру, например бимодальным распределением по среднему диаметру, когда для композиции выбирают две фракции по среднему диаметру. Свойства мультимодальной композиции строятся из свойств индивидуальных фракций по среднему диаметру и их количеств в композиции. В другом осуществлении нерастворимые в воде дегидратированные частицы можно разделять не менее чем на три фракции по среднему размеру частиц, где не менее чем две фракции по среднему диаметру выбирают и не менее чем одну фракцию по среднему диаметру отбрасывают.
Дегидратированные частицы обычно гидратируют в присутствии физиологически приемлемого раствора (например, физиологического раствора или фосфатного буфера, как представлено в разделе Примеры) при условиях, включающих температуру не менее приблизительно 100°С, давление не менее приблизительно 120 кПа (килопаскалей) и продолжительность не менее приблизительно 15 мин. Такие условия можно достигать в автоклаве, к примеру, и применять также для стерилизации частиц. Другие условия включают: температуры от приблизительно 100°С до приблизительно 150°С, обычно, от приблизительно 110°С до приблизительно 140°С, или предпочтительно от приблизительно 120°С до приблизительно 140°С; давление от приблизительно 120 кПа до приблизительно 200 кПа, обычно от приблизительно 120 кПа до приблизительно 160 кПа, или предпочтительно от приблизительно 130 кПа до приблизительно 140 кПа; продолжительность от приблизительно 15 до приблизительно 75 мин, более типично от приблизительно 20 мин до приблизительно 60 мин.
Дополнительные рассматриваемые способы стерилизации/гидратирования включают следующие. В одном осуществлении продукт можно подвергнуть действию чистого пара при температуре 118-133°С (типично, приблизительно 121°С) и соответствующем давлении пара при насыщении (от приблизительно 103 кПа до приблизительно 186 кПа). Охлаждение при испарении может происходить во время вакуумизации или естественное охлаждение может происходить, например, при медленном отводе из системы пара под давлением. В другом осуществлении продукт можно стерилизовать при температуре 118-133°С (обычно 121°С), применяя смесь воздуха с паром, предпочтительно циркулирующую, например, под вентилятором. Обычное давление составляет от 69 кПа до приблизительно 103 кПа над давлением насыщенного пара (обычно менее 310 кПа). Охлаждение можно достигнуть, например, введением в циркуляцию под вентилятором холодного воздуха. В другом осуществлении продукты можно разбрызгивать с жидкой водой при температуре стерилизации, при достаточном давлении на измерителе, чтобы удерживать воду в жидком состоянии (обычно менее 310 кПа). Охлаждение до приблизительно 80°С можно достигать при прямом контакте водяных брызг с охлаждающей системой в теплообменнике. Охлаждение от приблизительно 80°С до приблизительно 20°С происходит в основном за счет испарения и может служить для удаления из продукта избытка жидкости. Возможно много вариантов описанной выше техники гидратации/стерилизации.
Композиция сшитой ГК предпочтительно включает физиологически эффективное количество не менее чем одного биоактивного агента, выбранного из группы, состоящей из клеток, генов, белков, антител, пептидов и фармацевтических веществ.
«Лекарственное вещество» как термин, применяемый здесь, включает, например, соединения и композиции, признанные в официальной фармакопее Соединенных Штатов, в официальной гомеопатической фармакопее Соединенных Штатов, или официальном национальном справочнике (National Formulary) или любом приложении к ним, соединения или композиции, предназначенные для применения в диагностике, излечении, смягчении, лечении или предотвращения заболевания у людей или животных, и соединения и композиции (отличные от продуктов питания), предназначенные для воздействия на структуру или любую функцию тела человека или животных. Фармацевтические вещества включают фармацевтические соединения и растворы, соли, кристаллические полиморфы и их стереоизомеры. Примеры классов фармацевтических веществ включают факторы роста (например, интерлейкины, простагландины, тромбоксаны, лейкотриены и цитокинины), стероидные и нестероидные контрацептивы, антибиотики (например, пенициллин, стрептомицин и линокомицин), анальгетики, анестетики, седативные вещества, барбитураты, аминоалкилбензены, катехоламины, наркотики, антагонисты наркотиков, антинеопластические агенты и антикоагулянты (например, гепарин и сульфат гепарина), стероидные и нестероидные противовоспалительные лекарства, анестетики, антибиотики, противогрибковые средства, гормоны и любые синтетические аналоги и фармацевтически активные фрагменты вышеперечисленных и т.п. Фармацевтические вещества, подходящие для применения в системах доставки в осуществлениях изобретения, могут быть жирорастворимыми, водорастворимыми, анионными или катионными пока они способны реагировать с группой производного гиалуроновой кислоты с образованием ковалентной или ионной связи или гидрофобных или гидрофильных взаимодействий, например в осуществлении может иметь место гидрофобное взаимодействие между гидрофобной частью фармацевтического соединения и производным ГК.
Биоактивный агент можно вводить на любой стадии, но обычно его добавляют во время приготовления композиции посредством включения в физиологически совместимый раствор, применяемый для гидратирования дегидратированных частиц, например фосфатный буфер в примерах. В одном осуществлении композиция сшитой ГК, например гидратированные частицы ГК, включает анестетик, например местный анестетик в качестве биоактивного агента. Местный анестетик может включать не менее одного члена группы, выбранного из амбукаина, амоланона, амилокаина, беноксината, бензокаина, бетоксикаина, бифенамина, бупивакаина, бутакаина, бутамбена, бутаниликаина, бутетамина, бутоксикаина, картикаина, хлоропрокаина, кокаэтилена, кокаина, циклометикаина, дибукаина, диметизоквина, диметокаина, диперодона, дициклонина, экгонидина, экгонина, этилхлорида, этидокаина, бета-эукаина, эупроцина, феналкомина, формокаина, гексилкаина, гидрокситетракаина, изобутил-р-аминобензоата, лейцинокаина, месилата, левоксадрола, лидокаина, мепивакаина, меприлкаина, метабутоксикаина, метилхлорида, миртекаина, наэпаина, остакаина, ортокаина, оксетазаина, паретоксикаина, фенакаина, фенола, пиперокаина, пиридокаина, полидоканола, прамоксина, прилокаина, прокаина, пропанокаина, пропаракаина, пропипокаина, пропоксикаина, псевдококаина, пиррокаина, ропивакаина, салицилового спирта, тетракаина, толикаина, тримекаина, золамина и их солей. Обычно биоактивный агент является местным анестетиком, выбранным из лидокаина, мепивакаина, прилокаина, бупивакаина, кокаина, прокаина, хлорокаина и тетракаина или их солей или растворов. Предпочтительно, биоактивный агент является местным анестетиком лидокаином или его раствором или солью, например соль лидокаин ·HCl.
Сшитая ГК может служить средством, обеспечивающим контролируемое или продолжительное освобождение биоактивного агента. В одном осуществлении ГК с контролируемым освобождением помещали в контакте с предварительно выбранной тканью и оставляли на месте до достижения желаемого клинического результата. ГК с контролируемым освобождением, по варианту осуществления, можно вводить посредством инъекции или имплантировать на участок, куда желательна доставка, или можно назначать через рот или таким путем, который является сочетанием двух или более таких путей назначения.
Диффузия обеспечивает доставку биоактивного агента через систему доставки, в которой лекарство реагирует со сшитой ГК не ковалентно. Такие нековалентные взаимодействия включают ионные, гидрофобные и гидрофильные взаимодействия, при которых биоактивный агент диспергирован внутри носителя. Как применяют здесь, термин «диспергирован» означает ионные, гидрофобные и гидрофильные взаимодействия между лекарством и ГК.
Скорость доставки биоактивного агента связана не только со скоростью его диффузии, но также со скоростью деградации ГК, в которой лекарство или другое биоактивное вещество диспергировано. Скорость деградации ГК связана со степенью сшивки и зависит также от множества метаболических процессов, происходящих in vivo. Процесс деградации обычно медленнее диффузии. Посредством выбора концентрации лекарства, диспергированного внутри ГК, и степени сшивки можно контролировать скорость деградации и диффузии и таким образом скорость доставки лекарства.
Как применяют здесь, «физиологически эффективное количество» - это количество биоактивного агента, которое достаточно для необходимого воздействия, например количество местного анестетика, достаточное для анестезирующего действия на субъект, которому сделана инъекция с композицией, включающей этот агент. Опытный в данной области сможет определить физиологически эффективное количество, основываясь на количестве применяемой композиции, истории болезни субъекта и т.п. Концентрацию лекарства можно варьировать в очень широких пределах и предпочтительно следует выбирать в зависимости от степени сшивки ГК, растворимости лекарства, его фармацевтической активности и желаемого действия.
Как применяют здесь, «физиологически приемлемый раствор» - это любой раствор, известный в данной области, который применяют как носитель в физиологических системах, например водные растворы, которые обычно стерильны, неаллергенны, нетоксичны и т.п., например физиологический раствор, буферный раствор, раствор сахара и т.п.
Вязкоэластические свойства композиции можно определить, как показано в Примерах. В одном осуществлении композиция обладает не менее чем одним параметром, измеренным при 37°С, выбранным из модуля упругости G′ не менее приблизительно 50 Па (Паскалей), измеряемой при частоте в 1 Гц (герц) с помощью плоской геометрии на 4 см; и кинематической вязкости не менее приблизительно 20000 сП (сантипуаз), измеряемой при скорости сдвига 1 с-1.
В другом осуществлении кинематическая вязкость составляет не менее приблизительно 40000 сП, более типично не менее приблизительно 60000 сП, и предпочтительно не менее приблизительно 70000 сП. В другом осуществлении кинематическая вязкость составляет от приблизительно 20000 сП до приблизительно 250000 сП. В других осуществлениях кинематическая вязкость составляет от приблизительно 40000 сП до приблизительно 220000 сП, более типично от приблизительно 60000 сП до приблизительно 200000 сП, и предпочтительно от приблизительно 70000 сП до приблизительно 170000 сП.
В других осуществлениях модуль упругости G′ составляет не менее приблизительно 100 Па, типично не менее приблизительно 100 Па, более типично, не менее приблизительно 200 Па, и предпочтительно не менее приблизительно 400 Па. В других осуществлениях модуль упругости G′ составляет от приблизительно 50 Па до приблизительно 1600 Па, типично, от приблизительно 100 Па до приблизительно 1200 Па, более типично от приблизительно 200 Па до приблизительно 1000 Па, и предпочтительно от приблизительно 400 Па до приблизительно 700 Па.
Композицию со сшитой ГК можно характеризовать биостабильностью, то есть устойчивостью к деградации in vitro под действием фермента гиалуронидазы, как показано в Примерах. Например, при соединении композиции при 37°С с ферментом гиалуронидазой в количестве приблизительно 0,3% по весу в условиях, подходящих для гиалуронидазной реакции, значение G′ для композиции, замеренное через 16 час реакции, составляет не менее приблизительно 5% величины G′, замеренной через приблизительно 15 мин от начала реакции. В других осуществлениях значение G′ для композиции, замеренное через приблизительно 16 час реакции, составляет долю значения, замеренного через приблизительно 15 мин от начала реакции, в основном, не менее приблизительно 10% или не менее приблизительно 25%, или не менее приблизительно 45%, или не менее приблизительно 50%, типично, не менее приблизительно 60%, более типично, не менее приблизительно 75%, или предпочтительно не менее приблизительно 80%. В одном осуществлении значение G′ для композиции, замеренное приблизительно через 16 час реакции, приблизительно такое же, как замеренное через приблизительно 15 мин от начала реакции.
В других осуществлениях модуль упругости G′ увеличен, то есть композиция стабилизирована посредством включения местного анестетика, например лидокаина, по сравнению с нестабилизированной композицией, то есть идентичной композицией, кроме того, что местный анестетик не включен. Для этих осуществлений стабилизированные и нестабилизированные композиции можно сравнить посредством измерения величины G′ в одинаковых условиях. Стабилизированная композиция, полученная посредством гидратирования частиц в условиях гидратирования, раскрытых здесь, с помощью раствора, содержащего 0,1%-ный местный анестетик (например, лидокаин) по весу, обладает большей G′, чем G′ у нестабилизированной композиции, что составляет обычно не менее приблизительно 110%, типично не менее приблизительно 120%, более типично не менее приблизительно 150%, и предпочтительно не менее приблизительно 175%.
В отдельном осуществлении композиция с ГК включает гидратированные частицы геля сшитой нерастворимой в воде ГК. Частицы включают лидокаин ·HCl. А также частицы обладают средним диаметром, выбранным из группы, состоящей из гидратированных частиц среднего диаметра между приблизительно 20 и приблизительно 1000 мкм и дегидратированных частиц среднего диаметра между приблизительно 10 и приблизительно 500 мкм. Далее, частицы включают сшивки, представленные следующей структурной формулой:
ГК′-U-R2-U-ГК′
где переменные имеют значения, описанные выше. Композиция обладает не менее чем одним параметром, измеренным при 37°С, выбранным из модуля упругости G′ величиной не менее приблизительно 50 Па, измеренной при частоте 1 Гц с применением плоской геометрии на 4 см, и кинематической вязкости не менее приблизительно 2000 сП, измеренной при скорости сдвига 1 с-1. А также композиция достаточно стабильна к ферментативной деградации, наблюдаемой при соединении композиции при 37°С с ферментом гиалуронидазой в количестве приблизительно 0,3% по весу, в условиях, подходящих для гиалуронидазной реакции, значение G′ для композиции, замеренное через 16 час реакции, составляет не менее приблизительно 5% величины G′, замеренной менее чем через приблизительно 15 мин от начала реакции. В другом осуществлении значение G′ для композиции, замеренное через 16 час реакции, составляет не менее приблизительно 50% величины G′, замеренной менее чем через приблизительно 15 мин от начала реакции.
Как применяют здесь, «при необходимости наращивания тканей» означает, что субъект по медицинским показаниям может выиграть от введения композиции с ГК изобретения, например субъект, нуждающийся в лечении или коррекции таких состояний как морщины, борозды или складки и другие морщины на коже, обычно на лбу и вокруг глаз, носа и губ, коррекции или переформировании дефектов мягких тканей и зарубцованных шрамов. Такие состояния могут быть наследственными или приобретенными вследствие старения, болезни, ранения, хирургических осложнений и т.п.
Термин «субъект» включает млекопитающих, например людей, домашних животный (например, собак, кошек, птиц и т.п.), сельскохозяйственных животных (например, коров, свиней, лошадей, домашнюю птицу и т.п.) и лабораторных животных (например, крыс, мышей, морских свинок, птиц и т.п.). Наиболее предпочтительно субъектом является человек.
Как применяют здесь, «алкильные группы» включают, например, метил, этил, пропил, бутил, пентил, гексил, октил, нонил, децил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонадецил, эйкозил, генэйкозил, докозил, трикозил, тетракозил, пентакозил и их изомерные формы. «Алкокси группой» является алькильная группа, связанная через атом кислорода, например метокси, этокси, пропокси и т.п.
Как применяют здесь, «алкенильными группами» являются алкильные группы, включающие от 2 до 25 атомов углерода, которые содержат двойную связь, такие как винил, аллил, бутенил, пентенил, гексенил, октенил, ноненил, деценил, ундеценил, додеценил, тридеценил, тетрадеценил, пентадеценил, гексадеценил, гептадеценил, октадеценил, нонадеценил, эйкозенил, генэйкозенил, докозенил, трикозенил, тетракозенил, пентакозенил и их изомерные формы.
Как применяют здесь, «алкинильные группы» являются алкильными группами, включающими от 2 до 25 атомов, которые содержат тройную связь, такими как винил, аллил, бутинил, пентинил, гексинил, октинил, нонинил, децинил, ундецинил, додецинил, тридецинил, тетрадецинил, пентадецинил, гексадецинил, гептадецинил, октадецинил, нонадецинил, эйкозинил, генэйкозинил, докозинил, трикозинил, тетракозинил, пентакозинил и их изомерные формы.
Термин «арил», как применяют здесь, отоносят к фенилу, толилу, ксилилу, нафтилу бифенилу, трифенилу и т.п. Термин «гетероарил» относят к гетероароматическим группам, например пирролилу, тиенилу, фуранилу, пиридинилу, оксазолилу, изооксазолилу, тиазолилу, изотиазолилу, хинолинилу и т.п. «Аралкильная группа» - это арильная группа, соединенная через алкильную группу, например бензил, этилнафтил и т.п.
Как применяют здесь, «циклоалкил» включает насыщенные кольца от 3 до 8 углеродных атомов включительно, такие как циклопоропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. «Циклоалкилалкильная группа» - это циклоалкильная группа, соединенная через алкильную группу, например метилциклопропил и т.п.
Термин «гетероциклил» относят к циклоалкильной группе, где один или более углеродных атомов кольца замещен гетероатомом, например азиридил, азетидил, пирролидил, пиперидил, тииранил, тиетанил, тетрагидротиофенил, тетрагидротиопиранил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, морфолинил и т.п.
Термин «циклоалкенил» относят к циклоалкильным группам, обладающим двойной связью, например циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и т.п.
Термин «циклоалкинил» относят к циклоалкильным группам, обладающим тройной связью, например циклопропинил, циклобутинил, циклопентинил, циклогексинил, циклогептинил, циклооктинил и т.п.
Термин «замещенные», как применяют здесь, обозначает группу, где один или более атомов водорода замещен химической группой, которая не оказывает неблагоприятного влияния на предпочтительное получение производного продукта. Представителями таких групп являются галогены (например, -F, -Cl, -Br, -I), амино, нитро, циано, -ОН, адкокси, алкил, арил, амидо, сульфамидо, сульфат, сульфонат, фосфат, фосфонат, карбоксилат, карбоксамидо и т.п.
Примеры осуществления изобретения
Сшитую ГК получают в следующих примерах посредством реагирования бис-карбодиимида с несшитой гиалуроновой кислотой в указанных соотношениях. Молекулярный вес несшитой ГК, примененной в этих примерах, составлял от приблизительно 5×105 Дальтон до приблизительно 2×106 Дальтон, хотя ГК с большим или меньшим молекулярным весом тоже можно применять. Примененную ГК получали из гребешков петуха или бактериальных источников. Все соединения получали из Sigma, St.Louis, МО кроме отдельно отмеченных случаев.
Получение MES-буферов (интервал рН 5,2-7,1)
Для каждого MES-буфера, 2-[N-морфолино]этансульфоновую кислоту (MES гидрат) (14,6 г) растворяют в 980 мл стерильной воды. Для каждого из трех растворов рН доводят до нужной величины (5,5, 6,0 или 6,5), добавляя 0,1 N NaOH. Объем доводят до 1 л, добавляя стерильную воду.
Фосфатные буферы 1-5
Для каждого индивидуального фосфатного буфера применяют 1 л стерильной воды для растворения указанных в Таблице 1 количеств фосфата натрия двенадцативодного (Na3PO4·12H2O), лидокаина гидрохлорида (лидокаин ·HCl), фосфата натрия двузамещенного (Na2HPO4) и фосфата натрия однозамещенного водного (NaH2PO4·Н2О).
Способ для примеров 1-9
В каждом из следующих примеров реагенты применяют в количествах, указанных в таблице 2. Несшитую ГК растворяют в 133,4 мл MES-буфера с указанным рН и соединяют с ацетоновым раствором пара-фенилен-бис(этилкарбодиимида) (ФБКДИ) с концентрацией 15 мг/мл, получая указанное соотношение молярных эквивалентов (МЭС %) и моль % между ФБКДИ и ГК. Реакционную смесь тщательно перемешивают (применяя либо стеклянную палочку, либо верхнюю механическую мешалку, например, в течение 1 мин, что приводит к образованию белой пасты из прозрачной реакционной смеси) и смесь оставляют стоять при комнатной температуре около 72 часов. В образующийся гель замешивают хлористый натрий (6,5 г для получения концентрации хлористого натрия 5% по весу) и оставляют стоять 1 час. Гель сшитой ГК осаждают добавлением этой смеси к приблизительно 1,2 л интенсивно перемешиваемого этанола. Осадок собирают и сушат при пониженном давлении с получением сшитой ГК.
Пример 10: Степень сшивки увеличивается при увеличении молярного соотношения в пользу сшивающего агента
Сшивание гиалуроновой кислоты пара-фенилен-бис(этилкарбодиимидом) вводит фениленовый хромофор, поглощающий в УФ, в продукт сшивки. Посредством измерения поглощения сшитого продукта в УФ можно количественно определить количество УФ хромофора и степень сшивки, включившей производное бис-карбодиимида в качестве связки.
Для приготовления раствора с концентрацией 0,1 мг/мл взвешенное количество (1-10 мг) каждого из продуктов сшивания в примерах 5, 8 и 9 отдельно растворяют в достаточном количестве раствора 5%-ной серной кислоты посредством нагревания при 70-75°С в течение 4 часов в запаянном контейнере. Каждый раствор разводят 5%-ной серной кислотой для получения раствора каждого продукта с концентрацией 0,1 мг/мл. Поглощение в УФ (УФ макс) таких растворов, измеренное при 249 нм, показано на Фигуре 1 в виде функции молярного соотношения эквивалентов бис-карбодиимид: ГК в %. Таким образом, видна корреляция между степенью сшивки, включающей производное бис-карбодиимида в виде связки (как доказывают значения УФ макс), и соотношением молярных эквивалентов бис-карбодиимид: ГК в %.
Пример 11: Степень сшивки можно контролировать через рН.
Для приготовления раствора с концентрацией 0,1 мг/мл взвешенное количество (1-10 мг) каждого из продуктов сшивания в примерах 5, 6 и 7 отдельно растворяют в достаточном количестве раствора 5%-ной серной кислоты посредством нагревания при 70-75°С в течение 4 часов в запаянном контейнере, и затем оставляют стоять в течение 16 часов при комнатной температуре. Такие растворы разводят 5%-ной серной кислотой для получения раствора каждого продукта с концентрацией 0,1 мг/мл. Поглощение в УФ таких растворов, измеренное при 249 нм, показано на Фигуре 2.
Можно видеть, что наибольшая степень сшивки, включающей производное бис-карбодиимида в виде связки, достигается при рН 5,5 (композиция по примеру 5), которая больше, чем при рН 6,0 (композиция из примера 6), и эти обе больше, чем при рН 6,5 (композиция из примера 7).
Пример 12: получение геля из дегидратированной сшитой ГК.
Порцию сухого остатка сшитой ГК из примера 5 размалывают в криогенной мельнице. Порошок суспендируют в диметилсульфоксиде (ДМСО) и суспензию перемешивают в течение 4-10 часов. Суспензию центрифугируют и ДМСО удаляют. Нерастворимую в воде сшитую ГК ресуспендируют в этаноле, перемешивают несколько часов, и этанол удаляют (промывку этанолом при необходимости можно повторять). После удаления этанола твердое вещество собирают и сушат под вакуумом. Сухой порошок сшитой ГК суспендируют в фосфатном буфере 4 для получения суспензии 30 мг/мл в форме густой массы или пасты. Осмолярность суспензии доводят до 280-340 мОсм (миллиосмолей) добавлением хлористого натрия и набирают в шприц. Шприц автоклавируют при 120°С и давлении около 138 кПа (килопаскаль) (20 фунтов/квадратный дюйм) в течение 25 мин и охлаждают после стерилизации холодной водой.
Пример 13: Описание модуля упругости G′ гелей гидратированной ГК.
Реологическое поведение (включая модуль упругости G′) геля по примеру 12 оценивали с помощью Реометра AR-1000 (ТА Instrument, New Castle, DE). Условия измерения включают температуру, равную 37°С, геометрию поверхности, представляющую плоскую пластину, зазор 200 мкм (микрометров) и частоту 1 Гц. Замеренный в таких условиях модуль упругости G′ геля, полученного по примеру 12, составлял 1076 Па (паскаля).
Пример 14: характеристика силы выдавливания (экструзии) гидратированных гелей ГК
Силу, необходимую для выдавливания геля, можно охарактеризовать посредством загрузки геля в стеклянный шприц на 1 мл с внутренним диаметром 0,635 см, снабженный иглой 30-го размера (внутренний диаметр приблизительно 150 мкм, площадь сечения 0,0177 мм2). Силу, необходимую для выдавливания геля через иглу со скоростью 4 мл/час, измеряли, помещая шприц в шприцевой насос, соединенный с системой измерения силы (Load Cell SLB-50, Transducer Techniques, CA). При приблизительно 25°С и скорости выдавливания 4 мл/час измеренная сила выдавливания составляла 10,7 Н (ньютона) (2,4 фунта).
Пример 15: Характеристика устойчивости гидратированных гелей ГК к ферментативному гидролизу.
Долговечность сшитой ГК при ферментативном гидролизе измеряют с помощью теста in vitro, соединяя гель с измеренным количеством фермента гиалуронидазы и регистрируя модуль упругости как функцию времени.
К гелю из примера 12 (0,75 г), помещенному в колбу, добавляют раствор гиалуронидазы из семенников быка (15 мкл раствора гиалуронидазы 0,15 мг/мл в 1,9 мМ фосфатном буфере в физиологическом растворе, приблизительно 2,5 единицы) и тщательно перемешивают в течение 1 мин. Смесью заполняют шприц и центрифугируют в течение 1 мин при 1500 об/мин для удаления пузырьков воздуха. 0,35 г такой смеси помещают на пластину реометра. Сбор данных начинают через 15 мин после добавления фермента. Модуль упругости G′ геля регистрируют с интервалами в 10 мин в течение 16 часов при температуре 37°С на плоской пластине при зазоре 200 мкм и частоте 1 Гц.
Скорость уменьшения модуля упругости ΔG′/Δt, то есть наклон графика зависимости G′ от времени, рассчитывают посредством деления ΔG′ на интервал времени. Такая скорость может представлять чувствительность продукта к ферментативному гидролизу. При сравнении устойчивости двух композиций композиция с большей стабильностью лучше поддерживает модуль упругости, чем композиция с меньшей стабильностью. В этом примере средняя скорость потери G′ гелем составляет около -5 Па/час. Таким образом, композицию примера можно считать стабильной в условиях теста. Опытный в данной области специалист поймет, что от композиции, устойчивой в таких условиях, можно ожидать хорошей стабильности также in vivo.
Пример 16: Влияние размера частиц на реологические свойства геля.
Сухой осадок сшитой ГК из примера 5 размалывают в криогенной мельнице и промывают ДМСО и этанолом, как описано в примере 12. После удаления этанола твердое вещество собирают и сушат под вакуумом. Сухой порошок сшитой ГК фракционируют по среднему диаметру с помощью пяти сит: 25 мкм, 75 мкм, 125 мкм, 180 мкм и 250 мкм, размещенных в виде стопки (друг над другом). Собирают пять фракций по среднему диаметру: 0-25 мкм, 25-75 мкм, 75-125 мкм, 125-180 мкм и 180-250 мкм. Каждую фракцию суспендируют в фосфатном буфере 5 для получения суспензии 32 мг/мл. Осмолярность суспензии доводят до 280-340 мОсм (миллиосмолей) и каждую суспензию загружают в шприц. Шприцы автоклавируют при 120°С и давлении около 138 кПа (килопаскаль) (20 фунтов/кв. Дюйм) в течение приблизительно 45 мин и затем охлаждают холодной водой.
На фигуре 3 показаны модули упругости (G′) для каждого геля, измеренные в условиях, описанных в примере 12. Как видно на фигуре 3, реологические свойства этих вязкоэластичных гелей зависят от распределения среднего диаметра частиц и состава геля.
На фигуре 4 показана сила, необходимая для выдавливания этих гелей через иглу 30-го размера по способу, описанному в примере 12. Как видно на фигуре 4, сила выдавливания таких вязкоэластичных гелей зависит от распределения среднего диаметра частиц и состава гелей.
Пример 17. Объединение фракций по размеру частиц для получения специальных реологических свойств.
Сухую осажденную сшитую ГК из примера 5 размалывают и промывают, как описано в примере 12. Порцию сухого порошка сшитой ГК затем просеивают через сито на 250 мкм. Все частицы среднего диаметра менее 250 мкм собирают и суспендируют в фосфатном буфере 4 для получения суспензии 32 мг/мл.
Две порции частиц со средним диаметром 250-125 мкм и меньше 125 мкм собирают. Эти фракции смешивают в соотношении 1:1 по весу и суспендируют в фосфатном буфере 4 для получения суспензии 32 мг/мл. Осмолярность каждой суспензии доводят до 280-340 мОсм (миллиосмоль) и загружают в шприц. Шприцы автоклавируют при 120°С и давлении около 138 кПа (килопаскаль) (20 фунтов/кв. дюйм) в течение приблизительно 45 мин и затем охлаждают холодной водой.
Модули упругости (G′) для этих гелей измеряют в условиях, описанных в примере 12. Образец геля, приготовленный из частиц со средним диаметром менее 250 мкм, обладает начальным G′ 600 Па; образец геля, приготовленный из частиц со средним диаметром 250-125 мкм и 125-0 мкм в соотношении 1:1, обладает начальным G′ 450 Па.
Пример 18: Модуль упругости как функция степени сшивки.
Порцию сухой осажденной сшитой ГК из каждого из примеров 5 и 6 размалывают и промывают, как описано в примере 12. Каждую порцию затем просеивают через сито на 250 мкм. Частицы со средним диаметром менее 250 мкм собирают и суспендируют в фосфатном буфере 4 для получения суспензии 32 мг/мл.
Осмолярность каждой суспензии доводят до 280-340 мОсм (миллиосмоль) и загружают в шприц. Шприцы автоклавируют при 120°С и давлении около 138 кПа (килопаскаль) (20 фунтов/кв. дюйм) в течение приблизительно 20 мин и затем охлаждают холодной водой.
Модули упругости (G′) для этих гелей измеряют, применяя условия измерения, описанные в примере 12. Образец геля, приготовленный из композиции примера 5, обладал начальной G′ 700 Па; образец геля, приготовленный из сшитой композиции примера 6, обладал начальной G′ 450 Па. Видно, что композиция с большей степенью сшивки по измерениям степени сшивки в УФ, т.е. композиция примера 5, обладает также большим модулем упругости.
Пример 19: ΔG′/Δt изобретения превосходит таковую у конкурирующих продуктов.
Сшитую ГК, полученную по примеру 5 и обработанную по примеру 12, превращают в гель с начальным G′ 450 Па. Оценивали устойчивость этого продукта и трех конкурирующих продуктов для наращивания тканей Рестилана®, Перлана® (оба от Q-Med, Uppsala, Sweden) и Гилаформа® (Genzyme, Cambridge, MA) к перевариванию гиалуронидазой. Раствор гиалуронидазы (15 мкл раствора гиалуронидазы 0,15 мг/мл в 1,9 мМ фосфатном буфере, ≈2,5 единиц) добавляют к 0,75 г каждого продукта и тщательно перемешивают. Каждую смесь загружают в шприц и центрифугируют в течение 1 мин при 1500 об/мин для удаления пузырьков воздуха. Затем 0,35 г каждой смеси помещают на пластину реометра. Собирать данные начинают через 15 мин от момента добавления фермента. Модуль упругости G′ геля регистрируют с интервалами 10 мин в течение 16 часов при температуре 37°С на плоской пластине, при зазоре 200 мкм и частоте 1 Гц.
На фигуре 5 приведены графики зависимости G′ от времени для каждого продукта. Как видно, скорость потери, представляющая подверженность продукта ферментативному гидролизу, гораздо меньше у композиции изобретения, чем у трех конкурирующих композиций.
Пример 20: ΔG′/Δt композиции против гиалуронидазы не зависит от G′.
На фигуре 6 приведены ΔG′/Δt за период 16 часов для набора композиций со сшитой ГК с начальными величинами модуля упругости между приблизительно 200 и приблизительно 1200 Па. Композиции получали и измерения проводили по вышеописанным примерам. Как видно, деградация композиций со сшитой ГК, в основном, не зависит от начальных модулей упругости G′ за такой период в 16 часов.
Пример 21: Синергетическое действие лидокаина на реологические свойства геля. Лидокаин может оказывать синергетическое действие и увеличивать начальный модуль упругости G′ геля по сравнению с идентичными помимо этого композициями, полученными в буфере без лидокаина. Сшитую ГК примера 5 обрабатывали, как описано в примере 12, с применением трех различных фосфатных буферов 1 (без лидокаина), 2 (0,2% лидокаин) и 3 (0,3% лидокаин). Готовили гели с концентрацией 32 мг/мл и измеряли модули упругости G′ и профили деградации ΔG′/Δt каждого по способу, описанному в примере 12. На фигуре 7 показано, что композиции с лидокаином обладают существенно более высоким модулем упругости за время испытаний. Таким образом, сшитая ГК с лидокаином может обладать высокой биостабильностью и в некоторых случаях обладать синергетическим эффектом с увеличением G′.
Пример 22: Изобретение эффективно для наращивания тканей.
Продукт сшивания ГК, примененный в данном исследовании, готовили по способу, описанному в примере 14. В исследовании внутрикожных (интердермальных) инъекций на морской свинке в качестве модели сшитый продукт ГК и контрольное вещество (Зидерм™II, Collagen, Palo Alto Ca) вводили внутрикожно (интрадермально). У каждого участка инъекции (6 на интервал времени на образец) замеряли высоту и диаметр через 2, 4, 8 и 12 недель. Образцы отбирали и культивировали в искусственной среде для гистологической оценки для каждого интервала времени.
Исследование включало двенадцать морских свинок, распределенных по две на каждый интервал времени опыта из 2, 4, 8, 12, 18 и 24 недель.
С правого и левого боков животных состригали шерсть не менее чем за час до введения дозы. Каждое животное получало шесть интрадермальных инъекций по три на бок. Тестируемое вещество и контрольное вещество распределяли случайным образом по каждому животному. Оба вещества дозировали по 0,2 см3 на участок. Каждый участок маркировали нетоксичным маркером, участки инъекций были на расстоянии приблизительно 2 см друг от друга. К тому же высоту и диаметр каждого участка измеряли через каждый интервал времени. Измерениям сразу после инъекции приписывали балл (степень) «0». Увеличение в высоту и в диаметре указывает на эдему (отек).
На каждом интервале завершения опыта умерщвляли трех животных, состригали мех, измеряли участок инъекции, удаляли участок и фиксировали его в 10%-ном нейтральном забуференном формалине. Иссеченные ткани заплавляли в блоки, делали срезы и окрашивали гематоксилином и эозином (Г&Э) и подвергали исследованию квалифицированным патологом. Образцы исследовали на присутствие введенных веществ и любую тканевую реакцию.
В течение первой недели опытов баллы (степень) эритемы были минимальными (слабая) и одинаково распределялись между участками инъекций с тестируемым веществом и Зидермом™II. Баллы (степень) эдемы были нерегулярны и одинаково распределены между двумя веществами. В течение второй недели баллы (степень) эритемы были сходными с первой неделей. Баллы (степень) эдемы были уменьшены, падая до нуля. Замеры участков инъекций на 4-й неделе были равны замерам, полученным сразу после инъекций.
Объем СТА (прироста тканей) не изменялся от 2 недель до 4 недель. На 8-й неделе наблюдения почти все участки с тестируемым веществом сохраняли размеры по высоте и диаметру. Напротив, почти все контрольные участки были не измеряемы. На 12-й неделе наблюдения участки с тестируемым веществом уплощались и раздавались в ширину. Однако в областях дермы с большей плотностью ткани тестируемое вещество не распространялось в такой степени, как в областях с меньшей. Фибробласты и жировая ткань пронизывали тестируемое вещество приблизительно с такой же плотностью, как ткани по соседству с местом инъекции. Контрольное вещество не идентифицировалось ни на одном из участков инъекции.
Микроскопическое исследование не показало никакого клеточного ответа на тестируемое вещество и только очень небольшой инфильтрат макрофагов в случае контрольного вещества на 2 неделе и на 4-й неделе. На 8-й и 12-й неделях не наблюдались клеточные ответы ни на один материал.
На 2, 4, 8 и 12 неделях участки с тестируемым веществом были лишены какого-либо тканевого ответа, подтверждая биосовместимость этого препарата. После инъекции тестируемое вещество, по-видимому, интегрируется в стромальные элементы дермы.
Размеры в высоту и по диаметру не изменялись между 2 и 4 неделями. По всей видимости, на 8 неделе СТА распространялся латерально (в стороны) в дермальных слоях, но по-прежнему удерживал свой объем. Напротив, контрольное вещество появляется в виде гомогенного шарика из материала, давящего на подлежащую дерму. Небольшой инфильтрат с макрофагами наблюдают для контрольного вещества на 4 неделе; на 8 неделе большая часть инъекции рассасывается с места инъекции.
Устойчивость тестируемого вещества in vivo на 8 и 12 неделях по сравнению с контрольным веществом указывает, что этот продукт может проявлять долгую жизнь в клинических приложениях. Эти результаты поддерживают данные in vitro, описанные выше, демонстрируя устойчивость к распаду под действием гиалуронидазы in vivo.
Хотя изобретение, в частности, показано и описано выше со ссылкой на избранные осуществления, любому опытному в данной области специалисту будет понятно, что различные изменения в форме и деталях могут быть здесь проделаны без выхода за рамки и область приложения изобретения, очерченные в приложенных пунктах формулы.
Реферат
Изобретение относится к области медицины. Предложена композиция с гиалуроновой кислотой (ГК), которая включает частицы геля сшитой нерастворимой в воде гидратированной ГК. ГК включает сшивки, представленные следующей структурной формулой: ГК′-U-R2-U-ГК′, где каждая группа ГК′ означает ту же самую или другую молекулу сшитой ГК′; каждая U независимо означает необязательно замещенную О-ацилизомочевину или N-ацилмочевину; и R2 представляет собой необязательно замещенный алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероциклический радикал, циклоалифатический алкил, аралкил, гетероаралкил или гетероциклолалкил. Также предложен способ наращивания тканей у субъекта, включающий введение субъекту иглы по месту, где наращивание тканей необходимо, причем игла соединена со шприцем, заполненным композицией с ГК, и приложение к шприцу силы для доставки композиции с ГК субъекту. Способ получения композиции с ГК включает образование нерастворимых в воде дегидратированных частиц сшитой ГК, разделение нерастворимых в воде дегидратированных частиц по среднему диаметру, отбор подмножества частиц по среднему диаметру и гидратирование подмножества дегидратированных частиц с помощью физиологически совместимого водного раствора. Другой метод получения композиции со сшитой ГК включает сшивание предшественника сшитой ГК с помощью бискарбодиимида в присутствии рН-буфера и дегидратирование сшитой ГК. Включен также способ наращивания тканей у субъекта, нуждающегося в наращивании тканей. Способ стабилизации сшитой ГК включает гидратирование нерастворимой в воде дегидратирова�
Формула
HA′-U-R2-U-HA′,
в которой
каждая группа НА′ означает ту же самую или другую молекулу сшитой НА′;
каждая U независимо означает необязательно замещенную O-ацилизомочевину или N-ацилмочевину; и
R2 представляет собой необязательно замещенный алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероциклический радикал, циклоалифатический алкил, аралкил, гетероаралкил или гетероциклолалкил, и
частицы имеют распределение среднего диаметра, выбранное из группы, состоящей из частиц НА, обладающих распределением по среднему диаметру, выбранному из группы, состоящей из гидратированных частиц со средним диаметром приблизительно между 20 и 1000 мкм и дегидратированных частиц со средним диаметром приблизительно между 10 и 500 мкм,
и указанная инъецируемая композиция пригодна для наращивания ткани у субъекта, нуждающегося в наращивании ткани, и/или для обеспечения эффективного введения и/или выделения лекарственных средств.
а) композиция имеет, по меньшей мере, один параметр, измеренный при 37°С и выбранный из модуля G′ при хранении, равный, по меньшей мере, приблизительно 50 Па, при измерении на частоте 1 Гц, используя образец с плоской геометрией и размером 4 см, и кинематическую вязкость, равную, по меньшей мере, приблизительно 20000 сПз, измеренную при скорости сдвига 1 с-1; и
b) композиция является достаточно стабильной к ферментативной деградации, так что при объединении композиции при 37°С с ферментом гиалуронидазой в количестве приблизительно 0,3 вес.% в условиях, подходящих для взаимодействия с гиалуронидазой, величина G′ композиции, измеренная через 16 часов взаимодействия, составляет, по меньшей мере, приблизительно 5% от величины G′, измеренной, по меньшей мере, приблизительно через 15 мин взаимодействия.
а) введение иглы субъекту в том месте, где необходимо наращивание ткани у субъекта, причем игла соединена со шприцем, заполненным композицией сшитой НА, которая включает частицы геля сшитой, нерастворимой в воде, гидратированных гелевых частиц НА, где НА включает связки, представленные следующей структурной формулой:
HA′-U-R2-U-HA′,
в которой
каждая НА′ является той же самой или другой молекулой сшитой НА;
каждая U независимо означает необязательно замещенную O-ацилизомочевину или N-ацилмочевину; и
R2 означает необязательно замещенный алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероциклический радикал, циклоалифатический алкил, аралкил, гетероаралкил или гетероциклоалкил; и
частицы НА не растворимы в воде и имеют распределение среднего диаметра, выбранное из группы, состоящей из гидратированных частиц среднего диаметра приблизительно между 20 и 1000 мкм, и дегидратированных частиц среднего диаметра приблизительно между 10 и 500 мкм; и
b) приложение к шприцу такой силы, чтобы, по меньшей мере, часть композиции НА была введена субъекту.
a) формирование частиц нерастворимой в воде, дегидратированной, сшитой НА посредством:
i) сшивания предшественника сшитой НА с помощью бис-карбодиимида в присутствии буфера при значении рН приблизительно между 4 и 8, причем образующаяся сшитая НА включает сшивки, представленные следующей структурной формулой
HA′-U-R2-U-HA′,
в которой
каждая НА′ является той же самой или другой молекулой сшитой НА′;
каждая U независимо означает необязательно замещенную O-ацилизомочевину или N-ацилмочевину и
R2 означает необязательно замещенный алкил, алкенил, алкинил, алкокси, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероциклический радикал, циклоалифатический алкил, аралкил, гетероаралкил или гетероциклоалкил; и
ii) дегидратация сшитой НА с получением дегидратированной сшитой НА.
b) измельчение дегидратированной сшитой НА с образованием частиц нерастворимой в воде, сшитой НА;
c) разделение нерастворимых в воде, дегидратированных частиц по среднему диаметру и выбор подмножества частиц по среднему диаметру; и
d) гидратация подмножества дегидратированных частиц с помощью физиологически совместимого водного раствора с целью получения композиции НА.
KH2PO4; N-трис(гидроксиметил)-2-аминоэтансульфоновой кислоты; триэтаноламина; диэтилбарбитурата; трис(гидроксиметил)аминоэтана; N-трис(гидрокси)метилглицина и N,N-бис(2-гидроксиэтил)глицина.

Комментарии