Противовоспалительная фармацевтическая композиция на основе бактериальных штаммов - RU2616899C1
Код документа: RU2616899C1
Чертежи



Описание
Область техники, к которой относится изобретение
Изобретение относится к фармакологии и медицине, в частности может быть использовано как основа лекарственного средства для лечения и профилактики воспалительных и аутоиммунных заболеваний кишечника, в том числе неспецифического язвенного колита.
Уровень техники
Воспалительные заболевания кишечника (ВЗК, англ. IBD) представляют собой хронический воспалительный процесс, захватывающий весь кишечник или часть желудочно-кишечного тракта (ЖКТ). Проявляются заболевания болям в животе и диарее, иногда могут возникать внекишечные симптомы: воспаление суставов, кожные высыпания, поражения глаз воспалительного характера; являются фактором риска для развития злокачественных образований, в том числе рака толстого кишечника. ВЗК поражено более 1 миллиона человек в США и 2,5-3 миллиона в Европе. Основными воспалительными заболеваниями кишечника являются неспецифический язвенный колит (НЯК) и болезнь Крона. НЯК - воспалительное заболевание толстой кишки, поражающее, как правило, слизистую оболочку прямой и других отделов толстой кишки (рис. 1). Болезнь Крона характеризуется трансмуральным воспалением, то есть затрагиваются все слои пищеварительной трубки; может поражать все отделы ЖКТ, начиная от полости рта и заканчивая прямой кишкой, с преимущественным поражением терминального отрезка подвздошной кишки и илеоколитом. Причины данных патологий до сих пор точно не известны, хотя предполагается участие генетических факторов, инфекционных агентов и иммунной системы; не исключена аутоиммунная природа заболеваний. Возможный механизм нарушений - наличие какого-то специфического антигена в просвете кишки/крови больных, приводящего к активации Т-лимфоцитов, клеточных макрофагов, фибробластов, к выработке антител, цитокинов, простагландинов, свободного атомарного кислорода, которые и вызывают различные тканевые повреждения. У пациентов обнаруживают патологически высокое число Т-лимфоцитов, антитела к кишечной палочке, белку коровьего молока, липополисахаридам, нарушение баланса между про- и противовоспалительными цитокинами в сторону повышения концентрации провоспалительных цитокинов IL-1, IL-6, IL-8, TNF-α. на фоне снижения IL-10. Кроме того, характерно нарушение равновесия между популяциями Th1- и Th2-лимфоцитов. Терапия ВЗК направлена на достижение ремиссии (клинической, эндоскопической, «излечение» слизистой оболочки) и увеличение ее продолжительности. Стандартное лечение включает использование противовоспалительных препаратов (мезаламина) и кортикостероидов, иммуномодуляторов (азатиоприна), а также моноклональных антител к цитокину ФНО-α (инфликсимаба). Нередко лечение оказывается неэффективным, кроме того, применяемые средства обладают рядом побочных эффектов [Khor В., Gardet А., Xavier R.J. Genetics and pathogenesis of inflammatory bowel disease. 2011. Nature. 474: 307-17].
Несмотря на то, что причины возникновения ВЗК различны, важнейшая роль в возникновении заболевания принадлежит кишечной микробиоте [Kostic A.D., Xavier R.J., Gevers D. The microbiome in inflammatory bowel disease: current status and the future ahead. 2014. Gastroenterology. 146(6):1489-99]. На моделях животных показана роль бактерий в возникновении и развитии ВЗК [Sellon R.K., Tonkonogy S., Schultz M. et al. 1998. Resident Enteric Bacteria Are Necessary for Development of Spontaneous Colitis and Immune System Activation in Interleukin-10-Deficient Mice. Inf, Immunity. 66: 5224-5231]. В исследованиях на людях продемонстрировано, что микробиота больных ВЗК значительно отличается от таковой у здоровых людей [Jeffery I.B., O'Toole P.W.,

Пробиотики - это живые микроорганизмы, оказывающие при естественном способе их введения (per os) в организм человека позитивное воздействие на физиологические, биохимические и иммунологические реакции через стабилизацию функции его микрофлоры [Цышкова О.Н. 2015. Современный пробиотик: новый взгляд на иммуномодуляцию. Практика педиатора. 32-37]. Пробиотики - это микроорганизмы, присутствующие в нормальной микрофлоре человека и способные к культивированию в лабораторных и промышленных условиях. Подавляющее большинство пробиотиков относится к лактобациллам и бифидобактериям, а также энтерококкам. Лактобациллы встречаются во многих отделах тела человека: в ротовой полости, в желудке, кишечнике, во влагалище, где они являются доминирующими микроорганизмами. Бифидобактерии являются одними из наиболее важных представителей микробиоты толстой кишки человека и других млекопитающих. Непатогенные энтерококки (Е. faecium) заселяют преимущественно тонкий кишечник [Turroni F, Ribbera A, Foroni Е, Douwe van Sinderen, Ventura M. 2008. Human gut micribiota and bifidobacteria: from composition to functionality. Antonie van Leeuwenhoek. 94:35-50; Walter J. Ecological role of Lactobacilli in the gastrointestinal tract: implications for fundamental and biomedical research. 2008. Appl. Env. Microbiol. 74:4985-4996]. Также бактерии, относящиеся к указанным родам (Lactobacillus, Bifidobacterium и Enterococcus), нередко выделяют из пищевых продуктов. В организме человека рассматриваемые пробиотические бактерии выполняют следующие функции [Quigley Е.М.М. 2011. Gut microbiota and the role of probiotics in therapy. Current Opinion in Pharmacology 11:593-603]:
- путем ассоциации со слизистой оболочкой кишечника осуществляют физиологическую защиту кишечного барьера от проникновения микробов и токсинов во внутреннюю среду организма;
- обладают высокой антагонистической активностью по отношению к патогенным и условно патогенным микроорганизмам (за счет выработки органических жирных кислот, бактериоцинов, перекиси водорода);
- участвуют в утилизации пищевых субстратов и активизации пристеночного пищеварения;
- синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: В1 - тиамин, В2 - рибофлавин, В3 - никотиновую кислоту, В9 - фолиевую кислоту, витамин В6 - пиридоксин;
- способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D.
- проявляют иммуномодулирующие свойства (как правило, увеличивают фагоцитоз и продукцию иммуноглобулина А, оказывают влияние на продукцию цитокинов и кластерную дифференцировку иммунокомпетентных клеток).
Следует подчеркнуть, что пробиотические свойства присущи не виду, а определенным штаммам. Разные штаммы одного и того же вида имеют различный набор пробиотических свойств. При изучении пробиотических бактерий было показано, что наряду с общими биологическими свойствами ряд штаммов обладает узкоспецифическими функциям, что позволило подойти к созданию пробиотических средств для таргетной терапии различных заболеваний с учетом ведущего звена их патогенеза [Borivart М., Strober W. 2007. The mechanism of action of probiotics. 2007. Curr. Opin Gastroenterol. 23(6): 679-692]. Например, пробиотики, обладающие иммуномодулирующими свойствами, могут как стимулировать, так и ингибировать иммунные реакции. Те из них, которые способны супрессировать иммунный ответ при иммунопатологических состояниях, в частности аутоиммунные реакции, являются кандидатами для поддержания ремиссии и предотвращения рецидивов НЯК в комплексной терапии наряду с уже существующими препаратами.
Пробиотики использовались и продолжают использоваться для профилактики и лечения ВЗК [Vergnolle N., Sallenave J.M., Langella P. Recombinant probiotic bacteria for the prevention and treatment of Inflammatory Bowel Disease (IBD) and Irritable Bowel Syndrome (IBS). 2013. US Patent US 20130344033 A1; Israelsen H. Treatment of IBD and IBS using both probiotic bacteria and fermented cereal as treatment effectors. 2014. US Patent US 8900570 B2; Dai C., Zheng C.-Q., Jiang L.-J. Probiotics and irritable bowel syndrome. 2013. Word J Gatroenterol. 19:5973-5380]. Результаты многолетних исследований суммированы в статье Ghouri с соавторами [Ghouri Y.A., Richards D.M., Rahimi E.F., Krill J.T., Jelinek K.A., DuPont A.W. Systematic review of randomized controlled trials of probiotics, prebiotics, and synbiotics in inflammatory bowel disease. 2014. Clin Exp Gastroenterol. 7:473-87]. Авторы делают вывод, что достаточного количества данных для доказательства участия исследованных пробиотиков в лечении болезни Крона нет, однако есть достоверные данные о положительном их влиянии на возникновение и поддержание ремиссии при лечении язвенного колита. Такими лекарственными препаратами являются VSL#3 (поликомпонентный пробиотик, состоит из смеси штаммов трех видов бифидобактерий, четырех - лактобацилл и одного вида стрептококков), E. coli Nissle 1917 и L. rhamnosus GG. Все штаммы этих пробиотических бактерий были выделены вне территории Российской Федерации, их свойства изучены недостаточно, а контроль за их присутствие в препаратах и продуктах невозможен, так как неизвестен их геном и какие-либо маркерные признаки, необходимые для идентификации чистых культур. Следовательно, можно полагать, что импортированные в РФ комплексные пробиотические препараты и продукты могут быть не такими эффективными, как ожидалось, так как они не полностью адаптированы к применению в российской популяции потребителей, а их эффекты, в частности, влияние на пищеварительную и иммунную системы, не предсказуемы.
Необходимость разработки новых отечественных препаратов продиктована современными тенденциями в изучении и использовании пробиотиков:
1. Использование местных пробиотических штаммов. Как было сказано выше, пробиотические свойства присущи определенным штаммам. При этом разные штаммы имеют различный набор пробиотических свойств. При использовании штаммов бактерий в качестве пробиотических средств важно учитывать происхождение штаммов. Состав кишечной микробиоты людей зависит от их образа жизни, характера питания, места проживания [Prideaux L., Kang S., Wagner J. et al. Impact of ethnicity, geography, and disease on the microbiota in health and inflammatory bowel disease. 2013. Inflamm Bowel Dis. 19(13):2906-18]. Поэтому важно, чтобы в качестве пробиотиков использовались штаммы микроорганизмов, выделенные из организма людей и пищевых продуктов именно в том географическом районе, где предполагается использовать лекарственное средство.
2. Использование пробиотиков с установленной последовательностью генома. Видовая характеристика пробиотических штаммов не всегда строго документирована, а штаммовая характеристика практически отсутствует. Для точной идентификации штамма необходимо определение полной нуклеотидной последовательности и аннотация генома. Эти данные нужны также для подтверждения отсутствия у штаммов нежелательных генов (патогенности, мобильных генов антибиотикоустойчивости и т.д.), для доказательства наличия генов, отвечающих за пробиотические свойства, включая иммуномодулирующие, антимикробные и другие, а также для последующих регулярных проверок сохранности пробиотических генов и стабильности штамма.
3. Использование комплексных препаратов, состоящих из нескольких штаммов, приводит к расширению спектра действия, по сравнению с монокомпонентными пробиотиками. Несомненно, при этом должна учитываться совместимость микроорганизмов, составляющих комплексный препарат.
Все сказанное выше указывает на целесообразность создания всесторонне исследованного комплексного ФП - пробиотика с известной структурой генома всех микробных компонентов, выделенных из организма людей - жителей центрального региона России для профилактики и лечения ВЗК в России.
Раскрытие изобретения
Настоящее изобретение раскрывает фармацевтическую композицию, проявляющую специфическую противовоспалительную активность на модели экспериментального дисбиоза, состоящую из штаммов Bifidobacterium longum GT15, Lactobacillus rhamnosus K32, Enterococcus faecium L-3, характеризующуюся наличием следующих пробиотических генов: для L. rhamnosus K32 - генов пилей spaABC и сортазы strC1, обеспечивающих адгезию с клетками кишечного эпителия; для В. longum GT15 - генов иммуномодуляции и коммуникации, в том числе генов адгезии; генов, участвующие в синтезе экзополисахаридов, пилей; генов, определяющих антиканцирогенные свойства; генов гидролаз, участвующих в гидролизе олиго- и полисахаридов; для Е. faecium L-3 - генов 5-ти бактериоцинов - энтероцинов А, В, Х-α, Х-β и лактобина L3.
Композиция может быть использована в качестве лекарственного средства для лечения и профилактики воспалительных и аутоиммунных заболеваний кишечника, в том числе неспецифического язвенного колита.
Краткое описание чертежей
Фигура 1 - Механизмы развития неспецифического язвенного колита
[Fava F., Danese S. Intestinal microbiota in inflammatory bowel disease: friend of foe? World J Gastroenterol. 2011 Feb 7; 17(5):557-66].
Фигура 2 - Состав микробиоты крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (культуральное исследование).
Обозначения к рисунку: Ось ординат lg КОЕ/мг; Lb - Lactobacillus spp.; Bf - Bifidobacterium spp.; Pr - Proteus spp.; Rl - Klebsiella spp. Ent - Enterococcus spp.
Фигура 3 - Разнообразие микробиоты кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками по родовому составу бактерий (метод мультилокусного секвенирования гена 16S рРНК).
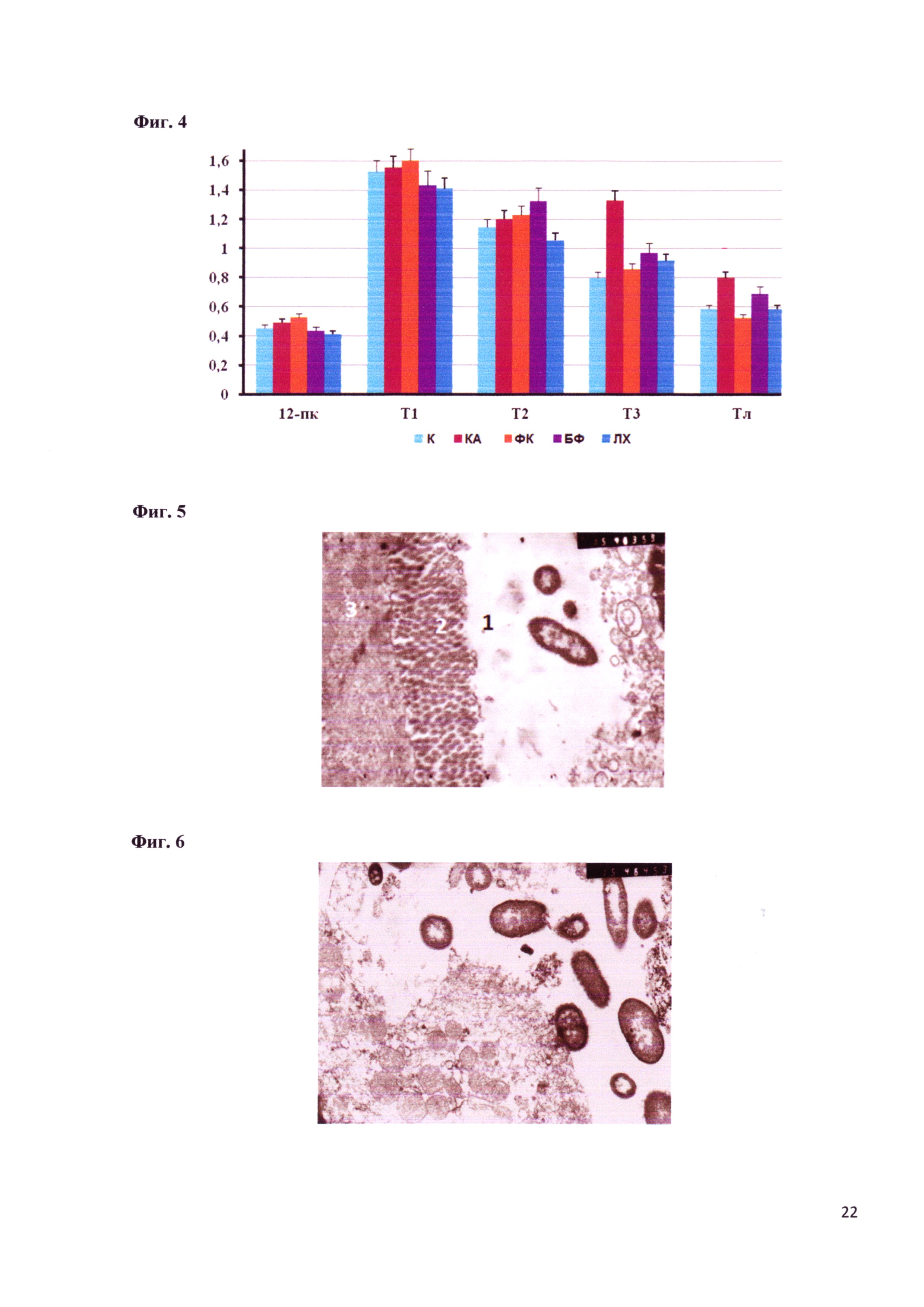
Фигура 4 - Масса слизистой оболочки кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (граммы).
Обозначения: Т1 - участок кишки от 12 перегной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
Фигура 5 - Ультратонкий срез слизистой оболочки тонкой кишки крыс, получавших ФК после воздействия антимикробными препаратами.
Обозначения: 1 - слой слизи, отделяющий бактерии от поверхности эпителиальных клеток;
2 - микроворсинки; 3 - Тесные межклеточные контакты. Фотографии сделаны на электронном микроскопе JEM-100C, JEOL Ltd., Япония.
Фигура 6 - Ультратонкий срез слизистой оболочки тонкой кишки крыс, не получавших пробиотиков после воздействия антимикробными препаратами. Фотографии сделаны на электронном микроскопе JEM-100C, JEOL Ltd., Япония.
Фигура 7 - Активность щелочной фосфатазы в химусе кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/ участок).
Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
Фигура 8 - Активность щелочной фосфатазы в слизистой оболочке кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/участок). Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
Фигура 9 - Полная активность мальтазы в химусе кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/ участок). Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
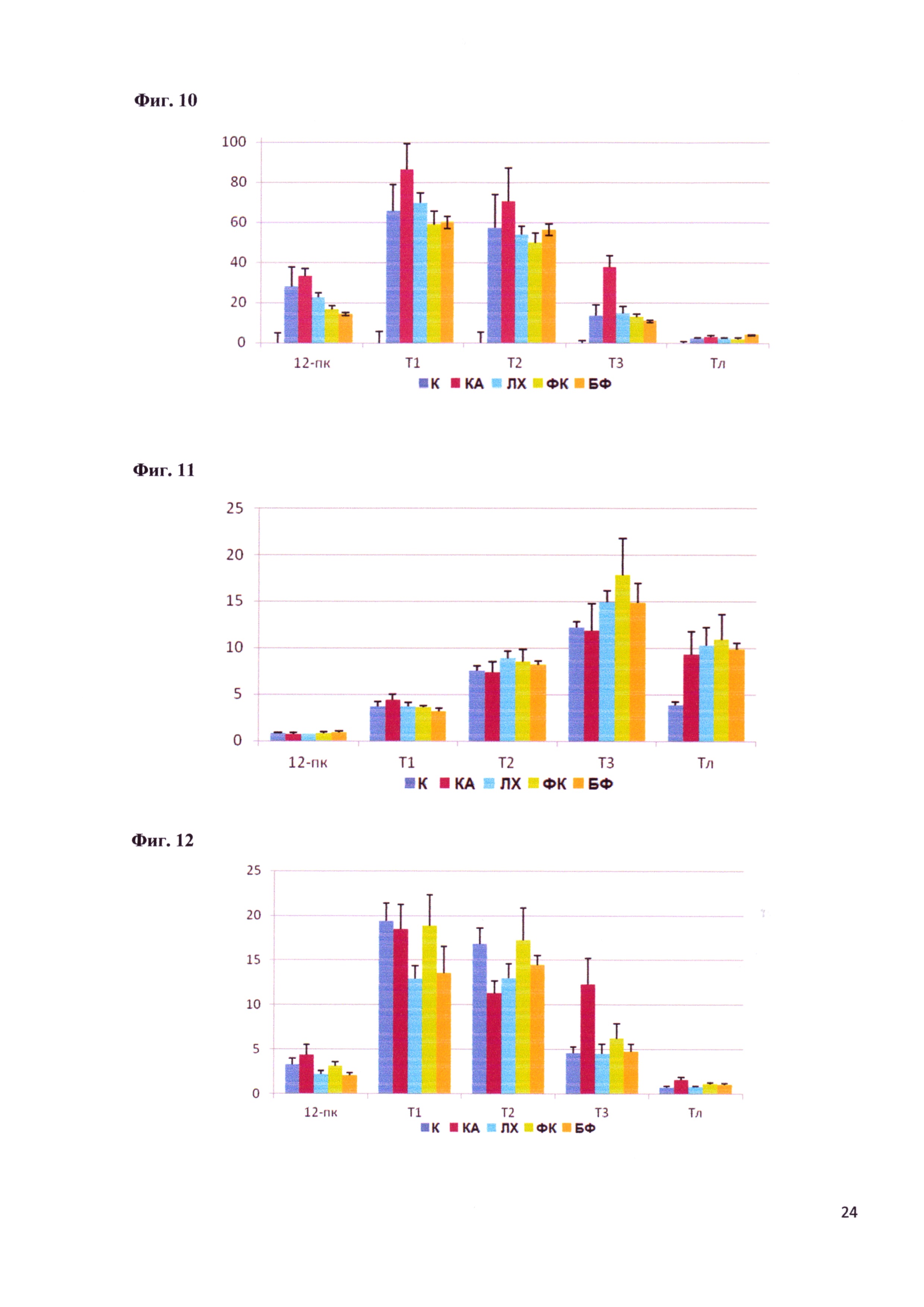
Фигура 10 - Полная активность мальтазы в слизистой оболочке кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/ участок). Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
Фигура 11 - Полная активность аланин аминопептидаза в химусе кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/участок).
Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
Фигура 12 - Полная активность аланин аминопептидаза в слизистой оболочке кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/участок).
Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
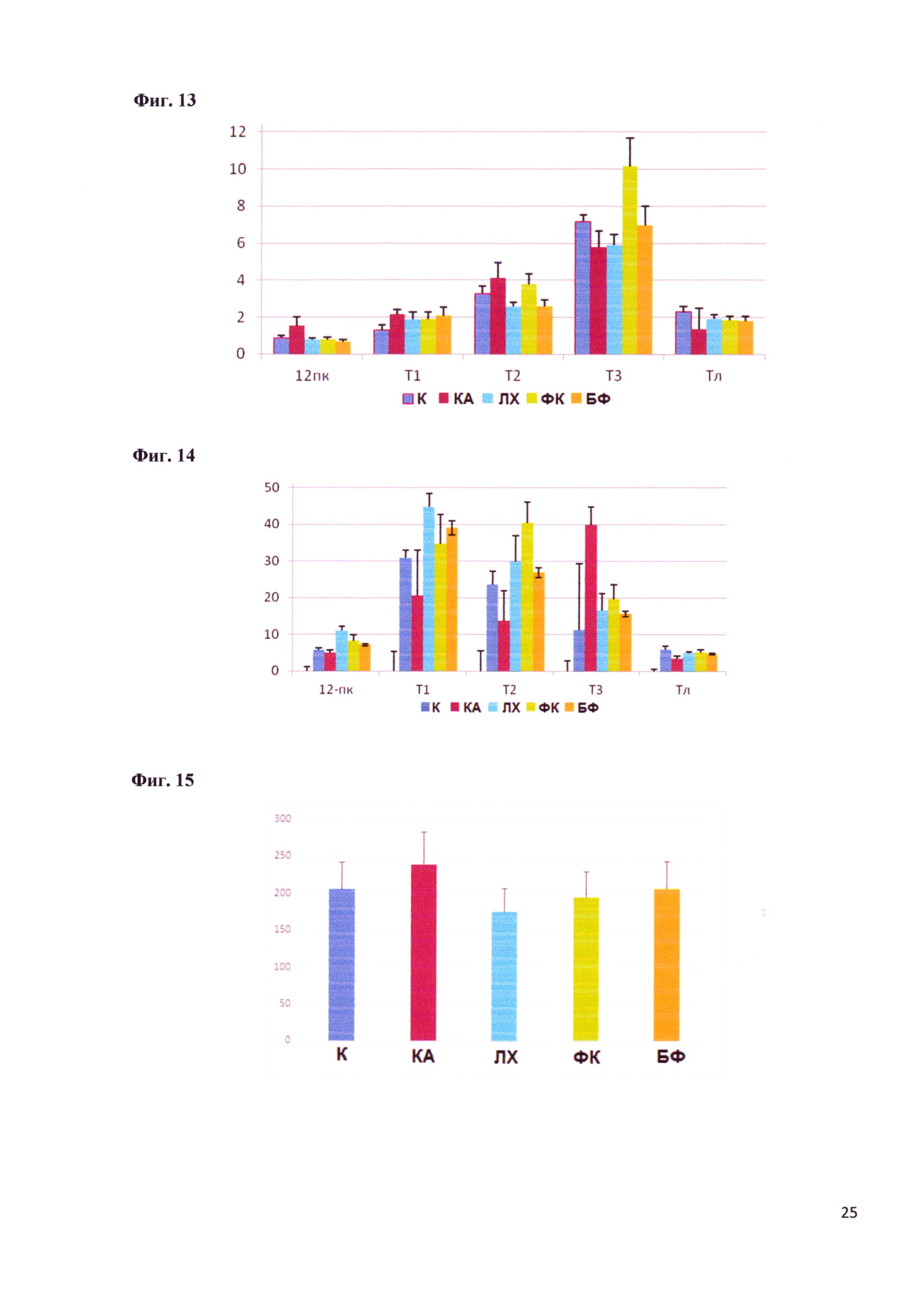
Фигура 13 - Полная активность глицил-L-лейцин дипептидазы в химусе кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/участок). Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
Фигура 14 - Полная активность глицил-L-лейцин дипептидазы в слизистой оболочке кишечника крыс после коррекции дисбиоза различными поликомпонентными пробиотиками (мкмоль/мин/участок). Обозначения: Т1 - участок кишки от 12 перстной кишки до тощей, Т2 - тощая кишка, Т3 - подвздошная кишка, ТЛ - толстая кишка (участок после слепой кишки).
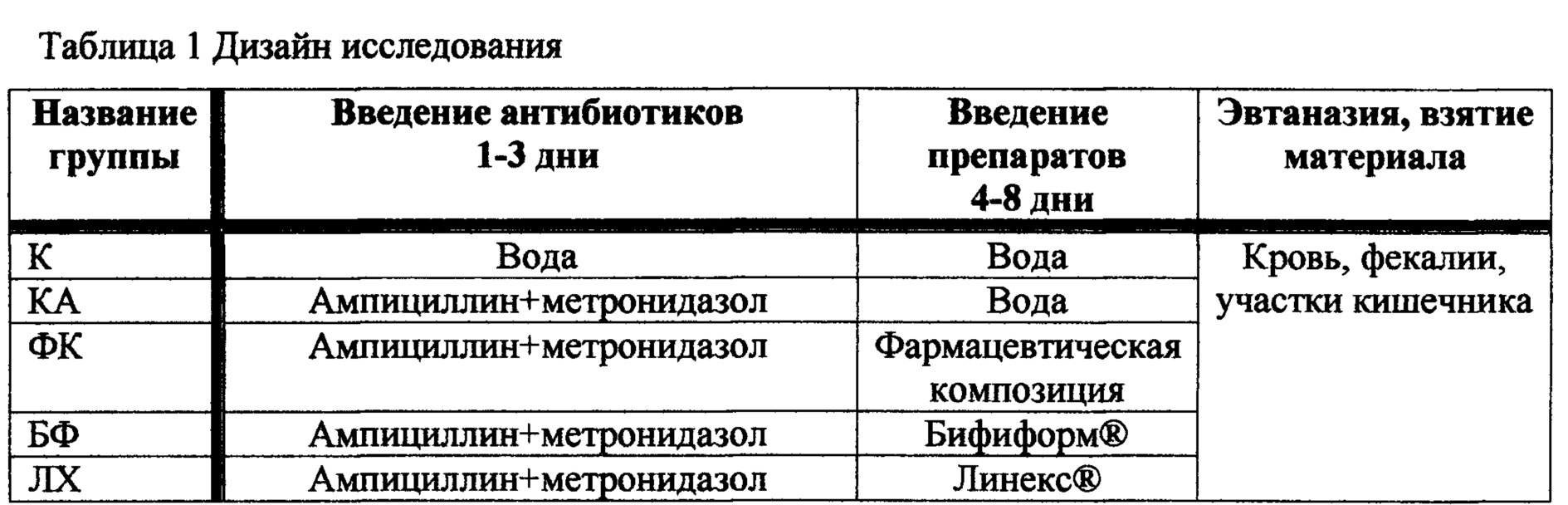
Фигура 15 - Содержание цитокина МСР-1 в сыворотке крови крыс после коррекции дисбиоза кишечника различными пробиотиками (пкм/мл).
Фигура 16 - Содержание цитокина TGF β в сыворотке крови крыс после коррекции дисбиоза кишечника различными пробиотиками (пкм/мл).
Фигура 17 - Содержание интерлейкина IL-10 в сыворотке крови крыс после коррекции дисбиоза кишечника различными пробиотиками (пкМ/мл).
Фигура 18 - Содержание интерлейкина IL-17 в сыворотке крови крыс после коррекции дисбиоза кишечника различными пробиотиками (пкм/мл).
Характеристика свойств и источников выделения штаммов-компонентов ФК
L. rhamnosus K32. Выделен из фекалий здоровой девушки 12 лет в 2007 г. (г. Тверь). Проявляет высокую антагонистическую активность по отношению к патогенным и условно-патогенным штаммам микроорганизмов (Staphylococcus aureus АТСС 25923, Pseudomonas aeruginosa АТСС 27853, Shigella sonnei I фазы 941, Bacillus subtillis 534, E. coli ATCC 25922, Klebsiella pneumoniae K1 5054), а также антимикотическую активность (Candida albicans АТСС 885-653). Депонирован в ВКПМ 21.07.2011, № В-11107.
В. longum subsp. longum GT15. Выделен из фекалий взрослого человека (г. Тверь) в 2010 г. Проявляет высокую и среднюю антагонистическую активность по отношению к перечисленным выше бактериальным культурам. Обладает иммуномодулирующей активностью (на модели лабораторных животных было выявлено статистически достоверное увеличение экспрессии IL-10 и уменьшение IL-8 после воздействия бифидобактерий). Депонирован в ВКПМ 08.06.2012, № АС-1928.
Е. faecium L-3. Выделен из молочнокислого продукта, использующегося в РФ. Штамм обладает выраженной антагонистической активностью в отношении: листерий (Listeria monocytogenes EGD), стрептококков (групп А, В, С, G), стафилококков (S. aureus АТСС 25923, S. aureus 209), патогенных энтерококков (E. faecalis АТСС 29212, энтеробактерий (Е. coli АТСС 25922, K. pneumoniae K1 5054, P. vulgaris AS2), псевдомонад (Pseudomonas aeruginosa АТСС 27853, P. aeruginosa AS1) микоплазм (Micoplasma hominis ATCC 15488), а также вирусов гриппа и простого герпеса. Также доказана антимикотическая активность штамма Е. faecium L-3 при использовании в качестве индикаторных культур С. albicans АТСС 885-653 и Cryptococcus neoformens Ei. В то же время доказан его бифидогенный эффект в системах in vitro и in vivo. Штамм отличается способностью синтезировать витамины группы В и фолиевую кислоту, а также бактериоцины. Штамм проявляет иммуномодулирующие свойства (на моделях лабораторных животных увеличивает экспрессию противовоспалительного и регуляторного IL-10 и уменьшает экспрессию провоспалительного IL-8). Штамм также обладает способностью стимулировать выработку слизи клетками слизистой оболочки кишечника, защищающей эпителий от патогенных микроорганизмов. Штамм Е. faecium L-3 депонирован в коллекции Института сельскохозяйственной микробиологии (ВНИИСХМ ВАСХНИЛ, г. Пушкин) и в международной коллекции Laboratorium voor Microbiologic - Universiteit Gent K.L. Ledeganckstraat 35 B-9000 Gent Belgium (Enterococcus faecium L-3 = LMG P-27496).
Выделенные штаммы ферментируют различные сахара и спирты без образования газа; фенотипически апатогенны, т.е. не обладают гемолитической, протеолитической, летициназной, гиалуронидазной, антилизоцимной, ДНК-ной и РНК-ной активностью.
Совместимость штаммов
Штаммы не подавляют роста друг друга.
Химическая структура компонентов фармацевтической композиции представлена известной нуклеотидной последовательностью геномов штаммов. Геномы были секвенированы с использованием технологий нового поколения (Roche 454). Последовательности геномов депонированы в GenBank и имеют следующие идентификационные номера: В. longum GT15 (PRJNA191592), L. rhamnosus K32 (PRJNA191611), Е. faecium L-3 (PRJNA190648). Анализ нуклеотидных последовательностей показал отсутствие генов патогенности и мобильных генов устойчивости к антибиотикам. Было также обнаружено наличие важных пробиотических генов: для L. rhamnosus K-32 - генов пилей spaABC и сортазы strC1, обеспечивающих адгезию с клетками кишечного эпителия; для В. longum GT15 - генов иммуномодуляции и коммуникации, в том числе генов адгезии; генов, участвующие в синтезе экзополисахаридов, пилей; генов, определяющих антиканцирогенные свойства; генов гидролаз, участвующих в гидролизе олиго- и полисахаридов; для Е. faecium L-3 - генов 5-ти бактериоцинов - энтероцинов А, В, Х-α, Х-β и лактобина.
Исследование устойчивости к низким pH
При обработке бактериальных культур - компонентов ФК - низкими значениями pH (рН=2) в течение 60 мин количество жизнеспособных клеток лактобацилл и энтерококков снижалось незначительно, тогда как количество жизнеспособных клеток бифидобактерий резко падало. Для повышения устойчивости бифидобактерий к кислой среде был использован оксид магния в концентрации 1%. После иммобилизации клеток бифидобактерий с оксидом магния устойчивость клеток к кислоте повышалась до уровня контроля (без кислоты). Выживаемость лактобацилл и энтерококков при этом не менялась. Чтобы компоненты ФК сохранялись при прохождении через агрессивно-кислую среду желудка, в состав ФК был введен оксид магния в концентрации 1%.
Биотехнология производства и хранения
Компоненты ФК были выращены в ферментерах, лиофилизированы, смешаны со вспомогательными веществами (магния стеарат, оксида магния и каолин) и стерильно расфасованы в капсулы. Жизнеспособность всех трех компонентов ФК сохранялась неизменной в течение года (108 КОЕ). Более длительное хранение ФК не тестировалось.
Исследование специфической активности
Исследование было проведено на модели экспериментального антибиотико-ассоциированного (ампициллин, метронидазол) дисбиоза кишечника крыс линии Вистар. Изучались изменения в микробиоте кишечника, морфофункциональные характеристики кишечника и состояние иммунитета у животных, получавших фармацевтическую композицию, по сравнению с контрольной группой и группами, получавшими препараты сравнения Бифиформ (Дания) и Линекс (Словения). Были отмечены: быстрая нормализация микробиоты (исчезновение признаков чрезмерного роста клебсиелл, протея, стафилококков и других условно-патогенных бактерий и грибов), увеличение содержания продуцирующих бутират Faecalibacterium prausnitzii; стимуляция синтеза противовоспалительных цитокинов IL-10 и TGFβ, тенденция к уменьшению синтеза провоспалительного цитокина МСР-1; увеличение фагоцитарной активности лейкоцитов; утолщение слоя слизи, отделяющего микробиоту кишечника от поверхности эпителия; увеличение выработки щелочной фосфатазы клетками слизистой оболочки тонкой кишки; быстрая компенсация после токсического действия антимикробных препаратов по биохимическим показателям сыворотки крови; восстановление активности пищеварительных ферментов слизистой оболочки кишечника и химуса. По полученным данным исследуемая фармацевтическая композиция не уступает препаратам сравнения Бифиформу и Линексу, а по ряду параметров даже превосходит их.
Исследование токсичности ФК
Определение острой токсичности было проведено при использовании различных доз на беспородных белых мышах (107-1010 КОЕ), крысах линии Вистар (108-1011 КОЕ) и кроликах породы 1 шиншилла (109-1012 КОЕ). Однократное внутрижелудочное введение ФК всем трем видам животных в максимальных использованных дозах не вызывало гибели животных и проявлений интоксикации. При внутрибрюшинном введении ЛД50 составила 1010 КОЕ для мышей (средний вес 20 гр) и 1011 КОЕ для крыс (средний вес 70 гр). Терапевтические дозы пробиотиков для людей при среднем весе 50 кг составляют 108-1010 КОЕ. Т.е. полученные на мышах и крысах ЛД50 при учете соотношения массы тела человека и грызунов превосходят терапевтические дозы на много порядков.
Исследование подострой токсичности ФК на мышах при внутрижелудочном введении не выявило значимых отклонений в динамике накопления массы тела. Высев фекалий не показал признаков дисбиоза в кишечнике мышей. Исследование хронической токсичности на двух видах животных (кроликах и крысах) при внутрижелудочном введении не выявило значимых отклонений в динамике накопления массы тела, потреблении корма и воды, гематологических и биохимических показателей, морфологии внутренних органов животных, не приводило к повышению температуры тела.
Полученные результаты позволяют отнести ФК на основе пробиотических бактерий (энтерококков, лактобацилл и бифидобактерий) с установленной последовательностью генома при использовании в терапевтических дозах к нетоксичным лекарственным веществам.
Исследование специфических видов токсичности
При изучении иммунотоксичности полученные результаты позволяют сделать вывод о том, что в диапазоне исследованных доз (107 и 108 КОЕ/мышь) ФК не оказывала иммунотоксического действия, а проявляла умеренные иммуностимулирующие (фагоцитоз) и супрессирующие (реакция гиперчувствительности замедленного типа) действия и не отменяла антителообразование, инициированное белковым антигеном.
При изучении мутагенности выявлено, что ФК как в дозе 1010 КОЕ при пероральном введении и 24 ч экспозиции, так и при пятикратном введении в дозе 108 КОЕ, не вызывала статистически достоверного увеличения количества клеток с хромосомными аберрациями в костном мозге мышей линии СВА. Следовательно, ФК не обладает мутагенной активностью в отношении соматических клеток теплокровных животных.
При исследовании терратогенности ФК на крысах линии Вистар (препараты вводили беременным самкам внутрижелудочно) анализ эмбрио/фетолетального действия ФК не выявил превышения уровней до - и постимплантационной гибели плодов, и суммарного эмбрио(фето)летального эффекта, при сравнении с показателями в контроле. Также ни в одной из подопытных групп не были выявлены плоды с макропатологией.
Исследование фармакокинетики ФК
В исследовании использовались крысы линии Вистар. ФК вводили внутрижелудочно в течение 5 дней в дозе 1*108 КОЕ. Наличие компонентов ФК тестировали в фекалиях животных высевом на чашки, а также выделением ДНК и ее анализом реакцией ПЦР в реальном времени. Все компоненты ФК были обнаружены в фекалиях крыс со второго дня и спустя 1 день после окончания введения ФК. Пробиотические бактерии, вводимые в составе ФК здоровым животным (а также людям), как правило, сохраняются в желудочно-кишечном тракте стабильно только во время введения препарата, а затем элиминируют в различные сроки. Следовательно, бактерии исследуемого ФК сохраняются в желудочно-кишечном тракте крыс в процессе введения ФК.
Пример 1
Секвенирование последовательности ДНК геномов
Проведено полногеномное секвенирование ДНК штаммов Bifidobacterium longum GT15, Lactobacillus rhamnosus К32, Enterococcus faecium L3 на секвенаторе GS Junior («Roche»). Результаты проведенного биоинформатического анализа показали:
Bifidobacterium longum GT15:
Размер генома - 2,337,521 пн; G + C состав - 60%;
Количество генов - 1,893 (кодирующих белки);
Количество rRNA оперонов - 5;
Количество tRNAs - 56.
Установлено наличие пробиотических генов/белков, в том числе:
а) важные бактериальные ферменты: (3-глюкозидаза (BLGT_06805 и BLGT_03815), и β-глюкуронидаза (BLGT_03575), данные ферменты участвуют в расщеплении сложных полисахаридов и ксенобиотиков;
б) обуславливающих адгезионные способности микроорганизма: адгезии (BLGT_05875), большие экзопротеины, участвующие в адгезии (BLGT_01370, BLGT_03935), внеклеточный «solute-binding» протеин (BLGT_09945), и трансальдолаза (BLGT_05575);
в) вовлеченные в формирование пилей «flp» (BLGT_00945);
г) вовлеченные в иммуномодуляцию и обуславливающие взаимодействие с клетками-хозяина: гликопротеин-связывающие фимбрии FimA (BLGT 00130) и FimB (BLGT 00135), карбоксипептидаза (BLGT 01045), и 19 гликозил трансфераз;
д) гены модуляция иммунной системы - серпин (BLGT_07170);
е) гены, участвующие в синтезе и транспортировке бактериоцинов - эписидин 280 (BLGT_07605).
Проведено депонирование геномного сиквенса в NCBI:
GenBank accession no. СР006741;
BioProject: PRJNA191592;
Organism name/label: Bifidobacterium longum subsp. longum GT15
Title: Bifidobacterium longum subsp. longum GT15, complete genome
Locus_tag prefix: BLGT
Lactobacillus rhamnosus К32
Размер генома - 3,016,919 пн; G + C состав - 46,7%;
Количество генов - 2,637 (кодирующих белки);
Количество rRNA - 14 (5S, 16S, 23S); Количество tRNAs - 57.
Установлено наличие пробиотических генов, в том числе:
а) обусловливающих устойчивость к стрессорным воздействиям и антигенную активность штамма (dltD - d-аланилирование JITA; rfbX - белок-экспортер полисахарида, о-антигена и тейхоевых кислот; yceI yttB oxlT mdr - пермеазы главного суперсемейства MFS1; ухеА - транспортер антимикробных белков);
б) обусловливающих гидролазную активность (mleP - малат пермеаза; galK, gale, galT, galR, galM - цикл Лелуара; lacC, lacD, lacB, lacA, lacR, lacE, lacT, lacF, lacG - тагатоза-6-фосфатный путь утилизации лактозы; malE, malF, malG, malK - утилизация мальтозы; rbsR, rbsD, rbsA, rbsC, rbsB, rbsK - утилизация рибозы);
в) обусловливающие взаимодействие микроорганизма с эпителиальными клетками человека (luxS - активированный метальный цикл; srtC1 - сортаза; spaABC и spaDEF специфические белки пилей, вовлеченные в процесс адгезии; mabA - модуляция адгезии и образования биопленок; wzb - адгезия и биосинтез полисахарида).
Проведено депонирование геномного сиквенса в NCBI:
Whole genome shotgun (WGS): accession JNNV00000000 (версия проекта 01);
BioProject: PRJNA191611;
Organism name/label: Lactobacillus rhamnosus K32
Title: Lactobacillus rhamnosus K32, whole genome shotgun sequencing project
Locus_tag prefix: LRK
Enterococcus faecium L3
Размер генома - 2642214 пн; G + C состав - 38%;
Количество генов - 2,558
Количество rRNA оперонов - 4; Количество tRNAs - 54.
Установлено наличие пробиотических генов, в том числе:
а), отвечающие за продукцию антиоксиданта - липоевой кислоты (lipA, lipA2 - липоатсинтетаза; lipB, lipM - метилтрансфераза; lipL - липоилтрансфераза);
б) отвечающие за синтез и транспорт рибофлавина (витамин В2): ribU, pnuX, ribY, ribX - трансмембранные транспортеры рибофлавина; ribK, ribL - рибофлавинкиназы, dmrS - 6,7-диметил-8-рибитиллумазинсинтетаза;
в) обуславливающие синтез и метаболизм биотина (bioF, bioB, bioC, bioD, bioH, bioG, bioK, bioZ - гены, отвечающие за синтез биотина; bioY - транспортер биотина; bioR - регуляторный компонент биотинового оперона);
г) синтез пиридоксина (витамина В6): pdxB, serA, pdxA - фосфатдегидрогеназа; pdxF - фосфосеринаминотрансфераза; pdxJ, dxs - пиридоксинсинтетаза; pdxK, pdxU субстрат-специфичный транспортер;
д) кодирующие антимикробные пептиды: энтероцин A (entA), энтероцин В (entB), две субъединицы энтероцина X (entXλ, entXβ) а также ген, кодирующий lactobin - подобный бактериоцин;
е) кодирующие щелочную фосфатазу.
Проведено депонирование геномного сиквенса в NCBI:
NCBI Reference Sequence: NZ_JRGX00000000.1
BioProject ID: PRJNA224116
Organism name/label: Enterococcus faecium L-3
Title: Enterococcus faecium strain L-3, whole genome shotgun sequencing project
Пример 2
Исследование специфической активности
В исследовании использовались крысы линии Вистар, вес 200-240 г (возраст 8 недель). В качестве контролей использовали препараты: Бифиформ, производитель Дания,«Ферросан А/С» и Линекс, производитель Словения ЗАО «Сандоз». ФК вводили животным в концентрации в пересчете на lg КОЕ: ФК по 8 lg КОЕ, Бифиформ® 7-8 lg КОЕ, Линекс® 7 lg КОЕ (Бифиформ и Линекс по капсуле на крысу ежедневно). Было создано 5 групп крыс (в каждую группу входило 10 крыс). Все вводимые препараты вводили внутрижелудочно через зонд в объеме 0,5 мл. Дизайн исследования представлен в таблице 1. В работе использована разработанная нами ранее модель экспериментального дисбиоза [Ермоленко Е.И., Донец В.Н., Дмитриева Ю.В., Ильясов Ю.Ю., Суворова М.А., Громова Л.В. Влияние пробиотических энтерококков на функциональные характеристики кишечника крыс при дисбиозе, индуцированном антибиотиками // Вестн. С.-Петерб. унта. Сер. 11, Медицина. 2009. Вып. 1. С. 157-167.], вызванного внутрижелудочным введением крысам Вистар 75 мг/кг ампицилина (ОАО «Органика», Россия) и метронидазола 50 мг/кг (ОАО «Ирбитский Химико-Фармацевтический завод», Россия). Наличие дисбиоза подтверждалось на основании клинических симптомов и при помощи бактериологического и генетического исследований микробиоты кишечника животных.
1. Влияние фармацевтической композиции (ФК) на миробиоту кишечника крыс при экспериментальном дисбиозе
Микробиоту кишечника крыс при коррекции антибиотико-ассоциированного дисбиоза ФК, Линексом и Бифиформом исследовали при помощи культурального метода и метагеномного агнализа, которые взаимно дополняли друг друга.
1.1. Результаты культурального исследования
Микробиологогическое исследование проводили в соответствии с Методическими указаниями «Бактериологическая диагностика дисбактериоза кишечника», по методу, разработанному Р.В. Эпштейн-Литвак и Ф.Л. Вильшанской (1969) с модификациями и в соответствии с рекомендациями, описанными в руководстве Симаненко В.И. [Симаненков В.И. Клинические аспекты диагностики и лечения дисбиоза кишечника в общетерапевтической практике. Учебно-методическое пособие. - СПб., 2003. - 36 с.]. Результаты культурального исследования представлены на фигуре 2.
Выводы: В результате действия антибиотиков увеличивается количество Ecoli-, клебсиел, стафилококков, дрожжей Candida. У животных, получавших ФК, снижается количество Ecoli-, протея, клебсиел, дрожжей и практически полностью исчезают стафилококки. Таким образом, ФК оказывает заметное положительный эффект на состав микрофлоры фекалий крыс; этот эффект сравним, а по некоторым позициям и превосходит действие Бифиформа и Линекса.
1.2 Результат исследования при помощи мультилокусного секвенирования
Один из существующих методов метагеномного анализа - анализ на основе гена 16S рРНК, который позволяет анализировать состав микробиологического сообщества. В данном эксперименте основной задачей было сравнить влияние на микробиоту кишечника крыс путем мультилокусного секвенирования ФК и препаратов сравнения (Линекса и Бифиформа). На 9 день эксперимента были отобраны фекалии для секвенирования по участку гена 16S рРНК (регион V9-V10) на приборе GS Junior, Roche.
Для анализа брались только те виды бактерий, процентное содержание которых в опытных экспериментах заметно отличалось от контрольных групп. Бактерии, содержание которых в микробиоте было менее 10%, не бралось для анализа данных (для лучшей наглядности результатов). Для укоренения результатов и отличия от контрольных групп использовалась группа крыс «Старт» - микробиота крыс до начала исследования и группа крыс «А/б» - состав микробиоты крыс после приема антибиотиков в течении 3-х дней. Высчитывалось значение среднего процентного содержания бактерий в метагеноме крыс на каждую группу (по результатам секвенирования ДНК из фекалий 10-ти крыс на каждую группу). Результаты представлены на фигуре 3.
После введения антимикробных препаратов в фекальной микробиоте увеличивается количество превотелл и уменьшается - фекалибактерий. Введение крысам ФК увеличивает количество всех трех исследуемых родов бактерий - особенно значительно - фекалибактерий. Это особенно важно, т.к. характерным признаком изменения микробиоты кишечника при ВЗК является снижение количественного содержания бактерий, продуцирующих бутират, в частности, F. prousnitzii. Увеличение количества превотелл и бактероидов также может рассматриваться как положительное действие ФК, т.к. эти бактерии являются непатогенными обычными компонентами микрофлоры кишечника.
2. Изменения морфологии слизистой кишечника при экспериментальном дисбиозе.
Изменения морфологии желудочно-кишечного тракта оценивали, используя гистологические методы и электронную микроскопию.
2.1. Осмотр брюшной полости при вскрытии
При осмотре брюшной полости макроскопические патологические изменения кишечника (вздутие, истончение стенок, увеличение числа Пейеровых бляшек) были выявлены только у животных, получавших антибиотики. Определение массы слизистой оболочки кишечника (после удаления химуса) показало ее увеличение (т.е. наличие воспалительного процесса) в подвздошной и толстой кишках животных, получавших антибиотики. Эти изменения совсем не проявлялись в группе животных, получавших ФК, и слабо проявлялись в группах ЛХ и БФ (фигура 4). Т.е. введение животным ФК снимает признаки воспаления.
2.2. Результаты гистологического исследования
В таблице 2 приведены результаты морфологического анализа слизистой оболочки кишечника, полученные при помощи гистологического исследования участков тонкой кишки крыс после воздействия различными пробиотиками.
Высота ворсин минимальна в группе животных, получавших ФК и Бифиформ, что может свидетельствовать о более выраженной регенерации эпителиального слоя. В этих же группах обнаружена тенденция к увеличению числа бокаловидных клеток, продуцирующих слизь. Для этих двух групп число межэпителиальных лимфоцитов больше, чем у животных, получавших Линекс, или из группы КА (без пробиотикотерапии). Эти данные свидетельствуют о том, что ФК способствовал компенсации местного воспаления. ФК действовал аналогично Бифиформу, но был эффективнее Линекса.

Также было проведено исследование ультратонких срезов слизистой оболочки тонкой кишки при помощи электронной микроскопии. В отличии от группы КА, в группах, получавших пробиотические средства, были не нарушены межклеточные контакты и микроворсинки. Специфической особенность действия ФК являлась способность стимулировать формирования слоя слизи, отделяющего бактерии от поверхности эпителиальных клеток (фигуры 5, 6).
3. Изменение активности пищеварительных ферментов и биохимических показателей сыворотки крови при экспериментальном дисбиозе
Влияние ФК и препаратов на метаболизм проводили, оценивая активность пищеварительных ферментов при помощи классических биохимических исследований химуса и экстракта слизистой оболочки различных участков кишки, а также анализируя биохимические показатели сыворотки крови животных из различных групп.
3.1. Исследования активности пищеварительных ферментов
Исследовали ряд ферментов, участвующих в заключительных стадиях гидролиза эфиров фосфорной кислоты (щелочная фосфатаза), углеводов (мальтаза) и белков (аминопептидаза М и глицил-L-лейциндипептидаза). Наиболее значимый для течения НЯК показатель - активность щелочной фосфатазы. Этот фермент, вырабатываемый как эукариотическими клетками, так и некоторыми бактериями, участвует в гидролизе и регуляции всасывания липидов, в защите кишечного барьера от проникновения люминальных бактерий, в детоксикации бактериальных токсинов, в частности липополисахаридов, являющихся обязательным компонентов клеточной стенки грамотрицательных бактерий. Следует подчеркнуть, что к числу этих бактерий относятся протей, клебсиеллы, ацинетобактеры и псевдомонады, наиболее часто вызывающие синдром чрезмерного роста в кишечнике, в том числе при НЯК. Высокая активность щелочной фосфатазы в проксимальных отделах кишечника является благоприятным признаком. Наличие щелочной фосфатазы в сыворотке крови может рассматриваться как маркер цитолиза гепатоцитов и нарушения эвакуаторных функций желчных протоков (другие виды патологии в данном эксперименте исключались). У Е. faecium L3 в геноме найдены гены, кодирующие щелочную фосфатазу и, путем транскрипционного анализа, мы доказали их экспрессию. Это важно, так как энтерококки расселяются, в отличии от бифидобактерий, и в проксимальных отделах желудочно-кишечного тракта. Результаты определения активности ключевых пищеварительных ферментов представлены на фигурах 7-14.
Антибиотики снижали активность щелочной фосфатазы (ЩФ) в химусе отделов Т1 и Т3 и в слизистой отделов 12-пк, T1, Т2. После введения пробиотиков, особенно ФК, повышалась активность ЩФ в слизистой оболочке кишечника от 12-перстной до подвздошной кишки (T1, Т2). Активность ЩФ в химусе была повышена в случае ЛС в подвздошной и толстой кишке, Линекса (в тощей, подвздошной и толстой кишке), Бифиформа (в толстой кишке).
Антибиотики увеличивали активность мальтазы в химусе отделов Т1-Т2 и ТЛ и в слизистой отделов 12-пк,-Т1-Т3; несколько снижали в химусе отдела Т3. ФК нормализовал активность мальтазы в химусе отделов Т1 и Т2 и в слизистой кишечника от 12-перстной до подвздошной кишки. ФК, Линекс и Бифиформ действовали практически идентично. Изменение активности аминопептидазы М при действии антибиотиков проявляются в толстой кишке для химуса, в тощей и подвздошной кишках для слизистой оболочки. Введение животным ФК нормализует активность фермента в слизистой оболочке, причем эффективнее, чем Линекс и Бифиформ.
Активность глицил-L-лейцин дипептидазы (ГЛ), цитозольного пищеварительного фермента, харктеризующего внутриклеточное пищеварение, при введении животным антибиотиков меняется в химусе практически во всех отделах кишечника и в слизистой всех отелов, кроме 12-перстной кишки. Введение животным ФК нормализует активность фермента в слизистой оболочке всех отделов и в химусе 12-перстной и толстой кишок.
3.2. Биохимические показатели сыворотки крови
Биохимические показатели сыворотки крови были определены при помощи полностью автоматического биохимического анализатора Aeroset Toshiba (США). Результаты исследования «печеночных ферментов» аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), гамма-грутамилтранспептидазы (ГГТП), общего билирубина, щелочной фосфатазы (ЩФ) и панкреатического фермента альфа-амилазы, косвенно свидетельствующие о состоянии гепатобиллиарной системы и функции поджелудочной железы и наличии воспаления, приведены в таблице 3.
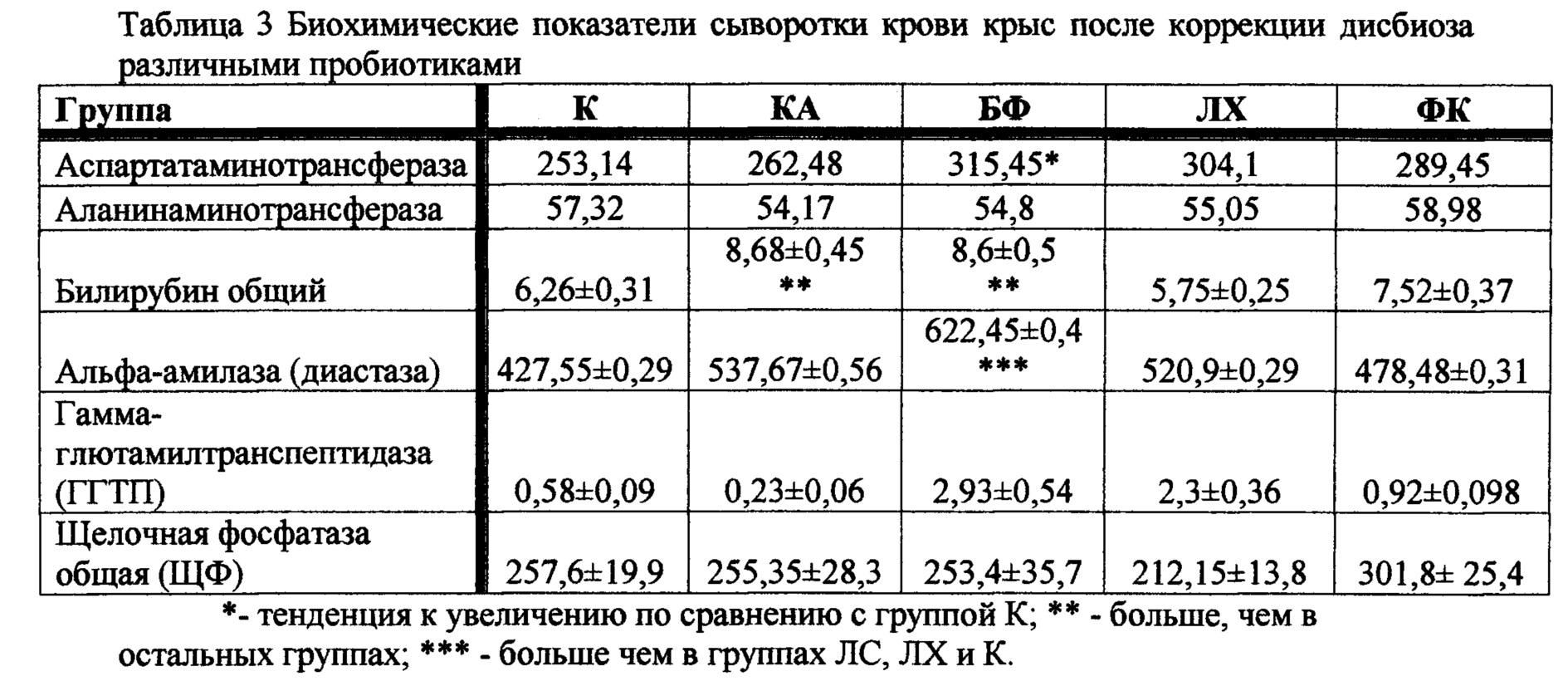
По следующим показателям группа ФК приближается к нормальным значениям в отличии от групп БФ, ЛХ и КА: общий билирубин, ACT и гамма-глютамил трансфераза. Следовательно, токсическое действие антимикробных препаратов компенсируется в большей степени под влиянием ФК.
4. Иммуномодулирующие эффекты ФК при коррекции экспериментального дисбиоза кишечника
4.1. Исследование содержание различных цитокинов в сыворотке крови крыс.
Содержание различных цитокинов в сыворотке крови крыс определяли при помощи ИФА, используя тест-системы (Bioscience, Bender MedSvstems, США).
Результаты исследования содержания цитокинов в сыворотке крови крыс после коррекции дисбиоза различными пробиотиками представлены на фигурах 15-18.
В контрольной группе без пробиотической коррекции кишечной патологии были отмечены увеличение провоспалительного цитокина МСР-1 и снижение концентрации IL-17 и TGF β. У животных, получавших ФК, выявлены статистически достоверное увеличение содержания в сыворотке крови IL-10, TGF β и IL-17; особенно значительным (в 2 раза) было увеличение активности противовоспалительного токсина IL-10. У животных, получавших Бифиформ и Линекс, количественные характеристики исследуемых цитокинов больше отличались от таковых у животных из контрольной группы (К).
4.2. Оценка фагоцитарной активности лейкоцитов периферической крови крыс после коррекции дисбиоза различными пробиотиками
Исследование показателей неспецифического иммунитета было проведено при помощи оценки фагоцитарной реакции по методу, описанному в справочнике «Медицинские технологии. Том 2» под редакцией А.И. Карпищенко, Санкт-Петербург, Интермедика, 2002, 600 с. (с. 212-213) с некоторыми модификациями.
Результаты исследования фагоцитарной активности представлены в таблице 4.
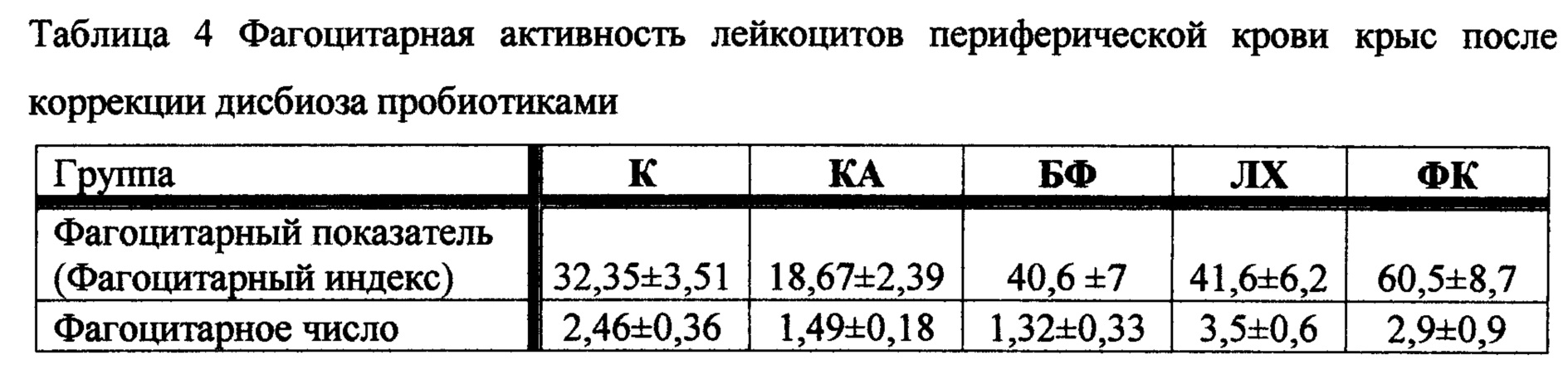
Отмечено резкое снижение фагоцитарной активности лейкоцитов периферической крови у животных, не получавших пробиотики после развития кишечной патологии. При введении ФК фагоцитоз усиливался в большей степени, чем в контрольныой группе животных и при введении препаратов сравнения.
Пример 5
Изучение фармакокинетики ФК
В исследовании использовано 60 крыс-самцов Вистар весом 180-220 г и 60 крыс-самок Вистар 220-240 г. ФК вводили внутрижелудочно при помощи специального зонда в течение 5 дней в дозе 1*108 КОЕ, ежедневно в 12 часов дня. Животные в период карантина и во время исследования не претерпевали никаких принципиальных изменений во внешнем виде, аппетите, характере поведения. Дизайн исследования представлен в таблице 5.

На 6-ой день животные были подвергнуты эвтаназии. Исследование проводили, высевая пробиотические бактерии, оценивая их культуральные свойства, а также морфологию и тинкториальные особенности, подсчитывая количество типичных колоний в пробе и в пересчете на 1 г исходного материала. Выявление введенных пробиотических культур было подтверждено методом ПЦР с использованием специфических праймеров (таблица 6) для штаммов L. rhamnosus К32, Е. faecium L-3, В. longum GT15 и последующей электрофоретической детекцией результатов в агарозном геле. Результаты приведены в таблице 7.


Опыт показывает, что на 6-й день эксперимента, через день после окончания введения ФК животным, все компоненты ФК обнаруживались в фекалиях крыс. Т.е. внутрижелудочное введение ФК позволяет его компонентам сохраняться в организме животных в течение 5 дней эксперимента и одного дня после него. Следует отметить различную восприимчивость животных к вводимому препарату.
Реферат
Изобретение относится к области медицины. Предложена фармацевтическая композиция, проявляющая специфическую противовоспалительную активность на модели экспериментального дисбиоза, состоящая из штаммов Bifidobacterium longum GT15, Lactobacillus rhamnosus K32, Enterococcus faecium L-3. Изобретение может быть использовано для лечения воспалительных заболеваний кишечника. 18 ил., 7 табл., 5 пр.

Комментарии