Способы лечения местных микробных инфекций - RU2675360C2
Код документа: RU2675360C2
Чертежи






















Описание
Область техники
Настоящее изобретение относится к способам лечения и предотвращения микробных инфекций кожи у субъекта, противомикробным фармацевтическим композициям для местного применения, применяемым в таких способах, и ветеринарным композициям, применяемым в таких способах.
Уровень техники
Частой причиной инфекционных заболеваний, как у человека, так и в ветеринарной практике, является инфицирование бактериями рода Staphylococcus. Стафилококки являются комменсалами здоровых млекопитающих и птиц и могут присутствовать на поверхности кожи и связанных с ней желез, в ноздрях, и транзиентно в желудочно-кишечном тракте, а также на поверхности слизистых оболочек верхних дыхательных путей и нижних мочеполовых путей. Хотя многие штаммы и виды стафилококков не вызывают инфекционные заболевания, некоторые штаммы и виды являются оппортунистическими патогенами. В медицинской и ветеринарной практике основное значение имеют два патогенных вида стафилококков Staphylococcus aureus (золотистый стафилококк) и Staphylococcus pseudintermedius. Staphylococcus aureus ассоциирован с кожными и послеоперационными раневыми инфекциями, тогда как Staphylococcus pseudintermedius обычно ассоциирован с гнойными кожными и послеоперационными раневыми инфекциями у собак и кошек. Staphylococcus pseudintermedius охарактеризован как основной патогенный вид ветеринарного значения группы Staphylococcus pseudintermedius (Staphylococcus pseudintermedius group, SIG), включающей штаммы Staphylococcus intermedius, Staphylococcus pseudintermedius и Staphylococcus delphini.
Лечение бактериальных инфекций антибиотиками
Лечение бактериальных инфекций, вызванных стафилококком, может быть затруднено, в частности, в случае заражения субъекта штаммами, устойчивыми к антибиотикам. Бактериальную инфекцию, вызванную стафилококком, как правило, лечат введением β-лактамных противомикробных препаратов, относящихся к классу противомикробных препаратов, мишенью которых являются пенициллин-связывающие белки (ПСБ), участвующие в биосинтезе клеточной стенки бактерий. Такие противомикробные препараты обладают бактерицидной активность и действуют путем ингибирования биосинтеза клеточной стенки бактерий, что приводит к увеличению внутреннего осмотического давления, в результате чего происходит лизис бактерий. Однако, применение, чрезмерное применение и неправильное применение противомикробных препаратов в лечении бактериальных инфекций привело к появлению бактерий, устойчивых к противомикробным препаратам, в особенности это характерно для бактерий рода Staphylococcus. Механизмы устойчивости у некоторых видов стафилококков включают секрецию ферментов β-лактамаз, способных гидролизовать β-лактамное кольцо β-лактамных противомикробных препаратов. Для преодоления этой формы устойчивости, как правило, совместно с β-лактамными противомикробными агентами вводят ингибиторы β-лактамазы, например, клавулановую кислоту, или применяют синтетические аналоги пенициллина, такие как метициллин, которые не являются субстратами β-лактамазы.
В последнее время даже комбинированное лечение стало неэффективным против устойчивых к антибиотикам штаммов Staphylococcus. Появление метициллин-устойчивых изолятов золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) в существенной степени препятствовало применению метициллина и других β-лактамным противомикробных препаратов, которые не инактивируются β-лактамазой. Устойчивые к метициллину изоляты, как было показано, содержат ген устойчивости mecA, кодирующий мутантную форму пенициллин-связывающих белков, или ПСБ, и обуславливает устойчивость к пенициллину, а также его аналогам, и другим β-лактамным противомикробным агентам, в том числе большинству цефалоспоринов и карбапенемов. Проблема MRSA часто встречается в больницах, где бактериальные изоляты MRSA передаются пациентам, например, «больничные» MRSA (hospital-acquired MRSA, НА-MRSA), которые часто сохраняются в больницах за счет заражения оборудования и персонала. К сожалению, пациенты с ослабленным иммунитетом, имеющие раны или другие травмы, предрасположены к беспрепятственному заражению MRSA, а также инфицированию другими видами стафилококков. В связи с этим многие больничные учреждения были вынуждены реализовывать меры против MRSA для снижения заболеваемостью HA-MRSA инфекциями. Более поздней проблемой стало появление штаммов MRSA за пределами больниц, называемых «бытовыми» изолятами MRSA (community-acquired, CA-MRSA). Эти штаммы зачастую даже более опасны, чем штаммы HA-MRSA, и они могут вызвать некротический фасциит.
В дополнение к MRSA, устойчивость к метициллину также наблюдается у других видов стафилококков. Например, известно, что многие штаммы непатогенных коагулазонегативных видов стафилококка (MR-CNS) и Staphylococcus pseudintennedius (MRSP) являются метициллин-устойчивыми. К другим устойчивым видам относятся грамотрицательные MDR Pseudomonas aeruginosa и MDR Escherichia coli и виды Enterobacter, а также грамположительные устойчивые к ванкомицину Enterococci (VRE) и устойчивые виды Streptococcus.
Появление устойчивости к антибиотикам усиливает потребность в альтернативных соединениях, способных ингибировать штаммы бактерий с множественной устойчивостью, такие как MRSA и MRSP.
Полиэфирные ионофоры
Карбоксильные полиэфиры, также известные как полиэфирные антибиотики или полиэфирные ионофоры, образуют электрически нейтральные комплексы с одновалентными или двухвалентными катионами, катализируя электрически неактивный обмен катионов или протонов в различных биологических мембранах. Было показано, что эти соединения в высокой степени перспективны для борьбы с устойчивыми к лекарственным средствам инфекциями, вызванными бактериями и простейшими, однако их применение строго ограничено их высокой токсичностью. Механизм действия этих молекул связан с тем, что они делают клеточные или внутриклеточные мембраны проницаемыми для катионов, которые в норме асимметрично распределены по биологическим мембранам, тем самым, образуя резкие концентрационные градиенты. Примеры простых ионофоров включают лазалоцид, монензин, наразин, салиномицин, семдурамицин, мадурамицин и лаидломицин.
Однако, острая токсичность этих соединений, связанная с их лизирующей активностью в отношении эритроцитов и сердечной токсичностью, эффективно предотвратила их применение in vivo. Основным препятствием для применения полиэфирных ионофоров в качестве лекарственных средств для контроля заболеваний человека является их токсичность. Например, как сообщают Naujokat и Steinhart (Naujokat and Steinhart, 2012, J Biomed Biotechnol 950658), значительная токсичность салиномицина была обнаружена в отношении человека. Так, в результате случайного вдыхания и проглатывания примерно 1 мг/кг салиномицина у 35-летнего мужчины наблюдался тяжелый острый и хронический токсический эффект, сильная тошнота, а также светобоязнь, слабость ног, тахикардия и повышение артериального давления и хроническое повышение уровня креатинкиназы (день 2 - день 35), миоглобинурия, слабость конечностей, боли в мышцах и слабый рабдомиолиза. Европейским ведомством по безопасности пищевых продуктов в последнее время были опубликованы данные по оценке риска и установлена допустимая суточная доза (ADI) салиномицина для человека - 5 мкг/кг, поскольку ежедневное потребление более 500 мкг/кг салиномицина у собак приводит к нейротоксическим эффектам, таким как потеря миелина и дегенерация аксонов (Naujokat and Steinhart, 2012, см. выше). В другом примере, Liu (Liu, 1982, Polyether Antibiotics. Naturally Occurring Acid lonophores. Volume 1. Biology. J.W. Westley. New York, Marcel Dekker Inc: 43-102) сообщает, что высокая пероральная и парентеральная токсичность полиэфирных ионофоров является вероятной причиной отсутствия данных о противомикробной активности полиэфирных ионофоров in vivo.
Единственным к настоящему времени применением полиэфирных ионофоров, о котором известно заявителю, является их применение в качестве пероральных агентов в ветеринарии для борьбы с кокцидиозом и для стимулирования роста.
Кроме того, не для всех полиэфирных ионофоров была показана значимая активность против грамположительных бактерий, таких как Staphylococcus aureus, и большинство из них не обладает активностью широкого спектра действия в отношении грамотрицательных бактерий. В связи со значительной токсичностью в отношении млекопитающих, как сообщают Naujokat и Steinhart (Naujokat and Steinhart, 2012, см. выше), салиномицин использовался только как кокцидиостат и стимулятор роста поголовья скота, но не рассматривался в качестве подходящего кандидата для разработки лекарств для человека.
Сохраняется потребность в альтернативных противомикробных препаратах в лечении инфекций, вызываемых бактериями со множественной устойчивостью, такими как MRSA и MRSP. Однако, по сообщениям Американского общества инфекционистов и Европейского центра по контролю и профилактике заболеваний, в разработке находится лишь небольшое количество новых лекарственных препаратов с перспективными результатами, превышающими существующие способы лечения, и еще меньше из них предназначено для направленного лечения стафилококков (Gilbert et al., 2010, Clinical Infectious Diseases, 50(8):1081-1083).
Задачей настоящего изобретения является устранение некоторых или всех недостатков предшествующего уровня техники.
Обсуждение предшествующего уровня техники, изложенное выше, предназначено для облегчения понимания всего настоящего изобретения. Обсуждение не подразумевает признание или принятие того, что любой из упомянутых источников является или являлся частью общедоступных сведений на дату приоритета заявки.
Краткое описание изобретения
В соответствии с одним аспектом настоящего изобретения, предложен способ лечения микробной инфекции у субъекта, включающий стадию введения субъекту терапевтически эффективного количества полиэфирного ионофора или его терапевтически приемлемой соли. Предпочтительно, микробная инфекция представляет собой местную микробную инфекцию. Предпочтительно, ионофор применяют локально. Более предпочтительно, ионофор применяют местно в области инфекции.
В соответствии с другим аспектом настоящего изобретения, предложен способ предотвращения микробной инфекции у субъекта, включающий стадию введения субъекту терапевтически эффективного количества полиэфирного ионофора или его терапевтически приемлемой соли. Местная инфекция может представлять собой инфекцию кожи, носовой полости, наружного ушного канала или глаза. Предпочтительно, микробная инфекция представляет собой местную микробную инфекцию. Предпочтительно, ионофор применяют локально. Более предпочтительно, ионофор применяют местно в области инфекции.
В соответствии с другим аспектом настоящего изобретения предложено применение полиэфирного ионофора или его терапевтически приемлемой соли в производстве лекарственного средства для лечения местной микробной инфекции у субъекта.
Введение может представлять собой местное введение непосредственно на кожу, в носовую полость, ушной канал или глаз. Например, введение может осуществляться через наружный ушной канал для лечения наружного отита или путем интраназального введения для лечения носительства MRSA.
Способ может представлять собой способ лечения микробного носительства или инфекции кожи или ноздрей у субъекта.
Местное введение может включать введение терапевтически эффективного количества ионофора непосредственно на поверхность субъекта. Предпочтительно, ионофор наносят местно на кожу, ноздри, наружный слуховой канал или глаз субъекта. Применение может включать введение терапевтически эффективного количества полиэфирного ионофора или его терапевтически приемлемой соли на кожу, ноздри, ушной канал или глаз субъекта.
Дополнительные признаки изобретения предусматривают полиэфирный ионофор или его терапевтически приемлемую соль, выбранный из группы, включающей момензин (также известный как А-3823А), наразин А (также известный как А-28086А), наразин В (также известный как А-28086 В), наразин D (также известный как A-28086D), лазалоцид, салиномицин, и мадурамицин, альбориксин (также известный как S-14750A, СР-38986), лаидломицин (также известный как АВ-78), леноремицин (также известный как А-130А, Ro21-6150), А-130 В, 130С-А, дианемицин (также известный какА-150 (М5-16183), А-204А, А-204 В, лономицин (также известный а А-218), деоксилаидломицин (также известный как А-712), кальцимицин (также известный как А-23187), септамицин (также известный как BL-580а и А-28695А), А-28695 В, К-41А (также известный как А-32887), септамицин (также известный как BL-580αb), BL-580β, BL-580δ, BL-580Z, карриомицин, кальмицинb (также известный как А-23187), катиономицин, хлорноборитомицин А (также известный как X-14766А), этеромицин (также известный как СР-38295, С 20-12, Т-40517), дезокси-салиномицин (также известный как SY-1), дезокси-эпи-салиномицина (SY-2), дезокси-наразин, дезокси эпи-наразин, дианемиконb (также известный как М5-16183,-150), эмерицид (также известный как лономицин А и DE 3938), дуамицин (также известный как нигерицин, хеликсин С и азаломицин М), гридориксин, иономицин, К-41 В, лазалоцид А (X-537А), лазалоцид В, лазалоцид С, лазалоцид D, лазалоцид Е, изо-лазалоцид А, леузерамицин, ломомицин В, ломомицин С, лизоцеллин, М-139603, монензин В, монензин С, монензин D, муталомицин, ноборитомицин А, ноборитомицин В, RP 30504, RP 37454, салиномицин, салиномицин AII, SY-4, SY-5, SY-8, тетрономицин, ТМ-531В, ТМ-531С, Х-206, Х-14547АХ-14667А, Х-14667В, Х-14868А, Х-14868В, Х-14868С, X-14868D, 5057, 6016.
Предпочтительно, полиэфирный ионофор выбран из группы, включающей салиномицин; лазалоцид; наразин; мадурамицин; монензин, лаидломицин и семдурамицин.
В одном варианте реализации полиэфирный ионофор не является нигерицином. В одном варианте реализации полиэфирный ионофор не является иономицином.
Субъект может представлять собой любой субъект, который может быть колонизирован (заражен) микроорганизмами. Субъект может представлять собой млекопитающее или птицу. Предпочтительно, субъект выбран из группы, включающей человека, собак, птиц, свиней, бычьих, овечьих, лошадей или кошек. Более предпочтительно, субъект выбран из группы, включающей человека, бычьих, свиней, лошадей, кошек и собак.
В одном варианте реализации полиэфирный ионофор вводят субъекту в дозе, выбранной из группы, включающей от 5 мкг/г до 900000 мг/г, предпочтительно от 5 мкг/г до 500 мг/г, более предпочтительно от от 5 мкг/г до 100 мг/г, наиболее предпочтительно от 16 мкг/г до 52 мг/г.
В одном варианте реализации полиэфирный ионофор вводят субъекту в дозе, составляющей от 16 мкг/г до 52 мг/г.
В одном варианте реализации полиэфирный ионофор вводят субъекту в дозе, выбранной из группы, включающей от 1 мкг/г до 100 мкг/г; от 100 мкг/г до 200 мкг/г; от 200 мкг/г до 300 мкг/г; от 300 мкг/г до 400 мкг/г; от 400 мкг/г до 500 мкг/г; от 500 мкг/г до 600 мкг/г; от 600 мкг/г до 700 мкг/г; от 700 мкг/г до 800 мкг/г; от 800 мкг/г до 900 мкг/г и от 900 мкг/г до 100 мкг/г. В одном варианте реализации полиэфирный ионофор вводят субъекту в дозе, выбранной из группы, включающей от 1 мкг/г до 10 мкг/г; от 10 мкг/г до 20 мкг/г; от 20 мкг/г до 30 мкг/г; от 30 мкг/г до 40 мкг/г; от 40 мкг/г до 50 мкг/г; от 50 мкг/г до 60 мкг/г; от 60 мкг/г до 70 мкг/г; от 70 мкг/г до 80 мкг/г; от 80 мкг/г до 90 мкг/г и 90 мкг/г до 100 мкг/г. В одном варианте реализации полиэфирный ионофор вводят субъекту в дозе, выбранной из группы, включающей от 1 мг/г до 100 мг/г; от 100 мг/г до 200 мг/г; от 200 мг/г до 300 мг/г; от 300 мг/г до 400 мг/г; от 400 мг/г до 500 мг/г; от 500 мг/г до 600 мг/г; от 600 мг/г до 700 мг/г; от 700 мг/г до 800 мг/г; от 800 мг/г до 900 мг/г и 900 мг/г до 1000 мг/г. В одном варианте реализации полиэфирный ионофор вводят субъекту в дозе, выбранной из группы, включающей от 1 мг/г до 10 мг/г; от 10 мг/г до 20 мг/г; от 20 мг/г до 30 мг/г; от 30 мг/г до 40 мг/г; от 40 мг/г до 50 мг/г; от 50 мг/г до 60 мг/г; от 60 мг/г до 70 мг/г; от 70 мг/г до 80 мг/г; от 80 мг/г до 90 мг/г и от 90 мг/г до 100 мг/г.
В одном варианте реализации изобретения полиэфирный ионофор вводят субъекту с применением режима дозирования, выбранного из группы, включающей: три раза в день; два раза в день; один раз в день; каждый второй день; каждый третий день; один раз в неделю; один раз в две недели, один раз в месяц.
В одном варианте реализации изобретения полиэфирный ионофор вводят субъекту в общем количестве на дозу, выбранном из группы, включающей: от 1 мг до 1000 мг; от 10 мг до 500 мг; от, 10 мг до 400 мг; от 10 мг до 300 мг; от 10 мг до 200 мг; от 10 мг до 100 мг и от 50 мг до 100 мг. В одном варианте реализации изобретения полиэфирный ионофор вводят субъекту в общем количестве на дозу, выбранном из группы, включающей: 1 мг, 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг и 100 мг. В одном варианте реализации изобретения полиэфирный ионофор вводят субъекту в общем количестве на дозу, выбранном из группы, включающей: 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 700 мг, 800 мг, 900 мг и 1000 мг.
Микроорганизм может быть как прокариотическим, так и эукариотическим. Предпочтительно, микроорганизм представляет собой бактериальный агент, выбранный из группы, включающей, но не ограниченной перечисленными, виды Staphylococcus spp, Streptococcus spp, Bacillus spp, Enterococcus spp, Listeria spp, Mycoplasma spp, и анаэробные бактерии. Бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Staphylococcus epidermidis, Staphylococcus simulans, Staphylococcus felis, Staphylococcus xylosus, Staphylococcus chromogenes, Staphylococcus warneri, Staphylococcus haemolyticus, Staphylococcus sciuri, Staphylococcus saprophyticus, Staphylococcus hominis, Staphylococcus caprae, Staphylococcus cohnii subsp. cohnii, Staphylococcus cohnii subsp. urealyticus, Staphylococcus capitis subsp. capitis, Staphylococcus capitis subsp. urealyticus, Staphylococcus hyicus, Staphylococcus aureus, Staphylococcus pseudintermedius, Staphylococcus delphini, Staphylococcus schleiferi subsp.coagulans, Staphylococcus aureus subsp. anaerobius, Streptococcus uberis, Streptococcus agalactiae, Streptococcus dysgalactiae. Streptococcus pyogenes. Streptococcus bovis. Streptococcus equi subsp. zooepidemicus, Streptococcus equinus, Bacillus melaninogenicus, Bacillus pumilus, Bacillus licheniformis. Bacillus cereus, Bacillus subtilis, Bacillus anthracis, Enterococcus faecium, Enterococcus faecalis, Enterococcus durans, Listena monocytogenes, Clostridium perfringens, Clostridium difficile, Actinomyces bovis, Propionibacterium acnes, Propionibacterium granulosum, Eubacterium, Peptococcus indolicus, Peptostreptococcus anaerobius и Mycoplasma bovis.
Более предпочтительно, бактериальный агент выбран из группы, включающей Staphylococcus aureus, Staphylococcus pseudintermedius, Streptococcus pyogenes и Propionibacterium acnes. Например, бактериальный агент представляет собой метициллин-устойчивый Staphylococcus aureus (MRSA) или метициллин-устойчивый Staphylococcus pseudintermedius (MRSP).
Наиболее предпочтительно, бактериальный агент представляет собой чувствительный к антибиотикам штамм или устойчивый к антибиотикам штамм. Примеры штаммов, устойчивых к антибиотикам, включают MRSA, MRSP и устойчивые к макролиду, тетрациклину, фторхинолону или цефалоспорину Streptococcus spp. В предпочтительном варианте реализации бактериальный штамм представляет собой MRSA и MRSP.
В одном варианте реализации, бактериальный агент выбран из группы, включающей, но не ограниченной перечисленными, коагулазонегативные стафилококки (КНС). Примеры коагулазонегативных стафилококков (КНС), включают Staphylococcus epidermidis (изолирован из мастита коров), Staphylococcus simulans (изолирован из мастита коров или кошачьего дерматита), Staphylococcus felis (изолирован из кошачьего дерматита), Staphylococcus xylosus (изолирован из мастита коров или коровьего дерматита), Staphylococcus chromogenes (изолирован из мастита коров или козьего дерматита), Staphylococcus warneri (изолирован из инфицированных коз), Staphylococcus haemolyticus (изолирован из инфицированных коз), Staphylococcus sciuri (изолирован из свиного экссудативного эпидерматита), Staphylococcus saprophyticus (изолирован из инфицированных коз), Staphylococcus hominis (изолирован из инфицированных свиней), Staphylococcus caprae (изолирован из инфицированных коз), Staphylococcus Staphylococcus cohnii subsp. cohnii (изолирован из инфицированных коз), Staphylococcus cohnii subsp. urealyticus (изолирован из инфицированных коз), Staphylococcus capitis subsp. capitis (изолирован из мастита коров), Staphylococcus capitis subsp. urealyticus (изолирован из мастита коров) и Staphylococcus hyicus (изолирован из свиного экссудативного эпидерматита и инфицированных коров).
В другом варианте реализации бактериальный агент выбран из коагулазо-позитивных стафилококков. Например, бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Staphylococcus aureus (выделенный из инфицированных людей, лошадей, свиней, бычьих, птиц, собак и кошек, коровьего и овечьего мастита, и из многих видов животных с дерматитами и послеоперационными раневыми инфекциями), Staphylococcus pseudinteimedius (пиодермия собак, инфекции собак и кошек), Staphylococcus delphini (гнойные поражения кожи дельфина), Staphylococcus schleiferi subsp. coagulans (наружный отит собак, инфекции собак и кошек) и Staphylococcus aureus subsp. anaerobius (лимфаденит овец). В наиболее предпочтительном варианте бактериальный агент представляет собой Staphylococcus aureus, который может быть получен из различных линий, адаптирован ко многим хозяевам, в том числе ассоциированный с домашним скотом MRSA, относящийся к типу последовательности ST9 (ST) и клональному комплексу 398 (clonal complex, CC), ассоциированный с различными сообществами людей CA-MRSA, и ассоциированный с больницами HA-MRSA.
В другом варианте реализации бактериальный агент относится к роду Streptococcus. Например, бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Streptococcus uberis. Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus pyogenes и другие β-гемолитические стрептококки, Streptococcus bovis, Streptococcus equi subsp. zooepidemicus и Streptococcus equinus.
В другом варианте реализации бактериальный агент относится к роду Bacillus. Например, бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Streptococcus uberis, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus pyogenes. Streptococcus bovis, Streptococcus equi subsp.zooepidemicus и Streptococcus equinus.
В другом варианте реализации бактериальный агент относится к роду Enterococcus. Например, бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Enterococcus faecium, Enterococcus faecalis и Enterococcus durans. Эти бактерии могут быть изолированы из мастита коров.
В другом варианте реализации бактериальный агент относится к роду Listeria. Например, бактериальный агент может представлять собой Listeria monocytogenes.
В другом варианте реализации изобретения бактериальный агент является анаэробным. Например, бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Clostridium perfringens, Clostridium difficile, Actinomyces bovis, Propionibacterium acnes, Propionibacterium granulosum, Eubacterium, Peptococcus indolicus и Peptostreptococcus anaerobius.
В другом варианте реализации микроорганизм относится к роду Mycoplasma. Например, микроорганизм может представлять собой Mycoplasma bovis.
В другом варианте реализации микроорганизм относится к грибам или дрожжам, например, грибам или дрожжам, выбранным из группы, включающей, но не ограниченной перечисленными, грибы или дрожжи, вызывающие поверхностные или кожные микозы, дерматофитов, которые включают различные виды Trichophyton, Microsporum и Epidermophyton, различные виды Candida и Malassezia (ранее известный как Pityrosporum).
В предпочтительном варианте реализации микроорганизм представляет собой Staphylococcus aureus. В наиболее предпочтительном варианте реализации микроорганизм представляет собой MRSA или MRSP.
Следует понимать, что полиэфирные ионофоры, описанные в настоящей заявке, как правило, эффективны против грамположительных бактерий и ряда анаэробных бактерий, а также микоплазмы и грибов. Чувствительность микроорганизма к полиэфирным ионофорам, описанным в настоящей заявке, варьирует в зависимости от индивидуального штамма, но в целом, грамположительные кокки и бациллы, а также некоторые анаэробы, такие как Clostridium, Eubacterium, Propionibacterium, Mycobacterium, and Streptomyces являются восприимчивыми к полиэфирным ионофорам, описанным в настоящей заявке. Грибы и дрожжи, такие как Sclerotinia sclerotiorum, Monila laxa, Phomopsis mail, Botrytis cineria, Thchthecium roseum и Verticillium albo-atrummay также могут проявлять чувствительность к полиэфирным ионофорам, описанным в настоящей заявке.
В одном варианте реализации настоящего изобретения предложен способ лечения микробной инфекции кожи, носовой полости, ушного канала или глаза у человека, способ включающий стадию местного введения терапевтически эффективного количества полиэфирного ионофора или его терапевтически приемлемой соли на кожу, в ноздри, ушной канал или глаз человека.
В другом варианте реализации настоящего изобретения предложен способ лечения микробной инфекции кожи, носовой полости, ушного канала или глаза у человека, способ включающий стадию местного введения терапевтически эффективного количества полиэфирного ионофора или его терапевтически приемлемой соли на кожу, в ноздри, ушной канал или глаз собаки.
В соответствии с другим аспектом настоящего изобретения предложена фармацевтическая или ветеринарная противомикробная композиция, включающая терапевтически эффективное количество полиэфирного ионофора, или его терапевтически приемлемой соли.
Фармацевтическая или ветеринарная противомикробная композиция может включать фармацевтически приемлемое вспомогательное вещество или носитель. Предпочтительно, композиция адаптирована для лечения местной микробной инфекции.
В одном варианте реализации композиция включает примеси, при этом количество примесей в процентах от общей массы композиции, выбрано из группы, включающей: менее 20% примесей (от общего веса композиции); менее 15% примесей; менее 10% примесей; менее 8% примесей; менее 5% примесей; менее 4% примесей; менее 3% примесей; менее 2% примесей; менее 1% примеси: менее 0,5% примесей; менее 0,1% примесей. В одном варианте реализации композиция включает микробные примеси или вторичные метаболиты, при этом количество микробных примесей в процентах от общей массы композиции выбрано из группы, включающей: менее 5%; менее 4%; менее 3%; менее 2%; менее 1%; менее 0,5%; менее 0,1%; менее 0,01%; менее 0,001%. В одном варианте реализации противомикробная композиция стерильна и хранится в герметичном стерильном контейнере. В одном варианте реализации композиция не содержит детектируемого количества микробной примеси.
В одном варианте реализации композиция не содержит цинк.
В одном варианте реализации композиция не содержит кератолитический агент.
В одном варианте реализации композиция обладает антибактериальной активностью. В одном варианте реализации композиция не обладает противогрибковой активностью. В одном варианте реализации композиция не обладает противовирусной активностью.
Фармацевтическая композиция по настоящему изобретению может применяться для лечения или предотвращения местного микробного носительства или инфекции у человека, например, бактериальной инфекции или бактериального носительства, вызванного бактериями рода Staphylococcus.
В соответствии с еще одним аспектом настоящего изобретения предложены противомикробные ветеринарные композиции, содержащие терапевтически эффективное количество полиэфирного ионофора или его терапевтически приемлемой соли.
Композиция может применяться местно.
Ветеринарная композиция может включать фармацевтически приемлемое вспомогательное вещество или носитель.
Композиция согласно настоящему изобретению может быть представлена в форме, выбранной из группы, включающей, но не ограниченной перечисленными, средство для ополаскивания, шампунь, лосьон, гель, несмываемое средство, несмываемое средство и мазь. Предпочтительно, композиция выбрана из группы, включающей композицию с немедленным высвобождением, композицию с замедленным высвобождением, композицию с контролируемым высвобождением и композицию с быстрым высвобождением.
Композиция согласно настоящему изобретению может содержать дополнительный противомикробный агент. Дополнительный противомикробный агент может представлять собой противогрибковый агент.
В одном варианте реализации противогрибковый агент выбран из группы, включающей, но не ограниченной перечисленными, Эхинокандины (Анидулафунгин, Каспофунгин, Микафунгин), Полиены (Амфотерицин В, Кандицидин, Филипин, Фунгихромин, Хачимицин, Гамицин, Люцензомицин, Мепартрицин, Натамицин, Нистатин, Пецилоцин, Перимицин, Гризеофульвин, Олигомицины, Пирролнитрин, Сикканин и Виридин. Противогрибковое средство может быть синтетическим соединением, выбранным из группы, включающей, но не ограниченной перечисленными, Аллиламины (бутенафин, Нафтифин, Тербинафин) Имидазолы (Бифоназол, Бутоконазол, Хлормидазол, Клоконазол, Клотримазол, Эконазол, Фентиконазол, Флутримазол, Изоконазол, Кетоконазол, Ланоконазол, Миконазол, Нетриконазол, Омоконазол, Оксиконазол нитрат, Сертаконазол, Сулконазол, Тиоконазол), Тиокарбаматы (Лиранафтат, Толциктат, Толиндат, Толнафтат), Триазолы (Флуконазол, Изавуконазол, Итраконазол, Позаконазол, Равуконазол, Саперконазол, Терконазол, Вориконазол), Акризорцин, Аморолфин, Бромсалицилхлоранилид, Буклозамил, Кальция пропионат, Хлорфенезин, Циклопирокс, Клоксиквин, Копараффинат, Экзаламид, Флуцитозин, Галопрогин, Гексетидин, Лофлукарбан, Нифуратель, Калия йодид, Пропионовую кислоту, Пиритион, Салициланилид, Натрия пропионат, Сулбентин, Тенонитрозол, Триацетин, Ундециленовую кислоту и Цинка пропионат.
В другом варианте противогрибковый агент выбран из группы, включающей, но не ограниченной перечисленными, Аморолфин, Амфотерицин В, Анидулафунгин, Бифоназол, Бромхлорсалициланилид, Бутенафина гидрохлорид, Бутоконазола нитрат, Каспофунгина ацетат, Хлормидазола гидрохлорид, Хлорфенезин, Циклопирокс, Климбазол, Клотримазол, Клоксиквин, Кроконазола гидрохлорид, Эберконазола нитрат, Эконазол, Энилконазол, Фентиконазола нитрат, Флуконазол, Флуцитозин, Флутримазол, Фосфлуконазол, Гризеофульвин, Изоконазол, Итраконазол, Кетоконазол, Ланоконазол, Лиранафтат, Луликоназол, Мепартрицин, Микафунгин натрия, Миконазол, Нафтифина гидрохлорид, Натамицин, Нетриконазола гидрохлорид, Нифуроксим, Нистатин, Омоконазола нитрат, Оксиконазола нитрат, Парконазола гидрохлорид, Пентамицин, Пироктон оламин, Позаконазол, Пропионовую кислоту, Пирролнитрин, Равуконазол, Сертаконазола нитрат, Сикканин, Парахлорбензоат натрия, Сулконазола нитрат, Тербинафин, Терконазол, Тиоконазол, Толциктат, Толнафтат, Триацетин, Триметрексата глюкуронат, Ундеценовую кислоту и вориконазол.
Композиция согласно настоящему изобретению может дополнительно содержать антибиотик, выбранный из группы, включающей, но не ограниченный перечисленными ингибиторы β-лактамазы (Клавулановую кислоту, Сульбактам, Сультамициллин, Тазобактам), ингибиторы почечной дипептидазы (Циластатин) и протекторы почек (Бетамипрон).
В одном варианте реализации композиция согласно настоящему изобретению содержит дополнительно антибиотик, выбранный из группы, включающей, но не ограниченной перечисленными, Аминогликозиды (Амикацин, Арбекацин, Бамбермицины, Бутирозин, Дибекацин, Дигидрострептомицин, Фортимицины, Гентамицин, Канамицин Изепамицин, Микрономицин, Неомицин, Нетилмицин, Паромомицин, Рибостамицин, Сизомицин, Спектиномицин, Стрептомицин, Тобрамицин), Амфениколы (Азидамфеникол, Хлорамфеникол, Тиамфеникол), Ансамицины (Рифамид, Рифампин, Рифамицин SV, Рифапентин, Рифаксимин), β-лактамы, Карбацефемы (Лоракарбеф), Карбапенемы (Биапенем, Дорипенем, Эртапенем, Имипенем, Меропенем, Панипенем), Цефалоспорины (Цефаклор, Цефадроксил, Цефамандол, Цефатризин, Цефазедон, Цефазолин, Цефкапен, Цефдинир, Цефдиторен, Цефепим, Цефетамет, Цефиксим, Цефменоксим, Цефодизим, Цефоницид, Цефоперазон, Цефоранид, Цефоселис, Цефотаксим, Цефотиам, Цефозопран, Цефпимизол, Цефпирамид, Цефпиром, Цефподоксим, Цефпрозил, Цефроксанид, Цефсулодин, Цефтаролин, Цефтазидим, Цефтерам, Цефтезол, Цефтибутен, Цефтизоксим, Цефтобипрол медокарил, Цефтриаксон, Цефуроксим, Цефузонам, Цефацетрил, Цефалексин, Цефалоглицин, Цефалоридин, Цефалотин, Цефапирин, Цефрадин, Пивцефалексин), Цефамицины (Цефбуперазон, Цефметазол, Цефминокс, Цефотетан, Цефокситин), Монобактамы (Азтреонам, Карумонам), Оксацефемы (Фломоксеф, Моксалактам), Пенемы (Фаропенем, Ритипенем), Пенициллины (Амдиноциллин, Амдиноциллин пивоксил, Амоксициллин, Ампициллин, Апалциллин, Аспоксициллин, Азидоциллин, Азлоциллин, Бакампициллин, Карбенициллин, Кариндациллин, Клометоциллин, Клоксациллин, Циклациллин, Диклоксациллин, Эпициллин, Фенбенициллин, Флоксациллин, Гетациллин, Ленампициллин, Метампициллин, Метициллин натрия, Мезлоциллин, Нафциллин, Оксациллин, Пенамециллин, Пенетамат гидроиодид, Пенициллин G, Пенициллин G бензатин, Пенициллин G прокаин, Пенициллин N, Пенициллин О, Пенициллин V, Фенетициллин калия, Пиперациллин, Пивампициллин, Пропициллин, Квинациллин, Сулбенициллин, Сультамициллин, Талампициллин, Темоциллин, Тикарциллин), Линкозамиды (Клиндамицин, Линкомицин), Макролиды (Азитромицин, Цетромицин, Кларитромицин, Диритромицин, Эритромицин, Эритромицин ацистрат, Эритромицин эстолат, Эритромицин глюкогептонат, Эритромицин лактобионат, Эритромицин пропионат, Эритромицин стеарат, Фидаксомицин, джозамицин, Леукомицин, Мидекамицины, Миокамицин, Олеандомицин, Примицин, Ротикамицин, Розарамицин, Рокситромицин, Спирамицин, Телитромицин, Тролеандомицин), Полипептиды (Амфомицин, Бацитрацин, Бацитрацин цинка, Капреомицин, Колистин, Далбаванцин, Даптомицин, Эндурацидин, Энвиомицин, Фузафунгин, Грамицидин(ы), Грамицидин S, Изеганан, Оритаванцин, Полимиксин, Квинупристин, Рамопланин, Ристоцетином, Тейкопланин, Телаванцин, Тиострептон, Туберактиномицин, Тироцидин, Тиротрицин, Ванкомицин, Виомицин), Тетрацикпины (Хпортетрациклин, Кломоциклин, Демеклоциклин, Доксициклин, Гуамециклин, Лумециклин, Меклоциклин, Метациклин, Миноциклин, Окситетрациклин, Пипациклин, Ролитетрациклин, Тетрациклин, Тигециклин), другие соединения (Циклосерин, Дальфопристин, Фосфомицин, Фузидиевую кислоту, Мупироцин, Пристинамицин, Ретапамулин и Виргиниамицин).
В другом варианте реализации композиция по настоящему изобретению дополнительно содержит синтетический антибиотик, выбранный из группы, включающей, но не ограниченный перечисленными, 2,4-диаминопиримидины (Бродимоприм, Иклаприм, Тетроксоприм, Триметоприм), Нитрофураны (Фуралтадон, Фуразолиум хлорид, Нифуратель, Нифурфолин, Нифурпиринол, Нифуртоинол, Нитрофурантоин) Оксазолидиноны (Линезолид), Пептиды (Омиганан, Пексиганан), Фторхинолоны и аналоги (Балофлоксацин, Безифлоксацин, Циноксацин, Ципрофлоксацин, Клинафлоксацин, Эноксацин, Финафлоксацин, Флероксацин, Флумекин, Гареноксацин, Гатифлоксацин, Гемифлоксацин, Грепафлоксацин, Ломефлоксацин, Милоксацин, Моксифлоксацин, Надифлоксацин, Налидиксовую кислоту, Норфлоксацин, Офлоксацин, Оксолиновую кислоту, Пазуфлоксацин, Пефлоксацин, Пипемидовую кислоту, Пиромидиновую кислоту, Прулифлоксацин, Розоксацин, Руфлоксацин, Ситафлоксацин, Спарфлоксацин, Тосуфлоксацин, Тровафлоксацин), Сульфаниламиды (ацетил Сульфаметоксипиразин, Хлорамин-В, Хлорамина-Т, Дихлорамин Т, Мафенид, Ноприлсульфамид, Фталилсульфацетамид, Фталилсульфатиазол, Салазосульфадимидин, Сукцинилсульфатиазол, Сульфабензамид, Сульфацетамид, Сульфахлорпиридазин, Сульфахризоидин, Сульфацитин, Сульфадиазин, Сульфадикрамид, Сульфадоксин, Сульфаэтидол, Сульфагуанидин, Сульфагуанол, Сульфален, Сульфалоксовая кислота, Сульфамеразин, Сульфаметер, Сульфаметазин, Сульфаметизол, Сульфаметомидин, Сульфаметоксазол, Сульфаметоксипиридазин, Сульфаметрол, Сульфамидохризоидин, Сульфамоксол, Сульфаниламид, N4-Сульфанилилсульфаниламид, Сульфанилмочевина, N-Сульфанилил-3,4-ксиламид, Сульфаперин, Сульфафеназол, Сульфапроксилин, Сульфапиразин, Сульфапиридин, Сульфатиазол, Сульфатиомочевина, Сульфизомидин, Сульфисоксазол), Сульфоны (Ацедиасульфон, Дапсон, Глюкосульфон натрия, Сукцисульфон, Сульфаниловую кислоту, п-Сульфанилилбензиламин, Сульфоксон натрия, Тиазолсульфон), Клофоктол, Метенамин, Метронидазол, Нитроксолин, Тауролидин и Ксиборнол.
В другом варианте реализации композиция по настоящему изобретению дополнительно содержит антибиотик, выбранный из группы, включающей, но не ограниченной перечисленными, Ацедиасульфон натрия, Амикацин, Аминосалициловую кислоту, Амоксициллин, Ампициллин, Апрамицин, Арбекацин сульфат, Арсаниловую кислоту, Аспоксициллин, Астромицин сульфат, Авиламицин, Авопарцин, Азидамфеникол, Азидоциллин натрия, Азитромицин, Азлоциллин, Азтреонам, Бакампициллин гидрохлорид, Бацитрацин, Балофлоксацин, Бамбермицин, Баквилоприм, Беканамицин сульфат, Бенетамин пенициллин, Бензатин бензилпенициллин, Бензатин феноксиметилпенициллин, Бензилпенициллин, Бесифлоксацин, Бетамипрон, Биапенем, Бродимоприм, Капреомицин сульфат, Карбадокс, Карбенициллин натрия, Кариндациллин натрия, Карумонам натрия, Цефаклор, Цефадроксил, Цефалексин, Цефалониум, Цефалоридин, Цефалотан натрия, Цефамандол, Цефапирин натрия, Цефатризин, Цефазолин, Цефбуперазон, Цефкапен пивоксил гидрохлорид, Цефдинир, Цефдиторен пивоксил, Цефепим гидрохлорид, Цефетамет, Цефиксим, Цефменоксим гидрохлорид, Цефметазол, Цефминокс натрия, Цефодизим натрия, Цефоницид натрия, Цефоперазон натрия, Цефоранид, Цефоселис сульфат, Цефотаксим натрия, Цефотетан, Цефотиам гидрохлорид, Цефовицин натрия, Цефокситин натрия, Цефозопран гидрохлорид, Цефпирамид, Цефпиром сульфат, Цефподоксим проксетил, Цефпрозил, Цефквином сульфат, Цефрадин, Цефсулодин натрия, Цефтаролин фозамил ацетат, Цефтазидим, Цефтерам пивоксил, Цефтезол натрия, Цефтибутен, Цефтиофур, Цефтизоксим натрия, Цефтобипрол медокарил, Цефтриаксон натрия, Цефуроксим, Цетромицин, Хлорамфеникол, Хлороксин, Хлорквиналдол, Хлортетрациклин, Циклациллин, Циластатин натрия, Циноксацин, Ципрофлоксацин, Кларитромицин, Клавулановую кислоту, Пенициллин клемизол, Клиндамицин, Клиохинол, Клофазимин, Клофоктол, Клометоциллин калия, Клоксациллин, Колистин сульфат, Ко-тетроксазин, Ко-трифамол, Ко-тримоксазол, Циклосерин, Далбаванцин, Данофлоксацин мезилат, Дапсон, Даптомицин, Деланамид, Демеклоциклин, Дибекацин сульфат, Диклоксациллин, Дифлоксацин гидрохлорид, Дигидрострептомицин сульфат, Диритромицин, Дорипенем, Доксициклин, Эноксацин, Энрофлоксацин, Эртапенем натрия, Эритромицин, Этамбутол гидрохлорид, Этионамид, Этимицин сульфат, Фаропенем натрия, Фидаксомицин, Флероксацин, Фломоксеф натрия, Флорфеникол, Флуклоксациллин, Флумекин, Флуритромицин этилсукцинат, Формосульфатиазол, Фосфомицин, Фрамицетин сульфат, Фтивазид, Фуралтадон гидрохлорид, Фуразидин, Фузафунгин, Фузидиевую кислоту, Гамиромицин, Гареноксацин мезилат, Гатифлоксацин, Гемифлоксацин мезилат, Гентамицин сульфат, Грамицидин, Грамицидин С, Галквинол, Ибафлоксацин, Иклаприм, Имипенем, Изепамицин, Изониазид, Джозамицин, Канамицин кислый сульфат, Китазамицин, Латамоксев динатрия, Левофлоксацин, Линкомицин, Линезолид, Ломефлоксацин гидрохлорид, Лоракарбеф, Лимециклин, Мафенид, Магаинины, Миндальную кислоту, Марбофлоксацин, Мециллинам, Меклоциклин, Мелеумицин, Меропенем, Метациклин, Метенамин, Метициллин натрия, Мезлоциллин, Микрономицин сульфат, Мидекамицин, Миноциклин, Миронамид, Моксифлоксацин гидрохлорид, Мупироцин, Надифлоксацин, Нафциллин натрия, Налидиксовую кислоту, Неомицин, Нетилмицин сульфат, Нифуроксазид, Нифурпиринол, Нифуртоинол, Нифурзид, Низин, Нитрофурантоин, Нитрофуразон, Нитроксолин, Норфлоксацин, Норванкомицин гидрохлорид, Новобиоцин, Офлоксацин, Олеандомицин фосфат, Орбифлоксацин, Оритаванцин, Орметоприм, Оксациллин натрия, Оксолиновую кислоту, Окситетрациклин, Панипенем, Пазуфлоксацин мезилат, Пефлоксацин мезилат, Пенетамат гидроиодид, Фенетициллин калия, Феноксиметилпенициллин, Фталилсульфацетамид, Фталилсульфатиозол, Пипемидовую кислоту, Пиперациллин, Пирлимицин гидрохлорид, Пиромидиновую кислоту, Пивампициллин, Пивмециллинам, Полимиксин В сульфат, Прадофлоксацин, Пристинамицина, Прокаин бензилпенициллин, Пропициллин калия, Протионамид, Прулифлоксацин, Пиразинамид, Квинупристин/дальфопристин, Рамопланин, Ретапамулин, Рибостамицин сульфат, Рифабутин, Рифампицин, Рифамицин натрия, Рифапентин, Рифаксимин, Рокитамицин, Ролитетрацикпин, Розоксацин, Рокситромицин, Руфлоксацин гидрохлорид, Сарафлоксацин гидрохлорид, Сизомицин сульфат, Ситафлоксацин, Спарфлоксацин, Спектиномицин, Спирамицин, Стрептомицин, Сукциниосульфатиазол, Сульбактам, Сульбенициллин натрия, Сульфабензамид, Сульфакарбамид, Сульфацетамид, Сульфахлорпиридазин, Сульфахризоидин Сульфаклозин, Сульфадиазин, Сульфадиазин серебра, Сульфадикрамид, Сульфадиметоксин, Сульфадимидин, Сульфадоксин, Сульфафуразол, Сульфагуанидин, Сульфамеразин, Сульфаметизол, Сульфаметоксазол, Сульфаметоксипиридазин, Сульфаметилтиазол, Сульфаметопиразин, Сульфаметрол, Сульфамонометоксин, Сульфамоксол, Сульфаниламид, Сульфапиридин, Сульфаквиноксалин, Сульфатиазол, Сульфатиазол серебра, Сульфатроксазол, Сульфизомидин, Сультамициллин, Тауролидин тазобактам натрия, Тейкопланин, Телаванцин, Телитромицин, Темоциллин, Теризидон, Тетрациклин, Тетроксоприм, Теноевую кислоту, Тиамфеникол, Тиоацетазон, Тиострептон, Тиамулин, Тикарциллин мононатриевый, Тигециклин, Тилдипирозин, Тилмикозин, Тобрамицин, Тосуфлоксацин, Триметоприм, Тролеандомицин, Тулатромицин, Тилозин, Тилвалозин тартрат, Тиротрицин, Валнемулин, Ванкомицин, Виргиниамицин и Ксиборнол.
Предпочтительно, композиция согласно настоящему изобретению содержит дополнительно антибиотик, выбранный из группы, включающей, но не ограниченной перечисленными, пенициллин G, пенетамат, клоксациллин, нафциллин, ампициллин, амоксициллин, кпавулановую кислоту, стрептомицин, неомицин, фрамицетин, тетрациклин, гентамицин, фторхинолы и полимиксины.
Ветеринарная композиция согласно изобретению может дополнительно содержать вспомогательное вещество, выбранное из группы, включающей, но не ограниченной перечисленными, связующие вещества и добавки для прессования, покрытия и пленки, красители, растворители и носители, разрыхлители, эмульгаторы и солюбилизаторы, ароматизаторы и подсластители, репелленты, вещества, способствующие скольжению, и смазывающие вещества, пластификаторы, консерванты, пропелленты, растворители, стабилизаторы, суспендирующие агенты и усилители вязкости. В одном из вариантов реализации изобретения композиция дополнительно содержит хелатирующий агент, такой как лимонная кислота, ЭДТА или мальтол. Следует понимать, что такие вспомогательные вещества могут привести к любому изменению рН композиции.
В одном варианте реализации композиция представляет собой мазь, содержащую полиэфирный ионофор, парафиновое масло и вазелин. Например, композиция включает:
Парафиновое масло 49,0 г
Вазелин 49,0 г
Ионофор 2,0 г
В одном варианте реализации композиция представляет собой мазь, содержащую полиэфирный ионофор, ланолин, консервант, парафиновое масло и вазелин. Например, композиция включает:
Ланолин 10,0 г
Вазелин 80,0 г
Парафиновое масло 7,9 г
Консервант 0,1 г
Ионофор (2%) 2,0 г
В одном варианте осуществления композиция представляет собой гель, содержащий полиэфирный ионофор, полиэтиленгликоль (ПЭГ), глицерин и дистиллированную воду. Например, композиция включает:
ПЭГ 4000 35,0 г
ПЭГ 200 40,0 г
Глицерин 6,0 г
Дистиллированная вода 17,0 г
Ионофор 2,0 г
В одном варианте реализации композиция представляет собой крем, содержащий полиэфирный ионофор, глицеролмоностеарат, консервант, парафиновое масло, стеариновую кислоту, стеарат калия, глицерин, дистиллированную воду и вазелин. Например, композиция включает:
Глицеролмоностеарат 12,0 г
Вазелин 15,0 г
Стеариновая кислота 1,3 г
Парафиновое масло 5,0 г
Стеарат калия 0,7 г
Глицерин 10,0 г
Консервант 0,1 г
Ионофор (2%) 2,0
Дистиллированная вода до 100 г
В соответствии с еще одним аспектом настоящего изобретения, предложено медицинское или ветеринарное устройство, применяемое в способе лечения или предотвращения местной микробной инфекции у субъекта.
В соответствии с еще одним аспектом настоящего изобретения, предложено медицинское устройство, содержащее композицию согласно настоящему изобретению.
Медицинское устройство может быть в форме, выбранной из группы, включающей пластырь, бинт, или другой перевязочный материал, наносимый на локализованную микробную инфекцию на коже, в ноздрях, ушном канале или глазах у субъекта.
В другом аспекте настоящее изобретение относится к применению полиэфирного ионофора или его терапевтически приемлемой соли для получения лекарственного средства для лечения местного микробного поражения у субъекта. Предпочтительно, применение включает введение субъекту терапевтически эффективного количества полиэфирного ионофора или его терапевтически приемлемой соли.
В другом аспекте, изобретение представляет собой способ, композицию, устройство или применение, по существу как описано в настоящей заявке со ссылкой на прилагаемые примеры и фигуры.
В другом аспекте настоящее изобретение представляет собой композицию по п.16, устройство по п. 26, а также применение по п. 29, по существу как описано в настоящей заявке со ссылкой на прилагаемые примеры и фигуры.
Термины, используемые в данном документе, имеют свои обычные значения в данной области, если не указано иначе. Как изложено в настоящем документе используются следующие термины, относящиеся к полиэфирным ионофорам:
В отношении Примеров и Фигур, LP 1088 относится к салиномицину; LP 1369 относится клазалоциду; LP 4525 относится к наразину; LP 6315 относится к мадурамицину; LP 9666 относится к монензину.
При использовании в настоящей заявке термин лазалоцид, (также известный как Аватек, Боватек, антибиотик Х-537А, ионофор Х-4537А и Ro 2-2985, регистрационный номер CAS 25999-31-9 (кислота), 25999-20-6 (натриевая соль)) относится к соединению, имеющему следующую химическую структуру:

При использовании в настоящей заявке термин монензин, (также известный как Кобан, Руменсин, Монензиновая кислота и 3823А, регистрационный номер CAS 17090-79-8 (кислота), 22373-78-0 (натриевая соль)) относится к соединению, имеющему следующую химическую структуру:

При использовании в настоящей заявке термин салиномицин (также известный как Коксистак, Позистак, Салоцин, Овикокс, AHR-3096, К-364 и К-748364А, CAS регистрационный номер 53003-10-4 (кислоты), 55721-31-8 (натриевая соль)) относится к соединению, имеющему следующую химическую структуру:

При использовании в настоящей заявке термин наразин (также известный как Монтебан, 4-метилсалиномицин, соединение 79891, А-28086 фактора А, С-7819В, регистрационный номер CAS 55134-13-9 (кислота)) относится к соединению, имеющему следующую химическую структуру:

При использовании в настоящей заявке термин мадурамицин относится к соединению, имеющему следующую химическую структуру (представлен ниже как мадурамицин аммония):

Преимуществом настоящего изобретения является то, что композиции, описанные в настоящей заявке, применяются в способе лечения местной микробной инфекции, такой как микробная инфекция кожи. Наружные слои кожи млекопитающего представляют собой физический барьер для абсорбции многих терапевтических веществ. Роговой слой кожи функционирует как физический барьер для поглощения токсичных веществ. Предполагается, что местное применение композиций по изобретению будет обеспечивать локализованное воздействие на зараженный участок на коже у субъекта за счет действия полиэфирного ионофора при минимальной системной абсорбции через кожу субъекта. Таким образом, для лечения микробной инфекции кожи могут применяться терапевтически эффективные количества полиэфирного ионофора без воздействия на субъект по существу токсических доз вещества.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Дополнительные признаки настоящего изобретения более полно описаны в последующем описании нескольких не ограничивающих вариантов его реализации. Данное описание представлено исключительно для иллюстрации настоящего изобретения. Описанные варианты реализации изобретения никоим образом не ограничивают краткого описания, раскрытия или описания изобретения, как изложено выше. Описание приведено со ссылкой на прилагаемые фигуры, где
Фигура 1 представляет собой таблицу, в которой приведена коллекция изолятов с указанием вида позвоночного, из которого были получены данные изоляты, с последующей биохимической характеристикой видов Staphylococcus, включая профиль устойчивости в соответствии с Примером 1. Cl означает клиндамицин, Enr - энрофлоксацин, Е - эритромицин, G - гентамицин, О - оксациллин, Р - пенициллин G, Те -тетрациклин, Tm - триметоприм-сульфаметоксазол;
Фигура 2 представляет собой схематическое изображение 96-луночного планшета для теста, выявляющего минимальную ингибирующую концентрации в соответствии с Примером 1;
Фигура 3 представляет собой схематическое изображение теста, выявляющего минимальную ингибирующую концентрацию, при этом затемненные области представляют собой расположение лунок объемом 10 мкл в двух повторностях, а стрелка указывает на увеличивающиеся концентрации в направлении по часовой стрелке вокруг чашки в соответствии с Примером 1;
На Фигуре 4 показан график минимальной ингибирующей концентрации (МИК) для индивидуальных изолятов, разделенных на метициллин-чувствительные и метициллин-устойчивые штаммы; значения выше 128 мкг/мл соответствуют штаммам, для которых не было получено значений МИК в диапазоне тестируемых концентраций (0,25-128 мкг/мл) в соответствии с Примером 1;
На Фигуре 5 приведена таблица, иллюстрирующая МИК50, МИК90 и диапазон МИК для метициллин-чувствительных штаммов для ампициллина и пяти тестируемых соединений в соответствии с Примером 1;
На Фигуре 6 приведена таблица, иллюстрирующая МИК50, МИК90 и диапазон МИК для метициллин-устойчивых штаммов для ампициллина и пяти тестируемых соединений в соответствии с Примером 1;
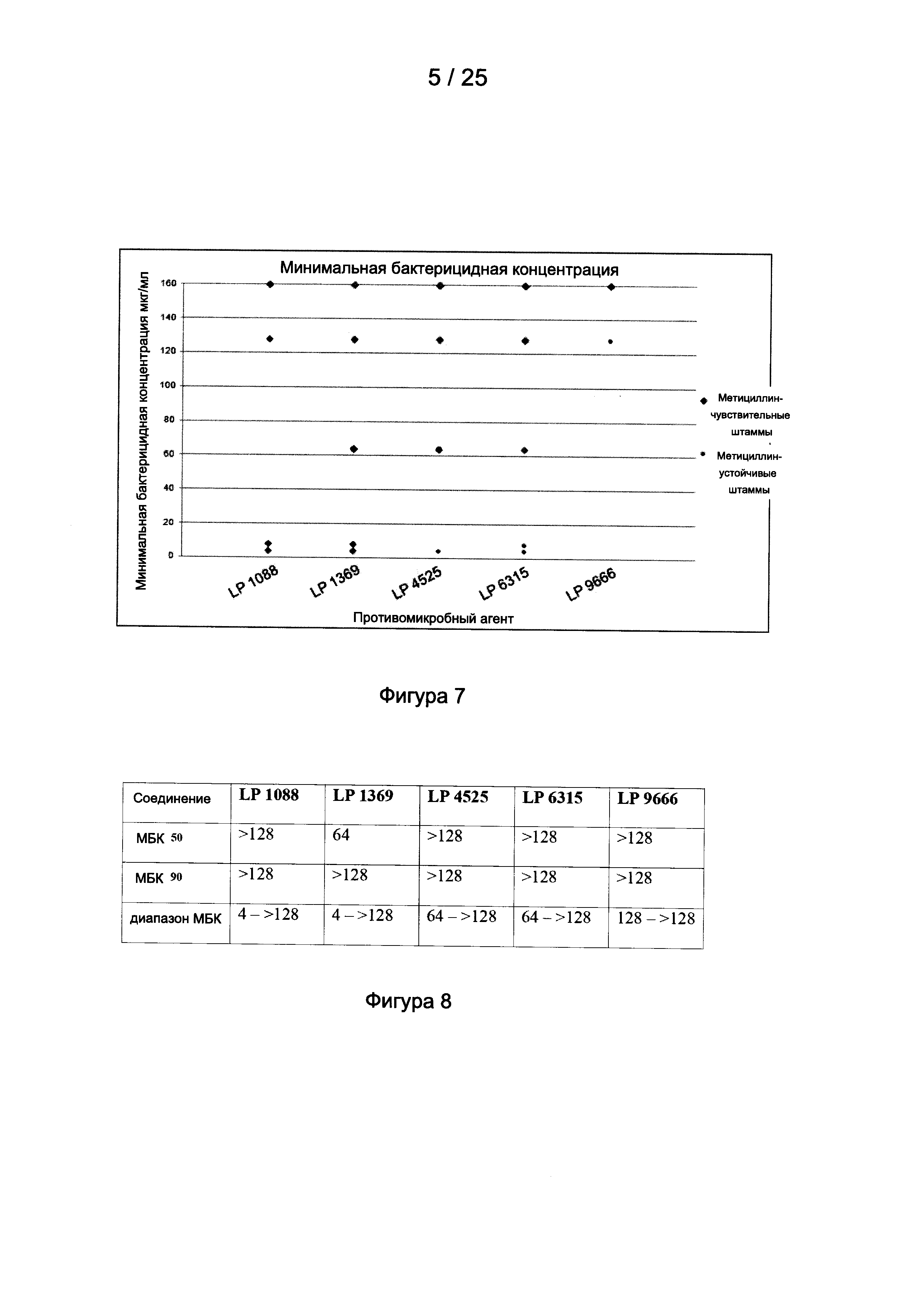
На Фигуре 7 приведен график минимальных бактерицидных концентраций (МБК) для отдельных штаммов, разделенных на метициллин-чувствительные и метициллин-устойчивые штаммы; значения выше 128 мкг/мл соответствуют штаммам, для которых не было получено значений МБК в диапазоне тестируемых концентраций (0,25-128 мкг/мл) в соответствии с Примером 1;
На Фигуре 8 приведена таблица, иллюстрирующая МБК50, МБК90 и диапазон МБК для метициллин-чувствительных штаммов для пяти тестируемых соединений в соответствии с Примером 1;
На Фигуре 9 приведена таблица, иллюстрирующая МБК50, МБК90 и диапазон МБК для метициллин-устойчивых штаммов для пяти тестируемых соединений в соответствии с Примером 1;
На Фигуре 10 приведен график, иллюстрирующий измерения оптической плотности, полученные для микроразведений в анализе время-элиминация (time-kill) для АТСС 49775 в течение 48 часов с использованием различных концентраций ампициллина, LP 1369 и LP 6315, по сравнению с кривой роста, в соответствии с Примером 1;
На Фигуре 11 приведен график, иллюстрирующий измерения оптической плотности, полученные для микроразведений в анализе time-kill для MSS 1 в течение 48 часов с использованием различных концентраций ампициллина, LP 1369 и LP 6315, по сравнению с кривой роста, в соответствии с Примером 1;
На Фигуре 12 приведен график, иллюстрирующий измерения оптической плотности, полученные для микроразведений в анализе time-kill для MSS 11 в течение 48 часов с использованием различных концентраций ампициллина, LP 1369 и LP 6315, по сравнению с кривой роста, в соответствии с Примером 1;
На Фигуре 13 приведен график, иллюстрирующий измерения оптической плотности, полученные для микроразведений в анализе time-kill для MRSA в течение 48 часов с использованием различных концентраций ампициллина, LP 1369 и LP 6315, по сравнению с кривой роста, в соответствии с Примером 1;
На Фигуре 14 приведен график, иллюстрирующий количество жизнеспособных колоний (log10) для АТСС 49775 в течение 24 ч при сравнении введения однократной, четырехкратной и восьмикратной МИК LP 1369, однократной и четырехкратной МИК ампициллина в соответствии с Примером 1;
На Фигуре 15 приведен график, иллюстрирующий количество жизнеспособных колоний (log10) для MRSA 9 в течение 24 ч при сравнении введения однократной, четырехкратной и восьмикратной МИК LP 1369, однократной и четырехкратной МИК ампициллина в соответствии с Примером 1;
На Фигуре 16 приведена таблица, в которой указано изменение количества КОЕ/мл (log10) для АТСС 49775 и MRSA 9 в течение 24 часов при различных концентрациях ампициллина или LP 1369, по сравнению с контрольными показателями роста в соответствии с Примером 1;
На Фигуре 17 приведен график, иллюстрирующий количество жизнеспособных колоний (log10) для АТСС 49775 в течение 24 ч при сравнении введения однократной, четырехкратной и восьмикратной МИК LP 6315, однократной и четырехкратной МИК ампициллина в соответствии с Примером 1;
На Фигуре 18 приведен график, иллюстрирующий количество жизнеспособных колоний (log10) для MRSA 9 в течение 24 ч при сравнении введения однократной, четырехкратной и восьмикратной МИК LP 6315, однократной и четырехкратной МИК ампициллина в соответствии с Примером 1;
На Фигуре 19 приведена таблица, в которой указано изменение количества КОЕ/мл (log10) для АТСС 49775 и MRSA 9 в течение 24 часов при различных концентрациях ампициллина или LP 6315, по сравнению с контрольными показателями роста в соответствии с Примером 1;
На Фигуре 20 показан график, иллюстрирующий показания оптической плотности, полученные в анализе токсичности эритроцитов для каждого испытуемого соединения при различных концентрациях, а также положительных и отрицательных контролей, и показания только для крови в соответствии с Примером 1; и
Фигура 21 представляет собой таблицу, в которой приведена коллекция изолятов и указаны породы собак, из которых они были получены, с последующей биохимической характеристикой изолятов Staphylococcus pseudintermedius, включая профиль устойчивости в соответствии с Примером 2;
Фигура 22 представляет собой таблицу, в которой приведен профиль устойчивости изолятов Staphylococcus pseudintermedius, собранных согласно Примеру 2;
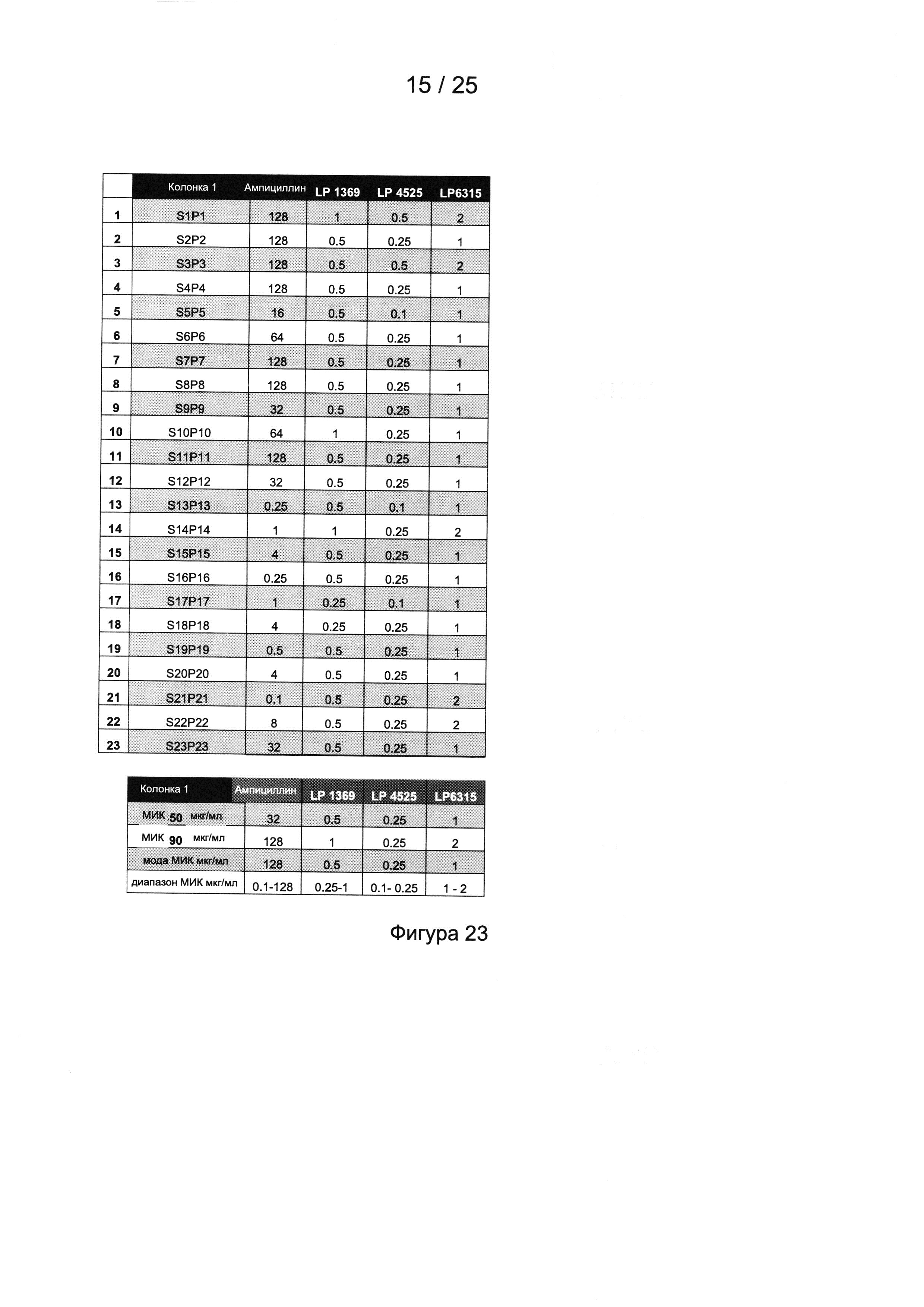
Фигура 23 представляет собой таблицу, в которой приведен профиль МИК для ампициллина и соединений LP в отношении изолятов Staphylococcus pseudintennedius, собранных согласно Примеру 2;
На Фигуре 24 представлено схематическое изображение, иллюстрирующее компоновку 96-луночного микротитрационного планшета для тестирования минимальной ингибирующей концентрации в соответствии с Примером 3;
Фигура 25 представляет собой таблицу, показывающую диапазон МИК50, МИК90, МИК и диапазон МБК50, МБК90 и МБК для каждого тестируемого соединения согласно Примеру 3;
Фигура 26 представляет собой таблицу, показывающую диапазон МИК50, МИК90, МИК и диапазон МБК50, МБК90 и МБК для каждого тестируемого соединения в отношении 14 изолятов Staphylococcus aureus согласно Примеру 3;
Фигура 27 представляет собой таблицу, показывающую диапазон МИК50, МИК90, МИК и диапазон МБК50, МБК90 и МБК для каждого тестируемого соединения в отношении шести коагулазонегативных изолятов Staphylococcus aureus согласно Примеру 3;
Фигура 28 представляет собой таблицу, показывающую диапазон МИК50, МИК90, МИК и диапазон МБК50, МБК90 и МБК для каждого тестируемого соединения в отношении 12 изолятов Staphylococcus agalactiae согласно Примеру 3;
Фигура 29 представляет собой таблицу, показывающую диапазон МИК50, МИК90, МИК и диапазон МБК50, МБК90 и МБК для каждого тестируемого соединения в отношении шести изолятов Staphylococcus uberis согласно Примеру 3;
Фигура 30 представляет собой таблицу, показывающую профили изолятов, полученных из мастита коров, в соответствии с Примером 3;
Фигура 31 представляет собой таблицу, показывающую МИК индивидуальных изолятов из мастита коров, в соответствии с Примером 3;
Фигура 32 представляет собой таблицу, показывающую МБК индивидуальных изолятов из мастита коров, в соответствии с Примером 3;
Фигура 33 представляет собой фотографию примера бритой шкуры на спине мыши в операционной области, используемой в исследованиях на мышах в Примере 5; и
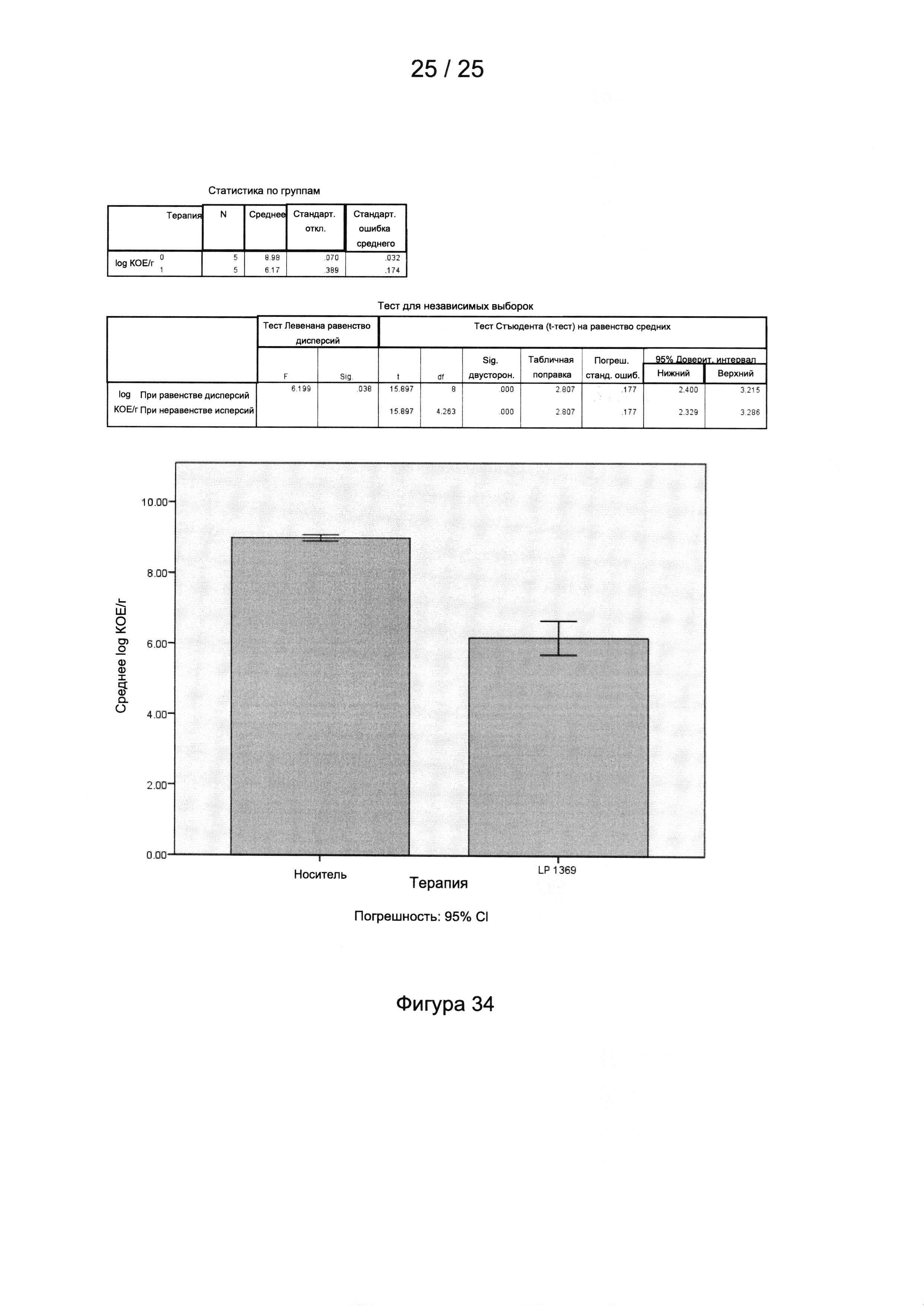
Фигура 34 включает в себя две таблицы, представляющие статистику по группам и график, представляющий результаты исследования, представленного в Примере 5.
ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
Общая часть
Перед описанием настоящего изобретения в деталях, следует понимать, что изобретение не ограничивается конкретными способами, приведенными в качестве примеров, или композициями, описанных в данном документе. Также следует понимать, что используемая здесь терминология предназначена только для описания конкретных вариантов реализации изобретения, и не является ограничивающей.
Все публикации, упоминаемые в настоящей заявке, в том числе патенты и заявки на патент, включены посредством ссылок в полном объеме. Однако, заявки, упомянутые в настоящем документе, приведены только в целях описания и раскрытия способов, протоколов и реагентов, указанных в публикации, которые, могут быть использованы в связи с настоящим изобретением. Цитирование какой-либо публикации в данном документе не следует толковать как признание того, что изобретение не имеет права датироваться более ранним числом на основании предшествующего изобретения.
Кроме того, при осуществлении настоящего изобретения специалистами в данной области техники используются, если не указано иное, стандартные микробиологические методы. Такие стандартные методы известны специалистам в данной области.
В настоящем описании и в прилагаемой формуле изобретения, формы слов, приведенные в единственном числе, включают также множественное число, если из контекста явно не следует иное.
Если не указано иное, все технические и научные термины, используемые здесь, имеют те же значения, которые обычно понятны среднему специалисту в области, к которой относится данное изобретение. Хотя для осуществления настоящего изобретения могут использоваться любые материалы и методы, аналогичные или эквивалентные тем, которые описаны в настоящей заявке, предпочтительные материалы и методы описаны в данном документе.
Изобретение, описанное в настоящей заявке, может включать один или несколько диапазонов значений (например, размер, концентрация, доза и т.д.). Следует понимать, что диапазон значений включает все значения в пределах диапазона, в том числе значения, определяющие диапазон, и значения, примыкающие к диапазону, которые обеспечивают такой же или по существу такой же результат, как и значения, непосредственно примыкающие к тому значению, которое определяет границу диапазона.
Выражение «терапевтически эффективное количество» при использовании в настоящей заявке относится к количеству, достаточному для ингибирования роста бактерий, связанного с бактериальным носительством или бактериальной инфекции кожи. То есть, упоминание введения терапевтически эффективного количества полиэфирных ионофоров согласно способам или композиций по настоящему изобретению относится к терапевтическому эффекту, в котором существенная бактерицидная или бактериостатическая активность вызывает существенное подавления бактериального носительства или бактериальной инфекции кожи. Термин «терапевтически эффективное количество» при использовании в настоящей заявке относится к нетоксичному, но достаточному для обеспечения желаемого биологического, терапевтического и/или профилактического результата количеству композиции. Желаемые результаты включают устранение бактериального носительства или уменьшение и/или облегчение признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Эффективное количество в каждом отдельном случае может быть определено одним из специалистов в данной области техники с использованием стандартных экспериментов. По отношению к фармацевтической или ветеринарной композиции, эффективные количества могут представлять собой дозы, рекомендуемые для изменения болезненного состояния или признаков, или их симптомов. Эффективные количества различаются в зависимости от применяемой фармацевтической или ветеринарной композиции и применяемого способа введения. Эффективные количества обычно оптимизированы с учетом различных факторов конкретного пациента, таких как возраст, вес, пол, и т.д., и области, подверженной заболеванию, или микроорганизмов, вызвавших заболевание.
Как указано в настоящем описании термины «микроорганизм/микроб» и «микробный» относятся к микроскопическому организму, включающему либо одиночные клетки, либо кластеры клеток, и охватывают, но не ограничены перечисленными, прокариотические формы, такие как бактерии и архебактерии; и эукариотические формы, такие как простейшие, грибы, водоросли. Предпочтительно термин «микроорганизм/микроб» и «микробный» относится к прокариотам и эукариотам. Прокариоты могут охватывать бактерий, таких как Staphylococcus spp, Streptococcus spp, Bacillus spp, Enterococcus spp, Listeria spp, Mycoplasma spp и анаэробные бактерии. Термины могут относиться к чувствительному к антибиотикам или устойчивому к антибиотикам штамму. В предпочтительном варианте реализации термины относятся к MRSA. В другом предпочтительном варианте реализации термины относятся к MRSP.
В одном варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более коагулазонегативных стафилококков (КНС): Staphylococcus epidermidis. Staphylococcus simulans, Staphylococcus felis, Staphylococcus xylosus, Staphylococcus chromogenes, Staphylococcus warneri, Staphylococcus haemolyticus, Staphylococcus sciuri, Staphylococcus saprophyticus, Staphylococcus hominis, Staphylococcus caprae,), Staphylococcus cohnii subsp. Cohnii, Staphylococcus cohnii subsp. urealyticus, Staphylococcus capitis subsp. capitis, Staphylococcus capitis subsp. urealyticus и Staphylococcus hyicus.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более из коагулазопозитивных стафилококков: Staphylococcus aureus, Staphylococcus pseudintermedius, Staphylococcus delphini, Staphylococcus schleiferi subsp. Coagulans и Staphylococcus aureus subsp. anaerobius.
В другом варианте реализации бактериальный агент относится к роду Streptococcus. Например, бактериальный агент может быть выбран из группы, включающей, но не ограниченной перечисленными, Streptococcus uberis, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus pyogenes, Streptococcus bovis, Streptococcus equi subsp. Zooepidemicus и Streptococcus equinus.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более из бактериальных агентов рода Bacillus: Bacillus melaninogenicus, Bacillus pumilus. Bacillus lichenifonnis, Bacillus cereus. Bacillus subtilise и Bacillus anthracis.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более из бактериальных агенту рода Enterococcus: Enterococcus faecium, Enterococcus faecalis и Enterococcus durans.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более из бактериальных агентов рода Listena, такому как Listeria monocytogenes.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одной или более из анаэробных бактерий: Clostridium perfringens, Actinomyces bovis, Propionibacterium acnes, Propionibacterium granulosum, Eubacterium, Peptococcus indolicus и Peptostreptococcus anaerobius.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более из видов рода Mycoplasma, такому как Mycoplasma bovis.
В другом варианте реализации термины «микроорганизм/микроб» и «микробный» относятся к одному или более из грибов рода Malassezia.
В другом варианте реализации термин «лечение» относится к полному или частичному снятию признаков и симптомов заболевания. Например, при лечении заболевания кожи, лечение полностью или частично снимает симптомы заболевания кожи. Предпочтительно при лечении заболевания кожи, ушного канала или глаза лечение уменьшает число клеток Staphylococcus aureus до менее 106,5 клеток/мл. Предпочтительно лечение уменьшает число клеток патогенных микроорганизмов до менее 106,5 клеток/мл, что в процентном соотношении представляет снижение по сравнению с уровнем до лечения представляет собой процент, выбранный из группы, включающей: уменьшение на 10%; на 20%; на 50%; 80%; на 90% и на 95%, на 99% и на более 99%.
Фармацевтически и ветеринарно приемлемые соли включают соли, которые сохраняют биологическую эффективность и свойства соединений согласно настоящему изобретению и которые не являются биологически или иным образом нежелательными. Во многих случаях соединения, описанные в настоящей заявке здесь, способны образовывать кислотные и/или основные соли в силу наличия амино- и/или карбоксильных групп, или групп подобных им. Фармацевтически и ветеринарно приемлемые соли присоединения основания могут быть получены из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают, в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничиваются перечисленными, соли первичных, вторичных и третичных аминов, таких как, только в качестве примера, алкиламины, диалкиламины, триалкиламины, замещенные алкиламины, ди- (замещенный алкил) амины, три (замещенный алкил) амины, алкениламины, диалкениламины, триалкениламины, замещенные алкениламины, ди- (замещенный алкенил) амины, три-(замещенный алкенил) амины, циклоалкиламины, ди- (циклоалкил) амины, три-(циклоалкил) амины, замещенные циклоалкиламины, дизамещенные циклоалкиламины, тризамещенные циклоалкиламины, циклоалкениламины, ди(циклоалкенил)амины, три(цикпоалкенил)амины, замещенные циклоалкениламины, дизамещенные циклоалкениламины, тризамещенные циклоалкениламины, ариламины, диариламины, триариламины, гетероариламины, дигетероариламины, тригетероариламины, гетероциклические амины, дигетероцикпические амины, тригетероциклические амины, смешанные ди- и триамины, где по меньшей мере два из заместителей у амина различаются между собой и выбраны из группы, включающей алкил, замещенный алкил, алкенил, замещенный алкенил, циклоалкил, замещенный циклоалкил, цикпоалкенил, замещенный циклоалкенил, арил, гетероарил, гетероцикпил, и т.п. Также охвачены амины, где два или три заместителя вместе с атомом азота из аминогруппы образуют гетероциклическую или гетероарильную группу.
Фармацевтически и ветеринарно приемлемые соли присоединения кислоты могут быть получены из неорганических и органических кислот. Неорганические кислоты, которые могут быть использованы для этой цели, включают, в качестве примера, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п.Органические кислоты, которые могут быть использованы для этой цели, включают, в качестве примера, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п.
Фармацевтически и ветеринарно приемлемые соли соединений, применяемых в настоящем изобретении, могут быть синтезированы из исходного соединения, которое содержит основную или кислотную группу, обычным химическими способами. Как правило, такие соли могут быть получены взаимодействием свободных кислотных или основных форм указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смеси двух. Как правило, предпочтительны неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Списки подходящих солей можно найти в справочнике Ремингтона Remington's Pharmaceutical Sciences. 17th ed., Mack Publishing Company, Easton, Pa. (1985), p.1418, включено в настоящее описание посредством ссылки. Примерами таких фармацевтически и ветеринарно приемлемых солей являются иодид, ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, γ-гидроксибутират, β-гидроксибутират, бутин-1,4-диоат, гексин-1,4-диоат, гексин-1,6-диоат, капроат, каприлат, хлорид, циннамат, цитрат, деканоат, формиат, фумарат, гликолат, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропионат, пропионат, фенилпропионат, салицилат, соль себациновой кислоты, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, пропансульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, р-толуолсульфонат, ксилолсульфонат, тартрат и т.п.
Следует понимать, что тип микробного носительства и инфекций, для лечения которых предназначены способы согласно настоящему изобретению, включают назальное носительство или колонизацию, инфекции кожи или подкожной клетчатки, раневые инфекции и какие-либо другие поверхностные микробные инфекцие, поражающие кожу. Такие инфекции кожи включают, но не ограничены перечисленными, акне, импетиго, фолликулит, фурункулез и карбункулез, эктиму, рожистое воспаление и целлюлит, некротический фасциит и пиодермию. Глазные инфекции включают, но не ограничены перечисленными, кератит и конъюнктивит, а ушные инфекции включают наружный отит, но не ограничены им.
Композиции, описанные в настоящей заявке, могут быть приготовлены для местного применения за счет заключения таких лекарственных форм в эмульсии «масло-в-воде» или эмульсии «вода-в-масле». В таком препарате лекарственная форма с быстрым высвобождением находится в непрерывной фазе, а лекарственная форма с замедленным высвобождением находится в виде дисперсной фазы. Также лекарственный препарат может быть приготовлен для доставки трех лекарственных форм, как описано выше. Например, может быть предусмотрена эмульсия «масло-в-воде-в-масле», при этом масло представляет собой непрерывную фазу, которая содержит компонент для немедленного высвобождения, диспергированная в масле вода содержит первую лекарственную форму с замедленным высвобождением, а диспергированное в воде масло содержит третью лекарственную форму с замедленным высвобождение.
Описанные в настоящей заявке композиции могут быть в форме жидкого состава. Жидкий состав может содержать раствор, который включает терапевтический агент, растворенный в растворителе. Как правило, можно применять любой растворитель, который имеет желаемый эффект, в котором растворяется терапевтический агент и который может быть введен субъекту. Как правило, можно применять любую концентрацию терапевтического агента, которая оказывает желаемое действие. В некоторых вариантах препарат представляет собой раствор, который является ненасыщенным, насыщенным или перенасыщенным. Растворитель может быть чистым растворителем или может быть смесью жидких компонентов растворителя. В некоторых вариантах раствор представлен в форме гелеобразующего in situ препарата. Растворители и типы растворов, которые можно применять, хорошо известны специалистам в области технологии доставки лекарств.
Композиции согласно настоящему изобретению могут быть введены местно. Таким образом, в настоящем изобретении предусмотрены для применения составы, адаптированные для прямого нанесения на кожу. Композиция может быть в форме, выбранной из группы, включающей суспензии, эмульсии, жидкости, кремы, масла, крема, мази, гели, гидрогели, пасты, пластыри, жидкости для шарикового аппликатора, пластыри, спреи, повязки со стеклянными шариками, синтетические полимерные повязки и твердые лекарственные формы. Например, композиции по настоящему изобретению могут быть предоставлены в виде композиции на водной основе или мази, основанной на органических растворителях, таких как масла. В качестве альтернативы, композиции по изобретению могут быть нанесены с помощью жидкостного спрея, содержащего пленкообразующие компоненты и по меньшей мере растворитель, в котором диспергированы или солюбилизированы полиэфирные ионофоры. Введение полиэфирных ионофоров в соответствии со способами и композициями согласно настоящему изобретению может быть осуществлено любыми подходящими средствами, с помощью которых возможно нанесение на кожу субъекта количества, достаточного для лечения микробной инфекции или для уменьшения роста микроорганизмов в месте инфекции. Полиэфирный ионофор может содержаться в любом соответствующем количестве и в любом подходящем носителе, и, как правило, присутствует в количестве 1-95% по массе от общей массы композиции. Фармацевтическая или ветеринарная композиция может быть приготовлена в соответствии со стандартной фармацевтической или ветеринарной практикой (см, например, Remington: The Science and Practice of Pharmacy, 20th edition, 2000, ed; A.R. Gennaro, Lippincott Williams & Wilkins, Philadelphia, and Encyclopedia of Pharmaceutical Technology, eds; J. Swarbrick and J.C. Boylan, 1988-1999, Marcel Dekker, New York; Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Company, Easton, Pennsylvania, USA).
Кроме того, настоящим изобретением предложено медицинское устройство в виде пластыря или губки, включающей дозированные лекарственные формы с полиэфирным ионофором, имеющие различные профили высвобождения, как описано выше.
Препараты, включающие композиции согласно настоящему изобретению, как альтернатива, могут быть составлены с применением методов доставки лекарств на основе нанотехнологий, таких, которые известны в данной области. Преимуществом систем доставки лекарств на основе нанотехнологий является улучшенная биодоступность, комплаентность пациента и снижение побочных эффектов.
Приготовление композиции настоящего изобретения включает приготовление наночастиц в виде наносуспензий или наноэмульсий, основанных на растворимости соединения. Наносуспензий представляют собой дисперсии наноразмерных частиц лекарственного средства, подготовленных на основе технологии «снизу вверх» или «сверху вниз» и стабилизированных с помощью подходящих вспомогательных веществ. Этот подход может применяться для полиэфирных ионофоров, описанных в настоящей заявке, где полиэфирный ионофор имеет низкую водную и липидную растворимость в целях повышения растворимости при насыщении и улучшения характеристики растворения. Растворимость при насыщении, как следует понимать, является константой, специфичной для конкретного соединения и зависящая от температуры, свойств среды для растворения и размера частиц (<1-2 мкм).
Композиция согласно настоящему изобретению может быть представлена в виде наносуспензии. Для наносуспензий увеличение площади поверхности может привести к увеличению растворимости при насыщении. Наносуспензии представляют собой коллоидные системы доставки лекарственных средств, состоящие из частиц менее 1 мкм. Композиции согласно настоящему изобретению могут быть в форме наносуспензии, включая нанокристаллические суспензии, твердые липидные наночастицы (solid lipid nanoparticles, SLNs), полимерные наночастицы, нанокапсулы, полимерные мицеллы, и дендримерз. Наносуспензии могут быть получены с использованием подхода «сверху вниз» таким образом, что более крупные частицы могут быть измельчены до манометровых размеров с помощью различных методов, известных в данной области, в том числе мокрого помола и гомогенизации при высоком давлении. В качестве альтернативы, наносуспензии могут быть получены с использованием технологии «снизу вверх» таким образом, что контролируемое осаждение частиц может осуществляться из раствора.
Композиция согласно настоящему изобретению может быть представлена в виде наноэмульсии. Наноэмульсии обычно представляют собой прозрачные двухфазные системы «масло-в-воде» или «вода-в-масле» с размером капель в интервале 100-500 нм, и при этом целевое соединение присутствует в гидрофобной фазе. Приготовление наноэмульсии может улучшить растворимость полиэфирных ионофоров, описанных в настоящей заявке, что обеспечивает лучшую биодоступность. Наноразмерные суспензии могут включать агенты для электростатической или стерической стабилизации, такие как полимеры и поверхностно-активные вещества. Композиции в форме SLN могут содержать биоразлагаемые липиды, такие как триглицериды, стероиды, воски и эмульгаторы, такие как соевый лецитин, яичный лецитин, и полоксамеры. Приготовление препаратов SLN может включать растворение/диспергирование лекарственного средства в расплавленном липиде с последующей горячей или холодной гомогенизацией. Если используется горячая гомогенизация, расплавленная липидная фаза может быть диспергирована в водной фазе, и таким образом получена эмульсия. Она может быть отверждена путем охлаждения до достижения SLN. При использовании холодной гомогенизации липидная фаза может быть отверждена в жидком азоте и измельчена до микронных размеров. Полученный порошок может быть подвергнут гомогенизации при высоком давлении в водном растворе поверхностно-активного вещества.
Композиции по изобретению могут быть в форме наноэмульсии. Полиэфирные соединения, как описано в настоящей заявке, могут быть растворены в маслах/ жидком липиде и стабилизированы с образованием препарата в виде эмульсии. Наноэмульсии могут быть получены с помощью высоко- и низкоэнергетических методов измельчения капель. Высокоэнергетические методы могут включать гомогенизацию при высоком давлении, ультразвуковую обработку и микрофлюидизацию. При использовании низкоэнергетических методов спонтанную наноэмульсию создает диффузия растворителя и инверсия фазы. Липиды, используемые в наноэмульсиях, могут быть выбраны из группы, включающей триглицериды, соевое масло, сафлоровое масло, кунжутное масло. Также могут быть добавлены другие компоненты, такие как эмульгаторы, антиоксиданты, модификаторы рН и консерванты.
Композиция может быть представлена в форме препарата с контролируемым высвобождением, и может включать разлагаемый или неразлагаемый полимер, гидрогель, органогель или другую физическую структуру, которая модифицирует высвобождение полиэфирного ионофора. Следует понимать, что такие композиции могут включать дополнительные неактивные ингредиенты, которые добавляют для обеспечения желаемого цвета, стабильности, буферной емкости, дисперсии или других известных желательных характеристик. Такие препараты могут дополнительно включать липосомы, такие как эмульсии, пены, мицеллы, нерастворимые монослои, жидкие кристаллы, фосфолипидные дисперсии, пластинчатые слои и т.п. Липосомы для применения в настоящем изобретении могут быть изготовлены из стандартных образующих везикулы липидов, как правило, включающих нейтральные и отрицательно заряженные фосфолипиды и стерол, такой как холестерин.
Композиции согласно изобретению могут быть в форме твердой дисперсии. В данном описании, если из контекста не следует иного, слово «содержать» или его формы, такие как «содержит» или «содержащий», подразумевает включение указанного элемента или группы элементов, но не исключение любого другого элемента или группы элемента.
ПРИМЕР 1 - Антибактериальная активность против штаммов Staphylococcus
Специальные сведения
Как видно из предыдущего описания изобретения, изобретение относится к способам лечения микробных инфекций кожи и подкожной клетчатки у субъектов, таких как люди, домашние животные (например, собаки) и домашний скот (например, бычьи). Также из предыдущего описания изобретения очевидно, что изобретение также относится к композициям, применяемым в таких способах лечения местных микробных инфекций.
Следует понимать, что системное воздействие на субъекта, подлежащего лечению в соответствии со способами лечения по настоящему изобретению или с помощью композиций, описанных в настоящей заявке, должно быть сведено к минимуму, чтобы уменьшить токсические эффекты действия терапевтически эффективных количеств полиэфирных ионофоров. Следует иметь в виду, что роговой слой кожи, stratum corneum, функционирует как физический барьер для поглощения терапевтически эффективных количеств полиэфирных ионофоров, входящих в составы, которые специальным образом приготовлены для локализованной противомикробной активности и снижения токсических эффектов.
Материалы и методы
Сбор и идентификация бактериальных изолятов
Из коллекции изолятов были собраны сорок два изолята Staphylococcus различных видов и типов штаммов. Для идентификации видов Staphylococcus были использованы биохимические тесты, в том числе анализ коагулазы, латекс-агглютинация, тест на белок А, тест Vogues-Proskauer и оценка устойчивости к полимиксину В. Также был проведен скрининг всех штаммов на устойчивость к различным противомикробным препаратам, обычно используемых для лечения кожных инфекций. Он был осуществлен с помощью дискодиффузионного метода и стандартов устойчивости, изложенных в CLSI. Были использованы следующие противомикробные препараты: амоксициллин-кпавулановая кислота (30 мкг), цефалотин (30 мкг), клиндамицин (2 мкг), энрофлоксацин (5 мкг), эритромицин (15 мкг), гентамицин (10 мкг), имипенем (10 мкг), оксациллин (1 мкг), пенициллин G (10 единиц), тетрациклин (30 мкг), 1:19 триметоприм-сульфаметоксазол (25 мкг) и ванкомицин (30 мкг). Все штаммы, устойчивые к оксациллину, также оказались устойчивыми к амоксициллин-клавулановая кислоте, цефалотину и имипенему, и они были определены как метициллин-устойчивые штаммы. Профили всех изолятов приведены на Фигуре 1.
Подготовка противомикробных препаратов
Для каждого из пяти тестируемых соединений готовили исходный раствор 256 мг/мл путем растворения 2,56 г вещества в 10 мл диметилсульфоксида (ДМСО). Полученный раствор затем делили на аликвоты объемом 500 мкл и хранили при -80°С до использования. Стоковый раствор 256 мг/мл ампициллина также получали растворением 0,303 г ампициллина (SigmaA-0166) в 10 мл ДМСО. Этот раствор разделяли на аликвоты и хранили таким же образом, как и пять тестируемых соединений. По мере необходимости готовили рабочий раствор соединений с концентрацией 256 мкг/мл путем разбавления 100 мкл стокового раствора (25,6 мг/мл) в 9,9 мл среды Мюллера-Хинтона со стандартизированным содержанием катионов (САМНВ).
Оценка минимальной ингибирующей концентрации
Оценку минимальной ингибирующей концентрации проводили в соответствии со стандартами CLSI (CLSI 2012). 90 мкл раствора одного из тестируемого соединений или ампициллина добавляли в крайнюю колонку 96-луночного планшета, в каждой лунке которого содержалось 90 мкл САМНВ. Затем проводили последовательное разбавление растворов вдоль ряда, оставляя 2 колонки для положительных и отрицательных контролей (Фигура 2). Бактериальную суспензию готовили добавлением свежих колоний, полученных из ночной культуры на овечьем кровяном агаре (SBA) к 9,1 г/л солевого раствора. Эту суспензию доводили до концентрации от 4×108 до 5×108 КОЕ/мл. Концентрацию суспензии определяли путем измерения оптической плотности (OD) с использованием спектрофотометра при длине волны 600 нм, при этом необходимая концентрация суспензии имела оптическую плотность от 1,00 до 1,20.1 мл этой суспензии добавляли к 9 мл физиологического раствора, после чего ее добавляли во все лунки, за исключением лунок с отрицательным контролем, в объеме 10 мкл с получением конечной концентрации от 4×105 до 5×105 КОЕ/мл в каждой лунке. Тестируемые образцы инкубировали в течение 24 часов при 37°С и затем оценивали визуально, а также с помощью планшет-ридера, оценивающего OD при длине волны 600 нм. Тестирование проводили в двух повторностях, и повторяли, если наблюдалось расхождение в показаниях.
Минимальную ингибирующую концентрацию (МИК) определяли как наименьшую концентрацию антибиотика, предотвращающую рост бактерий визуально и на основе показаний OD. Прямые статистические сравнения между испытуемыми соединениями и ампициллинам не проводили в связи с ограничениями по конфиденциальности информации, в том числе с ограничения по раскрытию информации, относящейся к структуре соединения и его молекулярному весу. Вместо этого проводили сравнение значений МИК и определяли наименьшую концентрацию каждого соединения, которая была эффективной против 50% и 90% изолятов, то есть МИК50 и МИК90, соответственно. Эти значения, а также ряд значений МИК затем использовали для прямого сравнения испытуемых соединений, а также для общего сравнения с ампициллином.
Определение минимальной бактерицидной концентрации
После определения МИК с использованием 96-луночного планшета МИК для определения минимальной бактерицидной концентрации (МБК) для каждого из тестируемых соединений использовали вариант капельно-чашечного метода. МБК оценивали с использованием образцов, взятых с планшета МИК после инкубации. Для каждого соединения каплю 10 мкл каждой концентрации, равной или выше МИК, наносили при помощи пипетки на овечий кровяной агар в направлении по часовой стрелке (Фигура 3). Каплю с каждой из анализируемых концентрацией наносили на чашку с помощью пипетки в двух повторностях, при этом вторую повторность раскапывали на внутреннем кольце капель. Чашки инкубировали при 37°С в течение ночи и рост оценивали на следующий день. МБК определяли как концентрацию, при которой было уничтожено 99,9% колоний на основании визуальной оценки по отсутствию роста на агаре в месте, где была размещена капля. На основании этих данных для некоторых соединений можно предположить наличие бактерицидного действия. Рассчитывали значения МБК для 50% и 90% изолятов (МБК50 и МБК90) и оценивали вместе с диапазоном МБК соединения для отбора соединений для дальнейшего исследования.
Анализ динамики время-элиминация (time-kill kinetics)
После оценки МИК и МБК были выбраны два соединения для анализа «время-элиминация» (time-kill assay) с использований микроразведений, LP 1369 и LP 6315, и было проведено их сравнение с ампициллином. Анализ «время-элиминация» проводили в соответствии с рекомендациями М26-а от CLSI, с модификациями. Готовили серию разведении тестируемого соединения и ампициллина в САМНВ вдоль ряда 96-луночного планшета, и добавляли бактериальную суспензию таким же образом, как для оценки МИК. После этого 96-луночные планшеты инкубировали при 37°С в течение 48 часов, при этом через определенные промежутки времени проводили оценку OD для лунок с положительным контролем, а также для лунок с однократной, четырехкратной и восьмикратной МИК концентрацией соединения, характерной для тестируемого штамма, с использованием спектрофотометра при длине волны 600 нм. Оценку проводили на следующих временных интервалах: 0, 1, 2, 4, 8, 12, 24 и 48 часов после добавления бактериальной суспензии в лунки. Каждое тестируемое соединение тестировали в трех повторностях, а для ампициллина проводили анализ в двух повторностях, и такой тест повторяли дважды независимо. Бактериальные штаммы, используемые для анализа микроразведений, были выбраны на основе бактерицидной активности, выявленной в ходе оценки МБК. Был выбран один штамм из каждой категорий коллекции изолятов Staphylococcus (метициллин-чувствительный, резистентный к метициллину и коагулазоотрицательный), а также референсный штамм АТСС для сравнения. Были выбраны следующие штаммы: MSS 1, MSS 11, MRSA 9 и референсный штамм АТСС 4977.
Из-за ограничений, связанных с пределом измерений OD, анализ «время-элиминация» также в макроразведениях. В 15 мл пробирках готовили по 9 мл раствора тестируемого соединения в САМНВ в концентрации, соответствующей однократной, четырехкратной и восьмикратной концентрации МИК, а также 9 мл ампициллина в САМНВ с однократной и четрехкратной МИК. В каждую из пробирок добавляли 1 мл от 4 до 5×106бактериальной суспензии (приготовленной так же, как для оценки МИК), а также оставляли одну контрольную пробирку для оценки роста, содержащую только 9 мл САМНВ. Пробирки инкубировали при 37°С в орбитальном шейкере со скоростью 100 об/мин в течение 24 часов. Через 0, 1, 4, 8, 12 и 24 ч после добавления бактерий из каждой пробирки брали по 100 мкл образцов, и готовили серийное разведение в солевом растворе 9,1 г/л. После этого полученные разведения высевали в двух повторностях на агар для подсчета колоний (plate count agar) и инкубировали в течение 24 часов при 37°С. После инкубации оценивали жизнеспособные колонии микроорганизмов на основании числа колоний, видимых на агаре, и использовали это значение для расчета количества КОЕ/мл в каждый момент времени. Для анализа «время-элиминация» в макроразведениях использовали только референсный штамм АТСС 49775 и MRSA 9 с целью дальнейшей оценки бактерицидной активности против метициллин-резистентные штаммы. Анализ «время-элиминация» с макроразведениями повторяли независимо, и бактерицидную активность определяли как ≥3 log уменьшение числа КОЕ/мл.
Тестирование токсичности в отношении эукариотических клеток
Для оценки токсичности всех пяти соединений в отношении эукариотических клеток использовали гемолиз эритроцитов. Образцы крови промывали с помощью солевого раствора 9,1 г/л и центрифугировали при 2500 об/мин в течение 10 минут. Этот процесс повторяли до удаления из раствора клеточных остатков и частично лизированных клеток. 2 мл оставшихся клеток крови суспендировали в 98 мл солевого раствора 9,1 г/л с получением 2%-ного раствора клеток крови, который наносили в объеме 90 мкл в лунки 96-луночного планшета. Растворы соединений, а также к хлорамфеникола, готовили из стокового раствора с концентрацией 256 мкг/мл (как описано выше). Хлорамфеникол использовали в качестве отрицательного контроля для лизиса эритроцитов, а готовый к употреблению раствор амфотерицина В использовали в качестве положительного контроля. Затем в разных ряды лунок добавляли по 90 мкл раствора соединений и контролей. Указанные соединения серийно разводили вдоль ряда для оценки различных концентраций противомикробных препаратов. Лунки, содержащие только 2%-ный раствор крови, также использовали для оценки различий между показаниями различных столбцов 96-луночного планшета. Анализируемые образцы инкубировали при 37°С в течение одного часа, а затем оценивали лизиса визуально и с помощью планшет-ридера для измерения оптической плотности при длине волны 600 нм. Каждый образец анализировали в двух повторностях, и затем повторяли в четырех повторности для большей точности оценки.
Результаты
Результаты оценки МИК подтвердили антибактериальную активностью для всех исследуемых соединений в отношении как метициллин-чувствительных, так и метициллин-устойчивых стафилококков. Все тестируемые соединения демонстрировали постоянно низкие значения МИК (меньше или равно 16 мкг/мл) в отношении всех штаммов, за исключением соединения LP 9666, как показано на Фигуре 4. Наблюдались вариации МИК для соединения LP 9666, о чем свидетельствует высокое значение МИК90 и широкий диапазон МИК. В то время как диапазон значений МИК был таким же, как для ампициллина, различий между метициллин-устойчивыми и метициллин-чувствительными штаммами, как это наблюдалось для значений МИК для ампициллина, выявлено не было. MHK50, МИК90 и диапазоны МИК для метициллин-чувствительных штаммов Staphylococcus показаны на Фигуре 5. Значения МИК50 для большинства тестируемых соединений, за исключением LP 9666, были сопоставимы с ампициллином, тогда как значения МИК90 были значительно ниже. Схожий результат также был отмечен для диапазонов МИК для тестируемых соединений в отношении всей коллекции штаммов, и были выявлены меньшие диапазоны, по сравнению с ампициллином, для всех тестируемых соединений, кроме LP 9666. Аналогичная тенденция наблюдалась и в отношении метициллин-устойчивых изолятов, как показано на Фигуре 6. Соединения LP 1088, 1369, 4525 и 6315 характеризовались значениями МИК50 и МИК90 значительно более низкими, чем ампициллин, а также узкими диапазонами МИК. Однако, хотя LP 9666 показал более высокие значения МИК50 и МИК90, чем четыре остальные тестируемые соединения, они были значительно ниже, чем для ампициллина в отношении метициллин-устойчивых штаммов.
Все пять тестируемых соединений демонстрировали бактерицидную активность в высоких концентрациях, но соединения LP 1088, 1369, 4525 и 6315 также показали некоторую бактерицидную активность в низких концентрациях. Соединения LP 1088 и 1369 демонстрировали бактерицидную активностью более согласованно в отношении метициллин-чувствительных штаммов, а соединения LP 4525 и 6315 демонстрировали бактерицидную активностью более согласовано в отношении метициллин-чувствительных штаммов, как показано на Фигуре 7.
Сравнение МБК50, МБК90 и диапазонов МБК для пяти тестируемых соединений для метициллин-чувствительные и метициллин-устойчивых штаммов показано на Фигурах 8 и 9, соответственно. Значения МБК50 и МБК90 показали, хотя была обнаружена некоторая зависимая от штамма бактерицидная активность для тестируемых соединений при низких концентрациях, большинство соединений оказывали бактериостатическое действие в отношении большинства штаммов. Наибольшая бактерицидная активность наблюдалась для соединений LP 1369 в отношении метициллин-чувствительных изолятов и для LP 6315 в отношении метициллин-устойчивых изолятов, так как эти соединения показали самые низкие значения МБК50, несмотря на схожий диапазон МБК.
В анализе «время-элиминация» для микроразведений оба соединения, LP 1369 и LP 6315, предотвращали рост референсного штамма АТСС течение 48-часового периода, по сравнению с контрольным ростом (Фигура 10). Некоторый рост наблюдался после 48 часов для LP 6315 при МИК, но он по-прежнему был значимо меньше, чем для контроля. Аналогичные тенденции наблюдались при анализе элиминации, выполненных для метициллин-чувствительных штаммов MSS 1 и MSS 11 (Фигуры 11 и 12, соответственно). Для референсного штамма АТСС все соединения предотвращали рост бактерий до уровня контрольного роста и, в большинстве концентраций, предотвращали рост выше начальной концентрации. Однако, для штамма АТСС рост наблюдался при МИК для LP 6315, но наблюдался на 24 часа раньше, и продолжал расти к заключительным 24 часов. Аналогичная тенденция наблюдалась и для МИК для ампициллина в отношении MSS 11, но увеличение числа бактерий в последние 24 часов было намного круче, чем для LP 6315 при 1×МИК в анализе «время-элиминация». Для анализа «время-элиминация» для MRSA 9 (Фигура 13), увеличение количества бактерий после 12 часов было заметно для ампициллина, и в результате роста после 48 часов было сопоставимо с ростом в контроле. Однако, в то время как увеличение для 1×МИК LP 6315 было заметно после 24 часов, а после 48 часов рост больше не наблюдался.;
Дальнейший анализ «время-элиминация» для макроразведений показал относительно постоянное снижение числа жизнеспособных бактерий, по сравнению с первоначальным 24-часовым периодом, для обоих тестируемых соединений, независимо от штамма. На Фигурах 14 и 15 показано, что эффект соединения LP 1369 на количество бактерий, является значимым, по сравнению с ростом в контроле на всех испытанных концентрациях, но, это соединение показало более высокую эффективность при четырехкратной МИК, чем при восьмикратной МИК для обоих штаммов, MRSA 9 и референсного штамма АТСС 49775. Оценивали общее уменьшение количества бактерий, как показано на Фигуре 16. Как и следовало ожидать, ампициллин оказывал бактерицидное действие в отношении обоих штаммов, поскольку уменьшение количества жизнеспособных бактерий было >3-log10, а соединение LP 1369 показало бактериостатическое действие для всех концентраций, поскольку уменьшение количества жизнеспособных бактерий было <3-log10.
Аналогичная тенденция, как и для LP 1369, наблюдалась для LP 6315. Для референсного штамма АТСС (Фигура 17), наблюдалось постоянное снижение количества бактерий в течение 24-часового периода для всех трех концентраций исследуемого соединения. Для MRSA 9, как показано на Фигуре 18, все концентрации приводили к снижению количества бактерий в течение первых 12 часов, но для МИК рост наблюдался между 12 и 24 часов. При количественной оценке такого снижения (Фигура 19), для ампициллина, как и ожидалось, было показано бактерицидное действие, тогда как большинство концентрации LP 6315 оказывали бактериостатическое действие. Однако при четырехкратной МИК LP 6315 демонстрировало бактерицидное действие в отношении MRSA, поскольку уменьшение числа колоний было >3-log10.
Показания оптической плотности в анализе токсичности в отношении эукариотических клеток приведены на Фигуре 20. Уменьшение оптической плотности интерпретировали как показатель лизиса эритроцитов. Хотя наблюдали снижение оптической плотности для всех тестируемых соединений в концентрации 32 мкг/мл и выше, для всех соединений, кроме LP 1369, это снижение не было статистически значимым, поскольку снижение было сравнимо с действием хлорамфеникола, и поскольку при этих концентрациях не наблюдали лизиса эритроцитов. Хотя уровень лизиса был не таким высоким, как для амфотерицина В, в случае соединения LP 1369 наблюдался некоторые лизис клеток в диапазоне концентраций 32 - 128 мкг/мл, но визуально он был наиболее заметен при 64 мкг/мл.
ПРИМЕР 2 - Антибактериальная активность против изолятов из кожных повреждений
Изоляты Staphylococcus pseudintennedius были собраны из кожных повреждений различных пород собак. Наличие гена тес и профиль устойчивости определяли в соответствии с Материалами и методами, описанными в Примере 1.
На Фигуре 21 показаны результаты ОТ-ПЦР по определению присутствия гена mecA и профиль устойчивости к различным антибиотикам. На Фигуре 22 представлен профиль устойчивости всех полученных изолятов. На Фигуре 23 приведены результаты тестирования ампициллина LP1369, LP 4525 и LP6315 против каждого изолята, а также приведены значения МИК50, МИК90, мода МИК и диапазон МИК.
ПРИМЕР 3 - Антибактериальная активность против изолятов из коровьего мастита Краткое описание
Пять противомикробных агентов, LP 1088, LP 1369, LP 4525, LP, 6315 и 9666 LP, были протестированы против 51 изолятов, полученных из мастита австралийских коров, в первую очередь патогенные виды S. aureus, S. agalactiae и S. uberis. Соединение LP4525 характеризовалось самыми низкими МИК50 и МИК90 (0,25 мкг/мл и 1 мкг/мл, соответственно). Для LP1088, LP1369, LP6315 и LP9666 были определены МИК90, равные 2 мкг/мл, 4 мкг/мл, 4 мкг/мл и 128 мкг/мл, соответственно. Все протестированные противомикробные соединения показали значения МБК, что указывает на то, что эти соединения оказывают бактериостатическое действие против патогенов мастита. Соединение LP4525 оказалось наиболее перспективным кандидатом как интрамаммарный противомикробный агент для лечения мастита у коров, вызванного инфекцией грамположительными бактериями.
Материалы и методы
Сбор и идентификация бактериальных изолятов
Из образцов молока, собранных на молочных фермах в сельских районах Южной Австралии Амбулатоной клиникой Университета, была собрана коллекция из пятьдесят одного изолята из мастита коров, охватывающая различные виды бактерий. Определение видов Staphylococcus, Streptococcus и Corynebacterium из грамотрицательных видов проводили на основании морфологии клеток после окрашивания по Граму и анализа каталазы. Для определения изолятов на видовом уровне использовали биохимический анализ, включая анализ коагулазы, определение группа по Лэнсфилд, гидролиз эскулина и тест CAMP. В случае, если биохимические тесты не давали окончательных результатов в определении видов, для подтверждения идентичности изолятов проводили амплификацию и секвенирование гена 16S рибосомной РНК.
Подготовка противомикробных препаратов
Для каждого из пяти тестируемых соединений готовили стоковый раствор с концентрацией 256 мг/мл путем растворения 2,56 г соединения в 10 мл диметилсульфоксида (ДМСО). Полученный раствор затем разделяли на аликвоты объемом 500 мкл и хранили при -80°С. Также готовили 256 мг/мл стоковый раствор ампициллина путем растворения 0,303 г ампициллина (Sigma A-0166) в 10 мл ДМСО. Этот раствор разделяли на аликвоты и хранили таким же образом, как и пять тестируемых соединений. При необходимости готовили рабочий раствор с концентрацией 256 мкг/мл путем разбавления 100 мкл стокового раствора (25,6 мг/мл) в 9,9 мл среды Мюллера-Хинтона со стандартизированным содержанием катионов (САМНВ).
Оценка минимальной ингибирующей концентрации
Оценку минимальной ингибирующей концентрации проводили в соответствии со стандартами CLSI (CLSI 2012). Тестируемые соединения наносили в лунки 96-луночного микротитровального планшета, содержащие 90 мкл САМНВ в объеме 90 мкл и делали серийные разведения с получением градиента концентрации в диапазоне от 128 мкг/мл до 0,25 мкг/мл (см. Фигуру 24). Для видов Streptococcus среду САМНВ заменяли на среду САМНВ с добавлением 4% лизированной овечьей крови (4% LSB: САМНВ). 4% LSB: САМНВ готовили путем смешивания 5 мл овечьей крови в 5 мл воды MilliQ и повторного замораживания при -20°С и оттаивания с последующим центрифугированием в течение 20 мин при 7000 об/мин 7 мл супернатанта удаляли и добавляли к 93 мл САМВ.
Бактериальные суспензии получали путем эмульгирования свежих колоний из ночной культуры, выращенной на овечьем кровяном агаре (SBA) в 4 мл 9,1 г/л физиологического раствора до оптической плотности от 1,00 до 1,20 при 600 нм (OD600nm). Стандартизированные бактериальные суспензии разводили 1:10 в физиологическом растворе и раскапывали во все лунки, за исключением лунок с негативным контролем, по 10 мкл с получением конечной концентрации между 4×105 и 5×105 КОЕ/мл в каждой лунке. 96-луночные планшеты инкубировали в течение 24 часов при 37°С в 5% CO2 и затем оценивали визуально и на основании значений оптической плотности, полученных с помощью планшет-ридера при длине волны 600 нм. Данный анализ проводили в двух повторностях и повторяли, если между повторами наблюдались расхождения в значениях МИК.
Минимальную ингибирующую концентрацию (МИК) определяли как наименьшую концентрацию антибиотика, предотвращающую рост бактерий визуально и на основе показаний 00. Значения МИК сравнивали и определяли наименьшую концентрацию каждого соединения, которая была эффективна против 50% и 90% изолятов, то есть МИК50 и МИК90, соответственно. Эти значения, а также ряд значений МИК затем использовали для прямого сравнения испытуемых соединений, а также для общего сравнения с ампициллином.
Определение минимальной бактерицидной концентрации
После определения МИК для определения минимальной бактерицидной концентрации (МБК) для каждого из тестируемых соединений использовали вариант капельно-чашечного метода. МБК оценивали, нанося аликвоты капель 10 мкл каждой концентрации из микротитровального планшета на SBA, и инкубировали при 37°С в течение 16 часов. МБК определяли как концентрацию, при которой было уничтожено 99,9% колоний на основании визуальной оценки по отсутствию роста на агаре в месте, где была размещена капля. Рассчитывали значения МБК для 50% и 90% изолятов (МБК50 и МБК90) и оценивали вместе с диапазоном МБК соединения для отбора соединений для дальнейшего исследования.
Результаты
Антибактериальная активность против изолятов, полученных из мастита коров, наблюдалась для всех пяти тестовых соединений, LP 1088, LP 1369, LP 4525, LP 6315 и LP 9666. Соединение LP4525 показало низкое значение МИК90 (1 мкг/мл). Значения LP1088, LP1369 и LP6315 были на 1 -2 разведения выше, тогда как значение для LP9666 было выше на несколько разведении (Фигура 25). В отличие от низких значений МИК90, полученных для 4 из 5 соединений, высокие значения МБК90, полученные для всех соединений, свидетельствуют о том, что все соединения оказывают по большей части бактериостатическое действие, хотя для некоторых штаммов наблюдалась бактерицидная активность при достаточно низких концентрациях выше МПК (2-8 мкг/мл). Значения МИК и МБК в отношении отдельных изолятов для всех пяти соединений приведены на Фигуре 31 и Фигуре 32.
При анализе данных МИК и МБК в зависимости от вида изолятов стало очевидно, что значения MHK50 и МИК90 являются более низкими для видов Streptococcus, по сравнению с видами Staphylococcus (Фигуры с 26 по 30). Однако диапазоны МИК указывают на то, что различия между двумя группами патогенов не являются значимыми. Значения МБК также сильно варьируют в пределах вида, при этом некоторые штаммы стафилококков и стрептококков эффективно элиминируются при концентрациях незначительно выше МИК (например, для LP4525 и LP6315), но значимых различий между видами выявлено не было.
Предварительные результаты этого исследования свидетельствую о том, что все пять соединения проявляют бактериостатическую активность, при этом некоторые соединения проявляют зависимую от штамма бактерицидную активностью в высоких концентрациях. Хотя все соединения демонстрировали некоторую мутность при разведении в среде Мюллера-Хинтона со стандартизированным содержанием катионов, соединения LP1088, LP1369, LP4525 и LP6315 все характеризовались низкими значениями МИК. Соединение LP9666, однако, характеризовалось значительно более высокими значениями МИК90 для каждой из групп патогенов, вызывающих мастит, и возможно, это было обусловлено образованием значительного количества осадка при разведении в среде Мюллера-Хинтона со стандартизированным содержанием катионов. Соединение LP4525 характеризовалось самыми согласованными значениями МИК для всех изолятов, и об этом свидетельствует небольшой диапазон МИК. LP4525 также характеризовалось меньшими значениями, по сравнению с МИК90 для всех других соединений. Мы также обнаружили, что один изолят грамотрицательных бактерий (изолят 2825) в коллекции был чувствителен к действию всех пяти соединений.
Пример 4 - Получение препарата для местного применения для исследования, представленного в Примере 5
Состав мази
Для нанесения на кожу соединения LP1369 в исследований на мышах, представленных в Примере 5, готовили следующий состав:
Парафиновое масло 49,0 г
Вазелин 49,0 г
LP1369 2,0 г
LP1369 и парафиновое масло смешивали и помещали в шаровую мельницу (модель Micro Mill Pulverisette 7 Premium Line, Fritsch Co., Rhineland-Palatinate, Germany) и 35 измельчали путем мокрого размола при 1000 об/мин в течение 10 циклов, длительностью 3 минуты на цикл, при времени измельчения 0,5 часа. После измельчения размер частиц лекарственного средства составлял 1-6 мкм. Полученную суспензию отделяли от шариков для измельчения с использованием одноразовой пластиковой пипетки. Вазелин нагревали при 100°С до его расплавления, а затем охлаждали (при комнатной температуре) до 50°С. Суспензию LP1369/парафиновое масло капали в вазелин, и композицию гомогенизировали при 50°С до образования однородной мази.
Другие возможные составы, воплощенные в настоящем изобретении, включают:
Состав мази
Состав геля
Состав крема
ПРИМЕР 5 - Эффективность экспериментальных ветеринарных продуктов, содержащих LP1369, в лечении состояния кожи у мышей
Краткое описание модели: Применяемая модельная система на животных должна быть клинически релевантной, экспериментально надежной, приемлемой с этической точки зрения, удобной в осуществлении, и она должна давать надежные и воспроизводимые результаты. Описано много моделей на животных для изучения местных инфекций кожи, в том числе модель «кротоновое масло-воспаленная кожа» (Akiyama, Н., Н. Kanzaki, Y. Abe, J. Tada and J. Arata (1994). "Staphylococcus aureus infection on experimental croton oil-inflamed skin in mice." Journal of Dermatological Science 8(1): 1-10), модель «обожженной кожи» (Stieritz, D.D., A. Bondi, D. McDermott and E.B. Michaels (1982). "A burned mouse model to evaluate anti-pseudomonas activity of topical agents." Journal of Antimicrobial Chemotherapy 9(2): 133-140), модель «кожный шов-рана» (McRipley, R.J. and R.R. Whitney (1976). "Characterization and Quantitation of Experimental Surgical-Wound Infections Used to Evaluate Topical Antibacterial Agents." Antimicrobial Agents and Chemotherapy 10(1):38-44), модель с использованием липкой ленты (Kugelberg, E., Т. Norstrom, Т.K. Petersen, Т. Duvold, D.I. Andersson and D. Hughes (2005). "Establishment of a Superficial Skin Infection Model in Mice by Using Staphylococcus aureus and Streptococcus pyogenes." Antimicrobial Agents and Chemotherapy 49(8): 3435-3441) и метод линейного надреза скальпелем на всю толщину кожи (Guo, Y., R.I. Ramos, J.S. Cho, N.P. Donegan, A.L. Cheung and L.S. Miller (2013). "In Vivo Bioluminescence Imaging To Evaluate Systemic and Topical Antibiotics against Community-Acquired Methicillin-Resistant Staphylococcus aureus-lnfected Skin Wounds in Mice." Antimicrobial Agents and Chemotherapy 57(2): 855-863).
В ходе предварительных исследований перед проведением настоящего исследования был разработан новый метод инфицирования кожи в результате детального изучения моделей, упомянутых выше. Вкратце, мышей анестезировали, выстригали участок шкуры на спине до оголения кожи и иссекали круглый участок кожи с помощью ручного штампа, оставляя рану на спине с полостью в центре. Рану инфицировали с помощью микроорганизма с известным номером. Примерно через четыре-шесть часов после заражения, рану либо обрабатывали местно с помощью препарата, содержащего только носитель, либо с помощью активного препарата. Инфицированные кожные раны повторно обрабатывали каждые 12 часов, всего 11 обработок. Мышей подвергали эвтаназии гуманным способом, обрезали площадь исходной инфицированной раны и извлекали, и оценивали содержание бактерий в извлеченном кожном участке с помощью стандартных микробиологических тестов. Таким образом, изменение концентрации бактерий за счет обработки активным препаратом можно легко определить путем анализа снижения бактериальной нагрузки, по сравнению с контрольным образцом, обработанным только носителем.
Материалы и методы
Приготовление инокулята для инфекции
Свежие культуры бактерий выращивали на агаре с овечьей кровью при 37°С в течение 16-18 часов. Несколько типичных колоний отбирали и суспендировали в 10 мл трипсинового соевого бульона и инкубировали в течение ночи в шейкере-инкубаторе (240 об/мин) при 37°С. Ночную суспензию перемешивали и разводили (1:100) в свежем триптическом соевом бульоне (100 мкл [0,1 мл] в 9,9 мл бульона). Свежую суспензию инкубировали в течение 3 часов в шейкере-инкубаторе (как описано выше) для получения бактерий в середине логарифмической фазы роста. Бактерий осаждали центрифугированием при 7500 об/мин в течение 10 мин. Супернатант удаляли и бактерий суспендировали в 10 мл фосфатно-солевого буфера (PBS). Эти стадии повторяли еще два раза. Плотность суспензии проверяли путем измерения оптической плотности при 600 нм с помощью спектрофотометра, с физиологическим раствором в качестве контрольного образца, для подтверждения необходимой плотности примерно 0,100, что соответствовало плотности бактерий 2,5×108 КОЕ/мл. Суспензию помещали в штатив, помещенный в сейф для транспортировки с кусочками льда для охлаждения во время транспортировки, а затем хранили в прохладном помещении после доставки в лабораторию, где осуществляли инфицирование кожи мышей. Конечную суспензию тщательно перемешивали перед инфицированием кожной раны у мышей.
В целях обеспечения чистоты и точности суспензии, проводили следующие операции перед помещением суспензии в сейф.
Чистоту бактериальной суспензии проверяли, высевая 100 мкл конечной суспензии на чашку с SBA (агар с овечьей кровью), которую инкубировали при 37°С в течение 18 часов и впоследствии осматривали для проверки равномерного роста колоний одного типа. Оценку количества жизнеспособных микроорганизмов проводили для конечной суспензии, добавляя физиологический раствор в пробирки-эппендорфы (примерно 900 мкл на пробирку), отбирая по 100 мкл образца, и добавляя к первой пробирке, встряхивали смесь, и повторяли с использованием второго эппендорфа, содержащего солевой раствор. Этот процесс продолжали в течение 5-6 пробирок. Наконец, 100 мкл 5-го и 6-го разведения высевали на агар для подсчета колоний, инкубировали при 37°С в течение 18 часов, и оценивали число колоний для подтверждения значения КОЕ/мл, равного примерно 2,5×108.
Хирургическая процедура нанесения раны на кожу
Каждую мышь помещали в индукционную камеру и анестезировали с помощью 2% изофлурана. Глаза каждой анестезированной мыши покрывали ветеринарной смазкой для глаз для предотвращения обезвоживания роговицы. Каждую мышь удаляли из индукционной камеры и помещали в операционное поле напротив индивидуального носового конуса для анестезии. В ходе анестезии у каждой мыши контролировали оценку глубины анестезии (ответ на боль, мигательный рефлекса, тонус скелетных мышц), а также дыхательную и сердечную функции. Волосы на спине выбривали в хирургической области (Фигура 33) с помощью механической машинки для стрижки. Выбритый участок очищали с помощью бумажного полотенца, смоченного 70% этанолом, а затем 10% раствором вес/объем повидон-йод. После высыхания раствора йода, вводили подкожную инъекцию нестероидного противовоспалительного агента мелоксикама. Аккуратно прищипывали кожу спины для возможности нанесения округлой раны во всю толщину кожи с помощью ушного штампа/дерматома для биопсии. Раны у контрольных мышей (только носитель) и мышей из группы, обрабатываемой LP1369, инокулировали с помощью 10 мкл бактериальной суспензии с помощью микропипетки (2,5×106 КОЕ/10 мкл). После высыхания бактериальной суспензии мышей помещали в индивидуальные боксы для восстановления, маркированные номерами, соответствующими каждой мыши. Записывали время прививки. Для каждой мыши измеряли массу тела и записывали значение в соответствующем протоколе. Мыши возвращались в полное сознание в течение 5 минут. После восстановления мышей возвращали в отдельные боксы для почасового наблюдения за осложнениями после хирургии или анестезии.
Послеоперационный уход (6 часов после операции)
Мышей оценивали на послеоперационные осложнения, и наблюдения записывали на клиническом учетном бланке. Каждую мышь тщательно извлекали из ИВК (индивидуальной вентилируемой камеры) и помещали в контейнер для оценки, стараясь не прикасаться к хирургической области. После помещения внутрь контейнера каждую мышь обследовали, и наблюдения записывали на постхирургическом клиническом учетном бланке. Всякий раз, когда показания соответствовали угрозе здоровья, вводили послеоперационное обезболивание и записывали на клиническом учетном бланке.
Наблюдение и ежедневный уход за животными
Введение антибиотика (7 часов утра и 6 часов вечера). Первое введение носителя или препарата с LP1369 (полученного в Примере 4) осуществляли через 4 часа после операции. Каждый контейнер с мазью взвешивали перед введением, и записывали значения. Каждую мышь осторожно придерживали. Мазь (носитель или LP1369) наносили на область поражения и обработанную мышь возвращали в ИВК, отслеживая, чтобы мазь не была сразу же удалена при груминге. Измеряли вес контейнера с мазью после применения, и записывали. Препарат с носителем и активный препарат с LP1369 наносили на кожные раны каждые 12 часов после первого введения, в общей сложности в ходе 11 последовательных процедур. Препарат LP1369 содержал LP1369 в концентрации 20 мг/г. Каждый раз наносили примерно 0,1-0,2 г мази, обеспечивая полную актуальную дозу LP1369 между 22 и 44 мг для мышей весом от 21 г и 24 г.
Ежедневное наблюдение. Наблюдение каждой мыши проводили один раз в день около 12 часов дня. Каждую мышь аккуратно извлекали из ИВК и помещали в контейнер для обследования, стараясь не прикасаться к хирургической области. Тщательно оценивали параметры шерстного покрова, позы, глаза, поведение, вокализацию и активность во время пребывания в контейнере, и наблюдения записывали на учетном бланке. Оценивали консистенцию фекалий мышей (на полу клетки или в контейнере), наблюдения заносили в протокол. Массу тела каждой мыши определяли во время ее пребывания в контейнере, рассчитывали изменение массы тела и показания заносили в протокол. Каждую мышь помещали на сетку для измерений и фотографировали. Контейнер для обследования дезинфицировали этанолом и оставляли высушиваться, и для следующей мыши использовали свежий контейнер.
Анализ тканей и оценка антибактериальной эффективности В конце 6 дня оценки кожных ран всех тестовых мышей подвергали эвтаназии перед сбором образцов ран для патологоанатомического обследования. На спинке у каждой мыши иссекали кожную рану. Образец помещали в пробирку, содержащую 1 мл PBS, и интенсивно встряхивали в течение 30 секунд. Отбирали 100 мкл супернатанта и помещали в пробирку-эппендорф, содержащую 900 мкл PBS. Эту процедуру повторяли с использованием серийных разведении, в общей сложности 8 разведении. Наконец, по 100 мкл каждого разведения с помощью пипетки наносили на агар для подсчета колоний в двух повторностях и инкубировали в течение ночи при 37°С. Десять микролитров исходной суспензии помещали на овечий кровяной агар для оценки чистоты культуры и инкубировали в течение ночи при 37°С. На следующий день оценивали количество жизнеспособных микроорганизмов с использованием чашек с агаром для подсчета колоний, и подтверждали идентичность собранного штамма Staphylococcus aureus (микроорганизм, используемый для инфицирования).
Результаты
Анализ количества жизнеспособных бактерий в исходной суспензии показал, что мышей инокулировали приблизительно с помощью 3,0×105 КОЕ (3,0×107 КОЕ/мл), при этом в течение времени операции не наблюдали статистически значимого снижения количества жизнеспособных бактерий (р=0,5). Исходная масса тела животных, как было показано, статистически не различалась среди групп, получавших различную терапию лечения (контрольная группа, получавшая только носитель, по сравнению с группой, получавшей LP1369). Как показано на Фигуре 34, наблюдается статистически значимое снижение бактериальной нагрузки у мышей, получавших LP1369 мышей, по сравнению с контрольной группой, получавшей только носитель.
Обсуждение
Результаты микробиологического исследования свидетельствуют о том, что соединение LP1369 в составе препарата для местного применения, наносимого на кожу в области индуцированной инфекции кожи у мышей, способно уменьшить бактериальную популяцию более чем на 99% (с log значения КОЕ на грамм инфицированной ткани, равного 8,98, до log значения КОЕ, равного 6,17 КОЕ/г). Четко показано, что соединение LP1369 является биологически доступным и проявляет антибактериальную активность против штамма Staphylococcus aureus, с помощью которого индуцировали инфекцию. При разработке нового антибактериального агента для применения в лечении местных бактериальных инфекций в первую очередь необходимо определить чувствительность бактерий-мишеней к целевому агенту (в данном случае LP1369), а затем удостовериться в том, что результаты по оценке МИК in vitro соответствуют эффективной биологической активности in vivo. Оба теста были успешно выполнены. Препараты, содержащие LP1369, могут быть оптимизированы путем модификации схемы приема и состава (с использованием стандартных стадий и методов, доступных в данной области техники), для улучшения клинически подходящего лечения местной микробной инфекции.
Реферат
Группа изобретений относится к медицине и предназначена для предотвращения или лечения местной микробной инфекции у субъекта. Используют терапевтически эффективное количество композиции, содержащей полиэфирный ионофор, выбранный из наразина, салиномицина, лазалоцида, моненсина, семдурамицина, мадурамицина и лаидломицина, или его терапевтически приемлемую соль, и хелатирующий агент. Также описано устройство, содержащее композицию в форме для местного применения. Группа изобретений позволяет расширить арсенал терапевтических средств. 4 н. и 20 з.п. ф-лы, 34 ил., 5 пр.

Комментарии