Ионтофоретическая доставка противомигреневого препарата - RU2166315C2
Код документа: RU2166315C2
Чертежи




Описание
Изобретение относится к ионтофоретическому введению пациентам, в особенности больным с мигренью, соединений формулы I, как показано ниже. Изобретение также относится к устройству для ионтофоретической доставки соединений формулы (I), а также к композициям, содержащим соединение формулы (I), которое может быть использовано в устройстве для ионтофоретической доставки.
Хотя обычно оральное введение лекарства рассматривается как наиболее удобное, этот путь ставит конкретные проблемы при введении препаратов, более конкретно, противомигреневых препаратов пациентам, страдающим от приступа мигрени. Больные мигренью часто чувствуют тошноту, иногда приводящую к непроизвольной рвоте, тем самым затрудняя оральное введение противомигреневых препаратов. Успешной оральной доставке некоторых антимигреневых соединений также препятствует их восприимчивость к разложению кислой средой желудка и ферментативная активность некоторых ферментов в желудочно-кишечном тракте. Другими недостатками орального пути являются часто низкое всасывание в результате гастропареза и обширная элиминация первой фазы в печени (эффект печеночной первой фазы), благодаря чему соединение трансформируется в печени в метаболит, более подходящий для экскреции. Вместе с подходящим путем введения существенным для эффективного лечения приступа мигрени является то, что активное действие лекарства проявлялось бы немедленно или по крайней мере очень быстро после введения, и эффект длился бы достаточно долго. Таким образом, для прямого введения противомигреневых препаратов следует выбрать средство прямого введения в кровоток противомигреневых препаратов. Очевидным путем действия подобным образом является инъекция раствора лекарства или внутривенно, или подкожно. Однако сопутствующая боль, опасность инфекции, сложные способы для самостоятельного введения и возможное плохое соблюдение больными режима и схемы лечения делают такое парентеральное введение нежелательным.
Чреcкожная доставка является привлекательной альтернативой,
поскольку:
а) она позволяет избежать гастроинтестинального разложения и печеночного эффекта первой фазы;
б) это является само по себе контролируемым и/или длительным высвобождением;
в) это позволяет удобно и просто самому пациенту ввести препарат и соблюдать режим, поскольку трансдермальный состав можно легко наносить или удалять.
Обычные системы чрескожного введения препаратов основаны на транспорте препаратов в кожу путем диффузии через внешний покров эпидермиса, т.е. ороговевший слой. Количество растворенного вещества, которое может быть доставлено этим путем, ограничено из-за отличных барьерных свойств указанного ороговевшего слоя. Следовательно, достижение терапевтически эффективного уровня является поэтому трудным без некоторых способов облегчения. Одним из средств облегчения является доставка препарата при помощи электрокинетического воздействия, более конкретно, путем ионтофоретического воздействия. Принцип ионтофореза основан на том, что ионизированные (или полярные) молекулы препарата могут быть доставлены через кожу, если приложить к коже подходящий электрический потенциал. Ионтофорез может быть основан исключительно на электромиграции, т.е. на движении ионизированных молекул препарата в электрическом поле как таковом, или это может происходить в результате комбинированного эффекта электромиграции и электроосмоса. Последний является трансдермальным током жидкого растворителя, содержащего препарат при наличии электрического поля.
Задачей, которую необходимо решить, является поиск или разработка соединений и композиций, которые обладают желаемой противомигреневой активностью и подходят для указанной удобной ионтофоретической доставки.
Недавно было обнаружено, что
соединения формулы (I) проявляют 5HT1-подобную агонистическую активность и, более конкретно, противомигреневую активность. Неожиданно было обнаружено, что эти соединения формулы (I) могут
быть доставлены путем ионтофоретического воздействия. Указанные соединения являются дигидробензопираналкиламиноалкилзамещенными гуанидинами формулы

их фармацевтически приемлемые соли присоединения кислот и их стереохимически изомерные формы, где
R1 - водород или C1-6алкил;
R2 - водород или C1-6алкил, C3-6алкенил или C3-6алкинил;
R3 - водород или C1-6алкил; или
R2 и R3, взятые вместе, образуют бивалентный радикал формулы -(CH2)m, где m = 4 или 5; или
R1 и R2, взятые вместе, образуют бивалентный радикал формулы -CH=CH- или формулы -(CH2)n, где n = 2, 3 или 4; или
R3 может обозначать связь, когда R1 и R2, взятые вместе, образуют бивалентный радикал формулы -CH=CH-CH=;
R4 и R5 каждый независимо - водород или C1-6алкил;
Alk1 - бивалентный C1-3 алкандиильный радикал;
Alk2 - бивалентный C2-15алкандиильный радикал; и
R6 и R7 каждый независимо - водород, галоген, С1-6алкил, С3-6алкенил, C3-6алкинил, гидрокси, С1-6алкилокси или циано.
В предшествующих определениях термин "галоген" объединяет фтор, хлор, бром, иод; термин "C1-6алкил" подразумевает прямые или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 6 атомов углерода, такие как метил, этил, пропил, бутил, пентил, гексил и тому подобное; "С3-6алкенил" определяет прямоцепочечные или разветвленные углеводородные радикалы, содержащие одну двойную связь и имеющие от 3 до 6 атомов углерода, такие как, например, 2-пропенил, 3-бутил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил и тому подобное; и атом углерода указанного C3-6алкенила, присоединенный к атому азота, предпочтительно является насыщенным; "C3-6алкинил" определяет прямоцепочечные или разветвленные углеводородные радикалы, содержащие одну тройную связь и имеющие от 3 до 6 атомов углерода, такие как, например, 2-пропинил, 3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-гексинил и тому подобное; и атом углерода указанного С3-6алкинильного радикала, присоединенный к атому азота, предпочтительно является насыщенным; "С1-3алкандиил" подразумевает прямые или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 3 атомов углерода, такие как метилен, этандиил, пропандиил и тому подобное; "С2-15алкандиил" подразумевает прямые или разветвленные насыщенные углеводородные радикалы, имеющие от 2 до 15 атомов углерода, такие как этандиил, пропандиил, бутандиил, гександиил, гептандиил, октандиил, нонандиил, декандиил, ундекандиил, додекандиил, тридекандиил, тетрадекандиил, пентадекандиил и их разветвленные изомеры.
Фармацевтически приемлемые соли присоединения кислот, как указано выше, включают формы терапевтически активных нетоксичных солей присоединения кислоты, которые способны образовывать соединения формулы (I) с подходящими кислотами, такими как неорганические кислоты, например, галогенводородные кислоты, например, хлористо-водородная, бромисто-водородная и тому подобные кислоты, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, этандиовая, пропандиовая, бутандиовая, (Z)-2-бутендиовая, (Е)-2-бутендиовая, 2-гидроксибутандиовая, 2,3-дигидроксибутандиовая, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфаминовая, 2-гидроксибензойная, 4-амино-2-гидроксибензойная и тому подобные кислоты. И, напротив, солевая форма может быть преобразована путем обработки щелочью в форму свободного основания.
Термин "стереохимические изомерные формы", как он используется выше и далее, обозначает все возможные изомерные формы, которые могут быть присущи соединениям формулы (I). Если не указано или не отмечено иного, химическое определение соединений обозначает смесь всех возможных стереохимических изомерных форм, и указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стерические центры могут иметь R- или S-конфигурацию. Ясно, что настоящее изобретение предполагает включение в свой объем как индивидуальных стереохимических изомерных форм, так и их смесей.
Необходимо учесть, что смеси представленных энантиомеров могут быть разделены в соответствии с классическими методами разделения, например, фракционной кристаллизацией их солей присоединения кислот с подходящей хиральной кислотой или хроматографическим разделением с использованием хиральной фазы.
Более того, соединения формулы (I) могут также существовать в их таутомерных формах. Предполагается, что такие формы, хотя они и не представлены определенно в вышеуказанной формуле (I), также включены в объем настоящего изобретения.
R1 подходящим образом представляет водород или метил;
R2 подходящим образом представляет водород или метил;
R3 подходящим образом представляет водород или метил;
предпочтительно R1 и R2, взятые вместе, для образования бивалентного радикала формулы -CH=CH-,
-(CH2)2- или -(CH2)3- или,
когда R3 является свободной связью, R1 и R2, взятые вместе, образуют бивалентный
радикал или формулу -CH=CH-CH=;
R4 подходящим образом представляет метил или водород, предпочтительно водород;
R5 подходящим образом представляет метил или
водород, предпочтительно водород;
R6 и R7 подходящим образом представляют водород, галоген или C1-6 алкил, предпочтительно водород, фтор, метил или этил.
Представляющими интерес соединениями формулы (I) являются такие соединения формулы (I), где Alk1 представляет C1-2алкандиил, особенно метилен.
Другими представляющими интерес соединениями являются такие соединения формулы (I), где Alk2 представляет C2-6алкандиил, в частности этандиил, пропандиил, бутандиил, пентандиил, гександиил, предпочтительно 1,3-пропандиил.
Наиболее предпочтительными соединениями являются N-[(3,4-дигидро-2H-1-бензопиран-2-ил)метил] -N'-(1,4,5,6-тетрагидро- 2-пиримидинил)-1, 3-пропандиамин, его стереохимические изомеры, в частности R-изомер, и его фармацевтически приемлемые соли присоединения кислот.
Соединения формулы (I) могут быть получены известными в данной области способами.
Способ ионтофоретической доставки лекарств осуществляют обычно путем приведения в контакт композиции, содержащей лекарство, с кожей. Такая композиция может быть, например, раствором (абсорбированным на каком-либо пористом материале, например, кусочке фильтровальной бумаги или кусочке гидрофильного полиуретана) или гелем. Композицию затем накрывают электродом. Второй электрод помещают где-нибудь на участке кожи, и непосредственный источник тока размещают между электродами таким образом, чтобы электрод, контактирующий с лекарственным раствором, принимал тот же заряд, что и ионизированное лекарство. Под действием приложенного электрического поля молекулы лекарства проникают сквозь кожу. Между электродами проходит ток, часть которого проводится лекарством.
Сами по себе ионтофоретические устройства известны в технике, например, WO-A-9116946, WO-A-9116944, WO-A-9116943, WO-A-911261, WO-A-9115260, WO-A-9115259, WO-A-9115258, WO-A-9115257, WO-A-9115250, WO-A-9109645, WO-A-9108795, WO-A-9004433, WO-A-9004432, WO-A-9003825, EP-A-254965, US 4717378, EP-A-252732 и GB-A-2239803.
Согласно первому аспекту данного изобретения предлагается ионтофоретическая система доставки лекарства для введения соединения формулы (I). В основном указанная ионтофоретическая система доставки лекарства, называемая также электротрансдермальной системой доставки лекарства (ЭТС), представляет собой устройство, содержащее четыре компонента: источник энергии, например батареи; контрольную цепь; электроды; и резервуары. Устройство может представлять собой устройство из одной или из двух частей; в последнем случае первая часть может содержать контрольную цепь и присоединенный к ней источник электрического тока, тогда как вторая часть может содержать электродную единицу, содержащую вышеуказанный активный ингредиент. Детали устройства или частей устройства обычно выполнены из электрически непроводящего материала, такого как гидрофобные непроводящие полимерные материалы, например полиэтилен или полипропилен. Отверстие у основания формы, которое контактирует с кожей, необязательно может быть покрыто микропористой мембраной, которая присоединена к дну формы и изготовлена предпочтительно из электрически непроводящего материала, такого как натянутая полиэтиленовая или полипропиленовая пленка. Мембрана может быть покрыта поверхностно-активным веществом, если необходимо сделать ее смачивающейся. Микропористая мембрана дает возможность проникать ионам, но замедляет проникновение жидкости. Материал, из которого изготовлена микропористая мембрана, может варьировать в зависимости от активного ингредиента, используемого в устройстве.
Система электродов содержит анод, катод и два резервуара, один, содержащий ионы лекарства, и другой, содержащий, например, биосовместимую соль, такую как хлорид натрия, соли щелочных металлов неорганических кислот, например хлориды, сульфаты, нитраты, карбонаты, фосфаты, или органические соли, например аскорбаты, цитраты, ацетаты. Для доставки положительно заряженной соли лекарства, как в данном случае, требуется, чтобы соль лекарства в процессе проведения доставки находилась в резервуаре анода, тогда как для доставки отрицательно заряженного лекарства требуется помещение соли лекарства в резервуар катода. Доставка того же лекарства из обоих резервуаров альтернативным способом может также сопровождаться периодическим обращением полярности электродов.
Электроды могут быть из металлической фольги, из полимерных матриц, заполненных порошком металла, из порошкообразного графита, из углеродных волокон и других подходящих электропроводных материалов. Подходящими металлами для использования в электродах являются, например, платина, серебро, алюминий, медь, свинец, железо, олово, хром или цинк. Также могут использоваться электроды металл/нерастворимая соль, такие как серебро/галогенид серебра, в частности электроды серебро/хлорид серебра. Представляющими интерес электродами являются платиновые электроды. Предпочтительно используют электроды серебро/хлорид серебра.
Конфигурация электродов может быть очень простой или может включать множество отдельных и изолированных электродов, расположенных на первой поверхности, предназначенной для контакта с кожей. Устройство электродов может быть связанным, например сторона к стороне, или концентрическим. Концентрическое связывание электродов может быть круговым, эллиптическим, прямоугольным или любым другим из многообразных геометрических конфигураций. Указанное устройство множества электродов может облегчить доставку активного ингредиента при минимальной потребности тока для такой доставки, а также при минимальном раздражении кожи, что может быть обусловлено применением устройства.
Объединенные контактирующие с кожей площади электродов могут варьировать от менее 1 см2 до более 200 см2. Среднее устройство будет иметь площадь контактирования от около 5 см2 до около 50 см2.
Источником энергии могут быть батарейки или гальванический элемент. Предпочтительными источниками энергии являются батарейки. Применяемые в данных системах доставки батарейки будут обычно миниатюрными или "световыми" ("light-weight") батарейками, например, можно применять обычные плоские батарейки и микробатарейки. Подходящими батарейками являются щелочные батарейки и литиевые батарейки типа используемых в слуховых аппаратах и часах.
Ионтофоретическая система далее содержит электронный контрольный модуль, включающий выключатель. Контрольная цепь ионтофоретической системы может быть такой простой, как резистор, который мог бы ограничить прилагаемый ток до некоторого максимального значения, или таким сложным, как интегрированная цепь, которая может позволить варьирование времени или контролируемую прекращаемую доставку лекарства. Таким образом, ионтофоретическая система доставки может, например, уменьшить вероятность недо- или передозировки в результате указанной возможности предварительного программирования доставки лекарства при требуемом терапевтическом пути. Представляющей интерес предварительно программированной схемой в этом случае введения противомигреневого лекарства может быть сначала введение болюса соединения формулы (I) для немедленного облегчения текущей боли и после некоторого времени поддерживаемая доставка меньших количеств соединения для обеспечения возможности раскалывающей головной боли.
Устройство может также содержать электрическую цепь с приспособлением для определения того, что активный ингредиент активно доставляется. Эта характеристика желательна, например, для успокоения пациента в том, что он или она получают лекарственный препарат.
Композиции, подходящие для включения в ионтофоретическое устройство, содержащее соединение формулы (I), относятся к другому аспекту настоящего изобретения. Указанные композиции могут, например, представлять собой жидкую форму, помещенную в резервуар, снабженный мембраной, которая проницаема для активного ингредиента.
Альтернативно активный ингредиент может быть диспергирован в матрице из твердого, полутвердого или клейкообразного вещества, и мембрана, проницаемая для активного ингредиента, необязательно должна быть связана с этим веществом. Вещество матрицы подходящим образом является гидрогелем, полиуретаном, силиконом или другим материалом, известным в данной области, для хранения лекарства в подходящем виде перед высвобождением на коже. Лекарство может также содержаться в резервуаре с помощью ионообменной смолы или обладающей лигандным сродством среды в качестве резервуарной матрицы для лекарств.
Подходящие вещества для образования матрицы для использования в электроде для устройства по изобретению включают, например, растительные экстракты, растительные масла, смолы, синтетические или природные полисахариды, полипептиды, альгинаты, углеводороды, синтетические полимеры, минеральные или кремниевые соединения и их смеси. Такие материалы являются отверждающимися или гельобразующими агентами, которые при смешивании и/или нагревании с активным ингредиентом и необязательно с одним или более вспомогательным(и) веществом(ами) в растворе или смеси растворителей образуют матрицу с активным ингредиентом и вспомогательным (и) веществом(ами), если они имеются, диспергируясь в них.
Термин "отверждающийся агент", как здесь используется, охватывает также загустители, отвердители, осадители, суспенгаторы и тому подобные агенты.
Подходящие растительные экстракты включают агар-агар, ispaghuia, cydonia и ceratonia или их смеси. Подходящим растительным маслом является гидрированное касторовое масло. Примеры подходящих смол включают gyar gym, аравийскую камедь, ghatti gym, karaya gum и смолу трагаканта или их смесь. Подходящие синтетические или природные полисахариды включают алкилцеллюлозу, гидроксиалкилцеллюлозу, простые эфиры целлюлозы, сложные эфиры целлюлозы, декстрин нитроцеллюлозы, каррагенан, пектин, фурцеллан и крахмал или производные крахмала. Примером предпочтительного производного крахмала является натрий крахмал гликолят. Синтетические полимеры включают поливиниловый спирт, полиакриламид, полиакриловую кислоту, поливинилпирролидон, гидроксиэтилметилакрилат, полиэтиленоксиды, полиэтилен, полипропилен, полиизопрены, полиизобутилен, поливинилацетат. Подходящие полипептиды включают зеин, желатин, коллаген и полигелин или их смеси. Подходящие альгинаты включат альгиновую кислоту, альгинат пропиленгликоля и альгинат натрия или их смеси.
Предпочтительные углеводороды включают мягкий парафин и твердый парафин, особенно белый вазелин.
Особенно предпочтительными синтетическими полимерами являются карбовинильный полимер или полиуретан.
Подходящие минеральные вещества включают бентонит, гекторит, алюминиймагний силикат и магний силикат или их соли.
Подходящие соединения, основанные на силиконе, включают коллоидный диоксид кремния, силиконы, полисилоксаны и силикагели или их смеси.
В случае гидрогеля используемым растворителем является предпочтительно вода. Используемым растворителем подходящим образом может быть спирт, такой как этанол или стеариловый спирт, глицерин, пропиленгликоль, полиэтиленгликоль или силикон или их смеси, включая смеси с водой.
Также могут быть использованы усилители проницаемости. Такие усилители проницаемости предпочтительно не являются ни токсичными, ни раздражающими, ни аллергенными. Подходящими усилителями проницаемости являются, например, этанол и высшие спирты, N-децилметилсульфоксид, полиэтиленгликоль монолаурат, дилаурат и связанные с ним эфиры, монолаурат глицерина и связанные моно-, ди- и трифункциональные глицериды, диэтилтолуамид, N,N-диметиллаурамид оксид, натрий даурил сульфат, натрий додецилсаркозинат, гемисукцинат холестерина, натрий цетилсульфат, натрий додецилбензолсульфонат, натрий диоксилсульфосукцинат и четвертичные аммониевые производные, такие как цетилтриметиламмонийхлорид и тому подобное.
Подходящие вспомогательные вещества могут включать одно или более из следующих: противомикробный агент, консервант, антиоксидант, пластификатор, увлажнитель, реологический агент, местный анестетик, желатинирующий агент или местнораздражающий агент.
pH раствора, содержащего активный ингредиент, может колебаться от 3 до около 12. Даже более интересной представляется область между 4 и около 11. Предпочтительно pH раствора, содержащего активный ингредиент, находится в области между около 8 и около 10. Более предпочтительным значением pH является около 8,5-9,5. Могут использоваться любые буферные системы, способные поддерживать pH, указанное выше. Представляющими интерес примерами являются буферы на основе фосфорной кислоты, борной кислоты, лимонной кислоты, этаноламина, трис(гидроксиметил)аминометана, бикарбоната натрия и тому подобное или их смеси. Данные буферные системы могут быть получены известными в данной области методами. Выбор буферного раствора зависит от используемых электродов и от других компонентов композиции, содержащей соединения формулы (I). Например, в случае, когда используемыми электродами являются серебро/хлорид серебра, буферный раствор предпочтительно содержит хлорид ионы.
Ионная сила раствора может быть в области от около 0,001 M до около 1 M, в частности, в области от около 0,01 M до около 0,5 М, особенно между около 0,05 M до около 0,1 M.
Количество активного ингредиента в ионизированной форме в растворе находится предпочтительно в области от около 0,1 мг/мл до около 100 мг/мл, предпочтительно между около 1 мг/мл и около 50 мг/мл, особенно между около 2 мг/мл и около 8 мг/мл.
Резервуар в контакте с противоположным электродом содержит биосовместимую соль. Подходящие соли включают хлорид натрия или соли щелочных или щелочноземельных металлов, такие как хлориды, сульфаты, нитраты, карбонаты, фосфаты и соли органических кислот, такие как аскорбаты, цитраты, ацетаты и их смеси.
Применяемая сила тока может быть в области 0,01-10 мА на 1 см2. Например, устройство наиболее обычно работает при от около 0,1 до около 0,7 мА на 1 см2, предпочтительно при от около 0,2 до около 0,4 мА на 1 см2. Ток может быть постоянным, переменным или пульсирующим в соответствии с данной программой для доставки активного ингредиента. Предпочтительно прилагаемый ток является постоянным.
Устройство и композиция по изобретению, описанные выше, могут использоваться в способе доставки соединения формулы (I) ионтофоретическим путем, включающим прикладывание данного устройства к пациенту. На практике пациенту, страдающему от приступа мигрени, ионтофоретическое устройство по доставке прикладывают к телу, например на руку или на грудную клетку, и подают на устройство ток. Когда головная боль возвращается, пациент может по своему выбору вновь включить устройство и получить другую дозу противомигреневого лекарства.
Ионтофоретическая доставка может поддерживаться в течение непрерывного периода времени. Приемлемым может быть прерывание периода активной ионтофоретической доставки (т. е. период, когда ионтофоретическое устройство включено) интервалами с отсутствием тока. Непрерывные периоды приложения изменяются от около 5 мин до около 120 мин, в частности от около 10 до около 60 мин, особенно от около 15 до около 40 мин. Интервалы обесточивания могут изменяться от 5 мин до около 3 ч, в частности от около 15 мин до около 2 ч, особенно от около 30 мин до 1 ч.
Экспериментальная часть
Эксперименты in vivo
В следующих примерах используют двухкамерную поликарбонатную ячейку. Два отделения отделены друг от друга
горизонтально закрепленным кусочком (3 см2) полным слоем абдоминальной свежеиссеченной кожи безволосых крыс. Донорское отделение, содержащее 1,4 мл раствора исследуемого соединения, то есть
R-N[(3,4-дигидро-2H-1-бензопиран-2-ил)метил] -N'-(1,4,5,6-
тетрагидро-2-пиримидинил)-1,3-пропандиамин (обозначаемый здесь как "исследуемое соединение"), определяемого с помощью меченого3
H-соединения. Радиомеченый спайк вводят при концентрации 1 мкCi/мл. Рецепторный отдел наполнен фосфатным буфером (0,024 М) при pH 7,4 изотонированным глюкозой. В обоих отделах укреплены электроды,
соединенные друг с другом с источником силы. Концентрацию исследуемого соединения, проникающего сквозь кожу, измеряют в указанной точке времени. Эту концентрацию определяют измерением радиоактивности
в жидком сцинтилляционном счетчике. Отношение совокупного количества, определенного в рецепторном отделе, к площади кожи (3 см2) представлено ниже как функция от времени. Результаты
выражены как данные как минимум трех опытов. Дано также значение стандартной ошибки (СО).
Пример 1.
Исследуемое соединение вводят в донорский отсек в концентрации 5
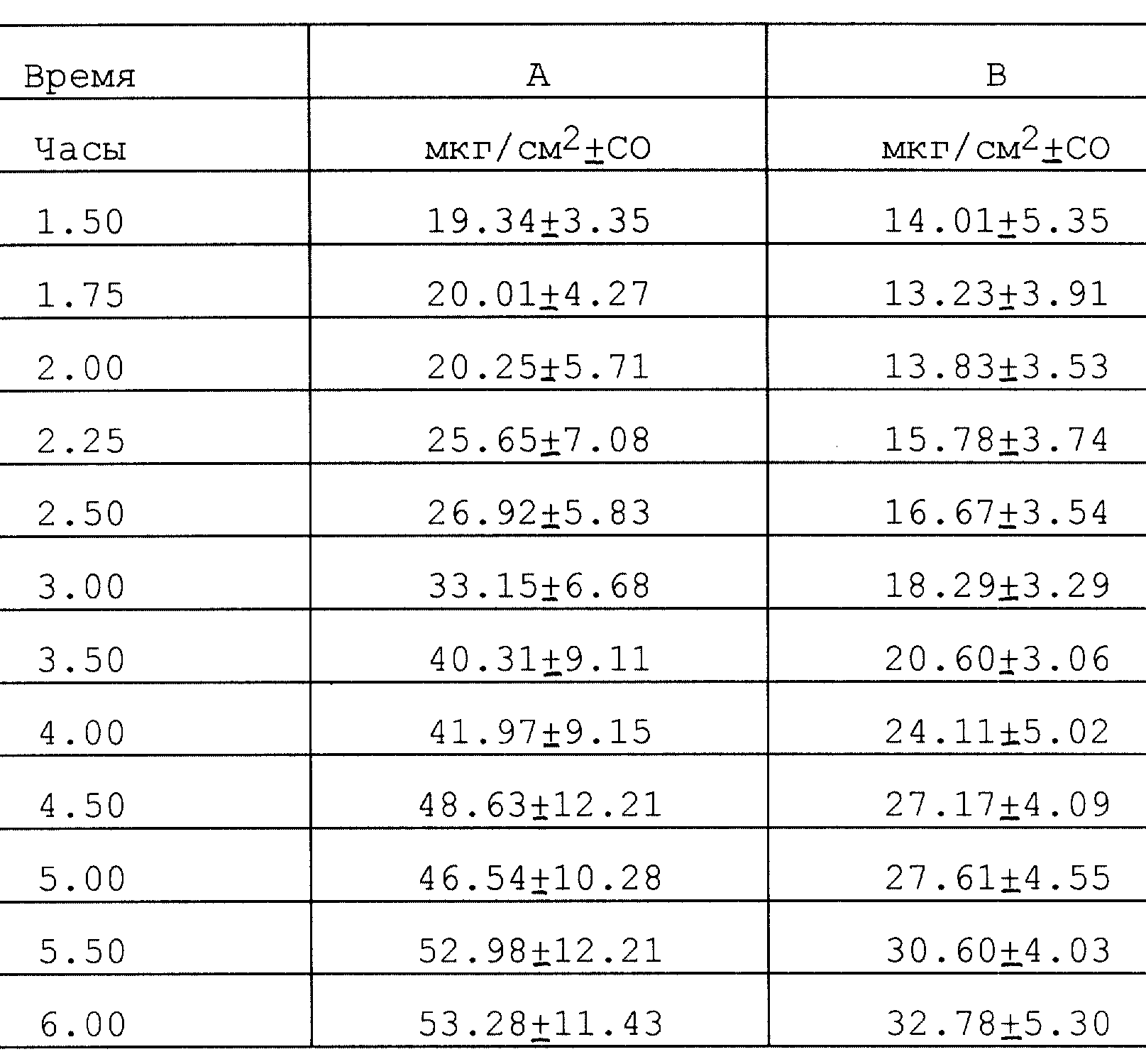
мг/мл в боратном буфере (0,1 М) при pH 9,5. В обоих отсеках устанавливают платиновые электроды. Используемые условия перечислены далее, и результаты представлены в табл. 1:
ток не
прикладывался (колонка А);
прикладывался прямой ток в 0,2 мА/см2 в течение 1 ч (колонка В);
прикладывался прямой ток в 0,4 мА/см2 в течение 1 ч (колонка С);
прикладывался пульсирующий ток (2 кГц) при значении плотности тока 0,4 мА/см2 в течение 1 ч (колонка D).
Пример 2.
Исследуемое соединение вводят в
донорский отсек в различных концентрациях в различных буферных системах при pH 9,5. В обоих отсеках устанавливают электроды серебро/хлорид серебра. Прикладывался прямой ток в 0,4 мА/см2 в
течение 1 ч. Используемые условия перечислены далее и результаты представлены в табл. 2:
концентрация исследуемого соединения была 5 мг/мл в боратном буфере (0,05 М), содержащем 0,007 М NaCl
(колонка А);
концентрация исследуемого соединения была 7,5 мг/мл в боратном буфере (0,05 М), содержащем 0,007 М NaCl (колонка В);
концентрация исследуемого соединения была 5 мг/мл в
этаноламиновом буфере (0,05 М) (колонка С).
Пример 3.
Исследуемое соединение вводят в донорнский отсек в различных концентрациях в различных буферных системах. В обоих
отсеках устанавливают платиновые электроды. Прикладывался прямой ток в 0,4 мА/см2 в течение 1 ч. Используемые условия перечислены далее и результаты представлены в табл. 3:
концентрация исследуемого соединения была 5 мг/мл в цитратном буфере (0,05 М) при pH 5,5 (колонка А);
концентрация исследуемого соединения была 5 мг/мл в цитратном буфере (0,1 М) при pH 5,5
(колонка В).
Пример 4.
Гидрофильные полиуретановые 10 см2 пенные пластыри (Allevyn, Smith & Nephew) смачивались раствором исследуемого соединения, т.е. R-N-[(3,4-дигидро-2H-1-бензопиран-2-ил)метил] -N'-(1,4,5,6-тетрагидро-2-пиримидинил)-1,3-пропандиамином (7,5 мг/мл в этаноламиновом буфере (0,05 М) при pH 9,5). Ag/AgCl электроды погружают в пенистый пластырь и присоединяют к генератору прямого тока.
В день обработки лекарством добровольцам вводили исследуемое соединение электротрансдермальной системой высвобождения лекарств (ЭТС) путем прямого тока в 0,2 мА/см2, пропускаемого с двумя последовательными 30-минутными промежутками времени (периоды разделены интервалом без тока в 90 мин). Система доставки (пенистый пластырь) была нанесена на внутреннюю часть предплечья и оставалась на месте в течение 90 мин после второго периода приложения тока (= 240 мин после начала 1-й стадии приложения тока).
Отбор образцов крови, измерения кровяного давления и электрокардиограммы проводят в нескольких точках в течение периода применения ЭТС и в определенных точках времени спустя 6 ч. Добровольцы остаются в фармакологическом отделении клиники до 4 ч после начала первого наложения тока. Для оценки переносимости добровольцы видели исследователя в течение визита, который проходил в период от 1 до 7 дней после введения лекарства.
Образцы венозной крови (5 мл) берут из противолоктевой вены (напротив участка введения) сразу после и через 30 (конец 1-го периода наложения тока), 60, 90, 120 (перед вторым периодом наложения тока), 180, 210, 240, 300 и 360 мин после начала 1-го периода наложения тока. Образцы крови собирают в гепаринизированные пробирки.
Концентрацию плазмы исследуемого соединения определяют с помощью радиоиммуноисследования (РИИ).
В эксперименте участвовали восемь добровольцев, и значения концентрации плазмы (в нг/мл) в образцах крови представлены в табл. 4.
Реферат
Изобретение относится к медицине, а именно к ионтофоретической доставке пациенту, страдающему
мигренью, соединения формулы (I). Изобретение относится также к устройству для ионтофоретической доставки соединения формулы (I), а также к композиции, содержащей соединение формулы (I), которое может
применяться в данном устройстве. Указанные соединения являются бензопираналкиламиноалкилзамещенными гуанидинами формулы (I), их фармацевтически приемлемыми солями присоединения кислоты и их
стереохимически изомерными формами, где R1 - водород или C1-6алкил; R2 - водород, C1-6алкил, C3-6алкенил или C3-6алкинил; R3
- водород или C1-6алкил; или R2 и R3, взятые вместе, образуют бивалентный радикал формулы -(CH2)m, где m = 4 или 5; или R1 и R2, взятые вместе, образуют бивалентный радикал формулы -CH=CH- или формулы -(CH2)n, где n = 2,3 или 4; или R3 может обозначать связь, когда R1 и R2, взятые вместе, образуют бивалентный радикал формулы -CH=CH-CH=; R4 и R5 каждый независимо - водород или C1-6алкил; Alk1 - бивалентный C1-3алкандиильный радикал; Alk2 - бивалентный С2-15 алкандиильный радикал; и R6 и R7 каждый независимо - водород, галоген, C1-6алкил, C3-6алкенил, C3-6алкинил, гидрокси, C1-6алкилокси или циано

Предложенное устройство позволяет ускорить облегчение боли без побочных эффектов, свойственных оральным противомигреневым средствам. 2 с. и 20 з.п. ф-лы, 4 табл.
Формула

его фармацевтически приемлемую соль присоединения кислоты или его стереохимически изомерную форму,
где R1 - водород или C1-6алкил;
R2 - водород или C1-6алкил, C3-6алкенил или C3-6алкинил;
R3 - водород или C1-6алкил или
R2 и R3, взятые вместе, образуют бивалентный радикал формулы -(CH2)m, где m = 4 или 5, или R1 и R2, взятые вместе, образуют бивалентный радикал формулы -CH=CH- или формулы -(CH2)]n, где n = 2, 3, 4, или R3 - связь, когда R1 и R2, взятые вместе, образуют бивалентный радикал формулы -CH=CH-CH=;
R4 и R5 каждый независимо - водород или C1-6алкил;
Alk1 - бивалентный C1-3 алкандиильный радикал;
Alk2 - бивалентный C2-15 алкандиильный радикал;
R6 и R7 каждый независимо - водород, галоген, C1-6алкил, C3-6алкенил, C3-6алкинил, гидрокси, C1-6алкилокси или циано.

Комментарии