Комплексное соединение металл-сален и способ его получения - RU2546663C2
Код документа: RU2546663C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к комплексному соединению металл-сален и к способу получения комплексного соединения металл-сален. Комплексное соединение металл-сален обладает магнитными характеристиками и его используют, например, в магнитных материалах и магнитных лекарственных средствах.
УРОВЕНЬ ТЕХНИКИ
Обычно, когда лекарственное средство вводят в живой организм, оно поступает на пораженный участок и оказывает свое фармакологическое воздействие на пораженный участок, тем самым оказывая свое терапевтическое воздействие. С другой стороны, оно не будет терапевтическим, если лекарственное средство попадает в ткани, не являющиеся пораженным участком (т.е. в здоровые ткани).
Поэтому важно знать, как эффективно направить лекарственное средство на пораженный участок. Методика направления лекарственного средства на пораженный участок называется доставкой лекарственного средства, которую активно исследовали и разрабатывали в последние годы. Эта доставка лекарственного средства обладает по меньшей мере двумя преимуществами. Одним преимуществом является то, что можно обеспечить достаточно большую концентрацию лекарственного средства в пораженной ткани. Фармакологическое воздействие не будет обнаруживаться, если концентрация лекарственного средства на пораженном участке не является постоянной или высокой. Нельзя ожидать терапевтического воздействия, если концентрация является низкой.
Вторым преимуществом является то, что лекарственное средство направляется только на пораженные ткани, и поэтому можно подавить побочные реакции в здоровых тканях.
Такая доставка лекарственного средства при лечении рака осуществляется с помощью противоопухолевых средств. Большинство противоопухолевых средств подавляет рост раковых клеток, которые активно делятся, так что противоопухолевые средства также подавляют рост клеток даже здоровых тканей, в которых клетки активно делятся, таких как костный мозг, корни волос или слизистая оболочка желудочно-кишечного тракта.
Поэтому у страдающих раком пациентов, которым вводят противоопухолевые средства, наблюдаются побочные реакции, такие как анемия, выпадение волос и рвота. Поскольку такие побочные реакции тяжело переносятся пациентами, дозы необходимо ограничивать, что приводит к невозможности обеспечения достаточного фармакологического воздействия противоопухолевых средств.
Алкилирующее противоопухолевое средство, входящее в число таких противоопухолевых средств, является родовым названием противоопухолевых средств, обладающих способностью объединять алкильную группу (-CH2-CH2-), например, с белком нуклеиновой кислоты. ДНК алкилируется и подавляется репликация ДНК, что приводит к гибели клетки. Это действие проявляется независимо от клеточных циклов и также проявляется для клеток в период G0, оказывает сильное влияние на клетки, которые активно растут, и склонно повреждать, например, костный мозг, слизистую оболочку желудочно-кишечный тракт, зародышевые клетки или корни волос.
Кроме того, противоопухолевые антиметаболиты являются соединениями, обладающими структурами, сходными со структурами нуклеиновых кислот или метаболитов при синтезе белка, повреждают клетки, например, путем подавления синтеза нуклеиновых кислот и специфически воздействуют на клетки в фазе митоза.
Кроме того, противоопухолевые антибиотики являются химическими соединениями, продуцируемыми микроорганизмами, и оказывают такие воздействия, как подавление синтеза ДНК и разрушение нити ДНК и обладают противоопухолевой активностью.
Кроме того, ингибиторы микротрубочек оказывают противоопухолевое воздействие путем прямого воздействия на микротрубочки, которые играют важную роль в поддержании нормальной функции клеток, например, путем формирования веретен при делении клетки, размещения внутриклеточных органелл и транспорта веществ. Ингибиторы микротрубочек воздействуют, например, на клетки, которые активно делятся, и на нервные клетки.
Кроме того, препараты платины подавляют синтез ДНК путем образования нитей ДНК, связей между цепями или связей ДНК-белок. Цисплатин является типичным лекарственным средством, но приводит к тяжелой нефропатии и требует значительного возмещения потери жидкости.
Кроме того, противоопухолевые средства - парагормоны эффективны для борьбы с гормонозависимыми опухолями. Женские гормоны или антиандрогены вводят при андрогензависимом раке предстательной железы.
Кроме того, лекарственные средства, воздействующие на молекулярные мишени, применяют для лечения, направленного на молекулы, которые соответствуют молекулярным биологическим характеристикам, специфическим для каждой злокачественной опухоли.
Кроме того, ингибиторы топоизомеразы являются ферментами, предназначенными для временного образования разрывов в ДНК и изменения количества сплетений нитей ДНК. Ингибитор топоизомеразы I является ферментом, который образует разрывы в одной нити кольцевой ДНК, не воздействуя на другую нить, и затем замыкает разрывы; и ингибитор топоизомеразы II является ферментом, который временно разрывает две нити кольцевой ДНК, не воздействуя на две другие нити между первыми двумя нитями, и повторно связывает разорванные нити.
Кроме того, неспецифические иммунопотенциаторы подавляют рост раковых клеток путем активации иммунной системы.
Примером специфической методики доставки лекарственного средства является использование носителя. Она заключается во включении в носитель, который склонен накапливаться на пораженном участке, лекарственного средства с последующим переносом лекарственного средства носителем на пораженный участок.
Перспективным возможным носителем является магнитное вещество, и предложен способ связывания носителя, который является магнитным веществом, с лекарственным средством и предоставления носителю возможности накапливаться на пораженном участке с помощью магнитного поля (см., например, Публикацию выложенной заявки на патент Японии № 2001-10978).
Однако было установлено, что при использовании магнитного вещества-носителя в качестве носителя затруднительно перорально ввести магнитное вещество-носитель, молекулы носителя обычно являются очень большими и существуют технические затруднения, обусловленные прочностью связывания и сродством между носителем и молекулами лекарственного средства; и, в первую очередь, затруднительно обеспечить практическое применение магнитного вещества-носителя.
Поэтому авторы настоящего изобретения предложили локальное терапевтическое лекарственное средство, в котором для придания положительной или отрицательной спиновой и зарядовой плотности боковые цепи связаны с основным каркасом органического соединения, и локальное терапевтическое лекарственное средство, в целом, эффективно управляется внешним магнитным полем, взаимодействующим с магнитным полем средства; и когда локальное терапевтическое лекарственное средство вводят в организм человека или животного, локальное терапевтическое лекарственное средство удерживается в области, в которой магнитное поле приложено локально с помощью магнитного поля, находящегося за пределами организма, и лечебные воздействия, которые может оказать само локальное терапевтическое лекарственное средство, проявляются на указанном выше участке (WO 2008/001851). Это терапевтическое лекарственное средство само является магнитным, и в нем не используются магнитные вещества-носители. В публикации раскрыто комплексное соединение железо-сален в качестве одного такого лекарственного средства. В Публикации выложенной заявки на патент Японии № 2009-173631 раскрыты противоопухолевые средства, содержащие комплексные соединения железо-сален.
Кроме того, авторы настоящей заявки предложили различные лекарственные средства, способные связывать, например, лекарственные молекулы с комплексом металл-сален, и методику их перемещения на целевой участок индивидуума с помощью магнитного поля (WO 2010/058280).
ПАТЕНТНЫЕ ДОКУМЕНТЫ
Патентный документ 1: Публикация выложенной заявки на патент Японии № 2001-10978.
Патентный документ 2: WO 2008/001851.
Патентный документ 3: Публикация выложенной заявки на патент Японии № 2009-173631.
Патентный документ 4: WO 2010/058280.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧА, РЕШАЕМАЯ ИЗОБРЕТЕНИЕМ
Если размер зерен комплекса металл-сален небольшой, то необходимые магнитные характеристики не могут проявиться. С другой стороны, если размер зерен комплекса металл-сален большой, то комплекс металл-сален не может пройти через капилляры. Таким образом, размер зерен комплекса металл-сален предпочтительно является таким, чтобы он мог воздействовать на живой организм в качестве лекарственного средства без закупоривания капилляров и он мог направляться на участок-мишень с помощью магнитного поля.
С другой стороны, даже если размер зерен кристаллов комплекса металл-сален таков, что приводит к затруднениям при прохождении через капилляры, пригодность комплекса металл-сален можно улучшить, если можно регулировать динамику комплекса металл-сален, например, путем содействия удерживанию комплекса металл-сален в пораженной ткани с помощью магнитного поля после локального введения в пораженную ткань.
Первым объектом настоящего изобретения является комплексное соединение металл-сален, размер зерен кристаллов которого регулируется так, чтобы он являлся подходящим. Кроме того, вторым объектом настоящего изобретения является комплексное соединение металл-сален, которое можно локально ввести на участок-мишень, такой как пораженная ткань. Кроме того, третьим объектом настоящего изобретения является комплексное соединение металл-сален, обладающее размером зерен, пригодным для направления на участок-мишень с помощью магнитного поля, даже если комплексное соединение металл-сален системно введено в живой организм в качестве лекарственного средства. Кроме того, четвертым объектом настоящего изобретения является способ получения этих комплексных соединений металл-сален.
Для решения указанных выше задач размер зерен кристаллов комплексного соединения металл-сален, предлагаемого в настоящем изобретении, ограничен так, что зерна не закупоривают капилляры людей или животных и комплексное соединение металл-сален, предлагаемое в настоящем изобретении, отличается тем, что его динамику можно регулировать внешним магнитным полем. С учетом того, что диаметр капилляров равен от 8 мкм до 20 мкм и размер зерен эритроцитов, которые проходят через капилляры, равен примерно 8 мкм, и размер зерен лейкоцитов, которые проходят через капилляры, равен примерно от 8 до 20 мкм, размер зерен кристаллов комплексного соединения металл-сален, предлагаемого в настоящем изобретении, предпочтительно равен 8 мкм или менее; предпочтительно от 1 мкм или более до 8 мкм или менее; более предпочтительно от 1 мкм или более до 5 мкм или менее и еще более предпочтительно от 1 мкм или более до 3 мкм или менее. Комплексное соединение металл-сален само является магнитным и может удерживаться на пораженном участке внешним магнитным полем, например, после локального введения на пораженный участок.
Если размер зерен комплексного соединения металл-сален равен менее 1 мкм, то намагниченность, которая обеспечивает локальное удерживание комплексного соединения металл-сален при воздействии внешнего магнитного поля, уменьшается, и комплексное соединение металл-сален может переходить из пораженной ткани-мишени в капилляры, находящиеся за пределами пораженной ткани-мишени. Таким образом, если комплексное соединение металл-сален вводят локально на пораженный участок, желательно, чтобы минимальный размер зерен кристаллов комплексного соединения металл-сален равнялся 1 мкм. Содержание комплексных соединений металл-сален с размером зерен кристаллов, равным от 1 мкм или более до 3 мкм или менее, предпочтительно составляет 70% или более.
Для того чтобы комплексное соединение металл-сален попало на пораженный участок при системном введении и чтобы комплексное соединение металл-сален удерживалось на пораженном участке магнитным полем, размер кристалла комплекса металл-сален должен быть равен 1 мкм или менее, так чтобы комплексные соединения металл-сален могли проходить через большое количество капилляров и содержание комплексных соединений металл-сален с размером зерен кристаллов, равным от 100 нм или более до 500 нм или менее, предпочтительно составляет 70% или более.
Если размер зерен комплексного соединения металл-сален превышает 1 мкм, то комплексное соединение металл-сален может не пройти через капилляры. Если размер зерен комплексного соединения металл-сален равен менее 100 нм, то невозможно эффективно обеспечить ферромагнетизм, необходимый для перемещения под действием магнитного поля. С другой стороны, если размер зерен превышает 500 нм, то комплексное соединение металл-сален не может с легкостью пройти через капилляры. Если содержание частиц с размером зерен, равным от 100 нм или более до 500 нм или менее, равно менее 70%, то увеличивается содержание зерен, неспособных проходить через капилляры. Размер зерен предпочтительно равен от 200 нм или более до 400 нм или менее, размер зерен еще более предпочтительно равен от 250 нм или более до 350 нм или менее.
Комплексное соединение металл-сален, предлагаемое в настоящем изобретении, обычно называется комплексом металлов с саленом в качестве лиганда и также включает замещенные и производные комплексов металлов. Структурная формула комплексного соединения металл-сален представлена ниже формулой (I). Все "a"-"h" могут означать водород или по меньшей мере один из "a"-"h" может быть заменен функциональными группами/заместителями, не являющимися водородом.
Производные комплексного соединения металл-сален, предлагаемые в настоящем изобретении, включают комплексные соединения металл-сален или их производные, связанные с функциональными молекулами, такими как молекулы лекарственных средств, ферменты и антитела, как, например, указано в WO 2010/058280. Раскрытие, приведенное в указанной публикации, во всей своей полноте включено в настоящее описание в качестве ссылки. Производное комплексного соединения металл-сален в комплексе с молекулой лекарственного средства применимо в качестве носителя для перемещения или локализации молекул лекарственных средств в пораженной ткани-мишени.
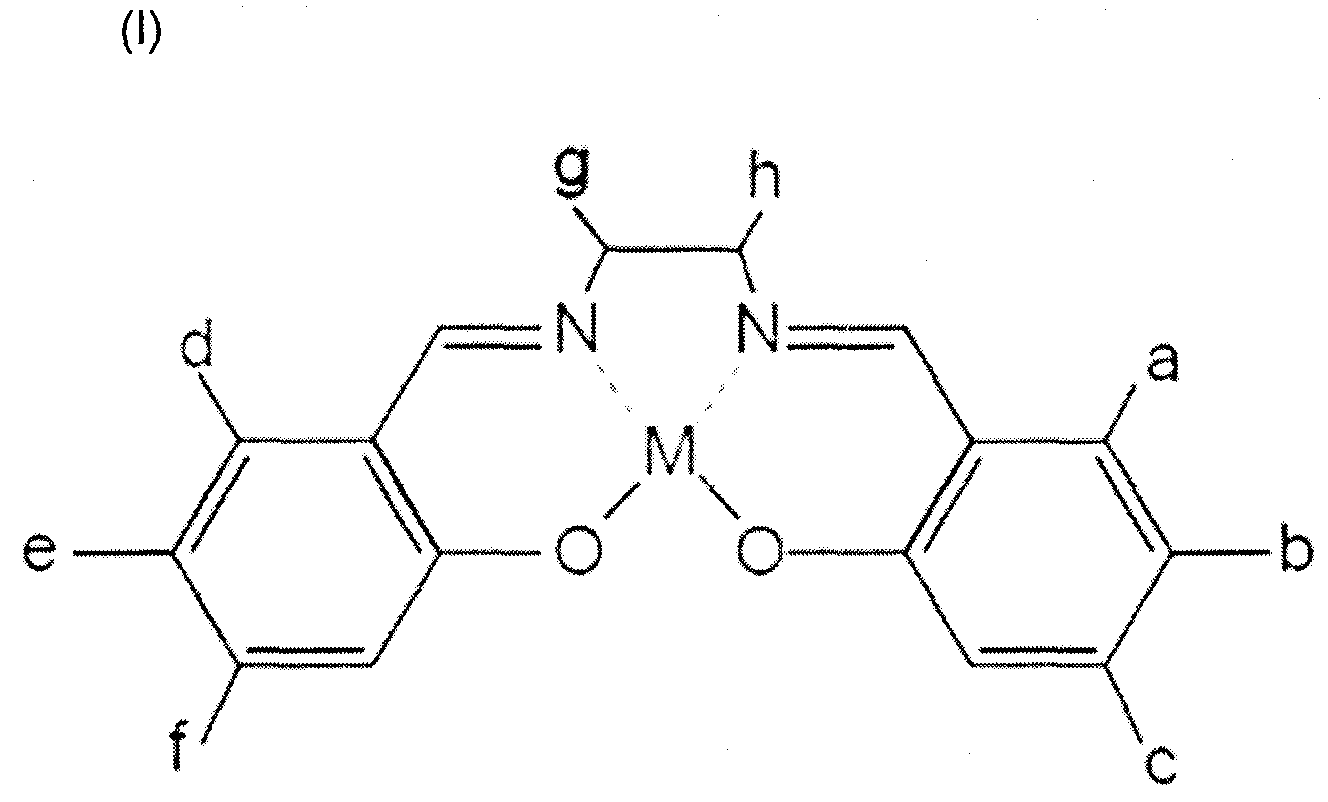
Комплекс N,N'-бис(салицилиден)этилендиамина с металлом
В формуле (I) "M" означает Fe, Cr, Mn, Co, Ni, Mo, Ru, Rh, Pd, W, Re, Os, Ir, Ft, Nd, Sm, Eu или Gd.
Предпочтительные варианты локального введения комплексного соединения металл-сален, предлагаемого в настоящем изобретении, в пораженную ткань организма человека или животного включают инъекцию в артерию, находящуюся вблизи от пораженной ткани или инъекцию в саму пораженную ткань. Общеизвестные варианты, такие как мази, лосьоны или кожные пластыри, можно считать другими вариантами локального введения. Варианты системного введения комплексного соединения металл-сален включают внутривенную инъекцию и/или вливание. Типичные примеры назначаемых инъекций и вливаний комплексного соединения металл-сален включают физиологический раствор в качестве растворителя и можно использовать суспензии или замутнители. Комплексное соединение металл-сален, предлагаемое в настоящем изобретении, предпочтительно использовать в качестве противоопухолевого средства, как это раскрыто в указанном выше предшествующем уровне техники. Другие случаи применения включают использование в качестве носителя для доставки лекарственной молекулы лекарственного средства путем связывания комплексного соединения металл-сален с другой лекарственной молекулой, как отмечено выше, и, кроме того, использование в качестве диагностического средства в магнитно-резонансной томографии.
При введении комплексного соединения металл-сален, предлагаемого в настоящем изобретении, индивидууму (человеку или животному) с приложением магнитного поля (от 500 мТл до 1 Тл (1000 мТл)) на участок-мишень, на котором находится пораженный орган или пораженная ткань, комплексное соединение металл-сален можно направить на пораженный участок-мишень или удерживать на нем, если имеется по меньшей мере магнитное поле.
РЕЗУЛЬТАТЫ ИЗОБРЕТЕНИЯ
Как указано выше, в соответствии с настоящим изобретением можно получить комплексное соединение металл-сален, для которого можно обеспечить надлежащий размер зерен кристаллов. Кроме того, в соответствии с настоящим изобретением можно получить комплексное соединение металл-сален, которое можно локально ввести на участок-мишень, такой как пораженная ткань. Кроме того, настоящее изобретение может предоставить комплексное соединение металл-сален, обладающее размером зерен, позволяющим направить его на участок-мишень магнитным полем, даже если комплексное соединение металл-сален системно введено в живой организм в качестве лекарственного средства. Кроме того, настоящее изобретение может предоставить способ получения этих комплексных соединений металл-сален.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
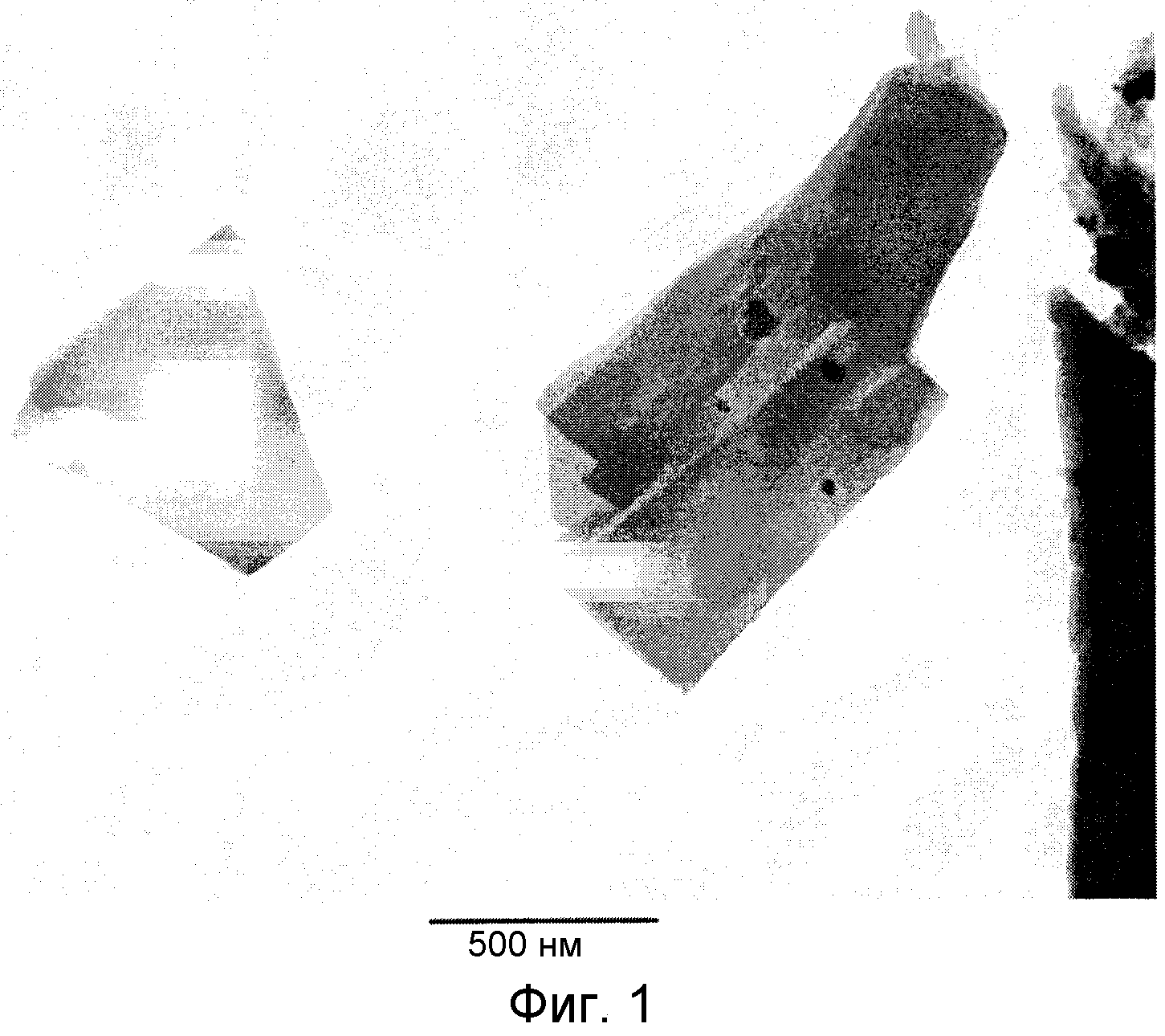
ФИГ. 1
На ФИГ. 1 приведена полученная с помощью трансмиссионного электронного микроскопа фотография комплексных соединений железо-сален, в которых зерна кристаллов являются крупными (наибольшая длина превышает 1 мкм), соответствующих примеру, приведенному в настоящем изобретении (пример I).
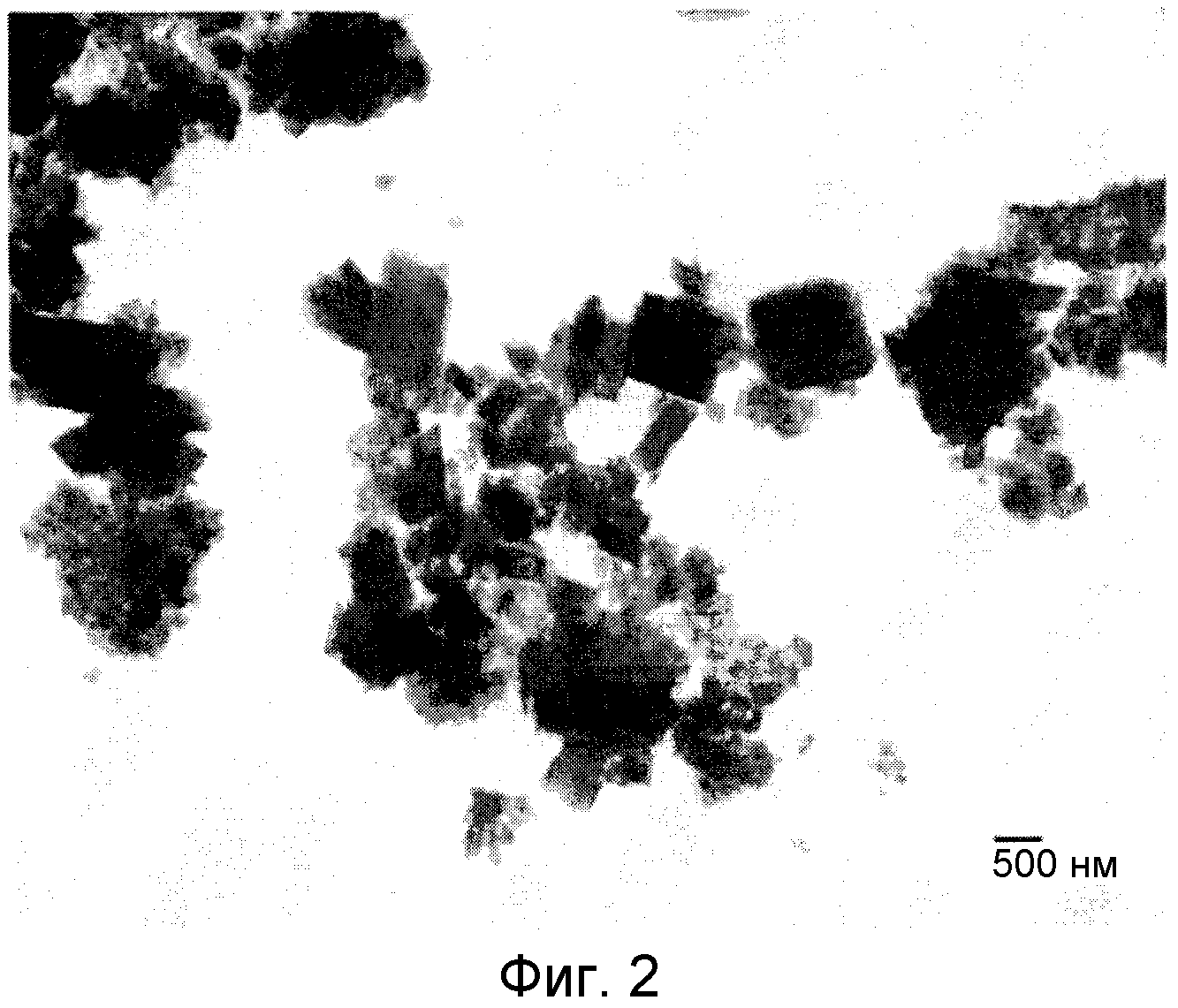
ФИГ. 2
На ФИГ. 2 приведена полученная с помощью электронного микроскопа фотография кристаллов комплексных соединений железо-сален, соответствующих примеру, приведенному в настоящем изобретении (пример II).
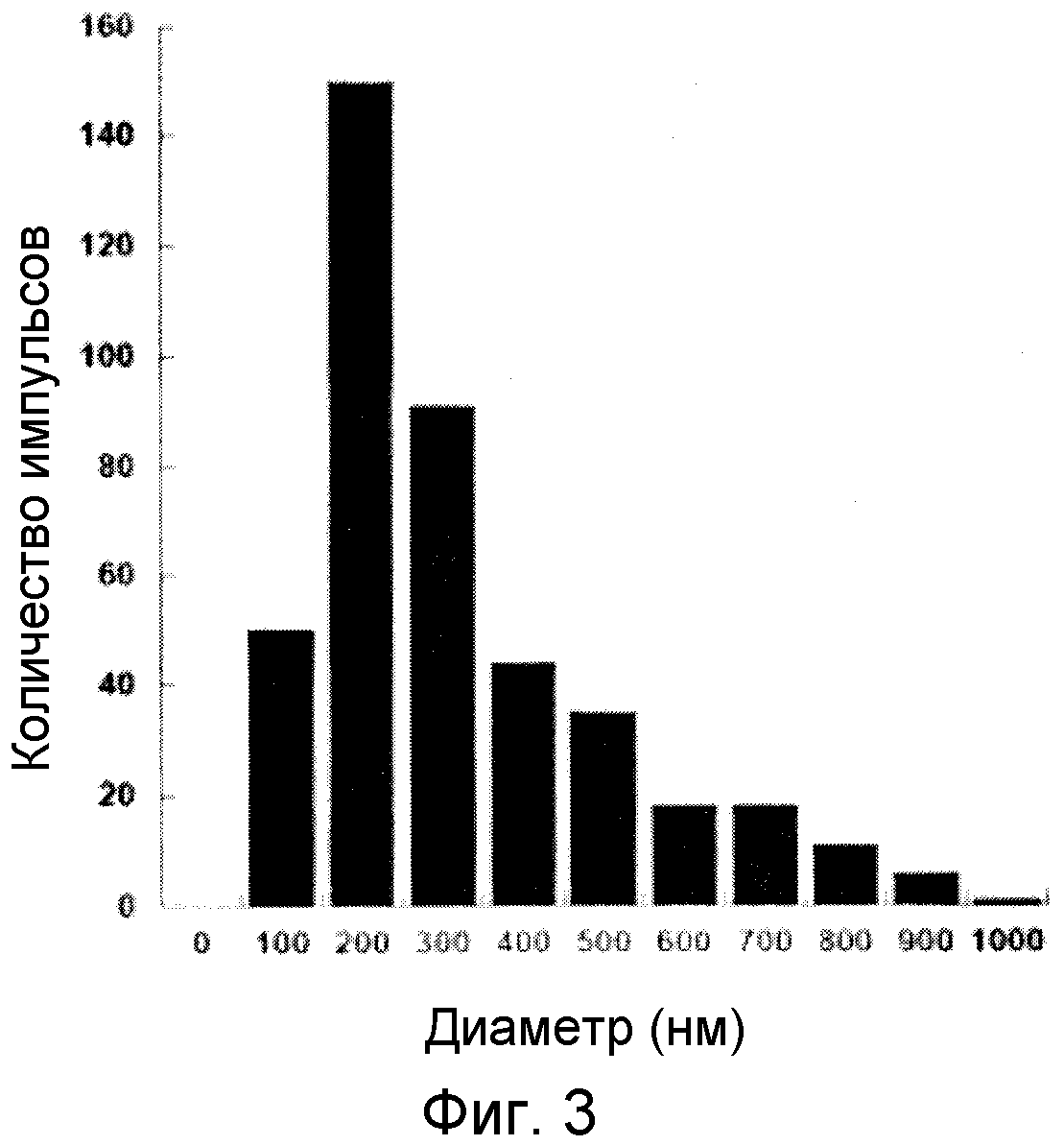
ФИГ. 3
На ФИГ. 3 приведена диаграмма распределения по размерам зерен кристаллов комплексных соединений железо-сален, соответствующих примеру, приведенному в настоящем изобретении (пример II).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Пример I: Локальное введение комплексных соединений металл-сален (комплексных соединений железо-сален)
Пример I-1: Получение комплексных соединений металл-сален
Лиганд сален (N,N'-бис(салицилиден)этилендиамин) и его производные синтезируют по реакции конденсации с дегидратацией производных салицилового альдегида и этилендиамина с получением лиганда салена (N,N'-бис(салицилиден)этилендиамина) и его производных. После превращения полученного лиганда в производное феноксидного иона или после реакции полученного лиганда с ионом металла в щелочной среде получают комплекс металл-сален. Подробное описание приведено ниже в настоящем изобретении.
Стадия 1:
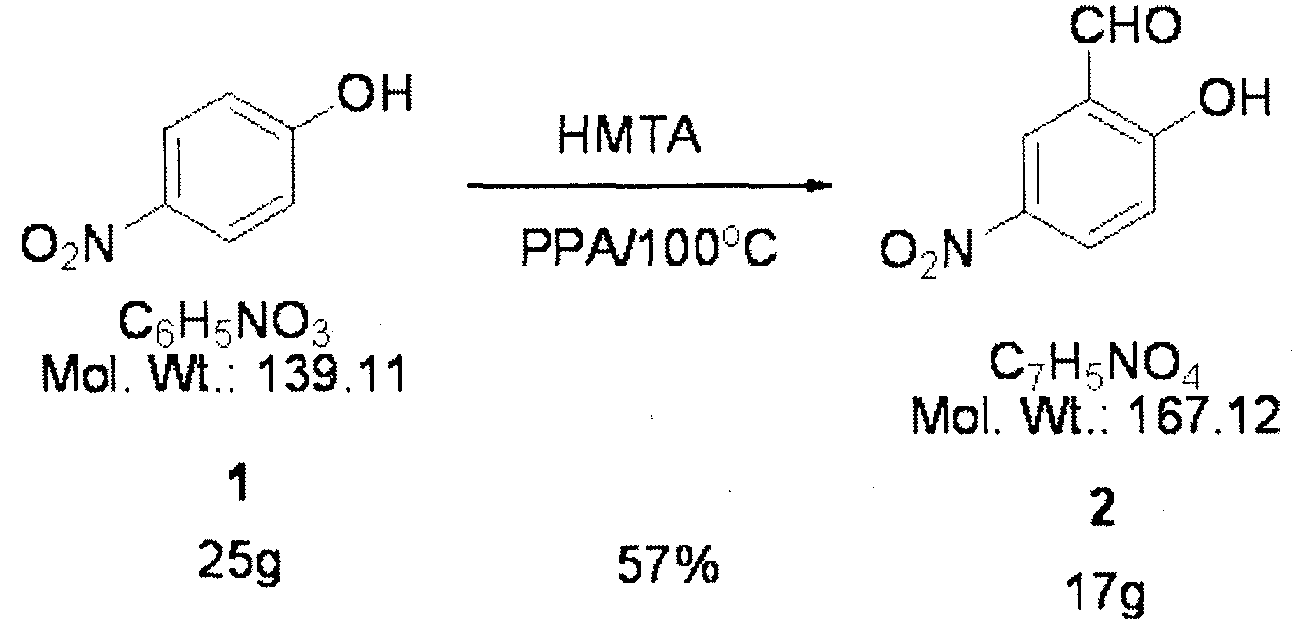
Смесь 4-нитрофенола (25 г, 0,18 моля), гексаметилентетрамина (25 г, 0,18 моля) и полифосфорной кислоты (200 мл) перемешивают в течение 1 ч при 100°C. Затем смесь добавляют к 500 мл этилацетата и 1 л воды и перемешивают до полного растворения. После добавления к раствору еще 400 мл этилацетата раствор разделяют на две фазы, водную фазу удаляют и оставшиеся соединения дважды промывают щелочным растворителем и сушат над безводным MgSO4 и получают 17 г синтезированного соединения 2 (выход 57%).
Стадия 2:
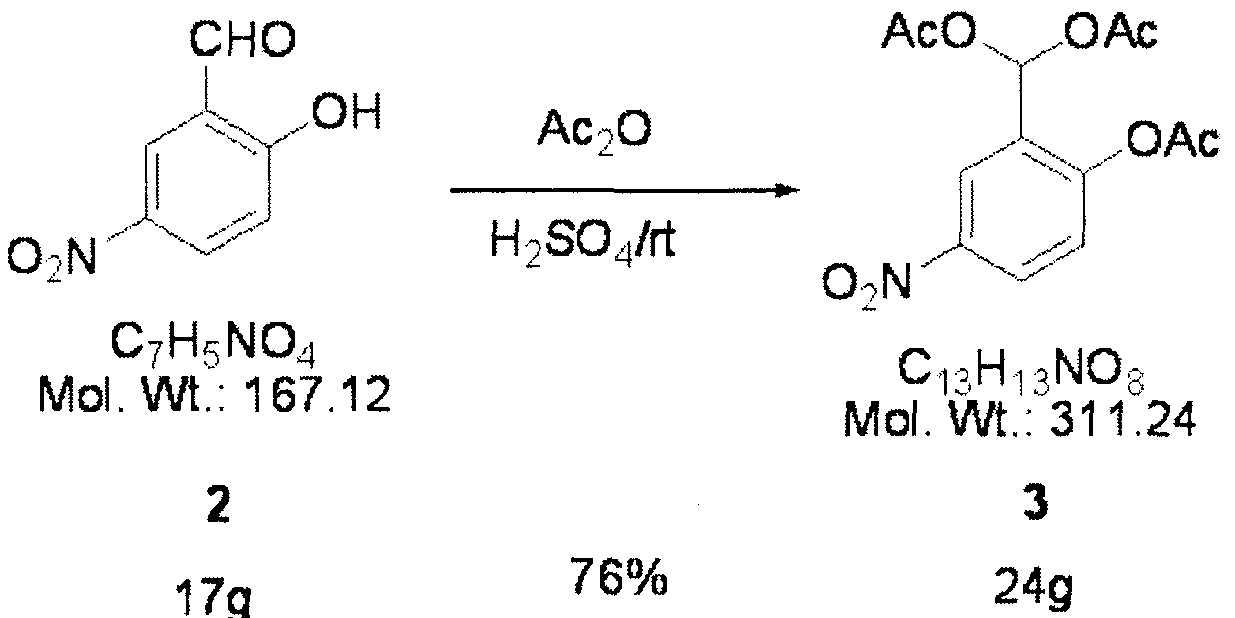
Соединение 2 (17 г, 0,10 моля), уксусный ангидрид (200 мл) и H2SO4 (небольшое количество) перемешивают в течение 1 ч при комнатной температуре. Полученный раствор перемешивают в течение 0,5 ч в воде со льдом (2 л) для проведения гидролиза. После фильтрования и сушки полученного раствора на воздухе получают белый порошок. После перекристаллизации порошка из раствора, содержащего этилацетат, получают 24 г соединения 3 (выход 76%) в виде кристаллов белого цвета.
Стадия 3:
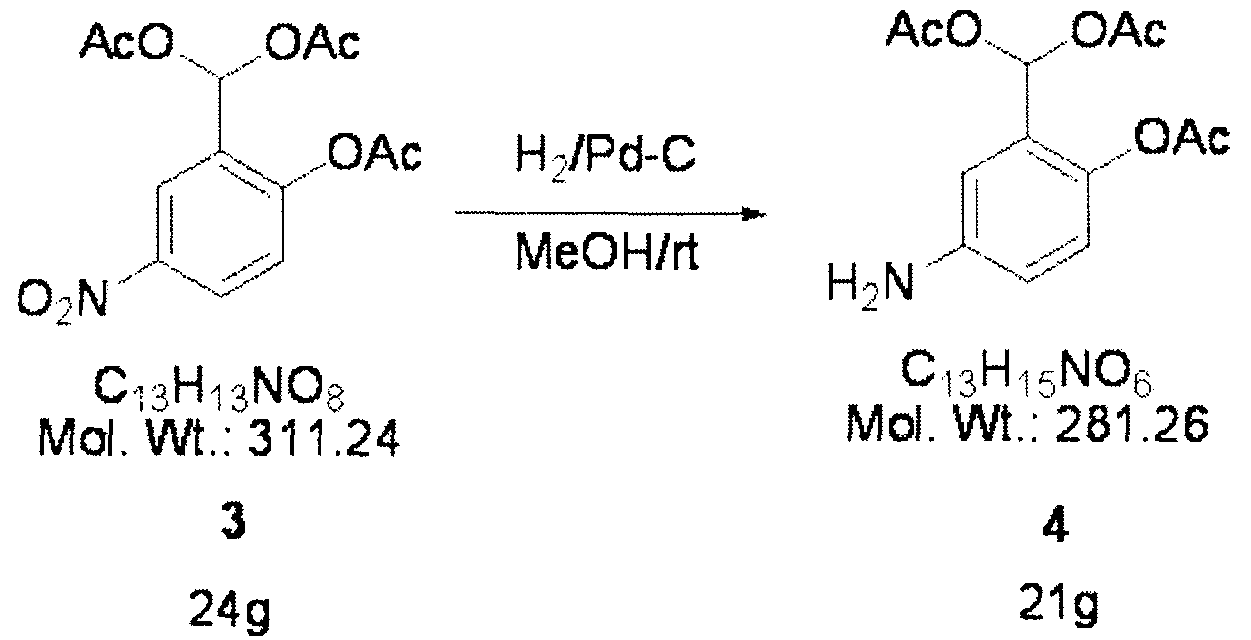
Смесь соединения 3 (24 г, 77 ммоля), метанола (500 мл) и угля (2,4 г), на котором находится 10% палладия, восстанавливают в восстановительной атмосфере водорода при давлении, равном 1,5 атм. После завершения восстановления продукт фильтруют и получают соединение 4 (21 г) в виде масла коричневого цвета.
Стадии 4 и 5:
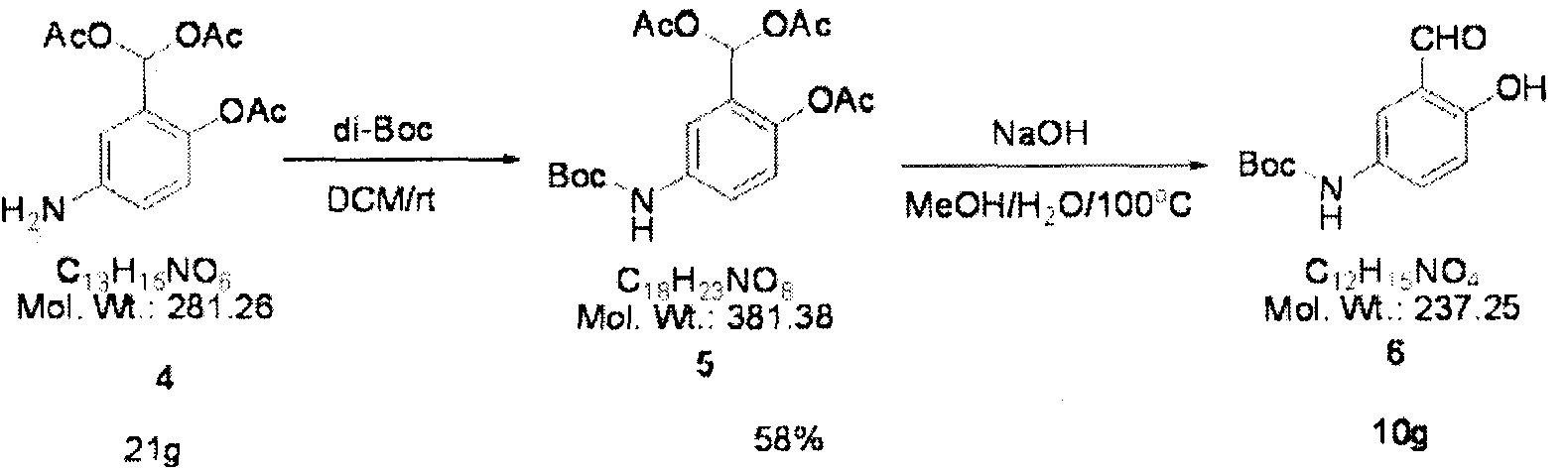
Соединение 4 (21 г, 75 ммоля) и ди(трет-бутил)дикарбонат (18 г, 82 ммоля) перемешивают в течение ночи в атмосфере азота в безводном дихлорметане (ДХМ) (200 мл). После выпаривания полученного раствора в вакууме оставшийся раствор растворяют в метаноле (100 мл). Затем добавляют гидроксид натрия (15 г, 374 ммоля) и воду (50 мл) и раствор кипятят с обратным холодильником в течение 5 ч. Затем раствор охлаждают, фильтруют, промывают водой, сушат в вакууме и получают коричневое соединение. Полученное соединение дважды обрабатывают с помощью флэш-хроматографии с использованием силикагеля и получают 10 г соединения 6 (выход 58%).
Стадия 6:
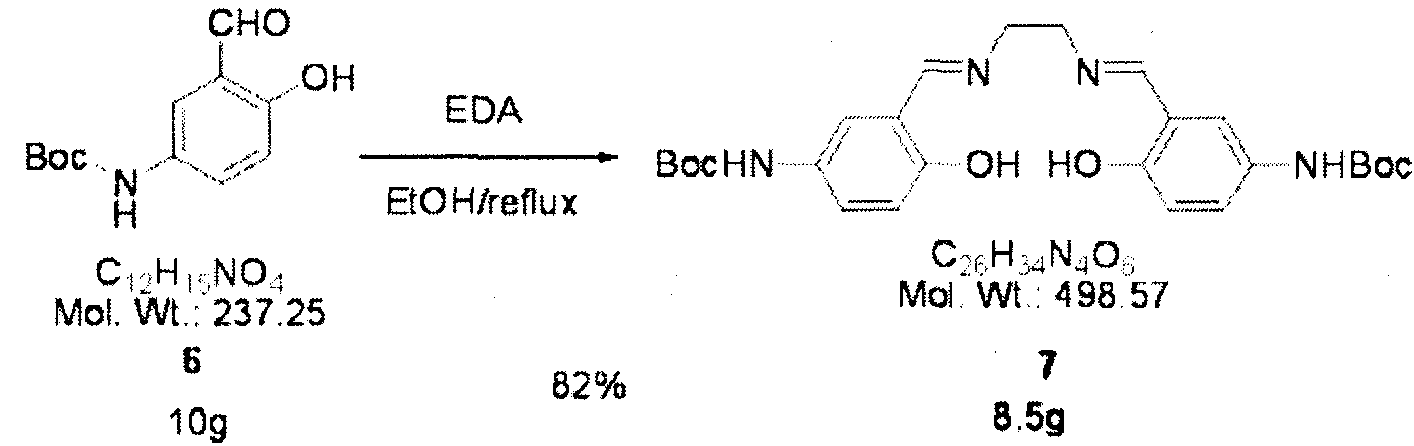
Соединение 6 (10 г, 42 ммоля) добавляют к 400 мл безводного этанола, кипятят с обратным холодильником и при перемешивании в течение 0,5 ч по каплям добавляют этилендиамин (1,3 г, 21 ммоля), растворенный в 20 мл безводного этанола. Затем перемешанный раствор помещают в контейнер со льдом, охлаждают и перемешивают в течение 15 мин. Затем раствор при перемешивании промывают с помощью 200 мл этанола, фильтруют и сушат в вакууме и получают 8,5 г соединения 7 (сален) (выход 82%).
Стадия 7:

Соединение 7 (8,2 г, 16 ммоля) и триэтиламин (22 мл, 160 ммоля) добавляют к безводному метанолу (50 мл) и в атмосфере азота перемешивают с раствором FeCl3 (2,7 г, 16 ммоля) в 10 мл метанола. После перемешивания раствора в атмосфере азота в течение 1 ч при комнатной температуре получают коричневое соединение. Полученное соединение нагревают при 80°C и затем медленно охлаждают до комнатной температуры (например, в течение от 10 ч до 12 ч), например, на воздухе. Раствор фильтруют и кристаллический остаток сушат в вакууме. Полученные кристаллы дважды промывают с помощью 400 мл дихлорметана и дважды щелочным раствором (тетрагидрофуран), сушат над Na2SO4 и дополнительно сушат в вакууме и получают комплекс A (комплексное соединение железо-сален (в котором все "a"-"h" означают H). Это соединение перекристаллизовывают из раствора в диэтиловом эфире и парафине и после очистки кристаллов с помощью высокоэффективной жидкостной хроматографии получают 5,7 г комплекса A (выход 62%), обладающего чистотой, равной 95% или более. Перекристаллизацию проводят при медленном охлаждении при условиях, аналогичных описанным выше. Реакцию на стадии 7 также можно проводить при нагревании. В этом случае не требуется проводить нагревание полученного соединения.
Если используют комплекс металла, не представляющий собой комплексное соединение железо-сален, то вместо FeCl3 можно использовать хлориды металлов, не являющихся железом, такие как MCl3. Тот факт, что комплекс Mn-сален, комплекс Cr-сален и комплекс Co-сален, которые не являются комплексными соединениями железо-сален, обладают магнитными характеристиками, которые позволяют перемещать комплекс Mn-сален, комплекс Cr-сален и комплекс Co-сален с помощью внешнего магнитного поля, раскрыт в заявке на патент Японии № 2009-177112, поданной заявителями настоящей заявки. Кроме того, из Публикации выложенной заявки на патент Японии № 2009-173631 видно, что металлы, такие как комплексное соединение железо-сален, обладают противоопухолевым воздействием. Раскрытия, приведенные в указанных заявках предшествующего уровня техники, во всей их полноте включены в настоящее описание в качестве ссылки.
Пример I-2: Измерение размера зерен
Затем измеряют размер зерен кристаллов после перекристаллизации. Сначала отвешивают примерно 2 г кристаллов и кристаллы размалывают к ступке в течение примерно 30 мин. Размолотые кристаллы собирают, повторно взвешивают, определяют количество разбавляющего растворителя (физиологического раствора) и кристаллы разбавляют указанным выше количеством растворителя. В этом случае концентрация зерен кристаллов равна 20 мМ.
Затем 50 мл раствора выливают в пробирку, затем в пробирку выливают 20 мл растворителя и измельчают путем обработки ультразвуком. Эту обработку проводят при перемешивании, пока невооруженным глазом не перестанут быть видны зерна. Затем раствор разбавляют точно определенным количеством разбавителя (до концентрации, необходимой для внутривенной инъекции: 9,25 мМ) и фильтруют через фильтр с ячейками размером 40 мкм (BD Falcon).
Размер зерен кристаллов, полученных после фильтрования, измеряют с помощью изображений, полученных посредством электронного микроскопа. Использованный прибор и, например, условия являются следующими.
Прибор: трансмиссионный электронный микроскоп (ТЭМ) (изготовленный фирмой Hitachi, H-7100FA).
Условия: ускоряющее напряжение равно 100 кВ.
Приготовление образца: методика диспергирования (после размола кристаллов в ступке добавляют чистую воду и диспергируют с помощью сетки с исследованием с помощью ТЭМ).
Программное обеспечение для определения распределения зерен по размерам: Image-Pro Plus (Media Cybernetics, MD, U.S.A.).
Оценки для измерения: изображения молекул комплексного соединения железо-сален на фотографиях, полученных с помощью ТЭМ.
Кристаллизацию и перекристаллизацию проводят при охлаждении на воздухе и измеряют размер зерен (количество образцов: 140). Полученный средний размер зерен равен 450 нм, при стандартном отклонении, равном 360. На ФИГ. 1 приведена полученная на электронном микроскопе фотография типичных образцов. На ней можно видеть кристаллы с размером зерен, превышающим 1 мкм, и содержание частиц с размером зерен, равным от 1 мкм или более до 3 мкм или менее, равно 70% или более (доля частиц). Кристаллы обладают игольчатой формой.
Пример I-3: Проверка магнитных характеристик
Проверено наличие ферромагнетизма у кристаллов с размером зерен, полученным в примере I-1. Определение зависимости магнитное поле - намагниченность, проведенное с помощью Quantum Design MPMS7, привело к петлям гистерезиса, характерным для ферромагнитных веществ, при температурах от -268°C до 37°C, и это подтвердило, что кристаллы с размером зерен, полученным в примере I-1, являются ферромагнитными веществами.
После этого клетки меланомы (клон М3) выращивают в круглой чашке Петри и их равномерно опрыскивают комплексами железо-сален. Затем под чашкой Петри на 24 ч помещают грибообразный магнит, обладающий плотностью магнитного потока, равной 240 мТл. В результате по краям грибообразного магнита наблюдается гибель клеток меланомы.
Пример I-4: Локальное введение в пораженную ткань
Взятую у кроликов плоскоклеточную карциному (VX2) трансплантировали в бедренную область кролика и через 2-3 недели после этого приживление трансплантата регистрировали. Затем комплексные соединения железо-сален, исследованные с помощью трансмиссионного электронного микроскопа, в которых зерна являются крупными, с размером зерен, равным 1500 нм (1,5 мкм), разбавляли физиологическим раствором до концентрации, равной 100 мкМ, и объем, равный 5 мг/кг, вводили в артерию с помощью катетера. Введение проводили в артерию бедренной области. Эта процедура соответствует подробно описанной в публикации Japan Radiological Society 50(4), 426-428, 1990. Через 7 дней после начала введения указанного объема обнаружено, что хотя объем опухоли в группе животных, которым в артерию не вводили комплексные соединения железо-сален, увеличивался примерно вдвое по сравнению с начальным объемом опухоли, объем опухоли в группе животных, которым в артерию вводили комплексные соединения железо-сален, уменьшился на 20% по сравнению с объемом опухоли до лечения. При проведении введения в артерию комплексы железо-сален удерживались на пораженном участке постоянным магнитом, обладающим плотностью магнитного потока, равной 600 мТл, так что лекарственное средство не перемещалось в другие органы. Срезы клеток пораженного участка подтвердили, что комплексы железо-сален удерживались в раковых тканях. Для окрашивания использовали берлинскую лазурь (гексацианоферрат железа(III) и хлороводородная кислота), изготовленную фирмой Sigma.
Пример II: Системное введение комплексных соединений металл-сален (комплексных соединений железо-сален)
Пример II-1: Получение комплексных соединений металл-сален
Хотя на стадии 7 примера I-1 охлаждение проводят медленно "(например, в течение от 10 ч до 12 ч), например, путем охлаждения на воздухе до комнатной температуры", в этом примере охлаждение проводят быстро (скорость охлаждения: 10-30°C/мин), например, путем охлаждения водой, обладающей комнатной температурой, или водой со льдом. Все остальные методики являются такими же, как в примере I.
Пример II-2: Измерение размера зерен
Исследовали 436 образцов. Все остальные методики измерения являются такими же, как в примере I-2. Размер зерен кристаллов каждого образца измеряют дважды. Полученный средний размер зерен равен 300 нм, а стандартное отклонение равно 300. На ФИГ. 2 приведена полученная с помощью электронного микроскопа фотография типичных образцов. На ФИГ. 3 приведено распределение зерен по размерам. На ФИГ. 3 можно видеть, что содержание частиц с размером зерен, равным 1 мкм или менее, и с размером зерен, равным от 100 нм или более до 500 нм или менее, равно 70% или более. Кристаллы обладают игольчатой формой.
Пример II-3: Проверка магнитных характеристик
Наличие ферромагнетизма у кристаллов с размером зерен, полученным в примере II-1, проверено по той же методике, как в примере I-2. Воздействие на клетки меланомы такое же, как воздействие, I-2.
Пример II-4: Прохождение через капилляры
Комплексы железо-сален, полученные в примере II-1, не закупоривают капилляры. Даже введение в хвостовую вену мыши раствора, обладающего концентрацией, равной 9,25 мМ, в котором комплексы железо-сален растворены в физиологическом растворе, не приводит к закупорке кровеносных сосудов. Введение в хвостовую вену мыши раствора, содержащего комплексные соединения железо-сален с размером зерен кристаллов, равным 10 мкм (растворены в физиологическом растворе при концентрации, равной 9,25 мМ), через 5 с явно приводит к закупорке кровеносных сосудов легких.
Сравнительный пример I: Проверка магнитных характеристик
Определение зависимости магнитное поле - намагниченность, проведенное с помощью Quantum Design MPMS7, привело к петлям гистерезиса, характерным для сверхпарамагнитных веществ, при температурах от -268°C до 37°C, и это подтвердило, что комплексы железо-сален с размером зерен, равным примерно 50, являются сверхпарамагнитными веществами.
Хотя в приведенном выше описании описаны предпочтительные варианты осуществления, такие же результаты можно получить для комплексных соединений металл-сален, в которых металлом не является железо. Кроме того, "размер зерен кристаллов" означает диаметр кристаллов и это значение может быть получено математически или статистически, например, путем расчета среднего значения или стандартного отклонения для каждого размера зерен множества частиц комплексных соединений металл-сален. В настоящем изобретении магнитное лекарственное средство означает само комплексное соединение металл-сален, замещенные комплексы металл-сален или их производные, описанные выше. Магнитное лекарственное средство содержит комплексные соединения салена, которые являются активными ингредиентами, при концентрации, достаточной для проявления фармакологического воздействия, такого как противоопухолевые воздействия.
Реферат
Настоящее изобретение относится к способу получения комплексного соединения металл-сален, описывающееся структурной формулой (I)где M означает Fe, Cr, Mn, Со, Ni, Mo, Ru, Rh, Pd, W, Re, Os, Ir, Pt, Nd, Sm, Eu или Gd. Способ включает кристаллизацию комплексного соединения металл-сален при условиях быстрого охлаждения, причем скорость охлаждения составляет от 10 до 30°C/мин. Изобретение позволяет получить комплексное соединение металл-сален, где размер зерен кристаллов, равный 1 мкм или менее, и размер зерен, равный от 100 нм или более до 500 нм или менее, составляет 70% или более. 1 з.п. ф-лы, 3 ил., 9 пр.
Формула
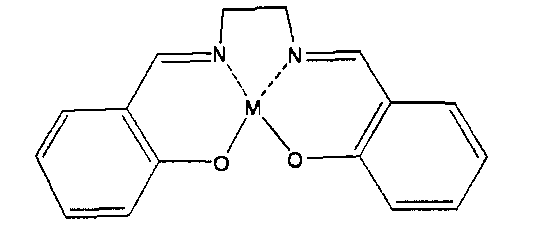
M означает Fe, Cr, Mn, Со, Ni, Mo, Ru, Rh, Pd, W, Re, Os, Ir, Pt, Nd, Sm, Eu или Gd, включающий:
кристаллизацию комплексного соединения металл-сален при условиях быстрого охлаждения, причем скорость охлаждения составляет от 10 до 30°C/мин.
проведение реакции салена с соединением металла и последующее получение кристаллической частицы комплекса металл-сален путем быстрого охлаждения нагретого реагента.

Комментарии