Твердые липидные композиции - RU2248218C2
Код документа: RU2248218C2
Описание
Настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере один ингибитор липаз.
Примерами таких ингибиторов липаз являются липстатин и орлистат. Последний также хорошо известен как тетрагидролипстатин или ТГЛ, и он является производным природного продукта, выделяемого Streptomyces toxytricini. Установлено, что этот класс соединений проявляет как in vitro, так и in vivo активность в отношении различных липаз, таких как лингвальная липаза, панкреатическая липаза, желудочная липаза и карбоксилэфир-липаза. Применение этого соединения для лечения или предупреждения ожирения и гиперлипидемии описано, например, в патенте US 4598089.
Орлистат обычно применяют в дозах 120 мг за один прием пищи, и эта доза не зависит от веса тела пациента. Орлистат оказывает локальное действие в желудочно-кишечном тракте (ЖК) и предупреждает расщепление липазой триглицеридов и вследствие этого ингибирует образование абсорбируемых продуктов расщепления липидов. Для этой цели не требуется наличие системной доступности ингибиторов липаз, наоборот, предпочтительным является их локальное присутствие в желудочно-кишечном тракте.
Общепринятые включающие ингибиторы липаз композиции примерно на 30% ингибируют абсорбцию жира после поглощения смешанной пищи; повышение концентрации ингибиторов липаз в фармацевтической композиции не повышает ее клиническую эффективность и/или активность, в то время как интенсивность местных побочных действий повышается.
Анальное истечение масла (маслянистые пятна) является побочным действием, которое иногда наблюдается у пациентов при лечении ингибиторами липаз. Это явление отражает физическое отделение некоторой части жидкого неабсорбированного поглощенного с пищей жира из массы твердых веществ в нижнем отделе толстой кишки.
Таким образом, задачей настоящего изобретения является создание содержащих ингибиторы липаз композиций, способствующих повышению клинической эффективности и/или активности самого ингибитора, в которых минимизированы или которые полностью лишены вышеуказанных недостатков.
Эта задача решается с помощью фармацевтической композиции, включающей по меньшей мере один ингибитор липаз и по меньшей мере один эфир жирных кислот и полиолов, которая отличается тем, что температура плавления эфира жирной кислоты превышает температуру тела, т.е. >37°С, и полиол выбирают из группы, включающей глицерин, сахара, производные сахаров и их смеси.
При создании изобретения неожиданно было установлено, что введение ингибитора липаз в композицию, которая включает по меньшей мере один из указанных выше эфиров жирных кислот, в значительной степени повышает эффективность и активность самого ингибитора липаз. Кроме того, снижается вариабельность эффективности и/или активности между пациентами, а также частота встречаемости и серьезность побочных действий.
Было установлено, что фармацевтические композиции по изобретению оказывают наиболее благоприятное действие при пероральном введении во время принятия пищи человеком. При создании изобретения неожиданно было установлено, что их эффективность и активность выше, чем у уже существующих композиций. Это является неожиданным в связи с тем, что композиции по изобретению остаются твердыми внутри организма и вследствие этого они должны плохо диспергироваться среди масляных частиц пищи в желудке.
Кроме того, композиции по изобретению при оценке с использованием одного пробного завтрака снижают неприятные побочные действия по сравнению с уже существующими композициями, несмотря на то, что большее количество жира остается неабсорбированным. В опытах на людях с использованием одного пробного завтрака было установлено, что в стуле, полученном после поглощения композиций по изобретению, обнаружена меньшая степень отделения масла от основной массы стула по сравнению с традиционными композициями. Это является неожиданным, поскольку в собранных образцах стула присутствует такое же или большее количество жира.
В контексте настоящего описания понятие "ингибитор липаз" и "липазный ингибитор" относится к соединениям, которые обладают способностью ингибировать действие липаз, например желудочных и панкреатических липаз. Например, орлистат и липстатин, описанные в патенте США 4598089, являются эффективными ингибиторами липаз. Липстатин представляет собой природный продукт микробного происхождения, а орлистат получают путем гидрирования липстатина. Другие ингибиторы липаз включают класс соединений - аналогов орлистата, которые обычно называют панклицинами (Mutoh и др., 1994). Понятие "ингибитор липаз" также относится к полимеру, связанному с ингибиторами липаз, например, описанному в международной заявке на патент WO 99/34786 (на имя фирмы Geltex Pharmaceuticals Inc.). Эти полимеры отличаются тем, что они замещены по меньшей мере одной или несколькими группами, ингибирующими липазы. Понятие "ингибитор липаз" также включает фармацевтически приемлемые соли этих соединений. Предпочтительно понятие "ингибитор липаз" относится к орлистату.
Орлистат представляет собой известное соединение, которое применяют для лечения или предупреждения ожирения и гиперлипидемии (см. патент US 4598089, выданный 1 июля 1986 г., в котором также описаны методы получения орлистата, и патент US 6004996, в котором описаны соответствующие фармацевтические композиции). Другие приемлемые фармацевтические композиции описаны, например, в международных заявках на патент WO 00/09122 и WO 00/09123. Дополнительные методы получения орлистата описаны в публикациях европейских заявок на патент 185359, 189577, 443449 и 524495.
Орлистат вводят предпочтительно пероральным путем в количестве от 60 до 720 мг в день в виде разделенных доз 2-3 раза в день. Предпочтительно вводить пациенту от 180 до 360 мг, наиболее предпочтительно 360 мг в день ингибитора липаз предпочтительно в виде разделенных доз 2 или особенно предпочтительно 3 раза в день. Пациент предпочтительно представляет собой человека, который страдает ожирением или избыточным весом, т.е. человека, у которого индекс веса тела составляет 25 или более. Как правило, предпочтительно применять ингибитор липаз в процессе поглощения пищи, содержащей жир. Как правило, ингибитор липаз, как он определен выше, предпочтительно применяют для лечения человека, имеющего тяжелый семейный анамнез с точки зрения ожирения и имеющего индекс веса тела 25 или более.
Таким образом, настоящее изобретение относится к композиции, содержащей по меньшей мере один ингибитор липаз и по меньшей мере один эфир жирных кислот и полиолов, которая отличается тем, что эфир жирной кислоты имеет температуру, превышающую температуру тела, а полиолы выбирают из группы, включающей глицерин, сахара, производные сахаров и их смеси.
Полиолы могут быть независимо друг от друга выбраны из группы, включающей глицерин, сахара, производные сахаров и их смеси. Эта группа, в частности, включает сахарозу, глицерин и сахарные спирты, и наиболее предпочтительно глицерин, т.е. в композициях по изобретению наиболее предпочтительно применяют эфиры, представляющие собой глицериды.
Понятие "сахарные спирты" относится к соединениям, включающим моно-, олиго- и полисахариды и их редуцированные продукты, например маннит.
Понятие "эфир, представляющий собой глицерид" относится к эфиру глицерина. Согласно настоящему изобретению эфир может включать 1-3, предпочтительно 1 или 3 фрагмента жирных С12-С20 кислот на фрагмент глицерина, или они могут представлять сбой фосфолипид, предпочтительно лецитин, или их смеси. Например, глицериды могут быть выбраны из группы, включающей один или несколько триглицеридов, один или несколько моноглицеридов, один или несколько фосфолипидов и их смеси.
Предпочтительно фрагменты жирных кислот в эфирах жирных кислот и полиолов независимо друг от друга имеют 12 или большее количество атомов углерода, предпочтительно 12-20 атомов углерода. Наиболее предпочтительно фрагменты жирных кислот в эфирах жирных кислот и полиолов имеют 12-20 атомов углерода и являются насыщенными.
Согласно предпочтительному варианту осуществления изобретения приемлемыми триглицеридами являются трилаурин, тримиристин, трипальмитин и тристеарин и их смеси. Наиболее предпочтительными триглицеридами являются тримиристин и трилаурин.
Моноглицериды могут быть выбраны из группы, включающей монокаприн, монолаурин, мономиристин и монопальмитин и их смеси.
Согласно предпочтительному варианту осуществления изобретения фосфолипид предпочтительно представляет собой лецитин, например, негидрогенизированный, частично или полностью гидрогенизированный лецитин и их смеси. Понятие "лецитин" в контексте настоящего описания относится к эфирам, образованным глицерином, двумя жирными кислотами и фрагментом фосфорилхолина. Лецитин имеет следующую структуру:
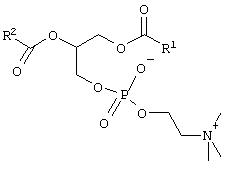
где R1-COO- и R2-COO- обозначают фрагменты жирных кислот, как указано выше.
Фосфолипиды, например лецитины, могут быть выбраны из группы, включающей природный лецитин, синтетический лецитин, соевый лецитин, яичный лецитин, синтетический дипальмитоиллецитин, частично или полностью гидрогенизированный лецитин и их смеси.
Эфиры жирных кислот и полиолов известны в данной области и имеются в продаже.
Предпочтительно эфир, представляющий собой глицерид, присутствует в количестве от 0,5 до 90% в пересчете на общую массу композиции.
Целесообразно, чтобы фармацевтические композиции по изобретению дополнительно включали по меньшей мере один фармацевтически приемлемый эксципиент. Дополнительный эксципиент может способствовать улучшению диспергируемости и распределению в желудке. Эксципиент может быть выбран из группы, включающей разрыхлители, шипучие смеси и их смеси. Также можно добавлять другие эксципиенты, такие как углеводы, крахмал и/или его производные, мальтодекстрины, целлюлоза, производные целлюлозы, сахара, наполнители, антиоксиданты, анионогенные и неионогенные поверхностно-активные вещества, такие как додецилсульфат натрия, соли жирных кислот, например Na-стеарат, сложные поли(оксиэтилен)алкиловые эфиры, простые поли(оксиэтилен)алкиловые эфиры и их смеси. Примерами дополнительных эксципиентов являются глюкоза, лактоза, сорбит, мальтодекстрин, тальк, стеарат магния, маннит, бикарбонат натрия, кросповидон, гликофурол, винная кислота и их смеси.
Согласно изобретению можно применять любой ингибитор липаз, но наиболее предпочтительными действующими веществами являются ингибиторы желудочной и панкреатической липаз и в частности орлистат.
Согласно изобретению ингибитор липаз присутствует в количестве от 1 до 50%, предпочтительно от 5 до 30% в пересчете на общую массу композиции.
В предпочтительном варианте осуществления настоящего изобретения описанная выше композиция может включать
а) от 1 до 50% ингибитора липаз в пересчете на общую массу композиции;
б) от 0,5 до 90% по меньшей мере одного эфира жирных кислот и полиолов в пересчете на общую массу композиции; и необязательно композиция включает один или несколько фармацевтически приемлемых эксципиентов.
Композиции по изобретению можно вводить с помощью общепринятых дозируемых форм, таких как гидроксипропилметилцеллюлозные (ГПМЦ) капсулы, твердые желатиновые капсулы, крахмальные капсулы, таблетки, жевательные таблетки и капсулы, порошки, пеллеты, гранулы и т.д.
Настоящее изобретение также относится к способу приготовлению описанных выше фармацевтических композиций, который предусматривает смешение по меньшей мере одного ингибитора липаз и по меньшей мере одного эфира жирных кислот и полиолов в твердом или расплавленном состоянии, причем эфир жирной кислоты имеет температуру, превышающую температуру тела, а полиолы выбирают из группы, включающей глицерин, сахара, производные сахаров и их смеси.
Еще одним объектом изобретения является способ лечения или предупреждения ожирения, включающий стадию введения пациенту описанной выше фармацевтической композиции.
Изобретение также относится к применению описанной выше композиции для приготовления лекарственного средства, предназначенного для предупреждения и лечения ожирения.
Ниже изобретение более подробно проиллюстрировано с помощью примеров.
Данные об эффективности в отношении экскреции жиров композиций на основе орлистата из примеров 1-10 и Xenical® в качестве эталона приведены в таблице 1.
ПРИМЕРЫ
Пример 1
10 г расплавленного тримиристина (Dynasan 114, фирма Hiils AG) смешивали в течение 30 мин при температуре 57-63°С с 20 г орлистата. К полученному таким образом объединенному расплаву (сорасплаву) добавляли 20 г глюкозы и смешивали при комнатной температуре до затвердевания. Полученный таким образом твердый продукт выдерживали в течение 1 ч при комнатной температуре, измельчали с помощью миксера для сухих продуктов и затем просеивали через сита с размером отверстий 1,6 мм. Образовавшиеся частицы выдерживали при 39°С в течение 4,5 ч в атмосфере инертного газа, подвергали криогенному размалыванию с помощью сухого льда и затем смешивали с лактозой (соотношение лактозы и образовавшихся частиц 100:15 мас./мас.). Наконец, полученную таким образом смесь прессовали с получением жевательных таблеток диаметром 16 мм, массой 1,15 г, каждая из которых включала 60 мг орлистата, 30 мг тримиристина, 60 мг глюкозы и 1000 мг лактозы.
Полученные таким образом жевательные таблетки давали добровольцам во время одного пробного завтрака. Люди получали пищу, состоящую из 130 г говяжьего фарша, 10 г масла и 100 г картофеля-фри (жаренного в арахисовом масле), общее содержание жира в которой составляло примерно 35 г. Собирали образцы стула, начиная с дня -1 (за день до начала эксперимента) до пятого дня после пробного завтрака. Первый и последний образцы стула использовали для оценки фонового уровня экскреции жира. Образцы стула хранили в замороженном состоянии и осуществляли экстракцию общих липидов согласно методу Bligh и Dyer (Bligh E.G. и Dyer W.J., Can. J. Biochem. Physiol., 37, 911 (1959)). Вычитали величину фонового уровня экскреции, получая количество жира, которое экскретировалось при лечении орлистатом. Количество экскретированного жира оценивали гравиметрически и выражали в виде процента от содержания жира в пробном завтраке.
Пример 2
100 г тримиристина (Dynasan 114, фирма Huls AG) расплавляли при 65°С в пригодном смесителе с высокими сдвиговыми усилиями. В смеситель вносили 200 г орлистата и расплавляли путем осторожного перемешивания (смесь представляет собой сорасплав). Расплавленную фазу перемешивали в течение 2 мин. Добавляли при перемешивании в виде двух порций 1800 г мальтодекстрина DE21 (соотношении сорасплава и мальтодекстрина 1:6 мас./мас.) и смешивали до затвердевания при комнатной температуре, получая текучий гранулят. Гранулят просеивали через сита с размером отверстий 0,85 мм. Отдельно 4950 г сорбита просеивали через сита с размером отверстий 0,85 мм и перемешивали с сорасплавленным гранулятом в течение 3 мин. Дополнительно внешнюю фазу (375 г талька и 75 г стеарата магния) просеивали вручную через сита с размером отверстий 0,5 мм и перемешивали с гранулятом в течение 3 мин. Наконец, полученную таким образом смесь прессовали с получением жевательных таблеток диаметром 20 мм, массой 1,5 г, каждая из которых включала 40 мг орлистата, 20 мг тримиристина, 360 мг мальтодекстрина, 960 мг сорбита, 75 мг талька и 15 мг стеарата магния.
Полученные таким образом жевательные таблетки испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 3
1,25 г ГПМЦ (Pharmacoat 603, фирма Shin-Etsu Chemocal Co) растворяли в 39,5 г воды при температуре примерно 75°С. Раствор охлаждали до комнатной температуры (25°С), и добавляя в раствор 5 г маннита, 2,5 г бикарбоната натрия и 1 г кросповидона, получая дисперсию. 0,75 г Kryosome 1703H (гидрогенизированный лецитин, фирма Lipoid AG) диспергировали в 7,5 г воды с использованием гомогенизатора (Polytron) в течение 30 с и затем смешивали с вышеуказанной дисперсией. Полученную водную систему использовали для приготовления эмульсии путем эмульгирования 4,5 г расплавленной масляной смеси, полученной путем совместного расплавления 3,15 г тримиристина (Dynasan 114, фирма Huls AG) и 6,3 г орлистата при 65°С, с помощью гомогенизатора типа Polytron в течение 1,5 мин при 65°С. Эту эмульсию замораживали при -80°С во вращающейся круглодонной колбе объемом 250 мл в смеси сухой лед-этанол и затем лиофилизировали. Затем лиофилизат размалывали при комнатной температуре и 3 г этого продукта перемешивали и просеивали через сита с размером отверстий 0,5 мм. 1,3 г смеси прессовали с получением жевательных таблеток диаметром 16 мм, массой 1,3 г, каждая из которых включала 60 мг орлистата, 30 мг тримиристина, 15 мг Kryosome, 25 мг ГПМЦ, 20 мг кросповидона, 100 мг маннита, 50 мг бикарбоната натрия и 1000 мг лактозы.
Полученные таким образом жевательные таблетки испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 4
30 г орлистата и 15 г тримиристина (Dynasan 114, фирма Huls AG) пропускали через сита с размером отверстий 0,9 мм и перемешивали в течение 10 мин. Смесь вновь просеивали через сита с размером отверстий 0,9 мм и перемешивали в течение 10 мин. Полученную таким образом смесь (порциями) подвергали грубому размолу в мельнице для сухих продуктов в течение 0,5 мин, добавляя трехкратное количество сухого льда. Эту охлажденную смесь затем подвергали криогенному размалыванию в мельнице со штифтами, получая мелкие частицы. Полученные частицы сушили в течение 15 мин в глубоком вакууме и затем смешивали с 2/3 (мас./мас.) глюкозы. 15 г этой сухой смеси смешивали с 100 г лактозы в течение 10 мин и затем просеивали через сита с размером отверстий 0,5 мм. Наконец, полученный таким образом размолотый и смешанный в мельнице гранулят прессовали с получением жевательных таблеток диаметром 16 мм, массой 1,15 г, каждая из которых включала 60 мг орлистата, 30 мг тримиристина, 60 мг глюкозы и 1000 мг лактозы.
Полученные таким образом жевательные таблетки испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 5
1,2 г орлистата и 1,8 г глюкозы просеивали через сита с размером отверстий 0,9 мм и перемешивали в течение 2 мин. После чего 4,0 г Kryosome 1702 (соотношение соевого лецитина и сахарозы 1:2, фирма Lipoid AG) также просеивали через сита с размером отверстий 0,9 мм и перемешивали с первой смесью в течение 2 мин. Объединенную смесь затем подвергали криогенному размалыванию в воздухоструйной мельнице, используя для охлаждения сухой лед. Образовавшиеся частицы сушили в течение 15 мин в глубоком вакууме. 3,5 г высушенных частиц перемешивали с 10 г лактозы в течение 15 мин. Наконец, полученную таким образом порошкообразную смесь прессовали с получением жевательных таблеток диаметром 16 мм, массой 1,35 г, каждая из которых включала 60 мг орлистата, 90 мг глюкозы, 200 мг Kryosome и 1000 мг лактозы.
Полученные таким образом жевательные таблетки испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 6
4,24 г соевого лецитина и 4,24 г орлистата последовательно растворяли в 31,52 г гликофурола 75 (фирма Roche). Пустые твердые желатиновыек апсулы запечатывали с помощью 25%-ного раствора желатина в воде и давали высохнуть. В запечатанных твердых желатиновых капсулах пробивали отверстие и затем заполняли 565 мг раствора орлистата/лецитина/гликофурола. Отверстия запечатывали с помощью вышеуказанного раствора желатина и закрытой капсуле давали высохнуть в течение по меньшей мере 15 мин. Каждая капсула содержала 60 мг орлистата, 60 мг соевого лецитина и 445 мг гликофурола.
Полученные таким образом капсулы испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 7
10 г расплавленного тримиристина (Dynasan 114, фирма Hills AG) смешивали в течение 30 мин при температуре 57-63°С с 20 г орлистата. К полученному таким образом сорасплаву добавляли 20 г глюкозы и смешивали при комнатной температуре до затвердевания, измельчали с помощью миксера для сухих продуктов и затем просеивали через сита с размером отверстий 1, 6 мм. 48 г полученных частиц выдерживали при 39°С в течение 4,5 ч в закрытом сосуде в атмосфере инертного газа, подвергали криогенному размалыванию с помощью сухого льда в мельнице со штифтами. Затем 15 г полученных частиц смешивали в течение 30 мин с 10 г Kryosome 1702 (фирма Lipoid AG) и 100 г лактозы. Смесь просеивали через сита с размером отверстий 0,5 мм и прессовали с получением жевательных таблеток диаметром 16 мм, массой 1,25 г, каждая из которых включала 60 мг орлистата, 30 мг тримиристина, 60 мг глюкозы, 100 мг Kryosome и 1000 мг лактозы.
Полученные таким образом капсулы испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 8
0,75 г совместно расплавленного и подвергнутого криогенному размалыванию продукта (орлистат-тримиристин-глюкоза 2:1:2), полученному согласно процессу, описанному в примере 7, и 0,5 г Kryosome 1702 просеивали через сита с размером отверстий 0,5 мм и перемешивали в течение 10 мин. 3,0 г бикарбоната натрия и 1,5 г винной кислоты размалывали при комнатной температуре в лабораторной лопастной мельнице, просеивали через сита с размером отверстий 0,5 мм и перемешивали в течение 10 мин. 2,7 г этой шипучей смеси добавляли к первой смеси и вновь перемешивали в течение 10 мин. 0,395 г этой смеси заполняли капсулы ГПМЦ размера 0, содержащие 30 мг орлистата, 15 мг тримиристина, 30 мг глюкозы, 50 мг Kryosome, 180 мг бикарбоната натрия и 90 мг винной кислоты.
Полученные таким образом капсулы испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 9
20 г орлистата и 10 г трилаурина (Dynasan 112, фирма Hiils AG) просеивали через сита с размером отверстий 0,5 мм и перемешивали. Эту смесь подвергали криогенному размалыванию с помощью сухого льда в мельнице со штифтами и затем сушили в вакууме в течение 15 мин. 10 г этой смеси перемешивали с 15 г глюкозы. 3 г этой смеси и 2 г Kryosome 1702 (фирма Lipoid AG) подвергали совместному криогенному размалыванию с помощью сухого льда в лабораторной лопастной мельнице и сушили в течение ночи в вакуумной эксикаторе. 1,25 г полученного порошка прессовали с получением жевательных таблеток диаметром 16 мм, массой 1,25 г, каждая из которых включала 60 мг орлистата, 30 г трилаурина, 60 мг глюкозы, 100 мг Kryosome и 1000 мг лактозы.
Полученные таким образом жевательные таблетки испытывали на добровольцах согласно методу, описанному в примере 1.
Пример 10
16 г монолаурина (Rylo MG12, фирма Danisco Ingregient AG) и 4 г эмульгатора монокаприна TS-PH003 (фирма Danisco Ingregient AG) совместно расплавляли при температуре примерно 70°С, охлаждали до комнатной температуры (25°С) и тем самым полностью отверждали. Через 1 день со стенок соскабливали пленку с помощью шпателя, порциями подвергали грубому размолу в миксере для сухих продуктов при низкой температуре при добавлении сухого льда (трехкратный объем относительно размалываемого продукта) в течение примерно 0,5 мин и затем подвергали тонкому криогенному размалыванию в мельнице со штифтами и сушили в вакууме в течение 15 мин. Смешивали 15 г этой смеси и 15 г орлистата. Добавляли 50 г сухого льда и смесь порциями подвергали грубому размолу, каждый раз по 0,5 мин. После сушки в вакууме полученный порошок просеивали через сита с размером отверстий 0,9 мм и подвергали тонкому криогенному размалыванию в мельнице со штифтами, получая тонкую порошкообразную смесь орлистата-монокаприна-монолаурина (50:10:40). 2,4 г совместно размолотой смеси, содержащей примерно 2,16 г винной кислоты и 4,56 г бикарбоната натрия, добавляли к 5,6 г вышеуказанной порошкообразной смеси и 2 г безводной лактозы, перемешивали в течение 5 мин и просеивали через сита с размером отверстий 0,5 мм и вновь перемешивали. 500 мг полученного порошка заполняли твердые желатиновые капсулы, содержащие 60 мг орлистата, 48 мг монолаурина, 12 мг монокаприна, 100 мг лактозы, 190 мг бикарбоната натрия и 90 мг винной кислоты.
Полученные таким образом капсулы испытывали на добровольцах согласно методу, описанному в примере 1.
(1) экскретированный жир в виде процента от поглощенного жира
(2) количество добровольцев, участвующих в эксперименте
(3) количество образцов стула, содержащих свободное масло/количество добровольцев
Как видно из таблицы 1, эффективность и/или активность композиций по изобретению существенно выше, чем у традиционных композиций.
Композиции по изобретению, содержащие только половину или даже четверть того количества ингибитора липаз, которое применяется в известных композициях, обладали близкой или даже более высокой эффективностью и/или активностью. С помощью настоящего изобретения можно, сохраняя такой же уровень ингибирования липаз, заметно снизить количество действующего вещества в композиции, минимизируя тем самым нежелательные побочные действия.
В таблице 1 для каждой из описанных выше композиций также указано количество образцов стула, которые включали свободное масло. В образцах стула, полученных после поглощения композиций по изобретению, обнаружено очень редко или не обнаружено совсем отделение масла от основной массы стула. Таким образом, композиции по изобретению обладают способностью минимизировать или полностью подавлять анальное истечение масла, что является одним из наиболее нежелательных побочных действий известных в данной области композиций.
Реферат
Изобретение относится к фармацевтической композиции для перорального введения при лечении или предупреждения ожирения или гиперлипидемии, включающей орлистат и по меньшей мере один эфир жирных кислот и полиолов, при этом температура плавления эфира жирной кислоты превышает температуру тела и полиол выбирают из группы, включающей глицерин, сахара, производные сахаров и их смеси, а также к способу приготовления вышеописанной композиции и способу лечения или предупреждения ожирения. Технический результат: изобретение повышает эффективность и активность орлистата, снижая вариабельность эффективности и/или активности между пациентами, а также частоту встречаемости и серьезность побочных действий. 3 н. и 21 з.п. ф-лы,1 табл.

Комментарии