Препараты соли бупропиона с модифицированным высвобождением - RU2408368C2
Код документа: RU2408368C2
Чертежи













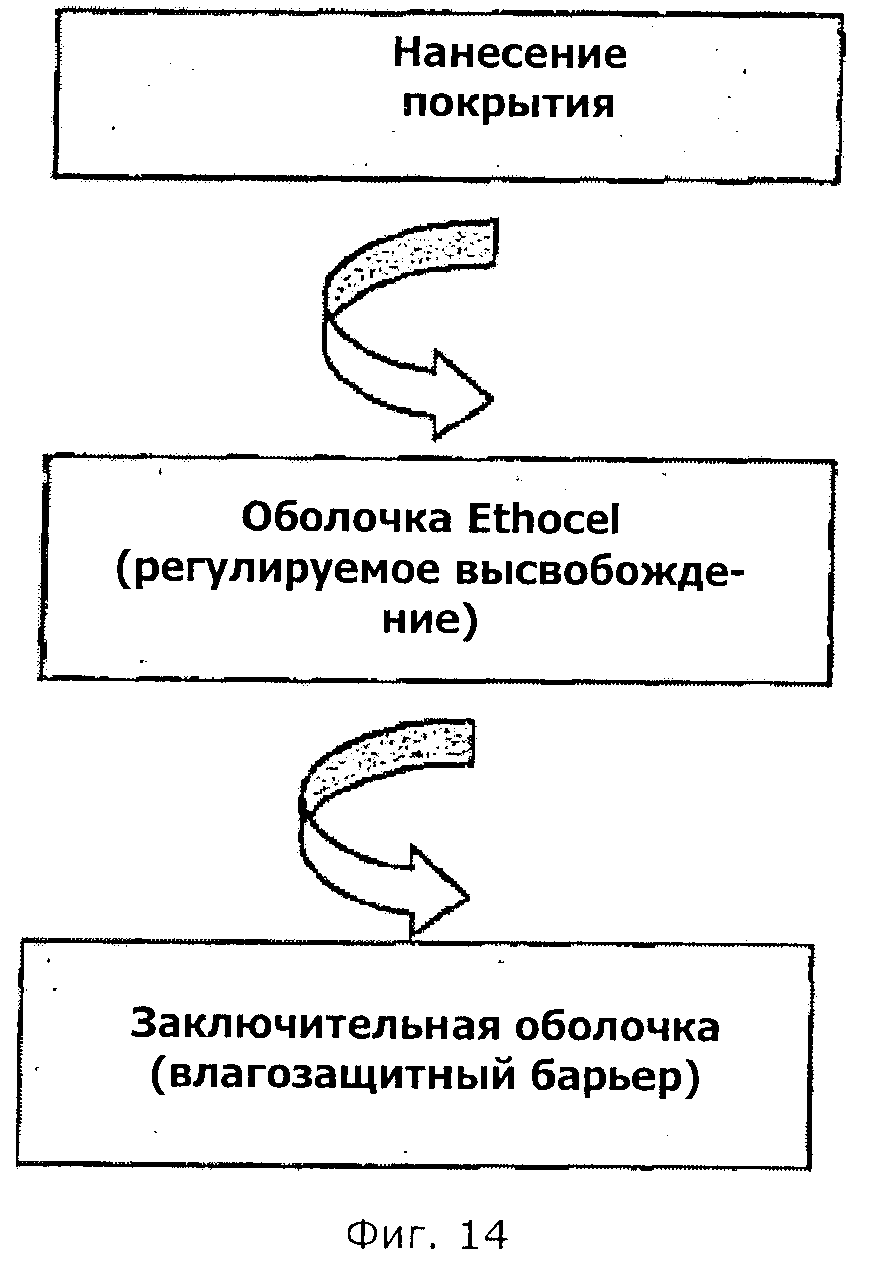









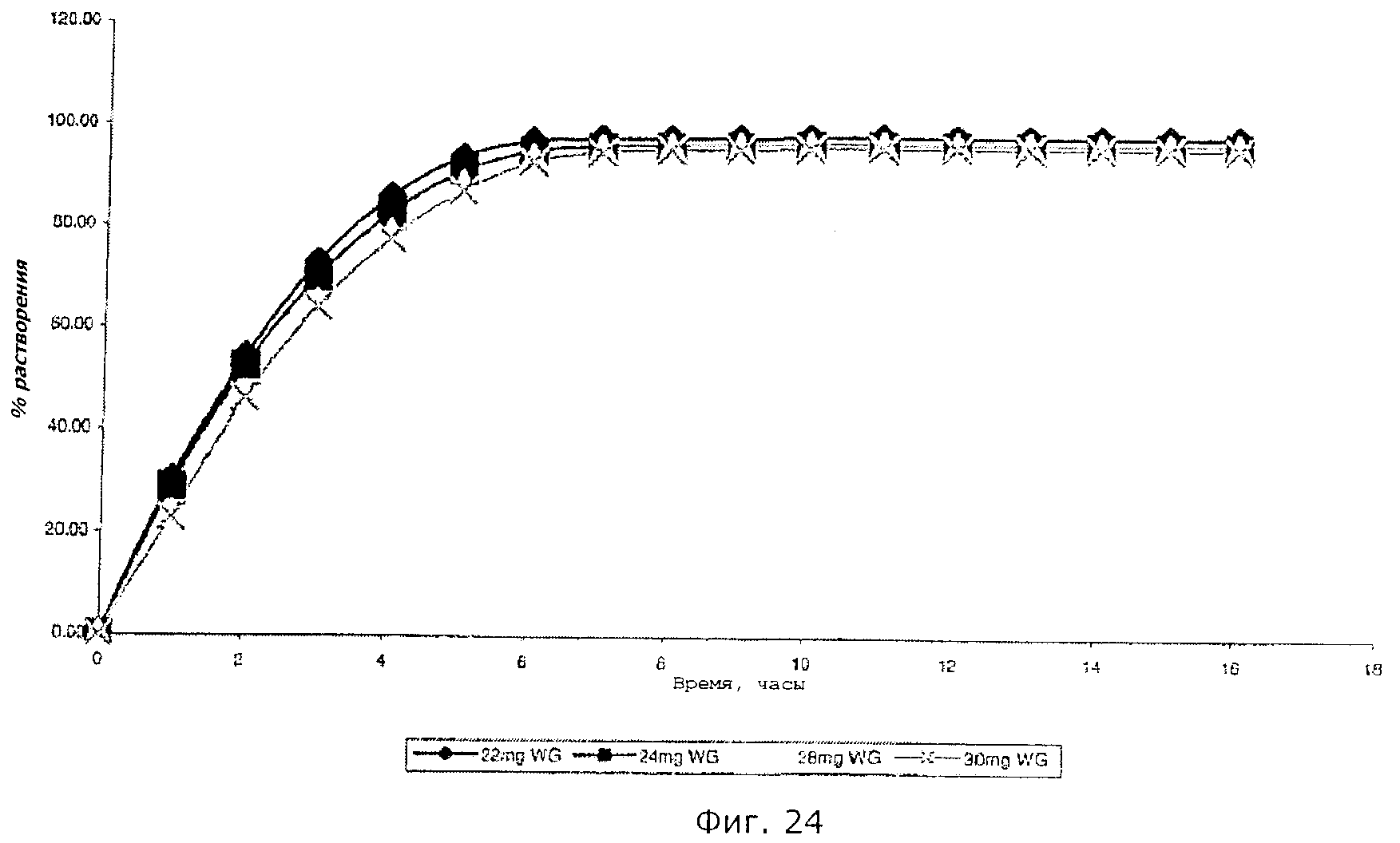




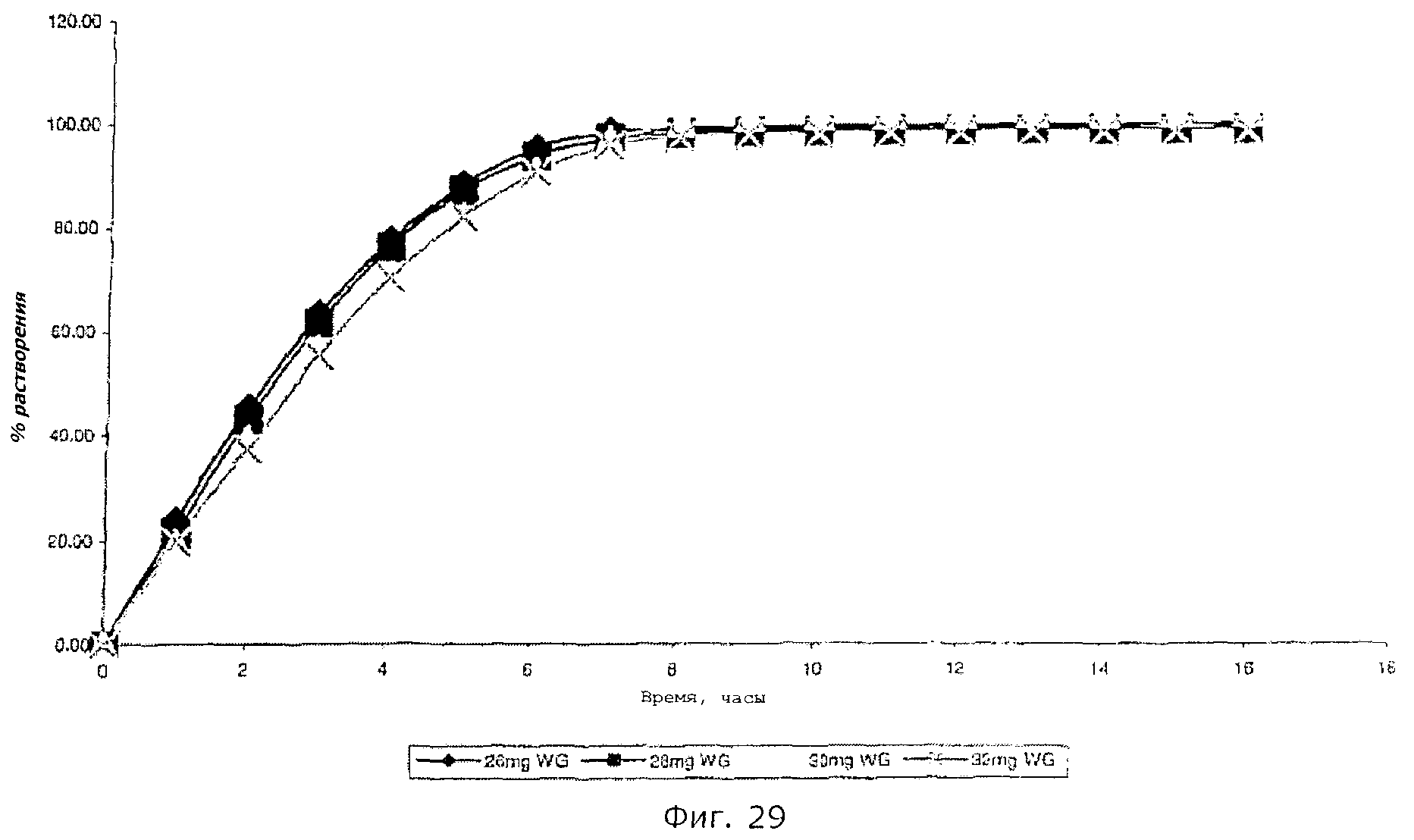







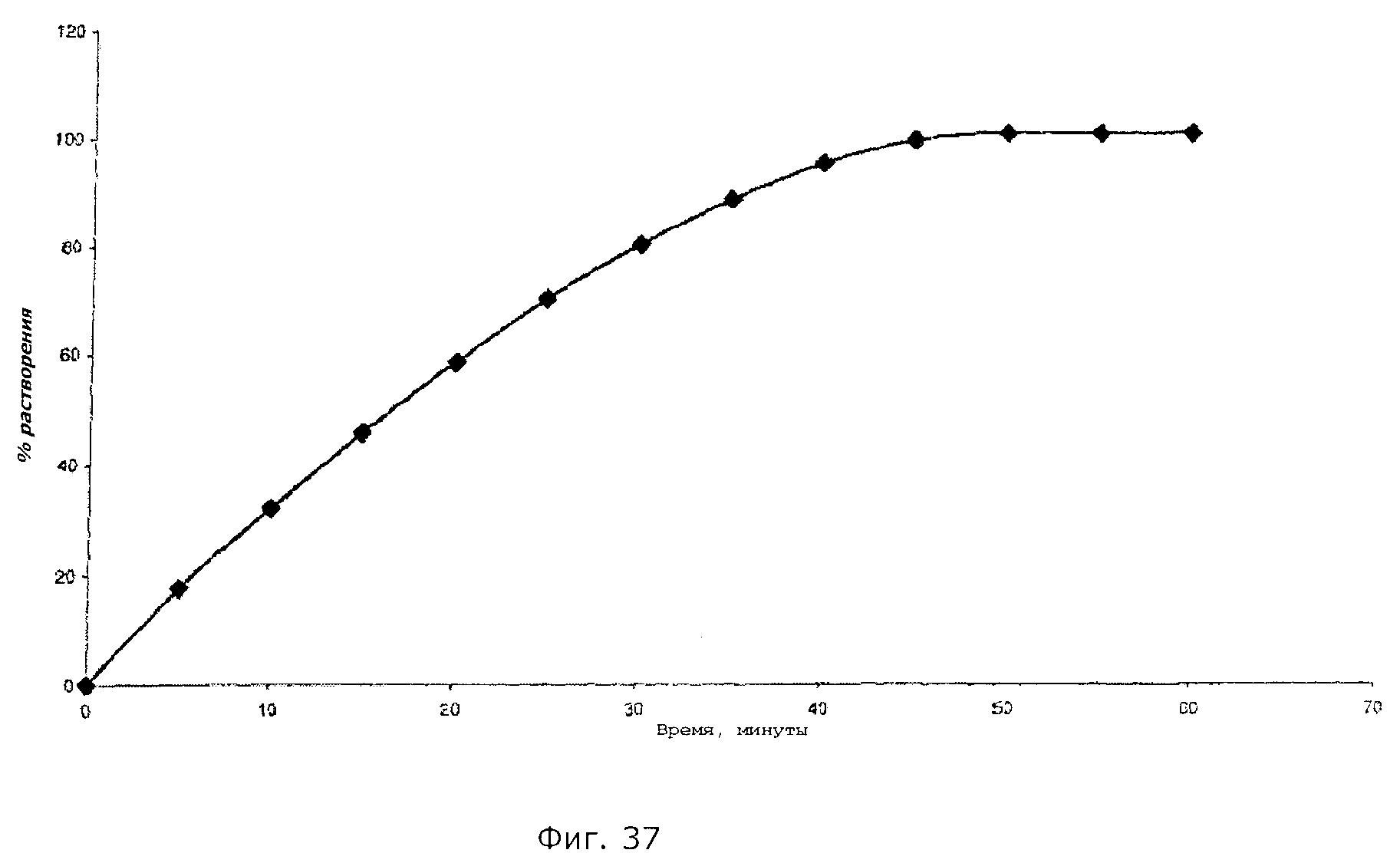



















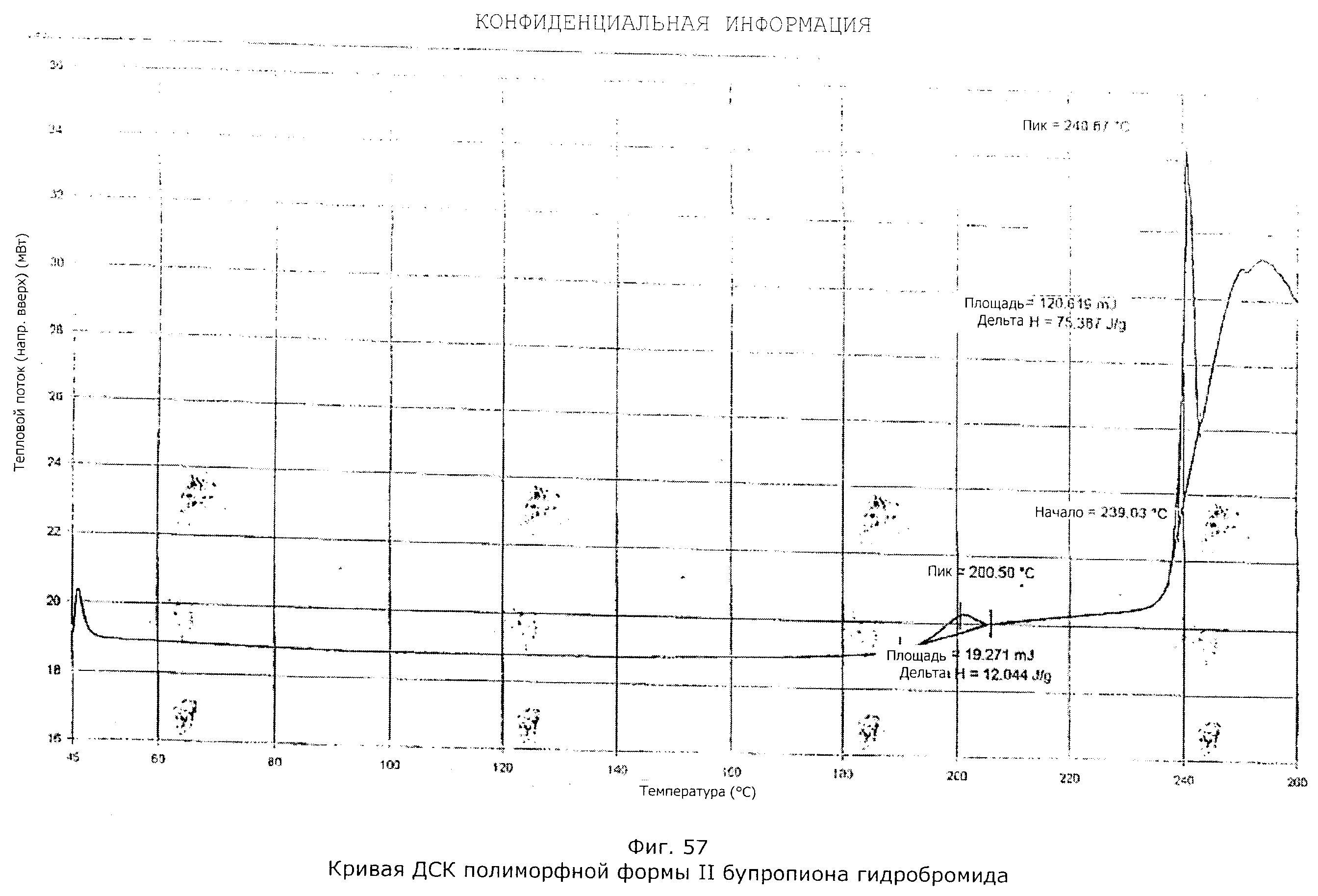


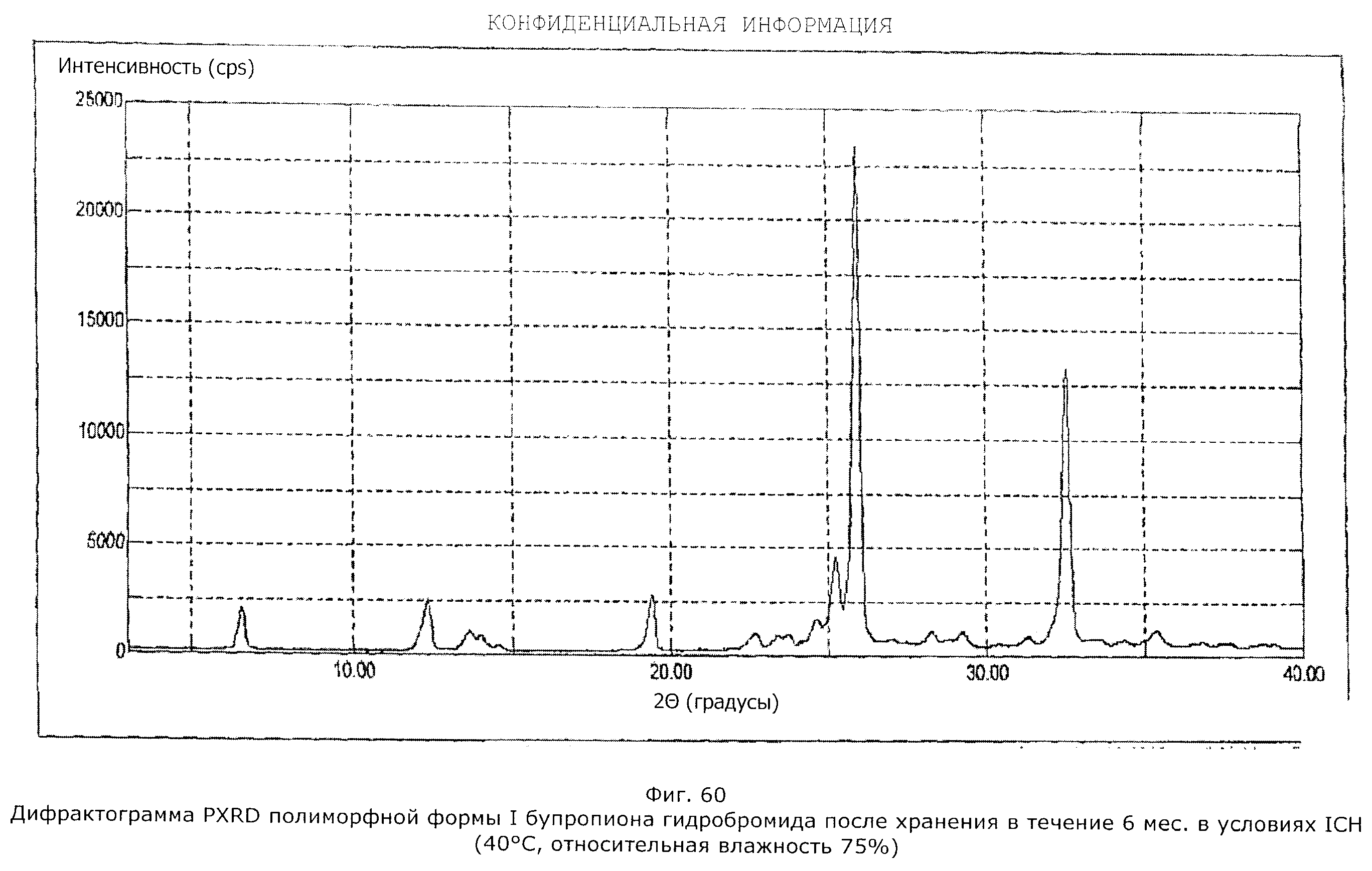





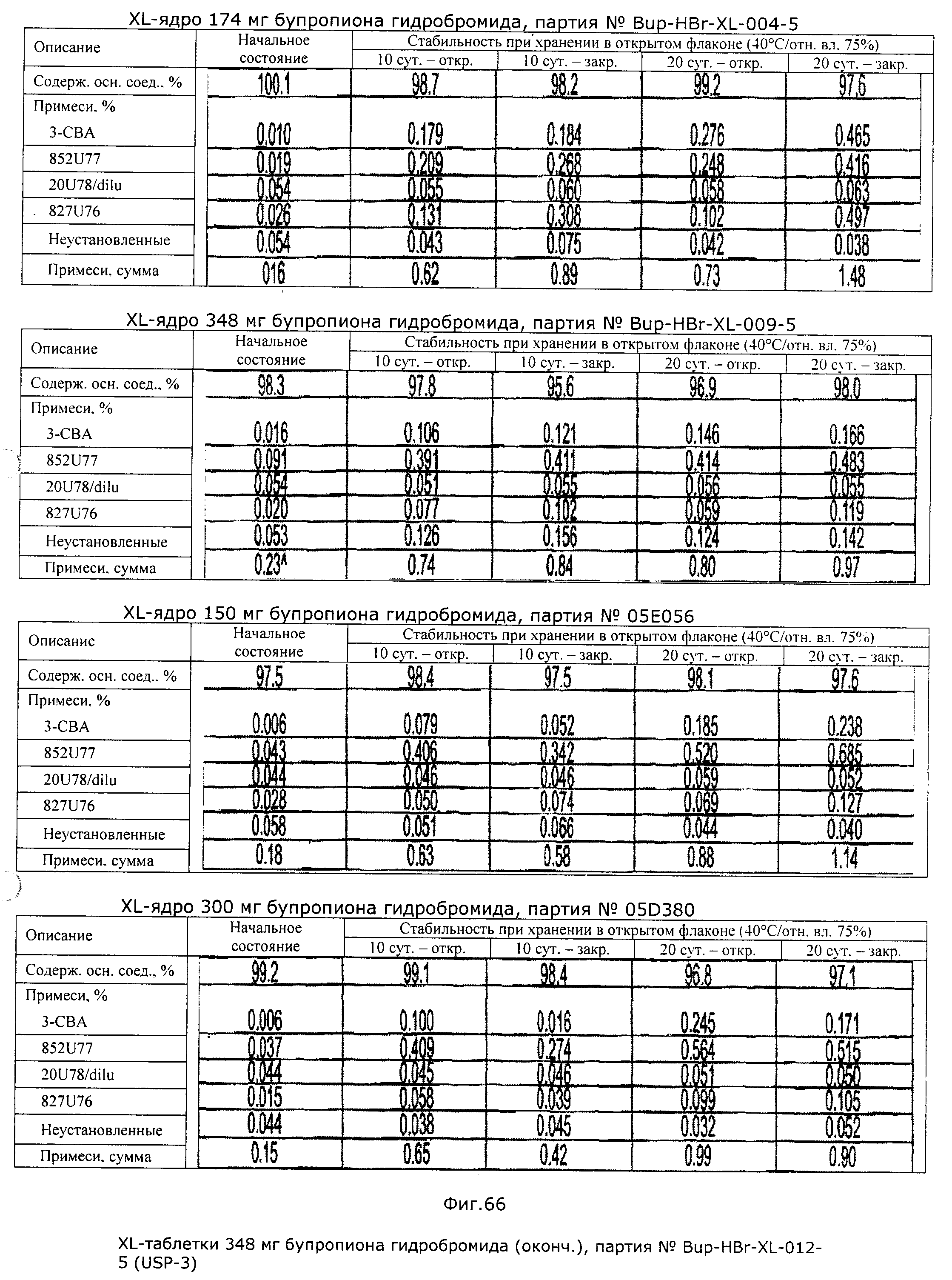



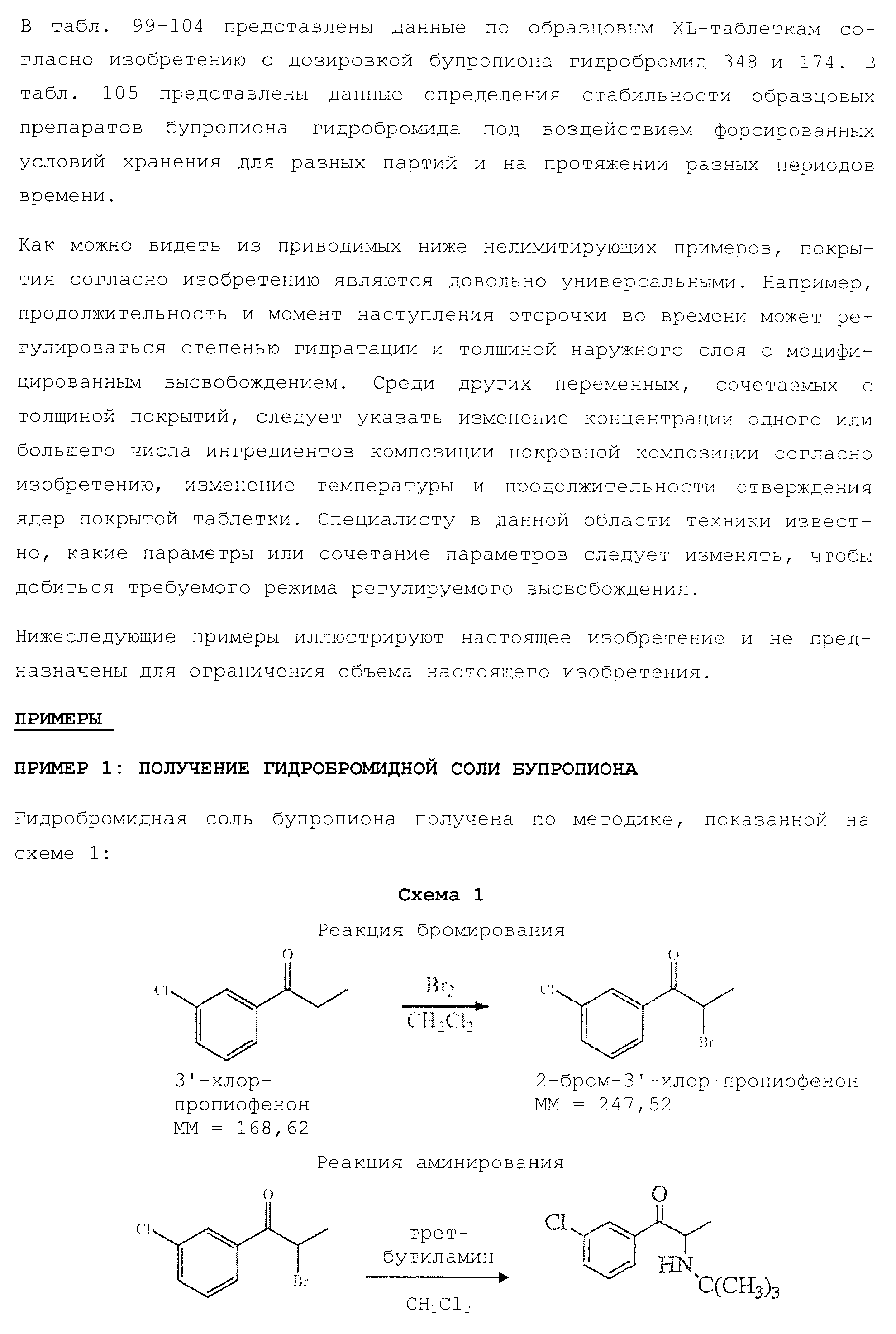
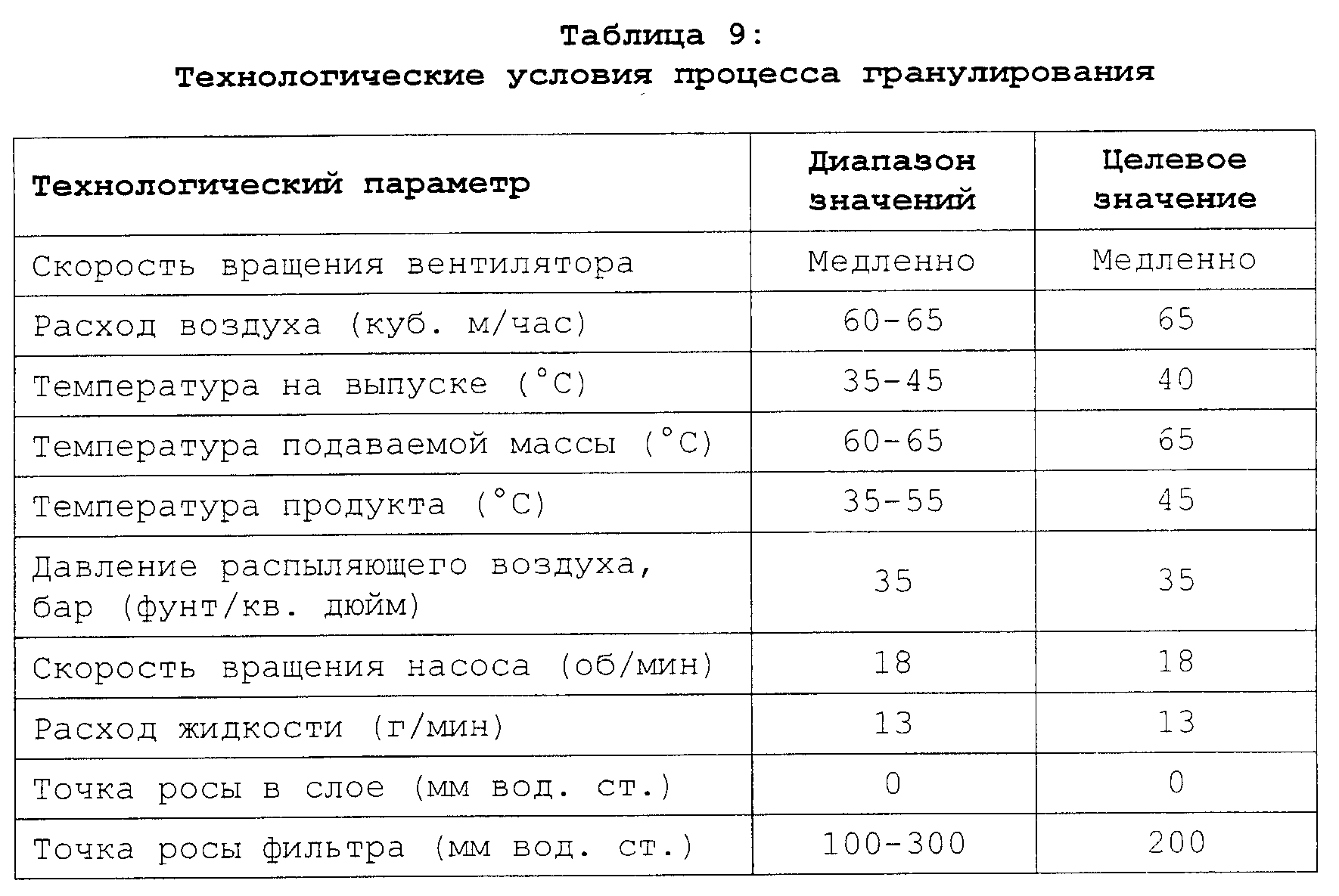
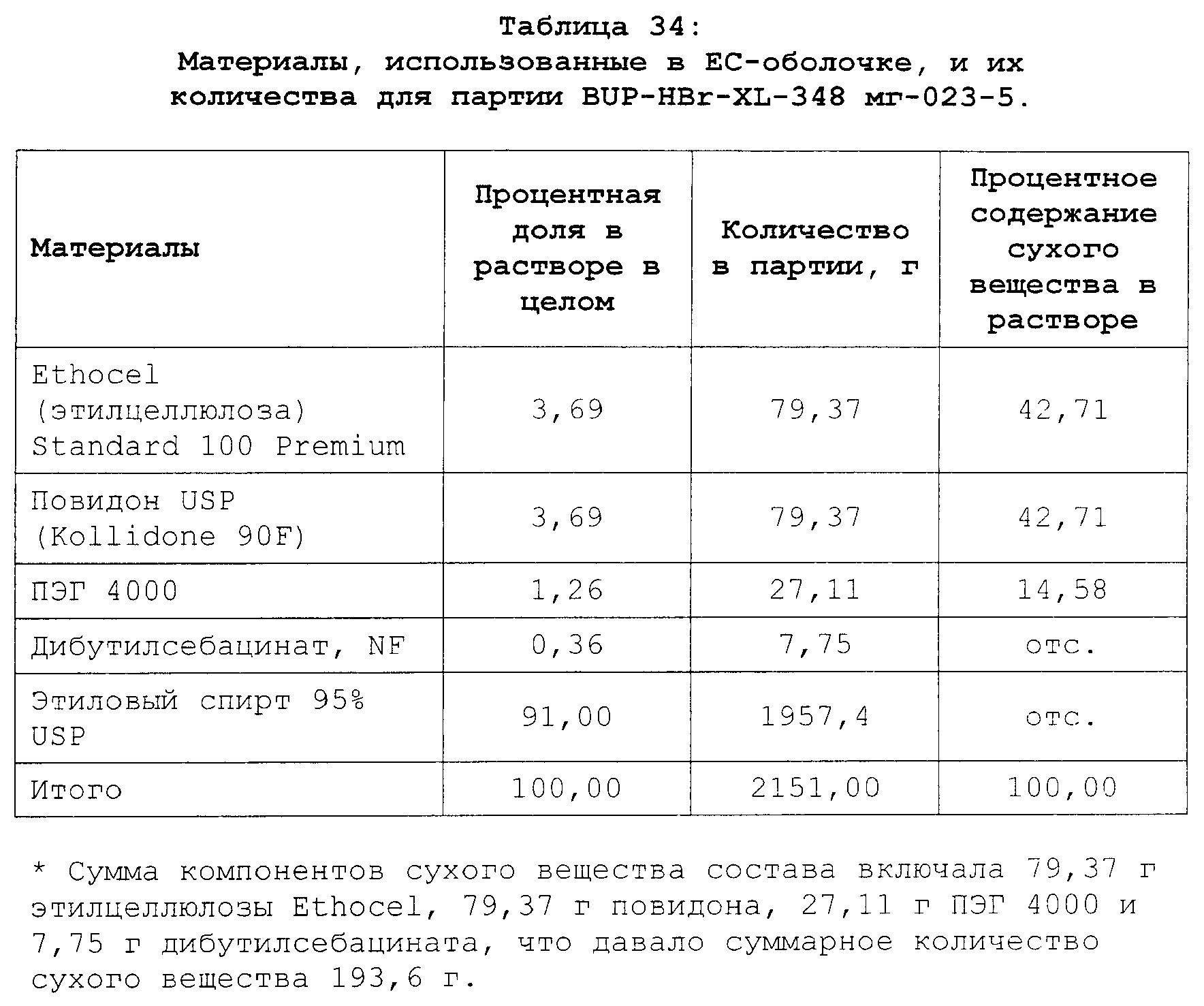
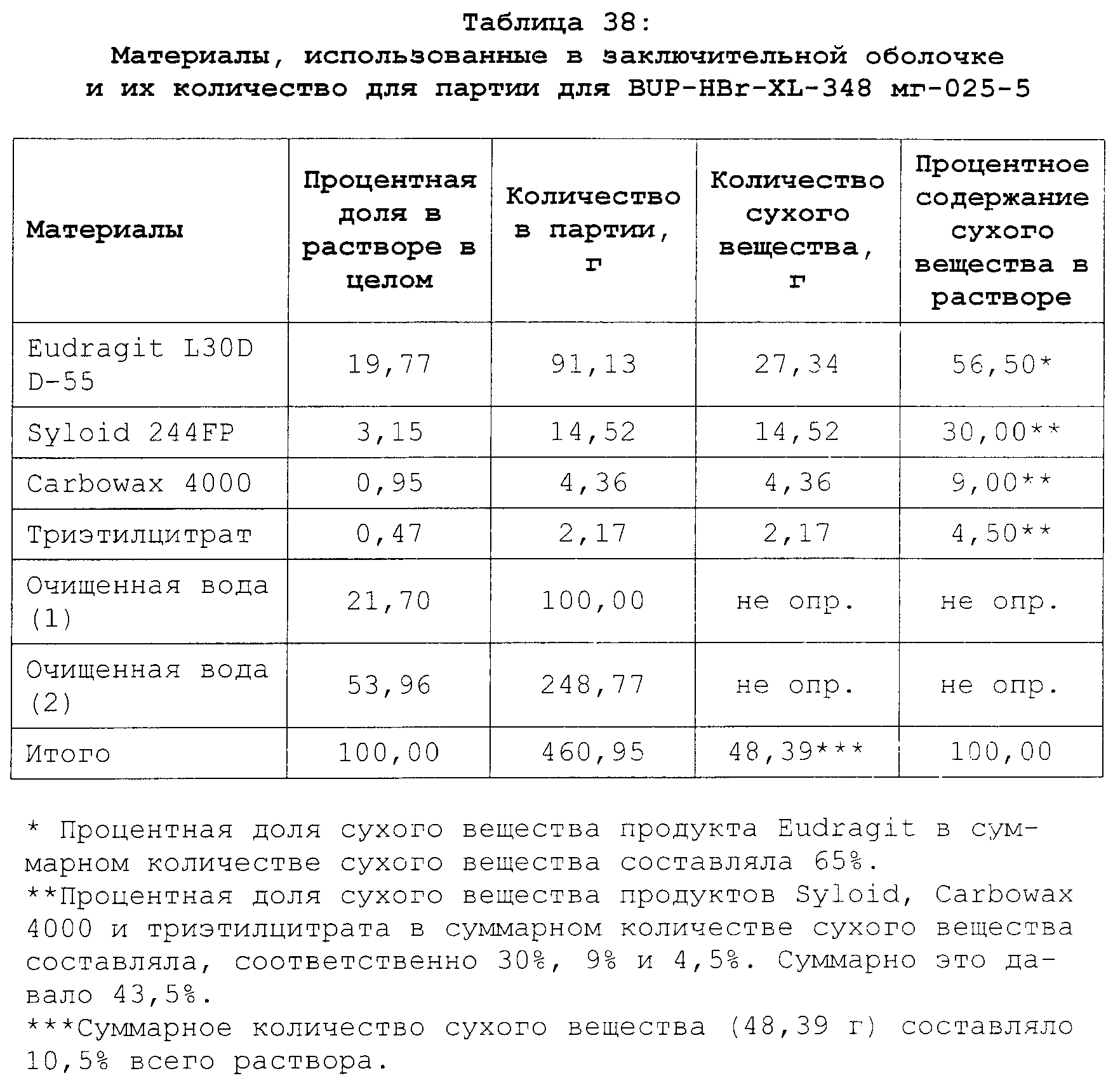
Описание
Текст описания приведен в факсимильном виде.


















































































































































































































































































































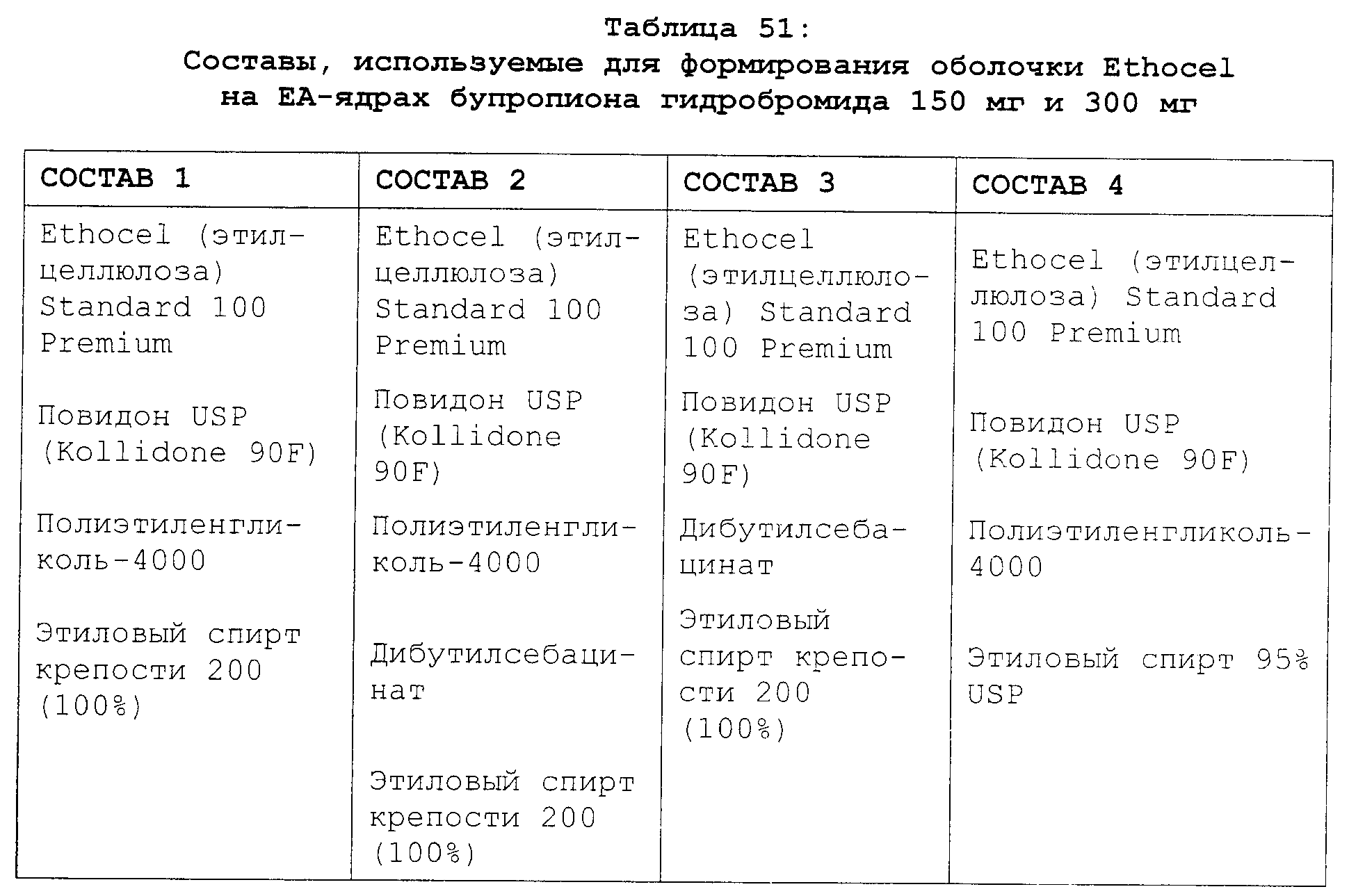

















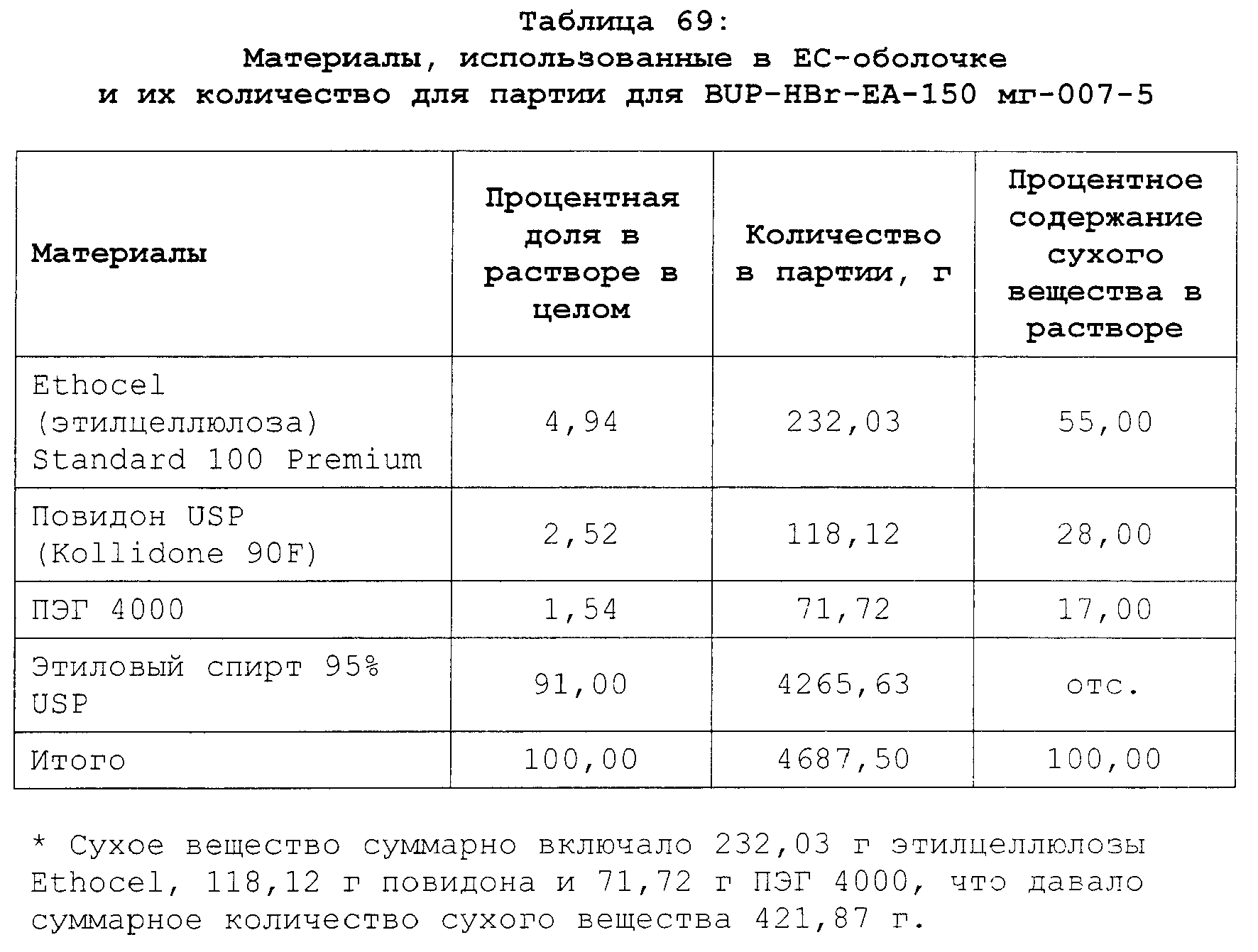
















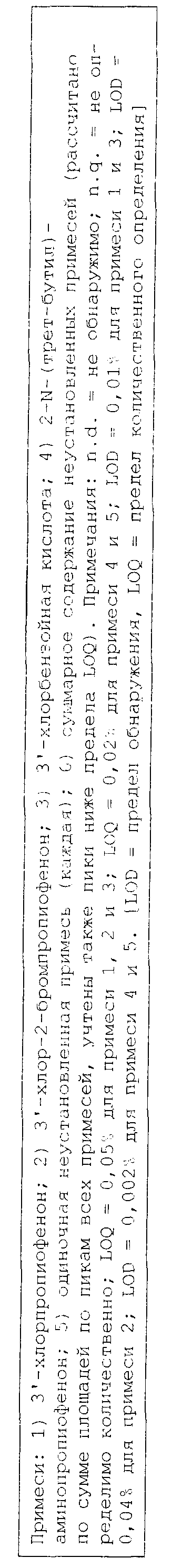






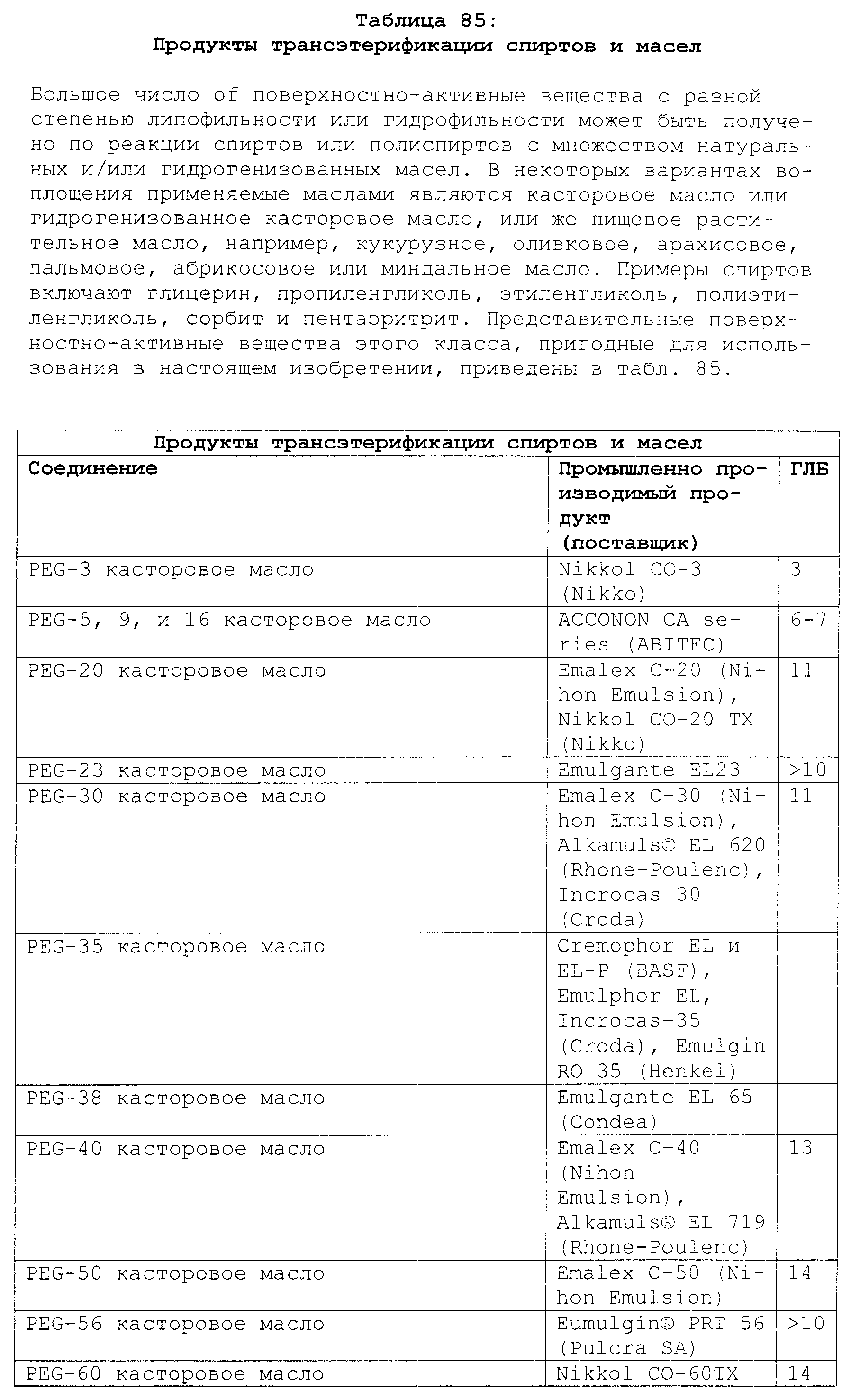


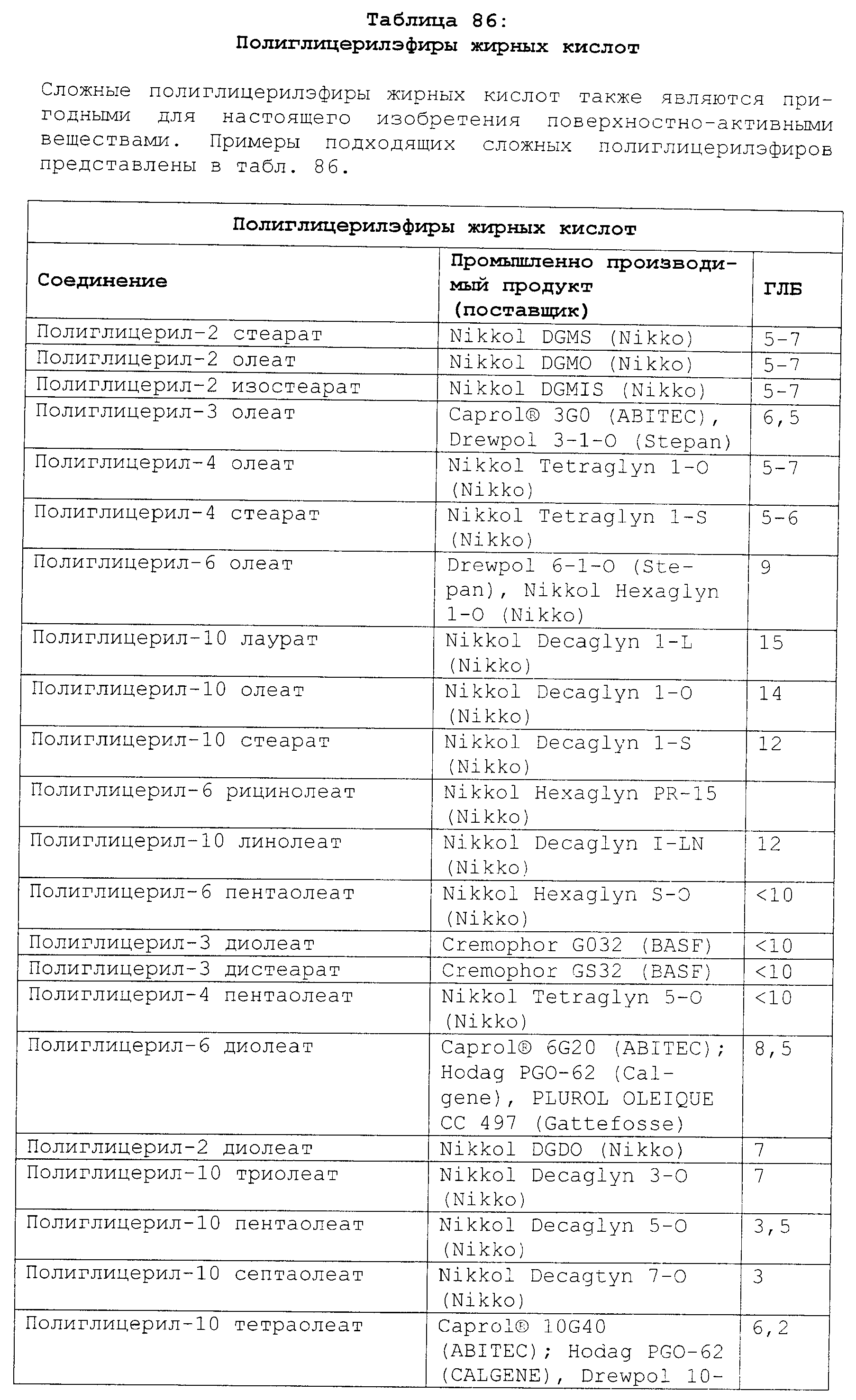
































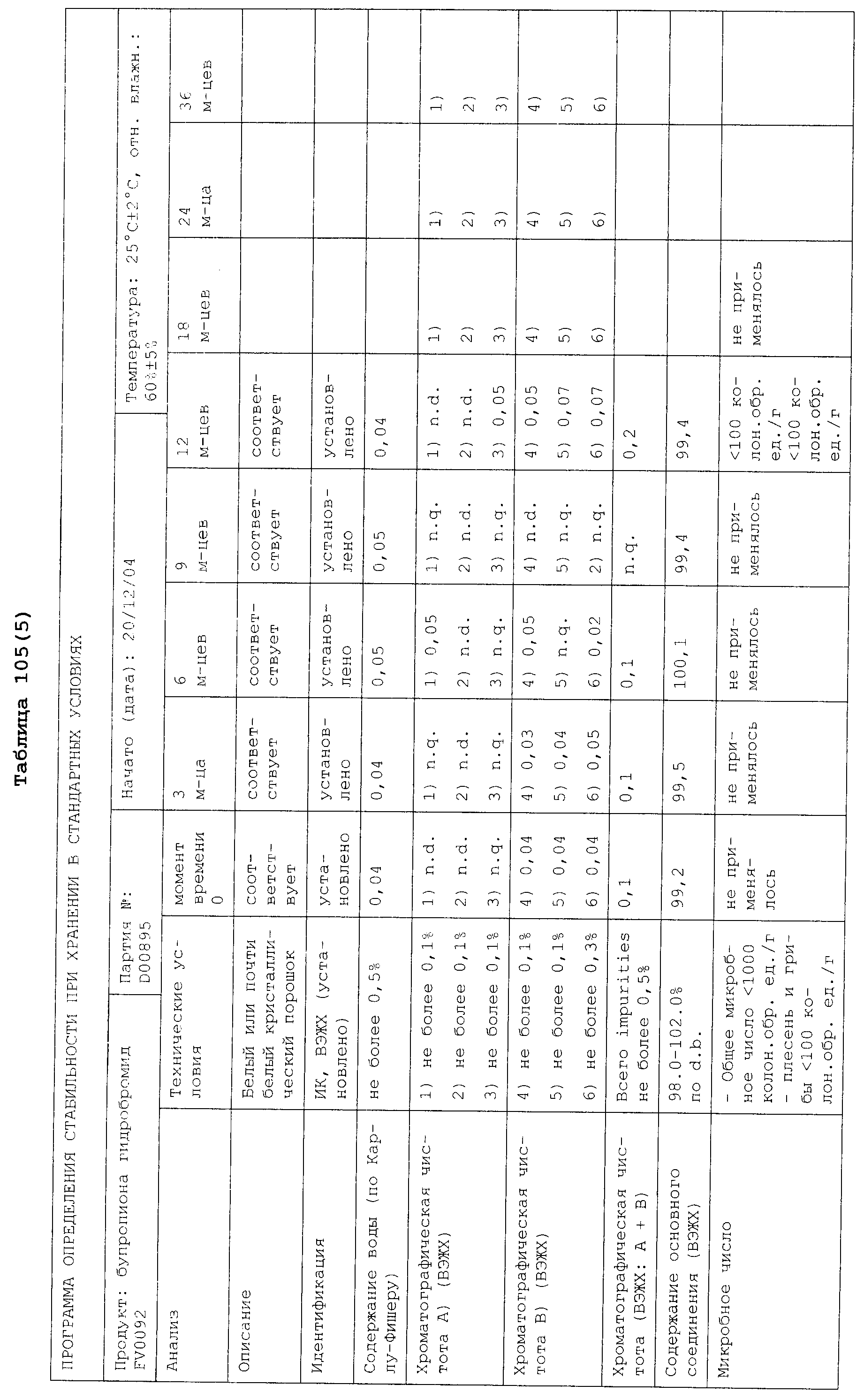



Реферат
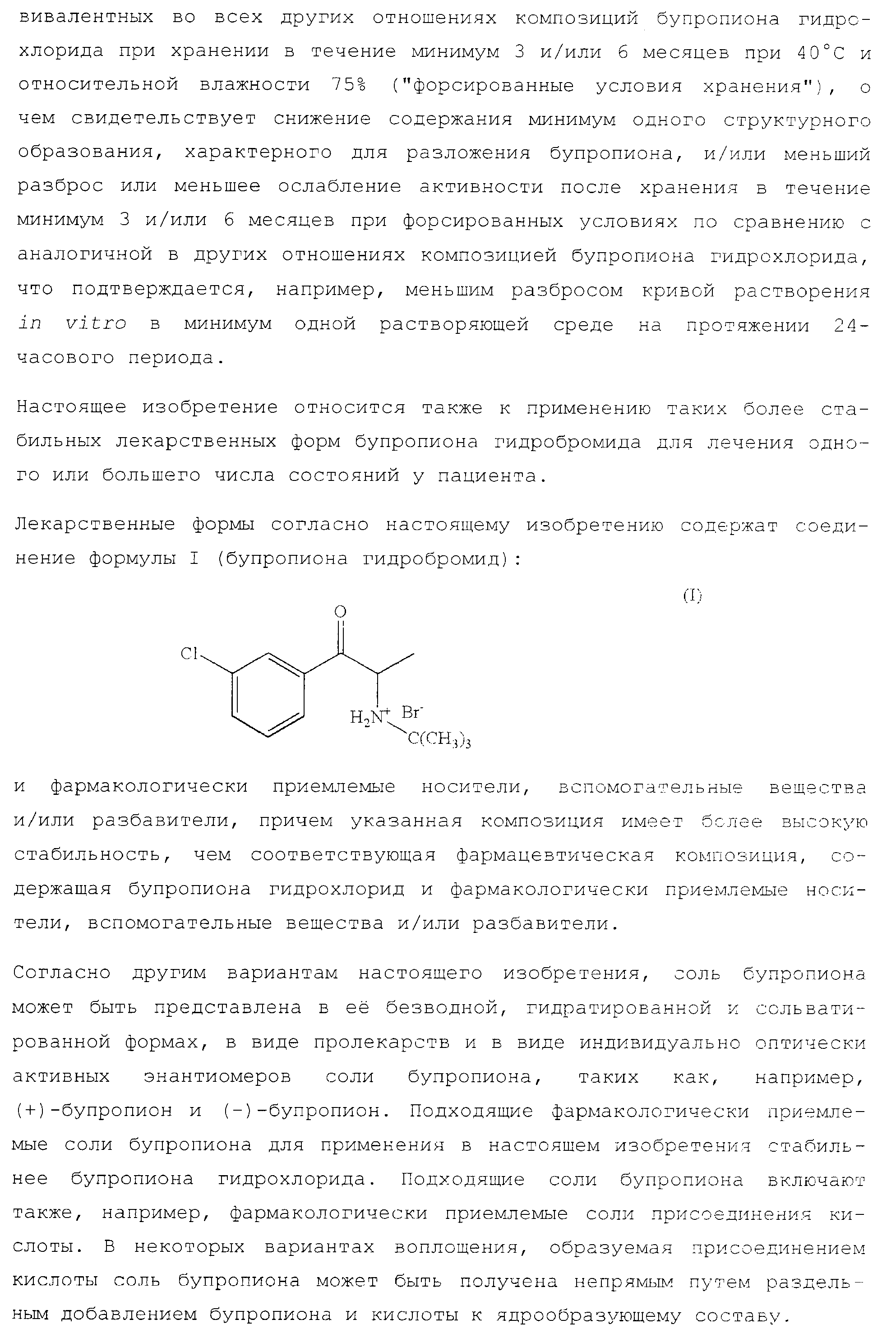
Настоящее изобретение относится к лекарственным формам, содержащим действующее количество фармакологически приемлемой соли бупропиона - бупропиона гидробромида, а также к применению таких лекарственных форм при лечении одного или большего числа состояний пациентов, по отношению к которым допустимо применение бупропиона или его фармакологически приемлемых солей. Лекарственные формы с бупропионом гидробромидом обладают более высокой стабильностью по сравнению с лекарственными формами, включающими бупропиона гидрохлорид, что подтверждается меньшим ослаблением активности композиций после хранения в течение минимум 3 или 6 месяцев при форсированных условиях при 40°С и относительной влажности 75%. 6 н. и 75 з.п. ф-лы, 69 ил., 73 табл.

Комментарии