Способ получения состава для регулированного выделения активных соединений - RU2073998C1
Код документа: RU2073998C1
Чертежи

Описание
Изобретение относится к системе контролированного освобождения активных соединений и способу ее изготовления. Система применима для различных типов активных соединений и описывается на примере наиболее предпочтительной области ее применения, т.е. регуляции освобождения лекарственных средств. Изобретение особенно рекомендуется для фармакологических препаратов, предназначенных для перорального введения и характеризующихся хорошей растворимостью; обеспечивает очень равномерное, контролируемое освобождение препарата на основе конвекционных процессов.
Идеальное медленно действующее фармацевтическое средство для перорального применения по терапевтической эффективности должно быть сопоставимо со средствами для внутривенного вливания. Иными словами, выделение активного соединения из фармацевтического препарата на протяжении физиологически и терапевтически обоснованного периода должно быть настолько равномерным и полным, чтобы обеспечивать его постоянную, адекватную задачам лечения концентрацию в крови. Такой подход гарантирует длительны эффект лекарственного средства в отсутствие побочного действия и одновременно улучшает локальную толерантность к нему желудочно-кишечном тракте.
Особенно перспективными считаются фармацевтические препараты, в которых обеспечивается контролируемое освобождение активного ингредиента, т.е. его выделение независимо от маргинальных условий. Это достигается высокой степенью надежности постоянства скорости освобождения активных соединений из таких фармацевтических препаратов и ее сопоставимости in vivo и in vitro.
Общеизвестно, что выделение активных соединений можно контролировать, заключая их в инородные материалы и/или матрицы, нанося на них различные типы покрытий или используя осмотические системы.
Применение матриц обычно имеет тот недостаток, что они нее обеспечивают освобождение фармацевтического средства в соответствии с кинетикой нулевого порядка (см. например, патент ГДР А 232821). Существует обширная литература по матричным системам (см. S. D. Bruck, Controlled Drung Delivery, vol. 1 and 2, CRS Press, 1983).
В случае фармацевтических средств, выпускаемых с различного рода покрытиями, особую важность имеет выбор оболочки, контролирующей диффузию разведенного активного соединения в соответствии с его физико-химическими свойствами. В настоящее время для изготовления таких покрытий используются почти исключительно композиции на основе эфиров акриловой и метакриловой кислот.
Покрытие лекарственных средств в значительной мере облегчает обеспечение требуемой фармакокинетики в соответствии с реакцией нулевого порядка и повышает ее надежность. Тем не менее, такие препараты имеют существенный недостаток, состоящий в том, что повреждение оболочки приводит к быстрому освобождению всей содержащейся в них дозы (выбросу дозы). Это, в свою очередь, оказывает неблагоприятное действие на состояние больного и значительно снижает безопасность терапии.
С целью повышения безопасности применения обычных лекарственных средств на основе систем, обеспечивающих медленное освобождение активного соединения, общую дозировку разбивают на несколько меньших доз, каждую из которых заключают в собственную оболочку (множественные формы), что приводит к значительному повышению стоимости их изготовления (S. D. Bruck, Controlled Drug Delivery, vol. 1 and 11m, CRS-Press, 1983; R. Baker, Controlleed Release of Bioactive Material, Acad. Press, 1980; Y. W. Chein, Novel Drug Delivery Systems, Mareel Dekker, 1982; J. K. Robinson, Sustained and Controlled Release Drug Delivery Systems, Markel Dekker, 1978).
Осмотические системы, описанные, например, Тиюсом (Themws, J. Pharm. Sci. V. 64, 12, 1987-1991) или BDE-A-2640193 и ЕР-А-О 169 105, обеспечивают почти идеальную скорость освобождения активного ингредиента, не зависящую от маргинальных условий, и позволяют поддерживать желаемый уровень его концентрации в крови на протяжении требуемого по терапевтическим и физиологическим соображениям периода.
В принципе каждая осмотическая система имеет одно или более отверстий для выхода лекарственного средства, изготовление которых (например, с использованием лазерных установок) значительно повышает стоимость технологического процесса. Точное описание методов изготовления таких отверстий, а также их минимальные и максимальные размеры приведены в US-A-3485770 и 3916899, а также на прилагаемых к ним рисунках.
Выраженные побочные эффекты при использовании осмотических систем, вызывающие необходимость отмены применяемых в них лекарственных средств (индометацина), по-видимому, обусловлены интенсивным освобождением последних через отверстия (так называемый эффект отсечки) (см. A. N. Martin, Phyrilalische Pharmarie, Ed. H. Stricker, 3d Edition, page 576, Stuttgartm 1987).
Таким образом, остается необходимость разработки системы для контроля освобождения хорошо растворимых активных соединений и способа изготовления такой системы, прежде всего для хорошо растворимых фармацевтических средств.
Цель изобретения создание системы для контроля освобождения активного соединения, в которой применительно к фармацевтическим препаратам такое освобождение осуществляется на протяжении физиологически или терапевтически обоснованного периода, и по возможности, в соответствии с кинетикой нулевого порядка, независимо от маргинальных условий. Кроме того, система должна обеспечивать возможность избирательной регуляции продолжительности лаг-периода, обычно имеющего место при использовании осмотических систем. Характер выделения лекарственного средства должен, в основном, оставаться постоянным даже в случае повреждения мембраны, регулирующей его скорость.
Желательно, чтобы освобождение активного соединения происходило по всей поверхности фармацевтического препарата, поскольку это позволяет предотвратить повреждение мембраны при выходе высоко концентрированного раствора лекарственного средства в адьюванте на одном ее участке. Задержка освобождения активного ингредиента реализуется использованием соответствующего адьюванта, который должен быть коммерчески доступным, легко поддаваться фармацевтическому и технологическому манипулированию и не обладать токсичностью.
При использовании других активных соединений, таких как протекторы растений, удобрения или регуляторы роста, вышеуказанные преимущества реализуются, исходя из индивидуальных свойств каждого из этих агентов.
Изобретение обеспечивает достижение всех названных целей.
Предмет изобретения система для контроля освобождения активных соединений, включающая внутреннюю золу, которая содержит по крайней мере один активный ингредиент и вспомогательные вещества, и полупроницаемую оболочку, образуемую наружной пленкой и растворимым, гидрофильным или гидрофобным пластификатором. Система отличается тем, что ее внутренняя зона содержит по крайней мере один осмотически активный агент и по крайней мере один полимерный адьювант, способный набухать и характеризующийся менее выраженной тенденцией к гидратации по сравнению с активными ингредиентами или осмотически активными адьювантами, входящими в состав данной системы.
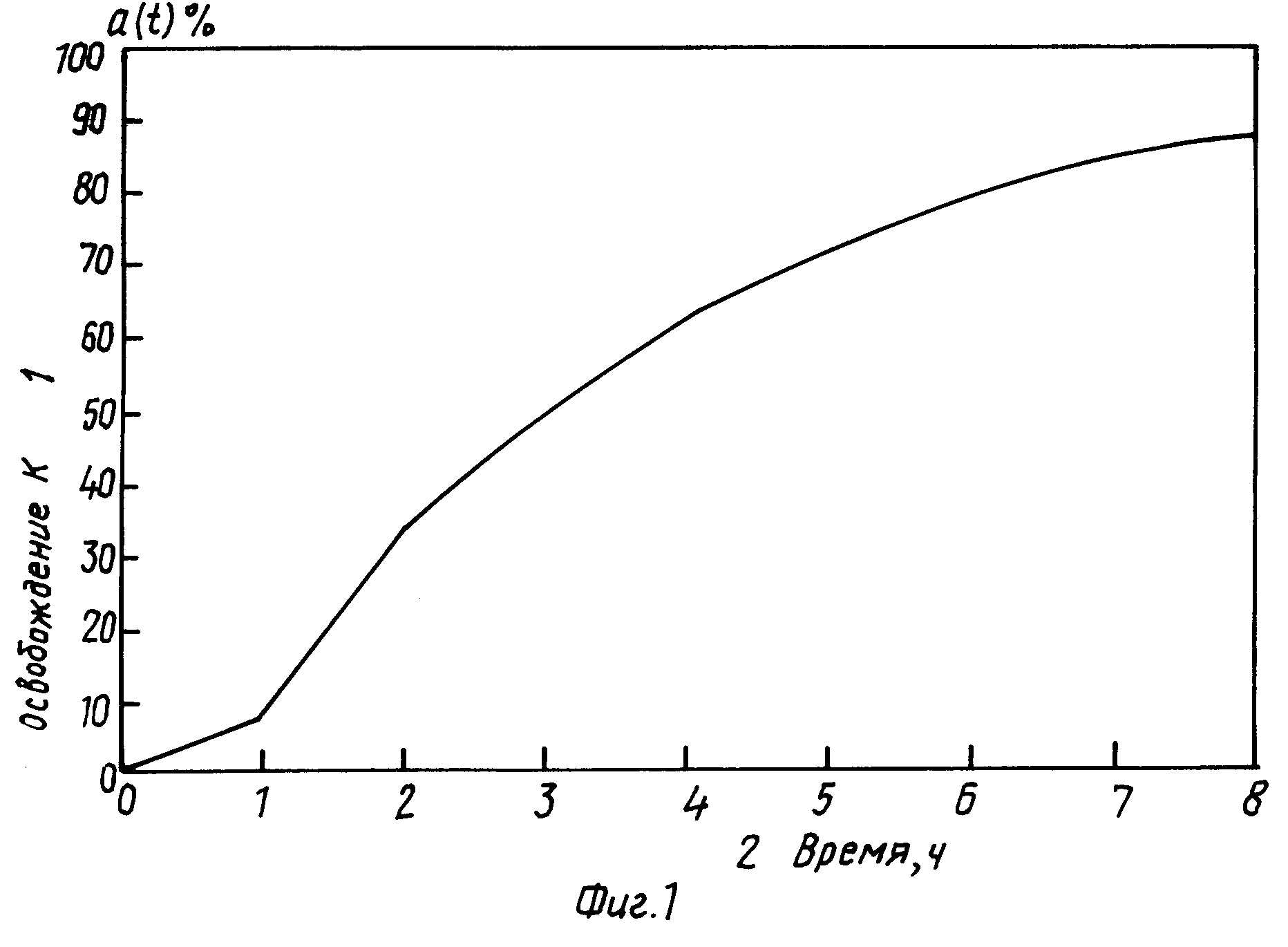
Другим предметом изобретения является способ изготовления системы для контроля освобождения активных соединений, отличающийся тем, что по крайней мере один активный ингредиент смешивают по крайней мере с одним осмотически активным веществом и по крайней мере с одним полимерным адьювантом, способным к набуханию, или (при необходимости) с обычными адьювантами, и тем, что смесь спрессована в ядро, которое затем покрывают оболочкой, состоящей из формообразующей пленки и растворимого, гидрофильного или гидрофобного пластификатора. На фиг. 1 показано освобождение дилтиазема из фармацевтических препаратов по примеру 2 ("Освобождение К"): 1 показатели "освобождение К", 2 время (часы); на фиг. 2 концентрация в плазме крови после введения фармацевтического препарата дилтиазема, изготовленного по способу в примере 2 ("введение К") в сопоставлении с коммерческим медленно действующим препаратом ("введение u"): 1 результаты измерений при "введении К", 2 результаты измерений при "введении u", 3 концентрация (нг/мл), 4 время (часы); на фиг. 3 концентрация в плазме первичного метаболита, дезацетилированного дилтиазема, после введения фармацевтического препарата дилтиазема, изготовленного по способу в примере 2 ("введение К") в сопоставлении с коммерческим медленно действующим препаратом ("введение u"): 1 результаты измерений при "введении К", 2 результаты измерений при "введении u", 3 - концентрация (нг/мл), 4 время (часы).
Что касается понятия растворимости активных ингредиентов, то термин "хорошо растворимое вещество" относится к таким веществам, 1 мас. ч. которых растворяется в объеме растворителя менее 30 мас. ч. (см. Arznubuch der DDR, Academic Verlag, Berlin 1985- 1 (II), ч.о.).
Контроль освобождения активных соединений в предлагаемой системе осуществляется формированием ее внутренней зоны из соответствующих осмотически активных и осмотически почти неактивных веществ (способного к набуханию полимерного адьюванта) и последующим покрытием этой сердцевины подходящим материалом при совместимости свойств сердцевины и оболочки, благодаря которой при протекании воды в лаг фазе через мембрану, обладающую способностью задерживать растворитель, скорость протекания определяется осмотической активностью материала внутренней зоны.
Система может иметь по крайней мере одно отверстие для выхода активного ингредиента, которое делается обычным способом. В отсутствие такого отверстия гидравлическое давление, развивающееся на протяжении лаг фазы, может вызвать истончение на одном из участков стенки покрытия и образование микропор, размер которых измеряется микрометрами. Это, в свою очередь, приведет к выкачиванию раствора активного соединения, образуемого жидкостью, поступающей во внутреннюю зону под воздействием осмоса и растворяющей активное соединение, преимущественно в ходе конвекционных процессов. Гидростатическое давление служит движущей силой освобождения активного ингредиента.
В качестве примеров вспомогательного лекарственного вещества с достаточно высокой осмотической активностью могут быть названы лактоза, фруктоза, декстроза, сахароза, маннитол, хлористый натрий, хлористый калий, сернокислый калий, моно-, дии трифосфаты натрия и их смеси.
Осмотически активный адьювант может представлять собой вещество, обладающее буферными свойствами. Если сам активный ингредиент обладает достаточно высокой осмотической активностью, он может выполнять функцию адьюванта. В этом случае отпадает потребность в использовании дополнительного осмотического активного адьюванта.
В предлагаемой системе осмотически активный адьювант применяется в концентрациях от 2 до 98 мас. в пересчете на общую массу адьюванта во внутренней зоне.
Примерами приемлемых полимерных адьювантов, обладающих способностью к набуханию, служат поливиниловые спирты, предпочтительно с остаточным содержанием ацетата от 6 до 18 мол. и средней молярной массой 20 000 70 000, а также производные клетчатки, такие как метилцеллюлоза, этилцеллюлоза, оксипропилцеллюлоза, оксипропилметилцеллюлоза и оксиметилцеллюлоза. Эти полимерные, способные к набуханию адьюванты проявляют менее выраженную тенденцию к гидратации, чем применяемые в системе активные соединения или смеси применяемых активных соединений с осмотически активными адьювантами. Условием их приемлемости является осаждение в насыщенных водных растворах осмотически активного адьюванта и/или активного соединения. Возможно также применение обычных, используемых при таблетировании вспомогательных лекарственных веществ, таких как связующие материалы, наполнители и лабриканты.
В предлагаемой системе способные набухать полимерные адьюванты используются в концентрациях от 5 до 90, предпочтительно от 5 до 60 мас. от общей массы во внутренней зоне.
Оболочка состоит из формообразующей пленки, материалом которой служат ацетатцеллюлоза, этилцеллюлоза, поливинилацетат или сополимеры полиакриловой кислоты, а также растворимые, гидрофильные (например, полиэтиленгликоль) или гидрофобные (например, касторовое масло) пластификаторы. Предпочтительным пластификатором служит полиэтиленгликоль, имеющей среднюю молярную массу от 400 до 20 000. В пересчете на масс пленкообразующего материала расход пластификатора составляет от 2 до 30 мас.
Материал покрытия подбирается таким образом, чтобы сообщить последнему способность задерживать соли, т.е. придать ему свойство полупроницаемости.
Одновременно подбирают подходящее осмотически активное вещество, обладающее буферной активностью (например, одно- или двуосновные соли фосфорной кислоты), а pН внутренней зоны системы доводят до требуемой величины общепринятым способом. Это необходимо также для обеспечения оптимальных условий растворения активного соединения, если оно зависит от рН среды, его освобождения из системы и набухания полимерного адьюванта, которое тоже может зависеть от pН.
Изобретение предполагает возможность контролируемого освобождения активного соединения посредством по крайней мере трех различных механизмов.
1. С использованием свойств оболочки (регуляторной мембраны), таких как толщина, характер поверхности, проницаемость для воды, количество и размеры пор. Все эти параметры могут контролироваться уже известными способами.
2. С использованием свойств материала внутренней зоны, состав которого определяет величину осмотического давления и вязкость раствора в системе активное соединение и адьювант.
3. Через соотношение насыщаемой растворимости используемых растворимого активного соединения и адьюванта.
Способный к набуханию полимерный адьювант, входящий в состав материала внутренней зоны, функционирует в нормальных условиях (т.е. при неповрежденной оболочке) в "обеспечивающей среде". Иными словами, он самое большее подвергается ишь слабой гидратации и соответственно мало растворимым. В случае повреждения покрытия образуется избыток воды, которая уже не может полностью связываться активным соединением, что приводит к набуханию адьюванта. Таким путем адьювант препятствует нерегулируемому притоку воды внутрь системы и беспрепятственному вытеканию из нее быстро растворяющегося активного ингредиента. Это, в свою очередь, вызывает уменьшение количества свободно доступной воды, которая снова связывается осмотически активным соединением с повышенным сродством к ней. В результате способный к набуханию адьювант по крайней ере частично подвергается дегидратации и таким образом снова переводится в твердую форму. Может показаться странным и неожиданным, что введение во внутреннюю зону предлагаемой системы гидрофильного полимерного адьюванта, способного к набуханию, не сопровождается набуханием полимера в соответствии с описанием в ЕР-А-0277092, где он применяется для контроля освобождения слабо растворимых фармацевтических средств, и что это не ведет к существенному увеличению вязкости раствора активного ингредиента и адьюванта в зоне, создаваемой полупроницаемой оболочкой, которую изготавливают обычными, хорошо известными способами. Как правило, ожидают, что это вызовет значительное увеличение освобождения активного ингредиента и растворенного адьюванта через поры полупроницаемой оболочки. На самом деле, при неповрежденном покрытии влияние на освобождение активного ингредиента из системы незначительно, в дополнение к тому преимуществу, что применение гидрофильных полимерных адьювантом, способных к набуханию и обладающих хорошими связывающими свойствами, увеличивает возможности формовки материала внутренней зоны.
Предлагаемая система предусматривает также покрытие сердцевины оболочкой, проницаемой для растворения активного ингредиента и/или растворенного осмотически активного адьюванта. Неожиданным является тот факт, что покрытие материала внутренней зоны проницаемой оболочки в соответствии с предлагаемым изобретением гарантирует функционирование, а следовательно, и безопасность системы.
Тем не менее, в случаях повреждения покрытия, которое сводит на нет функциональную активность, а следовательно, и безопасность существующих систем контроля освобождения фармацевтических средств, основанных на использовании мембран с регулируемыми свойствами или пористостью, предлагаемая система, гарантирует сохранение нормального функционирования и безопасности. Для специалиста совершенно очевидны преимущества этой системы с точки зрения ее терапевтической безопасности, технологической простоты и низкой стоимости изготовления. Очевидна также возможность регуляции режима освобождения активного ингредиента посредством изменения толщины покрытия. Общеизвестно, что для увеличения продолжительности замедленного выделения активного соединения, особенно сохранения его линейного характера (в данном описании - освобождения в соответствии с кинетикой нулевого порядка), толщина покрытия должна быть минимальной. Процесс выведения активного соединения характеризуется лаг-фазой большей или меньшей продолжительности, на протяжении которой его освобождение не имеет клинических последствий или вообще отсутствует (K. Heilmann, Theraneutcsche Systeme, Georg Thieme, Stuttgart, 1978).
Предлагаемые процедура и состав фармацевтического препарата обеспечивают достижение линейного характера освобождения активного ингредиента даже при минимальной толщине покрытия.
Предлагаемая система может изготавливаться в виде общепринятой лекарственной формы, например в виде таблеток или капсул. Она может также входить в состав обычных многокомпонентных средств или применяться в виде микрофлоры, например, для заполнения капсул. Многокомпонентная форма предполагает разделение общей дозы между несколькими меньшими формами (микроформами, такими как, например, микрокапсулы, пилюли и микротаблетки; при этом малые формы, обычный размер которых не превышает 3 мм, получают разнообразными способами, включая коацервацию, экструзию, компрессию и таблетирование).
Примерами высоко растворимых активных соединений, пригодных для использования в системе освобождения, могут служить фоледринсульфат и дилтиазем. В соответствии с настоящей заявкой, применение этих активных соединений обеспечивает получение систем эффективного контроля освобождения при условии использования рекомендуемых соотношений адьювантов.
Изобретение иллюстрируется на примере фолэдрин сульфата в качестве активного соединения (используется в качестве растворимого лекарственного средства), хлористого калия в качестве осмотически активного вещества и поливинилового спирта (ПВС) в качестве способного к набуханию растворимого полимера (тип 55/12, VEB Chem. Werke Buna, Schkopau, German Democratic Republic). Последний служит примером полимерного адьюванта, способного к набуханию и обладающего менее выраженной тенденцией к гидратации по сравнению с осмотически активными компонентами внутренней зоны, 2,5 ацетат - целлюлозой в качестве пленкообразующего материала и полиэтиленгликолем (ПЭГ 6000) в качестве гидрофильного пластификатора.
Пример 1.
Состав покрытия, мас.ч.
2,5 ацетат целлюлоза 100
Полиэтиленгликоль 600 25
Эти соединения в
указанных соотношениях разбавляют ацетоном и, пользуясь
существенными методами, наносят на сердцевин фармацевтического средства в качестве покрытия толщиной 60 мкм.
Состав внутренней
зоны 1a:
Сердцевину формируют из фолэдрин
сульфата и хлористого калия в соотношении соответственно 60,0 и 190,0 мг (общий вес 250,0 мг), пользуясь существующими способами и получая тело
диаметром 7 мм.
Состав внутренней зоны
1б:
Сердцевину формируют из фолэдрин сульфата, хлористого калия и ПВС 55/12 в соотношении соответственно 60,0, 165,0 и 25,0 мг (общий
вес 250,0 мг), пользуясь существующими способами и
получая тело диаметром 7 мм.
Состав внутренней зоны 1в:
Сердцевину формируют из фолэдрин сульфата, хлористого калия и ПВС
55/12 в соотношении соответственно 60,0, 152,5 и 36,5
мг (общий вес 250,0 мг), пользуясь существующими способами и получая тело диаметром 7 мм.
Состав внутренней зоны 1г:
Сердцевину формируют из фолэдрин сульфата, хлористого
калия и ПВС 55/12 в соотношении 60,0, 127,5 и 62,6 мг (общий вес 250,0 мг), пользуясь существующими способами и получая тело диаметром 7 мм.
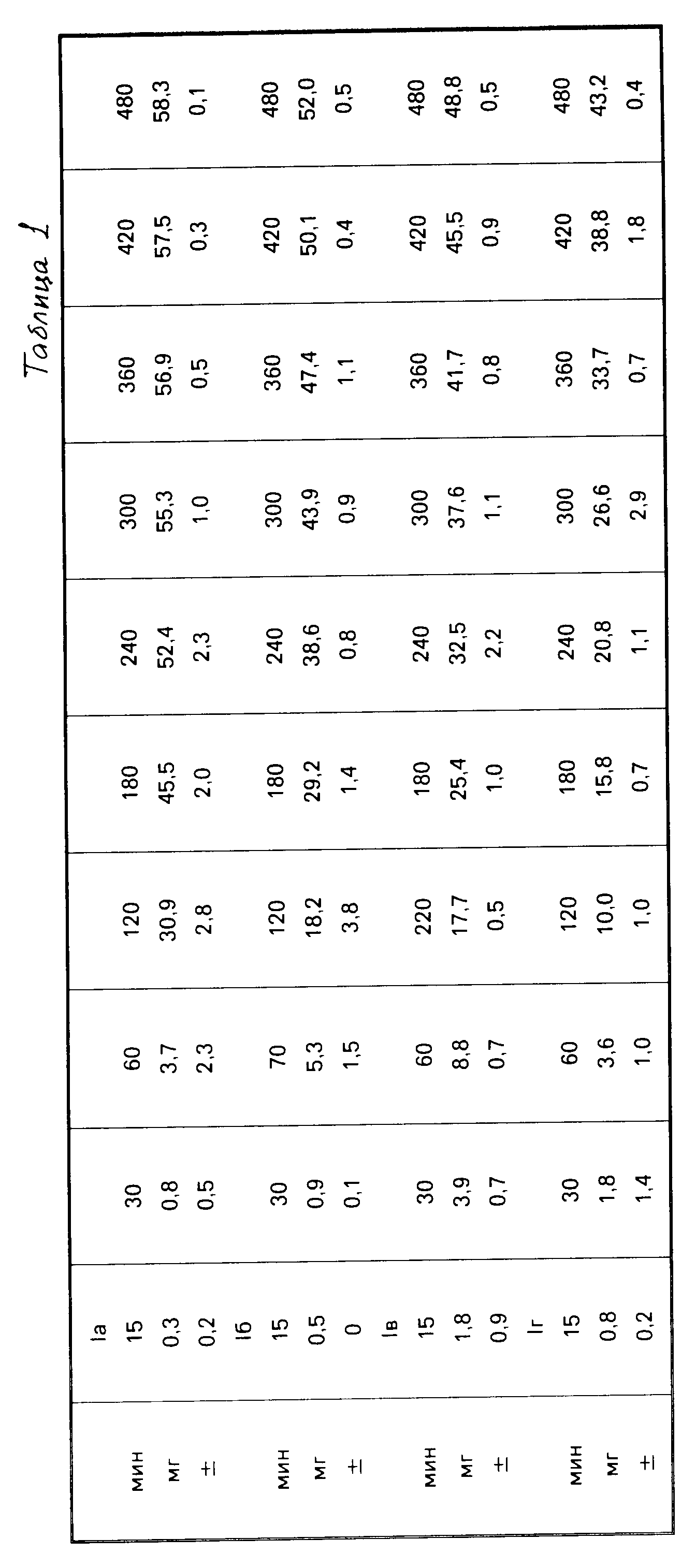
Характер освобождения фармацевтических средств по примеру 1 (количество выводящегося фолэдрин сульфата: вес ± стандартное отклонение (с)) по результатам 6 определений (в соответствии с ХХI, Paddle Meythod, в качестве среды освобождения вода) представлен в табл.1.
В соответствии с желаемой кинетикой нулевого порядка при толщине покрытия 60 мкм выделение фолэдрин сульфата сначала не происходит по крайней мере на протяжении короткого периода. Это объясняется тем, что к этому времени еще не достигается минимальная толщина покровного слоя, необходимая для функционирования осмотической системы освобождения активного соединения.
Однако чем выше содержание ПВС, тем больше степень линейности кривых. При составе внутренней зоны 1 г она содержит 25% поливинилового спирта, что обеспечивает наибольшее приближение к идеальному профилю освобождения по кинетике нулевого порядка.
Необычным для специалиста является тот факт, что большие количества растворимого в холодной воде и способного к набуханию поливинилового спирта не вызывают разрыва тонкой оболочки и резкого уменьшения скорости освобождения заключенного в нее лекарственного средства.
Ниже описан характер выделения активного соединения из внутренней зоны, имеющей состав 1 г, после повреждения покрытия толщиной 60 мкм. Дополнительные отверстия диаметром до 300 мкм, имеющиеся в оболочке, согласно существующим представлениям должны были бы значительно ухудшить или полностью нарушить функциональную активность системы контроля выделения активного соединения, которая сама имеет диаметр всего 7 мм. Такую возможность легко проверить в контрольных экспериментах с использованием осмотических систем или фармацевтических средств, изготовленных иными, нежели в данном изобретении, способами.
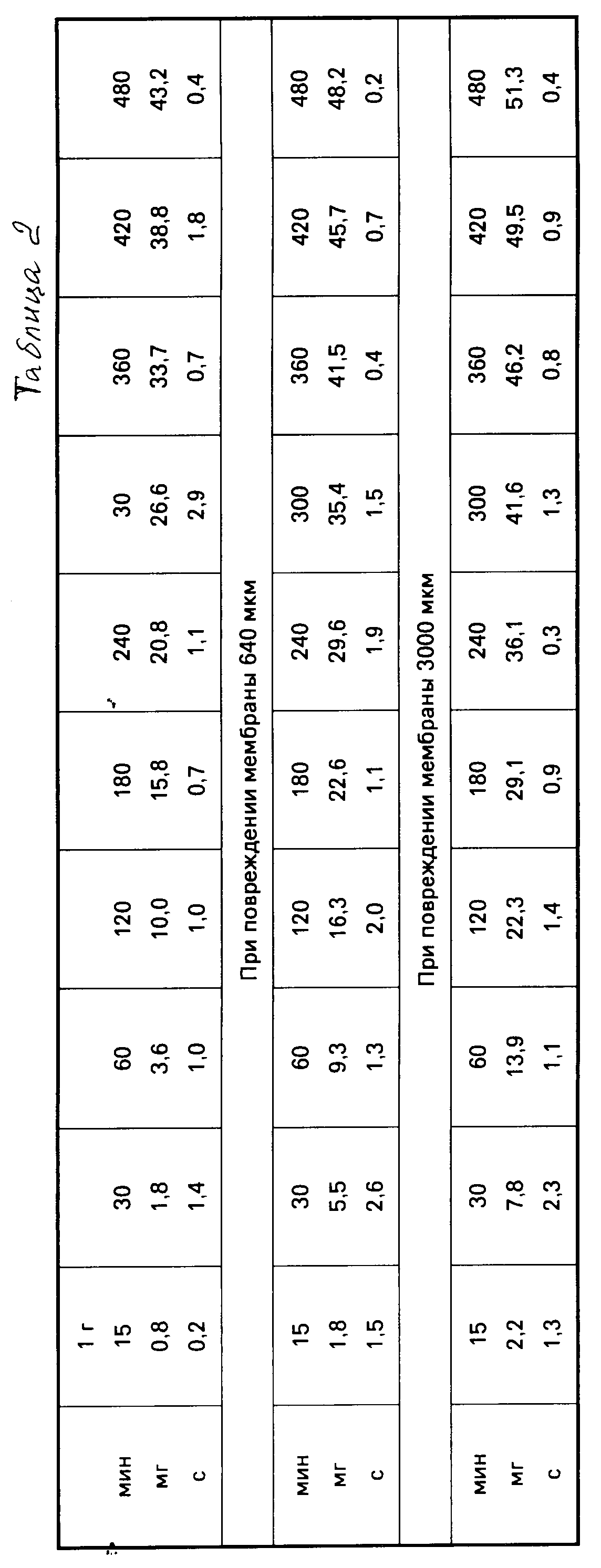
Характер освобождения фармацевтических средств по примеру 1 при составе внутренней зоны 1 г (количество выводящегося фолэдрин-сульфата: вес ± стандартное отклонение) по результатам 6 определений представлен в табл.2.
Приведенные данные показывают, что в течение 8 ч после введения системы контролируемого освобождения фармацевтического средства в организм поступило только 8 мг активного ингредиента из 60 мг его общего количества. Нижеприведенные цифры еще более четко иллюстрируют эту ситуацию. Характер освобождения фармацевтических средств по примеру 1 при составе внутренней зоны 1 г (количество определений 6, толщина мембраны 60 мкм) представлен в табл.3.
В предлагаемой системы может компенсироваться даже обширное повреждение оболочки, что повышает безопасность применения фармацевтических средств.
Другое преимущество состоит в том, что активный транспорт используемого в системе лекарственного средства обеспечивает его более полное освобождение, в связи с чем биологическая доступность такого препарата значительно выше, чем, например, в матричных фармацевтических композициях.
Эффективность процесса освобождения иллюстрируется примером 2, описывающим поведение лекарственного средства дилтиазема в условиях in vivo и in vitro. Этот пример подтверждает также функциональную активность данной системы in vivo.
Пример 2.
Готовят таблетки следующего состава:
Состав покрытия мас.ч.
2,5 ацетатцеллюлоза 225
Полиэтиленгликоль 112,5
Это покрытие после разведения ацетоном наносят на сердцевин до образования оболочки толщиной
30 мкм, используя для этого существующие методы. Состав внутренней зоны,
мг:
Дилтиазем гидрохлорид 180,0
ПВС 55/12 78,8
Сернокислый калий 250,2
Стеарат магния 1,
0
Общий вес 510,0
Эти ингредиенты формуют в таблетки
диаметром 9 мм, используя общепринятые методы.
В отрытом рандомизированном исследовании с использованием двойного перекрестного контроля изучены фармакокинетические параметры после введения медленно действующих лекарственных форм дилтиазема, содержащих 90 или 180 мг активного вещества.
Стандарт/"введение и"
90 мг, таблетки медленно действующего
коммерческого препарата,
Активный ингредиент 90 мг дилтиазема
Тестируемое средство/"введение К"
Дилтиазем ретард, 180 мг, таблетки
Состав по примеру 2, активный
ингредиент 180 мг дилтиазема.
Количественно определение дилтиазема и основного продукта его превращения дилтиазем дезацетата в плазме крови проводят с помощью специфической, отвечающей требованиям контроля качества высокоэффективной жидкостной хроматографии. Чувствительность определения составляла 2 и 1 нг/мол соответственно для дилтиазема и его дизацетилированного производного.
Исследование проводили на 4 добровольцах мужчинах в возрасте 18-40 лет. Во всех четырех случаях исследование было завершено в соответствии с протоколом.
В соответствии с протоколом исследования, введение дилтиазема производили по методу случайной выборки с перерывами в одну неделю. Включенные в исследование пациенты уменьшали потребления пищи в течение 10 ч до и до 4 ч после каждого введения препарата.
Непосредственно перед введением и через 1, 2, 3, 4, 6, 8, 10, 12, 24, 30, 36 и 48 ч после него отбирали пробы венозной крови объемом 10 мл и получали плазму, использовавшуюся для определения концентрации дилтиазема и его дезацетилированного производного.
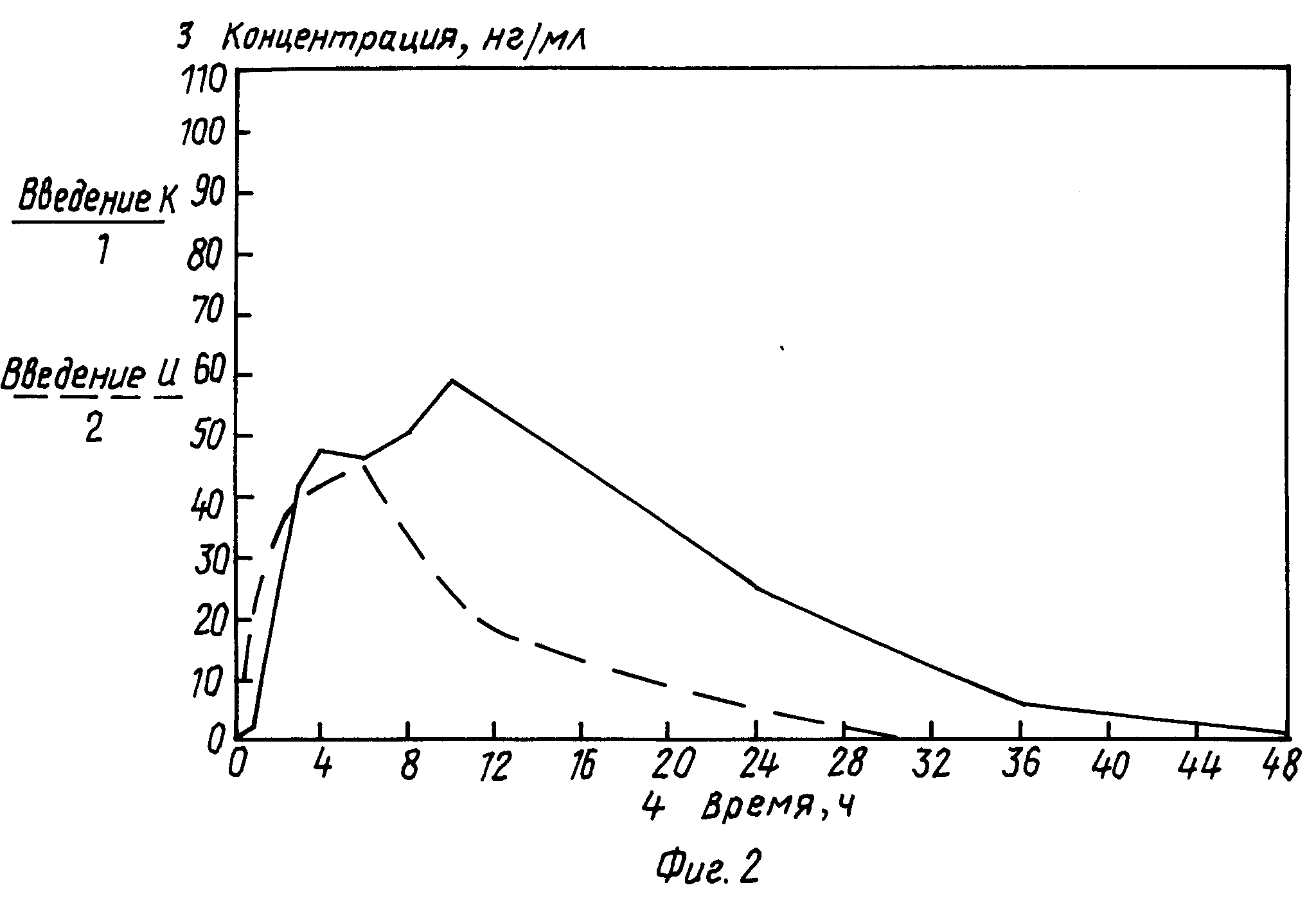
На фиг. 1 показан характер выделения дилтиазема в опытах in vitro (даны средние величины 6 определений при использовании таблеток, изготовленных по способу в примере 2). На фиг. 1 видна лаг фаза, на протяжении которой выделение активного соединения было незначительным.
Концентрация дилтиазема в плазме крови после введения двух его лекарственных форм показана на фиг. 2. Очевидно явное преимущество предлагаемой системы с точки зрения биологической доступности препарата и продолжительности периода минимальных терапевтических эффективных концентраций, несмотря на его более высокую дозировку в соответствии с примером 2. Фармацевтическое средство, изготовленное по способу примера 2, позволяет ограничиваться однократной суточной дозой.
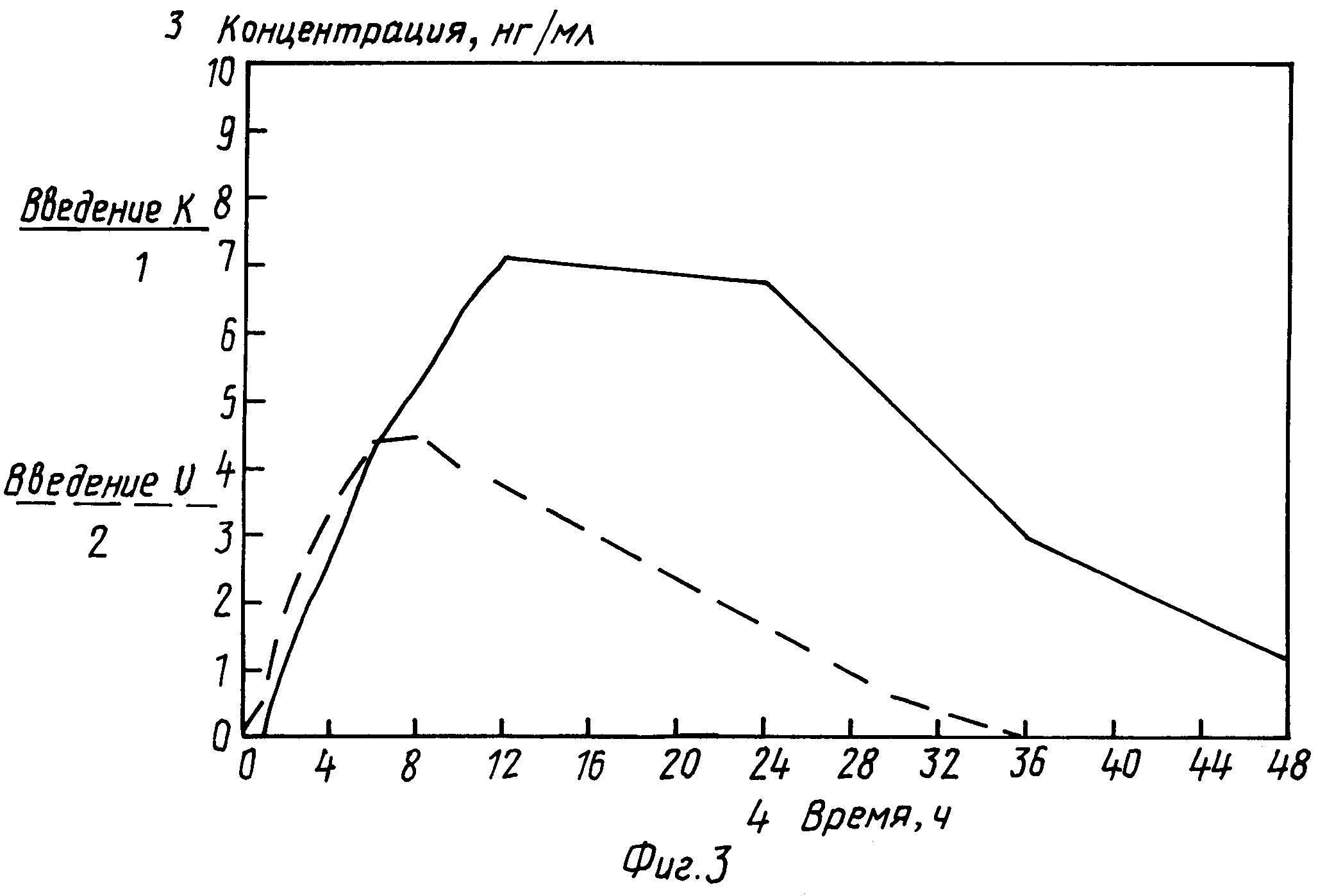
Концентрации дезацетилированного дилтиазема, приведенные на фиг. 3, подтверждают достоверность методики определения и получаемых с ее помощью результатов.
Теоретически вышеописанные системы могут быть использованы для введения различных биоактивных средств. В дополнение к активным соединениям, применяемым в сельском хозяйстве, например, инсектицидам и другим протекторам растений, регуляторам роста или удобрениям, эти системы могут быть особенно рекомендованы для введения лекарственных препаратов, используемых в медицине и ветеринарии.
Возможность применения таких активных соединений в описываемой системе ограничена их насыщаемой растворимостью и кумулятивными дозировками. В этой связи важное значение имеет соотношение между насыщаемой растворимостью осмотически активного соединения и активного ингредиента или смеси активных ингредиентов, поскольку это отношение определяет потребное количество адьювантов, а следовательно, общую массу системы и условия ее практического применения. При очень высокой растворимости активных ингредиентов их содержание в системе может быть также очень высоким.
При слабой растворимости активное соединение может быть введено в систему только в относительно небольших количествах.
Возможности использования слаборастворимых активных соединений расширяются в случаях применения плохорастворимых носителей (например сернокислого калия).
Реферат
Изобретение относится к способу получения состава для регулированного выделения активных соединений. По терапевтической эффективности полученный состав сопоставим с системами для внутривенного капельного вливания, обеспечивающими равномерное и полное освобождение активного соединения из фармацевтического препарата на протяжении физиологически и терапевтически обоснованного периода, преимущественно в ходе конвекционных процессов. Это обеспечивает поддерживание постоянного содержания активного соединения в крови, отвечающего целям терапии, что гарантирует длительное действие препарата в отсутствие отрицательных побочных эффектов и одновременное улучшение местной толерантности к препарату в желудочно-кишечном тракте. Полученная система обеспечивает быстрое достижение требуемой скорости освобождения активного соединения в течение короткого периода. Сущность изобретения заключается в том, что одно растворимое активное соединение смешивают с одним осмотически активным веществом, таким как хантоза, фруктоза, декстроза, сахароза, лианнитол, NaCl, KCl, K2SO4 моно-, ди-, тринатрийфосфат или их смесь и по крайней мере с одним способным к набуханию полимерным адьювантом, или с обычным адьювантом, формуют ядpо, которое покрывают оболочной из пленкообразователя и растворимого гидрофильного или гидрофобного пластификатора. 3 фиг., 3 табл.

Комментарии