Генно-модифицированные организмы для получения липидов - RU2617963C2
Код документа: RU2617963C2
Чертежи




Описание
Область изобретения
Данное изобретение направлено на генно-модифицированные организмы не млекопитающих, в частности микроорганизмы, в которых определенные ферментные активности уменьшены и/или повышены, которые являются полезными в промышленном биосинтезе липидов, в частности нейтральных липидов. Данное изобретение дополнительно относится к применениям таких организмов, транспортным основам для получения таких организмов и способам получения таких организмов.
Предпосылки создания изобретения и уровень техники
Липиды являются гидрофобными или амфифильными малыми молекулами, которые образовываются полностью или частично при помощи карбанионных конденсаций тиоэфиров, например, жирных кислот или поликетидов, и/или при помощи карбанионных конденсаций изопреновых звеньев, например, пренолов или стеролов. Данная группа включает несколько веществ высокой экономической важности. Группа триглицерол-липидов включает, например, масла, жиры или воски, которые используют в широком разнообразии контекстов, например, в качестве ингредиентов для пищевой промышленности или для приготовления пищи, для получения мыл, продуктов по уходу за кожей, духов и других средств личной гигиены и косметических продуктов. Для получения красок и других продуктов обработки древесины, в качестве биоразлагаемых изоляторов в электротехнической промышленности, для получения биоразлагаемых гидравлических жидкостей, в качестве смазывающих веществ, или даже в качестве основы биодизельного топлива, которое может быть использовано для замещения традиционных дизелей. Изопреноид-липидный сквален, например, используют в качестве адъюванта в вакцинах или других фармацевтических средствах, пищевых добавках, косметических средствах, а также безрецептурных лекарственных средствах. Сквален может быть также использован в качестве билдинг-блока для синтеза терпенов. Дополнительно сквален может быть использован в промышленности в качестве биоразлагаемого смазочного вещества. Другими экономически важными липидами являются стеролы, такие, как эргостерол, зимостерин, эпистерол, вещество для получения таких соединений, как сапонин, стероидные гормоны, витамины и фармацевтические вещества.
Липиды, в частности нейтральные липиды, обычно сохраняются в клетке в специфичных внутриклеточных органеллах, известных как липидные частицы. Данные частицы характеризуются простой структурой, состоящей из высокогидрофобного монослоя с только небольшим количеством включенных белков. Липиды сохраняются в липидных частицах, пока гидролиз не направит возврат их компонентов в метаболические и/или катаболические маршруты. Данный процесс образования липидных депо широко используют в природе, и все типы эукариотных клеток содержат внутриклеточные липидные частицы, которые также могут иметь название липидных телец, липидных капель, масляных телец или олеосом. В дрожжах Saccharomyces cerevisiae липидные капли накапливают до 70% общего содержаний липидов клетки.
Поскольку большинство из перечисленных липидов получают из природных источников, например, растений, животных или микроорганизмов, были предприняты попытки повысить количество липидов живых клетках, т.е., накопить большее количество липидов в липидных частицах. Для этого, как известно, модифицируют метаболические маршруты организмов. Документ ЕР-0486290 А описывает избыточную экспрессию генов метаболизма эргостерола в дрожжах, приводящую к увеличению эргостерола в клетках. Документ WO03/064652 А описывает способ продуцирования зимостерина на основе увеличения ланостерин-С14-деметилазнойы и HMG-CoA-редуктазной активности. В документе WO2004/083407 А описаны тренсгенные организмы, имеющие пониженную Δ22-десатуразную активность и повышенную активность HMG-CoA редуктазы, ланостерин С14-деметилазы, сквален эпоксидазы и сквален синтетазы. Такие организмы могут быть использованы для выработки стерол липид эргоста-5,7-диенола. Таким образом, путем биологического модифицирования организмов, вырабатывающих липиды, выход полученных липидов может быть существенно увеличен.
Однако полученные липидные соединения в основном не очищены и перемешаны и должны быть разделены и/или очищены, в частности, если липиды предназначены для применения в качестве исходного вещества для дополнительных химических синтезов или модификаций. Дополнительно, любая процедура очистки, в особенности при проведении в промышленном масштабе, является дорогой, трудоемкой и имеет тенденцию к загрязнению окружающей среды.
Техническая проблема данного изобретения
Соответственно, техническая проблема, лежащая в основе данного изобретения, включает обеспечение средств и способов, позволяющих выработку липидов организмами в более чистой форме во избежание трудоемких и дорогостоящих процедур очистки.
Краткое описание данного изобретения и преимущественные варианты исполнения изобретения
Для решения такой технической проблемы, данное изобретение описывает организм в соответствии с п.1. Преимущественные варианты исполнения описаны в пунктах, зависимых от п.1. В них выражение "генно-модифицированные" предназначено для включения не только организмов, в которых геном был модифицирован способами генной инженерии, известными из уровня техники, которые были выбраны из мутантной группы в соответствии с целевой генной модификацией (традиционный мутагенез).
Данное изобретение основано на открытии, что возможно генно конструировать или биохимически модифицировать организмы таким образом, чтобы конкретные (нейтральные) липиды накапливаются в липидных частицах в более чистой форме. Организмы в соответствии с данным изобретением модифицированы таким образом, который устраняет или уменьшает синтез нежелательных стерилацильных эфиров и/или триацилглицеринов и/или восковых эфиров, в зависимости от липида, который предназначен для выработки организмом при более высокой чистоты. В дополнение к накоплению нейтрального липиды в более чистом виде, такое уменьшение или устранение возможно загрязняющих стерилацильных эфиров и/или триацилглицеринов и/или восковых эфиров также неожиданно приводят к увеличенным уровням и выходам целевого липида. Это может быть вызвано, не будучи связанными данной теорией, с увеличенным объемом хранения липидных частиц и/или повышенной биодоступностью субстрата для синтеза целевого липида.
Термин "нейтральный липид" относится к липидам, не имеющим заряженных групп и поэтому неспособных интегрироваться в двухслойные мембраны в существенных количествах. Термин включает триацилглицерины (TAGs), стерилацильные эфиры (SAEs) и восковые эфиры (WEs). Сквален также относится к классу "нейтральных липидов". Обычно, содержимое липидной частицы представляет собой смесь различных нейтральных липидов, что препятствует эффективной выработке целевого конкретного нейтрального липиды в рекомбинантном организме. Эту проблему решает данное изобретение путем модификации вырабатывающего организма таким образом, что как минимум один тип нейтрального липида, встречающегося в природе в указанном организме в указанной липидной частице, более не синтезируется таким образом. В результате, композиция оставшихся нейтральных липидов, содержащихся в липидной частице, становится более чистой и, таким образом, более привлекательной для выработки в коммерческих целях.
В общем, может быть применена любая одна активность или комбинация различных активностей (две, три или четыре) в соответствии с п.1, в зависимости от нейтрального липида, предназначенного для синтеза с более высокой чистотой, или, в свою очередь, в зависимости от нейтрального липида, который предназначен для удаления в биосинтезе как нежелательное загрязнение. Таким образом, существуют различные варианты исполнения данного изобретения и только конкретные варианты исполнения изобретения будут описаны далее более подробно.
Таким образом, в первом варианте исполнения изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что более не синтезирует стерилацильный эфир (SAE). Стерилацильные эфиры являются эфирами стеролов с длинноцепочечными жирными кислотами. В общем, синтез SAEs происходит в клетках при помощи ферментного механизма, задействующего ацил-СоА: стеролацил трансфераза/стерол O-ацилтрансферазу (ЕС 2.3.1.26). Катализируемая реакция представляет собой этерификацию стеролов длинноцепочечными жирными кислотами. Таким образом, в преимущественном варианте исполнения изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что активность ацил-СоА: стерол ацилтрансферазы/стерол O-ацилтрансферазы (ЕС 2.3.1.26) уменьшена по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа.
В дрожжах, в частности в S. cerevisiae, этерификация стеролов с получением стерилацильных эфиров достигается двумя изоферментами стерилацил трансферазы, т.е. Are1p и Are2p, имеющими различные специфичные афинности для различных стерольных промежуточных веществ. Are1p приводит в частности к этерификации предшественников эргостерола, таких, как ланостерин, зимостерин, эргоста-5,7-диенол и вещества, чужеродные дрожжам, такие, как 7-дегидро холестерин. Are2p приводит преимущественно к этерификации эргостерола, конечного продукта маршрута биосинтеза эргостерола в дрожжах. Если организм является дрожжевым организмом, в частности рода Saccharomyces и, преимущественно, S. cerevisiae, активность Are1p или Are2p или обоих, Are1p и Are2p, может быть снижена или устранена по сравнению с соответствующим немодифицированным дрожжевым организмом, преимущественно соответствующим организмом дикого типа. При устранении обеих ферментных активностей, в клетках не происходит этерификания стеролов. Путем устранения только одной активности и сохранения другой, возможно получить, при желании, определенный тип стерилацильного эфира в клетках, если ферментные активности, приводящие к определенным стеролам, соответственно сохранены или адаптированы в организме.
В связи с первым аспектом данного изобретения, в котором организм отличается тем, что более не синтезирует стерильный ациловый сложный эфир, организм в соответствии с данное изобретение может в принципе быть любым возможным организмом, растительным организмом, грибковым организмом или бактериальным организмом. Однако, преимущественно организм получен из организма, который не сохраняет природно восковые эфиры в его липидных частицах, а только другие липиды, например, триацилглицерины и стерилацильные эфиры. Таким образом, путем устранения биосинтетического маршрута для синтеза стерилацильного эфира, такой организм накапливает в его липидных частицах в основном только триацилглицерины, таким образом, позволяя продуцировать в такой организм триацилглицерины в скорее чистой форме из липидных частиц. Примеры организмов, которые не накапливают природно восковые эфиры в их липидных частицах, в частности главным образом, представляют собой животных, клетки грибов и большинство растительных клеток, за исключением водорослей и клеток планктона. В особо преимущественном варианте исполнения изобретения в связи с первым аспектом данного изобретения, организм является грибковым организмом, преимущественно грибковым организмом рода, выбранного из группы, состоящей из Yarrowia, Rhodotorula, Lipomyces, Candida, Rhodosporidium, Mortierella, Mucor, Saccharomyces, Pichia, Kluyveromyces, Aspergillus, Penicillium и Dictyostelium. Особо преимущественным являются грибковые организмы вида Yarrowia lipolytica, Rhodotorula glutinis, Lipomyces starkeyi, Candida curvata, Rhodosporidium tortuloides, Mortierella isabellina, Mucor javonicus, Saccharomyces cerevisiae, Pichia pastoris, виды Kluyveromyces, виды Aspergillus, виды Penicillium или виды Dictyostelium. В особо преимущественном варианте исполнения изобретения первого аспекта данного изобретения организм представляет собой S. cerevisiae.
Во втором варианте исполнения изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что более не синтезирует стерилацильный эфир (SAE) и восковый эфир (WE). В общем, синтез WEs происходит в клетках по ферментному механизму, включающему ацил СоА-воск спиртовые ацилтрансферазы (ЕС 2.3.1.75). Таким образом, в преимущественном варианте исполнения второго аспекта данного изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что активность ацил-СоА: стерол ацилтрансферазы/стерол O-ацилтрансферазы (ЕС 2.3.1.26) и ацил СоА-воск спиртовой ацилтрансферазы (ЕС 2.3.1.75) уменьшена по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа.
Организм в соответствии с данным изобретением в связи со вторым аспектом данного изобретения накапливает в липидных частицах главным образом триацилглицерины, поскольку синтез стерилацильных эфиров и восковых эфиров уменьшен, преимущественно, полностью устранен. Такие организмы поэтому являются приемлемыми для выработки, в частности в промышленном масштабе, триацилглицеринов в чистом виде.
Организм в соответствии со вторым аспектом данного изобретения, преимущественно, получают из организма, которые природно вырабатывает восковые эфиры и хранит их внутриклеточно в липидных частицах. Организмы, вырабатывающие и сохраняющие восковые эфиры представляют собой, например, растений и насекомые, в которых их используют для обеспечения гидрофобной оболочки тканей для минимизирования дегидратации поверхностей, водорослей, планктонных организмов и бактерий.
В преимущественном варианте исполнения второго аспекта данного изобретения, организм представляет собой бактериальный организм, преимущественно рода Mycobacterium, Streptomyces, Rhodococcus, Nocardia, Bacillus, Corynebacterium, Escherichia или Lactobacillus. Наиболее преимущественно организм представляет собой Escherichia coli.
Дополнительно, не только возможно получить в таком организме в соответствии с данным изобретением триацилглицерины, которые природно получают в организме, или в количестве, в котором они природно вырабатываются в организме, но также возможно генно модифицировать такой организм для увеличения количества одного или более конкретных триацилглицеринов, природно вырабатываемых в указанном организме или генно модифицировать такой организм таким образом, чтобы привести к синтезу одного или более триацилглицеринов, которые/который не вырабатываются таким организмом.
В особо преимущественном варианте исполнения изобретения триацилглицерин, который накапливается организмом в соответствии с данным изобретением, является эфиром глицерина и как минимум одной ненасыщенной жирной кислоты и более преимущественно указанной ненасыщенной жирной кислотой является омега-3 жирная кислота. В принципе, указанная омега-3 жирная кислота может быть любой возможной омега-3 жирной кислотой, но преимущественно, является α-линоленовой кислотой (ALA), стеаридоновой кислотой, эйкозосатететраноевой кислотой, эйкозопентаноевой кислотой (ЕРА), докозопентаноевой кислотой (DPA) или докозогекасноевой кислотой (DHA).
В другом преимущественном варианте исполнения изобретения ненасыщенная жирная кислота в триацилглицерине представляет собой омега-6 жирную кислоту. В принципе, указанная омега-6 жирная кислота может быть любой возможной омега-6 жирной кислотой, но преимущественно она является линолевой кислотой, гамма-линоленовой кислотой, эйкозодеканоевой кислотой, дигомо-гамма-линоленовой кислотой, арахидоновой кислотой, докозадеканоевой кислотой, адреновой кислотой, докозапентаноевой кислотой или календовой кислотой.
В другом преимущественном варианте исполнения изобретения ненасыщенная жирная кислота в триацилглицерине является омега-9 жирной кислотой. В принципе, омега-9 жирная кислота может быть любой возможной омега-9 жирной кислотой, но преимущественно, она является олеиновой кислотой, эйкозоноевой кислотой, медовой кислотой, эруковой кислотой или ацетэруковой кислотой.
Первый и второй варианты исполнения изобретения могут быть дополнительно улучшены, как описано далее. Триацилглицерины в общем образуются путем этерификации диацилглицерола с длинноцепочечными жирными кислотами или фосфолипидами. Этерификация с длинноцепочечными жирными кислотами катализируется диацилглицерол ацилтрансферазой/диацилглицерол O-ацилтрансферазой (ЕС 2.3.1.20). Этерификация с фосфолипидами катализируется лецитин холестеринацил трансферазой/фосфолипид: диацилглицерол ацилтрансферазой (ЕС 2.3.1.158). В особо преимущественном варианте исполнения изобретения организм в соответствии с третьим или вторым аспектом данного изобретения отличается тем, что активность диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и/или активность лецитин холестеринацил трансферазы/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158) повышена в сравнении с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа. Повышение активности одного или обоих указанных выше ферментов приводит к увеличению синтеза TAGs в клетках организма.
Отдельно от этого, также возможно генно модифицировать организм таким образом, чтобы позволить организму вырабатывать определенные жирные кислоты для включения в TGAs или для повышения выработки таких жирных кислот, если они уже природно вырабатываются в таком организме для увеличения их содержания в TGAs, вырабатываемых в указанном организме. Например, если предполагается увеличить TGAs, вырабатываемые в организме, то количество омега-3 жирных кислот, таких, как эйкозопентаноевая кислота (ЕРА), докозапентаноевая кислота (DPA) и/или докозагексаноевая кислота (DHA), то будет полезным увеличить такие ферментные активности: Δ12 жирнокислотную десатуразу (ЕС 1.14.19), Δ15-десатуразу (ЕС 1.14.19), Δ6 жирнокислотную десатуразу (ЕС 1.14.19.3), жирнокислотную элонгазу, Δ5-десатуразу/Δ5-жирнокислотную десатуразу (ЕС 1.14.19) и Δ4 жирнокислотную десатуразу (ЕС 1.14.19). Таким образом, в преимущественном варианте исполнения изобретения органика отличается тем, что активность диацилглицерола ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и/или лецитин холестеринацил трансфераза/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158) и как минимум одной из активностей, выбранного из группы, состоящей из Δ12 жирнокислотной десатуразы (ЕС 1.14.19), Δ15-десатуразы (ЕС 1.14.19), Δ6 жирнокислотной десатуразы (ЕС 1.14.19.3), жирнокислотной элонгазы, Δ5-десатуразы/Δ5-жирнокислотной десатуразы (ЕС 1.14.19) и Δ4 жирнокислотной десатуразы (ЕС 1.14.19) повышено по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа. Например, растения и некоторые грибы способны к выработке омега-3 и омега-6 жирных кислот, в то время как, например, Saccharomyces cerevisiae может синтезировать только омега-9 жирные кислоты. Таким образом, если организм в соответствии с данное изобретение является Saccharomyces cerevisiae, то может быть желательным ввести в клетки такие ферментные активности, которые необходимы для выработки омега-3 и/или омега-6 жирных кислот. Подходы для введения соответствующих генов в дрожжевые клетки уже были описаны в литературе, также как и соответствующие гены (см., например, WO2004/101575). Гетерологический биосинтез конкретных жирных кислот, например, в дрожжевых клетках, например, описан в Beaudoin et al. (Proc. Natl. Acad. Sci. USA 97(2000), 6421-6426) и в Veen et al. (Appl. Microbiol. Biotechnol. 63(2004), 635-646).
Данное изобретение также относится к способу получения триацилглицерина, включающего культивирование организма в соответствии с первым или вторым аспектом данного изобретения. Как описано выше, такие организмы способны к накоплению в их липидных частицах больших количеств триацилглицеринов в основном чистом виде, TAGs могут быть выделены из организмов в соответствии со способами, хорошо известными из уровня техники. Например, из уровня техники известно, как выделить липидные частицы из клеток и каким образом выделить из них нейтральные липиды, содержащиеся в них. Пример такого способа описан для организма Saccharomyces cerevisiae в прилагающихся Примерах.
Данное изобретение также относится к способу получения триацилглицерина, который представляет собой эфир глицерина и как минимум одной ненасыщенной жирной кислоты, включающий
(i) уменьшение или устранение при помощи ингибитора активности ацил-СоА: стеролацил-трансфераза/стерол O-ацилтрансферазы (ЕС 2.3.1.26) и/или ацил СоА-воск спиртовой ацилтрансферазы (ЕС 2.3.1.75); и
(ii) повышение активности диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и/или лецитин холестеринацил трансферазы/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158)
в организме по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа. Организм культивируют и TAGs могут быть выделены.
Касательно ненасыщенной жирной кислоты(кислот) которые должны содержаться в триацилглицерине, который предполагается получить, то же самое применяется в отношении преимущественных вариантов исполнения изобретения, которые уже были описаны выше в отношении природы полиненасыщенной жирной кислоты(кислот) и ферментной активности, которая должна быть повышена. В особо преимущественном варианте исполнения изобретения, полиненасыщенная жирная кислота представляет собой омега-3 жирную кислоту и повышенная ферментная активность является как минимум одной из активностей, приведенных в данной заявке дополнительно выше в связи с омега-3 жирными кислотами.
В третьем варианте исполнения изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что более не синтезирует триацилглицерина (TAG) и стерилацильный эфир (SAE).
Как описано выше, в общем синтез TAGs происходит при помощи ферментной активности диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и лецитин холестеринацил трансферазы/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158). Таким образом, в преимущественном варианте исполнения изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что активность ацил-СоА: стерол ацилтрансферазы/стерол O-ацилтрансферазы (ЕС 2.3.1.26) диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и лецитин холестерин ацилтрансферазы/фосфолипид:диациглицерина ацилтрансферазы (ЕС 2.3.1.158) уменьшена по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа.
В преимущественном варианте исполнения изобретения организм в соответствии с третьим аспектом данного изобретения представляет собой организм, который получен из организма, который природно вырабатывает и сохраняет восковые эфиры. Такие организмы уже описаны выше. Преимущественно организм является бактериальным организмом, как уже описано выше, наиболее преимущественно, Escherichia coli. Ввиду устранения синтеза TAG и SAE, такой организм будет приемлемым для основного накопления в его липидных частицах восковых эфиров. В особо преимущественном варианте исполнения изобретения такой организм дополнительно отличается тем, что проявляет увеличение активности ацил-СоА воск спиртовой ацилтрансферазы (ЕС 2.3.1.75) по сравнению с соответствующим немодифицированным штаммом, преимущественно, соответствующим штаммом дикого типа. Это позволит увеличить количество восковых эфиров, синтезированных в организме. Средства и способы повышения активности целевого фермента в клетках организма известны специалисту в данной области и описаны в данной заявке дополнительно ниже.
В другом преимущественном варианте исполнения изобретения организм в соответствии с третьим аспектом данного изобретения получен из организма, который природно не вырабатывает и хранит восковые эфиры. Такие организмы были описаны выше в связи с первым аспектом данного изобретения. Преимущественно, такой организм является грибковым организмом, как описано выше, более преимущественно рода Saccharomyces и наиболее преимущественно вида Saccharomyces cerevisiae. Ввиду устранения синтеза TAG и SAE, липидные частицы такого организма могут быть использованы для накопления рассматриваемого липида, например, сквалена, как описано дополнительно ниже.
В четвертом варианте исполнения изобретения, организм в соответствии с данным изобретением модифицирован таким образом, что более не синтезирует восковый эфир (WE), триацилглицерин (TAG) и стерилацильный эфир (SAEs). В данном аспекте организм в основном не хранит какие-либо WEs, TAGs и SEs в его липидных частицах. Такой организм является особо полезным для разработки организмов, в липидные частицы которых могут быть направлены конкретно целевые липиды. Например, возможно ввести в такой организм молекулы нуклеиновой кислоты, позволяя синтез другого типа липида, который затем накапливается в липидных частицах. Кроме этого, могут быть обеспечены организмы, позволяющие синтез в основном чистых липидов в липидных частицах.
В преимущественном варианте исполнения изобретения, организм в соответствии с четвертым аспектом данного изобретения модифицирован таким образом, что активность ацил-СоА: стерол ацилтрансферазы/стерол O-ацилтрансферазы (ЕС 2.3.1.26) диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20), лецитин холестеринацил трансферазы/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158) и ацил СоА-воск спирт ацилтрансферазы (ЕС 2.3.1.75) уменьшена по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа.
В пятом варианте исполнения изобретения, организм в соответствии с данным изобретением представляет собой организм, который вырабатывает в клетке(ах) нейтральный липид, который накапливается в липидной частице и который является генно-модифицированным таким образом, что более не синтезирует триацилглицерин (TAG) и поэтому более не содержит указанный триацилглицерин, встречающийся в природе в его липидных частицах в указанных частицах. Как описано выше, в общем синтез TAGs происходит, например в дрожжах, при помощи ферментной активности диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и лецитин холестеринацил трансферазы/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158). Таким образом, в преимущественном варианте исполнения изобретения, организм в соответствии с пятым аспектом данного изобретения является генно-модифицированным таким образом, что активность диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) и лецитин холестерин ацилтрансферазы/фосфолипид:диацилглицерин ацилтрансферазы (ЕС 2.3.1.158) уменьшена по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа.
В преимущественном варианте исполнения пятого аспекта данного изобретения организм получен из организма, который природно не вырабатывает и хранит восковые эфиры в его липидных частицах. Такие организмы были описаны выше. Преимущественно организм является грибковым организмом, как описано выше, более преимущественно рода Saccharomyces и наиболее преимущественно вида Saccharomyces cerevisiae.
В шестом варианте исполнения изобретения, организм в соответствии с данным изобретением представляет собой организм, который вырабатывает а клетке(ах) нейтральный липид, который накапливается в липидной частице и который является генно-модифицированным, так что более и поэтому более не содержит триацилглицерины и восковые эфиры, которые природно встречаются в его липидных частицах в указанных частицах. В преимущественном варианте исполнения изобретения, организм в соответствии с шестым аспектом данного изобретения является генно-модифицированным таким образом, что активность диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20), лецитин холестеринацил трансферазы/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158) и ацил СоА-воск спиртовой ацилтрансферазы (ЕС 2.3.1.75) уменьшена по сравнению с соответствующим немодифицированным организмом, преимущественно соответствующим организмом дикого типа.
В преимущественном варианте исполнения изобретения организм в соответствии с пятым или шестым аспектом данного изобретения, т.е. организм, который более не синтезирует триацилглицерин или который более не синтезирует триацилглицерин и восковый эфир, способен к накоплению в его липидных частицах ацильного эфира стерольного липида. Накопление ацильного эфира стерольного липида в липидных частицах может быть вызвано тем фактом, что организм природно синтезирует такие эфиры или это может быть вызвано тем фактом, что гены, кодирующие соответствующие ферменты, приводящие к биосинтезу ацильных эфиров стерольных липидов, были введены в клетки.
Стерольные липиды, такие, как холестерин и его производные, являются важными компонентами мембранных липидов, наряду с глицерофосфолипидами и сфингомиелинами. Стероиды, которые также включают такую же гибридизованную четырехчленную циклическую структуру, имеют различные биологические роли в качестве гормонов и сигнальных молекул. С18 стероиды включают семейство эстрогенов, в то время как С19 стероиды включают андрогены, например, тестостерон и андростерон. С21 подкласс включает прогестогены, а также глюкокортикоиды и минералокортикоиды. Секостероиды, включающие различные формы витамина D, характеризуются расщеплением В цикла основной структуры. Другие примеры стеролов представляют собой желчные кислоты и их конъюгаты, которые у млекопитающих являются окисленными производными холестерина и синтезируются в печени.
В преимущественном варианте исполнения изобретения стерольный липид является стеролом или стероидом. Стероидом является терпеноидный липид, характеризующийся углеродным скелетом с четырьмя гибридизованными циклами, в общем расположенными 6-6-6-5 образом. Стероиды различаются по функциональным группам, присоединенным к таким циклам и степени окисления циклов. Сотни различимых стероидов найдены в растениях, животных и грибах. Все стероиды получены в клетках из стерол ланостерина (животного или грибкового) или стерол циклоартенола (растения). Оба стерола получают циклизацией тритерпенового сквалена. Стероиды включают эстроген, прогестерон и тестостерон.
Стеролы (или стероидные спирты) являются подгруппой стероидов с гидроксильной группой в 3-положении А-цикла. Они являются амфифильными липидами, синтезируемыми из ацетил-коэнзима А. Общая молекула является достаточно плоской. Гидроксильная группа на А цикле является полярной. Остаток алифатической цепи является неполярным. Стеролы растений называют фитостеролы и стеролы животных называют зоостеролы. Наиболее важными зоостеролами являются холестерин и некоторые стероидные гормоны; наиболее важными фитостеролами являются кампестерол, ситостерол и стигмастерол. Стеролы играют существенную роль в физиологии эукариотных организмов. Например, холестерин образует часть клеточной мембраны, где его присутствие влияет на текучесть клеточной мембраны и служит вторичным мессенджером в развитии сигналов. Растительные стеролы также известны как блокирующие сайты поглощения холестерина в кишечнике человека, таким образом способствуя уменьшению холестерина у людей. У людей, стеролы действуют как обеспечивающие важные сигналы и метаболические связи, например, циркадные ритмы, свертывание крови.
В преимущественном варианте исполнения изобретения стерол является холестерином, производным холестерина, 7-дегидро-холестерином, ланостерином, производным ланостерина, зимостерином, производным зимостерина, латостерином, производным латостерина, кукурбитацином, производным кукурбитацина, эпистеролом, производным эпистерола, теастероном, производным теастерона, кастастероном, производным кастастерона, тифастеролом, производным тифастерола, катастероном, производным катастерона, циклоейкаленолом, производным циклоейкаленола, ситостеролом, производным ситостерола, изофукостеролом, производным изофукостерола, фукостеролом, производным фукостерола, горгостеролом, производным горгостерола, эргостеролом, производным эргостерола, стигмастеролом или производным стигмастерола.
В частности, в организме, если накапливается ацетиловый эфир 7-дегидро-холестерина, активность HMG-CoA-редуктазы (ЕС 1.1.1.34), и/или Δ24-редуктазы, и/или ланостерин СН-деметилаза/цитохрома Р450 51 (ЕС 1.14.13.70), и/или сквален-эпоксидазы/ сквален-монооксигеназы (ЕС 1.14.99.7) может возрасти по сравнению с соответствующим организмом дикого типа. Дополнительно, активность SAM:C-24 стерол метил трансферазы, и/или С-22 стерол десатуразы и/или С-5 стерол десатуразы может быть уменьшена или устранена по сравнению с соответствующим организмом дикого типа. В организме, в котором накапливается ациловый эфир эргостерола, активность HMG-CoA-редуктазы (ЕС 1.1.1.34), и/или ланостерин СН-деметилаза/цитохрома Р450 51 (ЕС 1.14.13.70) и/или сквален-эпоксидазы/сквален-монооксигеназы (ЕС 1.14.99.7), может быть увеличена по сравнению с соответствующим организмом дикого типа. В организме, котором накапливается ациловый эфир эпистерола, активность HMG-CoA-редуктазы (ЕС 1.1.1.34), и/или ланостерин С14-деметилаза/цитохром Р450 51 (ЕС 1.14.13.70), и/или сквален-эпоксидазы/сквален-монооксигеназы (ЕС 1.14.99.7) может быть увеличена по сравнению с соответствующим организмом дикого типа и/или Δ22-десатуразу/цитохром Р450 61 (ЕС 1.14.14.1) активность может быть уменьшена по сравнению с соответствующим организмом дикого типа.
В другом преимущественном варианте исполнения изобретения стероид является андростероном, производным андростерона, тестостероном, производным тестостерона, андростендиолом, производным андростендиола, андростендионом, производным андростендиона, калустероном, производным калустерона, метандриолом, производным метандриола, боластероном, производным боластерона, эпиандростероном, производным эпиандростерона, местанолоном, производным местанолона, станолоном, производным станолона, стенболоном, производным стенболона, эпитестостероном, производным эпитестостерона, тестостероном, производным тестостерона, кортизолом, производным кортизола, альдостероном, производным альдостерона, прегненолоном, производным прегненолона, кортизоном, производным кортизона, кортикостероном, производным кортикостерона, норетиндропом, производным норетиндрона, урокортизолом или производным урокортизола.
В преимущественном варианте исполнения изобретения пятого и шестого аспекта данного изобретения организм, который способен к накоплению ацилового эфира стерольного липида, представляет собой организм, который природно обладает маршрутом биосинтеза, приводящим к синтезу соответствующего стерольного липида и в котором, более преимущественно, ферментная активность соответствующего маршрута увеличена по сравнению с соответствующим немодифицированным организмом для получения большего накопления соответствующего стерольного липида.
В преимущественном варианте исполнения изобретения, организм в соответствии с аспектами 1-6 данного изобретения способен к накоплению в его липидной частице пренольного липида. Пренольные липиды синтезируются из 5-углеродных предшественников изопентил дифосфата и диметилаллил дифосфата, которые вырабатываются главным образом через маршрут мевалоновой кислоты (MVA). Пренольные липиды охватывают изопреноиды, хиноны и гидрохиноны, полипренолы, гопаноиды и некоторые другие незначительные типы. Простые изопреноиды (линейные спирты, дифосфаты, и т.д.) образуются путем последовательного добавления звеньев С5 и классифицируются в соответствии с количеством таких терпеновых звеньев. Структуры, содержащие более 40 атомов углерода, известны как политерпены. Каротиноиды являются важными простыми изопреноидами, функционирующими как антиоксиданты и как предшественники витамина А. Другой биологически важный класс молекул представлен хинонами и гидрохинонами, содержащими изопрецоидный хвост, присоединенный к хиноновому каркасу неизопреноидного происхождения. Витамин Е и витамин K, а также убихиноны, являются примерами данного класса. Бактерии синтезируют полипренолы под названием бактопренолы), в которых концевое изопреноидное звено присоединено к кислороду, оставаясь ненасыщенным, в то время как в животных полипренолах (долихолах) концевой изопреноид восстановлен.
В преимущественном варианте исполнения изобретения пренольным липидом, который накапливается в липидных частицах, является изопреноид. Изопреноиды включают, например, С5 изопреноиды, С10 изопреноиды (монотерпены), С15 изопреноиды (секвитерпены), С20 изопреноиды (дитерпены), С25 изопреноиды (сестертерпены), С30 изопреноиды (тритерпсны), С40 изопреноиды (тетратерпены), политерпены и ретиноиды.
В особо преимущественном варианте исполнения изобретения, изопреноидом является тритерпен. Тритерпены состоят из шести изопреновых звеньев и имеют основную молекулярную формулу С30Н48-50. Данная группа охватывает, например, 3S-сквален-2,3-эпоксид, сквален, пресквален дифосфат, тетрагиманол, α-амирин, β-амирин, люпеол, люпеол ацетат, тараксастерол, азадирахтин А, неоквассин, квассин и 3-ацетил-1-тиглоилазадирахтинин. Линейный тритерпеновый сквален, основной компонент жира акульей печени, получают путем восстановительного сочетания двух молекул фарнезил пирофосфата. Сквален затем обрабатывают биосинтетически с получением ланостерина или циклоаретнола, структурных предшественников всех стероидов.
В особенно преимущественном варианте исполнения изобретения пренольный липид, который накапливается в липидных частицах, является скваленом или производным сквалена. Производное сквалена включает одну или более, в частности 1-10 или 1-4, дополнительных метильных или этильных групп на каркасных атомах углерода вместо атома(ов) водорода, связанных с каркасными атомами углерода в сквалене.
В особо преимущественном варианте исполнения изобретения организм в соответствии с данным изобретением, преимущественно в связи с первым, третьим и пятым аспектом данного изобретения, представляет собой организм который не вырабатывает и не хранит в его липидных частицах восковые эфиры, например, грибковый организм, как описано выше, и более преимущественно грибковый организм рода Saccharomyces, наиболее преимущественно Saccharomyces cerevisiae. Такой организм, который, в соответствии с первым, третьим и пятым аспектом данного изобретения, модифицирован таким образом, чтобы не синтезировать триацилглицерин и/или стерилацильный эфир, способен синтезировать и хранить в его липидных частицах пренольные липиды, в частности сквален, таким образом, позволяя выработку такого пренольного липида в липидных частицах в основном в чистом или более чистом виде. Таким образом, уже путем устранения в дрожжевом организме синтетических маршрутов биосинтеза TAGs и/или SAEs, возможно сильно улучшить выработку в отношении количества и чистоты сквалена, выработанного таким организмом.
Дополнительным улучшением при выработке сквалена в таком организме можно достичь путем модифицирования метаболизма организма таким образом, чтобы увеличить ферментную активность, приводящую к синтезу сквалена, и уменьшить ферментную активность маршрутов, превращающих сквален в другие соединения.
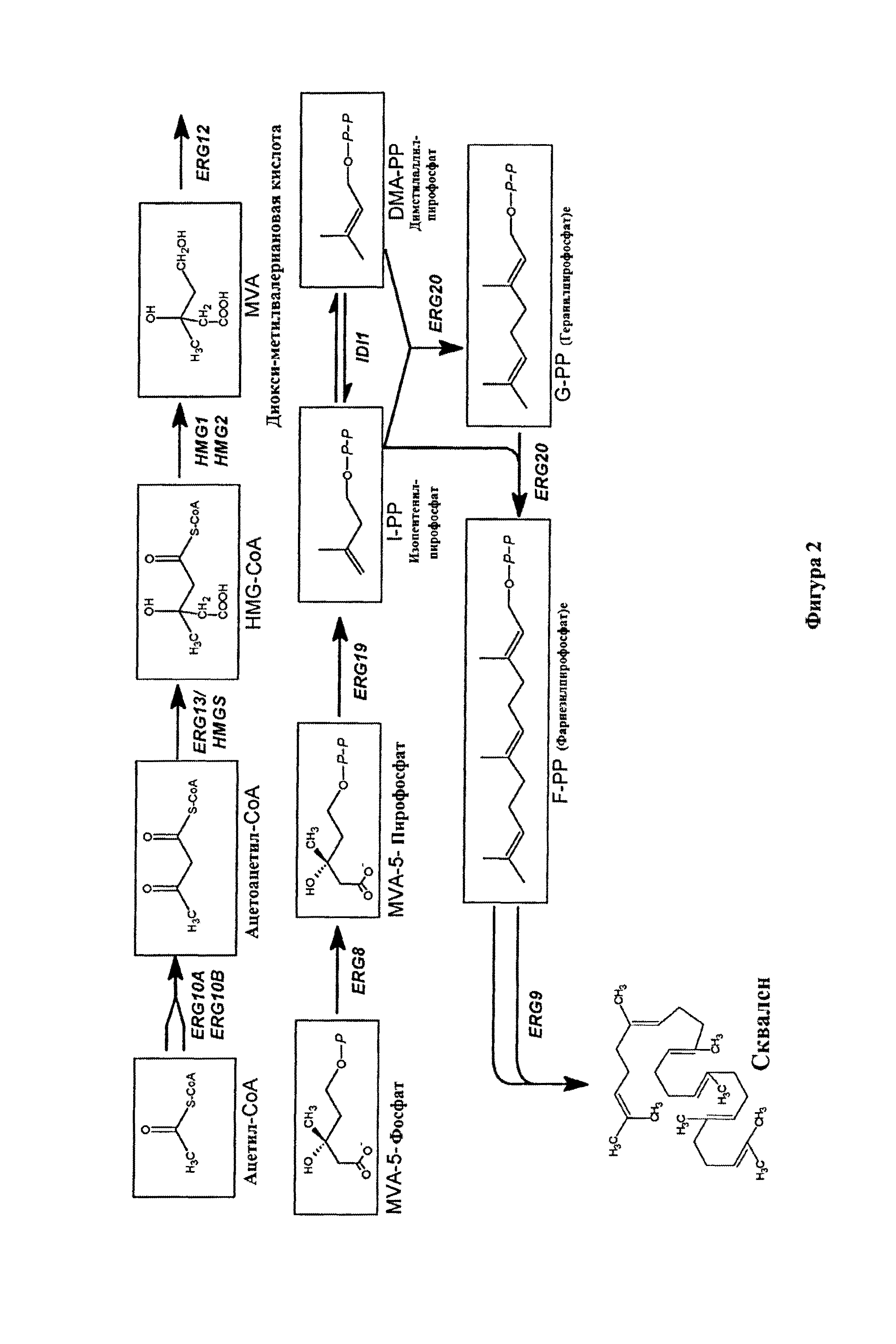
Гены скваленового биосинтетического маршрута известны и клонированы, например, в дрожжах S. cerevisiae. Основным критическим ферментом является HMG-CoA-редуктаза (HMG1) (Basson et al. (Mol. Cell. Biol. 8 (1988), 3793-3808). Таким образом, в преимущественном варианте исполнения изобретения организм в соответствии с первым, третьим или пятым аспектом данного изобретения способен к накоплению сквален в липидных частицах и отличается тем, что активность HMG-CoA-редуктазы (ЕС 1.1.1.34) повышена по сравнению с соответствующим немодифицированным организмом, преимущественно с соответствующим организмом дикого типа. Увеличение активности HMG-CoA-редуктазы может быть достигнуто при помощи средств и способов, хорошо известных специалистам в данной области, которые также описаны более подробно дополнительно ниже. В преимущественном варианте исполнения изобретения увеличение активности HMG-CoA-редуктазы достигается экспрессией в организме HMG-CoA-редуктазного гена, кодирующего только каталитическую область фермента, и не кодирующего мембранно-связанные домены. Такое изменение уже описано в ЕР-А 486290. Путем такой модификации ответная регуляция HMG-CoA-редуктазы при помощи промежуточных соединений маршрута биосинтеза эргостерола избегнута. В другом преимущественном варианте исполнения изобретения, ген, кодирующий HMG-CoA-редуктазу в организме в соответствии с данным изобретением контролируется гстерологическим промотором, т.е., промотором, чужим для HMG-CoA-редуктазного гена, в частности, данный промотор является промотором, который не регулируется по активности при помощи промежуточных соединений по биосинтетическому маршруту эргостерола. Примером приемлемого промотора является ADH1 промотор, в частности, "средний" ADH1 промотор, проявляющий приблизительно конститутивную экспрессию (Ruohonen et al., Journal of Biotechnology 39 (1995), 193-203).
В некоторых организмах, таких, как дрожжи, сквален может быть превращен в другие соединения, в частности в эргостерол и промежуточные соединения биосинтетического маршрута эргостерола. Химические реакции и маршруты приводят к образованию стерол эргостерол ((22Е)-эргоста-5,7,22-триен-3-бета-ол) происходят в спорынье, дрожжах и плесени. В таких организмах сквален превращается при помощи сквален монооксигеназы/сквален эпоксидазы (ЕС 1.14.99.7; также под названием сквален эпоксидазы или ERG1) в (S)-2,3-ерохусквален. Который затем превращается 2,3-оксидосквален-ланостерин циклазой (ЕС 5.4.99.7; ERG7) в ланостерин. Ланостерин затем превращается в цитохром Р450 ланостерин 14a-деметилаза (ЕС 1.14.13.70; ERG11) при помощи NADPH и O2 в 4,4-диметил-холеста-8,14,24-триенол. Который затем превращается при помощи С14 стерол редуктазы (ЕС 1.3.1.70; ERG24) при помощи NADPH в 4,4-диметил-8,24-холестадиенол. Данное соединение затем дополнительно превращается под действием С-4 стерол метил оксидазы (ЕС 1.14.13.72; ERG25) в 4-метил-8,24-холестадиенол. Такое вещество превращают при помощи С-3 стерол дегидрогеназы (ЕС 1.1.1.170; ERG26) в 3-кето-4-метилзимостерин. затем 3-кето-4-метилзимостерин превращается при помощи 3-кето стерол редуктазы (ЕС 1.1.1.270; ERG27) в зимостерин. Зимостерин сам по себе вместе с S-аденозил-L-метионином превращается под действием SAM:C-24 стерол метилтрансферазы (ЕС 2.1.1.41; ERG6) в фекостерол и S-аденозил-гомоцистеин. Фекостерол затем превращается под действием С-8 стерол изомеразы (ERG2) в эпистерол, который затем превращается под действием С-5 стерол десатуразы (ЕС 1.14.21.6; ERG3) при помощи NADPH и O2 в 5,7,24(28)-эргостатриенол. Данное соединение дополнительно превращается под действием С-22 стерол десатуразы (ЕС 1.14.14; ERG5) в 5,7,22,24(28)-эргостатетраенол. 5,7,22,24(28)-эргостатетраенол затем превращается под действием С-24 стерол редуктазы (ЕС 1.3.1.71; ERG4) в эргостерол. Если желательно, чтобы организм в соответствии с данным изобретением накапливал сквален в липидных частицах и если такой получен из организма, который природно способен синтезировать эргостерол или промежуточные эргостерольные маршруты из сквалена, может быть желательным уменьшить активность одного или более из указанных выше ферментных активностей маршрута, приводящего из сквалена в эргостерол в организме. В принципе, любой, более одного или все из указанных выше ферментов описанного выше эргостерольного маршрута могут быть уменьшены.
В преимущественном варианте исполнения изобретения, активность сквален монооксигеназы (ЕС 1.14.99.7; которая также имеет название сквален эпоксидазы или ERG1) уменьшена, однако, не полностью устранена, поскольку некий синтез стерола необходим для жизнеспособности дрожжевых клеток. Также возможно уменьшить активность одного или более из следующих ферментов, задействованных в биосинтезе эргостерола: SAM:C-24 стерол метил трансфераза (ЕС 2.1.1.41), С-22 стерол десатураза (ЕС 1.14.14) и С-5 стерол десатураза (ЕС 1.14.21.6). Все это применимо к любому из указанных выше вариантов исполнения изобретения данного изобретения.
Как часть данного изобретения, но независимо от природы, применяют следующие признаки относительно генно-модифицированных организмов.
В данном изобретении также было найдено, что конститутивная надэкспрессия генов SAK1 и/или НАР4 в дрожжах Saccharomyces cerevisiae приводит в сильно возросшей выработке липидов, в частности, сквалена и стерола. Гены SAK1 и НАР4 относятся к респиро-ферментативному распределению потока.
Ген SAK1 кодирует верхнюю серин/треонин киназу, отвечающую за фосфорилирование Snf1p/Snf4p комплекса. Фосфорилирование приводит к активному Snf1p/Snf4p комплексу, локализованному в ядре. Snf1p/Snf4p комплекс относится к протенисерин/треонинкиназам и играет центральную роль в ослаблении подавления глюкозы во время "диауксического сдвига". Диауксический сдвиг означает сдвиг от ферментативного к респиративному метаболизму, если глюкоза или другой ферментативный источник углерода расходуется в среде. Snf1/Snf4 комплекс находится в диапазоне в иерархии каскада, ответственного за подавление и повторную активацию глюкозы, соответственно. В ходе диауксического сдвига уровень экспрессии составляет приблизительно четверть от 6000 генов Saccharomyces cerevisiae и значительно изменяется. Такие основные изменения главным образом направлены на центральный метаболизм, который сдвигается от ферментативного режима в респираторный режим. В ферментативном режиме дрожжевая клетка метаболизирует ферментативные источники углерода, такие, как глюкоза, в этанол и карбондиоксид. В респираторном режиме выработанный этанол вдыхается с получением аденозинтрифосфата (АТФ), обеспечивающего энергию в клетке. В ходе диауксического сдвига Snf1p/Snf4p комплекс фосфорилируется и поэтому активируется Snf1-киназами Sak1p, Tos1p и Elm1p. Активированный комплекс локализирован в ядре, в котором он влияет на два транскрипционных фактора Mig1p и Cat8p. Белок цинковых пальцев Mig1p является транскрипционным репрессором, который задействует белки Tup1p и Сус8р для связывания консенсусной последовательности большого количества глюкозно-ингибированных генов в комплекс, где транскрипция гена ниже данной консенсусной последовательности ингибирована. Cat8p является активатором транскрипции и вызывает экспрессию как минимум 34 генов, при исчерпывании глюкозы в среде. Данные гены являются основными генами глиоксилатного ответвления, необходимого для метаболизации С2 соединений, таких, как этанол или ацетат. Дополнительно к этому также гены, отвечающие за внутриклеточный транспорт промежуточных соединений цикла лимонной кислоты и глиоксилатное ответвление, регулируются Cat8p. Активный Snf1p/Snf4p комплекс фосфорилирует Mig1p, где белок инактивирован и перемещен из ядра и фосфорилирует Cat8p и Sip1p, функциональный гомолог, что приводит к дезактивации данных двух белков. Активный Snf1p/Snf4p комплекс локализован в ядре и поэтому делает существенный вклад в уменьшение глюкозного ингибирования и сдвиг от ферментации к респирации, поскольку влияет на несколько факторов транскрипции в репресссорном каскаде. Соответственно, организм в соответствии с данным изобретением может быть дополнительно разработан таким образом, что проявляет более активный Snf1p/Snf4p комплекс даже в присутствии глюкозы. Данная модификация достигается транскрипционным разрегулированием белка Sak1p, который отвечает как основная киназа за фосфорилирование и поэтому за активацию Snf1p/Snf4p комплекса,
Нар2/3/4/5 белковый комплекс регулирует большое количество глюкозы подавленных генов. Это главным образом гены респираторной цепи и цикла лимонной кислоты. В качестве активатора он вызывает транскрипции этих генов во время диауксического сдвига и сильно способствует сдвигу респиро-ферментативного баланса в сторону дыхания. Гены НАР2, НАР3 и НАР5 экспрессируются конститутивно. Природно НАР4 экспрессируется только во время роста на неферментируемом источнике углерода. Во время выращивания НАР4-надэкспрессией мутантного штамм было отмечено, что эта мутация приводит к увеличению скорости роста биомассы и выработки ацетата и снижению образования глицерина и этанола. Нар2/3/4/5 белковый комплекс распространяется респираторной системой путем увеличения респираторной емкости, митохондриального биогенеза и потока углерода через цикл лимонной кислоты.
Еще одно наблюдение в данном изобретении состоит в том, что удаление гена fld1 приводит к неожиданному значительному увеличению выработки липидов, в частности выработки сквалены, в организме, таком как дрожжи, в частности дрожжи Saccharomyces CEREVISIAE. Ген кодирует белок fld1 seipin, участвующий в липидной капельной морфологии, количестве и размере. Было сообщено, что надерэкспрессия fld1 приводит к слиянию липидных частиц, что приводит к образованию значительно большего количества, но меньших частиц липидов в дрожжевой клетке. В штамме дрожжей дикого типа сквален является промежуточным соединением в биосинтезе стерол и не накапливается в клетке. Повышение активности ГМГ-КоА-редуктазы, которое достигается путем экспрессии в дрожжах ГМГ-КоА-редуктазы гена, который кодирует только каталитическую частью фермента, но не кодирует мембранную областях, как описано В ЕР-486290, приводит к накоплению сквалена в клетке. Это накопление происходит из-за отсутствия обратной связи регуляции ГМГ-КоА-редуктазы на промежуточном маршруте биосинтеза эргостерола. В рамках этого изобретения было обнаружено, что удаление гена fld1 приводит к неожиданному значительному увеличением выработки липидов, в частности выработки сквалена в штаммах дрожжей, проявляющих усиленную ГМГ-КоА-редуктазную активность.
Описанные выше открытия в отношении к SAK1, НАР4 и FLD1 приводят к дополнительным усовершенствованиям и вариантам исполнения изобретения в рамках любого из шести аспектов данного изобретения, как описано выше. Однако, данные открытия также имеют независимое значение для организма, не содержащего модификаций, описанных выше, но имеющего способность синтезировать все липиды, типично синтезируемые соответствующими немодифицированными организмами. Немодифицированные организмы в данном контексте содержат кроме дикого типа такие организмы, которые имеют повышенную HMG-CoA-редуктазную (ЕС 1.1.1.34) активность, по сравнению с соответствующим организмом дикого типа.
Соответственно, данное изобретение также включает выделенный генно-модифицированный не млекопитающий организм, в котором гены НАР4 и/или SAK1 транскрипционно нерегулированы и/или надэкспрессированы и/или где ген FLD1 подавлен или инактивирован или удален, все по сравнению с соответствующим организмом дикого типа. Конкретно, один из генов НАР4 и SAK1, или оба, могут быть помещены под контроль констутивно активного промотора, например (необязательно) ADH1 промотора В дополнительном варианте исполнения данного варианта ген REG1 подавлен или инактивирован или удален, по сравнению с соответствующим организмом дикого типа. Здесь, все предыдущие комментарии в отношении данного изобретения применимы к данному независимому аспекту аналогично и любой из ранее описанных признаков может быть включен также в данный независимый аспект.
Данное изобретение также относится к способу получения второго липида, где организм в соответствии с данным изобретением используют и культивируют, и где второй липид выделяют из организма. Например, способ в соответствии с данным изобретением для выработки пренольного липида включает культивирование организма в соответствии с третьим или четвертым аспектом данного изобретения, как описано выше, который способен к накоплению в его липидных частицах пренольного липида. В отношении пренольного липида, который должен быть накоплен, аналогично применимо для предпочтительного варианта исполнения изобретения, как было описано выше в связи с организмом в соответствии с третьим и четвертым аспектом данного изобретения. То же самое сохраняется для ферментной активности, которая снижена или повышена в соответствующем организме. В качестве другого примера, способ получения стерилацильного эфира включает культивирование организма в соответствии с пятым или шестым аспектом данного изобретения.
Уменьшение активности белка или фермента, как указано в данной заявке, выше по сравнению с соответствующим немодифицированным организмом, составляет преимущественно как минимум 50%, более преимущественно как минимум 75%, даже более преимущественно как минимум 80%, в особенности преимущественно на как минимум 90% и наиболее преимущественно 100%. Уменьшение на 100% означает отсутствие белковой или ферментной активности указанного фермента, присутствующего в данном организме. Увеличение активности фермента или белка, как указано в данной заявке выше, по сравнению с соответствующим немодифицированным организмом, составляет преимущественно как минимум 10%, более преимущественно как минимум 50%, даже более преимущественно как минимум 200%, в особенности преимущественно как минимум 1000%. Выражение "повышение" также включает присутствие (любой измеримой) ферментной активности фермента или белка в случае, когда немодифицированный организм не имеет любой измеримой такой активности. Выражение "усиление активности" дополнительно охватывает увеличение количества белка во всех таких случаях, где белок не является ферментом (например, НАР4). Затем указанные повышения применяют аналогично к количествам. Активности ферментов могут быть измерены путем добавления к предварительно определенному количеству выделенного вещества предварительно определенного количества фермента, катализирующего реакцию выделенного вещества и продукта, и необязательно дополнительно необходимых компонентов реакции, и путем измерения количества продукта, синтезированного в течение предварительно определенного периода времени. Конкретные способы измерения активности фермента, обсужденного выше, описаны, например, в документе WO 03/064650 А1. Измерение активности указанных выше ферментов, которое не описано в указанном документе, выполнено аналогичным образом.
Способы уменьшения активности данного фермента в клетке представляют собой, например, уменьшение или устранение генной экспрессии гена, кодирующего фермент, например, путем применения более слабого промотора вверху соответствующего гена или путем полной или частичной делеции гена и/или родственного промотора, и/или добавлением ферментного ингибитора для ингибирования транслированного фермента в клеточном организме и/или включением siPHK в клетки для уменьшения количества активного транскрипта и/или мутации гена с получением менее активного варианта.
Уменьшение генной экспрессии означает, что уровень генной экспрессии нуклеотидной последовательности, кодирующей соответствующий фермент, уменьшен по сравнению с уровнем генной экспрессии указанной нуклеотидной последовательности в соответствующем немодифицированном организме, преимущественно соответствующем организме дикого типа. Те же уровни уменьшения, что представлены выше, применимы к активностям. Средства и способы детекции уровня генной экспрессии включают, например, определение количества синтезированной соответствующей иРНК или белка или определение ферментной активности соответствующего белка. В преимущественном варианте исполнения изобретения уровень генной экспрессии определяют путем измерения количества иРНК, например, в Норзерн-блоттинге. В другом преимущественном варианте исполнения изобретения уровень генной экспрессии определяют путем измерения количества синтезированного соответствующего белка, например, в Вестерн-блоттинге, или путем определения количества соответствующей ферментной активности. Уменьшение генной экспрессии может быть также достигнуто путем придания рассматриваемому гену не функциональности. Одним возможным средством придания генной не функциональности является разрушение гена.
Способы повышения активности фермента включают трансформацию клеток таким образом, что достигается транскрипционное разрегулирование, таким образом, что ген (гетерологический или гомологический), кодирующий фермент, расположен под контролем конститутивно активного (гетерологического или гомологического) промотора, и/или таким образом, что количество копий (гетерологического или гомологического) гена, кодирующего фермент, повышено и/или повышение активности путем мутации.
Конкретные примеры влияния на повышенную или пониженную ферментную активность приведены в примерах. Специалист в данной области, однако, также сможет применить другие способы, хорошо известные из уровня техники, без необходимости в конкретном описании в данной заявке.
Приемлемые генные последовательности для ферментов, задействованные в данном изобретении, описаны далее, но другие генные последовательности, имеющие такую же ферментную активность, могут быть также задействованы. Не конкретные генные последовательности или белковые последовательности, кодированные таким образом, являются релевантными структурными признаками в данном изобретении, но вместо этого классификация под теми же ЕС (Enzyme Commision) номерами.
Генные последовательности для ацил-СоА:стерол ацилтрансферазы/стерол O-ацилтрансферазы (ЕС 2.3.1.26) включают: NC_001135.4, NC_001147.6, NM_005891, NM_144784, NM_153728.
Генные последовательности для диацилглицерол ацилтрансферазы/диацилглицерол O-ацилтрансферазы (ЕС 2.3.1.20) включают: NC_001147.5, ХМ_002478787, NM_123089, ХМ_002378082, NM_032564, NM_001012345, NM_010046, ХМ_002146497.
Генные последовательности для лецитин холестеринацил трансфераза/фосфолипид: диацилглицерол ацилтрансферазы (ЕС 2.3.1.158) включают: NC_001147.6, NM_008490, NM_001162568, NM_000229, NM_001005715, NM_017024, NM_001082190.
Генные последовательности для ацил СоА-воск спирт ацилтрансферазы (ЕС 2.3.1.75) включают: NM_123089, NM_177448.
Генные последовательности для HMG-CoOA-редуктаз включают: NC_001145, NM_106299, NC_003421.2, NC_009784.1, NC_003028.3, NC_007308.3, и последовательность, приведенную на Фиг.5 (усеченная, tHMG1).
Генные последовательности для С-24 стерол метил трансфераз включают: NC_001145, NC_000911.1, NC_003423.3, ХМ_505173, ХМ_716615.
Генные последовательности для С-22 стерол десатуразы включают: NC_003424.3, NC_009046.1, NC_001145.2, XM_500188, ХМ_711840.
Генные последовательности для С-5 стерол десатуразы включают: NC_001144, S46162, NG_009446, NM_053642, NM_001035356, XM_503090, XM_708519.
Генные последовательности для НАР4 включают: NC_001143.7, XM_448596, ХМ_001645329.
Генные последовательности для SAK1 включают: NC_001137.2, XM_502591, ХМ_448319, ХМ_453478, NM_208704.
Генные последовательности для REG1 включают: NC_001136.8, XM_500990, ХМ_448729, ХМ_455276.
Генные последовательности для FLD1 включают: NC_001144.4, NM_210286, ХМ_001647166, ХМ_449778.
Генные последовательности для 7-дегидрохолестерин редуктазы включают: NM_103926, NM_001360, NM_007856, NM_203904, NM_001014927, NM_201330, NM_022389, NM_001131727, NM_001087087, XM_001497598, XM_001174160, XM_001099101, BM490402, CA753545.
Генные последовательности для 24-дегидрохолестерин редуктазы включают: NM_014762, NM_001016800, NM_001094456, NM_001008645, NM_001103276, NM_001080148, NM_053272, NM_00103128, XM_001488247, AB125202, XM_001153751.
Генные последовательности для ланостерин стерол 14-деметилазы включают: NC_001140.5, ХМ_500518. EF059165, ХМ_445876, ХМ_454109.
Генные последовательности для сквален монооксигеназ включают: NC_001139.8, М64994, ХМ_503994, ХМ_706801, ХМ_455763
Генные последовательности для приемлемых промоторов (промоторы соответствующих различных ферментов, экспрессированных гетерологически, могут быть одинаковыми или различными) включают: NC_001142, NC_001139, NC_001147, NC_001139, NC_001148, NC_001135, NC_001136.
В общем организм в соответствии с данным изобретением (независимо от того, в каком из аспектов он был описан выше) может быть любым возможным нечеловеческим преимущественно не млекопитающим организмом. Примеры приемлемых организмов представлены в формуле изобретения.
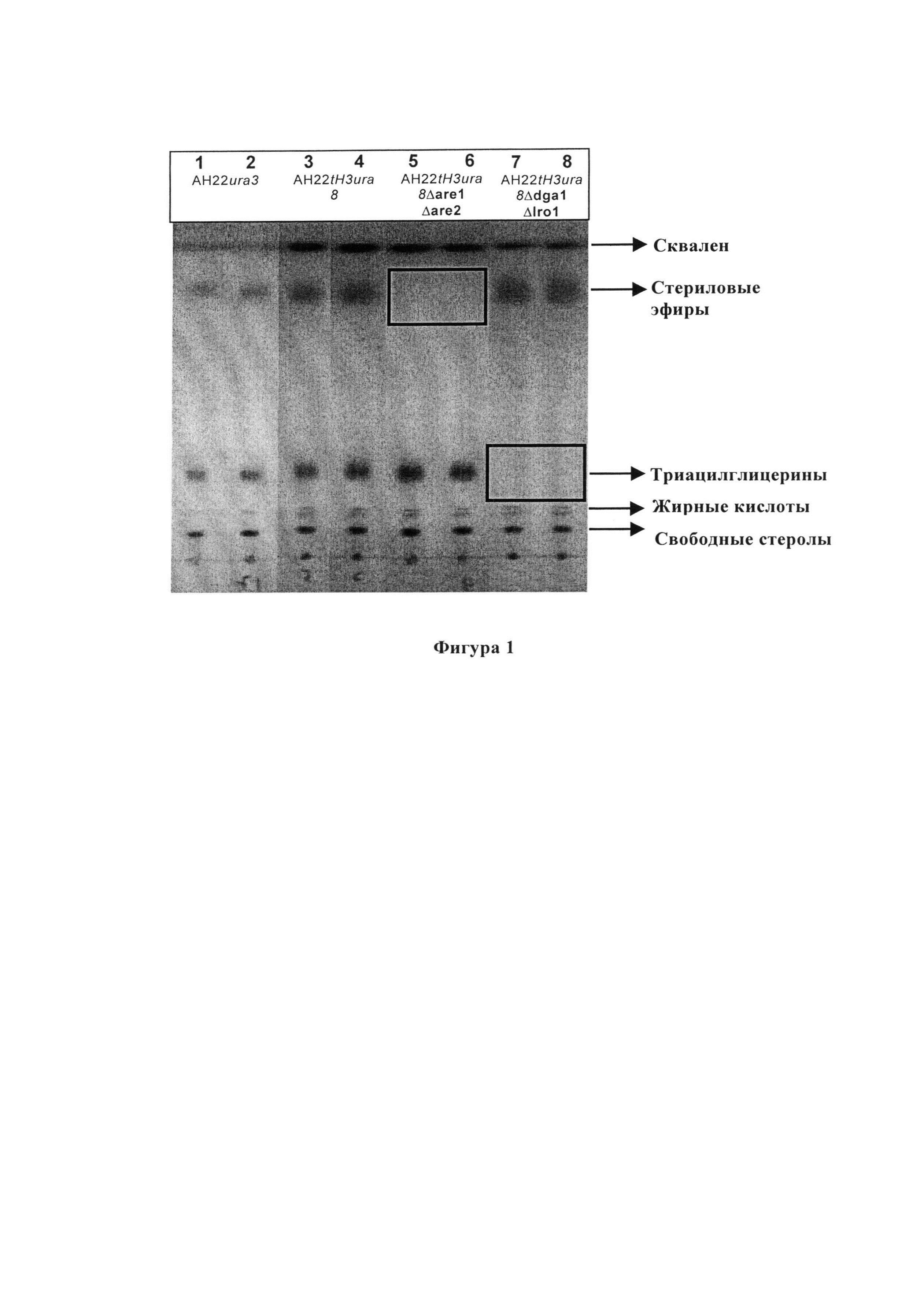
Фигура 1 Тонкослойная хроматография цельного липидного экстракта из сконструированных мутантных штаммов дрожжей Saccharomyces cerevisiae
Фигура 2 схематически демонстрирует биосинтез сквалена в дрожжах Saccharomyces cerevisiae.
Фигура 3 схематически демонстрирует биосинтез триацилглицеринов в дрожжах Saccharomyces cerevisiae.
Фигура 4 схематически демонстрирует биосинтез стерилацильных эфиров в дрожжах Saccharomyces cerevisiae.
Фигура 5 демонстрирует последовательность усеченной HMG СоА-редуктазы, tHMG1.
Следующие Примеры приведены только для иллюстрации данного изобретения.
Следующие материалы и способы были применены в примерах.
1. Рестрикционные расщепления
Рестрикцию плазмид (1-10 мкг) выполняли в 30 мкл партиях. Для этого, ДНК поглощали в 24 мкл Н2О, и смешивали с 3 мкл соответствующего буфера, 1 мкл АБС (альбумина бычьей сыворотки) и 2 мкл фермента. Концентрация фермента составляла 1 единица/мкл или 5 единиц/мкл в зависимости от количества ДНК. В некоторых случаях, добавляли еще 1 мкл РНКазы к партии для разложения tPHK. Реакционную партию инкубировали в течение двух часов при 37°С. Рестрикцию контролировали минигелем.
2. Гель-электрофорез
Гель-электрофорез проводили в минигелевом или широком минигелевом оборудовании. Минигели (приблизительно 20 мл, 8 пакетов) и широкие мипигели (50 мл, 15 или 30 пакетов) состояли из 1% агарозы в ТАЕ. 1*ТАЕ использовали в качестве подвижного буфера. Пробы (10 мкл) смешивали с 3 мкл стоп-раствора и наносили. 1-ДНК срез с HindIII использовали в качестве стандарта (полосы при: 23.1 kb; 9.4 kb; 6.6 kb; 4.4 kb; 2.3 kb; 2.0 kb; 0.6 kb). Для разделения, применяли напряжение 80 В в течение 45-60 минут. Затем гель окрашивали в растворе бромистого этидия и выдерживали в УФ излучении с системой видеодокументации INTAS или фотографировали с оранжевым фильтром.
3. Гель-элюирование
Желаемые фрагменты были выделены гель-элюированием. Рестрикционный препарат применялся в нескольких пакетах минигеля и был разделен. Только [лямбда]-HindIII и "следы умерщвления" были окрашены в растворе бромистого этидия, рассматриваемого под ультрафиолетовым светом, и нужный фрагмент был помечен. В результате, было предотвращено повреждения ДНК остаточных пакетов бромистым этидием и ультрафиолетовым излучением. Путем выравнивания окрашенных и неокрашенных частей геля, желательный фрагмент из неокрашенных кусков геля может быть вырезан на основании маркировки. Часть агарозы с фрагментом для выделения была добавлена в диализную пробирку, запечатанную без пузырьков воздуха с небольшим буфером ТАЕ и помещена в BioRad-минигель аппарата. Подвижный буфер состоял из 1*ТАЕ, а напряжение составляло 100 В в течение 40 минут. Затем полярность потока изменялась в течение 2 минут, чтобы ослабить ДНК адгезию к диализной пробирке. Буфер, который содержит фрагменты ДНК диализной пробирки, был перенесен в реактор, и таким образом производится осаждение этанола. С этой целью фракцию (1/10) объемом 3 М ацетата натрия, тРНК (1 мкл на 50 мкл раствора) и в 2,5 раза объем ледяного 96% этанола, были добавлены в раствор ДНК. Партия была инкубирована в течение 30 минут при температуре -20°С., а затем центрифугирована при 12000 об/мин в течение 30 минут при 4°С. ДНК осадок сушили и растворяли в 10 до 50 мкл Н2О (в зависимости от количества ДНК).
4. Обработка Klenow
Выступающие концы фрагментов ДНК получали путем обработки Klenow, так что получаются "тупые концы". На 1 мкг ДНК, следующая партия была отобрана пипеткой вместе. В этом случае ДНК должны быть получены путем осаждения этанола для предотвращения загрязнения от ингибирования Klenow полимеразы. Инкубация проводилась в течение 30 минут при 37°С, а затем в течение еще 5 минут при 70°С. Реакция была остановлена. ДНК была получена из партии путем осаждения этанола и растворена в 10 мкл Н2О.
5. Сшивание
ДНК фрагменты, которые подлежали сшиванию, были соединены. Конечный объем 13,1 мкл содержал приблизительно 0,5 мкг ДНК с соотношением вектор-инсерция 1:5. Пробу инкубировали в течение 45 секунд при 70°С, охлаждали до комнатной температуры (приблизительно 3 минуты) и инкубировали во льду в течение 10 минут. Затем добавляли буферы сшивки: 2,6 мкл 500 ммоль TrisHCl, рН 7,5, и 1,3 мкл 100 ммоль MgCl2, и их инкубировали во льду еще 10 минут. После добавления 1 мкл 500 ммоль DTT и 1 мкл 10 ммоль АТР, добавляли 1 мкл лигазы (1 единица/мкл) во льду в течение еще 10 минут. Вся обработка должна быть произведена при небольшом встряхивании, настолько возможным, чтобы предотвратить прилегающие концы ДНК от повторного разделения. Сшивание проводили всю ночь при 14°С.
6. Е. coli трансформация
Клетки компонента Escherichia coli (E. coli) NM522 трансформировали ДНК препарата сшивки. В качестве позитивного контроля, партию снабдили 50 нг pScL3 плазмид, и в качестве нулевого контроля, партию не снабжали ДНК. Для каждого трансформирующего препарата, 100 мкл 8% ПЭГ раствора, 10 мкл ДНК 200 мкл компетентных клеток (E. coli NM522) отбирали пипеткой в настольную центрифугирующую пробирку. Партии помещали на лед в течение 30 минут и встряхивали периодически. Затем имел место термический шок: 1 минута при 42°С. для регенерации, 1 мл LB-среды добавляли в клетки и инкубировали во встряхивателе в течение 90 минут при 37°С. 100 мкл каждой неразбавленной партии, разведение 1:10 и 1:100 разведение выравнивали на LB+ампициллин планшетах и инкубировали всю ночь при 37°С.
7. Выделение плазмиды из Е. coli (Miniprep)
Е. coli колонии культивировали всю ночь в 1.5 мл LB+ампициллин среде в настольных центрифугирующих пробирках при 37°С и 120 об/мин. На следующий день. Клетки центрифугировали в течение 5 минут при 5000 об/мин и 4°С, и осадок растворяли в 50 мкл ТЕ-буфера. Каждую партию смешивали с 100 мкл 0,2N NaoH, 1% SDS раствором, смешивали и помещали на лед в течение 5 минут (лизис клеток). Затем, добавляли 400 мкл Na-ацетата/NaCl раствором (230 мкл Н2О, 130 мкл 3 М ацетата натрия, и 40 мкл 5 М NaCl), партию смешивали и помещали на лед еще на 15 минут (преципитация белка). Через 15 минут центрифугирования при 11,000 об/мин, супернатант, который содержит плазмид-ДНК, переносили в сосуды Оппендорфа. Если супернатант не был полностью прозрачным, его центрифугировали еще раз. Супернатант смешивали с 360 мкл ледяного изопропанола и инкубировали в течение 30 минут при -20°С (преципитация ДНК). ДНК центрифугировали (15 минут, 12,000 об/мин, 4°С), супернатант отбрасывали, осадок промывали в 100 мкл ледяного 96% этанола, инкубировали в течение 15 минут при -20°С и снова центрифугировали (15 минут, 12,000 об/мин, 4°С). Осадок высушивали в высоком вакууме и растворяли 100 мкл Н2О. Плазмиды-ДНК характеризовали при помощи анализа рестрикции. Для этого, 10 мкл каждой партии подвергали рестрикции и расщепляли при помощи гель-электрофореза в широком минигеле (см. выше).
8. Выделение плазмиды на Е. coli (Maxiprep)
Для выделения больших количеств плазмид-ДНК, выполняли способ maxiprep. Два плунжера с 100 мл LB+ампициллиновой среды инокулировали с колонией или с 100 мкл замороженной культуры, которая переносит плазмид, подлежащий выделению, и инкубировали всю ночь при 37°С и 120 об/мин. На следующий день (200 мл) переносили в GSA стакан и центрифугировали в течение 10 минут при 4000 об/мин (2600*g). Клеточный остаток повторно суспендировали в 6 в ТЕ-буфере. Для дигестирования клеточной стенки, добавляли 1,2 мл лизоцимного раствора (20 мг/мл ТЕ-буфера) и инкубировали в течение 10 минут при комнатной температуре. Затем проводили клеточный лизис с 12 мл 0,2N NaOH, 1% SDS раствором и еще 5 минут инкубации при комнатной температуре. Белки осаждали путем добавления 9 мл охлажденного 3 М раствора ацетата натрия (рН 4,8) и 15-минутной инкубации во льду. После центрифугирования (GSA: 13,000 об/мин (27,500*g), 20 минут, 4°С), супернатант, содержавший ДНК, переносили в новый GSA стакан и ДНК осаждали с 15 мл ледяного изопропанола и инкубации в течение 30 минут при -20°С. Остаток ДНК промывали в 5 мл ледяного этанола и высушивали на воздухе (приблизительно 30-60 минут). Затем его повторно суспендировали в 1 мл Н2О. Проводили исследование плазмиды путем рестрикционного анализа. Концентрацию определяли путем осаждения разведении на минигеле. Для уменьшения содержания соли, проводили 30-60 минутный микродиализ (размер пор 0.025 мкм).
9. Трансформация дрожжей
Для трансформации дрожжей, получали прекультуру штамма Saccharomyces cerevisiae (S. cerevisiae) AH22. Плунжер с 20 мл YE-среды инокулировали со 100 мкл замороженной культуры и инкубировали всю ночь при 28°С и 120 об/мин. Основное культивирование проводили в аналогичных условиях в плунжере со 100 мл YE-среды, которую затем инокулировали с 10 мкл, 20 мкл или 50 мкл пре культуры.
9.1 Выработка компетентных клеток
На следующий день, поршни были подсчитаны с помощью камеры Thoma, и процедура была продолжена с поршнем, который содержал 3-5* 07 клеток/мл. Клетки собирали центрифугированием (GSA: 5000 об/мин (4000*g), 10 мин). Осадок клеток повторно суспендировали в 10 мл ТЕ-буфера и разделяли на две настольные центрифугирующие пробирки (5 мл). Клетки центрифугировали в течение 3 минут при 6000 об/мин и дважды промывали 5 мл ТЕ-буфером каждый. Затем осадок клеток был растворен в 330 мкл буфера ацетата лития на 109 клеток, перенесен в стерильную 50 мл колбу Эрленмейера и его встряхивали в течение одного часа при 28°С. В результате, клетки были компетентными для трансформации.
9.2 Трансформация
Для каждого препарата трансформации, 15 мкл ДНК спермы селедки (10 мг/мл), 10 мкл ДНК для трансформации (приблизительно 0,5 мкг) и 330 мкл компетентных клеток отбирали пипеткой в настольную центрифугирующую пробирку и инкубировали в течение 30 минут при 28°С (без встряхивания!). Затем, добавляли 700 мкл 50% ПЭГ 6000 и инкубировали еще один час при 28°С, без встряхивания. Затем применяли термический шок в течение 5 минут при 42°С. 100 мкл суспензии высевали на планшет с селективной средой (YNB, Difco) для обора лейциновой прототрофии. В случае отбора G418 резистентности. Проводили регенерацию клеток после термического шока (см. раздел 9.3 Фаза регенерации).
9.3 Фаза регенерации
Поскольку селективный маркер резистентен к G418, клеткам нужно время для экспрессии резистентного гена. Препараты трансформации смешивали с 4 мл YE-среды и инкубировали всю ночь при 28°С во встряхивателе (120 об/мин). На следующий день, клетки центрифугировали (6,000 об/мин, 3 минут), растворяли в 1 мл YE-среды и 100 мкл или 200 мкл выравнивали на YE+G418 планшетах. Планшеты инкубировали в течение нескольких дней при 28°С.
10. Условия ПЦР реакции
Условия реакции для полимеразной цепной реакции должны быть оптимизированы для отдельных случаев и не обязательно быть валидными для любой партии. Таким образом, среди прочего, количество использованной ДНК, концентрации солей и температура плавления могут различаться. Для формулировки нашей проблемы, было доказано преимущество соединения следующих веществ в колпачке-Оппендорфе, что было приемлемым для применения в термоустройстве для циклирования: 5 мкл супер буфера, 8 мкл dNTP’s (0,625 мкМ каждый), 5’-праймер, 3’-праймер и 0,2 мкг матриксной ДНК растворяли в достаточном количестве воды с получением общего объема ПЦР препарата, добавляли в 2 мкл (-0,1 U) Super Taq полимеразы. Партию быстро центрифугировали и покрывали каплей масла. Для амплификации отбирали от 37 до 40 циклов.
11. Выделение лнпидных частиц из S. cerevisiae
Дрожжевые клетки выращивали в 50 мл WMVIII минимальной среды в течение 72 часов при 28°С со взаимным встряхиванием при 250 об/мин. Клетки собирали путем центрифугирования и липидные частицы выделяли и очищали в соответствии с Leber et al. (Leber R, Zinser E, Zellnig G, Paltauf F, Daum G. Characterization of lipid particles of the yeast, Saccharomyces cerevisiae. Yeast. 1994 Nov; 10(11):1421-1428). Для анализа стерола липидные частицы омыляли в течение 16 часов при 30% метанольном KOH при комнатной температуре для количественного определения общего стерола при помощи ГХ или стеролы непосредственно экстрагировали хлороформом/метанолом (4:1) и анализировали при помощи ТСХ для различения свободных и этерифицированных стеролов или при помощи ГХ для количественного определения свободных стеролов.
12. Анализ сквалена и стерола
Для количественного определения цельных клеточных липидов и общих липидов в липидных частицах, пробы омыляли перед ГХ анализом. 125 OD600 of клетки обрабатывали в течение 20 минут при 100°С в 0,5 N НСl и оставляли охлаждаться до комнатной температуры. Затем добавляли 3 г KОН и 12,5 мл метанола с пирогаллолом (2 г/л). Для омыления смесь инкубировали в течение 2 часов при 70°С на водяной бане. Гидролизованные эфиры экстрагировали н-гексаном. Неомыленную фракцию повторно суспендировали в 2 мл н-гексана. Сквален и стеролы количественно определяли при помощи ГХ со скваленом и холестерином в качестве внутренних стандартов. Сквален и стеролы разделяли на газовом хроматографе Hewlett-Packard 5890 с капиллярной колонкой (25 м на 0,25 мм при 0,25 мкм [толщина пленки]; Chrompack CPSU5) запрограммированной от 150 до 250°С. Температура сначала составляла 150°С в течение 2 минут; ее затем повышали при 15°С/мин до конечной температуры 250°С, при которой ее поддерживали в течение 20 мин. Линейная скорость составляла 30 см/с. Гелий использовали в качестве газа-носителя и впрыскивания проводили в режиме без разделения. Объем впрыскиваний составлял 1 мкл. Площадь каждого пика рассчитывали и относили к одному грамму сухой массы клетки. Каждую пробу измеряли дважды. Стандарты эргостерола и сквалена использовали для идентификации.
Нейтральные липиды экстрагировали и определяли количественно способом согласно Sorger and Daum (J. Bacteriol. 184 (2002), 519-524). Подробно, для количественного определения нейтральных липидов, экстракты наносили на силикагелевые 60 планшеты и регистрировали хроматограммы с использованием системы растворителей - петролейный эфир-диэтиловый эфир-уксусная кислота (25:25:1, об/об/об) для первой трети расстояния. Затем планшеты быстро сушили и дополнительно размещали в верхней части планшеты при помощи растворителей - петролейный эфир-диэтиловый эфир (49:1, об/об). Нейтральные липиды визуализировали путем окрашивания тонкослойных пластин парами йода в ТСХ-камере. Количественное определение проводили при помощи денситометрического сканирования.
Стандартная процедура культивирования штаммов дрожжей Saccharomyces cerevisiae для анализа сквалена и стерола.
Прекультура: 20 мл WMVIII среды в 100 мл колбе для встряхивания инокулировали с 20 мкл соответствующего глицеринового маточного раствора и культивировали в течение 48 часов при 30°С и 150 об/мин.
Основная культура: 50 мл WMVIII среды в 250 мл колбе для встряхивания с отражателями инокулировали с 1% прекультуры и культивировали в течение 72 часов при 30°С и 150 об/мин.
Пример 1
Деления генов ARE1 и ARE2 в S. cerevisiae AH22ura3
Вектор pUG6 (Guldener U, Heck S, Fiedler T, Beinhauer JD and Hegemann JH (1996). A new efficient gene disruption cassette for repeated use in budding yeast. Nucleic Acids Res 24 2519-24) использовали для делении генов ARE1 и ARE2.
Делецию производили последовательно тем же способом. Сначала ARE1, а затем ARE2 подвергали делеции. После получения плазмиду, фрагмент pUG6 амплифицировали посредством ПЦР с получением инструмента, состоящего из loxP-kanMX-loxP. Праймеры конструировали для гибридизации 5’ и 3’ последовательностей ARE1 соотв. ARE2 кодирующих последовательностей в lохР регионы pUG6 вектора.
Полученный в результате ПЦР продукт состоит из KanR гена, lохР сайтов и ARE1 соотв. ARE2 гомологичных регионов для интеграционной трансформации в S. cerevisiae AH22ura3. Гетерологическая рекомбинация в дрожжах приводит к делеции целевой последовательности.
Резистентность к G418 была использована для выбора позитивных клонов ARE1 соотв. ARE2 кодирующая область была удалена в этом штамме дрожжей. Для получения штамма для удаления дополнительных генов, резистентность G418 была удалена из штамма. С этой целью штамм был трансформирован в pSH47 (Guldner et al., 1996). Вектор имеет кре-рекомбиназу, чтобы избавиться от гена KanR в окружении сайтов lохР.
Для расположения pSH47 штамм был снова отобран на 5-FOA (5-фтороротовая кислота) (1 г/л) агаровых пластинах. Полученный в результате штамм имеет делецию обоих генов ARE1 и ARE2.
Пример 2
Делеция генов DGA1 и LRO1 в S. cerevisiae AH22ura3
Вектор pUG6 (Guldner et al.,1996) использовали для делеции генов DGA1 и LRO1.
Делецию обоих генов производили последовательно тем же способом. Сначала подвергали делеции DGA1, а затем LRO1. После получения плазмиды, фрагмент pUG6 амплифицировали при помощи ПЦР с получением инструмента, состоящего из loxP-kanMX-loxP. Праймеры конструировали для гибридизации 5’ и 3’ последовательностей DGA1 соотв. LRO1 кодирующих последовательностей в lохР области pUG6 вектора.
Полученный в результате ПЦР продукт состоит из KanR гена, lохР сайтов и DGA1 соотв. LRO1 гомологичных регионов для интеграционной трансформации в S. cerevisiae AH22ura3. Гетерологическая рекомбинация в дрожжах приводит к делеции целевой последовательности.
Резистентность к G418 была использована для выбора позитивных клонов DGA1 соотв. LRO1 кодирующая область была удалена в этом штамме дрожжей. Для получения штамма для удаления дополнительных генов, резистентность G418 была удалена из штамма. С этой целью штамм был трансформирован в pSH47 (Guldner et al., 1996). Вектор имеет кре-рекомбиназу, чтобы избавиться от гена KanR в окружении сайтов lохР.
Для расположения pSH47 штамм был снова отобран на 5-FOA (5-фтороротовая кислота) (1 г/л) агаровых пластинах. Полученный в результате штамм несет делецию обоих генов DGA1 и LRO1.
Пример 3
Деления генов DGA1 и LRO1 в S. cerevisiae AH22ura3are1are2
Вектор pUG6 (Guldner et al., 1996) использовали для делеции генов DGA1 и LRO1.
Делению обоих генов производили последовательно тем же способом. Сначала подвергали делеции DGA1, а затем LRO1. После получения плазмиды, фрагмент pUG6 амплифицировали при помощи ПЦР с получением инструмента, состоящего из loxP-kanMX-loxP. Праймеры конструировали для гибридизации 5’ и 3’ последовательностей DGA1 соотв. LRO1 кодирующих последовательностей в lохР области pUG6 вектора.
Полученный в результате ПЦР продукт состоит из KanR гена, lохР сайтов и DGA1 соотв. LRO1 гомологичных регионов для интеграционной трансформации в S. cerevisiae AH22ura3. Гетерологическая рекомбинация в дрожжах приводит к делеции целевой последовательности.
Резистентность к G418 была использована для выбора позитивных клонов DGA1 соотв. LRO1 кодирующая область была удалена в этом штамме дрожжей. Для получения штамма для удаления дополнительных генов, резистентность G418 была удалена из штамма. С этой целью штамм был трансформирован в pSH47 (Guldner et al., 1996). Вектор имеет кре-рекомбиназу, чтобы избавиться от гена KanR в окружении сайтов lохР.
Для расположения pSH47 штамм был снова отобран на 5-FOA (5-фтороротовая кислота) (1 г/л) агаровых пластинах.
Полученный в результате штамм несет квадрупольную делецию генов ARE1, ARE2, DGA1 и LRO1.
Пример 4
Экспрессия t-HMG1 в штаммах дрожжей, полученных в примерах 1-3 и AH22ura3 в качестве реперных штаммов с использованием эписомальной плазмиды
ДНК последовательность для tHMG (Basson et al. (Mol. Cell. Biol. 8 (1988), 3793-3808)) амплифицировали посредством ПЦР из геномной ДНК Saccharomyces cerevisiae S288C. (Mortimer and Johnston (Genetics 113 (1986), 35-43)) при помощи стандартных способов. Праймеры, использованные в данном случае, представляли собой ДНК олигомер tHMG-5’ и tHMG-3’. Полученный ДНК-фрагмент вводили в вектор клонирования pUC19 (Yanisch-Perron et al. (1985): Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors. In: Gene. Bd. 33, S. 103-119) после Klenow обработки и получали вектор pUC19-tHMG. После выделения плазмиду и рестрикции pUC 19-tHMG эндонуклеазами EcoR1 и BamH1, полученный фрагмент вводили в вектор экспрессии дрожжей pPT2b (Lang and Looman (Appl. Microbiol. Biotechnol. 44 (1995), 147-156)), который также обрабатывали EcoR1 и BamH1. Плазмиду pPT2b-tHMG, которая была произведен, содержала усеченный ADH1-промотор (Bennetzen and Hall (Yeast 7 (1982), 475-477)) и TRP1-терминатор (Tschumper G, Carbon J. Sequence of a yeast DNA fragment containing a chromosomal replicator and the TRP1 gene. Gene. 1980 Jul; 10(2):157-166), между которыми был найден tHMG-ДНК фрагмент. Участок ДНК выделяли из вектора pPT2b-tHMG при помощи эндонуклеаз EcoRV и Nru1, и указанный участок ДНК содержит так называемый среднецепочечный ADH1-промотор, tHMG ген и TRP1-терминатор. Данный ДНК участок вводили в дрожжевой вектор YEp13 (Fischhoff et al. (Gene 27 (1984), 239-251)), который обрабатывали эндонуклеазой Sph1 и ДНК полимеразой.
YEpH2 трансформировали в S. cerevisiae AH22URA3are1are2, AH22URA3dga1lro1, AH22URA3are1are2dga1lro1 и AH22URA3. В качестве реперной плазмиды использовали YEp13.
Пример 5
Хромосомальная интеграция и надэкспрессия t-HMG1 в штаммах дрожжей, полученных в примерах 1-3 и AH22ura3 в качестве репсрных штаммов, используя хромосомальную интегративную плазмиду YDpUHK3
Вектор YEpH2 обрабатывали эндонуклеазой EcoRV и Nru1. Затем получали ДНК-фрагмент со следующими областями таким образом: транскрипции, активирующие области от гена резистентности к тетрациклину (Sidhu and Bollon (10 (1990) 157-166)), ADH1-промотор средней длины, tHMG и TRP1-терминатор (кассет экспресии). Этот ДНК-фрагмент был введен в вектор YDpU (Berben et al. 1991 Berben G., Dumont J., Gilliquet V, Bolle P-A. und Hilger F. (1991): "The YDp plasmids: a uniform set of vectors bearing versatile gene disruption cassettes for Saccharomyces cerevisiae". Yeast 7, 475-477), который был обработан Stu1. Вектор YDpUH2/12, произведенный таким образом, обрабатывали эндонуклеазой Sma1 и сшивали с ДНК-последовательностью, которая кодирует резистентность к канамицину (Webster, Т. D., Dickson, R. С. (1983) Direct selection of Saccharomyces cerevisiae resistant to the antiobiotic G418 following transformation with a DNA vector carrying the kanamycin-resistance gene of Tn903. Gene 26:243-252). Конструкт, который продуцируется (YDpUHK3) обрабатывали EcoRV. Штамм дрожжей Saccharomyces cerevisiae AH22 трансформировали с данным конструктом. Трансформация дрожжей с линеаризованным вектором, как в данном примере, приводит к хромосомной интеграции всего вектора в URA3 генный локус. Чтобы исключить области из интегрированного вектора, которые не являются частью кассеты экспресии (Е. coli происхождения, ген резистентности к Е. coli ампициллину, TEF-промотор ген резистентности к канамицину), трансформированные дрожжи были подвергнуты давлению отбора путем выбора FOA (Boeke et al. (Methods in Enzymology 154 (1987), 164-175)), что способствует урацил-ауксотрофным дрожжам. Урацил-ауксотрофных штамм, который описан в выборе, имеет название AH22tH3ura8 и имеет tHMG1 кассету экспрессии хромосомной интеграции в URA3-ген.
Штаммы дрожжей, указанные в таблице 1, были оценены на продуктивность/содержание сквалена. Для этого штаммы культивировали в течение 72 часов в WMVIII-среде при 30°С и 150 об/мин встряхивании. После разрушения клеток в 0,5 М кипящей НСl липиды экстрагировали 2 раза 20 мл н-гексаном и анализировали/количественно определяли при помощи ГХ/МС (пожалуйста, см. Пункт 12 для подробного описания). Были получены следующие данные (Таблица 1).
Пример 6
Делеция гена FLD1 в S. cerevisiae AH22tH3ura8 are1are2
Вектор pUG6 (Guldner et al., 1996) был использован для удаления гена fld1.
После подготовки плазмиды, фрагмент pUG6 был усилен ПЦР с получением инструмента, состоящего из loxP-kanMX-loxP. Праймеры были сконструированы с гибридизацией 5’ и 3’ последовательностей FLD1 кодирующей последовательности в lохР регионах pUG6 вектора.
Полученный в результате продукт ПЦР состоит из генов KanR, lохР сайтов и FLD1 гомологичных регионов для интегративной трансформации в S. cerevisiae AH22tH3ura8 are1are2. Гомологичные рекомбинации в дрожжах приводит к делеции целевой последовательности.
Резистентность к G418 была использована для выбора позитивных клонов. FLD1 кодирующей области был удален в этом штамме дрожжей. Для получения штамма для удаления дополнительных генов, резистентность G418 был удалена из штамма. С этой целью штамм был трансформирован в pSH47 (Guldner et al., 1996). Вектор имеет кре-рекомбиназу, чтобы избавиться от гена KanR в окружении сайтов lохР.
Для расположения pSH47 штамм был снова отобран на FOA (5-фтороротовая кислота) (1 г/л) агаровых пластинах.
Полученный в результате штамм имеет тройную делению генов ARE1, ARE2 и FLD1 и обозначен AH22tH3ura8 are1are2fld1.
Штаммы дрожжей, указанные в таблице 2, были оценены на их врабатываемость/содержание сквалена. Для этого штаммы начали культивировать в течение 72 часов в WMVIII-среде при 30°С и 150 об/мин встряхивании. После разрушения клеток в 0,5 М кипящей НСl липиды экстрагировали 2 раза 20 мл н-гексана и проанализированы/определены количественно с помощью ГХ/МС (пожалуйста, см. Пункт 12 для подробного описания). Были получены следующие данные (Таблица 2).
Пример 1
Эписомальная надэкспрессия генов SAK1 и НАР4 в штаммах дрожжей, полученных в примерах 1-5
Для эписомальной надэкспрессии генов SAK1 и НАР4 эти гены клонировали в векторы экспрессии pFlat1 и pFlat3, соответственно. Для этого два гена амплифицировали хромосомальной ДНК из штамма S. cerevisiae S288 с праймерами, вводя NotI сайт рестрикции на 5’ конце и XhoI сайт рестрикции на 3’ конце. Полученные в результате ПЦР фрагменты, а также векторы pFlat1 и pFlat3 подвергали воздействию рестрикционных эндонуклеаз XhoI и NotI. Подвергнутые рестрикции ПЦР фрагменты и линеаризованные векторы сшивали, получая векторы pFlat1-SAK1 и pFlat3-HAP4. Данные векторы несут копию генов SAK1 и НАР4, соответственно, прилегая к конститутивной версии ADH1 промотора и TRP1 терминатора с обеспечением сильной конститутивной экспрессии SAK1 и НАР4.
Для конструирования плазмиды pFlat3, плазмиду YEp24 обрезали SphI, и 900 bp SphI фрагмент, содержащий ADH1 промотор и TRP1 терминатор разделенные сайтом множественного клонирования плазмиду pUC19 вставляли из плазмиды рРТ2В. Сайт множественного клонирования был расширен путем включения полилинкера, содержащего сайты рестрикции для NotI и XhoI. Полученную в результате плазмиду pFlat1, которая несет ген URA3 для отбора, линеаризовали Nco\ рестрикцией, дефосфорировали с помощью полимеразы Klenow и фосфорилированный на конце ВаmHI фрагмент YDpL, содержащий ген дрожжей LEU2, интегрировали. Полученный в результате вектор был pFlat3.
Плазмиды pFlat1-SAK1 и pFlat3-HAP4, а также пустые плазмиды pFlat1 и pFlat3 в качестве контроля трансформировали в штаммы дрожжей, полученные в примерах 1-6
Штаммы дрожжей, указанные в таблице 3, были оценены на выработку/содержание сквалена. Для этого культивировали штаммы в течение 72 часов в WMVIII-среде при 30°С и 150 об/мин встряхивания. После разрушения клеток 0,5 М кипящей НС1 липиды экстрагировали 2 раза 20 мл н-гексаном и анализировали/определяли количественно при помощи ГХ/МС (пожалуйста, см. Пункт 12 для подробного описания). Были получены следующие данные (таблица 3).
Пример 8
Нейтральную липидную композицию сконструированных штаммов оценивали путем тонкослойной хроматографии. Вся экстракция липидов и тонкослойная хроматография была выполнена в соответствии с пунктом 12. Фигура 1 показывает цельную/нейтральную липидную композицию штамма дикого типа AH22ura3, штамм с разрегулированием HMG-CoA Редуктазы AH22tH3ura8 и штаммов с двумя двойными делениями АН22tН3ura8Δare1Δare2 и AH22tH3ura8Δdga1Δlro1. Фигура 1 показывает, что штамм дикого типа (AH22ura3, полоса 1 и 2) производит очень небольшое количество сквалена по сравнению с штаммами в полосе от 3 до 8, которые экспрессируют разрегулирование HMG-CoA-редуктазы и производят большое количество сквалена. Делеция генов, кодирующих ферменты, ответственные за формирование стерильных эфиров (are1, are2) и триацилглицеринов (DGA1, lro1) приводит к полному отсутствию этих компонентов в соответствующих штаммах (обозначены черными квадратами в полосе от 5 до 8). Липидные компоненты были определены по стандартам сквален, холестерин-олеат триолеат, олеат и эргостерол (не показано).
Реферат
Группа изобретений относится к области биотехнологии. Представлен выделенный генно-модифицированный организм для получения сквалена или производного сквалена, в котором по сравнению с соответствующим организмом дикого типа уменьшена или устранена активность обоих паралогов ARE1 и ARE2 ацил-СоА:стерол ацилтрансферазы/стерол О-ацилтрансферазы (ЕС 2.3.1.26), а активность HMG-CoA-редуктазы (ЕС 1.1.1.34) повышена. Представлено применение вышеуказанного организма для получения липида, представляющего собой сквален или производное сквалена, включающее культивирование организма и выделение липида из организма. Группа изобретений позволяет получать сквален со сниженным уровнем примесей не только сложных эфиров стерила, но и примесей в целом. 2 н. и 4 з.п. ф-лы, 5 ил., 3 табл., 8 пр.
Формула

Комментарии