Экстракты aphanizomenon flos aquae и питательные, косметические и фармацевтические композиции, содержащие их - RU2442564C2
Код документа: RU2442564C2
Чертежи






























Описание
Изобретение относится к экстрактам микроводорослей Aphanizomenon Flos Aquae Aquae Ralfs ex Born. & Flah. Var. flos aquae (AFA Klamath) и их биологически активным компонентам, обладающим антиоксидантными, противовоспалительными и противоопухолевыми свойствами. Кроме того, настоящее изобретение относится к питательным, косметическим и фармацевтическим композициям, содержащим эффективные количества экстракта или его активных компонентов, в частности, AFA-фикоцианина, с его комплексом C-фикоцианин/фикоэритроцианин, AFA-фитохромом и микоспоринподобными аминокислотами (MAA), отдельно или в сочетании с кофакторами, содержащимися в водорослях, для применения в профилактике и лечении заболеваний, расстройств или состояний, вовлекающих острое или хроническое воспаление и окислительную дегенерацию клеток или тканей организма или неконтролируемую пролиферацию клеток.
Предпосылки изобретения
Aphanizomenon Flos Aquae (AFA), которые представляют собой один из множества типов сине-зеленых водорослей, встречаются в большом количестве в Верхнем озере Кламат в Южном Орегоне. Они представляют собой один из немногих типов пищевых микроводорослей и отличаются от других микроводорослей, растущих в водоемах, таких как Spirulina и Chlorella, поскольку они являются дикорастущими в оптимальных условиях окружающей среды, которые позволяют им приобретать поистине примечательный питательный профиль, включающий широкий диапазон витаминов и органических минералов, белков и аминокислот, жирных кислот Омега 3. Также известно, что они содержат определенное количество питательных веществ, обладающих антиоксидантными свойствами, таких как хлорофилл и каротины. Различные исследования за последние несколько лет показали значительные антиоксидантные и противовоспалительные свойства, которыми обладают фикоцианины сине-зеленых микроводорослей Spirulina; позднее, были описаны антиоксидантные свойства неочищенного экстракта AFA in vitro (Benedetti S., Scoglio S., Canestrari F., et al., Antioxidant properties of a novel phycocyanin extract from the blue-green alga Aphanizomenon Flos Aquae, in Life Sciences, 75 (2004): 2353-2362).
Описание изобретения
Настоящее изобретение относится к экстрактам кламатских микроводорослей (Aphanizomenon Flos Aquae Aquae Ralfs ex Born. & Flah. Var. flos aquae), в которых сконцентрированы активные компоненты водорослей, а именно: a) специфичный комплекс фикобилипротеина, уникальный для водорослей AFA, который содержит i) фикобилисому, содержащую C-фикоцианин (C-PC) и фикоэритроцианин (PEC) - в дальнейшем в настоящем документе обозначаемые как "AFA-фикоцианины" - и включающую их специфичный хромофор фиковиолобилин; ii) AFA-специфичный фитохром (в настоящем документе обозначаемый как AFA-фитохром");
b) MAA (микоспоринподобные аминокислоты), хлорофилл и каротины.
В процессе экстракции применяют центрифугирование и разделение гель-фильтрацией, которые можно модулировать, модифицируя концентрации различных компонентов. Для обеспечения надлежащей концентрации различных компонентов, первой фазой является получение водного экстракта (обозначаемого в настоящем документе как основной экстракт), в соответствии со следующими стадиями:
a) замораживание свежих собранных водорослей AFA и размораживание их, или, если исходным материалом является высушенный порошок AFA, обработка ультразвуком разбавленного в воде порошка AFA, для разрушения клеток;
b) центрифугирование продукта стадии a) для разделения супернатанта (сохранение большей части цитоплазматической фракции) и осадка (сохранения большей части фракции клеточных стенок);
c) сбор супернатанта, содержащего водорастворимые компоненты (основного экстракта).
Далее, можно концентрировать водорастворимые фракции посредством пропускания супернатанта через мембрану для ультрафильтрации. В частности, для получения экстрактов с концентрированными водорастворимыми компонентами первичный водный экстракт, описанный выше (основной экстракт), подвергают эксклюзионной ультрафильтрации, предпочтительно с использованием мембраны с пределом молекулярной массы 30 кДа, посредством которой получают ретенат (указанный в качестве экстракта B) и фильтрат. Экстракт B содержит более высокую концентрацию AFA-фикоцианинов (C-PC + PEC) и AFA-фитохрома. Интересно, что даже несмотря на то, что MAA имеют молекулярную массу, значительно меньшую используемого предела размеров, в ретенате также повышена концентрация MAA. С другой стороны, фильтрат обладает более высокой концентрацией каротинов, хлорофилла и незаменимых жирных кислот.
Липофильные компоненты экстракта, главным образом, представлены каротинами, хлорофиллом и альфа-линоленовой кислотой (18:3n-3), все из которых присутствуют в водорослях AFA в больших количествах. Эти компоненты частично задерживаются в супернатанте (основной экстракт), но большая их часть присутствует в осадке, получаемом центрифугированием на стадии b), выше. Затем этот осадок можно подвергать последующему процессу экстрагирования, направленному на концентрирование упомянутых выше жирорастворимых веществ. Концентрирование жирорастворимых веществ предпочтительно проводят экстракцией на основе этанола, в соответствии со следующими стадиями:
a) суспендирование высушенного осадка в растворе 100% этанола, гомогенизация и поддержание гомогената при постоянном перемешивании в течение 24 ч при комнатной температуре в темноте;
b) центрифугирование полученной суспензии при 3000 об/мин в течение 5' при 4°С;
c) сбор супернатанта;
d) необязательно, проведение второй экстракции осадка этанолом в соответствии со стадиями с a) по c);
e) высушивание супернатанта с получением жирорастворимого концентрата (экстракт C).
Затем полученную таким образом обогащенную жирорастворимыми компонентами фракцию можно добавлять к основному экстракту или к фильтрату, полученному ультрацентрифугированием, с получением наибольшей возможной концентрации жирорастворимых веществ, которые усиливают эффекты биологически активных веществ, уже присутствующих в экстрактах.
Экстракты по настоящему изобретению могут быть предоставлены в форме питательных добавок, фармацевтических и/или косметических продуктов. Основной экстракт, в большинстве случаев, является предпочтительным, поскольку он сохраняет очень высокие антиоксидантные и противовоспалительные свойства.
Компоненты, которые сохраняют или усиливают антиоксидантные свойства экстракта, были выделены и физико-химически охарактеризованы. Конкретный тип AFA-фикоцианина (C-PC/PEC); хромофор фиковиолобилин (PVB); специфичный AFA-фитохром; микоспоринподобные аминокислоты (MAA) porphyra и shinorine оказались наиболее активными, отдельно или в различных сочетаниях, и их антиоксидантная активность далее повышалась посредством других компонентов, таких как хлорофилл, бета-каротин, каротиноиды провитамина A, ксантофильные каротины, такие как кантаксантин, витамины и минералы. Было выявлено, что в дополнение к их показанной антиоксидантной активности, как основной экстракт, так и очищенные AFA-фикоцианины, значительно ингибируют фермент циклооксигеназу-2 (COX-2); затем это свойство подтвердили для основного экстракта, который, как было показано, посредством включения как AFA-PC, так и других противовоспалительных молекул, способен предотвращать и/или подавлять воспаление в модели на животных in vivo. Более того, при тестировании на опухолевой клеточной линии, было показано, что AFA-фикоцианин обладает высокой антипролиферативной активностью.
Таким образом, настоящее изобретение далее включает питательную, косметическую или фармацевтическую композицию, содержащую, в качестве активного ингредиента, экстракт кламатских микроводорослей или его выделенный и очищенный активный компонент, в частности: a) определенный тип AFA-фикоцианинов (C-PC/PEC), присутствующий в AFA или в любых других микроводорослях b) PEC; c) фиковиолобилин (PVB); d) AFA-фитохром; e) микоспоринподобные аминокислоты (MAAs) porphyra и shinorine, присутствующие в AFA, или из любых других водорослей; необязательно в сочетании с кофакторами или коадъювантами, выбранными из хлорофилла, бета-каротина, каротиноидов провитамина A, ксантофильных каротинов, кантаксантина, витаминов и минералов, и необязательно в сочетании с пищевыми, косметическими или фармацевтически приемлемыми носителями или эксципиентами. Для получения композиций в соответствии с этим изобретением, различные жидкие экстракты, упомянутые выше, можно использовать либо в таком виде, либо их можно высушивать способами, такими как лиофилизация, высушивание распылением и другие.
В предпочтительном варианте осуществления, питательные композиции представляют собой диетические добавки в форме таблеток, капсул, напитков, которые пригодны для повышения или поддержания природной защиты против патогенов, для удаления окислительных молекул, продуцируемых посредством метаболических, воспалительных и связанных со старением процессов. В другом предпочтительном варианте осуществления, косметические композиции представлены в форме местных препаратов, таких как эмульсии, гели, лосьоны, порошки, примочки для глаз, в частности мази или кремы, для применения в целях профилактики или лечения дерматологических или связанных с возрастом нарушений, и в качестве светозащитных средств для профилактики старения кожи и фотоокислительной дегенерации кожи и волос.
В другом предпочтительном варианте осуществления, фармацевтические композиции представлены в форме таблеток, капсул, саше, сиропов, суппозиториев, ампул и мазей и их можно использовать для профилактики или лечения опосредуемых свободными радикалами патологий, воспаления или неоплазий.
Подробное описание изобретения
Определение структуры и конкретных характеристик фикобилисомводорослей AFA(AFA-фикоцианинов)
В интактной клетке цианобактерий фикоцианины (PC) присутствуют внутри фикобилисомы в функциональной форме (αβ)6 (1). После разрушения клетки, белок можно встретить в состояниях различной агрегации (мономеры, димеры, тримеры, гексамеры) в соответствии с анализируемым организмом. В случае кламатских водорослей AFA, электрофоретический анализ PC, как находящихся в экстрактах AFA, так и обособленных очищенных из экстракта, показал, что белок встречается в большинстве случаев в его тримерной форме (αβ)3 с общей молекулярной массой 121000. Масса мономера αβ составляет приблизительно 40000 (18500 для субъединицы α+21900 для субъединицы β). Вместо этого, большинство исследований очищенных PC из Spirulina указывают на то, что белок встречается в Spirulina в мономерной форме αβ с молекулярной массой приблизительно 37500, демонстрируя, таким образом, отличающееся состояние агрегации относительно очищенных PC из AFA.
Хроматографический анализ фикобилисом AFA также показал, что, как в других видах цианобактерий, α-субъединица PC связывает простетическую группу, в то время как β-субъединица связывает две. Простетическую группу или хромофор называют фикоцианобилином (PCB) и она отвечает за голубую окраску белка и за его антиоксидантный потенциал (2).
В основе фундаментального отличия между AFA и Spirulina лежит различная структура фикобилисомы. В противоположность Spirulina, кламатская фикобилисома AFA не содержит пигмент аллофикоцианин, а содержит только пигмент c-фикоцианин, связанный со структурным компонентом, который отсутствует в Spirulina, а именно, с фикоэритроцианином (PEC). PEC представляет собой фотосинтетический пигмент, который к настоящему времени идентифицирован только в ограниченном количестве видов цианобактерий (3). PEC имеет химическую структуру, высоко сходную со структурой PC, состоящую из двух субъединиц α и β, которые ассоциируют с образованием мономеров и тримеров. Тем не менее, несмотря на то, что каждый мономер PC связывает 3 молекулы PCB, PEC обладает уникальным свойством связывать две молекулы PCB с β-субъединицей и одну молекулу фиковиолобилина (PVB) с α-субъединицей, которая ответственна за фиолетовое окрашивание пигмента.
Для фикобилисомы кламатских водорослей является характерным то, что она состоит из объединенных c-фикоцианина и фикоэритроцианина, и это отличающаяся качественная структура фикобилисомы кламатских водорослей AFA добавляет дополнительный убедительный фактор, отличающий AFA от Spirulina и от других сине-зеленых водорослей.
На фиг.1 представлено сравнение компонентов клеточного лизата AFA с клеточными лизатами других хорошо известных цианобактерий, Synechocystis PCC 6803. В обоих видах цианобактерий можно видеть синюю полосу, соответствующую фикобилисоме, но в водорослях AFA фикобилисома проявляет меньшую молекулярную массу, подтверждая, что, в противоположность обычным микроводорослям, таким как Spirulina, в фикобилисоме AFA присутствуют только фикоцианины, но не аллофикоцианины. Более того, на фиг.1 представлено, что в AFA также присутствует светло-фиолетовая полоса (показанная стрелкой), которая является типичной для фикоэритроцианинов, таким образом, доказывая их присутствие в фикобилисоме кламатских водорослей.
Каждую синюю полосу далее анализировали посредством ВЭЖХ, соединенной с масс-спектрометром (RP-HPLC-ESI-MS). Благодаря различному времени удержания, белки фикобилисомы были разделены и идентифицированы на основании их молекулярной массы. Полученные результаты представлены в следующих таблицах. Во-первых, было выявлено, что, несмотря на то, что в Synechocystis (таблица 1) присутствуют как фикоцианин (cpcA при 28,2 мин и cpcB при 28,9 мин), так и аллофикоцианин (apcA при 30,7 мин и apcB при 31,2 мин), в AFA (таблица 2) присутствует только фикоцианин (cpcA при 28,8 мин и cpcB при 30,0 мин). Во-вторых, в AFA был идентифицирован белок с молекулярной массой 19469, который не присутствует в Synechocystis и который соответствует бета-субъединице фикоэритроцианина с двумя присоединенными билинами (pecB при 25,0 мин).
.
Эта уникальная структура является важным элементом для объяснения более сильного антиоксидантного и противовоспалительного действия экстракта водорослей AFA, в котором сконцентрированы их фикоцианины, и более всего она важна для объяснения того, почему очищенный AFA-фикоцианин оказался более эффективным, чем другие PC, такие как PC из Spirulina (как показано посредством как антиоксидантных, так и противовоспалительных тестов, см. ниже). Связывание между C-PC и PEC в фикобилисоме AFA является настолько сильным, что его нельзя разрушить известными способами очистки (см. ниже). Таким образом, очищенный AFA-PC следует понимать как очищенную AFA-фикобилисому, образованную комплексом C-PC/PEC. Однако для простоты комплекс обозначают как "AFA-PC" или PC.
Способы очистки (фиг.2)
AFA-PC и его хромофор PCB были очищены, начиная с основного экстракта. PC очищали из высушенного экстракта AFA следующим образом:
- суспендировать 500 мг экстракта в 50 мл 100 мМ Na-фосфатного буфера pH 7,4;
- центрифугировать при 2500 об/мин в течение 10' при 4°C;
- собрать супернатант и добавить твердый сульфат аммония до 50% насыщения;
- осаждать белки в течение 60 мин при 4°C при встряхивании образца;
- центрифугировать при 10000 об/мин в течение 30 мин при 4°С;
- удалить прозрачный бесцветный супернатант и ресуспендировать синий осадок в небольшом объеме 5 мМ Na-фосфатном буфере pH 7,4;
- диализировать в течение ночи при 4°C против того же буфера;
- поместить диализированный PC в 2,5×25 см колонку с гидроксиапатитом (Bio-Rad Laboratories, CA, USA), уравновешенную 5 мМ Na-фосфатным буфером pH 7,4;
- элюировать образец Na-фосфатным буфером, pH 7,0, с возрастающей ионной силой (от 5 до 150 мМ);
- собрать фракции и считывать поглощение при 620 нм и 280 нм с помощью спектрофотометра;
- объединить фракции, в которых Abs620/Abs280>4 (индекс чистого PC);
- осаждать PC сульфатом аммония при 50% насыщении в течение 1 часа при 4°С;
- центрифугировать при 10000 об/мин в течение 30' при 4°C;
- удалить супернатант и снова суспендировать PC в 150 мМ Na-фосфатном буфере, pH 7,4;
- диализировать против того же буфера при 4°C;
- перенести очищенный PC в колбу и хранить в темноте при +4°C или -20°С.
На фиг.2 представлен спектрофотометрический график экстракта, полученного после очистки. Можно видеть, что очищенный PC в действительности представляет собой целую фикобилисому, содержащую две субъединицы C-PC и PEC. В действительности, известно, что максимум поглощения C-PC составляет 620 нм, который на спектрометрии фигуры 2 соответствует верхушке пика. Также известно, что максимум поглощения PEC составляет 566 нм для α-субъединицы (фиковиолобилин) и соответственно 593 нм и 639 нм для двух PCB β-субъединицы. Все три значения в действительности включены в конусообразный пик, образующий спектрофотометрический паттерн очищенного PC. Принимая во внимание сильную связь между C-PC и PEC в водорослях AFA, C-PC, а также PEC обязательно присутствуют в очищенном экстракте PC. Это означает, что PC из AFA значительно отличается, как структурно, так и функционально, от PC других цианобактерий, включая PC из Spirulina, на которых было проведено большинство исследований. В частности, это отличие состоит в том, что PC AFA имеет одну часть, а именно C-PC, являющуюся общей с PC из других источников, и одну часть, компонент PEC, которая отличается, так что его свойства, ассоциированные с комплексом C-PC/PEC, являются новыми и свойственными исключительно AFA (и сходным комплексам C-PC/PEC из других микроводорослей).
Количественное определение AFA-фикоцианина
Для определения молярной концентрации чистого PC авторы настоящего изобретения использовали коэффициент молярной экстинкции ε при 620 нм, который для тримерной формы (αβ)3 равен 770000 М-1 см-1. Это означает, что 1 M раствор PC при 620 нм имеет величину поглощения 770000.
Для измерения концентрации PC в экстрактах, авторы настоящего изобретения использовали коэффициент удельной экстинкции E1% при 620 нм 70 л г-1 см-1. Это означает, что поглощение раствора, содержащего 1% PC (т.е. 1 г/100 мл) при 620 нм составляет 70. На основании этих вычислений, среднее содержание PC в основном экстракте равно 80-100 мг/г DW (8-10% DW); в то время как среднее содержание PC в экстракте B составляет приблизительно 360 мг/г DW (36% DW).
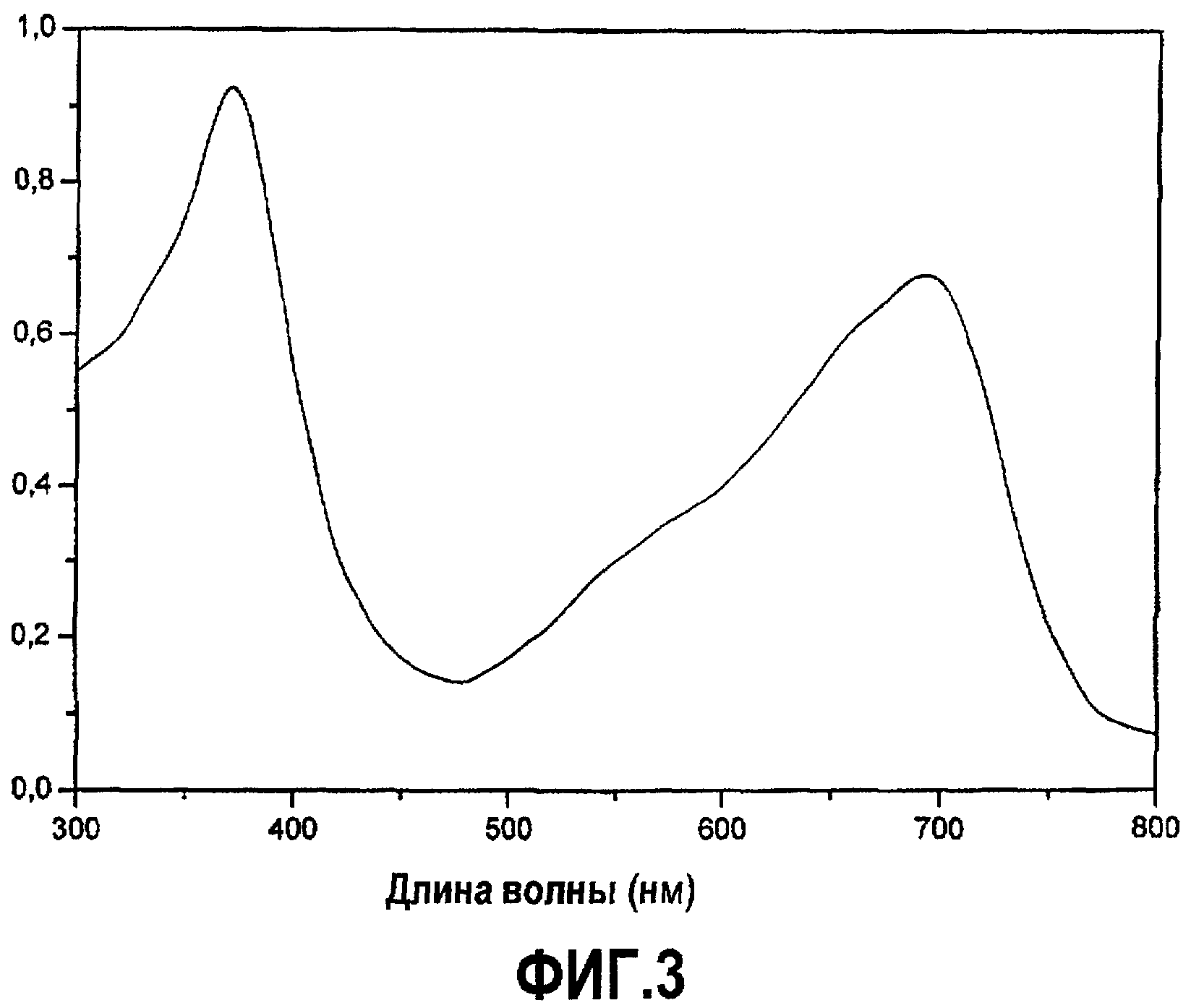
Очистка хромофора PCB (фиг.3)
- Суспендировать 500 мг экстракта в 50 мл дистиллированной H2O.
- Центрифугировать при 2500 об/мин в течение 10' при 4°С.
- Удалить темно-синий супернатант и осадить PC 1% трихлоруксусной кислотой.
- Инкубировать в течение 1 ч в темноте при 4°C при встряхивании.
- Центрифугировать при 10000 об/мин в течение 30' при 4°С.
- Собрать осадок, содержащий PC, и промыть 3 раза метанолом.
- Ресуспендировать осадок в 10 мл метанола, содержащего 1 мг/мл HgCl2.
- Инкубировать в течение 20 ч при 42°С в темноте для высвобождения PCB из PC.
- Центрифугировать при 2500 об/мин в течение 10' для удаления белков.
- Добавить к супернатанту, содержащему PCB, β-меркаптоэтанол (1 мкл/мл) для осаждения HgCl2.
- Инкубировать при -20°С в течение 24 ч.
- Центрифугировать при 10000 об/мин в течение 30' при 4°C для удаления белого осадка.
- Добавить к супернатанту 10 мл смеси метиленхлорид/бутанол (2:1, об./об.).
- Промыть 20 мл дистиллированной H2O и центрифугировать при 3000 об/мин в течение 10'.
- Удалить верхнюю фазу, собрать нижнюю часть, содержащую PCB.
- Промыть PCB в 15 мл H2O 3 раза.
- Высушить в атмосфере азота и хранить при -20°С.
Полученная спектрофотометрическая сканограмма демонстрирует, что PCB показывает два пика поглощения, при 370 и 690 нм.
Антиоксидантное превосходство кламатских водорослей фикоцианинов по сравнению с другими фикоцианинами.
Фикоцианины (PC) представляют собой синие пигменты, типичные для всех сине-зеленых микроводорослей, но обладающие отличающимися структурными и функциональными характеристиками в каждых конкретных микроводорослях (22). В отношении источников PC, используемых в качестве питательных добавок и потенциальных природных лекарственных средств, до настоящего времени исследования были сфокусированы на Spirulina. Было показано, что фикоцианины Spirulina обладают антиоксидантными (23) и противовоспалительными (24, 25, 26) свойствами, со значительной активностью в отношении различных физиологических областей, таких как печень (27), дыхательная система (28) и головной мозг (29, 30). Учитывая отсутствие исследований других фикоцианинов, таких как фикоцианины кламатских водорослей, авторы настоящего изобретения провели сравнительное измерение антиоксидантной способности водного экстракта из кламатских водорослей AFA относительно продукта Serum BleuTM, жидкого экстракта, в котором сконцентрированы PC из микроводорослей Spirulina platensis.
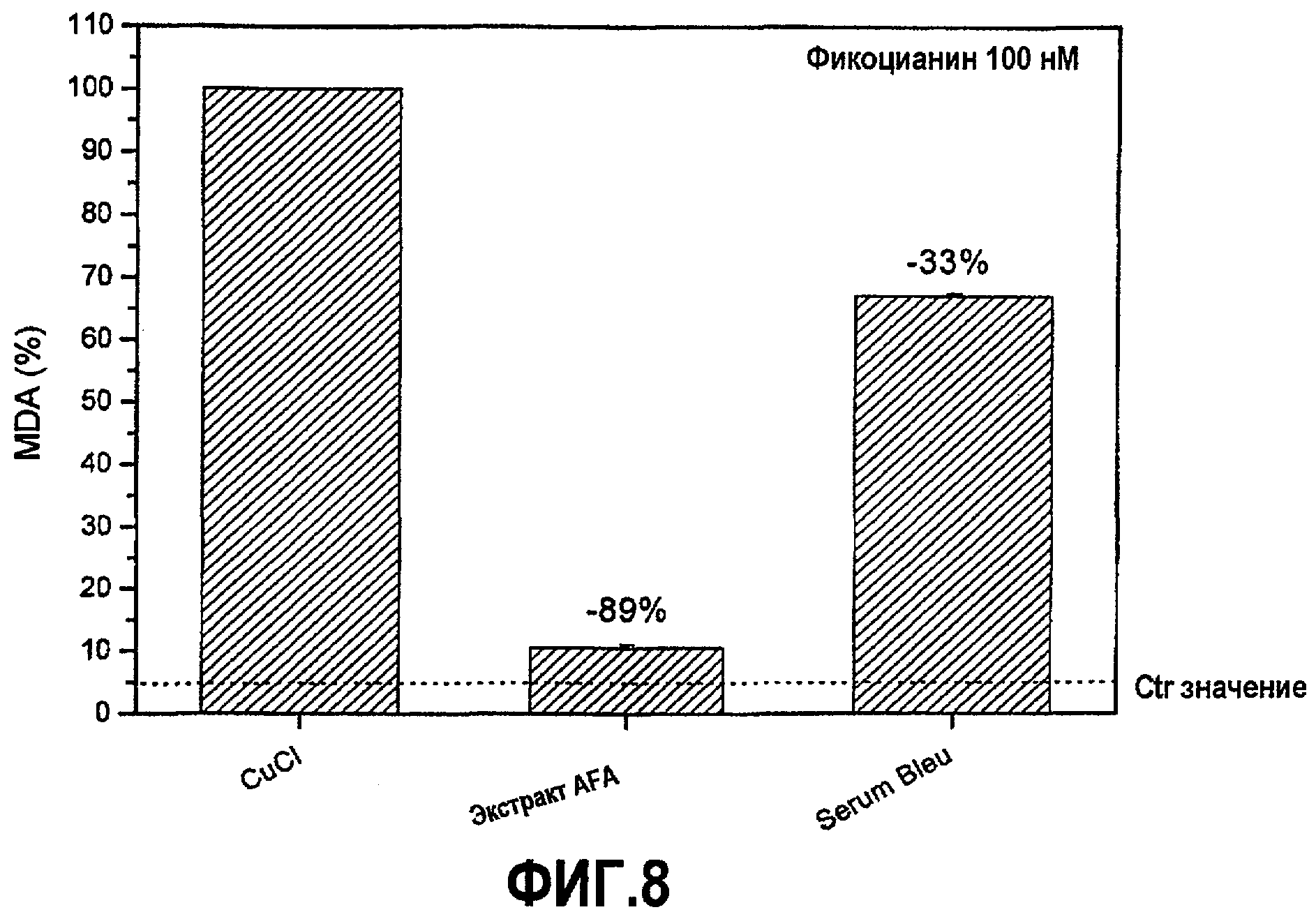
Снижение уровней MDA (малондиальдегида) в образцах плазмы, окисленных посредством CuCl2 и предварительно инкубированных с двумя экстрактами, показано на фиг.8, где можно видеть, что экстракт при концентрации PC 100 нМ является значительно более эффективным в отношении ингибирования окисления липидов плазмы, с ингибированием образования MDA, достигающим уровня 89%, против 33% ингибирования, обеспечиваемого Serum BleuTM при идентичной концентрации PC 100 нМ. Это показывает, что при одинаковой концентрации PC экстракт AFA является значительно более эффективным, чем экстракт Spirulina. Такое отличие может быть свойственно двум отличающимся и взаимодополняющим факторам: a) структурному и, таким образом, функциональному разнообразию двух типов PC; b) наличию в экстракте дополнительных антиоксидантных факторов, которые отсутствуют, как в случае фитохрома, или представлены в меньшей степени, такие как MAA, в других микроводорослях, таких как Spirulina. Однако более высокая антиоксидантная сила PC AFA в отношении C-PC (из Spirulina) показана также посредством сравнения с данными, доступными в литературе, касающимися липопероксидации.
Пероксидация липидов плазмы и эритроцитов
При тестировании в отношении свойств против пероксидации липидов на микросомах печени крысы, окисленных AAPH, C-PC из Spirulina ингибировал продукцию TBARS (конъюгированных диенов, MDA) с IC50 11,35 мкМ (23, Bhat et al.). C-PC из Spirulina также был протестирован Romay & Gonzales (41) против лизиса эритроцитов человека, индуцированного AAPH: IC50 в этом случае составляла 35 мкМ.
Авторы настоящего изобретения тестировали эту же способность как для AFA-PC, так и для его PCB, в отношении ингибирования образования MDA на: a) плазме человека, окисленной CuCl2; b) на RBC (красных кровяных клетках или эритроцитах), окисленных AAPH. Авторы настоящего изобретения также тестировали способность AFA-PC и PCB ингибировать индуцируемый AAPH лизис эритроцитов. В первом случае, образцы плазмы получали после центрифугирования гепаринизированной крови от здоровых добровольцев при 1500 g в течение 10 мин. Степень окисления липидов в образцах плазмы, инкубированных в течение 2 ч при 37°C с PBS (контроль) или с 100 мкМ CuCl2 в присутствии возрастающих концентраций PC или PCB (диапазон 0,1-1 мкМ), оценивали посредством измерения реагирующих с TBA веществ при 535 нм (42). В отношении эритроцитов, гепаринизированные образцы крови получали от здоровых добровольцев посредством венопункции после получения информированного согласия. Эритроциты (RBC) выделяли центрифугированием при 1500 g в течение 10 мин, промывали три раза посредством PBS и в конце ресуспендировали с использованием того же буфера до уровня гематокрита 5%. RBC инкубировали с PBS (контроль) или 50 мМ AAPH в течение 4 часов при 37°С в присутствии различных концентраций PC или PCB (диапазон 0,1-1 мкМ). Реагирующие с TBA вещества, главным образом, малонилдиальдегид (MDA), в качестве показателей пероксидации липидов, анализировали, как описано ранее (42). В кратком изложении, 1 мл реакционной смеси инкубировали при 95°C в течение 1 ч с 250 мкл TBA (0,67%) и 100 мкл H3PO4 (0,44 M); затем добавляли 150 мкл TCA (20%). После центрифугирования определяли содержание пероксида в супернатанте с использованием коэффициента молярной экстинкции (OD535) MDA.
Как описано на фиг.9A, PC и PCB ингибировали зависимым от дозы образом (p<0,05 для каждой тестируемой концентрации) степень пероксидации липидов в RBC (эритроциты), инкубированных в течение 2 часов при 37°С с генератором пероксильных радикалов AAPH (панель A); в то же время, PC и PCB зависимым от дозы образом защищали липиды плазмы от индуцируемого металлами окисления (p<0,05) в образцах, инкубированных в течение 2 часов при 37°C с CuCl2 (панель B). В обоих экспериментах по ингибированию, значения IC50 составляли приблизительно 0,140 мкМ и 0,160 мкМ для PC и PCB (против 11,35 мкм C-PC из Spirulina).
Авторы настоящего изобретения также тестировали способность AFA-PC ингибировать индуцируемый AAPH лизис эритроцитов: как показано на фигуре 9B, AFA-PC способен постоянно (т.е. с 1 по 6 час) ингибировать лизис эритроцитов более чем на 50% всего с 250 нМ AFA-PC (против IC50 37 мкМ для C-PC из Spirulina).
Даже учитывая некоторые отличия в способе тестирования или концентрации, в обоих случаях превосходство AFA-PC над C-PC из Spirulina является поистине примечательным, причем отличие значений IC50 составляет от 75 до 150 раз в пользу AFA-PC. Даже больший показатель отличия в эффективности можно видеть, учитывая тот факт, что, как описано в том же исследовании Bhat et al. (23), пероксидация липидов ингибируется на 95% дозировкой C-PC Spirulina 200 мкМ. На фигуре 9A можно видеть, что для получения сходной степени ингибирования требуется только 1 мкМ AFA-PC, что в 200 раз меньше. Это подтверждает, что значительное отличие между самим C-PC и комплексом C-PC/PEC, который характеризует водоросли AFA и их экстракты, определенно является следствием PEC, единственного отличающегося элемента, показывая, таким образом, что PEC самостоятельно является очень эффективной молекулой.
Кроме того, IC50 для PC является немного более низкой, чем для PCB. Это является в некоторой степени удивительным, с учетом того, что PCB, который считают его наиболее активным компонентом, после очистки и, таким образом, в более концентрированном состоянии, должен быть более эффективным, чем целая молекула, частью которой является активный компонент. Тот факт, что он является в действительности немного более слабым, хотя, тем не менее, высоко эффективным, означает, что в целом PC существуют другие факторы, которые в действительности могут быть еще более эффективными, чем сам PCB. Известно, что целый PC содержит PEC, помимо C-PC и его хромофора PCB, который включает в качестве его хромофоров как PCB, так и PVB (фиковиолобилин). Таким образом, авторы настоящего изобретения полагают, что фактор, обеспечивающий значительное отличие эффективности между очищенным PCB и целым PC, определенно является компонентом PEC, в частности его хромофором PVB, который считают очень сильным антиоксидантом.
Оценка антиоксидантной способности (ORAC) AFA-PC и его PCB
Способ ORAC (cпособность к поглощению кислородных радикалов) широко применяют для определения общей антиоксидантной способности чистых и составных веществ, измеряя их активности по сравнению с Trolox (растворимым аналогом витамина E) в качестве контрольной молекулы (31). Однако до настоящего времени его никогда не использовали для определения антиоксидантной способности чистых природных молекул из цианобактерий, таких как PC и PCB.
Анализ ORAC проводили при 37°С на спектрофлуориметре FLUOstar OPTIMA (BGM LABTECH, Germany) при возбуждении при 485 нм и испускании при 520 нм, с использованием способа Ou et al. (32) с небольшими модификациями. В кратком изложении, в конечной смеси для анализа, в качестве мишени для атаки свободных радикалов использовали флуоресцеин (FL) (0,05 мкМ), с AAPH (4 мМ) в качестве генератора пероксильных радикалов. В качестве контрольного стандарта использовали Trolox (1 мкМ) и в качестве пустого образца использовали фосфатный буфер. Концентрации тестируемых соединений в анализируемой смеси варьировали от 0,025 мкМ до 2 мкМ. Все вещества растворяли и разбавляли 75 мМ Na-фосфатным буфером, pH 7; раствор PCB получали сначала растворением соединения в этаноле, а затем доведением раствора до требуемой концентрации буфером. Все образцы анализировали в трех экземплярах. Флуоресценцию регистрировали каждые 5 мин после добавления AAPH. Конечные результаты (значения ORAC) вычисляли с использованием отличий в площадях под кривыми затухания флуоресценции (AUC) между образцом и пустым образцом и выражали в качестве эквивалентов Trolox:
Значение ORAC = [(AUCобразец-AUCпустой образец)/(AUCtrolox-AUCпустой образец)]×(молярностьtrolox/молярностьобразец)
Линейные регрессионные анализы величин ORAC (y) против концентраций AA, GSH, PC и PCB (x), на должном уровне описали данные, как оценивали по коэффициенту корреляции.
PC представляет собой флуоресцентный водорастворимый белок, который при возбуждении при 620 нм, испускает при 647 нм, эта собственная флуоресценция не препятствует испусканию FL при 520 нм, и не было выявлено изменения флуоресценции после добавления к реакционной смеси PC. Эффекты PC на кинетику снижения флуоресценции FL после добавления AAPH описаны на фигуре 10, на которой отчетливо представлена линейная корреляция между концентрациями PC (варьирующими от 0,025 до 0,150 мкМ) и суммарная площадь под кривой затухания флуоресценции (AUC) (r=0,998, p<0,0001).
Хромофор PCB отвечает за ярко-синюю окраску PC и после высвобождения из белка проявляет два характерных пика поглощения при 370 и 690 нм, которые, как в случае PC, не влияют на флуоресценцию FL. На фигуре 11 представлена кинетика тушения FL различными концентрациями билина и положительная корреляция (r=0,995, p<0,0005) AUC против концентраций PCB (диапазон 0,025-0,150 мкМ).
В конце, способность чистого PC и PCB непосредственно тушить пероксильные радикалы сравнивали со способностью хорошо известных молекул чистых антиоксидантов. На фиг.12 представлен линейный регрессионный анализ Trolox, GSH, AA, PC и PCB в отношении их значения ORAC. Исходя из этих данных, авторы настоящего изобретения выявили, что PC и PCB имели наиболее высокие значения ORAC (20,33 и 22,18 Trolox экв., соответственно), в то время как GSH и AA показали наименьшие (0,57 и 0,75). Тот факт, что также в тесте ORAC значения AFA-PC и PCB являются очень сходными, подтверждают очень важную роль, которую играет PEC в AFA-PC.
Для цитируемых природных компонентов отсутствуют доступные ссылки на значения ORAC; однако, насколько известно авторам настоящего изобретения, значение ORAC PCB (выраженное в качестве мкмоль Trolox/мкмоль PCB или в качестве мкмоль Trolox/мг PCB) является наиболее высоким значением, встречающимся в литературе, относительно чистых антиоксидантных молекул, для которых оценивали активность ORAC с использованием FL в качестве флуоресцентного зонда (ORACFL). В качестве примера, Ou et al. (Ou et al., 2001) определили антиоксидантную способность различных фенольных соединений способом ORACFL, и наибольшие выявленные значения составляли 7,28 и 6,76 мкмоль Trolox/мкмоль соединения, которые, если соответствующие значения ORAC выражают в качестве мкмоль Trolox/мг образца, вместо мкмоль Trolox/мкмоль образца, получаются 24,0 и 23,3 мкмоль Trolox/мг соединения, для флавоноидов кверцетина и (+)-катехина, соответственно; в то время как ORAC для PCB получается 37,0 мкмоль Trolox/мг.
Защитный эффект AFA-фикоцианина и его PCB на культивируемые клетки.
Начиная с основного экстракта, и согласно уже описанным способам, авторы настоящего изобретения очистили AFA-фикоцианин, с его комплексом C-PC/PEC, для тестирования его антиоксидантных свойств на живых культивируемых клетках. Клетки Jurkat (иммортализованная линия T-лимфоцитов лейкоза) подвергали окислительному стрессу посредством 500 мкМ H2O2, совместно с возрастающими дозировками AFA-PC и PCB или без них. Флуоресценцию, испускаемую внутриклеточным зондом (дихлорфлуоресцеином), после окисления H2O2, регистрировали после 30 минут инкубации с H2O2 с помощью флуориметра (возбуждение при 492 нм и испускание при 520 нм). Посредством инкубации клеток как с AFA-PC (диапазон 0,1-10 мкМ), так и с 500 мкМ H2O2 в течение 30 минут, авторы настоящего изобретения выявили зависимый от дозы защитный эффект со снижением внутриклеточной флуоресценции, индуцируемым H2O2, с IC50 0,5 мкМ, и 100% ингибированием (не окисленные клетки) при 10 мкМ (фиг.13).
Антиоксидантные свойства целого PC, состоящего из C-PC и PEC, принадлежат его хромофорам, которые представляют собой фикоцианобилин (PCB) для C-PC, и как PCB, так и PVB (фиковиолобилин), для PEC. Авторы настоящего изобретения очистили хромофор C-PC PCB, для тестирования его на культивируемых клетках, окисленных H2O2 (диапазон FCB 0,1-40 мкМ). Также в этом случае авторы настоящего изобретения наблюдали зависимый от дозы антиоксидантный эффект с IC50 0,5 мкМ и 100% ингибированием (не окисленные клетки) при 40 мкМ (фиг.13).
В концентрациях, которые тестировали, как AFA-PC, так и PCB, инкубированные в течение 30 минут с культивируемыми клетками и без H2O2, не обладают каким-либо окислительным эффектом, как показано посредством того факта, что не существует возрастания внутриклеточной флуоресценции.
Наиболее важно, для оценки захвата клетками PC и PCB, оба соединения предварительно инкубировали в течение 2 ч с клетками; после этого среду смывали для исключения какого-либо не захваченного PC и PCB, и клетки подвергали окислению в течение 30 мин посредством H2O2. Как показано на фиг.14, существует зависимое от дозы ингибирование внутриклеточной флуоресценции. Это означает, что клетка способна сохранять обе антиоксидантные молекулы, либо в мембране, либо в цитоплазме.
Это является очень важным открытием, поскольку оно показывает, что антиоксидантная активность двух молекул, очень вероятно, является эффективной in vivo для терапевтических целей.
В то время как исследования, проведенные на очищенном C-PC Spirulina, уже доказали его способность проникать в цитозоль клеток (43), это является первой демонстрацией способности очищенного PCB проникать в клетку и удерживаться в ней. Более того, впервые ту же способность показывают для определенного AFA-PC (комплекс C-PC/PEC). В тестируемых концентрациях, как PC, так и PCB, инкубированные в течение 2 ч с клетками, не приводили к какому-либо окислительному эффекту, как показано посредством того факта, что не происходит возрастания внутриклеточной флуоресценции.
В то же время, на фиг.13, где окислитель и антиоксиданты добавляли одновременно, можно видеть, что степень защиты клеток, обеспечиваемая PC и PCB, является эквивалентной; в тесте захвата, как показано на фигуре 14, результаты антиоксидантного эффекта PCB являются немного более быстрыми (IC50 1,9 мкМ для PCB против 4,2 мкМ для PC); и также немного более высокими (более чем 90% защита посредством PCB; менее чем 90% посредством PC). Это означает, что степень захвата PCB, относительно PC, является действительно немного более высокой (как можно было ожидать с учетом более чистой природы PCB). Тем не менее, степень захвата является поистине примечательной для обоих соединений, с учетом того, что в обоих случаях она является очень близкой к степени защиты, обеспечиваемой одновременным добавлением антиоксидантов и окислителя.
С другой стороны, этот тест на живых клетках подтверждает предшествующее предположение о неотъемлемой необходимости компонента PEC для антиоксидантного свойства целого PC. Как показано на фиг.13, 14, тот факт, что целый очищенный PC имеет такую же очень высокую антиоксидантную эффективность, что и очищенный PCB, концентрация которого является значительно более высокой после очистки относительно его концентрации в качестве части целого PC, указывает на то, что PCB является не единственным активным веществом PC и что в действительности, независимо от того, какое другое вещество или вещества (начиная с PVB) присутствуют в PC, они, очень вероятно, являются значительно более эффективными, чем сам PCB.
Новое определение синергических факторов, которые обеспечивают большую эффективность экстракта, чем AFA-фикоцианинов, содержащихся в нем.
Как было показано, AFA-PC с его комплексом C-PC/PEC, является значительно более эффективным, чем чистый C-PC из других водорослей, таких как Spirulina, но в кламатских водорослях существуют другие факторы, которые объясняют также превосходство их экстрактов, начиная с основного экстракта, относительно их основного антиоксидантного и противовоспалительного компонента, комплекса фикоцианины/фикоэритроцианин.
Основным фактором, который объясняет такое отличие, является второй элемент, который представляет собой более широкий комплекс фикобилипротеина, образующий систему контроля освещения водорослей AFA, а именно его специфичный фитохром, в основных терминах, наиболее мощный антиоксидантный компонент, до настоящего времени выявленный в водорослях. В конкретных молекулах, типичных для всех водорослей, можно идентифицировать дополнительные факторы, называемые "микоспоринподобными аминокислотами" или MAA, которыми кламатские водоросли особенно богаты; и ряд питательных молекул, антиоксидантное и противовоспалительное действие которых уже известно, таких как хлорофилл, бета-каротин и каротиноиды, плюс различные витамины и минералы.
A) Идентификация "AFA-фитохрома", уникального фитохрома, типичного для кламатских водорослей
Фитохромы представляют собой фоторецепторы, пигменты, которые растения используют для детекции света, и которые чувствительны к свету в красной и дальней красной области видимого спектра. Они выполняют множество различных функций в растениях, включая регуляцию цветения (посредством суточных ритмов), прорастание и синтез хлорофилла. Последний является особенно важным для водорослей AFA, поскольку наличие этого уникального типа фитохрома в AFA можно объяснить отсутствием в них другого фикобилипротеина, обычно используемого другими цианобактериями для дополнения C-фикоцианина в процессе фотосинтеза, а именно, аллофикоцианина. Несмотря на то, как было видно, что место аллофикоцианина в кламатских водорослях занимает PEC, вероятно, что PEC отдельно не является достаточным, особенно с учетом того, что кламатские водоросли живут в нетропическом окружении, которое требует высокой светособирающей эффективности, и таким образом водоросли AFA, по-видимому, интегрируют их более высокие потребности с их собственным фитохромом.
Несмотря на то, что фитохром AFA, который был выявлен и описан в настоящем документе впервые, имеет свою собственную характерную структуру, его, тем не менее, можно определить как представителя общего семейства фитохромов. С течением времени, в растениях были выявлены различные типы фитохромов, которые не только имеют различные гены фитохромов (3 в рисе, но 6 в маисе, например), но, в большинстве случаев, конкретный фитохром каждого растения, или по меньшей мере каждого семейства растений, имеет значительно отличающиеся белковые компоненты и, таким образом, структуру. Тем не менее, все они являются фитохромами, поскольку все они используют один и тот же билипротеин, называемый фикохромобилином, в качестве поглощающего свет хромофора. Этот хромофор сходен с хромофором фикоцианина фикоцианобилином и характеризуется тем, что он представляет собой единственную молекулу билина, состоящую из открытой цепи из четырех пиррольных колец (тетрапирролы). Поскольку активным компонентом всех фитохромов, в их отличающейся общей структуре, тем не менее, остается этот хромофор, даже учитывая некоторые варианты среди различных видов, можно приписать свойства каждого отдельного фитохрома другим фитохромам. (44) Более конкретно, в его нормальном состоянии Pr, этот билипротеин поглощает свет при максимуме 650-670 нМ; в то время как при активации красным светом он превращается в Pfr с максимумом поглощения 730 нМ.
Описание и очистка фитохрома AFA
AFA-фитохром, несмотря на то, что он имеет относительно уникальную структуру, имеет билипротеин в качестве его хромофора, который поглощает свет в красном/дальнем красном спектре. Для установления его структуры и видов активности, авторы настоящего изобретения очистили фитохром с помощью следующего протокола:
- Суспендировать 1 г экстракта в 10 мл 1 K-фосфатного буфера, pH 7,0.
- Встряхивать два раза в течение 1 мин с половиной их объема.
- Инкубировать клетки в течение 35' с 2% Triton X 100.
- Центрифугировать при 28000 об/мин в течение 16-18 ч.
- Собрать супернатант на пошаговом градиенте плотности сахарозы.
- Центрифугировать градиент с использованием роторов с корзинами при 150000 g в течение 12 ч.
- Хранить при -20°С.
Фитохром соответствует полосе лизата с насыщенным оранжевым цветом, которая является видимым при приблизительно 1 M сахарозы, в то время как фикобилисома находится приблизительно на уровне 0,75 M. Эта взаимосвязь двух полос также обеспечивает надежный показатель молекулярной массы фитохрома, присутствующего в водорослях, которая приблизительно 4 раза превышает молекулярную массу тримерного AFA-PC: последняя составляет 121 кДа, ММ AFA-фитохрома можно предварительно определить на уровне 480 кДа (фиг.15).
Протестированный по его свойствам в отношении поглощения света, фитохром показывает поглощение света с двумя пиками при 672 нМ и 694 нМ, которые соответствуют соответственно формам Pr (поглощение красного света) и Pfr (поглощение дальнего красного света) в состоянии равновесия (фиг.16).
В отношении количества фитохрома, содержащегося в AFA, первая оценка авторов настоящего изобретения дает следующий предварительный результат: 2 мг/г (или 0,2% DW). В отношении экстрактов, концентрация возрастает до приблизительно 0,5% в основном экстракте и приблизительно до 1% в экстракте B.
Антиоксидантная активность
Было показано, что очищенный AFA-фитохром является очень мощным антиоксидантом. Инкубация образцов плазмы человека в течение 2 ч со 100 мкМ окислителем CuCl2 приводит к повышенным уровням малондиальдегида (MDA), позднего побочного продукта пероксидации липидов, который измеряют с помощью спектрофотометра при 535 нм после реакции с тиобарбитуровой кислотой (TBA тест). Когда плазму инкубируют в течение 2 ч при 37°C со 100 мкМ CuCl2 совместно с возрастающими количествами AFA-фитохрома (2-16 нМ), экстрагированного из водорослей AFA, можно наблюдать очень сильное зависимое от дозы снижение уровней MDA (фиг.17). В действительности, авторы настоящего изобретения получили практически полное ингибирование липопероксидации, с уровнями MDA, близкими к контролю, всего только с 16 нМ фитохрома AFA. Примечательно, что IC50 3,6 нМ в 45 раз меньше, чем IC50, полученная для PCB. Нет сомнений, что фитохром, описанный в настоящем документе, ответственен за более высокую антиоксидантную активность, выявленную для основного экстракта, по сравнению с AFA-PC.
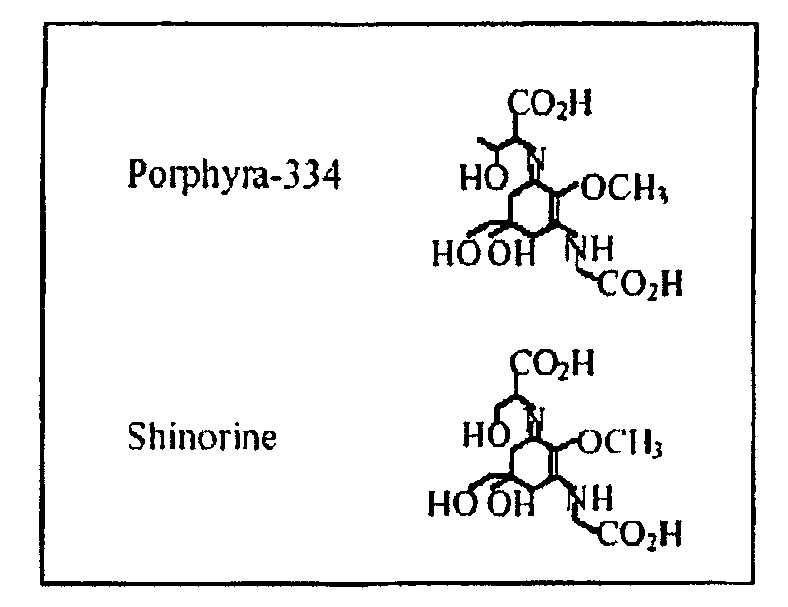
B) Идентификация "микоспоринподобных аминокислоты" (MAA) кламатских водорослей
MAA представляют собой водорастворимые соединения, характеризующиеся хромофором циклогексеноном или циклогексенимином, конъюгированным с атомом азота, замещающим аминокислоту или ее аминоспирт (как показано на фиг.4).
Они обладают максимумом поглощения, варьирующим от 310 до 360 нм, и средней молекулярной массой приблизительно 300 (4). MAA представляют собой пассивные солнцезащитные фильтры, предпочтительно поглощающие УФ-фотоны с последующим рассеянием поглощенной энергии облучения в форме безвредного тепла без создания фотохимических реакций, и таким образом, защищающие, по меньшей мере частично, фотосинтез и рост фототропных организмов. Помимо наличия роли в УФ-скрининге, было показано, что некоторые MAA также показывают антиоксидантные свойства, действуя в качестве уборщиков фотодинамически образованных реакционно-способных частиц кислорода в организме (5).
Авторы настоящего изобретения тестировали наличие MAA в cyanophyta Aphanizomenon flos-aquae и их экстракте. В то время как большинство цианобактерий, описанных в настоящее время, содержат shinorine в качестве их основных MAA; авторы настоящего изобретения выявили редкий случай porphyra-334 в качестве основной MAA в Aphanizomenon flos-aquae в дополнение к небольшому количеству shinorine.
Экстракция, очистка и количественное определение MAA
MAA экстрагировали, как описано ранее (6). В кратком изложении, 20 мг порошка AFA или 20 мг экстракта экстрагировали 2 мл 20% (об./об.) водного метанола (для применения в ВЭЖХ) посредством инкубации на водяной бане при 45°C в течение 2,5 ч. После центрифугирования (5000 g; GS-15R Centrifuge, Beckman, Palo Alto, USA), супернатант выпаривали до высыхания и повторно растворяли в 2 мл 100% метанола, встряхивали в течение 2-3 мин и центрифугировали при 10000 g в течение 10 мин. Супернатант выпаривали и экстракт повторно растворяли в том же объеме 0,2% уксусной кислоты для анализа ВЭЖХ или в 200 мкл фосфатного буфера (PBS) для оценки антиоксидантных свойств. Образцы фильтровали через фильтрационные шприцы с размером пор 0,2 мкм (VWR International, Milan, Italy), а затем подвергали анализу ВЭЖХ, или тесту антиоксидантных свойств (см. ниже).
MAA AFA и их экстрактов имеют максимум поглощения 334 нм. Последующую очистку MAA проводили с использованием системы ВЭЖХ (Jasco Corporation, Tokyo, Japan), оборудованной колонкой Alltima C18 и ограничителем (4,6×250 мм Ld., упаковка 5 мкм, Alltech, Milan, Italy), в соответствии с литературой (7). Длина волны для детекции составляла 330 нм; подвижная фаза представляла собой 0,2% уксусную кислоту со скоростью потока 1,0 мл мин-1. Идентификацию MAA проводили посредством сравнения спектров поглощения и времени удержания со стандартами, такими как Porphyra и Pterocladia sp., главным образом, содержащими porphyra-334, shinorine и palythine, любезно предоставленными Dr Manfred Klisch, Friedrich-Alexander-Universitat, Erlangen, Germany. Спектры поглощения образцов измеряли при от 200 до 800 нм в однолучевом спектрофотометре (DU 640, Beckman, Palo Alto, USA). Необработанные спектры переносили в компьютер и математически обрабатывали для анализа пиков MAA.
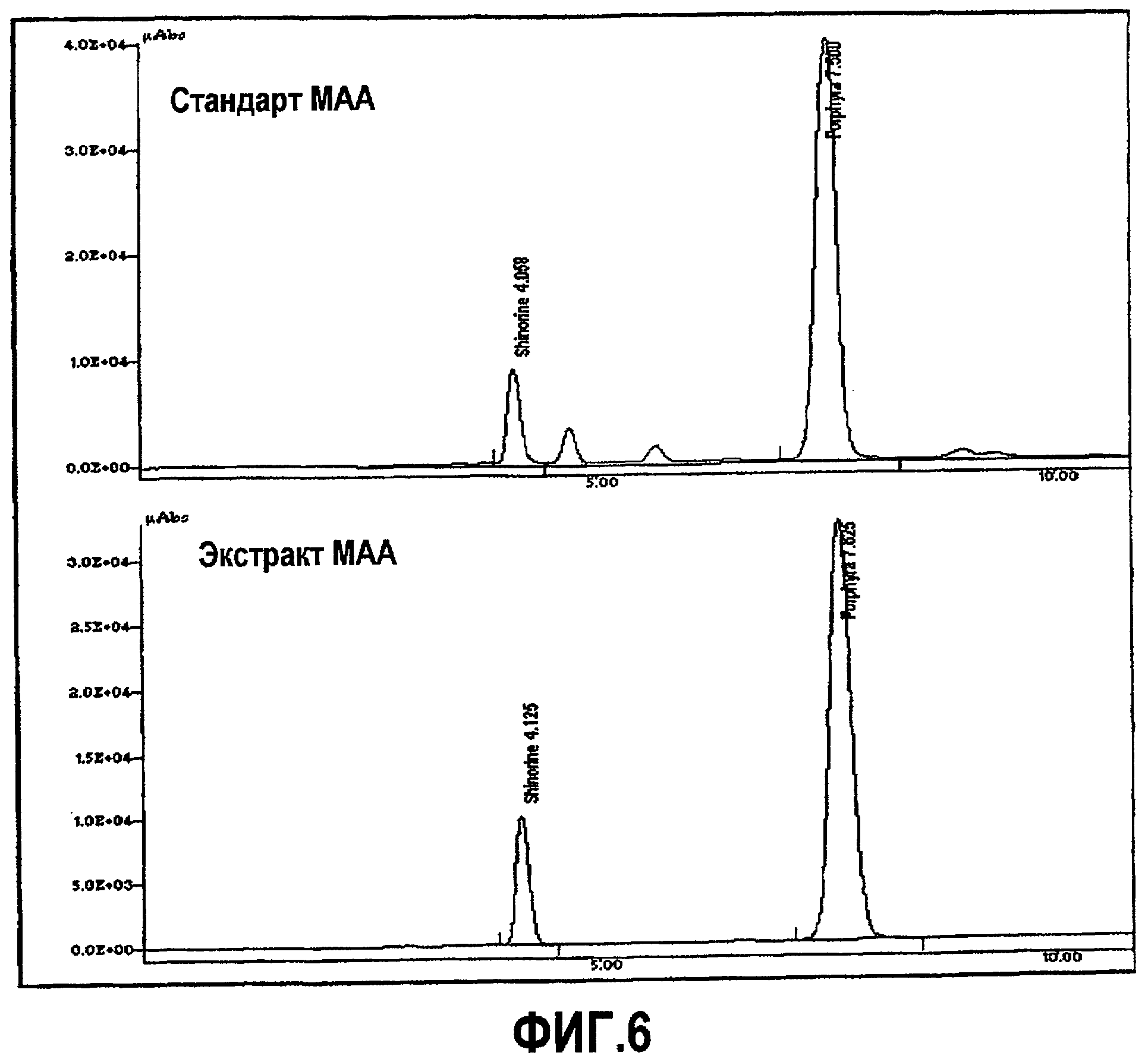
MAA частично очищали из образца AFA и из экстракта, как описано ранее. Экстракция образцов 20% метанолом при 45°C в течение 2,5 ч приводила к заметному пику при 334 нм (MAA); даже если в этом процессе также экстрагировали небольшие количества фотосинтетических пигментов (таких как фикоцианин при 620 нм) (см. следующую фигуру, пунктирная линия). Образцы MAA далее обрабатывали 100% метанолом в целях удаления белков и солей и в конце 0,2% уксусной кислотой для удаления неполярных фотосинтетических пигментов. Полученные частично очищенные MAA имеют максимум поглощения при 334 нм (фиг.5, сплошная линия).
Последующий анализ и очистку MAA проводили посредством ВЭЖХ с целью выявления того, являлись ли соединения, поглощающие при 334 нм, одной MAA или смесью более чем одной MAA. Хроматограмма образца (фиг.6) показывает наличие двух MAA со временем удержания 4,2 (пик 1) и 7,6 мин (пик 2), которые были идентифицированы как shinorine и porphyra-334, соответственно. Porphyra-334, по-видимому, является основной MAA в AFA, поскольку shinorine была представлена только в небольших количествах (соотношение площадей пиков 1:15).
УФ-спектры очищенных MAA подтвердили их максимум поглощения при 334 нм (фиг.7). Учитывая, что коэффициенты молярной экстинкции при 334 нм для shinorine и porphyra-334 составляют 44700 и 42300 M-1 см-1, соответственно, авторы настоящего изобретения вычислили:
a) для кламатских водорослей, концентрации 0,49 мг г-1 DW для shinorine и 7,09 мг
г-1 DW для porphyra-334; общее содержание MAA, таким образом, равно 0,76% DW водорослей;
b) для экстракта, концентрации 17-21 мг для MAA (т.е. 1,7-2,1% DW).
Эти данные являются существенными, поскольку целые водоросли AFA содержат высокий постоянный уровень MAA (0,76% DW), близкий к максимальной концентрации, встречающейся под воздействием УФ, т.е. 0,84% (8). Также, авторы настоящего изобретения выявили, что экстракт имеет значительно более высокую концентрацию, чем целые водоросли, достигая уровней, которые значительно превышают максимальную потенциальную концентрацию.
MAA (shinorine и porphyra-334 в экстракте) являются структурно простыми молекулами, с молекулярной массой 300. Это позволяет этим водорастворимым молекулам легко проникать через различные барьеры, от мембраны кишечника до гематоэнцефалического барьера, подтверждая их способность проявлять их антиоксидантную активность, где это необходимо, от кишечника до головного мозга.
Оценка антиоксидантного эффекта MAA
Для оценки антиоксидантных свойств MAA, содержащихся в экстракте, образцы эритроцитов человека инкубировали в течение 3 ч при 37°C с возрастающими количествами MAA (5-80 мкМ) совместно со 100 мМ AAPH для индукции образования цепи свободных радикалов с последующим окислением мембранных фосфолипидов с параллельным повышением гемолиза эритроцитов, измеренного посредством дозирования гемоглобина с раствором Драбкина (33). Результаты представлены на фиг.18, где можно видеть, каким образом MAA вызывают зависимое от дозы снижение гемолиза эритроцитов, индуцируемое AAPH, таким образом, защищая клетки от окислительного повреждения.
Таким же образом, инкубация образцов плазмы с окислителем (CuCl2 100 мкМ) приводит к повышенным уровням малондиальдегида (MDA), позднего побочного продукта пероксидации липидов, который измеряют с помощью спектрофотометра при 535 нм после реакции с тиобарбитуровой кислотой (тест TBA). Когда плазму инкубируют в течение 2 ч при 37°C с 100 мкМ CuCl2 совместно с возрастающими количествами MAA (5-80 мкМ), экстрагированными из кламатских AFA, можно наблюдать зависимое от дозы снижение уровней MDA, как показано на фиг.19. С концентрацией MAA, равной 80 мкМ, получают уровни MDA, очень сходные с уровнями не окисленной плазмы (контроль).
Оба теста позволяют утверждать, что MAA из AFA являются истинными антиоксидантными молекулами, что делает экстракт более мощным в качестве уборщика свободных радикалов, помимо молекул, образованных из их фикоцианинов.
C) Определение дополнительных синергических факторов, которые делают экстракт более эффективным, чем фикоцианины, находящиеся в нем.
Кламатские водоросли AFA содержат широкий набор питательных веществ, обладающий различными функциональными видами активности. В частности, кламатские водоросли и экстракт содержат важные активные компоненты, такие как хлорофилл; бета-каротин и другие каротиноиды провитамина A; ксантофильные каротины, такие как кантаксантин; антиоксидантные витамины и минералы.
Хлорофилл
В последние несколько лет произошло значительное продвижение в исследованиях молекулы хлорофиллина (CHLN), которая представляет собой полусинтетический аналог хлорофилла (CHL). Различные исследования продемонстрировали значительные антиоксидантные свойства CHLN, значительно более высокие, чем для обычных антиоксидантов (витамины C и E, GSH, и т.д.), в частности в отношении важных органов, таких как печень и головной мозг (9). Антиоксидантное свойство ассоциировано с конкретным противовоспалительным свойством, вследствие способности CHLN селективно ингибировать COX-2 (10). Способность хлорофиллов селективно ингибировать COX-2, совместно с такой же способностью фикоцианинов, делает экстракт особенно эффективным в качестве природного противовоспалительного средства. Также это помогает объяснить тот факт, что экстракт является более эффективным ингибитором COX-2, чем фикоцианины, содержащиеся в нем.
В более общем смысле, было показано, что CHLN показывает антимутагенные (11) и антипролиферативные свойства в отношении различных типов опухоли, таких как опухоли печени (12), молочной железы (13) и толстого кишечника (14). Поскольку фикоцианины также обладают существенными антипролиферативными свойствами, одновременное наличие обеих молекул делает экстракт потенциально значимым противоопухолевым продуктом.
Даже несмотря на то, что большинство исследований проводили на полусинтетическом CHLN, с учетом близкого сходства двух молекул, те же свойства можно отнести также к природному хлорофиллу. В действительности, когда сравнивали антипролиферативную способность двух молекул, было показано, что природный CHL является значительно более эффективным, чем CHLN; и при более низких концентрациях (15).
Антиоксидантная, противовоспалительная и антипролиферативная синергия фикоцианинов и хлорофилла приводит к значительному превосходству кламатского экстракта AFA, принимая во внимание, что в кламатских водорослях концентрация хлорофилла является одной из наиболее высоких в природе, с минимумом 1% (в противоположность максимальной концентрации 0,3% для растений, наиболее обогащенных хлорофиллом, таких как пырей и другие травы).
Способ количественного определения хлорофилла a в водорослях AFA основан на экстракции пигмента в органическом растворителе после разрушения клеток водорослей и последующем спектрофотометрическом определении, как рассмотрено в литературе (16). После применения различных типов органических растворителей, авторы настоящего изобретения выявили, что метанол обладает наилучшей способностью к экстракции. Образец (100 мг AFA REFRACTANCE WINDOW 2 MESH 122/071005) суспендировали в 10 мл 100% метанола, гомогенизировали посредством механического гомогенизатора Поттера в течение 3' и оставляли на вращающейся плите в течение 24 ч при комнатной температуре в темноте.
Затем полученный экстракт центрифугировали при 3000 об/мин в течение 5' при 4°C; супернатант собирали и дозировали, в то время как осадок снова ресуспендировали в 10 мл 100% метанола для экстракции во второй раз. После 24 ч при комнатной температуре, экстракт центрифугировали при 3000 об/мин в течение 5' при 4°C, супернатант собирали и дозировали, в то время как осадок снова ресуспендировали в 10 мл 100% метанола для экстракции в третий раз. Концентрацию хлорофилла a в трех экстрактах метанола вычисляли посредством следующего уравнения Porra (17), с помощью пигмента, имеющего характерный пик поглощения при 664 нм.
Хлорофилл a (мкг/мл)=16,29 × Abs664
При первой экстракции, авторы настоящего изобретения получили концентрацию хлорофилла a 96,11 мкг/мл; с концентрациями при второй и третьей экстракциях 4,63 и 0,68 мкг/мл. Общее содержание хлорофилла a в образце AFA, таким образом, составляет 101,42 мкг/мл, или 10,14 мг/г DW (1,014% DW).
С использованием тех же способов, которые описаны выше, авторы настоящего изобретения выявили, что в основном экстракте происходит приблизительное снижение содержания хлорофилла 50%, с концентрацией, таким образом, приблизительно 0,5%.
Каротины
Кламатские водоросли обладают высоким содержанием каротинов, выраженным в бета-каротине. Более того, они содержат широкий спектр каротинов, как предшественников, так и непредшественников витамина A. Среди непредшественников, кламатские водоросли обладают особенно значительным содержанием кантаксантина:
Указанные выше числа представляют собой средние значения для различных тестов на различных партиях продукта за несколько лет. Концентрация каротинов в основном экстракте значительно снижена, хотя она остается значительной. В большой степени, каротины в водорослях и их экстракте хорошо ассимилируются организмом человека, поскольку их источником является природный источник пищи, который не обладает ни какой-либо целлюлозной мембраной, ни другими факторами, которые в распространенных растениях частично ингибируют ассимиляцию. Ретинол плазмы представляет собой активную форму витамина A, и показано, что он обладает важными антиоксидантными свойствами и способен защищать различные системы организма человека, от глаза до печени, от полости рта до нервной системы (18).
Особенно интересным является содержание кантаксантина, каротиноида, обладающего антиоксидантным действием, превышающим сам бета-каротин, относительно ROS (19), и промежуточного соединения между бета-каротином и ликопеном (максимальный эффект) и лютеином и зеаксантином (минимальный эффект) в отношении синглетного кислорода (20). Кантаксантин также обладает выраженными антилипопероксидативными свойствами (21), синергичными с теми же свойствами фикоцианинов и хлорофилла, содержащегося в водорослях и их экстракте. Эта синегрия помогает объяснить факт, что экстракт, с точки зрения антиоксидантной и противовоспалительной активности, является более эффективным, чем очищенные фикоцианины, содержащиеся в нем.
Тестирование основного экстракта против AFA-фикоцианинов и PCB.
Ингибирование основным экстрактом образования TBARS при окислительном повреждении CuCl2
Антиоксидантную силу экстракта, со стандартизованным содержанием PC AFA, сравнивали с силой самого очищенного PC, а также с силой очищенного хромофора фикоцианобилина (PCB), активной простетической группы PC. Тесты на образование малонилдиальдегида (MDA), образующегося при окислении плазмы посредством CuCl2, показывают, что экстракт обладает более высокой антиоксидантной силой, чем чистый PC и его хромофор PCB, вследствие наличия в целом экстракте других активных антиоксидантных молекул; в то время как PC и PCB обладают сходной антиоксидантной способностью, со степенью ингибирования образования MDA 30-40% в концентрации 100 нМ, основной экстракт, со сходной концентрацией 100 нМ PC приводит к степени ингибирования вплоть до 89% (фиг.20).
Также при образовании конъюгированных диенов после окисления плазмы посредством CuCl2 основной экстракт в концентрации 100 нМ PC обладает антиоксидантной способностью, значительно превышающей чистый PC в той же концентрации 100 нМ. На фиг.21 в действительности показано, что, в противоположность чистому PC, в случае экстракта, образование конъюгированных диенов частично ингибируется. Снова, это показывает, насколько основной экстракт является значительно более эффективным, чем чистый PC, очевидно вследствие наличия в нем других активных молекул, в частности AFA-фитохрома.
Ингибирование предварительно инкубированным основным экстрактом образования TBARS при окислительном повреждении посредством CuCl2
Когда экстракт AFA предварительно инкубировали с образцами плазмы человека, с последующей инкубацией тех же образцов с окислителем CuCl2 при 100 мкМ, окисление липопротеинов, при измерении по продукции ранних побочных продуктов, конъюгированных диенов, посредством спектрофотометра при 245 нм, значительно снижалось зависимым от дозы образом. Прогрессирующее уменьшение окисления, окисления, которое, более того, развивается после первой lag-фазы, в которой образование диенов ингибируется экстрактом, достигает уровня практически полного ингибирования при концентрации PC только 150 нМ в экстракте (фиг.22).
Окисление липидов плазмы CuCl2 также приводит, на более поздней стадии, к образованию малонилдиальдегида или MDA. Предварительная инкубация плазмы с экстрактом AFA также приводит к зависимому от дозы снижению уровней MDA, настолько сильному, что при концентрации PC только 100 нМ авторы настоящего изобретения получили значения MDA, полностью сравнимые со значениями не окисленной или контрольной плазмы (# p<0,05) (фиг.23).
Оценка ORAC основного экстракта
Для оценки антиоксидантной способности экстракта с помощью теста ORAC, авторы настоящего изобретения использовали те же способы, которые они использовали для тестирования ORAC для PC и PCB. В целях тестирования как водорастворимых, так и жирорастворимых компонентов экстракта AFA, авторы настоящего изобретения сначала получили два растворимых в воде и липидах экстракта, следующим образом.
Получение водорастворимого экстракта
- Взвесить 10 мг экстракта в 1 мл дистиллированной воды и гомогенизировать в течение 1 мин посредством механического гомогенизатора Поттера.
- Центрифугировать при 2500 об/мин в течение 10' при 4°С для удаления клеточного дебриса.
- Собрать супернатант и ресуспендировать осадок в 1 мл воды.
- Гомогенизировать в течение 1 мин посредством механического гомогенизатора Поттера.
- Центрифугировать при 2500 об/мин в течение 10' при 4°С.
- Собрать супернатант и смешивать с супернатантом, полученным при первой водной экстракции.
- Сохранить водный экстракт (синего цвета вследствие наличия PC) при +4 - 20°С.
Получение жирорастворимого экстракта
Ресуспендировать осадок, полученный при предшествующей экстракции в 1 мл ацетона.
- Гомогенизировать в течение 1 мин посредством механического гомогенизатора Поттера.
- Центрифугировать при 2500 об/мин в течение 10' при 4°C.
- Собрать супернатант и ресуспендировать осадок в 1 мл ацетона.
- Гомогенизировать в течение 1 мин с помощью механического гомогенизатора Поттера.
- Центрифугировать при 2500 об/мин в течение 10' при 4°C.
- Собрать супернатант и смешивать с супернатантом, полученным при первой экстракции ацетоном.
- Сохранить липофильный экстракт (оранжевого цвета вследствие присутствия каротинов) при +4 - 20°С.
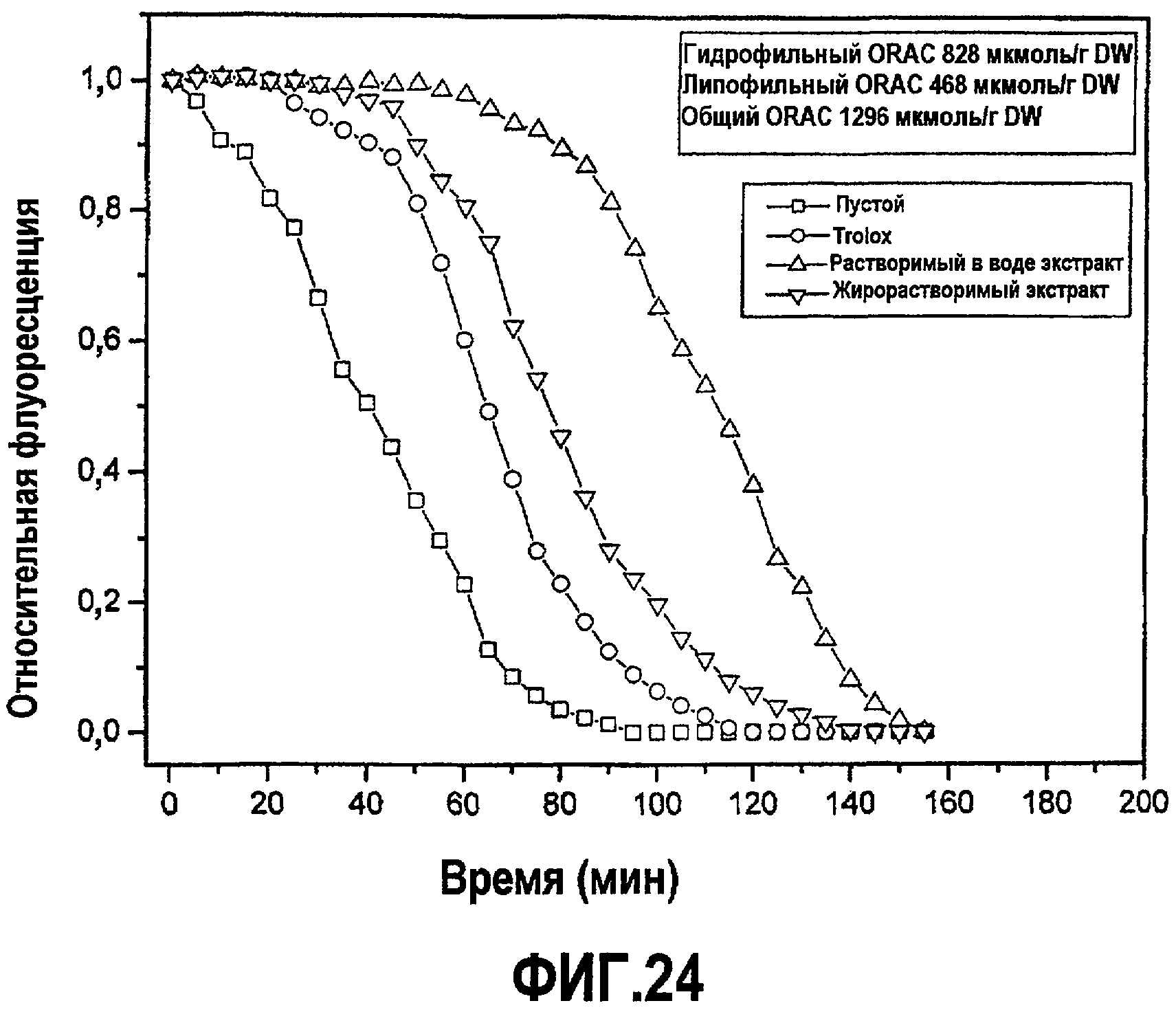
На фиг.24 представлено затухание флуоресценции, вызванное AAPH в отсутствие (пустые) и в присутствии двух экстрактов относительно контрольного стандартного Trolox. Исходя из измерения площадей под кривой, авторы настоящего изобретения получили ORAC для водорастворимого экстракта 828 мкмоль Trolox экв/г сухой массы; и для жирорастворимого экстракта 468 мкмоль Trolox экв/г сухой массы. Это означает, что общая способность ORAC составляет 1296 мкмоль Trolox экв/г сухой массы.
Исследования in vivo
Эффект на добавку водорослей AFA и экстракта AFA на уровни в плазме MDA, GSH и ретинола у здоровых субъектов.
Следующее исследование проводили для состава, главным образом, на основе водорослей AFA и экстракта водорослей AFA. Даже несмотря на то, что он также содержал желудочно-кишечные факторы, такие как lactobacillus acidophilus и протеолитические ферменты, антиоксидантная активность свойственна, главным образом, факторам водорослей.
В исследовании участвовали восемь относительно здоровых субъектов в качестве свободных добровольцев: 4 мужчины и 4 женщины, возраст от 23 до 63, в клиническом анамнезе которых не было показано какой-либо предшествующей тяжелой желудочно-кишечной, гликемической или иной патологии. Ни один из субъектов не следовал какой-либо конкретной диете или ограничению калорий, ни один из них не был вегетарианцем, и в ходе дополнения не предполагалась модификация приема пищи или стиля жизни.
Перед началом исследования, участников подвергали медицинскому анализу и оценке их медицинского анамнеза, которые по большей части показали наличие только некоторых заболеваний, предположительно нейровегетативного характера, распространенных в популяции, таких как эпизоды диспепсии, основные желудочно-кишечные нарушения, эпизодические головные боли, ощущение тяжести после приема пищи, эпизодические случаи боли в суставах, некоторые случаи предменструального синдрома.
Питательный состав, используемый в исследовании, вводили в "0" растительных капсулах, содержащих 500 мг порошка, имеющего следующий состав: водоросли озера Кламат AFA, 200 мг; экстракт AFA, 100 мг; Lactobacillus Acidophilus DDS-1 (10 миллиардов КОЕ/г), 100 мг; ферментированные мальтодекстрины с протеолитической активностью, 100 мг. Каждый участник, начиная с 0 суток, принимал 9 капсул в сутки, по 3 капсулы с каждым приемом пищи.
Образцы крови забирали в гепаринизированные вакуумные контейнеры в 0 момент времени, через 1 месяц и через 3 месяца, и каждый образец разделяли на две части. Одну часть анализировали в Analytical Laboratory of the Hospital of Urbino в отношении наиболее распространенных параметров: эмокромоцитометрическое исследование с помощью автоматической системы и элемента COULTER (импеденциометрического), белкового и липидного анализа с помощью автоматической системы и сухой химической обработки, ферментативного теста в отношении функционирования печени, сердца и почек, профиля щитовидной железы посредством автоматизированных инструментов на основе иммунофелометрии и хемилюминесценции, иммунофенотипирования лимфоцитов посредством проточной цитометрии.
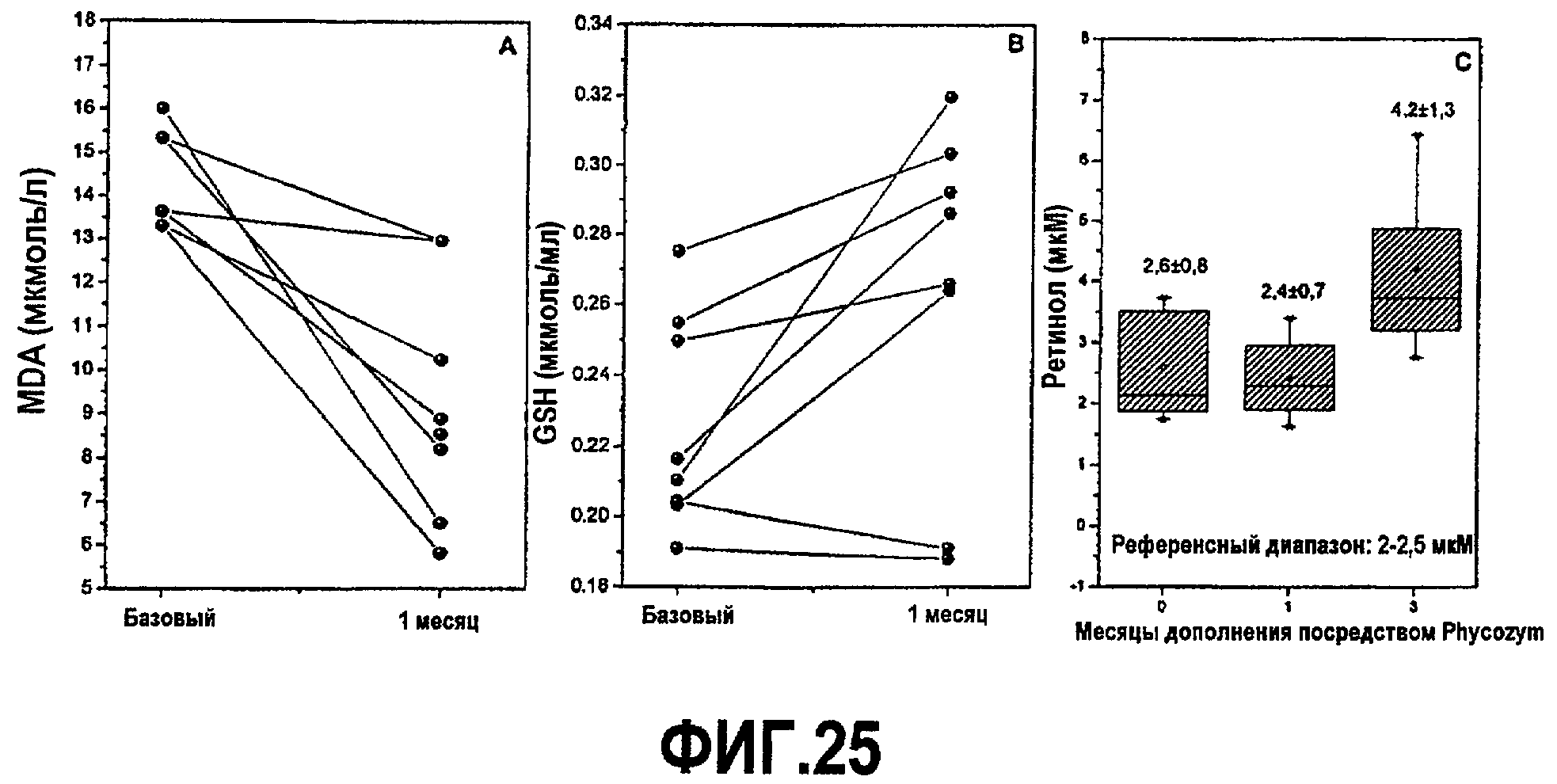
В другой части образец крови использовали для тестирования уровней липопероксидации посредством измерения MDA и восстановленного антиоксидантами глутатиона (GSH), витамина E (α-токоферола) и витамина A (ретинола). Образцы крови обрабатывали центрифугированием при 3000 об/мин в течение 10 минут при +4°C, и плазму, полученную таким образом, хранили при -20°С для применения следующим образом. Плазматический MDA измеряли с помощью спектрофотометра при 535 нм в соответствии со способом TBARS (реагирующие с тиобарбитуровой кислотой вещества) (28). Дозировка GSH была основана на способности GSH восстанавливать дисульфид DTNB (5,5'-дитиобис-2-нитробензойную кислоту) (29). В его восстановленной форме, DTNB (c.e.m. 13600 M-1 см-1) проявляет насыщенный желтый цвет, который измеряют при 412 нм. Уровни α-токоферола и ретинола в плазме определяли посредством ВЭЖХ (Jasco Corporation, Tokyo, Japan), как описано в (30) с использованием колонки Alltima C18 (5 мкМ, 250 мм × 4,6 мм i.d.; Alltech, Italia), с предшествующей предколонкой Alltech (7,5×4,6 мм i.d.). Хроматографические профили анализировали с помощью программного обеспечения Borwin 1.5 (Jasco Corporation, Tokyo, Japan). Результаты, полученные для трех тестируемых параметров в отношении окислительного/антиоксидантного состояния субъекта, представлены на фиг.25.
Важным является тот факт, что высоко положительные результаты в отношении антиоксидантного статуса и в отношении липопероксидации, полученные при дополнении продуктом, были получены без введения каких-либо модификаций диеты или образа жизни. AFA-фикоцианины, фитохром и MAA, находящиеся в водорослях AFA и далее сконцентрированные в экстракте AFA, также представляют собой эффективный положительный контроль в качестве уборщика свободных радикалов, и благодаря высокому уровню хлорофилла, каротиноидов и других антиоксидантных витаминов и минералов, присутствующих в водорослях AFA и их экстракте, продукт представляет собой сильный усилитель общей антиоксидантной активности в организме человека. Результаты можно обобщить следующим образом:
a) происходит очень высокое среднее повышение ретинола в плазме, а именно +60%, после 3 месяцев дополнения;
b) происходит выраженное снижение уровней в плазме MDA (-35,5%), одного из наиболее существенных маркеров липопероксидации. Этот результат строго подтверждается in vivo, очень значительные результаты in vitro показаны выше;
c) общая антиоксидантная защита, обеспечиваемая продуктом, также способствовала образованию организмом значительного повышения эндогенного GSH (+16,8%).
Эффекты дополнения продуктом на основе AFA и экстракта AFA у пациентов, подвергающихся гипербарическому лечению.
Гипербарическую кислородную терапию успешно используют для лечения нескольких клинических состояний, таких как заболевания вследствие декомпрессии, интоксикация монооксидом углерода, газовая эмболия и тканевые инфекции. Воздействие гипербарического кислорода, в действительности, приводит к благоприятному повышению кислорода, растворенного в крови. Кроме того, совместно с благоприятным действием, также может происходить повышение циркулирующих ROS (реакционно-способных частиц кислорода), которые могут повреждать клетки и ткани, если они не защищены достаточными антиоксидантными защитами (34). Это является причиной того, что у пациентов, подвергающихся гипербарической терапии, как правило, проводят дополнение антиоксидантными витаминами.
Для оценки эффектов составов на основе AFA и кламатских экстрактов AFA на окислительный стресс, индуцируемый гипербарической терапией, в исследование были включены 9 пациентов "Centro di Terapia Iperbarica" of Fano (Italy). Среди 9 пациентов было 5 мужчин и 4 женщины, в возрасте между 16 и 73 лет, и страдающих различными патологиями, такими как аспетический остеонекроз бедренной кости (n=5), ревматическая полимиалгия (n=1) и остеомиелит бедренной и большеберцовой костей (n=3).
Этим пациентам проводили дополнение тем же продуктом, что описан выше. Начиная с первого гипербарического сеанса, пациенты начинали принимать 6 капсул в сутки, разделенные между тремя приемами пищи.
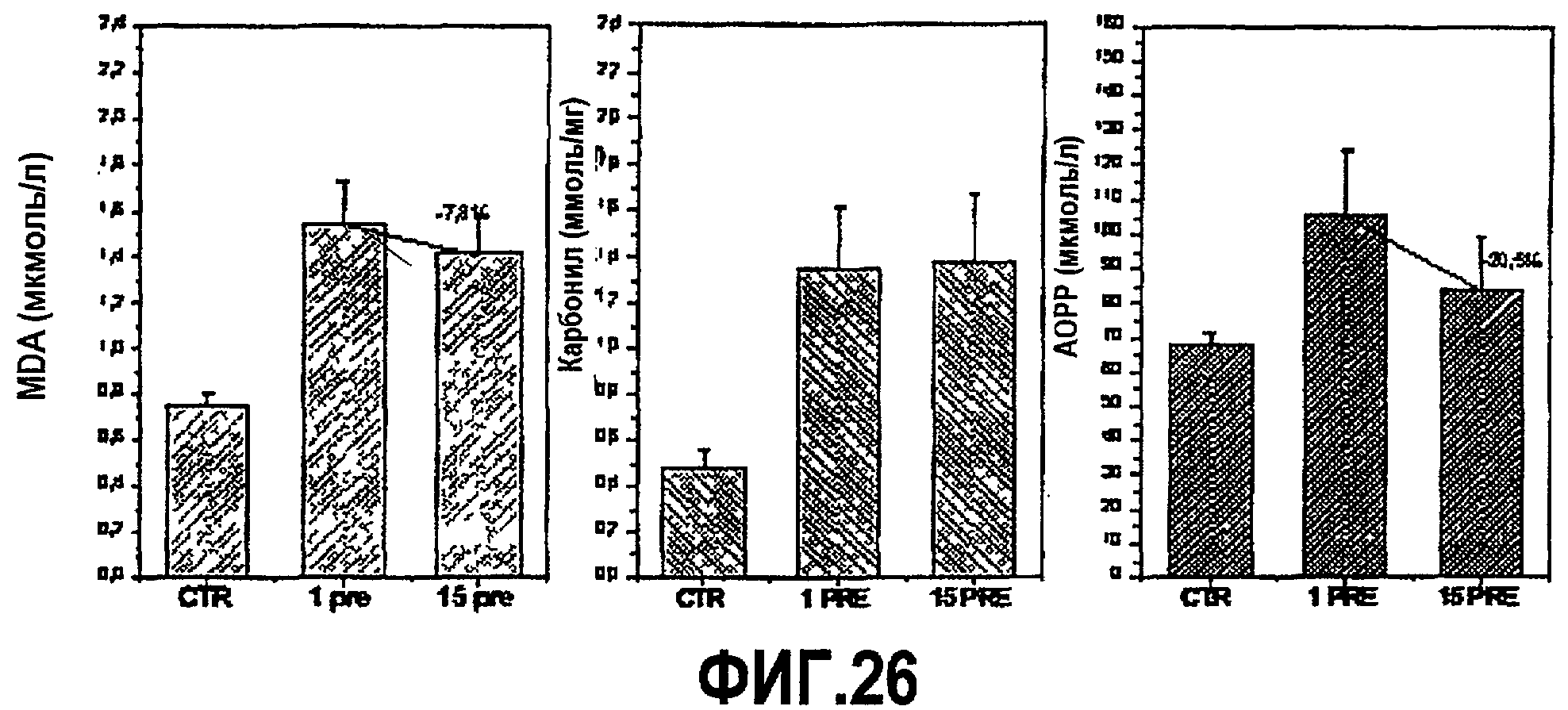
Сбор образцов крови от каждого пациента проводили непосредственно перед гипербарическими сеансами и после 1 и 15 гипербарических сеансов. Затем образцы оценивали в отношении содержания в них некоторых маркеров окисления, таких как MDA, карбонилы, AOPP, а также тиолы плазмы, жирорастворимые витамины и непосредственно общий уровень антиоксидантов в плазме.
Результаты показывают, что пациенты, у которых проводили дополнение составом, гипербарическое лечение не приводит к какому-либо повышению окислительных маркеров даже после 15 сеансов (фиг.26). В действительности, с учетом того, что обычно происходит значительное повышение этих маркеров при прохождении терапии, здесь в действительности видно снижение на 7,8%, от 1 до 15 сеанса, уровней MDA (липопероксидации), со значениями от 1,54±0,17 мкмоль/л (1 сеанс) до 1,42±0,16 мкмоль/л (15 сеанс) (p<0,05); 20,5% снижение AOPP (поздние побочные продукты окисления белков), со значениями от 105,7±18,8 мкмоль/л (1 сеанс) до 84,0±15,5 мкмоль/л (15 сеанс) (p<0,05); в то время как карбонилы белков (ранние побочные продукты окисления белков) остаются неизмененными (фиг. 26).
Общий антиоксидантный профиль также сохраняется в ходе гипербарической обработки. Уровни в плазме общих тиолов (группы SH глутатиона и белков) возрастают на 8,3% (p=n.s.), со значениями от 254±18 мкмоль/л (1 сеанс) до 275±30 мкмоль/л (15 сеанс). В то же время можно видеть значимое повышение (p<0,05) общего антиоксидантного статуса в плазме, со значениями от 1,19±0,03 моль/л эквивалентов Trolox (1 сеанс) до 2,04±0,03 ммоль/л эквивалентов Trolox (15 сеанс), как представлено на фигурах фиг.27 и 28.
С учетом того, что уровни в плазме наиболее распространенных антиоксидантов (токоферолов, каротиноидов, ретинола) остаются неизменными, можно предположить, что повышение общего антиоксидантного статуса частично является следствием пополнения потребленных антиоксидантов, таких как каротиноиды и ретинол, теми же пищевыми добавками, которые представлены в составе; и посредством параллельного накопления в кровеносной системе определенных антиоксидантов водорослей, таких как фикоцианины, фотохром, MAA и хлорофилл. В общем, состав на основе AFA и экстракта AFA значительно повышает антиоксидантную защиту, эффективно защищая пациентов, подвергающихся гипербарической терапии, от повышения свободных радикалов, продуцируемых гипербарическим кислородом.
ПРОТИВОВОСПАЛИТЕЛЬНАЯ АКТИВНОСТЬ
Исследования in vitro
Ферменты циклооксигеназы (COX) катализируют первую стадию синтеза эйкозаноидов, таких как простагландины (ПГ), тромбоксаны и простациклины. Существует две различные изоформы этого фермента: COX-1 вовлечен в нормальную регуляцию гомеостаза; в то время как COX-2 ответственен за продукцию PG, которые в свою очередь запускают острое воспаление. Фикоцианины из сине-зеленых водорослей обладают мощной противовоспалительной активностью. Было показано, что фикоцианины из микроводорослей Spirulina Platensis являются эффективными селективными ингибиторами COX-2 (35), и что они ингибируют физиологическим и частичным образом каскад, который приводит от жирных кислот к образованию воспалительных эйкозаноидов (36). С учетом того, что фикоцианины из кламатских водорослей AFA отличаются от фикоцианинов из Spirulina, и что ранее не проводили тестирования их эффекта в отношении ферментов COX, авторы настоящего изобретения решили провести такое тестирование с помощью иммуноферментного набора "COX Inhibitor Screening Assay" компании Cayman. Таким образом, авторы настоящего изобретения оценивали ингибирование COX-1 и COX-2 экстрактом AFA (как растворимой в воде части в воде, так и растворимой в липидах в ацетоне; диапазон 25-200 мкг/мл); чистым PC (0,03-3 мкМ) и PCB (0-15 мкМ). Результаты представлены на фиг.29, на которой показан график процентной активности COX-1 и COX-2 при различных концентрациях экстракта AFA, PC и PCB.
Жирорастворимая фракция основного экстракта AFA селективно ингибирует COX-2 с IC50 134 мкг/мл, в то время как COX-1 возрастает. Водорастворимая фракция также селективно ингибирует COX-2 c IC50 84,5 мкг/мл; в то время как происходило только умеренное ингибирование COX-1 (30% ингибирование для 200 мкг/мл экстракта AFA).
Чистый PC действует на оба фермента, однако даже в этом случае ингибирование является предпочтительным для COX-2 относительно COX-1, причем активность в отношении COX-2 практически в 10 раз превышает активность в отношении COX-1 (IC50 0,15 против 1,1 мкМ). Наконец, хромофор PCB повышает активность COX-1 и почти не является ингибитором COX-2.
Таким образом, авторы настоящего изобретения подтвердили, что также фикоцианины кламатских водорослей AFA являются мощными противовоспалительными молекулами, обладающими способностью к значительному селективному ингибированию COX-2. Также интересно отметить, что ингибирование COX осуществляется не только водорастворимым экстрактом, содержащим фикоцианины, но также растворимым в липидах экстрактом, таким образом, указывая, что в экстракте AFA присутствуют другие молекулы.
Здесь также можно предложить некоторые сравнительный анализ соображения с исследованиями, которые были проведены на фикоцианинах из Spirulina. В исследовании Reddy et al., описано, что IC50 для фикоцианинов из Spirulina Platensis составляет 0,18 мкМ, против 0,15 мкМ для кламатских фикоцианинов. В отличие от этого небольшого отличия в пользу PC Кламат, можно подчеркнуть дополнительное и более значимое отличие. При 1 мкМ фикоцианины из Spirulina приводят к ингибированию COX-2 приблизительно 60%; в то время как кламатские фикоцианины, в той же концентрации 1 мкМ, приводят к ингибированию приблизительно 75%. Это является существенным отличием, показывающим, что фикоцианины AFA могут приводить к более быстрым и более выраженным противовоспалительным эффектам.
Также процентное ингибирование, обеспечиваемое фикоцианинами AFA, является средним между более низким уровнем PC Spirulina и более высоким уровнем лекарственных средств, таких как целекоксиб и рофекоксиб (37). Это означает, что степень ингибирования COX-2, обеспечиваемая PC кламатских водорослей, является идеальной: достаточно высокой для обеспечения быстрой и эффективной противовоспалительной активности, и, тем не менее, неполной и, таким образом, физиологической для избежания типичных сердечно-сосудистых побочных эффектов лекарственных средств.
Также очень важным является активность экстракта AFA в отношении ингибирования COX-2. Как показано на фигурах, жирорастворимый компонент обладает значительной степенью ингибирования (IC50 134 мкг/мл), хотя и более низкой, чем у водорастворимого компонента, совместно с активностью запуска стимуляции COX-1. Это приводит к интересному результату, поскольку если ингибирование COX-2 снижает образование воспалительных эйкозаноидов, стимуляция COX-1 повышает эндогенную продукцию противовоспалительных эйкозаноидов, таким образом удваивая общий противовоспалительный эффект. Это делает жирорастворимую фракцию основного экстракта AFA уникальным противовоспалительным средством, обладающим важными фармакологическими свойствами. Настоящий патент также охраняет питательное и фармакологическое применение любого жирорастворимого экстракта из кламатских водорослей.
Если затем обратить внимание на основной экстракт AFA в целом, комбинированная активность растворимых в воде и растворимых в липидах компонентов приводит к значительному ингибированию COX-2, с учетом того, что оба они действуют в качестве мощных ингибиторов COX-2; и существенное поддержание того же уровня COX-1, являющееся следствием снижения COX-1, продуцируемого водорастворимым компонентом с одной стороны (-30%), и стимуляцией COX-1, обеспечиваемой жирорастворимым компонентом (+45%). IC50 для экстракта AFA в целом составляет приблизительно 100 мкг/мл (среднее значение для двух компонентов), в то время как при дозировке 200 мкг/мл происходит ингибирование COX-2 приблизительно 75%. Это представляет собой уровень процентного ингибирования, рассмотренный выше, в отношении чистого PC, и представленная там оценка требует конкретного значения с учетом того факта, что 200 мкг/мл in vitro вероятно может соответствовать дозировке in vivo всего 600-800 мг (38). Ожидая экспериментальных подтверждений, авторы настоящего изобретения могут достоверно утверждать, что экстракт AFA в дозировках, легко достигаемых всего 1-2 капсулами/таблетками в сутки, представляет собой мощное противовоспалительное средство, обладающее терапевтическими свойствами, питательными и фармакологическими, в действительности уникальными. Эти свойства были подтверждены исследованием на животных in vivo.
Исследование in vivo
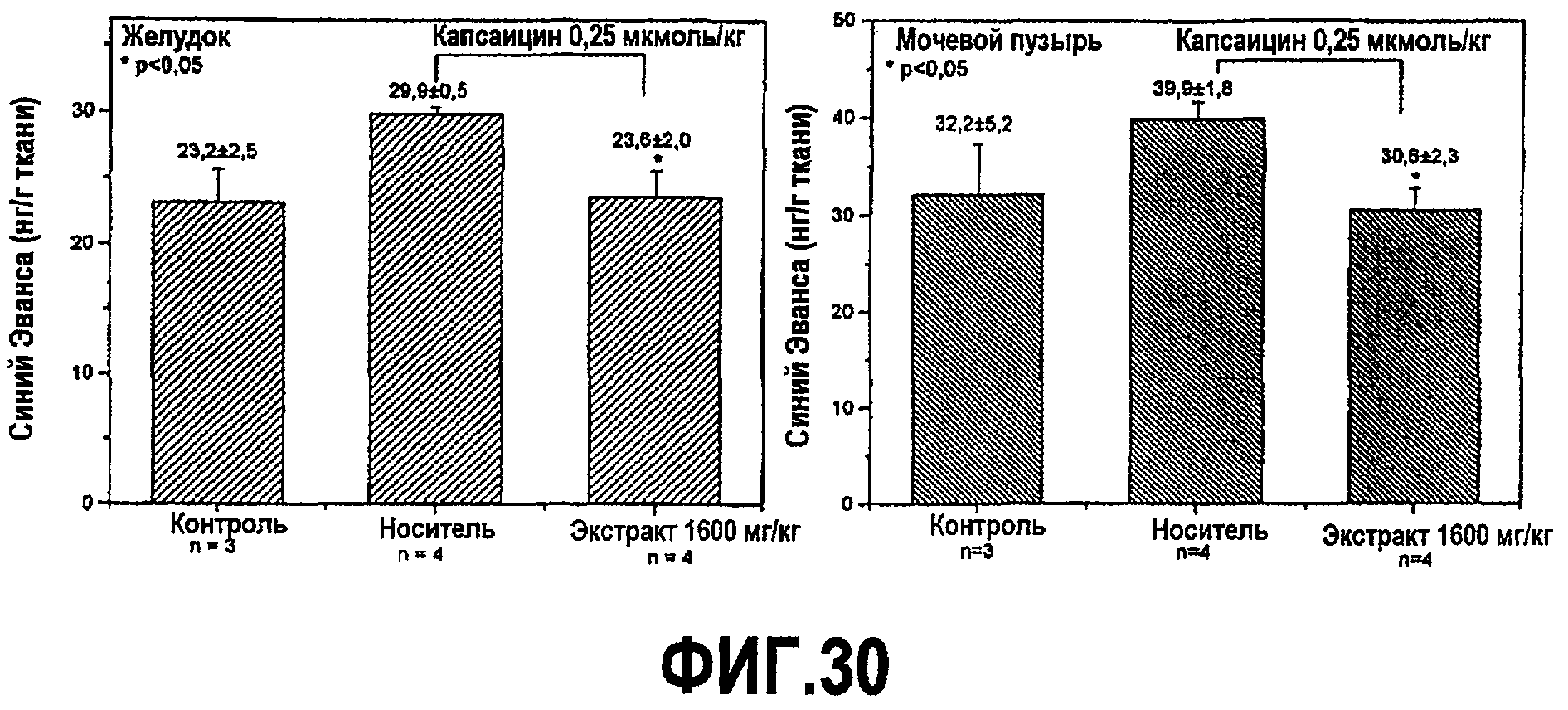
В этом исследовании авторы настоящего изобретения исследовали противовоспалительные свойства экстракта водорослей, содержащего PC (экстракта AFA) у самцов мышей-альбиносов Swiss, которых подвергали провоспалительному стимулу капсаицином 0,25 мкмоль/кг (активный компонент чилийского перца) или веществом P 2 нмоль/кг (действующим через рецепторы, ответственные за воспалительный нейрогенный ответ). Уровни воспаления в тканях измеряли посредством спектрофотометрической дозировки красителя Эванса синего, накопленного в областях воспаления вследствие выхода белков плазмы в ткани. Как показано на фиг.30, внутривенная инъекция капсаицина (0,25 мкмоль/кг) или SP (2 нмоль/кг) индуцирует и повышает выход плазмы в исследуемые ткани относительно выхода у контрольных мышей, которых не подвергали воспалительному стимулу. Предварительное введение мышам экстракта AFA (1600 мг/кг или 800 мг/кг) значительно ингибирует выход плазмы, снижая его до значений, равных в контрольной группе.
Действительно, инъекция капсаицина индуцирует повышение выхода плазмы как в желудке (23,2±0,2 против 29,9±0,5 нг EB/г ткани, p<0,05) и в мочевом пузыре (33,2±5,2 против 39,9±1,8 нг EB/г ткани, p<0,05). Предварительное введение мышам 1600 мг/кг экстракта AFA индуцирует значительное повышение выхода белков плазмы в обе ткани, со значениями 23,6±0,2 нг EB/г в желудке и 30,6±2,3 нг EB/г в мочевом пузыре.
Аналогично, инъекция SP индуцирует значимое повышение выхода плазмы в желудке (13,5±1,1 против 22,1±1,8 нг EB/г ткани, p<0,05) и в двенадцатиперстной кишке (17,2±1,2 против 24,0±1,8 нг EB/г ткани p<0,05). Предварительное введение мышам 800 мг/кг экстракта AFA снижает выход белков плазмы со значениями 20,1±1,3 нг EB/г в желудке (p=n.s.) и 16,7±1,9 нг EB/г в мочевом пузыре (p<0,05) (фиг.31).
Антипролиферативная активность
В литературе описано, что чистый PC из микроводорослей Spirulina обладает свойством значительно ингибировать рост опухолевых клеточных линий in vitro, таких как клеточные линии лейкоза (39) и макрофагальные клеточные линии (40), посредством механизма апоптоза.
Таким образом, авторы настоящего изобретения тестировали антипролиферативную активность чистого AFA-PC, с его комплексом C-PC/PEC, в отношении моноцитарно-макрофагальной опухолевой клеточной линии RAW 264,7 посредством инкубации клеток с возрастающими дозировками PC (диапазон 0-25 мкМ). Анализ жизнеспособности клеток после инкубации в течение 24, 48 и 72 ч показал, что AFA-PC обладает очень значительным зависимым от дозы и времени антипролиферативным эффектом, как следует из фиг.32.
Дерматологические и косметические свойства экстракта AFA
С учетом антиоксидантных и противовоспалительных свойств фикоцианинов и других синергичных молекул в кламатских водорослях AFA и их экстрактах, очевидно, что, помимо перорального введения для питательных и фармакологических свойств, также их можно применять местно на кожу, как для дерматологического терапевтического применения, так и для косметических целей.
Тест с окклюзионным пластырем (тест раздражения)
Как в предварительном исследовании, авторы настоящего изобретения проводили токсикологическое тестирование кламатских водорослей AFA, для установления того, что их дерматологическое применение не приводит к какой-либо токсичной или воспалительной реакции. Тест проводили в "Centra di Cosmetologia" of the University of Ferrara, Italy. "Тест с окклюзионным пластырем" проводили в целях оценки раздражающего эффекта косметического продукта при нанесении в единичной дозе на интактную кожу человека. Тест проводили на 20 здоровых добровольцах обоих полов, которые дали информированное согласие на участие в исследовании. Следующие субъекты были исключены из тестирования:
- все субъекты, которые принимали участие в сходных тестах в течение последних двух месяцев;
- все субъекты, страдающие дерматитом;
- все субъекты с аллергической кожной реакцией в анамнезе;
- все субъекты, подвергаемые терапии противовоспалительными лекарственными средствами (либо стероидными, либо нестероидными).
Тест проводили на порошке кламатских водорослей AFA. Для получения продукта для нанесения, порошок смешивали с дистиллированной водой и сразу наносили на Finn chamber (Bracco) с использованием шприца; затем его наносили на кожу предплечья или спины участников, с защитой посредством самоклеящейся ленты. Косметический продукт оставляли в контакте с поверхностью кожи в течение 48 часов, обращаясь к участникам с просьбой не мыть область, на которую нанесен продукт в течение последующих 48 часов. Удаление Finn chamber и очистку области кожи от оставшегося косметического продукта проводил экспериментатор. Оценку кожных реакций проводили через 15 мин и 24 часа после удаления Finn chambers, в соответствии со следующей шкалой:
Сумма показателей эритемы и отека определяет "индекс раздражения". Индекс раздражения через 15 мин и 24 часа регистрируют в конечном отчете. Вычисляют средний индекс раздражения для 20 тестов. Затем продукт классифицировали в соответствии со следующими параметрами:
Результаты теста на кламатских водорослях AFA, в соответствии со способами и параметрами, описанными выше, являются следующими:
"Тестируемый нанесенный продукт, разбавленный дистиллированной водой (1:10) в окклюзионных условиях на здоровой коже 20 добровольцев, привел к среднему индексу раздражения:
0,25 (ноль целых, двадцать пять сотых) через 15 минут после удаления Finn Chamber,
0,15 (ноль целых, пятнадцать сотых) через 24 часа после удаления Finn Chamber.
В соответствии с используемой шкалой оценки, продукт кламатских водорослей (Aphanizomenon Flos Aquae) можно классифицировать как: не раздражающий".
Исследования эффективности
После установления не раздражающей и нетоксичной природы водорослей в качестве косметического и дерматологического ингредиента, авторы приступили к изготовлению крема, содержащего 8% основного экстракта кламатских водорослей, для тестирования его эффективности в отношении косметических параметров, таких как эластичность, увлажнение кожи и морщины. Тест проводили случайным образом на 15 индивидах в возрасте от 30 до 65 лет. Они были выбраны не вследствие конкретных дерматологических или кожных проблем, и в действительности в отношении параметров, таких как объем морщин, тот факт, что большинство участников не имели серьезных морщин, сделал результат статистически незначимым. Тем не менее, результаты в отношении уменьшения морщин, когда морщины в действительности имелись, были совершенно очевидными. В исследовании, хотя и не оконченном по некоторым параметрам вследствие отсутствия статистической значимости, предварительный отчет строго подтверждает дерматологические и косметические свойства экстракта AFA, и, таким образом, требуются дополнительные исследования, более строго ориентированные на дерматологические и кожные проблемы. Здесь представлены способы и основные результаты исследования.
Проводили тест, сравнивающий продукт с экстрактом 8% AFA с продуктом плацебо, состоящим из той же растительной основы, но без экстракта водорослей. Авторы настоящего изобретения называют два продукта:
a) растительная эмульсия с экстрактом AFA,
b) основная растительная эмульсия.
15 добровольцев женского пола, в возрасте между 30 и 65 лет отобрали для тестирования, в соответствии с упомянутыми критериями включения:
- хорошее состояние общего здоровья;
- отсутствие дерматопатий;
- отсутствие продолжающегося фармакологического лечения;
- обязательство не менять обычный распорядок дня;
- отсутствие атопии в анамнезе.
Два продукта участники самостоятельно наносили каждый день, по одному на каждую сторону лица, следующим образом:
- на правую сторону лица (DX): растительная эмульсия с экстрактом AFA;
- не левую сторону лица (SX): основная растительная эмульсия.
Параметры, которые анализировали для этого исследования, представляли собой:
- Эластичность кожи
- Индекс увлажнения
- Профилометрия кожи
Измерение параметров проводили в соответствии со следующей схемой:
- перед нанесением продукта (T0)
- после 15 (T15) и 30 (T30) суток нанесения продукта.
Эластичность кожи
Эластичность кожи измеряли посредством CUTOMETER® SEM 575 (COURAGE + KHAZAKA electronic GmbH). Измерение эластичности проводили по шкале от 0 до 1, 1 представляет собой максимальную возможную эластичность.
Индекс увлажнения кожи
Измерение увлажнения кожи основано на международно признанном CORNEOMETER®. Здоровая кожа в нормальных комнатных условиях (20°С и 40-60% влажность воздуха) в тестируемой области должна иметь индекс увлажнения >50. Индекс увлажнения в диапазоне 35-50 соответствует сухой коже, в то время как индекс увлажнения менее 35 соответствует очень сухой коже. Эти значения являются показательными только для интерпретации результатов.
Профилометрия кожи
Посредством VISIOSCAN VC 98 для анализа поверхности кожи in vivo исследуют сокращение морщин (фиг.33). Параметры представляют собой:
- SEr: шероховатость;
- SEsc: чешуйчатость;
- SEsm: гладкость, пропорциональна ширине и форме морщин;
- Sew: морщины, пропорционален количеству и ширине морщин;
- Объем: пропорционален глубине морщин, чем более глубокими являются морщины, тем больше параметр объема.
Когда результаты на различных параметрах анализировали статистически посредством многофакторного дисперсионного анализа (ANOVA), проводимого с помощью специального программного обеспечения Statgraphic plus (версия 5.1), только для двух параметров, а именно эластичности кожи и увлажнения кожи, были получены статистически значимые результаты. Заключение, к которому пришли исследователи Pavia, которые проводили тест согласно инструкциям авторов настоящего изобретения, было следующим: "Применение активного продукта, нанесенного на правую сторону лица, вызвало статистически значимое повышение увлажнения и эластичности, относительно исходных уровней; в то время как обработка плацебо (левая сторона) не привела к значительным изменениям в ходе всего периода лечения".
В качестве заключения для указанного выше, отсутствовал статистически значимый результат профилометрии кожи. Однако это было не следствием неуспеха продукта, а следствием того факта, что большинство участников имели исходное состояние, в 0 момент времени, которое делают невозможным, с учетом того, что их кожа уже близка к оптимальному состоянию, какое-либо серьезное улучшение. Это было слабым местом исследования. Однако когда авторы настоящего изобретения провели отбор участников, которые в действительности имели состояние кожи, нуждающееся в улучшении (не попадающее в состояние дерматологической патологии), и интерпретируя результаты соответствующим образом, авторы настоящего изобретения получили следующие результаты.
Эластичность кожи
Среди 15 участников, только 12 обладали состоянием эластичности, которое было менее чем оптимальным. В действительности, с учетом индекса эластичности от 0 до 1 (1 является максимально возможным), получили диапазон значения среди участников от 0,57 до 0,98. На основании этого диапазона, авторы настоящего изобретения установили 3 вероятные категории:
от 0,9 до 1 = состояние оптимальной эластичности
от 0,75 до 0,9 = состояние средней эластичности
< 0,75 = состояние низкой эластичности.
Учитывая период обработки 30 суток, график на фигуре 34 описывает уровень улучшения в качестве перехода участников от более низкого к более высокому уровню: среди 12 проанализированных участников, в начале 4 имели низкую эластичность, и 8 имели умеренную или среднюю эластичность кожи. После 30 суток обработки, не было участников с низкой эластичностью; было только 2 участника со средней эластичностью, и оставшиеся 10 достигли высокой эластичности, с выраженным сдвигом от 0 до 10 в этой последней категории!
Увлажнение кожи
Здоровая кожа в нормальных комнатных условиях (20°С и 40-60% влажность воздуха) в тестируемой области должна обладать индексом увлажнения >50. Показатели увлажнения в диапазоне 35-50 соответствуют умеренно сухой коже, в то время как показатель <35 указывает на очень сухую кожу. Взяв эти показатели в качестве стандарта для интерпретации, в графике на фиг.35 описано улучшение, полученное в течение периода 30 суток в качестве перехода участников от более низкого уровня до более высокого уровня:
Среди 15 участников, только 1 (синий цвет) имел очень сухую кожу; 7 имели умеренно сухую кожу; 7 имели нормально увлажненную кожу. Даже несмотря на то, что только 8 из 15 нуждались в действительном улучшении, конечный результат показывает, что в конце периода обработки, не осталось участников с очень сухой кожей; количество участников с умеренно сухой кожей было снижено от 7 до 5; в то время как количество участников со здоровой увлажненной кожей изменились от 7 до 10.
Профилометрия кожи
В отношении профилометрии кожи, некоторые из тестируемых параметров не были пригодны, поскольку слишком большое число участников имели исходные или T0, близкие к незначительным. Таким образом, при изучении параметра Ser или шероховатости кожи, авторы настоящего изобретения видели, что 12 из 15 участников имели исходное значение 0,0 или полное отсутствие шероховатости кожи; и в отношении параметра SEsc или чешуйчатости кожи, 10 из 15 участников имели показатель 0,0 или полное отсутствие чешуйчатости. Таким образом, авторы настоящего изобретения ограничили оценку до двух параметров Sew, или количество и ширина морщин, и VOL, относящийся к объему морщин, измеренному в показателях глубины морщин. Даже здесь, поскольку только 7 участников для Sew и 9 для VOL имели исходные значения, требующие коррекции, а остальные имели показатели, близкие к нулю, статистическая значимость не могла быть достигнута. Тем не менее, участники, которые имели даже немного измененные показатели, обладали значимыми улучшениями, как показано на фиг.36.
Таким образом, с точки зрения снижения объема или глубины морщин, авторы настоящего изобретения получили диапазон снижения в течение периода обработки 30 суток от -18% до -65%, достижение очень значительного уровня с точки зрения улучшения объема морщин.
На фиг.37 представлено уменьшение количества морщин и ширины в течение периода обработки 30 суток, от -5% до -48%, снова значимый результат, который подтверждает заявление о потенциальной эффективности косметического крема на основе экстракта AFA в отношении морщин и, более всего, который оправдывает проведение более конкретных исследований в отношении уменьшения морщин, посредством более конкретного выбора участников, страдающих этой проблемой.
Источники информации



39(1):55-9


Реферат
Изобретение относится к фармацевтической и косметической промышленности, в частности к средству, обладающему антиоксидантными, противовоспалительными и противоопухолевыми свойствами. Водорастворимая фракция кламатских микроводорослей Aphanizomenon Flos Aquae Aquae Ralfs ex Born. &Flah. Var. flos aquae (водорослей AFA), обладающая антиоксидантными, противовоспалительными и противоопухолевыми свойствами, включающая фикобилисому, содержащую фикоцианин/фикоэритроцианин (С-РС/РЕС), фиковиолобилин (PVB), фитохром AFA, микоспоринподобные аминокислоты, хлорофилл и каротины. Выделенный биологически активный компонент водорастворимой фракции кламатских микроводорослей AFA. Композиция, содержащая водорастворимую фракцию или выделенный компонент, или их смесь. Применение водорастворимой фракции кламатских водорослей или их выделенного компонента (варианты). Вышеописанная фракция или биологически активный компонент обладают эффективными антиоксидантными, противовоспалительными и противоопухолевыми свойствами. 8 н. и 8 з.п. ф-лы, 37 ил., 2 табл.
Формула
и полученная следующими стадиями:
a) замораживание свежих собранных водорослей AFA и размораживание их или, если исходным материалом являются высушенный порошок водорослей AFA, обработка ультразвуком разбавленного в воде порошка AFA, для разрушения клеток;
b) центрифугирование продукта стадии а) для разделения супернатанта и осадка;
c) сбор супернатанта, содержащего водорастворимые компоненты и концентрацию водорастворимых компонентов;
d) подвергая экстракт, полученный на стадии с), эксклюзионной ультрафильтрации с мембраной с пределом молекулярной массы 30 кДа;
e) сбор ретената.
f) суспендирование высушенного осадка, полученного на стадии b) по п.1 в чистом этаноле, гомогенизация и поддержание гомогената при постоянном перемешивании в течение 24 ч при комнатной температуре в темноте;
g) центрифугирование полученной суспензии при 3000 об/мин в течение 5′ при 4°С;
h) сбор супернатанта;
i) необязательно проведение второй экстракции осадка этанолом в соответствии со стадиями с f) no h);
1) необязательно высушивание супернатанта с получением жирорастворимого концентрата.

Комментарии