Новые лекарственные средства для местного применения на основе сульфатированной гиалуроновой кислоты в качестве стимуляторов или ингибиторов цитокиновой активности - RU2673661C2
Код документа: RU2673661C2
Чертежи






Описание
Область техники, к которой относится изобретение
В течение многих лет в научной/патентной литературе публиковались данные исследования сульфатированной гиалуроновой кислоты, которая получена из гиалуроновой кислоты (HA), подходящим образом сульфатированной в соответствии со способом, описанным в уровне техники (см. патенты EP0940410B1 и EP0702699B1), которой приписывают антикоагулянтные эффекты. HAS (сульфатированная гиалуроновая кислота) может быть также получена деацетилированием и последующей сульфатацией глюкозамина HA (определяемого как HA-NS) (EP0971961B1), для получения хирургических изделий и фармацевтических композиций. Известны также патенты EP0754460B1 и EP1385492B1, в которых описано применение HAS при таких патологиях как, например, ARDS (тяжелая респираторная недостаточность, респираторный дистресс-синдром взрослых), суставной ревматизм и ревматоидный артрит. Настоящее изобретение относится к новому и неожиданному кожному применению HAS в качестве агента, регулирующего цитокиновую активность, поскольку заявитель обнаружил исключительную способность HAS модулировать активность конкретных цитокинов (и про-, и противовоспалительных), был исследован ее механизм действия и выявлено существенное различие между двумя типами сульфатированного продукта (HAS и HA-NS), но сверх того, заявитель неожиданно обнаружил неожиданно высокую активность в отношении различных типов и штаммов вируса герпеса, цитомегаловируса и вируса везикулярного стоматита.
Наконец, еще один объект настоящего изобретения относится к применению HAS в качестве стимулятора всасывания в кожу лекарственных средств противовоспалительной и гормональной природы.
Начиная с 1970 г, ученые поняли, что выбранные популяции лимфоидных клеток могут вырабатывать и высвобождать в циркуляторное русло молекулы белковой природы, не отождествляемые с антителами, определяемые термином «цитокины». Они представляют новый тип «гормона», способного действовать на различные клетки-мишени в многочисленных областях организма.
Прогресс научных знаний, относящихся к синтезу и биологическим/биохимическим функциям указанных белков, изменил «старое» представление об иммунной системе (I.S.) в научных кругах и открыл новые горизонты в понимании ее многочисленных функций, таким образом, создавая новые перспективы для лечения различных патологий, местных и/или системных, также включая новые терапевтические возможности, связанные с иммунотерапией онкологических заболеваний.
Центральными клетками иммунной системы являются лимфоциты, которые составляют примерно 20% всех белых телец и, на основании их разнообразных функций, образуют 3 группы: B-лимфоциты, T-лимфоциты и лимфоциты-киллеры. Многие цитокины представляют собой растворимые белки, продуцируемые лимфоцитами и/или моноцитами, способные действовать на другие клетки/ткани, также расположенные очень далеко от участка их продукции. Они действительно имеют иммунологические функции, а также регуляционные функции в синтезе других цитокинов в отношении части других клеток иммунной системы или клеток-мишеней, участвующих в каскаде реакций, инициируемых иммунной системой.
До настоящего времени были исследованы многочисленные различные цитокины, также имеющие многочисленные различные акронимы, но те цитокины, которые, в частности, исследованы заявителем, представляют собой: интерлейкин 1 и 2, интерлейкин 6, 7 и 12, далее определенные в настоящем описании как IL-1, IL-2, IL-6, IL-7 и IL-12, которые с TNF (фактором опухолевого некроза) определяются как цитокины воспалительной природы, тогда как интерлейкин-10 (IL-10), напротив, представляет собой цитокин с сильными противовоспалительными свойствами.
Первый цитокин, подлежащий исследованию, представлял собой определенно IL-1: он присутствует в двух формах α и β, это мощный индуктор провоспалительных процессов (системных и/или кожных). Он главным образом продуцируется B-лимфоцитами, T-лимфоцитами и макрофагами после бактериального стимула или стимуляции со стороны других агентов, включая другие цитокины; он также секретируется из периферических нейтрофилов, эндотелиальных, эпителиальных и гладкомышечных клеток, фибробластов, клеток Лангерганса кожи, остеокластов, синовиоцитов и многих других типов клеток. Обе формы связываются с одним и тем же рецептором и имеют очень похожие, если не идентичные, виды биологической активности. Многие из их провоспалительных функций связаны со стимуляцией других цитокинов, таких как IL-6 и IL-8, и сам их синтез может быть вызван цитокинами, такими как TNF, Интерферон, бактериальные эндотоксины, вирусы и различные типы других антигенов. Он участвует в развитии септического шока, но следует отметить, что недавно проведенные исследования продемонстрировали, что IL-1 способен активировать экспрессию некоторых онкогенов и, следовательно, участвовать в патогенезе неоплазий. В комбинации с другими цитокинами IL-1, поэтому, представляет один из основных медиаторов воспалительных процессов: он стимулирует T-клетки, фактически, для продукции IL-2 и B-клетки для продукции иммуноглобулинов. Он также участвует в патогенезе ревматоидного артрита и артроза: большие количества IL-1 были в действительности обнаружены в синовиальной жидкости пациентов, пораженных ревматоидным артритом и/или остеоартрозом. Он также активен при многочисленных патологиях преимущественно кожной природы, таких как дерматит в целом, атопический дерматит и псориаз. Наконец, он участвует в образовании сосудистого повреждения, такого как венозный тромбоз, и присутствует во всех сосудах при патологиях артерио/артериосклеротического типа. Рецепторные антагонисты в настоящее время уже находят клиническое применение (и также исследуются экспериментально) для данного цитокина, поскольку оказывается, что блокада рецептора является эффективным путем лечения указанных патологий, при которых IL-1 относится к протагонистам.
TNF: Фактор некроза опухоли представляет собой часть группы цитокинов, которая содействует фазе острого системного воспаления. Поэтому TNF участвует в очень широком числе процессов, таких как клеточная пролиферация, дифференциация и апоптоз, канцерогенез и вирусная репликация.
Он главным образом продуцируется макрофагами и рядом других типов клеток, включая мастоциты, лимфоидные клетки, мышечные и эндотелиальные клетки, фибробласты и нервные клетки. Его синтез может стимулироваться бактериальными эндотоксинами, другими цитокинами, такими как IL-2, Интерферон и IL-1, и он может ингибироваться стероидами.
Путем действия на многочисленные органы и системы, в целом, вместе с другими цитокинами, он участвует в развитии и регуляции многих патогенетических процессах:
- он модулирует экспрессию многих белков и важных цитокинов, таких как IL-1 и IL-6, таким образом, приводя к участию в кожных патологиях, таких как витилиго, экзема, псориаз и дерматит в целом;
- он стимулирует синтез коллагеназ в синовиоцитах и по этой причине большие количества TNF были обнаружены в синовиальных жидкостях пациентов, страдающих артрозом и ревматоидным артритом;
- он активирует остеокласты и поэтому вызывает реабсорбцию костной ткани (остеопороз);
- он сильно привлекает нейтрофилы и помогает им прикрепляться к эндотелиальным клеткам для экстравазации;
- он стимулирует продукцию макрофагами молекул с окисляющим действием;
- он участвует в развитии определенных патологических состояний сердечно-сосудистой системы, участвуя в образовании венозного тромбоза, в патогенезе артериосклероза и васкулита;
TNF способен связываться с двумя рецепторами, TNF-R1 (рецептором TNF типа 1) и TNF-R2 (рецептором TNF типа 2), которые экспрессируются во всех соматических клетках, исключая эритроциты. Вкратце, TNF стимулирует и системную, и кожную воспалительную реакцию, которая в свою очередь запускает многочисленные патологические процессы, также имеющие аутоиммунную природу, такие как ревматоидный артрит, болезнь Крона, псориаз и астма. До настоящего времени в научных исследованиях предпринимались попытки усовершенствовать «биологические» лекарственные средства (такие как, например, моноклональные антитела), которые ингибируют синтез TNF и/или блокируют его рецептор.
IL-2: это обладающий высокой провоспалительной активностью, атерогенный цитокин, главным образом продуцируемый T-лимфоцитами, синтез которого ингибируется стероидами и циклоспоринами. IL-2 играет центральную роль в регуляции иммунного ответа: он в действительности стимулирует синтез IFN в периферических лейкоцитах и вызывает продукцию IL-1 и TNF. IL-2 может также повредить гематоэнцефалический барьер и целостность эндотелия церебральных сосудов, вызывая нейропсихиатрические расстройства, такие как дезориентация и депрессия.
Следовательно, имеются многочисленные патологические состояния, которые были связаны с аберрантной продукцией IL-2, такие как лимфома Ходжкина, рассеянный склероз, ревматоидный артрит и красная волчанка.
IL-6: продуцируется многими типами клеток, кроме иммунной системы, он с TNF относится к наиболее важным членам группы химических медиаторов острой фазы воспалительного процесса, и поэтому вовлечен в патологические процессы с сильным воспалительным компонентом, такие как астма (где он участвует в возникновении и поддержании воспалительного процесса), хроническое воспаление кишечника (болезнь Крона), ревматоидный артрит и артроз. Действительно, как ранее утверждалось, цитокины, такие как TNF, IL-1 и IL-6, как оказалось, в значительной степени вовлечены в дегенеративный процесс суставного остеоартроза, поскольку они играют главную роль в регуляции экспрессии металлопротеиназ (ответственных за разрушение хрящевой ткани), в продукции простагландинов и в остеокластической активации и, по этой причине, высокие уровни цитокинов были зарегистрированы в синовиальных жидкостях пациентов, страдающих артрозом и ревматоидным артритом (R.A.). Указанные данные стимулировали использование ингибиторов указанных выше интерлейкинов и/или антагонистов их рецепторов в качестве новой стратегии лечения артрозной патологии.
Наконец, недавно проведенные исследования связали онкологические заболевания с продолжительностью жизни и выявили, как на некоторые опухоли влияет вид/количественная ситуация цитокиновых белков пациента: вкратце, недавно полученные доказательства связали низкий профиль продукции IL-10 и высокий уровень секреции IL-6 со снижением клинического выживания пациентов, пораженных патологическими опухолевыми процессами, тогда как генотип, способный продуцировать и поддерживать высокие уровни IL-10, может содействовать выживанию (Caruso C. et al., Ann N. Y. Acad. SCI., 2004, 1028:1-13).
IL-7: цитокин, главным образом, продуцируемый стромальными клетками костного мозга, он также секретируется тимусом и кератиноцитами. IL-7 индуцирует синтез воспалительных цитокинов, таких как IL-1, IL-6 и TNF, таким образом, участвуя в патогенезе некоторых кожных заболеваний (таких как псориаз и кожная лимфома) и заболеваний костно-суставной системы; действительно, высокие уровни IL-7 были обнаружены у пациентов, страдающих R.A.
IL-12: этот белок также играет центральную роль в регуляции функций иммунной системы. Он в действительности действует на дифференциацию лимфоцитов, он индуцирует синтез Интерферона и TNF, и его продукция может ингибироваться IL-10. Избыточная продукция данного белка участвует в патогенезе заболеваний аутоиммунной природы, таких как колит, артрит, инсулинозависимый сахарный диабет, энцефаломиелит, псориаз и рассеянный склероз (Brahmachari S. et al., Minerva Med., 2008, 99(2):105-118).
IL-10: главным образом продуцируется лимфоцитами, он представляет собой цитокин противовоспалительной природы, способный ингибировать синтез IL-2 и Интерферона, продуцируемого T-лимфоцитами. Противовоспалительное действие IL-10 также выявляется в способности ингибировать синтез IL-1, IL-6, IL-8, IL-12 и TNF в макрофагах, стимулированный бактериальными эндотоксинами. Дефициты IL-10 связаны с такими патологическими состояниями как сахарный диабет и хронические кишечные воспаления, такие как болезнь Крона. Недавно полученные данные также привели к экспериментальному применению IL-10 в качестве нового терапевтического подхода к лечению системной красной волчанки. Низкие уровни IL-10 наблюдались в кожных тканях пациентов, страдающих такими патологическими состояниями как витилиго, псориаз, экзема и дерматит. Следует отметить, что и кортикостероиды, и циклоспорин увеличивают продукцию и/или высвобождение данного интерлейкина из связанных с процессом компетентных клеток во время обычной иммуносупрессивной терапии для лечения воспалительных состояний и отторжения органов (Zhou X. et al., Current Drug Tar-gets-Immune, Endocrine & Metabolic Disorders, 2005, 5(465-475). Экспериментальные данные также продемонстрировали эффективность в снижении высвобождения простагландинов и циклооксигеназы, индуцированной in vitro TNF, на человеческих синовиоцитах, таким образом, указывая на способность IL-10 снижать воспалительные процессы, которые вовлекают суставы, пораженные остеоартритической дегенерацией (Alaaeddine N. et al., Arthritis & Rheumatism, 1999, 42:710-718). Недавно проведенные исследования подтвердили его терапевтическую эффективность в отношении астматической патологии на моделях бронхиальной гиперреактивности у экспериментальных животных, показывая, что данный цитокин имеет высокую терапевтическую перспективность в плане снижения воспаления, которое характеризует дыхательные пути страдающих астмой пациентов, в которых высокие концентрации TNF, IL-1, IL-5, IL-6 и IL-8 были обнаружены в бронхиальной промывной жидкости, и/или в сыворотке, и/или в тканях (Stankiewicz W. et al., Mediators of Inflammation, 2002, 11:307-312). Поэтому для данного интерлейкина предполагалась важная роль регуляторного цитокина в поддержании иммунологического гомеостаза.
Астма может быть крайне инвалидизирующим заболеванием, которым страдают приблизительно 200 миллионов людей во всем мире при смертности более 5000 случаев ежегодно. Это патология, которая основана на извращенной реакции иммунной системы на факторы внешней среды, в последующем связанной с повышенной продукцией провоспалительных цитокинов для роста и дифференциации тучных клеток и эозинофилов с другими типами клеток иммунной системы. Причины такой разбалансированной активности иммунной системы еще не полностью известны, однако, имеются генетические, экологические, вирусные, а также связанные с питанием факторы, которые различными путями содействуют развитию данной патологии. Следовательно, эффективная терапия (системная и/или местная терапия) для ее профилактики и/или лечения, которая обеспечила бы возможность прекращения или уменьшения применения стероидов (обычной лечебной терапии), могла бы представить обоснованное решение и по поводу более тяжелых форм (поскольку оно в любом случае обеспечило бы возможность снижения применения стероидов), и по поводу менее тяжелых случаев, поскольку можно было бы полностью прекратить терапию стероидами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является новое и неожиданное местное применение HAS в качестве средства, регулирующего активность цитокинов, поскольку заявитель обнаружил ее исключительную способность модулировать активность конкретных цитокинов; был исследован ее механизм действия и выявлено существенное различие между различными типами сульфатированных продуктов, известных в данной области, но, прежде всего, заявитель обнаружил неожиданную активность в отношении различных типов и штаммов вируса герпеса, цитомегаловируса и вируса везикулярного стоматита. Наконец, еще одна цель настоящего изобретения относится к применению HAS в качестве стимулятора всасывания через кожу лекарственных средств, преимущественно противовоспалительной природы, в качестве фибринолитического средства, а также в качестве высокогидратирующего средства для лечения всех патологических состояний кожи, характеризуемых сухостью, раздражением и гиперемией, воспалением и шелушением.
Сульфатированную гиалуроновую кислоту, подходящую для целей настоящего изобретения, получают в соответствии со способом, описанным в патенте EP 702699 B1: сульфатация осуществляется посредством комплекса SO3-пиридин и задействует спиртовые гидроксилы, присутствующие в полисахаридной цепи, исходя из HA, происходящей из любого источника, например, полученной экстракцией из петушиных гребней с использованием или ферментативных, или биотехнологических методов, и имеющей молекулярную массу в диапазоне от 400 до 3×106 Да, в частности, от 1×104Да до 1×106 Да, еще конкретнее, от 10000 до 50000 Да, от 150000 до 250000 Да и от 500000 до 750000 Да.
Полученное производное сохраняет все физические характеристики исходного неизмененного полимера, в частности, молекулярная масса исходной HA не уменьшается за счет сульфатации, таким образом, обеспечивая возможность сохранения всех физико-химических характеристик исходного полисахарида. Сульфатация затрагивает различные гидроксильные группы дисахаридного элемента, и поэтому возможно получение различных степеней сульфатации, от 0,5 до 3,5 (имеется в виду число сульфатных групп на дисахаридный элемент), путем варьирования введенного количества SO3-пиридина, как известно в современном уровне техники.
Производное, использованное во всех выполненных экспериментах, в целом имеет степень сульфатации 1 или степень 3 и далее определяется в настоящем описании как HAS1 и HAS3. Все свободные карбоксильные группы HA могут образовывать соль с катионами органического и/или неорганического происхождения.
Оба вида HAS растворимы в воде, и они могут также стерилизоваться обычными методиками, известными специалистам в данной области, даже если предпочтительна стерилизация с использованием автоклава.
Заявитель описывает и заявляет новое применение HAS для получения лекарственного средства для местного применения:
- для профилактики и/или лечения патологических состояний кожи, связанных с иммунной недостаточностью и, в частности, недостаточностью IL-10, таких как витилиго, экзема, псориаз и дерматит в целом, путем стимуляции синтеза противовоспалительных цитокинов;
- для профилактики и/или местного лечения астмы, связанной с активацией IL-1, IL-6 и TNF, путем ингаляции;
- для профилактики и/или лечения патологических состояний кожи, связанных с повреждением эндотелия и/или стенок кровеносных сосудов вследствие, например, травм, сосудистых кровоизлияний поверхностной природы и/или средней глубины с последующим образованием тромбов и отеков,
- для профилактики и/или лечения нанесением на кожу кожных заболеваний, связанных с увеличением/активацией IL-1, IL-2, IL-6, IL-7, IL-8, IL-12 и TNF, таких как, например, дерматит, атопический дерматит, псориаз, витилиго, фотодерматит, сыпь, все виды раздражения кожи (а также десен) и экзема;
- для профилактики и/или лечения заболеваний аутоиммунной природы, таких как псориаз, астма и кожные проявления системной (LES) и дискоидной красной волчанки;
- для профилактики и/или местного лечения кожных новообразований, таких как, например, базалиома, саркома Капоши, плоскоклеточная карцинома, кожная лимфома, фунгоидный микоз и актиновый кератоз;
- для профилактики и/или местного лечения сосудистых патологических состояний, таких как, например, васкулит и склеродермия, связанных с активацией TNF, IL-1 и IL-6;
Заявитель также в действительности продемонстрировал в описанных ниже экспериментах, что:
- HAS способна стимулировать продукцию новой мРНК и белковый синтез цитокинов противовоспалительной природы (таких как, например, IL-10), таким образом, увеличивая способность иммунной защиты клеток и, следовательно, всего организма. Противовоспалительное действие указанных выше цитокинов выявляется по способности ингибировать синтез IL-1, IL-6, IL-8, IL-12 и TNF, которые все представляют собой белки с высокой провоспалительной активностью, задействованные при многочисленных патологических состояниях кожи.
- HAS эффективна и при уменьшении синтеза новой мРНК, и при значительном снижении белкового синтеза IL-2, IL-7 и IL-12, в ситуациях, в которых не вызывается иммунный ответ, и в конкретных случаях воспалительного стресса, при которых клетки реагируют продуцированием каскада цитокинов: в частности, в данном случае представленные данные выявляют больший эффект HAS.
- HAS эффективна в ингибировании связывания TNF, IL-1 и IL-6 с их рецепторами. Эти данные имеют фундаментальное значение, поскольку они доказывают, что поведение сульфатированного продукта полностью аналогично поведению моноклональных антител, специфических в отношении рецепторов указанных выше провоспалительных белков, поэтому способных блокировать их функцию, но в то же самое время обладающих специфичностью к данному антителу. Блокада этих рецепторов представляет наиболее эффективный путь противодействия провоспалительных и опухолевых эффектов фактора TNF, IL-1 и IL-6, таким образом, открывая новые горизонты для клинического экспериментирования, обеспечивающие возможность усовершенствования новых терапевтических подходов при лечении и/или профилактике крайне большого числа патологических состояний с учетом роли, которую играют TNF, IL-1 и IL-6 в возникновении и прогрессировании многочисленных системных и кожных заболеваний.
Заявитель также описывает и заявляет новое применение HAS для получения лекарственного средства для местного применения:
- для профилактики и/или лечения инфекции губ, вызванной вирусом простого герпеса и генитального герпеса;
- для профилактики и/или лечения инфекции, вызванной вирусом везикулярного стоматита;
- для профилактики и/или лечения инфекции, вызванной цитомегаловирусом.
Заявитель действительно продемонстрировал в описанных ниже экспериментах мощное противовирусное действие HAS в отношении различных типов вируса:
- Экспериментальные данные доказывают противовирусное действие HAS1 и HAS3 в отношении вируса простого герпеса 1 и 2 и в отношении вируса везикулярного стоматита (VSV). Первая форма, крайне широко распространенная, ответственна за появление характерных сопровождающихся лихорадочной реакцией пузырьков, которые обычно поражают кожные покровы лица (губы, ноздри); она также называется herpes simplex labialis. Инфекция, вызванная губным герпесом, может легко рецидивировать, поскольку вирус выживает внутри клеток и не устраняется даже при использовании эффективных лекарственных средств. Вторая форма представляет собой генитальную инфекцию, также известную как herpes genitalis. Обе формы передаются посредством физического или полового контакта. Ввиду локализации вирионов в нервных ганглиях, где они могут оставаться в латентном состоянии в течение длительного периода времени, герпетическая инфекция имеет характеристики рецидивирования в соответствии со стрессирующими явлениями, воздействующими на иммунную систему, и обычно рецидивирует в первичном участке. Вирус везикулярного стоматита является РНК-вирусом, он поражает млекопитающих и используется в лаборатории для исследования развития жизненного цикла РНК-вируса. Сравнение HA-NS1 и HAS1 снова показывает, что не все сульфатированные гиалуроновые кислоты эквивалентны, поскольку HA-NS1 оказалась вообще неактивной, тогда как и HAS1, и 3 проявляют очень сильную противовирусную активность в отношении вируса простого герпеса, а также в отношении VSV. Ни один из тестированных образцов не оказался цитотоксичным в отношении клетки-хозяина; полученная минимальная цитотоксическая концентрация в действительности была равна минимальной цитотоксической концентрации эталонных лекарственных средств, обычно применяемых в клинической практике для лечения инфекции вирусом герпеса, и в среднем она оказалась в 100 раз выше, чем минимальная цитотоксическая концентрация, выявленная как активная в ингибировании вирусной репликации.
- Экспериментальные данные, полученные и для HAS1, и для HAS3 выявили отчетливый и значимый противовирусный эффект в отношении Cytomegalovirus: это конкретный тип вируса, который поступает в некоторые типы клеток организма, в которых он паразитически воспроизводит себя, вызывая гибель клеток. Данный вирус относится к тому же семейству, что и herpes labialis и herpes genitalis, вирус ветряной оспы и вирус инфекционного мононуклеоза. Эпителиальные клетки, слизистые оболочки, лимфатические узлы представляют собой участки множественной первичной инфекции. Вирус остается в латентной форме на всю жизнь в периферической крови, в эпителии почечных канальцев и в эпителии слюнных желез. Тяжелые формы обнаруживаются у индивидов с нарушенным иммунитетом (таких как индивиды, пораженные СПИД, и индивиды после трансплантации органов, получающие иммуносупрессивную терапию). Лечебная терапия состоит во введении лекарственных средств, таких как ганцикловир, валганцикловир и фоскарнет (ингибиторы синтеза вирусной ДНК). Также в данном случае HA-NS1 оказалась неэффективной в ингибировании пролиферации вируса, подтверждая абсолютное различие противовирусной активности между двумя типами сульфатированных продуктов.
Еще одна цель настоящего изобретения относится к применению HAS в качестве фибринолитического средства для разрушения фибриновых тромбов, которые образованы на уровне кожи (на поверхности и/или в глубине) после разрушения эндотелия и/или стенок капилляров и/или мелких сосудов, вследствие механических травм и/или кровотечений средней/небольшой интенсивности.
В описанных ниже экспериментах заявитель в действительности продемонстрировал:
- что HAS эффективна в качестве плазмина при фибринолизе/удалении фрагментов сгустков крови и тромбов. Плазмин представляет собой важный фермент, относящийся к группе гидролаз, способный разрушать многие белки плазмы крови, и, в частности, фибрин в тромбах и сгустках крови. Разрушение фибрина называется фибринолизом. Недостаточность плазмина может привести к тромбозу, поскольку тромбы адекватно не разрушаются. Следует отметить существенное различие между процессом антикоагуляции и фибринолитическим процессом: в первом случае антикоагулянтное средство должно предотвратить образование кровяного сгустка, а в последнем случае фибринолитическое средство, с другой стороны, должно вмешаться в ситуацию, при которой кровяной сгусток уже присутствует и поэтому должен быть разрушен для его полного удаления.
Еще одна цель настоящего изобретения относится к новому применению HAS в качестве стимулятора всасывания через кожу лекарственных средств, таких как, например, лекарственные средства противовоспалительной природы, и, наконец, в качестве средства, обладающего выраженным дегидратирующим действием, для лечения патологических состояний кожи, характеризуемых сухостью, лихенизацией, раздражением, зудом и гиперемией кожи, ее воспалением и шелушением.
Заявитель в действительности продемонстрировал, что:
- сульфатация гиалуроновой кислоты существенно увеличивает всасывание через кожу, следовательно,
- гидратирующая сила HAS оказалась значительно выше чем таковая несульфатированной HA и поэтому HAS вызывает важное уменьшение шероховатости обработанных кожных поверхностей относительно HA и местных контрольных препаративных форм, таким образом, выявляя ее способность эффективно лечить и защищать кожные поверхности, характеризуемые сухостью, раздражением, лихенизацией, зудом и гиперемией, воспалением и шелушением при всех других патологических состояниях кожи, которые делают кожу более чувствительной к наружным средствам;
- HAS представляет собой мощный и эффективный стимулятор кожного всасывания лекарственных средств. Способность HAS так эффективно проникать сквозь толщу кожи представляет собой научную основу, на которой базируется данное неожиданное новое свойство, которое обеспечивает возможность его включения в состав препаративных форм с фармакологическими средствами различной природы, такими как, например, нестероидные противовоспалительные препараты (в частности, диклофенак, кетопрофен и ибупрофен) или средства стероидного типа, гормоны, сосудорасширяющие средства, холинергические средства, антибиотики и другие лекарственные средства, составленные в различные формы, предпочтительно, в виде гелей, кремов или пластырей для дермального и/или трансдермального всасывания.
Наконец, заявитель описывает получение различных местных фармацевтических препаративных форм/композиций, содержащих HAS в виде единственного действующего начала, или в ассоциации с другими фармакологически и/или биологически активными средствами, такими как, например, стероиды, гормоны, белки, трофические факторы, витамины, нестероидные противовоспалительные лекарственные средства (FANS), такие как, например, диклофенак, кетопрофен или ибупрофен, или их соли, химиотерапевтические лекарственные средства для местного применения, антибиотики, противовирусные средства, местные анестетики, антикоагулянты и/или фибринолитические средства и/или ферменты, такие как, например, коллагеназа и/или гиалуронидаза и/или другие протеазы; она может составляться в препаративные формы с полимерами, такими как гиалуроновая кислота и ее производные, карбоксиметилцеллюлоза (CMC) и/или другие полимеры естественной (такой как коллаген) или синтетической природы.
Рассматриваемая фармацевтическая композиция может составляться в виде мази, липогеля, гидрогеля, губной помады, крема, влагалищных суппозиториев и свечей, пены, геля для слизистых оболочек, офтальмологических препаратов, составов для промывания влагалища, полосканий для ротовой полости, пластырей для дермального и/или трансдермального всасывания, в частности FANS и гормонов, растворов; поэтому она может вводиться местным нанесением или путем ингаляции для лечения патологических состояний респираторной системы, таких как, например, астма.
Особое внимание уделяется композициям, содержащим ферменты, такие как гиалуронидаза, в препаративной форме лекарственного средства для лечения кожных гематом, и средств, содержащих нестероидные противовоспалительные препараты или гормоны, в форме гелей, кремов и накладок для дермального и/или трансдермального всасывания лекарственного средства.
Некоторые примеры получения HAS 1 и 3 степени, фармацевтические препаративные формы, содержащие ее, приведены исключительно в описательных и неограничивающих целях, вместе с результатами, полученными экспериментированием in vitro.
Пример 1
Получение тетрабутиламмониевой соли гиалуроновой кислоты (HA), имеющей среднюю молекулярную массу, равную 200 кД (в диапазоне от 150000 до 250000 Да)
5,00 г натриевой соли гиалуроновой кислоты ферментативного происхождения (200 кД) растворяют в 250 мл воды и полученный раствор пропускают через стеклянную колонку, предварительно заполненную 100 см3 смолы Dowex в форме тетрабутиламмония (TBA). Элюированный раствор соли HA-TBA собирают и сублимируют. Получают 7,50 г продукта.
Пример 2
Синтез сульфатированной HA из НА, имеющей среднюю молекулярную массу 200 кД и степень сульфатации, равную 3 сульфатным группам на повторяющееся звено
Способ A
10,0 г TBA соли гиалуроновой кислоты, имеющей среднюю молекулярную массу 200 кД, полученную в соответствии с примером 1, растворяют в 300 мл диметилсульфоксида (DMSO); 26,0 г комплекса SO3-пиридина (триоксида серы и пиридина, далее обозначаемого аббревиатурой PySO3) диспергируют в 150 мл DMSO, и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C, реакцию прерывают добавлением 0,1 объема воды; неочищенный продукт реакции выделяют осаждением после добавления 2 объемов этанола. Полученное твердое вещество диспергируют в 150 мл воды и pH доводят до нейтральности 1M NaOH. Смесь полностью диализируют против воды через мембрану при отсечке 12-14000 Да. Диализированный продукт подвергают сублимации. Получают 9,7 г продукта со степенью сульфатации, равной 3 сульфатным группам на повторяющееся звено (выход = 88%).
Способ B
32,0 г TBA соли гиалуроновой кислоты, имеющей среднюю молекулярную массу 200 кД, полученную в соответствии с примером 1, растворяют в 900 мл N-метилпирролидона (NMP); 100 г PySO3 диспергируют в 600 мл NMP и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21±1°C, реакцию прерывают добавлением 0,5 объемов воды. pH, который исходно был ниже, чем 2,5, доводят до нейтральности добавлением моля NaOH (в растворе). Неочищенный продукт реакции выделяют осаждением добавлением 2,5 объемов метанола и промывают 2 объемами смеси метанол/вода 8/2. Твердое вещество повторно растворяют и полностью диализируют против воды с использованием мембраны при отсечке 12-14000 Да. Получают 30,4 г продукта со степенью сульфатации, равной 3 сульфатным группам на повторяющееся звено (выход = 86%).
Пример 3
Синтез сульфатированной HA из HA, имеющей среднюю молекулярную массу 200 кД и степень сульфатации, равную 1 сульфатной группе на повторяющееся звено
Используя процедуру, иллюстрируемую в примере 1, получают 10,0 г TBA соли HA, которую растворяют в 350 мл DMSO. 10,0 г комплекса PySO3 диспергируют в 100 мл DMSO, и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°, реакцию прерывают добавлением 0,1 объема воды; неочищенный продукт реакции выделяют осаждением после добавления 2,5 объемов этанола. Полученное твердое вещество диспергируют в 150 мл воды и pH доводят до нейтральности NaOH 1 моль/л. Смесь полностью диализируют против воды через мембрану при отсечке 12-14000 Да. Диализированный продукт подвергают сублимации. Получают 7,54 г продукта со степенью сульфатации, равной 1,0 сульфатной группе на повторяющееся звено (выход = 93%).
Пример 4
Синтез сульфатированной HA из HA, имеющей низкую молекулярную массу (средняя MW 10 кД, в диапазоне от 5000 до 30000 Да) и степень сульфатации, равную 3 сульфатным группам на повторяющееся звено
Используя процедуру, иллюстрируемую в примере 1, получают 12,4 г TBA соли гиалуроновой кислоты с низкой молекулярной массой, которую растворяют в 300 мл NMP. 40 г PySO3 диспергируют в 100 мл NMP, и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C, реакцию прерывают добавлением 0,5 объема воды. pH, который исходно был ниже чем 2,5, доводят до нейтральности добавлением моля 4M NaOH. Неочищенный продукт реакции выделяют осаждением после добавления 2,5 объемов метанола и промывают 2 объемами смеси метанол/вода 8/2. Твердое вещество повторно растворяют и полностью диализируют против воды с использованием мембраны при отсечке 3500 Да. Получают 12,0 г продукта со степенью сульфатации, равной 3,0 сульфатным группам на повторяющееся звено (выход = 85%).
Пример 5
Синтез сульфатированной HA из HA, имеющей низкую молекулярную массу и степень сульфатации, равную 1 сульфатной группе на повторяющееся звено
Используя процедуру, иллюстрируемую в примере 1, получают 12,4 г TBA соли HA и растворяют в 300 мл DMSO. 16,0 г PySO3 диспергируют в 100 мл DMSO, и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 21°C, реакцию прерывают добавлением 0,1 объема воды; неочищенный продукт реакции выделяют осаждением после добавления 2,5 объемов этанола. Полученное твердое вещество диспергируют в 150 мл воды и pH доводят до нейтральности NaOH 1 моль/л. Смесь полностью диализируют против воды через мембрану при отсечке 3500 Да. Диализированный продукт подвергают сублимации. Получают 9,04 г продукта со степенью сульфатации, равной 1,0 сульфатной группе на повторяющееся звено (выход = 90%).
Пример 6
Синтез сульфатированной HA из HA, имеющей молекулярную массу в пределах диапазона от 500 до 730 Да и степень сульфатации, равную 3 сульфатным группам на повторяющееся звено
21,0 г натриевой соли гиалуроновой кислоты экстрактивного происхождения (500-730 кД) растворяют в 1,5 л воды, и полученный раствор пропускают через стеклянную колонку, предварительно заполненную 450 см3 смолы Dowex в форме TBA. Элюированный раствор соли HA-TBA собирают и сублимируют. Получают 32,0 г продукта, который растворяют в 1,35 л NMP; 100 г PySO3 диспергируют в 650 мл NMP и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 23±1°C, реакцию прерывают добавлением 0,5 объема воды. pH, который первоначально был ниже, чем 2,5, доводят до нейтральной реакции добавлением NaOH (в растворе в концентрации 4 моля/л). Неочищенный продукт реакции выделяют осаждением добавлением 2,5 объемов метанола и промывают 3,5 объемами смеси метанол/вода 8/2. Твердое вещество повторно растворяют и полностью диализируют против воды, используя мембрану, при отсечке 12-14000 Да. Получают 30,3 г продукта со степенью сульфатации, равной 3 сульфатным группам на повторяющееся звено (выход = 83%).
Пример 7
Синтез сульфатированной HA из HA, имеющей молекулярную массу от 500 до 730 Да и степень сульфатации, равную 1 сульфатной группе на повторяющееся звено
21,0 г натриевой соли гиалуроновой кислоты экстрактивного происхождения (500-730 кД) растворяют в 1,5 л воды, и полученный раствор пропускают через стеклянную колонку, предварительно заполненную 450 см3 смолы Dowex в форме TBA. Элюированный раствор соли HA-TBA собирают и сублимируют. Получают 32,0 г продукта, который растворяют в 1,65 л NMP; 40 г PySO3 диспергируют в 350 мл NMP и затем добавляют к раствору HA. После 20 часов в условиях механического перемешивания при температуре 25±1°C, реакцию прерывают добавлением 0,5 объема воды. pH, который первоначально был ниже, чем 2,5, доводят до нейтральности добавлением NaOH (в растворе в концентрации 4 моля/л). Неочищенный продукт реакции выделяют осаждением добавлением 3,5 объемов метанола и промывают 3,5 объемами смеси метанол/вода 8/2. Твердое вещество повторно растворяют и полностью диализируют против воды, используя мембрану, при отсечке 12-14000 Да. Получают 22,5 г продукта со степенью сульфатации, равной 1,0 сульфатной группе на повторяющееся звено (выход = 87%).
Пример 8
Оценка регулирующего эффекта HAS со степенью сульфатации 1 и 3 на генную экспрессию IL-10 и IL-12
Человеческие синовиоциты, ранее размноженные in vitro и поддерживаемые в культуре при 37°C в среде DMEM, содержащей 10% FCS (фетальной телячьей сыворотки), высевают в концентрации 20000 клеток на лунку (синовиоциты представляют собой клетки, способные продуцировать различные типы цитокинов, и поэтому обычно используются для данного типа экспериментального тестирования). Затем сульфатированную HA степени 1 (HAS1) и степени 3 (HAS3), полученную, как описано в примерах 1-3, добавляют к культуральной среде в концентрации 0,1 и 0,5 мг/мл (для обоих образцов), в то время как контрольная обработка представлена несульфатированной HA, имеющей среднюю молекулярную массу (MW) 200 кД. После 3 дней обработки проводят ПЦР (полимеразную цепную реакцию) в реальном масштабе времени для оценки генной экспрессии IL-10 и IL-12: клеточную РНК экстрагируют, используя способ «Trizol» и следуя указаниям поставщика (реагент TRIZOL, LIFE Techonologies, GIBCO BRL). Вкратце, клетки лизируют добавлением 1,0 мл Trizol, и общее содержание РНК количественно определяют измерением ее спектральной поглощательной способности при 260 нм. Соответствующие праймеры выбирают для каждого гена, подлежащего амплификации, с использованием программного обеспечения Primer3 (Roche Molecular Diagnostics, Pleasanton, CA, USA). Генную экспрессию оценивают посредством ПЦР в реальном масштабе времени с помощью прибора Rotor-gene TM5500 (Corbett research, Sydney, Australia). Реакции ПЦР проводят с использованием праймеров при 300 нм и красителя SYBR Green (Invitroge, Carlsbad, CA, USA) при 40 циклах по 15 с при 95°C, и 1 мин при 60°C. Величину «Порогов флуоресценции (Ct)» автоматически определяют с помощью программного обеспечения, оценивая коэффициент амплификации для исследуемого гена от 92 до 110%. Для каждого образца кДНК величина генной экспрессии выражается с точки зрения соотношения между ct гена «домашнего хозяйства» (т.е. гена для белка бета-актина, который представляет контрольный ген, поскольку он присутствует в каждой клетке и не подвергается влиянию HAS) и ct представляющего интерес гена (т.е. гена для IL-10 и IL-12), следовательно величина отношения ct «домашнего хозяйства»/ct исследуемого гена указана на оси ординат, которая поэтому указывает количество мРНК, экспрессированной исследуемым геном. Полученные результаты представлены на Фиг. 1 и 2:
Фиг. 1: обработка человеческих синовиоцитов HAS1 и HAS3 вызывала значительное увеличение экспрессии гена цитокина IL-10 в сравнении с контролем, обработанным несульфатированной HA.
Фиг. 2:
В данном эксперименте обе степени сульфатации HAS (степень 1 и степень 3) также оказались способными значительно снизить генную экспрессию IL-12, наполовину уменьшая синтез ее мРНК, в сравнении с контролем, обработанным несульфатированной HA. Поэтому оказалось, что сульфатированная гиалуроновая кислота:
- способна стимулировать продукцию новой мРНК для синтеза противовоспалительных цитокинов, таким образом, увеличивая защитную способность клетки и, следовательно, всего организма, в сравнении с ранее описанными патологическими состояниями, при которых IL-10, как оказалось, имеет фундаментальное значение для разрешения и/или улучшения состояния при таких заболеваниях как астма, витилиго и все воспалительные процессы, в которых задействован IL-10.
- эффективна в уменьшении синтеза новой мРНК высоко провоспалительного цитокина IL-12, оказываясь действенным противовоспалительным средством, способным вмешиваться в экспрессию белков, задействованных в патогенезе инвалидизирующих заболеваний, таких как псориаз и все описанные выше заболевания.
Пример 9
Ингибирование связывания TNF с его рецептором, экспрессированным у линий моноцитов: оценка эффективности HAS степени 1 и степени 3 при различных величинах молекулярной массы
Указанные эксперименты были проведены для оценки эффективности тестированных образцов (полученных в соответствии с примерами 1-4) в плане влияния на способность ингибирования связывания TNF с его рецептором, экспрессируемым клетками иммунной системы, обычно используемыми in vitro для данного типа эксперимента, проводимого с иодированными цитокиновыми компонентами для оценки в анализах связывания радиолигандов.
Экспериментальную процедуру проводили, как описано в публикации Baglioni C. et al., J Biol Chem, 1985, 260:13395-13397.
Вкратце, использовали линию человеческих гистиоцитов лимфомы U937, с характеристиками моноцитов, чувствительных к цитотоксической активности TNF, экспрессирующих связанный с ним рецептор. Клетки первоначально инкубировали с 0,028 нМ125I-TNF (проводимое в воде) одновременно с подлежащими анализу образцами (в концентрации 1 мг/мл, которая оказалась самой низкой концентрацией, вызывающей максимальное ингибирование), в инкубационном буфере, состоящем из 50 мМ Tris-HCl pH 7,4, 0,5 мМ EDTA, при 4°C в течение 3 часов.
В конце инкубации клетки центрифугировали с дибутилфталатом/динонилфталатом 2/1, и осадок, полученный после центрифугирования, анализировали в γ-счетчике.
Полученные результаты представлены на Фиг. 3:
Полученные результаты показывают эффективность HAS в полном (100%) ингибировании связывания TNF с его рецептором и для степени 1, и для степени 3 HAS со средней и низкой молекулярной массой. Данные результаты имеют фундаментальное значение, поскольку они доказывают, что поведение сульфатированного продукта полностью аналогично поведению моноклонального антитела, специфичного для рецептора TNF, и поэтому сульфатированный продукт способен блокировать его функцию. Следовательно, блокада этого рецептора представляет наиболее эффективный путь противодействия провоспалительным и опухолевым воздействиям фактора TNF.
Пример 10
Ингибирование связывания цитокина IL-1 с его рецептором, экспрессированным в линиях фибробластов: оценка эффективности HAS степени 3 при различных величинах молекулярной массы
Указанные эксперименты были проведены для оценки эффективности тестированных образцов (полученных в соответствии с примерами 1-3 и 4) в плане влияния на способность ингибирования связывания IL-1 с его рецептором, экспрессируемым мышиными клетками 3T3, обычно используемых in vitro для данного типа эксперимента, проводимого с иодированными цитокиновыми компонентами для оценки в анализах связывания радиолигандов.
Экспериментальную процедуру проводили, как описано в публикации Chin J et al., J Exp Med, 1987, 165:70-86.
Вкратце, использовали линию мышиных фибробластов 3T3, чувствительных к цитотоксической активности IL-1, экспрессирующих связанный с ним рецептор. Клетки первоначально инкубировали с 10 пМ125I-IL-1 (проводимое в воде) одновременно с подлежащими анализу образцами (в концентрации 1 мг/мл, которая оказалась самой низкой концентрацией, вызывающей максимальное ингибирование), в инкубационном буфере, состоящем из среды RPMI 1640, содержащей 20 мМ HEPES pH 7,2 и 1% BSA (бычьего сывороточного альбумина), при 37°C в течение 2 часов. В конце инкубации клетки промывали фосфатным буфером, затем растворяли в 2,5M NaOH и импульсы подсчитывали в γ-счетчике.
Полученные результаты представлены на Фиг. 4:
Полученные результаты показывают эффективность HAS (и со средней, и с низкой молекулярной массой) в ингибировании связывания IL-1 с его рецептором на 30%. Данные результаты имеют крайне большое значение, поскольку они доказывают, что поведение сульфатированного продукта полностью аналогично поведению моноклонального антитела, специфичного для рецептора рассматриваемого цитокина, и поэтому сульфатированный продукт способен блокировать его функцию. Блокада этого рецептора представляет наиболее эффективный путь противодействия провоспалительным и опухолевым воздействиям IL-1, как описано ранее.
Пример 11
Ингибирование связывания цитокина IL-6 с его рецептором, экспрессированным в клетках миеломы человека: оценка эффективности HAS степени 3 при различных величинах молекулярной массы
Указанные эксперименты были проведены для оценки эффективности тестированных образцов (полученных в соответствии с примерами 1-3 и 4) в плане влияния на способность ингибирования связывания IL-6 с его рецептором, экспрессированным в человеческой миеломе U266, обычно используемых in vitro для данного типа эксперимента, проводимого с иодированными цитокиновыми компонентами для оценки в анализах связывания радиолигандов.
Экспериментальную процедуру проводили, как описано в публикации Taga T. et al., J Exp Med, 1987, 166:967-981.
Вкратце, использовали линию клеток миеломы человека U266, чувствительных к цитотоксической активности IL-6, экспрессирующих связанный с ним рецептор. Клетки первоначально инкубировали с 0,08 нМ125I-IL-6 (проводимое в воде) одновременно с подлежащими анализу образцами (в концентрации 1 мг/мл, которая оказалась самой низкой концентрацией, вызывающей максимальное ингибирование), в инкубационном буфере, состоящем из среды RPMI 1640, содержащей 25 мМ HEPES pH 7,1 и 10% BSA, при 4°C в течение 16 часов. В конце инкубации клетки промывали фосфатным буфером, центрифугировали при 9000 об/мин и импульсы из осадка после центрифугирования подсчитывали в γ-счетчике.
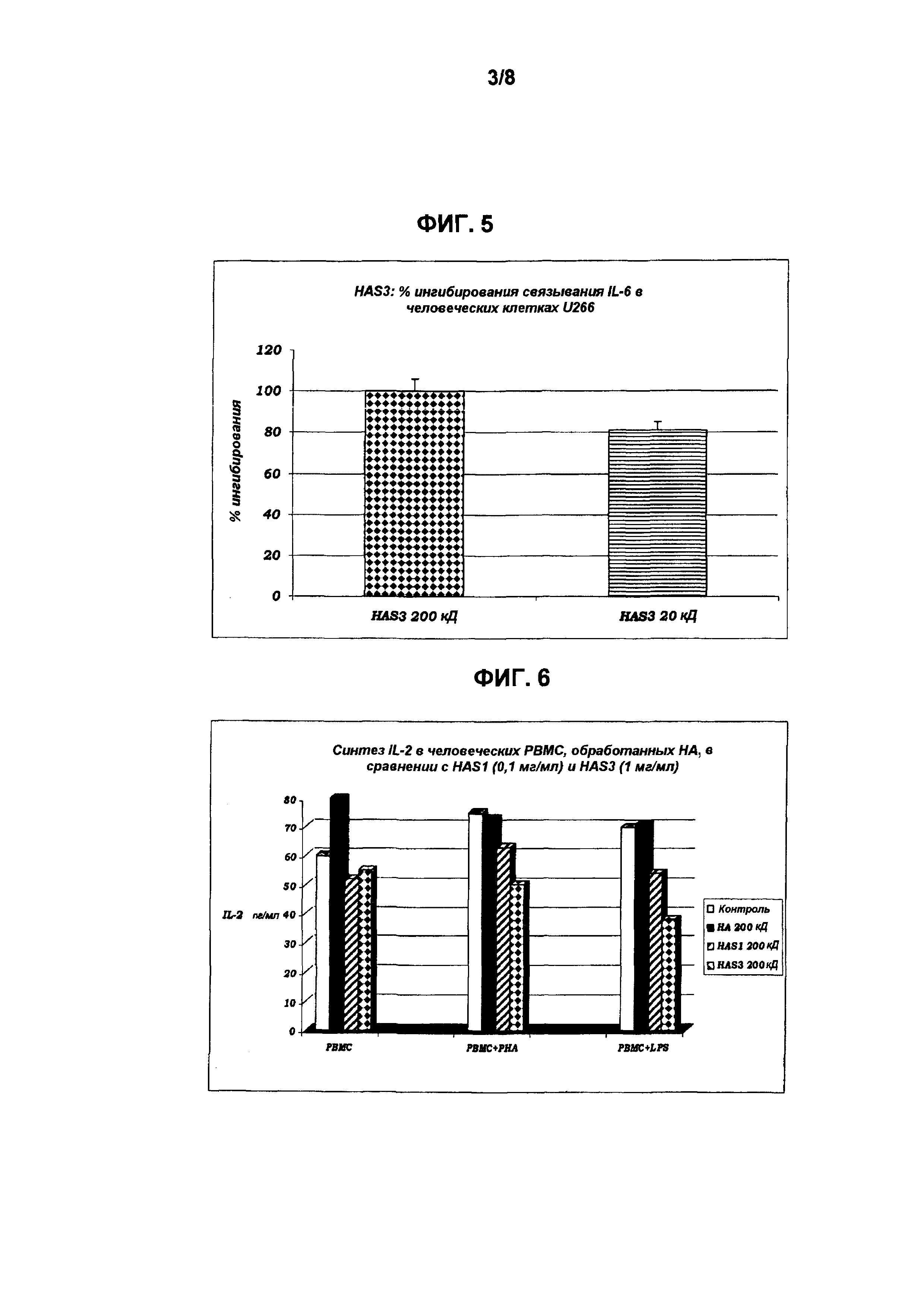
Полученные результаты представлены на Фиг. 5:
Полученные результаты показывают эффективность HAS и со средней, и с низкой молекулярной массой, при полном (100%) ингибировании связывания IL-6 с его рецептором. Данные результаты, следовательно, доказывают, что поведение сульфатированного продукта также в данном случае полностью аналогично поведению моноклонального антитела, специфичного для рецептора рассматриваемого цитокина, и поэтому сульфатированный продукт способен блокировать его функцию. Блокада этого рецептора представляет наиболее эффективный путь блокирования провоспалительных эффектов IL-6.
Пример 12
Оценка ингибиторного эффекта HAS степени 1 и степени 3 на синтез белка цитокинов IL-2, IL-7, IL-10 и IL-12 в человеческих PBMC
Для данных экспериментов использовали мононуклеарные клетки периферической крови человека (PBMC), полученные у различных доноров, для оценки воздействия HAS на продукцию перечисленных выше цитокинов с использованием:
- несульфатированной HA (средняя молекулярная масса: 200 кД),
- HAS1 и HAS3 (полученные, как описано в примерах 1-3).
Выделение PBMC (Bøyum A., Scand J Clin Lab Invest 21 Suppl, 1968, 97:77-89) осуществляли с использованием продукта Ficoll-Paque PLUS (GE Healthcare) в соответствии с протоколом, указанным поставщиком. В нулевой день 100000 клеток высевали на лунку (с использованием планшетов с 96 лунками) в 200 мкл среды RPMI 1640, к которой добавляли 10% фетальной телячьей сыворотки, 10 мМ HEPES, 2 мМ глутамина, 1% пенициллина-стрептомицина 100 ЕД/мл. Воздействие всех образцов оценивали на необработанных PBMC или PBMC, стимулированных липополисахаридом LPS (10 мкг/мл) (высоко провоспалительным) или фитогемагглютинином PHA (10 мг/мл) (веществом, способным стимулировать лимфоциты для их деления), причем оба агента способны стимулировать синтез цитокинов. Клетки обрабатывали отдельно тремя соединениями в концентрации 0,1 мг/мл или 1 мг/мл. После 24 часов инкубации при 37°C (5% CO2), 100 мкл супернатанта брали из каждой лунки для анализа продукции IL-2, IL-7, IL-10 и IL-12.
Количественное определение медиаторов воспаления осуществляли посредством технологии SearchLight® с использованием планшета Custom Human 9-Plex Array, следуя протоколу, указанному поставщиком в технической карте. Полученные результаты представлены на Фиг. 6-9:
Эти графики ясно показывают, что HAS степени 1 и степени 3 способны значительно снижать синтез IL-2, IL-7 и IL-12 у части моноцитов и когда клетки не стимулируются, и также когда, напротив, они стимулируются специфическими и мощными воспалительными факторами и/или митогенами. Поэтому оказывается, что HAS представляет собой молекулу с точными фармакологическими характеристиками, способную модулировать/регулировать синтез цитокинов с выраженной противовоспалительной активностью и в ситуациях, когда иммунный ответ не стимулируется, и при определенных явлениях воспалительного стресса, при которых иммунная клетка реагирует продукцией каскада цитокинов и, прежде всего, в этом случае, представленные данные выявляют больший модулирующий эффект HAS.
С другой стороны, Фиг. 9 подтверждает очевидный стимул для продукции IL-10 также для клеток, относящихся к иммунной системе. Следовательно, снова подтверждается, что HAS способна модулировать синтез цитокинов, стимулируя те, которые являются противовоспалительными и ингибируют синтез провоспалительных цитокинов.
Пример 13
Оценка противовирусного действия HAS степени 1 и степени 3 в сравнении с HA-NS:
Вирус простого герпеса-1, вирус простого герпеса-2, вирус везикулярного стоматита
Активность тестированных образцов определяли оценкой ингибирования цитопатогенности, вызванной вирусом простого герпеса-1 (HSV-1: штамм KOS, F и McIntyre) и вирусом простого герпеса-2 (HSV-2: штамм G, 196 и Lyons) в фибробластах E6SM, происходящих из мышечной/кожной эмбриональной ткани. Кроме того, противовирусную активность тестировали снова в отношении клеток E6SM, инфицированных вирусом везикулярного стоматита (вирус везикулярного стоматита: VSV). HSV-1 представляет собой вирус, который преимущественно инфицирует слизистую оболочку ротовой полости, тогда как HSV-2 атакует слизистую оболочку половых органов. Экспериментальная процедура соответствовала описанию в публикации Baba M. et al., ANTIMICROB. AGENTS CHEMOTHER., 1988, 32:1742-1745.
Вкратце, слившиеся клеточные культуры подвергали действию инфекционных доз вирусов, перечисленных выше, в присутствии образцов HS-NS1 (EP0971961), HAS1 и HAS3, полученных, как описано в примерах 1-3. После периода инкубации в течение 1 ч при 37°C, культуральную среду замещали свежей средой, содержащей только образцы, подлежащие тестированию. Цитопатогенность вируса тестировали на 2-ой день инкубации. Измерение ингибирования вирусной цитопатогенности оценивали определением ингибирования синтеза ДНК и РНК в «инфицированных» клетках и подвергали обработке, как указано выше: клетки высевали в микролунки в культуральную среду, содержащую различные концентрации подлежащих тестированию образцов с 2,5 мкКи 3H-тимидина и 3H-уридина на мл. После 16 ч при 37°C клетки обрабатывали трихлоруксусной кислотой, промывали в этаноле, оставляли для сушки и сцинтилляцию подсчитывали в 7,5 мл жидкости. Противовирусную активность тестированных образцов выражали в виде минимальной концентрации, требуемой для ингибирования цитопатогенности вируса на 50%: IC50. Кроме того, для оценки также цитотоксичности тестируемых образцов определяли минимальные концентрации, необходимые для вызова морфологического повреждения (наблюдаемого оптическим микроскопом) использованных клеток. Сравнение проводили с декстран-сульфатом (DS) и лекарственным средством ацикловир (обеими молекулами с известной противовирусной эффективностью, поэтому использованными в качестве положительного контроля).
Полученные результаты представлены на Фиг. 10:
Экспериментальные данные подтверждают мощное противовирусное действие и HAS1, и HAS3: сравнение HA-NS1 и HAS1 показывает, что не все сульфатированные гиалуроновые кислоты являются эквивалентными, поскольку, как оказалось, HA-NS1 не была активной, и данная разница эффективности не зависела от молекулярной массы или степени сульфатации гиалуроновой кислоты, и эта разница поэтому заключается в самой структуре HA-NS1 в сравнении с HAS1. HAS в действительности проявляет эффективность, равную эффективности декстран-сульфата и сравнимую с эффективностью ацикловира, эталонного лекарственного средства для лечения инфекции вирусом простого герпеса. Кроме того, следует указать, что ацикловир является неактивным в отношении VSV, тогда как HAS степени 1 и 3 обладает очень мощной противовирусной активностью в отношении VSV.
Все тестированные образцы является нетоксичными в отношении клетки-хозяина; полученная минимальная цитотоксическая концентрация в действительности равна минимальной цитотоксической концентрации эталонных лекарственных средств, обычно применяемых в клинической практике для лечения герпеса, и оказалась в среднем в 100 раз выше, чем концентрация, оказавшаяся активной в ингибировании вирусной репликации.
Цитомегаловирус
Активность тестированных образцов определяли оценкой ингибирования цитопатогенности, определяемой цитомегаловирусом (CMV: штамм AD-169 и Davis), с использованием предыдущего протокола. Противовирусную активность тестировали в сравнении с клетками HEL (легочными эмбриональными клетками) и выражали в виде концентрации, требуемой для ингибирования числа бляшек, образованных указанным выше вирусом, на 50%. Полученные результаты представлены на Фиг. 11:
в таблице показан ясный и значимый положительный результат, полученный и для HAS1, и для HAS3, что снова подтверждает их эффективность в качестве противовирусных средств. Также в данном случае HA-NS1 не оказалась активной в плане ингибирования пролиферации вируса, подтверждая абсолютное различие противовирусной активности между двумя типами продукта с сульфатацией степени 1.
Пример 14
Оценка in vitro фибринолитических свойств HAS степени 3 с различными величинами молекулярной массы
Оценку фибринолитических свойств продуктов, подвергнутых тестированию, сравнивали с признанной фибринолитической активностью плазмина. В частности, оценивали скорость растворения фибриновой сети и образование растворимых продуктов распада фибрина (FDP).
Использованные образцы плазмы были получены из цельной крови здоровых индивидов, не получающих какое-либо фармакологическое лечение.
Для тестирования фибринолитической эффективности подвергаемых испытанию продуктов, образцы крови распределяли по различным пробиркам, в которых вызывали образование кровяных сгустков.
Затем образование FDP оценивали после добавления:
- плазмина в качестве контрольной обработки
- HAS3, полученной в соответствии с примером 1 и 2
- HAS3, полученной в соответствии с примером 4.
Экспериментальное исследование
Свежие взятые образцы крови распределяли по различным пробиркам, содержащим цитрат натрия, в соотношении 9:1. Пробирки немедленно центрифугировали при 3000 об/мин в течение 5 минут. Полученную плазму переносили в новую пробирку и сразу использовали для осуществления оценки FDP.
Тромбин (300 мЕ/мл), предварительно нагретый до 37°С, добавлялик образцам плазмы в качестве активатора фибриногена при индукции образования сгустка.
Следующие материалы добавляли в различные кюветы, содержащие фибриновый сгусток:
- раствор плазмина 0,5 мЕ, 5 мЕ, 50 мЕ, 500 мЕ и 1 Ед,
- растворы HAS3 в концентрациях 25 мг/мл, 50 мг/мл, 100 мг/мл, 150 мг/мл и 200 мг/мл.
Изменение спектральной поглощательной способности при 405 нм в течение 60 секунд оценивали спектрофотометрически для каждой кюветы. Реакционную смесь оставляли для продолжения взаимодействия до тех пор, пока не происходило полное растворение сгустка.
Коагулированную плазму, раствор плазмина и раствор HAS3 200 кД и HAS3 20 кД смешивали в соотношении 1:1 об./об. и поддерживали при рабочей температуре 37°C.
Таблица 1. Фибринолитическая активность ПЛАЗМИНА
В таблице показаны средние величины mAb/мин (среднее изменение спектральной поглощательной способности/мин), зарегистрированные в содержащих коагулированную плазму кюветах, в которые был добавлен плазмин в различных концентрациях. Указанные величины указывают скорость, с которой растворяется фибриновый сгусток, и, следовательно, скорость, с которой продуцируются FDP. Фибринолитическая активность плазмина пропорциональна его концентрации.
Средние величины mAb/мин, зарегистрированные для каждой концентрации плазмина, в последующем наносили на график зависимости от соответствующих единиц фермента для установления математической функции, которая коррелирует величины mAb/мин с единицами фермента.
ПЛАЗМИН: фибринолитическая активность (mAb/мин)
Таблица 2. Фибринолитическая активность HAS3 при различных величинах молекулярной массы
Рассчитывали величины mAb/мин, зарегистрированные в содержащих коагулированную плазму кюветах, в которые добавляли HAS3 в различных концентрациях. Величины указывали скорость, с которой растворялся фибриновый сгусток, и, следовательно, скорость, с которой продуцировались FDP. Фибринолитическая активность HAS3 была пропорциональна ее концентрации. В таблице фибринолитическая активность HAS3 выражена в виде единиц-эквивалентов плазмина.
Фибринолитическая активность HAS3 (200 кД) (выраженная в мЕ эквивалентах плазмина)
Фибринолитическая активность HAS3 (10 кД) (выраженная в мЕ эквивалентах плазмина)
Результаты:
Проведенные эксперименты показали, что HAS представляет собой мощное фибринолитическое средство с эффективностью, равной плазмину. Плазмин представляет собой важный фермент, относящийся к группе гидролаз, который разрушает многие белки плазмы крови и, в частности, фибрин тромбов и сгустков крови. Разрушение фибрина называется фибринолизом. Недостаточность плазмина может привести к тромбозу, поскольку тромбы разрушаются неадекватно. Хотя HAS не является ферментом, ее активность оказалась эквивалентной ферментативному контролю, таким образом, обеспечивая возможность применения сульфатированного продукта в качестве нового фибринолитического средства, имеющего все преимущества неферментативной молекулы, такие как, например, устойчивость при комнатной температуре при гораздо более длительных периодах времени хранения и легкость включения в препаративные формы.
Пример 15
Оценка проницаемости через кожу HAS1 и HAS3 с различными величинами молекулярной массы
Оценка кожного всасывания диклофенака, включенного в препаративную форму в сочетании с HAS в сравнении с HA
Кожу, использованную для проведения экспериментов, получали из области живота пациентов в возрасте от 30 до 50 лет, перенесших операции хирургической редукции живота. Срезы кожи полной толщины замораживали после хирургического вмешательства и сохраняли при -20°C до момента проведения эксперимента, при котором образцы размораживали при комнатной температуре и осторожно отделяли от жировой ткани. Кожу делили на квадратные секции площадью 2,5 см2, погружали на одну минуту в воду при температуре 60°C и с помощью специального микропинцета осторожно отделяли роговой слой и эпидермис (SCE) от подлежащих тканей. Полученные образцы анализировали оптическим микроскопом и удаляли, если обнаруживались проколы. SCE собирали в нижней части ячейки Франца с эпидермисом, обращенном книзу, и роговым слоем, контактирующим с донорским раствором, который располагался выше. Площадь проникновения представляла собой круговую поверхность и составляла 0,636 см2. Нижнюю и верхнюю часть ячейки Франца осторожно фиксировали к SCE для отделения донорского отсека (объем донорского раствора: 0,50 мл) и акцепторного отсека (объем принимающего раствора 5,00 мл), объемы которых были точно откалиброваны. Растворители, подлежащие использованию, дегазировали для исключения образования пузырьков, которого необходимо избегать, особенно для принимающего раствора, температура которого поддерживается термостатом на уровне 37°C посредством термостатической бани с циркуляцией; в указанных условиях температура SCE составляла 31-33°C. Каждый эксперимент проводили в трех повторениях, и результат представляли в виде средней величины по трем экспериментам, выраженной в виде количества анализируемого вещества, которое проходило через единицу поверхности кожи за 24 часа.
Проникновение HA, HAS1 и HAS3 обеих молекулярных масс осуществляли из растворов при 3% (масс./об.), с выявлением количества проникающего раствора посредством анализа соответственно глюкуроновой кислоты и спектрометрии ICP (с индуктивно связанной плазмой) на сере.
Проникновение натриевой соли диклофенака осуществляли на самой соли в водном растворе, на соли в присутствии HA 200 кД в количестве 3% (масс./об.) и на соли в присутствии HAS3, полученной в соответствии с примерами 1-2, в количестве 3% (масс./об.). Во всех трех случаях, концентрация натриевой соли диклофенака в проникающем растворе была равна 1% (масс./об.). Концентрацию диклофенака определяли посредством анализа ВЭЖХ в обращенной фазе на аппарате Agilent 1200 Series и УФ выявления (254 нм), колонка C18, элюент ацетонитрил/вода/уксусная кислота при потоке 1,2 мл/мин.
Полученные результаты показаны в виде графика на Фиг. 12 и Фиг. 13:
На Фиг. 12 показано, что сульфатация HA значительно увеличивала ее проникновение через кожу и что этот результат особенно очевиден для средней молекулярной массы.
На Фиг. 13, с другой стороны, показано, как себя ведет HAS в качестве стимулятора кожного всасывания активного действующего начала диклофенака, удваивая его общее проникающее количество за 24 ч в отношении контроля и ассоциации с HA.
Пример 16
Оценка гидратирующей и защитной активности, полученной при использовании HAS, в сравнении с HA и контрольным основным кремом
20 человек в возрасте от 18 до 70 лет, не имевших кожной патологии и не получавших во время исследования фармакологическое лечение, ежедневно на кожу на уровне предплечья наносили определенные и постоянные количества тестируемых продуктов. Экспериментальными продуктами были:
- контроль: состоящий из гидратирующего основного крема
- основной крем (в качестве контроля), содержащий HA 200 кД 0,1%
- основной крем (в качестве контроля), содержащий HAS3 0,1%, полученную в соответствии с примерами 1-2
Способ получения
Загружали 90% воды и динатрий EDTA и Isocide PF. Нагревали до 65-70°C в соответствующем контейнере, растворяли Nikkomulese, Dermol 88 нагреванием до 65-70°C; соединяли жирную фазу с водной фазой под действием турбины. Охлаждали до 30-35°C, добавляли Kemipure 100, растворенный в остальных 10% воды, добавляли Sepigel для регулировки вязкости и охлаждали до 25°C.
Разность полученных величин гидратации оценивали посредством корнеометра CM825 по средней величине 3 точек и проводили также профилометрический анализ поверхности кожи с использованием видеокамеры Visioscan VC98 во время T0 (исходная величина) и T7, после 7 дней применения продукта.
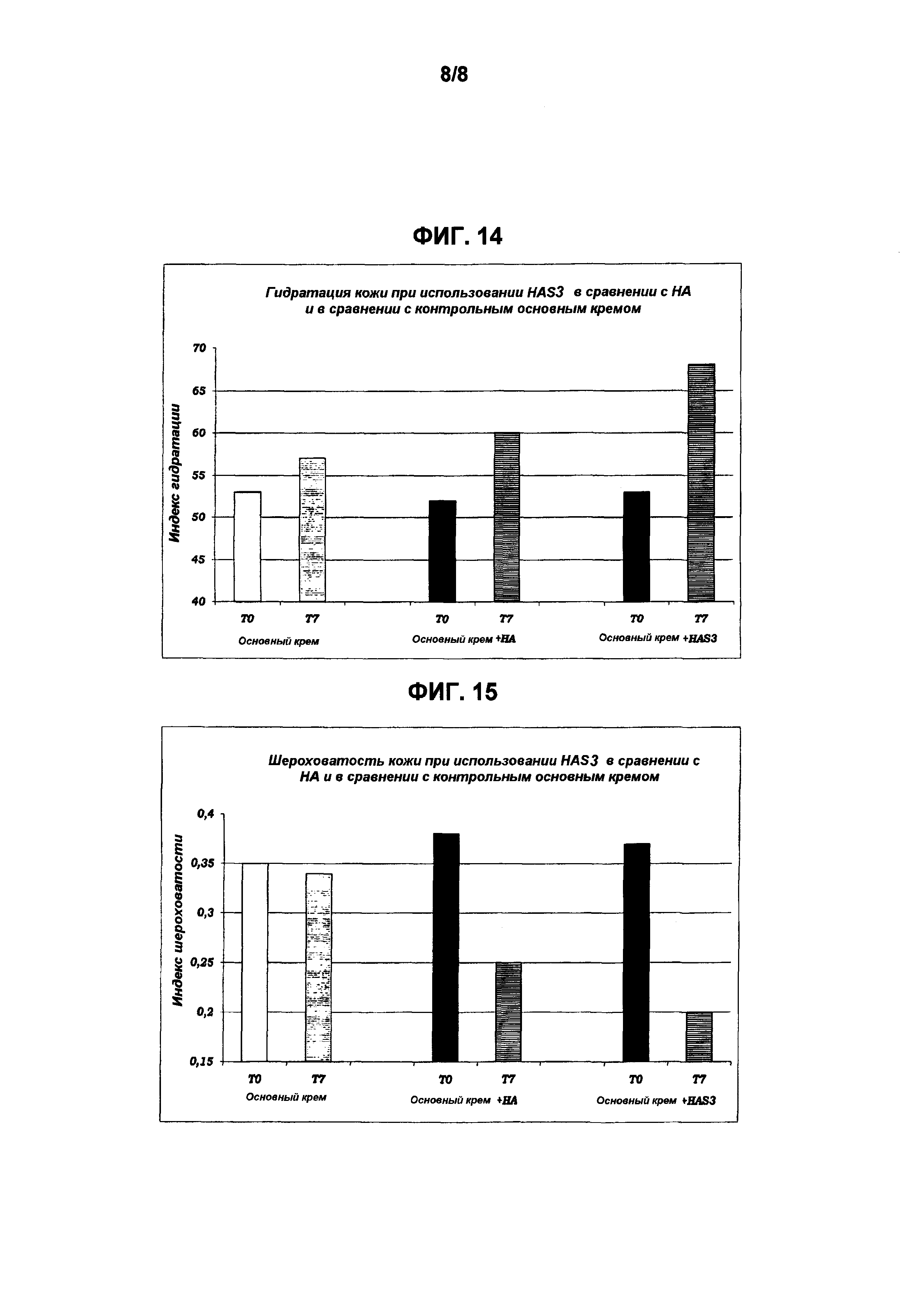
Полученные результаты представлены в виде графика на Фиг. 14 и 15:
Фиг. 14 показывает больший гидратирующий эффект на кожу после обработки HAS3, в сравнении и с основным кремом, и с кремом, содержащим HA. С другой стороны, на Фиг. 15 демонстрируется значительное снижение индекса шероховатости кожи после 7 дней обработки в отношении контролей. Эти данные ясно демонстрируют эффективность HAS в выраженном улучшении индекса гидратации кожи, показывая эффективную гидратацию и защитную активность при действии на кожу путем снижения транспирации трансэпидермальной воды.
Пример 17
Получение препаративной формы в виде раствора для ингаляций, содержащего HAS степени 1
40 мг (или 20 мг, если HAS имеет молекулярную массу 500-730 кД) сульфатированной гиалуроновой кислоты степени 1, имеющей низкую или среднюю молекулярную массу, вводили в стеклянную колбу объемом 50 мл, после чего добавляли 15 мл стерильного 0,2M PBS (солевого раствора с фосфатным буфером) с pH 7,4. Смесь подвергали перемешиванию в течение примерно 30 минут до полного растворения порошка. Когда было получено полное растворение, добавляли 2 мл пропиленгликоля и далее 0,2M стерильного PBS с pH 7,4 до достижения общего объема 20 мл. Перемешивание раствора продолжали в течение нескольких минут.
Пример 18
Получение препаративной формы в виде раствора для ингаляций, содержащей HAS степени 3
100 мг сульфатированной гиалуроновой кислоты степени 3 (HAS3), полученной из HA 200 кД, вводили в стеклянную колбу объемом 50 мл, после чего добавляли 15 мл стерильного 0,2M PBS с pH 7,4. Смесь подвергали перемешиванию в течение примерно 30 минут до полного растворения порошка. Когда было получено полное растворение, добавляли 2 мл пропиленгликоля и далее 0,2M стерильного PBS с pH 7,4 до достижения общего объема 20 мл. Перемешивание раствора продолжали в течение нескольких минут.
Пример 19
Получение препаративной формы в виде гидрофильного геля, содержащей HAS, HA и CMC
Метил- и пропилпарабен растворяли в очищенной воде при 80°C. После охлаждения раствора до комнатной температуры, добавляли гиалуронат натрия при перемешивании до растворения с последующим добавлением HAS1 (или HAS3), продолжая перемешивание до полного растворения. Затем в условиях перемешивания добавляли глицерин и пропиленгликоль до полного растворения. Наконец, добавляли карбоксиметилцеллюлозу (CMC) натрия и смесь смешивали до получения гелеобразного раствора.
Пример 20
Получение препаративной формы, содержащей HAS и HA, в виде гидрофильного геля (без консервантов) для нанесения на слизистые оболочки
Гиалуронат натрия, а затем HAS1 (или HAS3) растворяли при перемешивании в количестве воды, составлявшем примерно 90% количества, предусмотренного препаративной формой. Добавляли пропиленгликоль, Symdiol 68 с последующим добавлением MP Diol Glycol, смешивая до полного растворения различных компонентов. В последующем добавляли Карбомер 974P и перемешивание продолжали до получения однородной дисперсии последнего. Гранулы гидроксида натрия растворяли в оставшихся 10% воды и данный раствор медленно добавляли к ранее полученному раствору, смесь смешивали для застудневания водной фазы.
Пример 21
Получение препаративной формы в виде гидрофильного геля, содержащей HAS и гиалуронидазу
Метил- и пропилпарабен растворяли в очищенной воде при 80°C. После охлаждения раствора до комнатной температуры добавляли фермент гиалуронидазу при перемешивании с последующим добавлением HAS3, продолжая перемешивание до полного растворения двух компонентов. В последующем добавляли Карбомер 974P и перемешивание продолжали до получения однородной дисперсии последнего. Затем добавляли TEA (тетраэтиламмоний) для застудневания водной фазы. Наконец, при перемешивании добавляют глицерин и пропиленгликоль.
Пример 22
Получение препаративной формы в виде гидрофильного геля (эмульсии масло-в-воде), содержащей HAS и гиалуронидазу
Масляную фазу получают расплавлением жидкого парафина, стеариновой кислоты и Tefose 1500 в условиях перемешивания при 50°C. Водную фазу получают отдельно первоначальным растворением при 80°C метилпарабена и последующим охлаждением до комнатной температуры и конечным включением глицерина, гиалуронидазы и в последующем HAS3 при перемешивании до полного растворения различных компонентов.
Водную фазу соединяют с масляной фазой и осуществляют эмульгирование; полученную эмульсию масло-в-воде охлаждают до комнатной температуры при перемешивании.
Пример 23
Получение препаративной формы, содержащей HAS и гиалуронидазу, в виде пены
Метил- и пропилпарабен растворяют в очищенной воде при 80°C. После охлаждения раствора до комнатной температуры добавляют фермент гиалуронидазу при перемешивании с последующим добавлением HAS3, продолжая перемешивание до полного растворения. Затем добавляют пропиленгликоль и смесь смешивают до полного растворения; в последующем включают поливинилпирролидон, смешивая до полного растворения, и, наконец, добавляют полисорбат 80, продолжая перемешивание до растворения.
Затем осуществляют распределение фаз полученного раствора в цилиндре повышением давления пропеллентом изобутаном, н-бутаном, пропаном.
Пример 24
Получение препаративной формы, содержащей HAS и гиалуронидазу, в виде мази
Мазевую основу получают расплавлением легкого жидкого парафина и белого вазелина при перемешивании при 70°C. После охлаждения до комнатной температуры включают гиалуронидазу при перемешивании с последующим добавлением HAS3, и смесь смешивается до получения однородной суспензии.
Пример 25
Получение препаративной формы, содержащей HAS и гиалуронидазу, в виде липогеля
Легкий жидкий парафин, белый вазелин и цетилстеариловый спирт расплавляют при перемешивании при 90°C. При перемешивании добавляют образующий липогель агент, гидрированное касторовое масло, до получения однородного раствора и смесь затем медленно охлаждают до комнатной температуры. Наконец, включают гиалуронидазу и HAS3, и смесь смешивают до получения однородной суспензии.
Пример 26
Получение препаративной формы, содержащей HAS и HA, в виде губной помады
Нужное количество жидкого парафина, указанное в изготавливаемом составе, загружают в подходящий контейнер. Его нагревают до 88-92°C и затем при перемешивании добавляют белый мягкий парафин, твердый парафин, белый пчелиный воск, церезин и арлацел; перемешивание продолжают до полного расплавления различных компонентов. Затем включают рацемическую смесь альфа-токолферола ацетата, аллантоин, бутилгидрокситолуол, пропил-п-гидроксибензоат и смесь смешивают до полного растворения, поддерживая температуру массы на уровне 88-92°C.
Количество очищенной воды, предусмотренное в составе, загружают отдельно в подходящий контейнер, затем при перемешивании добавляют гиалуронат натрия, HAS1 (или HAS3) до полного растворения с последующим добавлением динатрия эдетата, продолжая перемешивание до растворения.
Водную фазу переносят при перемешивании в контейнер, содержащий расплавленную массу, поддерживая температуру системы на уровне 88-92°C и продолжая перемешивание до получения прозрачного раствора. Затем при перемешивании добавляют два ароматизирующих агента, и смесь смешивают в течение 10 мин. Расплавленную массу выливают в пресс-формы и немедленно охлаждают до T<0ºC до получения твердых брикетов.
Пример 27
Получение препаративной формы, содержащей HAS и HA, в виде влагалищных суппозиториев
Желатину дают возможность набухнуть в 70% очищенной воды при 85°C; гиалуронат натрия и HAS1 (или HAS3) растворяют в остающемся количестве воды, и этот раствор смешивают с глицерином, доведенным до такой же температуры. Раствор глицерина добавляют к раствору набухшего желатина, и перемешивание продолжают до полного растворения желатина. Массу выливают в пресс-формы и охлаждают до T<0°C до получения твердых суппозиториев.
Пример 28
Получение препаративной формы, содержащей HAS и HA, в виде гидрофильного крема (эмульсии масло-в-воде)
Масляную фазу получают расплавлением жидкого парафина, стеариновой кислоты и тефозы 1500 при перемешивании при 50°C. Водную фазу получают отдельно первоначальным растворением при 80°C метилпарабена и последующим охлаждением до комнатной температуры и включением глицерина, гиалуроната натрия и в последующем HAS1 (или HAS3) при перемешивании до полного растворения различных компонентов.
Водную фазу соединяют с масляной фазой и осуществляют эмульгирование, полученную эмульсию O/A охлаждают при перемешивании до комнатной температуры.
Пример 29
Получение препаративной формы, содержащей HAS, в виде мази
Мазевую основу получают расплавлением легкого жидкого парафина и белого вазелина при перемешивании при 70°C. После охлаждения до комнатной температуры при перемешивании включают HAS1 (или HAS3), и смесь смешивают до получения однородной суспензии.
Пример 30
Получение препаративной формы, содержащей HAS3, HA и диклофенак, в виде гидрофильного геля
Метил- и пропилпарабен растворяют в очищенной воде при 80ºC. После охлаждения раствора до комнатной температуры, при перемешивании добавляют диклофенак натрия, гиалуронат натрия и затем HAS3, продолжая перемешивание до полного растворения двух компонентов. В последующем добавляют Карбомер 974P и перемешивание продолжают до получения однородной дисперсии последнего. Затем добавляют TEA для застудневания водной фазы. Наконец, при перемешивании включают глицерин и пропиленгликоль.
Пример 31
Получение препаративной формы, содержащей HAS3 и диклофенак, в виде гидрофильного крема (эмульсии масло-в-воде)
Масляную фазу получают расплавлением жидкого парафина, стеариновой кислоты и Тефозы 1500 при перемешивании при 50ºC. Водную фазу получают отдельно первоначальным растворением при 80°C метилпарабена и последующим охлаждением до комнатной температуры и конечным включением глицерина, диклофенака натрия и в последующем HAS3 при перемешивании до полного растворения различных компонентов.
Водную фазу соединяют с масляной фазой и осуществляют эмульгирование, полученную эмульсию масло-в-воде охлаждают при перемешивании до комнатной температуры.
Пример 32
Получение препаративной формы, содержащей HAS и диклофенак, в форме пены
Метил- и пропилпарабен растворяют в очищенной воде при 80°C. После охлаждения раствора до комнатной температуры при перемешивании добавляют диклофенак натрия с последующим добавлением HAS3, продолжая перемешивание до полного растворения. Затем добавляют пропиленгликоль и смесь смешивают до полного растворения; в последующем включают поливинилпирролидон, смешивая до полного растворения, и, наконец, полисорбат 80, продолжая перемешивание до растворения.
Затем осуществляют распределение фаз полученного раствора в цилиндре повышением давления пропеллентом изобутаном, н-бутаном, пропаном.
Пример 33
Получение препаративной формы, содержащей HAS и диклофенак, в виде пластыря
Данные эксперименты относятся к получению полимерной матрицы, содержащей HAS, для контрольного высвобождения лекарственных средств для местного применения, и в данном случае нестероидного противовоспалительного препарата натриевой соли диклофенака, которая улучшает дермальное и/или трансдермальное всасывание содержащегося в ней активного действующего начала, благодаря стимулирующему действию HAS. Рассматриваемая матрица предпочтительно содержит сополимеры акриловой кислоты и акриловых и/или метакриловых сложных эфиров с температурой стеклования (Tg) ниже чем комнатная температура, предпочтительно, ниже чем 0°C, чьи свободные карбоксильные группы, присутствующие в полимерной цепи, образуют соли с органическими основаниями (например, аммиаком, этилендиамином, сополимерами сложного эфира акриловой и/или метакриловой кислоты, имеющими катионную аммониевую функциональную группу в алкильной группе (предпочтителен EUDRAGIT® E100) или неорганическими основаниями (например, гидроксидами или карбонатом или бикарбонатом щелочных, щелочноземельных и переходных металлов), как известно специалистам в данной области. Сополимеры, обычно используемые в соответствии с настоящим изобретением, состоят из 2 или более мономеров в различных процентных долях; примерами данных мономеров являются:
- акриловая кислота
- бутил- и/или метилакрилат
- 2-этилгексилакрилат
- глицидилметакрилат
- винилацетат
На рынке имеется множество сополимеров (таких как Duro-tak® 280-2416, 280-2516, 87-2620, 87-2852, 380-1054, 87-2051, выпускаемых компанией National and Starch), растворенных в органических растворителях, с процентным содержанием свободных карбоксильных групп от 0,1 до 15%, которые могут быть превращены в соли органическими или неорганическими основаниями, как описано выше. Указанные сополимеры предпочтительно содержатся в матрице пластыря в количестве 30-90% масс.
Кроме того, могут быть получены содержащие HAS полимерные матрицы, включающие следующие два основных компонента:
- a: Полиметакрилаты: т.е. предпочтительны сополимеры сложного эфира акриловой и/или метакриловой кислоты, имеющие катионную аммониевую функциональную группу в алкильной группе (EUDRAGIT® E100, EUDRAGIT® RS и EUDRAGIT® RL). Указанные полимеры могут составлять от 10 до 40% масс. всей адгезивной матрицы после сушки, предпочтительно, от 10 до 25%.
- b: органическая дикарбоновая или трикарбоновая кислота (такая как, например, янтарная, фумаровая, адипиновая и лауриновая кислота), в качестве противоиона катионному компоненту a (кроме того, они действуют в качестве образующих сетчатость агентов компонента a). Компонент b может подбираться так, чтобы осуществлялась частичная или полная нейтрализация. Другой подходящий компонент b представляет собой кислотно-функциональные акрилатные и метакрилатные полимеры, например, полиакриловую кислоту Карбопол®. Компоненты b могут содержаться в % масс. в диапазоне от 1 до 40% масс. всей адгезивной препаративной формы после сушки, предпочтительно, от 1 до 20%.
Указанная выше полимерная матрица внутри конечной препаративной формы находится в диапазоне от 10 до 90% относительно сухой массы, предпочтительно, от 50 до 90% на основании сухой массы конечной композиции. Включенное количество активного действующего начала варьируется в отношении его природы и желательного дермального или трансдермального терапевтического эффекта. Оно обычно присутствует в количестве в диапазоне от 0,1 до 30% масс. в отношении сухой массы конечной композиции.
Препаративная форма может также содержать эксципиенты, успокаивающие средства, смягчающие средства, эмульгирующие средства, модуляторы адгезии, консерванты, пластификаторы, подкислители/буферы. Количества эксципиентов могут варьироваться в больших диапазонах, от 0,01 до 30%, в зависимости от их функции.
Стимулятор всасывания через кожу с успокаивающими, противозудными и антигиперемическими свойствами представляет HAS степени 1 или степени 3, предпочтительно, степени 3, присутствующая в концентрациях в диапазоне от 0,1 до 30% сухой массы конечной композиции. Указанная выше матрица обеспечивает регулируемое, постоянное проникновение активного действующего начала без раздражения и адгезивности к коже.
Способ получения
1 кг метакрилатного сополимера, выбранного (например, из Duro-tak® 280-2416, 280-2516 или 87-2852), имеющего содержание твердого вещества 30-40% масс./масс., добавляют при механическом перемешивании с 300 г 30% масс./масс. EUDRAGIT® E100 раствора на основе воды/растворителя; смесь оставляют при умеренном перемешивании на 30 мин. Затем добавляют активное действующее начало (100 г натриевой соли диклофенака) и HAS3, предварительно растворенную в водном растворе. Смесь оставляют при перемешивании до полного растворения. Для получения матричного слоя данную смесь затем наслаивают поверх пленки силиконового полиэфира/бумаги, и сушку осуществляют выпариванием остаточных растворителей. Распределенная поверх пленки матрица имеет сухую массу примерно 60 г/м2. Полученную таким образом матрицу затем соединяют с не плетеной полиэфирной тканью или полиэтиленовой пленкой для окончательного образования пластыря.
Конечная композиция каждой отдельной трансдерсмальной системы содержит 140 мг диклофенака и 40 мг HAS3.
Очевидно, что способы, представленные в настоящем описании, могут быть модифицированы различными путями. Указанные модификации не должны рассматриваться как отклоняющиеся от сущности и перспектив изобретения, и все модификации, которые с очевидностью может предложить специалист в данной области, включены в объем следующей формулы изобретения.
Реферат
Изобретение относится к фармацевтической промышленности и представляет собой применение сульфатированной гиалуроновой кислоты для местного нанесения для профилактики и/или лечения простого герпеса губ и половых органов, вируса везикулярного стоматита и цитомегаловируса, причем указанная сульфатированная гиалуроновая кислота (HA) имеет молекулярную массу в диапазоне от 10000 до 50000 Да, от 150000 до 250000 Да или от 500000 до 750000 Да и степень сульфатации, равную 1 или 3. Изобретение обеспечивает высокую активность против простого герпеса губ и половых органов, вируса везикулярного стоматита и цитомегаловируса. 2 н. и 5 з.п. ф-лы. 15 ил., 4 табл., 32 пр.

Комментарии