Производные сульфатированных полисахаридов, их способ получения, модификация и применение - RU2708327C2
Код документа: RU2708327C2
Чертежи


Описание
Область изобретения
Изобретение относится к производным сульфатированных полисахаридов, имеющих сопряженную двойную связь в 4-м и 5-м положениях галактопиранозного кольца, расположенного в 6-м положении относительно альдегида. Кроме того, изобретение относится к способу их получения, модификации и применения.
Предпосылки создания изобретения
Гликозаминогликаны представляют собой линейные полисахариды, состоящие из аминогексозы и уроновой кислоты, за исключением кератинсульфата. Они составляют большую часть внутриклеточного матрикса соединительной ткани, в частности хряща, связок и сухожилий. Сульфированные полисахариды, напр., хондроитинсульфат или дерматансульфат, также, помимо гиалуроновой кислоты, являются важными примерами гликозамингликанов.
Хондроитинсульфат представляет собой линейный, сульфатированный и отрицательно заряженный гликозаминогликан, состоящий из повторяющихся мономерных звеньев N-ацетил-D-галактозамина и D-глюкуроновой кислоты, присоединенных друг к другу через β(1→3) и β(1→4) O-гликозидные связи (структурную формулу хондроитинсульфата см. ниже).

где
R1 представляет собой Н или Na,
R2 представляет собой Н, -SO2-OH или -SO2-ONa
Хондроитинсульфат получают из соединительных тканей животных, где он связывается с белками и, таким образом, образует часть протеогликанов. Сульфатирование хондроитина осуществляют с помощью сульфотрансфераз в различных положениях и различных видов. Уникальная картина сульфатирования конкретных позиций в полимерной цепи кодирует специфическую биологическую активность хондроитинсульфата. Хондроитинсульфат является важным строительным компонентом хряща в суставах, придавая им сопротивление сжатию и восстанавливая баланс состава смазочных материалов (Baeurle S.A., Kiselev М.G., Makarova Е.S., Nogovitsin Е.А. 2009. Polymer 50: 1805). Вместе с глюкозамином хондроитинсульфат применяют в качестве пищевой добавки для лечения или предотвращения остеоартрита у людей (напр., Flextor®, Advance Nutraceutics, Ltd.) или животных (напр., Gelorendog®, Contipro Pharma, Ltd.). С фармацевтической точки зрения, хондроитинсульфат считается лекарственным средством с отсроченной реакцией обезболивания при дегенеративных заболеваниях суставов (Aubry-Rozier В. 2012. Revue

Дерматансульфат представляет собой линейный, сульфатированный и отрицательно заряженный гликозаминогликан, состоящий из повторяющихся мономерных звеньев N-ацетил-D-галактозамина и L-идуроновой кислоты, присоединенных друг к другу через β(1→3) и β(1→4) О-гликозидные связи (структурную формулу дерматансульфата см. ниже).

где
R1 представляет собой Н или Na,
R2 представляет собой Н, -SO2-OH или -SO2-ONa
Дерматансульфат отличается от хондроитинсульфата присутствием L-идуроновой кислоты, которая представляет собой С5-эпимер D-глюкуроновой кислоты. Обратная конфигурация идуроновой кислоты обеспечивает лучшую гибкость дерматансульфатных цепей и обеспечивает их специфическое взаимодействие гликозамин-гликопротеин в окружающей области. Эти взаимодействия способствуют регуляции нескольких клеточных процессов, таких как миграция, пролиферация, дифференцировка или ангиогенез. Трансформация хондроитинсульфата в дерматансульфат обеспечивается с помощью трех ферментов: дерматансульфат-эпимеразы 1 (DS-epi1), дерматансульфат-эпимеразы 2 (DS-epi2) и дерматан-4-О-сульфотрансферазы (D4ST1). Реакция эпимеризации глюкуроновой кислоты в идуроновую кислоту вместе с методом сульфатирования является не случайной, а специфически ферментативно контролируемой, что приводит к кодированию информации, касающейся функции сконструированного гликозаминогликана (Thelin М., et al. 2013. FEBS Journal 280: 2431).
Каррагинаны представляют собой группу линейно сульфатированных полисахаридов, полученных экстракцией красных морских водорослей. Их основными строительными единицами являются галактоза и ее 3,6-ангидропроизводное, которые связаны друг с другом через α(1→3) или β(1→4) О-гликозидные связи. Существует три основных типа каррагинана, которые отличаются степенью сульфатирования и водорастворимости. Каппа-каррагинан имеет один сульфат на димер и образует жесткие гели в воде. Йота-каррагинан содержит два сульфата и образует мягкие гели, тогда как лямбда-каррагинан с тремя сульфатами не обладает гелеобразующими свойствами. Каррагинан является альтернативой животному желатину для вегетарианцев и веганов. Он используется для сгущения и стабилизации пищевых продуктов и в качестве эмульгатора в фармацевтической и текстильной промышленности.
Окисление гликозаминогликанов
Благодаря их функциональному разнообразию полисахариды могут окисляться в различных положениях (Cumpstey I., 2013. ISRN Organic Chemistry, 1). В случае гликозамингликанов существует три способа окисления. В первом случае первичный гидроксил окисляется с образованием карбоновой кислоты. Наиболее часто для окисления используется комбинация TEMPO/NaClO (Jiang В., et al. 2000. Carbohydrate Research 327: 455; Huang L. et al. 2006. Chemistry, 12: 5264). Из-за стерической объемности TEMPO этот способ является региоселективным только для первичных гидроксилов.
В противоположность этому, второй способ приводит к окислению вторичных гидроксилов с образованием дикетоновых соединений. В этом случае в качестве окислителей используют оксиды переходных металлов на основе Cr(VI) (Hassan R., et al. 2013. Carbohydrate Polymers, 92: 2321) или Mn(VII) (Gobouri A.A., et al. 2013. International Journal of Sciences, 2:1; Zaafarany I.A., et al. 2013. Journal of Materials Science Research, 2: 23).
Третий тип окисления основан на окислении периодатом (IO4-), который также атакует вторичные гидроксильные группы, но одновременно разрывается пиранозное кольцо (Dawlee S. et al. 2005. Biomacromolecules, 6: 2040; Liang Y., et al. 2011. Colloids and Surfaces B: Biointerfaces, 82: 1; Xu Y., et al. 2012. Carbohydrate Polymers, 87: 1589). Bo время окисления сначала формируется диальдегид, а затем он окисляется до дикарбоновой кислоты.
Все вышеупомянутые способы окисления имеют несколько недостатков. В случае окисления с использованием TEMPO/NaClO вместо желаемого С6-альдегида предпочтительным является образование полиуроновой кислоты. Условия реакции для количества альдегида необходимо оптимизировать, как это было продемонстрировано в случае гиалуроновой кислоты (Buffa R., et al., WO 2011069475,

Несмотря на то что хемоселективный ход реакции может быть достигнут окислением периодатом, этот способ не является предпочтительным из-за резкого снижения молекулярной массы полимера и необратимого расщепления пиранозного кольца, что приводит к потере нативного характера полисахарида.
Что касается использования окислителей, полученных из оксидов переходных металлов, то окисленные полисахариды не могут использоваться для биомедицинских применений из-за их высокой токсичности (Normandin L., et al. 2002. Metabolic Brain Disease, 17: 375; Katz S.A., et al. 2006. Journal of Applied Toxicology, 13: 217).
Реакции дегидратации окисленных производных полисахаридов
Присутствие альдегида в структуре полисахарида приводит к кислотному характеру атома водорода в соседнем α-положении. Этот водород становится легко доступным для реакций элиминирования при обычных условиях с образованием карбаниона, который стабилизируется конъюгацией с соседним альдегидом и, таким образом, вытесняет уходящую группу в β-положении (путь а, Схема 1). Элиминирование может протекать также в кислых условиях, когда активация уходящей группы происходит сначала с образованием карбаниона в β-положении (способ b, Схема 1). В реакционной смеси карбанион нейтрализуется свободной электронной парой в α-положении. Третий возможный способ может быть осуществлен без добавления основания или кислоты с одновременным удалением молекулы (путь с, Схема 1).

Схема 1. Реакция элиминирования в структуре альдегида: (а) образование карбаниона путем обработки основанием, механизм E1cb (b) образование карбаниона путем обработки кислотой, механизм Е1 (с) одновременное элиминирование, механизм Е2.
Целевая дегидратация альдегида гиалуронана в 6-м положении в глюкозаминовом кольце была описана в патенте (Buffa et al.: CZ 304512). Авторы описывают получение α,β-ненасыщенного альдегида гиалуронана и его использование в реакциях перекрестного сшивания. Раскрытый синтез включает использование стерически объемных органических оснований (напр., диизопропиламина, триметиламина), неорганических оснований, напр., Са(ОН)2 в смеси водно-органического растворителя типа DMSO, сульфолана в соотношении от 3/1 до 1/2 при более высоких температурах 50-60°С. Дегидратацию также проводят в твердом состоянии, нагревая полимер до 50-100°С в течение 4-5 дней. Авторы описывают окисление и дегидратацию гиалуроновой кислоты в две стадии и не описывают прямую дегидратацию во время стадии окисления. Это решение имеет существенный недостаток при двустадийном синтезе и использовании ненадлежащих условий реакции в присутствии каустических (коррозионных) агентов элиминирования, присутствии органического растворителя, необходимости повышенной температуры и длительного времени реакции. Все эти параметры приводят к тому, что синтез становится более дорогостоящим и более сложным с технологической точки зрения (напр., коррозия производственного аппарата, сложная очистка продукта, более высокая цена диполярных апротонных растворителей, таких как DMSO, сульфолана и элиминирующих агентов, таких как Et3N и DIPEA, высокий расход энергии и охлаждающей воды, более высокий риск опасных примесей в продукте, риск биосовместимости продукта, более высокая степень деградации полимера из-за основной среды и более высокой температуры). Указанные недостатки синтеза α,β-ненасыщенного альдегида НА согласно CZ 304512 в соответствии с настоящим изобретением успешно преодолеваются, так как синтез протекает в одном сосуде без необходимости выделения промежуточного продукта в виде насыщенного С6-альдегида, без добавления элиминирующего агента, без добавления органического растворителя, при комнатной температуре и с временем реакции порядка часов.
Реакция сшивания окисленных полисахаридов
Введение альдегида в структуру полисахарида позволяет дополнительно модифицировать полимерную цепь с помощью нуклеофильного добавления. Известно несколько патентных документов, описывающих связывание аминов с альдегидами. Типичным примером реакции гликозаминогликанов является реакция диальдегида, образующегося при окислении перйодатом, с различными низкомолекулярными (амины, гидразиды, алкоксиамины, семикарбазиды) или полимерными N-нуклеофилами (желатин, хитозан) или S-нуклеофилами (тиолы, аминотиолы) для получения биосовместимых гидрогелей (Dawlee S., et al. 2005. Biomacromolecules, 6: 2040; Weng L., et al. 2008. Journal of Biomedical Materiasl Research part A, 85: 352, Bergman K., et al.: WO 2009/108100, Hilborn J., et al.: WO 2010/138074). Поперечное сшивание альдегида гиалуроновой кислоты, полученного с использованием перйодинана Десса-Мартина или с использованием комбинирования TEMPO/NaClO с различными аминами, описано в патентных документах (Buffa R., et al.: WO 2011069474; Buffa R., et al.: WO 2011069475). α,β-Ненасыщенный альдегид гиалуроновой кислоты получали дегидратацией С6-альдегида в субъединице N-ацетил-D-глюкозамина (Buffa R., et al: CZ 304512). В дополнение к окисленным производным гиалуроновой кислоты авторы описывают также их использование в реакции с алифатическими, ароматическими аминами, имеющими необязательное содержание атомов N, S или О. Однако они синтезируются при высоких температурах и с использованием агрессивных средств для элиминирования, что значительно неблагоприятно для поддержания их биологической активности из-за их возможной денатурации и наличия побочных продуктов. Кроме того, упомянуты реакции сшивания α,β-ненасыщенного альдегида гиалуроновой кислоты с деацетилированными полисахаридами в качестве многофункционального амино линкера для иллюстрации преимущества конъюгации альдегида из полисахарида, влияющей на реологические свойства получаемых гидрогелей. Однако гидрогели, полученные таким образом, не обладают удовлетворительными механическими свойствами, особенно в отношении жесткости гидрогеля.
Сущность изобретения
Целью изобретения является получение сульфатированных полисахаридов в мягких условиях реакции за более короткое время и без использования нежелательных примесей элиминирующих агентов или органических растворителей. Этот способ предотвращает значительную деградацию и потерю биологических свойств сульфатированных полисахаридов, которые важны для тканевой инженерии, регенеративной медицины или биомедицинских применений. Задача изобретения состоит в получении производных сульфатированных полисахаридов, имеющих в составе своей полимерной цепи по меньшей мере одно галактопиранозное кольцо, модифицированное в соответствии с общей формулой I или II, причем указанное кольцо содержит двойную связь в 4-м и 5-м положениях с конъюгированным альдегидом или его гидратированной формой соответственно (общая формула II)
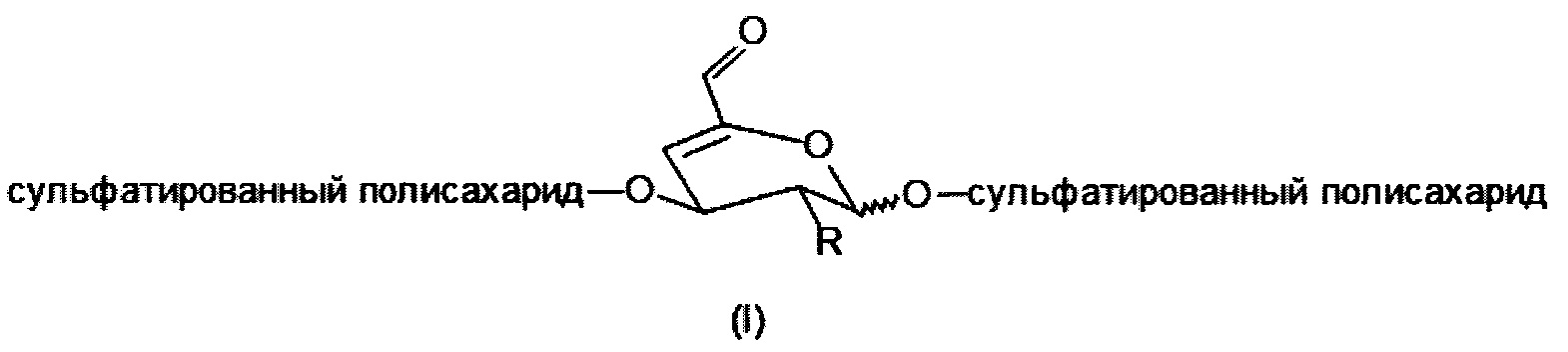

где
R представляет собой ОН, O-SO2-OH, O-SO2-ONa или NH-C(O)-CH3.
Необходимым условием является использование сульфатированных полисахаридов, содержащих по крайней мере одно галактопиранозное кольцо в их цепи, причем это кольцо сульфатировано в 4-м положении и одновременно связано в цепи через α(1→3) или β(1→3) О-гликозидную связь в соответствии с общей структурной формулой III.

где
R представляет собой ОН, O-SO2-OH, O-SO2-ONa или NH-C(O)-CH3
R1 представляет собой Н или Na.
Полисахарид предпочтительно выбирают из группы, включающей хондроитинсульфат, дерматансульфат, каррагенан и их фармацевтически приемлемые производные и/или соли, и его молекулярная масса предпочтительно находится в диапазоне от 1×103 до 5×104 г. моль-1, а степень замещения в диапазоне от 1 до 40%, предпочтительно от 10 до 25%. В формуле I или II соответственно, термин «степень замещения» относится к степени модификации ненасыщенного альдегида или его гидратированной формы соответственно.
Это решение позволяет стабилизировать конъюгаты сульфатированных полисахаридов с аминами посредством множественной связи из альдегида, поэтому значительно более широкий диапазон аминов может быть более стабильно связан с модифицированными полисахаридами таким образом (Схема 2) в физиологических условиях.

где
R представляет собой ОН, O-SO2-OH, O-SO2-ONa или NH-C(O)CH3
R2 представляет собой алкил, арил, гетарил.
Схема 2. Связывание амина с α,β-ненасыщенным альдегидом сульфатированного полисахарида.
Кроме того, изобретение относится к способу получения производного общей структурной формулы I или II, где сульфатированный полисахарид, который является водорастворимым в его нативной форме и содержит в своей структуре по меньшей мере одну галактопиранозную единицу, сульфатированную в 4-м положении, где эта единица, связанная в полимерной цепи через α(1→3) или β(1→3) O-гликозидную связь, сначала окисляется до альдегида в 6-м положении и сразу после окисления в текущей реакционной смеси обеспечивает α,β-ненасыщенный альдегид посредством прямого элиминирования (Схема 3).

где
R представляет собой ОН, O-SO2-OH, O-SO2-ONa или NH-C(O)CH3
R1 представляет собой Н или Na.
Схема 3. Способ получения α,β-ненасыщенного альдегида в структуре сульфатированного полисахарида.
Селективное окисление первичной гидроксильной группы в 6-м положении галактопиранозы может быть реализовано, напр., с помощью системы окисления 2,2,6,6-тетраметил-1-пиперидинилоксильного радикала R3-TEMPO/NaClO, где R3 представляет собой водород или N-ацетил, в воде или водном растворе неорганических солей. Предпочтительно эта стадия протекает в воде при температуре от 5 до 25°С, более предпочтительно от 5 до 10°С, где молярное количество NaClO находится в пределах от 0,1 до 2,0 эквивалентов и молярное количество R3-TEMPO находится в пределах от 0,01 до 0,2 эквивалентов по отношению к сульфатированному полисахаридному димеру. Молекулярная масса исходного сульфатированного полисахарида находится в пределах от 1×104 до 5×106 г. моль-1, и он должен содержать галактопиранозные единицы, сульфатированные в 4-м положении, и он связан через α(1→3) или β(1→3) О-гликозидные связи в полимерной цепи. Предпочтительно, исходным сульфатированным полисахаридом является хондроитинсульфат, дерматансульфат, каррагинан или их фармацевтически приемлемое производное и/или соль. Водный раствор солей может быть, напр., водным раствором, содержащим соль щелочного металла, и/или буфером, напр., PBS.
Реакция элиминированиия окисленного и сульфатированного полисахарида протекает сразу же после окислительной стадии в той же реакционной смеси без необходимости добавления элиминирующего агента, особенно кислоты или основания, органического растворителя или без повышения температуры реакции и без выделения насыщенного С6-альдегида в субъединице галактопиранозы, сульфатированной в 4-м положении. Реакция элиминирования протекает в воде или в водных растворах неорганических солей (напр., солей щелочных металлов) или буферах (напр., PBS) при температуре 5-25°С и нет необходимости в дополнительном времени реакции. Кроме того, стадия элиминирования пропорциональна достигнутой стадии окисления в реакционной смеси. Способ получения α,β-ненасыщенного альдегида объединяет две реакционные стадии (окисление и элиминирование) в одном сосуде без выделения промежуточного соединения со стадии окисления. Окисление приводит к α,β-ненасыщенному альдегиду вместо насыщенного С6-альдегида в структуре сульфатированного полисахарида. В сопоставлении со способом получения α,β-ненасыщенного альдегида гиалуроновой кислоты (Buffa R et al.: CZ 304512) представленный подход отличается и определенно выгоден по параметрам, перечисленным в Таблице 1.

В Таблице 1 выше ясно показано, что способ получения сульфатированных производных полисахарида согласно изобретению приводит непосредственно к образованию α,β-ненасыщенных альдегидов вместо их насыщенных аналогов. Другое отличие предлагаемого способа изобретения состоит в том, что оно не применимо к полисахаридам, упомянутым в уровне техники, поскольку присутствие сульфата необходимо для процесса. Другие преимущества относятся к реакции, протекающей исключительно в воде, без необходимости добавления какого-либо органического растворителя или любого элиминирующего агента. Кроме того, реакция протекает при комнатной температуре (20-25°С) с коротким временем реакции (1-2 ч) без выделения насыщенного С6-альдегида. Вышеупомянутый способ приводит к получению производных сульфатированных производных, имеющих общие формулы I и/или II, DS в пределах от 20 до 25%. Способ их получения технологически интересен и существенно более предпочтителен с точки зрения времени и стоимости по сравнению с известными способами.
Учитывая химическую модификацию, α,β-ненасыщенный альдегид в сульфатированных полисахаридах может использоваться, главным образом, для реакций конденсации с различными N-нуклеофилами. Альдегид в роли реакционноспособного электрофильного центра сохраняет свою стабильность и реакционную способность также в воде, которая может быть предпочтительно использована для упомянутого связывания (сопряжения) биосовместимых аминов с производными общих формул I и II. Термин «амин» хорошо известен специалисту в данной области техники и может без каких-либо ограничений представлять собой алкиламин, ариламин, гетариламин, аминокислоту, пептид или полимер со свободной аминогруппой. Последний может быть непосредственно включен в полимер или связан с помощью подходящего линкера, который может быть линейным или разветвленным, необязательно содержащим атомы N, S или О. Под термином «полимер с аминогруппой» понимают деацетилированньш полисахарид, белок, пептид или другой биополимер или биосовместимый синтетический полимер.
Таким образом, изобретение также относится к способу модификации производного общей формулы I или II, где производное реагирует с амином общей формулы R2-NH2, где R2 представляет собой алкил, арил, гетероарил, линейную или разветвленную C1-С30 цепь, необязательно содержащую атомы N, S или О. Амин предпочтительно представляет собой биологически активный амин, особенно аминокислоту или пептид, или биологически приемлемый полимер, содержащий свободную аминогруппу, где эта аминогруппа является неотъемлемой частью полимера (напр., желатин, хитозан, деацетилированная гиалуроновая кислота, деацетилированный хондроитинсульфат и т.д.) или связана с полимером посредством линкера, содержащего амино, гидразин, гидразид, аминоалкокси, гидроксильную, карбоксильную, тиольную группу или любую их комбинацию. Молярное количество амина может быть предпочтительно в пределах 0,05-3 эквивалентов по отношению к димеру сульфатированного полисахарида. Связывание амина может протекать в воде, фосфатном буфере или системе вода-органический растворитель при температуре в диапазоне от 20 до 60°С в течение от 10 минут до 150 часов. Под подходящим органическим растворителем понимается смешивающийся с водой спирт, предпочтительно изопропанол или этанол, и смешивающиеся с водой апротонные растворители, предпочтительно диметилсульфоксид, причем их содержание в реакционной смеси не превышает 50% (об./об.). Реакцию с амином можно предпочтительно проводить в физиологических условиях (pH=7,4 и T=37°С). Помимо аминов, реакция протекает также с другими N-нуклеофилами, содержащими в своей структуре аминогруппу, такими как гидразины, гидроксиламины, гидразиды, семикарбазиды или тиосемикарбазиды. В случае реакции с монофункциональными N-нуклеофилами, они связаны с полимером, где использование би- и полифункциональных N-нуклеофилов обеспечивает сшивание полимерных цепей, т.е. образование гидрогелей. В зависимости от типа используемого N-нуклеофила его количество относительно отношения участков связывания, структуры полимера, концентрации раствора, степени замещения и молекулярной массы полимера, сшитых полимеров с широким диапазоном вязкоупругих и механических свойств может быть получено точно в соответствии с потребностями предполагаемых применений в тканевой инженерии или регенеративной медицине. В некоторых конкретных случаях реакция производного по изобретению с амином может протекать во всем диапазоне рН, где в других случаях значение рН важно для реакции. Специалист в данной области техники может заранее распознать его или определить посредством рутинных измерений.
Предполагаемые применения предназначены, в основном, для подготовки каркасов в качестве биологически активных и биоразлагаемых материалов подложек, имитирующих внеклеточный матрикс. Эти материалы могут служить носителями для клеток или биологически активных веществ, клеточных аттрактантов, в качестве среды-носителя для доставки клеток к месту дефекта ткани, в качестве тканевого наполнителя, адекватного заменителя ткани или защитного барьера. Другие требования, предъявляемые к функциональным каркасам, включают обеспечение подходящей химической и физиологической среды для пролиферации и дифференцировки клеток, транспортировки питательных веществ и отходов клеточного метаболизма. В зависимости от способа применения каркаса можно получить инъекционные каркасы из сшитых сульфатированных полисахаридов в форме гелеобразующих растворов, в которых каркас и новая ткань образуются in vivo, или твердых каркасов, которые имплантированы в организм после культивирования клеток и образования новой ткани in vitro. Кроме того, правильный выбор параметров реакции поперечного сшивания (концентрации и соотношения участков связывания) позволяет достичь коротких периодов гелеобразования порядка секунд (см. Пример 30), которые могут быть предпочтительно использованы для гелеобразования in situ при наличии биологического материала, так называемое инкапсулирование клеток. Реакция сшивания показана на Схеме 4:
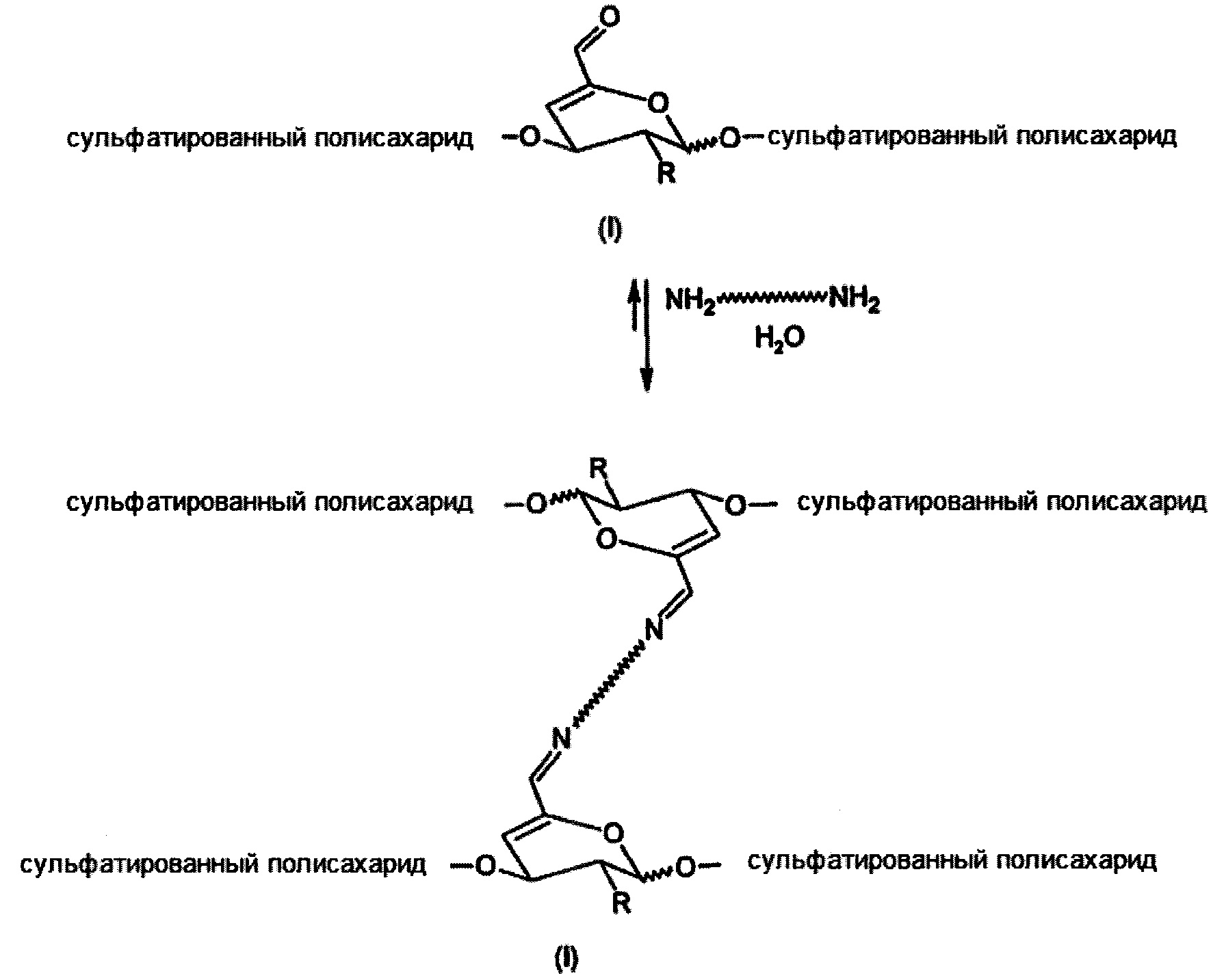
где
R представляет собой ОН, O-SO2-OH, O-SO2-ONa или NH-C(O)CH3
Схема 4. Сшивание сульфатированного полисахарида с помощью α,β-ненасыщенного альдегида и диамина.
Более высокая стабильность связи амина с α,β-ненасыщенным альдегидом по сравнению с обычным насыщенным альдегидом обеспечивается посредством конъюгации альдегида с соседней двойной связью. Таким образом, могут быть получены более стабильные и лучше сшитые материалы на основе сульфатированных полисахаридов, чем показанные на примере несульфатированного полисахарида гиалуроновой кислоты (Buffa R.,et al: CZ 304512).
Сшивание осуществляют путем взаимодействия производного с водорастворимым биосовместимым би- и полифункциональным N-нуклеофилом, выбранным из группы, включающей алкиламины, ариламины, гетероалкиламины, гетариламины, аминокислоты, пептиды, полимеры со свободной аминогруппой, гидразины, гидроксиламины, гидразиды, семикарбазиды или тиосемикарбазиды, при котором происходит сшивание производного. Предпочтительные нуклеофилы включают гидразиды, дигидразиды, деацетилированные полисахариды или алкоксиамины. Реакция может предпочтительно протекать в фосфатном буфере.
Однако сравнительный анализ механических свойств (модуль упругости Юнга при сжатии, предел упругости при сжатии и скорость деформации сшитых гелей) показал более высокую плотность гелей, полученных из окисленного хондроитинсульфата (см. Пример 31 по изобретению) по сравнению с гелями на основе окисленного гиалуронана. Более высокая жесткость гелей отражает более высокую плотность сшивки в структуре полисахарида и, таким образом, обеспечивается более высокая стабильность объема и формы сшитого материала. Кроме того, улучшенные сшитые материалы с течением времени демонстрируют меньшие изменения в механических свойствах и, таким образом, удовлетворяют потребности, связываемые с каркасом для функциональных клеток. В этом случае, более эффективное сшивание может быть достигнуто путем более высокой степени замещения α,β-ненасыщенного альдегида в структуре сульфатированного полисахарида (см. Таблицу 1 выше), что является одним из важных преимуществ по сравнению с предшествующим уровнем техники.
Второе преимущество более эффективно сшитых гелей заключается в более низкой скорости набухания в физиологической среде. Это может быть предпочтительно использовано для каркасов в тканевой инженерии, где желательны контролируемые характеристики материала в живом организме при контакте с тканью без существенных изменений их механических свойств, или формы, или объема.
Третьим преимуществом более высокой степени замещения α,β-ненасыщенного альдегида в структуре сульфатированного полисахарида является возможность связывания более высокого количества, напр., биологически активного амина. Таким образом, для применения систем поддержки в месте воздействия может быть достигнута более высокая концентрация биологически активного вещества, для которых также может быть использовано описанное изобретение. Кроме того, предлагаемый способ позволяет связывать более широкий спектр биологически активных аминов (напр., аминокислот, пептидов), которые могут быть естественным образом высвобождены в их нативной (активной) форме. В нескольких примерах (бутиламин, лизин, RGD-пептид) неоднократно было обнаружено, что при более низком рН связь амин-α,β-ненасыщенный альдегид является менее стабильной (Схема 5), поэтому полученные конъюгаты могут предпочтительно использоваться для систем доставки лекарств на основе чувствительных к рН биоматериалов.
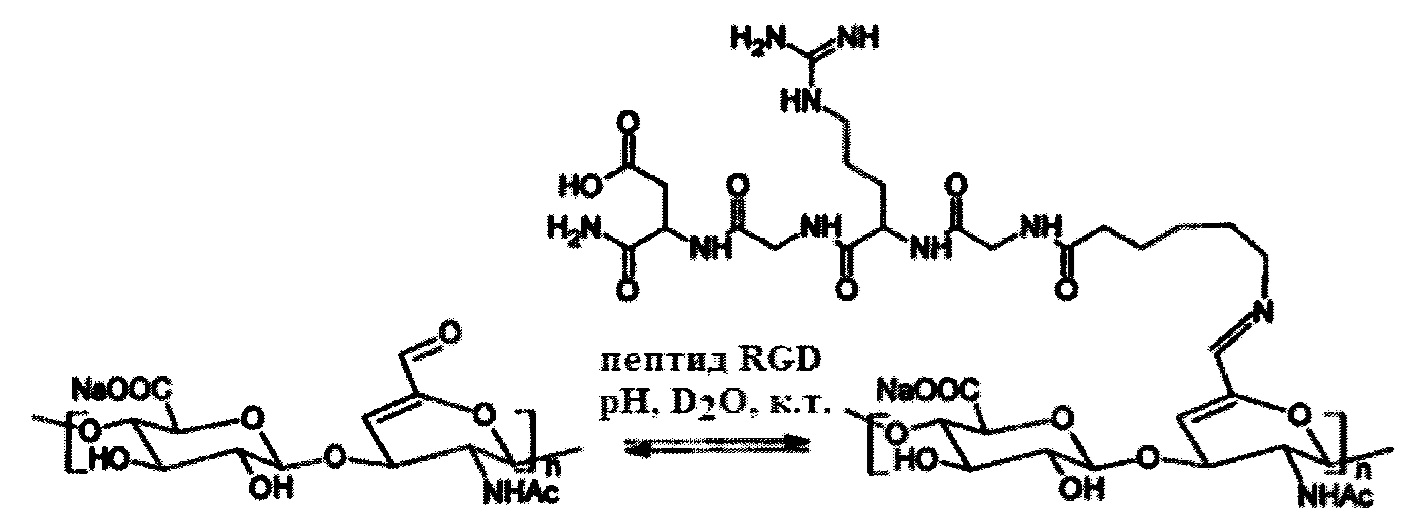

Схема 5. Стабильность имина α,β-ненасыщенного альдегида хондроитинсульфата (DS=20%) с пептидом RGD (аминогексановая кислота-Gly-Arg-Gly-Asp-NH2) в воде.
Более конкретно, эта стабильность имина на основе алкил-, арил- или гетариламина в воде может быть использована следующим образом: когда конъюгат (имин), образованный биологически активным амином (напр., препарат, антисептический препарат, пептид, аминокислота и т.д.) и полисахаридом (носитель), стабильный в умеренно основных условиях, включается в целевой участок организма, рН которого отличается (нейтральный или умеренно кислый), этот конъюгат разлагается и биологически активное вещество высвобождается в этом месте.
Было доказано, что α,β-ненасыщенный альдегид сам по себе в структуре хондроитинсульфата не является цитотоксическим (см. Пример 32 по изобретению), поэтому конъюгаты и сшитые продукты α,β-ненасыщенных альдегидов формулы I или II с биосовместимыми аминами подходят для целевых применений в биомедицине и тканевой инженерии. Предполагается, что эти вещества не должны отрицательно влиять на жизнеспособность клеток, и не должны индуцировать иммунную реакцию в организме, должны быть ферментативно разлагаемыми, тогда как продукты их деградации должны быть также биосовместимы. Таким образом, производные формул I или II могут быть использованы для получения носителей биологически активных веществ в области косметики или фармацевтики или в качестве носителей биологически активных веществ с контролируемым высвобождением посредством изменения рН. Что касается реакции, протекающей в физиологических условиях и с биосовместимыми исходными материалами, то сшитые продукты сульфатированных полисахаридов можно рассматривать как многообещающий материал для клеточных каркасов в тканевой инженерии или регенеративной медицине, где их можно предпочтительно использовать для включения клеток и их последующего культивирования. Способ, описанный в этом изобретении, может быть легко реализован в промышленности, поскольку он не является ни дорогостоящим, ни трудоемким. Это происходит из-за сочетания двух стадий в одном сосуде без необходимости выделения промежуточного продукта. Другим преимуществом является отсутствие токсичных, коррозионных или дорогостоящих химических веществ в роли элиминирующего агента, а также отсутствие органического растворителя, поскольку реакция протекает исключительно в воде. Время реакции короткое; и, кроме того, реакция протекает при комнатной температуре. Конечные продукты выделяют путем осаждения спиртами или неорганическими солевыми растворами без какого-либо вредного воздействия на окружающую среду. Кроме того, относительно высокие степени замещения (20-25%) достигаются предложенным методом в существенно более мягких условиях, чем в (Buffa R., et al: CZ 304512, см. Таблицу 1 выше).
Сульфатированные полисахариды, модифицированные описанным способом по изобретению, пригодны в качестве предшественников для реакций конъюгации или сшивания с различными N-нуклеофилами, приводящими к биосовместимым материалам, подходящим для биомедицинских применений, тканевой инженерии и регенеративной медицины. Более предпочтительно, производные, полученные способом по изобретению, могут быть использованы в качестве носителей биологически активных веществ с контролируемым высвобождением при изменении значения рН в области косметики и фармацевтики. Производные, модифицированные способом по изобретению, могут быть использованы в качестве биосовместимых материалов для биомедицинских применений и образования каркасов для тканевой инженерии или для регенеративной медицины.
Краткое Описание Чертежей:
На Фиг. 1 показано образование гидрогеля на основе хондроитинсульфата, окисленного адипиновым дигидразидом (Пример 21): (а) раствор α,β-ненасыщенного альдегида хондроитинсульфата в PBS, (b) гелеобразование раствора после добавления раствора адипинового дигидразида в PBS, (с) гидрогель через 1 час в PBS (рН=7,4, с=0,9% мас./об.), (d) использование иллюстративной формы для приготовления гидрогеля, (е) использование определенной формы для приготовления гидрогеля, (f) подробный вид сегмента гидрогеля.
На Фиг. 2 показаны фотографии лиофилизированного гидрогеля на основе окисленного хондроитинсульфата с адипиновым дигидразидом, полученные с помощью сканирующего электронного микроскопа: (а) поперечное сечение, увеличение 200х, обнаружение вторичных электронов, (b) увеличенный участок пористой структуры гидрогеля с измеренным диаметром.
На Фиг. 3 проиллюстрированы результаты тестов жизнеспособности клеток фибробластов 3Т3 в α,β-ненасыщенном альдегиде хондроитинсульфата (Mw=4×104 г/моль, DS=20%). Кривая активации по отношению к ингибированию, выраженная в %, по отношению к контролю за время Т=0 ч (100%). Оценка методом МТТ, шесть повторений.
На Фиг. 4. показана кинетика гелеобразования в Примере 30 с определением точки гелеобразования (Tg=97 с, Т=45°С). Графическое представление зависимости упругого (G') и вязкого (G'') модулей во времени.
Примеры:
Используемый здесь термин «эквивалент» (экв.) относится к димерной единице сульфатированного полисахарида, если не указано иное. Процент выражается в массовых процентах, если не указано иное. Молекулярная масса исходного хондроитинсульфата (источник: Sigma Aldrich, Ltd., Prague, CZ) представляет собой средневзвешенную молекулярную массу в диапазоне от 4×104 до 5×104 г. моль-1.
Соотношение хондроитин-4-сульфата (тип А) и хондроитин-6-сульфата (тип С) составляло 3:2. Материал был выделен из животного материала.
Натриевая соль дерматансульфата (натриевая соль хондроитинсульфата В) с растворимостью 5 мг/мл в воде была приобретена у Sigma Aldrich. Материал был выделен из животного материала.
Лямбда-каррагенин с растворимостью 10 мг/мл в воде был приобретен у Sigma Aldrich и выделен из морских водорослей без желатиновых свойств в нативной форме.
Степень замещения α,β-ненасыщенного альдегида в структуре сульфатированного полисахарида определялась в соответствии со следующим расчетом:
DS = степень замещения α,β-ненасыщенного альдегида = 100% * (молярное количество модифицированного димера сульфатированного полисахарида / (молярное количество всех димеров сульфатированного полисахарида)
Степень замещения реакции аминирования в структуре сульфатированного полисахарида определялась в соответствии со следующим расчетом:
DS = степень замещения для аминирования = 100% * (молярное количество модифицированного димера сульфатированного полисахарида / (молярное количество всех димеров сульфатированного полисахарида)
Спектры FT-IR измерялись в диапазоне 4000-400 см-1 в KBr с помощью спектрометра Nicolet 6700 FTIR. Спектры UV-VIS измерялись с помощью устройства Shimadzu UV-2401PC в диапазоне 200-600 нм и обрабатывались с помощью программного обеспечения UV Probe версии 2,00.
Кинетику гелеобразования определяли с помощью аппарата AR-G2, и для оценки использовали ТА Analysis в качестве программного обеспечения. Точку гелеобразования (Tg) определяли по зависимости упругого и вязкого модулей от времени.
Механические свойства выбранных гелей измеряли тестом на сжатие с помощью прибора Instron 3433 и оценивали с помощью программного обеспечения Bluehill. Определенные параметры для каждого образца были следующими: модуль Юнга для сжатия, прочность на сжатие, деформация при предельной прочности и нагрузке.
Морфологию поверхности лиофилизированных материалов анализировали с помощью электронного микроскопа Zeiss Ultra Plus.
Деацетилированную гиалуроновую кислоту получали деацетилированием гидразином согласно Buffa R., et al CZ 304512.
Аминопропоксильное и гидразиновое производное гилауроновой кислоты получали восстановительным аминированием в соответствии с Buffa R., et al.: WO 2011069474.
Список сокращений
TEMPO - радикал 2,2,6,6-тетраметил-1-пиперидинилокси
4-AcNH-TEMPO - TEMPO с ацетамидной группой в 4-м положении
PBS - забуференный фосфатом физиологический раствор
Пептид RGD - пептид с последовательностью аминогексановая кислота-Gly-Arg-Gly-Asp-NH2
АМК - аминокислота
IPA - изопропиловый спирт
DMSO - диметилсульфоксид
Пример 1
Получение α,β-ненасыщенного альдегида хондроитинсульфата
Способ 1. Водный раствор гипохлорита натрия (0,8 экв., 11% активного хлора) постепенно добавляли в 2%-ный водный раствор хондроитинсульфата (200 мг, Mw=4,5×104 г. моль-1), охлажденный до 5°С, содержащий додекагидрат динатрийфосфата (2,2 экв.), бромид натрия (0,8 экв.) и 4-AcNH-TEMPO (0,01%). Смесь перемешивали в течение 2 ч при 5°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре.
Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=23% (определено с помощью ЯМР), Mw=2,1×104 г. моль-1 (определено с помощью SEC MALLS)
Способ 2. Водный раствор гипохлорита натрия (0,8 экв., 11% активного хлора) постепенно добавляли в 2%-ный водный раствор хондроитинсульфата (200 мг, Mw=4,5×104 г. моль-1), охлажденный до 5°С, содержащий бромид натрия (0,8 экв.) и 4-AcNH-ТЕМРО (0,01%). Смесь перемешивали в течение 2 ч при 5°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре. Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=20% (определено с помощью ЯМР)
Спектральный анализ α,β-ненасыщенного альдегида хондроитинсульфата: ЯМР1H (500 МГц, D2O, δ ppm): 2.02 (3Н, Ac-NH-, bs), 4.31 (1Н, H2, bs), 4.49 (1H, H3, bs), 5.20 (1H, H1, bs), 6.34 (1H, H4, bs), 9.21 (1H, H6, bs);
ЯМР1H-1H COZY (D2O), поперечные пики, δ ppm: 4.31-4.49, 4.31-5.20, 4.49-6.34; ЯМР1H-13C HSQC
(D2O), поперечные пики, δ ppm: 2.02-25.1, 4.31-51.0, 4.49-73.1, 5.20-98.6, 6.34-122.0, 9.21-189.0;
ЯМР DOSY (D2O), log D ((2.02, Ac-NH-), (4.31, H2), (4.49, H3), (5.20, H1), (6.34, H4), (9.21, H6)) ~ -10.3 m2c-1, log D (4.72, H2O) ~ -8.6 m2c-1;
ИК (KBr, см-1): 1725, 1650 (ν C=O st), 1615, 1663 (ν C=C st);
UV/Vis (0,1%, H2O); λmax1,2 (Cβ=Cα-C=O)=254 нм (π→π*), 300-350 (n→π*).
Пример 2
Получение α,β-ненасыщенного альдегида хондроитинсульфата
Водный раствор гипохлорита натрия (0,4 экв., 11% активного хлора) постепенно добавляли в 2%-ный водный раствор хондроитинсульфата (200 мг, Mw=4,5×104 г. моль-1), охлажденный до 5°С, содержащий додекагидрат динатрийфосфата (2,2 экв.), бромид натрия (0,4 экв.) и 4-AcNH-TEMPO (0,01%). Смесь перемешивали в течение 2 часов при 5°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре. Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=2% (определено с помощью ЯМР), Mw=2,8×104 г. моль-1 (определено с помощью SEC MALLS). Структурный анализ продукта представлен в Примере 1.
Пример 3
Получение α,β-ненасыщенного альдегида хондроитинсульфата
Водный раствор гипохлорита натрия (1 экв., 11% активного хлора) постепенно добавляли в 2%-ный водный раствор хондроитинсульфата (200 мг, Mw=4,5×104 г. моль-1), охлажденный до 5°С, содержащий додекагидрат динатрийфосфата (2,2 экв.), бромид натрия (1 экв.) и 4-AcNH-TEMPO (0,01%). Смесь перемешивали в течение 2 часов при 5°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре. Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=21% (определено с помощью ЯМР), Mw=2,0×104 г. моль-1 (определено с помощью SEC MALLS). Структурный анализ продукта представлен в Примере 1.
Пример 4
Получение α,β-ненасыщенного альдегида хондроитинсульфата
Водный раствор гипохлорита натрия (2 экв., 11% активного хлора) постепенно добавляли в 2%-ный водный раствор хондроитинсульфата (200 мг, Mw=4,5×104 г. моль-1), охлажденный до 5°С, содержащий додекагидрат динатрийфосфата (2,2 экв.), бромид натрия (2 экв.) и 4-AcNH-TEMPO (0,01%). Смесь перемешивали в течение 2 часов при 5°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре. Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=21% (определено с помощью ЯМР), Mw=1,8×104 г. моль-1 (определенный методом SEC MALLS). Структурный анализ продукта представлен в Примере 1.
Пример 5
Получение α,β-ненасыщенного альдегида дерматансульфата
Водный раствор гипохлорита натрия (0,8 экв., 11% активного хлора) постепенно добавляли в 2%-ный водный раствор дерматансульфата (200 мг, 0,42 моль), охлажденный до 5°С, содержащий додекагидрат динатрийфосфата (2,2 экв.), бромид натрия (0,8 экв.) и 4-AcNH-TEMPO (0,01%). Смесь перемешивали в течение 2 часов при 5°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре. Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=20% (определено с помощью ЯМР)
Спектральный анализ α,β-ненасыщенного альдегида дерматансульфата: ЯМР1Н (500 МГц, D2O, δ ppm): 2.01 (3Н, Ac-NH-, bs), 6.30 (1Н, H4, bs), 9.20 (1H, H6, bs).
Пример 6
Получение α,β-ненасыщенного альдегида каррагинана
Водный раствор гипохлорита натрия (0,8 экв., 11% активного хлора) постепенно добавляли в 1%-ный водный раствор каррагинана (200 мг, 0,31 моль), охлажденный до 10°С, содержащий додекагидрат динатрийфосфата (2,2 экв.), натрия бромид (0,8 экв.) и 4-AcNH-TEMPO (0,01%). Смесь перемешивали в течение 2 часов при 10°С. Затем к реакции добавляли этанол (10 экв.), который перемешивали в течение дополнительного часа при комнатной температуре. Продукт выделяли осаждением с помощью IPA и анализировали с помощью ЯМР.
DS=10% (определено с помощью ЯМР)
Спектральный анализ α,β-ненасыщенного альдегида каррагинана: ЯМР1Н (500 МГц, D2O, δ ppm): 6.30 (1Н, Н4, bs), 9.20 (1Н, H6, bs).
Пример 7
Связывание гидразина с α,β-ненасыщенным альдегидом хондроитинсульфата
Гидразина гидрат (2 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Продукт анализировали в виде неочищенной реакционной смеси.
DS=20% (определено с помощью ЯМР)
ЯМР1Н (500 МГц, D2O, δ ppm): 5.40 (1H, -CH=C-CH=N-, bs), 7.38 (1H, -CH=C-CH=N-, bs)
Пример 8
Связывание бутиламина с α,β-ненасыщенным альдегидом хондроитинсульфата
Способ 1. Бутиламин (0,2 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=11,20. Продукт анализировали в виде неочищенной реакционной смеси.
DS=20% (определено с помощью ЯМР)
ЯМР1H (500 МГц, D2O, δ ppm): 5.67 (1H, -CH=C-CH=N-, bs), 7.74 (1Н, -СН=С-CH=N-, bs)
Способ 2: Дейтерированную уксусную кислоту (14,5 мкл) добавляли к образцу ЯМР из Способа 1. Измеренный рН составлял 4,10, и образец затем анализировали с помощью ЯМР.
DS=0% (определено с помощью ЯМР)
Пример 9
Связывание бутиламина с α,β-ненасыщенным альдегидом хондроитинсульфата
Бутиламин (0,2 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в дейтерированном PBS. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=7,30.
Продукт анализировали в виде неочищенной реакционной смеси.
DS=0% (определено с помощью ЯМР)
Пример 10
Связывание гексан-1,6-диамина с α,β-ненасыщенным альдегидом хондроитинсульфата
Гексан-1,6-диамин (0,5 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=11,60. Продукт анализировали в виде неочищенной реакционной смеси.
DS=20% (определено с помощью ЯМР)
ЯМР1H (500 МГц, D2O, δ ppm): 5.68 (1H, -CH=C-CH=N-. bs), 7.74 (1H, -СН=С-CH=N-, bs)
Пример 11
Связывание пропоксиамина с α,β-ненасыщенным альдегидом хондроитинсульфата
Гидроксид пропоксиамина (0,5 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=3,90. Продукт анализировали в виде неочищенной реакционной смеси.
DS=20% (определено с помощью ЯМР)
ЯМР1Н (500 МГц, D2O, δ ppm): 5.57 и 6,88 (1Н, -CH=C-CH=N-, bs), 7.52 и 7.70 (1Н, -CH=CCH=N-, bs)
Пример 12
Связывание лизина с α,β-ненасыщенным альдегидом хондроитинсульфата
Гидрохлорид лизина (0,5 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль--1) в дейтерированном PBS. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=7,46. Продукт анализировали в виде неочищенной реакционной смеси.
DS=4% (определено с помощью ЯМР)
ЯМР1H (500 МГц, D2O, δ ppm): 5,69-5,75 (1Н, -CH=C-CH=N-, bs), 7,70-7,75 (1Н, -CH=CCH=N-, bs)
Пример 13
Связывание лизина с α,β-ненасыщенным альдегидом хондроитинсульфата
Гидрохлорид лизина (0,5 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. рН реакции доводили до 8,40 путем добавления бикарбоната натрия (2 экв.). Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Продукт представлял собой смесь в виде неочищенной реакционной смеси.
DS=7% (определено с помощью ЯМР)
Структурный анализ представлен в Примере 12.
Пример 14
Связывание пептида RGD с α,β-ненасыщенным альдегидом хондроитинсульфата
RGD-пептид (0,2 экв., последовательность Ahx-Gly-Arg-GlyAsp-NH2) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=4,22. Продукт анализировали в форме неочищенной реакционной смеси.
DS=0% (определено с помощью ЯМР)
Пример 15
Связывание пептида RGD с α,β-ненасыщенным альдегидом хондроитинсульфата
Пептид RGD (0,2 экв., последовательность Ahx-Gly-Arg-GlyAsp-NH2 добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитин сульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в дейтерированном PBS. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=7,22. Продукт анализировали в виде неочищенной реакционной смеси.
DS=4% (определено с помощью ЯМР)
ЯМР1Н (500 МГц, D2O, δ ppm): 5.68 (1Н, -CH=C-CH=N-. bs), 7.74 (1H, -CH=C-CH=N-, bs)
Пример 16
Связывание пептида RGD с α,β-ненасыщенным альдегидом хондроитинсульфата
Пептид RGD (0,2 экв., последовательность Ahx-Gly-Arg-GlyAsp-NH2) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. рН реакции доводили до 10,49 путем добавления бикарбоната натрия (2 экв.). Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Продукт анализировали в виде неочищенной реакционной смеси.
DS=20% (определено с помощью ЯМР)
Структурный анализ представлен в Примере 15.
Пример 17
Связывание анилина с α,β-ненасыщенным альдегидом хондроитинсульфата
Анилин (0,3 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. рН реакции доводили до 4,22 путем добавления дейтерированной уксусной кислоты (8,8 мкл). Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Продукт анализировали в виде неочищенной реакционной смеси.
DS=0% (определено с помощью ЯМР)
Пример 18
Связывание анилина с α,β-ненасыщенным альдегидом хондроитинсульфата
Анилин (0,3 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в дейтерированном PBS. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=7,42. Продукт анализировали в виде неочищенной реакционной смеси.
DS=5% (определено с помощью ЯМР)
ЯМР1Н (500 МГц, D2O, δ ppm): 5.93 (1H, -CH=C-CH=N-, bs), 8.03 (1H, -CH=C-CH=N-, bs)
Пример 19
Связывание анилина с α,β-ненасыщенным альдегидом хондроитинсульфата
Анилин (0,3 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. рН реакции доводили до 10,73 путем добавления карбоната натрия. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре. Продукт анализируют в виде неочищенной реакционной смеси.
DS=25% (определено с помощью ЯМР)
Структурный анализ представлен в Примере 18.
Пример 20
Связывание дигидразида адипата с α,β-ненасыщенным альдегидом хондроитинсульфата
Дигидразида адипат (3 экв.) добавляли к 2%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в D2O. Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и рН=7,50. Продукт анализировали в виде неочищенной реакционной смеси.
DS=20% (определено с помощью ЯМР)
ЯМР1Н (500 МГц, D2O, δ ppm): 1.64 (4Н, DHA2,3, bs), 2.04 (3Н, Ac-NH-, bs), 2,34 (4H, DHA1,4, bs), 4.28 (1H, H2, bs), 4.36 (1H, H3, bs), 5.20 (1H, H1, bs), 5.62 (1H, Н4цис, bs), 5,68 (1H, Н4транс, bs), 7.52-7.48 (1H, Н6цис, bs), 7.61 (1H, Н6транс, bs);
ЯМР1H-1H COSY (D2O), поперечные пики, δ ppm: 1.64-2.34, 4.28-5.20, 4.36-5.68; ЯМР1H-13C HSQC
(D2O), поперечные пики, δ ppm: 1.64-24.9, 2.34-34.1, 4.28-51.0, 4.36-73.6, 5.20-98.8, 5.68-111.3, 7,61148,5;
ЯМР DOSY (D2O), log D ((2,04, Ac-NH-), (4.28, H2), (4.36, H3), (5.20, H1), (5.62 и 5.68, Н4цис/транс), (7,52 и 7,68, Н6цис/транс)) ~ -10.4 м2с-1, log D (4.72, H2O) ~ -8.6 м2с-1;
IR (KBr, см-1): 1640-1650 (ν-C=N-st);
UV/Vis (0.1%, H2O); λmax1,2 (-C=N-) = 280 nm (π→π*).
Пример 21
Сшивание α,β-ненасыщенного альдегида хондроитинсульфата с дигидразида адипатом
Дигидразида адипат (0,12 экв., соотношение связующих звеньев 1:1) в PBS добавляли к 8%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (40 мг, DS=23%, Mw=2,1×104 г. моль-1) в PBS (рН=7,40, с=0,9% мас./об.). После добавления раствора дигидразида адипата гелеобразование происходило с течением времени (Tg=34 с). Эластичный гель фотографировали (Фиг. 1), лиофилизировали и анализировали с помощью SEM (Фиг. 2).
Модуль упругости Юнга при сжатии = 9×103 Па
Предельная прочность при сжатии = 64×103 Па
Деформация при предельной прочности = 64%
Нагрузка = 3668 Дж.м-3
Пример 22
Сшивание α,β-ненасыщенного альдегида дерматансульфата с дигидразида адипатом
Дигидразида адипат (0,1 экв., соотношение связующих звеньев 1:1) в PBS добавляли к 8%-ному раствору α,β-ненасыщенного альдегида дерматансульфата (40 мг, DS=20%, Mw≤40 кДа) в PBS (рН=7,40, с=0,9% мас./об.). После добавления раствора дигидразида адипата гелеобразование продолжалось.
Пример 23
Сшивание α,β-ненасыщенного альдегида каррагинана с дигидразида адипатом
40 мкл дигидразида адипата (0,05 экв.) в PBS добавляли к 8%-ному раствору α,β-ненасыщенного альдегида каррагинана (40 мг, DS=10%, Mw≤50 кДа) в PBS (рН=7,40, с=0,9% мас./об.). После добавления раствора дигидразида адипата вязкость увеличивалась.
Пример 24
Сшивание α,β-ненасыщенного альдегида хондроитинсульфата с гидразидным производным гиалуроновой кислоты
4%-ный раствор гидразидного производного гиалуроновой кислоты (9,2 мг, DS=25%, Mw=138×103 г. моль-1) в PBS (рН=7,4, с=0,9% мас./об.) добавляли к 4%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (10 мг, DS=23%, Mw=2,1×104 г. моль-1) в PBS. После смешивания растворов гелеобразование происходило с течением времени (Tg=109 с).
Модуль упругости Юнга при сжатии = 6×103 Па
Предельная прочность при сжатии = 840×103 Па
Деформация при предельной прочности = 96%
Нагрузка = 11978 Дж.м-3
Пример 25
Сшивание α,β-ненасыщенного альдегида хондроитинсульфата с деацетилированной гиалуроновой кислотой
2%-ный раствор деацетилированной гиалуроновой кислоты (2 экв., DS=11%, Mw=116 кДа, соотношение связующих звеньев 1:1) в PBS (рН=7,4, с=0,9% мас./об.) добавляли к 4%-му раствору α,β-ненасыщенного альдегида хондроитинсульфата (10 мг, DS=23%, Mw=2,1×104 г. моль-1) в PBS (рН=7,40, с=0,9% мас./об.). Реакционную смесь перемешивали при комнатной температуре, при этом повышение вязкости наблюдалось через 0,5 ч, после чего через 1 ч образовывался эластичный гель.
Модуль упругости Юнга при сжатии = 3×103 Па
Предельная прочность при сжатии = 395×103 Па
Деформация при предельной прочности = 95%
Нагрузка = 14670 Дж.м-3
Пример 26
Получение кислотной формы хондроитинсульфата
Получали 1%-ый раствор хондроитинсульфата (500 мг, 1,1 ммоль) в дистиллированной воде. Раствор охлаждали до 5°С и добавляли 1,2 мл катекса Amberlite IR 120 Na (Н+). Реакционную смесь перемешивали в течение 24 ч при 5°С. Катекс отфильтровывали, продукт замораживали и лиофилизировали. Его растворимость в DSMO была проверена и признана удовлетворительной.
Пример 27
Получение деацетилированного хондроитинсульфата
Получали 1%-ный раствор кислотной формы хондроитинсульфата (200 мг, 0,44 ммоль, Mw≤40 кДа) в DMSO. Раствор дегазировали потоком азота. Добавляли 10,6 мл гидразингидрата и 3 экв. гидразинсульфата. Реакционную смесь перемешивали в течение 24 ч при 60°С в атмосфере азота. Затем в реакционную смесь добавляли NaHCO3. Продукт выделяли осаждением с помощью IPA.
DS=10% (определено с помощью ЯМР), Mw=1,8×104 г. моль-1 (определено с помощью SECMALLS)
ЯМР1Н (500 МГц, 1% NaOD v D2O, δ ppm): 3.01 (1H, -CH=C-CH=N-, bs) HSQC (500 МГц, D2O, δ ppm): поперечный пик: 3.42-52.2 ppm
Пример 28
Сшивание α,β-ненасыщенного альдегида хондроитинсульфата с деацетилированным хондроитинсульфатом
8%-ный раствор деацетилированного хондроитинсульфата (2 экв., DS=10%, Mw=1,8×104 г. моль-1, соотношение связующих звеньев = 1/0,85) в PBS (рН=7,4, с=0,9% мас./об.), добавляли к 8%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (20 мг, DS=23%, Mw=2,1×104 г. моль-1) в PBS (рН=7,40, с=0,9% мас./об). Реакционную смесь перемешивали при комнатной температуре, причем через 0,5 ч наблюдалось увеличение вязкости, а через 3 ч образовывался эластичный гель.
Модуль упругости Юнга при сжатии = 3×103 Па
Предельная прочность при сжатии = 774×103 Па
Деформация при предельной прочности = 95%
Нагрузка = 16489 Дж.м-3
Пример 29
Сшивание α,β-ненасыщенного альдегида хондроитинсульфата с пропоксиамином
К 10%-ному раствору α,β-ненасыщенного альдегида хондроитинсульфата (50 мг, DS=23%, Mw=2,1×104 г. моль-1) в PBS (рН=7,40, с=0,9% мас./об.) добавляли раствор в PBS пропоксиамина гидрохлорида (0,12 экв., соотношение связующих звеньев = 1/1), причем гель образовывался с течением времени (Tg=110 с).
Модуль упругости Юнга при сжатии = 8×103 Па
Предельная прочность при сжатии = 74×103 Па
Деформация при предельной прочности = 65%
Нагрузка = 3768 Дж.м-3
Пример 30
Измерение кинетики гелеобразования реакции сшивания α,β-ненасыщенного альдегида хондроитинсульфата с аминопропоксильным производным гиалуроновой кислоты
Измерение кинетики гелеобразования проводили с использованием 4%-ного образца α,β-ненасыщенного альдегида хондроитинсульфата (10 мг, DS=23%, Mw=2,1×104 г. моль-1) в PBS (рН=7,40, с=0,9% мас./об.) с 4%-ным раствором аминопропоксильного производного гиалуроновой кислоты (1 экв., DS=25%, Mw=66 кДа) в PBS (рН=7,4, с=0,9% мас./об.). Время гелеобразования, т.е. стадия, было определено по формированию первой макроскопической гелевой сети (Tg=97 с, Фиг. 4).
Пример 31
Сравнение механических свойств гидрогелей на основе сшитого α,β-ненасыщенного альдегида хондроитинсульфата и α,β-ненасыщенного альдегида гиалуронана
Раствор 1: 4%-ный раствор α,β-ненасыщенного альдегида хондроитинсульфата (DS=23%, Mw=2,1×104 г. моль-1, Пример 1) в PBS (рН=7,40, с=0,9% мас./об.).
Раствор 2: 4%-ый раствор α,β-ненасыщенного альдегида гиалуроновой кислоты (DS=7%, Mw=2,5×104 г. моль-1) в PBS (рН=7,40, с=0,9% мас./об.).
Раствор 3: 4%-ный раствор аминопропоксильного производного гиалуроновой кислоты (DS=25%, Mw=66 кДа) в PBS (рН=7,40, с=0,9% мас./об.).
Гидрогели были приготовлены из указанных растворов путем смешивания их эквивалентных объемных соотношений в следующих комбинациях: раствор 1 + раствор 3 (образец А) и раствор 2 + раствор 3 (образец В). Образцы А и В оставляли созревать при комнатной температуре в течение 3 часов. Затем измерялись механические свойства материалов, а именно модуль упругости Юнга при сжатии, предел прочности при сжатии и деформации при предельной прочности (Таблица 2).


Измеренные данные указывают на преимущества использования материала с более высокой степенью замещения в производном хондроитинсульфата (образец А), поскольку гидрогели, полученные из этого производного, имеют более высокую жесткость и демонстрируют более низкую скорость деформации по сравнению с производным гиалуроновой кислоты (образец В). Поскольку образцы имели одинаковую молекулярную массу и были проанализированы в тех же условиях, этот факт, по-видимому, является следствием более высокой плотности сшивки и непосредственно коррелирует при сохранении той же молекулярной массы с более высокой степенью замещения α,β-ненасыщенного альдегида в структуре модифицированного полисахарида.
Пример 32
Тесты на жизнеспособность фибробластов 3Т3 в присутствии α,β-ненасыщенного альдегида хондроитинсульфата
Испытуемое вещество, α,β-ненасыщенный альдегид хондроитинсульфата (DS=20%, Mw=40 кДа), растворяли в полной среде 3Т3. Раствор фильтровали через фильтр 0,22 мкм. Конечные тестовые концентрации тестируемого раствора составляли 10, 100, 500 и 1000 мкг. мл-1. Клетки 3Т3 с плотностью 3000 клеток на лунку инокулировали в 96-луночные планшеты. Перед обработкой клетки культивировали в течение 24 часов в полной среде. Жизнеспособность клеток оценивали с помощью спектрофотометрии с помощью бромида 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия (метод МТТ) в интервалах 0, 24, 48, 72 часа. Весь эксперимент был дополнен набором необработанных контролей и контрольных проб. Измеренные данные по оптической плотности были преобразованы в процентную формулу, связанную с контролем за время Т0 часов (отношение оптической плотности обработанного образца к оптической плотности необработанного контроля Т0, умноженное на 100) и была рассчитана стандартная ошибка среднего (SEM). Результаты теста графически представлены на Фиг. 3.
Реферат
Изобретение относится к области биотехнологии. Предложен способ получения α,β-ненасыщенных альдегидов в структуре сульфатированных полисахаридов. Данный способ позволяет получать материалы, подходящие для систем доставки лекарств, чувствительных к рН, или для получения каркасов в тканевой инженерии или регенеративной медицине. 6 н. и 16 з.п. ф-лы, 4 ил., 2 табл., 32 пр.
Формула




Комментарии