Способ получения иммобилизованного ферментного препарата на основе папаина, гиалуроновой кислоты и полисахаридов, модифицированных виниловыми мономерами - RU2750378C1
Код документа: RU2750378C1
Чертежи

Описание
Изобретение относится к биотехнологии, а именно к способу стабилизации папаина растворами гиалуроновой кислоты и графт-сополимерами с полисахаридной основной цепью из карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с боковыми цепями из гомополимеров N-винилимидазола (ВИ) или N,N-диметиламиноэтилметакрилата (ДМАЭМА). Изобретение может быть использовано в химико-фармацевтической промышленности, медицинской практике, косметологии.
Папаин (КФ 3.4.22.2) - растительный протеолитический фермент, катализирующий гидролиз белков, пептидов, амидов и сложных эфиров основных аминокислот. Папаин состоит из 212 аминокислотных остатков, на С-конце его полипептидной цепи располагается аспарагин, на N-конце - изолейцин. Для папаина характерно отсутствие остатков метионина. Он хорошо растворяется в водных солевых растворах, воде и в 70% метиловом и этиловом спиртовых растворах. Фермент используется в пищевой промышленности, в пивоварении, медицине, косметологии, ветеринарии и других отраслях.
Папаин применяется для ухода за полостью рта в виде добавки, расщепляющей белковую основу зубного налета и таким образом размягчающей его [Патент RU 2416391 С1, МПК A61K 8/66, A61K 36/236, A61Q 11/00, опубл. 20.04.2011, Бюл. №11]. Папаин способствует очищению ран [Патент RU 2011122967 А, МПК А61Н 7/00, опубл. 27.01.2013, Бюл. №3], входит в состав набора ферментной биоочистки и для удаления биопленок с субстратов [Патент RU 2018110873 А, МПК C11D 3/12, опубл. 27.09.2019, Бюл. №27].
По своей химической структуре гиалуроновая кислота представляет собой линейный полисахарид, состоящий из чередующихся дисахаридов, которые включают D-глюкуроновую кислоту и D-N-ацетилглюкозамин, соединенные β-1,4- и β-1,3-гликозидными связями.
На сегодняшний день существуют различные косметические препараты и композиции на основе гиалуроновой кислоты. Известна косметическая композиция, обеспечивающая глубокое увлажнение кожи за счет содержания низкомолекулярной гиалуроновой кислоты (15-40 кДа) [Патент RU 2660350 С1, МПК A61K 8/67, A61K 8/73, A61K 8/97, A61Q 19/08, опубл. 05.07.2018, Бюл. №19]. Низкомолекулярная гиалуроновая кислота (менее 130 кДа) используется в качестве трансдермального переносчика биологически активных компонентов (различных протеинов и аминокислот) композиции для волос и кожи головы [Патент RU 2671511 С1, МПК A61K 8/03, A61K 8/04, A61K 8/64, A61K 8/67, A61K 8/73, A61K 8/97, A61K 8/36, A61K 8/44, A61Q 5/00, A61Q 19/08, опубл. 01.11.2018, Бюл. №31]. Описан состав маски, обладающей репарирующим эффектом для повышения эластичности и упругости кожи. Одним из компонентов данной маски является гиалуроновая кислота или ее соли в качестве веществ, повышающих влагоудерживающую способность верхнего слоя кожи [Патент RU 2191000 С2, МПК А 61 К 7/48, 7/00, опубл. 20.10.2002]. Гиалуроновая кислота с молекулярной массой менее 40 кДа как трансдермальный переносчик содержится в креме с широким спектром действий [Патент RU 2666602 С1, МПК A61K 8/04, A61K 8/34, A61K 8/73, A61K 8/92, A61K 8/97, A61K 8/9767, A61Q 19/08, опубл. 11.09.2018, Бюл. №26]. Гиалуроновая кислота со смесью аминокислот входит в состав косметического средства «Кожа косметическая» для ухода за кожей в период реабилитации после инвазивных косметологических процедур и пластических операций для обеспечения регенерации поверхностных кожных слоев [Патент RU 2528899 С1, МПК A61K 8/04, A61K 8/73, A61K 8/64, A61Q 19/00, опубл. 20.09.2014, Бюл. №26].
Графт-сополимеры карбоксиметилцеллюлозы или хитозана с боковыми цепями из N-винилимидазола или N,N-диметиламиноэтилметакрилата представляют собой биодеградируемые сополимеры с основной цепью из полисахарида, обеспечивающего биодеструкцию сополимера за счет наличия 1,4-β-гликозидных связей [N.М. Mahmoodi, М.Н. Saffar-Dastgerdi, В. Hayati. Environmentally friendly novel covalently immobilized enzyme bionanocomposite: From synthesis to the destruction of pollutant. Composites Part B: Engineering. 2020. Vol. 184. P. 107666; K.J. Edgar, С.M. Buchanan, J.S. Debenham et al. Advances in cellulose ester performance and application. Progress in Polymer Science. 2001. Vol. 26. P. 1605-1688], а также высокую комплексообразующую способность за счет присутствия в боковых цепях звеньев имидазольных [V.A. Kuznetsov, А.V. Sorokin, М.S. Lavlinskaya et al. Graft copolymers of carboxymethyl cellulose with N-vinylimidazole: synthesis and application for drug delivery. 2019. Polymer Bulletin. Vol. 76. P. 4929-4949] или диметиламиноэтилметакрилатных заместителей [L. Fang, N. Wang, M. Zhou, et al. Poly(N,N-dimethylaminoethyl methacrylate) grafted poly(vinyl chloride)s synthesized via ATRP process and their membranes for dye separation. Chinese Journal of Polymer Science. 2015. Vol. 33. P. 1491-1502].
На данный момент нет сведений о комплексах растительного фермента папаина с гиалуроновой кислотой и полисахаридами, модифицированными виниловыми мономерами, такими как графт-сополимеры карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА).
Известен способ получения гетерогенного препарата на основе папаина, обладающего регенерационными свойствами [Патент RU 2677873 С2, МПК A61K 38/48, A61K 47/30, А61Р 17/02, опубл. 22.01.2019, Бюл. №3]. Данный способ включает обработку матрицы ионообменных волокон ВИОН АН-1 или ВИОН КН-1 раствором папаина, инкубирование, при этом для иммобилизации на ВИОН КН-1 используют 0.2 М ацетатный буфер (рН 4.5-5.5) или 0.05 М боратный буфер с добавлением KCl (рН 9.0-9.5), а для иммобилизации на ВИОН АН-1 - 0.05 М трис-глициновый (рН 9.0) или 0.05 М глициновый (рН 10.0) буфер в расчете 20 мл раствора фермента в концентрации 5 мг/мл на 1 г волокон, инкубирование проводится в течение 24 ч при комнатной температуре, образовавшийся осадок промывают использованным при иммобилизации буфером до отсутствия в промывных водах белка.
Недостатком способа является получение ферментного препарата в твердой фазе, не позволяющей проникать молекулам папаина в глубокие слои кожи.
Запатентован способ стабилизации ферментов - пепсина, химотрипсина, трипсина, панкреатина, папаина и других протеаз, путем добавления в их растворы полисахаридов - гуаровой камеди, ксантановой камеди, камеди бобов рожкового дерева, крахмала, декстрана, пуллулана, альгиновой кислоты, гиалуроновой кислоты, каррагинана, пектина, хитозана и прочих полисахаридов, а также производных целлюлозы: карбоксиметилцеллюлозы, метилцеллюлозы, этилцеллюлозы, гидроксипропилцеллюлозы [JPH034791A].
Известен способ получения гетерогенного препарата папаина в геле на основе пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана, включающий иммобилизацию папаина в буферном растворе на матрицу хитозана в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя; инкубацию при комнатной температуре с периодическим перемешиванием; промывку образовавшегося осадка 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка, отличающийся тем, что иммобилизацию проводят на матрицу пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана; в качестве буферного раствора для иммобилизации используют 0.05 М глициновый буфер с рН 10.0 или 0.05 М ацетатный буфер с рН 5.8; инкубация проводится в течение 2 часов [Патент RU 2712690, МПК C12N 11/04, C12N 11/10, опубл. 30.01.2020 Бюл. №4].
В отличие от этих двух способов предложенное нами использование полисахаридов (карбоксиметилцеллюлозы и хитозана), модифицированных виниловыми мономерами (N-винилимидазолом или N,N-диметиламиноэтилметакрилатом) обеспечивает большее количество связей между полисахаридом и ферментом в ходе иммобилизации, что увеличивает прочность образуемого комплекса и пролонгирует процесс высвобождения фермента в область поврежденных тканей. Кроме того, добавление в препарат гиалуроновой кислоты, которая обладает свойством глубокого проникновения в различные слои кожи, будет способствовать более качественному очищению папаином поверхностных слоев кожи и слизистых оболочек от белковых загрязнений.
Известно, что полимеры на основе поли-β-гликозидов (целлюлозы и ее производных, хитозана, гиалуроновой кислоты и т.д.) склонны к образованию пленок, которые могут защитить кожу от пересыхания или обеспечить дополнительную защиту на поверхности раневого повреждения. Однако способность образовывать конъюгаты у таких полимеров несколько ограничена рядом факторов: поверхностным зарядом, типом функциональной группы и т.д. Поэтому для придания ряда новых свойств целесообразно проводить химическую модификацию природных полисахаридов. Так, например, введение азольных заместителей повышает комплексообразующую способность полисахаридов и снижает поверхностный отрицательный заряд карбоксиметилцеллюлозы [V.A. Kuznetsov, А.V. Sorokin, М.S. Lavlinskaya et al. Graft copolymers of carboxymethyl cellulose with N-vinylimidazole: synthesis and application for drug delivery. 2019. Polymer Bulletin. Vol. 76. P. 4929-4949], а введение звеньев N,N-диметиаминоэтилметакрилата не только снижает поверхностный заряд, но придает водному раствору модифицированного полисахарида стимулочувствительные свойства [V.A. Kuznetsov, А.V. Sorokin, М.S. Lavlinskaya. Synthesis of graft copolymers of carboxymethyl cellulose and N,N-dimethylaminoethyl methacrylate and their study as Paclitaxel carriers. 2020. Polymer Bulletin. DOI: 10.1007/s00289-020-03250-z].
В качестве прототипа служила топическая противомикробная дерматологическая композиция [Патент RU 2668827 С2, МПК A61K 38/08, A61K 31/728, А61Р 31/00, А61Р 17/00, A61K 31/722, опубл. 02.10.2018, Бюл. №28], предложенная в качестве лекарственного средства в медицине и ветеринарии, включающая комбинацию по меньшей мере одного положительно заряженного противомикробного пептида, соединенного с липидом, и гиалуроновой кислоты со средним молекулярным весом от 100 кДа до 800 кДа или одной из ее солей, причем противомикробный пептид представляет собой гексапептид, соединенный с пальмитиновой кислотой, содержащий дисульфидные мостики.
В отличие от прототипа в качестве действующего вещества мы используем не противомикробный пептид, а фермент папаин, который кроме антимикробных обладает противовоспалительными свойствами, не действуя напрямую на очаг воспаления, папаин стимулирует метаболизм, что оказывает влияние на ускорение регенерации воспаленных тканей, увеличивает приток крови и разрушает токсичные вещества в очаге воспаления, выделяемые многими болезнетворными микроорганизмами, ускоряет заживление ран, трофических язв и пролежней, может использоваться при лечении келлоидных рубцов, осложненных форм неврита лицевого нерва, при терапии различных патологий, связанных с развитием рубцово-спаечного процесса: при грыже позвоночного диска, травмах, в хирургической косметологии для лечения гипертрофических рубцов.
Кроме того, добавление нами в раствор графт-сополимеров карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) позволяет путем включения в полисахаридный гель (один из способов физической иммобилизации ферментов) дополнительно стабилизировать папаин и обеспечить ему пролонгированное действие.
Технический результат заявленного изобретения заключается в разработке способа получения иммобилизованного жидкого или гелеобразного ферментного препарата на основе папаина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты низкомолекулярной (300 кДа), среднемолекулярной (500 кДа) или высокомолекулярной (800 кДа), благодаря чему растворы папаина можно хранить при температурах от 4 до 25°С в течение 21 суток, а фермент при этом становится более стабильным в сравнении с нативным и способен проникать в глубокие слои кожи; при этом внесение в состав препарата модифицированных полисахаридов позволяет не только варьировать вязкость и консистенцию образцов (от жидкого состояния до геля с различной текучестью), но также способствует образованию конъюгатов с ферментом с большим количеством связей и взаимодействий между полисахаридом и ферментом, по сравнению с немодифицированными карбоксиметилцеллюлозой и хитозаном, что дополнительно повышает стабильность препарата и концентрацию активного вещества в пораженном участке кожи, а также обеспечивает контролируемое (порционное) высвобождение папаина, поддерживая его необходимую концентрацию в течение длительного времени. Кроме того, способность модифицированных полисахаридов образовывать устойчивые пленки защищает фермент и обрабатываемый участок кожи от пересыхания, позволяет легко удалить препарат вместе с гноем и экссудатом.
Технический результат достигается тем, что в способе получения иммобилизованного ферментного препарата на основе папаина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты, включающем растворение папаина в водном растворе низкомолекулярной гиалуроновой кислоты (300 кДа) или среднемолекулярной гиалуроновой кислоты (500 к Да) или высокомолекулярной гиалуроновой кислоты (800 кДа) в соотношении 10 мг папаина на 2 мл водного раствора низкомолекулярной гиалуроновой кислоты (300 кДа) или среднемолекулярной гиалуроновой кислоты (500 кДа) или высокомолекулярной гиалуроновой кислоты (800 кДа) в концентрации 1.5%, при этом осуществляют перемешивание до полного растворения при комнатной температуре; затем ведут иммобилизацию папаина, согласно изобретению иммобилизацию осуществляют путем добавления к полученной смеси графт-сополимера карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) при молекулярной массе полисахарида 50-100 к Да в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля.
Фиг. 1. Диаграмма значений каталитической активности папаина в присутствии гиалуроновой кислоты различной молекулярной массы после его хранения при 4°С.
Фиг. 2. Диаграмма значений каталитической активности папаина в присутствии гиалуроновой кислоты различной молекулярной массы после его хранения при 25°С.
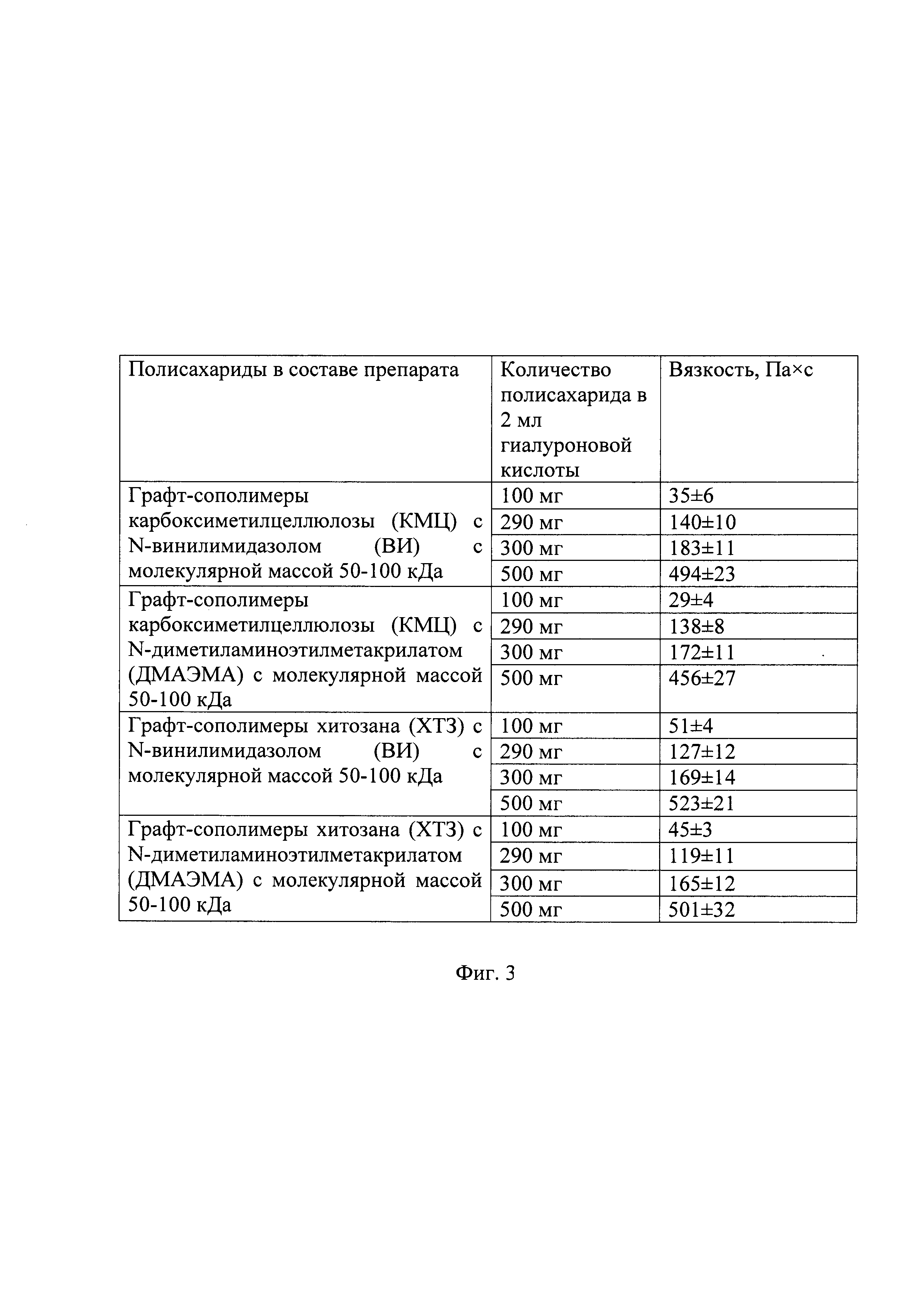
Фиг. 3. Таблица 1. Вязкость препаратов, содержащих папаин, гиалуроновую кислоту и полисахариды, модифицированные виниловыми мономерами.
Пример реализации способа.
В качестве объекта исследования был выбран папаин фирмы «Sigma-Aldrich», субстратом для гидролиза служил азоказеин фирмы «Sigma-Aldrich». В качестве стабилизирующих агентов применяли три вида гиалуроновой кислоты (ООО «Лаборатория Гиалика») с молекулярной массой 300 (НМГК), 500 (СМГК) и 800 (ВМГК) кДа. В качестве матрицы для иммобилизации папаина применяли графт-сополимеры карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) с молекулярной массой 50-100 кДа.
Стабилизацию папаина осуществляли путем растворения его навески массой 10 мг в 2 мл водного раствора гиалуроновой кислоты с молекулярной массой 300 (НМГК), 500 (СМГК) или 800 (ВМГК) кДа в концентрации 1.5% с последующим перемешиванием при комнатной температуре до полного растворения. Затем к полученной смеси добавляли для иммобилизации папаина графт-сополимер карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) (при молекулярной массе полисахарида 50-100 кДа) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля (табл. 1).
Содержание белка в иммобилизованных препаратах папаина определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275]. Измерение уровня протеолитической активности фермента проводили на субстрате азоказеине (Fluka) [Garcia-Carreno, F.L. The digestive proteases of langostilla (Pleuroncodes planipes, Decapoda): their partial characterization and the effect of feed on their composition //Comparative Biochemistry and Physiology Part B: Comparative Biochemistry - 1992. - V. 103. - P. 575-578]. К 200 мкл образца добавляли 200 мкл трис-HCl буфера (рН 7.5), 800 мкл азоказеина (0.5% в 50 мМ трис-HCl буфере, рН 7.5) и инкубировали 2 часа при 37°С. Далее добавляли 800 мкл трихлоруксусной кислоты (ТХУ) (5%), инкубировали 10 минут при минус 4°С, затем центрифугировали в течение 3 мин при 13000 об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3% NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 1 см кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 200 мкл трис-HCl буфера и 200 мкл образца, который вносили после инкубации смеси в течение 2 часов при 37°С. За единицу каталитической активности папаина принимали количество фермента, которое в условиях эксперимента гидролизует 1 мкМ субстрата за 1 мин. Удельную протеолитическую активность папаина рассчитывали по формуле:
ПА=D*1000/120/200/С,
где ПА - протеолитическая активность, мкМ/мин на 1 мг белка,
D - оптическая плотность пробы при 410 нм,
С - концентрация белка в пробе, мг/мл, измеренная по методу Лоури,
120 - время инкубации в минутах,
200 - объем пробы, в мкл,
1000 - пересчет в мкМ.
Статистическую обработку полученных результатов проводили при уровне значимости 5% с использованием t-критерия Стьюдента.
Были проведены исследования стабильности папаина в растворах гиалуроновой кислоты (300, 500 и 800 кДа) по сравнению с нативным энзимом. Препараты инкубировали при 4 и 25°С в течение 0,1,2, 3, 7,14 и 21 суток с дальнейшим измерением протеолитической активности. Полученные результаты отражены на фиг. 1, 2.
В ходе наших экспериментов было выявлено, что гиалуроновая кислота не ингибирует папаин. На фиг. 1 представлена диаграмма зависимости каталитической активности энзима от времени его хранения при 4°С. Установлено, что нативный папаин сохраняет свою каталитическую активность после 7 суток инкубации при 4°С. На 14 день хранения ферментативная способность энзима составляет 23% от начальной. После 21 дня инкубации папаин практически полностью инактивирован (на 95%). Раствор папаина со среднемолекулярной гиалуроновой кислотой (500 кДа) на 7 и 14 сутки хранения снижает свою активность на 32 и 35% соответственно. Энзим сохраняет 36% каталитической способности после 3 недель инкубации. Папаин в растворе высокомолекулярной гиалуроновой кислоты (800 кДа) после 7 дней хранения активен на 73% от исходного уровня. После 14 и 21 дня инкубации при 4°С фермент сохраняет не более 60% активности от интактного образца. Папаин в растворе низкомолекулярной гиалуроновой кислоты (300 кДа) на 7 день хранения теряет 20% каталитической способности. Активность продолжает снижаться после 2 и 3 недель и составляет не более 46% от исходной.
На фиг. 2 изображена диаграмма изменения каталитической активности папаина после его хранения при 25°С. Выявлено, что свободный энзим на 7 сутки инкубации при температуре 25°С сохраняет 50% активности, на 14 и 21 сутки - инактивируется на 96-97%. Раствор папаина в среднемолекулярной гиалуроновой кислоте (500 кДа) после 7 и 14 суток инкубации при температуре 25°С стабильнее раствора нативного фермента и сохраняет 85-87% от исходной протеолитической способности. Раствор папаина в высокомолекулярной гиалуроновой кислоте (800 кДа) на 7 сутки теряет 48% каталитической способности от неинкубированного препарата, при повышении срока хранения происходит более значительная инактивация энзима. Папаин в растворе низкомолекулярной гиалуроновой кислоты (300 кДа) оказался наименее стабильным из растворов фермента в гиалуроновой кислоте.
Из вышеизложенного материала следует, что папаин в растворе высокомолекулярной гиалуроновой кислоты (800 кДа) наиболее стабилен по сравнению с остальными растворами фермента при хранении при 4°С. Раствор папаина в среднемолекулярной гиалуроновой кислоте (500 кДа) после 7 и 14 суток инкубации при температуре 25°С оказался активнее раствора нативного фермента и его растворов в высокомолекулярной и низкомолекулярной гиалуроновой кислоте.
Таким образом, был разработан способ получения иммобилизованного ферментного препарата на основе папаина, низкомолекулярной (300 кДа), среднемолекулярной (500 кДа) и высокомолекулярной (800 кДа) гиалуроновой кислоты с последующим добавлением графт-сополимера карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) для иммобилизации папаина.
Полученный предложенным способом препарат можно хранить при температурах от 4 до 25°С в течение 21 суток, а папаин при этом становится более стабильным в сравнении с нативным и способен проникать в глубокие слои кожи. Внесение в состав препарата модифицированных полисахаридов позволяет не только варьировать вязкость и консистенцию образцов (от жидкого состояния до геля с различной текучестью), но также способствует образованию конъюгатов с ферментом с большим количеством связей и взаимодействий между полисахаридом и ферментом, по сравнению с немодифицированными карбоксиметилцеллюлозой и хитозаном, что дополнительно повышает стабильность препарата и концентрацию активного вещества в пораженном участке кожи, а также обеспечивает контролируемое (порционное) высвобождение папаина, поддерживая его необходимую концентрацию в течение длительного времени. Кроме того, способность модифицированных полисахаридов образовывать устойчивые пленки защищает фермент и обрабатываемый участок кожи от пересыхания, позволяет легко удалить препарат вместе с гноем и экссудатом.
Реферат
Изобретение относится к способу получения иммобилизованного ферментного препарата на основе папаина, полисахаридов, модифицированных виниловыми мономерами, и гиалуроновой кислоты. Способ включает растворение папаина в водном растворе низкомолекулярной гиалуроновой кислоты (300 кДа) или среднемолекулярной гиалуроновой кислоты (500 кДа) или высокомолекулярной гиалуроновой кислоты (800 кДа) в соотношении 10 мг папаина на 2 мл водного раствора низкомолекулярной гиалуроновой кислоты (300 кДа) или среднемолекулярной гиалуроновой кислоты (500 кДа) или высокомолекулярной гиалуроновой кислоты (800 кДа) в концентрации 1.5%, при этом осуществляют перемешивание до полного растворения при комнатной температуре; затем ведут иммобилизацию папаина путем добавления к полученной смеси графт-сополимера карбоксиметилцеллюлозы (КМЦ) или хитозана (ХТЗ) с N-винилимидазолом (ВИ) или N,N-диметиламиноэтилметакрилатом (ДМАЭМА) при молекулярной массе полисахарида 50-100 кДа в количестве от 100 до 290 мг для получения жидкого препарата или от 300 до 500 мг для получения геля. Получаемый препарат обеспечивает большее количество связей между полисахаридом и ферментом в ходе иммобилизации, что увеличивает прочность образуемого комплекса и пролонгирует процесс высвобождения фермента в область поврежденных тканей. 1 табл., 1 пр., 3 ил.

Комментарии