Полипептид, имеющий ферментативную активность фосфодиэстеразы - RU2272841C2
Код документа: RU2272841C2
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится в общем к семейству фосфодиэстераз, названному PDE8A, и его применениям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Фосфодиэстеразы (PDE) гидролизуют 3',5'-циклические нуклеотиды до соответствующих нуклеозид-5'-монофосфатов. Циклические нуклеотиды цАМФ и цГМФ синтезируются аденилил- и гуанилилциклазами соответственно и служат в качестве вторичных мессенджеров в ряде клеточных путей передачи сигналов. Продолжительность и сила сигнала этих вторичных мессенджеров является функцией скорости синтеза и скорости гидролиза циклического нуклеотида.
Были идентифицированы многочисленные семейства PDE. Система номенклатуры включает в себя сначала число, которое указывает семейство PDE. К настоящему времени известны семь семейств (PDE1-7), которые классифицируются по: (i) первичной структуре; (ii) субстратной предпочтительности; (iii) реакции на различные модуляторы; (iv) чувствительности к специфическим ингибиторам и (v) способам регуляции (Loughney and Ferguson, in Phosphodiesterase Inhibitors, Schudt, et al. (Eds), Academic Press: New York, New York (1996) pp.1-91). За числом, указывающим семейство, следует заглавная буква, указывающая определенный ген, и за заглавной буквой следует второе число, указывающее специфический сплайсинг-вариант или специфический транскрипт, который использует уникальный сайт инициации транскрипции.
Аминокислотные последовательности всех PDEs млекопитающих, идентифицированных к настоящему времени, включают в себя высококонсервативную область из приблизительно 270 аминокислот, расположеннную в карбоксиконцевой половине белка [Charbonneau, et al., Proc. Natl. Acad. Sci. (USA) 83:9308-9312 (1986)]. Этот консервативный домен включает в себя каталитический сайт для гидролиза цАМФ и/или цГМФ и два предположительных сайта связывания цинка, а также специфические для семейства детерминанты [Beavo, Physlol. Rev. 75:725-748 (1995); Francis, et al., J. Biol. Chem. 269:22477-22480 (1994)]. Аминоконцевые области различных PDE являются высоковариабельными и включают в себя другие специфические для семейства детерминанты, такие как: (i) сайты связывания кальмодулина (PDE1); (ii) некаталитические сайты связывания циклического ГМФ (PDE2, PDE5, PDE6); (iii) нацеливающие на мембрану сайты (PDE4); (iv) сайты гидрофобного связывания с мембраной (PDE3) и (v) сайты фосфорилирования для кальмодулинзависимой киназы II (PDE1), цАМФ-зависимой киназы (PDE1, PDE3, PDE4) или цГМФ-зависимой киназы (PDE5) [Beavo, Physiol. Rev. 75:725-748 (1995); Manganiello, et al., Arch. Biochem. Acta 322:1-13 (1995); Conti, et al., Physiol. Rev. 75:723-748 (1995)].
Члены семейства PDE1 активируются кальцием-кальмодулином. Были идентифицированы три гена: PDE1A и PDE1B предпочтительно гидролизуют цГМФ, тогда как PDE1C, как было показано, проявляет высокую аффинность в отношении как цАМФ, так и цГМФ. Семейство PDE2 характеризуется как семейство, специфически стимулируемое цГМФ [Loughney and Ferguson, supra]. Был идентифицирован только один ген, PDE2A, ферментативный продукт которого специфически ингибируется эритро-9-(2-гидрокси-З-нонил)аденином (EHNA). Ферменты в семействе PDE3 специфически ингибируются цГМФ. Известны два гена, PDE3A и PDE3B, оба имеющие высокую аффинность в отношении как цАМФ, так и цГМФ, хотя Vмакс для гидролиза цГМФ является достаточно низкой, чтобы цГМФ действовал как конкурентный ингибитор для гидролиза цАМФ. Ферменты PDE3 специфически ингибируются милриноном и эноксимоном [Loughney and Ferguson, supra]. Семейство PDE4 выполняет гидролиз цАМФ и включает в себя четыре гена, PDE4A, PDE4B, PDE4C и PDE4D, каждый из которых имеет многочисленные сплайсинг-варианты. Члены этого семейства специфически ингибируются лекарственным средством, антидепрессантом ролипрамом. Члены семейства PDE5 связывают цГМФ в некаталитических сайтах и предпочтительно гидролизуют цГМФ. Был идентифицирован только один ген, PDE5A. Фоторецепторные ферменты PDE6 специфически гидролизуют цГМФ [Loughney and Ferguson, supra]. Гены включают в себя PDE6A и PDE6B (белковые продукты которых димеризуются и связывают две копии меньшей ингибиторной субъединицы γ с образованием палочкообразной PDE), в дополнение к PDE6C, которая связывается с тремя меньшими белками с образованием конусообразной PDE. Семейство PDE7 выполняет гидролиз цАМФ, но, в противоположность семейству PDE4, не ингибируется ролипрамом [Loughney and Ferguson, supra]. Был идентифицирован только один ген, PDE7A.
Таким образом, при условии важности цАМФ и цГМФ во внутриклеточной передаче сигнала, в данной области существует растущая необходимость идентификации дополнительных видов PDE. Идентификация до сих пор неизвестных семейств PDE, и их генов и сплайсинг-вариантов, обеспечит дополнительные фармакологические подходы к лечению состояний, в которых связанные с циклическими нуклеотидами пути являются нарушенными, а также состояний, в которых желательно модулирование внутриклеточных уровней цАМФ и/или цГМФ в определенных типах клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце, данное изобретение обеспечивает полипептиды и соответствующие полинуклеотиды для нового семейства PDE, обозначенного PDE8. Данное изобретение включает в себя как природно-встречающиеся, так и не встречающиеся в природе полинуклеотиды PDE8 и их полипептидные продукты. Природно-встречающиеся продукты PDE8 включают в себя определенные разновидности генов и полипептидов в семействе PDE8 (например, PDE8A); эти разновидности включают в себя разновидности генов и полипептидов, которые экспрессируются в клетках одного и того же животного, а также соответствующие гомологичные разновидности, экспрессируемые в клетках других животных. В каждой разновидности PDE8, данное изобретение предусматривает далее сплайсинг-варианты, кодируемые тем же самым полинуклеотидом, но возникающие из отличающихся мРНК-транскриптов (например, PDE8A1 и PDE8A2). Не встречающиеся в природе продукты PDE8 включают в себя варианты природно-встречающихся продуктов, такие как аналоги (т.е. продукты, в которых одна или несколько аминокислот добавлены, заменены или делегированы) и такие продукты PDE8, которые включают в себя ковалентные модификации (т.е. слитые (гибридные) белки, гликозилированные варианты, Met-1PDE8s, Met-2-Lys-1-PDE8s, Gly-1PDE8s и т.п.) Семейство PDE8 отличается от известных ранее семейств PDE проявлением высокой аффинности в отношении гидролиза как цДМФ, так и цГМФ, но относительно низкой чувствительностью к ингибиторам фермента, специфическим для других семейств PDE. В предпочтительном варианте изобретение предусматривает полинуклеотид, содержащий последовательность, представленную в SEQ ID NO:1. Данное изобретение включает в себя также полинуклеотиды, кодирующие аминокислотную последовательность, представленную в SEQ ID NO:2. Предпочтительный в настоящее время полипептид по данному изобретению содержит аминокислотную последовательность, представленную в последовательности SEQ ID NO:2. Изобретение предусматривает два сплайсинг-варианта кДНКs, которые дают два полипептида, обозначенных PDE8A1 и PDE8A2. Полипептиды PDE8A1 и PDE8A2 и полинуклеотиды, кодирующие эти полипептиды, обсуждаются здесь как характерные представители семейства ферментов PDE8, включенные в данное изобретение.
Данное изобретение предусматривает новые очищенные и выделенные полинуклеотиды (например, последовательности ДНК и РНК-транскрипты, как смысловые, так и комплементарные антисмысловые цепи, в том числе их сплайсинг-варианты), кодирующие PDE8s человека. Последовательности ДНК данного изобретения включают в себя геномные и кДНК-последовательности, а также полностью или частичные химически синтезированные последовательности ДНК. Термин "синтезированные", в применении здесь и в понимании специалистов в данной области, относится к чисто химическим, в противоположность ферментативным, способам получения полинуклеотидов. Таким образом, "полностью" синтезированные последовательности ДНК получают полностью химическими способами, а "частично" синтезированные ДНК включают в себя ДНК, в которых только части полученной ДНК произведены химическими способами. Предпочтительная последовательность ДНК, кодирующая полипептид PDE8 человека, представлена в SEQ ID NO:1. Также предпочтительными являются полинуклеотиды, кодирующие полипептид PDE8 SEQ ID NO:2, и сплайсинг-вариантные полипептиды PDE8A1 и PDE8A2, представленные в SEQ ID NOs:6 и, соответственно. Предпочтительные полипептиды, кодирующие PDE8A1 и PDE8A2, представлены в SEQ ID NOs:5 и, соответственно. Кроме того, данное изобретение включает в себя разновидности ДНК, предпочтительно млекопитающих, являющиеся гомологами ДНК PDE8 человека.
Данное изобретение включает в себя также последовательности ДНК, кодирующие молекулы PDE8, которые гибридизуются при умеренно строгих условиях с некодирующими цепями, или комплеменатами, полинуклеотидов, представленных в SEQ ID NOs:1, 3 и 5. Последовательности ДНК, кодирующие полипептиды PDE8A, которые могли бы гибридизоваться с ними, если бы не вырожденность генетического кода, включены в это изобретение. Примером умеренных условий гибридизации являются следующие условия: гибридизация при 65°С в 3Х SSC (растворе хлорида и цитрата натрия), 0,1% саркозиле и 20 мМ фосфате натрия, рН 6,8, и промывание при 65°С в 2Х SSC с 0,1% ДСН. В данной области понятно, что условия эквивалентной строгости могут быть достигнуты путем варьирования температуры и буфера или концентрации солей, как описано Ausebel, et al., (Eds.), Protocols in Molecular Biology, John Wiley & Sons (1994), pp. 6.0.3 to 6.4.10. Модификации в условиях гибридизации могут быть определены эмпирически или точно рассчитаны на основании длины и процента спаривания оснований гуанозин/цитозин (ГЦ) зонда. Условия гибридизации могут быть рассчитаны, как описано в Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York (1989), pp.9.47-9.51.
Обеспечены также автономно реплицирующиеся рекомбинантные экспрессионные конструкции, такие как плазмидные и вирусные ДНК-векторы, включающие в себя последовательности PDE8. Обеспечены также экспрессионные конструкции, в которых PDE8-кодирующие полинуклеотиды оперативно (функционально) связаны с эндогенной или экзогенной регулирующей экспрессию ДНК-последовательностью и терминатором транскрипции.
Согласно другому аспекту данного изобретения предусмотрены клетки-хозяева, в том числе прокариотические и эукариотические клетки, стабильно или временно трансформированные последовательностями ДНК данного изобретения таким образом, что они делают возможной экспрессию полипептидов PDE8 данного изобретения. Клетки-хозяева данного изобретения представляют собой ценный источник иммуногена для разработки антител, специфически иммунореактивных с PDE8. Клетки-хозяева данного изобретения являются также в большой степени применимыми в способах крупномасштабного получения полипептидов PDE8, в которых эти клетки выращивают в подходящей культуральной среде и желаемые полипептидые продукты выделяют из этих клеток или из среды, в которой выращивались эти клетки, например, при помощи иммуноаффинной очистки.
Знание ДНК-последовательностей PDE8 позволяет модифицировать клетки таким образом, чтобы сделать возможной или увеличить экспрессию эндогенной PDE8. Клетки могут быть модифицированы (например, гомологичной рекомбинацией) для обеспечения повышенной экспрессии PDE8 путем замены, полностью или частично, природно-встречающегося промотора PDE8 полным гетерологичным промотором или его частью таким образом, что эти клетки экспрессируют высокие уровни PDE8. Гетерологичный промотор может быть встроен таким образом, что он оперативно связан с кодирующими PDE8 последовательностями. См., например, РСТ International Publication No. WO 94/12650, РСТ International Publication No. WO 92/20808 и РСТ International Publication No. 91/09955. Данное изобретение обсуждает также, что, кроме гетерологичного промотора ДНК, амплифицируемая маркерная ДНК (например, ada, dhfr и мультифункциональный ген CAD, который кодирует карбамилфосфатсинтазу, аспартаттранскарбамилазу и дигидрооротазу) и/или интронная ДНК могут быть встроены вместе с гетерологичным промотором ДНК. При соединении их с кодирующей последовательностью PDE8 амплификация маркерной ДНК с применением стандартных способов отбора приводит к ко-амплификации кодирующих PDE8 последовательностей в этих клетках.
Информация о последовательностях ДНК, обеспечиваемая данным изобретением, позволяет получить, например, при помощи стратегий гомологичной рекомбинации или "нокаута" [Capecchi, Science 244:1288-1292 (1989)], животных, которые не могут экспрессировать функциональную PDE8 или которые экспрессируют вариант PDE8. Такие животные применимы в качестве моделей для исследования активностей in vivo PDE8 и модуляторов PDE8.
Данное изобретение предусматривает также очищенные и выделенные полипептиды PDE8 млекопитающих. Предпочтительные в настоящее время полипептиды PDE8A представлены в SEQ ID NOs:4 и 6. Наиболее предпочтительным является полипептид PDE8, содержащий аминокислотную последовательность, представленную в SEQ ID NOs:2. Полипептиды PDE8 данного изобретения могут быть выделены из природных клеточных источников или могут быть химически синтезированными, но их предпочтительно получают рекомбинантными процедурами с использованием клеток-хозяев данного изобретения. Ожидается, что применение клеток-хозяев млекопитающих обеспечит такие посттрансляционные модификации (например, гликозилирование, усечение, липидирование и фосфорилирование), которые могут быть необходимыми для придания оптимальной биологической активности рекомбинантным экспрессионным продуктам данного изобретения. PDES-продукты данного изобретения могут быть полноразмерными полипептидами, биологически активными фрагментами или их вариантами, которые сохраняют биологическую активность PDE8. Варианты могут включать в себя полипептидные аналоги PDE8, в которых одна или несколько специфических (т.е. природно-кодируемых) аминокислот делегированы или заменены или в которых добавлены одна или несколько не указанных аминокислот: (1) без потери одной или нескольких биологических активностей или иммунологических характеристик, специфических для PDE8; или (2) со специфическим лишением конкретной биологической активности PDE8.
Вариантные продукты данного изобретения включают в себя зрелые продукты PDE8A, т.е. продукты PDE8, в которых удалены лидерная или сигнальная последовательности, имеющие дополнительные аминоконцевые остатки. Рассматриваются PDE8-продукты, имеющие дополнительный остаток метионина в положении -1 (Met-1PDES), как и PDE8-продукты, имеющие дополнительные остатки метионина и лизина в положениях -2 и -1 (Met-2Lys-1 -PDES). Варианты этих типов применимы, в частности, для получения рекомбинантных белков в бактериальных клеточных типах.
Данное изобретение включает в себя также варианты PDE8, имеющие дополнительные аминокислотные остатки, которые возникают вследствие применения специфических систем экспрессии. Например, применение коммерчески доступных векторов, экспрессирующих желаемый полипептид, такой как слитый (гибридный) продукт глутатион-S-трансфераза (GST), обеспечивает желаемый полипептид, имеющий дополнительный остаток глицина в положении -1 как результат отщепления компонента GST от желаемого полипептида. Рассматриваются также варианты, которые возникают из экспрессии в других векторных системах.
Далее, изобретение включает в себя продукты PDE8, модифицированные таким образом, что они включают в себя один или несколько присоединенных водорастворимых полимеров. Особенно предпочтительными являются продукты PDE8, ковалентно модифицированные субъединицами полиэтиленгликоля (ПЭГ). Водорастворимые полимеры могут быть связаны в специфических положениях, например, при аминоконце продуктов PDE8, или произвольно присоединены к одной или нескольким боковым цепям этого полипептида.
Данным изобретением охватываются также антитела (например, моноклональные и поликлональные антитела, одноцепочечные антитела, химерные антитела, CDR-привитые антитела и т.п.) и другие связывающие белки, специфические для продуктов PDE8 или их фрагментов. Специфические связывающие белки могут быть получены с применением выделенных или рекомбинантных продуктов PDE8, вариантов PDE8 или клеток, экспрессирующих такие продукты. Связывающие белки применимы для очистки продуктов PDE8 и обнаружения или количественного определения продуктов PDE8 в пробах жидкости и тканей с применением известных иммунологических процедур. Связывающие белки применимы также, как очевидно, в модулировании (т.е. блокировании, ингибировании или стимуляции) биологических активностей PDE8, в частности активностей, участвующих в трансдукции (передаче) сигнала. Рассматриваются также антиидиотипические антитела, специфические для антител против PDE8.
Научная ценность информации, вносимой описаниями последовательностей ДНК и аминокислотных последовательностей данного изобретения, является очевидной. В качестве одной серии примеров, знание последовательности кДНК для PDE8A делает возможной, посредством применения гибридизации по Саузерну или полимеразной цепной реакции (ПЦР), идентификацию геномных последовательностей ДНК, кодирующих PDE8, и регуляторных последовательностей управления экспрессией PDE8, таких как промоторы, операторы, энхансеры, репрессоры и т.п. Ожидается также, что процедуры гибридизации ДНК/ДНК, проводимые с последовательностями ДНК данного изобретения в условиях умеренной - высокой строгости, позволят выделить ДНК, кодирующие аллельные варианты PDE8A; в данной области известно, что аллельные варианты включают в себя структурно родственные белки, имеющие одно или несколько общих биохимических и/или иммунологических свойств, специфических для PDE8A. Подобным образом, разновидности генов не человека, кодирующие белки, гомологичные PDE8A, могут быть также идентифицированы при помощи анализа по Саузерну и/или ПЦР-анализа. В качестве альтернативы, исследования комплементации могут быть применимы для идентификации других продуктов PDE8 человека, а также белков не человека и ДНК, кодирующих белки, обладающие одним или несколькими общими биологическими свойствами PDE8A.
Полинуклеотиды данного изобретения применимы также в тестах гибридизации для обнаружения способности клеток экспрессировать PDE8. Полинуклеотиды данного изобретения могут быть также основой для диагностических способов, применимых для идентификации генетического изменения (изменений) в локусе PDE8, которое может лежать в основе патологического состояния или состояний.
Посредством данного изобретения становятся также доступными антисмысловые полинуклеотиды, которые узнают полинуклеотиды, кодирующие PDE8, и гибридизуются с ними. Обеспечены полноразмерные антисмысловые полинуклеотиды и их фрагменты. Антисмысловые полинуклеотиды имеют, в частности, отношение к регуляции экспрессии PDE8 клетками, экспрессирующими мРНК PDE8.
Информация о ДНК- и аминокислотной последовательности, обеспечиваемая данным изобретением, делает также возможным систематический анализ структуры и функции PDE8. Информация о ДНК- и аминокислотной последовательности для PDE8 позволяет также идентифицировать молекулы, с которыми будет взаимодействовать PDE8A. Агенты, которые модулируют (т.е. увеличивают, уменьшают или блокируют) активность PDE8, могут быть идентифицированы инкубированием предполагаемого модулятора с PDE8 и определением действия этого предполагаемого модулятора на фосфодиэстеразную активность PDE8. Селективность соединения, которое модулирует активность PDE8, может быть оценена сравнением его активности на PDE8 с его активностью на других ферментах PDE. Способы на основе клеток, такие как дигибридные тесты и тесты расщепления гибридов, а также способы in vitro, в том числе тесты, в которых полипептид или его партнер связывания иммобилизуется, и тесты в растворе рассматриваются данным изобретением.
Селективные модуляторы могут включать в себя, например, антитела и другие белки или пептиды, которые специфически связываются с PDE8 или нуклеиновой кислотой PDE8, олигонуклеотиды, которые специфически связываются с PDE8 или нуклеиновой кислотой PDE8, и другие, непептидные соединения (например, выделенные или синтетические органические молекулы), которые специфически реагируют с PDE8 или кодирующей PDE8 нуклеиновой кислотой. Мутантные формы PDE8, влияющие на ферментативную активность или клеточную локализацию PDE8 дикого типа, также рассматриваются данным изобретением. Предпочтительные в настоящее время мишени для разработки селективных модуляторов включают в себя, например: (1) районы PDE8, которые контактируют с другими белками и/или локализуют PDE8 в клетке, (2) районы PDE8, которые связывают субстрат, (3) аллостерический циклический нуклеотидсвязывающий сайт (сайты) PDE8, (4) сайт (сайты) фосфорилирования PDE8 и (5) районы PDE8, которые участвуют в мультимеризации субъединиц PDE8. Модуляторы активности PDE8 могут быть терапевтически применимыми в лечении большого диапазона заболеваний и физиологических состояний, для которых известно участие активности PDE.
Кроме того, данное изобретение рассматривает низкомолекулярные модуляторы ферментативной активности PDE8A. Имеется по меньшей мере три различных типа библиотек, используемых для идентификации низкомолекулярных модуляторов. Они включают в себя: (1) химические библиотеки, (2) библиотеки природных продуктов и (3) комбинаторные библиотеки, состоящие из произвольных пептидов, олигонуклеотидов или органических молекул.
Химические библиотеки состоят из структурных аналогов известных соединений или соединений, которые идентифицированы как "хиты" ("попадания") ("hits") или "указания" ("leads") при помощи скрининга природных продуктов. Библиотеки природных продуктов являются коллекциями микроорганизмов, животных, растений или морских организмов, которые используют для создания смесей для скрининга при помощи: (1) ферментации и экстракции бульонов из почвенных, растительных или морских микроорганизмов или (2) экстракции растений или морских организмов. Комбинаторные библиотеки состоят из больших количеств пептидов, олигонуклеотидов или органических соединений в виде смеси. Их относительно легко приготовить при помощи традиционных способов автоматизированного синтеза, ПЦР, клонирования или подходящих синтетических способов. Особый интерес представляют собой пептидные и олигонуклеотидные комбинаторные библиотеки. Другие представляющие интерес библиотеки включают в себя пептидные, белковые, пептидомиметические, мультипараллельные синтетические коллекционные, рекомбинаторные и полипептидые библиотеки. В отношении обзора комбинаторной химии и библиотек, создаваемых на ее основе, смотрите Myers, Curr. Opion. Biotechnol. 8:701-707 (1997).
Идентификация модуляторов с применением различных библиотек, описанных здесь, позволяет модифицировать предполагаемый "хит" ("попадание") (или "указание") для оптимизации способности "хита" модулировать активность.
Далее, изобретение предусматривает способы идентификации партнера специфического связывания полипептида PDE8A изобретения, предусматривающие стадии: а) контактирования полипептида PDE8A с соединением в условиях, позволяющих связывание между этим соединением и полипептидом PDE8A; b) детектирования связывания этого соединения с полипептидом PDE8A и с) идентификации этого соединения как партнера специфического связывания полипептида PDE8A. Партнер связывания, идентифицированный в способах данного изобретения, предпочтительно модулирует ферментативную активность PDE8A либо посредством ингибирования, либо посредством активации или усиления этого фермента.
Данное изобретение предусматривает также способы идентификации соединения-партнера связывания полинуклеотида PDE8A изобретения, предусматривающие стадии: а) контактирования полинуклеотида PDE8A с соединением в условиях, позволяющих связывание между этим соединением и полинуклеотидом PDE8A; b) детектирования связывания этого соединения с полинуклеотидом PDE8A и с) идентификации этого соединения как партнера специфического связывания полинуклеотида PDE8A. Партнер связывания полинуклеотида PDE8A предпочтительно модулирует экспрессию полипептида PDE8A, кодируемого этим полинуклеотидом PDE8A, либо посредством ингибирования экспрессии, либо посредством усиления экспрессии.
Данное изобретение обеспечивает также соединения, идентифицированные способом данного изобретения, а также композиции, содержащие идентифицированное соединение и фармацевтически приемлемый носитель.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение иллюстрируется следующими примерами, которые относятся к выделению полинуклеотидов, кодирующих полипептиды PDE8, а также к экспрессии и характеристике кодируемых полипептидов. Пример 1 описывает способы поиска в базе данных экспрессируемых маркеров последовательностей (EST) для идентификации зондов, потенциально применимых для выделения ДНК данного изобретения. Пример 2 относится к идентификации кодирующих PDE8A полинуклеотидов. Пример 3 относится к анализу последовательности выделенных полинуклеотидов. Пример 4 описывает анализ полипептидов, кодируемых полинуклеотидами PDE8A. Пример 5 относится к экспрессии рекомбинантных полипептидов PDE8A. Пример 6 относится к Нозерн-анализу экспрессии PDE8A. Пример 7 описывает хромосомное картирование гена, кодирующего PDE8A. Пример 8 описывает подтверждение того, что PDE8A1 и PDE8A2 представляют собой сплайсинг-варианты. Пример 9 относится к экспрессии и характеристике рекомбинантной PDE8A. Пример 10 детализирует получение моноклональных антител против PDE8A. Пример 11 описывает анализ экспрессии PDE8A при помощи гибридизации in situ.
Пример 1
Идентификации EST, относящихся к PDE человека
С использованием последовательностей известных 3',5'-циклический нуклеотид-фосфодиэстераз человека был предпринят поиск в базе данных экспрессируемых маркеров последовательностей (EST) Национального Центра Информации Биотехнологии (NCBI) для идентификации кДНК-фрагментов, которые могли бы быть потенциально применимы для идентификации новых генов фосфодиэстераз (PDE). Эта база данных содержит последовательности ДНК, представляющие один или оба конца кДНК, собранные из многочисленных источников тканей. Один цикл секвенирования выполняют на одном или обоих концах этой кДНК и качество этой последовательности ДНК варьируется чрезвычайно сильно. Во время проведения поисков на PDE база данных последовательностей EST содержала более 600000 кДНК-последовательностей из разнообразных организмов.
Поиск на новые последовательности PDE включал в себя три стадии. В первой стадии использовали программу BLASTN, доступную через NCBI, для идентификации последовательностей ДНК в базе данных последовательностей EST с гомологией в отношении последовательностей кДНК, кодирующих известные PDE человека. Эта программа сравнивает испытуемую нуклеотидную последовательность с базой данных нуклеотидных последовательностей. кДНК-последовательности пятнадцати известных PDE человека были представлены на экспертизу и было проведено пятнадцать BLASTN-поисков; испытуемые последовательности PDE включали в себя PDE1A3 [Loughney, et al., J. Biol. Chem. 271:796-806 (1996)], PDE1B1 [Yu, et al., Cell Signalling, in press (1997)], PDE1C2 [Loughney, et al., J. Biol. Chem. 271:796-806 (1996)], PDE2A3 [Rosman, et al., Gene 191:89-95 (1997)], PDE3A [Meacci, et al., Proc. Natl. Acad. Sci. (USA) 89:3721-3735 (1992)], PDE3B [Miki et al., Genomics 36:476-485 (1996)], PDE4A5 [Bolger, et al., Mol. Cell. Biol. 13:6558-6571 (1993)], PDE4B2 [Bolger, et al., Mol. Cell. Biol. 13:6558-6571 (1993)], PDE4C [Bolger, et al., Mol. Cell. Biol. 13:6558-6571 (1993)], PDE4D1 и PDE4D3 [Bolger, et al., Mol. Cell. Biol. 13:6558-6571 (1993)], PDE5A, PDE6A [Pittler, et al., Genomics 6:212-283 (1990)], PDE6B [Collins, et al., Genomics 13:698-704 (1992)], PDE6C [Piriev, et al., Genomics 28:429-435 (1995) и PDE7A1 [Michaeli, et al., J. Biol. Chem. 17:12925-12932 (1993)]. Результаты BLASTN исследовали и последовательности EST, которые были оценены как соответствующие каждой из пятнадцати известных кДНК PDE, были идентифицированы и собраны в таблицу. Последовательности PDE6A и PDE6B, используемые в качестве испытуемых, были усеченными на 3'-конце (с удалением части 3'-нетранслируемого района) вследствие присутствия повторяющихся элементов в 3'-нетранслируемом районе этих кДНК.
Во-вторых, программу TBLASTN NCBI использовали для исследования гомологии между последовательностью белка пятнадцати известных PDE человека (описанных выше) и шестью различными возможными белками, кодируемыми каждой из последовательностей ДНК EST. В этом поиске последовательности EST транслируют в шести рамках считывания и полученные аминокислотные последовательности сравнивают с испытуемыми аминокислотными последовательностями PDE. Последовательности, идентифицированные как гомологичные на уровне аминокислот, исследовали и любые последовательности EST, положительно идентифицированные как соответствующие известной PDE во время поиска BLASTN, описанного выше, были отброшены.
Третья стадия этого поиска включала в себя анализ последовательностей, которые не были известными PDEs. Эти аминокислотные последовательности были гомологичны известным PDE, но не были идентифицированы как один из 15 известных генов PDE во время поисков BLASTN.
Поиски по программе BLASTN идентифицировали последовательность EST (обозначенную как WO4835) из библиотеки кДНК легких эмбриона человека как кодирующую аминокислотную последовательность, имеющую гомологию с каталитическим районом PDE2A, PDE3A, PDE3B, PDE4A, PDE4B, PDE4C, PDE5A, палочкообразной альфа PDE6A, палочкообразной бета PDE6B, конусообразной альфа PDE6C и PDE7A. Эта последовательность базы данных для WO4835 представлена в SEQ ID NO:7. Результаты из анализа с применением базы данных, обсуждаемые ниже, используют в качестве примера последовательность PDE4D.
кДНК WO4835 получали из Американской коллекции типов тканевых культур (Rockville, MD), которая хранит и делает открыто доступными депозиты EST, идентифицированных и секвенированных при помощи I.M.A.G.E. (Lawrence Livermore National Laboratory, Livermore, CA). ДНК WO4835 секвенировали под расписку для подтверждения ее идентичности и определили, что она соответствует SEQ ID NO: 7.
Аминокислотную последовательность, кодируемую -1 рамкой считывания последовательности EST WO4835, узнавали все испытуемые последовательности кДНК PDE, за исключением PDE1A, 1В и 1С. С применением результатов TBLASTN с PDE4D3 в качестве примера обнаружили два района сходства. Первый район обнаружил 15/37 точных совпадений или 40% идентичность (19/37 одинаковых аминокислот) и включал в себя мотив HD(X)2 HXG(X)13A (SEQ ID NO: 8), найденный во всех испытуемых последовательностях. [Charboneau, Mol. Pharmacol. Cell Regul. 2:267-298 (1990)]. Второй район обнаружил 9/20 точных совпадений или 45% идентичность и включал в себя мотив YHNxxHA, найденный в большинстве испытуемых последовательностей. BLASTN-анализ последовательности WO4835 выявил, что она была уникальной в том смысле, что она не была идентична ни одной из других последовательностей ДНК человека в базе данных банка генов (Genbank database). Введение WO4835 в базу данных EST идентифицировало эту последовательность как сходную с PIR:A48719, бычьей последовательностью PDE5A1, связывающей цГМФ, гидролизующей цГМФ. Сравнение белковой последовательности рамки -1 WO4835 с бычьей последовательностью PDE5A1 обнаружило 58/153 совпадений для общей идентичности 38%. В этом районе были небольшие районы большей гомологии; один район обнаружил 12/14 идентичных аминокислот. При условии уникального характера последовательности WO4835, ее относительно низкой гомологии с бычьей PDE5A1 и присутствия мотивов аминокислот, обнаруженных в большинстве других известных аминокислотных последовательностей PDE человека, WO4835 представляет собой новую кДНК PDE человека.
Пример 2
Выделение предполагаемой кДНК PDE
кДНК-вставку WO4835 расщепляли из вектора pT7T3D на два фрагмента рестриктазами EcoRI и HindIII и эти два фрагмента очищали при помощи двух последовательных плавящихся при низкой температуре агарозных гелей. Оба фрагмента использовали в качестве зондов для скрининга библиотек кДНК, полученных из сердца человека (Stratagene, La Jolla, CA) и мозга эмбриона человека (Stratagene), с применением процедур, установившейся практикой в данной области. Скринировали приблизительно 5×105 фагов из каждой библиотеки. Гибридизацию проводили в течение ночи в буфере, содержащем 3Х SSC, 0,1% саркозил, 20 мМ фосфат натрия, рН 6,8, 10Х раствор Денхардта и 50 мкг/мл ДНК спермы лосося, при 65°С. Фильтры промывали при 65°С в буфере, содержащем 2Х SSC и 0,1% ДСН, перед авторадиографией.
Девять клонов из библиотеки кДНК мозга эмбриона и два клона из библиотеки кДНК сердца гибридизовались с зондом WO4835. Частичное секвенирование и картирование привело к отбору одного клона из библиотеки мозга эмбриона, обозначенного FB66a, для дальнейшей характеристики.
Второй скриниг приблизительно 7,5×105 фагов из библиотеки кДНК мозга эмбриона в условиях, использованных в первом скрининге, с применением фрагмента EcoRI/HindIII 1,3 т.п.н. из 5'-части WO4835 дал девятнадцать дополнительных клонов кДНК. Шесть из этих кДНК также гибридизовались с фрагментом HindIII/KpnI WO4835, включающим в себя район из 256 нуклеотидов при 5'-конце WO4835. Частичное секвенирование и картирование пяти из этих клонов привело к отбору второго клона, обозначенного FB85c-2, для дальнейшего анализа.
Пример 3
Анализ последовательности ДНК FB66a и FB85c-2
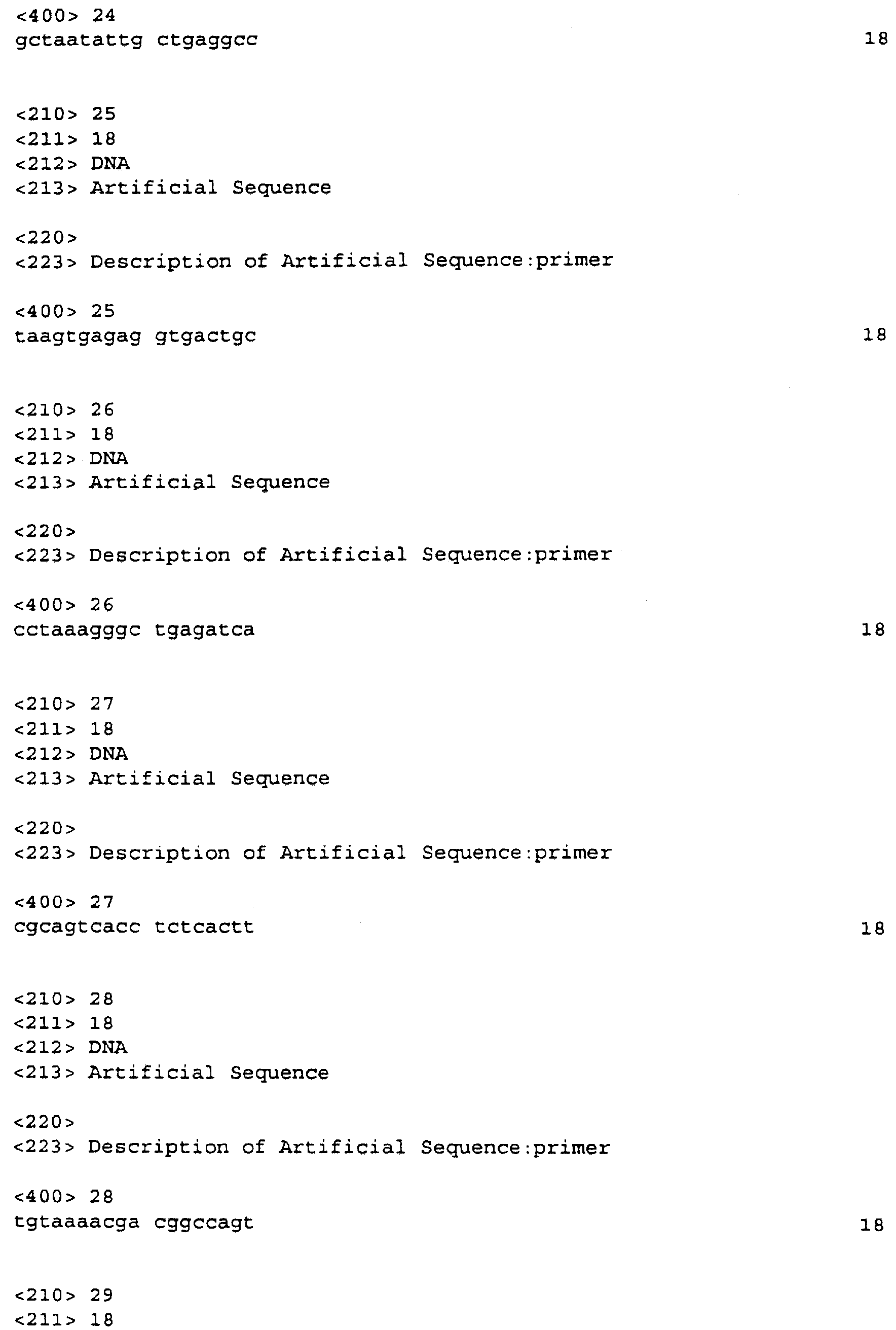
Последовательность ДНК FB66a определяли для обеих цепей с использованием ДНК-олигонуклеотидных праймеров, приведенных ниже в SEQ ID NO:9-31, и ДНК-секвенатора Perkin Elmer Applied Biosystems Division 373A в соответствии с предлагаемым изготовителем протоколом. Количество ПЦР-продукта, используемого в качестве матрицы, рассчитывали на основании размера ПЦР-продукта и продукт секвенировали с применением готового реакционного набора для секвенирования (ABI PRISM Dye Terminator Cycle Sequencing Ready Reaction Kit) с ДНК-полимеразой ApliTaq, FS (Perkin Elmer, Foster City, CA) и асимметричной ПЦР. Продукт реакции очищали на вращаемой колонке AGCT (Advanced Genetic Technologies Corp., Gaithersburg, MD) и сушили. Буфер для нанесения добавляли к каждой очищенной пробе и смесь нагревали при 90°С в течение двух минут. Раствор переносили на лед и выдерживали до нанесения на 4% полиакриламидный гель. Результаты собирались автоматически, как только была инициирована программа сбора данных, и анализировались автоматически и регистрировались с применением программы анализа последовательности (Sequence Analysis program). Все редактирование выполняли вручную и полученные последовательности выстраивали для определения консенсусной последовательности.
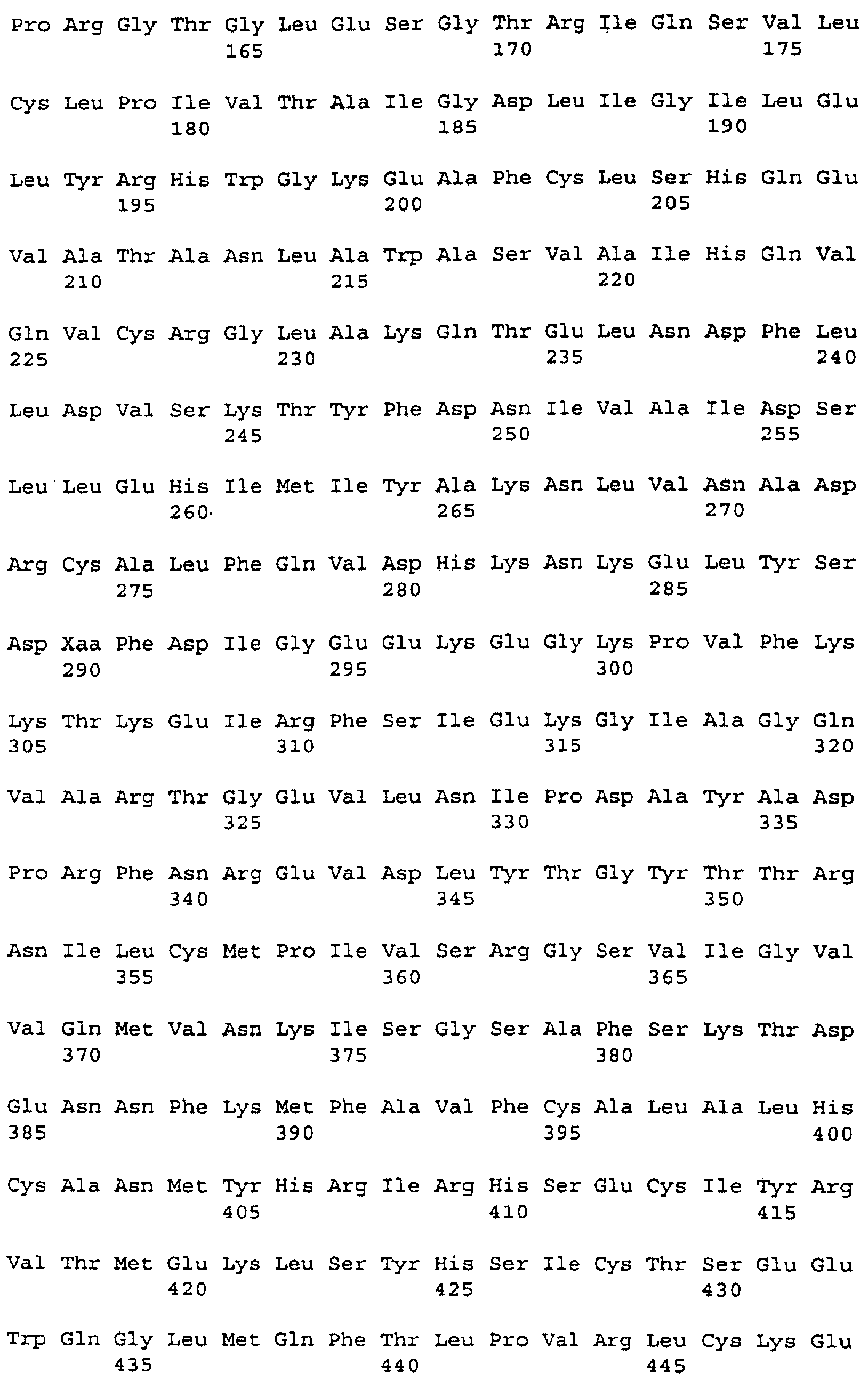
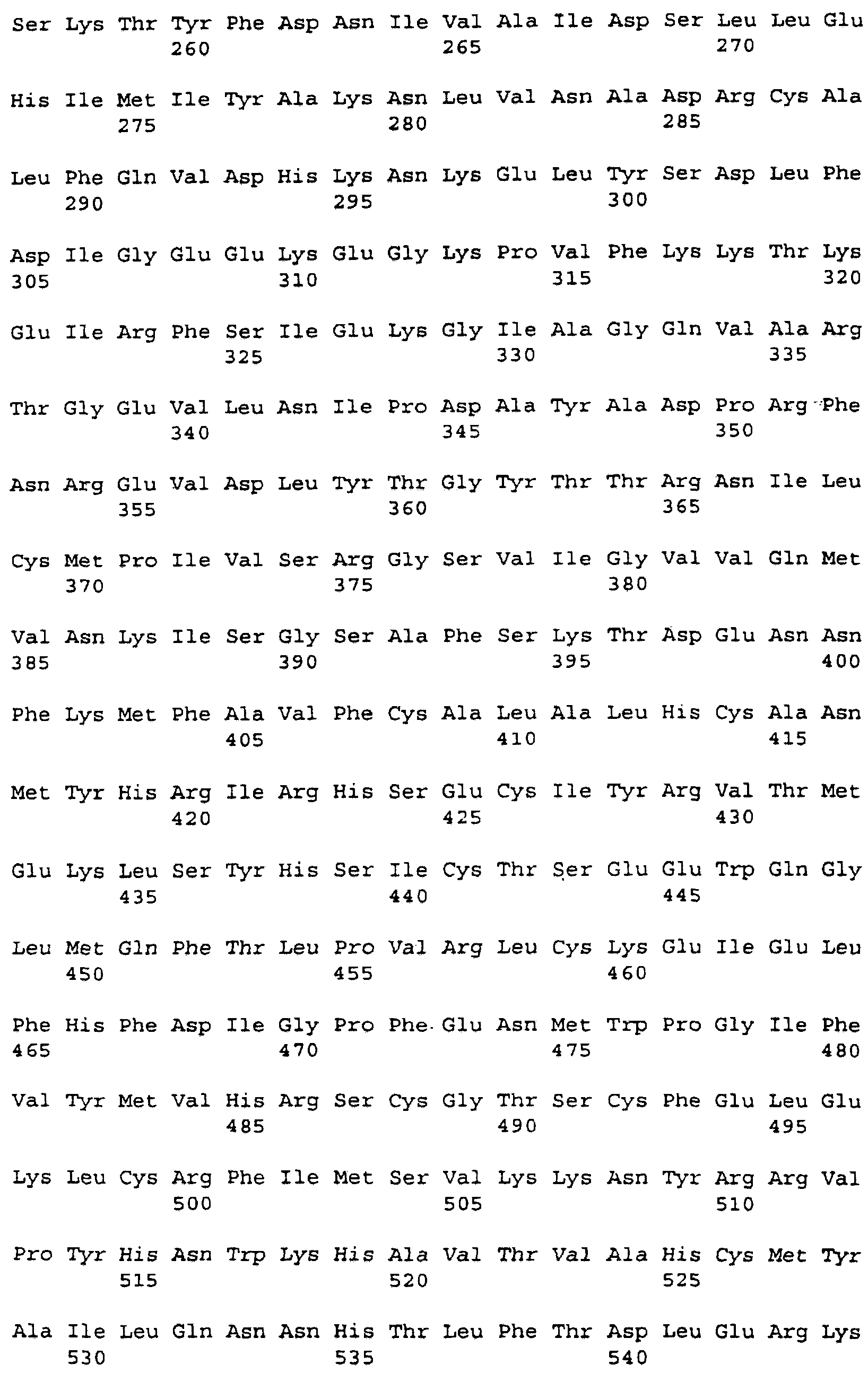
кДНК FB66a, представленная в SEQ ID NO:3, имеет длину 4389 нуклеотидов и, от нуклеотида 3 до нуклеотида 2411, кодирует белок из 803 аминокислот с предсказанной молекулярной массой приблизительно 90775 Да (дальтон). Расшифрованная аминокислотная последовательность для FB66a представлена в SEQ ID NO:4. Первый метионин кодируется при нуклеотиде 45; отсутствие по ходу транскрипции в рамке считывания стоп-кодона делает неясным, является ли этот остаток внутренним метионином или началом открытой рамки считывания.
Последовательность ДНК FB85c-2 (SEQ ID NO:5) определяли подобным образом с использованием праймеров M13Rev.1, W48A2, W48A9, W48A4, W48S1, W48A1, W48S6, W48A5, W48A6, W48S2, W48S3, W48S4, W48S5, W48S7, W48A8 и М13. FB85c-2, по-видимому, включает в себя две отличающиеся вставки ДНК, только одна из которых была гомологична WO4835. Район, гомологичный WO4835, был длиной приблизительно 2,8 т.п.н. Точная последовательность на 5'-конце этой вставки не могла быть определена и, следовательно, несколько сотен оснований последовательности, в которой может быть 5'-нетранслируемый район, не включены в последовательность из 2573 нуклеотидов, представленную в SEQ ID NO:5. Район нуклеотид 67 - нуклеотид 2406 кодирует белок, имеющий 779 аминокислот (SEQ ID NO:6), имеющий предсказанную молекулярную массу 88353 Да. Стоп-кодон в рамке считывания делает вероятным, что метионин, кодируемый в положении нуклеотида 67, является инициирующим метионином.
Белки, кодируемые FB66a и FB85c-2, имеют различные аминоконцевые последовательности, которые могут быть связаны с альтернативным сплайсингом. Эти последовательности ДНК отличаются одна от другой 5' от нуклеотида 112 в FB66a и нуклеотида 104 в FB85c-2. Так, FB85c-2 имеет 13 аминокислот при аминоконце, которые не найдены в белке FB66a. Белок FB66a включает в себя 23 уникальных аминоконцевых остатка, если инициирующий метионин, как это предполагается, кодируется в нуклеотиде 35; этот белок включает в себя более 37 уникальных аминоконцевых остатков, если открытая рамка считывания в клоне FB66a является неполной.
BLASTN-анализ последовательности FB66a, в котором испытуемую нуклеотидную последовательность сравнивают с базой данных нуклеотидных последовательностей, не обнаружил идентичности с последовательностями в банке генов, базах данных NCBI STS, NCBI HTGS или NCBIGSS. Однако две идентичные последовательности были идентифицированы в базе данных NCBI EST.
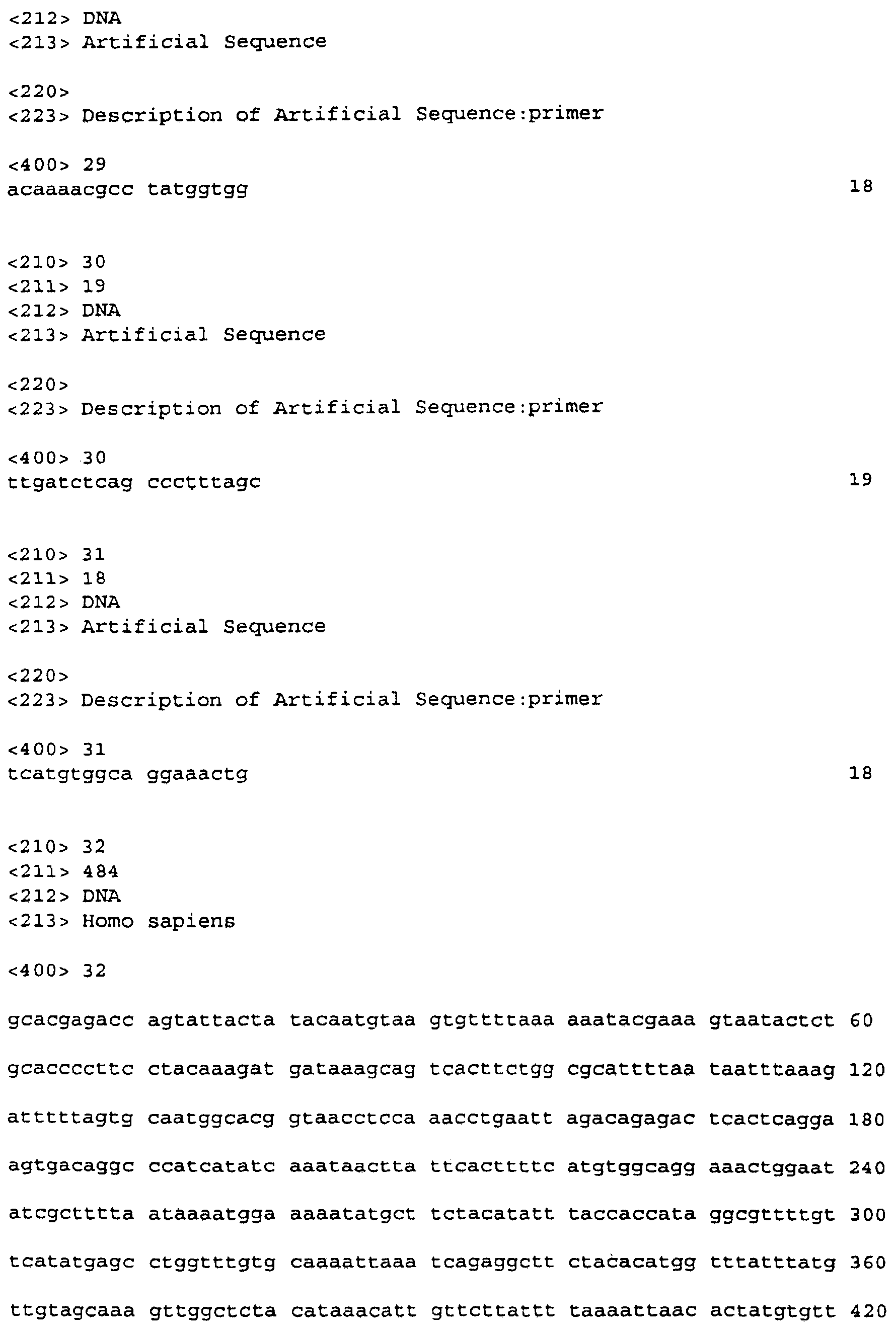
Одной последовательностью была WO4835 EST, которую использовали для идентификации кДНК-клона. Вторая последовательность, АА307865 (SEQ ID NO:32), полученная из клональной клеточной линии рака толстой кишки КМ12С (НСС), обнаружила идентичность последовательности с 3'-нетранслируемым районом клонов FB66a и FB85c-2. Во время поиска, в котором идентифицировали АА307865, дополнительные ДНК EST были идентифицированы, предположительно кодирующие возможные мышиный (EST FF386789, SEQ ID NO:38) и крысиный (EST H32734, SEQ ID NO:33) гомологи белков человека, кодируемых FB66a и FB85c-2. Мышиная последовательность была на 86% идентична последовательностям человека, а крысиная была идентична на 81%.
Пример 4
Анализ белка FB85c-2 и белка FB66a
PDE, кодируемые клонами FB85c-2 и FB66a, были названы PDE8A1 и PDE8A2, соответственно. Оба белка PDE8A, имеющие полную идентичность аминокислотной последовательности за точкой дивергенции (расхождения), обсужденной выше, наиболее сходны с PDE2A, PDE5A, PDE6A, PDE6B и PDE6C человека. Таблицы 1 и 2 показывают процент аминокислотной идентичности между PDE8A и PDE2A, PDE5A и PDE6A.
PDE8A1 и PDE8A2 имеют гомологию с другими PDE на протяжении каталитического района (аминокислоты 492-748 в PDE8A1) и с предположительным цГМФ-связывающим доменом, эволюционно сохраненным в аминоконцевом районе PDE2A, PDE5A, PDE6A, PDE6B и PDE6C. Потенциальный цГМФ-связывающий домен PDE8A простирается от аминокислоты 75 до аминокислоты 445 в полипептиде PDE8A1. В цГМФ-связывающих доменах PDE2A, PDE5A, PDE6A, PDE6B и PDE6C имеются два внутренних повтора, названных "а" и "b", и каждый повтор содержит ряд консервативных аминокислот [McAllister-Lucas, et al., J. Biol. Chem. 268:22863-22873 (1993)]. В соответствующем повторяющемся районе "b" PDE8A обнаружены все эти консервативные аминокислоты; в соответствующем повторяющемся районе "а" были обнаружены только некоторые из этих консервативных остатков. Остаток аспартата, который, как было показано, является существенным для цГМФ-связывания бычьей PDE5A [McAllister-Lucas, et al., J. Biol. Chem. 270:1-9 (1995)], не присутствует в повторяющемся районе "а" PDE8A. Таким образом, неясно, функционирует ли этот район в PDE8A как район связывания цГМФ.
Пример 5
Экспрессия рекомбинантной PDE8A
Была генерирована экспрессионная конструкция PDE8A, которая включала в себя последовательности ДНК 3' от точки разветвления PDE8A1 и PDE8A2 через стоп-кодон. Эта экспрессионная конструкция включала в себя ДНК, кодирующую маркер эпитопа из восьми аминокислот. Этот так называемый "FlAG"-маркер", содержащий пептидную последовательность, представленную в SEQ ID NO:34, добавляли к аминоконцу, для того чтобы этот белок мог быть идентифицирован по способу Вестерн-блоттинга с использованием антител М2 против FLAG (Eastman Kodak, Rochester, NY), которые специфически узнают пептид SEQ ID NO:34.
SEQ ID NO:34 Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys
Последовательности, кодирующие инициирующий метионин в аминоконце белков, также добавляли.
В качестве первой стадии в конструировании экспрессирующей плазмиды ПЦР проводили с применением ДНК FB66a в качестве матрицы с использованием праймеров, представленных в SEQ ID NO:35 (ниже) и W48A2 (SEQ ID NO:10), в реакционной смеси, содержащей 2 мкл каждого праймера (исходный раствор 100 мкг/мл), 2 мкл 10Х буфера II ПЦР (Perkin Elmer), 2 мкл 10Х исходного раствора каждого нуклеотида (исходный раствор 2 мМ), 1,2 мкл MgCl2 (исходный раствор 25 мМ), 0,09 мкл 5 единиц/мкл полимеразы taq (Perkin Elmer), ДНК FB66a и воду для доведения реакционной смеси до 20 мкл. В 5'-праймере (SEQ ID NO: 35) сайт Ncol напечатан жирным шрифтом, а район, кодирующий маркер FLAG, подчеркнут.
ПЦР проводили в термоциклере ДНК Perkin Elmer при следующих условиях: 94°С в течение 4 минут, затем 30 циклов 94°С в течение 1 минуты, 50°С в течение одной минуты и 72°С в течение двух минут.
Полученный продукт ПЦР расщепляли Ncol и Kpnl, очищали на геле и субклонировали в вектор pBluescript SKII, предварительно расщепленный теми же самыми ферментами. Вектор pBluescript был ранее модифицирован таким образом, что он включает в себя фрагмент SacI/NcoI промотора алкогольдегидрогеназы 2 (ADH2), удаленный из вектора YEpC-PADH2d [Price, et al., Meth. Enzymol. 185:308-315 (1990)]. Полученная плазмида была обозначена W48pcr1.
Фрагмент KpnI/SstI, содержащий 3'-часть открытой рамки считывания, выделяли из кДНК FB66a и встраивали в W48pcr1, предварительно расщепленную Kpnl и EcoRV. Полученная плазмида была обозначена W485.1.1.
Фрагмент SacI/KpnI, содержащий промотор ADH2 и 5'-часть гена PDE8A, выделяли из W48pcr1. Фрагмент KpnI/SalI, содержащий 3'-район PDE8A, выделяли из W485.1. Оба эти фрагмента лигировали в дрожжевой экспрессирующий вектор YEpC-PADH2d, который был предварительно расщеплен SacI и SalI. Полученная плазмида была названа W48-2ADH2 и депонирована 2 октября 1997 года согласно условиям Будапештского Договора Американской коллекцией типов тканевых культур (А.Т.С.С.), 12301 Parklawn Drive, Rockville, MD 20852. Бактериальный штамм, несущий плазмиду W48-2ADH2, получил номер доступа АТСС 98552. Последовательности ДНК, генерированные ПЦР, и последовательности ДНК в местах соединений PDE8/вектор определяли для гарантии правильной конструкции плазмиды. После подтверждения этой последовательности плазмиду трансформировали в штамм дрожжей BJ2-54, лишенный эндогенной активности PDE [ura3-52; trp1; leu2; cir0; gal1; рер4-3; prb1-1122; prc1-402; ΔPDE1::URA3; HIS3; ΔPDE2::TRP1).
Клетки-хозяева выращивали в течение ночи в SC-leu-селективной среде, включающей в себя 2% глюкозу, разбавляли до 1-2×105 клеток/мл и затем выращивали до плотности 107клеток/мл в той же самой среде. Присутствие экспрессирующей плазмиды, по-видимому, увеличивало время удвоения для клеточного роста в два-три раза даже при неиндуцирующих условиях. Клетки собирали центрифугированием, промывали YEP-средой, содержащей 3% глицерин, ресуспендировали (повторно суспендировали) в YEP/3% глицерине при плотности 107 клеток/мл и выращивали в течение 24 часов перед сбором. Клетки замораживали до использования.
Замороженные клеточные осадки (0,06 мл) оттаивали и суспендировали в 0,2 мл лизисного буфера, содержащего 100 мМ MOPS, рН 8,0, 200 мМ NaCl, 2 мкМ ZnSO2, 2 мМ дитиотреитол и 10 мкг/мл каждого из ингибиторов протеаз пепстатина, лейпептина и апротинина. Приблизительно 0,2 мл стеклянных бусин 0,5 мм добавляли к клеткам, которые затем лизировали с применением четырех 30-секундных циклов вихревого встряхивания. Лизат отсасывали и бусины промывали дважды 0,3 мл лизисного буфера. Лизат объединяли с промывками с получением дрожжевого экстракта. В некоторых экспериментах лизат фракционировали центрифугированием при 105000 × g в течение тридцати минут.
Вестерн-анализ проводили на дрожжевом экстракте, содержащем рекомбинантные белки, следующим образом. Белки сначала разделяли при помощи электрофореза в ДСН-ПААГ и переносили на Иммобилон-Р (Millipore) с применением стандартных способов. Блоты белков блокировали при помощи 5% обезжиренного сухого молока в 20 мМ Трис-HCl, рН 7,4, 150 мМ NaCl, 0,05% Твине-20 (TBST-буфер плюс молоко) в течение одного часа при комнатной температуре. Блоты инкубировали с антителом М2 против FLAG (обсужденным выше) при концентрации 1 мкг/мл в TBST-буфере плюс молоко в течение одного часа, после чего блоты промывали четыре раза TBST-буфером. Затем блоты инкубировали в течение одного часа с аффинно очищенным до чистоты, требующейся для блоттинга, козьим антимышиным IgG-антителом, конъюгированным с пероксидазой хрена (HRP) (BioRad). Козий IgG предварительно разбавляли 1:10000 в TBST-буфере плюс молоко. Блоты промывали четыре раза TBST и обрабатывали в соответствии с предлагаемым изготовителем протоколом системой Renaissance® (New England Nuclear Life Sciences Products) для усиленной хемилюминесценции перед авторадиографией. Большая часть белка, детектируемого этим антителом, имела размер, ожидаемый для рекомбинантного белка.
Активность PDE определяли регистрированием32P-фосфата, высвобождаемого из32Р-цАМФ или32Р-цГМФ, как описано ранее [Loughney et al., J. Biol. Chem. 271:796-806 (1996)]. Дрожжевой экстракт разбавляли в 0,5Х лизисном буфере, также содержащем 0,5 мг/мл бычьего сывороточного альбумина. Двадцать мкл дрожжевого экстракта или разбавленного дрожжевого экстракта анализировали в реакционном объеме 100 мкл, который включал в себя дополнительно 50 мМ Трис-HCl (рН 8, 0), 5 мМ MgCl2, 1 мкМ ZnSO2 и 0,1 мг/мл бычьего сывороточного альбумина. Концентрацию белка определяли по методу Бредфорда.
Было обнаружено, что PDE8A гидролизовал как цАМФ, так и цГМФ. В нефракционированных лизатах удельная активность в отношении цАМФ была 3,9 нмоль/мин/мг и в отношении цГМФ 7,6 нмоль/мин/мг. Фракционирование выявило, что 20-40% общей активности были связаны с высокоскоростной фракцией супернатанта. Кинетический анализ активности с цАМФ в качестве субстрата предполагал присутствие форм этого фермента как с низкой Km, так и с высокой Km в соотношении 1:1. Определенные величины Km были 0,2 мкМ и 350 мкМ. Анализ высокоскоростного осадка предполагал, что присутствовали те же самые молекулы, но в соотношении активности с высокой Кm и активности с низкой Km 1:4. Кинетический анализ с цГМФ в качестве субстрата также предполагал присутствие "низкой" и "высокой" форм фермента. В этих анализах величины Km были 3 мкМ и 300 мкМ.
Величины IC50 для ингибирования активности PDE8A определяли с применением ряда изозим-селективных ингибиторов PDE и неселективного ингибитора изометилбутилксантина (IBMX). Так как эти определения проводили при концентрации цАМФ 60 нМ, величины IC50 отражают только ингибирование формы с низкой Кm. Эти результаты приведены в таблице 3 с величинами, представленными в микромолярных единицах.
Величины IC50 для каждого из селективных ингибиторов были по меньшей мере в 30 раз более высокими против PDE8, чем против их изозимов-мишеней, что предполагает, что ингибиторный профиль PDE8 отличается от ингибиторного профиля PDE 1-5. Гидролиз цАМФ и цГМФ явно отличает ферментативную активность PDE8 от активности PDE6 и PDE7A. IC50 неселективного ингибитора IBMX для PDE8 была в диапазоне, наблюдаемом для известных PDE человека, предполагая, что каталитический сайт PDE8 сходен с сайтами других PDE человека и млекопитающих и отличается от форм низших эукариот, которые нечувствительны к IBMX.
Пример 6
Нозерн-аналиэ экспрессии PDE8A
Нозерн-анализ экспрессии PDE8 проводили с применением блота многочисленных тканей человека (Clontech, Palo Alto, СА). Зонд из 327 п.н. простирался от нуклеотида 1767 до нуклеотида 2293 в SEQ ID NO:3. Получение рибо-зонда и условия гибридизации соответствовали ранее описанным [Loughney et al., supra].
Результаты показали мРНК 9,5 т.п.н. во всех испытанных тканях, но интенсивность полосы варьировала. Сигнал был наиболее сильным в сердце, мозгу и почке; сигнал был более слабым в печени, плаценте, поджелудочной железе и скелетной мышце. Самым слабым был сигнал в легком.
Пример 7
Хромосомное картирование PDE8A человека
Дрожжевые искусственные хромосомы человека (YAC), содержащие ген PDE8A человека, выделяли из панели YAC человека, купленной у Research Genetics, и подвергали скринингу с использованием ПЦР следующим образом.
Супер-пулы YAC скринировали двумя "футлярными" парами праймеров. В первой реакции скрининга, смысловой праймер WO 48S5 (SEQ ID NO:36) спаривали с антисмысловым праймером W 48A10 (SEQ ID NO: 37). ПЦР проводили с 10 мМ Трис-HCl, рН 8,3, 50 мМ KCl, 2 мМ MgSO4, 0,2 мМ каждого dNTP, 10 мкг/мл каждого праймера, 0, 5 единицами полимеразы Taq (Perkin Elmer) и 1,5 мкл ДНК пула YAC в качестве матрицы. Реакции проводили в течение 30 циклов, причем каждый цикл состоял из одной минуты при 94°С, двух минут при 60°С и четырех минут при 72°С. После первого цикла амплификации продукты реакции повторно амплифицировали с парой внутренних праймеров W 48S12 (SEQ ID NO: 36) и W 48A12 (SEQ ID NO: 37).
Реакции проводили, как описано выше, за исключением того, что матрицей был 1 мкл разведения 1:10 (в воде) реакции первого цикла. Были идентифицированы супер-пулы, дающие правильный размер продукта ПЦР, и соответствующие суб-пулы скринировали с теми же самыми "футлярными" парами праймеров при тех же самых условиях для идентификации уникальных сайтов для YAC, содержащих PDE8A.
Штаммы дрожжей, несущие релевантные YACs, приобретали из Research Genetics. Для проверки присутствия гена PDE8A в различных YACs, из каждого штамма получали ДНК согласно способу, описанному ранее [Hoffman and Winston, Gene 57:267-272 (1987)], но модифицированному следующим образом. Штаммы выращивали в течение ночи при 30°С в среде YEP, содержащей глюкозу. Десять мл культуры осаждали центрифугированием и ресуспендировали (повторно суспендировали) в 200 мкл водного буфера, содержащего 10 мМ Трис-HCl, рН 8,0, 100 мМ NaCl, 1 мМ Na2-ЭДТА, 1% ДСН и 2% Тритон-Х100. Клетки лизировали вихревым встряхиванием в присутствии 200 мкл смеси фенол/хлороформ (1:1) и 100 мкл стеклянных бусин (425-600 мкм). После лизиса добавляли 200 мкл ТЭ-буфера (10 мМ Трис, рН 8,0, 1 мМ Na2-ЭДТА) и пробы центрифугировали для разделения фаз. Органическую фазу экстрагировали опять 200 мкл водного буфера. Объединенную водную фазу обрабатывали 100 единицами РНКазы бычьей поджелудочной железы ((Boehringer Mannheim) в течение 1 часа при 37°С и пробу экстрагировали смесью фенол/хлороформ, повторно экстрагировали хлороформом и осаждали этанолом в соответствии с установленными способами. Полученный осадок ресуспендировали в 50 мкл ТЭ-буфера. ПЦР проводили, как описано выше, за исключением того, что объем реакции был 25 мкл и матрица состояла из 1 мкл соответствующего препарата дрожжевой ДНК.
Три YACs человека, содержащие ген PDE8, были идентифицированы с названиями 805В6, 919Н10 и 920А3 (согласно обозначениям СЕРН (Центра по изучению (генетического) полиморфизма у человека)). Согласно информации в Центре баз данных для исследования генома (Whitehead), эти три YACs перекрываются друг с другом и являются частью связанной с одной цепью хромосомы единой последовательности, "контига" (WC6.16), на хромосоме 6 человека. Два сайта маркерных последовательностей в этом "контиге" (D6S305 и D6S411) были помещены на генетической карте хромосом 6 в положении 167 сМ (сантиморганид) от конца 6р при работе в Центре исследования генома; D6S305 был картирован до положения 173 сМ от конца 6р при работе в CEPH-Genethon. Три других YAC в "контиге" WC6.16 (932F1, 956D1 и 947D5) были картированы при помощи гибридизации in situ с использованием флуоресценции в CEPH-Genethon. Сигналы гибридизации находятся между 0,94 и 0,99 фракционными единицами длины от конца 6р. Согласно интегрированной суммарной карте СЕРН [Chumakov et al., Nature 377 (Suppi):175-297 (1995)] эта область соответствует цитогенетической области 6q26-27.
Наследственные дефекты, которые были ассоциированы с этой областью генома человека, включают в себя дегенерацию колбочек (база данных OMIM), инсулинзависимый сахарный диабет [Davies et al., Nature 371:130-136 (1994); Luo et al., Am. J. Hum. Genet. 57:911-919 (1995)] и паркинсонизм, возникающий в ювенильном возрасте [Matsumine et al., Am. J. Hum. Genet. 60:588-596 (1997)]. Кроме того, потеря гетерозиготности (LOH) часто наблюдается в этой области во многих различных раковых клетках, в том числе лимфоме Беркита [Parsa et al. Genes, Chromosomes & Cancer 9:13-18 (1994)], астроцитоме [Liang et al. Neurology 44:533-536 (1994)], раке желудка [Queimado et al. Genes, Chromosomes & Cancer 14:28-34 (1995)], аденоме паращитовидной железы [Tahara et al. Cancer Res. 56:599-605 (1996)] и раке яичника [Cooke et al. Genes, Chromosomes & Cancer 15:223-233 (1996)]; Saito et al. Cancer Res. 56:5586-5589 (1996)]. Было предположено, что LOH (потеря гетерозиготности) свидетельствует о присутствии опухолевого супрессорного гена в пораженном районе [Weinberg, Science 254:1138-1146 (1991)]. Вследствие его широко распространенной экспрессии, возможно, что мутация гена PDE8 может участвовать во всех или некоторых из этих генетических аномалий.
Пример 8
Подтверждение того, что PDE8A1 и PDE8A2 представляют собой сплайсинг-варианты, и попытки удлинения 5'-последовательности PDE8A2
Для подтверждения того, что PDE8A1 и PDE8A2 представляют собой 5'-сплайсинг-варианты, были предприняты два подхода. Во-первых, ПЦР-анализ выявил, что, в геномной ДНК, последовательности ни PDE8A1, ни PDE8A2 не являются смежными с последовательностью ДНК общего района. Геномные последовательности по ходу транскрипции от общего района присутствовали в третьей кДНК PDE8A, FB74b, которую идентифицировали в группе из шести исходных клонов, которая гибридизовалась с 5'-концом зонда WO4835, описанного в примере 2. Частичная последовательность (755 нуклеотидов на 3'-конце) клона FB74b представлена в SEQ ID NO: 39. кДНК FB74b отклоняется от FB85c-2 и FB66a в том же самом положении, в котором FB85c-2 и FB66a расходятся друг от друга, но клон FB74b не сохраняет открытой рамки считывания. В FB74b последовательность от 5' до точки последовательности дивергенции от клонов FB66a и FB85c-2, стоп-кодон в рамке считывания был ближе к точке дивергенции, чем инициирующий кодон метионина, что указывает на то, что, если FB74b представляет скорее кДНК, чем несплайсированный предшественник, то инициирующий метионин обязательно находился бы в последовательности, общей как для FB66a, так и для FB85c-2.
ПЦР-анализ проводили с использованием одного праймера, названного FB74bS1 (SEQ ID NO: 40), в расположенных по ходу транскрипции последовательностях FB74b, и второго праймера, названного W48A9 (SEQ ID NO: 11), в последовательностях, общих для FB74b, FB66a и FB85c-2.
FB74bS1 GTTAGATGAGAGGTTGCTGG SEQ ID NO: 40
С использованием 1 мкг геномной ДНК человека в качестве матрицы амплифицировали (экстракопировали) полосу, имеющую тот же самый размер, что и размер полосы, амплифицированной с применением в качестве матрицы FB74b, что указывало на то, что последовательности, уникальные для FB74b, и общий район находятся рядом в геномной ДНК. Таким образом, последовательность FB74b может представялть собой несплайсированный интрон или может представлять собой третий сплайсинг-вариант, который мог бы кодировать белок с инициирующим метионином в общем районе. В любом случае, последовательности FB85c-2 и FB66a, вероятно, генерируются посредством сплайсинга.
Во-вторых, проводили 5'-RACE-анализ с использованием РНК, выделенной из тканей коры головного мозга человека, мозжечка, сердца, печени и легких. РНК выделяли из фрагментов замороженных тканей, как описано [Loughney et al., J. Blol. Chem. 271:796-806 (1996)], и поли А+-мРНК отбирали с применением системы выделения мРНК Fast Track™ (Invitrogen). Двухцепочечную кДНК получали с использованием 5 мкг поли А+-мРНК и набора для синтеза кДНК (Boehringer Mannheim). Эту кДНК лигировали с линкером, образованным отжигом олигонуклеотидов L15 (SEQ ID NO: 41) и L30 (SEQ ID NO: 42).
Для 5'-RACE лигированную с линкером кДНК амплифицировали при помощи ПЦР с применением олигонуклеотидов L18 (SEQ ID NO: 43) и W48A13 (SEQ ID NO: 44).
Реакция содержала 10 мМ Трис-HCl, рН 8,3, 50 мМ KCl, 1,5 мМ MgCl2, 0,2 мМ каждого из dNTP, 10 мкг/мл каждого праймера и 1 мкл связанной с линкером кДНК в реакционном объеме 25 мкл. После стадии нагревания при 94°С ПЦР инициировали добавлением 0,1 единицы полимеразы Taq (Boehringer Mannheim) и продолжали с 30 циклами; одна минута при 94°С, две минуты при 60°С и четыре минуты при 72°С.
Продукты этой реакции ПЦР разбавляли в 10 раз водой и использовали в качестве матрицы во второй реакции ПЦР с олигонуклеотидами L21 (SEQ ID NO: 45) и W48A9S (SEQ ID NO: 46) в тех же самых условиях, описанных выше.
ДНК, амплифицированную во второй реакции ПЦР, расщепляли EcoRI и SalI и лигировали в вектор pBluescript (Stratagene), расщепленный предварительно теми же ферментами.
Сначала исследовали последовательности ДНК в пяти плазмидах из каждого источника ткани и среди выделенных кДНК были обнаружены 5'-последовательности как PDE8A1, так и PDE8A2. 5'-последовательности FB74b также были получены, как и несколько последовательностей, каждая выделенная только один раз, которые могли бы представлять собой дополнительные сплайсинг-варианты или неродственные последовательности ДНК.
Поскольку ни одна из PDE8A2-подобных кДНК не простиралась дальше в направлении 5', чем исходная кДНК FB66a, анализировали дополнительные клоны RACE PDE8A2 в попытке удлинить 5'-концевую последовательность. Идентифицировали и секвенировали пять кДНК PDE8A2 легких, но не получили удлиненной последовательности PDE8A2.
Второй цикл ПЦР RACE повторяли с применением праймера L21 (SEQ ID NO:45) с праймером W48A14S (SEQ ID NO: 47).
Полученные клоны подвергали скринингу при помощи ПЦР и самые длинные из них выбирали для секвенирования. Только два клона были более длинными, чем исходная кДНК FB66a, и они имели удлиненную на 8 п.н. и 12 п.н., соответственно, 5'-последовательность в нетранслируемой области. Последовательности FB66a были удлинены последовательностью 5'-CCCAGGGCGCCA. Дополнительный 5'-конец FB66a является очень богатым GC, что может способствовать трудностям в выделении полноразмерных кДНК.
Пример 9
Экспрессия и характеристика PDE8A
Рекомбинантная PDE8A, описанная в примере 5, существовала в виде как низкоаффинной формы, так и высокоаффинной формы в дрожжевом экстракте. Ввиду возможности того, что низкоаффинная форма представляет собой частично неактивный фермент, экспрессию PDE8A проводили в клетках sf9 и COS в попытке либо получить гомогенный фермент, либо определить, всегда ли эти две кинетические формы экспрессируются из этой кДНК.
Экспрессионную конструкцию PDE8 sf9 генерировали с 3'-фрагментом KpnI/SalI из плазмиды W485.1 (описанной в примере 5) и 5'-фрагментом, генерированным посредством ПЦР, следующим образом. Праймеры FLAG-1 (SEQ ID NO: 48) и W48A4 (SEQ ID NO: 12) использовали в ПЦР с ДНК PDE8 COS-1 (описанной ниже) в качестве матрицы.
ПЦР проводили, как описано в примере 8, за исключением того, что вместо MgCl2 использовали 2 мМ MgSO4 и использовали 0,02 Е полимеразы Taq. После четырех минут исходной инкубации при 94°С проводили 30 циклов с одной минутой при 94°С, одной минутой при 50°С и двумя минутами при 72°С. Продукт амплификации расщепляли BamHI и KpnI, очищали на геле и лигировали с 3'-фрагментом в вектор pFASTBAC (Gibco BRL, Gaithersburg, MD), предварительно расщепленный BamHI и SalI. Полученная плазмида была обозначена pFBRPDE8. Все продукты амплификации и все новые сочленения подтверждали секвенированием.
Рекомбинантные вирусные штаммы получали с применением системы FastBac (Gibco BRL) в соответствии с предлагаемым изготовителем протоколом и экспрессию белка проводили следующим образом. Клетки sf9 выращивали при 27°С в среде ССМ3 (Hyclone, Logan, UT), содержащей 50 Е/мл пенициллина и 50 мкг/мл сульфата стрептомицина (Gibco). Экспоненциально растущие клетки инфицировали при множественности заражения приблизительно два вируса на клетку и инкубировали в течение 48 часов. Клетки собирали центрифугированием, промывали средой CMF-PBS (2,7 мМ KCl, 1,5 мМ КН2PO4, 137 мМ NaCl, 8,1 мМ Na2PO4) и осадки замораживали и хранили при -80°С до использования. Клетки лизировали в буфере (50 мМ MOPS, рН 7,2, 10 мкМ сульфат цинка, 1 мМ ДТТ, 2 мМ бензамидин, 10 мкг/мл каждого из пепстатина, лейпептина и апротинина и 20 мкг/мл каждого из ингибиторов калпаина I и калпаина II) с применением вортекса в присутствии равного объема стеклянных бусин (промытых кислотой, с диаметром 0,4 мм, Sigma) и активность PDE определяли, как описано в примере 5.
В экстракте sf9 активность PDE 45,4 нмоль/мин/мг обнаружили для гидролиза цАМФ (100 мкМ субстрат) и активность PDE 69,4 нмоль/мин/мг для гидролиза цГМФ (100 мкМ субстрат). Фоновая активность PDE была незначительной. Активность PDE8A, по-видимому, является смесью высокоаффинной и низкоаффинной форм, детектированных (обнаруженных) в дрожжевых экстрактах, как описано в примере 5.
Для экспрессии в клетках COS, PDE8 COS-1 генерировали объединением 3'-фрагмента KpnI/SalI из плазмиды W485.1 (пример 5) и фрагмента NheI/KpnI, полученного расщеплением продукта амплификации при помощи ПЦР из реакции, включающей в себя кДНК FB66a в качестве матрицы, с праймерами W 48A2 (SEQ ID NO: 10) и ATG (SEQ ID NO: 35). Условия для ПЦР включали в себя исходную инкубацию в течение четырех минут при 94°С с последующими 30 циклами с одной минутой при 94°С, одной минутой при 50°С и двумя минутами при 72°С в термоциклере ДНК Perkin Elmer Cetus. Полученные 5'-фрагмент и 3'-фрагмент, описанные выше, лигировали в вектор pC1neo (Promega, Madison, WI), который был предварительно расщеплен NheI и SalI.
Полуконфлюэнтные клетки COS, растущие в чашках с диаметром 15 см, промывали один раз 25 мл DMEM (модифицированной по способу Дульбекко средой Игла, 100 Е/мл пенициллина и 100 мкг/мл сульфата стрептомицина, Gibco), после чего на чашку добавляли 14 мл смеси DMEM/ДЭАЭ-декстран/хлорохин. Смесь DMEM/ДЭАЭ-декстран/хлорохин состоит из 75 мл DMEM и 30 мкл 0,25 М хлорохина в ЗФР (2,7 мМ KCl, 1,5 мМ КН2PO4, 137 мМ NaCl, 8,1 мМ Na2 PO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2), вместе с 0,75 мл 50 мкг/мл ДЭАЭ-декстрана (Pharmacia, Uppsala, Sweden). Двадцать мкг плазмидной ДНК в 135 мкл буфера Трис-ЭДТА (ТЭ) добавляли на чашку и чашки инкубировали в течение двух часов при 37°С в 5% CO2. Среду удаляли и 12 мл смеси 10% ДМСО/ЗФР добавляли на одну минуту и удаляли. Клетки промывали один раз 25 мл DMEM, после чего добавляли еще 25 мл DMEM, содержащей 10% фетальную телячью сыворотку (Hyclone, Logan, UT), и клетки инкубировали в течение ночи при 37°С в 5% СО2. Среду удаляли и монослой промывали 25 мл CMF-PBS (ЗФР). Добавляли шесть мл раствора, содержащего 0,05% трипсин/0,5 мМ ЭДТА (Gibco) и клетки инкубировали пять минут при 37°С. Клетки удаляли из чашек растиранием и переносили в конические центрифужные пробирки. Чашки промывали шестью мл полной DMEM для сбора всех оставшихся клеток и промывной раствор добавляли в центрифужные пробирки. Клетки осаждали центрифугированием в течение пяти минут при приблизительно 340 × g, ресуспендировали в пяти мл полной DMEM, удаляли на чашку для культуры ткани 15 мм, содержащую 20 мл полной DMEM, и инкубировали в течение ночи в 5% CO2.
Монослой промывали два раза CMF-PBS(ЗФР), инкубировали пять минут при 37°С в версене (0,5 мМ Na2-ЭДТА. 2Н2 О, 137 мМ NaCl, 2,68 мМ KCl, 8,1 мМ Na2PO4, 1,1 мМ глюкоза, рН 7,4) и собирали, как описано выше. Осажденные клетки промывали CMF-PBS (ЗФР), замораживали в сухом льду и хранили при -80°С до использования. Клетки лизировали в буфере (50 мМ MOPS, рН 7,2, 10 мкМ сульфат цинка, 1 мМ ДТТ, 2 мМ бензамидин, 10 мкг/мл каждого из пепстатина, лейпептина и апротинина и 20 мкг/мл каждого из ингибиторов калпаина I и калпаина II) пропусканием через Французский электролизер, работающий под давлением (SLM Instruments), при 20000 psi (137895,14 Па) и активность PDE определяли, как описано в примере 5.
Экспрессия PDE8A была низкой в экстракте клеток COS и не могла быть точно охарактеризована вследствие высокого уровня фоновой активности от эндогенных PDE. Для более полной характеристики продукта экспрессии клеток COS фермент, включающий в себя маркер FLAG при аминоконце (пример 5), очищали из супернатанта 100000 × g клеточного экстракта с применением аффинной колонки с антителами М2 против FLAG (Sigma), в соответствии с предлагаемым изготовителем протоколом. Для более точной характеристики активности дрожжевой PDE8A экспрессию рекомбинантного белка, который укорочен при аминоконце, но сохраняет каталитический район, проводили, как описано в примере 5, в попытке получения гомогенного белка.
Пример 10
Получение антител против PDE8A
Слитый с GST белок получали в Е. coil для обеспечения антигена для генерирования моноклональных антител к PDE8A. EcoRI-фрагмент из FB70a (кДНК PDE8A, которая включает в себя нуклеотиды 182-1330 FB85c-2 и которая была одним из девяти клонов, исходно идентифицированных, которые гибридизовались с полноразмерным зондом WO4835, описанным в примере 2) встраивали в сайт EcoRI pGEX5X1 (Pharmacia) и полученную конструкцию трансформировали в штамм Е.coil XLI Синий. Слитый белок GST-PDE8A, включающий в себя 382 аминокислоты из PDE8A, получали из этой конструкции после индукции при помощи IPTG. Слитый белок выделяли при помощи электрофореза в ДСН-ПААГ, полосу подходящего размера вырезали из геля после окрашивания холодным 0,4 М KCl и белок получали из акриламида электроэлюцией. Элюированный продукт диализовали против ЗФР и концентрировали с применением колонок Centriprep и Centricon (Amicon, Beverly МА) перед инъецированием в мышей.
В день 0 у четырех мышей Balb/c брали предварительно кровь и инъецировали их подкожно панелью антигенов, в том числе 30 мкг/мышь слитого белка GST-PDE8, в полном адъюванте Фрейнда в 200 мкл общего объема. Те же самые инъекции повторяли при неделе три и девять в неполном адъюванте Фрейнда. Через 10 дней после последней иммунизации получали тест-кровопускания и подвергали их скринингу посредством улавливания антигена по способу ELISA и при помощи Вестерн-анализа.
В твердофазном иммуноферментом анализе ELISA планшеты с Иммулоном 4 (Dynex, Cambridge, Massachusetts) покрывали при 4°С 50 мкл/лунку раствора, содержащего 2 мкг/мл GST-PDE8 в 50 мМ карбонатном буфере, рН 9,6. Планшеты блокировали 0,5% желатином рыбьей кожи (Sigma) в течение 30 минут и добавляли 50 мкл сыворотки, разведенной в ЗФР с 0,5% Твином 20 (ЗФР-Т). Разведения сыворотки были в диапазоне от 1:100 до 1:102400 и их получали серией удваивающихся разведений. После инкубирования при 37°С в течение 30 минут и промывки три раза ЗФР-Т добавляли 50 мкл конъюгированного с пероксидазой хрена антимышиного IgG(fc)-антитела (Jackson) (разведенного 1:10000 в ЗФР-Т). Планшеты инкубировали, как описано выше, и промывали четыре раза ЗФР-Т. Антитело детектировали добавлением тетраметилбензидина ((Sigma Chemical, St. Louis, Missouri) и цветную реакцию останавливали после пяти минут добавлением 50 мкл 15% H2SO4. Поглощение при 450 нм измеряли на планшет-ридере.
Для Вестерн-анализа проводили электрофорез на гелях ДСН-ПААГ с приблизительно 10 мкг дрожжевого PDE8-экстракта и приблизительно 200 нг гель-очищенного GST-PDE8 и белки переносили на Иммунобилон-ПВДФ. Стандартный протокол Вестерн-блоттинга с повышенной хемилюминесценцией (ECL) проводили с использованием конъюгата козьего антимышиного IgG с пероксидазой хрена в качестве вторичного антитела.
При получении гибридом спленоциты из мышей, дающие позитивный ответ из протоколов ELISA и/или протоколов Вестерн-блоттинга, описанных выше, сливали с клетками NS-1 в соотношении 5:1 при помощи стандартных способов с применением полиэтиленгликоля 1500 (Boehringer Mannheim) (Harlow and Lane, Antibodies, a Laboratory Manual, Cold Spring Harbor Laboratory, 1988). Слитые клетки повторно суспендировали в 200 мл RPMI, содержащей 15% FBS, 100 мМ гипоксантин натрия, 0,4 мМ аминоптерин, 16 мМ тимидин (HAT) (Gibco), 25 единиц/мл ИЛ-6 (Boehringer Mannheim) и 1,5 × 106 тимоцитов/мл, и разливали в десять 96-луночных планшетов с плоским дном лунок для культуры ткани (Corning, United Kingdom) при 200 мкл/лунку. Клетки кормили в дни 2, 4 и 6 после слияния оттягиванием приблизительно 100 мкл из каждой лунки иглой 18 G (Beckton Dickinson) и добавлением 100 мкл/лунку среды для планшетов, описанной выше, но содержащей 10 единиц/мл ИЛ-6 и не содержащей тимоцитов. В дни 9-12 супернатанты из лунок со слитым белком подвергали скринингу при помощи улавливания антигена ELISA с применением GST и GST-PDE8 и Вестерн-анализа с ECL, как описано выше.
Позитивный сигнал ожидаемого размера получали на обеих дорожках Вестерн-блота с применением мышиной крови, и моноклональное антитело с очень слабой реактивностью в отношении дрожжевого рекомбинантного белка получали в последующем слиянии. Всю процедуру повторяют с применением 50 мкг антигена на мышь для получения более высокореактивных моноклональных антител.
Пример 11
Анализ экспрессии PDE8A при помощи гибридизации in situ
Экспрессию PDE8A исследовали в срезах ткани при помощи гибридизации in situ, как описано ниже.
Приготовление зонда
Фрагмент рестриктаз (эндонуклеазы рестрикции) XhoI/EcoRI из кДНК FB70a (соответствующий нуклеотидам 571-1226 SEQ ID NO: 1) субклонировали в вектор pBluescript (Stratagene, La Jolla, CA) для генерирования экспрессирующей плазмиды, обозначенной PDE8XR2A. Эту плазмиду расщепляли XhoI и транскрибировали (см. ниже) полимеразой Т3 для получения антисмыслового зонда. Смысловой зонд генерировали расщеплением PDE8XR2A EcoRI и транскрибированием полимеразой Т7. PDE8A-матрицы транскрибировали с применением набора для транскрипции РНК (Stratagene, La Jolla, CA) в реакции, содержащей 5 мкл 5Х транскрипционного буфера (Stratagene), 30 мМ ДТТ (Stratagene), 0,8 мМ каждого из АТФ, ЦТФ, ГТФ (10 мМ (Stratagene), 40 Е РНКазы BlockII (Stratagene), 12,5 Е полимеразы Т3 или Т7 (Stratagene) и 300 нг линеаризованной плазмидной матрицы, 50 мкКи35S-УТФ (более 1000 Ки/ммоль, Amersham, Arlington Heights, IL). Смесь инкубировали при 37°С в течение одного часа, после чего матричную ДНК удаляли добавлением 1 мкл ДНКазы I, не содержащей РНКазы (Stratagene), и инкубированием в течение 15 минут при 37°С. Зонд гидролизовали добавлением 4 мкл 1 М NaHSO3 и 6 мкл 1 М Na2СО3 в течение 22 минут при 60°С и реакционную смесь нейтрализовали добавлением 25 мкл раствора, содержащего 100 мкл 3 М ацетата натрия, 5 мкл уксусной кислоты (VWR, So. Plainfield, NJ), и 395 мкл dH2O. Колонку РНК Quick Spin G50 (5'→3' Inc., Boulder, CO) готовили в соответствии с предлагаемым изготовителем протоколом. Зонд помещали в центре этой колонки и колонку центрифугировали в течение четырех минут при 1000 об/мин на настольной центрифуге. Проходящий через колонку объем смешивали с 50 мкл dH2O, 2 мкл 10 мг/мл раствора тРНК, 10 мкл 3 М ацетата натрия и 200 мкл 100% этанола (VWR) и полученную смесь инкубировали при -20°С в течение ночи. Раствор зонда микрофугировали в течение 15 минут при 4°С, супернатант удаляли и осадок ресуспендировали в 40 мкл 1X ТБЭ, содержащем 1 мкл 0,1 М ДТТ. Зонд хранили при -70°С до проведения анализа гибридизации in situ.
Приготовление проб тканей и гибридизация in situ
Готовили срезы тканей (National Disease Research Interchange, Philadelphia, PA and Cooperative Human Tissue Network, Philadelphia, PA) при 6 мкм и помещали на предметные стекла Superfrost Plus (VWR). Срезы фиксировали в течение 20 минут при 4°С в 4% параформальдегиде (Sigma, St. Louis, МО). Предметные стекла промывали в трех сменах 1X CMF-PBS (ЗФР), дегидратировали тремя последовательными промывками 70% этанолом, 95% этанолом и 100% этанолом и сушили в течение 30 минут при комнатной температуре. Препараты помещали в 70% формамид (J.T.Baker) в 2Х SSC на две минуты при 70°С, промывали в 2Х SSC при 4°С, дегидратировали промывками 70%, 95% и 100% этанолом и сушили в течение 30 минут при комнатной температуре.
Стадию предгибридизации проводили помещением препаратов в воздухонепроницаемый бокс, содержащий кусок фильтровальной бумаги, насыщенный буфером для бокса, содержащим 50% формамид (J.T.Baker) в 4Х SSC. Каждый срез покрывали 100 мкл буфера rНВ2, состоящего из 10% сульфата декстрана (Sigma), 50% формамида (J.T.Baker, Phillpsburg, NJ), 100 мМ ДТТ (Boehringer Mannheim, Indianapolis, IN), 0,3 M NaCl (Sigma), 20 мМ Триса, рН 7,5, 5 мМ ЭДТА (Sigma) и 1X раствора Денхардта (Sigma), и препараты инкубировали при 42°С в течение 1 часа. Зонд, описанный выше, готовили смешиванием 4×105 имп/мин/срез ткани с 5 мкл 10 мг/мл раствора тРНК на срез и нагреванием этой смеси при 95°С в течение трех минут. Охлажденный на льду буфер rНВ2 добавляли для доведения конечного объема до 20 мкл/срез. Содержащий зонд раствор (20 мкл/срез) добавляли к 100 мкл ранее нанесенного буфера rНВ2. Препараты инкубировали при 55°С в течение 12-16 часов. После гибридизации препараты промывали один раз в 4Х SSC, содержащем 10 мМ ДТТ, в течение одного часа при комнатной температуре, один раз в 50% деионизованном формамиде (J.T.Baker), 1X SSC и 1 мМ ДТТ в течение 40 минут при 60°С, один раз в 2Х SSC в течение 30 минут при комнатной температуре; и один раз в 0,1X SSC в течение 30 минут при комнатной температуре. Срезы дегидратировали промывками 70%, 95% и 100% этанолом и сушили на воздухе в течение 30 минут. Препараты погружали в ядерную фотоэмульсию Kodak NTB2, сушили в течение одного-трех часов при комнатной температуре в темноте и хранили в темноте при 4°С с дессикантом до времени проявления. Препараты проявляли в проявителе 4°С Kodak Dektol в течение четырех минут, погружали четыре раза в dH2O (4°С) и помещали в фиксирующий раствор 4°С Kodak на четыре минуты. Препараты промывали в dH2O и выполняли стандартное окрашивание Н&Е следующим образом.
Препараты промывали в dH2O и окрашивали гематоксилином и эозином проведением препаратов через ряд следующих стадий: пять минут в смеси формальдегид/спирт (100 мл формальдегида, 900 мл 80% этанола); три промывки в воде в течение в целом двух минут; пять минут в 0,75% гематоксилине Harris (Sigma); три промывки в воде в течение в целом двух минут; одно погружение в раствор 1% HCl/50% этанол; одну промывку в воде; четыре погружения в 1% карбонат лития; десять минут в водопроводной воде; две минуты в 0,5% эозине (Sigma); три промывки в воде в течение в целом двух минут; две минуты в 70% этаноле; три одноминутных промывки в 95% этаноле; две одноминутных промывки в 100% этаноле и две двухминутных промывки в ксилоле. Препараты покрывали цитогерметиком (cytoseal 60, Stephens Scientific, Riverdale, NJ).
Сигналы, полученные с антисмысловым зондом PDE8A, сравнивали с контрольными сигналами, генерируемыми смысловым зондом PDE8A, и предполагалось, что любой сигнал, специфический для антисмыслового зонда, представляет экспрессию PDE8A. Сигнал PDE8A обнаруживали на большой части мозжечка, в субпопуляции клеток в семенных канальцах яичек, на рассеянных клетках пока еще не определенного происхождения в скелетной мышце, в зернистых клетках и яичниковой строме в яичнике, в эпителиальных клетках в петле Генле в почке и на гладкой мышце некоторых артериол в сердце.
Эти результаты отличаются от полученных Нозерн-блоттингом и описанных в примере 6 тем, что в сердце Нозерн-блоттингом детектировали умеренный сигнал, тогда как результаты in situ с использованием этой пробы сердца дали слабый сигнал. Это несоответствие могло бы отражать различия в тканях из различных индивидуумов или уровень обнаруживаемых различий, присущий этим двум способам. Сигнал в яичнике и сигнал в почке может указывать на то, что PDE8A участвует в овуляции или в солевом и/или водном гомеостазе, соответственно.
Многочисленные модификации и вариации в данном изобретении, представленном в приведенных выше иллюстративных примерах, могут, как ожидается, встретиться специалистам в этой области. Поэтому только такие ограничения, которые вытекают из прилагаемой формулы изобретения, должны быть поставлены для данного изобретения.





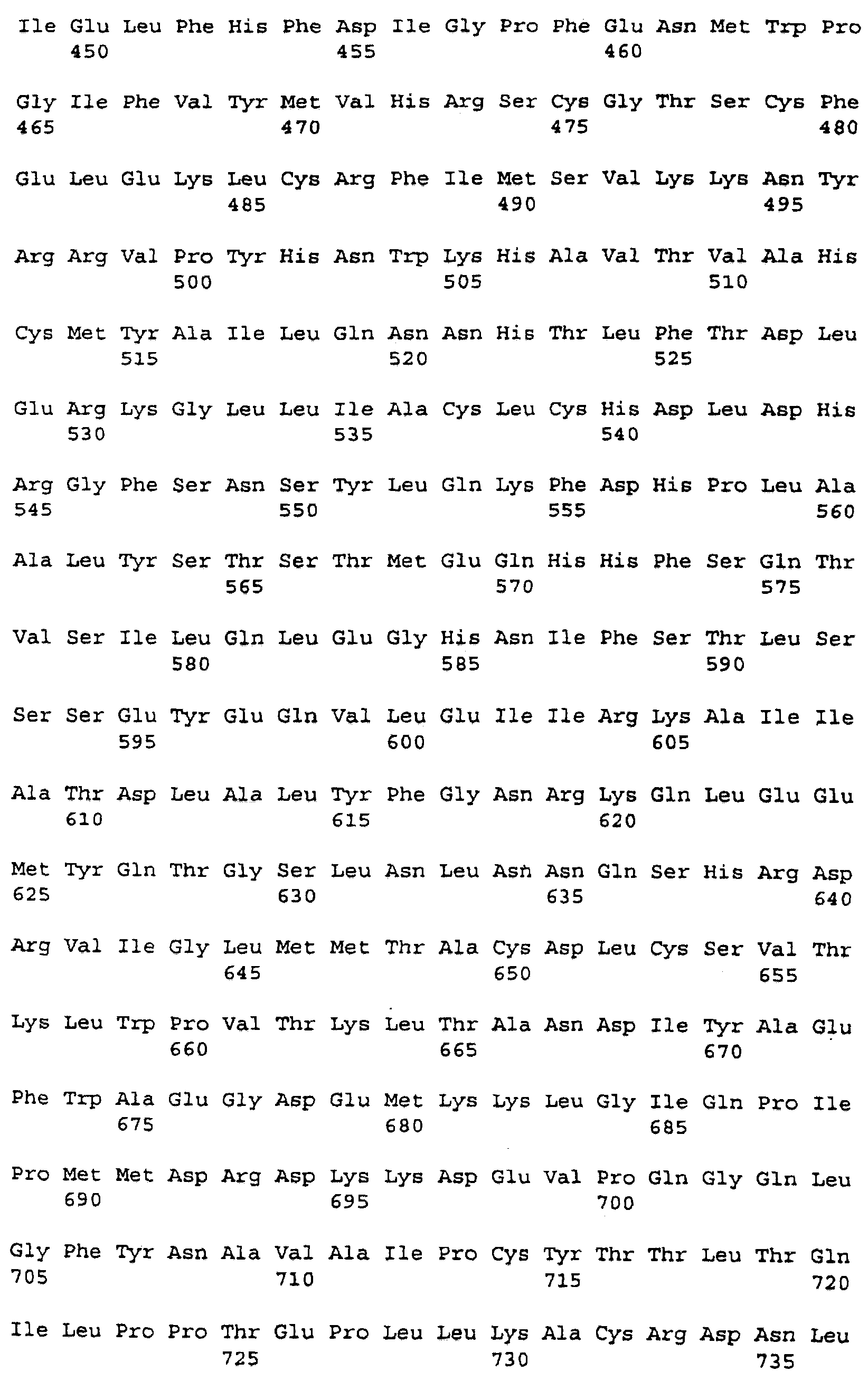







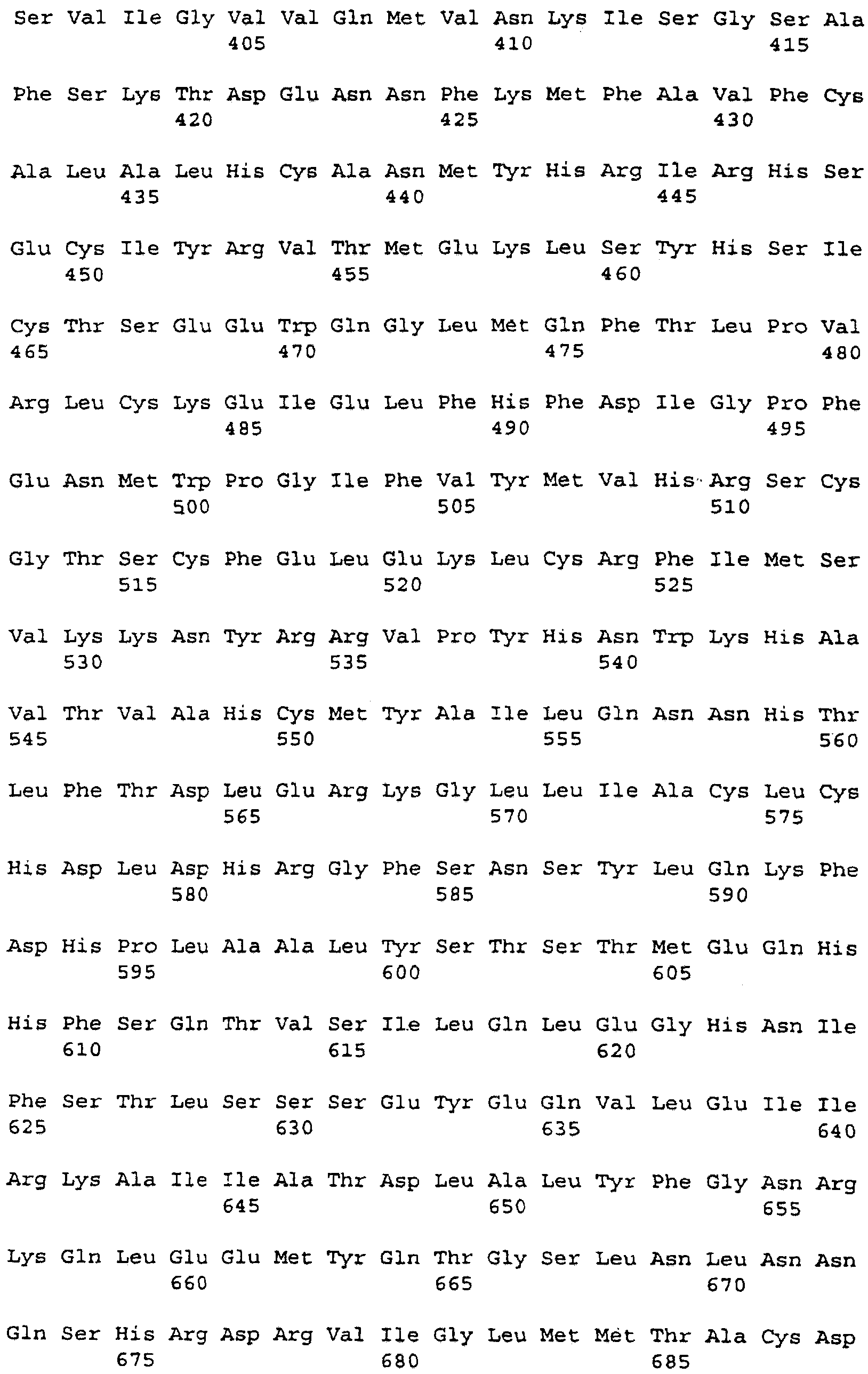
















Реферат
Изобретение относится к области генной инженерии и биотехнологии и может быть использовано в медицине. Представлены полипептид нового семейства фосфодиэстераз и кодирующий его полинуклеотид. Разработаны способы выявления партнеров специфического связывания указанных полипептида и полинуклеотида, включающие стадии их контактирования с соединением, обнаружения связывания и выявления соединения как партнера специфического связывания. Сконструирована экспрессионная конструкция, которая используется в способе получения полипептида нового семейства фосфодиэстераз для получения клетки-продуцента. К полипептиду получены моноклональные и поликлональные антитела. Описан антисмысловой полинуклеотид для регулирования экспрессии полипептида нового семейства фосфодиэстераз. Применение изобретения обеспечит дополнительные фармакологические подходы к лечению состояний, связанных с нарушением путей циклических нуклеотидов. 13 н. и 14 з.п. ф-лы, 3 табл.

Комментарии