Способ получения чистых фосфатидов и их применение в области косметики, фармацевтики и питания - RU2289625C2
Код документа: RU2289625C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения чистых фосфатидов исходя из смесей природных фосфатидов или их отдельных компонентов, таких как соевый или яичный лецитин, или животные фосфолипиды, или синтетических фосфатидов, посредством их реакции с фосфолипазой D, обладающей трансфосфатидилазной активностью, в одной водной фазе в присутствии определенных субстратов, содержащих первичную или вторичную спиртовую группу.
Изобретение также относится к получению, очистке и определению характеристик фосфолипазы D, используемой в способе.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Синтез чистых фосфолипидов, особенно в промышленном масштабе, является очень широко распространенной проблемой. Действительно, имеются многочисленные научные публикации и патенты, включая ряд совсем недавних, в которых описаны различные методологии. Обычно в упомянутых способах используют трансфосфатидилазные свойства фосфолипазы D для получения оптически активных фосфатидов. Одной из основных проблем является то, что каждый из этих способов пригоден только для получения одного специфического фосфатида и не может быть адаптирован для синтеза всего класса соединений. В целом, наиболее широко исследованным фосфолипидом является фосфатидилсерин (ФС), поскольку он широко используется для получения фармацевтических композиций для приготовления рецептур, содержащих липосомы, и пищевых добавок. Относительно мало или ничего не опубликовано относительно синтеза сфингофосфолипидов.
Одно из ограничений всех способов, описанных в научной и патентной литературе, обусловлено тем, что реакция трансфосфатидилирования идет в двухфазных системах, состоящих из воды и органического растворителя. Это создает ряд технических проблем, связанных с использованием больших количеств растворителя, особенно если промышленный способ имеет химическую природу, и его целью является получение высококачественного продукта. В заявке на патент DE 19917249 А1 описан способ, в котором фактически используется одна водная фаза, но не указаны ни выход, ни степень чистоты полученного ФС, ни тип использованного фермента. Кроме того, нет сведений о том, можно ли с использованием той же методики и тех же субстратов получить другие фосфолипиды, кроме ФС, и могут ли в описанных условиях другие фосфолипиды выполнять роль субстратов реакции. В Японской Патентной Публикации №5/42917 (JP 2130088) также описан способ, в котором используется среда, состоящая только из воды или из смеси воды и органического растворителя. Однако в этом патенте сделан вывод, что для предотвращения побочных реакций предпочтительно содержание воды, равное 10% или менее. Таким образом, данная работа позволяет предположить, что использование одной водной среды неблагоприятно. Фактически в примерах, содержащихся в ней, описаны только способы, в которых использована двухфазная смесь воды и этилового эфира.
Общий характер приведенной информации и отсутствие в упомянутых работах предшествующего уровня техники сведений о применимости реакции трансфосфатидилирования с фосфолипазой D в одной водной фазе не позволяли специалистам в данной области техники считать, что это могло бы быть решением проблемы. Кроме того, о важности удаления загрязнений, возникающих из-за использования органических растворителей в способах производства продуктов, используемых в области питания и фармацевтики, стало известно лишь в последние годы после ограничений, установленных Фармакопеей Соединенных Штатов Америки (USP) и директивами Европейского Сообщества (СРМР/СН/283/95).
Другой критический вопрос, который не был глубоко исследован ни в научной литературе, ни на больных, касается перекисного окисления продуктов, образующихся при использовании гетерогенных фаз «вода/растворитель» в эмульсии в ходе реакции трансфосфатидилирования, используемых условий реакции и последующей необходимости осуществлять многочисленные стадии способа (повторное осаждение, промывки и, возможно, также хроматографию) для получения продуктов с высоким уровнем чистоты. Многие растворители, используемые для этих реакций, в гетерогенной фазе не гарантируют отсутствия свободнорадикальных предшественников (промежуточных продуктов), типичных для инициации реакции перекисного окисления. Кроме того, встряхивание/перемешивание, необходимые для осуществления реакции в гетерогенной фазе, повышают вероятность контакта с атмосферным кислородом и последующего запуска окислительных явлений. Это перекисное окисление действует наподобие цепной реакции, когда даже незначительные начальные первичные стадии могут с течением времени дать огромные результаты, несмотря на то что запускающие условия были устранены или минимизированы. Перекисное окисление «жировых» веществ, таких как триглицериды (масла или жиры), а также фосфолипидов, приводит к тому, что жирные кислоты «прогоркают» с последующим образованием неприятного запаха и вкуса. Особенно важно то, что продукты должны иметь высокий уровень аппетитности (запах и вкус), если они, особенно ФС, используются для приготовления пищевых добавок (нутрицевтиков, биологически активных добавок) с особыми рецептурами, например - гранул или так называемых «функциональных пищевых продуктов», к которым добавляется продукт для обогащения их состава. Поэтому важно, чтобы полученные продукты, особенно ФС, могли быть четко охарактеризованы химическими терминами как в отношении химического состава жирных кислот, так и по степени перекисного окисления и обусловленной этим аппетитности.
Наконец, следует отметить, что препараты фермента фосфолипазы D, имеющиеся на рынке, обычно проявляют трансфосфатидилазную активность в отношении фосфатидилхолиновой фракции фосфолипидной смеси. В результате этого другие компоненты, такие как фосфатидилэтаноламин (ФЭ), подвергаются гидролизу до фосфатидной кислоты, за счет чего снижаются как выход, так и степень чистоты конечного продукта.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения неожиданно было обнаружено, что при использовании очищенной фракции фосфолипазы D, выделенной из Streptoverticillium hachijoense, можно провести реакцию трансфосфатидилирования с различными спиртовыми рецепторами, начиная от смеси природных фосфатидов или их очищенных фракций, в 100% водной среде с высоким выходом продукта и перекисным числом (уровнем перекисного окисления) менее 5 мЭкв О2/кг, установленным в Европейской Фармакопее - Дополнение 2000, страница 41 (способ А), посредством одной стадии реакции и одного осаждения.
Реакцию трансфосфатидилирования можно проводить при различных условиях в отношении температуры и концентрации субстрата, устанавливая первую в диапазоне от 20 до 60°С, предпочтительно 45°С, а вторую - в диапазоне от 10 до 500 мг/мл, предпочтительно - 150 мг/мл, в зависимости от степени дисперсности субстратов.
Второй аспект настоящего изобретения состоит в том, что этот конкретный ферментативный препарат обладает трансфосфатидилазной активностью с высокими выходами продукта даже при использовании субстратов, отличающихся от фосфатидилхолина (лецитина), что позволяет использовать этот способ и для недорогих, неочищенных сырьевых материалов.
Значение штамма, использованного для получения Фосфолипазы D и ее фракционирования, можно понять из следующей таблицы, в которой проведено сравнение очищенной фракции фермента, полученной согласно Примеру 1, с различными имеющимися в продаже ферментативными препаратами.
Получение фосфатидилсерина
(чистый лецитин с содержанием фосфатидилхолина, равным 95%, в качестве субстрата; условия реакции, как в Примере 1).
Другим преимуществом данного ферментативного препарата и условий реакции, описанных в настоящем изобретении, является практически полное превращение субстрата в ФС по сравнению со степенью преобразования, не превышающей 70%, достигнутой в двухфазной системе вода/органический растворитель, описанной в JP 213008.
Третий аспект настоящего изобретения касается получения фармацевтических и косметических композиций и пищевых и диетических добавок на основе фосфолипидов, полученных в соответствии с вышеописанным способом и имеющих степень перекисного окисления менее 5 мЭкв O2/кг и высокий уровень аппетитности, для того чтобы сделать их более предпочтительными по сравнению с другими сходными продуктами, имеющимися на рынке, но не имеющими указанных характеристик.
Фармацевтические композиции и пищевые и диетические добавки особенно показаны к применению при лечении состояний психофизического стресса с нарушениями внимания, концентрации и памяти, часто связанных со старением, и они могут быть изготовлены, например, в форме капсул, таблеток и гранул.
Косметические композиции прежде всего можно использовать при лечении нарушений физиологических функций кожи и в качестве вспомогательных средств при лечении дерматита экзематозного и/или воспалительного типа, и их можно изготовить, например, в форме кремов или гелей.
С чисто иллюстративными целями ниже приводятся несколько примеров получения Фосфолипазы D и фосфолипидов, полученных с ее помощью согласно настоящему изобретению.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1: Получение Фосфолипазы D
Использован штамм Streptoverticillium hachijoense ATCC 19769.
Приготовление инокулята для использования в испытании с ферментацией начинается с колонии на твердой среде в чашке Петри. Состав твердой среды является следующим: 21,0 г/литр дрожжевого экстракта, 2% агара. Бактерии, взятые из чашек Петри, используют для запуска системы «масштабирования» в колбах Эрленмейера следующим образом:
- бактерии берут с твердой среды стерильной платиновой петлей и инокулируют в колбу объемом 100 мл, содержащую 20 мл среды следующего состава: 21,0 г/л дрожжевого бульона;
- колбу помещают в инкубатор-шейкер с установками на 30°С, 150 об/мин на 48 часов;
- 20 мл культуры переносят в колбу на 5,0 литров, содержащую 2,5 л среды описанного выше состава;
- колбу помещают в инкубатор-шейкер с установками на 30°С, 150 об/мин на 72 часа.
После этого культура готова для инокуляции в биореактор. Эта операция возможна благодаря тому, что культура находится в колбе, снабженной системой, состоящей из силиконовой трубки и иглы. Используемый биореактор имеет емкость, равную 50 литрам (Braun Biostat U). Состав среды следующий: дрожжевой бульон - 21,0 г/л, рН 6,5 (среда стерилизуется прямо в биореакторе при добавлении антивспенивающего средства); параметры ферментации: взбалтывание - 200 об/мин, температура 30°С, поток воздуха 0,5 vvm.
Через 72 часа ферментацию прерывают. Максимальное полученное количество фермента равно 5000 Ед/л, а ферментативную активность определяют по модифицированному способу Kato et al., описанному в литературе (К.Shimbo et al., Agric. Biol. Chem. 54(5), 1189-93, 1990).
Культуральный бульон фильтруют с целью удаления биомассы, супернатант концентрируют с помощью спирального картриджа в ацетате целлюлозы с уровнем отсечки по молекулярной массе, соответствующим 10000 Д, и диализируют против Трис-HCl-буфера в концентрации 50 мМ, рН 8,0. Полученную таким образом пробу загружают в хроматографическую колонку (внутренний диаметр = 10 см, h=50 см), наполненную 500 г анионообменной смолы Watman DE-52, предварительно уравновешенной тем же буфером, который был использован для диализа. Фермент не адсорбируется и элюируется из колонки, его диализируют против Na-фосфатного буфера с рН 5,4, а затем загружают в хроматографическую колонку (внутренний диаметр = 10 см, h=50 см), наполненную 50 г катионобменной смолы CM-Sephadex Pharmacia C-50, предварительно сбалансированной с тем же буфером, что и фермент. Фермент элюируют в градиенте рН от 5,5 до 7,0 с использованием Na-фосфатного буфера (20 мМ, рН 7,0). Фракцию, которая элюируется при рН 6,2, собирают, концентрируют и диализируют против Трис-HCl буфера (50 мМ, рН 8,0) до концентрации 100 Ед/мл, а затем лиофилизируют.
Пример 2: Получение ФС (фосфатидил-L-серина) из ФХ (фосфатидилхолина)
В реакторе с рубашкой, оборудованном встряхивателем и дефлегматором, 272 г ацетата натрия тригидрата и 59 г гидрохлорида натрия тригидрата растворяют в 10 литрах воды. рН доводят до 5,6 (ацетатный буфер, 0,2 М + хлорид кальция, 0,04 М, рН 5,6), добавляют 5,0 кг L-серина и солюбилизируют посредством нагревания до 45°С. Весь процесс проводят в атмосфере азота.
После завершения солюбилизации добавляют 1,5 кг очищенного соевого лецитина следующего состава: ФХ (фосфатидилхолина) 95%, ФК (фосфатидной кислоты) 4%, лизо-ФХ (лизофосфатидилхолина) 1%. Через десять минут добавляют 16100 Ед фосфолипазы D из Примера 1 и эту смесь оставляют для протекания реакции на 24 часа при 45° С.
После завершения реакции реактор разгружают посредством добавления 10 литров смеси п-гексана/изопропанола/воды (60/80/15); массу растворяют посредством встряхивания, затем встряхивание прекращают и оставляют реакционную смесь для разделения фаз.
Нижнюю фазу собирают и выделяют непрореагировавший L-серин посредством охлаждения в кристаллизаторе.
Верхнюю фазу промывают 6950 мл 1N HCl и 1113 мл изопропанола при 5°С. Кислую фазу повторно экстрагируют 10 литрами смеси гексана/изопропанола/воды (60/80/15), после чего две органические фазы в каскадной установке промывают смесью 7 литров воды и 6 литров изопропанола.
Органические фазы концентрируют под вакуумом и осаждают посредством медленного добавления смеси 450 мл 4,5 М водного раствора ацетата натрия и 33,2 литров этанола.
Осадок фильтруют и высушивают.
Получают 1,14 кг фосфатидилсерина с титром более 95%, содержанием фосфатидной кислоты менее 5% и перекисным числом менее 5.
После кристаллизации и сушки выделяют 3,25 кг L-серина.
Пример 3: Получение ФС (фосфатидил-L-серина) из яичного лецитина
180 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором, после чего добавляют 90 г L-серина и солюбилизируют посредством нагревания до 45°С. Весь процесс проводят в атмосфере азота.
После завершения солюбилизации добавляют 27 г очищенного яичного лецитина (содержание ФХ≥95%); через 10 минут добавляют 290 Ед фосфолипазы D из Примера 1 и оставляют для протекания реакции на 24 часа при 45°С.
После завершения реакции реактор разгружают посредством добавления 200 мл смеси п-гексана/изопропанола/воды (60/80/15) и растворяют массу посредством встряхивания, затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси п-гексана/изопропанола/воды (60/80/15), затем две органические фазы в каскадной установке промывают смесью 100 мл воды и 130 мл изопропанола.
Органические фазы концентрируют под вакуумом и осаждают посредством медленного добавления раствора 8 мл 4,5 М ацетата натрия в воде в 600 мл этанола. Осадок фильтруют и высушивают.
Это дает 20,8 г фосфатидилсерина с титром более 95% с содержанием фосфатидной кислоты менее 5% и перекисным числом менее 5.
Пример 4: Получение фосфатидил-L-серина из неочищенного соевого лецитина
180 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором, после чего добавляют 90 г L-серина и солюбилизируют посредством нагревания до 45°С. Весь процесс проводят в атмосфере азота.
После завершения солюбилизации добавляют 27 г неочищенного соевого лецитина (общее содержание фосфолипидов 75%, процентное содержание ФХ 60,6/ФЭ 29,5/ФК 3,4/лизо-ФХ 2,5/прочих 3,9); через 10 минут добавляют 290 Ед фосфолипазы D из Примера 1 и оставляют для протекания реакции на 24 часа при 45°С.
После завершения реакции реактор разгружают посредством добавления 200 мл смеси п-гексана/изопропанола/воды (60/80/15) и растворяют массу посредством встряхивания, затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси n-гексана/изопропанола/воды (60/80/15), затем две органические фазы в каскадной установке промывают смесью 100 мл воды и 130 мл изопропанола.
Органические фазы концентрируют под вакуумом и осаждают посредством медленного добавления смеси 8 мл 4,5 М водного раствора ацетата натрия и 600 мл этанола. Осадок фильтруют и высушивают.
Это дает 19 г фосфатидилсерина с титром более 83,5% (ФК 7,7%, лизо-ФС 2,3%, ФЭ 1,9%, прочие 4,5%) и перекисным числом менее 5.
Пример 5: Получение фосфатидил-D-серина
180 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором, после чего добавляют 90 г D-серина и солюбилизируют посредством нагревания до 45°С. Весь процесс проводят в атмосфере азота.
После завершения солюбилизации добавляют 27 г очищенного соевого лецитина, как в Примере 2; через 10 минут добавляют 290 Ед фосфолипазы D из Примера 1 и оставляют для протекания реакции на 24 часа при 45°С.
После завершения реакции реактор разгружают посредством добавления 200 мл смеси n-гексана/изопропанола/воды (60/80/15) и растворяют массу посредством встряхивания, затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1 N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси n-гексана/изопропанола/воды (60/80/15), затем две органические фазы в каскадной установке промывают смесью 100 мл воды и 130 мл изопропанола.
Органические фазы концентрируют под вакуумом и осаждают посредством медленного добавления смеси 8 мл 4,5 М водного раствора ацетата натрия и 600 мл этанола. Осадок фильтруют и высушивают.
Это дает 18,7 г фосфатидил-D-серина с титром более 95%, с содержанием фосфатидной кислоты менее 5% и с перекисным числом менее 5.
Пример 6: Получение фосфатидилэтаноламина (ФЭ) из фосфатидилхолина (ФХ)
200 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором. Весь процесс проводят в атмосфере азота.
Добавляют 58 г этаноламина и доводят рН до 5,6 ледяной уксусной кислотой при заданной температуре 30°С.
В конце операции смесь нагревают до 45°С и добавляют 30 г очищенного соевого лецитина, как в Примере 2. Через 10 минут добавляют 325 Ед фосфолипазы D из Примера 1, а затем оставляют для протекания реакции на 24 часа при 45° С.
После завершения реакции реактор разгружают посредством добавления 400 мл смеси n-гексана/изопропанола/воды (60/80/15), затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси n-гексана/изопропанола/воды (60/80/15), затем две органические фазы в каскадной установке промывают смесью 100 мл воды и 130 мл изопропанола, затем - 100 мл 1N раствора ацетата натрия и 130 мл изопропанола.
Органические фазы концентрируют под вакуумом.
Их очищают посредством хроматографии на силикагеле с использованием хроматографа аксиального давления с колонкой на 1 л, уравновешенной смесью хлороформа и метанола (80/20); выполняют градиентное элюирование до соотношения хлороформа/метанола/воды, равного 70/30/3.
Чистые фракции испаряют, растворяют в 250 мл циклогексана и лиофилизируют с получением 24 г светло-желтого твердого продукта, не содержащего фосфатидной кислоты и лизопроизводных и имеющего чистоту более 99%.
Пример 7: Получение фосфатидил-гомосерина из ФХ
180 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором, после чего добавляют 102 г гомосерина и солюбилизируют посредством нагревания до 45°С. Весь процесс проводят в атмосфере азота.
После завершения солюбилизации добавляют 27 г очищенного соевого лецитина, как в Примере 2; через 10 минут добавляют 290 Ед фосфолипазы D из Примера 1 и оставляют для протекания реакции на 24 часа при 45°С.
После завершения реакции реактор разгружают посредством добавления 200 мл смеси n-гексана/изопропанола/воды (60/80/15). Массу растворяют посредством встряхивания, затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси n-гексана/изопропанола/воды (60/80/15), затем две органические фазы в каскадной установке промывают смесью 100 мл воды и 130 мл изопропанола.
Органические фазы концентрируют под вакуумом и осаждают посредством медленного добавления смеси 8 мл 4,5 М водного раствора ацетата натрия и 600 мл этанола. Осадок фильтруют и высушивают.
Получают 22,6 г фосфатидил-гомосерина с титром более 95%, с содержанием фосфатидной кислоты менее 5% и с перекисным числом менее 5.
Пример 8: Получение фосфатидил-гидроксипролина из ФХ (фосфатидилхолина)
180 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором, после чего добавляют 112 г гидроксипролина и солюбилизируют посредством нагревания до 45°С. Весь процесс проводят в атмосфере азота.
После завершения солюбилизации добавляют 27 г очищенного соевого лецитина, как в Примере 2; через 10 минут добавляют 290 Ед фосфолипазы D из Примера 1 и оставляют для протекания реакции на 24 часа при 45°С.
После завершения реакции реактор разгружают посредством добавления 200 мл смеси n-гексана/изопропанола/воды (60/80/15) и растворяют массу посредством встряхивания, затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси n-гексана/изопропанола/воды (60/80/15), затем две органические фазы в каскадной установке промывают смесью 100 мл воды и 30 мл изопропанола.
Органические фазы концентрируют под вакуумом и осаждают посредством медленного добавления смеси 8 мл 4,5 М водного раствора ацетата натрия и 600 мл этанола. Осадок фильтруют и высушивают.
Это дает 18,4 г фосфатидил-гидроксипролина с титром более 95%, с содержанием фосфатидной кислоты менее 5% и с перекисным числом менее 5.
Пример 9: Получение фосфатидилглицерина из ФХ (фосфатидилхолина)
200 мл смеси 0,2 М ацетатного буфера и 0,04 М хлорида кальция с рН 5,6 помещают в реактор с рубашкой, оборудованный встряхивателем и дефлегматором. Весь процесс проводят в атмосфере азота.
Добавляют 80 г глицерина; его нагревают до 45°С, затем добавляют 30 г очищенного соевого лецитина, как в Примере 2; через 10 минут добавляют 325 Ед фосфолипазы D из Примера 1 и оставляют для протекания реакции на 24 часа при 45°С.
После завершения реакции реактор разгружают посредством добавления 400 мл смеси n-гексана/изопропанола/воды (60/80/15), затем встряхивание прекращают и оставляют две фазы для разделения.
Нижнюю фазу отбрасывают.
Верхнюю фазу промывают 150 мл 1N HCl и 30 мл изопропанола при 5°С.
Кислую фазу повторно экстрагируют 180 мл смеси n-гексана/изопропанола/воды (60/80/15), затем две органические фазы промывают в каскадной установке смесью 100 мл воды и 130 мл изопропанола, а затем - 100 мл 1N раствора ацетата натрия и 130 мл изопропанола.
Органические фазы концентрируют под вакуумом.
Очистку производят посредством хроматографии на силикагеле с использованием хроматографа аксиального давления с колонкой на 1 л, уравновешенной смесью хлороформа и метанола (80/20). Выполняют градиентное элюирование до соотношения хлороформа/метанола/воды, равного 70/30/3.
Чистые фракции испаряют, растворяют в 250 мл циклогексана и лиофилизируют с получением 22,2 г белого твердого продукта, не содержащего фосфатидной кислоты и лизопроизводных и имеющего чистоту более 95%.
Его фильтруют и высушивают.
Пример 10: Выделение и повторное использование L-серина
Маточные воды от первого распределения ферментативной реакции, как в Примере 2, выдерживают при температуре 0°С в течение 24 часов, затем кристаллизовавшийся продукт фильтруют. Его промывают этанолом и высушивают с получением белых игольчатых кристаллов чистого продукта, идентичного исходному.
Восполняют недостающее количество (примерно 20%), после чего продукт может быть использован как нормальный.
Пример 11: Примеры фармацевтических композиций
(а) Каждая желатиновая капсула содержит:
(б) Каждая ампула для инъекций содержит:
Пример 12: Примеры пищевых и диетических добавок
(а) Каждая желатиновая капсула содержит:
(б) Каждый пакет содержит:
(в) Каждая жевательная таблетка содержит:
18 Пример 13: Примеры косметических композиций
(а) Каждый тюбик крема для тела содержит:
(б) Каждый тюбик мази для тела содержит:
Реферат
Изобретение относится к области биотехнологии. Способ основан на взаимодействии смесей природных фосфатидов или их отдельных компонентов, например соевого или яичного лецитина или животных фосфолипидов, или синтетических фосфатидов, посредством их реакции с фосфолипазой D, обладающей трансфосфатидилазной активностью, в водной среде. Способ позволяет получить чистые фосфатиды и упростить процесс выделения, а также увеличить выход фосфатидов и степень их чистоты. 11 н. и 17 з.п. ф-лы, 2 табл.
Формула
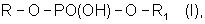

Комментарии