Новые 4-(гетероциклоалкил)бензол-1,3-диольные соединения в качестве ингибиторов тирозиназ, способ их получения и их применение в лечении человека, а также в косметических средствах - RU2482116C2
Код документа: RU2482116C2
Чертежи

Описание
Изобретение относится к новым 4-(гетероциклоалкил)бензол-1,3-диольным соединениям в качестве продуктов для промышленных и других целей. Оно также относится к способу их получения и к их применению в качестве ингибиторов тирозиназ, в фармацевтической или косметической композициях для применения в лечении или предотвращении пигментных нарушений.
Пигментация кожи, в частности пигментация кожи человека, является результатом синтеза меланина дендритными клетками, меланоцитами. Меланоциты содержат органеллы, называемые меланосомами, которые переносят меланин в верхние слои кератиноцитов, которые затем транспортируются на поверхность кожи посредством дифференцировки эпидермиса (Gilchrest BA, Park HY, Eller MS, Yaar M, Mechanisms of ultraviolet light-induced pigmentation. Photochem. Photobiol. 1996; 63:1-10; Hearing VJ, Tsukamoto K, Enzymatic control of pigmentation in mammals. FASEB J. 1991; 5:2902-2909).
Среди ферментов меланогенеза ключевым ферментом является тирозиназа, которая катализирует первые две стадии синтеза меланина. Гомозиготные мутации тирозиназы вызывают окулокутанный альбинизм типа 1, характеризующийся полным отсутствием синтеза меланина (Toyofuku K, Wada I, Spritz RA, Hearing VJ, The molecular basis of oculocutaneous albinism type 1 (OCA1): sorting failure and degradation of mutant tyrosinases results in a lack of pigmentation. Biochem. J. 2001; 355:259-269).
Для лечения нарушений пигментации, являющихся результатом увеличения продукции меланина, для которых нет лечения, которое бы удовлетворяло все ожидания пациентов и дерматологов, важно разработать новые терапевтические подходы.
Большинство из осветляющих кожу соединений, которые уже известны, являются фенолами и гидрохиноновыми производными. Эти соединения ингибируют тирозиназу, но большинство из них являются цитотоксическими для меланоцитов вследствие образования хинонов. Существует риск того, что это токсическое действие вызовет постоянную депигментацию кожи. Получение соединений, которые могут ингибировать меланогенез, в это же время являясь очень слабо цитотоксическими или не обладая токсичностью в отношении меланоцитов, является наиболее желательным.
Среди соединений, уже описанных в литературе, в патентной заявке WO 99/15148 в качестве депигментирующих средств описано применение 4-циклоалкилрезорцинолов.
В патенте FR2704428 в качестве депигментирующих средств описано применение 4-гелогенрезорцинолов.
В патентных заявках WO 2006/097224 и WO 2006/097223 в качестве депигментирующих средств описано применение 4-циклоалкилметилрезорцинолов.
В патентной заявке WO 2005/085169 в качестве депигментирующего средства описано применение алкил-3-(2,4-дигидроксифенил)пропионата.
В патентной заявке WO 2004/017936 описано применение 3-(2,4-дигидроксифенил)акриламида в качестве депигментирующего средства.
В патентной заявке WO 2004/052330 в качестве депигментирующих средств описано применение 4-[1,3]дитиан-2-илрезорцинолов.
Более конкретно, в патенте EP 0341664 в качестве депигментирующих средств описано применение 4-алкилрезорцинолов, среди которых 4-н-бутилрезорцинол, также известный как руцинол, является частью композиции депигментирующего крема, продаваемого под названием Иклен (Iklen®).
Неожиданно и на удивление заявитель к настоящему времени обнаружил, что новые соединения с 4-(гетероциклоалкил)бензол-1,3-диольной структурой обладают очень хорошей ингибирующей активностью в отношении фермента тирозиназы и очень низкой цитотоксичностью. Кроме того, эти соединения обладают ингибирующей активностью в отношении фермента тирозиназы, которая является большей, чем ингибирующая активность руцинола, в то же время являясь менее цитотоксической в отношении меланоцитов, чем руцинол.
Эти соединения находят применение в лечении человека, в частности в дерматологии и в области косметологии.
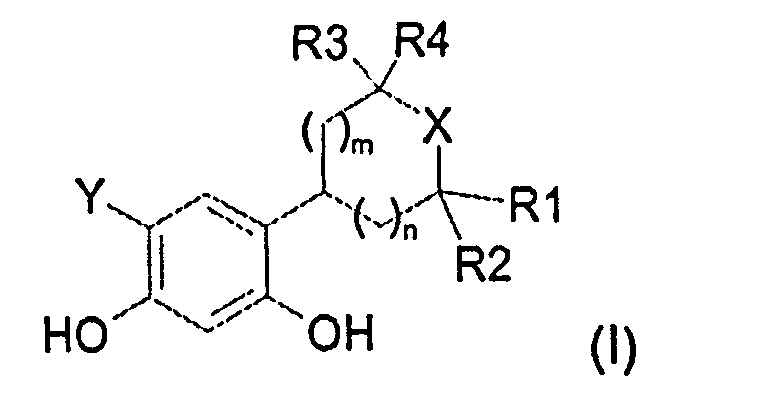
Таким образом, настоящее изобретение относится к соединениям общей формулы (I), приведенной ниже:

в которой:
R1, R2, R3 и R4, которые могут быть одинаковыми или различными, представляют собой:
- водород,
- C1-C4-алкильный радикал,
- гидроксиметил, гидроксиэтил,
- (C1-C4-алкокси)карбонил,
- C1-C4-алкокси,
- гидроксил,
или
R1 и R2 связаны друг с другом и с атомом углерода, к которому они присоединены, с образованием углеродного цикла, содержащего 5 или 6 атомов углерода, а R3 и R4, которые могут быть одинаковыми или различными, представляют собой:
- водород,
- C1-C4-алкильный радикал,
или
R1 и R4 связаны друг с другом и формируют цепь -(CH2)2- или -(CH2)3-, а R2 и R3, которые могут быть одинаковыми или различными, представляют собой:
- водород,
- C1-C4-алкильный радикал,
X представляет собой атом кислорода или атом серы,
Y представляет собой водород, атом хлора или атом фтора,
значение m может представлять собой 1 или 2, а значение n может представлять собой 0 или 1, и когда n=0, тогда m=1 или 2, а когда n=1, тогда m=1,
а также к солям соединений общей формулы (I) и их изомерным и энантиомерным формам.
Среди солей соединений общей формулы (I) с фармацевтически приемлемым основанием предпочтительно можно указать соли с органическим основанием или с неорганическим основанием.
Подходящие неорганические основания представляют собой, например, гидроксид калия, гидроксид натрия или гидроксид кальция.
Подходящие органические основания представляют собой, например, морфолин, пиперазин или лизин.
Соединения общей формулы (I) также могут существовать в форме гидратов или сольватов.
Растворители, подходящие для формирования сольватов, представляют собой, например, спирты, такие как этанол или изопропанол.
Термин "C1-C4-алкил" по настоящему изобретению означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 4 атомов углерода.
Термин "(C1-C4-алкокси)карбонил" по настоящему изобретению означает карбоксильный радикал, замещенный алкильным радикалом, содержащим от 1 до 4 атомов углерода.
Термин "C1-C4-алкокси" по настоящему изобретению означает атом кислорода, замещенный линейной или разветвленной насыщенной углеводородной цепью, содержащей от 1 до 4 атомов углерода.
Термин "изомеры" по настоящему изобретению означает цис- и транс-формы в отношении заместителей в гетероциклоалкиле в положении 4 бензол-1,3-диола.
По настоящему изобретению, соединения общей формулы (I), являющиеся особенно предпочтительными, представляют собой соединения, у которых:
- R1 представляет собой водород, C1-C4-алкильный радикал или гидроксиметильный радикал,
- R2 представляет собой водород,
- R3 представляет собой водород,
- R4 представляет собой водород,
- X представляет собой атом кислорода,
- Y представляет собой атом водорода или фтора,
- m=1 и n=1,
а также соли этих соединений общей формулы (I) и их изомерные и энантиомерные формы.
Среди соединений формулы (I), попадающих в контекст настоящего изобретения, в частности, можно указать следующие:
1: 4-(тетрагидропиран-4-ил)бензол-1,3-диол
2: 4-(тетрагидротиопиран-4-ил)бензол-1,3-диол
3: 4-(цис-2,6-диметилтетрагидропиран-4-ил)бензол-1,3-диол
4: транс-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диол
5: цис-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диол
6: транс-4-(2-этилтетрагидропиран-4-ил)бензол-1,3-диол
7: цис-4-(2-этилтетрагидропиран-4-ил)бензол-1,3-диол
8: транс-4-(2-гидроксиметилтетрагидропиран-4-ил)бензол-1,3-диол
9: 4-(2,2,6,6-тетраметилтетрагидропиран-4-ил)бензол-1,3-диол
10: 4-(тетрагидрофуран-3-ил)бензол-1,3-диол
11: 4-(тетрагидротиофен-3-ил)бензол-1,3-диол
12: 4-(6-оксаспиро[4.5]дец-9-ил)бензол-1,3-диол
13: 4-хлор-6-(тетрагидропиран-4-ил)бензол-1,3-диол
14: 4-фтор-6-(тетрагидропиран-4-ил)бензол-1,3-диол
15: 4-(2,2-диэтилтетрагидропиран-4-ил)бензол-1,3-диол
16: 4-(тетрагидропиран-3-ил)бензол-1,3-диол
17: транс-4-(5-гидроксиметилтетрагидрофуран-3-ил)бензол-1,3-диол
18: цис-4-(5-гидроксиметилтетрагидрофуран-3-ил)бензол-1,3-диол
19: транс-4-фтор-6-(5-гидроксиметилтетрагидрофуран-3-ил)бензол-1,3-диол
20: цис-4-фтор-6-(5-гидроксиметилтетрагидрофуран-3-ил)бензол-1,3-диол
21: транс-4-фтор-6-(2-гидроксиметилтетрагидропиран-4-ил)бензол-1,3-диол
22: цис-4-фтор-6-(2-гидроксиметилтетрагидропиран-4-ил)бензол-1,3-диол
23: цис-4-(8-оксабицикло[3.2.1]окт-3-ил)бензол-1,3-диол
24: транс-4-(8-оксабицикло[3.2.1]окт-3-ил)бензол-1,3-диол
25: 4-фтор-6-(тетрагидротиопиран-4-ил)бензол-1,3-диол
Соединения общей формулы (I) получают в соответствии с общими схемами реакций 1-4, представленными на фиг.1.
Схема 1 на фиг.1 соответствует получению соединений общей формулы (I), у которых m=n=1, X = O, и R1, R2, R3, R4 и Y имеют то же определение, как указано выше.
В соответствии со схемой реакции 1 на фиг.1 2,4-дибензилоксибромбензол (1) в присутствии бутиллития подвергают реакции с гетероциклоалканоном общей формулы (2), который коммерчески доступен или который получают общепринятыми способами синтеза (W.D. Langley, Org. Synth. I, 122 (1932)), так, чтобы получить бензиловый спирт общей формулы (3).
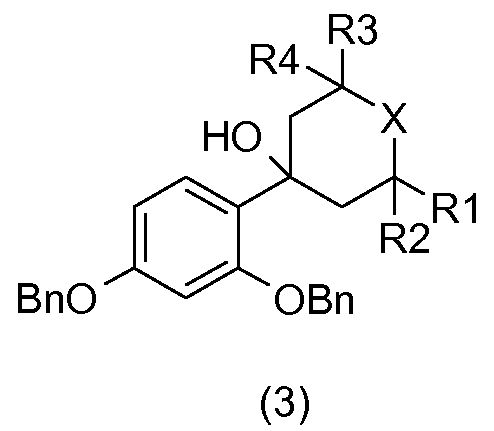
Бензиловый спирт общей формулы (3) подвергают дегидратации в апротонном растворителе, таком как толуол, в присутствии кислоты, например, такой как камфорсульфокислота, так, чтобы получить соединение общей формулы (4).

Соединения общей формулы (5):

получают или, исходя из соединения общей формулы (3), или, исходя из соединения общей формулы (4), посредством гидрирования в растворителе, например, таком как метанол, и в присутствии водорода и катализатора на основе палладия, например, такого как палладий на углероде.
Соединения общей формулы (6):

получают посредством галогенирования соединений общей формулы (5) с применением галогенирующего агента, например, такого как N-хлорсукцинимид (Y = Cl) или селектфлуор® (Y = F).
Схема 2 на фиг.1 соответствует получению соединений общей формулы (I), у которых m=n=1, X = O или S, и R1, R2, R3, R4 и Y имеют то же определение, как указано выше.
В соответствии со схемой реакции 2 на фиг.1, 2,4-бис(метоксиметокси)бромбензол (7) подвергают реакции в присутствии основания, например, такого как бутиллитий, с гетероциклоалканоном общей формулы (2), который коммерчески доступен или который получают общепринятыми способами синтеза (W.D. Langley, Org. Synth. I, 122 (1932)), так, чтобы получить бензиловый спирт общей формулы (8).

Бензиловый спирт общей формулы (8) в растворителе, таком как толуол, в присутствии кислоты, например, такой как камфорсульфокислота, подвергают дегидратации с получением соединения общей формулы (9).

Соединения общей формулы (10) получают, например, посредством гидрирования соединений общей формулы (9) в присутствии водорода в растворителе, например, таком как метанол, и катализатора на основе палладия, такого как палладий на углероде.

Соединения общей формулы (5) получают, например, исходя из соединений общей формулы (10), в присутствии соляной кислоты в метаноле.

Схема 3 на фиг.1 соответствует получению соединений общей формулы (I), у которых m=1, n=0, X = O, R1 = R2 = H, и R3, R4 и Y имеют то же определение, как указано выше.
С применением схемы реакции 3 на фиг.1, 2,4-дибензилоксибромбензол (1) в присутствии бутиллития подвергают реакции, например, с гетероциклоалканоном общей формулы (11), который коммерчески доступен или который получают общепринятыми способами синтеза (W.D. Langley, Org. Synth. I, 122 (1932)), так, чтобы получить соединение общей формулы (12).

Соединения общей формулы (13) получают, исходя из соединений общей формулы (12), посредством гидрирования в растворителе, например, таком как метанол, в присутствии водорода и катализатора на основе палладия, например, такого как палладий на углероде.

Соединения общей формулы (16):

получают посредством галогенирования соединений общей формулы (13) с применением галогенирующего агента, например, такого как N-хлорсукцинимид (Y = Cl) или селектфлуор® (Y = F).
Схема 4 на фиг.1 соответствует получению соединений общей формулы (I), у которых m=1, n=0, X = O или S, R1 = R2 = H, и R3, R4 и Y имеют то же определение, как указано выше.
С применением схемы реакции 4 на фиг.1, 2,4-бис(метоксиметокси)бромбензол (7) в присутствии бутиллития подвергают реакции, например, с гетероциклоалканоном общей формулы (11), который коммерчески доступен или который получают общепринятыми способами синтеза (W.D. Langley, Org. Synth. I, 122 (1932)), так, чтобы получить бензиловый спирт общей формулы (14).

Затем бензиловые спирты общей формулы (14) в растворителе, например, таком как метанол, в присутствии кислоты, например, такой как соляная кислота, подвергают дегидратации с получением соединений общей формулы (15).

Соединения общей формулы (13) получают посредством гидрирования соединений общей формулы (15) в присутствии водорода в растворителе, например, таком как метанол, и катализатора на основе палладия, например, такого как палладий на углероде.

Таким образом, изобретение относится к применению по меньшей мере одного соединения общей формулы (I), как определено выше, в качестве лекарственного средства.
Изобретение также относится к применению по меньшей мере одного соединения общей формулы (I), как определено выше, в качестве лекарственного средства, в котором указанное соединение обладает ингибирующим тирозинкиназу действием.
Изобретение также относится к применению по меньшей мере одного соединения общей формулы (I), как определено выше, для получения фармацевтической или косметической композиции, в которых указанное соединение обладает ингибирующим тирозинкиназу действием.
Преимущественно значение IC50 соединений по настоящему изобретению (доза, ингибирующая 50% ферментативной активности) в отношении тирозиназы является меньшим или равным 10 мкМ, а более конкретно - меньшим или равным 1 мкМ.
Изобретение также относится к соединению общей формулы (I) для его применения для лечения и/или предотвращения пигментных нарушений.
Фактически соединения общей формулы (I) по изобретению особенно пригодны для применения, связанного с лечением или предотвращением пигментных нарушений, таких как мелазма, хлоазма, лентигиноз, старческое лентиго, неравномерная гиперпигментация, связанная со старением кожи от воздействия ультрафиолетовых лучей, веснушчатость, поствоспалительная гиперпигментация вследствие царапин, ожогов, рубцов, дерматоза, контактной аллергии; невусы, генетически определенная гиперпигментация, гиперпигментация метаболического или связанного с лекарственными средствами происхождения, меланомы или другие очаги гиперпигментации.
Объектом настоящего изобретения также является фармацевтическая композиция для применения, в частности, для лечения указанных выше состояний, и которая характеризуется тем, что она в фармацевтически приемлемом носителе, совместимом с выбранным для указанной композиции способом введения, содержит соединение общей формулы (I) в форме одного из его изомеров или энантиомеров, или его соли с фармацевтически приемлемым основанием.
Термин "фармацевтически приемлемый носитель" предназначен для обозначения среды, которая совместима с кожей, слизистыми оболочками и производными кожи.
Композицию по изобретению можно вводить местно. Предпочтительно фармацевтическая композиция упакована в форме, подходящей для местного применения.
При местном применении фармацевтическая композиция по изобретению более конкретно предназначена для применения в лечении кожи и слизистых оболочек и может находиться в жидкой, пастообразной или твердой форме, а более конкретно в форме мазей, кремов растворов или гелей.
Концентрация соединений по изобретению в композициях, используемых для местного применения, как правило, составляет от 0,001% до 10% по массе, предпочтительно от 0,01% до 5% по массе относительно общей массы композиции.
Соединения общей формулы (I) по изобретению также находят применения в области косметики, в частности, в защите от вредных составляющих солнечного света, для предотвращения и/или борьбы с вызванным действием света или возрастным старением кожи и производных кожи.
Таким образом, объектом изобретения также является композиция, содержащая в косметически приемлемом носителе по меньшей мере одно из соединений общей формулы (I). Термин "косметически приемлемый носитель" предназначен для обозначения носителя, который совместим с кожей, слизистыми оболочками и производными кожи.
Объектом настоящего изобретения также является косметическое применение композиций, содержащих по меньшей мере одно соединение общей формулы (I), для предотвращения и/или лечения признаков старения и/или кожи.
Объектом настоящего изобретения также является косметическое применение композиций, содержащих по меньшей мере одно соединение общей формулы (I), для гигиены тела или волос.
Косметическая композиция по изобретению, содержащая в косметически приемлемом носителе соединение общей формулы (I), или одну из его изомерных и энантиомерных форм или его соль с косметически приемлемым основанием, в частности, может находиться в форме крема, молочка, геля, суспензий микросфер, или наносферы, или липидных, или полимерных везикул, пропитанных салфеток, растворов, спреев, пен, карандашей, мыла, моющих основ или шампуней.
Концентрация соединения общей формулы (I) в косметической композиции предпочтительно составляет от 0,001% до 10% по массе относительно общей массы композиции.
Фармацевтические и косметические композиции, как описано выше, также могут содержать инертные добавки или даже фармакодинамически активные относительно фармацевтических композиций добавки или комбинации этих добавок и, в частности:
- увлажнители;
- ароматизатор;
- консерванты, такие как сложные эфиры парагидроксибензойной кислоты;
- стабилизаторы;
- регуляторы влажности;
- регуляторы pH;
- модификаторы осмотического давления;
- эмульгаторы;
- экранирующие средства от УФ-A и УФ-B;
- антиоксиданты, такие как α-токоферол, бутилированный гидроксианизол или бутилированный гидрокситолуол, супероксиддисмутаза, убихинол; метабиссульфит натрия;
- смягчающие средства;
- увлажняющие средства, такие как глицерин, PEG 400, тиаморфолинон и его производные или мочевина;
- противосеборрейные или противоугревые средства, такие как S-карбоксиметилцистеин, S-бензилцистамин, их соли или их производные, или бензоилпероксид.
Понятно, что специалисты в данной области смогут проследить за выбором оптимального соединения(ий) для добавления в эти композиции так, чтобы благоприятные свойства, по существу связанные с настоящим изобретением, не нарушались или по существу не нарушались рассматриваемым добавлением.
Далее посредством иллюстрации и без какого-либо ограничительного характера будут приведены несколько примеров получения соединений общей формулы (I) по изобретению, результаты исследования биологической активности этих соединений, а также различные составы на основе таких соединений.
ПРИМЕР 1: 4-(тетрагидропиран-4-ил)бензол-1,3-диол
a) 4-(2,4-бис(бензилокси)фенил)тетрагидропиран-4-ол
2,4 мл 2,5 M н-бутиллития в гексане добавляют в раствор 1,85 г 2,4-бис(бензилокси)-1-бромбензола в 20 мл тетрагидрофурана, охлаждают до -70°C. Реакционную смесь перемешивают при -70°C в течение 1 часа и добавляют 555 мкл тетрагидро-4H-пиран-4-она. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем оставляют на ночь для возвращения к комнатной температуре. Реакционную смесь выливают в 15 мл насыщенного раствора хлорида аммония, в который добавляют 2 мл 2 М соляной кислоты, а затем экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 70/30.
Получают 820 мг 4-(2,4-бис(бензилокси)фенил)тетрагидропиран-4-ола в виде белого твердого вещества. Выход = 42%.
b) 4-(тетрагидропиран-4-ил)бензол-1,3-диол
Смесь 815 мг 4-(2,4-бис(бензилокси)фенил)тетрагидропиран-4-ола в 10 мл этилацетата, в присутствии 244 мг 10% палладия на углероде перемешивают при температуре окружающей среды при давлении водорода 5 бар (500 кПа) в течение 17 часов. Реакционную смесь фильтруют, а затем фильтрат выпаривают. Остаток (394 мг) кристаллизуют из этилацетата.
Получают 275 мг 4-(тетрагидропиран-4-ил)бензол-1,3-диола в виде белого кристаллического твердого вещества. Выход = 68%.
1H ЯМР (ДМСО D6, 400 МГц): 1,54 (м, 4H); 2,92 (м, 1H); 3,39 (м, 2H); 3,90 (м, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,82 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,11 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 32,6, 33,5, 67,7, 102,3, 106,0, 122,4, 126,7, 155,2, 156,0.
ПРИМЕР 2: 4-(тетрагидротиопиран-4-ил)бензол-1,3-диол
a) 1-бром-2,4-бис(метоксиметокси)бензол
42,56 г карбоната калия добавляют в раствор 20,0 г 97% 4-бромресорцинола в 200 мл ацетона. Реакционную смесь перемешивают при 5°C в течение 10 минут, а затем по каплям добавляют 23,4 мл хлорметилметилового эфира. Реакционную смесь перемешивают при температуре окружающей среды в течение 3 часов. Растворитель выпаривают, а затем остаток растворяют в смеси вода-этилацетат. Водную фазу экстрагируют этилацетатом, и органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 90/10.
Получают 27,94 г 1-бром-2,4-бис(метоксиметокси)бензола в виде бесцветного масла. Выход = 99%.
b) 4-(2,4-бис(метоксиметокси)фенил)тетрагидротиопиран-4-ол
6,35 мл тетраметилэтилендиамина добавляют в раствор 5,54 г 1-бром-2,4-бис(метоксиметокси)бензола в 80 мл тетрагидрофурана. Смесь охлаждают до -70°C и добавляют 16,8 мл 2,5 М н-бутиллития в гексане. Реакционную смесь перемешивают при -70°C в течение 1 часа и в раствор добавляют 2,79 г тетрагидротиопиран-4-она в 30 мл тетрагидрофурана. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем оставляют на ночь при температуре окружающей среды. Добавляют 50 мл 2 М соляной кислоты и реакционную смесь энергично перемешивают в течение 15 минут, а затем экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию смесью гептана/этилацетата 75/25.
Получают 2,97 г 4-(2,4-бис(метоксиметокси)фенил)тетрагидротиопиран-4-ола в виде желтого масла. Выход = 47%.
c) 5-(2,4-бис(метоксиметокси)фенил)-3,6-дигидро-2H-тиопиран
22 мг камфорсульфокислоты добавляют в раствор 2,96 г 4-(2,4-бис(метоксиметокси)фенил)тетрагидротиопиран-4-ола в 60 мл толуола. Смесь кипятят с обратным холодильником в течение 1 часа. Растворитель выпаривают и остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 80/20.
Получают 1,90 г 5-(2,4-бис(метоксиметокси)фенил)-3,6-дигидро-2H-тиопирана в виде желтоватого масла. Выход = 68%.
d) 4-(2,4-бис(метоксиметокси)фенил)тетрагидротиопиран
Смесь 1,89 г 4-(2,4-бис(метоксиметокси)фенил)-3,6-дигидро-2H-тиопирана в 20 мл этилацетата в присутствии 1,89 г 10% палладия на углероде перемешивают при 50°C при давлении водорода 80 бар (8 МПа) в течение 8 часов. Реакционную смесь фильтруют через целит и фильтрат выпаривают.
Получают 1,48 г 4-(2,4-бис(метоксиметокси)фенил)тетрагидротиопирана в виде масла. Выход = 77%.
e) 4-(тетрагидротиопиран-4-ил)бензол-1,3-диол
18 мл 1 M соляной кислоты добавляют в раствор 1,47 г 4-(2, 4-бис(метоксиметокси)фенил)тетрагидротиопирана в 18 мл метанола в присутствии 3 мл этилацетата. Смесь перемешивают при температуре окружающей среды в течение 3 часов и нагревают при 50°C в течение 17 часов. В реакционную смесь добавляют 12,0 мл насыщенного раствора гидрокарбоната натрия, после чего энергично перемешивают в течение 20 минут, а затем разделяют посредством осаждения. Водную фазу экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 70/30. Полученное твердое вещество растворяют диэтиловым эфиром и гептаном, фильтруют и сушат.
Полученное твердое вещество кристаллизуют из диэтилового эфира, фильтруют и сушат.
Получают 30 мг 4-(тетрагидротиопиран-4-ил)бензол-1,3-диола в виде белого порошка. Выход = 3%.
1H ЯМР (ДМСО D6, 400 МГц): 1,61 (м, 2H); 1,92 (м, 2H); 2,55 (м, 2H), 2,72 (м, 3H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,80 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,10 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 28,7, 33,8, 35,6, 102,3, 106,0, 123,5, 126,7, 154,8, 156,0.
ПРИМЕР 3: цис-4-(2,6-диметилтетрагидропиран-4-ил)бензол-1,3-диол
a) цис-2,6-диметилтетрагидропиран-4-он
10 г 2,6-диметил-гамма-пирона растворяют в 200 мл метанола, а затем добавляют 0,8 г 10% палладия на углероде. Реакционную смесь перемешивают в течение 24 часов при 25 атм. (2,533 МПа) водорода. Смесь фильтруют, а затем растворитель выпаривают. Получают 8,81 г цис-2,6-диметилтетрагидропиран-4-он. Выход = 88%.
b) 4-(2,4-бис(метоксиметокси)фенил)-2,6-диметилтетрагидропиран-4-ол
3,0 мл тетраметилэтилендиамина добавляют в раствор 2,65 г 1-бром-2,4-бис(метоксиметокси)бензола в 40 мл тетрагидрофурана. Смесь охлаждают до -70°C и добавляют 8,0 мл 2,5 М н-бутил-лития в гексане. Реакционную смесь перемешивают при -70°C в течение 1 часа и в раствор добавляют 1,47 г цис-2,6-диметилтетрагидропиран-4-она в 15 мл тетрагидрофурана. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем оставляют на ночь при температуре окружающей среды. Добавляют 25 мл 2 М соляной кислоты и реакционную смесь энергично перемешивают в течение 15 минут, а затем экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 75/25.
Получают 562 мг 4-(2,4-бис(метоксиметокси)фенил)-2,6-диметилтетрагидропиран-4-ола в виде желтого масла. Выход = 18%.
c) 4-(2,4-бис(метоксиметокси)фенил)-2,6-диметил-3,6-дигидро-2H-пиран
2 мг камфорсульфокислоты добавляют в раствор 247 мг 4-(2,4-бис(метоксиметокси)фенил)-2,6-диметилтетрагидропиран-4-ола в 5 мл толуола. Смесь кипятят с обратным холодильником в течение 2 часов. Растворитель выпаривают и остаток подвергают хроматографии на силикагеле, проводят элюцию смесью гептана/этилацетата 80/20.
Получают 132 мг 4-(2,4-бис(метоксиметокси)фенил)-2,6-диметил-3,6-дигидро-2H-пирана в виде желтого масла. Выход = 57%.
d) цис-4-(2,4-бис(метоксиметокси)фенил)-2,6-диметил-тетрагидропиран
Смесь 132 мг цис-4-(2,4-бис(метоксиметокси)фенил)-2,6-диметил-3,6-дигидро-2H-пирана в 10 мл метанола в присутствии 28 мг 10% палладия на углероде перемешивают при температуре окружающей среды при давлении водорода 3 бар (300 кПа) в течение 5 часов. Реакционную смесь фильтруют, а затем фильтрат выпаривают.
Получают 125 мг цис-4-(2,4-бис(метоксиметокси)фенил)-2,6-диметилтетрагидропирана в виде белого порошка. Выход = 94%.
e) цис-4-(2,6-диметилтетрагидропиран-4-ил)бензол-1,3-диол
1,9 мл 1 н. соляной кислоты добавляют в раствор 120 мг цис-4-(2,4-бис(метоксиметокси)фенил)-2,6-диметилтетрагидропирана в 2,5 мл метанола. Смесь перемешивают при температуре окружающей среды в течение ночи, а затем кипятят с обратным холодильником в течение 1 часа. Добавляют 1,5 мл насыщенного раствора гидрокарбоната натрия и реакционную смесь энергично перемешивают в течение 20 минут, а затем разделяют посредством осаждения. Водную фазу экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию дихлорметаном/метанолом 95/5. Получают 40 мг цис-4-(2,6-диметилтетрагидропиран-4-ил)бензол-1,3-диола в виде белого порошка. Выход = 46%.
1H ЯМР (ДМСО D6, 400 МГц): 1,09 (д, J=6 Гц, 6H); 1,14 (кв, J=12,4 Гц, 2H); 1,61 (дд, J=1,6 Гц & 12,3 Гц, 2H); 2,95 (м, 1H), 3,50 (м, 2H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,4 Гц, 1H); 8,94 (с, 1H); 9,09 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 21,9, 33,4, 72,7, 102,3, 105,9, 122,3, 126,6, 155,1, 155,9.
ПРИМЕР 4: транс-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диол
a) 2-метил-2,3-дигидропиран-4-он
1,7 мл BF3·Et2O добавляют в раствор 2,07 г диена Данишевского (((E)-3-метокси-1-метиленаллилокси)триметилсилан) и 581 мг ацетальдегида в 25 мл диэтилового эфира, охлаждают до -70°C. Смесь перемешивают при -70°C в течение 1 часа. Добавляют 10 мл насыщенного раствора гидрокарбоната натрия и реакционную смесь экстрагируют диэтиловым эфиром. Органические фазы объединяют, сушат над сульфатом магния, фильтруют и выпаривают холодным способом.
Получают 1,35 г 2-метил-2,3-дигидропиран-4-он в виде оранжевого масла. Выход = 100%.
b) 2-метилтетрагидропиран-4-он
1,35 г 2-метил-2,3-дигидропиран-4-она в 15 мл этилацетата в присутствии 270 мг 10% палладия на углероде, перемешивают в атмосфере водорода при температуре окружающей среды в течение 3 суток. Реакционную смесь фильтруют через фильтровальную бумагу и фильтрат выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию пентаном/диэтиловым эфиром 60/40.
Получают 787 мг 2-метилтетрагидропирана-4-он в виде желтого масла. Выход = 57%.
c) 4-(2,4-бис(бензилокси)фенил)-2-метилтетрагидропиран-4-ол
2,7 мл 2,5 М н-бутиллития в гексане добавляют в раствор 2,06 г 2,4-бис(бензилокси)-1-бромбензола в 20 мл тетрагидрофурана, охлаждают до -70°C. Реакционную смесь перемешивают при -70°C в течение 10 минут и в раствор добавляют 766 мг 2-метилтетрагидропирана-4-она в 7 мл тетрагидрофурана. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем оставляют для возвращения к температуре окружающей среды в течение 3 часов. Реакционную смесь выливают в 20 мл насыщенного раствора хлорида аммония, в который добавляли 3 мл 2 М соляной кислоты, а затем экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 70/30.
Получают 838 мг 4-(2,4-бис(бензилокси)фенил)-2-метил-тетрагидропирана-4-ола в виде желтого масла. Выход = 37%.
d) транс-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диол
830 мг 4-(2,4-бис(бензилокси)фенил)-2-метил-тетрагидропиран-4-ола в 12 мл этилацетата в присутствии 415 мг 10% палладия на углероде при перемешивают при температуре окружающей среды при давлении водорода 5 бар (500 кПа) в течение 3 часов. Реакционную смесь фильтруют, а затем фильтрат выпаривают. Остаток (516 мг) подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 80/20.
Получают 37 мг транс-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диола в виде белого порошка. Выход = 8%.
1H ЯМР (ДМСО D6, 400 МГц): 1,20 (д, J=6 Гц, 3H); 1,48 (м, 1H); 1,58 (м, 2H); 1,79 (м, 1H); 3,16 (м, 1H); 3,56 (м, 1H); 3,67 (м, 1H); 3,94 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,11 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 18,3, 27,5, 31,4, 36,4, 60,9, 68,1, 102,4, 105,8, 122,1, 127,1, 155,4, 156,0.
ПРИМЕР 5: цис-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диол
В предшествующей очистке выделяют более полярную фракцию: получают 57 мг цис-4-(2-метил-тетрагидропиран-4-ил)бензол-1,3-диола в виде белого порошка. Выход = 13%.
1H ЯМР (ДМСО D6, 400 МГц): 1,10 (д, J=6 Гц, 3H); 1,20 (м, 1H); 1,50 (м, 2H); 1,62 (м, 1H); 2,94 (м, 1H); 3,42 (м, 2H); 3,90 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,80 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,10 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 21,9, 31,9, 33,5, 40,7, 67,3, 73,1, 102,3, 106,0, 122,4, 126,7, 155,1, 156,0.
ПРИМЕР 6: транс-4-(2-этилтетрагидропиран-4-ил)бензол-1,3-диол
Транс-4-(2-этил-тетрагидропиран-4-ил)бензол-1,3-диол получают способом, аналогичным способу из примера 4, но с применением на стадии 4a пропиональдегида, а затем аналогичным способом повторяя стадии 4b, 4c и 4d.
1H ЯМР (ДМСО D6, 400 МГц): 0,81 (т, J=6 Гц, 3H); 1,20 (м, 1H); 1,45-1,65 (м, 5H); 2,92 (м, 1H); 3,21 (м, 1H); 3,40 (тд, J=11,2 & 2,4 Гц, 1H); 3,90 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,11 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 9,9, 28,8, 32,2, 33,5, 37,7, 67,5, 78,4, 102,4, 106,0, 122,5, 126,7, 155,1, 156,0.
ПРИМЕР 7: цис-4-(2-этилтетрагидропиран-4-ил)бензол-1,3-диол
Способом, аналогичным способу из примера 5, получают более полярную фракцию посредством очистки продукта, полученного при синтезе в примере 6; получают цис-4-(2-этил-тетрагидропиран-4-ил)бензол-1,3-диол.
1H ЯМР (ДМСО D6, 400 МГц): 0,90 (т, J=6 Гц, 3H); 1,50 (м, 1H); 1,61 (м, 3H); 1,81 (м, 2H); 3,22 (м, 1H); 3,69 (м, 3H); 3,67 (м, 1H); 3,94 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,11 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 10,3, 24,2, 27,8, 31,4, 34,6, 61,0, 73,8, 102,4, 105,8, 122,2, 127,0, 155,4, 156,0.
ПРИМЕР 8: транс-4-(2-гидроксиметилтетрагидропиран-4-ил)бензол-1,3-диол
Транс-4-(2-гидроксиметилтетрагидропиран-4-ил)бензол-1,3-диол получают способом, аналогичным способу из примера 4, но с применением на стадии 4a бензилоксиацетальдегида, а затем аналогичным способом повторяя стадии 4b, 4c и 4d.
1H ЯМР (ДМСО D6, 400 МГц): 1,20 (м, 1H); 1,55 (м, 2H); 1,65 (м, 1H); 2,92 (м, 1H); 3,40 (м, 4H); 3,95 (м, 1H); 4,56 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,12 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 32,2, 33,2, 34,6, 64,8, 37,3, 78,5, 102,4, 106,0, 122,5, 126,7, 155,2, 156,0.
ПРИМЕР 9: 4-(2,2,6,6-тетраметилтетрагидропиран-4-ил)бензол-1,3-диол
a) 2,2,6,6-тетраметилтетрагидропиран-4-он
5 г коммерческого форона растворяют в 36 мл 1 М раствора соляной кислоты и нагревают при 40°C в течение 2 суток. Реакционную смесь перегоняют (63-65°C) так, чтобы получить 3,0 г желтоватого масла. Выход = 53%.
1H ЯМР (ДМСО D6, 400 МГц): 1,25 (м, 4H); 2,3 (м, 12H).
b) 4-(2,2,6,6-тетраметилтетрагидропиран-4-ил)бензол-1,3-диол
4-(2,2,6,6-Тетраметилтетрагидропиран-4-ил)бензол-1,3-диола получают способом, аналогичным способу из примера 4, но с применением на стадии 4c 2,2,6,6-тетраметилтетрагидропиран-4-она, а затем аналогичным способом повторяя стадию 4d.
1H ЯМР (ДМСО D6, 400 МГц): 1,11 (с, 6H); 1,25 (м, 8H); 1,56 (м, 2H); 3,28 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,79 (д, J=8,4 Гц, 1H); 8,95 (с, 1H); 9,09 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 25,8, 27,4, 33,7, 43,0, 71,7, 102,3, 106,0, 122,5, 126,5, 155,2, 155,9.
ПРИМЕР 10: 4-(тетрагидрофуран-3-ил)бензол-1,3-диол
a) дигидрофуран-3-он
Раствор 16,8 г оксида хрома VI в 50 мл воды в присутствии 15,6 мл 95% серной кислоты по каплям добавляют в раствор 4,9 г 3-гидрокситетрагидрофурана в 450 мл ацетона. Реакционную смесь перемешивают при 0°C в течение 40 минут. Добавляют 450 мл воды и реакционную смесь экстрагируют диэтиловым эфиром. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию пентаном/диэтиловым эфиром 60/40. Получают 1,78 г дигидрофуран-3-она в виде бесцветного масла. Выход = 28%.
b) 3-(2,4-бис(бензилокси)фенил)-2,5-дигидрофуран
2 мл 2,5 M н-бутиллития в гексане добавляют в раствор 4,74 г 2,4-бис(бензилокси)-1-бромбензола в 50 мл тетрагидрофурана, охлаждают до -70°C. Реакционную смесь перемешивают при -70°C в течение 10 минут и в раствор добавляют 1,77 г дигидрофуран-3-она в 15 мл тетрагидрофурана. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем оставляют на ночь для возвращения до температуры окружающей среды. Реакционную смесь выливают в 35 мл насыщенного раствора хлорида аммония, в который добавляли 6,5 мл 2 М соляной кислоты, а затем экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 60/40.
Получают 1,57 г 3-(2,4-бис(бензилокси)фенил)-2,5-дигидрофурана в виде желтого масла. Выход = 34%.
c) 4-(тетрагидрофуран-3-ил)бензол-1,3-диол
Смесь 1,56 г 3-(2,4-бис(бензилокси)фенил)тетрагидрофуран-3-ола в 25 мл этилацетата в присутствии 780 мг 10% палладия на углероде перемешивают при температуре окружающей среды при давлении водорода 5 бар (500 кПа) в течение 7 часов. Реакционную смесь фильтруют, а затем фильтрат выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 50/50. Полученное твердое вещество кристаллизуют из дихлорметана/гептана. Получают 285 мг 4-(тетрагидрофуран-3-ил)бензол-1,3-диола в виде белого порошка. Выход = 36%.
1H ЯМР (ДМСО D6, 400 МГц): 1,85 (м, 1H); 2,10 (м, 1H); 3,42 (м, 2H); 3,73 (кв, J=8,4 Гц, 1H); 3,85 (м, 1H); 3,92 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,87 (д, J=8,4 Гц, 1H); 9,02 (с, 1H); 9,21 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 32,0, 37,5, 67,2, 72,5, 102,3, 106,0, 118,3, 127,3, 155,8, 156,4.
ПРИМЕР 11: 4-(тетрагидротиофен-3-ил)бензол-1,3-диол
a) 3-(2,4-бис(метоксиметокси)фенил)тетрагидротиофен-3-ол
23,0 мл 2,5 М н-бутиллития в гексане добавляют в раствор 13,10 г 1-бром-2,4-бис(метоксиметокси)бензола в 200 мл тетрагидрофурана, охлаждают до -70°C. Реакционную смесь перемешивают при -70°C в течение 20 минут и добавляют 4,90 мл тетрагидротиофен-3-она. Реакционную смесь перемешивают при -70°C в течение 1 часа, а затем оставляют на ночь для возвращения до температуры окружающей среды. Реакционную смесь выливают в 150 мл насыщенного раствора хлорида аммония, в который добавляли 30 мл 2 М соляной кислоты, а затем экстрагируют этилацетатом. Органические фазы объединяют, сушат над сульфатом магния и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 85/15.
Получают 4,10 г 3-(2,4-бис(метоксиметокси)фенил)тетрагидротиофен-3-ола в виде оранжевого масла. Выход = 29%.
b) 4-(4,5-дигидротиофен-3-ил)бензол-1,3-диол
50 мл 1 н. соляной кислоты добавляют в раствор 4,10 г 3-(2,4-бис(метоксиметокси)фенил)тетрагидротиофен-3-ола в 50 мл метанола в присутствии 8 мл этилацетата. Смесь нагревают при 50°C в течение 4 часов. Добавляют 40 мл насыщенного раствора гидрокарбоната натрия и реакционную смесь энергично перемешивают в течение 20 минут, а затем разделяют посредством осаждения. Водную фазу экстрагируют этилацетатом. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 80/20.
Получают 400 мг 4-(4,5-дигидротиофен-3-ил)бензол-1,3-диола в виде желтого масла. Выход = 15%.
c) 4-(тетрагидротиофен-3-ил)бензол-1,3-диол
Смесь 400 мг 4-(4,5-дигидротиофен-3-ил)бензол-1,3-диола в 10 мл этилацетата в присутствии 400 мг 10% палладия на углероде перемешивают при температуре окружающей среды при давлении водорода 6 бар (600 кПа) в течение 4 суток. Реакционную смесь фильтруют, а затем фильтрат выпаривают. Остаток подвергают хроматографии на силикагеле, проводят элюцию гептаном/этилацетатом 80/20. Полученное твердое вещество кристаллизуют из дихлорметана/гептана.
Получают 232 мг 4-(тетрагидротиофен-3-ил)бензол-1,3-диола в виде кремового твердого вещества. Выход = 57%.
1H ЯМР (ДМСО D6, 400 МГц): 1,94 (м, 1H); 2,16 (м, 1H); 2,67 (т, J=9,8 Гц, 1H); 2,81 (м, 2H); 2,99 (м, 1H); 3,37 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,27 (д, J=2,4 Гц, 1H); 6,95 (д, J=8,4 Гц, 1H); 9,05 (с, 1H); 9,27 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 29,9, 35,5, 35,6, 42,5, 102,5, 106,4, 118,0, 127,0, 155,7, 156,6.
ПРИМЕР 12: 4-(6-оксаспиро[4.5]дец-9-ил)бензол-1,3-диол
a) 6-оксаспиро[4.5]декан-9-он
В раствор 3,9 г циклопентанона в 11 мл 2-бутанола при температуре окружающей среды добавляют 5 г (E)-3-[(трет-бутил-диметилсиланилокси)бута-1,3-диенил]диметиламина. Реакционную смесь перемешивают в течение 18 часов при температуре окружающей среды. Растворитель выпаривают, а затем остаток растворяют в 100 мл диэтилового эфира. Смесь охлаждают до -78°C, а затем медленно добавляют 1,9 мл ацетилхлорида. Смесь перемешивают в течение 10 мин при -78°C, а затем реакцию останавливают добавлением 100 мл насыщенного раствора хлорида аммония. Полученную смесь экстрагируют 200 мл диэтилового эфира, и органические фазы объединяют, а затем сушат над безводным сульфатом натрия. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 8/2). Остаток растворяют в 50 мл метанола, а затем добавляют 200 мг 10% палладия на углероде. Реакционную смесь перемешивают в течение 2 часов в атмосфере водорода. Реакционную смесь фильтруют, а затем метанол выпаривают. Получают 600 мг 6-оксаспиро[4.5]декан-9-она. Выход = 18%.
b) 4-(6-оксаспиро[4.5]дец-9-ил)бензол-1,3-диол
4-(6-Оксаспиро[4.5]дец-9-ил)бензол-1,3-диол получают способом, аналогичным способу из примера 1, но с применением на стадии 1a 6-оксаспиро[4.5]декан-9-она, а затем аналогичным способом повторяя стадию 1b.
1H ЯМР (ДМСО D6, 400 МГц): 1,49 (м, 10H); 1,98 (м, 2H); 2,45 (м, 1H); 3,01 (м, 1H); 3,56 (м, 1H); 3,67 (м, 1H); 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,25 (д, J=2,4 Гц, 1H); 6,81 (д, J=8,4 Гц, 1H); 8,94 (с, 1H); 9,08 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 23,0, 24,1, 30,7, 31,8, 32,3, 41,2, 41,8, 61,9, 83,3, 102,4, 106,0, 122,6, 126,5, 155,2, 156,0.
ПРИМЕР 13: 4-хлор-6-(тетрагидропиран-4-ил)бензол-1,3-диол
2,4 г N-хлорсукцинимид добавляют в раствор 2 г 4-(тетрагидропиран-4-ил)бензол-1,3-диола (пример 1) в 30 мл дихлорметана при 0°C. Реакционную смесь перемешивают при температуре окружающей среды в течение 16 часов. Реакционную смесь экстрагируют дихлорметаном, а затем промывают водой. Органические фазы объединяют, а затем сушат над сульфатом натрия. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 75/25). Получают 400 мг 4-хлор-6-(тетрагидропиран-4-ил)бензол-1,3-диола. Выход = 17%.
1H ЯМР (ДМСО D6, 400 МГц): 1,58 (м, 4H), 2,91 (м, 1H), 3,39 (м, 2H), 3,88 (м, 2H), 6,49 (с, 1H), 6,91 (с, 1H), 9,44 (с, 1H), 9,70 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 32,3; 33,6; 67,6, 103,6; 109,3; 124,2; 126,9; 151,2; 154,0.
ПРИМЕР 14: 4-фтор-6-(тетрагидропиран-4-ил)бензол-1,3-диол
3,65 г бис(тетрафторбората) N-фтор-N'-(хлорметил)триэтилендиамина добавляют в раствор 2 г 4-(тетрагидропиран-4-ил)бензол-1,3-диола (пример 1) в 20 мл ацетонаитрила при 0°C. Реакционную смесь перемешивают в течение 16 часов при температуре окружающей среды. Реакционную смесь экстрагируют этилацетатом и органические фазы промывают, а затем сушат над сульфатом натрия. Остаток подвергают хроматографии на силикагеле (гептан/этилацетат 9/1). Получают 200 мг 4-фтор-6-(тетрагидропиран-4-ил)бензол-1,3-диола. Выход = 10%.
1H ЯМР (ДМСО D6, 400 МГц): 1,62 (м, 4H); 2,98 (м, 41H); 3,44 (м, 2H); 3,94 (м, 2H); 6,49 (с, 1H); 6,83 (с, 1H); 9,16 (с, 1H); 9,45 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 32,3, 33,4, 67,6, 104,4, 113,3 (JCF = 19 Гц), 122,3, 142,4 (JCF = 13 Гц), 144,6 (JCF = 229 Гц), 150,4.
ПРИМЕР 15: 4-(2,2-диэтилтетрагидропиран-4-ил)бензол-1,3-диол
4-(2,2-Диэтилтетрагидропиран-4-ил)бензол-1,3-диол получают способом, аналогичным способу из примера 12a, но с применением диэтилкетона, а затем аналогичным способом повторяя стадию 12b.
1H ЯМР (ДМСО D6, 400 МГц): 0,82 (т, J=6,7 Гц, 6H); 1,22-1,64 (м, 8H); 1,85 (м, 1H); 3,18 (м, 1H); 3,66 (м, 2H); 6,20 (дд, J=8,4 & 2,4 Гц, 1H); 6,31 (д, J=2,4 Гц, 1H); 6,88 (д, J=8,4, Гц, 1H); 9,00 (с, 1H); 9,14 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 8,8, 22,6, 28,8, 32,2, 32,4, 39,5, 60,9, 75,0, 102,4, 106,0, 122,7, 126,6, 155,2, 156,0.
ПРИМЕР 16: 4-(тетрагидропиран-3-ил)бензол-1,3-диол
4-(Тетрагидропиран-3-ил)бензол-1,3-диол получают способом, аналогичным способу из примера 1, но с применением дигидропиран-3-она.
1H ЯМР (ДМСО D6, 400 МГц): 1,54-1,77 (м, 6H); 2,95 (м, 1H); 3,12 (т, J=10,6 Гц, 1H); 3,30 (м, 1H); 3,73 (м, 1H), 3,80 (м, 1H), 6,14 (дд, J=8,4 & 2,4 Гц, 1H); 6,26 (д, J=2,4 Гц, 1H); 6,84 (д, J=8,4, Гц, 1H); 9,00 (с, 1H); 9,18 (с, 1H).
13C ЯМР (ДМСО D6, 100 МГц): 26,2, 28,8, 34,9, 67,2, 72,1, 102,3, 106,0, 119,0, 127,3, 155,6, 156,3.
ПРИМЕР 17: Анализ ингибирования тирозинкиназной активности
Активность ингибиторов измеряют, используя лизат клеток B16F1 (линия меланомы мышей). В присутствии субстрата L-тирозина, тирозиназа, присутствующая в этих клетках, катализирует гидроксилирование L-тирозина с получением L-DOPA, а затем окисление L-DOPA с получением допахинона. В присутствии MBTH (3-метил-2-бензотиазолинонгидразона) допахинон захватывается так, что формирует розовый комплекс, поглощающий при 520 нм.
Клетки B16F1 культивируют в среде DMEM + 10% эмбриональная телячья сыворотка + 10-9 M α-MSH в течение 4 суток при 37°C в 7% CO2. Их обрабатывают трипсином, отмывают в PBS, подсчитывают и осаждают. Осадок растворяют при 107 клеток/мл в лизирующем буфере (10 мМ фосфат натрия, pH 6,8 - 1% Igepal) и суспензию обрабатывают ультразвуком в течение 10 секунд. После центрифугирования в течение 30 минут при 4000 об./мин полученный супернатант составляет клеточный лизат, используемый в качестве источника тирозиназы в ферментативном анализе.
Анализы проводят в двух повторениях в 384-луночных планшетах в общем объеме 50 мкл. Каждая лунка содержит:
- 40 мкл раствора, содержащего 1,25 мМ L-тирозин, 6,25 мкМ L-DOPA (кофактор) и 3,75 мМ MBTH в буфере B (62,25 мМ фосфат натрия, pH 6,8 - 2,5% диметилформамид),
- 5 мкл ингибитора, разведенного в ДМСО,
- 5 мкл клеточного лизата, разведенного до 1/2 в 50 мМ буфере Tris-HCl, pH 7,5.
Планшет инкубируют при 37°C и через 6 часов инкубации проводят спектрофотометрическое сканирование при 520 нм. Во избежание любого возможного поглощения продуктами, в системе используют скорректированную оптическую плотность (оптическая плотность на момент 6 час - оптическая плотность на момент ноль).
Ингибиторы оценивают в виде дозы-ответа с тем, чтобы подсчитать IC50 (доза, ингибирующая 50% ферментативной активности).
В каждый эксперимент добавляют несколько внутренних контролей:
- контроль 100% активности: 5 мкл ингибитора заменяют 5 мкл ДМСО,
- контроль 50% активности: 5 мкл ингибитора заменяют 5 мкл фенилтиомочевины при 300 мкМ в ДМСО,
- контроль 0% активности: субстрат L-тирозин замещают буфером B.
Результаты, полученные для соединении по изобретению, приведены в таблице A:
ПРИМЕР 18: Анализ ингибирования меланогенеза
Ингибирование меланогенеза измеряют в клетках меланомы человека MNT1 в соответствии с протоколом, адаптированным из Reigner et al., Cell Mol. Biol. (1999) 45:969-980. Анализ основан на одновременном включении 2 радиоактивно меченных маркеров:14C-тиоурацил включается во вновь синтезирующийся меланин и отражает меланогенез, тогда как3H-лейцин включается в белки и отражает жизнеспособность клеток, и, таким образом, тестируют токсичность соединений.
Клетки MNT1 высевают в 96-луночные планшеты в присутствии тестируемых соединений и радиоактивных изотопов. После инкубации в течение 24 час при 37°C клетки отмывают и измеряют количество 2 радиоактивных изотопов. Тестируемые соединения оценивают в виде дозы-ответа с тем, чтобы подсчитать IC50 для ингибирования меланогенеза на основании включения14C, которое стандартизуют по включению3H. Также на основании включения3H рассчитывают IC50 клеточной токсичности.
Таким образом, этот анализ дает возможность различать продукты, которые специфически ингибируют меланогенез, от продуктов, которые являются цитотоксическими для меланоцитов.
ПРИМЕР 19: Составы
Этот пример иллюстрирует различные составы на основе соединений по изобретению.
МЕСТНО
Реферат
Настоящее изобретение относится к новым 4-(гетероциклоалкил)бензол-1,3-диольным соединениям, соответствующим общей формуле (I), приведенной ниже, в которой: R1, R2, R3 и R4, могут быть одинаковыми или различными, и представляют собой: - водород, - С-С-алкильный радикал, - гидроксиметил, гидроксиэтил, - (C-C-алкокси)карбонил, - С-С-алкокси, - гидроксил, или R1 и R2 связаны друг с другом и с атомом углерода, к которому они присоединены, с образованием углеродного цикла, содержащего 5 или 6 атомов углерода, а R3 и R4 могут быть одинаковыми или различными и представляют собой: - водород, - С-С-алкильный радикал, или R1 и R4 связаны друг с другом с образованием цепи -(СН)- или -(СН)-, а R2 и R3 могут быть одинаковыми или различными, и представляют собой: - водород, - C-С-алкильный радикал, Х представляет собой атом кислорода или атом серы, Y представляет собой водород, атом хлора или атом фтора, значение m может представлять собой 1 или 2, а значение n может представлять собой 0 или 1, и когда n=0, тогда m=1 или 2, а когда n=1, тогда m=1, а также к солям соединений общей формулы (I) и их изомерным и энантиомерным формам, а также изобретение относится к применению этих соединений в фармацевтических или косметических композициях для применения в лечении или предотвращении пигментных нарушений.2 н. и 5 н.п. ф-лы., 2 табл., 19 пр.
Формула
в которой R1, R2, R3 и R4, которые могут быть одинаковыми или различными, представляют собой:
- водород,
- С1-С4-алкильный радикал,
- гидроксиметил, гидроксиэтил,
- (С1-С4-алкокси) карбонил,
- С1-С4-алкокси,
- гидроксил,
или
R1 и R2 связаны друг с другом и с атомом углерода, к которому они присоединены, с образованием углеродного цикла, содержащего 5 или 6 атомов углерода, а R3 и R4, которые могут быть одинаковыми или различными, представляют собой:
- водород,
- С1-С4-алкильный радикал,
или
R1 и R4 связаны друг с другом с образованием цепи -(СН2)2- или -(СН2)3-, а R2 и R3, которые могут быть одинаковыми или различными, представляют собой:
- водород,
- С1-С4-алкильный радикал,
Х представляет собой атом кислорода или атом серы,
Y представляет собой водород, атом хлора или атом фтора,
значение m может представлять собой 1 или 2, а значение n может представлять собой 0 или 1, и когда n=0, тогда m=1 или 2,
а когда n=1, тогда m=1,
а также соли соединений общей формулы (I) и их изомерные и
энантиомерные формы.
- R1 представляет собой водород, С1-С4-алкильный радикал или гидроксиметильный радикал,
- R2 представляет собой водород,
- R3 представляет собой водород,
- R4 представляет собой водород,
- Х представляет собой атом кислорода,
- Y представляет собой атом водорода или фтора,
- m=1 и n=1,
а также соли этих соединений и их изомерные и энантиомерные формы.
1: 4-(тетрагидропиран-4-ил)бензол-1,3-диола
2: 4-(тетрагидротиопиран-4-ил)бензол-1,3-диола
3: 4-(цис-2,6-диметилтетрагидропиран-4-ил)бензол-1,3-диола
4: транс-4-(2-метилтетрагидропиран-4-ил)бензол-1,3-диола
5: цис-4-(2-метилтетрагидропиран-4-ил)бензол-1,3 -диола
6: транс-4-(2-этилтетрагидропиран-4-ил)бензол-1,3-диола
7: цис-4-(2-этилтетрагидропиран-4-ил)бензол-1,3-диола
8: транс-4-(2-гидроксиметилтетрагидропиран-4-ил)бензол-1,3-диола
9: 4-(2,2,6,6-тетраметилтетрагидропиран-4-ил)бензол-1,3-диола
10: 4-(тетрагидрофуран-3-ил)бензол-1,3-диола
11: 4-(тетрагидротиофен-3-ил)бензол-1,3-диола
12: 4-(6-оксаспиро[4,5]дец-9-ил)бензол-1,3-диола
13: 4-хлор-6-(тетрагидропиран-4-ил)бензол-1,3-диола
14: 4-фтор-6-(тетрагидропиран-4-ил)бензол-1,3-диола
15: 4-(2,2-диэтилтетрагидропиран-4-ил)бензол-1,3-диола
16: 4-(тетрагидропиран-3-ил)бензол-1,3-диола.






Комментарии