Новые фенольные производные и их фармацевтическое или косметическое применение - RU2540858C2
Код документа: RU2540858C2
Описание
Объектом настоящего изобретения являются новые соединения общей формулы:

и их косметическое или фармацевтическое применение.
Настоящим изобретением предлагаются новые фенольные производные, которые являются мощными модуляторами рецептора андрогенов.
Из документов из уровня техники, описывающих молекулы, модулирующие активность рецептора андрогенов, можно, например, назвать фенилимидазолины, описанные в патентной заявке ЕР 580459 или в заявке WO 200542464.
Объектом изобретения являются новые фенольные производные, которые соответствуют следующей общей формуле (I):

в которой:
- R1 обозначает (С2-6)алкил, (С3-7)циклоалкил, (С1-6)алкилокси, -S(O)m-(С1-6)алкил, (С1-6)фторалкил, (С1-6)фторалкилокси, -(СН2)n-(С3-9)циклоалкил, -(СН2)n-(С3-9)циклоалкил, (С2-6)алкил-ОН, -(СН2)n-(С1-6)алкилокси, -(СН2)n-(С1-6)фторалкил, -(СН2)р-О-(С1-6)фторалкил, CORa, CN, NO2, NR8R9, галоген, фенильную или гетероарильную группу, содержащую либо а) от 1 до 4 атомов азота, либо b) атом кислорода или серы и 1 или 2 атома азота. Эти фенильная и гетероарильная группы могут быть замещены одной-тремя группами Rb, одинаковыми или разными,
- R2 и R3 являются одинаковыми или разными и обозначают атом водорода или (С1-9)алкил, (С3-9)циклоалкил, (С1-6)фторалкил, -(СН2)r-(С3-9)циклоалкил, (С2-6)алкил-ОН, -(СН2)r-(С1-6)алкилокси, -(СН2)r-(С3-7)циклоалкил, -(СН2)r-(С1-6)фторалкил, -(СН2)q-О-(С1-6)фторалкил.
Возможно, группы R2 и R3 могут образовывать с атомом углерода, с которым они связаны, (С3-9)циклоалкил или гетероцикл, такой как тетрагидрофуран, тетрагидропиран, тетрагидротиопиран, тетрагидро-1-окситиопиран или тетрагидро-1,1-диокситиопиран.
- R4, R5, R6, R7 являются одинаковыми или разными и обозначают либо атом водорода, либо (С1-6)алкил, (С3-7)циклоалкил, (С1-6)алкилокси, -S(O)s-(С1-6)алкил, (С1-6)фторалкил, (С1-6)фторалкилокси, -(СН2)t-(С3-9)циклоалкил, -(СН2)t-(С3-9)циклоалкил, (С1-6)алкил-OH, -(СН2)t-(С1-6)алкилокси, -(СН2)t-(С1-6)фторалкил, -(СН2)u-O-(С1-6)фторалкил, CORd, CN, NR8'R9' или галоген или фенильную или гетероарильную группу, содержащую либо а) от 1 до 4 атомов азота, либо b) атом кислорода или серы и 1 или 2 атома азота. Эти фенильная и гетероарильная группы могут быть замещены одной-тремя группами Rc, одинаковыми или разными,
- Х обозначает СН или N,
- Y обозначает либо атом азота, либо атом углерода, замещенный (С1-6)алкилом, (С3-7)циклоалкилом, (С1-6)алкилокси, -S(O)v-(С1-6)алкилом, (С1-6)фторалкилом, (С1-6)фторалкилокси, -(СН2)l-(С3-9)циклоалкилом, -(СН2)l-(С3-9)циклоалкилом, (С1-66)алкил-OH, -(СН2)l-(С1-6)алкилокси, -(СН2)l-(С1-6)фторалкилом, -(СН2)w-О-(С1-6)фторалкилом, CORe, CN, NR10R11, NO2, атом водорода или галоген или фенильную или гетероарильную группу, содержащую либо а) от 1 до 4 атомов азота, либо b) атом кислорода или серы и 1 или 2 атома азота. Эти фенильная и гетероарильная группы могут быть замещены одной-тремя группами Rb, одинаковыми или разными,
- Ra, Rd и Reявляются одинаковыми или разными и обозначают (С1-6)алкил, (С1-6)алкилокси или NR12R13,
- Rb и Rcявляются одинаковыми или разными и обозначают галоген, (С1-6)алкил, (С3-7)циклоалкил, (С1-6)алкилокси, -S(O)j-(С1-6)алкил, (С1-6)фторалкил, (С1-6)фторалкилокси, -(СН2)i-(С3-7)циклоалкил, OH, -(СН2)i-(С3-7)циклоалкил, (С1-6)алкил-OH, -(СН2)i-(С1-6)алкилокси, -(СН2)i-(С1-6)фторалкил, -(СН2)z-O-(С1-6)фторалкил, CORa, CN или NR14R15,
- R8 и R8'являются одинаковыми или разными и обозначают (С1-6)алкил, (С3-7)циклоалкил, -(СН2)f-(С3-7)циклоалкил или -(СН2)f-(С1-6)фторалкил.
- R9, R9', R10, R11, R12, R13, R14 и R15 являются одинаковыми или разными и обозначают атом водорода, (С1-6)алкил, (С3-7)циклоалкил, -(СН2)g-(С3-7)циклоалкил или -(СН2)g-(С1-6)фторалкил.
Возможно, группы R8 и R9 могут образовывать с атомом азота, с которым они связаны, гетероцикл, такой как азетидин, пиролидин, пиперидин, азепан, морфолин или пиперазин. Возможно группы R8' и R9' могут образовывать с атомом азота, с которым они связаны, гетероцикл, такой как азетидин, пиролидин, пиперидин, азепан, морфолин или пиперазин. Возможно, группы R10 и R11 могут образовывать с атомом азота, с которым они связаны, гетероцикл, такой как азетидин, пиролидин, пиперидин, азепан, морфолин или пиперазин. Возможно, группы R12 и R13 могут образовывать с атомом азота, с которым они связаны, гетероцикл, такой как азетидин, пиролидин, пиперидин, азепан, морфолин или пиперазин. Возможно, группы R14 и R15 могут образовывать с атомом азота, с которым они связаны, гетероцикл, такой как: азетидин, пиролидин, пиперидин, азепан, морфолин или пиперазин.
- f, g, i, l, n, r и t являются одинаковыми или разными и равны 1, 2 или 3,
- j, m, s и v являются одинаковыми или разными и равны 0, 1 или 2,
- p, q, u, w и z являются одинаковыми или разными и равны 2, 3 или 4,
а также их фармацевтически приемлемые соли, сольваты или гидраты и их конформеры или ротамеры.
Соединения формулы (I) могут содержать один или несколько ассиметрических атомов углерода. Следовательно, они могут быть в форме смеси энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, относятся к изобретению.
Соединения формулы (I) могут быть в форме основания или солей присоединения с кислотами. Такие соли присоединения относятся к изобретению. Эти соли преимущественно получают с использованием фармацевтически приемлемых кислот, но соли других кислот, пригодных, например, для очистки или выделения соединений формулы (I), также относятся к изобретению. Эти кислоты могут, например, представлять собой пикриновую кислоту, оксалиновую кислоту или оптически активную кислоту, например, винную кислоту, дибензоилвинную кислоту, миндальную кислоту или камфосульфоновую кислоту и такие, которые образуют физиологически приемлемые соли, такие как хлоргидрат, бромгидрат, сульфат, гидрогеносульфат, дигидрогенофосфат, малеат, фумарат, 2-нафталинсульфонат, паратолуолсульфонат. Для обзора физиолигически приемлемых солей см. Handbook of Pharmaceutical Salts: Properties, Selection and Use de Stahl et Wermuth (Wiley-VCH, 2002).
Сольваты или гидраты можно получать непосредственно на выходе из способа синтеза, причем соединение (I) выделяют в форме гидрата, например, моно или гемигидрата или сольвата растворителя реакции или очистки.
В рамках изобретения понимают под:
- Cb-c, где b и с могут принимать значения от 1 до 9, углеродную цепочку, содержащую от b до с атомов углерода, например С1-6-углеродную цепочку, которая может содержать от 1 до 6 атомов углерода,
- алкилом - алифатическую группу, насыщенную линейную или разветвленную, например (С1-6)алкил означает углеродную цепочку, содержащую от 1 до 6 атомов углерода, линейную или разветвленную, предпочтительно, метил, этил, пропил, изопропил, бутил, изобутил, третбутил, пентил, гексил,
- циклоалкилом - углеродную цепочку, насыщенную циклическую, возможно разветвленную, содержащую от 3 до 7 атомов углерода. В качестве примера (С3-7)циклоалкил означает углеродную цепочку, содержащую от 3 до 7 атомов углерода, предпочтительно, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил,
- гетероциклом - углеводородную цепочку, циклическую или бициклическую, насыщенную или ненасыщенную, содержащую один или несколько гетероатомов, выбранных из О, S и N,
- гетероарилом - ароматический гетероцикл, предпочтительно, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, пиразолил, изооксазолил, оксадиазолил, тиазолил, тиадиазолил, триазолил или имидазолил,
- галогеном - атом фтора, хлора или брома,
- алкилокси - О-алкил,
- алкилтио - -S-алкил,
- фторалкилом - алкил, один или несколько атомов водорода которого были заменены атомом фтора,
- фторалкилокси - алкилокси, один или несколько атомов водорода которого были заменены атомом фтора.
Предпочтительной является группа (А) соединений формулы (I), определенной выше, в которых:
- Х обозначает СН и Y обозначает атом углерода, замещенный одной из групп, таких как определены выше, и предпочтительно группами метильной, этильной, изопропильной, циклопропильной, CF3, CONH2, CO2CH3, CO2CH2CH3, CN, NO2, SCH3, SCH2CH3, атом водорода, галоген, OCF3, OCH3, OCH2CH3 или ОСН(СН3)2.
Группа (В) соединений формулы (I), заместители которых Х и Y определены выше или в предпочтительной группе (А), таких что группа R1 обозначает галоген, этил, изопропил, трифторметил, нитрил, нитро, метокси, этокси, изопропокси, тиометил, тиоэтил или тиоизопропил, является группой предпочтительных соединений и более конкретно таких, что R1 обозначает галоген, метокси, этокси, тиометил, тиоэтил или трифторметил.
Приведенные ниже соединения, а также их фармацевтически приемлемые соли, сольваты и гидраты и их конформы или ротамеры, являются наиболее предпочтительными:
2-[(6-метоксипиридин-2-иламино)метил]фенол,
2-[(6-бромпиридин-2-иламино)метил]фенол,
2-[(6-бромпиридин-2-иламино)метил]-4-фторфенол,
6-(2-гидроксибензиламино)пиридин-2-карбонитрил,
2-[1-(6-метоксипиридин-2-иламино)этил]фенол,
2-[(6-трифторметилпиридин-2-иламино)метил]фенол,
2-[(6-хлорпиридин-2-иламино)метил]фенол,
2-[(6-этилпиридин-2-иламино)метил]фенол,
2-[(6-этоксипиридин-2-иламино)метил]фенол,
2-[(6-изопропоксипиридин-2-иламино)метил]фенол,
5-хлор-2-[(6-метоксипиридин-2-иламино)метил]фенол,
2-[(2-трифторметилпиримидин-4-иламино)метил]фенол,
2-[(6-бромпиразин-2-иламино)метил]фенол,
2-[(2-хлорпиримидин-4-иламино)метил]фенол,
2-[(2-бромпиримидин-4-иламино)метил]фенол,
2-[(2-хлор-6-метилпиримидин-4-иламино)метил]фенол,
2-[(6-хлор-4-трифторметилпиридин-2-иламино)метил]фенол,
2-[(6-хлор-4-метилпиридин-2-иламино)метил]фенол,
2-[(6-метоксипиразин-2-иламино)метил]фенол,
2-[(2-метоксипиримидин-4-иламино)метил]фенол,
2-[(2-метокси-6-метилпиримидин-4-иламино)метил]фенол,
2-[(6-метилсульфанилпиридин-2-иламино)метил]фенол,
2-[(6-метансульфинилпиридин-2-иламино)метил]фенол,
2-[(6-метансульфонилпиридин-2-иламино)метил]фенол,
2-[(6-метоксипиридин-2-иламино)метил]-6-метилфенол,
2-[(4-бром-6-метоксипиридин-2-иламино)метил]фенол,
2-[(6-бром-2-метоксипиримидин-4-иламино)метил]фенол,
2-[(4-хлор-6-метоксипиридин-2-иламино)метил]фенол,
2-[(6-бром-2-метоксипиримидин-4-иламино)метил]фенол,
2-[(4-бром-6-метоксипиридин-2-иламино)метил]-6-фторфенол,
2-[(4-бром-6-метоксипиридин-2-иламино)метил]-5-фторфенол,
2-[(4-бром-6-метоксипиридин-2-иламино)метил]-3-фторфенол,
2-[(4-бром-6-метоксипиридин-2-иламино)метил]-4-фторфенол,
2-[(6-бром-2-метоксипиримидин-4-иламино)метил]-4-фторфенол,
2-[(4-хлор-6-метоксипиридин-2-иламино)метил]-4-фторфенол,
2-[(6-хлор-2-метоксипиримидин-4-иламино)метил]-4-фторфенол,
2-[1-(4-бром-6-метоксипиридин-2-иламино)этил]фенол,
2-[1-(4-бром-6-метоксипиридин-2-иламино)пропил]фенол,
2-[1-(6-бром-4-метилпиридин-2-иламино)-1-метилэтил]фенол,
2-[1-(4-бром-6-метоксипиридин-2-иламино)пропил]-4-фторфенол,
2-[1-(6-бромпиридин-2-иламино)пропил]-4-фторфенол,
4-фтор-2-[(6-метоксипиридин-2-иламино)метил]фенол,
4-фтор-2-[1-(6-метоксипиридин-2-иламино)этил]фенол,
4-фтор-2-[1-(6-метоксипиридин-2-иламино)пропил]фенол,
2-[(6-бром-4-метоксипиридин-2-иламино)метил]фенол,
2-[(6-бром-4-метилпиридин-2-иламино)метил]фенол,
2-[(6-хлор-4-метоксипиридин-2-иламино)метил]фенол.
Объектом изобретения является также способ получения соединений общей формулы (I).
Согласно изобретению можно получать соединения формулы (I) одним из трех способов, описанных по нижеследующей Схеме 1, и возможно дополнить одной или несколькими реакциями, такими, как описаны по Схеме 2.
Схема 1

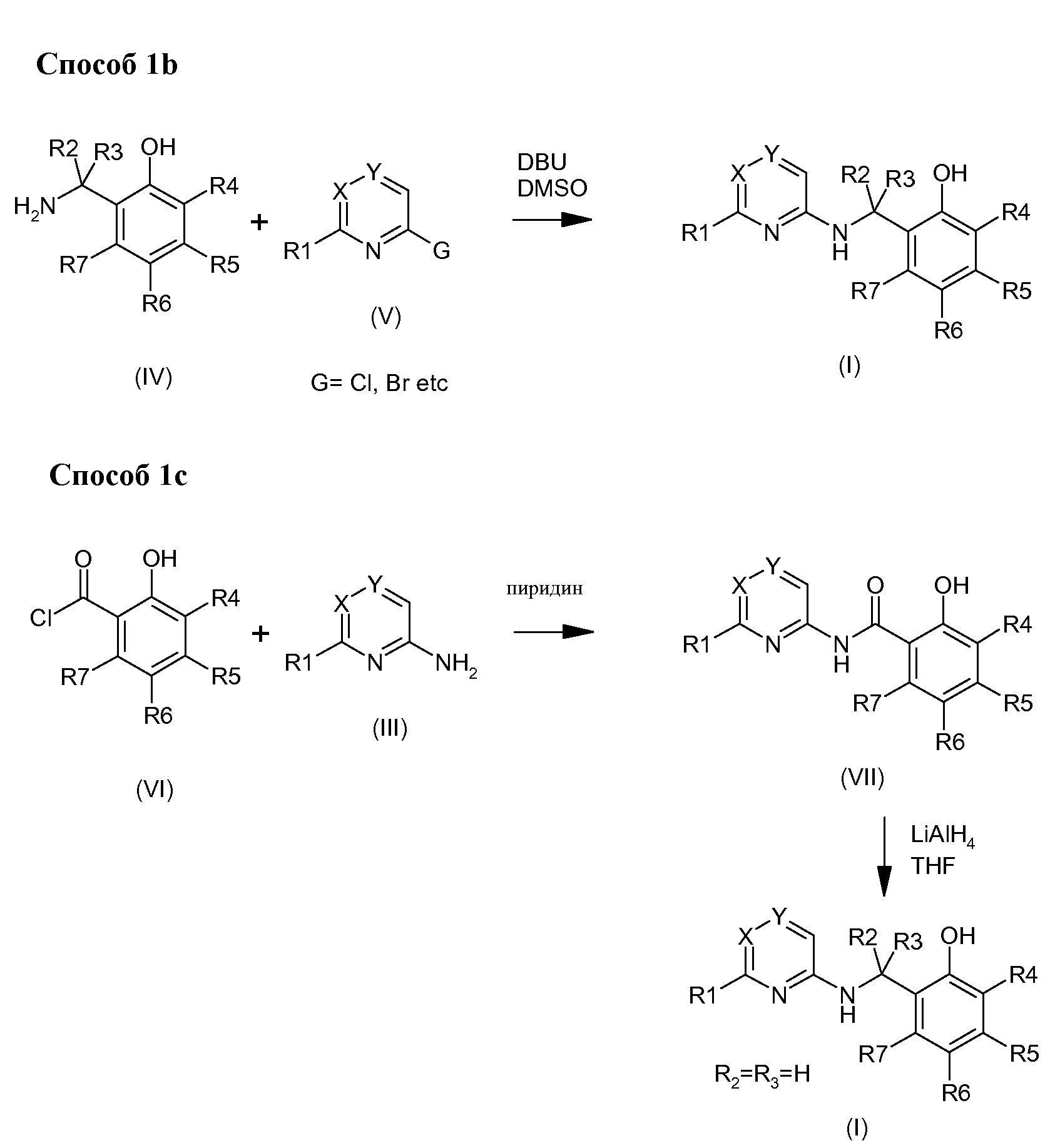
Фенольные соединения формулы (I), в которой R1, R2, R3, R4, R5, R6, R7,X и Y являются такими, как описаны выше, можно получать восстановительной реакцией аминирования между альдегидом или бензиловым кетоном (II) и амином (III) в присутствии восстановительного агента, такого как, например и без ограничения, триацетоксиборогидрид натрия Способом 1а, который иллюстрирует схема 1, и по аналогии, например, с реакциями, описанными в Org.Pro.R & D (2006) 971-1031.
Фенольные соединения формулы (I) можно получить взаимодействием между гетероциклами (V), содержащими уходящую группу и бензольные амины, в присутствии основания такого как, без ограничения, 1,8-диазабицикло[5.4.0]ундек-7-ен, например, в растворителе таком, как диметилсульфоксид, и таком, как описан в Способе 1b по Схеме 1. Под уходящей группой понимают группу, хорошо известную специалисту, такую как, без ограничения, галоген, мезилат, тозилат или трифлат.
Третий способ получения фенольных соединений формулы (I) заключается в восстановлении амидных промежуточных соединений (VII) реактивом-донором гидридов, таким как, без ограничения, гидрид лития и алюминия, как показано в Способе 1С по Схеме 1. Эти амидные производные можно получать взаимодействием между, например, без ограничения, ацилхлоридом (VI) и амином (III) в пиридине. Ацилхлориды (VI) получают из кислот технологиями, хорошо известными специалисту, например, кипячением с обратным холодильником в тионилхлориде.
Некоторые соединения, содержащие сульфоксильную (Х) или сульфоновую группу (XI) возможно получают окислением промежуточного соединения простого тиоэфира (IX), такого как описан по Схеме 2 способом 2а. Окисление можно, например и без ограничения, проводить в озоне. Промежуточное соединение простого тиоэфира (IX) можно получить из соединений (VIII), содержащих уходящую группу такую, как, без ограничения, атом хлора, путем взаимодействия с тиолатом в диметилсульфоксиде. Некоторые соединения, содержащие группу простого эфира, возможно получают взаимодействием промежуточного соединения (VIII) с соответствующим спиртом таким, например и без ограничения, как метанол, в присутствии основания, такого как гидроксид натрия, возможно при нагревании в микроволновой печи и как описано по Схеме 2 способом 2b.
Схема 2

Функциональные группы, возможно присутствующие в реакционноспособных промежуточных соединениях, используемых в способе, могут защищаться либо постоянно, либо временно защитными группами, которые обеспечивают однозначный синтез целевых соединений. Реакции защиты и снятия защиты проводят хорошо известными специалисту способами. Под временной защитной группой аминов, спиртов или карбоновых кислот понимают защитные группы, такие как описаны в “Protective Groups in Organic Chemistry”, ed McOmie J.W.F., Plenum Press, 1973, в “Protective Groups in Organic Synthesis”, 2 издание, Greene T.W. и Wuts P.G.M., ed John Wiley et Sons, 1991 и в “Protecting Groups”, Kocienski P.J., 1994, Georg Thieme Verlag.
Продукты, являющиеся объектом настоящего изобретения, обладают интересными фармакологическими свойствами; в частности, было отмечено, что они модулируют активность рецептора андрогенов.
Тесты, приведенные в экспериментальной части, иллюстрируют эту модулирующую активность рецептора андрогенов. Продукты, являющиеся объектами настоящего изобретения, обладают активностью антагонизма или агонизма, полного или частичного. Эта активность позволяет использовать продукты по изобретению в качестве лекарственных средств в медицине или ветеринарии.
Эти свойства делают продукты общей формулы (I) по настоящему изобретению пригодными в качестве лекарственных средств для лечения гормонозависимого рака, такого как рак предстательной железы или рак молочной железы, а также для лечения доброкачественной гиперплазии предстательной железы, раннего полового созревания, вирилизации, синдрома поликистоза яичников, синдрома Штайна-Левенталя, снижения либидо, эндометриоза. Соединения, обладающие активностью частичного или полного агонизма, могут, в частности, применяться для лечения таких заболеваний, как снижение мышечной массы (саркопения), мышечная атрофия, импотенция и мужское бесплодие, анормальная мужская дифференцировка (гермофродитизм), гипогонадизм, остеопороз.
Продукты общей формулы (I) по изобретению также имеют косметическое применение для гигиены тела или волос.
Продукты общей формулы (I) по изобретению также применяются в лечении гирсутизма, акне, себореи, жирной кожи андрогенной алопеции, гипертрихоза или гирсутизма, их также можно применять для получения лекарственного средства для предупреждения и/или лечения гирсутизма, андрогенной алопеции, гипертрихоза, атопического дерматита, нарушений сальных желез, таких как гиперсеборея, акне, жирная кожа или себорейный дерматит. Продукты формулы (I) можно, таким образом, использовать в дерматологии: их можно использовать индивидуально или в комбинации. Их можно, в частности, комбинировать с антибиотиками, такими как производные азелаиновой, фузидиновой кислоты, эритромицином или с производным ретиноидов, таким как третиноин, для лечения акне, или с ингибитором 5а-редуктазы, таким как (5-альфа, 17-бета)-N-1,1-диметилэтил-3-оксо-4-азаандрост-1-ен-17 карбоксамид (или Finasteride Merck, 13 издание) или с азелаиновой кислотой, или с агентом, блокирующим андрогенные рецепторы, для лечения акне, алопеции или гирсутизма, или с продуктом, стимулирующим рост волос, таким как Minoxidil для лечения алопеции.
Объектом настоящего изобретения также являются соединения формулы (I) в качестве лекарственного средства, такие как описаны выше, а также их фармацевтически приемлемые соли, фармацевтически приемлемые сольваты и/или гидраты.
В качестве иллюстраций и без ограничения, несколько примеров получения активных соединений формулы (I) приведены ниже, а также результаты биологической активности таких соединений.
ПОРЯДОК ПРОВЕДЕНИЯ ОПЫТА
Пример 1: 2-[(6-метоксипиридин-2-иламин)метил]фенол
Синтез по Схеме 1, Способ 1а
512 мг (2,41 ммоля, 1,5 эк) триацетоксиборогидрида натрия добавляют в раствор 200 мг (1,61 ммоля, 1 эк) 6-метоксипиридин-2-иламина (исходный продукт 1), 236 мг (2,41 ммоля, 1 эк) 2-гидроксибензальдегида (исходный продукт 2) в 20 мл тетрагидрофурана. Раствор перемешивают при комнатной температуре в течение 48 часов. Его выпаривают и остаток обрабатывают 100 мл дихлорметана, затем экстрагируют насыщенным водным раствором хлорида аммония. Водную фазу дважды экстрагируют дихлорметаном. Органические фазы объединяют и сушат над сульфатом натрия. Остаток подвергают хроматографии на силикагеле (этилацетат/гептан 5/95). 2-[(6-метоксипиридин-2-иламин)метил]фенол получают в форме твердого белого вещества.
Точка плавления = 103°С.
ЯМР 1H (CDCl3): 3,94 (с, 3Н); 4,52 (д, 2H, J=3,08 Гц); 4,95 (с, 1H), 6,03 (дд, 2H, J=6,2 Гц, J'=1,64 Гц); 6,85 (т, 1H, J=6,28 Гц, J'=7,4 Гц); 6,95 (д, 1H, J=9,04 Гц); 7,15-7,23 (м, 2H); 7,36 (т, 1H, J=7,92 Гц, J'=7,96 Гц); 10,21 (с, 1H).
Получение промежуточного соединения 6 аминопиридин-2-карбонитрила
340 мг (2,89 ммоля, 1 эк) цианида цинка вводят в 500 мг (2,89 ммоля, 1 эк) 6-бромпиридин-2-иламина в 10 мл диметилформамида в микроволновой трубке. Вводят 170 мг (0,147 ммоля, 0,05 эк) тетракис(трифенилфосфин)палладия. Среду нагревают до 170°С в течение 1 часа 30 минут в микроволновой печи. Добавляют 50 мл этилацетата в среду, которую фильтруют через целит. Фильтрат промывают водой и экстрагируют этилацетатом. Органические фазы объединяют и сушат над сульфатом натрия. Остаток растирают в гептане. 6-аминопиридин-2-карбонитрил получают в форме твердого вещества оранжевого цвета.
Точка плавления = 92°С.
Получение промежуточного соединения 6-этоксипиридин-2-иламина
В микроволновую трубку вводят 500мг (2,89 ммоля) 2-амин-6-бромпиридина, к которому добавляют 2 мл этанола, и 231 мг (5,78 ммоля, 2 эк) гидроксида натрия. Смесь нагревают в течение 10 часов в микроволновой печи до 170°С. Реакционную среду разбавляют 50 мл дихлорметана, затем промывают два раза 50 мл воды. Органическую фазу концентрируют досуха и остаток очищают хроматографией на кремнеземе, используя в качестве элюента гептан/этилацетат (1/1). Получают целевой продукт в виде бесцветного масла.
Получение промежуточного соединения 6-изопропоксипиридин-2-иламина
Это промежуточное соединение получают в соответствии с порядком получения, описанным в отношении 6-этоксипиридин-2-иламина, заменяя этанол изопропанолом. Получают целевой продукт в виде бесцветного масла.
Примеры 2-12
Примеры 2-12 описаны ниже в таблице 1. Соединения синтезируют в соответствии с порядком получения, описанным выше, заменяя исходные продукты 1 и 2, упомянутые в примере 1, продуктами, приведенными в таблице 1.
Пример 13: 2-[(6-бромпиразин-2-иламин)метил]фенол
Синтез по схеме 1, Способ 1b
В колбу объемом 50 мл вводят 1 г (4,2 ммоля) 2,6-дибромпиразина (исходный продукт 3), к которому добавляют 15 мл диметилсульфоксида, 638 мг (4,2 ммоля, 1 эк) 1,8-диазабицикло[5.4.0]ундек-7-ена и 1,03 г (8,4 ммоля, 2 эк) 2-гидроксибензиламина (исходный продукт 4), перемешивают в течение 2 часов при комнатной температуре. Реакционную среду разводят 50 мл этилацетата, промывают 50 мл насыщенного раствора хлорида аммония, затем два раза 50 мл воды. Органические фазы сушат над сульфатом магния, фильтруют и концентрируют досуха.
Остаток очищают хроматографией на кремнеземе, используя в качестве элюента смесь гептан/этилацетат (8/2). 2-[(6-бромпиразин-2-иламин)метил]фенол получают в виде белого твердого вещества.
Точка плавления = 168°С.
ЯМР 1H (DMSO): 4,36 (д, 1H, J=5,3 Гц); 6,74-6,76 (м, 1H); 6,83 (дд, 1H); 7,07-7,11 (м, 1H); 7,17 (дд, 1H); 7,75 (с, 1H); 7,80-7,83 (м, 1H); 7,96 (с, 1H); 9,61 (с, 1H).
Примеры 14-18
Примеры 14-18 описаны ниже в таблице 2. Соединения синтезируют в соответствии с порядком получения, описанным выше, заменяя исходные продукты 3 и 4, упомянутые в примере 13, продуктами, приведенными в таблице 2.
Пример 19: 2-[(6-метоксипиразин-2-иламин)метил]фенол
Синтез по схеме 2, Способ 2b
В микроволновую печь вводят 363 мг (1,29 ммоля) 2-[(6-бромпиразин-2-иламин)метил]фенола, полученного, как описано выше в примере 12, к которому добавляют 3 мл метанола и 103 мг (2,58 ммоля, 2 эк) гидроксида натрия. Реакционную среду нагревают в течение 30 минут в микроволновой печи при 150°С, затем разбавляют 50 мл этилацетата. Нейтрализуют раствором хлорида аммония до рН=7, отстаивают, органическую фазу промывают дважды 50 мл воды. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток очищают хроматографией на кремнеземе, используя в качестве элюента гептан/этилацетат (7/3). 2-[(6-метоксипиразин-2-иламин)метил]фенол получают в виде твердого белого вещества.
Точка плавления = 158°С.
ЯМР 1H (DMSO) 3,78 (с, 1H); 4,40 (д, 2H, J=5,2 Гц); 6,73 (т, 1H, J=7,4 Гц); 6,81 (д, 1H, J=8 Гц); 7,05 (т, 1H, J=7,8 Гц); 7,19 (д, 1H, J=7,4); 7,26 (с, 1H); 7,31-7,32 (м, 1H); 7,50 (с, 1H); 9,55 (с, 1H).
Пример 20: 2-[(2-метоксипиримидин-4-иламин)метил]фенол
Это соединение получают в соответствии с порядком получения, описанным в примере 19, из 2-[(2-хлорпиримидин-4-иламин)метил]фенола. 2-[(2-метоксипиримидин-4-иламин)метил]фенол получают в виде твердого белого вещества.
Точка плавления = 161°С.
ЯМР 1H (CD3OD) 3,90 (с, 3H); 4,53 (с, 3H); 6,15 (д, 2H, J=6,0 Гц); 6,77-6,81 (м, 2H); 7,07-7,12 (м, 1H); 7,21 (д, 1H, J=7,4 Гц); 7,78 (с, 1H).
Пример 21: 2-[(2-метокси-6-метилпиримидин-4-иламин)метил]фенол
Это соединение получают в соответствии с порядком получения, описанным в примере 19, из 2-[(2-хлор-6-метилпиримидин-4-иламин)метил]фенола.
ЯМР 1H (DMSO) 2,12 (с, 3H); 3,74 (с, 3H); 4,38 (м, 2H); 6,04 (с, 1H); 6,73 (т, 1H, J=7,4 Гц); 6,80 (д, 1H, J=8,0 Гц); 7,06 (т, 1H, J=7,7 Гц); 7,11 (д, 1H, J=7,3 Гц); 7,65 (с, 1H); 9,71 (с, 1H).
Пример 22: 2-[(6-метилсульфанилпиридин-2-иламин)метил]фенол
Синтез по схеме 2, Способ 2а
В микроволновую печь вводят 300 мг (1,28 ммоля) 2-[(6-хлорпиридин-2-иламин)метил]фенола, к которому добавляют 5 мл диметилсульфоксида и 448 мг (6,4 ммоля, 5 эк) метантиолата натрия. Нагревают в течение 16 часов до 90°С. Реакционную среду разбавляют 50 мл этилацетата, затем промывают 50 мл насыщенного раствора хлорида аммония, затем дважды 50 мл дистиллированной воды. Органическую фазу сушат над сульфатом магния, затем фильтруют и концентрируют досуха. Остаток очищают хроматографией на 40 г кремнезема, используя в качестве элюента гептан/этилацетат (7/3). Полученный продукт растворяют в этилацетате, добавляют гептан до появления мутности, охлаждают до 0°С, фильтруют. Получают 2-[(6-метилсульфанилпиридин-2-иламин)метил]фенол в виде твердого белого вещества.
Точка плавления = 61°С.
ЯМР 1H (DMSO) 2,38 (с, 3H); 4,38 (д, 2H, J=5,6 Гц); 6,21 (д, 1H, J=8,2 Гц); 6,34 (д, 1H, J=7,4 Гц); 6,72 (т, 1H, 7,3 Гц); 6,93-6,96 (м, 1H); 7,04 (т, 1H, J=7,7 Гц); 7,15 (д, 1H, J=7,1 Гц); 7,23 (т, 1H, J=7,6 Гц); 9,65 (с, 1H).
Пример 23: 2-[(6-метансульфинилпиридин-2-иламин)метил]фенол
Смешивают 160 мг (0,66 ммоля) 2-[(6-метансульфанилпиридин-2-иламин)метил]фенола и 406 мг (0,66 ммоля, 1 эк) оксона в 20 мл диоксана. Перемешивают в течение 1 часа при комнатной температуре, после чего реакционную среду нагревают до 90°С в течение 4 часов. После охлаждения до комнатной температуры реакционную среду разбавляют 50 мл этилацетата, затем промывают дважды 50 мл воды. Органическую фазу сушат над сульфатом магния, затем фильтруют и концентрируют досуха. Остаток очищают хроматографией на кремнеземе, используя в качестве элюента смесь гептан/этилацетат (1/1). 2-[(6-метансульфинилпиридин-2-иламин)метил]фенол получают в виде твердого белого вещества.
Точка плавления = 133°С.
ЯМР 1H (CDCl3) 2,89 (с, 3H); 4,51 (д, 2H, J=6,2 Гц); 5,32-5,33 (м, 1H); 6,5 (дд, 1H); 6,87-6,95 (м, 2H); 7,19-7,28 (м, 2H); 7,30-7,59 (м, 1H); 7,62 (т, 1H, J=7,3 Гц); 9,28 (с, 1H).
Пример 24: 2-[(6-метансульфонилпиридин-2-иламин)метил]фенол
Смешивают 80 мг (0,33 ммоля) 2-[(6-метансульфанилпиридин-2-иламин)метил]фенола и 406 мг (0,66 ммоля, 2 эк) оксона в 20 мл диоксана и нагревают в течение 16 часов до 90°С. Реакционную среду разбавляют 50 мл этилацетата, затем промывают дважды 50 мл воды. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток очищают хроматографией на кремнеземе, элюируя смесью гептан/AcOEt (1/1). 2-[(6-метансульфонилпиридин-2-иламин)метил]фенол получают в виде твердого светло-зеленого вещества.
ЯМР 1H (CDCl3) 3,12 (с, 3H); 5,32-5,33 (м, 1H); 6,58 (д, 1H, J=7,9 Гц); 6,79-6,83 (м, 1H); 6,87 (д, 1H, J=7,4 Гц); 7,3 (д, 1H, J=6,6 Гц); 7,5 (т, 1H, J=7,2 Гц); 8,56 (с, 1H).
Пример 25: 2-[(6-метоксипиридин-2-иламин)метил]-6-метилфенол
Синтез по схеме 1, Способ 1с
80 мг (2,1 ммоля, 6 эк) гидрида алюминия и лития вводят небольшими фракциями в смесь 90 мг (0,35 ммоля) 2-гидрокси-N-(6-метоксипиридин-2-ил)-3-метилбензамида в 10 мл диоксана. Реакционную среду нагревают до 80°С в течение 16 часов. Вводят еще 80 мг (2,1 ммоля, 6 эк) гидрида алюминия и лития и нагревают до 80°С в течение 4 часов. Реакционную среду разбавляют 50 мл этилацетата, промывают 50 мл насыщенного раствора хлорида аммония, затем дважды 50 мл воды. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха. Остаток очищают хроматографией на кремнеземе, элюируя смесью гептан/этилацетат (1/1). 2-[(6-метоксипиридин-2-иламин)метил]-6-метилфенол получают в виде твердого белого вещества.
ЯМР 1H (CDCl3) 2,19 (с, 3H); 3,89 (с, 3H); 4,46 (д, 2H, J=6,7 Гц); 4,75 (с, 1H); 5,93-5,97 (м, 2H); 6,68 (т, 1H, J=7,4 Гц); 6,92 (д, 1H, J=7,5 Гц); 7,0 (д, 1H, J=7,4 Гц); 7,27 (т, 1H, J=7,9 Гц), 9,66 (с, 1H).
Получение промежуточного соединения 2-гидрокси-N-(6-метоксипиридин-2-ил)-3-метилбензамида
10 мл тионилхлорида вводят в 1,47 г (16,11 ммоля) 2-гидрокси-3-метилбензойной кислоты и реакционную смесь нагревают до 90°С в течение 2 часов. Реакционную среду концентрируют досуха, азеотропируя толуолом. Затем остаток растворяют в 10 мл пиридина, к которому добавляют по каплям 600 мг (4,83 ммоля, 1 эк) 2-метоксипиридин-6-амина и перемешивают при комнатной температуре в течение 1 часа 30 мин. Вводят 30 мл гидроксида натрия 1М (19,34 ммоля, 4 эк) и нагревают до 60°С в течение 16 часов. Реакционную среду разбавляют 100 мл этилацетата, водную фазу экстрагируют и промывают 50 мл этилацетата. Водную фазу затем подкисляют, добавляя по каплям HCl 37% при 0°С до рН=4. Органические фазы экстрагируют два раза по 50 мл этилацетата, затем промывают дважды 50 мл воды. Органические фазы концентрируют досуха и остаток очищают хроматографией на кремнеземе, элюируя смесью гептан/этилацетат (1/1). 2-гидрокси-N-(6-метоксипиридин-2-ил)-3-метилбензамид получают в виде твердого белого вещества.
ЯМР 1H (CDCl3) 2,23 (с, 3H); 3,84 (с, 3H); 6,48 (д, 1H, J=8 Гц); 6,78 (т, 1H, J=7,7 Гц); 7,26 (д, 1H, J=7,3 Гц); 7,38 (д, 1H, J=8 Гц); 7,58 (т, 1H, J=8 Гц); 7,76 (д, 1H, J=7,7 Гц); 8,31 (с, 1H); 12,12 (с, 1H).
Все спектры ЯМР (ядерный магнитный резонанс) соответствуют предложенным структурам. Химические перемещения выражены в миллионной части. Внутренним стандартом является тетраметилсилан. Используют следующие аббревиатуры: CDCl3 = дейтерированный хлороформ, DMSO = дейтерированный диметилсульфоксид, CD3OD = дейтерированный метанол.
Пример 26: Биологические тесты
Соединения по изобретению обладают свойствами ингибиторов рецепторов типа AR. Эта ингибиторная активность рецепторов AR измеряется в тесте на трансактивацию при помощи констант диссоциации KdR (неактивная), KdA (активная) и Kdapp (явная) способом, изложенным в J.Molecular Biology (1965), 12(1), 88-118, Monod J. и другие.
В рамках изобретения под ингибитором рецепторов типа AR понимают любое соединение, которое имеет константу диссоциации Kdapp меньше или равную 1 мкм и отношение KdR/KdA <10 в тесте на трансактивацию.
Предпочтительные соединения по настоящему изобретению имеют константу диссоциации меньше или равную 500 нМ и преимущественно меньше или равную 100 нМ.
Тест на трансактивацию проводят с использованием линии клеток PALM (PC3 Androgene receptor Luciferase MMTV), которая является устойчивым трансфектантом, содержащим плазмиды PMMTV-neo-Luc (ген-репортер) и pSG5puro-AR.
В этом исследовании определяют сродство каждого продукта для 2 состояний рецепторов (KdR и KdA), а также явную Kd (KdApp). Эта константа является результирующей обеих Kd, но также зависит от первоначального равновесия рецептора между активным состоянием и неактивным состоянием (L0) и от степени его экспрессии. Ее определяют по следующей формуле:
1/KdApp=(L0/(1+L0))×(1/KdR)+(1/(1+L0))×(1/KdA).
Для определения этих констант «перекрестные кривые» тестируемого продукта по сравнению с контрольным агонистом, метилтриенолоном, выполняют в 96-луночном планшете. Тестируемый продукт используют в 10 концентрациях, а контрольный агонист используют в 7 концентрациях.
В качестве иллюстрации, KdApp 40 нМ получают для соединения (1), KdApp 2 нМ получают для соединения (2), KdApp 8 нМ получают для соединения (19), KdApp 1000 нМ получают для соединения (18), KdApp 200 нМ получают для соединения (4).
Реферат
Изобретение относится к соединениям структурной формулы (I), которые могут быть использованы для лечения заболеваний, опосредованных андрогенным рецептором. В формуле (I) Rобозначает (С)алкил, (С)алкилокси, -S(O)-(C)алкил, (С)фторалкил, CN или галоген, Rи Rявляются одинаковыми или разными и обозначают атом водорода или (С)алкил, R, R, R, Rявляются одинаковыми или разными и обозначают атом водорода или галоген, X обозначает СН или N, Y обозначает либо атом азота, либо атом углерода, замещенный (C)алкилом, (C)алкилокси, (C)фторалкилом, атомом водорода или галогена, m равен 0, 1 или 2. Изобретение также относится к применению соединений для получения лекарственного средства для профилактики и/или лечения гирсутизма, андрогенной алопеции, гипертрихоза, атопического дерматита, нарушений сальных желез, таких как гиперсеборея, акне, жирная кожа или себорейный дерматит. 3 н. и 5 з.п. ф-лы, 2 табл., 26 пр.
Формула

в которой:
- R1 обозначает (С2-6)алкил, (С1-6)алкилокси, -S(O)m-(C1-6)алкил, (С1-6)фторалкил, CN или галоген,
- R2 и R3 являются одинаковыми или разными и обозначают атом водорода или (С1-9)алкил,
- R4, R5, R6, R7 являются одинаковыми или разными и обозначают атом водорода или галоген,
- X обозначает СН или N,
- Y обозначает либо атом азота, либо атом углерода, замещенный (C1-6)алкилом, (C1-6)алкилокси, (C1-6)фторалкилом, атомом водорода или галогена,
- m равен 0, 1 или 2,
а также их фармацевтически приемлемые соли.
- X обозначает атом углерода и Y обозначает атом углерода, замещенный метильной группой, CF3, атомом водорода, атомом галогена или ОСН3 группой.
2-[(6-метоксипиридин-2-иламино)метил]фенол
2-[(6-бромпиридин-2-иламино)метил]фенол
2-[(6-бромпиридин-2-иламино)метил]-4-фторфенол
6-(2-гидроксибензиламино)пиридин-2-карбонитрил
2-[1-(6-метоксипиридин-2-иламино)этил]фенол
2-[(6-трифторметилпиридин-2-иламино)метил]фенол
2-[(6-хлорпиридин-2-иламино)метил]фенол
2-[(6-этилпиридин-2-иламино)метил]фенол
2-[(6-этоксипиридин-2-иламино)метил]фенол
2-[(6-изопропоксипиридин-2-иламино)метил]фенол
5-хлор-2-[(6-метоксипиридин-2-иламино)метил]фенол
2-[(2-трифторметилпиримидин-4-иламино)метил]фенол
2-[(6-бромпиразин-2-иламино)метил]фенол
2-[(2-хлорпиримидин-4-иламино)метил]фенол
2-[(2-бромпиримидин-4-иламино)метил]фенол
2-[(2-хлор-6-метилпиримидин-4-иламино)метил]фенол
2-[(6-хлор-4-трифторметилпиридин-2-иламино)метил]фенол
2-[(6-хлор-4-метилпиридин-2-иламино)метил]фенол
2-[(6-метоксипиразин-2-иламино)метил]фенол
2-[(2-метоксипиримидин-4-иламино)метил]фенол
2-[(2-метокси-6-метилпиримидин-4-иламино)метил]фенол
2-[(6-метилсульфанилпиридин-2-иламино)метил]фенол
2-[(6-метансульфинилпиридин-2-иламино)метил]фенол
2-[(6-метансульфонилпиридин-2-иламино)метил]фенол
2-[(6-метоксипиридин-2-иламино)метил]-6-метилфенол.

Комментарии