Выделение вируса, родственного парвовирусу-2 собак, от енота - RU2565538C2
Код документа: RU2565538C2
Чертежи














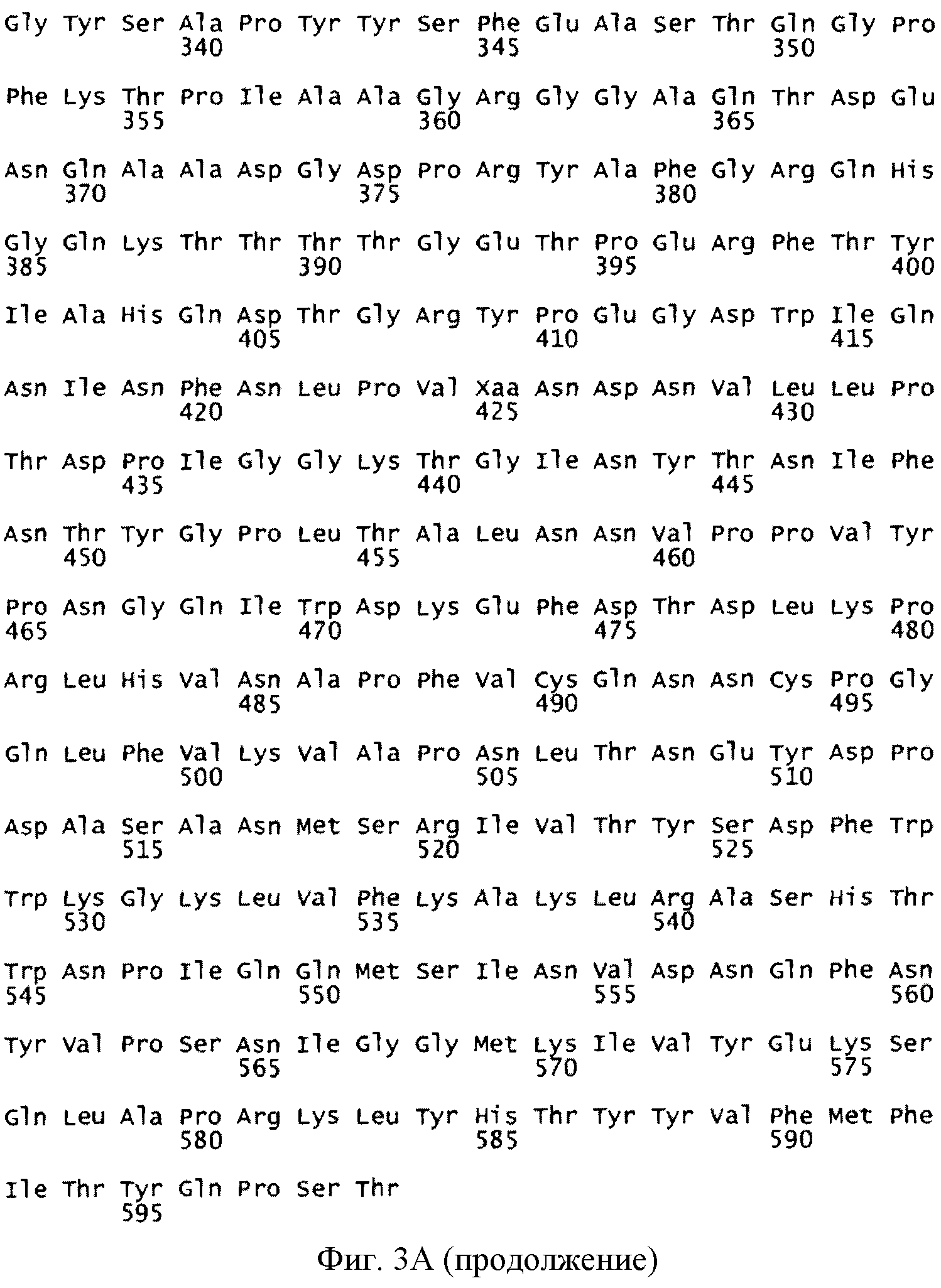








Описание
Эта заявка включает в качестве Списка последовательностей полное содержание сопроводительного текстового файла «PCT Sequence Listing_ST25.txt», созданного 14 октября 2010, включающего 18268 байтов, которое тем самым включено посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники
Настоящее изобретение в целом относится к улучшенным вакцинам против вирусов вроде парвовируса собак. В частности, настоящим изобретением обеспечиваются вакцины, подходящие для щенков, которые основаны на новом парвовирусе, выделенном от енота.
Предпосылки создания изобретения
Парвовирус собак (CPV) является в основном энтеральным патогеном, который инфицирует собак, особенно молодых собак. Парвовирусное инфекционное заболевание характеризуется острой диарей, лихорадкой и лейкопенией у собак и щенков возрастом старше 4-5 недель и заболеванием миокарда у щенков более младшего возраста. Коэффициент смертности в результате этого заболевания у невакцинированных собак является очень высоким. Хотя существуют вакцины против CPV, из-за того, что CPV является содержащим одноцепочечную ДНК вирусом и обладает чрезвычайной способностью к мутированию, вирус демонстрирует поразительную способность варьировать в антигенном отношении (Parrish and Kawaoka 2005) и, тем самым, уходить от иммунной защиты, которую дают вакцины. Поэтому необходим постоянный контроль антигенного типа и гепотипа циркулирующих вирусов, и корректировка вакцинных компонентов соответственно.
Новорожденные щенки приобретают иммунитеты против таких заболеваний, как CPV инфекционное заболевание, при грудном вскармливании от своей матери, особенно во время первых двух дней жизни. Вскармливаемый грудью щенок получает молозиво в молоке, которое выделяется сначала, и щенку передаются антитела в молозиве. В случае собак, а также многих других млекопитающих, иммунитет, который придает молозиво, иногда утрачивает свое действие в возрасте приблизительно пяти недель.
Особенно сложной задачей при вакцинировании щенков является введение вакцин в соответствии с периодом времени, который обеспечивает защиту, накладываемую на обеспечиваемую материнскими антителами защиту, и начинается, когда материнские антитела идут на убыль. В настоящее время схемы вакцинации щенков обычно начинаются в возрасте приблизительно 6 недель, и бустер-инъекции назначают приблизительно каждые 3 недели, например, в 9, 12 и 15 недель, после этого. Однако, чтобы эта схема обеспечила полную защиту, первая доза вакцины должна сразу вызывать протективный иммунный ответ. Это является совершенно нереальным вследствие недоразвития иммунной системы у щенков и периода времени, требуемого для установки иммунного ответа. Полная защита обычно не развивается до прохождения всего курса вакцинаций. Смертность вследствие CPV в зависимости от возраста представлена на фиг. 1, которая показывает, что максимальное значение смертности вследствие CPV наблюдается до того, как могут быть завершены протоколы вакцинирования.
Простым решением могло бы быть начинать программу вакцинации даже раньше, например, в 2-3 недель. Однако это будет бесполезно, поскольку в случае щенков, матери которых были вакцинированы штаммом вируса с теми же антигенными детерминантами или иначе подвергнуты воздействию такого штамма, материнские антитела, переданные щенку, будут нейтрализовать вирусы в вакцине, тем самым не позволяя собственной иммунной системе щенка отвечать на этот вирус.
Другой сложной задачей в ветеринарии является лечение рака, например, у собак. Существует множество недостатков в существующих средствах для лечения рака, особенно в случае старых собак. Введение онколитических парвовирусов для уничтожения раковых клеток является очень перспективным в качестве эффективного лечения рака (Rommelaere et al, Cytokine & Growth Factor Reviews 21: 185-195, 2010; и патент США с № 7179456, выданный Rommelaere и др., полное содержание которых включено сюда посредством ссылки) и могло бы применяться для собак. Однако наличие уже существующих антител против парвовирусов (например, в результате вакцинации) будет делать этот способ неэффективным, поскольку парвовирус будет нейтрализоваться существующими антителами. Кроме того, генная терапия для собак редко предпринимается в настоящее время, но могла бы быть многообещающим способом лечения нескольких нарушений в случае идентификации подходящих векторов, являющихся нуклеиновыми кислотами.
До сих пор известный уровень техники не решил эти задачи.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение основывается на обнаружении новых парвовирусов (выделенных от енотов в США). Анализы нуклеотидных и аминокислотных последовательностей показали, что эти вирусы представляют собой уникальный вариант парвовируса типа 2 собак (CPV-2). Этот новый CPV-2, названный «AR08071304» (и упоминаемый здесь как парвовирус энотов, «RPV», «08071304» и «парвовирус-2 (от енота)» и т.д.), применим в качестве компонента вакцин против парвовируса собак. В частности, этот вариант применим в качестве компонента вакцин для очень молодых собак, например, щенков, все еще вскармливаемых молоком матери, или тех, кто находится в процессе прекращения естественного вскармливания, и, следовательно, решает задачи, как обеспечить соответствующие протоколы вакцинирования щенков. Этот парвовирус енотов не будет полностью нейтрализоваться существующими у собак антителами против парвовируса-2 собак. Кроме того, этот парвовирус енотов можно использовать в качестве онколитического агента и в качестве вектора (носителя, переносчика) для генной терапии, благодаря отсутствию нейтрализации с помощью уже существующих антител у реципиента или в организме хозяина, например, собаки.
Вариант вируса имеет близкую гомологию с численно преобладающими вирусами CPV-2, циркулирующими в настоящее время. Поэтому введение вакцины, содержащей новый вариант, вероятно, вызовет иммунный ответ, который также даст защиту от известных циркулирующих вирусов CPV-2. Однако существует некоторые антигенные различия между новым изолятом и известными вирусами CPV-2, воздействию которых ощенившаяся собака, вероятно, подвергалась (например, через посредство приготовления вакцины или предшествующего воздействия CPV). В частности, аминокислотным остатком в положении 232 вариантного капсидного белка, VP-2, является Thr (кодируемый ACA), а его аминокислотным остатком в положении 300 является Asp (кодируемый GAT). Эти различия в последовательности являются достаточными, чтобы дать в результате уникальный иммунореактивный профиль для варианта. Поэтому, маловероятно, что материнские антитела, переданные щенку (например, от ранее вакцинированной/подвергнутой воздействию матери), будут полностью инактивировать новый вирус, когда его введут щенку в качестве вакцины. В результате, иммунный ответ будет вызываться собственной иммунной системой щенка при подвергании воздействию RPV настоящего изобретения через посредство вакцинации, и иммунный ответ, вероятно, обеспечит широкую защиту от циркулирующих в настоящее время CPV вообще. Более того, этот парвовирус енотов, как представляется, является природной химерой парвовирусов плотоядных животных. Хотя нуклеотидная последовательность, кодирующая белок VP-2 RPV, имеет наибольший показатель общей гомологии (3309) с парвовирусом-2a собак (CPV-15), она также имеет высокую степень гомологии с вирусом панлейкопении у кошек, ранее выделенными парвовирусами енотов и вирусом энтерита у норок. Этот тип химерной последовательности не отмечался ранее в последовательностях парвовирусов собак или кошек, хотя схожие парвовирусы, как представляется в настоящее время, циркулируют в популяциях енотов в США (смотрите раздел «Примеры» ниже). Этот RPV обеспечит широкую иммунную защиту у нескольких видов плотоядных животных и, следовательно, подходит для применения в качестве вакцины против широкого круга парвовирусов. В редких, необычных случаях собака или кошка может умереть от инфицирования гетерологичным живым, не аттенуированным парвовирусом плотоядных животных; однако преимущества применения RPV настоящего изобретения, описываемого здесь, значительно перевешивают этот минимальный риск.
Хотя настоящее изобретение не основывается на какой-либо эволюционной модели или теории, одной интересной интерпретацией раскрытых здесь генетических данных является то, что RPV настоящего изобретения может являться предком нынешних парвовирусов собак и кошек. В вирусологическом сообществе ведутся дебаты в отношении происхождения парвовируса-2 собак, и RPV настоящего изобретения мог бы быть, в пределах границ этой теории, «живым ископаемым» парвовируса-2 собак. В любом случае описываемый здесь RPV кодирует уникальный белок VP-2, который включает мозаику из аминокислотных последовательностей парвовирусов кошек и собак. Таким образом, RPV настоящего изобретения является кандидатом на то, чтобы быть «предком» парвовирусов как кошек, так и собак, т.е. этих более новых парвовирусов плотоядных животных, произошедших от этого RPV. Альтернативно, RPV настоящего изобретения может представлять собой химерное промежуточное звено на «перекрестке» эволюции парвовирусов. В любом случае этот RPV обеспечивает средство для перекрестной иммунизации против гетерологичных парвовирусов, которого нет в распоряжении в настоящее время в противном случае при использовании любого из более специализированных для видов парвовирусов собак и кошек. Кроме того, RPV настоящего изобретения слабо агглютинирует свиные эритроциты (трансферрин); не разделяет некоторые важные эпитопы (например, аминокислотный остаток в положении 300 последовательности белка VP-2); и плохо растет в линиях клеток почки кошек (смотрите раздел «Примеры» ниже). В своей совокупности эти признаки соответствуют вирусу, который либо предшествует, либо является ранним промежуточным звеном в эволюционном каскаде парвовирусов собак и кошек.
Настоящим изобретением обеспечивается парвовирус, включающий характеристики парвовируса-2 (от енота) с № депонирования в ATCC.
Кроме того, настоящим изобретением обеспечиваются вакцины, включающие парвовирус, включающий характеристики парвовируса-2 (от енота) с № депонирования в ATCC. В одном варианте осуществления вакцина, кроме того, включает, один или более антигенных компонентов, выбираемых из группы, состоящей из вируса собачьей чумы (CDV), собачьего аденовируса типа 2, вируса парагриппа у собак, коронавируса собак, герпесвируса собак, ротавируса собак, одного или нескольких сероваров Leptospira и парвовируса-2 собак, в котором аминокислотой в положении 232 белка VP-2 не является Thr, а аминокислотой в положении 300 белка VP-2 не является Asp. В некоторых вариантах осуществления один или более сероваров Leptospira выбирают из группы, состоящей из Leptospira interrogans серовара canicolar, Leptospira interrogans серовара icterohaemorrhagiae, Leptospira interrogans серовара pomona и Leptospira kirschneri серовара grippotyphosa.
Настоящим изобретением также обеспечиваются выделенные нуклеиновые кислоты, включающие нуклеотидную последовательность SEQ ID NO: 1 или часть SEQ ID NO: 1; причем часть SEQ ID NO: 1 кодирует антигенную область белка VP-2, включающую аминокислотный остаток 232 SEQ ID NO: 3, аминокислотный остаток 300 SEQ ID NO: 3 или как аминокислотный остаток 232, так и аминокислотный остаток 300 SEQ ID NO: 3. В других вариантах осуществления настоящим изобретением обеспечиваются иммуногенные композиции, включающие эту нуклеиновую кислоту, причем нуклеиновая кислота присутствует в вирионе убитого или аттенуированного парвовируса или парвовирусе енотов низкократного пассирования (RPV). В некоторых вариантах осуществления вирион убитого парвовируса включает характеристики парвовируса-2 (от енота) с № депонирования в ATCC. В других вариантах осуществления вирион аттенуированного парвовируса присутствует в твердом носителе, подходящем для супралингвального растворения. В еще одних вариантах осуществления иммуногенная композиция подходит для подкожного введения.
Настоящее изобретение также относится к способу вызова у животного иммунного ответа против парвовирусной инфекции. Способ включает стадию введения животному иммуногенной композиции, включающей нуклеиновую кислоту, включающую нуклеотидную последовательность SEQ ID NO: 1 или часть SEQ ID NO: 1; причем указанная часть SEQ ID NO: 1 кодирует антигенную область белка VP-2, включающую аминокислотный остаток 232 SEQ ID NO: 3, аминокислотный остаток 300 SEQ ID NO: 3 или как аминокислотный остаток 232, так и аминокислотный остаток 300 SEQ ID NO: 3. В некоторых вариантах осуществления нуклеиновая кислота присутствует в вирионе убитого или аттенуированного парвовируса или RPV низкократного пассирования. В некоторых вариантах осуществления вирион убитого парвовируса включает характеристики парвовируса-2 (от енота) с № депонирования в ATCC. В некоторых вариантах осуществления вирион аттенуированного парвовируса присутствует в твердом носителе, подходящем для супралингвального растворения, и в некоторых вариантах осуществления животным является щенок. В еще одних вариантах осуществления иммуногенная композиция подходит для подкожного введения.
Настоящее изобретение, кроме того, относится к в значительной степени очищенному белку VP-2 парвовируса, который имеет остаток треонина в аминокислотном положении 232 и остаток аспарагиновой кислоты в аминокислотном положении 300; или его антигенный фрагмент, причем указанный антигенный фрагмент включает по меньшей мере часть указанного белка VP-2, которая имеет остаток треонина в аминокислотном положении 232 или остаток аспарагиновой кислоты в аминокислотном положении 300; или как остаток треонина в аминокислотном положении 232, так и остаток аспарагиновой кислоты в аминокислотном положении 300. В некоторых вариантах осуществления в значительной степени очищенный белок VP-2 парвовируса включает аминокислотную последовательность SEQ ID NO: 3.
Настоящим изобретением также обеспечиваются экспрессионные векторы, включающие нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 3 или часть SEQ ID NO: 3; причем указанная часть SEQ ID NO: 3 является антигенной областью белка VP-2, включающей аминокислотный остаток 232 SEQ ID NO: 3, аминокислотный остаток 300 SEQ ID NO: 3 или как аминокислотный остаток 232, так и аминокислотный остаток 300 SEQ ID NO: 3. В некоторых вариантах осуществления экспрессионным вектором является рекомбинантный вирусный экспрессионный вектор. В других вариантах осуществления рекомбинантным вирусным экспрессионным вектором является экспрессионный вектор на основе поксвируса канареек.
Настоящим изобретением также обеспечивается способ уничтожения опухолевых клеток у млекопитающего. Способы включают стадию введения млекопитающему композиции, включающей парвовирус, включающий характеристики парвовируса-2 (от енота) с № депонирования в ATCC, в количестве, достаточном для инфицирования и уничтожения указанных опухолевых клеток у млекопитающего. В некоторых вариантах осуществления млекопитающим является собака, которая является серопозитивной по парвовирусу-2 собак. В других вариантах осуществления способ выполняют с использованием способа введения, выбираемого из группы, состоящей из внутривенного и внутриопухолевого введений. В еще одних вариантах осуществления парвовирусом является парвовирус низкократного пассирования.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Распределение генотипов CPV-2 и числа летальных исходов CPV инфекционного заболевания относительно возраста собаки.
Фиг. 2A и B. Последовательности нуклеиновых кислот, кодирующие белки VP-2 нового варианта CPV-2 - AR08071304. A, более длинный вариант нуклеотидной последовательности (SEQ ID NO: 1), который кодирует белок из 599 аминокислот. Внутренний стоп-кодон, расположенный в положениях нуклеотидов 1753-1755, выделен полужирным шрифтом и подчеркнут. B, более короткий вариант нуклеотидной последовательности (SEQ ID NO: 2), который кодирует белок из 584 аминокислот. И в A, и в B подчеркнуты нуклеотиды, кодирующие Thr в положении 232 (нуклеотиды 694-696), и нуклеотиды, кодирующие Asp в положении 300 (нуклеотиды 898-900).
Фиг. 3A и B. Аминокислотная последовательность белка VP-2 нового варианта CPV-2 - AR08071304. A, (SEQ ID NO: 3), является более длинным вариантом белка в случае трансляции всех 599 кодируемых аминокислот; B, (SEQ ID NO: 4), является более коротким вариантом белка в случае возникновения терминации в стоп-кодоне. Положения 232 и 300 аминокислот, которыми являются Thr и Asp, соответственно в обоих белках, заключены в рамку.
Фиг. 4A-C. Схематические изображения: A, ДНК парвовируса енота (RPV); B, расположение открытых рамок считывания (ORF) RPV; C, связывание RPV с эукариотическими клетками.
Фиг. 5A и B. A, Схематическое изображение связывания парвовируса енота с рецептором трансферрина на клеточной поверхности (TFR); B, схема общей стратегии для приготовления автономных парвовирусных векторов.
Фиг. 6. Родство только что выделенного парвовируса енота с другими схожими вирусами.
Фиг. 7. Аминокислоты в важных эпитопах белка VP-2 только что выделенного парвовируса енота.
Фиг. 8. Филогенетическое дерево, сравнивающее белок VP-2 только что выделенного парвовируса енота с таковыми других парвовирусов плотоядных животных. CPV = парвовирус собак; RPV = парвовирус енота; FPV = парвовирус кошек; PV = парвовирус; MEV = вирус энтерита у норок; FPL = вирус панлейкопении у кошек; Aleu = парвовирус Алеутской болезни у норок; MVC = «минут-вирус» собак.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вакцине и виротерапевтическим препаратам, включающим аттенуированные формы нового варианта парвовируса, выделенного от инфицированного енота. В то время как вакцинные препараты подходят для введения широкому ряду плотоядных животных (например, собакам, кошкам, норке, еноту, членам семейств Canidae (собачьи), Procyonidea, Mustelidae и Viveridae, и т.д.), они, в частности, применимы для введения очень молодым собакам (щенкам). Это обусловлено тем, что новый вариант отличается от используемых в современных вакцинах вариантов CPV в степени, достаточной для того, чтобы сделать маловероятным распознавание и инактивацию вируса материнскими антителами (выработанными в ответ на введение вакцины и переданными щенкам при вскармливании грудью). Так же, в случае других применений для собак, в том числе взрослых собак, (например, в качестве терапии рака и в качестве вектора для генной терапии), RPV будет обходить уже существующие антитела, образованные в результате предшествующих вакцинаций, и, следовательно, ускользать от немедленного иммуноклиренса. А именно, в белке VP-2 изолята от енота аминокислотным остатком в положении 232 является Thr (кодируемый ACA), а остатком в положении 300 является Asp (кодируемый GAT). Таким образом, эти два аминокислотных остатка в RPV отличны от таковых белков VP-2 всех других известных изолятов CPV и могут быть ответственны за уникальные свойства (например, реактивность с антителами, смотрите раздел «Примеры» ниже) этого RPV. Вследствие аттенуации вирус не будет вызывать заболевание у реципиентов вакцины. С другой стороны, новый изолят схож с циркулирующими в настоящее время вирусами (например, идентичность аминокислотной последовательности составляет ~99% для белка VP-2) в степени, достаточной для того, чтобы после введения вируса молодому животному был вероятен вызов выработки антител, по меньшей мере некоторые из которых будут обладать перекрестной реактивностью с известными циркулирующими вирусами, и, следовательно, обеспечение защиты от этих вирусов вакцинированного молодого животного.
Описываемая здесь последовательность нуклеиновой кислоты (SEQ ID NO: 1) содержит внутренний стоп-кодон в положениях 1753-1755 нуклеотидов (смотрите фиг. 2A). Поэтому транслируемый с нее белок VP-2 имеет две различные формы. Одна форма, представленная на фиг. 3A (SEQ ID NO 3), является результатом сквозного прочитывания («протечки») стоп-кодона и поэтому является длиннее (599 аминокислот) второй формы, которая представлена на фиг. 3B и которая заканчивается в стоп-кодоне. Вторая форма белка содержит лишь 584 аминокислот (SEQ ID NO: 4). В первой, более длинной форме VP-2 стоп-кодон не транслируется, а «пропускается», что приводит к белку из 599 аминокислот. Используемый здесь термин «белок VP-2» включает как первую, более длинную форму VP-2, так и вторую, более короткую форму VP-2, и обе формы белка могут использоваться при осуществлении на практике настоящего изобретения. Эти две формы белка можно выявить, используя Вестерн-блоттинги. К тому же при осуществлении на практике настоящего изобретения могут использоваться обе последовательности нуклеиновых кислот (SEQ ID NO: 1 и 2), например, любая из двух или обе последовательности могут использоваться при приготовлении вакцины, в векторе и т.д. В некоторых вариантах осуществления аминокислотную последовательность SEQ ID NO: 3 кодирует нуклеотидная последовательность SEQ ID NO: 1. В других вариантах осуществления аминокислотную последовательность SEQ ID NO: 4 кодирует SEQ ID NO: 2. В еще одних вариантах осуществления настоящего изобретения SEQ ID NO: 1 может быть модифицирована в результате элиминации (делеции) стоп-кодона (например, с помощью генетической инженерии), чтобы с нее транслировалась аминокислотная последовательность SEQ ID NO: 3.
Этот новый RPV также служит в качестве модели правильной бустер-иммунизации в случае других животных и инфекционных заболеваний человека. Например, при гриппе у людей (H1N1) на основе имеющейся информации ответная реакция на вакцину варьирует в зависимости от наличия уже существующих антител. Если у человека уже существуют антитела, титр не повышается, но аффинность антител действительно увеличивается. Если у человека нет уже существующего титра, то у человека нет ответной реакции с развитием нейтрализующего протективного иммунитета.
Новый изолят был депонирован в Американскую коллекцию типовых культур (АТСС) в Manassas, VA, 7 октября 2010, как Parvovirus-2 (Raccoon), от имени Oklahoma State University, (расписка от ATCC в получении была получена 12 октября 2010), и ему присвоен № депонирования в ATCC. Настоящим изобретением также обеспечивается выделенный парвовирус, включающий характеристики № депонирования в ATCC, и его потомство. Настоящее изобретение, кроме того, включает убитые или аттенуированные парвовирусы, включающие характеристики № депонирования в ATCC, депонированные 7 октября 2010, и потомство аттенуированных парвовирусов, а также включающие их вакцины и иммуногенные композиции.
Настоящее изобретение также относится к другим RPV, выделенным в Illinois и размноженные в CRFK, (10071199-A и 10071199-C), частичные последовательности которых представлены в разделе «Примеры». Таким образом, настоящее изобретение также включает парвовирусы енотов, которые циркулируют в США (например, в Arkansas и Illinois), общей особенностью которых является то, что они не реагируют с моноклональным антителом против парвовируса собак (MoAb) 3B10, MoAb, которое чаще всего используется для диагностики. 3B10 является специфичным для аминокислоты в положении 300 VP-2, которая обычно является глицином. Таким образом, эти RPV имеют мутацию в положении 300 аминокислоты VP-2, которая включена в посадочное место этого MoAb и мешает ему распознавать белки. Иначе, эти вирусы имеют составляющую приблизительно 98% гомологию с VP-2 других парвовирусов-2 плотоядных животных. Однако хорошо известно, что даже небольшое число мутаций в важных местах может оказывать большое влияние на свойства вируса (например, смотрите Qu et al, 2005, где описываются мутации в двух важных аминокислотных остатках шипообразного белка коронавирусов, которые изменяли его тропизм).
Филогенетические исследования этого вируса (например, смотрите примеры 1 и 5) показали, что этот RPV [парвовирус-2 (от енота)] является близкородственным CPV-2 собак и, в сущности, может быть вариантом этого вируса. Как таковые, домашние взрослые собаки могут быть восприимчивыми к этому вирусу, и им, вероятно, принесет пользу введение вакцин, которые включают этот вариант.
Передача только что выделенного парвовируса от енотов любимым домашним животным, таким как собаки, а также другим диким животным, вероятно, будет происходить вследствие особенностей поведения енотов. Например, еноты являются весьма умными и очень быстро адаптируются к новым источникам пищи. Они являются всеядными, поедая широкий ряд растений и животных, в зависимости от времени года и наличия. Из-за их легкой интеграции в городские территории и адаптации к ним еноты обычно взаимодействуют с домашними собаками и кошками и близко контактируют с ними. Еноты обладают отличными способностями схватывания и легко учатся, например, открывать контейнеры, определять местонахождение и открывать консервы для животных, и т.д. Вследствие этого поведения они потенциально способны к передаче парвовируса домашним плотоядным животным. Еноты также взаимодействуют с другими дикими животными, такими как скунсы, и, следовательно, также существует возможность межвидового взаимодействия и передачи парвовирусов. Поэтому взрослым собакам и другим домашним любимым животным могло бы принести пользу введение вакцин, которые включают описываемый здесь вирус енота, даже если они были ранее вакцинированы вакциной против другого парвовируса; и введение таких вакцин могло бы принести пользу другим видам, либо одомашненным, либо нет. Польза могла бы быть двойной: 1) вакцинация могла бы обеспечить иммунитет к инфицированию этим конкретным CPV; и 2) этот CPV достаточно схож с другими парвовирусами (например, гомологичен на приблизительно 99% другим парвовирусам плотоядных животных), чтобы он с долей вероятности также вызвал и повысил бы по меньшей мере какой-либо иммунитет против них.
В некоторых вариантах осуществления вакцины и имммуногенные композиции согласно настоящему изобретению являются моновалентными по природе, т.е. содержащими единственным агент, которым является описываемый здесь изолят парвовируса (например, с характеристиками парвовируса-2 (от енота), с № депонирования в ATCC, депонированного 7 октября 2010), или аттенуированная или убитая форма изолята, описываемого здесь, или потомство любого из них. В других вариантах осуществления вакцины и иммуногенные композиции являются поливалентными, т.е. они содержат множество антигенных агентов, одним из которых является изолят настоящего изобретения. Приводимые в качестве примеров дополнительные компоненты поливалентных композиций включают, но без ограничения, один или несколько из вирусов собачьей чумы (CDV), собачьего аденовируса типа 2, вируса парагриппа у собак, коронавируса собак, герпесвируса собак, ротавируса собак, одного или нескольких сероваров Leptospira и парвовируса-2 собак, который отличается по последовательности гена VP-2, т.е. в котором аминокислотой в положении 232 белка VP-2 не является Thr, и/или аминокислотой в положении 300 белка VP-2 не является Asp, или в котором кодоном, кодирующим Thr в аминокислотном положении 232 белка VP-2, не является ACA, и/или кодоном, кодирующим Asp в аминокислотном положении 300 VP-2, не является GAT. Приводимые в качестве примеров CDV включают, но без ограничения, вирусы собачьей чумы, описанные в заявке на патент США 12/696983 (Kapil), опубликованной как US2010/0196420, полное содержание которой тем самым включено посредством ссылки. Приводимые в качестве примеров серовары Leptospira включают, но без ограничения, Leptospira interrogans серовар canicolar, Leptospira interrogans серовар icterohaemorrhagiae, Leptospira interrogans серовар pomona и Leptospira kirschneri серовар grippotyphosa. Кроме того, изолят настоящего изобретения можно объединить со множеством различных антигенов, например, с антигенами известных поливалентных вакцин, таких как Galaxy® DA2PPV или Nobivac DA2PPv + L4, и т.д.
В конкретном варианте осуществления реципиентом вакцины согласно настоящему изобретению является молодое животное (например, щенок), а способом введения является введение через посредство «леденца для щенков»». Леденцы для щенков для применения при введении вакцинных композиций молодым собакам (или молодым животным других видов) подробно описываются в находящейся одновременно на рассмотрении патентного ведомства PCT-заявке на патент с № PCT/US2010/042142 Kapil и др., поданной 15 июля 2010, полное содержание которой тем самым включено посредством ссылки. Вкратце, леденец для щенков и схожая уловка используется для доставки вакцины на верхнюю сторону языка, т.е. супралингвально. В частности, вакцинный препарат вводят способом, который доставляет вакцину к базальным клеткам языка или близко к ним. Базальные клетки инфицируются аттенуированным парвовирусом в вакцине, и создается антигенное депо (например, резервуар вируса), которое постепенно, со временем и с очень раннего возраста, высвобождает аттенуированный парвовирус внутри щенка. В этом способе используется тот факт, что язык является иммунологически относительно привилегированным (свободным от иммунного ответа). Вакцина может быть, например, включена в удерживаемый рукой в каком-либо положении «леденец для щенков», который вводит супралингвально тот, кто ухаживает за щенком, например, посредством удерживания палочки, веревочки или другого средства доставки, прикрепленной к твердому вакцинному препарату, который помещают в рот щенка. Твердый препарат включает твердый, инертный носитель; при этом парвовирус рассредоточен или распределен по всему твердому носителю, и врожденный сосательный рефлекс, демонстрируемый щенком, позволяет постепенно растворить носитель, и на язык высвобождается парвовирус.
В одном варианте осуществления настоящее изобретение включает нуклеиновые кислоты с нуклеотидной последовательностью, кодирующей белок VP-2 RPV, такой как та, которая определена в SEQ ID NO: 1, или альтернативно SEQ ID NO: 2 (смотрите фиг. 2A и B), или частями такой нуклеотидной последовательности, которые кодируют антигенные области или эпитопы, достаточные для вызова иммунного ответа на RPV у реципиента вакцины, и включающие их вакцины. В частности, такие последовательности нуклеиновых кислот будут включать один из кодонов или оба кодона, которые кодируют аминокислоты в положениях 232 и 300 белка VP-2. Этими кодонами являются ACA и GAT, соответственно, кодирующие Thr и Asp, соответственно. В другом варианте осуществления настоящее изобретение включает нуклеиновые кислоты с нуклеотидной последовательностью, кодирующей белок VP-2, включающий аминокислотную последовательность, которая определена в SEQ ID NO: 3 (или альтернативно, SEQ ID NO: 4, которую охватывает SEQ ID NO: 3, смотрите фиг. 3A и B), или части аминокислотной последовательности, определенной в SEQ ID NO: 3, которые включают антигенные области или эпитопы, достаточные для вызова иммунного ответа на антигенные области или эпитопы у реципиента вакцины, и включающие их вакцины. В частности, такие белки или их части будут включать один или оба из аминокислотных остатков 232 и 300 белка VP-2 RPV, которыми являются Thr и Asp, соответственно. Настоящим изобретением также охватываются описываемые здесь варианты и/или производные таких последовательностей, и вакцинные препараты, которые включают варианты и/или производные. Например, квалифицированным в данной области техники специалистам будет понятно, что, вследствие избыточности генетического кода, отличные от SEQ ID NO: 1 последовательности могут использоваться для кодирования аминокислотной последовательности, определенной в SEQ ID NO: 3. К тому же, хотя нуклеотидная последовательность, определенная в SEQ ID NO: 1, представляет собой одноцепочечную (оц) ДНК, настоящее изобретение также включает соответствующую двухцепочечную (дц) ДНК, комплементарную ДНК и РНК любой формы (например, мРНК, гибриды РНК/ДНК, и т.д.), которая основа на этих последовательностях, происходит из них или которая служит их комплементом. Такие последовательности могут быть либо смысловыми, либо антисмысловыми последовательностями. Кроме того, для применения в вакцинах также предусматриваются последовательности, которые гомологичны SEQ ID NO: 1 на по меньшей мере приблизительно 50%, предпочтительно приблизительно 60%, более предпочтительно приблизительно 70, 80 или 90%, или даже приблизительно 95, 96, 97, 98 или 99% или более, при условии, что эти последовательности кодируют один или оба из аминокислотных остатков 232 и 300 в виде Thr и Asp, соответственно. Такие последовательности могут отличаться, например, в результате содержания альтернативных кодонов, которые кодируют одну и ту же аминокислоту, в одном или нескольких положениях.
К тому же, также предусматриваются части этих последовательностей, которые кодируют антигенные области или эпитопы белка VP-2 AR08071304. Предусматриваются, в частности, нуклеотидные последовательности, включающие кодоны, которые кодируют один или оба из аминокислотных остатков 232 и 300 в виде Thr и Asp, соответственно. В одном варианте осуществления кодоном, кодирующим аминокислотный остаток 232 в виде Thr, является ACA, а кодоном, кодирующим аминокислотный остаток 300 в виде Asp, является GAT. К тому же, также включены последовательности, которые кодируют аминокислотные последовательности, идентичные SEQ ID NO: 3 на 70%, или более предпочтительно приблизительно 80, 90 или 95% или даже более (например, 96, 97, 98 или 99%), при условии, что эти последовательности кодируют один или оба из аминокислотных остатков 232 и 300 в виде Thr и Asp, соответственно, или их варианты и/или производные, включающие более короткие антигенные области или эпитопы. Такие варианты и/или производные SEQ ID NO: 3 и/или ее антигенных областей или эпитопов могут варьировать, например, в результате содержания консервативных или неконсервативных аминокислотных замен или делеций (особенно делеций с амино-конца или карбоксильного конца), или различных вставок, и т.д., при условии, что результирующий белок/пептид является антигенным и вызывает иммунный ответ у реципиента вакцины. Длина таких антигенных областей или эпитопов предпочтительно составляет по меньшей мере приблизительно 10 аминокислот, и они включают одну или более из аминокислот в положениях 232 и 300, с привязкой к нумерации аминокислотных остатков белка VP-2, представленной на фиг. 3, которыми являются Thr и Asp, соответственно. Антигенная область может, однако, включать весь ген/белок VP-2 AR08071304.
Кроме того, изобретение также относится к последовательностям нуклеиновых кислот, которые гибридизуются с раскрытыми здесь последовательностями (или частями этих последовательностей) в жестких условиях (особенно условиях высокой жесткости), при условии, что эти последовательности кодируют один или оба из аминокислотных остатков 232 и 300 в виде Thr и Asp, соответственно. Жесткие условия относятся к условиям гибридизации, которые позволяют последовательности нуклеиновой кислоты гибридизоваться с конкретной последовательностью. Как правило, условия высокой жесткости относятся к условиям гибридизации, которые позволяют последовательности нуклеиновой кислоты длиной по меньшей мере 50 нуклеотидов и предпочтительно приблизительно 200 или более нуклеотидов гибридизоваться с конкретной последовательностью при приблизительно 65°C в растворе, включающем приблизительно 1 M соль, предпочтительно 6 × SSC или любом другом растворе, имеющем соизмеримую ионную силу, и промывке при 65°C в растворе, включающем приблизительно 0,1 M соль, или меньше, предпочтительно 0,2 × SSC или любом другом растворе, имеющем соизмеримую ионную силу. Эти условия позволяют выявлять последовательности, идентичные на приблизительно 90% или более. Как правило, условия низкой жесткости относятся к условиям гибридизации, которые позволяют последовательности нуклеиновой кислоты длиной по меньшей мере 50 нуклеотидов и предпочтительно приблизительно 200 или более нуклеотидов гибридизоваться с конкретной последовательностью при приблизительно 45°C в растворе, включающем приблизительно 1 M соль, предпочтительно 6 × SSC или любом другом растворе, имеющем соизмеримую ионную силу, и промывке при комнатной температуре в растворе, включающем приблизительно 1 M соль, предпочтительно 6 × SSC или любом другом растворе, имеющем соизмеримую ионную силу. Эти условия позволяют выявлять последовательности, идентичные на вплоть до 50%. Квалифицированный в данной области техники специалист будет способен модифицировать эти условия гибридизации, чтобы идентифицировать последовательности со степенью идентичности, варьирующей между 50% и 90%.
Настоящее изобретение также относится к различным типам рекомбинантных и/или экспрессионных векторов, которые содержат и экспрессируют раскрытые здесь последовательности нуклеиновых кислот (или их части, которые кодируют антигенные пептиды и/или полипептиды). Такие векторы могут использоваться при приготовлениях вакцин или могут служить другим целям, например, для манипуляции раскрытой последовательностью в лабораторной обстановке. Примеры таких векторов и экспрессионных систем включают, но без ограничения, различные бактериальные (например, Escherichia coli) экспрессионные векторы или экспрессионные векторы на основе пробиотиков (например, Lactobacillus); различные рекомбинантные вирусные векторы, такие как аденовирусные векторы, бакуловирус, векторы на основе поксвируса канареек, и т.д.; Pichia и дрожжевые экспрессионные системы, и т.д. Такие рекомбинантные векторы и экспрессионные системы могут использоваться, например, при приготовлениях вакцин или, альтернативно, для других целей, например, для манипуляции последовательностями в лаборатории, или для исследовательских или диагностических целей.
Настоящее изобретение также относится к химерным белкам и кодирующим их генам, таким как белки, включающие белок VP-2 RPV настоящего изобретения, или их антигенные области или эпитопы. В некоторых вариантах осуществления размер таких эпитопов находится в диапазоне от по меньшей мере приблизительно 5 до приблизительно 20 или более аминокислот. Такие химерные белки (или кодирующие их последовательности нуклеиновых кислот) могут включать другие полезные аминокислотные последовательности, такие как адъюванты, другие белки, на которые направлены вакцины, например, из других организмов, вызывающих заболевание у плотоядных животных, особенно животных семейства собачьи, и т.д. Кодирующие такие белки нуклеиновые кислоты могут включать последовательности линкеров или спейсеров, например, между антигенными областями или эпитопами. Также включены рекомбинантные и/или экспрессионные векторы, которые кодируют и/или экспрессируют такие химерные (или слитые) белки.
В данной области техники известно несколько способов производства вакцин, подходящих для вакцинации против парвовируса. Смотрите, например, патенты Соединенных Штатов с № 4193990 и 4193991, выданные Appel и др., патент Соединенных Штатов с № 4303645, выданный Carmichael и др., патент Соединенных Штатов с № 4971793, выданный Wood и др.; патент Соединенных Штатов с № 5882652, выданный Valdes и др., и патент Соединенных Штатов с № 5885585, выданный Parrish и др., в каждом из которых предлагаются изменения подходящих стратегий приготовления вакцин. Полное содержание каждого из этих патентов тем самым включено посредством ссылки. Как правило, для производства вакцины будет использоваться вирусный вектор, содержащий описанные последовательности нуклеиновых кислот (например, оцДНК, встречающуюся в природе внутри вируса, или оцДНК или другую эквивалентную форму, генетически сконструированную, в неприродном вирусном векторе (например, дцДНК, оц или дцРНК, гибриды РНК-ДНК). Примеры включают вирусы RPV (или другие), которые являются «убитыми», инактивированными или в противном случае аттенуированными, чтобы не вызывать симптомы тяжелого заболевания у животного, которому их вводят, вместе с подходящим физиологическим носителем. Предпочтительно, когда симптомы заболевания не будут возникать в результате введения. Однако квалифицированные в данной области техники специалисты признают, что многие эффективные вакцинные препараты вызывают некоторый дискомфорт или относительно незначительное недомогание при введении или после него. Однако польза от того, чтобы быть защищенным от резко выраженного заболевания, значительно перевешивает этот возможный эффект. В качестве альтернативы может использоваться гетеротипический вектор, который в естественных условиях не инфицирует подвергаемого вакцинированию животного или который обычно не вызывает у него заболевание. Примеры способов инактивации антигенов настоящего изобретения (например, RPV настоящего изобретения) включают, но без ограничения, нагрев, обработку формальдегидом, формалином, биэтиленамином, облучение и обработку бета-пропиолактоном.
Специалистам в данной области техники хорошо известны другие подходящие компоненты вакцин, например, фармакологически приемлемые носители, как и получение таких композиций для применения в качестве вакцин. Как правило, такие композиции готовят либо в виде жидких растворов, либо суспензий, однако также предусматриваются твердые формы, такие как таблетки, пилюли, порошки и т.п. Можно также приготовить твердые формы, подходящие для растворения, или приготовления суспензии, в жидкостях до введения, или для растворения во рту. Препарат может быть также эмульгированным. Активные ингредиенты можно смешать с наполнителями, которые являются фармацевтически приемлемыми и совместимыми с активными ингредиентами. Подходящими наполнителями являются, например, вода, солевой раствор, декстроза, глицерин, этанол и т.п., или их комбинации. К тому же, композиция может содержать незначительные количества вспомогательных веществ, таких как смачивающие вещества или эмульгаторы, pH-буферные вещества и т.п. Если желательным является введение пероральной формы композиции, могут быть добавлены различные загустители, корригенты, разбавители, эмульгаторы, средства, способствующие диспергированию, или связующие вещества, и т.п. Композиция настоящего изобретения может содержать любые такие дополнительные ингредиенты для обеспечения композиции в форме, подходящей для введения. Конечное количество транслируемой нуклеиновой кислоты в препаратах может варьировать. Однако, как правило, количество будет составлять приблизительно 1-99%. Композиции могут, кроме того, включать адъювант, подходящие примеры которого включают, но без ограничения, Seppic, Quil A, Alhydrogel, и т.д.
Как правило, в случае введения в качестве вакцины нуклеиновая кислота будет включена в вирусную или вирионную частицу, и вся частица будет компонентом вакцины. Как будет понятно квалифицированным в данной области техники специалистам, когда вакцина будет содержать вирионы (такие как RPV настоящего изобретения), они будут инактивированными (убитыми) или аттенуированными, т.е. полученными после нескольких пассирований вируса в культуре клеток, чтобы частицы не вызывали симптомы заболевания или вызывали лишь слабые, не опасные для жизни симптомы. Квалифицированным в данной области техники специалистам будет также понятно, что существуют другие способы аттенуации вирусов, и любой из них может использоваться при осуществлении на практике настоящего изобретения для разработки подходящей формы варианта вируса, описываемого здесь. Например, могут быть введены различные мутации, которые затрагивают токсичность вирусов, способность к репродукции и т.д.
Альтернативно, нуклеотидная последовательность, представленная в SEQ ID NO: 1, (или ее сегменты, которые кодируют антигенные области или эпитопы, описываемые здесь, например, SEQ ID NO: 2)) может доставляться в гетерологичном векторе, таком как отличный вирус (например, вирус, который не вызывает заболевание у являющихся реципиентами вакцины видов), или другом типе конструкции, которая сконструирована так, что она приводит к экспрессии кодируемого белка у реципиента вакцины, без вызова симптомов заболевания. Примеры таких вирусов включают, но без ограничения, вирус панлейкопении у кошек (FPV), различные герпесвирусы, непатогенные «сиротские вирусы», кишечные вирусы, такие как энтеровирус, и т.д. Также предусматриваются другие формы вакцины. Также предусматриваются, например, вакцины на основе «пустых» вирионных частиц (без нуклеиновой кислоты), как и вакцины, включающие белки, которые не собираются в капсид. RPV настоящего изобретения может также быть в значительной степени или частично очищенным и/или сконцентрированным посредством пэннинга, например, с использованием покрытых трансферрином гранул в колонке, в чашках, и т.д.
RPV согласно настоящему изобретению можно без риска вводить в очень высоких титрах. Например, обычная доза CPV-2 в вакцине составляет приблизительно 10000 вирусных частиц при каждой инъекции. Вводимое количество в случае использования RPV колеблется от приблизительно 10000 частиц при каждой инъекции до приблизительно 100000 частиц при каждой инъекции, или даже больше, например, от приблизительно 100000 вплоть до 1000000 частиц при каждой инъекции.
Альтернативно, вакцинный препарат может включать последовательность белка VP-2 (полипептида, пептида и т.д.), определенную в SEQ ID NO: 3 или в SEQ ID MO: 4, или ее антигенные области или эпитопы. Кроме того, для использования в вакцинах также предусматриваются описанные выше последовательности, которые демонстрируют составляющую по меньшей мере приблизительно 50%, предпочтительно приблизительно 60%, более предпочтительно приблизительно 70, 80 или 90%, или даже приблизительно 95, 96, 97, 98 или 99% или более идентичность или схожесть с SEQ ID NO: 3 или SEQ ID NO: 4, или их антигенные области или эпитопы, при условии, что эти последовательности включают один или оба из аминокислотных остатков 232 и 300 в виде Thr и Asp, соответственно. Термины «идентичность» и «схожесть» известны в данной области техники, причем использование термина «идентичность» обычно предполагает сравнение последовательностей на основе полного совпадения между соответствующими одними и теми же положениями в сравнимых последовательностях.
Термин «схожесть» относится к сравнению между аминокислотными последовательностями и учитывает не только идентичные аминокислоты в соответствующих положениях, но также функционально схожие аминокислоты в соответствующих положениях (например, Asp и Glu, обе из которых обладают боковой цепью, которая обычно является отрицательно заряженной при нейтральном pH, и поэтому могут функционировать схожим образом). Таким образом, схожесть между последовательностями полипептидов означает функциональную схожесть, помимо схожести последовательностей. Охватываемые настоящим изобретением последовательности могут отличаться от тех, которые раскрыты в явном виде, например, в результате наличия консервативных аминокислотных замен, как понятно квалифицированным в данной области техники специалистам, (например, положительно заряженные аминокислоты могут замещать друг друга, отрицательно заряженные аминокислоты могут замещать друг друга, алифатические аминокислоты могут замещать друг друга), при условии, что аминокислотная последовательность сохраняет способность вызывать эффективный, соответствующий иммунный ответ при введении реципиенту вакцины. Кроме того, настоящим изобретением также охватываются аминокислотные последовательности антигенных областей или эпитопов, которые являются короткими непрерывными последовательностями внутри SEQ ID NO: 3 (т.е. усеченными или частичными последовательностями, которые представляют собой часть SEQ ID NO: 3), но которые сохраняют способность вызывать эффективный, соответствующий иммунный ответ против развития у реципиента вакцины симптомов парвовирусного инфекционного заболевания у собак. Длина таких антигенных областей обычно находится в диапазоне - приблизительно 5-10 аминокислот, но может составлять приблизительно 15, 20, 25, 30, 35, 40, 45 или даже приблизительно 50 аминокислот или более, и такие области будут, как правило, включать один или оба из аминокислотных остатков 232 и 300.
В одном варианте осуществления настоящего изобретения реципиентом вакцины является щенок. Под «щенком» подразумевается молодая собака возрастом менее чем приблизительно 8 недель. Обычно вакцину вводят щенку в возрасте = 2-3 недели, с последующими бустер-дозами в 4 и 6 недель. В некоторых вариантах осуществления вакцину не используют после 8 недель, поскольку после этого момента времени могут далее использоваться вакцины, направленные на другие известные циркулирующие вирусы, без внесения помех материнскими антителами.
Хотя в некоторых вариантах осуществления реципиентом вакцины является щенок, специалистам в данной области техники будет понятно, что не всегда требуется, чтобы это имело место. Вакцину можно вводить собаке любого возраста и другим видам животных (особенно плотоядным животным), которые подвержены инфицированию парвовирусами, как взрослым, так и молодым животным. Примеры включают, но без ограничения, животных семейства собачьи (например, диких животных семейства собачьи, таких как волки, виды красного волка, койоты, лисы, например серые, американские и рыжие, и т.д.), скунсов, кошек (в том числе домашних кошек и котят, и виды кошек большего размера, либо одомашненных, либо диких, таких как рыжие рыси, кугуары, лев, тигры и т.д.), норку, малую панду и т.д.; различных представителей семейства Procyonidae (енотовые), включающих енотов, коати, кинкажу, олинго, кольцехвостых енотов и какомицли, и т.д. Такие животные могут быть одомашненными (например, любимыми домашними животными), «работающими» животными (например, животными-поводырями), домашним скотом, животными на воле, животными в неволе или в заповедниках, в зоологических садах, в приютах, и т.д., при условии, что им может принести пользу введение вакцины.
Иммуногенные/вакцинные препараты согласно настоящему изобретению можно вводить любым из множества подходящих способов, которые хорошо известны квалифицированным в данной области техники специалистам, в том числе, но без ограничения, посредством инъекции, осуществляемой парентерально, например, внутримышечно, подкожно, внутрибрюшинно, внутрикожно или т.п., введения перорально через посредство «леденца для щенков», как описано выше, интраназально, посредством проглатывания пищевого продукта, содержащего антиген, и т.д. Однако в предпочтительном варианте осуществления способом введения взрослому реципиенту является введение посредством инъекции, и, как описано выше, способ введения молодым животным осуществляют через посредство твердого препарата, который растворяется во рту при сосании. Композиции настоящего изобретения можно вводить отдельно или в комбинации с другими лекарственными средствами или иммуногенными композициями, например, в виде части многокомпонентной вакцины. Кроме того, введение может быть однократным, или множество бустер-доз может вводиться с различными, спланированными по времени интервалами для усиления иммунного ответа. В случае введения щенкам типичной схемой введения будет (как описано выше) первоначальное введение в возрасте, например, 2-3 недели с последующими бустер-дозами в 4 и 6 недель. Предпочтительно введение является профилактическим, т.е. до того, как воздействие вируса имело место, или, как подозревают, имело место, но может также осуществляться после этого факта, т.е. после известного и подозреваемого факта воздействия, или терапевтическим, например, после возникновения симптомов заболевания, связанных с вирусной инфекцией.
Настоящее изобретение также относится к способам вызова иммунного ответа у пациента или индивидуума, нуждающегося в этом, а также способы вакцинирования пациента или индивидуума (особенно плотоядных животных, таких как молодые животные семейства собачьи, например, щенок) против парвовирусной инфекции. Способы включают введение реципиенту одной или нескольких доз вызывающего иммунный ответ препарата или вакцинного препарата. Величина вводимой дозы является достаточной для вызова иммунного ответа, предпочтительно протективного иммунного ответа, на антигены, кодируемые нуклеиновыми кислотами, которые вводят. Альтернативно, в случае введения одной или нескольких описываемых здесь аминокислотных последовательностей иммунный ответ направлен на присутствующие в аминокислотных последовательностях антигены. Предпочтительно иммунный ответ является протективным, и симптомы заболевания не будут возникать в результате введения. Однако квалифицированные в данной области техники специалисты признают, что многие эффективные вакцинные композиции вызывают некоторые относительно незначительные симптомы после введения или ослабевают без устранения всех симптомов заболевания после инфицирования реципиента вызывающим заболевание организмом. Однако польза от того, чтобы быть защищенным от резко выраженного заболевания, значительно перевешивает этот возможный эффект.
В других вариантах осуществления парвовирус енота согласно настоящему изобретению используют в качестве системы доставки генов. Описываемый здесь парвовирус енотов (RPV) является автономно реплицирующимся парвовирусом (ARP). Использование ARP в качестве средств доставки генов и экспрессионных векторов было описано (смотрите патент Соединенных Штатов с № 5585254, выданный Maxwell и др.). Поскольку RPV настоящего изобретения в антигенном отношении является не реактивным с сыворотками от собак, вакцинированных CPV или подвергнутых воздействию CPV в естественных условиях, этот RPV хорошо подходит для применения в качестве носителя генов и/или экспрессионного вектора для собак, а также для других видов (смотрите ниже). Разработанные с помощью генетической инженерии RPV используются для переноса в представляющую интерес клетку «чужеродных» или «гетерологичных» последовательностей нуклеиновых кислот, т.е. последовательностей, которые не происходят из RPV, но которые кодируют и экспрессируют в представляющей интерес клетке представляющий интерес полипептид или пептид, или в противном случае способствуют такой экспрессии или облегчают ее. Например, может кодироваться один или более иммуногенов, и RPV можно вводить субъекту, чтобы вызывать иммунный ответ на один или более иммуногенов (например, чтобы вакцинировать субъекта).
RPV является небольшим, содержащим одноцепочечную ДНК вирусом без оболочки. Геном RPV, подобно другим автономным парвовирусам позвоночных животных, имеет две открытых рамки считывания, ORF1 и ORF2, фланкированных инвертированными концевыми повторами (ITR), которые необходимы для репликации ДНК (фиг. 4A). Экспрессией ORF1 и OEF2 управляют промоторы P4 и P38, соответственно (фиг. 4B). ORF1 кодирует неструктурные (NS) белки NS1 и NS2, а ORF2 кодирует капсидные белки VP-1, VP-2 и VP-3 (фиг. 4C). NS1 является мультифункциональным белком, который необходим для репликации вирусной ДНК и стимуляции транс-активации, такой как та, которая запускает транскрипцию VP-1 и VP-2. NS2 важен для репликации, продуцирования вирусов и выхода из ядра вирионов потомства. Парвовирусные частицы имеют икосаэдральную симметрию, и их диаметр равен приблизительно 20 нм. Частицы содержат приблизительно 50% белка и 50% ДНК, при этом эпитопы нейтрализации присутствуют на открытой поверхности частиц.
Можно вставить гетерологичные последовательности внутрь капсидных белков парвовирусов собак, например, белка VP-2, и такие же или схожие стратегии используются для генетического конструирования RPV настоящего изобретения (Austin et al., Tropic determinant for canine parvovirus and feline panleukopenia virus functions through the capsid protein VP-2, Journal of General Virology (1997), 78, 925-928.). В таблице 1 перечислены рестрикционные сайты, расположенные внутри кодирующего VP-2 гена. Один или более из этих рестрикционных сайтов могут использоваться в качестве мест вставки чужеродной ДНК.







Рестрикционные сайты, которые будут особенно применимыми для встраивания последовательностей нуклеиновых кислот в ген VP-2, включают EcoRI, HpaI и PstI. Это обусловлено тем, что эти рестрикционные сайты обычно создают в сайтах множественного клонирования большинства рекомбинантных векторов.
Автономные парвовирусы обычно имеют ограничение в упаковке всего количества ДНК, равное приблизительно 105% от содержания дикой ДНК в них. Таким образом, длина предпочтительных трансгенов или их частей (т.е. гетерологичных или чужеродных нуклеотидных последовательностей, последовательностей нуклеиновых кислот, которые не встречаются в природе у парвовирусов, и т.д.) для включения в средства доставки генов на основе RPV настоящего изобретения составляет, как правило, от приблизительно 9 до приблизительно 60 нуклеотидов. Можно без труда разместить, например, последовательности из приблизительно 60 нуклеотидов или меньше (например, приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50 или 55 нуклеотидов). Такие последовательности, как правило, кодируют представляющие интерес последовательности (например, небольшие белки, полипептиды, пептиды и т.д.), включающие от приблизительно 3 до приблизительно 20 аминокислот, например, приблизительно 3, 4, 5, 6, 7, 8, 9, 19, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот. В одном варианте осуществления RPV дает пристанище пептидам из вплоть до 12 аминокислот, кодируемых 36 нуклеотидами. Однако в других вариантах осуществления встраивают последовательности нуклеиновых кислот значительно большей длины посредством замещения частей белка VP-2 чужеродной ДНК. Например, в некоторых вариантах осуществления чужеродной ДНК замещают от приблизительно 50 до 550 аминокислот, например, приблизительно 50, 100, 150, 200, 250, 300, 350, 400, 450, 500 или даже 550 (весь ген VP-2), с сохранением или добавлением требуемых инвертированных повторов.
Представляющие интерес последовательности, кодируемые гетерологичными нуклеотидными последовательностями, могут включать, например, один или более представляющих интерес эпитопов или антигенных областей представляющего интерес белка, примеры которого включают, но без ограничения, поверхностные белки весьма сильных патогенов собак, кошек и других видов; кассеты линейных эпитопов поверхностных белков вируса собачьей чумы, собачьего аденовируса и/или вируса гриппа у собак; множество пептидов, выбираемых из гемагглютинина вируса собачьей чумы и вируса гриппа у собак; эпитоп аминогена парвовируса собак; амино-концевой эпитоп аденовируса собак (происходящий из белка пентона), и т.д. Были определены дополнительные эпитопы некоторых важных вирусов собак (смотрите, например, Sugai et al., Microbiol. Immunol. 53(12): 667-74, 2009; Jung et al., J. Vet. Sci. 6(1): 21-24, 2005; Ghosh et al, Immunology 104(1): 58-66, 2001; и т.д.).
В других вариантах осуществления кодируемый полипептид/пептид имеет функцию или свойства, отличную от (или помимо) вызова иммунного ответа, например, обладает цитотоксичностью по отношению к опухолевым клеткам, способностями к наведению на цель и т.д.
В некоторых вариантах осуществления настоящего изобретения можно, кроме того, генетически сконструировать средство доставки генов на основе RVP, которое позволяет наводить RVP на представляющий интерес тип клеток или типы клеток. Подобно парвовирусам других плотоядных животных (а также аренавирусам грызунов), парвовирусы енотов проникают в клетки посредством связывания с рецепторами трансферрина на клеточной поверхности (TFR), как схематически проиллюстрировано на фиг. 5A. Посредством манипуляции родственными сайтами связывания трансферрина RPV (антирецепторными сайтами) (например, белками VP-1, VP-2 и/или VP-3) и их мутирования, можно изменить тропизм вируса и/или тип клеток, которые может инфицировать RPV. Например, такие генетически сконструированные RPV способны связываться с рецепторами трансферрина и инфицировать клетки видов, отличных от енота (в том числе людей), и могут, таким образом, использоваться в качестве средств доставки генов у видов, отличных от собак. Альтернативно, RPV с измененным тропизмом можно идентифицировать и отобрать во время пассирования вируса в клетках ряда видов. Как правило, существуют два способа достижения специфичности наведения на цель: трансдукционное наведение на цель и транскрипционное наведение на цель. Трансдукционное наведение на цель включает селективное внедрение вектора в представляющие интерес клетки, например, делящиеся раковые клетки собак, интестинальные клетки и т.д. Это может иметь место в результате генетической модификации вируса с включением и экспрессией факторов, необходимых для связывания с представляющей интерес клеткой и ее инфицирования, например, лигандов (например, родственных лигандов, которые могут быть белками), которые связываются с рецепторами, расположенными исключительно (или почти исключительно) на поверхности представляющей интерес клетки, и которые приводят к поглощению вируса представляющей интерес клеткой или допускают такое поглощение. Например, трансдукционное наведение на цель с помощью RPV, как правило, осуществляют посредством конструирования методами генетической инженерии RPV, который экспрессирует на своей внешней поверхности родственный лиганд для типа рецептора, который обнаружен только на интересующей клетке. В случае транскрипционного наведения на цель, хотя множество различных клеток-хозяев могут поглощать трансген, он транскрибируется только в клетках-мишенях. Транскрипционное наведение на цель с помощью RPV, как правило, осуществляют посредством включения в конструкцию специфичного для клетки и/или индуцибельного промотора для управления экспрессией представляющих интерес гетерологичных последовательностей только (или почти исключительно) в интересующих клетках.
Общая стратегия приготовления автономных парвовирусных векторов была описана Maxwell и др. (Methods 28 (2002) 168-181), и продукцию вирусных векторов на основе RPV можно адаптировать, как здесь описывается, например, аналогично продукции вектора LuIII. Вкратце, используют линию клеток-продуцентов, такую как CRFK. Клетки-продуценты (такие как линия клеток 324K) трансфицируют сверхспиральными формами рекомбинантной плазмиды на основе RPV, содержащей представляющие интерес последовательности трансгенов, вместе с одной или несколькими плазмидами, экспрессирующими необходимые вспомогательные функции для вырезания, амплификации и упаковки вирусных частиц, например, NS1, NS2, VP1, VP-2 и т.д. Этот процесс схематически проиллюстрирован на фиг. 5B. Стратегии создания рекомбинантных плазмид в случае парвовирусов собак и кошек были описаны (Austin et al., Journal of General Virology (1996), 77, 1787-1792), и такие же или схожие стратегии используются для создания рекомбинантных плазмид на основе RPV. RPV векторы получают из клеточных экстрактов, которые готовят спустя несколько дней после трансфекции.
В настоящее время проводятся исследования виротерапии опухолей (смотрите, например, Rommelaere et al, Cytokine & Growth Factor Reviews 21: 185-195, 2010; и патент США с № 7179456, выданный Rommelaere и др., полное содержание каждого из которых включено сюда посредством ссылки). Однако существует потребность в новых вирусах, которые могут выполнять адресные атаки. RPV настоящего изобретения может использоваться таким образом, т.е. в качестве средства для лечения опухолей. Применение RVP таким образом, как правило, включает идентификацию субъекта с опухолью, в которой RVP способен реплицироваться, и введение RVP субъекту, имеющему опухоль. Введение может осуществляться любым подходящим способом, включающим, но без ограничения, внутривенное введение, введение посредством инъекции непосредственно в опухоль (т.е. внутриопухолевое введение), и т.д. Виротерапия с использованием RPV, главным образом, предназначена для лечения с помощью однократного введения (например, лечения «одной дозой»). Это обусловлено тем, что после введения субъекту (например, собаке) RPV он будет отвечать иммунологически созданием антител против RPV. Таким образом, вероятность введения эффективной второй дозы является меньшей. Поэтому одна доза, которую вводят, имеет очень высокую концентрацию парвовируса. Например, доза будет колебаться от по меньшей мере приблизительно 10 миллионов до 100 миллионов вирусных частиц на дозу. Лишь RPV можно вводить взрослой собаке без вызова диареи для уничтожения остаточных опухолевых клеток в диффузной опухоли. Лишь RPV (но не, например, CPV-2 или FPLV) можно использовать в этих очень высоких дозах, и он, тем не менее, не вызывает клиническую картину заболевания у реципиента, т.е. RPV не будет вызывать диарею у имеющей опухоль собаки или кошки.
Пациенты с опухолями, которых можно лечить таким образом, включают, но без ограничения, например, собак, кошек, домашних норок, енотов и людей, при этом терапия является в высокой степени эффективной для собак и кошек. Пациент может быть молодым или взрослым. Типы опухолей, которые можно лечить RPV согласно настоящему изобретению, включают, но без ограничения, в случае собак гистиоцитарную саркому (которая является диффузной, и для которой в настоящее время нет в распоряжении успешного лечения), раки поджелудочной железы, лимфомы, глиомы и остеосаркомы, и т.д.; в случае кошек перечисленные выше опухоли, а также гепатобилиарные опухоли, и т.д.
В одном варианте осуществления RPV, используемый для лечения опухоли, генетически конструируют так, чтобы он был специфическим образом нацелен на опухолевые клетки, чтобы связывание вируса с опухолевыми клетками было селективным или предпочтительно специфическим. Такое применение RVP согласно настоящему изобретению можно также осуществить, например, для взрослых собак, поскольку, даже если они ранее были вакцинированы против CPV, антитела, которые они несут, не будут полностью нейтрализовать RPV согласно настоящему изобретению.
Настоящее изобретение также относится к диагностическим наборам для выявления описываемых здесь парвовирусов енотов. Такие наборы могут включать являющиеся олигонуклеотидами праймеры, специфичные для амплификации (например, посредством полимеразной цепной реакции) раскрытых здесь последовательностей нуклеиновых кислот. Альтернативно, такие наборы могут включать антитела (например, моноклональные или поликлональные), которые селективно или специфически связываются с уникальными антигенными детерминантами, демонстрируемыми парвовирусами, например, в случае Asp в положении 300 белка VP-2. Также включены способы выявления RPV. Такие способы обычно включают получение биологического образца от пациента с подозрением на инфицирование RPV настоящего изобретения и выявление присутствия или отсутствия RPV настоящего изобретения в образце, например, используя являющиеся олигонуклеотидами праймеры, специфичные для амплификации (например, посредством полимеразной цепной реакции) раскрытых здесь последовательностей нуклеиновых кислот, и/или используя антитела, специфичные для раскрытых здесь RPV. Также изобретение относится к способам диагностики инфекции животного RPV, используя эти способы (например, MoAb, которое взаимодействует с RPV, и культуру клеток почки енотов).
Приведенные далее примеры служат для иллюстрации настоящего изобретения, но не должны рассматриваться как его ограничение.
ПРИМЕРЫ
ПРИМЕР 1. Выделение нового парвовируса от енота
Распространенный в Северной Америке енот (Procyon lotor) является ведущим ночной образ жизни всеядным животным, которое хорошо приспособилось к городской среде обитания. Еноты предпочитают жить вблизи речных берегов, которые предоставляют убежище и пищу; в городской обстановке они могут взаимодействовать с собаками и кошками. Еноты восприимчивы к некоторым заболеваниям, которые поражают плотоядных животных, особенно к вирусу собачьей чумы, вирусу бешенства, аденовирусу собак, возбудителю лептоспироза, вируса гриппа A и парвовирусу. Ранее сообщалось о выявлении и определении характеристик парвовируса от енотов в Канаде (Barker et al., 1983) и США (Nettles et al., 1980); однако в последние два десятилетия нет опубликованных сообщений. Также сообщалось, что еноты не поддаются инфицированию парвовирусом типа 2 собак (CPV-2) (Appel and Parrish, 1982). Однако, как здесь описано, предоставлены данные, говорящие о том, что дело обстоит не так. Более того, здесь описывается выделение парвовируса, генетически родственного CPV-2, от спасенного енота в реабилитационном комплексе для диких животных в США.
Двухмесячного самца енота приняли в реабилитационный комплекс для диких животных в Arkansas, США. Енот был клинически нормальным во время поступления. Спустя 4 недели енот потерял аппетит, и у него развилась тяжелая диарея. Енота лечили энрофлоксацином (Baytril, Bayer), вводимым раз в день, и подкожно вводили жидкости. Несмотря на это лечение животное умерло. В этом же комплексе ранее умерли два других енота, один после демонстрации схожих клинических признаков. Енота передали в Oklahoma Animal Disease Laboratory для посмертного исследования.
При макроскопическом исследовании слизистая оболочка полости рта и склера были бледными - белого цвета, живот был рыхлым, а промежность и анальная область были покрыты легкоподвижной, «текучей» желтой жидкостью. Животное весило 1,5 кг и имело соответствующие скелетную мускулатуру и жировые запасы в теле, согласующиеся с быстрой смертью. Содержимое желудка было желтым слизеподобным с желтым гранулированным материалом. Тонкая кишка была расширенной и красной, с шероховатой серозной оболочкой. Содержимое и тонкой, и толстой кишки было текучим, слизеподобным и желтоватым, с желтым материалом, покрывающим гладкую, глянцевую слизистую оболочку.
Гистопатологическое исследование показало, что селезенка была застойной, а в фолликулах были истощены лимфоциты за счет некроза лимфоидных клеток. В легких был выражен диффузный отек легких. Отделы тонкой кишки характеризовались обширным некрозом крипт с отваливанием ворсинок и сплющиванием остающейся собственной пластинки. В небольшом числе областей обнаружены разбросанные, большие, гиперхроматические регенерирующие крипты эпителиальные клетки. Поверхность полости кишечника была покрыта фибрином, нейтрофилами, бактериями и немного кровоизлиянием. Иммуногистохимическое исследование CPV показало редкие положительные сигналы, которые в соответствии с оценкой были сомнительными. Микроскопический вид кишечника соответствовал вирусному энтериту.
Свежие срезы кишечника и языка исследовали с помощью флуоресцентного анализа с использованием моноклонального антитела 3B10 (меченного флуоресцеин-изотиоцианатом анти-CPV конъюгата; MVPvD) (Kapil et al., 2007). Установлено, что обе ткани являются отрицательными. Основываясь на гистопатологических данных, в кишечнике оставалось небольшое число энтероцитов, которые могли содержать вирус. Обычную ПЦР для выявления парвовируса плотоядных животных, разработанную Desario и др., (2005), выполняли дважды на содержимом кишечника, и результат был убедительно положительным оба раза. Для дополнительного подтверждения вирусологических данных содержимое кишечника инокулировали в культивируемые клетки почки кошек Крандалла-Риза (CRFK) (ATCC).
Для выделения вируса образец кишечника готовили в виде 10 процентной (в отношении веса к объему) суспензии и подвергали замораживанию-оттаиванию один раз. Экстракт суспензии получали с использованием равного объема хлороформа. После центрифугирования при 10000×g в течение пяти минут супернатант фильтровали через 0,22 мкм шприцевой фильтр. Фильтрат инокулировали в клетки CRFK спустя приблизительно 45 минут после засева в матрасы. За клетками следили каждый день в течение 5 дней, и на пятый день определили цитопатологические характеристики по округлению, и отметили отсоединение клеток. Клетки подвергали замораживанию-оттаиванию дважды и подвергали реакции гемагглютинации с использованием свиных эритроцитов. Образец продемонстрировал гемагглютинирующую активность, этот парвовирус размножился в культуре клеток. Присутствие вируса было, кроме того, подтверждено, с помощью обычной ПЦР для выявления парвовируса (Desario et al., 2005) на супернатанте культуры клеток с последующим секвенированием ампликона.
Из одного и того же образца (AR-08071304) были получены три независимых последовательности. Все последовательности были одинаковыми. Две были получены на основе свежего образца содержимого кишечника, а третья была получена на основе изолята, подвергнутого культивированию в клетках CRFK. Три последовательности были подвергнуты BLASTN-анализу и CLUSTALW-анализам (National Center for Biotechnology Information). На основе анализа последовательностей было установлено, что парвовирус енота является генетически наиболее близкородственным CP-V2.
Для определения полной последовательности вирусного белка-2 (VP-2) парвовируса енота были выполнены две дополнительные амплификации с помощью ПЦР, как описано Decaro и др., (2008). Полную последовательность VP-2 парвовируса енота подвергли BLAST-анализу. Последовательность имела наибольшую степень идентичности с CPV (98 процентов); и имела составляющую 97 процентов степень идентичности с изолятами вируса панлейкопении у кошек, другого парвовируса енотов (M24005) и вирусом энтерита у норок (фиг. 6).
В экспериментальных исследования было установлено, что еноты поддаются инфицированию вирусом энтерита у норок и парвовирусом кошек (Barker et al., 1983). Описываемый здесь изолят от енота обладал биологической гомологией и гомологией последовательности с CPV-2. Приблизительно 500 пар оснований частичной последовательности VP-2 имели наибольшую степень гомологии (99 процентов) с CPV-2. Кодоны в положениях 426 и 555 помогли отнести изолят от енота к CPV-2 (Desario et al., 2005). Кроме того, CPV-2 также соответствуют кодоны 564 и 568 (Truyen et al., 1994). Кодоном 564 в изоляте от енота был AGT, как и в парвовирусе собак; в парвовирусе кошек и предыдущем изоляте от енота (M24005) этим кодоном в положении 564 является AAT. Кодоном 568 является GGT как в CPV-2, так и в изоляте от енота настоящего изобретения; однако в парвовирусе кошек и предыдущем изоляте от енота (M24005) им является GCT.
Так же на основе аминокислотной последовательности VP-2 парвовирус енота может считаться уникальным вариантом CPV-2. В аминокислотном положении 80 VP-2 изолят от енота имел аргинин, также как VP-2 из изолятов CPV; напротив, парвовирус кошек имеет лизин в аминокислотном положении 80. В аминокислотном положении 87 изолят от енота имел остаток лейцина, подобно вариантам CPV-2, CPV-2a и CPV-2b; как FPV, так и CPV-2 имеют метионин в аминокислотном положении 87. В аминокислотном положении 93 изолят от енота имел аспарагин, подобно всем CPV, в то время как FPV имеет лизин в этом аминокислотном положении. В аминокислотном положении 101 изолят от енота имел треонин, подобно CPV-2a и CPV-2b; как FPV, так и CPV-2 имеют изолейцин в аминокислотном положении 101. В аминокислотном положении 103 парвовирус енота имел аланин, подобно CPV-2a и CPV-2b, тогда как FPV и CPV-2 имеют валин в аминокислотном положении 103. Парвовирус енота имел треонин в аминокислотном положении 232, серин в аминокислотном положении 297 и аспарагиновую кислоту в аминокислотном положении 300; FPV и CPV-2 имеют аланин в аминокислотном положении 300, в то время как CPV-2a и CPV-2b имеют глицин в аминокислотном положении 300. В аминокислотном положении 305 изолят от енота имел аспарагиновую кислоту, подобно FPV и CPV-2; CPV-2a и CPV-2b имеют тирозин в этом аминокислотном положении. Парвовирус енота имел аспарагин в аминокислотном положении 426, подобно FPV, CPV-2 и CPV-2a. В аминокислотном положении 555 изолят от енота имел валин, подобно большинству генотипов CPV и FPV; однако CPV-2a имеет изолейцин в аминокислотном положении 555. В аминокислотном положении 564 изолят от енота имел серин, подобно всем изолятам CPV; FPV имеет аспарагин в этом аминокислотном положении. В аминокислотном положении 568 парвовирус енота имел глицин, подобно CPV-2; FPV имеет аланин в этом аминокислотном положении. Таким образом, на основе полной последовательности VP-2 изолята парвовируса от енота (CAR-08071304) его считали уникальным генетическим вариантом CPV-2. Сводка этих различий представлена на фиг. 7.
Примечательно, что в изоляте от енота аминокислотным остатком в положении 232 является Thr, а аминокислотным остатком в положении 300 является Asp. Эти два аминокислотных остатка в белке VP-2 RPV являются, таким образом, отличными от таковых в белках VP-2 всех других известных изолятов CPV и могут быть ответственны за уникальные свойства (например, реактивность с антителами) этого RPV. В частности, замена аминокислотного остатка в положении 300 с Gly (с незаряженной боковой цепью = H) на Asp (с отрицательным зарядом при нейтральном pH, боковая цепь = CH2COO-) изменяет антигенные свойства вируса. Без ограничения какой-либо теорией, вероятно, что эта замена также оказывает влияние на способности вируса к связыванию с рецепторами.
Предыдущий изолят от енота M24005 был выделен в США в 1979. Изолят настоящего изобретения был в антигенном отношении отличен от изолятов циркулирующих в настоящее время CPV-2 в США, на основе отсутствия у него реактивности с моноклональным антителом A3B10 (Kapil et al., 2007). При прямом флуоресцентном анализе с использованием антитела ткань, положительная в отношении выделения вируса, была отрицательной. На основе гистологических данных присутствовало небольшое количество энтероцитов, выстилающих кишечник, когда енот умер. Отсутствие реактивности с A3B10 не было удивительным, поскольку это моноклональное антитело взаимодействует с основным антигенным доменом CPV-2 (Wikoff et al., 1994). Содержимое кишечника было отрицательным по яйцам паразитов при прямом исследовании и исследовании фекалий методом флотации, и отрицательным по токсину Clostridium difficile в ELISA. Streptococcus dysgalatiae sp. equisimilis и Streptococcus uberis были выделены из образца лимфатического узла при обычном бактериологическом исследовании. Вторичные бактериальные инфекционные агенты или их токсины могли внести вклад в смерть енота.
Вследствие вероятных взаимодействий енотов с домашними животными на городских территориях США это обнаружение является эпидемиологически значимым. Основываясь на опубликованном исследовании из Канады (Barker et al., 1983), еноты могут часто подвергаться воздействию CPV-2. В исследовании Barker и др. (1983), 25 из 112 енотов (22,4 процентов), исследованных в Канаде, были серопозитивными; при этом большинство животных было позитивным с дающими ингибирование гемагглютинации титрами антител, равными или превышающими 1:256. Установлено, что еноты также вовлечены в передачу FPV животных в зоологических садах в городских условиях (Junge et al., 2007). Еноты могут подвергаться воздействию CPV-2 вследствие их всеядности и пищевым привычкам. Для выяснения роли городских енотов в передаче CPV-2 другим животным требуется дополнительное исследование. Нет опубликованных данных о природном CPV-2 инфекционном заболевании у енотов. Однако, на основе реакции гемагглютинации свиных эритроцитов при pH 7,2, CPV-2 подразумевался у находящегося в неволе енота в США (Nettles et al., 1980); последовательность генома не была определена в этом исследовании.
ПРИМЕР 2. Реактивность парвовирусов плотоядных животных с имеющимися в продаже моноклональными антителами
Анализ нового изолята осуществляли, используя четыре дополнительных, имеющихся в продаже антитела, CPV1-24, CPV1-13 и CPV1-5 (Custom Monoclonal Antibodies, Sacramento, CA). Эти антитела против парвовируса-2 собак продают для обычного диагностирования парвовируса-2 собак. Результаты представлены в таблице 2. Как можно видеть, антитела взаимодействуют сходно с CPV, FPLV и RPV. Это свидетельствует о том, что некоторые иммуногенные эпитопы являются консервативными среди этих вирусов.


ПРИМЕР 3. Реактивность трех других парвовирусов енотов с панелью моноклональных антител:
Помимо описанного выше парвовируса енота из Arkansas -0807130, три дополнительных парвовируса енотов, происходящих от енотов, но из Illinois, исследовали в отношении реактивности с MoAb 3В10 (VMRD, WA), используя флуоресцентный анализ с использованием антитела. MoAb 3B10 является специфичным для CPV-2 и часто используется для идентификации и/или диагностирования парвовирусной инфекции у собак. Все три исследованных вируса дали отрицательный результат при использовании MoAb 3B10. Таким образом, как это имело место в случае описанного в примерах 1 и 2 RPV, эпитопы этих трех дополнительных вирусов енотов не узнавались этим антителом MoAb против CPV-2.
Эти результаты показывают, что эти три парвовируса, подобно RPV, также имеют мутацию в аминокислотном положении 300 VP-2, поскольку эти образцы ткани кишечника не взаимодействовали с MoAb 3B10, которое, как известно, взаимодействует с эпитопом, который включает другую аминокислоту в положении 300 в других парвовирусах.
ПРИМЕР 4. Определение последовательности гена, кодирующего белки VP-2 трех дополнительных парвовирусов енотов
Ген, кодирующий белок VP-2 каждого из трех вирусов, описанных в примере 3, подвергали частичному секвенированию, и результаты представлены ниже.
Обратный комплемент в случае 10071191-A, положения 1216-1773 нуклеотидов (т.е. длиной 557 нуклеотидов):
Обратный комплемент в случае 10071191-B, положения 1214-1779 нуклеотидов (длиной 565 нуклеотидов):


Обратный комплемент в случае 10071191-C, положения 1216-1774 нуклеотидов (длиной 556 нуклеотидов):

Они представляют собой частичные последовательности VP-2 RPV из Chicago, Illinois. Таким образом, аминокислотный остаток 300 не был определен. Однако отсутствие реактивности с MoAb 3B10 (смотрите пример 3) служит косвенным подтверждением того, что мутация в аминокислотном положении 300 также присутствует в этих вирусах. Совмещение четырех последовательностей (а именно полноразмерной последовательности 08071304 с тремя частичными последовательностями 10071191-1, 2, 3) выявило некоторые различия. Первой значительной вариацией является то, что в положении 1216 нуклеотида 08071304 имеет «A», тогда как все три недавно идентифицированных RPV (10071191A, B и C) имеют «T». Все четыре последовательности идентичны с нуклеотида 1217 до нуклеотида 1261. Однако в положении 1262 нуклеотида 10071191-B находится «G» вместо «A», который присутствуют в других 3 последовательностях. С нуклеотида 1263 до нуклеотида 1268 включительно все последовательности являются идентичными. Однако в положении 1269 нуклеотида последовательность 10071191-B имеет «G» вместо «T», который присутствует в других трех последовательностях. Так же в положениях 1272 и 1273 нуклеотидов 10071191-B имеет «GG» вместо пары «AA», которая присутствует в других трех последовательностях. С нуклеотида 1274 до нуклеотида 1292 включительно все четыре последовательности являются идентичными. Однако в положении 1293 нуклеотида все последовательности имеют «A», но 10071191-B имеет «G». С нуклеотида 1294 до нуклеотида 1300 включительно все последовательности являются идентичными, но затем в положении 1301 нуклеотида 10071191-B имеет «G», а не «A». С нуклеотида 1302 до нуклеотида 1349 включительно все последовательности являются идентичными, но в положении 1350 нуклеотида все последовательности имеют «T», но 10071191-2 имеет «G». С нуклеотида в положении 1351 все последовательности являются идентичными вплоть до нуклеотида в положении 1706.
На основе этого авторы настоящего изобретения делают вывод, что один изолят, 10071191-B, имеет точковую мутацию с заменой на «G» в нескольких местах гена VP-2.
Проведенные эксперименты по культивированию этих 3 новых RPV показали, что 10071199-A может размножаться в культуре клеток, и что 10071199-C является высоко цитопатическим по отношению к линии клеток CRFK.
ПРИМЕР 5. Филогенетическое сравнение новых изолятов парвовирусов от енотов 0808294, 10071191-1, 10071191-2 и 10071191-3 с другими известными парвовирусами плотоядных животных.
Для построения более крупного филогенетического дерева парвовирусов плотоядных животных были сравнены полноразмерная последовательность, кодирующая белок VP-2 нового изолята парвовируса от енота 0808294, частичные последовательности, кодирующие белок VP-2 изолятов от енотов - VP-2 10071191-1, 10071191-2 и 10071191-3, и несколько других последовательностей парвовирусов CPV-2 (имеющихся на Web-сайте Национального центра биотехнологической информации (NCBI)). Все последовательности сначала преобразовывали в FASTA-форматы, а затем совмещали, используя программу CLUSTAL/W программого обеспечения MEGA 4.1. Построение дерева осуществляли, используя анализ Bootstrap и метод иерархической кластеризации UPGMA (невзвешенный попарно-групповой метод с использованием среднеарифметического).
Результаты представлены на фиг. 8, на которой показаны NCBI GI номера каждого изолята. Как можно видеть, RPV из Arkansas (08071304) образует кластер с хорошо охарактеризованными парвовирусами собак. Таким образом, в эволюционном отношении он является вирусом, подобным парвовирусу-2 собак.
ПРИМЕР 6. Анализ с использованием средства поиска основного локального совмещения (BLAST) полноразмерной последовательности VP-2 RPV 08071304.
Последовательность из 1801 нуклеотидов VP-2 RPV 08071304 была проанализирована, используя BLAST-анализ. Результаты показали, что эта последовательность в высокой степени гомологична таковым других парвовирусов плотоядных животных.
Первые 7 наибольших степеней идентичности (99%) отмечались с парвовирусами собак. Неожиданно несколько составляющих 98% степеней идентичности было получено с вирусом панлейкопении у кошек. Показатель идентичности с парвовирусом енотов (M24005.1) составлял 98%, и отмечалась также составляющая 98% идентичность с вирусом энтерита у норок. Это является необычным для последовательностей VP-2 парвовирусов, поскольку такие высокие степени идентичности обычно не отмечаются среди нескольких различных парвовирусов плотоядных животных. Обычно парвовирус собак совмещается и демонстрирует высокую степень идентичности лишь с другими парвовирусами собак, вирус панлейкопении у кошек демонстрирует наибольшую степень идентичности с другими вирусами панлейкопении у кошек, и т.д. Поэтому представляется, что 08071304 является химерным парвовирусом плотоядных животных. Эти данные наблюдений дополнительно подкрепляются при сравнениях аминокислотных последовательностей, представленных на фиг. 7. Раньше классификацию парвовирусов плотоядных животных без труда осуществляли на основе аминокислотной последовательности VP-2. Интересно, RPV (08071304) настоящего изобретения не подчиняется традициям и правилам для линейных ДНК VP-2. В некоторых местах, как показано на фиг. 7, аминокислота, которая находится в важном эпитопе, подобна аминокислоте FPV или MEV (например, в аминокислотном положении 305). Однако в аминокислотном положении 93 она подобна аминокислоте CPV. Таким образом, RPV 08071307 является уникальным генетически, в антигенном отношении и что касается аминокислотной последовательности. Этот вирус мог бы, вероятно, представлять общий парвовирус плотоядных животных для преодоления заимствованного у матери иммунитета у нескольких видов.
СПИСОК ЛИТЕРАТУРЫ



Хотя настоящее изобретение было описано касательно его предпочтительных вариантов осуществления, квалифицированные в данной области техники специалисты признают, что настоящее изобретение может быть осуществлено на практике с использованием модификации в пределах сущности и объема прилагаемой формулы изобретения. Соответственно, настоящее изобретение не должно ограничиваться описанными выше вариантами осуществления, а должно, кроме того, включать все их модификации и эквиваленты в пределах сущности и объема представленного здесь описания.
Реферат
Изобретение относится к области биотехнологии и вирусологии. Предложен новый штамм парвовируса, представляющий собой парвовирус-2. Описанный штамм выделен от енота и может быть использован для иммунизации собак против парвовирусной инфекции или уничтожения опухолевых клеток у млекопитающего. Также раскрыты вакцина, содержащая такой штамм, и способы уничтожения опухолевых клеток у млекопитающего и вызова иммунного ответа у млекопитающего, предусматривающие использование нового штамма парвовируса. Предложенная группа изобретений может быть использована в ветеринарии. 4 н. и 8 з.п. ф-лы, 13 ил., 2 табл., 6 пр.

Комментарии