Популяция стволовых клеток шейки матки человека и ее применение - RU2679500C2
Код документа: RU2679500C2
Чертежи

















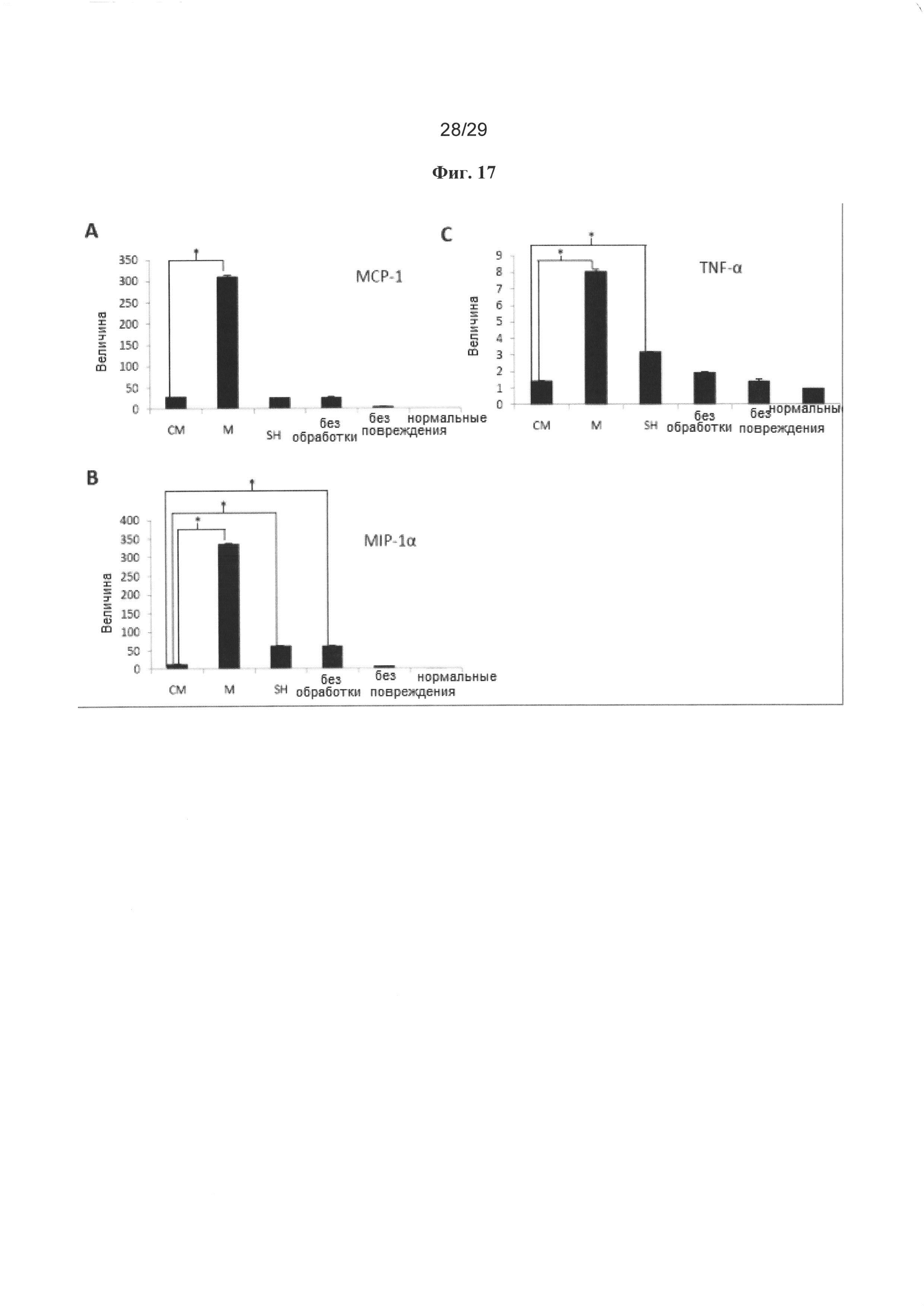

Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу выделения стволовых клеток, включающему получение клеточной суспензии из ткани шейки матки, к стволовым клеткам, выделяемым указанным способом, и к кондиционированной среде, получаемой из культуры указанных стволовых клеток. Изобретение также относится к применению указанных стволовых клеток или кондиционированной среды для лечения или профилактики злокачественной опухоли, воспалительных заболеваний, аутоиммунных заболеваний, хронических патологий или инфекционных заболеваний, а также для косметического лечения. Таким образом, настоящее изобретение относится к области стволовых клеток и их терапевтического или косметического применения.
Предшествующий уровень техники
Стволовая клетка характеризуется своей способностью к самообновлению и дифференцировке в нескольких направлениях. В частности, перспективным типом стволовых клеток взрослого организма для терапевтических применений являются так называемые мезенхимальные стволовые клетки (MSC). MSC, также определяемые как мультипотентные мезенхимальные стромальные клетки, представляют собой гетерогенную популяцию клеток, которые пролиферируют in vitro как пластик-адгезивные клетки, характеризуются фибробластополобной морфологией, образуют колонии in vitro и могут дифференцироваться в клетки мезодермальной линии, таких как остеоциты, хондроциты и адипоциты, а также клетки других эмбриональных линий.
Полагают, что стволовые клетки располагаются в нише, которая регулирует равновесие между самоподдержанием стволовых клеток и регенерацией тканей. Понятие ниши стволовых клеток первоначально было описано в отношении гемопоэза млекопитающих, где ниша представляла собой специализированное микроокружение, обеспечивающее жизнедеятельность гемопоэтической стволовой клетки и обеспечивающее ее продолжительное существование. Предполагали, что поддерживающие клетки в нише посредством своих продуктов секреции взаимодействуют со стволовыми клетками и направляют их поведение. В соответствии с этой моделью для поддержания активности стволовых клеток условия в ниши способствуют поддержанию состояния покоя стволовых клеток при отсутствии каких-либо внешних активирующих сигналов, но способствуют пролиферации и созреванию предшественников в случае необходимости, а также обеспечивают самоподдержание совокупности стволовых клеток.
Несколькими авторами опубликовано наличие различных популяций мультипотентных взрослых клеток в мягких тканях, получаемых из эмбриональной мезодермы. Например, опубликовано, что мультипотентные клетки можно получать из скелетной мышцы и другой соединительной ткани млекопитающих, из аспирированной жировой ткани человека или из костного мозга [так называемые мультипотентные взрослые клетки-предшественники (МАРС)]. В основном все эти выделенные популяции клеток можно использовать для восстановления и регенерации соединительной ткани аналогичным образом как MSC костного мозга. Однако за исключением МАРС, до настоящего времени ни одна из этих популяций не была достаточно охарактеризована фенотипическом уровне. Таким образом, несмотря на то, что в существующем уровне уровень техники было описано наличие мультипотентных взрослых клеток в различных соединительных тканях, невозможно идентифицировать и однозначно проводить различие различных типов мультипотентных клеток, получаемых из мягкой ткани, или получать по существу чистую популяцию. В настоящее время характеристика фенотипа стволовых клеток включает определение маркеров, таких как рецепторы клеточной поверхности, наряду с другими; и определение их способности для дифференцировки культур in vitro. Каждый тип клеток содержит определенную комбинацию поверхностных маркеров, таким образом, он обладает определенным профилем экспрессии, который характеризует этот конкретный тип клеток, отличающий его от других.
Идеальный источник взрослых стволовых клеток представляет собой источник, в котором их можно получать простым, неинвазивным способом, и источник, который обеспечивает достаточное количество клеток, которые можно выделять. В частности, источник должен обеспечивать стволовые клетки, которые можно легко выделять у живого индивидуума без существенных рисков и неудобства, и источник должен обеспечивать возможность получения высокого уровня с минимальным загрязнением другими типами клеток без чрезмерных затрат на выделение и культивирование.
Несмотря на то, что костный мозг (ВМ) являлся основным источником для выделения мультипотентных MSC, жировая ткань представляет собой другой источник такой клетки, но сбор ВМ и жировой ткани является в высшей степени инвазивным способом. Одним из альтернативных источников является пуповинная кровь, которую можно получать менее инвазивным способом без вреда матери или ребенку. Другие источники MSC идентифицировали в различных других тканях взрослого человека, включая плаценту, ткань волосистой части головы и стволовые клетки кишечника. Все клетки, выделяемые из ВМ, жировой ткани или пуповинной крови (UCB), обладали типичными характеристиками MSC: фибробластоидной морфологией, образованием колониеобразующих единиц фибробластов (КОЕ-Ф), способностью к мультипотентной дифференцировке и экспрессией характерного набора белков поверхности. Несмотря на то, что MSC, получаемые из трех источников, экспрессировали классические маркерные белки MSC, наблюдали значимые отличия, касающиеся экспрессии CD90, CD105 и CD106. Таким образом, MSC могут обладать различным фенотипов в зависимости от их источника.
Способ получения костного мозга является болезненным, а выход очень низким, где для получения клинически значимого количества необходимо получать существенное увеличение числа клеток экспансией ex vivo. Этот этап увеличивает затраты и делает способ времязатратным, а также повышает риск загрязнения и потери вещества. По этим причинам очень желательной является возможность выделения мультипотентных клеток из мезенхимальных тканей, отличных от костного мозга. В частности, учитывая их хирургическую доступность, подходящей являлась бы возможность выделения клеток из неостеохондральных мезодермальных тканей, таких как, но, не ограничиваясь ими, кожа, жировая и мышечная ткань.
Таким образом, в существующем уровне техники существует необходимость в предоставлении альтернативного источника стволовых клеток путем неинвазивного и безболезненного сбора. В этом смысле источником стволовых клеток может являться матка. Однако матка является сложным орган, разделенным на различные отделы. В частности, матка человека представляет собой фиброзно-мышечный орган, который можно разделить на верхнее мышечное тело матки и нижнюю фиброзную шейку матки, которая выступает во влагалище. Тело матки разделяют на дно и нижний сегмент матки (или перешеек), который располагается приблизительно на уровне простирания маточной артерии и внутреннего зева шейки матки. Шейка матки представляет собой узкий проход цилиндрической формы, который соединен своим нижний концом с влагалищем, а на своем верхнем конце шейка матки расширяется с образованием нижнего сегмента матки (перешейка); нижний сегмент матки в свою очередь расширяется в дно матки (фигура 18). Нижний конец шейки матки, который можно видеть изнутри влагалища при гинекологическом осмотре, известен как влагалищная часть шейки матки. В центре влагалищной части шейки матки открывается отверстие, известное как наружный зев, обеспечивая проход между маткой и влагалищем. Надвлагалищная часть шейки матки окружает эндоцервикальный канал, который представляет собой туннель через шейку матки от наружного зева в матку (фигура 19). Перекрывающаяся граница между надвлагалищной частью шейки матки и влагалищной частью шейки матки называется зоной трансформации. Зона трансформации представляет собой область, в которой предпочтительно собирать стволовые клетки по изобретению.
Выдающийся канадский гистолог Артур Ворфз Хэм (Arthur Worth Ham) описал в своем учебном пособии "Histology" (Ham A.W. and Cormack D.H. Ham's Histology, 9th ed. Philadelphia: Lippincott, 1987), расцениваемом многими практикующими врачами как незаменимый справочник, отличающийся слой ткани тела матки и шейки матки. Тело матки человека состоит из следующих ниже трех слоев ткани: 1) внутренний слой, называемый эндометрием, представляет собой наиболее активный слой и реагирует на циклические изменения гормонов яичника; эндометрий является высокоспециализированным и очень важным для менструальной и репродуктивной функции (эндометриальные стволовые клетки, получаемые из этого слоя ткани); 2) средний слой или миометрий составляет большую часть объема матки и является мышечным слоем, состоящим преимущественно из гладкомышечных клеток (миометральные стволовые клетки, получаемые из этого слоя ткани) и 3) наружный слой матки, серозная оболочка или периметрий представляет собой тонкий слой ткани, состоящей из эпителиальных клеток, которые окружают матку. Однако, как стенка шейки матки, так и оболочка, выстилающая канал, обладают отличающимися характеристиками по сравнению с телом матки. Фактически, стенка шейки матки состоит в основном из соединительной ткани. Шейка матки состоит из внутренней оболочки, известной как слизистая оболочка, которая состоит из тонких, плоских, чешуйчатых клеток, называемых сквамозными клетками, и наружной оболочки, известной как серозная оболочка (гладкий покров). Кроме того, стенка части тела матки, которая соединена с шейкой матки, называемой нижним сегментом матки или перешеек, преимущественно состоит из гладкой мышцы. Таким образом, гистология, а также функция этих двух отделов матки (тела матки, включая нижним сегментом матки, и шейки матки) являются отличными.
В международной заявке WO 2011/042547 описан способ получения стволовых клеток из ткани миометрия, конкретно из области выше шейки матки, называемой телом матки, которая включает дно и нижний сегмент матки. Кроме того, авторы указывают, что эксплантаты миометрия получали из нижнего сегмента матки тела матки посредством десквамации. Как описано выше, нижний сегмент матки представляет собой верхний конец шейка матки и считается частью тела матки, которая анатомически и гистологически отличается от шейки матки. Однако общепринято известно, что стенка нижнего отдела тела матки в основном состоит из ткани миометрия, т.к. слой эндометрия уменьшается до этого уровня. Однако наружная стенка шейки матки состоит в основном из соединительной ткани. Таким образом, невозможно получать ткань миометрия поверхностным отбором цитологических проб из шейки матки. Таким образом, биологический материал получают инвазивными способами, такими как биопсия, образцы ткани миометрия, эксплантаты миометрия или в виде десквамации матки, для которых требуется высокая степень десквамации для достижения миометрия. Таким образом, образцы ткани иссекали из ткани эндометрия, серозной, жировой и фиброзной ткани перед тем как использовать для выделения клеток-предшественников миометрия. Популяция стволовых клеток, описанная в международной заявке WO 2011/042547, экспрессирует поверхностные маркеры, такие как CD31, CD34 и HLA-DR, которые являются поверхностными маркерами гемопоэтической линии. С другой стороны, мезенхимальные стволовые клетки, не экспрессируют такие гемопоэтические маркеры.
Baege Astrid С и коллеги (Baege Astrid С. et al., Proc. Amer. Assoc. Cancer Res. Annual Meeting, 47 Vol 2006: 938) описывают выделение предполагаемых эпителиальных стволовых клеток, отличающихся от мезенхимальных стволовых клеток. Следует отметить, что популяция клеток, описываемая в настоящем описании, являлась связанной с возможной ролью в индуцированном вирусом папилломы человека канцерогенезе шейки матки.
Кроме того, Maruyama Т. et al. (Maruyama Т. et al., Reproduction, 2010; 140: 11-22) описывают роль стволовых клеток/клеток-предшественников эндометрия и миометрия в физиологии и патологии матки, однако в этом документе не упоминают мезенхимальные стволовые клетки шейки матки. Как указано выше, миометрий представляет собой средний слой тела матки, он составляет большую часть объема матки и является мышечным слоем, состоящим преимущественно из гладкомышечных клеток.
С другой стороны, Lopez J. et al. (

Подробное раскрытие настоящего изобретения
Авторами настоящего изобретения было обнаружено, что ткань шейки матки можно использовать в качестве источника стволовых клеток. Клетки, выделяемые из этой ткани, называемые стволовыми клетками шейки матки (UCESC), обладают более высокими показателями противовоспалительной активности, противоопухолевого потенциала, противомикробной активности и скорости роста по сравнению с мезенхимальными стволовыми клетками, получаемыми из других тканей, и способны к сохранению своей функциональности и стабильного кариотипа в течение по меньшей мере 10 пересеваний клеток. Кроме того, новый источник стволовых клеток позволяет выделять мезенхимальные стволовые клетки неинвазивным и безболезненным способом, т.к. указанную ткань можно получать всего лишь десквамацией указанного органа во время рутинного гинекологического осмотра.
На основании этого нового источника стволовых клеток и клеток, получаемых из него, авторы настоящего изобретения разработали следующие ниже аспекты изобретения, которые подробно описаны ниже.
Способ согласно настоящему изобретению
Как объясняется выше, авторы настоящего изобретения обнаружили, что ткань шейки матки можно использовать в качестве источника стволовых клеток, предпочтительно незлокачественную ткань шейки матки.
Таким образом, в одном из аспектов настоящее изобретение относится к способу выделения стволовых клеток, далее в настоящем описании "способу по изобретению", включающему:
(a) получение клеточной суспензии из ткани шейки матки,
(b) выделение клеток из указанной клеточной суспензии,
(c) инкубирование указанных клеток в подходящей среде для культивирования клеток в условиях, которые обеспечивают пролиферацию клеток, и
(d) отбор стволовых клеток.
Этапы (a)-(d) можно проводить общепринятыми способами, известными специалистам в данной области. Дополнительное преимущество этого нового источника стволовых клеток заключается в том, что он позволяет получать стволовые клетки из организма животного неинвазивным и безболезненным путем.
В контексте настоящего изобретения термин "неинвазивный" относится к способу, когда не повреждают кожу и полости организме не исследуют с использованием инструментов, которые не ограничиваются общепринятыми инструментами, используемыми для гинекологического осмотра. В контексте настоящего изобретения термин "безболезненный" относится к способу, который не вызывает физической боли. Таким образом, способ по изобретению представляет собой неинвазивный и безболезненный способ выделения стволовых клеток, т.к. источник, из которого выделяют указанные стволовые клетки, представляет собой шейку матки.
Таким образом, на первом этапе [этапе (а)] способ по изобретению включает получение клеточной суспензии из ткани шейки матки.
Термин "ткань шейки матки" относится к ткани, происходящей из шейки матки, т.е. органа, который отделяет тело и полость матки от влагалища. Шейка матки представляет собой узкий проход цилиндрической формы, который соединен своим нижний концом с влагалищем, а на своем верхнем конце шейка матки расширяется с образованием нижнего сегмента матки (перешейка); нижний сегмент матки в свою очередь расширяется в дно матки (фигура 18). Нижний конец шейки матки, который можно видеть изнутри влагалища при гинекологическом осмотре, известен как влагалищная часть шейки матки. В центре влагалищной части шейки матки открывается отверстие, известное как наружный зев, обеспечивая проход между маткой и влагалищем. Надвлагалищная часть шейки матки окружает эндоцервикальный канал, который представляет собой туннель через шейку матки от наружного зева в матку (фигура 19). Перекрывающаяся граница между влагалищной частью шейки матки и надвлагалищной частью шейки матки называется зоной трансформации. Зона трансформации представляет собой область, в которой предпочтительно собирать стволовые клетки по изобретению.
Ткань шейки матки можно получать любым известным специалисту в данной области общепринятым способом удаления ткани из организма животного, как инвазивными, такими как биопсия, так и неинвазивными способами, такими как десквамация шейки матки. Предпочтительно ткань шейки матки получают посредством десквамации шейки матки во время рутинного гинекологического осмотра, который предполагает неинвазивный и безболезненный путь получения стволовых клеток. Ткань шейки матки можно получать от любого подходящего млекопитающего, например коровы, овцы, свиньи, собаки, кошки, лошади, примата и т.д., предпочтительно людей.
После получения ткани шейки матки перед тем как обрабатывать ткань для выделения клеток по изобретению ее предпочтительно промывают от оставшейся части материала. В протоколе ткань шейки матки поддерживают в физиологически совместимом солевом растворе (например, фосфатно-солевом буфере (PBS)) или в среде, не содержащей сыворотки. Вследствие особых характеристик ткани шейки матки в конкретном варианте осуществления этап (а) способа по изобретению включает ферментативную дезагрегацию цервикальной слизи. В настоящем способе можно использовать любой фермент, способный дезагрегировать цервикальную слизь (например, коллагеназу, диспазу, трипсин и т.д.). Количество и длительность ферментативной обработки изменяется в зависимости от применяемых условий, но использование таких ферментов, как правило, известно в данной области. Альтернативно или в сочетании с такой ферментативной обработкой, цервикальную слизь можно расщеплять с использованием других видов обработки, таких как механическое перемешивание, энергия ультразвука, тепловая энергия и т.д. Если расщепление проводят ферментативными способами, желательно нейтрализовать фермент после подходящего периода для сведения к минимуму вредного воздействия на клетки.
На этапе расщепления, как правило, получают взвесь или суспензию агрегированных клеток и жидкую фракцию, содержащую, как правило, свободные стромальные клетки (например, эритроциты, эндотелиальные клетки, фибробласты и стволовые клетки). Следующая стадия [этап (b)] в способе относится к выделению клеток из указанной клеточной суспензии, что означает отделение агрегированных клеток от оставшейся части. Это можно проводить центрифугированием, которое приводит к тому, что клетки выпадают в осадок, покрытый супернатантом. Затем супернатант можно откидывать и суспендировать осадок в физиологически совместимой жидкости. Кроме того, суспендированные клетки, как правило, содержат эритроциты и во многих протоколах желательно их лизировать. Способы избирательного лизиса эритроцитов известны в данной области, и можно применять любой подходящий протокол (например, инкубацию в гипер- или гипотонической среде, посредством лизиса с использованием хлорида аммония и т.д.). Как известно, если лизируют эритроциты, затем из лизата необходимо отделять оставшиеся клетки, например, фильтрованием, седиментацией, центрифугированием или фракционированием по плотности. Суспендированные клетки можно промывать, повторно центрифугировать и повторно суспендировать последовательно один или более раз для получения более высокой степени чистоты. Альтернативно, клетки можно разделять на основании профиля поверхностных клеточных маркеров или на основании размера и гранулярности клеток.
После выделения клеток из клеточной суспензии клетки культивируют в подходящей среде для культивирования клеток в условиях, которые обеспечивают пролиферацию клеток [этап (с)]. Предпочтительно клетки культивируют без дифференцировки с использованием подходящих сред для культивирования клеток в подходящих плотностях клеток и условиях культивирования. Таким образом, клетки культивируют без дифференцировки на твердой поверхности в присутствии подходящей среды для культивирования клеток [например, DMEM, DMEM-F12, альфа-MEM, RPMI, как правило с добавлением 5-25% (например, 20%) подходящей сыворотки, такой как эмбриональная бычья сыворотка, эмбриональная телячья сыворотка, сыворотка новорожденных телят, телячья сыворотка, свиная сыворотка, овечья сыворотка, лошадиная сыворотка, сыворотка человека или факторы сыворотки человека, аминокислоты и т.д.] и инкубируют в условиях, которые обеспечивают пролиферацию клеток. Условия культивирования, т.е. pH, температура и т.д., общепринято известны специалисту в данной области. Предпочтительно, клетки культивируют на твердой поверхности и в условиях, которые обеспечивают прикрепление к указанной твердой поверхности и пролиферацию клеток.
Как используют в настоящем описании, термин "твердая поверхность" относится к любому материалу, который обеспечивает прикрепление клеток по изобретению. Например, указанный материал представляет собой пластиковый материал, такой как чашки Петри или колбы для культивирования клеток, обработанный, чтобы облегчать прикрепление клеток млекопитающих к его поверхности, например, коммерчески доступные полистироловые планшеты, необязательно покрытые желатином, фибронектином, поли-D-лизином или другими реагентами. После инкубации клетки промывают для удаления неприкрепившихся клеток и фрагментов клеток.
После пролиферации клеток их можно поддерживать в культуре в той же среде и в тех же условиях до тех пор, пока они не достигнут достаточной конфлюэнтности, как правило, приблизительно 80% конфлюэнтности клеток, с заменой среды для культивирования клеток при необходимости. После достижения желаемой конфлюэнтности клеток клетки можно подвергать экспансии посредством последовательных пересеваний с использованием средства для открепления, такого как трипсин, и высевания на большую поверхность культуры клеток при подходящей плотности клеток (как правило, 2000-10000 клеток/см2). Таким образом, затем клетки пересевают по меньшей мере два раза в такой среде без дифференцировки, при этом они все еще сохраняют свой фенотип развития. Более предпочтительно, клетки можно пересевать по меньшей мере 10 раз (например, по меньшей мере 15 раз или даже по меньшей мере 20 раз) без потери фенотипа развития. Как правило, клетки высевают при желаемой плотности, такой как приблизительно от 100 клеток/см2 приблизительно до 100000 клеток/см2 (такой как приблизительно от 500 клеток/см2 приблизительно до 50000 клеток/см2, или более конкретно приблизительно от 1000 клеток/см2 приблизительно до 20000 клеток/см2). В случае высевания при более низких плотностях (например, приблизительно 300 клеток/см2) для клеток можно более просто выделять клоны. Например, через несколько суток клетки, высеваемые при таких плотностях, пролиферируют в гомогенные популяции.
Наконец, способ включает отбор стволовых клеток [этап (d)]. Стволовые клетки можно отбирать любым общепринятым способом, таким как иммуноцитохимия (ICC), проточная цитометрия и т.д. Иммуноцитохимия представляет собой технику, используемую для оценки наличия конкретного белка или антигена в клетках (культивируемых клетках, клеточных суспензиях) с использованием специфического антитела, которое с ним связывается, таким образом, обеспечивая возможность визуализации и исследования под микроскопом. Как известно специалисту, клетки, подлежащие окрашиванию, можно фиксировать на твердой подложке для обеспечения простоты обработки при последующих процедурах, что можно получать несколькими способами: прикрепленные клетки можно выращивать на предметных стеклах, покровных стеклах, оптически подходящей пластиковой подложке и т.д. С другой стороны, проточная цитометрия представляет собой биофизический способ на основе лазера, применяемый при подсчете, сортировке клеток, детекции биомаркеров и конструировании белков, путем удержания клеток в потоке жидкости и пропускания их через устройство электронной детекции. Определенный тип проточной цитометрии представляет собой активируемую флуоресценцией сортировку клеток или FACS. Она представляет собой способ сортировки гетерогенной смеси биологических клеток в два или более контейнера по одной клетке за один раз в зависимости от специфического светорассеяния и характеристики флуоресценции каждой клетки. Эти способы широко известны специалисты в данной области, также как и клеточные маркеры, например, маркеры клеточной поверхности, которые необходимо детектировать для идентификации или отбора стволовых клеток.
При желании любой из этапов и процедур выделения стволовых клеток можно проводить вручную. Альтернативно, способ выделения таких клеток можно облегчать и/или автоматизировать посредством одного или более подходящих устройств, примеры которых известны в данной области. В примере 1 подробно описывают выделение клеток по изобретению из ткани шейки матки человека. В результате способа по изобретению получают гомогенную популяцию стволовых клеток шейки матки.
Таким образом, в конкретном варианте осуществления выделенные стволовые клетки:
(a) экспрессируют клеточные маркеры CD29, CD44, CD73, CD90, CD105, виментин, цитокератин (СКАЕ1АЕ3), Klf4, Oct4 и Sox-2, и
(b) не экспрессируют по меньшей мере один клеточный маркер, выбранный из группы, состоящей из десмина, актина HHF35, β-катенина, р63, Е-кадгерина, CD 117, CD133, HLA-DR, TRA1-81, CD45, CD34 и CD31.
Подтверждение представляющего интерес фенотипа проводить с использованием общепринятых средств. Клеточные маркеры, например, маркеры клеточной поверхности, можно идентифицировать любым подходящим общепринятым способом, как правило, на основе позитивного/негативного отбора, например, можно использовать моноклональные антитела против маркеров клеточной поверхности, наличие/отсутствие которых в клетках необходимо подтверждать, хотя также можно использовать другие способы.
Моноклональные антитела против клеточных маркеров CD29, CD44, CD73, CD90, CD105, виментина, цитокератина (СКАЕ1АЕ3), Klf4, Oct4 и Sox-2 используют для подтверждения наличия указанных маркеров в отбираемых клетках (или детектируемых уровней экспрессии указанных маркеров) и моноклональные антитела против по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 клеточных маркеров, выбранных из группы, состоящей из десмина, актина HHF35, β-катенина, p63, Е-кадгерина, CD117, CD133, HLA-DR, TRA1-81, CD45, CD34 и CD31, используют для подтверждения их отсутствия. Указанные моноклональные антитела являются известными, коммерчески доступными, или специалист в данной области может их получать общепринятыми способами.
В другом конкретном варианте осуществления выделенные стволовые клетки, дополнительно характеризуются:
(a) скоростью пролиферации от 0,4 до 2,1 удвоений в течение 24 часов в среде для выращивания,
(b) фибробластоподобной морфологией,
(c) стабильным кариотипом в течение по меньшей мере 10, предпочтительно 20 пересеваний клеток,
(d) способностью расти в монослое и прикрепляться к субстрату,
(e) способностью дифференцироваться в эндоремальном, эктодермальном или мезодермальном направлении, предпочтительно адипогенном, остеогенном, нейрональном или миоцитарном направлении клеточной дифференцировки,
(f) отсутствием опухолеобразующей способности и/или
(g) способностью образовывать сферы.
В другом конкретном варианте осуществления способ, описываемый в настоящем описании, характеризуется тем, что ткань шейки матки не является злокачественной тканью шейки матки, предпочтительно не является злокачественной тканью шейки матки млекопитающего и более предпочтительно не является злокачественной тканью шейки матки человека.
Термин "незлокачественная ткань шейки матки" относится к ткани шейки матки с морфологией отличной от морфологии нормальной ткани шейки матки, такой как злокачественная опухоль или злокачественная ткань.
Подробное описание стволовых клеток, получаемых способом по изобретению, можно найти ниже.
В связи с указанным выше специалисту в данной области понятно, что использование выделенной ткани шейки матки, предпочтительно незлокачественной выделенной ткани шейки матки, т.е. ткани, удаленной из своего естественного окружения (шейки матки) и, таким образом, с измененным "рукой человека" состоянием относительно своего природного состояния для получения стволовых клеток шейки матки, предпочтительно, незлокачественных стволовых клеток шейки матки, предусматривают как другой аспект настоящего изобретения. Клетка и кондиционированная среда по изобретению
Вследствие применения на практике способа по изобретению (описываемого выше) получают стволовую клетку шейки матки.
Таким образом, в другом аспекте настоящее изобретение относится к выделенной стволовой клетке шейки матки, далее в настоящем описании "клетке по изобретению", где указанная клетка:
(a) экспрессирует клеточные маркеры CD29, CD44, CD73, CD90, CD105, виментин, цитокератин (СКАЕ1АЕ3), Klf4, Oct4 и Sox-2, и
(b) не экспрессирует по меньшей мере один клеточный маркер, выбранный из группы, состоящей из десмина, актина HHF35, β-катенина, p63, Е-кадгерина, CD117, CD133, HLA-DR, TRA1-81, CD45, CD34 и CD31.
В контексте настоящего изобретения, термин "выделенная" относится к клетке, выделенной из организма человека или животного, который по существу не содержит одну или более клеток, которые ассоциированы с указанной клеткой in vivo или in vitro.
Стволовая клетка, получаемая способом по изобретению, экспрессирует клеточные маркеры CD29, CD44, CD73, CD90, CD105, виментин, цитокератин (СКАЕ1АЕ3), Klf4, Oct4 и Sox-2. В контексте настоящего изобретения считается, что клетка экспрессирует клеточный маркер, когда наблюдают "значительную экспрессию" анализируемого клеточного маркера. Как используют в настоящем описании, выражение "значительная экспрессия" означает, что в популяции клеток, содержащей клетку по изобретению, для более 10%, предпочтительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или для всех клеток, выявляют сигнал специфического клеточного маркера при проточной цитометрии или иммуноцитохимии выше фонового сигнала общепринятыми способами и с использованием общепринятых устройств (например, системы Beckman Coulter Epics XL FACS или системы Dako Autostainer Plus, используемой с коммерчески доступными антителами и стандартными протоколами, известными в данной области). Для цитокератина (СКАЕ1АЕ3) "значительная экспрессия" означает наличие очаговой экспрессии. Фоновый сигнал определяют как интенсивность сигнала, обеспечиваемого неспецифическим антителом того же изотипа как специфическое антитело, используемое для детекции каждого поверхностного маркера в общепринятом анализе FACS. Таким образом, для того, чтобы считали, что маркера "присутствует" в клетке или является положительным, наблюдаемый специфический сигнал составляет более 10%, предпочтительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 500%, 1000%, 5000%, 10000% или выше по сравнению с интенсивностью фонового сигнала общепринятыми способами и с использованием общепринятых устройств (например, системы Beckman Coulter Epics XL FACS, используемой с коммерчески доступными антителами и стандартными протоколами, известными в данной области).
Кроме того, клетка по изобретению не экспрессирует по меньшей мере один клеточный маркер, выбранный из группы, состоящей из десмина, актина HHF35, β-катенина, p63, Е-кадгерина, CD117, CD133, HLA-DR, TRA1-81, CD45, CD34 и CD31, т.е. они являются отрицательными в отношении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 следующих маркеров: десмина, актина HHF35, β-катенина, p63, Е-кадгерина, CD117, CD133, HLA-DR, TRA1-81, CD45, CD34 и CD31.
Как используют в настоящем описании, "отрицательный" в отношении клеточных маркеров означает, что в популяции клеток, содержащей клетку по изобретению, для менее 10%, предпочтительно 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или ни для одной из клеток не выявляют сигнал специфического клеточного маркера при проточной цитометрии или иммуноцитохимии выше фонового сигнала общепринятыми способами и с использованием общепринятого устройства (например, системы Beckman Coulter Epics XL FACS или системы Dako Autostainer Plus с использованием коммерчески доступных антител и стандартных протоколов, известных в данной области).
Преимущественно, как показано в примерах, клетка по изобретению обладает другими пригодными характеристиками. Таким образом, в конкретном варианте осуществления клетка по изобретению дополнительно обладает по меньшей мере одним, предпочтительно всеми следующими ниже признаками:
(a) Скоростью пролиферации от 0,4 до 2,1 удвоений за 24 часа в среде для выращивания.
Высокая скорость роста клеток по изобретению обеспечивает быструю и в больших количествах продукцию стволовых клеток или кондиционированной среды. Это обеспечивает возможность (i) проведения большего числа экспериментов для анализа биологии и применения таких стволовых клеток (что затруднительно проводить с мезенхимальными стволовыми клетками, известными в настоящее время в существующем уровне техники, которые обладают низкой скоростью роста); (ii) быстрой регенерацией ткани, т.к. можно получать большое число стволовых клеток за короткий период времени, и (iii) быстрого получения большого количества стволовых клеток для их использования в противовоспалительной, противоопухолевой и противоинфекционной видах терапии.
(b) Фибробластоподобной морфологией.
(c) Стабильным кариотипом в течение по меньшей мере 10, предпочтительно 20 пересеваний клеток, т.е. клетки сохраняют в течение длительного времени число и визуальные характеристики хромосом с ядре.
Это позволяет обеспечивать функциональность стволовых клеток в течение длительного периода времени с возможностью получения воспроизводимого и эффективного лекарственного средства на всем протяжении пересеваний стволовых клеток.
(d) Способностью расти а монослое и прикрепляться к субстрату.
(e) Способностью дифференцироваться в эндоремальном, эктодермальном или мезодермальном направлении, предпочтительно адипогенном, остеогенном, нейрональном или миоцитарном направлении клеточной дифференцировки.
Способность отобранных клеток дифференцироваться по меньшей мере в одном из указанных направлений дифференцировки можно оценивать общепринятыми известными в данной области способами и может представлять собой общепринятую практику для специалиста.
(f) Отсутствием опухолеобразующей способности, т.е. они не представляют изменений фенотип поведения или пролиферации, который приводит к образованию опухолевой клетки.
(g) Способностью образовывать сферы, т.е. способностью образовывать группу или колонию клеток в суспензионной культуре, высоко пролиферативные в присутствие митогенных факторов (в основном эпидермального фактора роста (EGF) и фактора роста фибробластов (FGF)). Эта способность является потенциальным способом получения in vitro нейроноподобных клеток-предшественников.
В конкретном варианте осуществления клетка по изобретению происходит от человека, предпочтительно, от человека не находящегося в фазе менструального цикла.
Специалисту в данной области понятно, что клетка по изобретению может являться частью популяции клеток. Таким образом, в другом аспекте изобретение относится к выделенной популяции клеток, содержащей клеток по изобретению, далее в настоящем описании "популяции клетка по изобретению".
Термин "выделенный", применяемый к популяции клеток, относится к популяции клеток, выделенной из организма человека или животного, которая по существу не содержит одну или более популяций, который ассоциированы с указанной популяцией клеток in vivo или in vitro.
Для клетки и популяции клеток, предоставляемых по настоящему изобретению, при желании можно проводить наращивание клонов подходящим способом клонирования популяции клеток. Например, пролиферирующую популяцию клеток можно физически отбирать и высевать в отдельных планшет (или в лунку много луночного планшета). Альтернативно, клетки можно субклонировать на многолуночном планшете со статистическими показателями для облегчения помещения одной клетки в каждую лунку. Как известно, клетки можно клонировать высеванием их при низкой плотности (например, в чашку Петри или другой подходящий субстрат) и отделением их от других клеток с использованием устройства, такого как клонзапирающие кольца. Продукцию популяции клонов можно наращивать в любой подходящей среде для культивирования. В любом случае выделенные клетки можно культивировать до подходящей точки, когда можно оценивать их фенотип развития.
Дополнительно к стволовой клетке шейки матки настоящее изобретение также предусматривает кондиционированную среду, получаемую из культуры указанной клетки. Как понятно специалисту, кондиционированную среду можно использовать вместо самих клеток, т.к. такая кондиционированная среда обеспечивает многие соединения, секретируемые клетками по изобретению.
Таким образом, в другом аспекте изобретение относится к кондиционированное среде, далее в настоящем описании "кондиционированной среде по изобретению", получаемой способом, включающим:
(a) инкубацию выделенной стволовой клетки по изобретению или популяции клеток по изобретению, и
(b) удаление клетки из среды для культивирования.
Как используют в настоящем описании, термин "кондиционированная среда" относится к истощенной среде, собираемой от культивируемых клеток, т.е. от культивируемых клеток по изобретению (стволовых клеток шейки матки). Кондиционированная среда содержит метаболиты, факторы роста и белки внеклеточного матрикса, секретируемые в среду культивируемыми клетками. Примеры каждого компонента включают, но не ограничиваются, метаболитами, такими как глюкоза, аминокислоты, нуклеозиды и т.д.; факторы роста, такие как интерлейкины, EGF (эпидермальный фактор роста), PDGF (тромбоцитарный фактор роста) и т.д., и матриксные белки, такие как коллаген, фибронектин, различные протеогликаны и т.д.
Кондиционированную среду по изобретению получают культивированием выделенной клетки по изобретению в подходящих условиях и в течение периода времени, достаточного для того, чтобы клетки секретировали активные соединения в среду. Подходящая среда для культивирования клеток для культивирования клеток по изобретению включает, например, DMEM, DMEM-F12 или альфа-MEM, RPMI, как правило, с добавлением 5-25% (например, 20%) подходящей сыворотки, такой как такой как эмбриональная бычья сыворотка, эмбриональная телячья сыворотка, сыворотка новорожденных телят, телячья сыворотка, свиная сыворотка, овечья сыворотка, лошадиная сыворотка, сыворотка человека или факторы сыворотки человека, аминокислоты и т.д. Условия культивирования, т.е. pH, температура и т.д., общепринято известны специалисту в данной области. Предпочтительно, клетки культивируют на твердой поверхности и в условиях, которые обеспечивают прикрепление к указанной твердой поверхности и пролиферацию клеток. С другой стороны, культивирование клеток можно проводить с использованием биореактора, позволяющего поддерживать большой объем среды и подходящем образом регулировать окружающую среду клетки. Биореакторы широко известны на существующем уровне техники и их использование является общепринятом для специалиста.
Затем после культивирования среду подвергают удалению клеток. Это модно проводить любым общепринятым способом, например, декантацией, центрифугированием, фильтрованием и т.д. Затем супернатант собирают в виде кондиционированной среды и хранят при 4°C, -20°C, -80°C в жидком азоте или в других условиях, которые могут сохранять его функциональность, таких как, но, не ограничиваясь ими, сушка вымораживанием, лиофилизация или сушка сублимацией, или его можно сразу использовать. Кондиционированную среду можно получать или обрабатывать, чтобы она являться концентрированной или разбавленной. Кроме того, можно синтезировать всю или часть композиции кондиционированной среды.
Применение клетки по согласно настоящему изобретению
После выделения клетки по изобретению клетку и получаемую от нее кондиционированную среду можно использовать для получения фармацевтической композиции.
Таким образом, в другом аспекте изобретение относится к фармацевтической композиции, содержащей выделенную стволовую клетку, популяцию клеток или кондиционированную среду по изобретению, далее в настоящем описании "фармацевтической композиции по изобретению", и фармацевтически приемлемый носитель и/или адъювант.
Фармацевтическая композиция по изобретению содержит профилактически или терапевтически эффективное количество клетки по изобретению, популяции клеток или кондиционированной среды по изобретению. Таким образом, термин "профилактически" или "терапевтически эффективное количество" относится к количеству средства, способного оказывать терапевтическое действие, определяемое его фармакологическими свойствами. Его рассчитывают для оказания желаемого действия и, как правило, определяют, в частности путем объединения характеристик соединений и пациентов, включая возраст, состояние пациента, тяжести нарушения или расстройства и пути и частоты введения.
Термин "фармацевтически приемлемый носитель" означает, что носитель одобрен регулирующим органом федерального правительства или правительства штата или перечислен в фармакопее США или Европейской фармакопее, или другой общепризнанной фармакопее для применения у животных и более конкретно у людей. Термин "носитель" относится к разбавителю, адъюванту, эксципиенту или носителю, совместно с которым вводят терапевтическое средство. При желании композиция также может содержать незначительные количества средств для буферирования pH. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" by E.W. Martin (18th edition, Mack Publishing Co.). Такие композиции содержат профилактически или терапевтически эффективное количество клетки по изобретению или популяцию клеток по изобретению предпочтительно в очищенной форме или кондиционированную среду по изобретению совместно с подходящим количеством носителя, таким образом, чтобы обеспечивать форму для подходящего введения индивидууму. Состав должен соответствовать способу введения. Предпочтительно фармацевтические композиции являются стерильными и находятся в подходящей форме для введения индивидууму, предпочтительно являющемуся животным индивидууму, более предпочтительно являющемуся млекопитающим индивидууму и наиболее предпочтительно являющемуся человеком индивидууму.
Фармацевтическая композиция по изобретению может находиться в различных формах. Они включают, например, твердые, полутвердые и жидкие лекарственные формы, такие как лиофилизированные препараты, жидкие растворы или суспензии, инъецируемые и инфузионные растворы и т.д. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения.
Введение клетки или популяции клеток или кондиционированной среды по изобретению, или содержащей их фармацевтической композиции нуждающемуся в этом индивидууму можно проводить общепринятыми способами. Предпочтительно указанную клетку или популяцию клеток вводят индивидууму способом, который включает перенос клеток в желаемую ткань in vitro или in vivo непосредственно в ткань животного. Клетку или кондиционированную среду можно переносить в желаемую ткань любым подходящим способом, который, как правило, изменяется в зависимости от типа ткани. Например, клетки можно высевать на желаемом участке в ткани для установления популяции и т.д. Клетки или кондиционированную среду можно переносить на участки in vivo с использованием устройств, таких как катетеры, трокары, канюлей, стентов, хирургическая нить (которую можно вводить при посеве с клетками или смоченной кондиционированной средой) и т.д.
Как видно в примерах, клетку по изобретению или кондиционированную среду по изобретению можно использовать для профилактики, лечения или улучшения состояния одного или более симптомов, ассоциированных с нарушениями, при которых благоприятной является модуляция иммунной системы индивидуума, включая, но, не ограничиваясь ими, воспалительные нарушения, аутоиммунные заболевания, иммунологически обусловленные заболевания, включая отторжение трансплантируемых органов и тканей, хронические патологии и инфекционные заболевания. Кроме того, благодаря противоопухолевому потенциалу их можно также использовать для лечения или профилактики злокачественной опухоли. Кроме того, благодаря их способности регенерировать или стимулировать регенерацию ткани (регенеративная медицина) их можно использовать при заживлении ран или других процессах, связанных с разрушением тканей.
Кроме того, благодаря их способности регенерировать или стимулировать регенерацию ткани (регенеративная медицина) их можно использовать при заживлении ран или других процессах, ассоциированных с разрушением тканей. Кроме того, благодаря их способности секретировать вещества в слизь канала шейки матки (которые помогают сперматозоидам проходить цервикальный канал матки и достигать яйцеклетку) их можно использовать в процессе оплодотворения. Как можно видеть из примеров, клетки или кондиционированная среда по изобретению модулирует характеристики свежего эякулята и ограничивает сперматозоиды, способствуя отборы подходящих половых клеток для процесса оплодотворения.
Таким образом, в другом аспекте настоящее изобретение относится к клетке, популяции клеток, кондиционированной среде или фармацевтической композиции по изобретению для применения в качестве лекарственного средства.
В другом аспекте настоящее изобретение относится к клетке, популяции клеток, кондиционированной среде или фармацевтической композиции по изобретению для применения для лечения или профилактики злокачественной опухоли, воспалительных заболеваний, аутоиммунных заболеваний, хронических патологий, инфекционных заболеваний, заболеваний с ткань потерей/разрушением тканей или для применения в диагностике, прогнозировании или лечении нарушений фертильности.
Как используют в настоящем описании, "лечение", "лечить" или "лечащий" относится к: (а) профилактике возникновения заболевания или состояния у индивидуума, который может являться предрасположенным к заболеванию или состоянию, но у которого еще не диагностировали его; (b) ингибированию заболевания или состояния, т.е. подавлению его развития; (с) ослабления и/или улучшения состояния заболевания или состояния, т.е. вызывания ремиссии заболевания или состояния, или (d) излечиванию заболевания или состояния, т.е. прекращению его развития или прогрессирования. Популяция индивидуумов, которая получает лечение стволовой клеткой, популяцией клеток, кондиционированной средой или фармацевтической композицией по изобретению, включает индивидуумов, страдающих нежелательным состоянием или заболеванием, а также индивидуумов, подвергающихся риску развития состояния или заболевания. В настоящем изобретении заболевания, в отношении которых проводят лечения, выбраны из злокачественной опухоли, предопухолевых состояний, воспалительного заболевания, аутоиммунного заболевания, иммунологически обусловленного заболевания, включая отторжение трансплантированных органов и тканей, хронической патологии и инфекционного заболевания; заболеваний с разрушением тканей или потерей ткани и нарушений фертильности.
Термины "нарушение" и "заболевание" используют взаимозаменяемо для обозначения состояния у индивидуума.
Термин "злокачественная опухоль" относится к классу заболевания, вызываемому нарушением процессов регуляции, которые в норме направляют клеточную пролиферацию, дифференцировку и выживаемость клеток, приводя к образованию клеток, которые претерпевают злокачественную трансформацию (также называемых злокачественными клетками или опухолевыми клетками), прорастая в окружающую ткань (и образуя злокачественную опухоль), и которые могут в конечном итоге мигрировать в другие отделы организма с образованием вторичных опухолей в процессе, называемом метастазированием. Кроме того, в контексте настоящего изобретения термин "опухоль" относится к аномальным тканевым массам и включает доброкачественные и злокачественные массы. Доброкачественные тканевые массы также можно лечить клетками, популяцией клеток, кондиционированной средой или фармацевтической композицией по изобретению.
Иллюстративные злокачественные опухоли включают, но не ограничиваются ими, адренокортикальную карциному, СПИД-ассоциированные злокачественные опухоли, СПИД-ассоциированную лимфому, рак анального канала, рак прямой кишки, злокачественную опухоль анального канала, злокачественную опухоль аппендикса, детскую мозжечковую астроцитому, детскую церебральную астроцитому, базально-клеточную карциному, рак желчных протоков, рак внепеченочных желчных протоков, рак внутрипеченочных желчных протоков, рак мочевого пузыря, злокачественную опухоль костей и суставов, остеосаркому и злокачественную фиброзную гистиоцитому, злокачественную опухоль головного мозга, опухоль головного мозга, глиому ствола головного мозга, астроцитому мозжечка, астроцитому головного мозга/злокачественную глиому, эпендимому, супратенториальные примитивные нейроэктодермальные опухоли, глиому зрительного пути и гипоталамуса, рак молочной железы, аденомы бронхов/карциноиды, карциноидную опухоль, злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль нервной системы, лимфому нервной системы, злокачественную опухоль центральной нервной системы, лимфому центральной нервной системы, рак шейки матки, детские злокачественные опухоли, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, хронические миелопролиферативные нарушения, рак толстого кишечника, колоректальный рак, Т-клеточную лимфому кожи, лимфоидную неоплазию, грибовидный микоз, синдром Сезари, рак эндометрия, рак пищевода, экстракраниальную гермиогенную опухоль, внегонадную гермиогенную опухоль, рак внепеченочных желчных протоков, злокачественную опухоль глаза, внутриглазную меланому, ретинобластому, рак желчного пузыря, карциноидную опухоль желудочно-кишечного тракта, гастроинтестинальную стромальную опухоль (GIST), герминогенную опухоль, герминогенную опухоль яичника, гестационную трофобластическую болезнь, глиому, рак головы и шеи, гепатоцеллюлярный рак (печени), лимфому Ходжкина, гипофарингеальную злокачественную опухоль, внутриглазную меланому, злокачественную опухоль глаза, опухоли из островковых клеток поджелудочной железы (эндокринной поджелудочной железы), саркому Калоши, рак почки, злокачественную опухоль почки, рак почки, рак гортани, острый лимфобластный лейкоз, острый миелолейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, волосатоклеточный лейкоз, злокачественную опухоль губы и полости рта, рак печени, рак легкого, немелкоклеточный рак легких, мелкоклеточный рак легких, СПИД-ассоциированную лимфому, неходжкинскую лимфому, первичную лимфому центральной нервной системы, макроглобулинемию Вальденстрема, медуллобластому, внутриглазную меланому (глаза), карциному из клеток Меркеля, злокачественную мезотелиому, мезотелиому, метастатический плоскоклеточный рак шеи, злокачественную опухоль полости рта, злокачественную опухоль языка, синдром множественных эндокринных неоплазий, грибовидный микоз, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, хронический миелогенный лейкоз, острый миелолейкоз, множественную миелому, хронические миелопролиферативные нарушения, злокачественную опухоль носоглотки, нейробластому, злокачественную опухоль полости рта, злокачественную опухоль ротовой полости, рак ротоглотки, рак яичника, эпителиальный рак яичников, опухоль яичника с низким потенциалом злокачественности, рак поджелудочной железы, злокачественную опухоль из островковых клеток поджелудочной железы, злокачественную опухоль околоносовой пазухи и носа, рак паращитовидной железы, злокачественную опухоль полового члена, злокачественную опухоль глотки, феохромоцитому, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, новообразование из плазматических клеток/множественную миелому, плевролегочную бластому, рак предстательной железы, рак прямой кишки, рак переходных клеток почечной лоханки и мочеточника, ретинобластому, рабдомиосаркому, злокачественную опухоль слюнных желез, опухоли типа саркомы Юинга, саркому Калоши, саркому мягкой ткани, рак матки, саркому матки, рак кожи (не являющийся меланомой), рак кожи (меланомой), карциному кожи из клеток Меркеля, злокачественную опухоль тонкого кишечника, саркому мягких тканей, плоскоклеточную карциному, рак желудка (желудочный), супратенториальные примитивные нейроэктодермальные опухоли, рак яичка, рак горла, тимому, тимому и карциному тимуса, рак щитовидной железы, рак переходных клеток почечной лоханки и мочеточника и других органов мочевыделения, гестационную трофобластическую болезнь, злокачественную опухоль мочеиспускательного канала, саркому матки, рак тела матки, рак влагалища, рак наружных половых органов и опухоль Вильма.
Термин "предопухолевое состояние" относится к очагам поражения, для которых демонстрируют гистологические изменения, которые являются ассоциированными с повышенным риском развития злокачественной опухоли.
Термин "воспалительное заболевание" относится к состоянию у индивидуума, характеризующемуся воспалением, например, хроническим воспалением. Иллюстративные, неограничивающие примеры воспалительных нарушений, которые можно лечить клеткой, популяцией клеток, кондиционированной средой или фармацевтической композицией по изобретению, включают, но не ограничиваются ими, ревматоидный артрит (RA), воспалительное заболевание кишечника (IBD), астму, энцефалит, хроническое обструктивное заболевание легких (COPD), воспалительный остеолиз, аллергические заболевания, септический шок, легочный фиброз (например, идиопатический легочный фиброз), воспалительные васкулиты (например, узелковый периартериит, гранулематоз Вегнера, артериит Такаясу, височный артериит и лимфогранулематоз), посттравматическую ангиопластику сосудов (например, рестеноз после ангиопластики), недифференцированную спондилоартропатию, недифференцированную артропатию, артрит, воспалительный остеолиз, хронический гепатит и хроническое воспаление, являющееся результатом хронических вирусных или бактериальных инфекций.
Термин "аутоиммунное заболевание" относится к состоянию у индивидуума, характеризующемуся повреждением клеток, тканей и/или органов, вызываемым иммунологической реакцией индивидуума на собственные клетки, ткани и/или органы. Иллюстративные неограничивающие примеры аутоиммунных заболеваний, которые можно лечить клетками, популяцией клеток, кондиционированной средой или фармацевтической композицией по изобретению, включают очаговую алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную болезнь Аддисона, аутоиммунные заболевания надпочечников, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунный оофорит и орхит, аутоиммунную тромбоцитопению, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, дерматит типа целиакии-спру, синдром хронической усталости и иммунной дисфункции (CF1DS), хроническую воспалительную демиелинизирующую полинейропатию, синдром Черджа-Строса, рубцовый пемфигоид, CREST-синдром, болезнь Холодовых агглютининов, дискоидную волчанку, эссенциальную криоглобулинемию смешанного типа, фибромиалгию-фибромиозит, гломерулонефрит, болезнь Грейвса, синдром Гийена-Барре, тиреоидит Хашимото, идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру (ITP), нейропатию IgA, юношеский артрит, лишай Вильсона, болезнь Меньера, смешанное заболевание соединительной ткани, рассеянный склероз, сахарный диабет 1 типа или иммуноопосредованный сахарный диабет, тяжелую миастению, обыкновенную пузырчатку, пернициозную анемию, узелковый периартериит, полихондрию, полиполигландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный биллиарный цирроз, псориаз, псориатический артрит, болезнь Рейно, синдром Рейтера, саркоидоз, склеродермию, прогрессирующий системный склероз, синдром Шегрена, синдром Гудпасчера, синдром скованного человека, системную красную волчанку, красную волчанку, артериит Такаясу, височный артериит/гигантоклеточный артериит, язвенный колит, увеит, васкулиты, такие как васкулит типа герпетиформного дерматита, витилиго, гранулематоз Вегенера, и т.д.
Термин "хроническая патология" относится к состоянию у индивидуума, характеризующемуся длительным заболеванием, стабильным или с медленным прогрессированием, постоянно присутствующим или переходящим в ремиссию и периодически прогрессирующим. Иллюстративные неограничивающие примеры хронических заболеваний, которые можно лечить клеткой, популяцией клеток, кондиционированной средой или фармацевтической композицией по изобретению, включают сердечно-сосудистое заболевание, заболевание сердца, инсульт, злокачественную опухоль, хронические респираторные заболевания, такие как, но, не ограничиваясь ими, астма или хроническое обструктивное заболевание легких, диабет, артроз, ожирение, ВИЧ/СПИД, полость зуба, заболевание тканей пародонта, хронические инфекции уха, глаукома и хроническая вирусная или бактериальная инфекция.
Термин "инфекционное заболевание" относится к состоянию у индивидуума, характеризующемуся присутствием в организме патогенного микроорганизма, такого как, бактерии, вирусы, паразиты или грибы. Иллюстративные неограничивающие примеры инфекционных заболеваний, которые можно лечить клеткой, популяцией клеток, кондиционированной средой или фармацевтической композицией по изобретению, включают грипп, птичий грипп, ВИЧ/СПИД, легионеллез, сепсис, туберкулез, язву Бурули, трипаносомоз, геморрагическую лихорадку (например, геморрагическую лихорадку Марбурга, геморрагическую лихорадку Эбола или геморрагическую лихорадку денге), гепатит (например, гепатит A, гепатит B, гепатит C), менингит (например, менингококковый менингит), холеру, желтую лихорадку, малярия, лепру.
Термин "индивидуум" в указанных выше определениях относится к любому животному, включая, но, не ограничиваясь ими, млекопитающие, предпочтительно приматов, более предпочтительно людей. Таким образом, выделенную стволовую клетку, популяцию клеток, кондиционированную среду или фармацевтическую композицию по изобретению можно использовать для лечения любого животного, страдающего указанными выше заболеваниями.
Термин "разрушение ткани" или "потеря ткани" относится к заболеванию, при котором (а) удален определенный процент массы структуры, или b) присущий паттерн и число клеток, содержащих структуру, являются поврежденными или нефункциональными, тогда как некоторые рудиментарные клетки и/или паттерны сохраняются. Примеры заболеваний с разрушением ткани или потерей ткани выбраны из: заболеваний поверхности глаза, таких как заболевание сухого глаза, травма роговицы; или заболеваний сетчатки, таких как возрастная дегенерация желтого пятна, дистрофии-дегенерации сетчатки, или оптические нейропатии, глаукома, увеит, или заболеваний кожи, заболеваний сердца, заболеваний почек или центральной нервной системы, болезни Альцгеймера, бокового амиотрофического склероза или спинальной мышечной атрофии.
Термин "нарушения фертильности" относится к проблемам зачатия ребенка вследствие проблем, связанных с овуляцией, включая, но, не ограничиваясь ими, плохое качество яйцеклетки, расстройство овуляции в результате недостаточности или дисбаланса гормонов, нерегулярная овуляция и синдром поликистоза яичников (PCOS); или к проблемам, связанным со сперматозоидами, включая, но, не ограничиваясь ими, аномальные сперматозоиды, отсутствие жизнеспособных сперматозоидов или низкая подвижность. Таким образом, клетку, популяцию клеток, кондиционированную среду или фармацевтическую композицию по изобретению можно использовать для лечения нарушений фертильности, как у мужчин, так и у женщин.
Термин "половые клетки" относится к репродуктивной клетке, такой как сперматоцит или ооцит, или клетке, которая развивается в репродуктивную клетку.
Термин "подходящие половые клетки" относится к гаметам, которые после процесса оплодотворения становятся зиготами. Анализы определения, способны ли гаметы становится зиготами, известны из существующего уровня техники, и они являются общепринятой практикой для специалиста.
Настоящее изобретение также предусматривает клетку, популяцию клеток, кондиционированную среду или фармацевтическую композицию по изобретению для применения в комбинированном лечении для профилактики или лечения злокачественной опухоли, предопухолевых состояний, воспалительных заболеваний, аутоиммунных заболеваний, хронических патологий, инфекционных заболеваний, заболеваний, связанных с потерей ткани, или для применения в диагностике, прогнозировании или лечении нарушений фертильности.
Термин "комбинированное лечение" относится к применению клетки, популяции клеток, кондиционированной среды или фармацевтической композиции по изобретению с другими активными средствами или способами лечения способом по настоящему изобретению для улучшения состояния одного или более симптомов, ассоциированных с нарушением, включая, но, не ограничиваясь ими, злокачественную опухоль, предопухолевые состояния, воспалительные заболевания, аутоиммунные заболевания, хронические патологии, инфекционные заболевания или иммунологически обусловленное заболевание, включая отторжение трансплантированных органов и тканей, а также заболевания, связанные с потерей ткани и нарушениями фертильности.
Такие другие средства или виды лечения могу включать известные лекарственные средства и виды терапии для лечения таких нарушений. Клетку, популяцию клеток, кондиционированную среду или фармацевтическую композицию по изобретению также можно комбинировать с кортикостероидами, нестероидными противовоспалительными соединениями или другими средствами, пригодными для терапии злокачественной опухоли, воспалительных заболеваний, аутоиммунных заболеваний, хронических патологий. Комбинированное использование средств по настоящему изобретению с такими другими видами терапии или способами лечения может проводить одновременно или проводить последовательно, другими словами, два вида лечения можно разделять, таким образом, что популяцию клеток или содержащую ее фармацевтическую композицию по настоящему изобретению можно вводить до или после другой терапии или способа лечения. Лечащий врач может определять подходящую последовательность введения популяции клеток или содержащей ее фармацевтической композиции в комбинации с другими средствами, терапией или способом лечения.
В другом аспекте настоящее изобретение также относится к клетке, популяции клеток, кондиционированной среде или фармацевтической композиции по изобретению для применения в косметическом лечении.
В настоящем изобретении термин "косметическое лечение" относится к лечению для улучшения состояния внешнего вида кожи, например, путем улучшения текстуры кожи, в частности для применения для стареющей кожи, в частности к сморщенной, морщинистой коже и/или коже с ямочками (целлюлит) или для улучшения внешнего вида ожогов. В этом случае косметический препарат предпочтительно формулировать в виде крема, лосьона, геля или воска, и он может содержать соединение для улучшения косметического эффекта. Косметический препарат предпочтительно применять накожно, подкожно или чрескожно, местно, трансдермально, внутрикожно или внутриэпидермально. Преимущественно стволовую клетку, популяцию клеток, кондиционированную среду или фармацевтическую композицию по изобретению можно применять просто в виде косметического наполнителя, известного из существующего уровня техники. Препарат стволовых клеток или кондиционированной среды также можно инъецировать в нескольких точках в области, где необходимо улучшать текстуру кожи, например, вокруг и/или под сморщенной, морщинистой кожей и/или кожей в ямочку предпочтительно от 200 мкл до 2 мл, наиболее предпочтительно от 0,5 мл до 2 мл на точку.
В другом аспекте изобретение относится к выделенной стволовой клетке, популяции клеток, кондиционированной среде или фармацевтической композиции по изобретению для ингибирования или снижения пролиферации и/или метастазирования опухолевых клеток, дифференцировки моноцитов, роста и/или репликации патогенных микроорганизмов или пролиферации мононуклеарных клеток периферической крови, или для усиления или индукции апоптоза опухолевых клеток или для усиления регенерации ткани (регенеративная медицина), или для применения в диагностике, прогнозировании или лечении нарушений фертильности или для применения при отборе половых клеток.
Термин "ингибирующий" или "ингибирование" пролиферации и/или метастазирования опухолевых клеток относится к прекращению, блокированию или предотвращению, соответственно, клеточного деления опухолевой клетки или к прекращению, блокированию или предотвращению распространения опухолевой клетки из одного органа или отдела в другой несмежный орган или отдел. Аналогично, термин "снижение" пролиферации и/или метастазирования опухолевых клеток, соответственно, относится к снижению клеточного деления опухолевой клетки или к снижению распространения опухолевой клетки из одного органа или отдела в несмежный орган или отдел.
Термин "ингибирующий" или "ингибирование моноцитарной дифференцировки моноцитов и/или пролиферации мононуклеарных клеток периферической крови" относится к прекращению, блокированию или предотвращению, соответственно, дифференцировки моноцитов в макрофаги или к прекращению, блокированию или предотвращению клеточного деления мононуклеарных клеток периферической крови. Аналогично, термин "снижение дифференцировки моноцитов и/или пролиферация мононуклеарных клеток периферической крови" соответственно относится к снижению дифференцировки моноцитов в макрофаги или к снижению клеточного деления мононуклеарных клеток периферической крови.
Термин "ингибирующий" или "ингибирование роста и/или репликации патогенных микроорганизмов" относится к прекращению, блокированию или предотвращению клеточного деления микроорганизма. Как следствие число микроорганизмов снижается или остается постоянным.
Выражение "усиление апоптоза опухолевых клеток" является аналогичным "индукции апоптоза опухолевых клеток", и оба выражения означают повышение или вызывание процесса программируемой гибели опухолевых клеток. Способы определения ингибирования или снижения пролиферации и/или метастазирования опухолевых клеток, дифференцировки моноцитов, роста и/или репликации патогенных микроорганизмов или пролиферации мононуклеарных клеток периферической крови представлены в примерах настоящего описания, наряду со способами проверки, усиливается или индуцируется ли апоптоз опухолевых клеток. Все эти способы широко известны в существующем уровне техники и являются общепринятой практикой для специалиста.
С другой стороны, настоящее изобретение также предусматривает набор, содержащий клетку, популяцию клеток, кондиционированную среду или фармацевтическую композицию по изобретению, а также применение указанного набора для лечения или профилактики злокачественной опухоли, воспалительных заболеваний, аутоиммунных заболеваний, хронических патологий или инфекционного заболевания, заболеваний, ассоциированных с разрушением тканей или потерей тканей, нарушений фертильности и для ингибирования или снижения пролиферации и/или метастазирования опухолевых клеток, дифференцировки моноцитов или пролиферации мононуклеарных клеток периферической крови, или для усиления или индукции апоптоза опухолевых клеток, или для усиления или индукции регенерации ткани, или для применения в диагностике, прогнозировании или лечении нарушений. Изобретение также относится к применению набора по изобретению в косметических целях.
Кроме того, в контексте настоящего изобретения также предусматривают соответствующие способы лечения, эквивалентные видам использования клетки популяции клеток, кондиционированной среды или фармацевтической композиции по изобретению, описываемых в настоящем описании.
В этом смысле в другом аспекте изобретение относится к способу лечения или профилактики злокачественной опухоли, воспалительных заболеваний, аутоиммунных заболеваний, хронических патологий или инфекционного заболевания, заболеваний, ассоциированных с потерей тканей, или нарушений фертильности у индивидуума, нуждающегося в таком лечении, или профилактики, предусматривающей введение индивидууму терапевтически эффективного количества выделенной стволовой клетки, популяции клеток, кондиционированной среды или фармацевтической композиция по изобретению.
Кроме того, настоящее изобретение относится к способу ингибирования или снижения пролиферации и/или метастазирования опухолевых клеток, дифференцировки моноцитов или пролиферации мононуклеарных клеток периферической крови, или усиления или индукции апоптоза опухолевых клеток, или усиления или индукции регенерации ткани, или увеличения отбора половых клеток или для применения в диагностике, прогнозировании или лечении нарушений фертильности у нуждающегося в этом индивидуума, включающему введение индивидууму терапевтически эффективного количества выделенной стволовой клетки, популяции клеток, кондиционированной среды или фармацевтической композиции по изобретению.
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, как общепринято понимает специалист в данной области, к которой принадлежит данное изобретение. В практическом осуществлении настоящего изобретения можно использовать способы и вещества, аналогичные или эквивалентные тем, которые описывают в настоящем описании. На всем протяжении описания и формулы изобретения слово "содержит" и его варианты не предназначены исключать другие технические признаки, добавки, компоненты или этапы. Дополнительные объекты, преимущества и признаки изобретения станут понятны специалистам в данной области при анализе описания, или их можно узнать при практическом осуществлении изобретения. Следующие ниже примеры, чертежи и список последовательностей предоставлены в качестве иллюстрации и не предназначены ограничивать настоящее изобретение.
Краткое описание чертежей
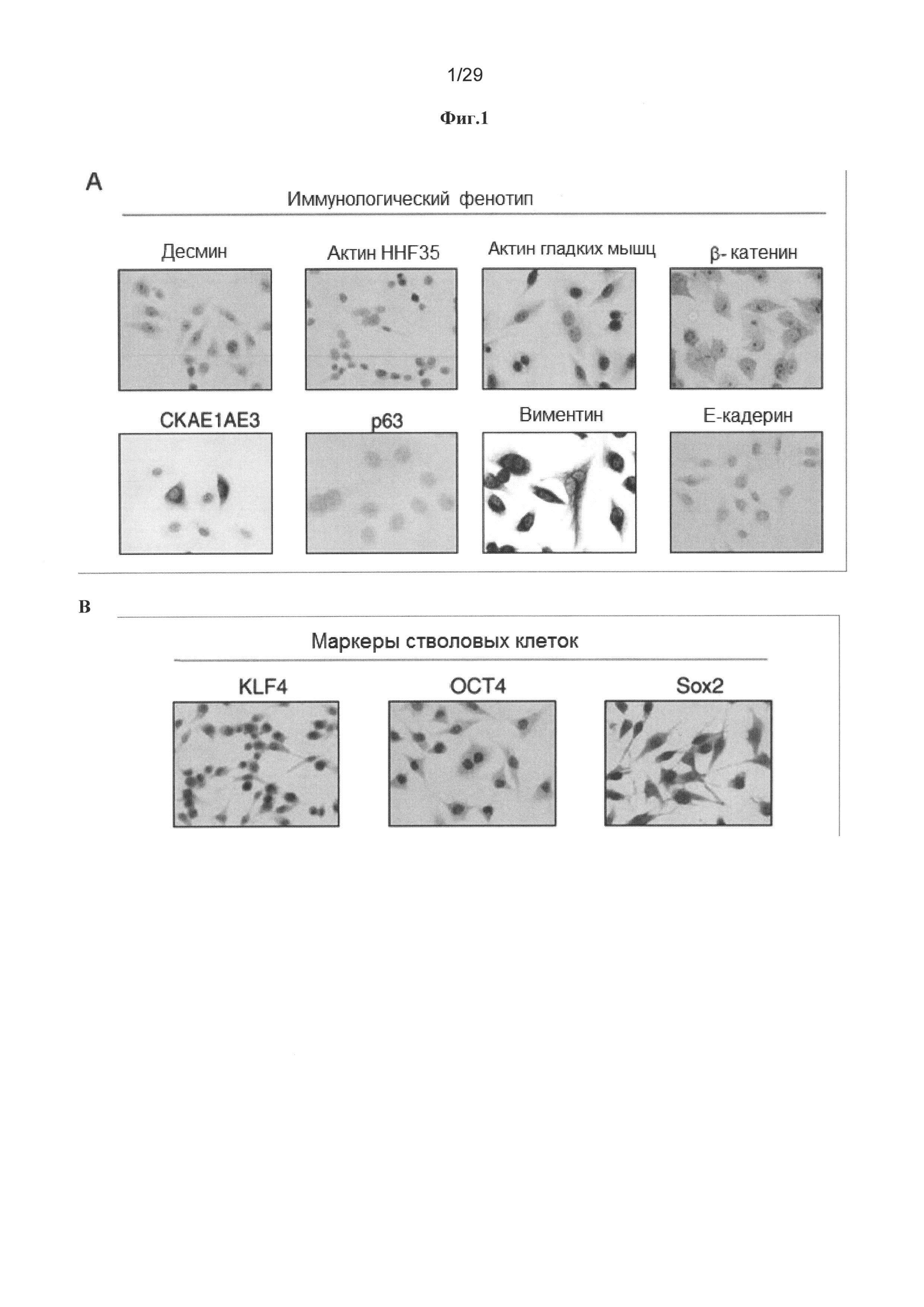
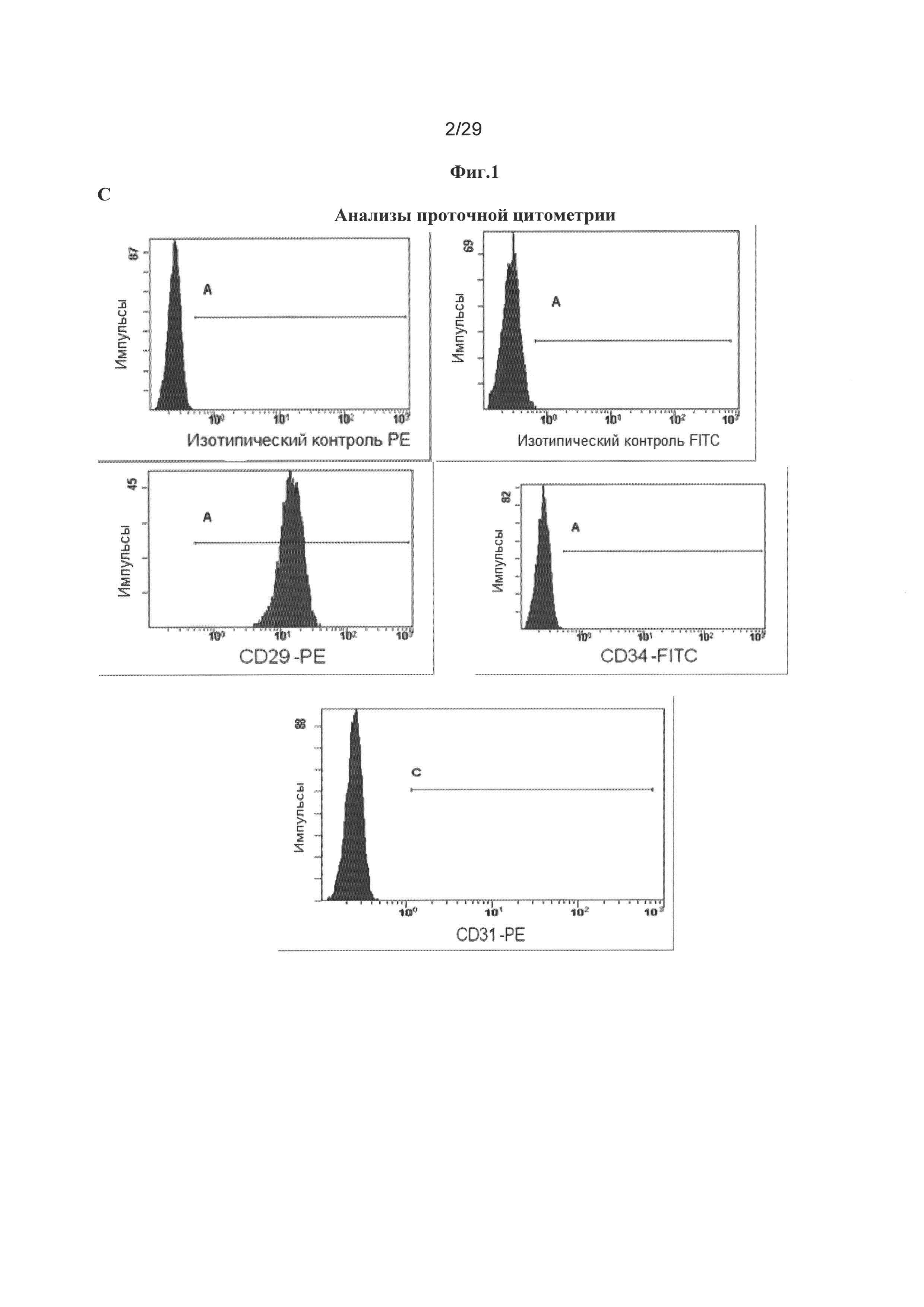
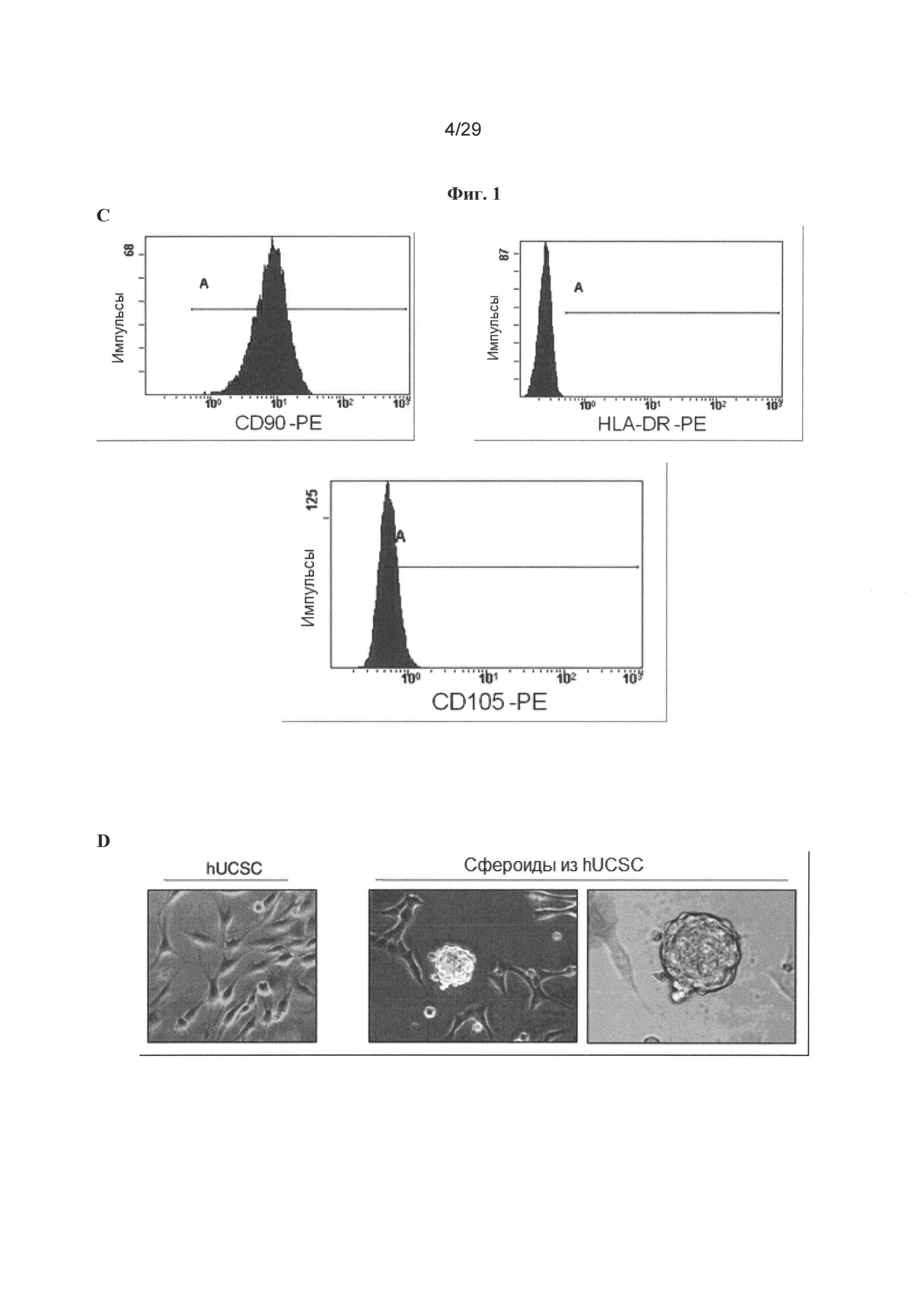
Фигура 1: Стволовые клетки шейки матки обладают иммунологическим фенотипом взрослых мезенхимальных стволовых клеток. А. Клетки, получаемые из мазка из шейки матки и культивируемые в течение 90 суток, подвергали иммуномечению специфическими антителами, а затем оценивали экспрессию белка. Не детектировали экспрессию десмина, актина HHF35, актина гладкой мышцы, p63 и Е-кадгерина, тогда как СКАЕ1АЕ3 фокально экспрессировался, и для виментина выявляли значительную экспрессию. В. Для специфических маркеров стволовых клеток, таких как klf4, oct4 и sox2, демонстрировали значительное иммуномечение в стволовых клетках шейки матки. С. Анализы проточной цитометрии стволовых клеток шейки матки человека (hUCESC) указывают на высокое процентное содержание белков CD29, CD44, CD73, CD90 и CD105, но отрицательную экспрессию белков CD31, CD34, CD45, CD117, CD133, HLA-DR и Tra1-81. D. Выделенные hUCESC образуют сфероиды при культивировании в конкретной среде.
Фигура 2: Скорость роста hUCESC. Рост hUCESC, выражаемый в виде числа клеток после высевания 2000 клеток/лунку.
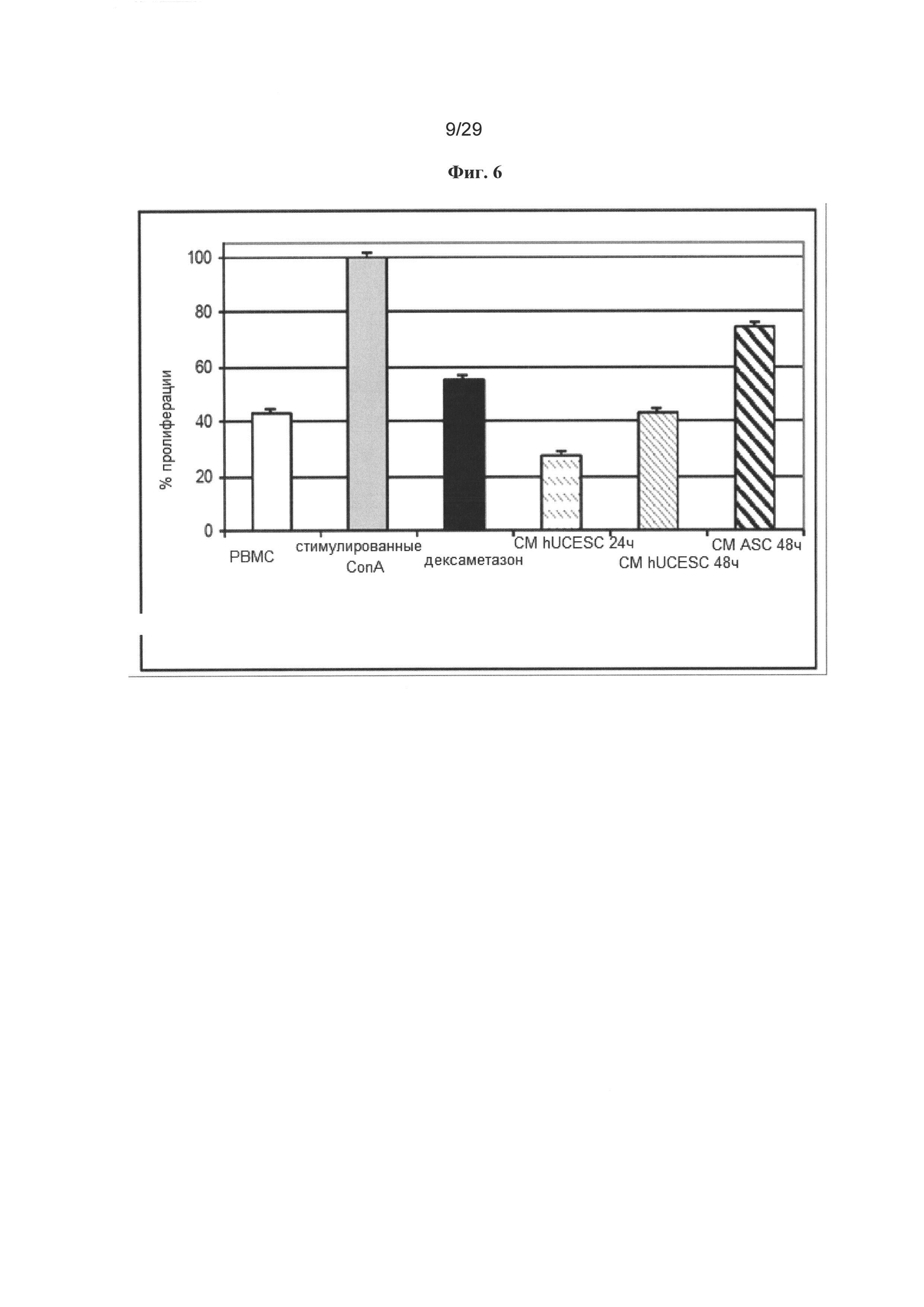
Фигура 3: Анализ иммуногенности. На фигуре продемонстрирована характерная MLR от двух доноров. Пролиферацию PBMCs определяли в отсутствие стимуляторных клеток, в присутствие аутогенных обработанных митомицином C РВМС (отрицательный контроль), в присутствии аллогенных обработанных митомицином C РВМС (положительный контроль), в присутствии обработанных митомицином C hUCESC и стимулированных Con A РВМС (положительный контроль). Стимуляторные клетки тестировали при плотности 2×104 на лунку. Для оценки иммуногенности hUCESC проводили анализы односторонние анализы MLR. Пролиферацию РВМС измеряли на основании увеличенного числа метаболически активных клеток в присутствии обработанных митомицином C стимуляторных клеток. Аутогенные и аллогенные РВМС служили в качестве отрицательного и положительного контролей стимуляторных клеток, соответственно. Стимулированные con A РВМС служили в качестве других стимуляторных контрольных клеток. hUCESC не индуцировали пролиферации Т-клеток в анализах MLR.
Фигура 4: Ингибирование дифференцировки моноцитов при стимуляции в присутствии кондиционированной среды hUCESC. А) Жизнеспособность клеток U937 составляет более 80%. В) Эффект кондиционированной среды hUCESC и ASC на экспрессию маркера дифференцировки макрофагов. Основной уровень экспрессии CD11b U937 составляет 34%. По сравнению с обработанными РМА контрольными клетками U937 процент клеток, положительно окрашенных на CD11b, снижался от 73% в обработанных РМА клетках U937 до 48% в обработанных кондиционированной средой hUCESC клетках U937. Процент экспрессии CD11b клеток U937, обработанных кондиционированной средой ASC, составляет 67%.
Фигура 5: Ингибирование дифференцировки моноцитов: стимуляция в течение 24 часов и добавление кондиционированной среды hUCESC. А) Жизнеспособность клеток U937 составляет более 80%. В) Основной уровень экспрессии CD11b U937 составляет 38%. По сравнению с обработанными РМА контрольными клетками U937 процент клеток, положительно окрашенных на экспрессию CD11b, снижался от 82% в обработанных РМА клетках U937 до 48% в U937 клетках, обработанных кондиционированной средой hUCESC, продуцируемой в течение 24 часов (СМ 24 часов) и до 34% в клетках U937, обработанных кондиционированной средой, продуцируемой в течение 48 часов (СМ 48 часов). Однако экспрессия CD11b в обработанных ASC СМ 48 часов клетках U937 составляет 77%.
Фигура 6: Ингибирование пролиферации РВМС кондиционированной средой. Обе кондиционированные среды 24 часов и 48 часов подавляли пролиферацию РВМС. Подавление является более эффективным с кондиционированной средой hUCESC по сравнению с кондиционированной средой ASC. Величина подавления кондиционированной среды hUCESC превышала величину подавления дексаметазона.
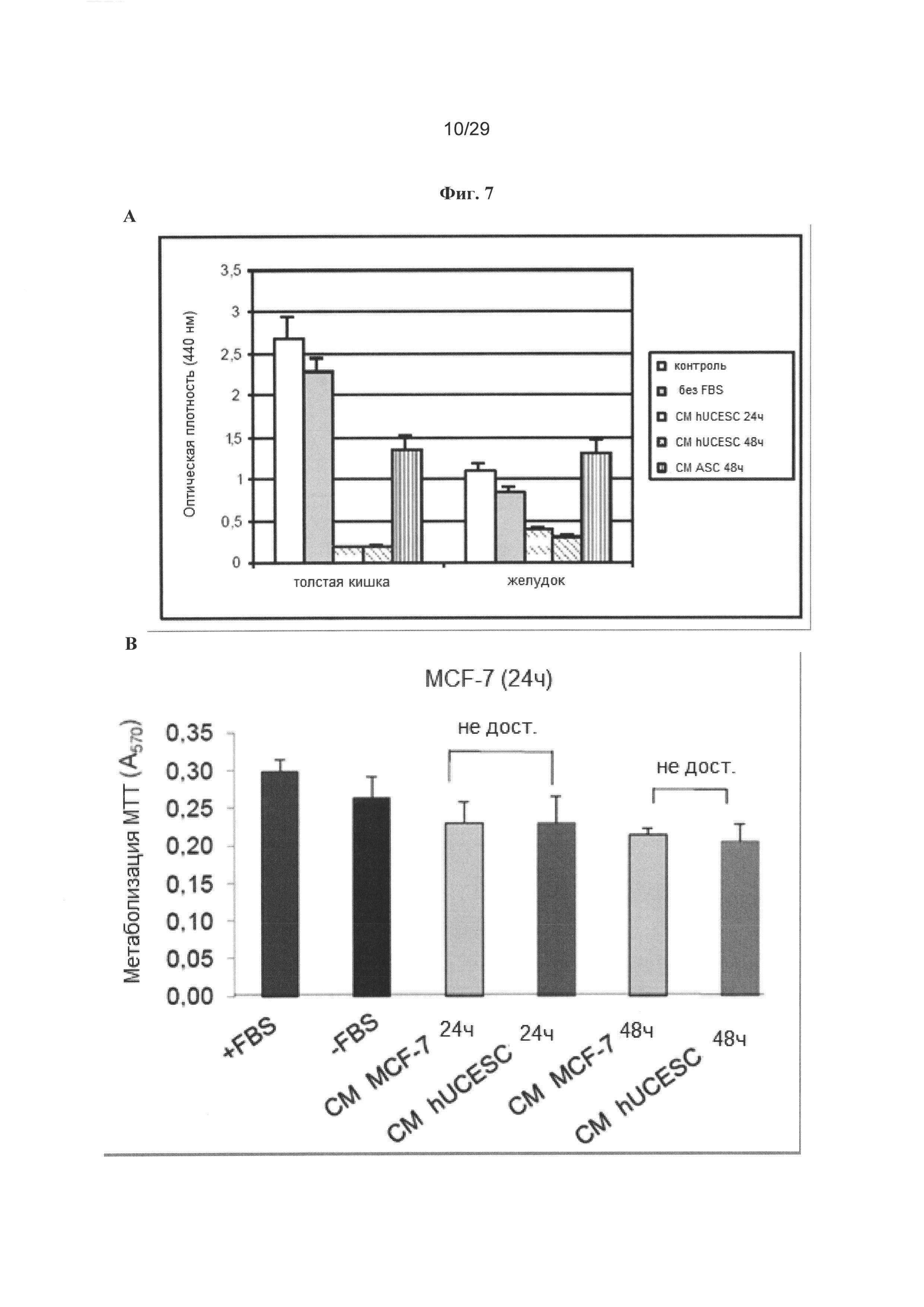
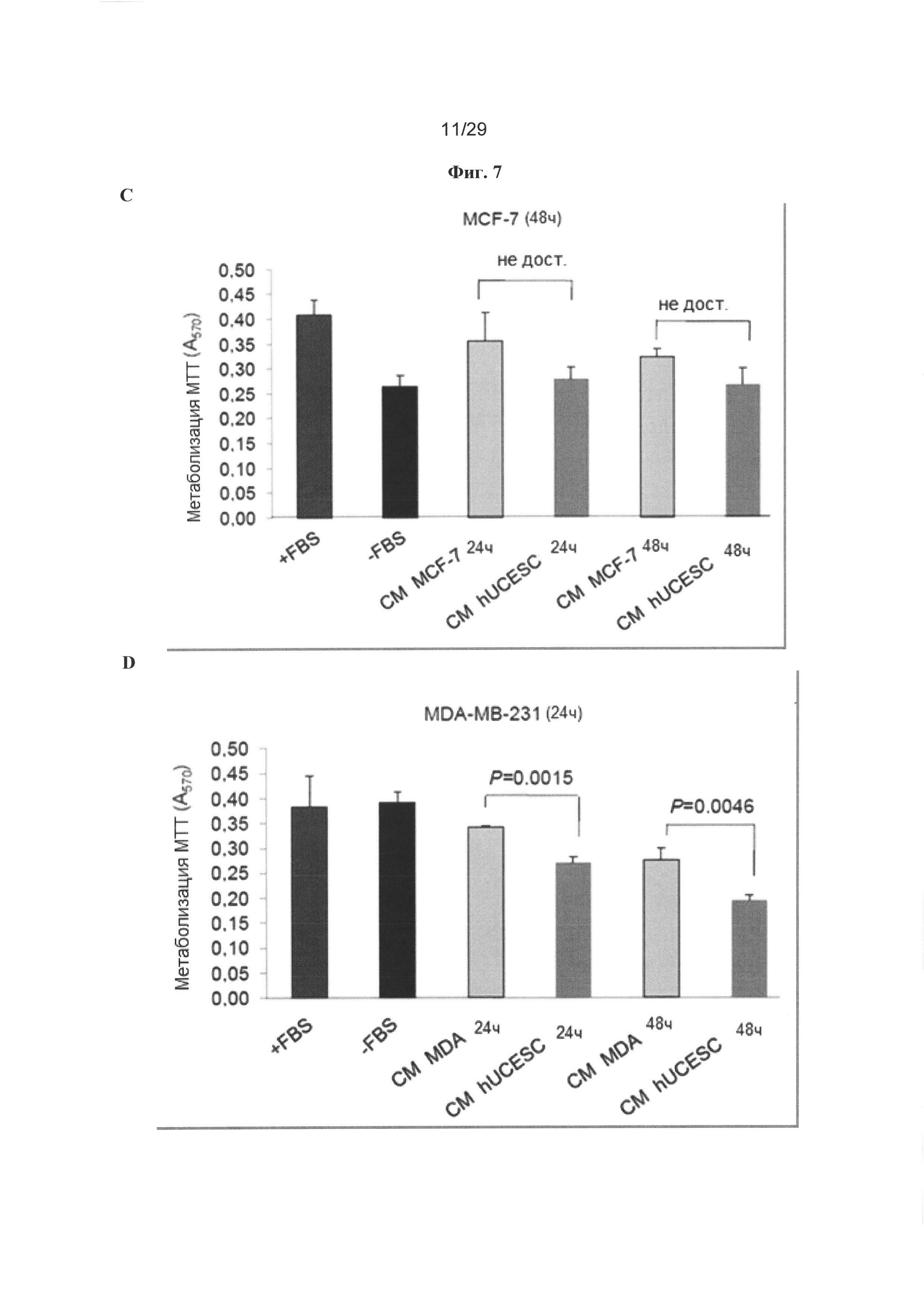
Фигура 7: Кондиционированная среда от hUCESC снижает клеточную пролиферация в клетках НТ29, AGS и MDA-MB-231, но не в линии клеток MCF-7. А. Анализ клеточной пролиферации линии клеток аденокарциномы толстой и прямой кишки (НТ29) и желудка (AGS), обрабатываемых в течение 48 часов полной средой (контроль), неполной средой (без FBS), кондиционированной средой от hUCESC, продуцируемой в течение 24 часов или 48 часов, и кондиционированной средой от ASC, продуцируемой в течение 48 часов. В-С. Анализ МТТ клеток MCF-7, обрабатываемых в течение 24 или 48 часов полной средой (+FBS), неполной средой (-FBS), кондиционированной средой от клеток MCF-7, продуцируемой в течение 24 или 48 часов, или кондиционированной средой от hUCESC, продуцируемой в течение 24 или 48 часов. D-E. Анализ МТТ клеток MDA-MB-231, обрабатываемых в течение 24 или 48 часов полной средой (+FBS), неполной средой (-FBS), кондиционированной средой от клеток MDA-MB-231, продуцируемой в течение 24 или 48 часов, или кондиционированной средой от hUCESC, продуцируемой в течение 24 или 48 часов. F. Клетки MCF-7 (1×105) метили красителем CellTracker и высевали в 6-луночные планшеты. Через четыре часа к клеткам MCF-7 добавляли 1×105 hUCESC, меченные красителем CellTracker Red, и проводили совместное культивирование в неполной среде (без FBS) в течение 72 часов. Получали изображения через 12, 48 и 72 часов. Последняя линия представляет собой пример роста клеток MCF-7 в неполной среде (-FBS), которые использовали в качестве контроля роста. G. Клетки MDA-MB-231 метели и культивировали совместно с hUCESC, как описано в (F) для клеток MCF-7.
Фигура 8: Введение кондиционированной среды (СМ) от hUCESC к клеткам MDA-MB-231 замедляет клеточный цикл и повышает апоптоз. А. Клетки MDA-MB-231 обрабатывали в течение 48 часов DMEM плюс 10% FBS (+FBS), неполной средой (DMEM без FBS, -FBS) или СМ 48 часов от hUCESC, а затем подвергали проточной цитометрии с использованием йодида пропидия (PI). Представлен процент клеток (среднее значение ± стандартное отклонение) в каждой фазе. В. Вестерн-блоттинг циклина А, циклина В, циклина Е, циклина D1 и GAPDH (используемого в качестве контроля внесения) экстрактов белка из клеток MDA-MB-231, обрабатываемых в течение 48 часов, как описано в (А). С. Апоптоз в клетках MDA-MB-231, культивируемых в течение 48 часов с полной (+FBS), неполной (-FBS) или СМ от hUCESC определяли проточной цитометрией с использованием аннексина V/PI. Аннексии V+/PI- и аннексии V+/PI+ указывают на ранний и поздний апоптоз, соответственно. D. Вестерн-блоттинг каспазы 8, -12, -9, активированной каспазы 3 и расщепленной PARP экстрактов белков MDA-MB-231, как указано в (С). Е. Вестерн-блоттинги антиапоптотического Bid, расщепленного Bid и белков Bim в экстрактах MDA-MB-231, обрабатываемых как в (С). GAPDH использовали в качестве контроля внесения.
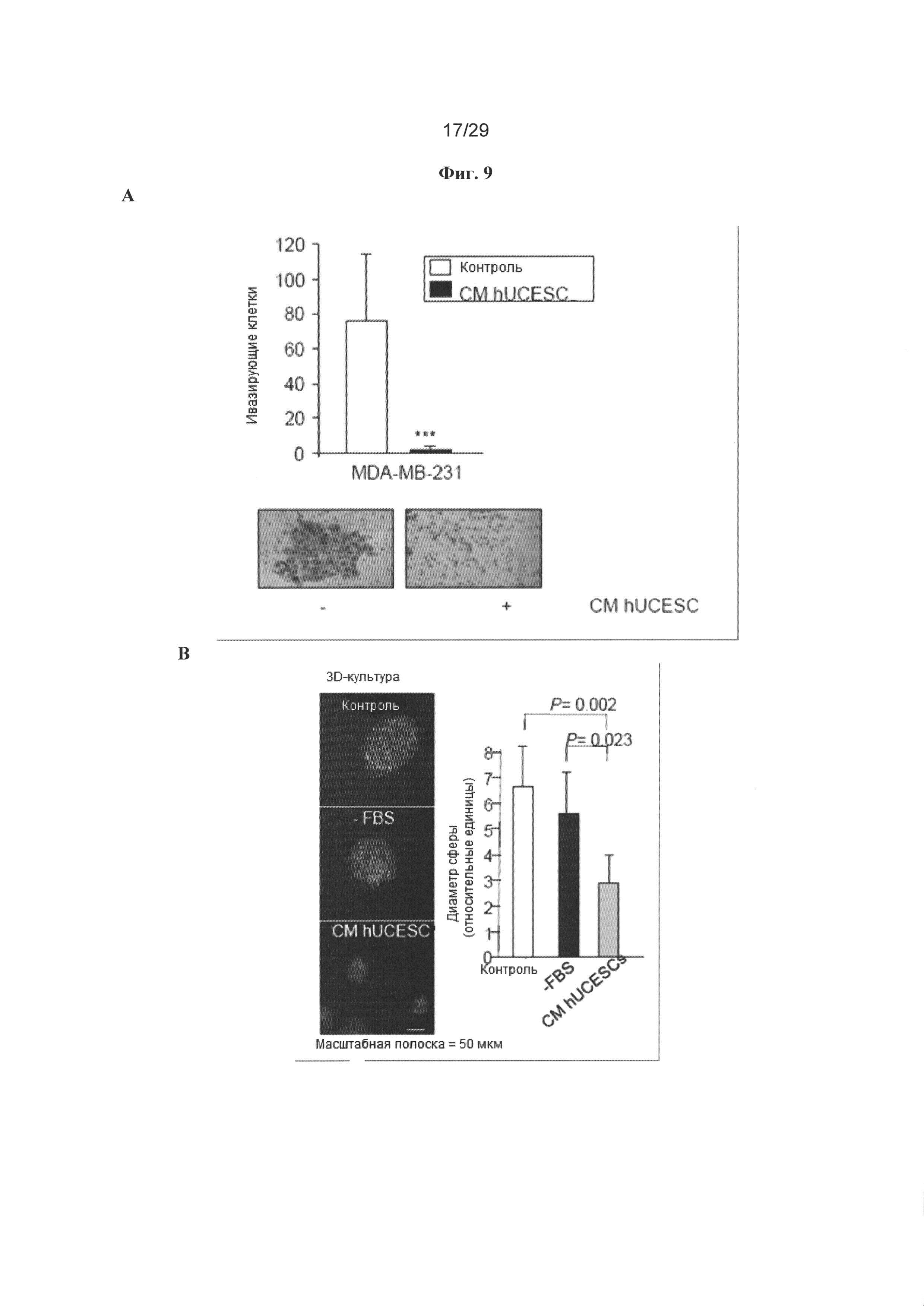
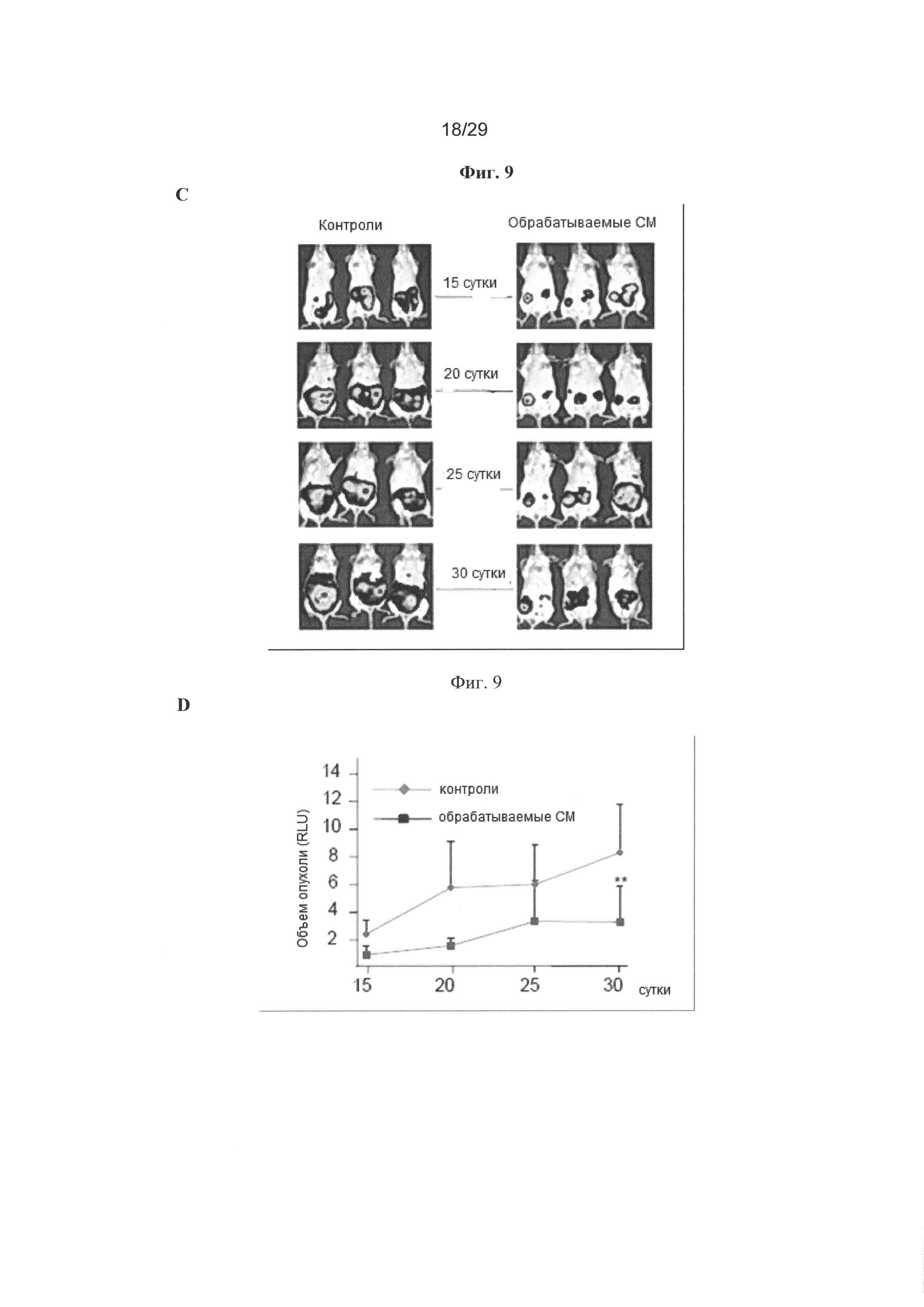
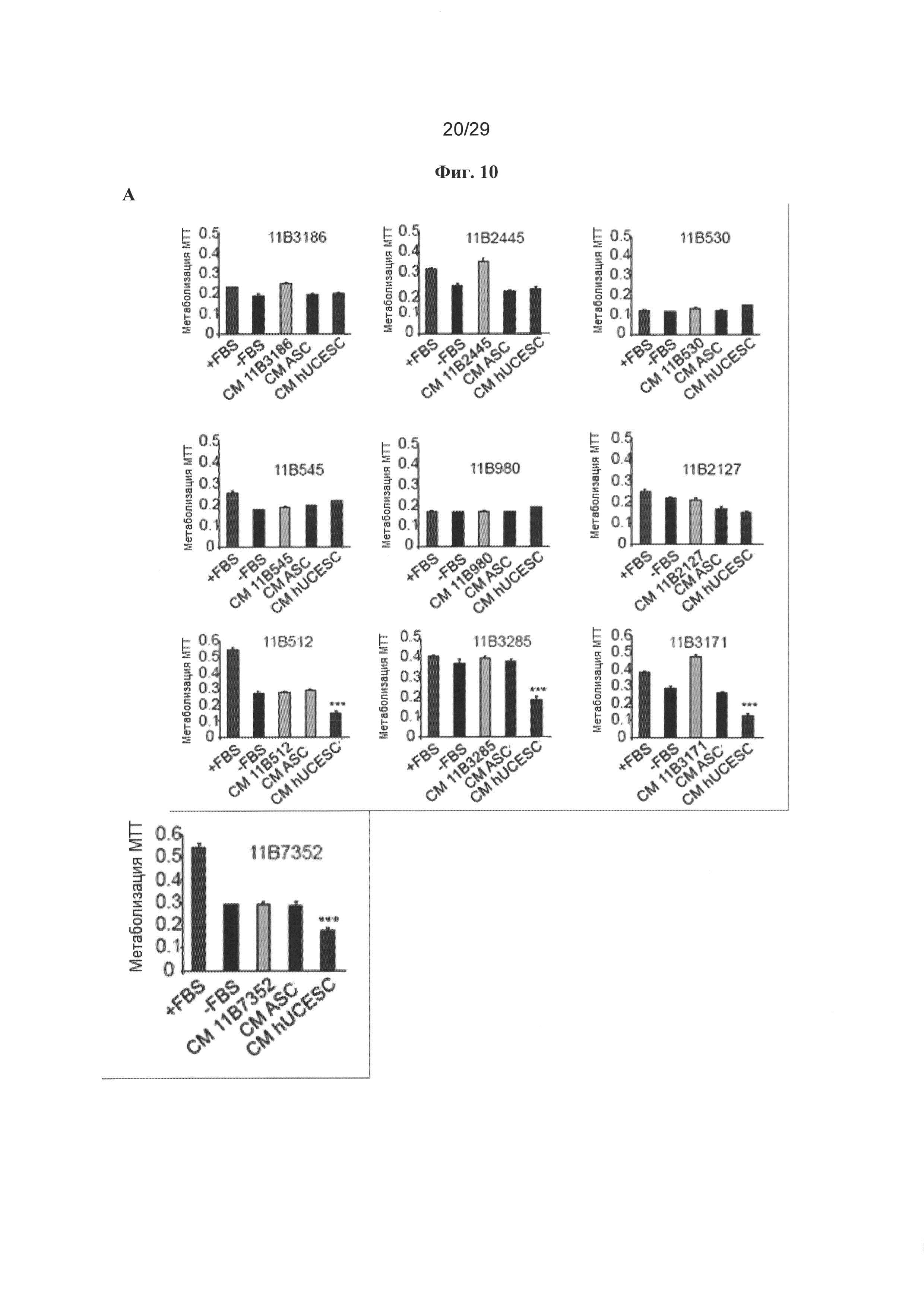
Фигура 9: Кондиционированные среды (СМ) от hUCESC ингибируют инвазию, 3D рост и объем опухоли на модели ксенотрансплантатов на мышах. А. СМ 48 часов от hUCESC значительно снижали инвазию клеток MDA-MB-231 через матрицу матригеля по сравнению с клетками с неполной средой (-FBS, контроль). В. Введение СМ после 48 часов от hUCESC, культивируемых в течение 9 суток, значительно снижает 3D рост клеток MDA-MB-231 по сравнению с клетками, обрабатываемыми полной (+FBS) или неполной (-FBS) средой. С.Тринадцать мышей SCID инъецировали клетками MDA-MB-231-luc в жировое тело молочной железы. Через пятнадцать суток семи мышам каждые пять суток инъецировали внутриопухолево 150 мкл кондиционированной среды (СМ) от hUCESC (обрабатываемые СМ) и шести мышам инъецировали неполную среду (-FBS, контроли). Характерные изображения контролей и обрабатываемых СМ мышей получали через 15, 20, 25 и 30 суток. D. Объем опухоли определяли измерением люминесценции. Значения выражают в виде среднего значения ± стандартное отклонение относительных уровней люминесценции. **: Р=0,011 в сравнении с контролями. Е. Иммуногистохиическая детекция экспрессии активированной каспазы-3 в характерных опухолях мышей SCID, обрабатываемых СМ и плацебо, как описано в (С). F. Графики Каплана-Мейера общей выживаемости обрабатываемых СМ мышей в сравнении с контрольными мышами. Мыши, которых обрабатывали СМ, имели длинную DFS по сравнению с контрольными мышами. Различие являлась статистически значимым (P=0,019).
Фигура 10: Клеточная пролиферация в первичных культурах из опухолей молочной железы с высокой скоростью пролиферации значительно снижается после введения кондиционированных сред (СМ) от hUCESC. А. Десять первичных культур из опухолей молочной железы человека обрабатывали: а) полной средой (+FBS), b) неполной средой (-FBS), с) кондиционированной средой (СМ), продуцируемой в течение 48 часов самими клетками, d) СМ, продуцируемой в течение 48 часов получаемыми из адипоцитов стромальными клетками (ASC), и е) СМ, продуцируемой в течение 48 часов hUCESC. Через 48 часов культивирования проводили анализ МТТ для оценки клеточной пролиферации. Для культур с высокой скоростью пролиферации (11В512, 11В3285, 11В3171 и 11В7352 красным) демонстрировали существенное (***: P<0,001) снижение пролиферации после обработки СМ от hUCESC по сравнению с другими видами обработки. В. Экстракты белков из первичных культур с высокой скоростью пролиферации, обрабатываемых СМ от hUCESC или неполной средой (-FBS), инкубировали с антителами против циклина D1, расщепленной PARP и GAPDH (используемого в качестве контроля внесения) и анализировали вестерн-блоттингом.
Фигура 11: Характерный пример ингибирования роста патогенного микроорганизма кондиционированной средой hUCESC в 96-микролуночных планшетах. А. Для контрольной среды (М) демонстрировали рост Е. Coli и для кондиционированной среды hUCESC (1) демонстрировали ингибирование бактериального роста вплоть до лунки 4 (разбавление 1/20). Кондиционированная среда MSC, получаемых из жировой ткани, бактериальный рост во всех лунках. В. Таблица объемов, добавляемых в лунки для каждого состояния. Кружки означают лунки, в которых выявляют ингибирование бактериального роста.
Фигура 12: Характерный пример ингибирования роста микроорганизма hUCESC. Значительное (p<0,001) ингибирование роста микроорганизма hUCESC, анализируемое подсчетом КОЕ и OD. Для одной среды и нормального фибробласта человека (NHF) не выявляют ингибирование роста Е. Coli.
Фигура 13: Характерный пример ингибирования роста микроорганизма кондиционированной средой hUCESC. Значительное (p<0,001) ингибирование роста микроорганизма кондиционированной средой hUCESC (СМ), анализируемое подсчетом КОЕ и OD. Для одной среды и кондиционированной среды нормального фибробласта человека (CM NHF) не выявляют ингибирование роста Е. Coli.
Фигура 14: Модель сухого глаза на крысе. А. Фотография, демонстрирующая экстраорбитальную слезную железу перед удалением. В. Для измерения продукции слез использовали адаптированный тест Ширмера. С. Тест Ширмера, демонстрирующий результаты в нормальном глазе (NE) и сухом глазе (DE) через 7 суток после удаления экстраорбитальной слезной железы в сухом глазе.
Фигура 15: Регенерация эпителия "in vivo". А. Репрезентативные изображения окрашивания флуоресцеином роговицы сразу после щелочного ожога (Т0 часов), через 15 часов (Т15 часов) и через 5 суток (Т5с). В. Статистический анализ процента регенерации эпителия роговицы через 15 часов после щелочного ожога (*p<0,005). С. Статистический анализ процента регенерации эпителия роговицы через 5 суток после щелочного ожога (*р=0,005). Используемые виды обработки представляли собой кондиционированную среду (СМ), только среду без какого-либо предварительного контактирования с клетками (М), офтальмологические капли с гиалуронатом натрия (SH) и без обработки (без обработки).
Фигура 16: Гистология. Характерные изображения окрашивания гематоксилинэозином 20 мкм срезов роговиц, обрабатываемых кондиционированной средой (СМ), только средой без какого-либо предварительного контактирования с клетками (М), офтальмологические капли с гиалуронатом натрия (SH) и без обработки (без обработки) через 5 суток после щелочного ожога (увеличение X10).
Фигура 17: Противовоспалительные эффекты. А-С. Статистический анализ результатов ПЦР в режиме реального времени МСР-1 (А), МIP-1α (В) и TNF-α (С) образцов роговицы через 5 суток после щелочного ожога. Анализируемые условия представляли сбой образцы роговицы, обработанные кондиционированной средой (СМ); образцы роговицы, обработанные только средой без какого-либо предварительного контактирования с клетками (М); образцы роговицы, обработанные офтальмологическими каплями с гиалуронатом натрия (SH), образцы роговицы из сухих глаз, но без какого-либо повреждения (NoUlc) и образцы роговицы из здоровых глаз без какого-либо повреждения (норма).
Примеры
Пример 1: Выделение и характеристика стволовых клеток шейки матки человека
I - МАТЕРИАЛЫ И МЕТОДЫ
Выделение и рост стволовых клеток шейки матки человека
Стволовые клетки шейки матки человека (hUCESC) получали из десквамации шейки матки во время рутинного гинекологического осмотра. В кратком изложении, цитологический образец подвергали ферментативной дезагрегации трипсином, коллагеназой или другим ферментом, который может дезагрегировать цервикальную слизь. Затем образец центрифугировали 5 минут при 400 g и осадок собирали и высевали на культуральный планшет. Лунки предварительно покрывали 1% желатином или фибронектином или другим субстратом для обеспечения прикрепления. Образец культивировали в модифицированной Дульбекко среде Игла: питательная смесь F-12 (DMEM-F12), глутамин, с антибиотиками или без них, с сывороткой, эпидермальным фактором роста (EGF), гидрокортизон, инсулин, не являющиеся незаменимыми аминокислоты, пируват натрия. Пересев клеток проводили с использованием трипсина или аккутазы, или других протеолитических и/или коллагенолитических ферментов.
Характеристика на основе проточной цитометрии
Стволовые клетки шейки матки человека (hUCESC) окрашивали с использованием панели специфических моноклональных антител: CD29-PE, CD45-FITC, CD90-PE, CD105-PE, HLA-DR-PE (Beckman Coulter), CD44-PE, CD73-PE, CD31-PE, TRA1-81-FITC (Becton Dickinson, Biosciences Pharmingen), CD34-FITC, CD117-PE и CD133-PE (Miltenyi Biotec). Для дискриминации погибших клеток добавляли 7-амино-актиномицин-D (7-AAD) (BD Pharmingen). Иммунофенотипирование проводили на одинаковых клетках, разделенных на равные аликвоты в различных пробирках. Окрашенные клетки ресуспендировали в PBS и анализировали с использованием проточного цитометра Cytomics FC500 (Beckman Coulter). Вычисленные данные анализировали с использованием программного обеспечения СХР, предоставляемого производителем.
Иммуногистохимическая характеристика
Стволовые клетки шейки матки человека клетки (hUCESC) культивировали, как описано выше. 3×104 клеток высевали на предметные стекла и фиксировали в течение 10 минут в 96% этаноле перед обработкой для иммуноцитохимии. Опухоли мышей фиксировали погружением в 10% нейтральный забуференный формалин в течение 24 часов и заливали парафином обычным способом.
Срезы толщиной 4 мкм подготавливали для исследования на предметных стеклах для микроскопа Flex IHC (Dako, Glostrup, Denmark). Иммуногистохимические (IHC) техники проводили автоматически на AutostainerLink 48 (Dako). Применяли готовые к применению первичные антитела FLEX Dako против СК (клон АЕ1/АЕ3), Е-кадгерина (клон NCH-38), виментина (клон V9), десмина (клон D33), актина (клон HHF35), актина гладких мышц (клон 1А4) и β-катенина (клон бета-катенин-1). Также использовали готовок к применению моноклональное антитело к p63 (клон 4А4) от Abcam (Cambridge, UK). Первичные антитела против KLF4, ОСТ4 и Sox2 получали от Santa Cruz Biotechnology, Millipore и Sigma-Aldrich, соответственно. Демаскировку эпитопа проводили в микроволновой печи в течение 20 минут с использованием буфера для демаскировки EnVision FLEX (pH 9). Все антитела инкубировали в течение 20 минут при комнатной температуре за исключением p63, которые инкубировали в течение 30 минут. В качестве системы детекции авторы использовали EnVision FLEX/HRP Dako (полимер декстран, конъюгированный с пероксидазой хрена и аффинновыделенными антителами козы против иммуноглобулинов мыши и кролика) в течение 20 минут. Для Е-кадгерина добавляли линкер мыши (Dako).
Скорость роста
Скорость пролиферации hUCESC определяли подсчетом общего числа клеток в лунках в двух повторениях каждые сутки в течение 12 суток. Первоначально клетки высевали при 2000 клеток/лунку в 6-луночном культуральном планшете.
Образование сфероидов и адипозная дифференцировка
hUCESC культивировали в среде DMEM/F12 (об./об.) (Invitrogen), 1% В27 (Invitrogen), 10 нг/мл эпидермального фактора роста (EGF) и 5 нг/мл фактора роста фибробластов 2 (FGF-2), 100 МЕд./мл пенициллина и 100 мкг/мл стрептомицина в 60 мм чашке и через 5-7 суток фотографировали сфероиды. Для индукции адипозной дифференцировки hUCESC культивировали в среде для дифференцировки hMSC Bulletkit-Adipogenic (Lonza Biologies, Walkersville, USA) в 60 мм чашке в течение 12 суток, а затем фиксировали формальдегидов для окрашивания масляным красным O (Sigma).
Получение кондиционированной среды
Клетки высевали при плотности 3×104 клеток/см2 в среде DMEM:F12 с 10% FBS и антибиотиками. Через 48 часов клетки промывали три раза фосфатно-солевым буфером (PBS), а затем, культивировали в DMEM: F12 без FBS в течение 24 часов или 48 часов. Затем собирали среду в качестве кондиционированной среды (СМ), центрифугировали 10 минут при 300g и непосредственно использовали или хранили при -20°C.
II-РЕЗУЛЬТАТЫ
Стволовые клетки шейки матки человека (hUCESC), получаемые в результате десквамации шейки матки, анализировали на иммунологический фенотип с использованием иммуноцитохимии и проточной цитометрии. Как представлено на фигуре 1А, hUCESC являются положительно иммунномеченными антителами против β-катенина и виментина, и некоторые диффузные фокальные клетки также являются положительными в отношении антитела против общих цитокератинов. Кроме того, hUCESC характеризуются сильной экспрессией трех факторов транскрипции, характерных для эмбриональных стволовых клеток, т.е. ОСТ4, KLF4 и Sox2 (фигура 1В). Проточной цитометрией также определяли фенотип hUCESC. Авторы выявили, что эти клетки являлись положительными в отношении CD29, CD44, CD73 и CD90, при этом они являлись отрицательными в отношении CD34, CD45, CD 133 (гемопоэтические маркеры), CD 117, CD31, TRA-1-81 (поверхностный маркер эмбриональных стволовых клеток) и HLA-DR (фигура 1С).
Для дополнительно оценки характеристик клеток hUCESC их индуцировали для образования сфероидов. Через семь суток в культуре индивидуальные клетки поддерживали в суспензионной культуре в кондиционированной среде, не содержащей сыворотки. Через семь суток клетки образовывали клональные сфероидные структуры (фигура 1D).
Кроме того, определяли скорость пролиферация hUCESC подсчетом общего числа клеток в лунках двух повторениях каждые сутки в течение 12 суток. hUCESC пролиферируют со скоростью 0,4-2,1 удвоений в течение 24 часов (фигура 2).
Пример 2: Связанные с воспалением эксперименты
I - МАТЕРИАЛЫ И МЕТОДЫ
Анализ иммуногенности
Для определения иммуногенности стволовых клеток шейки матки человека (hUCESC) использовали односторонний анализ реакции смешанной культуры лимфоцитов (MLR). MLR проводили в 96-луночных планшетах для микротитрования с использованием среды RPMI 1640 без FBS. Мононуклеарные клетки периферической крови (РВМС), получаемые от двух разных доноров, высевали при 2×105 клеток от донора на лунку. Разных доноров использовали для максимального повышения вероятности, что по меньшей мере одни из РВМС представляли основное несоответствие с тестируемыми клетками hUCESC. Используемые в анализе стимуляторные клетки включали аутогенные РВМС (фоновый ответ), аллогенные РВМС (ответ положительного контроля) и популяцию клеток hUCESC. Перед тем как добавлять в лунки с культурой (2×104 клеток на лунку, 10% стимуляторных клеток) стимуляторные клетки обрабатывали митомицином C. Культуры дополнительных контролей состояли из РВМС, высеваемых в одну среду (без стимуляторных клеток), стимулированных конканавалином A (ConA) РВМС и обработанных только митомицином C hUCESC. Для каждой обработки проводили культивирование в трех повторениях. Пролиферацию оценивали посредством реагента клеточной пролиферации WST-1 (Roche applied bioscience). Живые (метаболически активные) клетки восстанавливали соли тетразолия до окрашенных соединений формазана; погибшие клетки не восстанавливали. Таким образом, в колориметрических анализах на основе солей тетразолия детектируют только жизнеспособные клетки. Оптическую плотность образцов измеряли против фонового контроля в виде пустой пробы с использованием спектрофотометра для планшетов для микротитрования. Длина волны для измерения оптической плотности продукта формазана составляет 420-480 нм (максимальная оптическая плотность приблизительно при 440 нм). Эталонная длина волны должна составлять более 600 нм.
Ингибирование дифференцировки моноцитов
Для этого теста использовали линию клеток U937. Клетки высевали в 24-луночный планшет при плотности 1,5×105 клеток/лунку в DMEM:F12 с 10% FBS и антибиотиками. Добавляли 2 нг/мл форбол-12-миристат-13-ацетат (РМА), обработка РМА, которая активирует протеинкиназу C, индуцирует более высокую степень дифференцировки в клетках U937, что отражается более сильным прикреплением и экспрессией поверхностных маркеров, ассоциированных с дифференцировкой макрофагов. В контрольные лунки не добавляли раствор РМА. Через 24 часа в тестируемых лунках среду меняли на кондиционированную среду от hUCESC или от стволовых клеток, получаемых из жировой ткани человека (ASC, StemPro®, Invitrogen) в течение еще 24 часов. Дополнительный тест состоял из линии клеток U937, стимулированных РМА в присутствие кондиционированной среды. Супернатант собирали и промывали прикрепленные клетки, трипсинизировали и собирали в соответствующую пробирку. Клетки центрифугировали 5 минут при 200 g и ресуспендировали в 100 мкл PBS. За дифференцировкой макрофагов наблюдали по экспрессии маркера дифференцировки моноцитов CD11b посредством анализа проточной цитометрии. Клетки окрашивали моноклональным антителом PE-CD11b и с 7-AAD для оценки жизнеспособности клеток. Антиген Мас-1 (CD11b) первоначально был описан как маркер клеточной поверхности макрофагов. Антиген Мас-1 опосредует присоединение и фагоцитоз частиц, покрытых C3bl гранулоцитами и макрофагами. Кроме того, по-видимому, Мас-1, опосредует широкий спектр функций зависящих от сцепления, включая хемотаксис гранулоцитов, адгезию к поверхности и агрегацию.
Ингибирование пролиферации РВМС кондиционированной средой
Выделяли мононуклеарные клетки периферической крови (РВМС) от здоровых добровольцев из 20 мл гепаринизированной периферической крови центрифугированием в градиенте плотности Histopaque-1077 (Sigma). Клетки, собираемые с поверхности раздела фаз, дважды отмывали PBS и ресуспендировали в RPMI 1640 с добавками. Жизнеспособность РВМС определяли по исключению трипанового синего. Аликвоты выделенных РВМС замораживали и хранили при -80° до дальнейшего использования. Для экспериментов замороженные аликвоты РВМС случайным образом выбирали от 8 неродственных доноров, размораживали и использовали.
Для анализа пролиферации РВМС выделенные РВМС культивировали (2×105 клеток/лунку) в течение 4 суток в 96-луночных плоскодонных планшетах для микротитрования в DMEM:F12 без FBS с кондиционированной средой (от hUCESC или ASC) и стимулировали 1 мкг/мл конканавалина А (ConA). Только РВМС и стимулированные ConA РВМС с 10-6 М дексаметазона служили в качестве основного контроля пролиферации и контроля ингибирования, соответственно. Пролиферацию оценивали посредством реагента клеточной пролиферации WST-1. В этот анализ детектируют только жизнеспособные клетки. Оптическую плотность образцов измеряли против фонового контроля в виде пустой пробы с использованием спектрофотометра для планшетов для микротитрования.
II-РЕЗУЛЬТАТЫ
Для оценки иммуногенности hUCESC проводили односторонние анализы MLR. Пролиферацию РВМС измеряли на основании повышенного числа метаболически активных живых клеток в присутствии обработанных митомицином C стимуляторных клеток. Аутогенные и аллогенные РВМС служили в качестве отрицательного и положительного контролей стимуляторными клетками, соответственно. Стимулированные ConA РВМС служили в качестве других положительных контрольных клеток стимуляции. Как представлено на фигуре 3, hUCESC не индуцировали Т-клеточной пролиферации в анализах MLR.
Кроме того, за дифференцировкой в макрофаги наблюдали по экспрессии маркера дифференцировки моноцитов CD11b посредством анализа проточной цитометрии. На фигуре 4 показано ингибирование дифференцировки моноцитов при стимуляции в присутствие кондиционированной среды hUCESC. Основной уровень экспрессии CD11b U937 составлял 34% и являлся сравнимым с контрольными клетками U937, обработанными РМА, процент клеток, положительно окрашенных на CD11b, снижался от 73% в обработанных РМА клетках U937 до 48% в обработанных кондиционированной средой hUCESC клетках U937. Процент экспрессии CD11b для клеток U937, обработанных кондиционированной средой ASC, составлял 67%. Следует отметить, что жизнеспособность клеток U937 при любых условиях составляла более 80%. Эти данные указывают на ингибированию или предотвращение дифференцировки моноцитов в присутствии кондиционированной среда hUCESC. На фигуре 5 продемонстрировано ингибирование дифференцировки моноцитов: стимуляция в течение 24 часов и добавление кондиционированной среды hUCESC. Основной уровень экспрессии CD11b U937 составлял 38% и являлась сравнимым с обработанными РМА контрольными клетками U937, процент клеток, положительно окрашенных на экспрессию CD11b, снижался от 82% в обработанных РМА клетках U937 до 48% в клетке U937, обработанной кондиционированной средой hUCESC, продуцируемой в течение 24 часов (СМ 24 часов), и до 34% в клетке U937, обработанной кондиционированной средой, продуцируемой в течение 48 часов (СМ 48 часов). Однако экспрессия CD11b в клетках U937, обработанных CM ASC 48 часов, составляла 77%. Следует отметить, что жизнеспособность клеток U937 при любых условиях составляла более 80%. Эти данные указывают на ингибирование дифференцировки моноцитов в присутствии кондиционированной среды hUCESC, и в случае кондиционированной среды 48 часов процент CD11b-положительных клеток являлся заметно таким же, как основной уровень U937.
На фигуре 6 продемонстрировано ингибирование пролиферации РВМС кондиционированной средой. Обе кондиционированные среды hUCESC 24 часа и 48 часов подавляли пролиферацию РВМС. Подавление являлось более эффективным кондиционированной средой hUCESC, чем кондиционированной средой ASC. Величина подавления кондиционированной средой hUCESC превышала величину подавления дексаметазоном. Дексаметазон является наиболее эффективным противовоспалительным лекарственным средством, эти данные подтверждают высокую противовоспалительную эффективность кондиционированной среды hUCESC.
Пример 3: Связанные со злокачественной опухолью эксперименты
I - МАТЕРИАЛЫ И МЕТОДЫ
Культуры клеток
Клетки MCF-7 и MDA-MB-231 (линии клеток аденокарциномы молочной железы человека) получали от European Collection of Cell Cultures (Salisbury, Wilts., UK) и HT29 (линию клеток аденокарциномы толстой и прямой кишки) и AGS (линию клеток аденокарциномы желудка) получали от American Type Culture Collection (АТСС, Manassas, VA, USA). Эти линии клеток выращивали в 90-мм чашках Петри в DMEM с добавлением 10% FBS, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина в атмосфере воздух-CO2 (95:5) при 37°C. Конфлюэнтные клетки дважды промывали фосфатно-солевым буфером и собирали посредством короткой инкубации с раствором трипсин-EDTA (Sigma-Aldrich, St. Louis, МО, USA) в PBS. Стволовые клетки шейки матки человека (hUCESC, получаемые как описано выше), первичные культуры из опухолей молочной железы человека и стволовые клетки, получаемые из жировой ткани человека (ASC, StemPro®, Invitrogen) выращивали в 90-мм чашках Петри в DMEM-F12 (1:1) с добавлением 10% FBS, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина в атмосфере воздух-CO2 (95:5) при 37°C.
Кондиционированную среду (СМ) от hUCESC, ASC, MCF-7 и MDA-MB-231 получали культивированием клеток до 70% конфлюэнтности в DMEM-F12 (10% FBS). Затем клетки промывали три раза в PBS и культивировали снова в DMEM-F12 без FBS. Через 24 или 48 часов среду центрифугировали в течение 10 минут при 300 g, собирали супернатант и сразу же использовали.
Проводили трехмерное культивирование клеток. В кратком изложении, культуральные покровные стекла покрывали 60 мкл ледяного матригеля (BD Biosciences) и инкубировали при 37°C в течение 20 минут для обеспечения затвердевания матригеля. Клетки обрабатывали в течение 5 минут 0,25% раствором трипсин-EDTA (2,5 г/л трипсина, 0,38 г/л EDTA) (Invitrogen). Суспензию одиночных клеток, содержащую 5×103 клеток в 100 мкл объема среды с добавлением 2% (об./об.) матригеля, аккуратно помещали на поверхность затвердевшего матригеля. Инкубацию проводили при 37°C в течение 30 минут для обеспечения прикрепления клеток к матригелю. Затем культуральные предметные стекла помещали в шестилуночные планшеты, добавляли 500 мкл среды на лунку и культивировали клетки в течение 10 суток. Затем hUCESC обрабатывали различными средами (DMEM-F12 с 10% FBS (+FBS), DMEM-F12 без FBS (-FBS), или кондиционированной средой 48 часов от hUCESC) в течение 1 недели. Фазово-контрастные фотографии клеток в виде монослоев или в трехмерных культурах 1 cultures получали с использованием камеры Olympus DP72. Количественное определение диаметра сферы проводили в ручном режиме путем вычерчивания неразветвленной линии по диаметру сферы и оценивая его величину в виде относительных единиц длины.
Совместные культуры
Клетки культивировали, как описано выше. Удаляли среду при 70% конфлюэнтности и метили клетки предварительно подогретым раствором CellTracker™ (MCF-7 и MDA-MB-231 с CellTracker™ GREEN CMFDA и hUCESC с CellTracker™ RED CMPTX; Invitrogen, Eugene, USA) по инструкциям производителя. Затем 1×105 MCF-7 или MDA-MB-231 клеток/лунку высевали в 6-луночные планшеты и через четыре часа к клеткам MCF-7 или MDA-MB-231 добавляли 1×105 клетки hUCESC и совместно культивировали в течение 72 часов. Изображения случайным образом фотографировали через 12, 48 и 72 часа с использованием цифровой камеры с высоким разрешением (Olympus DP 72; Olympus Corp., Tokyo, Japan). Рамку для подсчета (102 мкм2) накладывали на получаемое изображение и подсчитывали только четко видимые клетки по меньшей мере в трех различных полях на микрофотографиях с использованием программного обеспечения ImageJ (National Institutes of Health, Bethesda, MD, USA).
Пролиферация линий клеток аденокарциномы прямой и толстой кишки и аденокарциномы желудка
Пролиферацию НТ29 и AGS оценивали с использованием реагента клеточной пролиферации WST-1 (Roche). Линии клеток НТ29 и AGS высевали при 2×104 клеток на лунку в 96-луночные плоскодонные планшеты для микротитрования для культивирования тканей. Через двадцать четыре часа клетки обрабатывали равными объемами (150 мкл) DMEM-F12 с 10% FBS (контроль), DMEM-F12 без FBS (без FBS) и кондиционированной средой 24 или 48 часов от hUCESC, ASC в течение 24 или 48 часов. В каждую лунку добавляли реагент WST-1 (15 мкл) и инкубировали смесь в течение 1 часа. Оптическую плотность (440 нм) измеряли против фонового контроля в виде пустой пробы с использованием спектрофотометра для планшетов для микротитрования.
Метаболизирование МТТ
Эксперименты по жизнеспособности клеток/пролиферации проводили с использованием анализов с 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромидом (МТТ). MCF-7, MDA-MB-231 или первичные культуры из опухолей молочной железы человека высевали при 3×104 клеток на лунку в 24-луночные планшеты. Через двадцать четыре часа клетки обрабатывали равными объемами (500 мкл) DMEM-F12 с 10% FBS (+FBS), DMEM-F12 без FBS (-FBS) и кондиционированной средой 24 или 48 часов от MCF-7, MDA-MB-231, hUCESC, ASC или первичными культурами опухолей рака молочной железы в течение 24 или 48 часов. В каждую лунку добавляли МТТ (0,5 мкг/мкл) и инкубировали смесь в течение 1 часа. Затем среду удаляли и добавляли в каждую лунку DMSO (500 мкл). Оптическая плотность образцов измеряли при 570 нм на спектрофотометре для многолунковых планшетов (Tecan ULTRA Evolution,
Анализ вестерн-блоттинга
Клетки MCF-7, MDA-MB-231 и первичные культуры из опухолей молочной железы человека лизировали при 4°C в 300 мкл лизирующего буфера (50 мМ HEPES, pH 7,5; 150 мМ NaCl; 5 мМ EGTA; 1,5 мМ MgCl2; 1% SDS; 10% глицерин; 1% Triton Х-100; 10 мМ ортованданата натрия; 4 мМ PMSF и 50 мкг/мл апротинина). Затем клеточные лизаты центрифугировали при 14000×g в течение 5 минут при 4°C, собирали получаемый супернатант и определяли концентрацию белка способом Брэдфорд. Проводили вестерн-блоттинг. В кратком изложении, 60 мкг общего белка подвергали электрофорезу SDS-PAGE. Белки переносили на нитроцеллюлозную мембрану, блокировали и подвергали иммунному мечению в течение ночи при 4°C первичным антителом (см. таблицу 1), промывали три раза PBS-Tween-20 и инкубировали с соответствующим вторичным антителом в течение 1 часа. Сигнал детектировали с использованием субстрата для вестерн-блоттинга Pierce ECL (Thermo Scientific, Rockford, IL, USA) и проводили визуализацию путем приведения блотта в контакт со стандартной рентгеновской пленкой по инструкциям производителя.
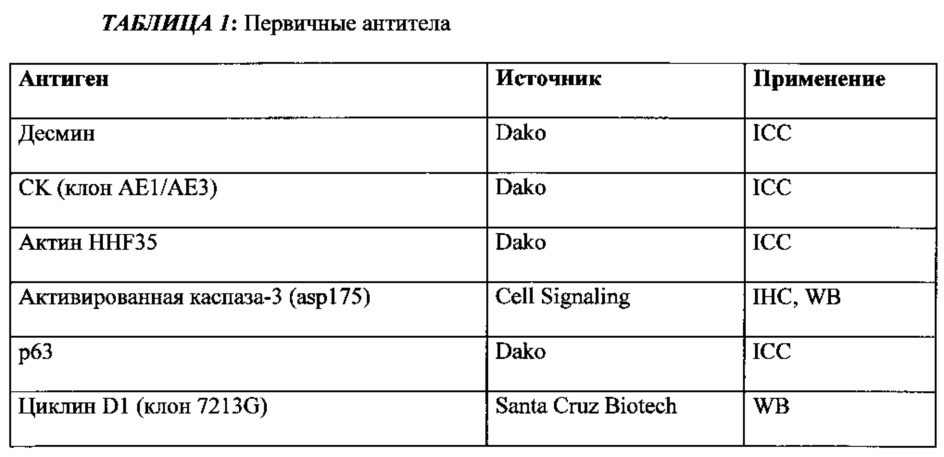
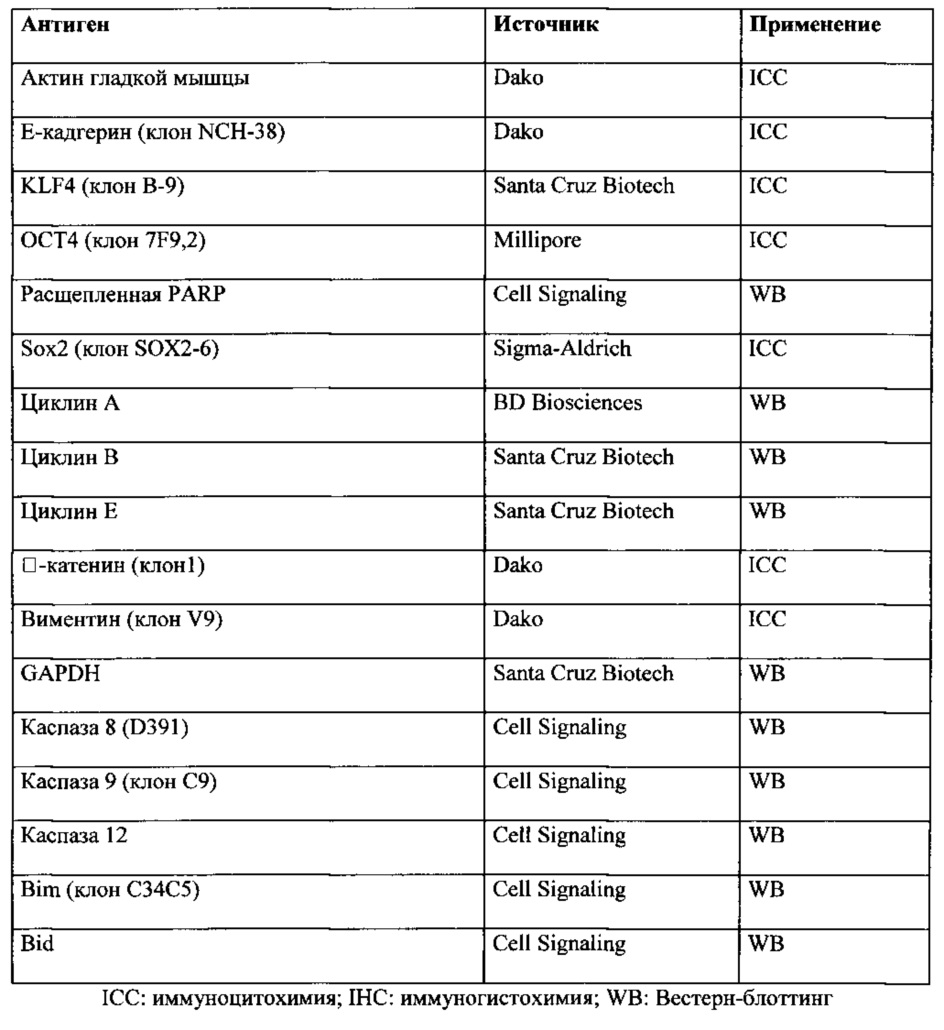
Анализы клеточного цикла и апоптоза
Анализы клеточного цикла и апоптоза проводили с использованием проточного цитометра Guava (Millipore Corporation, Billerica, MA, USA). В кратком изложении, для исследования клеточного цикла 2×105 клеток/лунку культивировали в: a) DMEM-F12 (1:1) с добавлением 10% FBS, b) DMEM-F12 (1:1) без FBS и с) кондиционированной средой в течение 48 часов, собирали, фиксировали 70% холодным этанолом в течение 30 минут, промывали PBS и инкубировали с рибонуклеазой (100 мкг/мл) и йодидом пропидия (PI, 50 мкг/мл) в течение 30 минут в темноте. Анализы апоптоза проводили с использованием аннексина V-FITC. Клетки собирали, дважды промывали PBS и ресуспендировали в 1× связывающем буфере (0,1 М Hepes (pH 7,4), 1,4 М NaCl и 25 мМ CaCl2). добавляли 5 мкл of FITC-аннексин V и инкубировали в течение 15 минут при комнатной температуре в темноте. В заключение в каждую пробирку добавляли 400 мкл 1 × связывающего буфера и анализировали. Аннексии V-положительные и PI-отрицательные указывают на ранний апоптоз, тогда как аннексии V отрицательные и PI положительные указывают на поздний апоптоз.
Анализ инвазии клеток
Анализы проводили в камерах для оценки инвазии BD BioCoatMatrigel по инструкциям производителя (BD Biosciences). Для анализа инвазии клеток использовали фильтры, предварительно покрытые матригелем. Клетки MDA-MB-231 помещали в верхнюю камеру в 0,5 мл среды DMEM, не содержащей сыворотки (5×104 клеток на фильтр). Кондиционированную среду hUCESC после 48 часов культуры помещали в нижнюю камеру как и 20% FBS. После инкубации в течение 22 часов клетки, которые мигрировали на нижнюю поверхность фильтров, фиксировали в метаноле в течение 2 минут при комнатной температуре, окрашивали с использованием кристаллического фиолетового в течение 2 минут, визуализировали и подсчитывали. Величины клеточной миграции или инвазии выражали в виде среднего числа клеток в поле зрения микроскопа из четырех полей на один фильтр для экспериментов в двух повторениях. Эксперименты повторяли три раза.
Исследования на животных
Для исследований ксенотрансплантации использовали самок мышей в возрасте 6-8 недель, гомозиготных по спонтанной мутации тяжелой комбинированной иммунной недостаточности (CB17-Prkdcscid, называемых SCID, Parc Recerca Biomedica, Barcelona, Spain). Тринадцати мышами SCID (6 контрольных и 7 обрабатываемых) инъецировали подкожно 3×106 клетками MDA-MB-231, стабильно трансфицированным вектором рсDNA3-люцифераза (клетки MDA-MB-231-luc) в левый и правый бок. Через пятнадцать суток после инъекции клеток мышам инъецировали внутриопухолево (150 мкл) кондиционированную среду (СМ) 48 часов от hUCESC или плацебо каждые пять суток до сорока семи суток. После инъекции люциферина (150 мг/кг) наблюдали за ростом опухоли экстракорпорально посредством люминесценции с использованием системы визуализации In Vivo (IVIS, Caliper Life Sciences, Alameda, CA, USA). Получали карту интенсивности с использование программного обеспечения Living Image (Caliper Life Sciences). В программном обеспечении используют шкалу на основе цвета для представления интенсивности каждого элемента изображения (в диапазоне от голубого, соответствующего низким значениям, до красного, соответствующего высоким значениям). Одну контрольную и одну обрабатываемую СМ мышь умерщвляли на сутки 31 и удаляли опухоли, фиксировали в 10% нейтральном забуференном формалине в течение 24 часов и погружали в парафин для гистологических и иммуногистохимических исследований. За всеми оставшимися мышами проводили мониторинг для анализов выживаемости.
Иммуногистохимия
Опухоли мышей фиксировали погружением в 10% нейтральный забуференный формалин в течение 24 часов и общепринято заливали парафином. Срезу толщиной 4 мкм помещали на микроскопические предметные стекла Flex IHC (Dako, Glostrup, Denmark). Иммуногистохимический (ШС) способ проводили в автоматическом режиме в AutostainerLink 48 (Dako). Применяли антитело против активированной каспазы 3 (Cell signalling). Проводили демаскировку эпитопа в микроволновой печи в течение 20 минут с использованием буфера для демаскировки EnVision FLEX (pH 9). Все антитела инкубировали в течение 20 минут при комнатной температуре. В качестве системы детекции авторы использовали EnVision FLEX/HRP Dako (полимер декстран, конъюгированный с пероксидазой хрена и аффинновыделенными антителами козы против иммуноглобулинов мыши и кролика) в течение 20 минут.
II - РЕЗУЛЬТАТЫ
Эффект hUCESC на пролиферацию злокачественных клеток человека
Для исследования возможного эффекта hUCESC на линию злокачественных клеток оценивали анализ клеточной пролиферации на линии клеток аденокарциномы толстой и прямой кишки (НТ29) и желудка (AGS), обрабатываемой в течение 48 часов полной средой (контроль), неполной средой (без FBS), кондиционированной средой от hUCESC, продуцируемой в течение 24 часов или 48 часов, и кондиционированной средой от ASC, продуцируемой в течение 48 часов. Эффект кондиционированной среды hUCESC на пролиферацию клеток аденокарциномы толстой и прямой кишки и желудка являлся более сильным чем кондиционированной среды от ASC (фигура 7А).
Для исследования возможного эффекта hUCESC на рак молочной железы после введения кондиционированной среды (СМ) от hUCESC оценивали пролиферацию/цитотоксичность в линии клеток неинвазивного рака молочной железы человека MCF-7 и в линии клеток высоко инвазивного рака молочной железы человека MDA-MB-231. Как продемонстрировано на фигуре 7В-С, через 24 и 48 часов после введения СМ от hUCESC (24 или 48 часов) у клеток MCF-7 не наблюдали значительного снижения метаболизиации МТТ по сравнению с клетками, обрабатываемыми средой без FBS или СМ, продуцируемой через 24 или 48 часов клетками MCF-7. Однако когда ту же СМ от hUCESC вводят в линию клеток MDA-MB-231, наблюдают значительное снижение клеточной пролиферации через 24 часов (СМ от hUCESC, культивируемых в течение 48 часов, P<0,01) и 48 часов (СМ от hUCESC, культивируемых в течение 24 и 48 часов, P<0,01 и P<0,001, соответственно) (фигура 7D-E). Для оценки, можно ли поддерживать эффект СМ от hUCESC на клеточную пролиферацию совместным культивированием hUCESC с клетками MCF-7 или MDA-MB-231, или он зависит только от СМ, клетки MCF-7 и MDA-MB-231 метили зеленым красителем, a hUCESC метили красным красителем. Выявлено, что, несмотря на то, что клетки MCF-7, культивируемые совместно с hUCESC, росли как MCF-7, культивируемые отдельно (фигура 7F), совместное культивирование клеток MDA-MB-231 с hUCESC значительно (P<0,01) снижало число клеток MDA-MB-231 по сравнению с ростом одних клеток MDA-MB-231 (фигура 7G).
Кондиционированная среда от hUCESC задерживает клеточный цикл и индуцирует апоптоз в линии клеток MDA-MB-231
Принимая во внимание, что СМ от hUCESC значительно снижали пролиферацию клеток MDA-MB-231, оценивали клеточный цикл и апоптоз как возможных посредников этого снижения. Клетки MDA-MB-231 культивировали в течение 48 часов с DMEM плюс 10% FBS (+FBS), DMEM без FBS (-FBS) или СМ 48 часов от hUCESC, а затем авторы проводили проточную цитометрию с использованием йодида пропидия (PI) (для оценки клеточного цикла) и аннексина V/PI для оценки апоптоза. Кроме того, проводили вестерн-блоттинг для оценки экспрессии белков, вовлеченных как в клеточный цикл, так и в апоптоз. Результаты указывают на то, что в обрабатываемых СМ клетках значительно увеличивается фаза G0-G1 по сравнению с клетками, обрабатываемыми полной (+FBS) или неполной (-FBS) средой (фигура 8А). Таким образом, в обрабатываемых СМ клетках наблюдали видимое снижение экспрессии белков циклина A, циклина В и циклина D1 (фигура 8 В). Обработка клеток MDA-MB-231 СМ индуцировала значительное увеличение клеток аннексин+/PI- и аннексин+/PI+ по сравнению с клетками, культивируемыми без FBS, что подтверждает, что СМ индуцирует ранний и поздний апоптоз, соответственно (фигура 8С). Иммуноблоты экстрактов белков из клеток MDA-MB-231, обрабатываемых СМ, демонстрировали явное повышение каспазы-8, -12, -9, активированной каспазы-3 и расщепленной PARP (фигура 8D) и снижение Bid и Bim (фигура 8Е) по сравнению с клетками, обрабатываемыми полной (+FBS) и неполной (-FBS) средой.
Кондиционированная среда от hUCESC модифицирует инвазию, образование 3-D культур, рост опухоли и коэффициент выживаемости
Исследовали, оказывала ли СМ от hUCESC влияние на инвазию клеток MDA-MB-231 через матрицу матригель. На фигуре 9А продемонстрировано значительное (P<0,001) снижение инвазивного потенциала клеток MDA-MB-231 в присутствии СМ по сравнению с клетками в присутствии неполной средой (-FBS). Также исследовали трехмерный рост клеток MDA-MB-231. Для этих экспериментов клетки MDA-MB-231 культивировали в матригеле, полутвердой среде, в которой они образуют сферические структуры. Обработка СМ приводила к значительному уменьшению диаметра этих сфер, что невозможно было оценить, когда клетки обрабатывали неполной средой (СМ, средний диаметр = 2,8±1,0 в сравнении с -FBS, средний диаметр = 5,7±1,6 относительных единиц, Р=0,023) (фигура 9В).
Затем оценивали эффект внутриопухолевого введения CM in vivo с использованием модели ксенотрансплантата опухоли на мышах с тяжелым иммунодефицитом (SCID). Мышам инъецировали клетки MDA-MB-231, стабильно трансфицированные вектором люциферазы, в жировую ткань молочной железы и через 15 суток, когда опухоль становилась видимой, им внутриопухолево инъецировали каждые пять суток неполную среду (контроли) или СМ от hUCESC (150 мкл) и проводили мониторинг экстракорпорально посредством люминесценции (фигура 9С). Через 15 суток обработки СМ (на сутки 30) наблюдали значительное снижение (P=0,011) объема опухоли (фигура 9D). На сутки 33 умерщвляли двух животных (одну контрольную мышь и одну обрабатываемую СМ мышь), удаляли опухоли и анализировали посредством иммуногистохимии на активированную каспазу-3 (как показатель апоптоза). На фигуре 9Е продемонстрировано значительное повышение экспрессии активированной каспазы-3 у мышей, обрабатываемых СМ. Для оценки коэффициента выживаемости мышей оставшимся мышам каждые 5 суток инъецировали СМ или плацебо и наблюдали за ними до суток 47. Как продемонстрировано на фигуре 9F, графики выживаемости Каплана-Мейера указывают на то, мыши, которых обрабатывали СМ, имели большую общую выживаемость по сравнению с контрольными мышами (P=0,019).
Кондиционированная среда снижает пролиферацию в опухолях с высокой скоростью пролиферации
Затем оценивали эффект введения СМ от hUCESC на первичные культуры от пациентов с раком молочной железы. Таким образом, десять первичных культур рака молочной железы оценивали в отношении клеточной пролиферации с использованием анализа МТТ. несмотря на то, что в клетках злокачественных опухолей молочной железы с низкой скоростью пролиферации (11В3186, 11В2445, 11В530, 11В545, 11В980 и 11В2127) введение СМ от hUCESC не оказывало достоверный эффект на клеточную пролиферацию по сравнению с эффектом, вызываемым неполной средой (-FBS), СМ от них или СМ, продуцируемую стромальными клетками, получаемыми из жировой ткани, (ASC), в первичных культурах из злокачественных опухолей молочной желез с высокой скоростью пролиферации (11В512, 11В3285, 11В3171 и 11В7352), введение СМ от hUCESC индуцировало значительное (P<0,001) снижение клеточной пролиферации по сравнению с другими видами обработки (фигура 10А). Также оценивали экспрессию циклина D1 и расщепленной PARP в экстрактах белков из этих первичных опухолей с более высокой скоростью пролиферации. Результаты представлены на фигуре 10 В. Наблюдали явное снижение экспрессии циклина D1 и расщепления PARP, когда вводили СМ от hUCESC, но не в первичных культурах, обрабатываемых неполной средой (без FBS).
Пример 4: Ингибирование роста патогенного микроорганизма hUCESC
I - МАТЕРИАЛЫ И МЕТОДЫ
Используемые бактериальные штаммы представляли собой: Е. coli (АТСС 25992), Staphylococcus aureus (АТСС 29213) и Enterococcus faecalis (АТСС 51299).
Ингибирование роста в многолуночных планшетах посредством серийного разведения
Ингибирование роста патогенного микроорганизма оценивали на культурах в 96-луночных микропланшетах для определения максимального разведения среды с противомикробной активностью. В кратком изложении, 100 мкл серийные разведения 1:2 и 75 мкл серийных разведений 1:2 контроля (среда DMEM-F12 без FBS) и кондиционированной среды (hUCESC или получаемые из жировой ткани MSC) помещали в 96-луночные планшеты. Затем в каждую лунку добавляли бактериальную суспензию в бульоне с сердечно-мозговой вытяжкой (разведение 1:300 суспензии 0,5 McFarland). Планшеты инкубировали при 37° в течение 24-48 часов. Ингибирование роста бактерий определяли сравнением контрольных лунок с лунками, которые содержат кондиционированную среду hUCESC или получаемых из жировой ткани MSC.
Ингибирование бактериального роста hUCESC и их кондиционированной средой
Для каждого эксперимента высевали колонии Escherichia coli (Е. coli, АТСС 25992) из замороженных исходных растворов и выращивали в течение ночи при 37°C в жидкой среде Луриа-Бертани (LB) (Difco BD, USA) при легком перемешивании. Перед каждым экспериментом бактериальные клетки однократно промывали и ресуспендировали в PBS и измеряли оптическую плотность (OD при λ=600 нм) суспензии. Число КОЕ рассчитывали в соответствии со следующим уравнением: OD600=1,0 соответствует 4×108 КОЕ/мл для Е. coli. Оценку прямого ингибирования бактериального роста hUCESC или их кондиционированной средой (СМ) проводили путем подсчета КОЕ и определения OD.
В кратком изложении, в 24-луночные планшеты добавляли 300 КОЕ E.coli к: а) 2×105 hUCESC в DMEM/F-12-НАМ (1:1) с добавлением 10% FBS, b) 2×105 нормальных фибробластов человека (NHF) в той же среде для культивирования и с) одной среде для культивирования. Затем культуры инкубировали в течение 6 часов в увлажненном инкубаторе CO2. Измеряли оптическую плотность после 2 часа роста инфицированных культур в LB при 37°C. Количественное определение КОЕ проводили в планшетах с LB-агаром после инкубации в течение ночи инкубация при 37°C. Оставшуюся инфицированную среду центрифугировали при 15000 об./мин. в течение 10 минут и замораживали при -20°C (для удаления любых остаточных бактериальных организмов). Образцы размораживали на льду и переносили аликвоты в 96-луночный планшет, инокулировали 100 КОЕ Е. coli и инкубировали в течение 16 часов при 37°C. OD и величины КОЕ подсчитывали, как описано выше.
II - РЕЗУЛЬТАТЫ
Ингибирование роста в многолуночных планшетах путем серийного разведения
Для всех разведений контрольной среды демонстрировали бактериальный рост. Для кондиционированной среды MSC получаемой из жировой ткани, не демонстрировали противомикробной активности, хотя для кондиционированной среды hUCESC демонстрировали ингибирование бактериального роста до разведения 1/20 (фигура 11).
Ингибирование бактериального роста hUCESC и их кондиционированной средой
hUCESC человека значительно (p<0,001) ингибировали бактериальный рост Е. coli по сравнению с контрольной средой и контрольными клетками NHF. Количественное определение КОЕ и OD демонстрировало уменьшение приблизительно на 50% числа колоний (фигура 12) и оптической плотности (фигура 13), соответственно, по сравнению с контролями (одна среда и NHF). Для инфицированной среды, получаемой из hUCESC, демонстрировали такой же эффект в отношении Е. coli как и для hUCESC. Эти результаты позволяют предположить, что антибактериальный эффект оказывает определенный растворимый фактор, секретируемый hUCESC.
Пример 5: Связанные с регенерацией ткани эксперименты: заживление вызываемых щелочью ран эпителия роговицы на модели сухого глаза на крысах кондиционированной средой hUCESC
I - МАТЕРИАЛЫ И МЕТОДЫ
Для проведения этого эксперимента использовали 15 самок крыс Sprague-Dawley массой 200-250 г. Всех животных анестезировали интраперитонеальной инъекцией смеси кетамина (0,425 мл) и ксилазина (0,2 мл), смоченного в NaOH (0,375 мл). В конце эксперимента всех крыс умерщвляли посредством ингаляции CO2.
Модель сухого глаза
3 из 15 крыс сохраняли со здоровыми глазами, оставшихся 12 крыс анестезировали и симметрично вырезали экстраокулярную слезную железу для создания сухих глаз. Экстраокулярная слезная железа является одной из трех слезных желез крысы. Эта железа является основной железой для продуцирования слез и характеризуется легким доступом (фигура 14А). Через одну неделю после операции измеряли продуцирование слез тестом Ширмера (Laboratorios Cusi SA, Barcelona). Адаптировали бумажные полоски нарезанием их по 2 мм шириной. Конец полоски длиной 1 мм загибали и вводили под веко на 5 минут. По прошествии этого времени измеряли длину смоченной полоски от загнутой отметки (фигура 14В, С). У всех 12 крыс выявили сухие глаза.
Рана роговицы в результате действия щелочи и анализ
Центральную рану роговицы в результате действия щелочи получали на обоих глазах наложения кусочка ватманской бумаги (2×2 мм), смоченной 2 мкл NaOH (1 моль/л), в течение 60 секунд. Затем роговицу ополаскивали физиологическим раствором в течение 30 секунд. Всех крысы предварительно анестезировали, как описано выше. Поврежденный эпителий являлся визуально заметным после окрашивания флуоресцеином (


Группы и виды обработки
Пятнадцать крыс разделяли на 5 групп по 3 крысы в каждой. Существовала одна группа со здоровыми глазами (нормальная группа) и без поражения роговицы и 4 группы (группы CM, М, SH и без обработки) с сухими глазами и щелочным ожогом роговицы на обоих глазах. Виды обработки состояли из местного применения глазных капель, дозируемых 4 раза в сутки:
Группа СМ: кондиционированная среда.
Группа М: среда для культивирования (DMEM-F12; Gibco, Life Technologies, Paisley, UK) без какого-либо предварительного контактирования с клетками.
Группа SH: офтальмологические капли с гиалуронатом натрия (0,015 г/10 мл).
Группа без обработки: обработка отсутствует.
Кондиционированная среда (СМ)
Мезенхимальные стволовые клетки шейки матки человека (клетки по изобретению) культивировали в 90-мм чашках Петри 70% конфлюэнтности с 5 мл среды для культивирования DMEM-F12 (Gibco, Life Technologies, Paisley, UK) в атмосфере воздух-СO2 (95:5) при 37°C в течение 48 часов. По прошествии этого времени собирали супернатант, замораживали и лиофилизировали для хранения при -80°C до использования. Лиофилизированный порошок ресуспендировали непосредственно перед использованием в бдН2O.
Гистология
В конце эксперимента через 5 суток после щелочного ожога роговицы умерщвляли одну случайным образом выбранную крысу из каждой группы, удаляли глазное яблоко и фиксировали погружением в 10% нейтральный забуференный формалин. Через 24 часа роговицу иссекали из глазного яблока и погружали в этанол (70%). Затем роговицу погружали в парафин и подготавливали срезы 20 мкм, и окашивали гематоксилин-эозином (Н-Е) для гистологической оценки.
Анализ экспрессии мРНК
В конце эксперимента через 5 суток после поражения роговицы умерщвляли две оставшиеся крысы из каждой группы и иссекали роговицы. Уровни экспрессии мРНК макрофагального белка воспаления 1 альфа (МIP-1α), белка хемотаксиса моноцитов 1 (МСР-1) и фактора некроза опухоли альфа (TNF-α) в образцах роговицы оценивали с использованием полимеразной цепной реакции в режиме реального времени (ПЦР в режиме реального времени). Тотальную РНК выделяли из образцов роговицы с использованием TRIzol (Invitrogen). кДНК синтезировали из РНК (1 мкг) в 30 мкл реакционной смеси с использованием набора Transcriptor First Strand cDNA Synthesis (Roche Diagnostics). Реакции количественной ПЦР в режиме реального времени проводили с 2 мкг кДНК в 20 мкл объеме с использованием iQ SYBRGreen Supermix (Bio-Rad) на оборудовании iCycler (7500 PCR Systems, Applied Biosystems-Life Technologies). Образцы денатурировали при 94°C в течение 10 секунд, отжигали при 58°C в течение 10 секунд и удлиняли при 72°C в течение 10 секунд в общей сложности 35 циклов. Образцы количественно определяли с использованием программного обеспечение Sequence Detection 1.4 (Applied Biosystems) с β-актином в качестве эндогенного контроля. Олигонуклеотидные последовательности описаны в таблице 2.

Анализ данных
Величины выражают в виде среднего значения ± стандартное отклонение. Средние значения сравнивали с использованием однофакторного дисперсионного анализа с ранговым критерием Тьюки для апостериорных сравнений. Значения P менее 0,05 считали статистически значимыми. Для всех вычислений использовали программное обеспечение MATLAB R2011a Version 7.1 (MathWorks, Inc).
Процент регенерации эпителия (%ER) рассчитывали по формуле:
%ER=100(mi-mf)/mi
Где m1 представляет собой первое измерение повреждения роговицы (сразу после щелочного ожога), и mf представляет собой последнее измерение через 48 часов. Оба измерения отражают процент раненой площади относительно общей площади роговицы.
II-РЕЗУЛЬТАТЫ
Эффекты на восстановление эпителия
Окрашивание эпителия роговицы флуоресцеином является показателем дефектов эпителия (фигура 15А). Процент регенерации эпителия (%ER) для каждой группы рассчитывали, как описано в разделе способы. Восстановление поверхности роговицы являлось значительно быстрее в группе, которую обрабатывали СМ, по сравнению с другими группами 15 часов после щелочного ожога (p<0,005, 1-факторный дисперсионный анализ, фиг. 15 В). Средние значения регенерации эпителия (ER) составляли: 62±5% для группы СМ; 34±15% для группы М; 32±15% для группы SH и 36±13% для группы без обработки. На сутки 5 после щелочного ожога восстановление поверхность роговицы практически полностью завершалось во всех группах обработки (>75%), но проходило значительно быстрее в группе, обрабатываемой СМ, по сравнению с группой без обработки (p=0,005, 1-факторный дисперсионный анализ; фигура 15С). Средние значения ER составляли: 92±4% для группы СМ; 77±15% для группы М; 74±15% для группы SH и 62±16% для группы без обработки.
Сравнивали закрытие раны в результате действия щелочи эпителия роговицы на сутки 5 после окрашивания Н-Е срезов роговицы, регенерация эпителия роговицы происходит быстрее в группе, обрабатываемой СМ, по сравнению с другими группами (фигура 16).
Противовоспалительные эффекты
Для исследования возможного механизма, посредством которого СМ ослабляют воспаление, авторы оценивали продукцию хемотаксических факторов MIP-1α и МСР-1 и иммуностимулирующего цитокина TNF-α. Авторы выявили, что уровни всех MIP-1α, МСР-1 и TNF-α являлись очень высокими в группе М (группе, обрабатываемой средой для культивирования без контактирования со стволовыми клетками) по сравнению с остальными группами, включая группу без обработки (с повреждением но без обработки) (p<0,05; 1-факторный дисперсионный анализ; фигура 17). Однако группа, которую обрабатывали такой же средой для культивирования, но с предварительном контактирование со стволовыми клетками (группа СМ), имела более низкие уровни всех MIP-1α, МСР-1 и TNF-α по сравнению с группой М (p<0,05; 1-факторный дисперсионный анализ; фигура 4). По-видимому, этот результат свидетельствует на том, что используемая среда для культивирования (DMEM-F-12) оказывает провоспалительные эффекты на этот тип повреждений, и эти эффекты являлись обусловленными определенными факторами, секретируемыми культивируемыми стволовыми клетками. Кроме того, уровни MIP-1α в группе СМ являются аналогичными уровням в группе без поражения (без поражения роговицы) и ниже чем в других обрабатываемых группах (М и SH) и в группе без обработки (p<0,05; 1-факторный дисперсионный анализ; фигура 17В). Этот результат является показателем противовоспалительного эффекта СМ в отношении пораженной роговицы.
Пример 6: Эксперименты, связанные с отбором половых клеток: эффект кондиционированной среды hUCESC на сперматозоиды
I - МАТЕРИАЛЫ И МЕТОДЫ
Кондиционированная среда (СМ) являлась лиофилизированной и восстановленной в трех концентрациях 0,5:1, 1:1 и 4:1. Эксперименты проводили на свежей семенной жидкости и/или капаситированных сперматозоидах в моменты времени 0 часов (Т0), 3 часа (Т3) и 24 часа (Т24).
Анализ семенной жидкости
Анализ семенной жидкости проводили в соответствии с руководствами 2010 Всемирной организации здравоохранения (ВОЗ) с использованием световой микроскопии. После разжижения 5 мкл семенной жидкости помещали в счетную камеру с сеткой Нейбауэра (Sefi Medical Instruments, Haifa, Israel). Общий подсчет сперматозоидов (×106/мл) и процент подвижности определяли вручную. Минимально 200 клеток подсчитывали в 5 мкл капли и исследовали по меньшей мере две капли на образец. Жизнеспособность сперматозоидов исследовали способом исключения красителя, также в соответствии с руководствами ВОЗ с использованием эозина красного и нигрозина.
Оценка окислительного стресса
Дигидроэтидий (DHE) представляет собой слабо флуоресцентный продукт восстановления двумя электронами этидия (Et+), который при окислении образует ДНК-чувствительные флуорохромы, которые приводят к образованию флуоресценции ядра красным при возбуждении при 510 нм. Результаты, получаемые с этим зондом, подтверждали как показатель способности сперматозоидов человека продуцировать ROS, включая окончательную идентификацию супероксид аниона. Для анализа внутриклеточной продукции ROS DHE (3 мМ) разбавляли в буфере PBS и добавляли к 0,5×106 свежих сперматозоидов в конечном объеме 500 мл. Затем клетки инкубировали в темноте при комнатной температуре в течение 45 минут, дважды промывали (2000 об/мин, 5 мин) и получаемую красную (НЕ) флуоресценцию анализировали проточной цитометрией с использованием анализатора FACScan. Данные выражали в виде процента флуоресцентных сперматозоидов.
Оценка целостности плазматической мембраны
Целостность плазматической мембраны митохондрий положительно коррелировала с подвижностью и жизнеспособностью сперматозоидов и отрицательно коррелировала с апоптозом клеток. В процессе окислительного фосфорилирования протоны посредством насоса переходят с внутренней стороны митохондрий на наружную, создавая электрохимический градиент, называемый внутренним мембранным потенциалом митохондрий (ММР). Способность отличать митохондрии с высоким ММР от митохондрий с низким ММР обеспечивает надежную оценку метаболической функции и целостности мембран митохондрий. Оценку ММР в сперматозоидах проводили посредством проточной цитометрии с использованием флуоресцентного красителя 3,3'-дигексилоксакарбоцианин йодида (DiOC6). В кратком изложении, сперматозоиды (0,5×106) из каждого свежего образца инкубировали с DiOC6 (0,1 нМ разведенного в среде HTF) при 37°C на водяной бане в течение 45 минут в конечном объеме 500 мл. Затем клетки дважды отмывали (2000 об/мин, 5 мин) PBS, ресуспендировали в 500 мл буфера PBS и анализировали проточной цитометрией. В качестве отрицательного контроля образец спермы также инкубировали с 1 мМ разобщающего средства карбамоилцианид-мета-хлорфенилгидразона (CCCIP).
II - РЕЗУЛЬТАТЫ
Кондиционированная среда (CM)hUCESC оказывает эффект на характеристики спермы в зависимости от концентрации и времени (таблица 3). По сравнению с контролем (без СМ) для 4:1 СМ демонстрируют снижение всех процентов характеристик спермы в моменты Т3 и Т24, тогда как для 1:1 СМ демонстрируют более высокий эффект на подвижность, жизнеспособность, окислительный стресс и мембранный потенциал в момент Т24.


В таблице 4 продемонстрировано, что CM hUCESC 1:1 оказывает более высокий эффект чем CM hUCESC 0,5:1 на характеристики спермы свежего эякулята и капаситированных сперматозоидов. Для CM hUCESC демонстрируют более высокий эффект на свежую сперму по сравнению с капаситированными сперматозоидами, это помогает проводить отбор сперматозоидов хорошего качества.

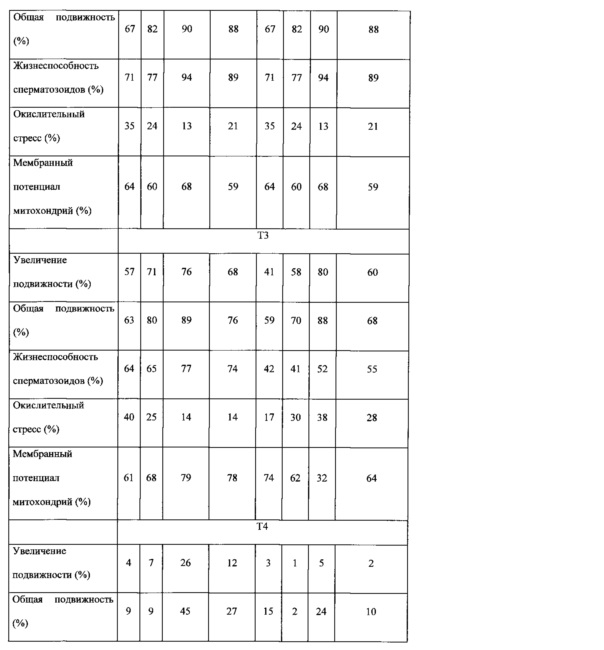
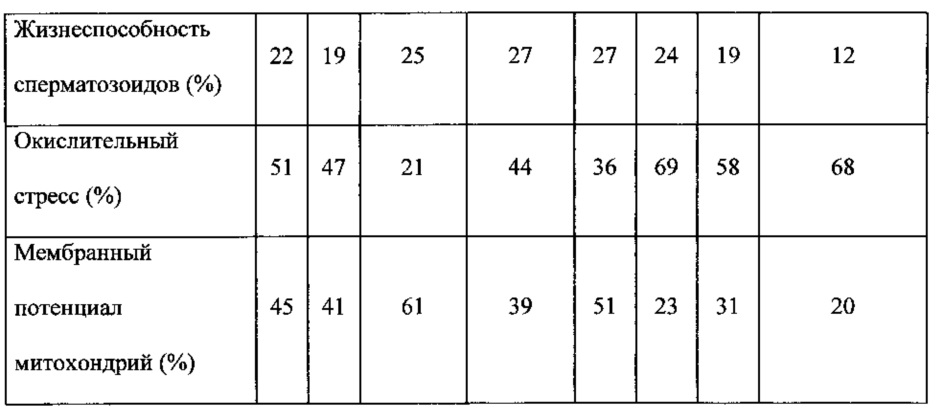
Реферат
Изобретение относится к области клеточной биологии и биотехнологии, в частности к способу выделения мезенхимальных стволовых клеток шейки матки, не являющихся опухолевыми, которые экспрессируют клеточные маркеры CD29, CD44, CD73, CD105 и CD90 и не экспрессируют клеточные маркеры CD117, CD133, HLA-DR, TRA-81, CD45, CD34 и CD31, применению выделенной ткани шейки матки и способу получения кондиционированной среды. Способ включает приготовление клеточной суспензии из ткани шейки матки, полученной десквамацией шейки матки, выделение клеток из указанной клеточной суспензии, инкубацию указанных клеток в подходящей среде для культивирования клеток и в условиях, которые обеспечивают пролиферацию клеток и отбор мезенхимальных стволовых клеток, где указанные мезенхимальные стволовые клетки шейки матки экспрессируют клеточные маркеры CD29, CD44, CD73, CD105 и CD90 и не экспрессируют клеточные маркеры CD117, CD133, HLA-DR, TRA1-81, CD45, CD34 и CD31. Далее осуществляют инкубацию данных клеток в среде для культивирования и удаление клеток из среды. Изобретение позволяет выделить мезенхимальные стволовые клетки шейки матки, не являющиеся опухолевыми, которые экспрессируют клеточные маркеры CD29, CD44, CD73, CD105 и CD90 и не экспрессируют клеточные маркеры CD117, CD133, HLA-DR, TRA-81, CD45, CD34 и CD31. 4 н. и 4 з.п. ф-лы, 18 ил., 4 табл., 6 пр.

Комментарии