Фармацевтическая композиция, содержащая индольное соединение - RU2557243C2
Код документа: RU2557243C2
Чертежи



















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, содержащей индольное соединение, для предотвращения или лечения заболеваний, связанных с окислительным стрессом, дисфункцией митохондрий, гипоксическим повреждением, некрозом и/или ишемическим реперфузионным повреждением, и к косметической композиции, содержащей индольное соединение, имеющее антиоксидантный эффект.
Уровень техники
Организмы, включая человеческое тело, получают энергию посредством процесса дыхания, и примерно 2% кислорода, поглощенного в ходе метаболизма, превращается в активные формы кислорода (ROS), известные как “кислородный токсин”. Под активными формами кислорода подразумевается кислород, содержащий свободный радикал (общее наименование атомов или молекул с неспаренным электроном), и обычно такая форма включает липидный пероксид, липидный пероксидный радикал, пероксинитрил и так далее. Известно, что такие активные формы кислорода являются нестабильными и, таким образом, весьма реакционно-способными в отношении веществ среды, вызывая окислительные повреждения ДНК, несущей генетическую информацию, а также белков или молекул липидов в клетке, вследствие чего, в конечном счете, клетка подвергается фатальному повреждению. С другой стороны, делается вывод, что в таких клетках иммунной системы, как макрофаги или нейтрофилы, продуцирование активных форм кислорода играет полезную роль в уничтожении патогенов, которые проникают извне. В отличие от вышеописанного случая и недавно подтвержденного случая, в котором активные формы кислорода играют важную роль в сигнальной трансдукции внутри клетки, активные формы кислорода, в общем, рассматриваются как вызывающие повреждение клетки и, таким образом, являющиеся губительными для организмов. Таким образом, чтобы защитить клетки от кислородного токсина, сами клетки имеют антиоксиданты (например, витамин C, витамин E, малые пептиды, такие как глутатион) и антиоксидантные ферменты (например, каталаза, супероксиддисмутаза [SOD], глутатион-зависимая пероксидаза [GPX] и так далее).
Примерами заболеваний или метаболических процессов, связанных с активными формами кислорода (ROS) или антиоксидантными ферментами, являются следующие:
1. Инсулинозависимый диабет развивается в результате повреждения бета-клеток поджелудочной железы, которое обусловлено ненормальной экспрессией ROS.
2. Синдром Дауна, являющийся в настоящее время объектом клинического внимания, как известно, вызывается дефектом хромосомы 21. В данном случае SOD, антиоксидантный фермент, экспрессируется ненормально.
3. Антиоксидантный фермент (каталаза, глутатион-зависимая пероксидаза), определенный анализом в клетке пациента, страдающего прогерией, показывает низкую ферментативную активность.
4. Даже в процессе превращения нормальных клеток в раковые клетки ROS активно продуцируется в клетках в ходе введения некоторых вызывающих рак веществ и облучения.
5. Кроме вышеупомянутого, известно, что ROS вовлечены в атеросклероз, болезнь Альцгеймера, ишемическую болезнь и так далее.
Некоторые свободные радикалы, активные формы кислорода и пероксиды продуцируются в ходе метаболических процессов даже в нормальных клетках. Однако клетки защищают себя от таких вредных веществ, используя антиоксидантные ферменты, такие как SOD, каталаза, пероксидаза и так далее, в качестве защитной системы наряду с антиоксидантами, такими как витамин E, витамин C, глутатион, убихинон, мочевая кислота и так далее. Когда такая защитная система имеет дефект или продуцирование активных форм кислорода превосходит функциональную способность защитной системы вследствие разнообразных физических или химических факторов, индуцируется, однако, окислительный стресс. Если заболевание субъекта связано с дисбалансом между окислительным стрессом и антиоксидантной защитной системой в организме, теоретически окислительное повреждение может быть уменьшено или дальнейшее прогрессирование заболевания может быть подавлено путем добавления антиоксидантного вещества. Таким образом, антиоксидантно-функциональные вещества, такие как поглотители свободных радикалов, или вещества, ингибирующие продуцирование пероксидов, широко применяются в настоящее время в полимерных, пищевых, косметических областях и так далее. Они также могут быть использованы в качестве ингибирующего или терапевтического агента в случае старения и различных заболеваний, вызванных данными оксидами, что основано на недавнем открытии того, что активные формы кислорода вовлечены в физиологические явления, связанные с различными заболеваниями. Постепенно возрастает интерес к разработке терапевтического агента с их применением, и агент в действительности реализуется на рынке в качестве пищевой добавки в США с возрастающей популярностью.
Показано, что окислительный стресс представляет собой важный причинный фактор индукции разнообразных заболеваний, включая старение. Соответственно, перспективы антиоксидантно-функциональных веществ, обладающих способностью удалять активные формы кислорода, в качестве агента для подавления старения и для лечения заболеваний сильно возрастают. Таким образом, требуется разработать новое антиоксидантно-функциональное вещество, которое может обладать функцией лечения старения, вызванного окислительным стрессом, и разнообразных заболеваний.
Существует много антиоксидантов, но большинство из них не доставляется эффективно в митохондрии, и, таким образом, они проявляют слабую или незначительную эффективность. Поэтому доставка антиоксидантов в митохондрии является весьма важной при лечении вышеупомянутых заболеваний. В случае соединения Mito Q было возможно использовать его в качестве терапевтического агента, поскольку он образован конъюгацией коэнзима Q10 с пептидом, нацеленным на митохондрии.
С другой стороны, сообщалось, что такой окислительный стресс является основным механизмом ишемического реперфузионного повреждения. Ишемические болезни предполагают эктомию, трансплантацию органов, эмболизацию, инфаркт миокарда, инсульт и так далее.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Следовательно, задача настоящего изобретения заключается в том, чтобы предоставить фармацевтическую композицию, содержащую индольное соединение, подходящее для предотвращения или лечения заболеваний, связанных с окислительным стрессом, дисфункцией митохондрий, гипоксическим повреждением, некрозом и/или ишемическим реперфузионным повреждением, и к косметической композиции, содержащей индольное соединение, имеющее антиоксидантный эффект.
Решение проблемы
Настоящее изобретение предоставляет фармацевтическую композицию для предотвращения или лечения заболеваний, связанных с окислительным стрессом, включающую терапевтически эффективное количество соединения следующей формулы (1), (2) или (3), его фармацевтически приемлемой соли или изомера в качестве активного ингредиента, и фармацевтически приемлемый носитель.
Формула 1
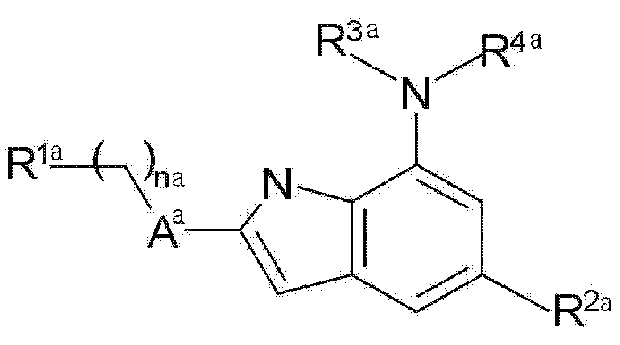
В вышеприведенной формуле (1) каждый из заместителей конкретно определен в публикации международной патентной заявки № WO 2009/025477 следующим образом:
В формуле (1):
na обозначает число от 0 до 3,
Aa представляет 5-членный гетероарил или гетероцикл, каждый из которых имеет от 1 до 3 гетероатомов, выбранных из N, O и S,
R1a представляет R5a-Xa-Ba-X'a-,
Ba представляет прямую связь или представляет 3-10-членный гетероцикл или гетероарил, каждый из которых имеет от 1 до 4 гетероатомов, выбранных из N, O и S,
Xa и X'a независимо друг от друга представляют прямую связь или выбраны из группы, состоящей из -NR6a-, -CO-, -CONR6a-, -CO2-, -OC(O)-, -S(O)ma-, -O-(CH2)ma-, -(CH2)ma-O-, -(CH2)ma-, -NR6aCO-, -(R6aO)2P(O)- и -NHCO2-, где ma обозначает число от 0 до 3 и R6a представляет водород, алкил или циклоалкил,
R5a представляет водород, нитрил, гидрокси, алкил, алкокси, циклоалкил или арил или представляет 3-10-членный моноциклический или конденсированный циклический гетероцикл или гетероарил, каждый из которых имеет от 1 до 3 гетероатомов, выбранных из N, O и S, и необязательно замещен оксо или алкилом, или
R5a и R6a могут вместе образовывать 4-8-членный цикл,
R2a представляет -(CR8aR9a)pa-Ya-R7a,
pa обозначает число от 0 до 2,
R8a и R9a независимо друг от друга представляют водород или алкил или могут вместе образовывать 4-8-членный цикл,
Ya представляет прямую связь или выбран из группы, состоящей из -O-, -S-, -NR6a-, -NR6aC(O)-, -CO2-, -C(O)-, -C(O)NR6a-, -S(O)qa- и -S(O)qaNR6a-, где qa обозначает число от 0 до 2,
R7a представляет водород, галоген, циано, гидрокси, нитро, алкил, циклоалкил или арил или представляет 3-10-членный гетероцикл или гетероарил, каждый из которых имеет от 1 до 3 гетероатомов, выбранных из N, S и O и который необязательно содержит оксо,
R3a представляет водород, алкил, -(CH2)qa-циклоалкил или -(CH2)qa-гетероцикл,
R4a представляет -(CH2)pa-Da-R10a-,
Da представляет прямую связь, представляет циклоалкил, необязательно содержащий оксо, представляет арил или представляет 3-10-членный гетероцикл или гетероарил, каждый из которых имеет от 1 до 3 гетероатомов, выбранных из N, S и O,
R10a представляет водород, галоген, амино, циано, нитро, гидрокси, алкил, алкилкарбонил, алкилсульфонил или -(CH2)pa-NR8aR9a,
где алкил, алкокси, арил, циклоалкил, гетероцикл и гетероарил могут быть необязательно замещены, и заместители представляют собой один или более, выбранные из группы, состоящей из гидрокси, галогена, нитрила, амино, алкиламино, диалкиламино, алкила, галогеналкила, алкилсульфонила, карбоксиалкила, алкилкарбонилокси, алкилтио, алкилоксикарбонила, алкиламинокарбонила, арилалкокси и оксо.
Формула 2

В вышеприведенной формуле (2) каждый из заместителей конкретно определен в публикации международной патентной заявки № WO 2009/025478 следующим образом:
В формуле (2):
nb обозначает число от 1 до 3,
mb обозначает 0 или 1,
Ab представляет прямую связь, представляет фенил или представляет 6-членный гетероарил, имеющий от 1 до 2 атомов азота,
Xb представляет C или N при условии, что mb составляет 0, когда Xb представляет собой N, и mb составляет 1, когда Xb представляет собой C,
R1b представляет водород, алкил, -(CH2)rbNR7bR8b или -(CH2)rbCO2H, где rb обозначает число от 1 до 5 и R7b и R8b независимо друг от друга представляют водород, алкил или алкилкарбонил, или могут вместе образовывать необязательно алкилзамещенную алкиленовую цепь, в которой необязательно один метилен замещен атомом N,
R2b представляет водород, галоген, циано, нитро, гидрокси, алкил, алкокси или триалкилсилил, представляет -(CH2)pbCO2R7b, -(CH2)pbOR7b, -(CH2)pbNR7bR8b, -NHR10b, -N(H)S(O)2R7b, -NHC(O)R10b, -(CH2)pbS(O)2R7b или (CH2)pb-гетероцикл-R10b, где pb обозначает число от 0 до 3, R7b и R8b являются такими, как определено выше, R10b представляет водород, оксо, алкилсульфонил, алкилкарбонил, алкилоксикарбонил, алкиламинокарбонил, алкокси, алкил или гетероцикл,
R3b представляет водород, циано, галоген, алкил или фенил или представляет -(CH2)nb-гетероцикл или -(CH2)nb-арил, где nb обозначает число от 0 до 3,
R4b представляет -YbR11b, где Yb представляет прямую связь или -(CR7bR8b)pbY'b-, где pb обозначает число от 0 до 3, R7b и R8b являются такими, как определено выше, Y'b выбран из группы, состоящей из -O-, -S-, -NR12b-, -NR12bC(O)-, -C(O)-, -C(O)O-, -C(O)NR12b-, -S(O)qb- и -S(O)qbNR12b-, где R12b представляет водород, алкил, арил или гетероарил, qb обозначает число от 0 до 2, R11b выбран из группы, состоящей из водорода, циано, галогена, гидрокси, тиол, карбокси, алкил и -(CH2)tbBb-R13b, где tb обозначает число от 0 до 3, Bb представляет гетероцикл, гетероарил или арил, R13b представляет водород, циано, галоген, гидрокси, оксо, тиол, карбокси, карбоксиалкил, алкилкарбонилокси, алкил, алкокси, алкилтио, алкилкарбонил или алкилсульфонил,
R5b представляет водород, алкил, циклоалкил, гетероцикл или гетероциклилалкил,
R6b представляет -(CR7bR8b)pb-Zb-Db-Wb-R14b, где Zb представляет прямую связь или выбран из группы, состоящей из -C(O)-, -C(O)O-, -C(O)NR12b- и -S(O)yb-, yb обозначает число 1 или 2, Db представляет прямую связь или представляет циклоалкил, гетероарил или гетероцикл, Wb представляет прямую связь или представляет -NR7b-, -C(O)-, -C(O)O-, -C(O)NR12b-, -S(O)yb-, -S(O)ybNR12b- или -NR12bS(O)yb-, где R14b представляет водород, гидрокси, алкил, алкокси, гетероцикл, гетероарил, арил или аралкил,
R5b и R6b вместе представляют алкиленовую цепь,
где алкил, алкокси, арил, циклоалкил, гетероцикл и гетероарил могут быть необязательно замещены, и заместители представляют собой один или более, выбранные из группы, состоящей из гидрокси, галогена, нитрила, амино, алкиламино, диалкиламино, карбокси, алкила, алкокси, карбоксиалкила, алкилкарбонилокси, алкилтио, алкилоксикарбонила, алкиламинокарбонила, арилалкокси и оксо.
Формула 3

В формуле (3):
Bc представляет арил или представляет 4-8-членный гетероцикл или гетероарил, каждый из которых имеет от 1 до 2 гетероатомов, выбранных из N, O и S,
R7c представляет водород, галоген, гидрокси, нитрил, нитро или алкокси,
R8c представляет C1-C6-алкил, C3-C8-циклоалкил, гетероциклил, арил, арилалкил, циклоалкил-алкил или гетероциклил-алкил,
R9c представляет водород, галоген, гидрокси, нитрил, нитро, алкокси, аллилокси, алкиламино или ариламино,
где алкил, алкокси, арил, циклоалкил, гетероцикл и гетероарил могут быть необязательно замещены, и заместители представляют собой один или более, выбранные из группы, состоящей из гидрокси, галогена, нитрила, амино, C1-C6-алкиламино, ди(C1-C6-алкил)амино, карбокси, C1-C6-алкила, галоген-C1-C6-алкила, C1-C6-алкокси, арил-C1-C6-алкокси и оксо.
В вышеприведенных определениях соединений формул (1), (2) и (3) термин “алкил” означает алифатический углеводородный радикал. Алкил может представлять собой насыщенный алкил, который не включает алкенильный или алкинильный фрагмент, или ненасыщенный алкил, который включает по меньшей мере один алкенильный или алкинильный фрагмент. “Алкенил” означает группу, содержащую по меньшей мере одну углерод-углеродную двойную связь, “алкинил” означает группу, содержащую по меньшей мере одну углерод-углеродную тройную связь. Алкил может быть разветвленным или иметь нормальную цепь, будучи использованным сам по себе или в составной форме, такой как алкокси.
Алкильная группа может иметь от 1 до 20 атомов углерода, если иное не определено. Алкильная группа может представлять собой алкил среднего размера, имеющий от 1 до 10 атомов углерода. В ином случае, алкильная группа может представлять собой низший алкил, имеющий от 1 до 6 атомов углерода. Ее типичные примеры включают следующие, но не ограничены ими: метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, гексил, этенил, пропенил, бутенил и так далее. Например, C1-C4-алкил имеет от 1 до 4 атомов углерода в алкильной цепи и выбран из группы, состоящей из метила, этила, пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила.
Термин “алкокси” означает алкилокси, имеющий от 1 до 10 атомов углерода, если не определено иное.
Термин “циклоалкил” означает замещенный алифатический 3-10-членный цикл, если не определено иное. Его типичные примеры включают следующие, но не ограничены ими: циклопропил, циклобутил, циклопентил, циклогексил и так далее.
Термин “арил” включает по меньшей мере одно кольцо, имеющее ковалентную π-электронную систему, например моноциклические или конденсированные полициклические (то есть циклы, которые делят смежные пары атомов углерода) группы. В настоящем описании арил означает ароматическое 4-10-членное, предпочтительно 6-10-членное, моноциклическое или полициклическое кольцо, включая фенил, нафтил и так далее, если не определено иное.
Термин “гетероарил” означает ароматический 3-10-членный, предпочтительно 4-8-членный, более предпочтительно 5-6-членный, цикл, который имеет от 1 до 4 гетероатомов, выбранных из N, O и S, и может быть конденсирован с бензо- или C3-C8-циклоалкилом, если не определено иное. Моноциклический гетероарил включает следующие, но не ограничен ими: тиазол, оксазол, тиофен, фуран, пиррол, имидазол, изоксазол, изотиазол, пиразол, триазол, триазин, тиадиазол, тетразол, оксадиазол, пиридин, пиридазин, пиримидин, пиразин и тому подобное. Бициклический гетероарил включает следующие, но не ограничен ими: индол, индолин, бензотиофен, бензофуран, бензимидазол, бензоксазол, бензизоксазол, бензтиазол, бензтиадиазол, бензтриазол, хинолин, изохинолин, пурин, пуропиридин и тому подобное.
Термин “гетероцикл” означает 3-10-членный, предпочтительно 4-8-членный, более предпочтительно 5-6-членный, цикл, который имеет от 1 до 4 гетероатомов, выбранных из N, O и S, может быть конденсирован с бензо- или C3-C8-циклоалкилом и является насыщенным или содержит 1 или 2 двойные связи, если не определено иное. Гетероцикл включает следующие, но не ограничен ими: пирролин, пирролидин, имидазолин, имидазолидин, пиразолин, пиразолидин, пиран, пиперидин, морфолин, тиоморфолин, пиперазин, гидрофуран и тому подобное.
Другие термины и сокращения в настоящем описании могут быть поняты как имеющие значение, традиционно используемое в данной области квалифицированным специалистом, если не определено иное.
Предпочтительные примеры соединений формулы (1) или (2) могут быть перечислены следующим образом:
Соединение 1:
[(S)-2-(7-циклопентиламино-5-метил-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]уксусная кислота
Соединение 2:
{(S)-2-[5-метил-7-(тетрагидропиран-4-иламино)-1H-индол-2-ил]-4,5-дигидротиазол-4-ил}уксусная кислота
Соединение 3:
[(S)-2-(7-циклопентиламино-5-метил-1H-индол-2-ил)-4,5-дигидрооксазол-4-ил]уксусная кислота
Соединение 4:
[(S)-2-(7-циклопентиламино-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]уксусная кислота
Соединение 5:
[(S)-2-(7-циклопентиламино-5-фенокси-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]уксусная кислота
Соединение 6:
4-{2-[(S)-2-(7-циклопентиламино-5-фенокси-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]этил}пиперазин-2-он
Соединение 7:
циклопентил-(2-{(S)-4-[2-(3-метил-5,6-дигидро-8H-[1,2,4]триазоло[4,3-a]пиразин-7-ил)этил]-4,5-дигидротиазол-4-ил}-5-фенокси-1H-индол-7-ил)амин
Соединение 8:
((S)-2-{7-[(тетрагидропиран-4-илметил)амино]-1H-индол-2-ил}-4,5-дигидротиазол-4-ил)уксусная кислота
Соединение 9:
(тетрагидропиран-4-ил)-[2-фенил-5-(1,1-диоксотиоморфолин-4-ил)метил-1H-индол-7-ил]амин
Соединение 10:
[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-ил]-(тетрагидропиран-4-ил)метиламин
Соединение 11:
[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-ил]-бис-[(тетрагидропиран-4-ил)метил]амин
Соединение 12:
{4-[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-иламино]пиперидин-1-ил}-(тетрагидропиран-3-ил)метанон
Соединение 13:
[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-ил]-(1-метилсульфонилпиперидин-4-ил)амин
Соединение 14:
((S)-2-{5-метил-7-[(тетрагидропиран-4-илметил)амино]-1H-индол-2-ил}-4,5-дигидротиазол-4-ил)уксусная кислота
Предпочтительными соединениями среди соединений вышеприведенной формулы (3) являются те, в которых
Bc представляет арил или представляет 5-6-членный гетероцикл или гетероарил, каждый из которых имеет от 1 до 2 гетероатомов, выбранных из N, O и S,
R7c представляет водород, галоген, нитрил или алкокси,
R8c представляет C1-C6-алкил, C3-C8-циклоалкил, гетероциклил, арилалкил, циклоалкил-алкил или гетероциклил-алкил,
R9c представляет водород, галоген, нитрил, алкокси, аллилокси, алкиламино или ариламино.
Более предпочтительно, в формуле (3) Bc представляет фенил или пиридин.
Более предпочтительно, в формуле (3) R7c представляет водород, галоген или алкокси и наиболее предпочтительно - водород
Более предпочтительно, в формуле (3) R8c представляет C1-C6-алкил, гетероциклил, циклоалкил-алкил, гетероциклил-алкил или арилалкил и наиболее предпочтительно - циклопентил или тетрагидропиран.
Более предпочтительно, в формуле (3) R9c представляет водород, галоген или алкокси и наиболее предпочтительно - водород.
Иллюстративные соединения формулы (3) включают следующие:
циклопентил-(2-фенил-3H-бензимидазол-4-ил)амин,
(2-фенил-3H-бензимидазол-4-ил)-(тетрагидропиран-4-ил)амин,
циклопентил-(2-пиридин-2-ил-3H-бензимидазол-4-ил)амин.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения заболевания, вызванного окислительным стрессом.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения заболевания, вызванного окислительным стрессом, который опосредован активными формами кислорода (ROS) или активными формами азота (RNS).
Фармацевтическая композиция настоящего изобретения может подавлять ишемическое реперфузионное повреждение.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения заболевания, вызванного гипоксическим повреждением.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения заболевания, вызванного некротической смертью клеток.
Фармацевтическая композиция настоящего изобретения может подавлять митохондриальную дисфункцию.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения синдрома MELAS, вызванного митохондриальной дисфункцией (митохондриальная миопатия, энцефалопатия, лактацидоз и инсультоподобные эпизоды), синдрома MERRF (миоклоническая эпилепсия с рваными мышечными волокнами) или синдрома Кирнса-Сейра, которые все вызываются митохондриальной дисфункцией.
Фармацевтическая композиция настоящего изобретения может подавлять некроз клеток, секретирующих HMGB1 (high-motility group box 1).
Более того, фармацевтическая композиция настоящего изобретения может предотвращать и/или лечить заболевание, опосредованное HMGB1, в частности опосредованное или связанное с воспалением заболевание. Такие заболевания включают сепсис, ревматический артрит, остеоартрит, цирроз печени, геморрагическую болезнь, различные некротические заболевания, вирусную или бактериальную инфекцию и так далее.
Заболевания, которые можно предотвратить и/или лечить, используя настоящее изобретение, включают заболевание печени, заболевание сердца, сосудистое заболевание, дегенеративное заболевание головного мозга, заболевание, вызванное ишемическим реперфузионным повреждением, и инфекционное заболевание, вызванное вирусом или бактериями; состояние при пересадке печени, резекцию печени, эмболизацию печени, фиброз печени, цирроз печени, алкогольную/безалкогольную жировую дистрофию печени и гепатит, вызванный вирусом или лекарственным средством (например, противораковым агентом, ацетаминофеном и так далее); сердечные или сердечно-сосудистые заболевания, такие как аритмия, кардиоплегия, инфаркт миокарда и так далее; дегенеративные заболевания головного мозга, такие как болезнь Лу Герига, инсульт, деменция, болезнь Паркинсона, болезнь Хантингтона и так далее; диабетический комплекс, артериосклероз, инфаркт миокарда или инсульт, каждое из которых вызвано ишемическим реперфузионным повреждением; заболевание, вызванное инфекцией вирусом, таким как вирус гриппа, HBV, HCV, ВИЧ и так далее, или бактериями.
В настоящем изобретении заболевание печени может представлять собой одно или более, выбранное из группы, состоящей из состояния при пересадке печени, резекции печени, эмболизации печени, фиброза печени, цирроза печени, алкогольной/безалкогольной жировой дистрофии печени и гепатита, вызванного вирусом или лекарственным средством (например, противораковым агентом, ацетаминофеном и так далее).
В настоящем изобретении сердечное или сердечно-сосудистое заболевание может представлять собой одно или более, выбранное из группы, состоящей из аритмии, кардиоплегии, инфаркта миокарда, сердечной недостаточности и грудной жабы.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения заболевания печени, сердечного или сердечно-сосудистого заболевания, каждое из которых вызвано ишемическим реперфузионным повреждением, где ишемическое реперфузионное повреждение может возникать в результате митохондриальной дисфункции, гипоксического повреждения и/или некротической смерти клеток.
Фармацевтическая композиция настоящего изобретения может быть эффективно использована для предотвращения и лечения одного или более заболеваний, выбранных из группы, состоящей из диабетического комплекса, артериосклероза и инсульта, каждый из которых вызван ишемическим реперфузионным повреждением.
Конкретные варианты осуществления синтеза соединений формулы (1) или (2) настоящего изобретения раскрыты в WO 2009/025477 и WO 2009/025478 соответственно.
Настоящее изобретение также предоставляет соединения формулы (3) и способы их получения. Здесь далее способы получения соединений формулы (3) будут пояснены на основе иллюстративных реакционных схем, чтобы содействовать пониманию настоящего изобретения. Однако следует понимать, что специалист, имеющий обычную квалификацию в данной области, смог бы получить соединения формулы (3) различными способами, основываясь на структуре формулы (3), и все такие способы входят в объем настоящего изобретения. Другими словами, следует понимать, что соединения формулы (3) могут быть получены любым сочетанием различных способов синтеза, описанных здесь или раскрытых в известном уровне техники, и такое сочетание входит в объем настоящего изобретения. Способы получения соединений формулы (3) не ограничены описанными ниже способами.
Во-первых, соединения формулы (3) могут быть синтезированы восстановлением нитрогруппы соединений формулы (4), что дает аминные соединения формулы (5), и проведением реакции восстановительного аминирования (RA) по образовавшейся аминогруппе с участием соединений формулы (6) согласно способу, показанному на нижеследующей реакционной смехе 1.
Реакционная схема 1

где
Bc, R7c, R8c и R9c являются такими, как определено в формуле (3);
R10c представляет алкил, циклоалкил, гетероциклил, гетероарил или арил;
R11c представляет водород или алкил; или
R10c и R11c могут замыкаться в цикл с образованием циклоалкила или гетероцикла.
Соединения формулы (5) могут быть получены восстановлением соединений формулы (4). Реакции восстановления могут быть проведены с использованием кислых катализаторов и металлов или с использованием металлических катализаторов в присутствии газообразного водорода.
Примеры кислоты, которая может быть использована в реакции восстановления, которая включает применение кислых катализаторов и металлов, включают неорганическую кислоту, такую как хлористоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическую карбоновую кислоту, такую как уксусная кислота и трифторуксусная кислота; и соль амина и кислоты, такую как хлорид аммония. Предпочтительными кислотами являются хлористоводородная кислота, уксусная кислота, хлорид аммония и так далее. Количество кислот, подлежащих использованию, составляет типично от 0,01 до 10 эквивалентов и предпочтительно от 0,1 до 5 эквивалентов на 1 эквивалент соединений формулы (4). Примеры металла, который может быть использован, включают железо, цинк, литий, натрий и олово (обычно хлорид олова). Предпочтительными металлами являются железо, цинк, хлорид олова и так далее. Количество металлов, подлежащих использованию, составляет типично от 1 до 20 эквивалентов и предпочтительно от 1 до 10 эквивалентов на 1 эквивалент соединений формулы (4). Реакции с металлами в присутствии кислых катализаторов могут быть проведены в инертном растворителе. Примеры инертного растворителя включают алкиловый спирт, такой как метанол и этанол; простой эфир, такой как тетрагидрофуран и диэтиловый эфир; и алкиловый сложный эфир, такой как этилацетат. Предпочтительными растворителями являются метанол, этанол, тетрагидрофуран и этилацетат и так далее. Температура реакции составляет типично от -10 до 200°C и предпочтительно от 25 до 120°C. Время реакции составляет типично от 10 мин до 60 часов и предпочтительно от 10 мин до 12 часов.
Примеры металлического катализатора, который может быть использован в реакции восстановления, которая включает применение металлических катализаторов в присутствии газообразного водорода, включают палладий, никель, платину, рутений, родий и тому подобное. Предпочтительными металлическими катализаторами являются палладий, никель и так далее. Количество металлического катализатора, подлежащего использованию, составляет типично от 0,001 до 2 эквивалентов и предпочтительно от 0,01 до 1 эквивалента на 1 эквивалент соединений формулы (2). Давление газообразного водорода составляет типично от 1 до 10 атм и предпочтительно от 1 до 3 атм. Реакции могут быть проведены в инертном растворителе, например, в алкиловом спирте, таком как метанол и этанол; простом эфире, таком как тетрагидрофуран и диэтиловый эфир; и алкилацетате, таком как метилацетат и этилацетат. Предпочтительными растворителями являются метанол, этанол, этилацетат и так далее. В реакции восстановления, которая включает применение металлических катализаторов, температура реакции составляет типично от -10 до 200°C и предпочтительно от 25 до 50°C. Время реакции составляет типично от 10 мин до 60 часов и предпочтительно от 10 мин до 12 часов.
Соединения формулы (6) коммерчески доступны и могут быть использованы в реакции восстановительного аминирования по аминогруппе соединений формулы (5).
Реакция восстановительного аминирования может быть проведена посредством реакции альдегида или кетона с восстановителем и кислым катализатором, если необходимо. Количество альдегида или кетона, подлежащего использованию, составляет типично от 1 до 10 эквивалентов и предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединения формулы (5). Примеры восстановителя, который может быть использован, включают боргидрид натрия, цианоборгидрид натрия (NaBH3CN) и триацетоксиборгидрид натрия (NaBH(OAc)3). Количество восстановителя, подлежащего использованию, составляет типично от 1 до 10 эквивалентов и предпочтительно от 1 до 3 эквивалентов на 1 эквивалент соединений формулы (5). Примеры кислого катализатора, который может быть использован, включают неорганическую кислоту, такую как хлористоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическую карбоновую кислоту, такую как уксусная кислота и трифторуксусная кислота; и соль амина и кислоты, такую как хлорид аммония. Предпочтительными кислотами являются хлористоводородная кислота, уксусная кислота и так далее. Количество кислот, подлежащих использованию, составляет типично от 0,1 до 10 эквивалентов и предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединений формулы (5). Реакции могут быть проведены в инертном растворителе, например в простом эфире, таком как тетрагидрофуран и диэтиловый эфир; и хлоралкане, таком как дихлорметан, хлороформ и дихлорэтан, и предпочтительно в дихлорэтане, хлороформе и так далее. Температура реакции составляет типично от -10 до 100°C и предпочтительно от -10 до 50°C. Время реакции составляет типично от 10 мин до 60 часов и предпочтительно от 10 мин до 12 часов.
Соединения формулы (4) могут быть получены реакцией сочетания и реакцией циклизации альдегидных соединений формулы (7) с соединениями формулы (8), как показано на нижеследующей реакционной схеме 2.
Реакционная схема 2
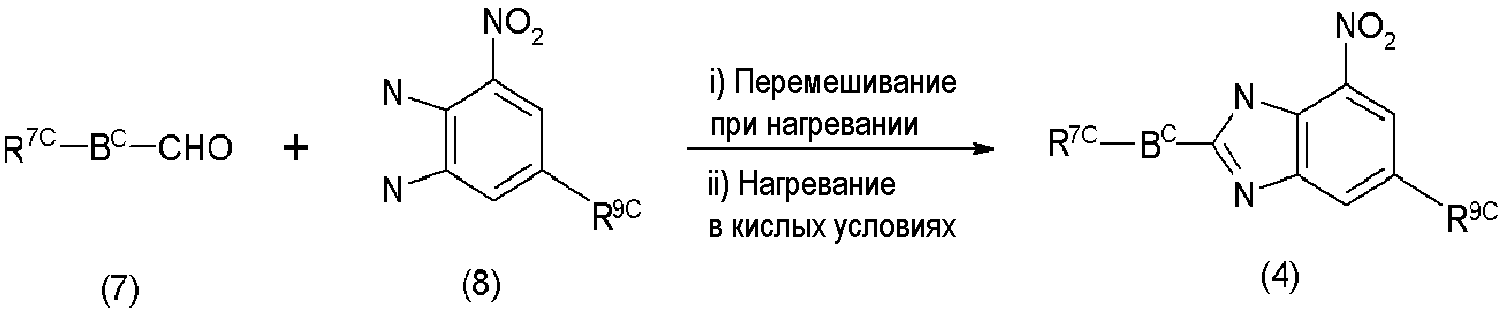
где Bc, R7c и R9c являются такими, как определено в формуле (3).
Во-первых, коммерчески доступные альдегиды, такие как соединения формулы (7), и коммерчески доступные диаминные соединения, такие как соединения формулы (8), нагревают при перемешивании, что приводит к циклизации. Затем, нагревание в присутствии кислых катализаторов могло бы дать соединения формулы (4). Примеры кислого катализатора, который может быть использован, включают неорганическую кислоту, такую как хлористоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическую карбоновую кислоту, такую как уксусная кислота и трифторуксусная кислота; и соль амина и кислоты, такую как хлорид аммония. Предпочтительными кислыми катализаторами являются хлористоводородная кислота, уксусная кислота и так далее. Количество кислот, подлежащих использованию, составляет типично от 0,1 до 10 эквивалентов и предпочтительно от 1 до 5 эквивалентов на 1 эквивалент соединений формулы (5). В зависимости от случая реакции могут быть проведены с использованием органических кислот, таких как уксусная кислота, в качестве растворителя.
В настоящем описании “фармацевтически приемлемая соль” включает нетоксическую кислотно-аддитивную соль, содержащую фармацевтически приемлемый анион, например соль с неорганическими кислотами, такими как серная кислота, хлористоводородная кислота, азотная кислота, фосфорная кислота, бромистоводородная кислота, йодистоводородная кислота и так далее; соль с органическими карбоновыми кислотами, такими как винная кислота, муравьиная кислота, лимонная кислота, уксусная кислота, трихлоруксусная кислота, трифторуксусная кислота, глюконовая кислота, бензойная кислота, молочная кислота, фумаровая кислота, малеиновая кислота, салициловая кислота и так далее; или соль с сульфоновыми кислотами, такими как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, нафталинсульфоновая кислота и так далее. Соединения формулы (1) могут также образовывать фармацевтически приемлемую основно-аддитивную соль, например соль с щелочными металлами или щелочноземельными металлами, такими как литий, натрий, калий, кальций, магний и так далее; соль с аминокислотами, такими как лизин, аргинин, гуанидин и так далее; или органическую соль с дициклогексиламином, N-метил-D-глюкамином, трис(гидроксиметил)метиламином, диэтаноламином, холином, триэтиламином и так далее. Соединения формул (1), (2) и (3) настоящего изобретения могут быть превращены в свои соли согласно любому из общепринятых способов, и формирование солей может быть с легкостью проведено специалистом в данной области на основе структурных формул (1), (2) и (3) без дополнительных пояснений в этом отношении.
Термин “изомер” в настоящем описании означает соединения, имеющие ту же химическую или молекулярную формулу, что и соединения формулы (1) или их соли, но оптически или стерически отличающиеся от них. Соединения формул (1), (2) и (3) настоящего изобретения могут иметь асимметрический(е) углеродный(е) центр(ы) в структуре и, таким образом, могут существовать в форме оптического изомера (R- или S-изомера), рацемата, смеси диастереомеров или индивидуального диастереомера и так далее. Если соединения имеют двойную связь, они могут существовать в форме геометрического изомера (транс- или цис-изомер). Все изомеры и их смеси также покрываются настоящим изобретением.
Здесь далее соединения формул (1), (2) и (3) включают фармацевтически приемлемые соли и их изомеры, если не пояснено иное. Соли и изомеры следует рассматривать как покрываемые настоящим изобретением. Для удобства, в настоящем описании они кратко обозначаются как соединения формулы (1).
Вышеупомянутая “фармацевтическая композиция” может включать фармацевтически приемлемые носители, разбавители, эксципиенты или их сочетания, если необходимо, вместе с соединениями настоящего изобретения. Фармацевтическая композиция облегчает введение соединения живому организму. Существует ряд методик введения соединения, и они включают следующие, но не ограничены ими: пероральное, инъекционное, аэрозольное, парентеральное и местное введение.
Использованный здесь “носитель” означает вещество, которое облегчает вхождение соединения в клетки или ткани. Например, диметилсульфоксид (ДМСО) представляет собой типичный носитель, который применяется, чтобы облегчить введение различных органических соединений в клетки или ткани живых организмов.
Использованный здесь “разбавитель” определен как вещество, которое растворено в воде, которая растворяет соединение, а также стабилизирует биологически активную форму соединения указанного соединения. Соли, растворенные в буферном растворе, используются в данной области в качестве разбавителей. Типично применяемым буферным раствором является забуференный фосфатом солевой раствор, который имитирует солевой состав солевого раствора человеческого организма. Буферные разбавители редко меняют биологическую активность соединения, поскольку буферные соли могут контролировать pH раствора в низкой концентрации.
Использованный здесь “фармацевтически приемлемый” означает свойство не ухудшать биологическую активность и физические свойства соединения.
Из соединений настоящего изобретения могут быть составлены рецептуры в виде различных фармацевтических дозировочных форм в соответствии с желаемой целью. Для получения фармацевтической композиции настоящего изобретения активный ингредиент, в частности соединения формулы (1), (2) или (3), их фармацевтически приемлемые соли или изомеры, смешивают вместе с различными фармацевтически приемлемыми носителями, которые могут быть выбраны в соответствии с подлежащей получению рецептурой. Например, фармацевтической композиции настоящего изобретения может быть придана форма инъецируемого препарата, препарата для перорального введения и так далее, согласно желаемой цели.
Из соединений настоящего изобретения могут быть составлены рецептуры способами, известными в данной области, которые используют фармацевтические носители и эксципиенты, известные в данной области, и могут быть заключены в контейнеры единичной дозировочной формы или мультидозировочной формы. Форма препарата может представлять собой растворы, суспензии или эмульсии в масляных или водных средах, и они типично содержат диспергирующие агенты, суспендирующие агенты или стабилизаторы. Дополнительно, например, препарат может иметь форму сухого порошка, который предназначен для переведения в исходное состояние перед использованием путем растворения в стерильной, апирогенной воде. Из соединений настоящего изобретения также могут быть составлены рецептуры в виде суппозиторных форм, используя типичную основу для суппозиториев, такую как масло какао или другие глицериды. Могут быть получены твердые дозировочные формы для перорального введения, капсулы, таблетки, пилюли, порошки и гранулы, и капсулы и таблетки являются особенно подходящими. Предпочтительно, таблетки и пилюли получают в виде форм с энтеросолюбильным покрытием. Твердые дозировочные формы могут быть получены смешением соединений настоящего изобретения вместе с носителями, такими как один или более инертных разбавителей, таких как сахароза, лактоза, крахмал и так далее, смазывающими веществами, такими как стеарат магния, дезинтеграторами, связующими и так далее.
Настоящее изобретение также предоставляет косметическую композицию, обладающую антиоксидантным эффектом, включающую соединение вышеуказанной формулы (1), (2) или (3), его фармацевтически приемлемую соль или изомер, в качестве активного ингредиента; и приемлемый носитель.
Обеспечивающие преимущество эффекты изобретения
Фармацевтическая композиция настоящего изобретения имеет превосходную антиоксидантную активность и, таким образом, может эффективно предотвращать или лечить различные заболевания, связанные с окислительным стрессом.
Кроме того, фармацевтическая композиция настоящего изобретения может эффективно предотвращать или лечить сердечные или сердечно-сосудистые заболевания подавлением дисфункции митохондрий в клетках сердечной мышцы, гипоксического повреждения, некроза и ишемического реперфузионного повреждения. Кроме того, она может быть использована в качестве агента для защиты сердца при реперфузионном лечении, таком как оперативная терапия, включающая обходные шунты коронарной артерии или чрескожную транслюминальную коронарную ангиопластику, и лекарственную терапию с использованием агентов тромболизиса или тому подобное.
Краткое описание чертежей
На фиг.1 представлена фотография, показывающая антиоксидантный эффект (тетрагидропиран-4-ил)-[2-фенил-5-(1,1-диоксотиоморфолин-4-ил)метил-1H-индол-7-ил]амина (соединение 9) в клетках, при использовании зонда DHR123.
На фиг.2 представлена фотография, показывающая антиоксидантный эффект соединения 9 в клетках, при использовании зонда MitoSOX red.
На фиг.3 представлена фотография, на которой сопоставлены результаты из группы, получавшей лечение соединением 9, с результатами группы, не получавшей лечение.
На фиг.4 представлена диаграмма, показывающая значения ALT и AST после ишемического реперфузионного повреждения при лечении и без лечения соединением 9.
На фиг.5 представлена фотография, показывающая сравнение окрашивания ткани между группой, в которой введено 13 мг/кг соединения 9, и группой, в которой соединение 9 не введено (IR: ишемическое реперфузионное повреждение).
На фиг.6 представлена диаграмма, показывающая сравнение результатов в группе, получавшей лечение соединением 9, и в группе, не получавшей лечение, на основе микроскопического наблюдения (дегенерация гепатоцитов, синусоидальная конгестия, воспалительная клеточная инфильтрация).
На фиг.7 представлена диаграмма, показывающая сравнение уровня MGB1 между группой, в которой введено 13 мг/кг соединения 9, и контрольной группой с ишемическим реперфузионным повреждением.
На фиг.8 представлена диаграмма, показывающая сравнение активности митохондриального комплекса I после ишемического реперфузионного повреждения между группой, получавшей лечение соединением 9, и группой, не получавшей лечения.
На фиг.9 представлена диаграмма, показывающая высвобождение HMGB1 после лечения соединением 9.
На фиг.10 представлена диаграмма, показывающая изменение содержания АТФ, вызванного соединением 9, после лечения соединением 9.
На фиг.11 представлена фотография, полученная на флуоресцентном микроскопе, клеток H9C2 после двойного окрашивания FDI и PI, иллюстрирующая защитный эффект соединения 9 против некротической смерти клеток.
На фиг.12 представлена диаграмма, показывающая прямой подсчет клеток для иллюстрации защитного эффекта соединения 9 против некротической смерти клеток.
На фиг.13 представлена диаграмма, показывающая результаты анализа FACS, иллюстрирующего защитный эффект соединения 9 против некротической смерти клеток.
На фиг.14 представлена диаграмма, показывающая ингибиторный эффект соединения 9 в отношении набухания митохондрий.
На фиг.15 представлена фотография, полученная на флуоресцентном микроскопе, показывающая митохондриальный защитный эффект соединения 9.
На фиг.16 представлена диаграмма, показывающая ингибиторный эффект соединения 9 в отношении набухания левого желудочка в модели ишемического реперфузионного повреждения.
На фиг.17 представлена диаграмма, показывающая ингибиторный эффект соединения 9 в отношении фракции укорочения левого желудочка после ишемического реперфузионного повреждения.
На фиг.18 представлено изображение, показывающее фиброз сердца при окрашивании по методу, использующему MT (Masson-Trichrome), для сравнения соединения 9 с циклоспорином A.
На фиг.19 представлена фотография, показывающая ход проведения операции на печени экспериментального примера 2.
Варианты осуществления изобретения
Здесь далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры, но объем настоящего изобретения не должен истолковываться как ограниченный ими каким-либо образом.
Пример 1: Получение циклопентил-(2-фенил-3H-бензоимидазол-4-ил)амина
Стадия A: 4-нитро-2-фенил-2,3-дигидро-1H-бензоимидазол
К раствору 3-нитро-бензол-1,2-диамина (1,0 г, 6,5 ммоль) в метаноле (10 мл) добавляли бензальдегид (0,69 г, 6,7 ммоль) и перемешивали при 80°C в течение 2 дней. После завершения реакции растворитель удаляли в вакууме и остаток очищали колоночной хроматографией с получением названного соединения в количестве 1,1 г (выход 70%).
1H-ЯМР (500 МГц, ДМСО): δ 8,68 (с, 1H), 7,43-7,31 (м, 5H), 7,18 (с, 1H), 6,95 (д, 1H), 6,44 (с, 1H), 6,36 (т, 1H), 6,29 (д, 1H).
Стадия B: 7-нитро-2-фенил-1H-бензоимидазол
4-нитро-2-фенил-2,3-дигидро-1H-бензоимидазол (1,1 г, 4,6 ммоль), полученный на стадии A, растворяли в уксусной кислоте (10 мл) и перемешивали при 80°C в течение 3 часов. После завершения реакции добавляли воду, экстрагировали этилацетатом и промывали 1 н гидроксидом натрия. После сушки безводным сульфатом магния фильтрат отгоняли в вакууме и остаток очищали колоночной хроматографией с получением названного соединения в количестве 0,91 г (83%).
1H-ЯМР (400 МГц, ДМСО): δ 13,3 (уш. с, 1H), 8,37 (д, 2H), 8,15 (д, 2H), 7,65-7,56 (м, 3H), 7,46 (т, 1H).
Стадия C: 2-фенил-3H-бензоимидазол-4-иламин
7-нитро-2-фенил-1H-бензоимидазол (0,137 г, 0,57 ммоль), полученный на стадии B, растворяли в тетрагидрофуране (5 мл), метаноле (5 мл) и воде (5 мл). К этому раствору добавляли порошок железа (0,40 г, 7,2 ммоль) и хлорид аммония (0,39 г, 7,2 ммоль) и перемешивали при 60°C в течение 1 часа. После завершения реакции добавляли воду и экстрагировали этилацетатом. После сушки безводным сульфатом магния фильтрат отгоняли в вакууме и остаток очищали колоночной хроматографией с получением названного соединения в количестве 0,12 г (выход 79%).
1H-ЯМР (500 МГц, ДМСО): δ 12,5 (с, 1H), 8,10 (д, 2H), 7,55-7,45 (м, 3H), 6,87 (т, 1H), 6,67 (д, 1H), 6,32 (д, 1H), 5,21 (с, 1H).
Стадия D: Циклопентил-(2-фенил-3H-бензоимидазол-4-ил)-амин
2-фенил-3H-бензоимидазол-4-иламин (0,040 г, 0,19 ммоль), полученный на стадии C, растворяли в дихлорэтане (5 мл). К раствору добавляли уксусную кислоту (0,012 г, 0,19 ммоль), циклопентанон (0,048 г, 0,57 ммоль) и триацетоксиборгидрид натрия (0,049 г, 0,23 ммоль) и перемешивали при комнатной температуре в течение 18 часов. После завершения реакции добавляли воду, экстрагировали дихлорметаном и промывали насыщенным раствором хлорида натрия. После сушки безводным сульфатом магния фильтрат отгоняли в вакууме и остаток очищали колоночной хроматографией с получением названного соединения в количестве 0,026 г (выход 49%).
1H-ЯМР (40 МГц, CDCl3): δ 9,36 (уш. с, 1H), 8,02 (м, 2H), 7,56-7,45 (м, 3H), 7,17 (т, 1H), 6,83 (д, 1H), 6,47 (д, 1H), 5,06 (уш. с, 1H), 4,02 (м, 1H), 2,13 (м, 2H), 1,82 (м, 2H), 1,69 (м, 4H).
Пример 2: Получение (2-фенил-3H-бензимидазол-4-ил)-(тетрагидрофуран-4-ил)амина
Используя 2-фенил-3H-бензоимидазол-4-иламин (0,040 г, 0,19 ммоль), полученный на стадии C примера 1, и тетрагидрофуран-4-карбальдегид (0,026 г, 0,23 ммоль), названное соединение в количестве 0,030 г (выход 51%) получали следуя тому же способу, который описан на стадии D примера 1.
1H-ЯМР (40 МГц, CDCl3): 8,02 (м, 2H), 7,56-7,45 (м, 3H), 7,17 (т, 1H), 6,85 (д, 1H), 6,44 (д, 1H), 4,05 (дд, 1H), 3,45 (тд, 2H), 3,27 (д, 2H), 2,02 (м, 1H), 1,85 (м, 2H), 1,45 (м, 2H).
Пример 3: Циклопентил-(2-фенил-2-ил-3H-бензоимидазол-4-ил)амин
Используя 2-карбоксиальдегид-3-нитробензол-1,2-диамин и циклопентанон, названное соединение получали следуя тому же способу, который описан в примере 1.
1H-ЯМР (40 МГц, CDCl3): 1,64 (м, 6H), 2,10 (м, 2H), 4,14 (с, 1H), 6,38-6,34 (д, 1H), 6,69-6,71 (д, 1H), 7,09-7,13 (т, 1H), 7,25-7,26 (м, 1H), 7,75-7,79 (м, 1H), 8,40-8,41 (д, 1H), 8,54-8,55 (м, 1H).
Эффект настоящего изобретения конкретно иллюстрируется экспериментальными примерами, приведенными ниже. В экспериментальных примерах использованы следующие соединения:
Соединение 1:
[(S)-2-(7-циклопентиламино-5-метил-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]уксусная кислота
Соединение 2:
{(S)-2-[5-метил-7-(тетрагидропиран-4-иламино)-1H-индол-2-ил]-4,5-дигидротиазол-4-ил}уксусная кислота
Соединение 3:
[(S)-2-(7-циклопентиламино-5-метил-1H-индол-2-ил)-4,5-дигидрооксазол-4-ил]уксусная кислота
Соединение 4:
[(S)-2-(7-циклопентиламино-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]уксусная кислота
Соединение 5:
[(S)-2-(7-циклопентиламино-5-фенокси-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]уксусная кислота
Соединение 6:
4-{2-[(S)-2-(7-циклопентиламино-5-фенокси-1H-индол-2-ил)-4,5-дигидротиазол-4-ил]этил}пиперазин-2-он
Соединение 7:
циклопентил-(2-{(S)-4-[2-(3-метил-5,6-дигидро-8H-[1,2,4]триазоло[4,3-a]пиразин-7-ил)этил]-4,5-дигидротиазол-4-ил}-5-фенокси-1H-индол-7-ил)амин
Соединение 8:
((S)-2-{7-[(тетрагидропиран-4-илметил)амино]-1H-индол-2-ил}-4,5-дигидротиазол-4-ил)уксусная кислота
Соединение 9:
(тетрагидропиран-4-ил)-[2-фенил-5-(1,1-диоксотиоморфолин-4-ил)метил-1H-индол-7-ил]амин
Соединение 10:
[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-ил]-(тетрагидропиран-4-ил)метиламин
Соединение 11:
[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-ил]-бис-[(тетрагидропиран-4-ил)метил]амин
Соединение 12:
{4-[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-иламино]пиперидин-1-ил}-(тетрагидропиран-3-ил)метанон
Соединение 13:
[5-(1,1-диоксотиоморфолин-4-ил)метил-2-фенил-1H-индол-7-ил]-(1-метилсульфонилпиперидин-4-ил)амин
Соединение 14:
((S)-2-{5-метил-7-[(тетрагидропиран-4-илметил)амино]-1H-индол-2-ил}-4,5-дигидротиазол-4-ил)уксусная кислота
Пример 1: циклопентил-(2-фенил-3H-бензимидазол-4-ил)амин
Пример 2: (2-фенил-3H-бензимидазол-4-ил)-(тетрагидропиран-4-ил)амин
Экспериментальный пример 1: Антиоксидантные эффекты ингибиторов некроза
Для измерения антиоксидантного эффекта каждого соединения были проведены следующие эксперименты: измерение общего антиоксидантного эффекта DPPH-методом, измерение антиоксидантного эффекта методом, использующим дигидрородамин 123, измерение ингибирования некроза методом, использующим tBOOH, который вызывает окислительный стресс клеток, измерение методом, определяющим способность удалять ONOO- (пероксинитрит), и измерение методом, определяющим прямые антиоксидантные эффекты в отношении H2O2 (пероксид водорода) и tBOOH.
Экспериментальный пример 1-1: Измерение антиоксидантного эффекта с использованием DPPH
DPPH (1,1-дифенил-2-пикрилгидразил) представляет собой стабильный свободный радикал и имеет пурпурный цвет. Антиоксидантный эффект соединения измеряли используя принцип, согласно которому цвет DPPH изменяется на желтый, когда DPPH восстанавливается соединением. DPPH показывает сильное поглощение при 517 нм, а когда DPPH восстановлен, цвет меняется на желтый и поглощение при 517 нм уменьшается. Здесь термин “IC50” относится к концентрации соединения, которая уменьшает поглощение при 517 нм до 50% начального значения.
180 мкл раствора DPPH (200 мкМ в ДМСО) распределяли в каждую лунку 96-луночного планшета и добавляли в нее 20 мкл соединений, которые последовательно разбавляли вдвое, исходя из 2000 мкМ. Затем их хорошо смешивали и выдерживали при комнатной температуре в течение 30 минут. Спустя 30 минут измеряли величину оптической плотности (O.D.) при 517 нм, используя ELISA-ридер SpectraMAX. Результаты представлены в нижеследующей таблице 1.
Экспериментальный пример 1-2: Измерение антиоксидантного эффекта с использованием дигидрородамина 123
Дигидрородамин 123 сам не является флуоресцентным, но превращается во флуоресцентный родамин 123, когда он окисляется ROS (активными формами кислорода) или RNS (активными формами азота). Антиоксидантные эффекты в клетках или in vitro измеряли используя такое свойство. Клетки H9C2 распределяли в каждую лунку 96-луночного планшета (1,5×104 клеток/100 мкл/лунка). На следующий день клетки предварительно обрабатывали каждым соединением, которое последовательно разбавляли втрое, исходя из наибольшей концентрации, в течение 1 часа и затем обрабатывали 10 мкл основного раствора DHR123 с концентрацией 12,5 мкМ (окончательная концентрация 1,25 мкМ) в инкубаторе при 37°C в течение 30 минут. Затем клетки немедленно обрабатывали 400 мкМ tBOOH и инкубировали в течение 2 часов. Затем измеряли флуоресценцию, которую возбуждалась при 480 нм и испускалась при 538 нм, используя ридер для микропланшетов SpectraMAX Gemini. Здесь термин “IC25” относится к концентрации соединения, которая вызывает ингибирование на 25% значения, где флуоресценцию по прошествии 2 ч после обработки tBOOH, которая испускалась за счет окисления DHR123 вследствие усиления окислительного стресса, принимали за 100%. Результаты представлены в таблице 2. Кроме того, чтобы проверить, действительно ли соединения оказывают антиоксидантный эффект на клетки, после вышеописанного анализа клетки в 96-луночном планшете фиксировали 4% формальдегидом и промывали три раза PBS. Затем 100 мкл PBS добавляли в каждую лунку 96-луночного планшета и измеряли флуоресценцию каждой клетки иммунофлуоресцентной микроскопией (флуоресцентный микроскоп Olympus). (Поскольку DHR123 находится в клетках, флуоресценция испускается пропорционально окислению). Результаты представлены на фиг.1. Кроме того, ингибирование генерации супероксида измеряли с помощью зонда MitoSOX red (конечная концентрация 5 мкМ) тем же методом.
Экспериментальный пример 1-3: Эффект защиты клеток от окислительного стресса, индуцированного tBOOH
Известно, что трет-бутилгидропероксид (tBOOH) индуцирует некроз клеток, вызывая окислительный стресс в различных клетках. Таким образом, ингибирование некроза клеток за счет антиоксидантного эффекта измеряли обработкой tBOOH клеток H9C2. Клетки H9C2 распределяли каждую лунку 96-луночного планшета (1,5×104 клеток/100 мкл/лунка). На следующий день клетки предварительно обрабатывали каждым соединением и затем обрабатывали tBOOH (конечная концентрация 400 мкМ) в течение 2 часов. В каждую лунку добавляли 50 мкл формальдегида, чтобы фиксировать клетки. Клетки фиксировали в течение 30 минут и промывали дистиллированной водой три раза. Затем планшет полностью высушивали в сушильном шкафу при 50°C и добавляли раствор SRB в лунки, чтобы окрасить оставшийся белок. Планшет промывали 1% уксусной кислотой и сушили. Затем 100 мкл раствора Tris (10 мМ) добавляли в лунки планшета для повторного растворения красителя и рассчитывали IC50 путем измерения оптической плотности (O.D.) при 590 нм и 650 нм с помощью ELISA-ридера SpectraMAX. Здесь термин ″IC50″ относится к концентрации соединения, которая защищает 50% клеток от некроза, индуцированного обработкой tBOOH. Результаты представлены в нижеследующей таблице 3.

Экспериментальный пример 1-4: Измерение способности удалять ONOO- (пероксинитрит) с использованием дигидрородамина 123
ONOO- (пероксинитрит), который известен как вид RNS, играет весьма важную роль в окислительном стрессе. Таким образом, весьма важным представляется оценивание способности ингибиторов некроза удалять ONOO-. Хорошо известно, что зонд DHR123 окисляется ONOO-. Таким образом, используя такое свойство, измеряли данную способность каждого соединения.
10 мкл каждого соединения, которое последовательно разводили 3-кратно, исходя из 50 мкМ, распределяли в каждую лунку 96-луночного планшета и затем в каждую лунку добавляли 170 мкл смеси для проведения анализа (10 мкМ DHR123, 1×PBS, 100 мкМ DPTA без ONOO-). В конце добавляли 20 мкл раствора ONOO- (конечная концентрация 1 мкМ), чтобы инициировать реакцию. Здесь термин “IC50” относится к концентрации соединения, которая вызывает 50% ингибирование окисления DHR123 под действием ONOO-.
Результаты исследования зависимости “структура-активность” (SAR) касательно способности соединений удалять ONOO- представлены в таблице 4.
Экспериментальный пример 1-5: Прямой антиоксидантный эффект в отношении H2O2 и tBOOH
Чтобы определить антиоксидантные эффекты ингибиторов некроза, имеющих индольную структуру, оценивали прямые антиоксидантные эффекты в отношении особых ROS, H2O2 (пероксида водорода) и tBOOH.
Добавляли 10 мкл зонда DHR123 (конечная концентрация 1,25 мкМ) к 10 мкл каждого соединения, которое разводили 100 мкл полной среды DMEM. Добавляли H2O2 и tBOOH в концентрации, показанной в нижеследующей таблице 5, и спустя 2 ч измеряли флуоресценцию при длинах волн (480 нм (возбуждение)/538 нм (испускание)) с помощью SpectraMAX Gemini. Здесь термин “IC25” относится к концентрации соединения, которая вызывает уменьшение на 25% флуоресценции в предположении, что количество, испущенное вследствие окисления DHR123, вызванного H2O2 или tBOOH, составляло за 100%.
Экспериментальный пример 2: Защитный эффект соединения 9 против повреждения печени вследствие ишемии/реперфузии у собак породы бигль
Дизайн исследования: Для исследования отбирали 27 здоровых собак породы бигль (масса тела 8,5-11,5 кг). Исследование проводили после получения разрешения от комиссии по этике Asan Hospital Ethics Commission. Чтобы минимизировать накопление гликогена в печени, собаки голодали в течение 24 часов перед операцией; и у них удаляли шерсть. Собак рандомизированно делили на контрольную группу (n=9), группу B (n=6), группу C (n=6) и группу D (n=6). Проводили эндотрахеальную интубацию и анестезировали собак золетилом и 2,5% энфлурана. Цефазолин и кеторолак использовали, соответственно, в качестве антибиотика и анальгетика согласно процедуре, утвержденной комиссией.
Проведение операции: Собак укладывали на операционный стол с теплыми одеялами и бутылками с теплой водой по обеим сторонам. Левую наружную яремную вену и правую большую подкожную вену ноги канюлировали IV катетером 21 калибра через открытый подход. Правую внутреннюю сонную артерию рассекали и канюлировали, так что в ходе операции можно было наблюдать за гемодинамикой. После получения полного внутривенного доступа анестезию поддерживали ингаляцией 2,5% энфлурана. Кристаллоидный раствор вводили со скоростью инфузии 15 мл/кг/ч.
За 20 минут до проведения окклюзии сосудов левой доли печени вводят 13 мг/кг, 4,5 мг/кг и 1,5 мг/кг лекарственного средства, соответственно, группам B, C и D через IV. Сочетанное введение доз и инфузия проводились таким образом, что Cmax 12,5 мг/мл (при 20 мин) соответствовала стационарной концентрации Css 5 мг/мл. В ходе операций кровяное давление, частоту ударов сердца, частоту дыхания и насыщение артериальной крови кислородом отслеживали каждые 15 минут для всех собак. Операции проводили путем обратного Т-образного разреза. Печеночно-дуоденальную связку изолировали после разделения малого сальника. Желчный пузырь и 4-ю долю печени фиксировали и вышележащие структуры осторожно осматривали наряду с корневыми структурами. На фиг.19a показаны левые и правые доли печени, которые разделяли вдоль линии Кантли На фиг.19b показаны обычные корневые структуры. У людей правая ножка образует 60-70% общего печеночного объема. Окклюзию печеночных сосудов проводили в течение 90 минут, чтобы вызывать ишемическое повреждение, и зажим отделяли, чтобы вызвать реперфузионное повреждение в течение 60 минут (фиг.19c). Следовательно, данная модель представляет собой систему, использующую 90-минутное ишемическое повреждение и 60-минутное реперфузионное повреждение. После операции брюшную полость и кожу закрывали.
Забор образцов крови и биопсия: Забор образцов крови и биопсию проводили в заданные интервалы, включая полный подсчет форменных элементов крови (FBE; гемоглобин Hb, лейкоцитарная формула WCC, гематокрит HCT, тромбоциты Plt, MCR, среднее содержание гемоглобина MCH и средняя концентрация гемоглобина в эритроците MCHC), функциональные пробы печени (LFT; AST, ALT, LDH и общий билирубин), определение мочевины и электролитов (U&E; BUN и креатин), биопсию печени (гистопатология и H&E-окрашивание) и измерение HMGB1. Световую микрофотографию и электронную микрофотографию использовали для исследования формы клеток печени. Собак породы бигль содержали после операции в теплой и чистой среде с введением анальгетиков постоянного действия и обеспечением мягкой и высокобелковой диеты. Спустя 48 часов их умерщвляли согласно процедуре. Результаты показаны на фиг.3, 4 и 5.
Гистологический анализ после IR-повреждения: Биопсийные образцы печени фиксировали и дегидратировали и затем заливали в парафин. Парафиновые блоки нарезали с толщиной 4 мкм, окрашивали по методу Майера гематоксилином-эозином и исследовали в световом микроскопе. Каждый образец распределяли случайным образом и анализировали слепым способом. Исследовали дегенерацию и некроз гепатоцитных клеток, синусоидальный и портальный венозный застой и воспалительную клеточную инфильтрацию. Результаты гистологического анализа количественно ранжировали согласно опубликованному методу (Hafez T at al., Journal of Surgical Research 2007; 138: 88-99): 0 (0%, нет), 1 (1-25%, слабо), 2 (26-50%, умеренно) или 3 (51-100%, выраженно). Результаты показаны на фиг.6.
Измерение HMGB1: HMGB1 измеряли согласно протоколу производителя, используя набор для проведения ELISA-анализа на HMGB1. Результаты показаны на фиг.7.
Измерение активности митохондриального комплекса I: Ткани печени промывали 2 раза охлажденным льдом Буфером A (320 мМ сахарозы, 1 мМ ЭДТА, 10 мМ Tris (pH 7,5)). Их нарезали на маленькие куски и гомогенизировали, используя 4 мл AT-буфера (75 мМ сахарозы, 225 мМ маннита, 1 мМ ЭГТА и 0,01% BSA, pH 7,4) на 1 г кусков, в стеклянно-тефлоновом гомогенизаторе. Гомогенат центрифугировали при 4°C в течение 5 минут при 1000 g и образовавшийся супернатант центрифугировали два раза при 13000 g. Обогащенную митохондриями массу использовали для измерения активности митохондриального комплекса I. Активность комплекса I (NADH: CoQ-оксидоредуктаза) измеряли мониторингом ротенон-чувствительного восстановления NADH в присутствии децилубихинона при 340 нм. Результаты показаны на фиг.8.
Экспериментальный пример 3: Профилактический эффект в отношении высвобождения HMGB1 соединения 9 после обработки tBOOH
Хорошо известно, что HMGB1 высвобождается, когда происходит некроз клетки. Таким образом, после обработки 400 мкМ tBOOH, который вызывает окислительный стресс, тестировали профилактический эффект соединения 9 в отношении высвобождения HMGB1.
Клетки H9C2 распределяли в количестве 1,5×104 клеток/100 мкл/лунка. На следующий день проводили обработку соединением 9 в концентрации 10 мкМ в течение 30 минут. После обработки tBOOH (конечная концентрация 400 мкМ) измеряли уровень HMGB1 из 50 мкл супернатанта в течение часа ELISA-анализом на HMGB1. Результаты показаны на фиг.9.
Экспериментальный пример 4: Наблюдение изменения общего содержания АТФ после обработки tBOOH
Клетки показывают уменьшение содержания АТФ в процессе некроза. Поддержание количества АТФ весьма важно для выживания клеток. Таким образом, после обработки tBOOH наблюдали изменение содержания АТФ.
Клетки H9C2 распределяли в количестве 1,5×104 клеток/100 мкл/лунка. На следующий день проводили обработку соединением 9 в концентрации 10 мкМ в течение 30 минут. После обработки tBOOH (конечная концентрация 400 мкМ) измеряли количество АТФ, оставшейся в клетках, с помощью набора для мониторинга АТФ (Perkin Elmer Life Science). Результаты представлены на фиг.10.
Экспериментальный пример 5: Защитный эффект соединения 9 в отношении некроза клеток после in vitro ишемического реперфузионного повреждения
Для измерения защитного эффекта соединения 9 в отношении некроза H9C2 клеток после ишемического реперфузионного повреждения были проведены следующие эксперименты: двойное окрашивание FDA и PI, подсчет числа клеток, FACS-анализ и измерение набухания митохондрий.
Культура клеток и условия гипоксического повреждения: Клетки H9C2 инкубировали в среде DMEM, содержащей FBS и антибиотик. Когда 80-90% клеток оказывалось конфлюэнтными, проводили эксперимент. За 24 ч до эксперимента клетки H9C2 высеивали в 35-мм сосуд и 150-мм сосуд. Когда примерно 80% клеток оказывалось конфлюэнтными, среду меняли на среду DMEM, содержащую 0,5% FBS и антибиотик. Клетки инкубировали в гипоксической камере в течение 24 ч. В точке 23,5 ч в гипоксической камере клетки обрабатывали различными химикатами (0,01% ДМСО, соединение 9 (20 мкМ), витамин C (10 мкМ) и z-VAD-fmk (20 мкМ)). Клетки переносили в инкубатор (37°C) и затем обрабатывали H2O2 (400 мкМ) непосредственно реинкубацией. Реоксигенацию проводили в течение 1,5 ч.
Экспериментальный пример 5-1: Измерение защитного эффекта путем двойного окрашивания FDA и PI после ишемического реперфузионного повреждения в H9C2
Клетки H9C2, инкубированные в 35-мм сосуде для измерения флуоресценции, дважды окрашивали FDA (диацетатом флуоресцеина, Sigma) и PI (йодидом пропидиума). Готовили маточные растворы FDA и PI. Клетки промывали PBS и к 1,5 мл клеточной культурной среды добавляли 4,5 мкл раствора FDA (5 мг/мл) и 4 мкл раствора PI (2 мг/мл). Используя флуоресцентный микроскоп получали изображения, окрашенные FRA/PI. Результаты показаны на фиг.11.
Экспериментальный пример 5-2: Измерение защитного эффекта путем подсчета клеток, подвергнутых двойному окрашиванию FDA и PI после ишемического реперфузионного повреждения в H9C2
После получения изображения, окрашенного FRA/PI, с использованием флуоресцентного микроскопа в экспериментальном примере 5-1 подсчитывали число живых клеток и мертвых клеток, используя Image Pro. Результаты представлены на фиг.12.
Экспериментальный пример 5-3: Измерение защитного эффекта FACS-анализом клеток, подвергнутых двойному окрашиванию аннексином V и PI после ишемического реперфузионного повреждения в H9C2
Апоптозные или некротические клетки окрашивали используя набор для обнаружения, включающий FITC и аннексином V, и затем анализировали используя проточный цитометр. Клетки, инкубированные в 35-мм сосуде, делили на три (3) группы согласно окрашиванию PI и аннексином V - FITC: не обработанные, одиночное окрашивание и двойное окрашивание. После реоксигенации собранные клетки центрифугировали при 2000 об/мин при 4°C в течение 10 минут. После удаления супернатантной среды клетки повторно суспендировали с помощью буфера, связывающего аннексин V, окрашивали 5 мкл PI и 5 мкл аннексина V - FITC в течение 15 минут в темноте и затем анализировали с помощью FACS (клеточный сортер флуоресцентно-активированных клеток). Результаты показаны на фиг.13.
Экспериментальный пример 5-4: Измерение ингибиторного эффекта в отношении набухания митохондрий после ишемического реперфузионного повреждения в H9C2
Клетки H9C2, инкубированные в 150-мм сосуде, использовали для измерения набухания митохондрий. Клетки собирали, используя 0,05% трипсина, и затем центрифугировали при 2000 об/мин при 4°C в течение 10 минут. После удаления супернатанта клетки промывали PBS. Клетки повторно центрифугировали при 2000 об/мин при 4°C в течение 10 минут, и затем супернатант отбрасывали. Полученную клеточную массу добавляли к 500 мкл фильтрованного буфера для выделения (300 мМ маннита, 0,2 мМ ЭДТА, 5 мМ Tris-HCl (pH 7,4), 1% бычьего сывороточного альбумина) и использовали для последующих экспериментов. Клетки, разрушенные шприцем, тестировали, используя раствор трипанового синего для окрашивания. Когда большинство клеток было разрушено, клеточный раствор немедленно центрифугировали при 2000 об/мин в течение 4 минут. Супернатант, содержащий митохондрии, отделяли и центрифугировали при 13000 об/мин при 4°C в течение 10 минут. После отбрасывания супернатанта полученную массу митохондрий повторно суспендировали в 100 мкл буфера для инкубации (150 мМ KCl, 20 мМ Tris-HCl (pH 7,4)). Концентрацию белка измеряли с помощью набора для количественного определения белка. Некоторые из выделенных митохондриальных белков распределяли в 96-луночном планшете и затем измеряли спектрофотометром при 513 нм. Результаты представлены на фиг.14.
Экспериментальный пример 5-5: Измерение митохондриального помутнения и некроза ядер с использованием двойного окрашивания MitoTracker и PI после ишемического реперфузионного повреждения в H9C2
Визуализация митохондрий и трехмерное изображение: Чтобы визуализировать митохондрии клеток H9C2, инкубированных в 35-мм соуде, готовили 1 мМ MitoTracker Green FM, растворенный в ДМСО. Клетки промывали средой для клеточных культур и затем подвергали двойной окраске 0,5 мМ MitoTracker Green FM и 4 мкл раствора PI. Спустя 1 ч клетки анализировали во флуоресцентном микроскопе и получали трехмерное изображение, используя программу Imaris.
Электронный микроскоп: Использовали клетки H9C2, которые инкубировали в 24-луночном планшете, имеющем на дне покровное стекло. Клетки фиксировали 0,1 М натрий-фосфатным буфером (pH 7,4), содержащим 2% глутарового альдегида. Клетки промывали PBS буфером и затем постфиксировали 1% OsO4 и 1,5% калия в течение 1 ч. Клетки последовательно промывали PBS буфером и дважды дистиллированной водой и затем обрабатывали фильтрованным 0,5% уранилацетатом при 4°C в течение ночи. Клетки промывали дважды дистиллированной водой, дегидратировали этанолом и дважды заливали в Epon в течение 1 ч каждый раз. Клетки в смоле Epon полимеризовали при 60°C в течение 2 дней и затем анализировали электронной микроскопией.
Флуоресцентное иммуноокрашивание: Срезы тканей, залитые OCT, промывали ледяным 0,05% TBST в течение 10 минут три раза. Срезы тканей обрабатывали блокирующим раствором, содержащим 1% BSA, при комнатной температуре в течение 1 ч. Для проведения иммунофлуоресцентного окрашивания на сердечный миозин с тяжелой цепью срезы тканей обрабатывали антителом к тяжелым цепям сердечного миозина (1:100, Abcam) в качестве первичного антитела. Срезы тканей дважды промывали PBS-Tween 20 и затем окрашивали вторичным антителом, ослиным антимышиным 633 IgM (Invitrogen) и промывали дважды PBS-Tween 20. Для окрашивания агглютинином из проростков пшеницы срезы тканей обрабатывали агглютинином из проростков пшеницы Alexa Fluor 555 (Invitrogen) при 37°C в течение 10 минут. Для проведения иммунофлуоресцентного окрашивания на альфа-саркомерный актин срезы тканей обрабатывали первичным антителом, антителом против альфа-саркомерного актина, при 4°C в течение 24 часов. Срезы тканей дважды промывали 0,05% TBST и затем окрашивали вторичным антителом, ослиным антимышиным IgG Alexa Fluor 555 (Invitrogen). Срезы тканей окрашивали гематоксилином в течение 5 секунд, чтобы окрасить ядро. После монтировки препаратов срезов тканей на флуоресцентном микроскопе получали изображения. Результаты показаны на фиг.15.
Экспериментальный пример 6: Защитный эффект соединения 9 против повреждения сердца ишемией/реперфузией у SD-крыс
Содержание животных: Самцов SD-крыс (270-360 г) приобретали у Seoul National University Animal Center. Крысы содержались в полуспецифичных свободных от патогенов условиях, при которых свет включался и выключался по 12-часовому циклу, температуру и влажность поддерживали при 22°C и 55%, соответственно. Обеспечивали стандартный твердый корм для грызунов и питьевую воду ab libitum. Перед экспериментом, который проводился с разрешения IACUC при Seoul National University, каждому животному предоставлялся адаптационный период в 1 неделю.
Подготовка к операции: По прошествии адаптационного периода в 1 неделю крыс анестезировали смесью кетамина (100 мг/кг, Yuhan Corp., Сеул, Корея) и ксилазином (10 мг/кг, Bayer, Shawnee Mission, Канзас, США) интраперитонеальной инфузией. После соответствующей анестезии выполняли базовое эхокардиографическое исследование и затем всем крысам подавали 100% кислорода.
Ишемическую реперфузию индуцировали временной перевязкой передней нисходящей ветви левой артерии (LAD) в течение 45 минут. LAD перевязывали с помощью 8-0 Ethilon (Ethicon) с использованием полиэтиленовой трубки 10 в течение 45 минут. Ишемию определяли невооруженным глазом по обесцвечиванию миокарда и вентрикулярной тахиаритмии.
Крыс делили на три группы: контрольную группу (5 мл 0,9% солевого раствора), группу, получавшую циклоспорин (25 мг/кг в 5 мл 0,9% солевого раствора), и группу, получавшую соединение 9 (30 мг/кг в 5 мл 5% декстрозы). Лекарственные средства вводили инфузией в течение 20 минут через хвостовую вену, используя инфузионный насос для животных.
Реперфузию начинали удаляя лигатуру и полиэтиленовую трубку 10 и характеристики, вызванные типичным гиперемическим изменением поврежденного миокарда в ходе первых нескольких минут, определяли как реперфузию. Свободные кусочки швов сохраняли для определения ишемической области для окончания.
После операции, в случае группы, получавшей соединение 9, соединение 9 вводили перорально один раз в сутки в одной и той же дозе в течение 3 суток. Оставшимся группам проводили введение в этой же дозе.
Исследование функции инфарктного сердца крыс эхокардиографией: Под анестезией удаляли шерсть левой половины грудной клетки. Трансторакальную эхокардиографию проводили немедленно перед коронарной перевязкой и данные собирали, используя допплеровскую эхокардиографическую систему с линейным датчиком. Изображение сердца получали в двумерном режиме просмотра по окологрудной длинной оси и короткой оси. Вид по короткой оси, включающий папиллярную мышцу, был использован для ориентировки курсора М-режима вертикально относительно межжелудочковой перегородки и задней стенки левого желудочка. Изображения, полученные в ходе тренировочного периода, не регистрировались. Конечно-диастолические (LVEDD) и конечно-систолические (LVESD) размеры левого желудочка измеряли согласно методу передовой технологии Американского эхокардиографического общества. Процент (%) фракции укорочения левого желудочка (LV) рассчитывали по уравнению 100×(LVEDD-LVESD)/LVEDD.
Анализ ткани инфарктного сердца крыс: Спустя 3 суток после события ишемии миокарда крыс анестезировали. Чтобы оценить размер нарушения, залитые парафином репрезентативные срезы LV нарезали в срезы толщиной 4 мкм. Нейтрофилы окрашивали гематоксилином и эозином и затем исследовали в световом микроскопе. На площади 1 мм2 каждого среза измеряли число воспалительных клеток. Площадь фиброза, окрашенную трихромом по Масону, исследовали с использованием системы анализа изображений (Image Pro, версия 4.5; MediaCybernetics, Бетезда, Мэриленд, США). Измерения площади фиброза проводили для 2 индивидуальных срезов, и среднее значение использовали для численного анализа.
Для иммуногистологического окрашивания и исследования крысиные сердца помещали в OCT-компаунд, имеющий срезы 8 мкм (Tissue-Teck, Sakura, Торранс, Калифорния, США), быстро замораживали и сохраняли. Окрашивание количественно измеряли по числу положительных клеток к окрашиванию в 10 полях зрения под большим увеличением (HPF) для каждого животного (n=3). Для оценки апоптоза проводили TUNEL-анализ (набор Chemicon S7100, Chemicon, Темекула, Калифорния, США) и иммуногистологическое окрашивание на каспазу-3. Положительные клетки по TUNEL-анализу или по окрашиванию на каспазу-3 исследовали в 10 областях под микроскопом для по меньшей мере 3 различных срезов для каждого животного.
Иммунофлуоресцентное окрашивание проводили используя противосердечный тропонин I (Santa Cruz Biothechnology). Для детектирования использовали конъюгированное с FITC козье антикроличье антитело к IgG (Molecular Probes). Окрашивание красным PI проводили, чтобы показать ядро, и окрашивание Alexa HMGB1 с помощью Fluro 350 проводили, чтобы показать ядро. Колокализацию красных Dil-меченых MSC и зеленого коннексина-43 или экспрессию кардиотропонина I исследовали во флуоресцентном микроскопе (LSM 510 META, Carl Zeiss, Пибоди Массачусетс, США).
Измерение размера инфаркта: Размер инфаркта определяли спустя 72 часа после того, как I/R-повреждение (ишемическое реперфузионное повреждение) миокарда оценивали процентом AAR (площадь, подверженная риску). Отношение AAR к LV (левый желудочек) представляет уровень I/R-повреждения ткани миокарда. Отношение IS/AAR представляет собой точный индекс для определения IS в поврежденном миокарде и является первичной конечной точкой оценки эффективности лекарственной терапии. Чтобы определить AAR, левую коронарную артерию снова перевязывали и 4% красителя Evans Blue вводили инфузией через грудную аорту ретроградным методом. Сердце быстро удаляли, промывали в 0,9% солевом растворе и затем сохраняли в морозильнике (-20°C). Сердце нарезали на пять 1 мм поперечных срезов. Срезы сердца выдерживали в 1% растворе хлорида трифенилтетразолия в течение 15 мин при 37°C и затем помещали в раствор формальдегида. Нормальная ткань окрашивалась в красный, а инфарктная ткань окрашивалась в белый. Изображения срезов сердца получали в цифровом режиме (Canon EOS 400D) под микроскопом и, используя программное обеспечение ImagePro (версия 1.34), измеряли IS, AAR и общую площадь LV.
Численный анализ: Все данные были представлены средним значением (SE). Последовательные переменные сравнены с использованием t-критерия Стьюдента, и множественные сравнения проводили дисперсионным анализом с апостериорной коррекцией Бонферрони. Если p-значение меньше 0,05, значение рассматривали как статистически значимое, и все анализы проводили используя SPSS, версия 17.0 (SPSS, Чикаго, Иллинойс, США).
Эффект подавления соединением 9 увеличения массы левого желудочка (LV) показан на фиг.16, а эффект подавления соединением 9 фракции укорочения LV после I/R-повреждения показан на фиг.17, и результат сравнительного анализа для соединения 9 и CsA (циклоспорин A) в отношении фиброза миокарда показан на фиг.18.
Реферат
Изобретение относится к фармацевтической композиции, содержащей соединение формулы (1) или (2), для предотвращения или лечения заболеваний, связанных с окислительным стрессом, выбранных из группы, состоящей из MELAS (митохондриальная миопатия, энцефалопатия, лактацидоз и инсультоподобные эпизоды), синдрома MERRF (миоклоническая эпилепсия с рваными мышечными волокнами) или синдрома Кирнса-Сейра, аритмии, кардиоплегии или инфаркта миокарда. В формуле (1) na обозначает 1 или 2, Апредставляет 5-членный гетероарил или гетероцикл, каждый из которых имеет 2 гетероатома, выбранные из N, О и S, Rпредставляет R-X-B-X′-, Впредставляет прямую связь, Хи Х′независимо друг от друга представляют прямую связь или -ОС(О)-, Rпредставляет водород или 6-9-членный моноциклический или конденсированный циклический гетероцикл или гетероарил, каждый из которых имеет от 1 до 3 гетероатомов, выбранных из N, О и S, и необязательно замещен оксо или С-С-алкилом, Rпредставляет -(CRR)-Y-R pa обозначает число от 0 или 1, Yпредставляет прямую связь или -О-, Rпредставляет водород или фенил, R, R, R, Rпредставляют водород, Rпредставляет -(СН)-D-R-, Dпредставляет С-циклоалкил или 6-членный гетероцикл, который имеет 1 гетероатом, выбранный из N, S и О. Значение радикалов для формулы (2) приведены в формуле изобретения. 19 ил., 5 табл., 3 пр.
Формула

в формуле (1):
na обозначает число 1 или 2,
Аа представляет 5-членный гетероарил или гетероцикл, каждый из которых имеет 2 гетероатома, выбранные из N, О и S,
Rla представляет R5a-Xa-Ba-X′а-,
Ва представляет прямую связь,
Ха и Х′а независимо друг от друга представляют прямую связь или -ОС(О)-,
R5a представляет водород или 6-9-членный моноциклический или конденсированный циклический гетероцикл или гетероарил, каждый из которых имеет от 1 до 3 гетероатомов, выбранных из N, О и S,
и необязательно замещен оксо или С1-С6-алкилом,
R2a представляет -(CR8aR9a)pa-Ya-R7a,
pa обозначает число от 0 или 1,
R8a и R9a независимо друг от друга представляют водород,
Ya представляет прямую связь или -О-,
R7a представляет водород или фенил,
R3a представляет водород,
R4a представляет -(СН2)pa-Da-R10a-,
Da представляет С5-циклоалкил или 6-членный гетероцикл, который имеет 1 гетероатом, выбранный из N, S и О,
R10a представляет водород,

в формуле (2):
nb обозначает число 1,
mb обозначает 1,
Ab представляет фенил,
Xb представляет С,
R1b представляет водород,
R2b представляет водород,
R3b представляет водород,
R4b представляет -YbR11b, где Yb представляет прямую связь, R11b представляет -(СН2)tbBb-R13b, где tb обозначает число 1, Bbпредставляет 6-членный гетероцикл, который имеет 2 гетероатома, выбранные из N, S и О, R13b представляет оксо,
R5b представляет водород или 6-членный гетероциклилС1-С6-алкил, где гетероциклил имеет 1 гетероатом, выбранный из N, S и О,
R6b представляет -(CR7bR8b)pb-Zb-Db-Wb-R14b, где R7b R8b независимо друг от друга представляют водород, pb обозначает число 0 или 1, Zb представляет прямую связь, Db представляет прямую связь или 6-членный гетероцикл, который имеет 1 гетероатом, выбранный из N, S и О, Wb представляет прямую связь, -С(О)- или -S(O)yb-, yb обозначает число 2, где R14b представляет С1-С6-алкил или 6-членный гетероцикл, который имеет 1 гетероатом, выбранный из N, S и О.

Комментарии