Способ культивирования клеток без компонентов животного происхождения - RU2369634C2
Код документа: RU2369634C2
Чертежи












Описание
Настоящее изобретение относится к способу культивирования клеток животных, таких как клетки млекопитающих, в частности, культивирования диплоидных, зависимых от культуральной подложки клеток животных, таких как клетки млекопитающих или предпочтительно человека, без экзогенных компонентов первичного животного происхождения, и к клеточной культуральной среде, по существу не содержащей экзогенные компоненты первичного животного происхождения, подходящей для осуществления указанного способа. В частности, изобретение относится к клеточной культуральной среде, которая содержит по меньшей мере один, более предпочтительно несколько экзогенных факторов роста неживотного происхождения. Такая среда особенно подходит для культивирования диплоидных, зависимых от культуральной подложки клеток животных, например млекопитающих, или предпочтительно человека, например, с эффективностью, эквивалентной эффективности минимальной среды для этого типа клеток, дополненной подходящей сывороткой. Настоящее изобретение также относится к способу культивирования диплоидных, зависимых от культуральной подложки клеток животных, например млекопитающих или предпочтительно человека, в среде по изобретению, включающему применение заменителя трипсина неживотного происхождения для пассирования клеток. Изобретение также относится к способу продуцирования вирусов, вирусных вакцин и тому подобного.
Предшествующий уровень техники
Клетки, зависимые от культуральной подложки, особенно диплоидные клетки, зависимые от культуральной подложки, используют в самых разных способах: для продуцирования продуктов, таких как вакцины и рекомбинантные белки, для нужд здравоохранения в крупномасштабных биопроцессах; для производства искусственных тканей, используемых в лечении человеческих ран; для экспериментальных исследований; в токсикологии in vitro; для скриннинга и тестирования новых лекарств и т.д.
Традиционно клетки, зависимые от культуральной подложки, культивируют в средах, содержащих сыворотку или другие компоненты животного происхождения в качестве заменителей сыворотки, такие как бычий сывороточный альбумин (БСА) или белковые гидролизаты. Сыворотку или компоненты животного происхождения используют также во время субкультивирования клеток и при криоконсервации клеток. Сыворотка является главным источником метаболитов, гормонов, витаминов, железа (трансферрин), транспортных белков, факторов прикрепления (например, фибронектина), факторов распластывания и роста. Она требуется для роста многих культур животных клеток in vitro. Кроме того, сыворотка действует в качестве буфера против разнообразных отклонений и токсических эффектов, таких как изменение рН, присутствие ионов тяжелых металлов, протеолитической активности или эндотоксинов. Альбумин является основным белковым компонентом сыворотки и оказывает несколько эффектов, которые способствуют росту и поддержанию клеток в культуре: он действует в качестве белка-носителя для ряда небольших молекул и в качестве переносчика жирных кислот, которые являются незаменимыми для клеток, но токсичными в несвязанной форме.
Диплоидные клетки, зависимые от культуральной подложки, стандартно выращивают на поверхности пластика, стекла или на микроносителях. Клетки прикрепляются и распластываются при помощи факторов прикрепления, таких как фибронектин (F.Grinnel & М.К.Feld Cell, 1979, 17, 117-129). Трипсин является одним из наиболее стандартных компонентов животного происхождения, используемых для открепления клеток в процессе клеточного пассирования (М.Schröder & P.Friedl), Methods in Cell Science, 1997, 19, 137-147; O.W.Mertens, Dev Biol Stand., 1999, Vol 99, p.167-180). После открепления клеток его необходимо заингибировать сывороткой или соевым ингибитором трипсина во избежание повреждения клеток. После открепления клетки высевают с меньшей плотностью на новую поверхность, где они могут размножаться и образовывать конфлуэнтный слой клеток перед следующим пересевом. Целью пассирования прикрепленных клеток является размножение и продуцирование достаточного количества клеток для осуществления вышеуказанных способов.
Существуют различные недостатки, связанные с использованием в этих способах сыворотки и компонентов животного происхождения, главным образом, их стоимость, варьирование их состава от партии к партии, их связь с более высоким риском загрязнения побочными агентами и последующие трудности, встречающиеся в технологии производства и выделения целевого продукта (например очистка, для того чтобы избавиться от сывороточных белков или введенных белков животного происхождения). Кроме того, как указанно выше, сообщают, что бессывороточная среда не подходит для зависимых от культуральной подложки диплоидных клеток (O.W.Mertens, Dev Biol Stand., 1999, Vol. 99, p.167-180; O.W.Merten, Dev. Biol. 2002, 101, 233-257).
Для культуры клеток, зависимых от культуральной подложки, был разработан целый ряд сред с низким содержанием сыворотки или ее отсутствием, в частности для культуры диплоидных клеток, зависимых от культуральной подложки (М.Kan & I.Yamane, Journal of Cellular Physiology, 1982, 111, 155-162; S.P.Forester et al. Biotechnology and Bioengineering, 1992, Vol. 40, p.1039-1044). Попытки, осуществленные с такими средами, были неудовлетворительными главным образом из-за того, что диплоидные клетки, зависимые от культуральной подложки, которые не являются трансформированными, нуждаются скорее в сложных бессывороточных средах с добавлением нескольких факторов роста и гормонов, а также потому, что в способах продуцирования таких клеток сыворотку обычно используют по меньшей мере в течение фазы производства биомассы (O.W.Merten, Dev. Biol. 2002, 101, 233-257). Кроме того, эти среды все же содержат компоненты животного происхождения, подобные БСА, белковым гидролизатам, факторам роста, транспортным белкам, аминокислотам, витаминам и т.д. Было предпринято очень мало попыток разработки составов сред для зависимых от культуральной подложки клеток, которые совсем не содержат компонентов животного происхождения. Сообщают, что составы, которые обычно не содержат животных компонентов, не способны поддерживать скорость роста клеток, эквивалентную той, которая наблюдается в присутствии сыворотки, и что они позволяют провести лишь несколько стадий пересева перед тем, как наблюдается раннее старение культуры (B.J.Walthall & R.Ham Experimental Cell Research (1981) 134 303-311). Кроме того, первичные клеточные культуры из зависимых от культуральной подложки клеток почти всегда вовлекают дезагрегацию клеточных слоев или ткани с использованием протеазы, главным образом сериновой протеазы животного происхождения, что подразумевает риск загрязнения клеточной культуры случайным вирусом и обусловливает неприемлемую изменчивость в росте клеток из-за изменения ферментативной активности протеазы от партии к партии. Например, применение свиного/бычьего трипсина при пассировании культур клеток, зависимых от культуральной подложки, представляет собой хорошо известную методику (O.W.Mertens, Cytotechnology, 2000, 34, 181-183).
Поэтому в области культивирования диплоидных клеток, зависимых от культуральной подложки, существует необходимость в разработке клеточной культуральной среды, которая по существу не содержит, а предпочтительно абсолютно не содержит компонентов животного происхождения и подходит для осуществления способа культивирования диплоидных клеток, зависимых от культуральной подложки, с эффективностью, эквивалентной эффективности минимальной среды для этого типа клеток, дополненной подходящей сывороткой, например, в терминах скорости клеточного роста, старения, клеточной морфологии, продуцирования белка или вируса по сравнению с этими параметрами, полученными в способах с использованием сыворотки.
Краткое изложение сущности изобретения
Было обнаружено, что применение клеточной культуральной среды, не содержащей по существу экзогенных компонентов первичного животного происхождения и содержащей по меньшей мере один экзогенный фактор роста неживотного вторичного происхождения, может с успехом заменить стандартную культуральную среду и бессывороточную среду, которые, как известно, содержат компоненты экзогенного первичного и/или вторичного животного происхождения.
Также обнаружили, что способ культивирования клеток, включающий применение указанной культуральной среды и дополнительно включающий пассирование клеток животных, таких как млекопитающие или предпочтительно человек, предпочтительно зависимых от культуральной подложки клеток, один или более раз в присутствии заменителя протеазы неживотного происхождения, также может быть осуществлен с уровнем эффективности, эквивалентным уровню эффективности, полученному в классическом способе, который осуществляют с использованием минимальной среды для этого типа клеток, дополненной подходящей сывороткой.
Соответственно, первый аспект настоящего изобретения относится к клеточной культуральной среде, по существу не содержащей, преимущественно абсолютно не содержащей экзогенные компоненты первичного животного происхождения, включающей по меньшей мере один, предпочтительно более чем один экзогенный фактор роста неживотного вторичного происхождения, выбранный из группы, состоящей из EGF (эпидермальный фактор роста), FGF (фактор роста фибробластов), трийод-L-тиронина и гидрокортизона, и по меньшей мере одного IGF-1 (инсулиноподобный фактор роста 1) и/или инсулина неживотного вторичного происхождения. Указанная культуральная среда соответствующим образом адаптирована для культивирования зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, предпочтительно диплоидных клеток, например, с эффективностью, эквивалентной эффективности минимальной среды для этого типа клеток, дополненной подходящей сывороткой.
Культуральная среда по изобретению возможно дополнительно содержит белковый гидролизат неживотного происхождения. Белковый гидролизат предпочтительно присутствует. Подходящим белковым гидролизатом является пшеничный гидролизат.
Кроме того, настоящее изобретение относится к применению указанной среды для культивирования зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, предпочтительно диплоидных, зависимых от культуральной подложки клеток, с эффективностью, эквивалентной эффективности, полученной с минимальной средой для этого типа клеток, дополненной подходящей сывороткой.
Авторы неожиданно обнаружили, что среда по изобретению особенно подходит для культивирования зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, особенно диплоидных, зависимых от культуральной подложки клеток, например, с эффективностью (например, скорость клеточного роста, старение, клеточная морфология, продуцирование вирусов или белка), эквивалентной эффективности, полученной с минимальной средой для этого типа клеток, дополненной компонентами животного происхождения, например, сывороткой.
Таким образом, изобретение в особенности относится к способу продуцирования зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, предпочтительно диплоидных клеток, в клеточной культуральной среде по изобретению, при котором:
а) высевают указанные клетки в клеточную культуральную среду, как определено в любом из пп.1-9, и дают возможность клеткам прикрепиться к субстрату;
б) осуществляют сбор кондиционированной среды, образующейся на стадии (а), открепление клеточного слоя от его субстрата и диссоциацию клеток протеазой неживотного происхождения, получая таким образом клеточную суспензию;
в) инокулируют в указанную культуральную среду клеточную суспензию со стадии (б) в устройство для культивирования, включающее адгезивную подложку, обеспечивающую прикрепление клеток; и
г) выращивают клетки в той же культуральной среде.
Стадии от (б) до (г) можно повторять несколько раз.
Кроме того, способ возможно включает стадию замораживания клеток, собранных на стадии (б) для получения клеточного банка.
Также обнаружили, что указанный способ продуцирования клеток не требует каких-либо стадий адаптации перед культивированием клеток в среде, не содержащей экзогенные компоненты животного происхождения, и что отсутствие этой стадии адаптации не влияет на старение клеток.
Таким образом, другой аспект изобретения касается получения линии клеток, в частности линии диплоидных, зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, адаптированных для роста в культуральной среде по изобретению, и в особенности получения линии клеток, в частности линии диплоидных, зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, адаптированных для продуцирования биологически активного продукта, предпочтительно вируса, в частности живого вируса для применения в качестве вакцины.
Изобретение также относится к способу продуцирования вирусов в зависимых от культуральной подложки клетках животных, таких как млекопитающие или предпочтительно человек, в клеточной культуральной среде, подходящей для продуцирования вирусов, причем указанная среда не содержит компоненты первичного животного происхождения, а содержит по меньшей мере один экзогенный фактор роста неживотного вторичного происхождения и возможно один белковый гидролизат неживотного происхождения, включающему стадии:
а) заражения клеток вирусом,
б) размножения вирусов, и
в) сбора вирусов.
Способ может включать одну или более чем одну стадию очистки собранного вируса. Вирус может быть подходящим образом приготовлен в виде вакцинного препарата с фармацевтически приемлемым носителем, эксципиентом и/или адъювантом.
Подробное описание изобретения
В особенно предпочтительном воплощении клеточная культуральная среда по изобретению по существу не содержит, предпочтительно абсолютно не содержит экзогенные компоненты первичного животного происхождения, предпочтительно она не содержит экзогенные компоненты первичного и вторичного животного происхождения. Указанная среда подходящим образом адаптирована для культивирования зависимых от культуральной подложки клеток животных, таких так млекопитающие или предпочтительно человек, особенно диплоидных, зависимых от культуральной подложки клеток, например, с эффективностью, которая эквивалентна, например, в терминах скорости клеточного роста, клеточной морфологии, старения или продуцирования вирусов, эффективности, полученной с минимальной средой для этого типа клеток, дополненной подходящей сывороткой. Например, минимальную среду для клеток животных, таких как млекопитающие или предпочтительно человек, можно найти в каталоге АТСС (Американской коллекции типовых культур), а примеры минимальной среды для данных типов клеток дополнительно приведены в Таблице 1. Сыворотка, используемая для сравнительных целей, типично представляет собой бычью сыворотку, в частности, фетальную бычью сыворотку. Таким образом, эквивалентность лучше всего оценивать при сравнении с минимальной средой согласно Таблице 1, и содержащей бычью сыворотку, типично в концентрации 10% (об./об.).
Под “скоростью клеточного роста” подразумевают среднюю скорость, с которой клетки растут в период от их оттаивания из клеточного банка до их старения. Ее выражают в Удвоении Популяции (УП)/день и получают путем расчета отношения количества Удвоений Популяции, наблюдаемого в период от оттаивания клеток до их старения, ко времени (выраженном в днях), прошедшем между оттаиванием клеток и их старением. Эквивалентная скорость клеточного роста по изобретению означает скорость роста, которая составляет по меньшей мере 80%, предпочтительно 90%, более предпочтительно по меньшей мере 95% или выше от скорости роста, полученной для клеток, культивируемых в минимальной среде для этого типа клеток, дополненной подходящей сывороткой, обычно бычьей сывороткой, в концентрации 10% (используемой в качестве контроля). Наиболее предпочтительной является скорость клеточного роста, которая выше скорости, полученной для клеток, культивируемых в среде, содержащей сыворотку.
Под “клеточной морфологией” подразумевают морфологию клеток, оцениваемую при помощи оптической микроскопии. Эквивалентная эффективность в терминах морфологии означает, что клетки сохранили морфологию, которую они демонстрировали при культивировании в присутствии бычьей сыворотки. В качестве примера, клетки MRC-5 будут сохранять их фибробластную природу после культивирования в среде по настоящему изобретению.
Под “старением” подразумевают потерю репликативной способности клеток, наблюдаемую после постоянного фиксированного числа удвоений популяции (уровень удвоения популяции, УУП), которое обычно называют пределом Хэйфлика (Hayflick limit) (Harry Rubin, Nature Biotechnology, 2002, 20, 675-681). Эквивалентное старение по изобретению означает старение, которое составляет по меньшей мере 70%, предпочтительно 90%, более предпочтительно по меньшей мере 95% или выше от старения клеток, культивируемых в минимальной среде для этого типа клеток, дополненной подходящей сывороткой, обычно бычьей сывороткой, в концентрации 10% (используемой в качестве контроля). Наиболее предпочтительным является старение, которое происходит при УУП, более высоком, чем УУП, наблюдаемый у клеток, культивируемых в среде, содержащей сыворотку. Типично для клеток MRC-5, которые являются предпочтительными, старение получают от примерно УУП60 до примерно УУП75 для клеток, культивируемых в присутствии сыворотки, как описано выше.
Под “зависимыми от культуральной подложки клетками животных” или “зависимыми от культуральной подложки клетками человека” подразумевают либо клетки, происходящие из клеточных линий, либо клетки, происходящие из животных или человеческих тканей, которые нуждаются в твердой подложке для нормального роста и размножения. Твердая подложка по существу представляет собой поверхность для роста, такую как поверхность пластика или стекла. Примерами подходящих твердых подложек являются: чашки Петри, флаконы для тканевых культур, клеточные фабрики, роллерные флаконы или микроносители. Для целей изобретения поверхность не покрыта каким-либо белком животного происхождения, или пептидами, происходящими из таких белков. Клетки прикрепляются и распластываются путем адгезии, т.е. благодаря секреции их аутокринных факторов адгезии. Предпочтительные клетки, зависимые от культуральной подложки, представляют собой диплоидные клетки. Не ограничивающие примеры диплоидных клеток, зависимых от культуральной подложки, можно найти в каталоге АТСС (WI 38: CCL-75, MRC-5: CCL-171, IMR-90: CCL-186, DBS-FRhL-2: CCL-160, MRC-9: CCL-212) или в каталоге NIA (TIG-1 и TIG-7, разработанные для банка стареющих клеток NIA, TIG-1 репозитарный номер AG06173; IMR-91: l91 L). Предпочтительными клетками являются MRC-5, WI-38, FRhL-2, MRC-9, а наиболее предпочтительной клеточной линией является MRC-5.
“Среда, по существу не содержащая” используется в отношении среды, включая свежую и кондиционированную среду, которая не содержит сыворотку или каких-либо экзогенные компоненты первичного животного происхождения (таких как, например, БСА). Такая свежая среда или кондиционированная среда может содержать следы экзогенных компонентов вторичного животного происхождения. Под "средой, не содержащей компоненты животного происхождения" подразумевают среду, которая не содержит сыворотку или любые экзогенные компоненты как первичного животного происхождения (такие как, например, БСА), так и вторичного животного происхождения. Экзогенные компоненты первичного животного происхождения включают, например, компоненты, происходящие от коров (включая телят), человека (такие как человеческий сывороточный альбумин - ЧСА) или свиней. Компоненты вторичного животного происхождения определяют как компоненты, которые на одной из стадий их производства находятся в контакте с продуктом животного происхождения. В частности, часто используемые компоненты вторичного животного происхождения представляют собой рекомбинантные факторы роста, такие как инсулин, EGF и FGF и IGF-1. Эти рекомбинантные факторы роста, которые могут продуцироваться в E.соli, находятся в контакте с бычьими или свиными компонентами, используемыми для ферментации с подпиткой и/или для ферментативных расщеплений. Следы компонентов вторичного животного происхождения находятся в пределах менее 1%, предпочтительно менее 0,5%, более предпочтительно менее 0,01%, наиболее предпочтительно менее 0,001%, однако, предпочтительнее всего их отсутствие (0%). Минимальные бессывороточные среды и среды, не содержащие компоненты животного происхождения, имеются в продаже или могут быть приготовлены путем смешивания каждого из отдельных компонентов. Они подходящим образом дополнены факторами роста неживотного происхождения. Согласно настоящему изобретению предпочтительно используют среду, которая абсолютно не содержит экзогенные компоненты животного происхождения. Хотя среда, абсолютно не содержащая экзогенные компоненты животного происхождения, является предпочтительным воплощением, все указанные компоненты могут быть заменены компонентами вторичного животного происхождения (такими как факторы роста, пшеничный пептон, аминокислоты, протеаза и т.д., как перечислено выше) без какого-либо влияния на эффективность способа.
Под “животного происхождения” или “происходящим из животных” подразумевают млекопитающих, например, человека, а также животных, не являющихся млекопитающими, таких как насекомые, рыбы, птицы, земноводные и пресмыкающиеся.
Термин “экзогенный” предназначен для обозначения компонента неживотного происхождения, который был добавлен в среду, в отличие от компонента, обозначаемого как “эндогенный”, который секретировался клеткой. Поэтому при сравнении термин “эндогенный” относится к компоненту, который синтезируется и секретируется (аутокринная секреция) клеткой для обеспечения ее прикрепления, распластывания и роста на подходящем субстрате (фибронектин, коллаген, протеогликаны, факторы роста…) (M.R.Koller & E.T.Papoutsakis, Bioprocess Technol., 1995, 60, 61-110).
Предпочтительно клеточная культуральная среда не содержит экзогенные компоненты первичного животного происхождения, а содержит по меньшей мере один экзогенный фактор роста неживотного вторичного происхождения, предпочтительно по меньшей мере два, более предпочтительно по меньшей мере три или более факторов роста. Соответственно клеточная культуральная среда содержит по меньшей мере один экзогенный фактор роста неживотного происхождения, выбранный из группы, состоящей из: EGF, FGF, трийод-L-тиронина и гидрокортизона, и по меньшей мере один IGF-1 и/или инсулин неживотного вторичного происхождения. Соответственно культуральная среда содержит комбинацию EGF, FGF, трийод-L-тиронина и гидрокортизона неживотного вторичного происхождения и по меньшей мере один IGF-1 и/или инсулин неживотного вторичного происхождения. Термин “фактор роста” относится к белку, пептиду или полипептиду, или комплексу полипептидов, включая цитокины, которые необходимы для роста клеток, которые могут продуцироваться клеткой в процессе культивирования и которые могут влиять на саму клетку и/или множество других соседних или удаленных клеток, например, путем стимуляции клеточного прикрепления и роста. Некоторые, но не все, факторы роста являются гормонами. Примерами факторов роста являются инсулин, инсулиноподобный фактор роста (IGF), включая IGF-1, эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), включая основной FGF (bFGF), колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF), колониестимулирующий фактор гранулоцитов (G-CSF), трансформирующий фактор роста-альфа (TGF-alpha), происходящие из тромбоцитов факторы роста (PDGFs), фактор роста нервов (NGF), фактор роста кератиноцитов (KGF), VEGF (фактор роста сосудистого эндотелия), трансформирующий фактор роста-бета (TGF-beta), интерлейкин-8 (IL-8), интерлейкин 6 (IL-6), трийод-L-тиронин и гидрокортизон. Предпочтительные факторы роста включают, например, EGF, FGF (предпочтительно bFGF), IGF-1 или инсулин, трийод-L-тиронин и гидрокортизон, и могут быть использованы либо по одиночке, либо предпочтительно в комбинации. Предпочтительная культуральная среда содержит EGF, FGFb, IGF-1 или инсулин, трийод-L-тиронин и гидрокортизон неживотного происхождения. Тем не менее, более предпочтительным является то, чтобы все компоненты клеточной культуральной среды по изобретению, такие как компоненты, перечисленные в Таблице 3, не имели первичного или вторичного животного происхождения.
В еще более предпочтительном воплощении культуральная среда дополнительно содержит белковый гидролизат неживотного прпоисхождения, предпочтительно белковый гидролизат, происходящий из растений или дрожжей. Под “белковым гидролизатом” или “белковым пептоном” подразумевают, как принято в данной области, очищенный препарат белкового гидролизата или его грубой фракции, который, следовательно, не содержит белка. Термин “безбелковый” предназначен для обозначения отсутствия какого-либо функционально активного белка, но он, однако, возможно не исключает нефункциональных пептидов, которые могут происходить именно из белковых гидролизатов. Особенно подходящая фракция гидролизата содержит белковый гидролизат пшеничный пептон, например ферментативный гидролизат, состоящий из пептидов в диапазоне до 10000 дальтон, с большей частью 80% пептидов в диапазоне от 300 до 1000 дальтон. Концентрация белкового гидролизата в культуральной среде, когда он присутствует, варьирует от 0 до 10 г/л, предпочтительно от 1 до 5 г/л, особенно предпочтительно 2,5 г/л. Конкретно, белковый гидролизат происходит из растений (например риса, кукурузы, пшеницы, сои, гороха, хлопчатника, картофеля) или дрожжей. Предпочтительный растительный белковый гидролизат по изобретению представляет собой белковый гидролизат пшеничный пептон.
Альтернативно, клеточная культуральная среда по изобретению относится к “свежей среде”, “кондиционированной среде” или к смеси обеих сред. “Свежая среда” относится к любой клеточной культуральной среде, имеющейся в продаже или приготовленной из отдельных компонентов, которые не были использованы для культивирования каких-либо клеток. Согласно предпочтительному аспекту изобретения, подразумевают, что свежая среда относится к имеющейся в продаже среде или среде, приготовленной из отдельных компонентов, как описано выше. Эта среда по изобретению, которая не содержит животных компонентов первичного происхождения и которая дополнена по меньшей мере одним экзогенным фактором роста неживотного вторичного происхождения, как описано здесь выше, и возможно, но предпочтительно, белковым гидролизатом неживотного происхождения, таким как пшеничный белковый гидролизат.
Подразумевают, что “кондиционированная среда” обозначает среду, которая была использована одной клеточной культурой и которую вновь используют для другой культуры. Эта кондиционированная среда включает высвобожденные первой культурой эндогенные стимулирующие рост вещества, эндогенные факторы прикрепления и специфические эндогенные питательные вещества.
Таким образом, в другом аспекте изобретения предложен способ получения кондиционированной культуральной среды, включающий объединение свежей культуральной среды по изобретению с зависимыми от культуральной подложки клетками животных или предпочтительно человека, для получения кондиционированной культуральной среды.
Если не указано иначе, свежую среду, кондиционированную среду и смесь обеих сред будут обозначать как “культуральная среда”.
Таблица 2 показывает диапазон концентраций и предпочтительные концентрации фактора(ов) роста и белкового гидролизата, добавленных в свежую среду. Соответственно, концентрация факторов роста, когда они присутствуют, в подходящей клеточной культуральной среде по изобретению такая, как определено в Таблице 2.
Будет понятно, что в зависимости от типа культивируемых клеток и эффективности, которую нужно достичь, свежая культуральная среда по изобретению может быть возможно дополнена ингредиентами, традиционно присутствующими в культуральной среде и имеющими неживотное происхождение. Подходящими ингредиентами являются, например, аминокислоты (включая заменимые), витамины, нуклеотиды/нуклеозиды, жирные кислоты, антибиотики и стабилизаторы окисления, которые все имеют неживотное происхождение.
Подходящими свежими средами являются стандартные среды, не содержащие животных компонентов, такие как среды на основе DMEM (high-glucose Dulbecco′s Modified Eagle′s Media, модифицированная Дульбекко среда Игла с высоким содержанием глюкозы), MEM (Minimum Essential Medium Eagle, минимальная поддерживающая среда Игла), Medium 199, RPM-I 1640 - все имеются в продаже от, среди прочих, Life-technologies-Gibco-BRL, BioWittaker, Sigma-Aldrich, и, кроме того, адекватно дополненные фактором(ами) роста и возможно белковым гидролизатом неживотного происхождения, как изложено выше. Квалифицированный специалист поймет, что исходную среду нужно выбирать в соответствии с типом культивируемых клеток. Предпочтительная имеющаяся в продаже свежая среда представляет собой Ультра-МЕМ, имеющуюся в продаже от BioWhittaker (кат. №12-745F). Альтернативно, в зависимости от типа клеток, которые нужно культивировать, свежая среда представляет собой среду без животных компонентов, приготовленную из отдельных компонентов, и содержит (список не является исчерпывающим) источник углеводов, ингредиенты неорганических солей, следы элементов, аминокислоты (включая заменимые), витамины, нуклеотиды/нуклеозиды, жирные кислоты, антибиотики, стабилизаторы окисления и воду, подходящим образом дополненную экзогенными факторами роста неживотного происхождения и возможно, но предпочтительно, белковым гидролизатом неживотного происхождения, как изложено выше. Пример базовой композиции такой среды дан в Примере I и Таблице 3.
Указанные среды подходят для культивирования клеток животных, таких как млекопитающие или предпочтительно человек, в особенности зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, предпочтительно диплоидных, зависимых от культуральной подложки клеток, что представляет собой другой аспект изобретения.
В предпочтительном аспекте изобретения также предложен способ продуцирования зависимых от культуральной подложки клеток животных или предпочтительно человека, предпочтительно диплоидных клеток, в культуральной среде по изобретению, при котором:
а) высевают указанные клетки в клеточную культуральную среду, как определено в любом из пп.1-9, и дают возможность клеткам прикрепиться к субстрату;
б) осуществляют сбор кондиционированной среды, образующейся на стадии (а), открепление клеточного слоя от его субстрата и диссоциацию клеток протеазой неживотного происхождения, получая таким образом клеточную суспензию;
в) инокулируют в указанную культуральную среду клеточную суспензию со стадии (б) в устройство для культивирования, включающее адгезивную подложку, обеспечивающую прикрепление клеток; и
г) выращивают клетки в той же культуральной среде;
д) возможно повторяют стадии от (б) до (г).
Возможно, способ включает стадию замораживания клеток, собранных на стадии (б), чтобы получить клеточный банк.
Протеазу, используемую на стадии (б), возможно, инактивируют после обработки.
В зависимости от типа клеток и от эффективности способа культивирования клеток, которую нужно достичь, специалист поймет, что используемая культуральная среда, особенно на стадиях (а) и (в), может быть либо свежей средой, либо кондиционированной средой, происходящей из предыдущей культуры, либо смесью свежей и кондиционированной среды. В этой смеси соотношение между свежей культуральной средой и кондиционированной культуральной средой варьирует от 1:0 (100% свежей среды) до 0:1 (100% кондиционированной среды). Кондиционированная среда предпочтительно составляет от 0 до примерно 75% общего объема среды. Предпочтительным соотношением между свежей культуральной средой и кондиционированной культуральной средой является 1:1 (50% свежей/50% кондиционированной), еще более предпочтительным - примерно от 7:1 (87,5% свежей/12,5% кондиционированной) до 1:7, наиболее предпочтительным - примерно от 3:1 (75% свежей/25% кондиционированной) до 1:3, а самым предпочтительным - 3:1 (75% свежей/25% кондиционированной). Предпочтительные соотношения предпочтительно поддерживают на протяжении всего способа культивирования при каждой смене среды.
Протеаза представляет собой протеазу неживотного происхождения, то есть протеазу, очистку которой производят не из животного источника. Протеаза может быть рекомбинантного происхождения, но предпочтительно бактериального, дрожжевого или растительного происхождения, если возможно, неживотного вторичного происхождения. Подразумевают, что протеаза рекомбинантного происхождения означает любую протеазу, которую продуцируют при помощи методов рекомбинантных ДНК, включая применение микроорганизма, например, бактерии, вируса, дрожжей, растений и т.д. для ее продуцирования. Предпочтительные протеазы включают: цистеиновую эндопептидазу; нейтральную грибковую протеазу (из A.oryzae); нейтральную бактериальную протеазу (из Bacillus subtilis) (описанную в Brocklehurst, К. et al., Cysteine proteinases. In New Comprehensive Biochemistry Vol.16, Hydrolytic Enzymes; Neuberger, A. & Brocklehurst, K., eds, pp.39-158 (1987) Elsevier, Amsterdam); сериновые протеазы, такие как трипсиноподобные протеазы (такие как rProtease от Invitrogen, 3175 Staley Road, Grand Island, NY 14072. Номер по каталогу поставщика 02-106) или рекомбинантный трипсин (такой как Trypzean, рекомбинантный трипсин, продуцируемый в кукурузе, Prodigen, 101 Gateway Blvd, Suite 100 College Station, Texas 77845. Код производителя: TRY). Протеазы из семейства трипсиноподобных протеаз обычно обнаруживают у прокариот, животных и вирусов, но неожиданно, что они до сих пор не обнаружены у растений. Эти ферменты участвуют в разнообразных физиологических процессах, наиболее известными из которых являются пищеварение, оплодотворение, каскад свертывания крови и процессы развития. Считают, что они дивергировали от общего белка-предшественника. Эти ферменты широко описаны в литературе (A.J.Greer, "Comparative modelling methods - application to the family of mammalian serine proteases" Proteins, Vol.7, p.317-334, 1990) и могут быть разделены на несколько семейств на основании их структуры (А.Sali & Т.Blundell, "definition of general topological equivalence in protein structures" J. Mol. Biol., 212, p.403-428, 1990). Подходящей протеазой является сериновая протеаза, такая как рекомбинантный трипсин или трипсиноподобная протеаза. Предпочтительной протеазой является нейтральная грибковая протеаза или нейтральная бактериальная протеаза. Более предпочтительной протеазой по изобретению является цистеиновая эндопептидаза. Особенно предпочтительной цистеиновой протеазой является протеаза растительного происхождения. Предпочтительные цистеиновые эндопептидазы растительного происхождения выбраны из группы, состоящей из: фицина (основной протеолитический компонент латекса фикуса, Ficus glabrata) (Liener, I.E. & Friedenson, В.Methods Enzymol, 1970, 19, 261-273), бромелаина стеблей (экстрагированного из стеблей растения ананаса, Ananas comosus), актинидина (из плодов киви или актинидии китайской Actinidia chinensis) и папаина (из латекса плодов папайи Carica papaya). Среди цистеиновых протеаз особенно предпочтительным является фицин.
Протеаза может быть использована в любой подходящей концентрации для обеспечения эффективной диссоциации клеток (обособленные клетки) в пределах приемлемого времени открепления.
Способ продуцирования диплоидных клеток, зависимых от культуральной подложки, можно лучше понять из стадий, проиллюстрированных в Примере II. Кратко, клеточный слой происходит из клеток, оттаянных и посеянных для клеточной культуры в культуральную среду по изобретению, или из предыдущей субкультуры. Затем на первой стадии для открепления клеток удаляют среду из культуры клеток, зависимых от культуральной подложки, сохраняют ее, чтобы использовать в качестве кондиционированной среды на стадии инокуляции. Клеточный слой, предпочтительно промытый, открепляют и диссоциируют на обособленные клетки при помощи раствора протеазы и встряхивания флакона. Когда клетки открепляются и обособляются, клеточную суспензию собирают, и она может быть использована для инокуляции клеток или создания клеточного банка. Когда активность протеазы является токсичной для культуры клеток, она возможно может быть заингибирована подходящим ингибитором протеазы. На второй стадии для инокуляции клеток эти клетки высевают в новые флаконы с обычной плотностью клеток, применяемой для получаемой клеточной линии. Затем культуральную среду, предпочтительно смесь свежей культуральной среды и кондиционированной среды добавляют в новые флаконы. На третьей стадии для роста клеток новые клеточные культуры инкубируют при тех же температурах и в тех же атмосферах, которые применяют в обычных способах, используемых для получения этой клеточной линии. Для создания клеточного банка может быть применена возможная четвертая стадия после стадии 1 (открепление клеток) и вместо стадии 2 (инокуляция клеток) и 3 (рост клеток). Ее осуществляют путем замораживания клеток в среде, не содержащей компоненты животного происхождения, с добавлением обычных криопротекторов неживотного происхождения, используемых для замораживания клеточной линии (обычно ДМСО и метилцеллюлоза).
Обычно клетки следует адаптировать для роста в среде, не содержащей экзогенные компоненты животного происхождения, следуя заранее установленной стратегии, включающей несколько культур с понижающимися концентрациями указанных компонентов перед их культивированием в среде, абсолютно не содержащей компоненты экзогенного животного происхождения (Chandler JP., Am Biotechnol Lab 1990, 8, 18-28). Эти стадии адаптации необходимы для обеспечения обычного роста клеток и типичной морфологии клеток.
В настоящее время обнаружили, что способ продуцирования клеток по изобретению не требует каких-либо стадий адаптации перед культивированием клеток в среде, не содержащей компоненты экзогенного животного происхождения, и что отсутствие этой стадии адаптации не влияет на старение клеток. Это является другим преимуществом изобретения. Действительно, обычный рост клеток и типичная морфология клеток поддерживаются на протяжении целого ряда поколений (Удвоений Популяции), необходимых для достижения Уровня Удвоения Популяции (УУП), равного двум третям УУП, при котором наблюдается старение клеток. Предпочтительно обычный рост клеток и типичная морфология клеток поддерживаются на протяжении целого ряда поколений (Удвоений Популяции), необходимых для достижения Уровня Удвоения Популяции (УУП), при котором наблюдается старение клеток. Старение клеток наблюдается при УУП, эквивалентном УУП, который наблюдается при обычных способах с содержанием компонентов животного происхождения. Например, для клеток MRC-5, происходящих из Master Cell Bank (PDL 13) и культивируемых в среде по изобретению, обычный рост клеток и типичная морфология клеток поддерживаются на протяжении более чем 50 поколений (Удвоений Популяции), после чего наблюдается старение клеток.
Соответственно, в настоящем изобретении также предложена клеточная линия, предпочтительно животная клеточная линия, такая как линия клеток млекопитающих, более предпочтительно линия диплоидных клеток человека, зависимых от культуральной подложки, адаптированная для роста в культуральной среде по изобретению. Под термином “адаптированная” подразумевают, что типичный рост клеток и морфология клеток поддерживаются на протяжении целого ряда поколений, сходного с тем, что наблюдаются при использовании классических сред, содержащих компоненты животного происхождения, или, с другой стороны, что старение не наблюдается значительно раньше, чем старение, наблюдающееся при использовании классических сред. Кроме того, в настоящем изобретении также предложена клеточная линия, предпочтительно животная клеточная линия, например линия клеток млекопитающих, более предпочтительно линия диплоидных клеток человека, зависимых от культуральной подложки, адаптированная для продуцирования биологически активного продукта, предпочтительно вируса, в культуральной среде по изобретению.
Соответственно, в другом воплощении настоящего изобретения предложен также способ получения культуры диплоидных, зависимых от культуральной подложки клеток животных, таких как млекопитающие или предпочтительно человек, для продуцирования рекомбинантного белка или вируса в культуральной среде по изобретению, включающий пассирование указанной клеточной культуры с протеазой, как определено выше. В частности, клетки, зависимые от культуральной подложки, типично диплоидные клетки, высевают с низкой плотностью в питательной среде, по существу не содержащей экзогенные компоненты животного происхождения, и после того, как они размножились с образованием конфлуэнтного слоя или мультислоя, их открепляют с образованием суспензии и вновь пересевают с низкой плотностью. Предпочтительно протеаза, используемая для открепления и пересева клеток, имеющая неживотное происхождение или рекомбинантное происхождение, выбрана из группы, состоящей из: цистеиновой эндопептидазы, нейтральной грибковой протеазы, нейтральной бактериальной протеазы или трипсиноподобной протеазы. Подходящими протеазами являются трипсиноподобная протеаза, такая как Trypzean, или рекомбинантный трипсин, такой как rProtease, или цистеиновая эндопептидаза, более предпочтительно фицин, бромелаин стеблей и актинидин. Среди цистеиновых протеаз особенно предпочтительным является фицин.
В предпочтительном воплощении изобретение относится к способу продуцирования вирусов в зависимых от культуральной подложки клетках животных, таких как млекопитающие или предпочтительно человек, предпочтительно диплоидных клетках, в клеточной культуральной среде по изобретению:
а) заражение клеток вирусом,
б) размножение вирусов, и
в) сбор вирусов.
Возможно собранный вирус подвергают одной или более чем одной стадии очистки. В еще одном аспекте настоящего изобретения предложен вирус, продуцируемый, как здесь описано и сформулировано, в виде иммунногенной композиции, такой как вакцина, в смеси с фармацевтически приемлемым носителем, эксципиентом и/или адъювантом.
В зависимости от типа клеток и от эффективности способа продуцирования вируса, которую нужно достичь, специалист поймет, что культуральная среда, используемая для посева клеток на стадии (а), может быть либо свежей средой, либо кондиционированной средой, происходящей от предыдущей культуры, либо смесью свежей и кондиционированной среды. Предпочтительно для оптимального продуцирования вируса соотношение между свежей культуральной средой и кондиционированной культуральной средой варьирует от 1:0 (100% свежей среды) до 0:1 (100% кондиционированной среды). Кондиционированная среда предпочтительно составляет от 0 до примерно 75% общего объема среды. Предпочтительным соотношением между свежей культуральной средой и кондиционированной культуральной средой является 1:1 (50% свежей/50% кондиционированной), еще более предпочтительным - примерно 7:1 (87,5% свежей/12,5% кондиционированной) и наиболее предпочтительным - примерно 3:1 (75% свежей/25% кондиционированной). Соотношение между свежей культуральной средой и кондиционированной культуральной средой 1:0 (100% свежей среды) является особенно предпочтительным. Среда, используемая для заражения клеток и размножения вируса, может быть идентична культуральной ростовой среде, более предпочтительно она содержит 25% масс./об. EGF, 25% масс./об. bFGF и 25% масс./об. Т3, кроме того возможно дополнена 20% масс./об. белкового гидролизата, предпочтительно пшеничного пептона Е1 (Organotechnie SA, Франция). Еще более предпочтительной является среда, которая не содержит никакого белкового гидролизата.
Способ продуцирования вирусов можно лучше понять из стадий, проиллюстрированных в Примере III.
Кратко, на первой стадии, для заражения вирусом, клетки, зависимые от культуральной подложки, культивируемые согласно способу и в среде по изобретению, заражают подходящим вирусом с той же множественностью заражения, что и множественность заражения, применяемая в обычных способах, используемых для продуцирования вирусов. На второй стадии, для размножения вируса, инфицированные клетки инкубируют при той же температуре и в той же атмосфере, которые стандартно применяют в обычных способах, используемых для продуцирования вирусов. На третьей стадии вирус собирают через такое же время размножения, что и в обычных способах, используемых для продуцирования вирусов. Способ сбора вируса соответствует способу, стандартно применяемому в способах сбора вирусов. Об общих условиях культивирования, применяемых для продуцирования вирусов, см. способ культивирования вируса гепатита A (WO 95/24468), вирусных вакцин против гепатита А (WO 94/06446; A. Hagen J., 2000, Bioprocess Engineering 23, 439-449).
Примеры вирусов и вирусных вакцин для человека, которые могут быть получены с использованием среды и способа по настоящему изобретению, включают живые, аттенуированные, инактивированные, рекомбинантные модифицированные вирусы. В частности, аттенуированные вирусы для применения в качестве вакцины, которые можно размножать на клетках, зависимых от культуральной подложки, включают, но не ограничиваются этим: аденовирусы (т.е. аденовирус 1-49), герпесвирусы (т.е. герпесвирус HSV, цитомегаловирус CMV, вирус ветряной оспы VZV, вируса Эпштейна-Барра EBV), флавивирусы (т.е. вирус денге, вирус гепатита С HEV, вирус японского энцефалита, вирус желтой лихорадки), поксвирусы (т.е. вирус оспы коров, вирус оспы обезьян, вирус осповакцины, вирус натуральной оспы), пикорнавирусы (т.е. эховирус, коксакивирусы, вирус гепатита А, полиовирусы, риновирусы), реовирусы (т.е. ротавирус, вирус колорадской клещевой лихорадки), тогавирусы (т.е. вирус восточного конского энцефалита, вирус краснухи), гепаднавирусы (т.е. вирус гепатита В), ретровирусы (т.е. вирусы иммуннодефицита HIV/SIV), парамиксовирусы (т.е. вирус кори, вирус эпидемического паротита, вирусы парагриппа, респираторно-синцитиальный вирус RSV), рабдовирусы (т.е. вирус бешенства, вирус везикулярного стоматита), ортомиксовирусы (т.е. вирусы гриппа), неклассифицированные вирусы (т.е. вирус гепатита Е, вирус гепатита дельта), астровирусы (т.е. астровирус), коронавирусы (т.е. коронавирус), аренавирусы (т.е. вирус Хунин (Junin)), буньявирусы (т.е. вирус лихорадки долины Рифт). В другом воплощении продуцирование вирусных вакцин с использованием способа по изобретению включает продуцирование рекомбинантных белков, экспрессируемых в прикрепленных клетках. Предпочтительные клетки, зависимые от культуральной подложки, включают, например, AGMK, VERO, MDCK (эпителиальные клетки почек собаки), CEF (цыпленок, эмбриональный фибробласт) и СНО (клетки яичника китайского хомячка) клетки, а особенно предпочтительными клетками являются диплоидные клетки, зависимые от культуральной подложки, такие как, например, MRC-5, WI-38, TIG-1, TIG-7, FRhL-2, MRC-9, IMR-90 и IMR 91. MRC-5 является особенно предпочтительной клеточной линией. Способ по изобретению оказался успешным для продуцирования вируса гепатита А, вируса эпидемического паротита и VZV.
Согласно предпочтительному аспекту изобретения предпочтительными являются клетки, зараженные любым из следующих вирусов: гепатита, особенно HAV, полиовирус, HSV, особенно HSV-1 и HSV-2, CMV, EBV, вирус краснухи, парамиксовирусы (т.е. вирус кори, вирус эпидемического паротита, вирусы парагриппа, респираторно-синцитиальный вирус RSV), VZV.
В среднем для создания основного клеточного банка требуется 15 поколений, а для создания рабочего клеточного банка требуется 10 поколений. По меньшей мере приблизительно 15 поколений требуется для создания средней периодической культуры в объеме 400 л. Начиная с линии клеток, зависимых от культуральной подложки, и используя среду по изобретению, можно следовать тому же плану получения главного банка клеток (ГБК) с примерно 15 поколениями и рабочего банка клеток (РБК) с примерно 10 поколениями, и, следовательно, культуры с примерно 15 поколениями при условиях, разработанных со средой, не содержащей экзогенные компоненты животного происхождения.
Настоящее изобретение также предполагает применение культуральной среды, как описано здесь выше, для культивирования клеток, предпочтительно диплоидных, зависимых от культуральной подложки клеток, более предпочтительно эукариотических клеток, наиболее предпочтительно клеток животных, таких как млекопитающие или предпочтительно человек. Целью изобретения также является получение клеточной культуры, которая содержит культуральную среду по изобретению и клетки, предпочтительно диплоидные, зависимые от культуральной подложки клетки, более предпочтительно эукариотические клетки, наиболее предпочтительно клетки животных, таких как млекопитающие или предпочтительно человек.
Настоящее изобретение, кроме того, относится к популяции вируса, которую можно получить способом, как здесь определено. Оно дополнительно относится к способу получения вирусной вакцины, включающему смешивание указанной популяции вируса с фармацевтически приемлемым носителем, эксципиентом или адъювантом.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1. Клеточная плотность в тесте на старение клеток MRC-5 с использованием протеаз фицина и бромелаина для открепления клеток и с использованием среды, как определено в Примере I.1.
Фиг.2. Жизнеспособность клеток в тесте на старение клеток MRC-5 с использованием протеаз фицина и бромелаина для открепления клеток и с использованием среды, как определено в Примере I.1.
Фиг.3. Рост клеток в тесте на старение клеток MRC-5 с использованием протеаз фицина и бромелаина для открепления клеток и с использованием среды, как определено в Примере 1.1.
Фиг.4. Сравнение плотности клеток в тесте на старение клеток MRC-5, полученных в среде, как определено в Примере I.1 (отдельные компоненты) и Примере 1.2 (среда ультра-МЕМ с добавками).
Фиг.5. Жизнеспособность клеток в тесте на старение клеток MRC-5, полученных в среде, как определено в Примере I.1 (отдельные компоненты) и Примере 1.2 (среда ультра-МЕМ с добавками).
Фиг.6. Рост клеток в тесте на старение клеток MRC-5, полученных в среде, как определено в Примере I.1 (отдельные компоненты) и Примере I.2 (среда ультра-МЕМ с добавками).
Фиг.7. Продуцирование HAV на клетках MRC-5, размноженных с использованием протеаз фицина и бромелаина для открепления клеток.
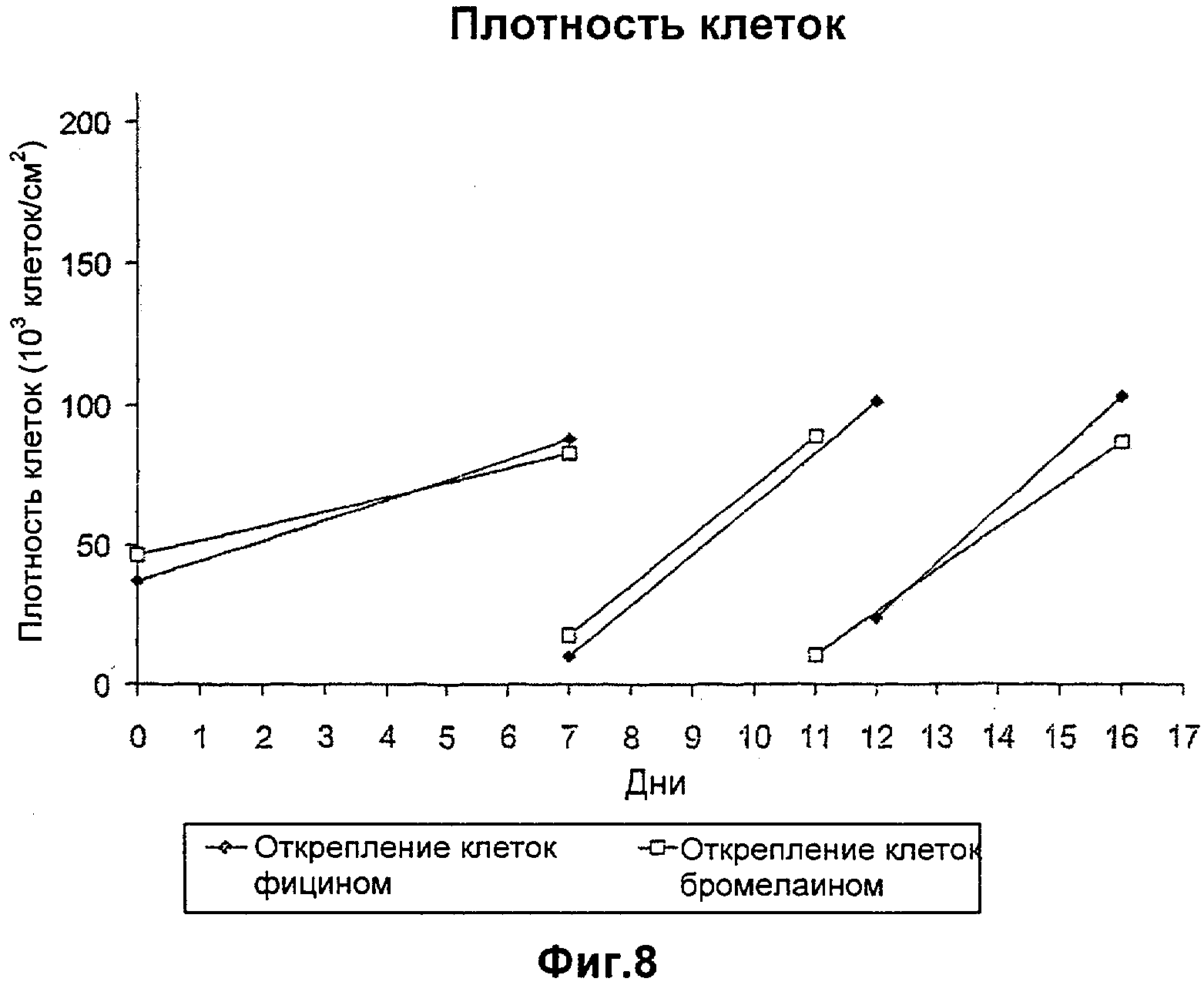
Фиг.8. Плотность клеток при создании банка клеток MRC-5, размноженных с использованием протеаз фицина и бромелаина для открепления клеток.
Фиг.9. Жизнеспособность клеток при создании банка клеток MRC-5, размноженных с использованием протеаз фицина и бромелаина для открепления клеток.
Фиг.10. Рост клеток при создании банка клеток MRC-5, размноженных с использованием протеаз фицина и бромелаина для открепления клеток.
Фиг.11. Плотность клеток при создании банка клеток MRC-5, размноженных с использованием Trypzean (Prodigen) или rProtease (Invitrogen) для открепления клеток.
Фиг.12. Жизнеспособность клеток при создании банка клеток MRC-5, размноженных с использованием Trypzean (Prodigen) или rProtease (Invitrogen) для открепления клеток.
Фиг.13. Рост клеток при создании банка клеток MRC-5, размноженных с использованием Trypzean (Prodigen) или rProtease (Invitrogen) для открепления клеток.
Изобретение будет описано далее с помощью следующих не ограничивающих примеров.
ПРИМЕР I
I.1. Приготовление свежей среды из отдельных компонентов
Примерная полезная свежая культуральная среда содержит все или большинство стандартных ингредиентов, перечисленных в Таблице 3. Согласно изобретению, она может быть соответствующим образом дополнена факторами роста и белковым гидролизатом, как перечислено в таблице 2.
I.2. Приготовление свежей среды из имеющейся в продаже среды с подходящими добавками
Имеющаяся в продаже среда: Ультра-МЕМ кат. №12-745F (среда с пониженным содержанием сыворотки, безбелковая минимальная среда, без L-глутамина) имеется в продаже от BioWhittaker.
Состав минимальной среды не содержит компонентов животного происхождения, но разработан классически и, согласно инструкции производителя, должен быть дополнен небольшим количеством сыворотки (например, менее 10%) и другими добавками (ИТЭС = Инсулин (животного происхождения) + Трансферрин (животного происхождения) + Этаноламин + Селен). Среду использовали в отсутствие рекомендованных добавок животного происхождения (сыворотки и ИТЭС).
В эту среду добавляли следующие ингредиенты, все без компонентов первичного и вторичного животного происхождения:
1. IGF-1: 0,1 мг/л
2. EGF: 0,005 мг/л
3. bFGF: 0,003 мг/л
4. Трийод-L-тиронин (Т3): 0,066 мг/л
5. Пшеничный пептон Е1: 2,5 г/л и, кроме того
6. Железофруктоза: 0,1667 мл/л
7. Пируват натрия: 0,055 г/л.
Для оптимизации способа культивирования, осуществляемого в отсутствие компонентов животного происхождения, добавляли также следующие ингредиенты:
- Глутамин: 0,2922 г/л
- Глюкоза: 0,33 г/л
- Селен (Na2SeO3): 0,01 мг/л.
- Этаноламин: 0,0006 мкл/л
Клетки MRC-5 из банка клеток (PDL 21), не содержащего животных компонентов, оттаивали и культивировали согласно способу, раскрытому в Примере II и IV, с использованием среды, описанной выше, и следующую схему субкультивирования:
- Д7: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д12: инокуляция клеток в соотношении 1/4 в 100 мл ростовой среды, состоящей из 25% кондиционированной среды;
- Д16: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д21: повторение схемы, начиная с Д7.
Клетки культивировали в 175 см2 Т-флаконах до тех пор, пока не состарятся, (±УУП 65) в течение ±3 месяцев (например, 80 дней). В этой методике клеточный инокулят не фиксирован на целевой плотности клеток. Подсчеты клеток, выполненные для контроля, показывают, что плотности клеточного инокулята перед тем, как наблюдается старение, заключены в пределах от 9000 клеток/см2 до 40000 клеток/см2. Клетки MRC-5 достигали УУП66 после 81 дня культивирования со скоростью роста 0,57 УУП/день, после чего наблюдали старение. Эти результаты, проиллюстрированные на Фиг.4, 5 и 6, эквивалентны результатам, которые наблюдают со средой, приготовленной из отдельных компонентов, как проиллюстрировано в разделе 1.2, которая приводит к старению примерно при УУП 65 после 81 дня и скорости роста клеток примерно 0,56 УУП.
Параллельно клетки, происходящие из этой культуры, используют для продуцирования HAV (вирус гепатита А) согласно способу, описанному в Примере III, с использованием той же среды, как описано здесь выше, за исключением того, что концентрации EGF, bFGF и Т3 снижены до 25% от концентрации, присутствующей в культуральной среде для роста клеток, и за исключением того, что концентрация пшеничного пептона снижена до 0,5 г/л. Сбор вируса проводят через 2 месяца после начала культивирования.
ПРИМЕР II
Способ получения зависимых от культуральной подложки клеток животных или человека в культуральной среде, по существу не содержащей каких-либо компонентов животного происхождения
Стадия 1: Открепление клеток
Культуральную среду от культуры клеток, зависимых от культуральной подложки, выращенных во флаконе для клеточных культур, удаляют и хранят в стерильном контейнере. Эта собранная среда рассматривается в качестве кондиционированной среды и будет использоваться для инокуляции клеток. Клеточный слой дважды промывают фосфатно-солевым буфером (ФСБ) с добавлением ЭДТА. Желательно достичь концентрации от примерно 0,04 г до примерно 1 грамм ЭДТА на литр ФСБ, а предпочтительно примерно 0,2 г/л.
Сразу после промывки клеточного слоя добавляют достаточный объем раствора протеазы, так чтобы покрыть весь клеточный слой. Желательно достигать объема от примерно 0,01 мл/см2 до 2 мл/см2, а предпочтительно 0,0333 мл/см2. Этот раствор протеазы готовят путем растворения фермента в ФСБ с добавлением ЭДТА. Желательно достигать концентрации от примерно 0,02 г до примерно 0,5 грамма ЭДТА на литр ФСБ, а предпочтительно примерно 0,1 г/л. Количество протеазы, добавленной в ФСБ/ЭДТА, представляет собой количество, необходимое для получения раствора с достаточной для эффективного открепления клеток протеолитической активностью. Открепление клеток считают эффективным, когда большинство клеток открепляется от флакона и когда клеточные агрегаты диссоциируют на обособленные клетки после желательного запланированного времени, составляющего от примерно 5 мин до примерно 30 мин, а предпочтительно примерно 12 мин. Ферментативные активности некоторых протеаз, которые могут быть использованы с клетками, зависимыми от культуральной подложки, даны для примера в следующем списке, но не ограничиваются им:
- Желательная целевая ферментативная активность фицина составляет от примерно 5,5 mкUPABA/мл до примерно 550 mкUPABA/мл, а предпочтительно примерно 55 mкUPABA/мл (одна единица РАВА представляет собой активность фермента, которая гидролизует 1 мкмоль Na-бензоил-DL-аргинин-п-нитроанилина/мин при 37°С (Methods in Enzymology Vol XIX Proteolytic enzymes p.261-284).
- Желательная целевая ферментативная активность бромелаина составляет от примерно 0,001 единицы переваривания желатина (Gelatin Digested Unit) (GDU)/ivm (Gelatin Digested Units, GDU) до примерно 0,1 GDU/мл, а предпочтительно примерно 0,01 GDU/мл (одна единица GDU активности представляет собой активность фермента, которая освобождает 1 мг аминокислот из определенного желатинового субстрата в условиях анализа (та же ссылка, что и выше).
- Желательная целевая ферментативная активность нейтральной грибковой протеазы из A.oryzae соответствует количеству белка примерно 12,5 мкг/мл (от 1,25 мкг/мл до примерно 125 мкг/мл, а предпочтительно примерно 12,5 мкг/мл) (согласно производителю, Lyven Zac Normandial, 11 avenue du Pays de Caen 14460 Colombelles, France).
- Желательная целевая ферментативная активность нейтральной бактериальной протеазы из В.subtilis соответствует количеству белка примерно 150 мкг/мл (от 15 мкг/мл до примерно 1,5 мг/мл, а предпочтительно примерно 150 мкг/мл) (согласно производителю, Lyven Zac Normandial, 11 avenue du Pays de Caen 14460 Colombelles, France).
- Желательная целевая ферментативная активность Trypzean составляет от примерно 100 USP/мл до 0,1 USP/мл, а предпочтительно 1 USP/мл (согласно производителю Prodigen, 101 Gateway Blvd, Suite 100 College Station, Texas 77845. Код производителя: TRY).
- Желательное целевое разведение исходного раствора rProtease составляет от примерно 3 до 300 раз, а предпочтительно 30 раз (согласно поставщику Invitrogen, 3175 Staley Road, Grand Island, NY 14072. Номер по каталогу поставщика 02-106).
Когда наблюдают открепление клеток, флакон легко встряхивают, а суспензию клеток собирают в стерильный контейнер. Для того чтобы получить максимальное количество клеток, флакон осторожно промывают свежей культуральной средой, которую собирают в тот же стерильный контейнер. Затем клеточная суспензия готова для стадии инокуляции клеток или стадии создания клеточного банка.
Стадия 2: Инокуляция клеток
Клетки, зависимые от культуральной подложки, полученные после открепления клеток, как описано на стадии 1, могут быть инокулированы в новые флаконы согласно этим инструкциям:
- Клетки инокулируют с той же плотностью клеток, которую используют в обычных способах культивирования клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, клетки MRC-5 инокулируют с целевой плотностью клеток от примерно 5000 клеток/см2 до примерно 40000
клеток/см2, а предпочтительно от 7500 клеток/см2 до 25000 клеток/см2.
- Объем ростовой среды, добавленной во флакон после инокуляции клеток, является таким же, как и объем, добавляемый в обычных способах культивирования клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Ростовая среда состоит из смеси свежей культуральной среды и кондиционированной среды. Кондиционированная среда представляет собой клеточную культуральную среду, собранную в начале стадии открепления клеток (см. стадию 1). Количество кондиционированной среды, добавленной к свежей среде, зависит от инокулируемой клеточной линии. Желательным целевым количеством обычно является от 0% до примерно 75% кондиционированной среды. В качестве примера для культуры клеток MRC-5 предпочтительное желательное целевое количество кондиционированной среды составляет от примерно 10% до примерно 35%, а предпочтительное желательное целевое количество культуральной среды, добавленной во флаконы, составляет от примерно 0,025 мл/см2 до примерно 3 мл/см2.
Стадия 3: Рост клеток
Зависимые от культуральной подложки клетки, инокулируемые во флаконы для клеточных культур, инкубируют при тех же температурах, которые используют в обычных способах культивирования клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, желательная целевая температура для инкубации клеток MRC-5 составляет от примерно 30°С до примерно 40°С, а предпочтительно 37°С.
Зависимые от культуральной подложки клетки, инокулируемые во флаконы для клеточных культур, инкубируют в тех же атмосферах, которые используют в обычных способах культивирования клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, клетки MRC-5 можно инкубировать с или без контроля СO2 и с или без контроля относительной влажности.
Стадия 4: Создание клеточного банка
Зависимые от культуральной подложки клетки, полученные после открепления клеток, описанного на стадии 1, можно заморозить для создания клеточного банка, следуя тем же методикам, которые применяются в обычных способах для культур клеток, зависимых от культуральной подложки, с компонентами животного происхождения, за исключением следующих деталей:
Клетки должны быть заморожены в среде, не содержащей компоненты животного происхождения, дополненной теми же криопротекторными добавками без компонентов животного происхождения, которые (добавки) используются в обычных способах замораживания клеток, зависимых от культуральной подложки, в присутствии компонентов животного происхождения. Например, клетки MRC-5 замораживают в среде, не содержащей компоненты животного происхождения, с добавлением желательного целевого количества ДМСО от примерно 2,5% до примерно 12,5% и желательного целевого количества метилцеллюлозы от примерно 0,01% до примерно 1%.
ПРИМЕР III
Способ продуцирования вирусов в зависимых от культуральной подложки клетках животных или человека в культуральной среде.
Стадия 5: Заражение вирусом
Клетки, зависимые от культуральной подложки, заражают с той же множественностью заражения (MOI) (Multiplicity Of Infection), что и MOI, применяемая в обычных способах для культур клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, желательная целевая MOI для заражения клеток MRC-5 вирусом гепатита A (HAV) составляет от примерно 0,005 до примерно 1. Клетки заражают в среде, не содержащей компоненты животного происхождения, как здесь описано, с добавлением ингредиентов согласно Таблице 2. Для продуцирования вирусов белковый гидролизат является возможным.
Стадия 6: Размножение вируса
Зараженные клетки, зависимые от культуральной подложки, инкубируют при тех же температурах, которые используются в обычных способах для размножения вирусов на культурах клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, желательная целевая температура для размножения HAV на клетках MRC-5 составляет от примерно 31°С до примерно 33°С, а предпочтительно 32°С. Зараженные клетки, зависимые от культуральной подложки, инкубируют в тех же атмосферах, которые применяются в обычных способах для размножения вирусов на культурах клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, клетки MRC-5, зараженные HAV,
можно инкубировать с или без контроля СO2 и с или без контроля относительной влажности.
Стадия 7: Сбор вируса
Время размножения вируса от заражения вирусом клеток, зависимых от культуральной подложки, до сбора вируса является тем же, что и время, используемое в обычных способах для размножения вирусов на культурах клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, размножение HAV на клетках MRC-5 достигается примерно к 21-29 дню после заражения вирусом.
Способ сбора вируса является таким же, как и способ, применяемый в обычных способах сбора вирусов в культурах клеток, зависимых от культуральной подложки, с компонентами животного происхождения. Например, сбор HAV, продуцируемого на клетках MRC-5, начинается с двух промывок клеточного слоя с помощью ФСБ, после чего вирус выделяют путем открепления клеток с использованием ФСБ, дополненного от 0,1 до 1 г/л ЭДТА и затем лизиса клеток путем замораживания.
ПРИМЕР IV
Культивирование клеток MRC-5 до тех пор, пока не состарятся, с использованием протеазы фицина для открепления клеток (см. фиг.1, 2 и 3)
Метод тестирования старения клеток MRC-5 в малых масштабах требует повторения способа получения клеток при помощи способа без использования компонентов животного происхождения, описанного на стадиях 1-3, до тех пор, пока не будут наблюдать старение. Клетки MRC-5, происходящие из банка клеток PDL 21, без компонентов животного происхождения, оттаивают, инокулируют во флакон Nunc T175 см2 с 100 мл свежей среды, соответствующим образом дополненной, как описано в Таблице 2, и инкубируют при 37°С. Через семь дней проводят пересев (см. стадии 1-3) во флаконе Nunc T-175 см2 при 37°С, используя 4,2 мл раствора фицина с ферментативной активностью 45 мкUPABA/мл для открепления клеток. Пересев проводят согласно следующей схеме:
- Д7: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д12: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д17: инокуляция клеток в соотношении 1/4 в 100 мл ростовой среды, состоящей из 25% кондиционированной среды;
- Д21: повторение схемы, начиная сД7.
В этой методике клеточный инокулят не фиксирован относительно целевой плотности клеток. Подсчеты клеток, выполненные для контроля, показывают, что плотности клеточного инокулята варьируют от 8000 клеток/см2до 33000 клеток/см2. Клетки MRC-5 достигали Уровня Удвоения Популяции 71 через 90 дней культивирования со скоростью роста клеток 0,56 УУП/день, после чего наблюдали старение. Эти результаты, проиллюстрированные на Фиг.1, 2 и 3, эквивалентны тем, которые наблюдают в методике с использованием свиного трипсина для открепления клеток и бычьей сывороткой (старение при УУП около 65 через 83 дня и скорости роста клеток около 0,55 УУП/день (Wistrom С, Villeponteau. В. Exp.Gerontol, 1990; 25(2): 97-105)).
ПРИМЕР V
Культивирование клеток MRC-5 вплоть до тех пор, пока не состарятся, с использованием протеазы бромелаина для открепления клеток (см. фиг.1, 2 и 3)
Этот способ сходен со способом, раскрытым в Примере III, за исключением следующих деталей:
- раствор бромелаина с ферментативной активностью 0,01105 Единиц Переваривания Желатина (GDU)/мл используют для открепления клеток вместо раствора фицина.
- пересев проводят согласно следующей схеме:
- Д7: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д12: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д17: инокуляция клеток в соотношении 1/4 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д21: повторение схемы, начиная сД7.
Подсчеты клеток, выполненные для контроля, показывают, что плотности клеточного инокулята варьируют от 8000 клеток/см2 до 33000 клеток/см2. Клетки MRC-5 достигали Уровня Удвоения Популяции 67 после 82 дней культивирования со скоростью роста 0,56 УУП/день, после чего наблюдали старение. Эти результаты, проиллюстрированные на Фиг.1, 2 и 3, эквивалентны результатам, которые наблюдают при использовании методики со свиным трипсином для открепления клеток и бычьей сывороткой (старение при УУП 65 после 83 дней и скорость роста клеток равна 0,55 УУП/день (Wistrom С, Villeponteau. В. Exp. Gerontol, 1990; 25(2): 97-105)).
ПРИМЕР VI
Продуцирование HAV на клетках MRC-5, размноженных с использованием протеазы фицина для открепления клеток (см. фиг.7)
Продуцирование HAV в клеточных фабриках (КФ) Nunc с клетками MRC-5, культивируемыми с использованием протеазы фицина для открепления клеток, требует выполнения способа, описанного на стадиях 5-7 Примера II. Клетки MRC-5, происходящие из клеточного банка (с УУП 21) без компонентов животного происхождения, размножают во флаконе Nunc T175 см2, затем в КФ до достижения Уровня Удвоения Популяции 36 с использованием способа, описанного на стадиях 1-3 Примера I (фиг.7). Клетки MRC-5 заражают исходным посевом HAV, приготовленным в среде, описанной в Таблице 2, с целевой MOI 0,01. После заражения клетки инкубируют при 32°С в течение 27 дней с 3 сменами среды после 7, 14 и 21 дня (фиг.7). Сбор HAV осуществляют через 27 дней после заражения, начиная с двух промывок клеточного слоя с помощью ФСБ, затем открепляя клетки при помощи ФСБ с добавлением примерно 0,2 г/л ЭДТА, и, наконец, замораживая клетки. Антигенные титры массы HAV, полученной при использовании этой методики, варьируют от 250 до 350 единиц E.L.I.S.A (ELU, enzyme-linked immunosorbent units)/0,1 мл. Эти результаты эквивалентны результатам, которые наблюдают при использовании методики со свиным трипсином для открепления клеток и бычьей сывороткой (антигенные титры массы HAV составляют примерно 250 ELU/0,1 мл).
ПРИМЕР VII
Продуцирование HAV на клетках MRC-5, размноженных с использованием протеазы бромелаина для открепления клеток (см. фиг.7)
Этот способ аналогичен способу, раскрытому в Примере V, за исключением того, что для открепления клеток используют раствор бромелаина с ферментативной активностью 0,01105 Единиц Переваривания Желатина (GDU)/мл, вместо раствора фицина.
Антигенные титры массы HAV, полученной с использованием этой методики, варьируют от 250 до 350 единиц E.L.I.S.A (ELU)/0,1 мл. Эти результаты эквивалентны результатам, которые наблюдают при использовании методики со свиным трипсином для открепления клеток и бычьей сывороткой (титр массы HAV равен примерно 250 ELU/0,1 мл).
ПРИМЕР VIII
Создание банка клеток MRC-5, размноженных с использованием протеазы фицина для открепления клеток (см. фиг.8, 9 и 10)
Методика создания банка клеток MRC-5, размноженных с использованием фицина, требует повторения способа получения клеток при помощи способа без компонентов животного происхождения, описанного на стадиях 1-3 Примера I, до достижения выбранного УУП (УУП 21). При этом УУП клетки замораживают, следуя способу, описанному на стадии 4 Примера I. Клетки MRC-5, происходящие из клеточного банка (с УУП 14), содержащего сыворотку, оттаивают, инокулируют во флакон Nunc T175 см2 со 100 мл среды, описанной в Таблице 2, и инкубируют при 37°С. Через семь дней осуществляют пересев (см. стадии 1-3) во флаконы Nunc T175 см2 при 37°С с использованием 4,2 мл раствора фицина с ферментативной активностью 45 мкUPABA/мл для открепления клеток. Пересев проводят согласно следующей схеме:
- Д7: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д12: инокуляция клеток в соотношении 1/4 в 100 мл ростовой среды, состоящей из 25% кондиционированной среды;
- Д16: создание клеточного банка с использованием соотношения 1/4.
В этой методике клеточный инокулят не фиксирован на целевой плотности клеток. Результаты подсчета клеток показаны на фиг.8, 9 и 10. Клетки MRC-5 достигали УУП 21 после 16 дней. При этом УУП клетки MRC-5 замораживают в среде, не содержащей компоненты животного происхождения, с добавлением 7,5% ДМСО и 0,1% метилцеллюлозы. После оттаивания эти клетки MRC-5 демонстрируют жизнеспособность и скорость роста, эквивалентные тем, которые наблюдаются перед замораживанием (жизнеспособность около 90-95% и скорость роста клеток более 0,55 УУП/день) (см. фиг.1, 2 и 3). Эти результаты эквивалентны результатам, которые наблюдают при использовании методики со свиным трипсином для открепления клеток и бычьей сывороткой (жизнеспособность около 90-95% и скорость роста клеток равна 0,55 УУП/день (Wistrom С, Villeponteau. В. Ехр. Gerontol, 1990; 25(2); 97-105)).
ПРИМЕР IX
Создание банка клеток MRC-5, размноженных с использованием протеазы бромелаина для открепления клеток (см. фиг.8, 9 и 10)
Этот способ аналогичен способу, раскрытому в Примере VII, за исключением следующих деталей:
- для открепления клеток используют раствор бромелаина с ферментативной активностью 0,01105 Единиц Переваривания Желатина (GDU)/мл вместо раствора фицина;
- пересев проводят согласно следующей схеме:
- Д7: инокуляция клеток в соотношении 1/4 в 100 мл ростовой среды, состоящей из 25% кондиционированной среды;
- Д11: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д16: создание клеточного банка с использованием соотношения 1/4.
Результаты подсчета клеток показаны на фиг.8, 9 и 10. Клетки MRC-5 достигали Уровня Удвоения Популяции 21 после 16 дней. После оттаивания эти клетки MRC-5 демонстрируют жизнеспособность и скорость роста, эквивалентные тем, которые наблюдаются перед замораживанием (жизнеспособность около 90-95% и скорость роста клеток более 0,55 УУП/день) (см. фиг.1, 2 и 3). Эти результаты эквивалентны результатам, которые наблюдают при использовании методики со свиным трипсином для открепления клеток и бычьей сывороткой (жизнеспособность около 90-95% и скорость роста клеток равна 0,55 УУП/день (Wistrom С, Villeponteau. В. Ехр. Gerontol, 1990; 25(2): 97-105)).
ПРИМЕР X
Культивирование клеток MRC-5 до тех пор, пока не состарятся, с использованием Trypzean (Prodigen) или rProtease (Invitrogen) для открепления клеток
Методику тестирования старения клеток MRC-5 выполняют в малом масштабе, включая повторение способа получения клеток при помощи способа без компонентов животного происхождения, описанного на стадиях 1-3 Примера II, до тех пор, пока не наблюдают старения. Клетки MRC-5 из клеточной культуры с УУП около 27, не содержащей компоненты животного происхождения, размножают в Nunc T175 см2 с использованием раствора Trypzean с активностью 1 USP/мл или с использованием раствора rProtease (Invitrogen) (исходный раствор разведен в 30 раз в ФСБ с добавлением ЭДТА, как использовано для открепления клеток, см. стадию 1 Примера II) согласно следующей схеме:
- Д0: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д5: инокуляция клеток в соотношении 1/4 в 100 мл ростовой среды, состоящей из 25% кондиционированной среды;
- Д9: инокуляция клеток в соотношении 1/8 в 100 мл ростовой среды, состоящей из 12,5% кондиционированной среды;
- Д14: повторение схемы, начиная с Д0.
В этой методике клеточный инокулят не фиксирован на целевой плотности клеток. Подсчеты клеток, выполненные для контрольного образца, показывают, что плотности клеточного инокулята варьируют от 8000 клеток/см2до 30000 клеток/см2. Клетки MRC-5 достигли УУП более 60 после 61 дня культивирования со скоростью роста клеток примерно 0,56 УУП/день, после чего наблюдали старение. Эти результаты, проиллюстрированные на фиг.11, 12 и 13, эквивалентны результатам, которые наблюдают при использовании методики со свиным трипсином для открепления клеток и бычьей сывороткой (старение при УУП около 65 после 83 дней и скорость роста клеток около 0,55 УУП/день (Wistrom С, Villeponteau. В. Exp.Gerontol, 1990; 25(2): 97-105)).
Реферат
Изобретение относится к области биотехнологии. Предложена культуральная среда для культивирования зависимых от подложки клеток животных, которая не содержит экзогенные компоненты первичного и вторичного животного происхождения. Также предложен способ получения зависимых от подложки клеток животных на данной среде, и способ продуцирования вируса в указанных клетках. Изобретение может быть использовано для получения вирусов, вирусных вакцин и тому подобного. 5 н. и 20 з.п. ф-лы, 13 ил., 3 табл.
Формула
1) по меньшей мере один экзогенный фактор роста неживотного вторичного происхождения, выбранный из: EGF (эпидермального фактора роста), FGF (фактора роста фибробластов), трийод-L-тиронина и гидрокортизона;
2) по меньшей мере один IGF-1 (инсулиноподобный фактор роста 1) и/или инсулин неживотного вторичного происхождения и
3) белковый гидролизат неживотного происхождения.
а) высевают указанные клетки в клеточную культуральную среду, как определено в п.1 или 2, и дают возможность клеткам прикрепиться к субстрату;
б) осуществляют сбор кондиционированной среды, образующейся на стадии (а), и открепление клеточного слоя от его субстрата и диссоциацию клеток протеазой неживотного происхождения, получая таким образом клеточную суспензию;
в) инокулируют в культуральную среду, как определено в п.1 или 2, клеточную суспензию со стадии (б) в устройстве для культивирования, включающем адгезивную подложку, обеспечивающую прикрепление клеток; и
г) выращивают клетки в указанной культуральной среде.
1) высевают зависимые от подложки клетки животных в культуральную среду, как определено в п.1 или 2, и дают возможность клеткам прикрепиться к субстрату; и
2) открепляют клетки от субстрата и диссоциируют клетки протеазой неживотного происхождения.
а) заражение клеток вирусами,
б) размножение вирусов и
в) сбор вирусов.

Комментарии