Новые противовирусные пептиды, которые предотвращают связывание вируса с dlc8 - RU2503686C2
Код документа: RU2503686C2
Чертежи














Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Это изобретение относится к области техники, связанной с разработкой новых противовирусных соединений, и к их применению для профилактики или лечения вирусных инфекций у животных или человека.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Вирусы являются внутриклеточными паразитами, которым необходима сохранность определенных клеточных функций, чтобы их репликативный цикл в клетках мог быть успешно выполнен. Было показано, что динеин играет соответствующую роль на различных этапах вирусной инфекции у различных вирусных моделей, таких как вирус бешенства, вирус простого герпеса человека типа I или вирус иммунодефицита человека. Динеин является двигательным белком микротрубочек, который вступает в процесс внутриклеточного транспорта, связанного с микротрубочками и эндосомальным каскадом реакций, а также является модулятором различных путей передачи внутриклеточных сигналов, наряду с другими функциями. Вирусы используют динеин для своего поглощения клеткой и внутриклеточного транспорта, для формирования вирусной фабрики, где будут производиться новые вирионы, и для регуляции клеточной сигнализации, необходимой для координации этих и других процессов.
В частности, белок p54 вируса африканской чумы свиней (ASFV) взаимодействует с клеточным белком, который является частью двигательного комплекса микротрубочек, называемым динеином, а его функция в основном связана с внутриклеточным транспортом [1]. Это взаимодействие было обнаружено с помощью двойной гибридной системы в дрожжах (гетерологичной системе) при поиске в библиотеке кДНК макрофагов свиньи белков-партнеров для белков, возможно взаимодействующих с вирусным белком p54. Кодирующая последовательность для p54 (ген E183L) оказалась включена в полную последовательность изолята BA71V, депонированную в базу данных NCBI с номером доступа U18466. Клоны, полученные и идентифицированные как положительные, секвенировали, обнаружив, что они содержат полную кодирующую последовательность легкой цепи динеина массой 8 килодальтон (кДа), называемой DLC8, LC8, DLC1, DNLC1 или PIN (ингибиторный белок нейрональной синтетазы оксида азота). Кодирующая последовательность DLC8 Sus scrofa (свиньи) была депонирована в базе данных NCBI с номером AF436777. Эти результаты были подтверждены с помощью методов другого типа, включая аффинную хроматографию, иммунопреципитацию и колокализацию обоих компонентов с помощью конфокальной микроскопии. Эти результаты только подтвердили взаимодействия между белком p54 ASFV и DLC8.
DLC8 представляет собой белок с аминокислотной и кодирующей ее нуклеотидной последовательностью, высококонсервативной для эволюционно далеких видов (от нематоды до человека) [2, 3]. Цитоплазматические динеины представляют собой семейство молекулярных двигателей, которые прикладывают различные усилия по всей длине микротрубочек. Они отвечают за транспорт везикул, эндосом и органелл с периферии клетки внутрь, к ядерной или перинуклеарной зоне. Они представляют собой большие многобелковые комплексы, составленные из тяжелых цепей, числом от одной до трех, с глобулярной головной частью и АТФазной активностью, которые отвечают за генерацию необходимой энергии для производства движения. С этими тяжелыми цепями связано переменное число промежуточных цепей и легких цепей. Последние ответственны за непосредственное взаимодействие, создавая усилие при транспорте. На сегодняшний день были описаны семь семейств легких цепей, среди которых мы можем найти DLC8. DLC8 используется in vivo в качестве переключателя, что допускает существование двух идентичных мест связывания различных последовательностей у обоих мономеров.
Что касается клеточного белка, для DLC8 были обнаружены два вида предпочтительных сайтов связывания с клеточными белками, с которыми они взаимодействуют [12, 13]. Один из фрагментов, (Lys/Arg)XThrThr (где X может являться любой аминокислотой), связывает DLC8 с рядом молекул, таких как промежуточная цепь динеина, проапоптотическая молекула Bim, Kid1 и факторы транскрипции Сваллоу, а также некоторые вирусные белки различного происхождения. Этот сайт связывания расположен между двумя димерами молекул DLC8. Второй фрагмент представляет собой: Gly(Ile/Val)GlnValAsp, который связывает DLC8 с нейрональной синтетазой оксида азота (nNOS) или с нейрональным каркасным белком, как это описано на настоящий момент.
Чтобы определить аминокислотные остатки, необходимые для связывания вирусного белка с динеином, были экспрессированы несколько усеченных фрагментов белка p54 и испытаны в дрожжевой системе, определив, что зона связывания с DLC8 находится на карбокситерминальном конце белка p54 внутри 13 аминокислотных остатков, находящихся между Tyr149 и Thr161 (TyrThrThrThrValThrThrGlnAsnThrAlaSerGlnThr) [1].
Некоторые вирусы используют легкую цепь динеина (DLC8) на различных стадиях своего инфекционного цикла внутри клетки-хозяина. С помощью метода, называемого пеп-скан, пептиды, имитирующие линейные последовательности различных белков вирусного происхождения, синтезировали, переносили блоттингом на фильтровальную бумагу и проверяли с помощью DLC8, чтобы определить, которые из линейных последовательностей являются пригодными для такого взаимодействия [10]. Линейные последовательности, которые приводятся ниже, теоретически были бы пригодны для связывания DLC8. Они часто содержат остатки Gln (Q), часто с остатками T (Thr), соседними по последовательности:
- фрагмент TyrAlaSerGlnThr из белка p54 вируса африканской чумы свиней;
- фрагмент TyrSerThrGlnThr связывающего гликопротеина респираторно-синцитиального вируса;
- фрагмент LysSerThrGlnThr P-белков вируса бешенства и вируса Мокола, хеликазы вируса простого герпеса человека, протеазы аденовируса или энтомопоксвируса А. moorei;
- фрагмент LysGlnThrGlnThr белков Е4 папилловирусов человека или полимеразы вируса оспы;
- фрагмент LysGlnThrGlnThr гена U19 вируса герпеса человека;
- фрагмент ArgValMetGlnLeu белка капсида вируса Коксаки человека и т.д.
Несмотря на то, что как было установлено, некоторые линейные последовательности вирусных белков теоретически способны связывать DLC8, это не исключает того, что все эти последовательности являются подходящими для взаимодействия в нативной форме белка, либо в виде молекулы интегрированы в двигательный комплекс in vivo. К тому же, не было показано ни того, что эти вирусные последовательности каким-либо образом экспонированы в вирусной частице, ни того, что их предполагаемые сайты связывания в действительности способны связывать DLC8, и/или будто эти вирусные белки синтезируются в клеточных компартментах, доступных для динеина во время инфекции, в таких как цитозоль (не в эндоплазматическом ретикулуме или других изолированных органеллах и структурах). Кроме того, до настоящего времени ни для одной из этих линейных последовательностей не была продемонстрирована способность каким-либо образом блокировать связывание данного белка с DLC8, и, наконец, не существует гарантий, что блокирование этого сайта может привести к подавлению инфекции. В действительности в молекуле DLC8 существуют два предполагаемых сайта связывания, как описано выше, и существует целый ряд других легких и промежуточной цепей, альтернативным образом применимых любым из приведенных вирусов. Таким образом, ничто из этих данных не указывает, что блокирование этого сайта нарушает взаимодействие, ни также того, что это препятствует вирусному заражению, и ничто не гарантирует, что вышеупомянутые последовательности могут быть полезны в качестве противовирусных соединений.
Кроме того, для того чтобы любой пептид мог являться кандидатом для использования в качестве противовирусного, он должен тем или иным способом на должном уровне добираться до внутриклеточной среды, а также должен обеспечивать нулевой или очень низкий уровень токсичности в живых клетках. Тот факт, что аминокислотные последовательности могут быть идентифицированы как участвующие в связывании вирусных белков с DLC8, когда эти последовательности остаются на уровне первичной (линейной) структуры, не исключает, что эти линейные последовательности будут ингибировать взаимодействие вирусных белков и DLC8, и, соответственно, пептиды в составе этих аминокислотных последовательностей могут служить в качестве противовирусных соединений. Должны быть проанализированы обе поверхности взаимодействия (например, с помощью их спектров ядерного магнитного резонанса), чтобы сконструировать пептидную последовательность, подходящую для блокировки белок-белковых взаимодействий. Основанием этого служит тот факт, что линейные аминокислотные последовательности, будучи свернутыми в клетке в сложные структуры более высокого порядка, а в качестве примера, - будучи связанными с макромолекулярным комплексом, называемым микротрубочковым двигательным комплексом, - могут прятать аминокислотные остатки, участвующие в связывании либо с DLC8, либо с вирусным белком и, по этой причине, эти пептиды, свернутые во вторичную структуру, не будут показывать никакой противовирусной активности. Кроме того, определенная последовательность, которая in vitro или в такой гетерологичной системе, как дрожжи, должна бы принимать участие в связывании, может и не быть экспонирована в случае вирусных частиц, и/или может быть синтезирована в изолированной органелле или структуре, что делает ее недоступной для клеточного белка при инфекции в клетках млекопитающих. Во всех этих случаях пептид, теоретически способный блокировать взаимодействие, не покажет никакой противовирусной активности. Еще одна причина состоит в том, что линейные пептиды, будучи растворенными в клеточном цитозоле, имеют тенденцию образовывать агрегаты, которые, в свою очередь, снова могут прятать аминокислоты, ответственные за связывание либо с DLC8, либо с вирусными белками. Эти агрегированные пептиды никогда не покажут противовирусных свойств. Другой важный аспект разработки новых противовирусных пептидов относится к их токсичности в неинфицированных клетках. Коммерческое противовирусное вещество должно предотвращать и/или подавлять вирусные инфекции, но, желательно, без ущерба для жизнеспособности клеток и клеточной пролиферации неинфицированных клеток. И последнее, но не менее важное: в данном изобретении было установлено, что аминокислоты, окружающие фрагменты, участвующие в области связывания DLC8 - вирусные белки, и, в частности, их гидрофобность, действительно играют важную роль в способности этих пептидов ингибировать связывание, и они будут рассматриваться как истинные противовирусные соединения. Противовирусные пептиды для достижения эффективного ингибирования связывания вирусных белков с DLC8 должны быть полностью растворены в цитозоле клеток, и, соответственно, гидрофобность и содержание пролина в аминокислотном окружении связывающих фрагментов имеет решающее значение.
По всем этим причинам, необходимо выработать противовирусные стратегии блокирования инфекции указанными вирусами путем встречного воздействия с использованием того факта, что данные вирусы производят клеточный динеин, то есть либо блокировать его функцию, либо сайты связывания, что позволяет различным белкам вирусного происхождения удовлетворительно использовать динеин. Однако, хотя некоторые перекрывающиеся частичные аминокислотные последовательности, присутствующие у этих вирусов, повторяются в виде таких связывающих фрагментов для DLC8, как KSTQT или GIQVD, также важно проверять соседние остатки для оценки того, насколько эффективно будет осуществляться взаимодействие вируса с DLC8. Конкретные изменения этих аминокислот были оценены по их способности прекращать взаимодействие с DLC8.
С помощью вирусной модели (вирус африканской чумы свиней, ASFV) авторы изобретения продемонстрировали, что противодействие системе DLC8-динеин влечет за собой блокирование инфекции, что является основным испытанием для новой противовирусной стратегии, которая составляет предмет настоящего изобретения. Авторы изобретения сравнили домены взаимодействия некоторых белков, участвующих во взаимодействии, и их фланкирующие последовательности, и эта информация была использована для разработки пептидов, выступающих в качестве основных антагонистов взаимодействия пары белков, которые взаимодействуют, но которые, в то же время, так маркированы дополнительной последовательностью, чтобы удовлетворительно достигать внутриклеточной среды и соответствовать всем требованиям, которым должно отвечать противовирусное соединение, главным образом, как было ранее заявлено, это: специфическое ингибирование связывания вирусных белков с DLC8 в определенных условиях, возможность доступа в клеточный цитозоль и растворимость в нем, отсутствие агрегации, а также отсутствие противодействия жизнеспособности клеток и пролиферативному потенциалу (отсутствие цитотоксичности).
В заключение необходимо отметить, что в настоящем изобретении впервые раскрыто применение в качестве противовирусных соединений пептидов, которые были разработаны на основе последовательности (полной или частичной), с помощью которой вирус связывает DLC8 динеина, как необходимый этап успешности инфекции, и было показано, что эти пептиды эффективно ингибируют вирусную инфекцию в чувствительных клетках и обладают очевидным противовирусным эффектом. Ингибирование взаимодействия вирус-DCL8 отражается в ингибировании вирусного цитопатического эффекта и в резком сокращении числа инфицированных клеток. Кроме того, был количественно измерен противовирусный эффект этих соединений, чтобы сравнить их относительные эффективности с помощью количественной ПЦР на примере снижения числа копий вирусных геномов в пересчете на клетку (что отражает сокращение вирусной репликации в нг/мкл, обнаруженное в клетке), а также были определены последовательно значительное снижение производства вирусов и синтеза вирусных белков. Изобретение иллюстрируется пептидами, полученными на основе последовательности p54 различных изолятов ASFV, которые предотвращают прогресс инфекции, служа основанием для проведения противовирусной терапии.
ПОДПИСИ К ФИГУРАМ
Фигура 1. Создание противовирусных пептидов. На основании сравнения анализов последовательностей белка p54 вируса ASFV, присутствующих в различных вирусных изолятах разнородного происхождения, авторы изобретения разработали набор пептидов (таблица 1), включающих консервативный фрагмент, и подбор наиболее подходящих фланкирующих последовательностей из присутствующих в вирусном белке, с учетом вариаций между различными вирусными изолятами.
Фигура 2. ЯМР динамика взаимодействия и дезинтеграции с помощью активного пептида. A. Получение и очистка 15-N меченых DLC8 и p54 для ЯМР-анализа. 1H-15N HSQC-спектры (спектры гетероядерной одноквантовой корреляции) 15N-меченной DLC8 в различных точках титрования: B, свободная DLC8; C, свободная DLC8 (черный спектр) и в присутствии 2 эквивалентов немеченого p54 (серый спектр); D, свободная DLC8 (черный спектр) и в присутствии 5 эквивалентов пептида PS19 (SEQ ID NO: 2) и 2 эквивалентов немеченого p54 (серый спектр); E, свободная DLC8 (черный спектр) в присутствии 5 эквивалентов пептида PS19 и 2 эквивалентов немеченого p54 (серый спектр) и в присутствии 2 эквивалентов немеченого p54 (серый спектр).
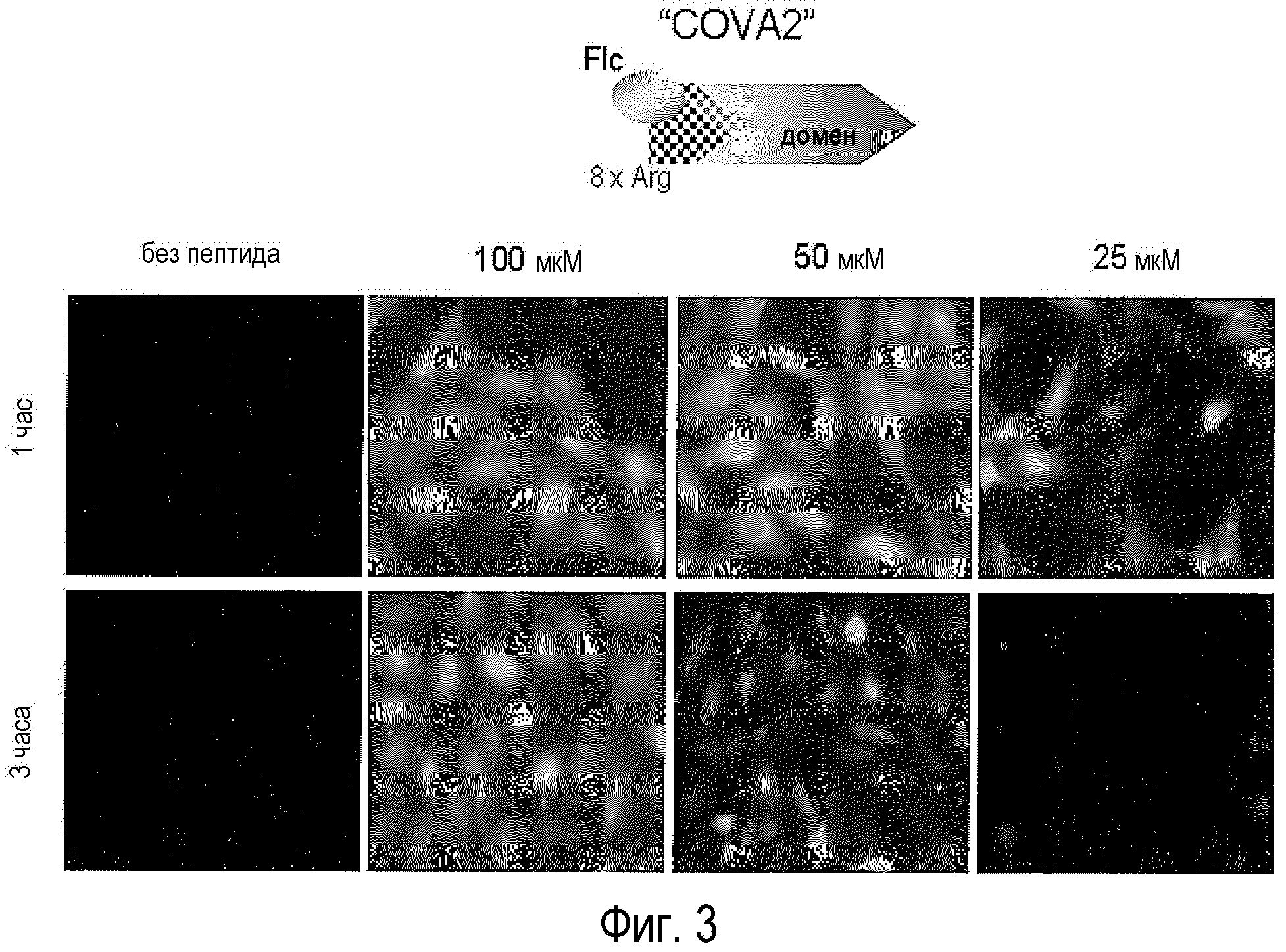
Фигура 3. Демонстрация интернализации пептидов в клетки. Распределение меченного флуоресцеином пептида COVA2 (SEQ ID NO: 7) в клетках Vero, инкубированных в течение 1 и 3 часов с различными концентрациями пептидных конструктов, присоединенных к обогащенному аргинином молекулярному переносчику (COVA2). FITC-меченный пептид (COVA2) интернализовался в 100% клеток при концентрации пептида 100 мкМ.
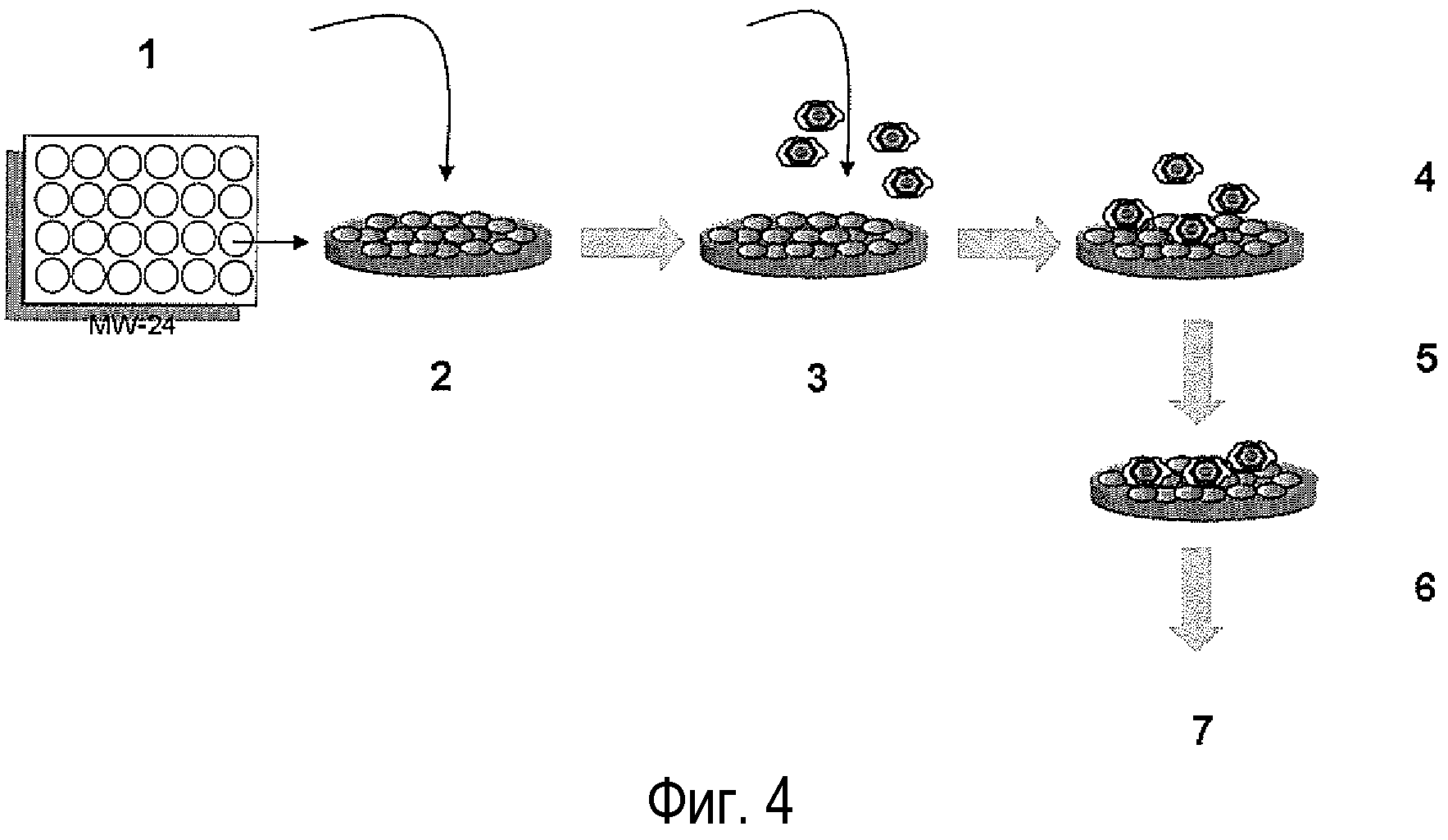
Фигура 4. Схема вирусной инфекции клеток и ингибирование указанной инфекции действием пептидов COVA1 (SEQ ID NO: 6) по изобретению. 1.- Клетки Vero культивировали в плотности 9×104/см2 накануне в течение ночи в 5% DMEM. 2.- По 300 мкл растворов различных пептидов в диапазоне от 0 до 100 мкМ добавляли в DMEM-SC в течение 1 ч при 37°C для интернализации пептидов. 3.- Инфекция по 1 БОЕ/клетку BA71V. 4. - Поглощение в течение 2 ч при 37°C. 5.- Элиминация остаточных вирусов путем 2 промывок 1 мл DMEM-SC. 6.- Течение инфекции в период от 6 до 18 ч после заражения в DMEM+пептиды. 7.- Детекция инфицированных клеток.
Фигура 5. Сравнение противовирусной активности противовирусных и контрольных пептидов по цитопатическому эффекту. Визуальное воспроизведение с помощью обычной микроскопии (100× увеличение) ингибирования цитопатического эффекта ASFV в присутствии растущих концентраций противовирусных пептидов (RS27 - SEQ ID NO: 3, и PS19 - SEQ ID NO: 2) - в столбцах 1 и 2, контрольных (RS28 - SEQ ID NO: 5, и SS20 - SEQ ID NO: 4) в столбцах 3 и 4, а также в отсутствие пептидов - в столбце 5.
Фигура 6. Обработка противовирусными пептидами и число инфицированных клеток по данным иммунофлуоресценции. На фиг.6A показан процент инфицированных клеток на 6 час после инокуляции, инкубированных с повышающимися концентрациями ингибиторного (COVA2 - SEQ ID NO: 7) и контрольного (RS28) пептидов, меченных антителом против p30 ASFV. На фиг.6B показан характерный фотографический снимок иммунофлуоресцентных анализов инфицированных клеток, инкубированных в 5 мкМ и 50 мкМ COVA2 и RS28 пептидах.
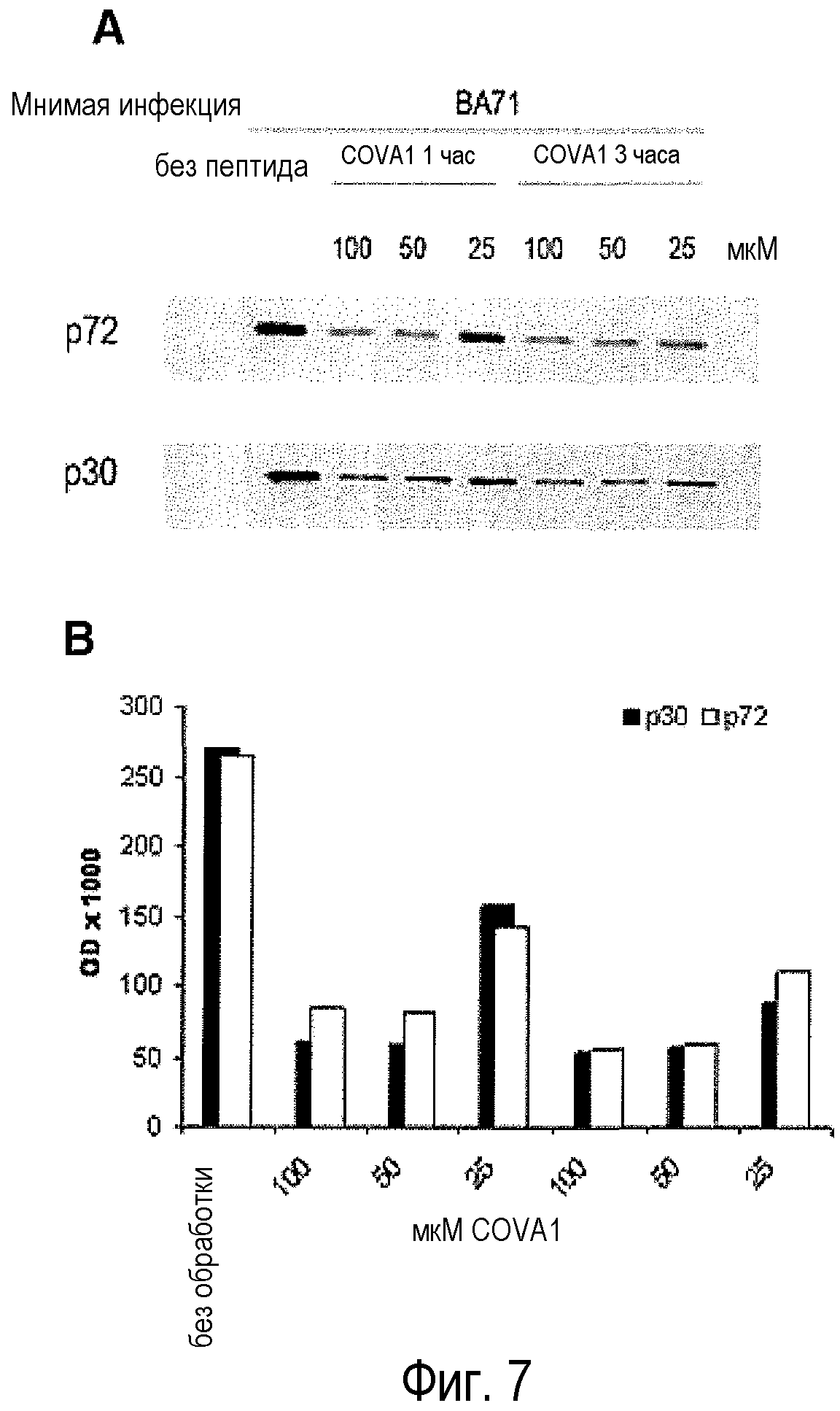
Фигура 7. Обработка противовирусными пептидами и синтез вирусных белков. Анализ синтеза раннего (p30) и позднего (p72) белков при различных концентрациях пептида COVA1 (SEQ ID NO: 6) на 1 и 3 часы. На фиг.7A показан типичный гель вестерн-блоттинга белков p30 и p72, а на фиг.7B показано количественное определение белков p30 и p72 с помощью денситометрии.
Фигура 8. Обработка противовирусными пептидами и количественное определение ДНК вируса ASF с помощью количественной ПЦР. Влияние на репликацию ДНК ASFV на 16 час после инокуляции после обработки повышающимися концентрациями ингибиторных пептидов (COVA1, PEP1 - SEQ ID NO: 9, и PEP3 - SEQ ID NO: 8) по сравнению с контрольным пептидом RS28. Пептиды, содержащие другие связывающие DLC8 последовательности (PEP1 и PEP3) также изображены на этой фигуре, показывая, что последовательность COVA1 является эффективной, начиная с более низких концентраций пептидов.
Фигура 9. Влияние противовирусного пептида на воспроизводство вирусов. Влияние на внутриклеточный (A) и внеклеточный (B) титры вируса, восстановленные через 36 часов после инокуляции в присутствии повышающихся концентраций ингибиторного пептида COVA1 (черные прямоугольники) в сравнении с контрольным пептидом RS28 (белые прямоугольники).
Фигура 10. Отсутствие цитотоксичности данных соединений. Пролиферативный индекс клеток Vero не изменяется через 36 часов инкубации с противовирусным (COVA1) и контрольным (RS28) пептидами при различных концентрациях.
Фигура 11. Сохранение клеточных структур после интернализации пептидов. Типичный фотографический снимок конфокальной микроскопии клеток Vero, обработанных COVA2 пептидом в различных концентрациях в течение 1 и 3 часов. На снимках показана сохраняющаяся архитектура цитоскелета микротрубочек (тубулина) в необработанных клетках (левый столбец) и в клетках, обработанных повышающимися концентрациями пептида, меченного FITC (правый столбец).
Фигура 12. Сохранение морфологии и формирование веретена в процессе митоза. Типичный фотографический снимок конфокальной микроскопии клеток Vero, обработанных контрольным (A) и ингибиторным (B) пептидами COVA1. Волокна тубулина, образующие митотическое веретено в процессе клеточного деления на различных стадиях как у контрольных (А), так и у обработанных пептидом (B) клеток. Клеточная жизнеспособность и пролиферативная способность не затрагивается пептидной обработкой.
Фигура 13. Образец клеточного распределения COVA2 пептида, меченного флуоресцеином. Пептид связывает один из карго-сайтов DLC8, и флуоресцентный пептид точно солокализуется с DLC8 в его динамических компартментах, таких как клеточные выросты (A), сайты цитоплазматической направленной миграции (А) и цитоплазма дочерних клеток после митоза (B), где DLC8 функционирует, репозиционируя органеллы после деления клеток.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
На основании сравнения анализов последовательностей белка p54 вируса ASFV, присутствующих в различных вирусных изолятах разнородного происхождения, авторы изобретения разработали набор пептидов (таблица 1), включающих консенсусную последовательность, консервативную в большинстве вирусных изолятов, и наиболее подходящие фланкирующие последовательности из числа тех вариаций между различными вирусными изолятами, в которых присутствует данный белок (фиг.1). Принимались во внимание длина, гидрофобность и содержание пролинов. Пролины могут подвергаться цис/транс изомеризации в растворах и агрегатах. После того, как выбрали набор пептидов, авторы синтезировали те, которые согласно предсказаниям по своим аминокислотным составам должны были быть растворимыми и стабильными, и пометили их последовательностью, чтобы доставлять их в клетки, а затем провели испытания этих пептидов с помощью следующих подходов.
Метод ядерного магнитного резонанса (ЯМР) позволяет проводить детальный анализ взаимодействующих поверхностей различных белков. В настоящем изобретении методом ЯМР было проанализировано взаимодействие между белком p54 ASFV и легкой цепью динеина (DLC8). В ходе этого анализа были получены данные, которые дали возможность получить представление о деталях указанного взаимодействия, с учетом трехмерной структуры обоих белков и обеих поверхностей взаимодействия, что позволило так усовершенствовать оптимальную пептидную последовательность, чтобы покрыть остатки, участвующие во взаимодействии. Был получен ЯМР-спектр DLC8, и было определено, как в присутствии возрастающих концентраций вирусного p54 изменялся этот спектр (химический сдвиг), указывая на высокоаффинное взаимодействие между двумя белками. Это дало возможность определить активный центр белка, составленный из тех остатков DLC8, которые исчезают из спектра, поскольку они участвуют во взаимодействии. Эти остатки являются следующими: Trp54, Lys9, Ser88, Asn61, Asn23, Asn33, Gly59, Ser86, Arg60, Glu15 и Tyr75. Затем авторы изобретения получили возможность отобрать пептиды, которые могли бы связывать и покрывать остатки, включенные в состав поверхности взаимодействия, а затем было проверено, которые из них были в состоянии предотвратить любое дальнейшее связывание вирусного белка p54 в любой концентрации путем блокирования этого высокоаффинного взаимодействия.
Настоящее изобретение показывает, что правильное взаимодействие вирусного белка с клеточным динеином имеет решающее значение для инфекции, которая обязательно включает в себя внутриклеточный транспорт вируса от мембраны к перинуклеарной зоне (в область, соответствующую центру организации микротрубочек или ЦОМТ, где происходит наибольшее накопление DLC8 в здоровых клетках), и которая, в случае инфекции ASFV, расположена там же, где и вирусная фабрика, и синтезируются вирусные белки, чтобы быть собранными и привести к возникновению новых вирионов.
Совсем недавно исследования, проведенные с помощью упомянутого выше ЯМР, сделали возможным показать в лаборатории авторов изобретения, что существует возможность предотвратить связывание p54 с DLC8, предварительно добавляя к DLC8 пептид, который включает в себя последовательность взаимодействия TyrThrThrThrValThrThrGlnAsnThrAlaSerGlnThr (SEQ ID NO: 13), присутствующую в p54.
Предпочтительный вариант осуществления по настоящему изобретению состоит из воспрепятствования употреблению динеина вирусом в процессе инфекции, посредством применения последовательности вирусных белков, или ее части, чтобы препятствовать инфекции, в некоторых случаях путем насыщения сайтов связывания клеточного белка противовирусными пептидами - антагонистами связывания вирусный белок - динеин. Среди указанных пептидов, изобретение при обработке клеток любого происхождения пептидными последовательностями подтвердило, что они вмешиваются в действие вирусных белков на легкую цепь динеина, например те, которые содержат 14 аминокислот: TyrThrThrThrValThrThrGlnAsnThrAlaSerGlnThr (SEQ ID NO: 13), включая изменения консервативных аминокислот в этой последовательности и в аналогах последовательности различных вирусов животных или функциональных аналогов этого пептида. Было установлено, что гидрофобность последовательностей, фланкирующих критический фрагмент (последовательность аминокислот, которые поддерживают взаимодействие между p54-DLC8, Thr Ala Ser Gln Thr - SEQ ID NO: 14), модифицирует способность пептида связывать DLC8. Схема пептидных последовательностей должна учитывать, что пептид должен связываться с DLC8 по специфическому сайту, который находится в гидрофобной впадине, как показано на трехмерной структуре DLC8. Учитывая тот факт, что из теоретических последовательностей, которые предположительно должны были бы связывать DLC8, некоторые связывали, а некоторые были неспособны связывать DLC8 in vitro, как это было объяснено выше, настоящее изобретение предполагало дальнейшее совершенствование данной пептидной последовательности с помощью ЯМР, и был отобран набор ингибиторных пептидов. Авторы продемонстрировали, что взаимодействие p54-DLC8 представляет собой высокоаффинное взаимодействие, как это определено по ЯМР-динамике их взаимодействия. Тем не менее, авторам удалось заблокировать это высокоаффинное взаимодействие добавлением некоторых пептидов, впервые показав, что взаимодействие p54-DLC8 может быть ограничено противодействием связыванию с данными пептидными последовательностями (таблица 1). Оптимальные отобранные пептидные последовательности были способны блокировать взаимодействие, тогда как другие были использованы в качестве контрольных пептидов, которые не изменяют динамику взаимодействия между p54 и DLC8, исследованную методом ЯМР.
Это методологическое приближение по настоящему изобретению также включает в себя любую обработку пептидными последовательностями любого происхождения, которые включают любую из предыдущих последовательностей, либо указанными последовательностями с заменами консервативных аминокислот. Они включают в себя все консервативные преобразования этих последовательностей и все известные в настоящее время механизмы, направленные на транспортировку этих пептидов вглубь клетки, например: любой из данных пептидов, присоединенных к последовательностям, обеспечивающим перемещение внутрь клетки (аминокапроновая или аминогексиновая кислота, и т.д.); липосомы или другие лекарственные основы, которые служат для интернализации указанных пептидов в клетки, такие как векторы, в частности - вирусные векторы, такие как аденовирус или ретровирус, плазмиды и т.д., преимущественно к этим векторам присоединены таговые последовательности. Обработка пептидами имеет целью насыщение связывающих динеин фрагментов, которые используют транспорт, присоединенный к динеину, преинкубируя их с легкой цепью динеина, белком DLC8, либо с любой последовательностью аминокислот, содержащихся в нем, либо с пептидом, который содержит фрагменты (Lys/Arg)XThrGlnThr или Gly(Ile/Val)GlnValAsp, либо с последовательностями, полученными из них консервативными заменами аминокислот. Консервативные замены определяют как те, которые не изменяют нагрузки, топологии или образования белка. Аналогичным образом, данное изобретение включает в себя любые из предыдущих пептидов, связанные с другими пептидными последовательностями, пептидными переносчиками и т.д., либо поставляемые вместе с липосомами и другими носителями для интернализации пептидов в клетку и, вообще говоря, транспортные системы, известные в настоящее время для клеток любого происхождения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Исходя из вышеизложенного, объектом изобретения является противовирусная композиция пептидов, отобранных среди последовательностей p54 из различных вирусных изолятов, которые могут конкурировать с вирусными белками за связывание с DLC8. В частности, эти пептиды должны эффективно предотвращать связывание белка и вируса с DLC8 in vitro и in vivo, а также, соответственно, ингибировать вирусную инфекцию. Среди этих пептидов могут быть выбраны пептиды, принадлежащие к последовательностям, участвующим во взаимодействии вирусный белок-DLCS, либо выделенной из последовательности вирусных белков, либо из самой последовательности DLC8. Любой пептид, полученный из таковых, в частности, с консервативными аминокислотными заменами, также включен в настоящее изобретение [14: Taylor, W. R.].
Отобранные пептиды, помимо ингибирования взаимодействия вирусных белков с DLC8, должны не показывать никакой токсичности при инкубации с клетками, к которым подбирается противовирусная защита. Кроме того, большинство выделенных пептидов, которые вовлечены в связывание вирусных белков с DLC8, либо выделенные из вирусных белков, либо из легкой цепи динеина (DLC8), имеют тенденцию агрегировать и образовывать димеры. Когда это происходит, их способность связывания становится значительно ниже и может даже исчезнуть. Такое образование димеров и/или агрегация можно удобно избежать путем замены некоторых аминокислот в последовательностях этих пептидов, учитывая гидрофобность, общую длину и содержание пролинов. Изобретение позволило изучить такие замены, и была отобрана группа пептидов, которые препятствуют связыванию вируса с DLC8 путем высокоаффинного конкурентного связывания с DLC8, не показывают агрегации и образования димеров и имеют низкую токсичность для клеток, в которых вирусную инфекцию необходимо либо предотвратить, либо вылечить.
Кроме того, у отобранных пептидов есть «хвост» из Arg, в количестве 8 в качестве примера, чтобы облегчить этим пептидам вход внутрь клеток, в которых вирусную инфекцию необходимо либо предотвратить, либо вылечить.
В группе отобранных пептидов (PS19, COVA1, COVA2, PEP1 и PEP3) все они происходят из части последовательности, принадлежащей p54, ответственной за связывание с DLC8. Группа пептидов по изобретению представлена SEQ ID NO: 14 и включает в себя любой другой пептид, полученный из него посредством консервативных замен по меньшей мере одной из аминокислот SEQ ID NO: 14. Подгруппа пептидов, представленная SEQ ID NO: 1, имеет особый интерес в связи с их нетоксическим воздействием на клетки.
Противовирусные композиции по данному изобретению, содержащие в составе по меньшей мере один пептид из группы, представленной либо SEQ ID NO: 14, либо SEQ ID NO: 1, дополнительно может включать любые другие активные соединения и/или фармацевтически приемлемый эксципиент, носитель или растворитель.
Среди вирусных инфекций, которые могут быть излечены с помощью противовирусных композиций по изобретению, можно назвать: ASFV, вирус папилломы человека, аденовирус, энтомопоксвирус А. moorei, вирус коровьей оспы, респираторно-синцитиальный вирус, вирус Коксаки человека, вирус бешенства, вирус простого герпеса человека, вирус Мокола или вирус СПИДа.
Другой объект по настоящему изобретению представляет собой способ селекции противовирусных соединений и оценки их эффективности, характеризуемый тем, что он включает:
а) преинкубирование или предварительное смешивание клеточной культуры с соединением, способным связываться с DLC8, либо помеченным соответствующими таг-последовательностями внутриклеточной доставки, либо в сочетании с известными способами доставки, такими как липосомы и т.д., трансфицированных вектором, экспрессирующим указанные пептидные последовательности;
b) приведение в контакт вируса с культурой клеток, инкубированной или смешанной ранее на стадии a);
c) детекцию и количественное определение уровня вирусной инфекции внутри клетки через некоторое время;
d) сравнение указанного уровня вирусной инфекции с достигнутой в инфицированной данным вирусом культуре клеток, без преинкубирования или предварительного смешивания с соединением, способным связываться с DLC8.
Другой объект по настоящему изобретению заключается в способе селекции противовирусных соединений и оценки их эффективности, характеризуемый тем, что он включает:
a) преинкубирование или предварительное смешивание вируса с соединением, которое включает в себя последовательность, способную связываться с DLC8, ее частичной последовательностью или аналогичной последовательностью, полученной путем консервативного замещения по меньшей мере одной аминокислоты данной последовательности, способной связываться с DLC8, или с ее частичной последовательностью;
b) приведение в контакт культуры клеток с вирусом, инкубированным или смешанным ранее на стадии a);
c) детекцию и количественное определение уровня вирусной инфекции внутри клетки через некоторое время;
d) Сравнение указанного уровня вирусной инфекции с достигнутой в инфицированной вирусом культуре клеток, без преинкубирования или предварительного смешивания с соединением стадии a).
Кроме того, другой объект по настоящему изобретению относится к исследованию вирусных путей передачи инфекции внутри клетки, связанных с транспортной системой динеина. Способ исследования, характеризуемый мечением набора пептидов, способных связывать DLC8, также рассматривается в настоящем изобретении, что может быть детектировано, в качестве примера, непосредственно флуоресцентным микроскопом. В качестве метящих маркеров могут быть выбраны любые из доступных для клеточных исследований: флуоресцеин, родамин или другие флуоресцентные и нефлуоресцентные метки, такие как биотин, гемагглютинин, продукт экспрессии протоонкогена c-myc и т.д., преимущественно используемые в качестве меток для детекции вторичными антителами и т.д.
Наконец, изобретение также относится к способу оценки ингибирования связывания лигандов с DLC8, измеряя изменения в спектрах легкой цепи динеина (DLC8).
Приведенные ниже примеры представляют собой предпочтительные варианты осуществления родственных изобретений, содержащихся в настоящей заявке, и даны без ограничения областей применения, лишь для того, чтобы позволить специалисту воспроизвести эти родственные изобретения без особых усилий.
ПРИМЕР: ингибирование инфекции вирусом африканской чумы свиней (ASFV) пептидами, которые препятствуют взаимодействию между p54 и легкой цепью клеточного динеина массой 8 кДа (DLC8).
1.1. МАТЕРИАЛЫ
1.1.1 Клеточные линии и использованные культуральные среды
На протяжении всего этого примера в качестве модели использовали линию клеток Vero. Тесты пептидов на интернализацию и инфекционные тесты были разработаны в этой стабильной клеточной линии, анеуплоидной культуре неограниченного роста. Она происходит из почек взрослых африканских зеленых мартышек (Cercopithecus), и была получена при участии Европейской коллекции клеточных культур (ECACC), где хранилась под номером 84113001. Их морфология относится к фибробластному типу, и их постоянно употребляли на некотором количестве этапов, меньшем, чем 20, храня их замороженными и разделенными на аликвоты в жидком азоте до момента их использования. Эту линию клеток культивировали с использованием среды Игла, модифицированной по способу Дульбекко (DMEM, Lonza), с добавлением 5%-ной фетальной телячьей сыворотки (BFS, Lonza), инактивированной в течение 30 минут при 56°C, 4 мМ глутамин (Invitrogen), 200 МЕ/мл пенициллин и 100 мМ стрептомицин (Invitrogen). Условиями культивирования клеток были 37°С и атмосфера 5% CO2. Эти клетки регулярно пересеивали 1:6 два раза в неделю, выращивая в колбах для культур Easy-T-Flasks, 75 см2 с покрытием Nunclon® (Nunc).
Культуральную среду DMEM дополняли в нескольких формах в зависимости от конкретных требований к тестам. Итак, авторы изобретения ссылаются на DMEM SC, когда она была использована без антибиотиков, глютамина или SBF. Авторы ссылаются на 2% DMEM, если данный процент SBF добавлен именно в таком процентном содержании, сохраняя другие добавки в концентрациях, упомянутых в предыдущем абзаце.
Для посева на агарозу использовали 2× среду Дульбекко (Gibco).
1.1.2. Использованные вирусные изоляты
Изолят вируса африканской чумы свиней, применявшийся в тестах на ингибирование инфекции, представлял собой BA71V, адаптированный к росту в линии клеток Vero [4]. Вирусный маточный раствор сохраняли в аликвотах по 100 мкл при -80°С в среде DMEM, дополненной 15% телячьей фетальной сывороткой. В момент их использования необходимое количество аликвот быстро размораживали в бане при температуре 37°С и хранили на льду.
1.1.3. Использованные взаимозаменяемые материалы
- Криопробирки емкостью 1 мл (Nalgene) для сохранения разделенных на аликвоты вирусных изолятов и поддержания линии клеток Vero в жидком азоте.
- Микропипетки (Gilson) с максимальной емкостью 1000, 200 и 20 мкл.
- Наконечники для микропипеток (Arc) с фильтром и свободные от РНКаз, чтобы избежать возможных загрязнений, емкостью 1000, 200 и 20 мкл.
- Пробирки емкостью 1,5 мл (Eppendorf), свободные от РНКаз.
- Многолуночные культуральные планшеты на 4, 6, 12 и 24 лунки (Nunc).
- Покровное стекло диаметром 12 мм (Gever Labs).
- Обычные прямоугольные предметные стекла (Gever Labs).
- Нитроцеллюлозные мембраны для белков, 9×7 см (GE Healthcare).
- Фильтровальная бумага Whatman, 9 х 7 см.
1.1.4. Использованные антитела и хромогены
- Моноклональные антитела против p30: разработаны в лаборатории д-ра Хосе Анхель Мартинес Эскрибано (Dr. Jose Angel Martinez Escribano), специфически распознающие и обнаруживающие ранний белок p30 ASFV.
- Поликлональные антитела против DLC8, полученные от кроликов, иммунизированных белком DLC8, связанным с 10 остатками гистидина, экспрессированным в гетерологичной системе E.coli, а затем очищенным. Получены в нашей лаборатории.
- Моноклональные антитела против α-тубулина (Sigma).
- Моноклональные антитела против p72 (против p73): продаваемые на рынке компанией Ingenasa, специфически распознающие и обнаруживающие структурные поздние белки ASFV, в основном p72 или p73.
- Антитела против IgG мыши, конъюгированные с флуорохромом Alexa 594 (Molecular Probes).
- Антитела против IgG мыши, конъюгированные с флуорохромом Alexa 488 (Molecular Probes).
- Антитела против IgG мыши, конъюгированные с пероксидазой хрена (GE Healthcare).
- Антитела против IgG кролика, конъюгированные с пероксидазой хрена (GE Healthcare).
1.1.5. Другие реагенты
- Тритон Х-100 (Sigma).
- Твин 20 (Sigma).
- Фосфатный буфер (PBS).
- BSA, бычий сывороточный альбумин (Sigma).
- Электрогенерированный хемилюминесцентный (ECL) реагент (GE Healthcare).
- Свободная от РНКаз вода (Ambion).
- Раствор RNAseZAP (Ambion) для уничтожения активности РНКаз с рабочих поверхностей и материалов.
- ProLong, фиксирующий реагент для стабилизации флуоресценции.
- Hoechst 3332 (Sigma) в качестве интеркалирующего хромогенного средства для нуклеиновых кислот.
- β-меркаптоэтанол, SDS, Трис-основание (Sigma).
- NP-40 (Fluka)
- NaCl (Duchefa biochemicais).
- Ультрачистая агароза с низкой температурой плавления (Invitrogen).
1.1.6. Использованные пептиды
Были разработаны различные пептиды, содержащие связывающий DLC8 фрагмент, ранее описанный у белка p54 ASFV, и другой ряд пептидов посторонней последовательности для использования в качестве отрицательного контроля (пептиды RS27 и SS20). Все они описаны в таблице 1. Для некоторых пептидов включены некоторые модификации, такие как:
- Добавление 8 остатков аргинина (R) в N-концевую область, с целью повышения интернализации пептида в клетку [6] (RS27; RS28; COVA1; COVA2; PEP3; PEP1).
- Конъюгация с флуоресцеином по N-концевой области для их непосредственного отображения методом флуоресцентной микроскопии (COVA2; PEP3; PEP1).
- Замена конкретных остатков, чтобы облегчить растворение пептида и избежать его агрегации (COVA1, COVA2, PEP1 и PEP3)
- Замена остатков во фрагменте ThrAlaSerGlnThr на другие, которые поддерживают способность взаимодействия p54 с DLC8 (PEP3) [1].
Все разработанные пептиды, использованные на протяжении настоящего примера, были синтезированы Sigma-Genosys. Их очистка была проведена методом высокоэффективной жидкостной хроматографии, обеспечившей получение во всех случаях степени чистоты более 90%. После синтеза и очистки данные пептиды были получены лабораторией в виде лиофилизата.
(1): содержит последовательность, связывающуюся с DLC8, присутствующую в p54.
(2): конъюгирован с флуоресцеином.
(3): содержит замены по сравнению с последовательностью, связывающейся с DLC8, присутствующей в p54, чтобы избежать агрегации и димеризации пептида.
(4): содержит последовательность 8× аргининов, чтобы облегчить свою интернализацию в клетку.
(5): отрицательный контроль.
(6): замены в DLC8 связывающем фрагменте, присутствующем в p54, не изменяющие связывание между обоими белками.
1.2. МЕТОДЫ
1.2.1 Анализ сравнения последовательностей
Последовательность p54, существующую в различных участках и лабораторных изолятах вируса ASF, депонированную в Genebank (NCBI), графически представляли в базе данных BLAST и сравнивали согласно алгоритму местного выравнивания Local Alignment Search Tool. Из различных последовательностей разных изолятов отбирали консервативный фрагмент и наиболее подходящие фланкирующие последовательности. Для дизайна этого пептида принимались во внимание длина, гидрофобность и содержание пролинов. Пролины могут подвергаться цис/транс изомеризации в растворах и агрегатах. Гидрофобный характер данного пептида может также представлять трудность для очистки и содействия преципитации. После того, как разработали набор пептидов, отбирали для синтеза те из них, которые согласно предсказаниям по своим аминокислотным составам должны были быть растворимыми и стабильными, и помечали их последовательностью, чтобы доставлять их в клетки («хвост» из 8 аргининов, как описано ниже).
1.2.2. Ядерный магнитный резонанс
Спектры ядерного магнитного резонанса получали после мечения N15 и очистки ASFV белков p54 и DLC8. Метод, используемый для этого исследования, называется отклонением химических сдвигов. Предпочтительно, оба белка очищали, и спектры сопоставляли с данными Lo et al, 1998 для DLC8 (фиг.2).
1.2.3 Обработка пептидов
Соразмерно своим молекулярным массам (см. таблицу 1), пептиды ресуспендировали в таких объемах H2O со степенью чистоты, соответствующей mQ, и стерильной, чтобы получить маточный раствор в концентрации 5 мМ. Особое внимание уделяли, чтобы избежать помутнения в растворе, и наконечники всегда использовали с фильтрами, чтобы избежать возможного перекрестного загрязнения. Были изготовлены аликвоты по 20 мкл, и их хранили при -80°C до момента использования. Для их использования их размораживание происходило медленно, на льду.
Рабочие растворы с пептидами изготавливали из маточных растворов в среде DMEM SC в диапазоне концентраций 0-100 мкМ, всегда в стерильных условиях, и непосредственно перед добавлением к культуре клеток, чтобы избежать деградации.
1.2.4 Блокирование взаимодействия p54-DLC8 пептидами в культуре клеток
9×104 клеток Vero культивировали в 24-луночных планшетах в ночь перед экспериментом. На следующее утро клетки промывали в DMEM SC, и существующую среду заменяли 300 мкл растворов, содержащими различные пептиды в разных концентрациях. Инкубацию клеток с пептидами продолжали в течение 1 часа при температуре 37°С и 5% CO2, после чего клетки были инфицированы ASFV. Для заражения клеток, существующую культуру клеток удаляли и заменяли на 2%, 350 мкл/лунку, содержащую количество, соответствующее для получения множественности заражения 1 бляшкообразующая единица (БОЕ) на клетку. Инфекции позволяли продолжаться требуемое время при 37°C и 5% CO2.
После периода абсорбции (2 ч при 37°C) остаточный вирус удаляли, дважды промывая DMEM SC, и окончательно клетки оставляли в 300 мкл свежей DMEM SC, содержащей соответствующие концентрации пептидов. Инфекции позволяли продолжаться при 37°С в течение необходимого времени в каждом эксперименте, в зависимости от анализируемого параметра инфекции. Этот процесс схематически представлен на фиг.4.
1.2.5 Детекция клеток, инфицированных ASFV, путем непрямой иммунофлуоресценции (IIF)
Детекцию клеток, инфицированных ASFV, среди клеток, ранее подвергшихся воздействию различных пептидов, проводили через 6 часов после инфекции. Методы IIF, использованные для выявления этих клеток, инфицированных в ASFV, с помощью иммунофлуоресценции, были традиционными. Вкратце, клетки промывали 1 мл PBS перед фиксацией в 3,8% PBS-параформальдегидном растворе при комнатной температуре в течение 10 минут. Остаточный параформальдегид затем удаляли путем 3-х кратной промывки клеток по 1 мл PBS. Нарушение проницаемости клеточных мембран проводили с помощью 0,2% PBS-Тритон Х-100 в течение 15 минут при комнатной температуре. После еще 3 промывок в PBS клетки инкубировали при 37°C в блокирующем растворе (3% PBS-BSA) в течение 45 минут. В качестве вирусного антигена для детекции был выбран ранний ASFV белок p30 [5], и его детекцию проводили с использованием антител против p30, разбавленных в PBS 1:200 в течение 1 часа при 37°C. Клетки промывали 3 раза в PBS, и инкубировали в течение 30 минут при комнатной температуре с раствором антител против IgG мыши, разбавленными 1:300 в PBS. Клетки промывали в PBS и в завершении вводили метящий ядро краситель Hoechst 3332. Наконец, покровные стекла, содержащие клетки, устанавливали на предметные стекла, применяя Prolong в качестве фиксирующей среды. Препараты наблюдали в обычном флуоресцентном микроскопе (Leica) для подсчета числа клеток, положительных по вирусному антигену p30.
1.2.6. Анализ синтеза вирусных белков с помощью вестерн-блоттинга в процессе инфекции ASFV
Предметом анализа вирусных белков служил ранний ASFV белок p30, экспрессируемый на начальных стадиях инфекции [5], и белок p72 (в некоторых случаях также называемый p73), экспрессируемый на поздней стадии инфекции [7, 8]. Вестерн-блоттинг проводили на клетках, которые промывали 1 мл холодного PBS, прежде чем они были собраны в 50 мкл замороженного RIPA - буфера для экстракции белков (150 мМ NaCl, 5 мМ β-меркаптоэтанол, 1% NP40, 1% SDS и 50 мМ Трис-HCl рН=8). Их инкубировали при 4°С при орбитальном перемешивании в течение 20 минут до растворения белков, а затем их центрифугировали при 12000 об/мин в настольной центрифуге при 40°C в течение 10 минут. Осадки отбрасывали, и собирали супернатанты, которые хранились при -70°С до их анализа вестерн-блоттингом.
Образцы размораживали на льду, и проводили количественное определение белка в различных образцах методом Брэдфорда. 20 мкг общего белка, денатурированного при 100°C в течение 5 минут, разделяли с помощью электрофореза в 15% акриламид:бис-акриламидных гелях в течение 90 минут при постоянных 100 В. Разделенные белки переносили на нитроцеллюлозные мембраны в течение 90 минут при постоянных 100 В в присутствии буфера переноса (Трис-глицин, 20% метанол). Мембраны блокировали в присутствии 50 мл 5% обезжиренного раствора сухого молока в PBS при комнатной температуре в течение как минимум 1 часа при орбитальном перемешивании. Затем, мембраны гибридизовали с 10 мл поликлональных антител против DLC8, разведенных 1:50 в PBS, в течение 1 часа при комнатной температуре при перемешивании. После этого момента мембраны промывали 3 раза по 20 мл 0,05% PBS-Твин при комнатной температуре в течение 15 минут в каждом случае. Инкубацию с конъюгированными с пероксидазой вторичными антителами против IgG кролика, разведенными 1:4000 в PBS, проводили 1 час при комнатной температуре при перемешивании. Завершив это, мембраны в каждом случае трижды промывали в 0,005% Твин-PBS в течение 15 минут. Наконец, традиционным образом проводили детекцию хемилюминесценции, применяя ECL, следуя инструкции производителя.
В качестве исходных образцов для анализа использовали общие экстракты растворимых белков из клеток Vero, подвергнутых или не подвергнутых действию различных пептидов, а затем инфицированных или не инфицированных ASFV в течение 16 часов.
В качестве первичных антител использовали моноклональные антитела против p30, разведенные 1:100 в PBS, и моноклональные антитела против p72, разведенные 1:2000 в PBS, на независимых мембранах. Мембраны инкубировали с обоими антителами в течение 1 часа при комнатной температуре при орбитальном перемешивании.
В качестве вторичных антител в обоих случаях использовали конъюгированные с пероксидазой антитела против IgG мыши.
Наконец, проводили денситометрию реакции хемилюминесценции для количественной оценки и выражения в относительных единицах количеств белка, присутствующих в каждой обнаруженной полосе.
1.2.7. Детекция и количественный анализ генома ASFV
Детекцию и количественный анализ генома ASFV обеспечивали за счет количественной ПЦР в реальном времени с использованием конкретных олигонуклеотидов (SEQ ID NO: 10 и SEQ ID NO: 11) и TaqMan зонда (SEQ ID NO: 12). ДНК из клеток, инфицированных или мнимо инфицированных BA71V, 0,5 БОЕ/клетку, экстрагировали и очищали с помощью набора DNeasy blood and tissue kit (Qiagen) на 16 час после инокуляции. Концентрацию и чистоту ДНК оценивали путем измерения оптического поглощения при 260 нм (A260).
Смесь для амплификации готовили на льду следующим образом:
3 мкл матричной ДНК (1 мкг);
1 мкл олигонуклеотида OE3F, 50 пмоль;
1 мкл олигонуклеотида OE3R, 50 пмоль;
10 мкл Quantimix Easy Probes Biotools 2X;
1 мкл TaqMan™ зонд SE2 5 пмоль;
4 мкл H2O.
Реакцию амплификации проводили в Rotor Gene 6000™ (Corvette Research), как указано в следующей таблице:
Положительные контроли амплификации (ДНК, очищенная из вирионов ASFV) и отрицательные контроли амплификации (ДНК из мнимо инфицированных клеток) были включены в анализ, и все образцы были проанализированы в дублированной форме.
1.2.7. Влияние пептидной обработки на воспроизводство вирусного потомства при инфекции ASFV
9×104 клеток Vero высеивали на 24-луночных планшеты за ночь перед экспериментом. За 1 час до инфицирования клетки инкубировали в 300 мкл DMEM, содержащих различные концентрации пептидов COVA1 или RS28. Затем клетки были инфицированы или мнимо инфицированы штаммом BA71V ASFV, 0,5 БОЕ/клетку. На 36 час после инокуляции, из лунок собирали по 100 мкл среды и хранили при -80°C до анализа внеклеточного вирусного потомства. Инфицированные клетки также собирали в 100 мкл свежей DMEM. Клетки замораживали и оттаивали три раза, чтобы сделать возможной солюбилизацию внутриклеточного вирусного потомства, а затем хранили при -80°C до их использования. Титры вирусов из внутриклеточных и внеклеточных образцов исследовали анализом бляшкообразования. Вкратце, монослои клеток Vero, посеянные в 6-луночные планшеты, инокулировали 500 мкл 10-кратных серийных разведений образцов, содержащих вирусное потомство. Через 90 минут периода адсорбции клетки дважды промывали в свежей 5% DMEM, и к клеткам добавляли по 3 мл/лунку верхнего слоя (2% агароза с низкой температурой плавления и DMEM 2X1 объем/объем). После того как верхний слой затвердел, планшеты инкубировали при 37°C и 5% CO2 в течение 12 дней. Затем клетки окрашивали 1% кристаллическим фиолетовым в 5% формальдегиде для визуализации вирусных бляшек. Титры вирусов рассчитывали следующим образом: БОЕ/мл=2×число бляшек×10кратность разведения.
1.2.9. Анализ цитотоксичности. Тесты на жизнеспособность клеток и пролиферацию
Для оценки жизнеспособности клеток клетки Vero, посеянные в 24-луночные планшеты, инкубировали в DMEM, содержащей ингибиторный пептид COVA1 или отрицательный контроль RS28 в концентрациях от 0 до 100 мкМ. После инкубации с пептидами в течение 24 ч клетки собирали, и количество жизнеспособных клеток в суспензиях клеток определяли с помощью теста с освобождением красителя трипана синего (Sigma). Вкратце, 20 мкл PBS с 0,08% трипаном синим добавляли в равный объем клеточной суспензии и перемешивали. Через 2 минуты подсчитывали синие клетки (мертвые клетки), применяя гемоцитометр и обычный световой микроскоп.
Для оценки клеточной пролиферации 3×104 клеток Vero, посеянные в 96-луночные планшеты, инкубировали в 50 мкл DMEM, содержащей ингибиторный пептид COVA1 или отрицательный контроль RS28 в концентрациях от 0 до 100 мкМ. После инкубации в течение 36 ч клеточную пролиферацию определяли с помощью анализа CellTiter 96 Aqueous™ (Promega), следуя указаниям производителя.
1.3. РЕЗУЛЬТАТЫ
1.3.1. Дизайн противовирусных пептидов
Последовательность p54, существующую в различных участках и лабораторных изолятах вируса ASF, графически представляли в базе данных и сравнивали. На основании этих сравнительных анализов последовательностей белка p54 вируса ASFV, присутствующих в различных вирусных изолятах разнородного происхождения, авторы изобретения разработали набор пептидов (таблица 1), включающих консенсусную последовательность, консервативную в большинстве вирусных изолятов, и наиболее подходящие фланкирующие последовательности из числа тех вариаций между различными вирусными изолятами, в которых присутствует данный белок (фиг.1). Для дизайна этого пептида принимались во внимание длина, гидрофобность и содержание пролинов. Пролин может подвергаться цис/транс изомеризации в растворах и агрегатах. Гидрофобный характер данного пептида может также представлять трудность для очистки и содействия преципитации. После того, как авторы разработали набор пептидов, они отобрали для синтеза те из них, которые согласно предсказаниям по своим аминокислотным составам должны были быть растворимыми и стабильными, и пометили их последовательностью, чтобы доставлять в клетки («хвост» из 8 аргининов, как описано ниже), а затем приступили к испытаниям этих пептидов с помощью следующих подходов.
1.3.2. Анализ поверхностей взаимодействия с помощью их спектров ядерного магнитного резонанса
Спектры ядерного магнитного резонанса получали после N15-мечения и очистки обоих белков. Метод, используемый для этого исследования, называется отклонением химических сдвигов. Этот метод анализирует химические изменения, наблюдаемые в белке-мишени при его взаимодействии с лигандом. Во-первых, оба белка очищали, и спектры сопоставляли со спектрами, приведенными в работе Lo et al, 1998 (13) для DLC8 (фиг.2А). В присутствии повышенных концентраций ASFV белка p54 спектры DLC8 изменяются, и сигналы, сопровождающие связывающий фрагмент, постепенно исчезают. При концентрации p54 0,1 экв, первыми исчезают сигналы, соответствующие остаткам W54, K9, S88, N61, N23. По достижении концентрации 0,3 экв, исчезающие сигналы соответствуют остаткам N33, G59, N23, S86, R60, E15, Y75 (фиг.1A). Медленный взаимный обмен процесса взаимодействия, наблюдаемого между DLC8 p54, свидетельствует, что связь между этими белками происходит с высокой аффинностью. Тем не менее, авторы смогли помешать этому высокоаффинному взаимодействию, когда добавляли некоторые пептиды, и в спектрах DLC8 не наблюдали никаких изменений у любого из вышеупомянутых остатков активного центра белка при любой концентрации p54 (фиг.2B), впервые показав, что это взаимодействие могло бы быть эффективно блокировано данными пептидными последовательностями (таблица 1).
1.3.3. Интернализация пептидов в клетки Vero
Библиография описывает, что добавление остатков аргинина по концам пептида значительно увеличивает проникновение их во внутреннее пространство клетки. С этим намерением авторы внедрили транспортер внутриклеточной доставки, состоящий из восьми аргининов. Чтобы проверить, что разработанные пептиды эффективно интернализуются во внутреннее пространство клетки, по N-терминальному концу внедрили флуоресцеиновую метку. Те пептиды, у которых отсутствовал аргининовый транспортер внутриклеточной доставки, не были способны войти в клетку, тогда как те, что включали транспортерный хвост, были эффективно интернализованы и однозначно окрашивали почти 100% клеток в культуре, через 1 и 3 часа инкубаций с пептидом, в непрерывной структуре микротрубочек (фиг.3). Пептид COVA2 соответствует этому набору особенностей, в том числе DLC8 связывающий фрагмент, ранее описанный для p54, и его использовали, чтобы непосредственно наблюдать интернализацию в клетки Vero.
Как видно на фиг.3, пептид эффективно интернализовался, при этом сохранив возможность быть легко детектируемым под микроскопом прямой флуоресценции даже через 6 ч после своего добавления.
Оптимальные концентрации пептидов COVA2 составили 50 и 100 мкМ, без существенных различий между обеими концентрации. COVA2 при концентрации 25 мкМ могут быть детектируемы, хотя и с гораздо большими трудностями, чем при более высоких концентрациях, а с другой стороны, при более низких концентрациях, т.е. ниже 5 мкМ, вряд ли могут быть детектируемы флуоресцентной микроскопией.
1.3.4. Ингибирование инфекции ASFV пептидами, которые блокируют связывание p54-DLC8
Как указано в методическом разделе этого примера, инфицирование проводили при 1 БОЕ/клетка на однослойных ASFV-клетках Vero, ранее подвергшихся воздействию различных пептидов. Инфицирование оставляли протекать в присутствии пептида, и анализировали следующие параметры инфекции, чтобы проверить ингибиторный эффект изучаемых пептидов.
1.3.4.1. Влияние пептидов на особенность цитопатического эффекта вирусной инфекции
Инфекция ASFV приводит к разрушению инфицированных клеток, что весьма характерно и легко детектируется как цитопатический эффект обычной микроскопией. Она начинается в ранние сроки после инфицирования и в конечном итоге приводит к прогрессирующей внутриклеточной вакуолизации, скруглению контура клетки и откреплению от поверхности, к которой инфицированная клетка прикреплялась [9].
Авторы изобретения определили наличие или отсутствие генерализованного цитопатического эффекта через 18 часов после инфицирования культур клеток Vero, где эта инфекция прогрессировала в присутствии различных пептидов. Используя этот метод, можно было убедиться в ингибировании цитопатического эффекта в этих культурах клеток, инкубированных с пептидами, содержащими в своей последовательности связывающий DLC8 фрагмент вместе с последовательностью аргининов, способствующей их входу внутрь клетки. Напротив, клетки, подвергнутые действию контрольных пептидов, или у которых отсутствовала последовательность аргининов, проявляли цитопатический эффект, аналогичный тому, который наблюдается в клетках, у которых эта инфекция развивалась нормально.
Как показано на фиг.5, тяжесть наблюдаемого цитопатического эффекта прямо пропорциональна концентрации использованного пептида. Таким образом, концентрации пептида PS19, ингибирующие цитопатический эффект полностью, находились в диапазоне концентраций от 25 до 100 мкМ, но концентрации меньше, чем 25 мкМ, не были эффективными для ингибирования цитопатического эффекта.
В таблице 2 сведены способности ингибировать цитопатический эффект для различных испытанных пептидов и их соответствующие концентрации.
Кроме того, пептид, который содержит связывающий DLC8 фрагмент с такими модификациями, поддерживал способность взаимодействия пептида и продемонстрировал свою эффективность при ингибировании цитопатического эффекта при инфекции.
1.3.4.2. Влияние пептидов на процент инфицированных клеток
Ингибиторный эффект пептидов анализировали путем подсчета числа клеток, инфицированных ASFV (положительных по антигену p30). Для этого клетки инкубировали в присутствии различных ингибиторных пептидов и контрольных пептидов, перед вирусными инфекциями, как это подробно изложено в методическом разделе настоящего примера.
Как показано на фиг.6, инкубация с пептидом COVA2 до инфицирования привела к резкому сокращению доли инфицированных клеток, по сравнению с данными, полученными на клетках, инкубированных с контрольным пептидом RS28. Кроме того, это сокращение зависело от концентраций используемого пептида COVA2.
1.3.4.3. Влияние пептидов на синтез вирусных белков
Синтез ранних и поздних белков ASFV анализировали вестерн-блоттингом, применяя специфические антитела. Таким образом, можно констатировать, что синтез как ранних (p30), так и поздних (p72) вирусных белков снижался в зависимости от дозы, когда инфекция ASFV происходит в присутствии пептида COVA1. Кроме того, указанное снижение зависит от дозы COVA1, добавленного к культуре клеток (фиг.7).
1.3.4.4. Влияние пептидов, определенное путем подсчета числа репликаций вирусного генома
Клетки Vero преинкубировали с различными пептидными концентрациями, как описано выше, и инфицировали BA71V ASFV изолятом. Клетки собирали на 16 час после инокуляции, и репликацию генома ASFV анализировали с помощью количественной ПЦР в реальном времени с использованием специфичного зонда TaqMan и олигонуклеотидов [11]. Как видно на фиг.8, обработка ингибиторным пептидом COVA1 сильно снижает дозозависимую репликацию генома ASFV. Аналогичным образом, преинкубация с другими блокирующими пептидами (PEP1 и PEP3), которые содержали замены в связывающем DLC8 фрагменте, не влияющими на взаимодействия p54-DLC8, также привела к снижению репликации генома ASFV, хотя обработка последовательностью COVA1 эффективна при более низких концентрациях пептида (25 мкМ). Это снижение репликации вирусной ДНК после пептидной обработки является следствием ингибирования инфекции этими пептидами. Затем, с помощью этого чувствительного количественного метода стало возможно определить в пептидах, которые могут препятствовать связи p54-DLC8 и оказывают противодействие инфекции, что существуют данные последовательности, которые могут более эффективно блокировать инфекции in vivo (фиг.8).
1.3.4.5. Влияние пептидной обработки на воспроизводство вирусного потомства при инфекции ASFV
9×104 клеток Vero, выращенных в 24-луночных планшетах, обрабатывали различными концентрациями пептидов COVA1 и RS28 в течение 1 час при 37°C, как описано в разделе «Материалы и методы». Затем клетки были инфицированы или мнимо инфицированы BA71V при 0,5 БОЕ/клетку. На 36 час после инокуляции внеклеточное и внутриклеточное вирусное потомство из инфицированных клеточных культур исследовали анализом бляшкообразования. Как показано на фиг.9, статистически значимое снижение внеклеточных (фиг.9B) и внутриклеточных (фиг.9A) рассчитанных титров вируса наблюдалось, когда инфекция протекает в присутствии 50 мкМ COVA1 или при большей концентрации. Тем не менее, инкубация с пептидом отрицательного контроля RS28 при различных концентрациях не влияет на вирусные титры, и итоговые величины вирусного потомства были сходны с таковыми для клеток, инфицированных в отсутствие пептида.
1.3.5. Анализ цитотоксичности. Влияние пептидной обработки на жизнеспособность клеток и пролиферацию
Чтобы оценить, связана ли какая-либо цитотоксичность или любые побочные эффекты с обработкой клеток Vero пептидами, проводили тесты клеточной пролиферации и жизнеспособности клеток. В этих экспериментах значения клеточной пролиферации после обработки различными концентрациями пептида COVA1 не снижались по сравнению с клетками, обработанными пептидом отрицательного контроля RS28 (фиг.10). Значения клеточной пролиферации, полученные с COVA1, были аналогичны полученным для контрольных клеток в отсутствие пептидов. Кроме того, процент выживаемости клеток не изменялся после инкубации с различными пептидами (ингибиторными или контрольными пептидами), судя по анализу исключения трипана синего. Проценты выживаемости клеток составили около 90% во всех случаях. Эти результаты показывают, что инкубация с пептидами, описанная в настоящем изобретении, не влияет ни на клеточную пролиферацию, ни на жизнеспособность клеток Vero.
1.3.5.1. Клеточная структура и сохранность функций DLC8
Авторы проверили, изменяла ли обработка пептидами основные клеточные структуры, относящиеся к микротубулярному двигателю - динеину. Вместе с интернализацией пептидов, анализировали сохранность компонентов цитоскелета и наблюдали, что микротрубочки не изменялись в присутствии пептида COVA2 (фиг.11). Кроме того, картина распределения легкой цепи динеина сохранялась на микротрубочках в зоне уплотнения, соответствующей центру организации микротрубочек (ЦОМТ) (фиг.11). Функции динеина, как известно, очень важны при митозе, играя роль в формировании митотического веретена и миграции хромосом, и авторы обнаружили, что деление клеток осталось неизменным (фиг.12).
1.3.5.2. Образец клеточного распределения COVA2 пептида, меченного флуоресцеином
Меченный флуоресцеином пептид COVA2 показал распределение, аналогичное окрашиванию по DLC8 с использованием поликлональных антител против целой молекулы DLC8. DLC8 взаимодействует в цитоплазме с отдельными грузами, опосредующими транспорт органелл, РНК и белков к минус-концу микротрубочки (в направлении ядра), и его функция имеет важное значение для смещения после митоза таких органелл, как аппарат Гольджи. Интересно, что пептид COVA2 солокализован именно с динамическим компартментом молекулы DLC8. Флуоресцентный пептид был распространен, в основном, в цитоплазматических областях, клеточных выростах, филоподиях и клеточных контактах покоящихся клеток. В клетках, в которых протекает митоз, он остается в периферийных областях цитоплазмы до тех пор, пока не протекут последние фазы митоза. Затем, в клетках, в которых протекает кариокинез, и дочерних клетках, окрашивание COVA2 возрастало и было очень интенсивным во всех цитоплазматических областях в тех клетках, где происходит перераспределение органелл после митоза (фиг.13). Проценты солокализации были выше в клетках, где активно перемещались клеточные органеллы после митоза, что показано окрашиванием с использованием антител против целой молекулы DLC8. Затем, было установлено, что селективный маркер динамического компартмента, связанный с DLC8, опосредует транспорт в клетках.
Эти результаты ясно показывают, что вирусная инфекция (посредством ASFV) может быть ингибирована с использованием специально разработанных пептидов на основе связывающего DLC8 фрагмента, присутствующего в вирусных p54 в различных вирусных изолятах, которые предотвращают взаимодействию между обоими белками. Это ингибирование находит свое отражение в ингибировании цитопатического эффекта, резком сокращении количества инфицированных клеток, копий вирусных геномов в расчете на клетку (что отражает снижение вирусной репликации в нг/мкл, обнаруженном в данной клетке), и в последующем значительном сокращении производства вирусов и синтеза вирусных белков.
В заключение, настоящее изобретение впервые использует пептиды, разработанные на основе последовательности, посредством которой вирус связывает DLC8 динеина, что является необходимым этапом для успеха инфекции, и было показано, что эти пептиды эффективно ингибируют вирусную инфекцию у чувствительных клеток и обладают очевидным противовирусным эффектом.
Реферат
Изобретение относится к области биотехнологии и вирусологии. Описаны противовирусные пептиды, противодействующие связыванию вируса с DLC8. Большое количество возбудителей заболеваний вирусного происхождения используют внутриклеточные механизмы транспорта на основе динеина в определенный момент их инфекционного цикла. Настоящее изобретение включает новую противовирусную терапию, состоящую в ингибировании вирусной инфекции, вызываемой теми вирусами, которые используют систему динеина посредством механизмов противодействия, главным образом, предотвращая взаимодействие между вирусным белком и клеточным белком DLC8. Настоящее изобретение впервые раскрывает блокирование функции этого взаимодействия пептидами, чья последовательность содержит или состоит из полной или частичной последовательности вирусного белка, соответствующей домену, связывающемуся с DLC8. 3 н. и 7 з.п. ф-лы, 13 ил., 2 табл.

Комментарии