Карбаматы и карбамиды, индуцирующие производство цитокинов - RU2135515C1
Код документа: RU2135515C1
Чертежи





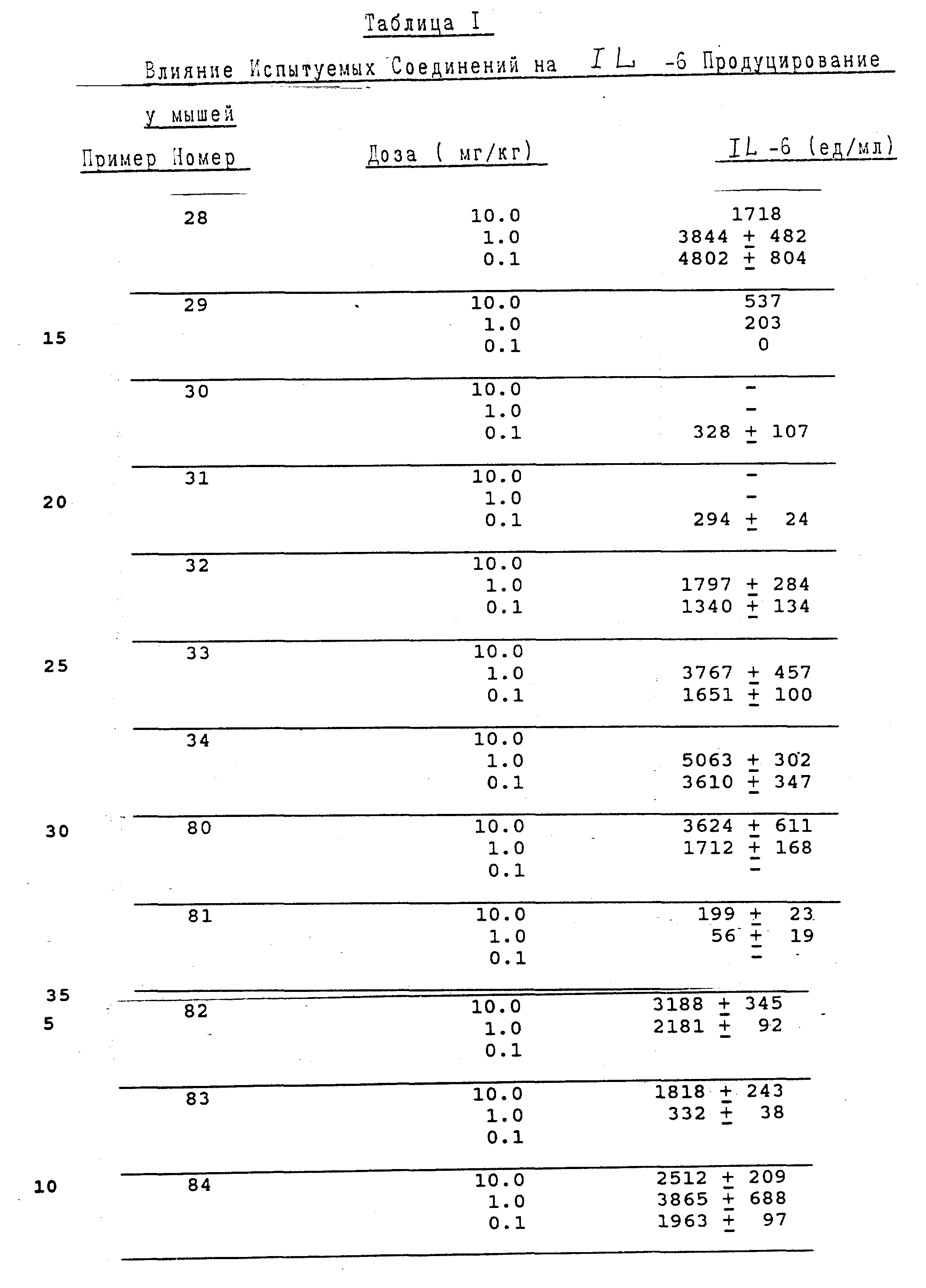







Описание
Цитокины, такие как G-CSF, M-CSF, GM-CSF (факторы стимуляции колонии) и IL-1, IL-3, IL-6 (интерлейкины) могут стимулировать гемопоэз (кроветворение) при заболеваниях, связанных с повреждением костного мозга и таким образом ускорять выздоровление при нейтропении, как сообщили Metcalf, D., Science, 529 (1991) и H.G. Klingemann и H.J. Deeg, CIPS, 14,243, (1989), а также G. Mortsyn и A.W.Burgess, Cancer Research 48,5624 (1988).
Было сообщено, что участки натуральной бактериальной оболочки клетки и синтетические липопептиды, которые имитируют оболочку клетки, обладают иммуностимулирующими свойствами, как описано J.Freund, Adv. Tubercl. Res., 1, 130, (1956); F. Ellouz, A.Adam, R.Ciorbaru and E.Lederer Biochem. Biophys. Res. Commun. , 59, 1317, (1974); V. St. Georgiev, Medicinal Res. Rev., 11, 81, (1991) и I.Azuma, Int. J.Immunopharmac., 14,487 (1992).
Конкретно, были идентифицированы определенные соединения, которые, по-видимому, индуцируют образование CSF и могут способствовать восстановлению
костного мозга после
миелосупрессии, вызванной химиотерапией или радиацией. Эти соединения включают такие, как пимелаутид (RP-40639), как сообщено F. Floch'h, J.Bouchaudon, C.Fizames, A.Zerial,
G.Dutruc- Rosset and
G.H.Werner, CIPS, 763 (1984) и в Патенте FR-2, 482, 961, (1981);
Муроктазин (Daiichi Seiyaku Co.) I.Azuma, Int.J. Immunopharmac, 14, 487 (1992); R.Nakajima Y.Yshida,
K.Akahane, M.Sekiguchi
and Y.Osada, Arzneim.-Forsch. , 41, 60, (1991); Scrip, 22, 1655 (1991); и Патент EP-135, 788, (1985);
и FK-156 и FK-565 (Fujisawa), как сообщено S.Izumi, K.Nakahara,
T.Gotoh, S. Hashimoto,
T.Kino, M.Okuhara, H.Aoki, and H.Imanaka, J.Antibiotics, 566, (1983); R.Nakamura, K.Nakahara, H.Aori, Agric. Biol. Chem., 48, 2579 (1984); H. Keiji, H.Takeno, S.Okada,
О.Nakguchi, Y.Kitaura, and M.
Hashimoto, Tetrahedron Lett., 23, 693 (1982) and Патент США 4, 349, 466 и 4,666,890.
Патент США 4,666,890 раскрывает синтетический трипептид, который, как сообщено, обладает активностью как иммуномодулятор, скорее для применения в качестве противоопухолевого агента, чем в качестве адьюванта при химиотерапии.
Компоненты оболочки клетки, о которых сообщалось, и их синтетические аналоги все являются пептидами, включающими составляющую D-глутаминовой кислоты (D-Glu) y-связанную либо с лизином (Lys), либо с диаминопимеловой кислотой (A2pm), с дополнительными пептидными связями или алифатическими ацильными группами, расположенными по бокам двух концов.
Новые карбаматы и карбамиды, раскрытые в данном изобретении, представляют первые примеры непептидных аналогов бактериальных компонентов оболочки клетки и не содержат обычную для предшествующей уровню D-Glu составляющую.
К тому же, тогда как предыдущим уровнем предусматривается отсутствие разветвления на основной цепи пептида, данное изобретение включает разветвленные аналоги, которые сохраняют желаемую активность при синтезе в специфической конфигурации, и метод синтеза этих хиральных разветвленных аналогов.
Краткое описание изобретения
Данное изобретение относится к уретанам (карбаматам) и
мочевинам (карбамидам) формулы:
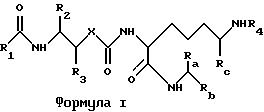
где R1 выбирается из группы, состоящей из водорода, замещенной или незамещенной (C1-C20) алкил группы, замещенной или незамещенной циклоалкил группы, замещенной или незамещенной циклоалкилалкил группы, винил группы, ацетилен группы, замещенной или незамещенной амино группы, замещенной или незамещенной ациламино группы, замещенной или незамещенной арил группы, замещенной или незамещенной аралкил группы, замещенной или незамещенной арилоксигруппы, замещенной или незамещенной алкоксиарил группы, замещенной или незамещенной алкоксиаралкил группы и замещенной или незамещенной моноциклической или бициклической гетероциклической группы, содержащей от 1 до 4 атомов, выбранных из группы, состоящей из атомов азота, серы и кислорода;
R2 и R3 независимо выбираются из водорода, замещенного или незамещенного (C1-C6) алкила, замещенного или незамещенного алкоксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного циклоалкилалкила, замещенного или незамещенного арила, замещенного или незамещенного аралкила, замещенного или незамещенного алкоксиаралкила, винила, ацетилена и замещенного или незамещенного моноциклического или бициклического гетероцикла, содержащего от 1 до 4 гетероатомов, выбранных из группы, состоящей из атомов азота, серы и кислорода при условии что, в случае R3, гетероатомы в названном гетероцикле не связаны непосредственно с -CH- группой -CH-X- остатка;
R2, Rb и Rc независимо выбираются из карбокси или защищенного карбокси, карбокси или защищенного карбоксинизшего алкила и карбоксиамида;
X является кислородом или азотом;
R4 представляет атом P или амино защитную группу и их фармацевтически приемлемые соли.
Ниже даются
конкретные случаи различных упомянутых выше определений и специфические примеры, подпадающие под эти определения:
(a) (C1-C20) алкил группой может быть линейная или
разветвленная низшая алкил группа, имеющая от 1 до 20 атомов углерода, такая как метил группа, этил группа, пропил группа, изопропил
группа, бутил группа, изобутил группа, втор-бутил группа,
трет-бутил группа, пентил группа, неопентил группа, изопентил группа, гексил группа, изогексил группа и так далее.
(b) Циклоалкил группа может быть циклоалкил группой, имеющей от 3 до 6 атомов углерода, такой как циклопропил группа, циклобутил группа, циклопентил группа или циклогексил группа.
(c) Циклоалкилалкил группа может быть циклоалкилалкил группой, имеющей от 4 до 12 атомов углерода, такой как циклопропилметил группа, циклобутилметил группа, циклопентилметил группа, циклогексилметил группа, 1-циклопропилэтил группа, 2-циклопропилэтил группа, 1-циклобутиэтил группа, 2-циклобутилэтил группа, 1-циклопентилэтил группа, 2-циклопентилэтил группа, 1-циклогексилэтил группа, 3-циклогексилпропил группа, 3-циклопентилпропил группа, 4-циклогексилбутил группа, 4-циклопентилбутил группа, 4-циклопентилпентил группа или 4-пентилциклогексил группа.
(d) Ациаламино группа может быть ациламино группой, в которой ацильная составляющая происходит от кислоты, такой как органическая карбоновая кислота или угольная кислота, каждая из которых еще, в частности, включает алифатическую, ароматическую и/или гетероциклическую группу в свою молекулу. Эти ацильные составляющие включают алифатические ацильные группы, имеющие ацильную группу, происходящую от алифатической кислоты и включающей: алканоил (например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, α-этилгексаноил, гептаноил, лауроил, стеароил, доказаноил, группу формулы: CH3(CH2)31CO, [CH3(CH2)21]2CHCO, [CH3(CH2)15]2 CHCO, CH3(CH2)41CO и т.д.); низший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, т-бутоксикарбонил, т-пентоксикарбонил и т.д.) и тому подобные. Ацильная составляющая может также быть ароматическим ацилом, означающим ацильную группу, происходящую от кислоты, имеющей замещенную или незамещенную арильную группу, в которой арильная группа может включать фенил, толил, ксилил, нафтил и тому подобные, и ее подходящие примеры иллюстрируются следующими: ароил (например, бензоил, толуоил, ксилоил, нафтоил, фталоил и т.д.); аралкоксикарбонил (например, бензилоксикарбонил, бензгидролоксикарбонил, тритилоксикарбонил, α- нафтилметоксикарбонил, и т. д.) и тому подобные. Ацильная составляющая может также быть гетероциклической ацильной группой, означающей ацильную группу, происходящую от кислоты, имеющей гетероциклическую группу, и включает: гетероциклический карбонил, в котором гетероциклическая составляющая является 5-6-членным гетероциклом, содержащим по крайней мере от одного до четырех гетероатомов, выбранных из азота, кислорода и серы (например, тиеноил, фуроил, пирролекарбонил, 5-оксо-2- пирролидинкарбонил, никотиноил и т.д.) и тому подобные.
(e) Арил группа может быть арил группой, имеющей от 6 до 15 атомов углерода, такой как фенил группа, дифенилил группа, 1-нафтил группа или 2-нафтил группа.
(f) Аралкил группа может быть аралкил группой, имеющей от 7 до 15 углеродных атомов, такой как бензил группа, 1-нафтилметил группа, 2-нафтилметил группа, 5,6,7,8-тетрагидро-1-нафтил группа, 5,6,7, 8-тетрагидро-2-нафтил группа, фенетил группа, 3-фенилпропил группа или 4-фенилбутил группа.
(g) Арилокси группа может быть арилокси группой, имеющей от 6 до 15 углеродных атомов, такой как фенокси группа, дифенилокси группа, 1-нафтилокси группа, или 2-нафтилокси группа.
(h) Алкоксиарил или алкоксиаралкил группа может быть алкоксиарил или алкоксиаралкил группой, имеющей от 6 до 21 углеродных атома, такой как бензопил группа, или алкоксифенилметил группа.
(i)
Моноциклическая или бициклическая гетероциклическая группа, содержащая от 1 до 4
гетеро атомов, выбранных из группы, состоящей и атомов азота, серы и кислорода, может быть гетероциклической группой,
имеющей от 4 до 15 углеродных атомов, такой как пирролил группа, фурил группа,
тиенил группа, пиридил группа, имидазолил группа, пиразолил группа, тиазолил группа, изотиазолил группа, изоксазолил
группа, офксазолил группа, пиразинил группа, пиримидинил группа, пиридазинил группа,
индолил группа, хинолил группа, изохинолил группа, фталазинил группа, нафтидинил группа, хиноксалинил группа,
хиназолинил группа,
1,4-бензодиоксанил группа, 1,3-бензодиоксанил группа, 1,2,
3- триазолил группа, 1,3,4-триазолил группа, 1,3,4-тиадиазолил группа, 1,2,3-тиадиазолил группа, тетразолил
группа, тетрагидрофуранил группа, тетрагидротиенил группа, пирролидинил группа,
имидазолидинил группа, 2-имидазолинил группа, морфолинил группа, морфолино группа, пиперизин N-окись группа, пиперазин
N-окись группа, морфолин N-окись группа, морфолино группа низшего алкила, такая
как N-метилморфолино группа, N-этилморфолино группа, пиперазинил группа, пиперидино группа, пиперидинил группа,
тиоморфолино группа или тиоморфолинил группа.
Заместителями в вышеупомянутых группах (а) - (i) могут быть: атом галогена, такой как атом хлора, атом фтора или атом брома, гидроксил группа; низшая алкильная группа, такая как метил группа, этил группа, пропил группа, изопропил группа, бутил группа, изобутил группа, втор-бутил группа или трет-бутил группа; низшая алкокси группа, такая как метокси группа, этокси группа, пропокси группа, изопропокси группа, бутокси группа, изобутокси группа, втор-бутокси группа или трет-бутокси группа; арилокси группа, такая как фенокси группа, 1- нафтилокси группа или 2-нафтилокси группа; аралкилокси группа, такая как бензилокси группа, фенетилокси группа, 1-нафтиометилокси группа или 2-нафтилметилокси группа; амино группа; моно- или ди-низшая алкиламино группа, такая как метиламино группа, этиламино группа, пропиламино группа, изопропиламино группа, бутиламино группа, втор-бутиламино группа, изобутил-амино группа, трет-бутиламино группа, диметиламино группа или диэтиламино группа, ариламино группа, такая как фениламино группа, 1-нафтиламино группа или 2-нафтиламино группа; аралкиламино группа, такая как бензиламино группа, фенетиламино группа, 1-нафтилметиламино группа или 2-нафтилметиламино группа; карбоксил группа; формил группа; низшая алкосикарбонил группа, такая как метоксикарбонил группа, этоксикарбонил группа, пропоксикарбонил группа, изопропоксикарбонил группа, бутоксикарбонил группа, вторбутоксикарбонил группа, изобутоксикарбонил группа или третбутоксикарбонил группа; арилоксикарбонил группа, такая как феноксикарбонил группа, 1-нафтилоксикарбонил группа или 2-нафтилоксикарбонил группа, аралкилоксикарбонил группа, такая как бензилоксикарбонил группа, фенетилоксикарбонил группа, 1- нафтилметилоксикарбонил группа, или 2-нафтилметилоксикарбонил группа; меркапто группа; низшая алкилтио группа, такая как метилтио группа, этилтио группа, пропилтио группа, изопропилтио группа, бутилтио группа, вторбутилтио группа, изобутилтио группа или трет-бутилтио группа; арилтио группа, такая как фенилтио группа, 1-нафтилтио группа или 2-нафтилтио группа; аралкилтио группа, такая как бензилтиогруппа, фенетилтиогруппа, 2-нафтилметилтио группа или 2-нафтилметилтио группа; арилсульфинил группа, такая как фенилсульфинил группа, 1-нафтилсульфинил группа или 2-нафтилсульфенил группа; аралкилсульфинил группа, такая как бензилсульфинил группа, фенетилсульфинил группа, 1-нафтилметилсульфинил группа или 2-нафтилметилсульфинил группа; низшая алкилсульфонил группа, такая как метилсульфонил группа, этилсульфонил группа, пропилсульфонил группа, изопропилсульфонил группа, бутилсульфонил группа, изобутилсульфонил группа, втор-бутилсульфонил группа или трет- бутилсульфонил группа; арилсульфонил группа, такая как фенилсульфонил группа, 1-нафтилсульфонил группа или 2-нафтилсульфонил группа; аралкилсульфонил группа, такая как бензилсульфонил группа, фенетилсульфонил группа, 1-нафтилметилсульфонил группа или 2-нафтилметилсульфонил группа; или моноциклическая или бициклическая гетероциклическая группа, имеющая от 4 до 15 углеродных атомов и 1-4 гетеро атома, выбранных из кислорода, азота и серы, такая как пирролил группа, фурил группа, тиенил группа, пиридил группа, имидазолил группа, пиразолил группа, тиазолил группа, изотиазолил группа, изоксазолил группа, оксазолил группа, пиразинил группа, пиримидинил группа, пиридазинил группа, индолил группа, хинолил группа, изохинолил группа, фталазинил группа, нафтидинил группа, хиноксалинил группа, хиназолинил группа, 1,4- бензодиоксанил группа, 1,3-бензодиоксанил группа, 1,2,3-триазолил группа, 2,3, 4-триазолил группа, 1,3,4-тиадиазолил группа, 1,2, 3-тиадиазолил группа, тетразолил группа, тетрагидрофуранил группа, тетрагидротиенил группа, пирролидинил группа, имидазолидинил группа, 2-имидазолинил группа, морфолинил группа, морфолино группа, мофолин N-окись группа, низшая алкил морфолино группа, такая как N-метиморфолино группа, N-этиморфолино группа или N-пропилморфолино группа, пиперазинил группа, пиперидино группа, пиперидинил группа, тиоморфолино группа или тиоморфолинил группа.
Примерительно к данному тексту "низший алкил" означает C1-C6 алкил группу.
Защитные группы для защищенного карбокси или защищенного карбокси низшего алкила включают любые обычные защитные группы для карбокси групп, обычно используемые специалистами в технике химии пептидов и амино кислот, такие как группы, найденные в T.Greene, "Protecting Groups in Organic Synthesis", J.Wiley and Sons, 1981.
Эти группы включают сложные силил эфиры, сложные алифатические эфиры и сложные ароматические эфиры, такие как триметилсилил, т-бутилдиметилсилил, ацетил, бензоил и тому подобные.
Защитная группа для защищенной амино группы включает любую обычную защитную группу для амино групп, обычно используемую специалистами в технике химии пептидов и аминокислот, такую как группа, найденная в T.Greene, supra, pp. 218- 287.
Подходящая защитная группа выбирается так, чтобы условия ее снятия были совместимы с другими структурными особенностями соединения. Подходящие защитные группы включают ацил группы, такие как треб-бутоксикарбонил или бензилоксикарбонил и тому подобные.
Подробное описание изобретения
Согласно приведенному выше общему описанию, соединения Формулы I, которые являются
предпочтительными,
представляют собой соединения, в которых:
R1 выбирается из группы состоящей из
замещенной или незамещенной (C1-C20) алкил группы,
замещенной и незамещенной циклоалкил группы,
замещенной и незамещенной циклоалкилалкил группы,
замещенной или незамещенной арил группы,
замещенной или незамещенной
аралкил
группы,
замещенной или незамещенной арилокси группы,
замещенной или незамещенной алкоксиарил группы и
замещенной или незамещенной алкоксиаралкил группы,
где
арил
составляющая в вышеприведенных группах выбирается из замещенного или незамещенного фенила;
R2 и R3 независимо выбираются из водорода и замещенного и незамещенного
(C1-C6) алкила;
R2, Rb и Rc независимо выбираются из карбокси или защищенного карбокси, карбокси или защищенного карбокси низшего
алкила
и карбоксиамида;
X является кислородом или азотом и
R4 является H или амино защитной группой.
Кроме того, наиболее предпочтительными соединениями
Формулы I
согласно данному изобретению являются те соединения Формулы I, в которых:
R1 выбирается из группы, состоящей из (C4-C14) алкил группы, циклоалкил
группы,
(C2-C8) алкил замещенной циклоалкил группы, фенил группы, бензил группы, (C4-C8) алкилфенилгруппы и (C1-C6) алкил или
алкоксифенилметил групп;
R2 и R3 независимо выбираются из водорода и (C1-C6) алкила;
R2, Rb и Rc
независимо выбираются из: карбокси или защищенной карбокси, карбокси или защищенный карбокси низший алкил и карбоксиамид;
X является кислородом или азотом и
R4 является H
или амино защитной группой.
Особенно наиболее предпочтительными соединениями Формулы I являются те соединения, в которых:
R1 выбирается из группы, состоящей из
н-гексил группы, 4-н-пентил циклогексил группы;
Ra и R3 независимо выбираются из водорода и метила;
R2, Rb и Rc являются
карбокси;
X является кислородом или азотом и
R4 является Н.
Особенно предпочтительными являются те соединения Формулы I, имеющие D-алло-треон конфигурацию
как следует ниже:

в которых R3 является метил и R1 и R2 такие, как определено выше.
Также особенно предпочтительными являются те соединения, имеющие следующую стереохимию в диаминопимелилаланиновой части молекулы:
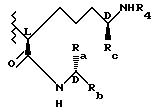
в которых R2 является метилом и Rb, Rc и R4 являются такими, как определено выше.
В отношении стереохимии следующие соединения Формулы I являются особенно наиболее предпочтительными:
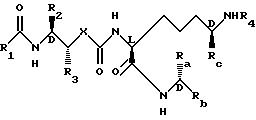
где R3 и Ra представляют метил, X является кислородом, Rb, Rc, R1, R2, R4 - такие, как определено выше.
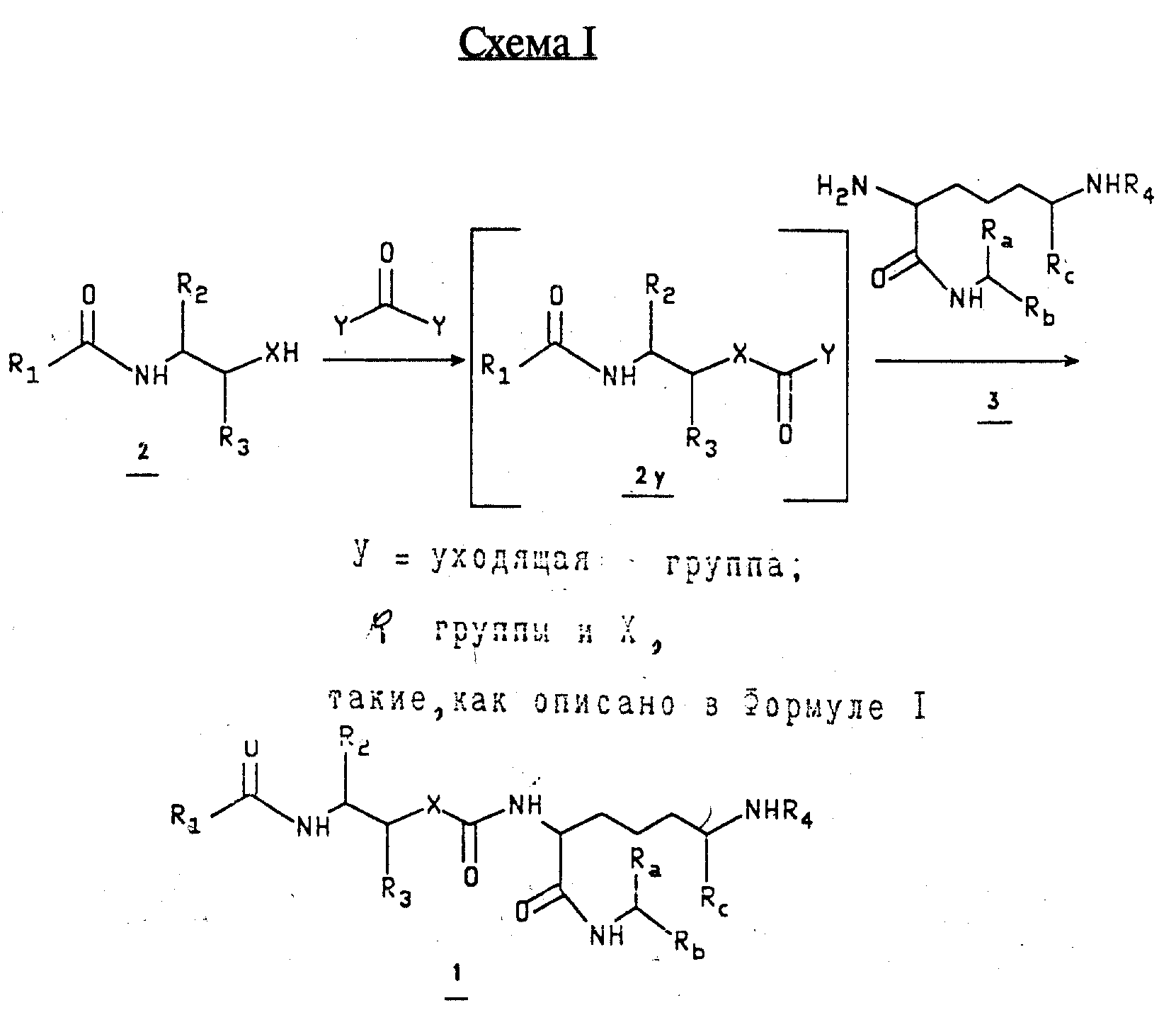
Карбаматы и карбамиды типа 1, которые являются предметом данного изобретения, создаются путем конвергентного синтеза (см. Схему I).
Левовращающий (X=0, спирт 2b, или X=NH, амин 2с) и правовращающий (амин 3) фрагменты, несущие соответствующие защитные группы (примеры обычно используемых амино защитных групп находятся в T.Greene, "Protecting Groups in Organic Synthesis", J.Wiley and Sons, 1981, p.p. 218-287) на многочисленных функциональных группах, приготовляются раздельно. Соединение 2 первоначально подвергается реакции с активированным карбонильным эквивалентом, YC(=0)Y, таким как фосген, трифосген, аддукт фосген/пиридин, трихлорметил хлороформиат, или 1,1'-карбонилдиимидазол, обычно при 0oC и образующееся промежуточное соединение 2y соединяется с 3 образуя карбамат 1а (X=O) или карбамид 1b (X=NH), соответственно.
Или же иначе, амин 3 первоначально подвергается реакции с YC(=O)Y и образующееся промежуточное соединение соединяется с 2, образуя 1a и 1b. Везде применяемые защитные группы удаляются при стандартных условиях для того, чтобы получить соединения типа 1 с незамаскированными функциональными группами.
Левовращающие фрагменты: Для синтеза левовращающего фрагмента 2а выполняется селективное N-ацилирование амино спирта 5 использованием подходящего ацилирующего агента 4 в условиях щелочной среды.
Если нет готового, заданный ацилирующий агент приготавливают из соответствующей кислоты 4а, которую в свою очередь можно получить окислением 6 или окислительным расщеплением 2с-1 по общепринятым методикам (см. Схему II).
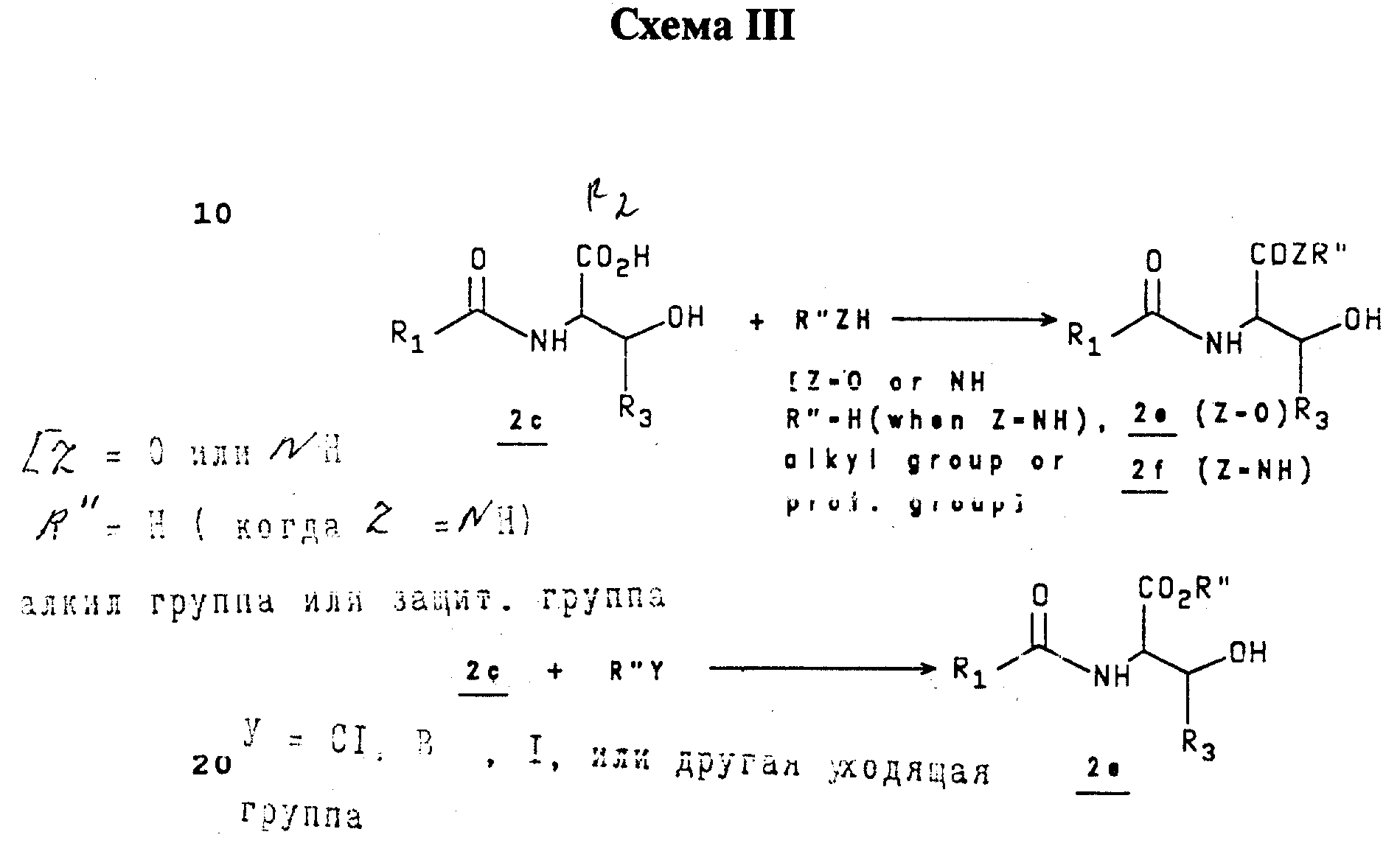
Соединения 2c (2a, где R2=CO2H) превращаются в сложный эфир 2е или амид 2f в условиях кислой среды, использованием подходящего спирта (R''OH) или амина (R''NH2), соответственно. Или же иначе, 2с этерифицируют, используя алкирующий агент R''Y в условиях щелочной среды (см. Схему III).
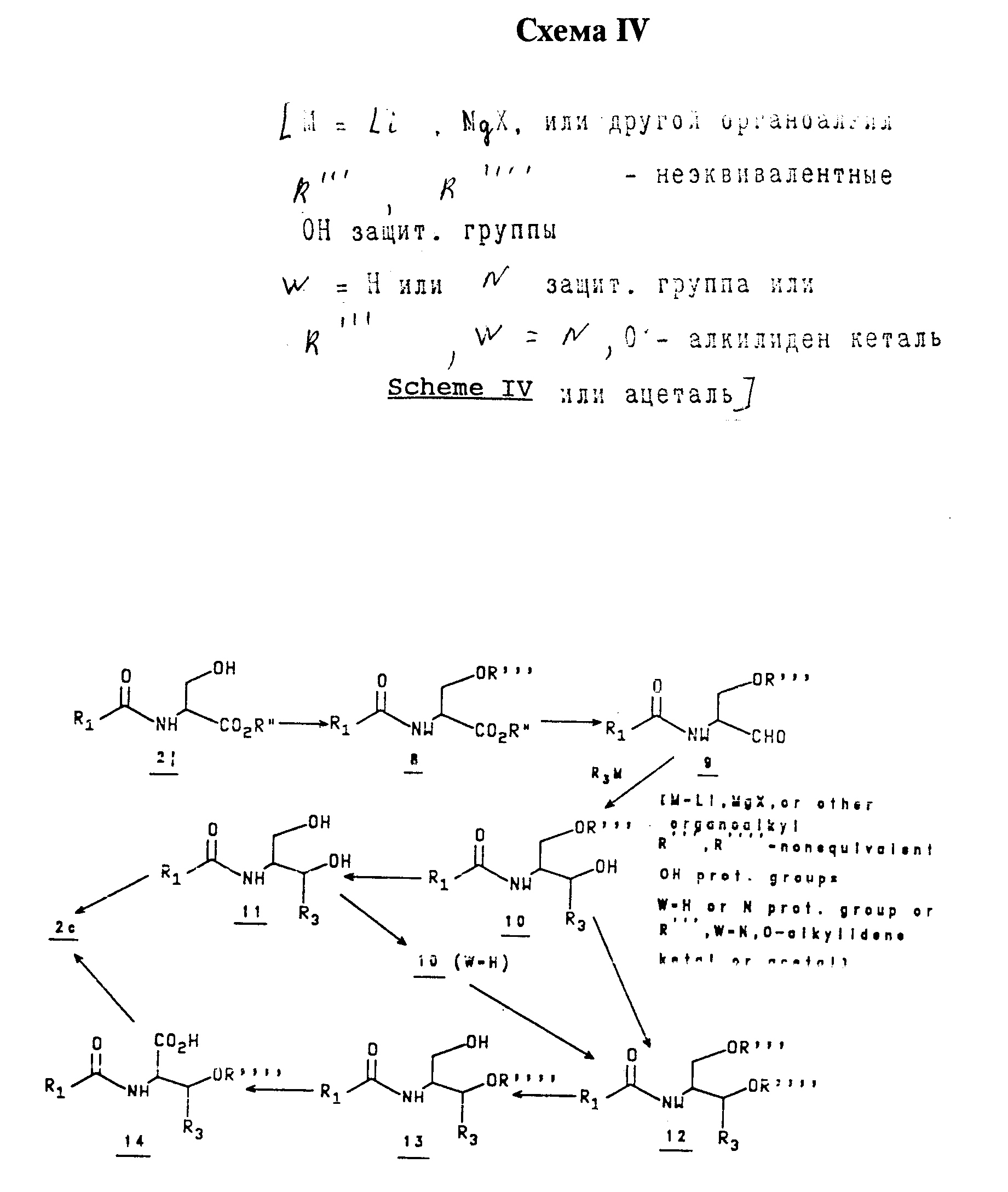
Спирты 2с с различными R3 боковыми цепями приготавливают в соответствии со Схемой IV.
Спирт 2j защищают соответствующей защитной группой (тогда как NH остается свободной, защищают как циклический N,O-ацеталь вместе с OH, или блокируют отдельной амино защитной группой), и сложный эфир 8 восстанавливают до альдегида 9 в одну стадию (Garner and Park, J. Org. Chem., 1987, 52, 2361) или в две стадии через восстановление до спирта и обратное окисление, используя общепринятые методики.
Добавление соответствующего органометаллического реагента R3 М к альдегиду дает 10 как отдельный диастереомер или смесь двух диастереомеров, полученный исходный материал 2j является не рацемическим.
Снятие защиты первичного спирта (и NH, если блокирована) для получения 11, с последующим селективным окислением (согласно Skarzewski, et. al, Tetrahedron Lett. , 1990, 31, 2177) с последующим стандартным окислением образующегося альдегида (согласно Mehltretter, et. al., J.Amer. Chem. Soc., 1950, 73, 2424) дает 2c.
Или же иначе, вторичный спирт в 10 защищают и селективно снимают защиту с первичного спирта (и NH, если блокирована) в образующемся 12 с целью получения 13.
Используя общепринятые методики, последнее соединение окисляют до 14, которое превращают в 2c. Первичные и вторичные спиртовые функциональные группы в 11 также защищают последовательно, чтобы получить 12 (W = Н).
Результирующее превращение из 2j в 2c включает инверсию конфигурации при углероде α в отношении карбоксильной группы, путем транспозиции карбоксил и спиртовой составляющих, и введение R3 группы в β положение, для хиральности. Диастереомеры 10, 12 или 13 могут быть разделены хроматографически.
Таким образом, 2j R конфигурации в α положении могут давать 2с диастереомеры S, R (α, β) и S,S (α,β) конфигурации и 2j S конфигурации могут давать 2с диастереомеры RR (α,β) и R,S (α,β) конфигурации.
Или иначе, 11 или 12 могут быть приготовлены из 5j согласно схеме V. Амин полностью блокируют двумя защитными группами или циклической защитной группой, чтобы получить 15. Конверсия 15 через 16 через 17 до 19 представляет такую же реакционную последовательность, что и описанная выше для перехода 8 через 9 через 10 в 12. Амино защитные группы в 17 или 19 удаляются для получения 18 или 20, соответственно. Последние ацилируют получая 11 или 12.
Для синтеза левовращающего фрагмента 2b ацилирование амина 21 в условиях щелочной среды приводит к 22. Первичный амид подвергается перегруппировке до амина 2b (согласно London et. al., J.Org. Chem. 1984, 49, 4272; Waki, et, al. , Synthesis, 1981, 53, 266; или Koser, et., al., J.Org. Chem., 1988, 53, 5158), (см. Схему VI).
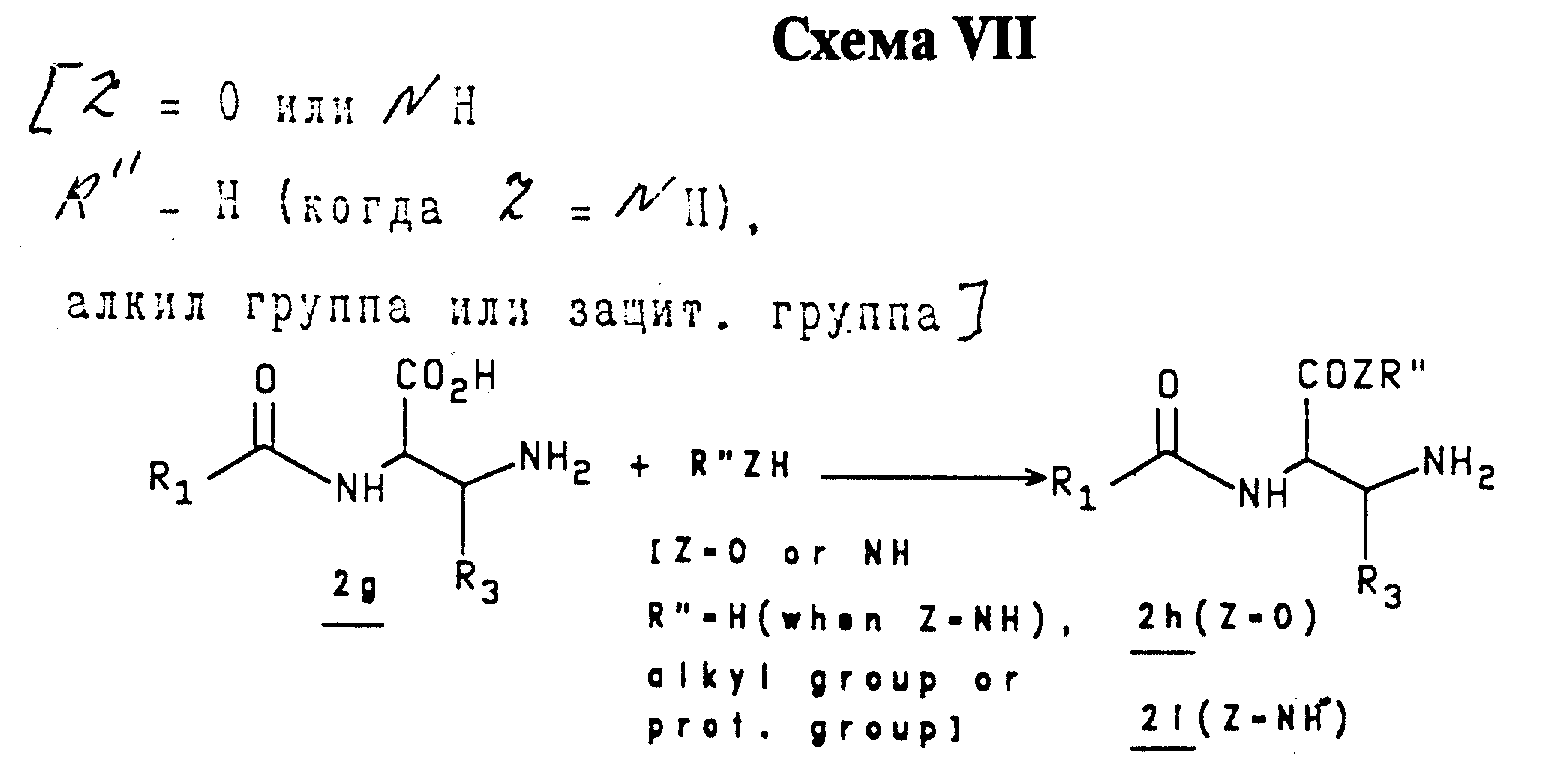
Соединения 2g (2b, где R2=CO2H) превращают в сложный эфир 2h или амид 2i (показано в Схеме VII) в условиях кислотной среды, используя подходящий спирт (R''OH) или амин (R''NH2), соответственно. Или иначе, амин 2g защищают как карбамат BOC или CBZ; кислоту превращают в сложный эфир или амид в условиях щелочной среды; и защитную группу удаляют, получая 2h и/или 2i.
Амины 2g с различным R3 алкильными боковыми цепями приготавливают согласно Схеме VIII. Спирт 10 получают согласно Схеме IV или путем восстановления имеющейся в наличии кислоты 2с, с последующей защитой образующегося первичного спирта 11.
Соединение 10 затем превращают по общепринятым методикам в азид 24 через промежуточное соединение 23. Азидная составляющая восстанавливается до амина (25) путем каталитического гидрирования, и последний защищают, получая 26.
Или иначе, окисление 10 по стандартной методике дает 27. Восстановительное амидирование кетона с соответствующим амином (W'''NH2) дает 28, который в свою очередь превращают в 26 (W'''=алкил, W''=алкоксикарбонил), путем дальнейшей защиты как карбамата или в 26 (W''=алкоксикарбонил, W'''=H) путем снятия защиты (до 25=) и повторной защиты.
Снятие защиты первичного спирта в 26 (и амида NH, если блокирован) для получения 29, с последующим окислением дает 30, как в Схеме IV для превращения 13 в 14. Амино защитную группу(ы) снимают для получения 2g.
Полученные в конце диастереоизомеры из 10 или 28 могут быть разделены хроматографически на одной из промежуточных (28, 26 или 29) стадий.
Или иначе, 26 может быть приготовлено из 17 согласно Схеме IX. Превращения 17 в 31 в 32 в 33 в 34, или 17 в 35 в 36 в 34 представляют такие же последовательности реакций, как описаны выше для 10 в 23 в 24 в 25 в 26, или 10 в 27 в 28 в 26, соответственно. Амино защитные группы W и W' удаляют, чтобы получить 37. Последнее ацилируют, получая 26.
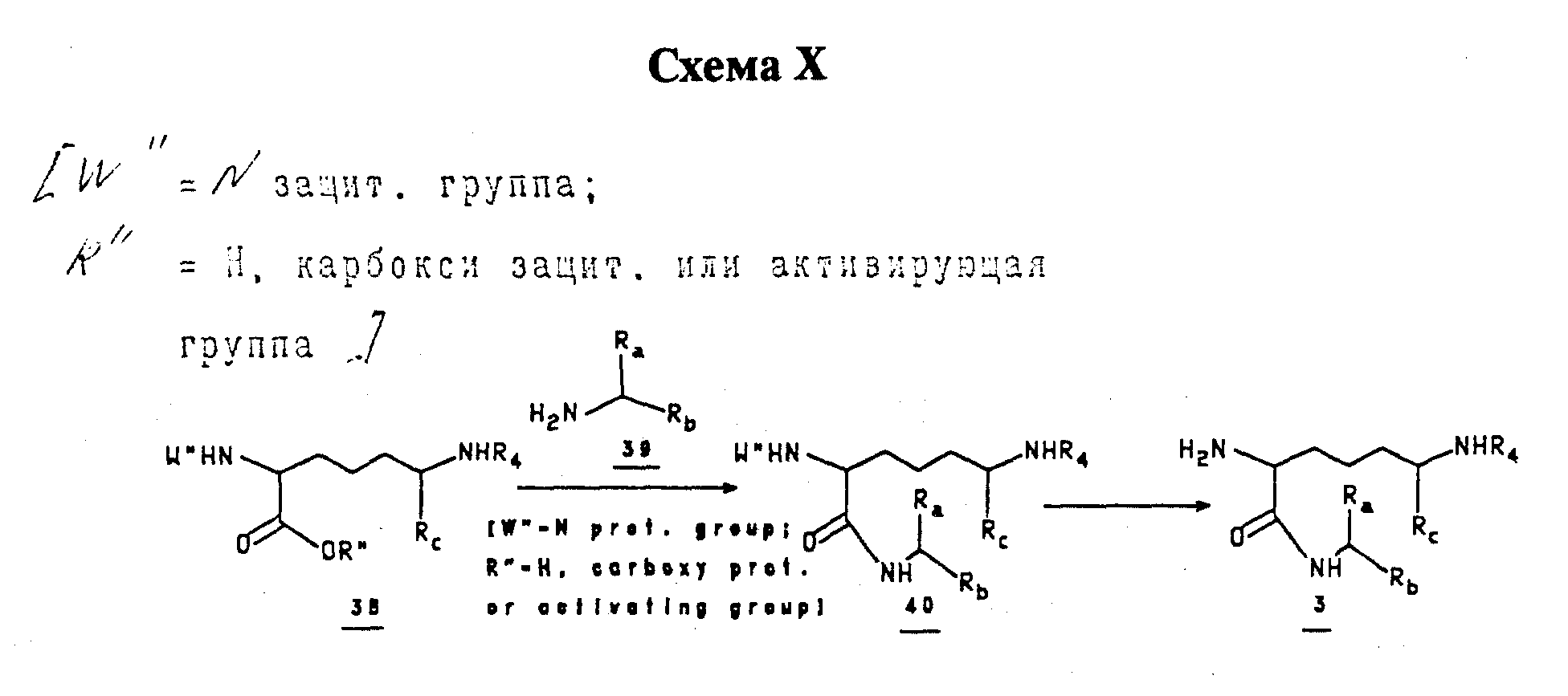
Правовращающие фрагменты: Фрагмент 3 приготавливают присоединением кислоты (или защищенной кислоты) 38 к соответствующему амину 39 с последующим селективным снятием защиты промежуточного соединения 40 (см. Схему X).
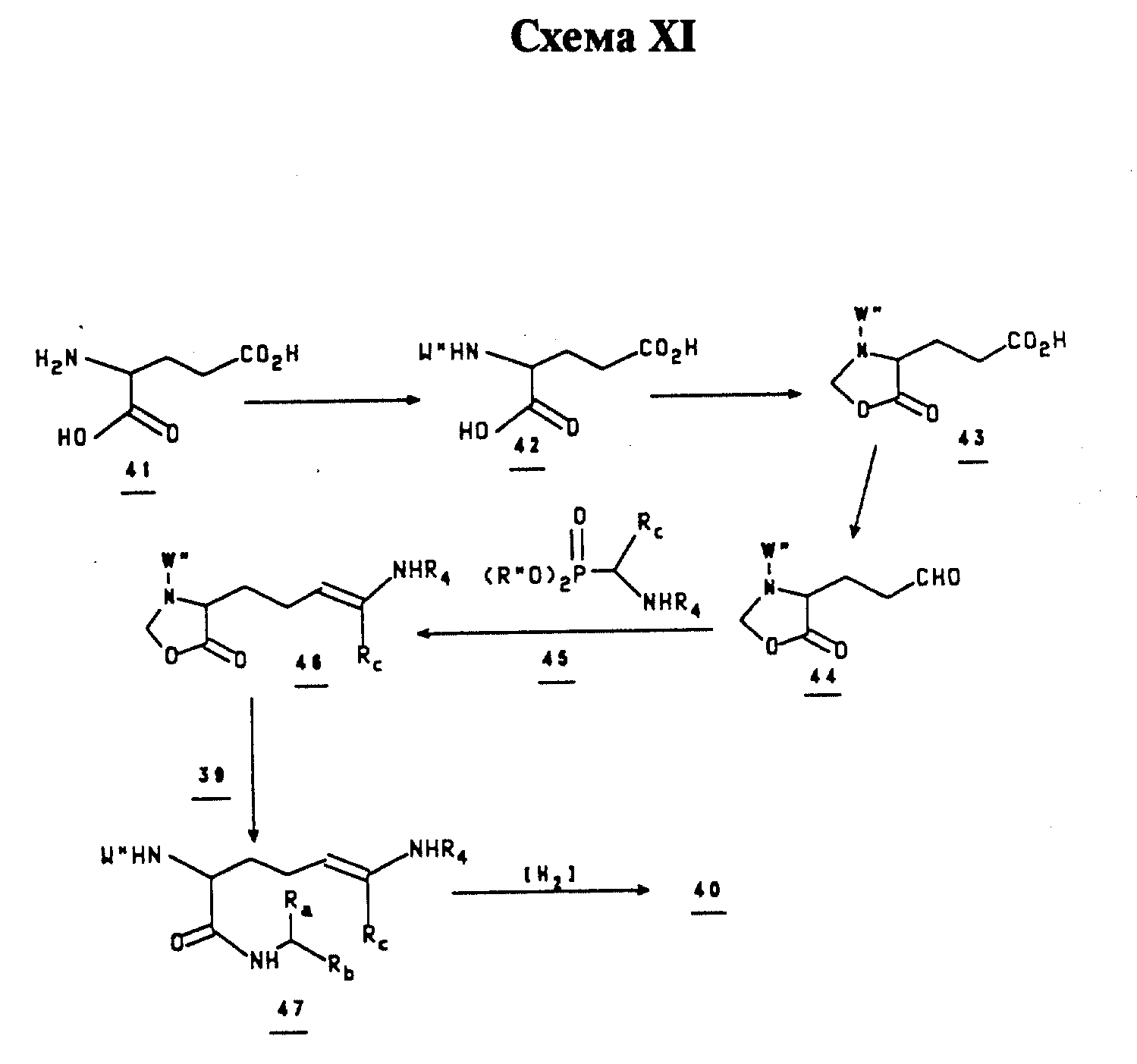
Кислоты 38 или амиды 40 приготавливают в соответствии с Kolodziejczyk, et. al (Int. J. Pept. Prot. Res., 1992, 39, 382; и ссылки в нем), Jurgens (Tetrahedron Lett, 1992, 33, 4727; и ссылки в нем), Williams (J. Org. Chem., 1992, 33, 4727; и ссылки в нем), Hashimoto (Tetrahedron Lett, 1982, 23, 693; и ссылки в нем), или согласно Схеме XI. Глутаминовую кислоту (41, хиральную или рацемическую) защищают при стандартных условиях, получая 42, которое в свою очередь конденсируют с формальдегидом для получения 43.
Последнее соединение восстанавливают до альдегида 44 по методике, использующей один реактор. Конденсация типа Виттига-Хорнера-Эммонса альдегида с реагентом типа 45 (приготовленным согласно Schmidt, et. al, Synthesis, 1984, 53) дает 46. Реакция лактона с подходящим амином 39 (если нет в наличии, приготовленным по методикам, описанным в "Synthesis of Optically Active α - Amino Acids", R.M. Williams, Ed., Pergamon Press, 1989; и ссылки в нем), сопровождающаяся потерей формальдегида, приводит к образованию 47. Каталитическое гидрирование двойной связи дает 40.
Когда используют хиральное соединение 41 в качестве исходного материала, то диастереомеры 40 разделяют путем фракционной кристаллизации или хроматографии. Соотношение полученных диастереомеров зависит от выбора защитных групп, катализатора гидрирования, и реакционных условий [Knonles, et. al., J. Amer. Chem. Soc. 99, 5947 (1988); Ojima and Suzuki, Tetrahedron Lett., 21, 1239 (1980)].
Так, 41 S конфигурации дает диастереомеры 40, несущие S,S и S,R конфигурацию на А2 pm, и 41 R конфигурации может давать диастереомеры 40, несущие R,S и R,R конфигурацию на A2pm.
Реакции осуществляют в растворителе, соответствующем применяемым реагентам и материалам и подходящем для выполняемых превращений. Специалисту в технике органического синтеза понятно, что присутствие различных функциональных групп в молекуле должно соответствовать предполагаемым химическим превращениям.
Это потребует часто правильного выбора относительно последовательности реакционных стадий, защитных групп, если необходимы, и условий снятия защиты.
Заместители в исходных материалах могут быть несовместимыми с некоторыми условиями реакций. Такие ограничения к заместителям, которые совместимы с условиями реакций, будут очевидны для специалистов в технике.
Фармацевтически приемлемые соли включают как неорганические соли металлов так и органические соли, список которых приведен в Remingron's Pharmaceutical Sciences, 17th Edition, pg. 1418 (1985).
Специалистам в технике хорошо известно, что соответствующая форма соли выбирается на основании физической и химической стабильности, текучести, гигроскопичности и растворимости.
По приведенным выше причинам предпочитаемые соли данного изобретения включают соли калия, натрия, кальция, магния и аммония.
Некоторые соединения, описанные в приведенных выше схемах, имеют центры асимметрии. Данное изобретение включает все стереоизомеры соединений или свободные от других стереоизомеров или смешанные с другими стереоизомерами в некотором соотношении и таким образом включает, к примеру, рацемическую смесь энантиомеров, а также и диастереомерную смесь изомеров.
Новые соединения данного изобретения полезны благодаря их способности индуцировать образование цитокинов и восстанавливать костный мозг после химиотерапии, как показали следующие испытания.
Описание приготовления образцов Биологических Проб Интерлейкина 6(IL-6) для
структурно-функционального анализа -
Испытуемые соединения растворяют в воде и
применяют подкожно в 0.2 мл, чтобы доставить дозу 0.1-10 мг/кг.
Плохо растворимые соединения сначала растворяют в 100% этаноле и затем доводят до соответствующей концентрации в воде.
Через четыре часа после инъекции мышам спускают кровь и вливают сыворотку. IL-6 зависимую линию клеток 7TD1 используют для приготовления пробы серийных разбавлений сывороток IL-6 содержимого. 7TD1 клетки (1 • 104) помещают в ячейки микротитра и инкубируют при 37oC в течение 72 часов со стандартным рекомбинантом для мышей IL-6 или с разбавлениями сыворотки, которые будут испытываться.
По прошествии последних 6 часов, клетки получают импульс с3H-Tdr (мкКи). Затем клетки собирают и определяют степень пролиферации по поглощению3H-Tdr, измеренному путем жидкостной сцинтилляционной спектрометрии. Концентрацию IL-6 в сыворотке рассчитывают из стандартных кривых, использующих рекомбинант IL-6 от RGD Systems Ins., и приводят в единицах IL-6 активности, как определено изготовителем.
Проверка
фактора стимуляции колоний гранулоцита (GCSF) -
Биопроба на GCSF
выполняется идентичным IL-6 испытанию способом за тем исключением, что используется GCSF зависимая линия клеток NFS-60 вместо
IL-6 зависимой 7TD1 линии клеток.
Для испытания специфичности пробы используют нейтрализующее моноклональное антитело для GCSF мыши.
Испытания образующего колонию
Гранулоцит-Макрофага (CFU-GM) -
Мышей обрабатывают 150
мг/кг 5-FU и, спустя 24 часа, начинается обработка испытуемым соединением. В последующие дни мышей забивают путем сворачивания шейного
позвоночника, и бедренные кости отделяют в стерильных условиях.
Бедренные кости промывают 1 мл охлажденной льдом среды (Iscove's среда, дополненная 20% FCS, 1% пеницилин-стрептомицина, 1% глутамина и
5 • 10-5 М 2-меркаптоэтанола).
Клетки костного мозга (5 • 105) затем помещают в 12 х 75 мм чашки для тканевых культур в 3 мл теплой ararose (3%) в Iscove's среде со 100 ед/мл мышиного рекомбинанта GM-CSF, приобретенного от Genzyme (Boston, МА).
Чашки инкубируют в течение 7 дней при 37oC в 5% CO2. Спустя 7 дней, колонии из 50 клеток и более перечисляют под препаровальной лупой.
Испытание сывороточного фактора стимуляции колоний (CSF) -
Для определения наличия CSF активности в
сыворотке, введенной с испытуемыми соединениями,
используют испытание, которое определяет активность фактора стимуляции колонии, но не делает различия между различными типами факторов стимуляции
колонии. Клетки костного мозга приготавливают, как
описано выше для CFU-GM испытания.
Затем клетки инкубируют в мягком агаре с 0.3% конечной концентрацией сыворотки, взятой из мышей через 4 часа после инъекции с испытуемыми соединениями.
После 7 дней инкубации при 37oC число образующих колонию (CFU) клеток на 105 высеянных на чашки клеток костного мозга определяют путем подсчета колоний из более чем 50 клеток под препаровальной лупой. Данные приводятся, как CFU/105 клеток костного мозга.
Испытание циркуляции
нейтрофила -
Мышей обрабатывают
5-FU (150 мг/кг) и, спустя 24 часа, начинают ежедневно обрабатывать испытуемым соединением. Мышам ежедневно спускают кровь путем заглазничной пункции в
гепаризинированные капиллярные трубки.
Циркулирующие количества WBC определяют с помощью счетчика культур. Мазки крови подкрашивают раствором Wright-Geimsz и процент циркуляции нейтрофилов определяют
дифференциальным подсчетом под
микроскопом.
5-Фторурацил (5- FU) Индуцированная Нейтропения у мышей -
Мышей обрабатывают внутрибрюшинно 150 мг/кг агента химиотерапии 5-FU,
который вызывает резкое снижение
нейтрофилов в периферической крови после 5-6 дней.
Через 24 часа после введения дозы начинают обработку испытуемыми соединениями. Влияние испытуемых соединений на восстановление клеток, предшествующих нейтрофилам, определяют путем CFU-GM испытания. Восстановление циркулирующих нейтрофилов сопровождается дифференциальным окрашиванием периферической крови.
Дельта испытание -
Мышей обрабатывают единичной дозой 5-FU (150 мг/кг внутрибрюшинно). Спустя 24 часа, клетки костного мозга удаляют и расщепляют в 2 аликвотах. Одну
аликвоту высеивают
непосредственно в мягкий агар с 15 нг/мл IL-1 и 250 ед/мл GM-CSF.
Через 14 дней определяют число колоний (CFU-1). Вторую аликвоту клеток помещают в культуру в жидкой среде с единичными факторами роста или лекарственные препараты или комбинации каждого с целью проверки способности агентов расширять совокупность образующих колонию клеток.
После 7 дней в культуре в жидкой среде эти клетки собирают и высеивают в мягкий агар с IL-1 и GM-CSF как и с первой аликвотной пробой.
Через 14 дней определяют число колоний во второй аликвоте, (CFU-2). Соотношение или дельта рассчитывается как CFU-2/CFU-1, и это соотношение используют, чтобы установить способность факторов роста и/или лекарственных препаратов, используемых в жидкой фазе, индуцировать рост образующих колонию клеток (CFU) или дифференцировкой от пред- CFU до CFU.
Результаты -
Испытуемые соединения способны индуцировать продуцирование IL-6 в
сыворотке мышей за время в пределах 4 часов при единичной подкожной инъекции (Таблица 1). Аналогично, также обнаруживается активность сыворотки CSF с этими соединениям на мышах (Таблица 2).
Испытание IL-6 выполняют количественным методом и используют для определения относительной активности. CSF испытание осуществляется при единичной концентрации сыворотки и является поэтому качественным по природе.
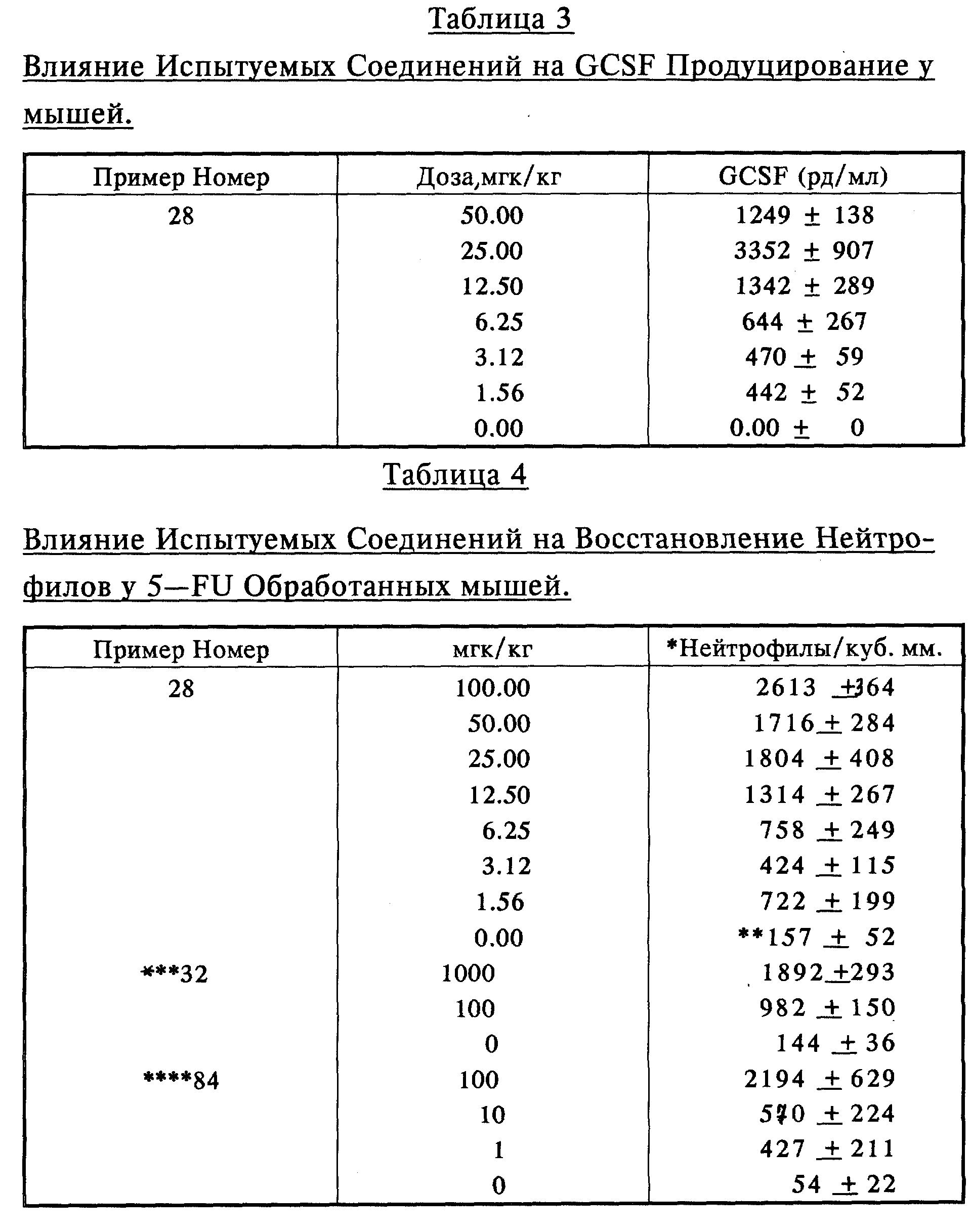
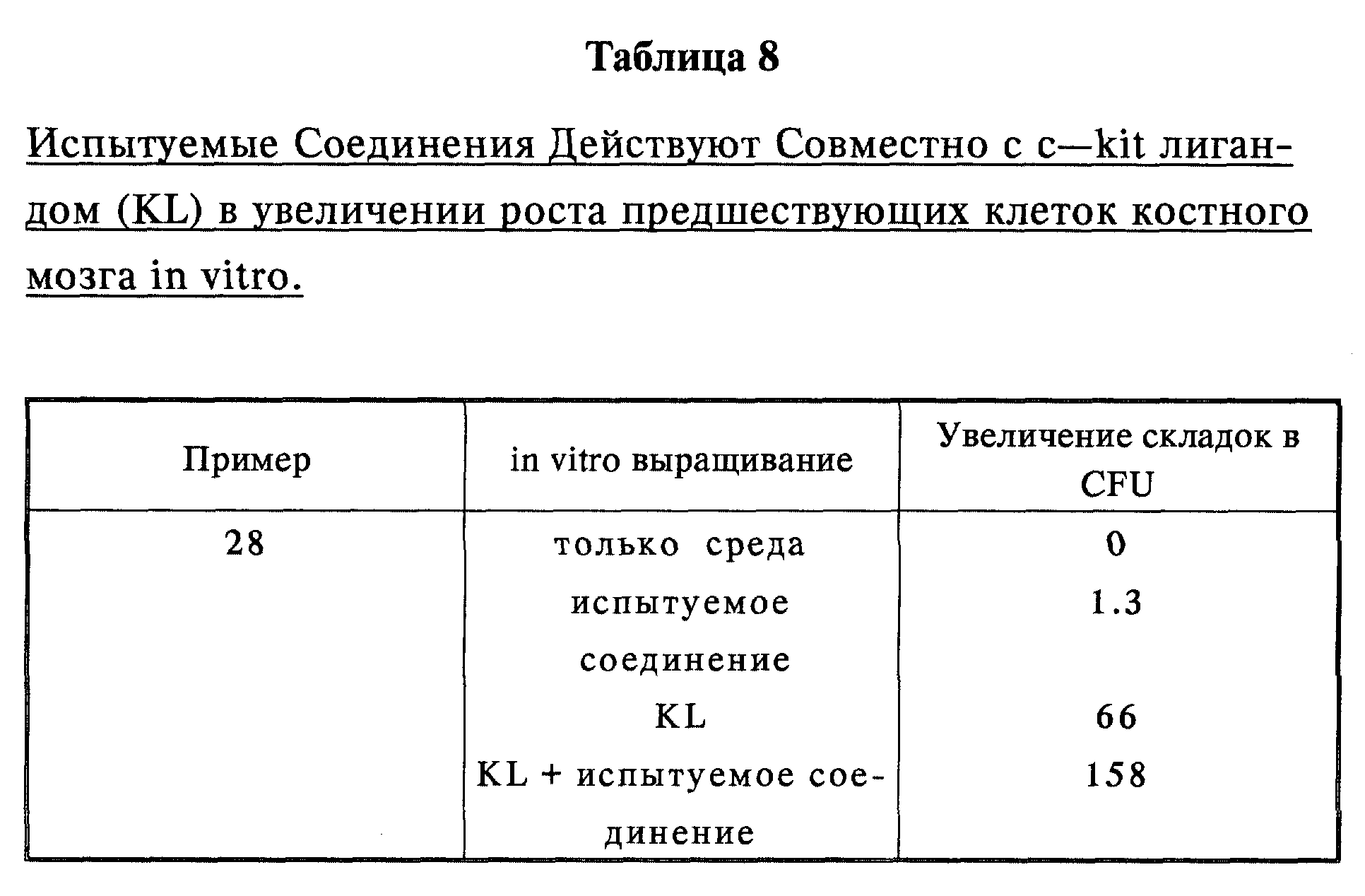
Показано, что типичное соединение (Пример 28) также индуцирует GCSF в сыворотке и инъецированных мышей (Таблица 3). Показано, что характерные соединения (Примеры 28, 32 и 84) вызывают восстановление нейтрофилов в 5-FU обработанных мышах (Таблица 4). Характерное соединение (Пример 28) увеличивает восстановление нейтрофилов периферической крови, которому предшествует увеличение CFU-GM, предшественников нейтрофилов в костном мозге (Таблица 5), показывая таким образом, что испытуемые соединения оказывают воздействие на костный мозг.
Типичное соединение (Пример 28) также вызывает IL-6 и GCSF продуцирование в сыворотке 5-FU обработанных приматов (Таблица 6). Характерное соединение (Пример 32) ускоряет восстановление нейтрофилов у приматов, обработанных химиотерапевтическим агентом цитоксан (Таблица 7).
Выделяют группы, обработанные испытуемыми соединениями, чтобы контролировать соответствующие уровни выздоровления: на 7 сутки против 10 суток для группы, обработанной только цитоксаном.
Таким образом, испытуемые соединения вызывают аналогичный спектр цитокинов и облегченное восстановление нейтрофилов как у приматов, так и у мышей.
Характерное соединение (Пример 28) действует синергитически in vitro (в лабораторном сосуде) с кроветворным C-kit (набор) лигандом фактора роста (KL), увеличивая рост клеток - предшественников костного мозга (Таблица 8).
Это к тому же подтверждает предположение, что данные соединения действуют таким образом, что увеличивают рост предшествующих нейтрофилам клеток в костном мозге.
Испытуемые соединения активны также в ускорении восстановления нейтрофилов у 5-FU обработанных мышей, когда вводятся орально (через рот) (Таблица 9), как показано на характерных соединениях (Примеры 28 и 32).
Клиническая значимость -
Данные, собранные на описанных испытуемых
соединениях, показали, что они способны вызывать эндогенное продуцирование факторов роста (IL-6 и GCSF), которые, как известно, регулируют продуцирование нейтрофилов в костном мозге.
Эти соединения могут быть использованы терапевтически для восстановления нейтрофилов после химиотерапии злокачественных новообразований, радиационной терапии, трансплантации костного мозга или инфекций.
В добавок, соединения могут быть использованы в комбинации с рекомбинантными факторами роста для усиления активности молекул рекомбинанта.
Кроме того, эти соединения могут быть полезны при лечении злокачественных опухолей, СПИДа, апластической анемии, миелодиспластического синдрома, инфекционных заболеваний и для усиления иммунной реакции. В отличии от рекомбинантных факторов роста, испытуемые соединения эффективны, когда принимаются орально.
Мыши (10/группу) получили единичную подкожную инъекцию испытуемого соединения, и кровь забрана спустя 4 часа. GCSF уровни в сыворотке определяют с помощью биопроб, используя GCSF зависимую линию клеток NES-60 (см. Таблицу 3).
Группы из 5 мышей, обработанные 5-FU при 150 мг/кг и начиная от 24 часов после этого ежедневно обрабатываемые испытуемым соединением подкожно при 0.1 мг/кг. Приведены данные на третий день после 5-FU обработки (см. Таблицу 5).
Группы из 3 cynomolgous обезьян обрабатываются 5-FU при 125 мг/кг и, начиная от 24 часов, после этого обрабатываются испытуемым соединением подкожно при 0.05 мг/кг. Данные приведены для сывороток, взятых через 4 часа после обработки испытуемым соединением (см. Таблицу 6).
Группы из 4 cynomolgous обезьян обрабатывают на день 1 и день 0 цитоксаном при 60 мг/кг. Начиная от 24 часов после введения второй дозы цитоксана, одну группу обрабатывают ежедневно подкожно мг/кг испытуемого соединения и другую - только средой (вода) (см. Таблицу 7).
Клетки костного мозга из 5-FU обработанных мышей используют для обогащения ранних клеток предшественника. Клетки расщепляют в 2 аликвотах, как описано в методологическом разделе для "дельта испытания". Увеличение складок определяют путем измерения воздействия на 7 день in vitro инкубацией клеток с тканевой культурной средой и/или К фактора роста на образующие колонию клетки (CFU).
Число CFUS затем сравнивают с образованием колонии свежими клетками костного мозга, которые не инкубировались in vitro, чтобы определить возрастание складок. Испытуемое соединение используют in vitro при 0.5 мгк/мл (см. Таблицу 8).
Группы из 5 мышей обрабатывают 150 мг/кг 5-FU. Спустя сутки, начинается ежедневное оральное введение дозы испытуемых соединений и продолжается в течение 10 дней. Приведенные данные соответствуют 6 дню после 5-FU обработки (см. Таблицу 9).
Когда соединения применяются для приведенных выше целей, они могут быть смешаны с одним или более фармацевтически приемлемыми носителями, например, растворителями, разбавителями и тому подобными, и могут быть назначены орально в таких формах, как таблетки, капсулы, способные к дисперсии порошки, гранулы, или суспензии, содержащие, например, приблизительно от 0.05 до 5% суспендирующего агента, сиропы, содержащие, например, приблизительно от 10 до 50% сахара, и эликсиры, содержащие, например, приблизительно от 20 до 50% этанола, и тому подобные, или парентерально в форме стерильных растворов для инъекций или суспензий, содержащих приблизительно от 0.05 до 5% суспендирующего агента в изотонической среде.
Такие фармацевтические препараты могут содержать, например, приблизительно от 0.05 до 90% активного ингредиента в комбинации с носителем, наиболее часто приблизительно между 5% и 60% по весу.
Эффективная доза активного ингредиента, которая применяется, может варьироваться в зависимости от конкретного употребляемого соединения, способа назначения и жесткости условий в которых будет проводиться лечение.
Однако, в основном, удовлетворительные результаты получаются, когда соединения изобретения назначаются в виде ежедневных доз в количестве приблизительно от 15 мгк до 100 мкг/кг веса тела животного, предпочтительно вводимого раздельными дозами от двух до четырех раз в день или в выдержанной реализуемой форме.
Для наиболее крупных млекопитающих общая ежедневная доза составляет приблизительно от 1 до 20 мгк. Формы дозировки, подходящие для внутреннего применения, содержат приблизительно от 5 мкг до 25 мгк активного соединения в тесной смеси с твердым или жидким фармацевтически приемлемым носителем.
Эта схема приема лекарственного средства может быть изменена для обеспечения оптимального терапевтического эффекта. Например, несколько раздельных доз может назначаться ежедневно или может быть пропорционально снижена как указано, с учетом терапевтической ситуации.
Эти активные соединения могут назначаться как орально, так и внутривенно, внутримышечно или подкожно. Твердые носители включают крахмал, лактозу, дикальций фосфат, микрокристаллическую целлюлозу и каолин, тогда как жидкие носители включают стерильную воду, полиэтилен гликоли, неионные поверхностно-активные вещества и пригодные в пищу масла, такие как кукурузное, арахисовое и кунжутное масла, как соответствующие природе активного ингредиента и конкретной форме желаемого введения.
Могут быть выгодно включены адъюванты, обычно применяемые в приготовлении фармацевтических композиций, такие как корригирующие агенты, красители, консервирующие агенты, и антиоксиданты, например витамин E, аскорбиновая кислота, ВНТ, ВНА.
Предпочтительными фармацевтическими композициями, с точки зрения легкости приготовления и применения, являются твердые композиции, в частности, таблетки и твердо-наполненные или жидко-наполненные капсулы. Предпочтительно, оральное применение соединений.
Эти активные соединения также могут назначаться парентерально или внутрибрюшинно.
Растворы или суспензии этих активных соединений в форме свободного основания или фармакологически приемлемой соли могут быть приготовлены в воде соответственно смешанной с сурфактантом (поверхностно-активным веществом), таким как гидроксипропилцеллюлоза. Дисперсии также могут быть приготовлены в глицерине, жидких полэтиленгликолях и их смесях в маслах.
При обычных условиях хранения и использования эти препараты содержат предохранительные вещества для предотвращения роста микроорганизмов.
Фармакологические формы, удобные для использования в качестве инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки для импровизированного приготовления стерильных растворов или дисперсий для инъекции.
Во всех случаях форма должна быть стерильна и должна быть жидкой, чтобы было легко заполнить шприц. Она должна быть стабильной в условиях изготовления и хранения и должна быть предохраненной от заражающего воздействия микроорганизмов, таких как бактерии и грибки.
Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиспирт (например, глицерин, пропилен гликоль и жидкий полиэтилен гликоль), подходящие их смеси, и растительные масла.
Сокращения
IL: интерлейкин
CSF: фактор стимуляции
колонии
G: (гранулоцит)
-, М (макрофаг)-, и
GM: (гранулоцит - макрофаг) CSF'S
AL2: аланин
A2pm: 2,6-диаминопимеловая кислота
Lys:
лизин
Ser: серин
Thr: треонин
BOC: т-бутоксикарбонил
BOP: бензотриазолилокситрис (диметиламино) фосфоний гексафторофосфат
CBZ: карбобензилокси
TFA: трифторуксусная кислота
MS: молекулярные сита
TEA: триэтиламин
DMAP: диметиламинопиридин
T.F.A.: трифтороуксусная кислота
В спектрах NMR:m:
мультиплет
(NMR)
S: синглет
d: дуплет
t: триплет
q: квартет
dd: двойной дуплет
br: уширенный сигнал
dq: двойной квартет
ddd: тройной дуплет
m.p.: температура
плавления
I.R. - UK-спектр
fine structure -тонкая структура
multiplets - мультиплет
overlapping - перекрывающийся
apparent - кажущийся
Соединения
данного изобретения и их приготовление могут быть лучше поняты из приведенных далее примеров, но не ограничиваются ими.
В приведенных далее примерах, если не оговорено особо, продукты разделяют путем мгновенной (флэш) хроматографии на силикагеле-60 (230-400 меш.). Чистоту продуктов определяют путем ТСХ на силикагеле GF (250 мм). Точки плавления определяют на приборе для определения температуры правления и не корректируют (все температуры вoC).
Если не оговорено особо, ПМР (300 МГц) спектр получают для растворов в дейтерохлороформе (1% внутренний стандарт, Me4Si; постоянные связи приведены в Hz единицах (Гц)). Реакции, требующие безводных условий, выполняют в атмосфере аргона, используя растворители в бутылках с изолирующими перегородками.
Органические растворы высушивают над сульфатом магния или сульфатом натрия, и растворители удаляют при пониженном давлении на роторном испарителе.
Пример 1
N-(1-оксогептил)-D-алло-Треонин (2с-1)
Раствор н-гептаноил хлорида (440 мл, 2.83 ммоля) в ТГФ (250 мл)
добавляют по каплям, за период в 30 мин, к охлажденной (-5 до 0oC), тщательно перемешиваемой смеси D-алло-Thr (300 мг, 2.51 ммоля) и 2H водн. NaOH (3.5 мл, 7.0 миллиэквивал.) в ТГФ (4.0
мл).
Образующуюся смесь перемешивают в течение 2 ч при той же самой температуре и в течение всей ночи при комнатной температуре. Летучие соединения удаляют, и остаток разбавляют водой и подкисляют, используя конц. HCl. Смесь экстрагируют ЕtOАс, и объединенный органический раствор промывают раствором соли, высушивают, фильтруют и концентрируют, чтобы получить неочищенный 2с-1 (420 мг, содержащий 10% избыток гептаноил реагента), который затвердевает при стоянии.
NMR "дельта" 1.28 (d, J = 6.5, 3H), 4.20 (m, 1H), 4.61 (dd, J = 3.4, 6.6, 1H), 6.56 (br d, J= 6.9, 1H); [α] -38±2 (CHCl3).
Пример 2
N-(1-оксогептил)-D-Треонин (2с-2)
D-Thr (2.50 г,
20.99 ммоля) превращают в 2с-2, следуя методике, описанной в Примере 1:
NMR δ 1.22 (d, J = 6.4, 3H), 4.45 (m, 1H), 4.55 (dd,
J = 1.9, 8.3, 1H), 6.30-6.80 (br s, variable, > 2H),
6.88 (br d, J = 8.3, 1H); MS (HR-EI) m/z 321.1939 (M calcd. for C18H27NO4, 321.1940).
Здесь и далее:
variable - переменная величина
calcd. - рассчитан.
Пример 3
N-(1-оксогептил)-L-алло-Треонин (2с-3)
L-алло-Thr (150 мг, 1.26 ммоля)
превращают в 2с-3, следуя методике, описанной в Примере 1:
NMR тот же самый, что и для 2с-1.
Пример 4
N-(1-оксогептил)-L-Треонин (2с-4)
L-Thr (300 мг, 2.51
ммоля) превращают в 2с-4, следуя методике, описанной в Примере
1:
ПМР тот же самый, что 2с-2.
Пример 5
N-(1-оксогептил)-D-Серии (2с-5)
D-Ser (6.00 г, 57.09
ммоля) превращают в 2с-5, следуя методике, описанной в Примере
1. Сырой продукт очищают хроматографически (2 х 21 см колонка, градиент 1% CH3OH и 0.5% HOAc до 3% CH3OH и 2% HOAc
в CH2Cl2):
ЯМР (CD3
OD) δ 0.90 (t, J = 6.8, 3 H), 1.32 (m, 6 H), 1.63 (m, 2 H), 2.27 (apparent t, J ≈ 7.5, 2H), 3.81 and 3.89 (AB of ABX, JAB = 11.2, JAX = 4.1, JBX = 5.0,
2Н), 4.49 (X of ABX, J 4.2, 4.8, 1H); MS (Cl, NH4) m/z 218 (M + H), 235 (M + NH4)]; [α]
Пример 6
N-[транс(4-пентилциклогексил)карбонил]-D-алло-Треонин (2с-6)
Раствор транс-4-пентилциклогексан карбоновой
кислоты (198 мг, 1.0 ммоля) в сухом толуоле (1 мл) обрабатывают оксалил хлоридом (760 мг, 5.9 ммоля) при 0oC и смесь перемешивают в
течение 2 ч при той же самой температуре и 1 ч при
комнатной температуре. Избыток реагента удаляют при пониженном давлении. Раствор сырого хлорангидрида в сухом ацетонитриле (2 мл) добавляют к смеси
D-алло-Thr (100 мг, 0.84 ммоля), 2HNaOH (600 мкл,
1.20 миллиэкв.) и TEA (85 мг, 0.85 ммоля) в ТГФ (1.5 мл), согласно методике, описанной в Примере 1. Сырой продукт 2с-6 очищают хроматографически (1.5
х 18 см колонка, 5% CH3OH и 0.4% HOAc в
CH2Cl2):
NMR δ 0.88 (t, J ≈ 7, 3H), 4.15 (m. 1H), 4.54 (m, 1H), 6.49 (d, 1H); MS (Cl, CH4)
m/z 300 (M + H).
Пример 7
N-[(4-бутоксифенил)ацетил]-D-алло-Треонин (2с-7)
4-бутоксифенилуксусную кислоту (288 мг, 1.38 ммоля) превращают в хлорангидрид и добавляют
к D-алло-Thr (150 мг, 1.26 ммоля) для получения 2с-9,
согласно методике, описанной в Примере 6. Сырой продукт очищают хроматографически (2.5 х 18 см колонка, градиент 4% CH3OH и 0.3% HOAc
в CH2Cl2):,
NMR δ
0.96 (t, J = 7.4, 3 H), 1.14 (d, J + 5.8, 3 H), 1.47 (m, 2H), 1.74 (m, 2H), 3.53 (br s, 2H), 3.91 (t, J ≈ 6.5, 2H), 4.10 (br s, 1H),
4.53 (br s, 1H), 4.90 (br s, > 2 H), 6.76 (br d, J =
6.0, 1H), 6.84 (d, J + 8.4, 2 H), 7.13 (d, J + 8.4, 2 H); MS (HR-EI) m/z 309.1567 (M calcd. for C16H23NO5,
309.1576; [α]
Пример 8
N-(1-оксогептил)-D-алло-Треонин
Фенилметил сложный эфир (2е-1)
Сырой 2с-1 (420 мг, 1.82 ммоля) растворяют в ДМФ (18 мл) и обрабатывают твердым N2HCO3
(321 мг, 3.82 ммоля), и образующуюся смесь
перемешивают в течение 1 ч при 70-75oC. Смесь охлаждают до 40-50oC и обрабатывают бензилбромидом (1.13 мл, 9.31 ммоля).
Перемешивание продолжают в течение 2 ч
при 40oC и 18 ч при температуре окружающей среды. Летучие продукты удаляют, и остаток поглощается H2O/EtOAc. Органический слой
отделяют, промывают раствором соли, высушивают,
отфильтровывают и упаривают. Очистка сырого продукта путем хроматографии (2 х 24 см колонка, 3 : 1, гексан/EtOAc) дает белый твердый продукт, который
характеризуется как 2е-1 (506 мг, 1.57 ммоля):
NMR δ 0.88 (apparent t, J = 6.8, 3 H), 1.09 (d, J = 6.4, 3H), 1.20-1.40 (m, 6 H), 1.55-1.74 (m, 2H), 2.27 (apparent t, J ≈ 7.5,
2H), 3.20-3.80 (br s, variable, 1H), 4.21 (dq, J =
3.3, 6.4, 1H), 4.74 (dd, J = 3.3, 6.8, 1H), 5.20 and 5.23 (AB, J = 12.2, 2H), 6.43 (br d, J = 6.5, 1H), 7.36 (m, 5H); MS (HR-EI) m/z 321.1939 (M
calcd. for C18H27NO4,
321.1940); [α]
Пример 9
N-(1-оксогептил)-D-Треонин Фенилметил сложный эфир (2е-2).
Бензилирование сырого продукта 2с-2,
согласно методике примера 8, дает 2е-2. Сырой твердый продукт очищают
хроматографически (3.0 х 39 см колонка, 3 : 1 гексан/EtOAc):
NMR δ 0.88 (apparent t, J ≈ 6.8, 3H), 1.20 (d,
J = 6.4, 3H), 1.23-1.38 (m, 6H), 1.60-1.71 (m, 2H), and 1.55-1.95
(overlapping br s, variable, > 1H), 2.28 (apparent t, J ≈ 7.6, 2H), 4.37 (dq, J = 2.4, 6.4, 1H), 4.67 (dd, J = 2.4,
8.9, 1H), 5.19 and 5.22 (AB, J = 12.3, 2H), 6.21 (br d, J ≈ 9,
1H), 7.35 (m, 5H). MS (HR-EI) m/z 322.2011 (M + H calcd. for C18H28NO4, 322.2019); [α
]
Здесь и далее:
overlapping - перекрывание
Пример 10
N-(1-оксогептил)-L-алло-Треонин Фенилметил сложный эфир (2е-3)
Бензилирование сырого продукта 2с-3, согласно методике Примера 8,
дает 2е-3. Сырой твердый продукт очищают хроматографически (2,
5 х 28 см колонка, 4: 1 гексан/EtOAc):
NMR: тот же самый, что и для 2е-1;
MS (HR-EI) m/z 321.1935 (M calcd. for C18H27NO4, 321.1940); [α
]
Пример 11
N-(1-оксогептил)-L-Треонин Фенилметил сложный эфир (2е-4)
Бензилирование сырого продукта 2с-4, согласно методике Примера 8, дает 2е-4.
Твердый продукт очищают хроматографически (2.0 х 20 см
колонка, градиент от 4:1 до 3:1 гексан/EtOAc): ПМР тот же самый, что и для 2е-2;
MS (HR-EI) m/z 321.1947 (M calcd. for C18
H27NO4, 321.1940); [α]
Пример 12
N-(1-оксогептил)-D-Серии Фенилметил сложный эфир (2е-5).
Бензилирование 2с-5, согласно методике Примера 8, дает 2е-5.
NMR δ 0.88 (apparent t, J ≈ 6.8,
3H), 1.20-1.40 (m, 6 H), 1.55-1.70 (m, 2H), 2.25 (apparent t, J ≈ 7.7, 2H), 2.45 and 2.80 (br s, 1 H), 3,92 and 3.99 (AB of ABX, JAB =
11.2, JAX = 3.4, JBX =
4.0, 1 H), 4.72 (ddd, apparent quintet, JX-NH = 7.3, JAX ≈ JDX 3.7, 1H), 5.21 (apparent s, small AB side signals,
2H), 6.46 (br d, J = 7.1, 1H), 7.36 (m, 5 H);
MS (HR-EI) m/z 307.1792 (M calcd. for C17H25NO4, 307.1801); [α]
Здесь и далее:
quintet - квинтет
small AB side
signals - небольшие AB боковые сигналы
Пример 13
N-[транс(4-пентилциклогексил)карбонил] -D-алло-Треонин Фенилметилметил сложный эфир (2е-6)
Бензилирование 2с-6, согласно
методике Примера 8, с последующей хроматографией (2
x 18 см колонка, 0.5% CH3OH в CH2Cl2) дает 2е-6.
NMR δ 0.88 (m, 5 H), 1.07 (d, J = 6.4,
3H), 1.10-1.35 (m, 8 H), 1.35-1.55 (m, 2H), 1.64 (br s,
1H), 1.64-1.97 (m, 4H), 2.14 (m, 1H), 3.67 (br s, 1H), 4.20 (m, 1H), 4.73 (dd, J = 3.2 and 6.7, 1H), 5.18 and 5.25 (AB, JAB = 12.2,
2H), 6.44 (d, J = 6.6, 1H); MS (HR-EI) m/z 389.2566 (M
calcd. for C23H35NO4, 389.2566); [α]
Пример 14
N-[(4-бутоксифенил)ацетил]-D-алло-Треонин Фенилметил сложный
эфир (2е-7)
Бензилирование 2с-7, согласно
методике Примера 8, с последующей хроматографией (2х20 см колонка, 3:1 гексан/EtOAc) дает 2е-7.
NMR δ 1.00 (m, 6H), 1.50 (m,
2H), 1.76 (m, 2H), 3.38 (br s, 1H), 3.56 (apparent
s, small AB side signals, 2H), 3.95 (apparent t, J = 6.5, 2H), 4.15 (m, 1H) 4.72 (dd, J = 7.0 and 3.4, 1H), 5.13 and 5.19 (AB, J = 12.2, 2H), 6.38
(br d, J = 6.8, 1H), 6.87 (d, J = 8.7, 2H), 7.15 (d,
J = 8.6, 2 H); MS (Cl, CH4) m/z 400 (M + H); [α]
Пример 15
(R)-3-(Гидрокси-N-(1-оксогептил)-D-норвалин фенилметил сложный эфир (2е-8)
Бензилирование 2с-8 из Примера 51, согласно методике
Примера 8, дает 2е-8.
Пример 16
(S)-3-(Гидрокси-N-(1-оксогептил)-D-норвалин фенилметил сложный эфир (2е-9)
Бензилирование 2с-9 из Примера 52, согласно методике
Примера 8, дает 2е-9.
Пример 17
N-[N2-[(1,1-диметилэтокси)карбонил] -N6-[фенилметокси)
карбонил]-(R)-6-[(фенилметокси)карбонил]-L-лизил-D-Аланин
Фенилметил сложный эфир (40b)
Смесь N-[N2-[(1,1-диметилэтокси)карбонил] -N6- [(фенилметокси)карбонил]
-(R)-6-[(метокси)карбонил] -L-лизил-D-Аланин 4-нитро фенилметил
сложного эфира (40а, Kolodziejczyk, et. al., Int. J. Pept. Prot. Res., 1992, 39, 382, 683 мг, 1.06 ммоля), 4A молекулярных сит (2,15 г,
дробленые), ТГФ (10.5 мл), и бензилового спирта (11.0 мл, 105,6
ммоля) перемешивают в течение 30 мин и затем обрабатывают титан (IV) изопропилатом (82 мкл, 0.27 миллиэкв.).
Образующуюся смесь нагревают в течение 24 ч при 85-90oC.
Твердые продукты отфильтровывают через инфузорную землю, и растворитель удаляют. Избыток бензилового спирта удаляют перегонкой в
аппарат Kugelrohr'2 (приблизительно 1000 мкм давление, 50-75с).
Неочищенное оранжевое масло хроматографируют (2.5 х 31 см колонка), градиент 4:1-2:1 гексан/ EtOAc), получая 40b (633 мг, 88%
выход):
NMR δ 1.39 (d, J = 7.2, 3H), 1.43 (s, 9 H),
1.40-1.67 (m, 4H), 1.84 (br s, 2H), 4.07 (br s, 1H), 4.40 (m, 1H), 4.58 (apparent quintet, 1H), 5.0 (br d, 1H), 5.07-5.25 (m, 6H),
5.43 (br d, J = 7.9, 1H), 6.68 (br d, 1H), 7.33 (m); MS (HR-FAB) m/z
676.3232 (M + H, calcd. for С37H46N3O9, 676.3234).
Пример 18
N-[N6
-[(фенилметокси)-карбонил]-(R)-6-(фенилметокси)-карбонил] -L-лизил] -D-Аланин Фенилметил сложный эфир (3b)
Раствор 40b (251 мг, 0.37 ммоля) в ТГФ (870 мкл) перемешивают в
течение 30 мин при
0oC. ТГФ удаляют, и масло поглощают EtOAc и промывают насыщенным NaHCO3 раствором. Высушивание и удаление растворителя дает 3b (225 мг, незначительный
избыток), который
используют в последующих реакциях без дополнительной обработки:
NMR δ 1.39 (d, 3H) and 1.20-1.70 (overlapping m, 4H), 1.82 (br s, 2H), 3.23 (br s, variable, 2H),
3.33 (br s, 1H), 4.39
(m, 1H), 4.47 (apparent quintet, 1H), 5.03-5.13 (m, 5 H), 5.27 (br d, 1H), 7.35 (m, 15H), 7.95 (br d, 1 H); MS (FAB) m/z 576 (M + H), 598 (M + Na).
Пример 19
R-(R*,
R*)]-N-[N2-[[3-оксо-2-[(1-оксогептил) амино]-1-метил-3-(фенилметокси)-пропокси] карбонил] -N6-[(фенилметокси)карбонил]
-(R)-6-[(фенилметокси)карбонил]-L-лизил]-D- Аланин Фенилметил сложный эфир (1a-1)
Раствор 2е-1 (173.6 мг, 0,54 ммоля) в ТГФ (тщательно закупоренный растворитель, дополнительно осушенный над
3
MS 1.45 мл) добавляют к избытку охлажденного фосгена (1.92 М раствор в толуоле; 1.40 мл, 2,63 ммоля), поочередно с ТЕА (81 мкл, 0.58 ммоля) за период 15 мин при 0oC.
Образующуюся молочную смесь перемешивают дополнительно 15 мин при той же самой температуре и 5 ч при комнатной температуре.
Смесь дегазируют аргоном в течение 30 мин и перемешивают под давлением аспиратора в течение 30 мин. Остаток обрабатывают раствором свежеприготовленного 3b (0.37 ммоля) в CH3CN (дополнительно осушенном, как в случае ТГФ, 2.9 мл) и затем TEA (81 мкл, 0.58 ммоля), оба добавлены все сразу. Белая суспензия перемешивается в течение ночи при температуре окружающей среды.
Смесь поглощают EtOAc/H2O и разделяют слои.
Водную фазу экстрагируют EtOAc дважды, и объединенную органическую фазу промывают раствором соли, высушивают, отфильтровывают и упаривают. Очистка продукта путем хроматографии (3 х 30 см колонка,
градиент 2:1-1:2 гексан/EtOAc) дает белый воск, который идентифицируется как 1a-1:
NMR δ 0.86 (m, 3H), 1.11 (d, J = 6.4, 3H), 1.20-1.40 (m, 8 H), 1.42 (d, J = 7.3, 3H), 1.50-1.75 (m,
4H, с перекрывающим H2O сигналом), 1.75-2.05 (br d, 2H), 2.20 (m, 2H), 4.15 (br s, 1H), 4.47 (br s, 1H), 4.62 (apparent quintet, 1H), 4.87 (apparent br d, J ≈ 6, 1H), 5.00-5.20 (m,
9
H), 5.23 (m, 1H), 5.37 (br d, 1H), 6.40 (br d, 1H), 7.33 (m, 20H), 7.77 (br d, 1H); NS (HR-FAB) m/z 923.4420 (M + H, calcd. for C51H63N4O12,
923.4442).
Пример 20
[S-(R*,S*)]-N-[N2-[3-оксо-2-[(1-оксогептил)амино]- 1-метил-3-(фенилметокси)-пропокси] карбонил] -N6
-[(фенилметокси)карбонил] -(R)-6-[фенилметокси)карбонил]-L-лизил]-D- Аланин Фенилметил сложный эфир (1a-2)
Соединение 2е-2 (20 мг, 0.062 ммоля) соединяется с 3b (0.043 ммоля), согласно
методике Примера 19. Очистка сырого продукта (1.5 х 21 см колонка, 2:1 гексан/EtOAc) дает белый воск, который характеризуется как 1а-2:
NMR δ 0.87 (m, 3H), 1.25 and 1.23-1.38
(overlapping d, J = 6.2, 3H and m, 8 H), 1.40 (d, J = 7.2, 3H), 1.55-1.75 (m, 4H, with overlapping H2O signal), 1.75-1.90 (m, 2H), 2.29 (n, 2H), 4.08 (br s, 1H), 4.83 (br s, 1H), 4.58
(apparent quintet, 1H), 4.83 (br d, 1H), 5.05-5.30 (m, 9H), 5.35 (br s, 1H), 5.68 (br s, 1H), 6.30 (br s, 1H), 6.62 (br s, 1H), 7.33 (m, 20 H); MS (HR-FAB) m/z 923.4455 (M + H, calcd. for C51H63N4O12, 923.4442).
Пример 21
[S-(R*)]-N-[N2
-[3-оксо-2-[(1-оксогептил)амино]-1- метил-3-(фенилметокси)-пропокси] карбонил] -N6-[(фенилметокси)карбонил] -(R)-6-[(фенилметокси)карбонил]-L-лизил]-D- Аланин Фенилметил сложный эфир
(1а-3)
Соединение 2е-3 (27.4 мг, 0.085 ммоля) соединяется с 3b (0.06 ммоля), согласно методике Примера 19. Очистка сырого продукта (1.5 х 16 см колонка, 2:1 гексан/EtOAc) дает белый воск,
который идентифицируется как 1а-3:
NMR δ 0.86 (m, 3H), 1.20-1.35 (m, 1H), 1.39 and 1.35-1.57 (overlapping d, J = 7.1, 3H, and m, 4 H), 1.75-1.95 (br s, 2H), 2.10-2.30 (m, 2H), 4.08
(br
m, 1H), 4.37 (br s, 1H), 4.57 (apparent quintet, J = 7.3, 1H), 4.70-5.30 (overlapping multiplets, 10 H), 5.93 (br d, 1H), 6.50 (br d, 1H), 6.63 (br d, J = 7, 1H), 7.05 (m, 1H), 7.34 (m, 20 H); MS
(HR-FAB) m/z 945.4281 (M + Na, calcd. for C51H62N4O12Na, 945.4262).
Пример 22
[R-(R*, S*)] -N-[N2
-[[3-оксо-2-[(1-оксогептил) амино] -1-метил-3-(фенилметокси)-пропокси] карбонил] -N6-[(фенилметокси)карбонил] -(R)-6-[(фенилметокси)карбонил]-L-лизил]-D- Аланин Фенилметил сложный эфир
(1a-4)
Соединение 2е-4 (27.6 мг, 0.085 ммоля) присоединяют к 3b (0.06 ммоля), согласно методике Примера 19. Очистка сырого продукта (1.5 х 16 см колонка, градиент 2:1-1:1 гексан/EtOAc) дает
белый воск, который идентифицируется как 1а-4:
NMR δ 0.86 (m, 3H), 1.25 and 1.25-1.40 (overlapping d, J = 6.5, 3 and m, 11H), 1.42 (d, J = 7.0, 3H), 1.53-1.73 (m, 4 H, with
overlapping
H2O signal), 1.73-1.95 (br s, 2H), 2.27 apparent t, J ≈ 7.5, 2H), 4.12 (br s, 1H), 4.38 (br s, fine structure, 1H), 4.58 (br s, 1H), 4.81 (br d, 1H), 5.03-5.23 (m, 8 H),
5.23-5.48 (m,
3H), 6.41 (br d, 1H), 6.71 (br d, 1H), 7.33 (m, 20H); MS (HR-FAB) m/z 945.4271 (M + Na, calcd. for C51H62N4O12Na, 945.4262).
Пример 23
(R)-N-[N2-[[3-оксо-2-[(1-оксогептил)амино] -3-(фенилметокси)-пропокси] карбонил] -N6-[(фенилметокси)карбонил]
-(R)-6- [(фенилметокси)карбонил]-L-лизил]-D-Аланин Фенилметил
сложный эфир (1a-5)
Соединение 2е-5 (99 мг, 0.32 ммоля) присоединяется к 3b (0.21 ммоля), согласно методике Примера 19. Очистка
сырого продукта (2 х 21 см колонка, градиент 2: 1-1:1
толуол/диэтиловый эфир) дает белый воск, который характеризуется как 1a-5:
NMR δ 0.88 (m, 3H), 1.20-1.38 (m, 8 H), 1.39 (d, J =
7.2, 3 H), 1.50-1.66 (m, 4 H), 1.85 (br s, 2H), 2.21
(apparent t, J ≈ 7.6, 2H), 4.09 (br s, 1H), 4.23-4.51 (m, 3H), 4.58 (apparent quintet, J = 7.3, 1H), 4.90 (br s, 1H), 5.05-5.25 (m, 9H),
5.55 (br t, 1H), 6.55 (br d, 1H), 6.90 (br d, 1H); 7.33
(m, 20H); MS (HR-FAB) m/z 909.4270 (M + H, calcd. for C50H61N4O12, 909.4285).
Пример 24
[R-(R*, R*)]
-N-[N2-[[1-метил-3-оксо-2-[[4-пентил- циклогексил)карбонил] амино] -3-(фенилметокси)-пропокси] карбонил] - N6
-[фенилметокси)карбонил]-(R)-6-[(фенилметокси)карбонил] -L- лизил]
-D-Аланин Фенилметил сложный эфир (1a-6)
Соединение 2е-6 (33 мг, 0.085 ммоля) присоединяется к 3b (0.06 ммоля), согласно
методике Примера 19. Очистка сырого продукта (1.5 х 17 см колонка, 2:1
гексан/EtOAc) дает белый воск, который характеризуют как 1a-6:
NMR δ 0.87 (m, 5 h), 1.10 (d, J = 6.6, 3H),
1.10-1.43 (m, 15 H), 1.43 (d, J = 7.3, 3H), 1.70-2.20 (m, 7 H), 4.15 (m, 1H),
4.37 (m, 1H), 4.64 (m, 1H), 4.89 (br d, J = 8.3, 1H), 5.03-5.30 (m, 9H), 5.37 (br d, 1H), 6.43 (br d, 1H), 7.33 (m, 20H),
7.34 (br d, 1H); MS (HR-FAB) m/z 1013.4903 (M + Na, calcd for C56
H70N4O12Na, 1013.4888).
Пример 25
[R-(R*, R*)] -N-[N2-[[4-бутилфенил) ацетил] амино]
-1-метил-3-оксо-3-(фенилметокси)пропокси] карбонил] -N6-[(фенилметокси)карбонил]
-(R)-6-[(фенилметокси)карбонил]- L-лизил]-D-Аланин Фенилметил сложный эфир (1a-7)
Соединение 2е-7
(34 мг, 0.085 ммоля) присоединяется к 3b (0.06 ммоля), согласно методике Примера 19. Очистка
сырого продукта (1.5 х 14 см колонка, 2:1 гексан/EtOAc) дает белый воск, который характеризуется как
1a-7:
NMR δ 0.97 (m, 6 H), 1.10-1.60 (m, overlapping d, J = 7.3, 9H), 1.65-2.03 (m,
4 H), 3.45 (m, 2H), 3.92 (apparent t, J = 6.5, 2H), 4.15 (m, 1H), 4.38 (m, 1H), 4.62 (apparent
quintet, J = 7.3, 1H), 4.86 (br d, J = 8.0, 1H), 5.05-5.25 (m, 9 H), 5.42 (br d, J = 7.5, 1H), 6.33 (br
d, 1H), 6.84 (d, J = 8.5, 2H), 7.13 (d, J = 8.5, 2H), 7.33 (m, 20 H), 7.89 (br d, 1H); MS
(HR-FAB) m/z 1023.4368 (M + Na, calcd. for C56H64N4O12Na,
1023.4368).
Пример 26
[R-(R*,R*)]-N-[N2
-[[1-Этил-3-оксо-2-[1-оксогептил) амино]-3-(фенилметокси)-пропокси] карбонил] -N6
-[(фенилметокси) карбонил] -(R)-6-[(фенилметокси)карбонил]-L-лизил]-D-Аланин Фенилметил сложный эфир
(1a-8)
Соединение 2е-8 (99 мг, 0.32 ммоля) присоединяется к 3b (0.21 ммоля), согласно
методике Примера 19.
Пример 27
[S-(R*,S*)]-N-[N2-[[1-Этил-3-oкco-2-[(1-окcoгептил амино]-3-(фенилметокси)-пропокси] карбонил] -N6
- [(фенилметокси)карбонил] -(R)-6-[(фенилметокси)карбонил]-L- лизил]-D-Аланин Фенилметил сложный эфир
(1a-9)
Пример 28
[R-(R*, R*)] -N-[(R)-6-карбонил-N2-[[(2-карбокси-1- метил-2[(1-оксогептил)амино]этокси]карбонил]-L-лизил-D-Аланин (1a-11)
Раствор 1a-1 (140 мг, 0.15 ммоля) в EtOAc/EtOH (5 мл : 15 мл) гидрируют над Pd(OH)2
(катализатор Pearlman's 20% на C, 100 мг) используя прибор Parr'a при начальном давлении 70 psi (11,95
кг/см2.
После 5.5 ч фильтрация и упаривание дают бесцветное стекло.
Последнее обрабатывают диэтиловым эфиром и стенки колбы протирают, чтобы получить белый кристаллический
порошок. Эфирный раствор удаляют с помощью шприца и твердый продукт промывают двумя или более
порциями диэтилового эфира, высушивают и характеризуют как 1a-11:
NMR (CD3OD) δ
0.89 (m, 3H), 1.22 (d, J = 6.5, 3 H), 1.24-1.39 (m, 6 H), 1.42 (d, J = 7.3, 3H), 1.45-1.99
(m, 8H), 2.26 (t, J ≈ 7.5, 2H), 3.62 (m, 1H), 4.06 (m, 1H), 4.41 (m, 1H), 4.89 (br s for ОН, NH; one
hidden CH signal), 5.14 (m, 1H); MS (HR-FAB) m/z 519.2671 (M + H calcd. for С22
H39N4O10, 519.2666).
где: one nidder CH - один скрытый CH
Signal - сигнал
Пример 29
[S-(R*, S*)]
-N-[(R)-6-карбокси-N2- [[2-карбокси-1-метил- 2-[(1-оксогептил)амино]этокси]карбонил]-L-лизил]-D-Аланин
(1a-12)
Гидрирование соединения 1a-2 (37 мг, 0.04 ммоля), согласно методике
Пример 28, дает 1a-12:
NMR (CD3OD) δ 0.90 (m, 3H), 1.26 (d, J = 6.3, 3H), 1.2-1.38 (m, 6
H), 1.40 (d, J = 7.2, 3H), 1.44-1.73 (m, 5 H), 1.73-2.05 (m, 3H), 2.33 (apparent t,
J ≈ 7.3, 2H), 3.92 (m, 1H), 4.16 (br s, 1H), 4.38 (m, 1 H), 4.64 (m, 1 H), 5.31 (m, 1H); MS (HR-FAB) m/z
519.2671 (M + H calcd. for C22H39N4O10,
519.2666).
Пример 30
[S-(R*, R*)] -N-[(R)-6-карбокси-N2
- [[2-карбокси-1-метил-2-[(1-оксогептил)амино]этокси]карбонил]- L-лизил]-D-Аланин
(1a-13)
Гидрирование соединения 1a-3 (22.0 мг, 0.024 ммоля), согласно методике Примера 28, дает 1a-13:
NMR (CD3OD) δ 0.91 (m, 3H), 1.19-1.45 [overlapping d (J = 6.5,
at 1. 25 d), m, and d (J = 7.3, at 1.39 d), 12H], 1.47-1.72 (m, 5H), 1.72-2.10 (m, 3H), 2.29 (apparent t, J = 7.5,
2H), 3.68 (m, 1H), 4.20 (m, 1H, 5.17 (m, 1H); MS (HR-FAB) m/z 519.2651 (M + H
calcs. for С22H39N4O10, 519.2666).
Пример 31
[R-R*, S*)] -N-[(R)-6-карбокси-N2
- [[2-карбокси-1-метил-2- [(1-оксогептил)амино]этокси]карбонил]-L-лизил]-D-Аланин (1a-14)
Гидрирование соединения 1a-4 (36.6
мг, 0.04 ммоля) согласно методике Примера 28, дает 1a-14:
NMR (CD3OD) δ 0.90 (m, 3H), 1.22-1.36 [overlapping d (J = 6.2, at 1.24 d) and m, 12H], 1.36-2.02 (m, 8H, 2.32 (m,
2H), 3.60-3.80 (m, 1H), 4.09 (m, 1H), 4.36 (m, 1H), 4.61 (m, 1H),
5.30 (br s, 1H); MS (HR-FAB) m/z 519.2667 (M + H calcd. for C22H39N4O10, 519.2666).
Пример 32
(R)-N-[(R)-6-карбокси-N2
-[[2-карбокси-2-[(1- оксогептил)амино] этокси] карбонил]-L-лизил]-D-Аланин (1a-15)
Гидрирование соединения 1a-5 (247 мг, 0.27
ммоля), согласно методике Примера 28, дает 1a-15:
NMR
(CD3OD) δ 0.90 (m, 3H), 1.16-1.46 [overlapping d (J = 7.0, at 1.40 d) and m, 9H], 1.46-2.05 (m, 8 H), 2.25 (m, 2H),
3.69 (br s, 1H), 4.11 (br s, 1H), 4.36 (m, 3H), 4.63 (br s, 1H);
MS (HR-FAB) m/z 505.2505 (M + H calcd. for С21H37N4O10, 505.2509).
Пример
33
[(R)-6-карбокси-N2
-[[2-карбокси-1-метил-2-[(4- пентилциклогексил)карбонил]амино]этокси]карбонил]-L-лизил]-D-Аланин (1a-16)
Гидрирование соединения 1a-6 (17 мг, 0.017
ммоля), согласном методике Примера 28,
дает 1a-16:
NMR (CD3OS) δ 0.90 (m, 5H), 1/10-1.75 [m, 19H, с overlapping 1.23 (d, J = 6.6) and 1.45 (d, J = 7.4)], 1.75-2.05 (m, 8H),
2.24 (m, 1H), 3.60 (m, 1H), 4.07 (m,
1H), 4.44 (m, 1H), 4.90 (m, 1H, under OH signal) 5.14 (m, 1H); MS (HR-FAB) m/z 609.3099 (M + Na, calcd. for C27H46N4O10
Na, 609.3112).
Где:
under OH signal - под OH сигналом
Пример 34
N-[N2-[[2-[[4-Бутоксифенил)ацетил] амино] -2-карбокси-1- метилэтокси]
карбонил]-(R)-6-карбокси-L-лизил]-D-Аланин
(1a-17)
Гидрирование соединения 1a-7 (33 мг, 0.034 ммоля), согласно методике Примера 28, дает 1a-17:
NMR (CD3OD) δ 0.99
(m, 3H), 1.10-2.05 (m, 16H), 3.55 (m, 2H),
3.65 (m, 1H), 3.96 (m, 2H), 4.07 (m, 1H), 4.38 (m, 1H), 4.90 (m, 1H, under OH signal), 5.18 (m, 1H), 6.85 (m, J = 8.6, 2H), 7.22 (m, J = 8.6, 2H); MS
(HR-FAB) m/z 597.2757 (M + H, calcd. for C27H41N4O11, 597.2772).
Пример 35
[S-(R*, R*)]
-N-[(R)-6-карбокси-N2
-[[1- [карбокси[(1-оксогептил)амино] метил]пропокси]карбонил]-L-лизил]-D- Аланин (1a-18)
Гидрирование соединения 1a-8 (247 мг, 0,27 ммоля), согласно методике
Примера 28, дает 1a-18.
Пример 36
[S-(R*, S*)] -N-[(R)-6-карбокси-N2-[[1- [карбокси[(1-оксогептил)амино]
метил]пропокси]карбонил]-L-лизил]-D-Аланин (1a-19)
Гидрирование соединения 1a-9 (247 мг, 0.27 ммоля), согласно методике Примера 28, дает 1a-19
Пример 37
N-(1-оксогептил)-L-Серин Метил сложный эфир (2j)
Хлоргидрат L-серин
метилового эфира превращают в 2j, согласно методике, описанной в Примере 1:
NMR δ 0.89 (t, J = 6.9, 3H),
1.30 (m, 6H), 1.65 (m, 2H), 2.28 (apparent t, J ≈ 7.5, 2H), 3.80 (s,
3H), 3.96 (m, 2H), 4.69 (m, 1H), 6.80 (br d, 1H); MS (HR-EI) m/z 231.1465 (m calcd. for C11H21NO4, 231.1459); [α]
Пример 38
(S)-2,2-Диметил-3-(1-оксогептил)-4-оксазолидинкарбоновой кислоты Метиловый
эфир (8a)
Соединение 2j (320 мг, 1.38 ммоля) и n-TSA (40 мг) растворили в сухом ацетоне (2 мл) и 2,
2-диметоксипропане (2 мл).
Образующийся раствор нагревают в течение ночи
до кипения с обратным холодильником. Добавляют твердый K2CO3, и летучие продукты удаляют
при пониженном давлении для получения остатка. Мгновенная хроматография (2 х 21 см
колонка, 6:1 гексан/EtOAc) остатка дает 8а в виде масла:
NMR δ 0.88 (m, 3H), 1.29 (m, 6H), 1.57 (s,
3H), 1.62 (m, 2H), 1.70.(s, 3H), 2.15 (m, 2H), 3.81 (s, 3H), 4.20 (m, 2H), 4.46 (m,
1H); [α]
Пример 39
(R)-2,
2-Диметил-3-(1-оксогептил)-4-оксазолидинметанол
Раствор 8а (296 мг, 1.09 ммоля) в сухом диэтиловом
эфире (1 мл) обрабатывают боргидридом лития (2 М раствор в ТГФ, 0.55 мл, 1.09 миллиэкв.) в
атмосфере аргона. Смесь перемешивают в течение 3 ч при нагревании до кипения с обратным холодильником и 18 ч
при комнатной температуре.
Образующуюся смесь разбавляют диэтиловым
эфиром и резко охлаждают при смешении с холодным метанолом. Летучие продукты удаляют, и остаток поглощают
EtOAc/H2O. Проведенные операции приводят к образование неочищенного спирта,
который очищают хроматографически (2:1 гексан/EtOAc):
NMR δ 0.88 (m, 3H), 1.30 (m, 6H), 1.54 (s,
3H), 1.62 (s, 3H), 2.35 (m, 2H), 3.30-4.40 (complex m, 6H); MS (HR-EI) m/z 243.1837 (M
calcd. for С13H25NO3 243.1840); [α]
Где:
complex - комплексный
Пример 40
(S)-2,
2-Диметил-3-(1-оксогептил)-4-оксазолидин- карбоксальдегид (9а)
Раствор оксалил
хлорида (105 мкл, 1.23 ммоля) в CH2Cl2 (2.75 мл) охлаждают до -60oC. Добавляют
раствор ДМСО (192 мкл) в CH2Cl2 (0.55 мл) за период 5 мин, и
образующуюся молочную смесь перемешивают в течение 15 мин при -60oC. К смеси добавляют спирт Примера 39
(133 мг, 0.55 ммоля) в CH2Cl2 (0.55 мл) за период 5 мин.
Бане дают возможность нагреться до -20oC (20 мин), и прозрачный раствор перемешивают 20 мин
при -20oC. Добавляют триэтиламин (0.77 мл) и H2O (3.4 мл), и
смесь перемешивают в течение 5 минут при температуре окружающей среды. Обработка CH2Cl2 дает
сырое масло, которое очищают хроматографически (1.5 х 20 см, 3:1 одновременно),
получая 9а:
NMR δ 0.85 (m, 3Н), 1.30 (m, 6Н), 1.60 (s, 3H), 1.60-1.70 (m, 2H), 1.70 (s, 3Н), 2.00-2.40
(m, 2H), 4.00-4.30 (m, 3Н), 9.65 (d, J ≈ 1, 1H).
Пример
41
(4S)-L-Этил-2,2-диметил-3-(1-оксогептил)-4- оксазолидинметанол (10a)
Раствор 9а в диэтиловом эфире
(1 мл) добавляют по каплям к охлажденному (5oC) раствору EtMgBr (3 M
в диэтиловом эфире, 0.36 мл). Охлаждающую баню убирают, и к смеси добавляют кристаллический иод, и перемешивание
продолжают в течение 1.5 ч при комнатной температуре.
Образовавшуюся
смесь разбавляют EtOAc и промывают насыщенным водным раствором NH4Cl. Водную фазу повторно экстрагируют,
и объединенный органический раствор высушивают и упаривают для получения сырого
10а:
NMR δ 0.88 (m, 3H), 1.05 (m, 3H), 1.30 (m, 6H), 1.45 (m, 2H), 1.57 (s, 3H), 1.50-1.75 (m, 5H),
2.10-2.60 (m, 2H), 3.50-4,50 (m, 4H); MS (EI) m/z 271 (M).
Пример
42
R-(R*,S*) и S-(R*,R*)-N-[2-гидрокси-1-(гидроксиметил)бутил
Гептанамид
Сырой 10а (107 мг, 0.39 ммоля) растворяют в охлажденном TFA
(0.38 мл), содержащем H2O (≈ 1%), и раствор перемешивают 45 мин при 0o. Летучие продукты
удаляют, и остаток поглощается EtOAc и промывается насыщенным N2
HCO3 и раствором соли.
После высушивания и удаления растворителя 11a (2:1 смесь диастереомеров)
выделяют хроматографически (1.5 х 18 см, 2% MeOH в CH2Cl2):
NMR δ 0.85-1.05 (m, 6H), 1.30 (m, 6H), 2.23 (m, 2H), 3.65-4.05 (m, 4H), 6.20 and 6.40 (two broad d,
2:1 ratio, respectively, 1H); MS (HR-EI) m/z 231/1887 (M calcd. for C12H25NO3, 231.1940).
Где:
two broad - два широких
ratio,
respectively - соотношение, соответственно
Пример 43
[S-(R*, R*)] -N-[1-[[[(1,1-Диметилэтил)дифенилсилил]-окси] метил]-2-гидроксибутил]Гептанамид (10c)
Смесь 11а (1.0 ммоля), т-бутилдифенилсилил хлорида (1.2 ммоля), TEA
(1.2 ммоля) и DMAP (0.04 ммоля) в CH2Cl2 (1.5 мл) перемешивают 20 ч при комнатной температуре согласно S. K.
Chaudhary and О. Hernander (Tetrahedron Lett., 1979, 99).
Образующуюся смесь распределяют между CH2Cl2 и H2O. Слои разделяют, и органическую фазу промывают насыщенным раствором NH4Cl и высушивают. Удаление растворителя дает смесь, которую очищают хроматографически. Менее полярный продукт идентифицируется как 10c.
Пример 44
[R-(R*, S*)]
-N-[1-[[[(1,1-Диметилэтил)дифенилсилил]- окси]метил]-2-гидроксибутил] Гептанамид (10d)
Более полярный изомер, выделенный в Примере 43,
характеризуется как 10d.
Пример 45
[S-(R*, R*)] -N-[1-[[[(1,1-Диметилэтил)дифенилсилил] - окси] метил]-2-(фенилметокси)-бутил Гептанамид (2d)
Раствор 10c в ДМФ (0.60 мл) и BnBr (0.96 мл, 8 ммолей)
обрабатывают н-Bu4N+I- (37 мг, 0.1 ммоля). Дисперсию N2H (60% в масле, 1.3 миллиэкв.) добавляют
порциями к раствору за период 1 час. Смесь перемешивают в
течение ночи при комнатной температуре. Эфирная обработка дает сырой масляный продукт, который очищают хроматографически. Основной продукт
характеризуется как 12с.
Пример 46
[S-(R*, S*)-N-[1-[[[(1,1-Диметилэтил)дифенилсилил] - окси] метил] -2-((фенилметокси)бутил Гептанамид (12d)
Соединение 12d приготавливают из 10d, используя методику
Примера 45.
Пример 47
[S-(R*,R*)]-N-[1-Гидроксиметил)-2-(фенилметокси)бутил] Гептанамид
(13с)
Соединение 12с (1 ммоль) растворяют в ТГФ (1.1
мл) и обрабатывают н-Bu4N+F- раствором (1H в ТГФ, 3.0 мл; (согласно F.J.Corey and A. Venkate's warlu, J.
Amer. Chem. Soc., 1972, 94, 6190).
После 40 мин при комнатной температуре реакцию прекращают резким охлаждением льдом, и смесь распределяют между диэтиловым эфиром и водой. Водный слой повторно экстрагируют диэтиловым эфиром, и объединенные органические слои промывают раствором соли, высушивают и растворитель удаляют, получая 13с, который очищают хроматографически.
Пример 48
[R-(R*,S*
)]-N-[1-Гидроксиметил-2-(фенилметокси)-бутил] Гептанамид (13d)
Соединение 13d приготавливают из 12d по методике, описанной в
Примере 47.
Пример 49
N-(1-Оксогептил)-3-(фенилметокси)-трео-D-Норвалин (14c).
Спирт 13с (1 ммоль) в ДМФ (4 мл) обрабатывают пиридиний дихроматом (3,5 миллиэкв), согласно методике (Corey and Schmidt, Tetrahedron Lett., 1979, 399). После 18 ч смесь выливают на лед. Обработка диэтиловым эфиром дает 14с, который очищают хроматографически.
Пример 50
N-(1-Оксогептил)-3-(фенилметокси)-эритро-D-Норвалин (14d)
Соединение 14d приготавливается из 13d согласно методике Примера 49.
Пример 51
3-Гидрокси-N-(1-оксогептил)-трео-D-Норвалин (2с-8)
Раствор 14с в EtOAc/EtOH гидрируют согласно методике Примера 28. Сырой продукт идентифицируется как 2с-8 и используют в Примере 15.
Пример 52,
3-Гидрокси-N-(1-оксогептил)-эритро-D-Норвалин (2с-9)
Соединение 2с-9 приготавливают из 14d, согласно методике Примера 51. Неочищенный продукт используют в
Примере 16.
Пример 53
N2-(1-оксигептил)-D-Аспарагин (22a)
D-Аспарагин 21a (4.5 г, 29.9 ммоля) превращают в 22а, согласно методике Примера 1. Смесь воды и
ТГФ используют в качестве растворителя, и 2H водный NaOH заменяют смесью триэтиламина и 0.5 H NaHCO3. Сырой твердый продукт очищают перекристаллизацией из смеси метиловый спирт-диэтиловый
эфир.
NMR (CD3OD) δ 0.90 (t, 3H), 1.61 (m, 2H), 2.23 (t, 2H), 2.75 (m, 2H), 4.71 (dd, 1H); MS (LR-CI) m/z 245 (M+H) calcd for C11H21N2O4 245.
Пример 54
3-Амино-N-(1-оксогептил)-D-Аланин (2g-1)
Соединение 22а (2.21 г, 9.0 ммоля) добавляют к раствору
бис-(трифторацетокси)иодобензола
(5.83 г, 13.57 ммоля) в 51 мл N,N-диметилформамида и 41 мл воды. Смесь перемешивают 15 мин и обрабатывают пиридином (1.46 мл, 18.09 ммоля).
Образующийся раствор перемешивают 18 ч при
комнатной температуре. Летучие продукты удаляют, и остаток разбавляют 90 мл воды. Смесь промывают 3 х 50 мл диэтиловым эфиром. Водный слой отделяют и
упаривают. Растирание образующейся жидкости с
диэтиловым эфиром дает белый твердый продукт, который характеризуется как 2g-1:
NMR (CD3OH) δ 0.61 (t, 3H), 1.35 (m, 2H), 2.05
(t, 2H), 3.0-3.2 (m, 2H), 4.40 (m, 1H); MS
(HR-FAB) m/z 217.1555 (M+H, calcd for C10H21N2O3, 217.1552).
Пример 55
3-Амино-N-(1-оксогептил)-D-Аланин Фенил Метиловый эфир
Моногидрохлорид (2h-1)
Ацетил хлорид (3.05 мл, 42.87 мл) добавляют по каплям за период 10 мин к охлажденному льдом раствору бензилового
спирта (10 мл, 96.63 ммоля).
Образующийся раствор перемешивают дополнительно 30 мин. Затем ледяную баню убирают и добавляют соединение 2-1 (1.32 г, 6,12 ммоля). Раствор перемешивают в течение ночи при комнатной температуре, и летучие продукты удаляют перегонкой Kugelrohr'a.
Остаток обрабатывают диэтиловым эфиром и затем перекристаллизовывают из этилового спирта,
получая белый твердый продукт, который
идентифицируется как 2h-1:
NMR (CDCl3) 0.75 (t, 3H), 1.45 (m, 2H), 2.20 (t, 2H), 3.40 (m, 2H), 4.80 (br s, 1H), 5.10 (s, 2H), 7.62 (br s,
1H); MS (HR-FAB) m/z 30.2017 (M + H, calcd
for C17H27N2O3 307.2022).
Пример 56
[S-(R*,R*
)]-N-[2-Гидрокси-1-(гидроксиметил)пропил]- гептанамид (11с)
К раствору (2е-2) (1.0 г, 3.11 ммоля) в диэтиловом эфире, с подогревом, добавляют по каплям при комнатной температуре раствор
борогидрида лития (1.60 мл, 3,2 ммоля) в тетрагидрофуране.
Реакционную смесь нагревают до кипения с обратным холодильником в течение 3 часов, разбавляют диэтиловым эфиром и медленно обрабатывают
метанолом до прекращения шипения.
Летучие продуты удаляют, получая остаток, который распределяют между водой и этил ацетатом. Органический слой отделяют, промывают раствором соли, высушивают и отфильтровывают. Фильтрат упаривают до остаточного масла, которое очищают хроматографически, используя элюирующую смесь 3:1 этил ацетат-гексан, и получают 560 мг желаемого продукта в виде масла.
NMR δ 1.20 (d, 3H), 1,65 (m, 2H), 2.26 (t, 2H), 4.19 (q, 1H), 6.23 (br d, 1H). MS (CI) m/z 218 (M+H calc'd for C11H24NO3 218).
Пример 57
[S-(R*, R*)] -N-[1-[[[(1,1-Диметилэтил)диметилсилил]- окси]метил]-2-гидроксипропил]гептанамид (10c)
Смесь 11с, (1.945 г)
т-бутилдиметилсилил хлорида, (1.4165 г) триэтиламина (951 мг, 1.31 мл) и
4-диметиламинопиридина (42.76 мг) в 13 мл метилен хлорида перемешивают в атмосфере аргона при комнатной температуре в течение
18 ч. Реакционную смесь разбавляют метилен хлоридом и добавляют воду.
Органический слой отделяют, промывают водой, высушивают и упаривают, получая 3.25 г остаточного масла, которое очищают
хроматографически, элюируя смесью 1:5 этил ацетат/гексан, получая 2.30 г
желаемого продукта в виде масла.
NMR δ 0.08 (d, 6H), 0,89 (t, 3H), 0.90 (s, 9H), 1.16 (d, 3H), 1.65 (m, 2H), 2.24 (t, 2H), 3.47 (s, 1H), 3.84 (m, 1H), 3.85 (s, 2H), 4.28 (q, 1H), 6.13 (brd, 1H); MS (FAB) m/z = 332 (M + H calc'd for C17H38NO3Si 332).
Пример 58
(S)-N-[1-[[[(1,1-диметилэтил)диметилсилил]
-окси]метил]-2- оксогептил]-Гептанамид (27c)
Смесь (10с) (2.30 г, 6.94 ммоля) и пиридин дихромата (10.62 г, 28,2 ммоля) в 20 мл
N,N-диметилформамида перемешивают в атмосфере аргона в течение
18 ч. Реакционную смесь разбавляют 100 мл воды и экстрагируют этил ацетатом (3 х 40 мл). Органический слой отделяют, промывают водой и
раствором соли, высушивают и упаривают, получая 1.87 г остаточной
коричневой жидкости. Жидкость очищают хроматографически, используя 1: 6 этил ацетат/гексан, и получают 997 мг желаемого продукта в
виде масла.
NMR δ 0.83 (s, 9H), 1.61 (m, 2H), 2.22 (t, 2H), 2.23 (s, 3H), 3.82 (dd, 1H), 4.09 (dd, 1H), 4.57 (m, 1H), 6.42 (brd, 1H); MS (FAB) m/z 330 (M+H calc'd for C17H36NO3Si 330).
Пример
59
[R-(R*, S*)] -N-[1-[[[(1,1-диметилэтил)диметилсилил] - окси]
метил]-2-[((фенилметил)амино]пропил]-Гептанамид (28с)
Смесь 27с (960 мг, 2.91 ммоля) в 5 мл
метилового спирта, содержащего молекулярные сита, перемешивают при комнатной температуре в течение
30 мин.
Во время перемешивания добавляют цианоборгидрид натрия (365 мг) и реакционную смесь перемешивают в атмосфере аргона в течение 18 ч. Реакционную смесь отфильтровывают и упаривают, получая остаток, который распределяют между этил ацетатом и водным бикарбонатом натрия.
Органический слой отделяют, промывают раствором соли, и высушивают и упаривают до получения 1.224 г остаточной желтой жидкости. Остаток очищают хроматографически, используя 2:5 этил ацетат/гексан для получения 561.2 мг желаемого продукта 28с в виде масла.
NMR 0.84 (s, 9H), 1.09 (s, 3H), 1.61 (m, 2H), 2.20 (t, 2H), 3.08 (m, 1H), 6.22 (brd, 1H), 7.32 (m, 5H); MS (HR-FAB) m/z 421.3245 (M + H calc'd for C24H44N2O2Si 421.3250).
Пример 60
[R-(R*, R*)-N-[1-[[[(1,
1-диметилэтил)диметилсилил] -окси] метил] -2-[(фенилметил)амино]пропил]-Гептанамид (28d)
Дальнейшая элюация хроматографической колонки в Примере 59 дает 239.4 mg желаемого продукта 28d в виде
масла.
NMR δ 0.84 (s, 9H), 1.18 (d, 3H), 1.61 (m, 2H), 2.18 (t, 2H), 2.80 (m, 1H), 6.47 (brd, 1H), 7.31 (m, 5H); MS (HR-FAB) m/z 421.3253 (M + H calc'd for C24H44N2O2Si 421.3250).
Пример 61
[R-(R*, S*)]-N-[2-Амино-1-[[[(1,1-диметилэтил)диметилсилил]- окси]метил] пропил]-Гептанамид
(25с)
Смесь 28с (208.6 г, 0.50 ммоля) и 104 мг Pd(OH)2 в 15 мл
метилового спирта встряхивают в аппарате Парра в атмосфере водорода в течение 18 ч. Реакционную смесь отфильтровывают
через инфузорную землю и фильтрат концентрируют для получения 169 мг желаемого
продукта 25с в виде масла.
NMR δ 0.84 (s, 9H), 1.05 (d, 3H), 1.60 (m, 2H), 2.10 (t, 2H), 3.31 (m, 1H), 6.47 (br d, 1H).
Пример 62
[S-(R*,
R*)]-N-[2-Амино-1-[[[(1,1-диметилэтил) диметилсилил]-окси]метил] пропил]-Гептанамид (25с)
Соединение
25d приготавливают из 28d, согласно методике, используемой для приготовления
25с.
Пример 63
[S-(R*, S*)] -[3-[[(1,1-Диметилэтил)диметилсилил]
-1- метил]-2-[(1-оксогептил)аминопропил]Фенил Метиловый эфир Карбаминовой Кислоты
(26с)
К раствору 25с (164 мг, 0.496 ммоль) в 1 мл метилен хлорида при 0oC в атмосфере аргона
добавляют триэтиламин (201 мг, 276.5 мкл, 1.98 ммоля) с последующим добавлением по
каплям бензил хлорформиата (169 мг, 142 мкл, 0.992 ммоля). Реакционной смеси дают нагреться до комнатной температуры
и затем перемешивают в течение 18 ч. Реакционную смесь разбавляют метилен хлоридом
и добавляют воду.
Органический слой отделяют, промывают раствором соли, высушивают и концентрируют для получения 230 мг остаточного палево- желтого масла. Остаток очищают хроматографически, используя 1:5 этил ацетат/гексан, чтобы получить 92 мг желаемого продукта 26с.
NMR δ 0.90 (s, 9H), 1.21 (d, 3H), 1.56 (m, 2H), 2.09 (t, 2H), 3.69 (2dd, 2H), 3.84 (m, 1H), 3.93 (m, 1H), 5.07 (q, 2H), 5,17 (d, 1H), 6.15 (br d, 1H), 7.34 (m, 5H), MS (FAB); m/z 465 (M+H calc'd for C25H45N2O4Si 465).
Пример 64
[R-(R*, R*)]-[3-[[(1,
1-Диметилэтил)диметилсилил]-окси]-1- метил]-2-[(1-оксогептил)аминопропил]Фенил Метиловый Эфир Карбаминовой Кислоты (26d)
Соединение 25d защищают, согласно методике использованной для
приготовления 26с, получая 26d.
Пример 65
[S-(R*, S*)]
-[3-Гидрокси-1-метил-2-[(1-оксогептил) амино]пропил]-Карбаминовой Кислоты Фенилметиловый Эфир
(29с)
Соединение 26с десилилируют, согласно методике Примера 47, для получения 29с.
Пример 66
[R-(R*, R*)]
-[3-Гидрокси-1-метил-2-[(1-оксогептил)амино] пропил]-Карбаминовой Кислоты Фенилметиловый Эфир (29d)
Соединение 26d
десилилируют, как в Примере 65, получая 29d.
Пример 67
[S-(R*, S*)]-2-[(1-Оксогептил)амино]-3-[[(фенилметокси)карбонил]амино]-Бутановая Кислота (30с)
Окисление соединения 29с, согласно методике Примера 49, дает 30с.
Пример 68
[R-(R*, R*)]-2-[(1-Оксогептил) амино]-3-[[(фенилметокси)
карбонил]амино] -Бутановая Кислота (30d)
Соединение 29d превращают в 30d,
согласно Примеру 67.
Пример 69
[R-(R*,S*
)]-3-Амино-2-[(1-оксогептил)амино]-3-Бутановая Кислота (2g-2)
Гидрирование 30с, согласно Примеру 28,
дает соединение 2g-2.
Пример 70
[R-(R*,R*
)]-3-Амино-2-[(1-оксогептил)амино]-3-Бутановая Кислота (2g-3)
Соединение 30d превращается в 2g-3,
согласно Примеру 69.
Пример 71
[R-(R*, S*
)]-3-Амино-2-[(1-оксогептил)амино]-3-Бутановой Кислоты Метиловый Эфир
Этерификация 2g-2, согласно
Примеру 55, с использованием MeOH в качестве спирта, дает 2h-2 в виде его хлористоводородной
соли.
Пример 72
[R-(R*, R*
)]-3-Амино-2-[(1-оксогептил)амино]-Бутановой Кислоты Метиловый Эфир (2h-3)
Соединение 2g-3 этерифицируют, как в
Примере 71, для получения 2h-3 в виде его хлористоводородной соли.
Пример 73
(S)-5-оксо-3-[(фенилметокси)карбонил] -4-оксазолидин- пропановая кислота (43с)
Смесь 100
г (355 ммоля) N-бензилоксикарбонил-L-Glu (42с) и 213 г параформальдегида
нагревают до кипения с обратным холодильником в толуоле (1 л).
Через 4 ч образующийся раствор охлаждают до комнатной температуры и экстрагируют насыщенным раствором бикарбоната натрия (5 х 150 мл).
Водные слои объединяют, затем распределяют с 400 мл этил ацетата и подкисляют твердым
бисульфатом натрия. Слои разделяют, и органически слой высушивают над сульфатом
магния, затем концентрируют, получая 89.72 г неочищенной кислоты в виде вязкого желтого масла:
NMR δ
7.38 (m, 5H), 5.6 (brs, 1H), 5.21 (d, J = 4.7 Hz, 1H), 5.19 (s, 2H), 4.41 (t, J = 6
Hz, 1H), 2.6-2.1 (m, 4H).
Пример 74
(S)-5-оксо-3-(фенилметокси)карбонил]-4-Оксазолидин- пропаналь (44с)
Раствор 27 г (92.7 ммоля) сырой кислоты (43с) в 200 мл ТГФ
охлаждают до 0oC и добавляют по каплям 13 мл (10.7
мг, 141 ммоль) комплекса боран-метил сульфид через дополнительную воронку. Реакционной смеси дают нагреться постепенно до комнатной
температуры и перемешивают в течение 12 ч.
Образующуюся смесь концентрируют при пониженном давлении, получая белый стеклообразный материал, который поглощают 500 мл метилен хлорида и обрабатывают пиридин хлорохроматом (61 г, 281 ммоль) при 0oC в присутствии ЗА молекулярных сит. Смеси дают нагреться до комнатной температуры и перемешивают в течение 3 ч.
Смесь профильтровывают через инфузорную землю с
диэтиловым эфиром (200 мл), затем концентрируют. Остаток поглощают диэтиловым эфиром и отфильтровывают снова через инфузорную землю с диэтиловым эфиром,
затем концентрируют, получая 13.22 г
неочищенного альдегида в виде светло-зеленого масла:
NMR δ 9.80 (br s, 1H), 7.40 (m, 5H), 5.55 (br s, 1H), 5.20 (m, 3H), 4.38 (t, J = 6.0 Hz, 1H),
2.6-2.1 (m, 4H).
Пример 75
4-[4-[[1,1-диметилэтокси)карбонил] амино] -5-метокси-5-оксо -3-пентенил] -5-оксо-3-оксазолидин-карбоновой кислоты Фенилметиловый эфир (46с)
К раствору 15.1 г фосфоната 45
в 300 мл метилен хлорида при -78oC добавляют по каплям 102 мл 0.5 М раствора гексаметилдисилиламида калия в ТГФ. Реакционную смесь перемешивают 10 мин и к
раствору энолята добавляют 18 г
неочищенного альдегида в 30 мл метилен хлорида.
Смесь перемешивают в течение 3 ч пока происходит нагревание до комнатной температуры. Реакционную смесь резко охлаждают 100 мл охлажденной воды и экстрагируют 2х300 мл диэтилового эфира. Органические экстракты объединяют и промывают 200 мл воды и 50 мл раствора соли.
После высушивания над сульфатом магния объем уменьшают. Остаток хроматографируют, используя переменный градиент гексан/этил ацетат. E изомер (2.4 г) вымывается первым с последующими 15.4 г желаемого Z изомера 46с.
NMR δ 1.45 (s, 9H); 2.00-2.40 (М, 4H); 3.74 (s, 3H); 4.36 (b t, 1H); 5.20 (М, 4H); 5.54 (b s, 1H); 6.43 (b t, 1H); 7.37 (m, 5H).
IR (neat)cm-1: 3350(s),
1800(s),
1740(s); MS(CI): m/z 466 (M + NH4); 410 (M-C4H8)+; 349 (M-C4H8CO2 + H)+); [α]
Где:
neat - чистый
Пример 76
(Z)-N-5,6-Дидегидро-N6-(1,
1диметилэтокси)-карбонил]-6- (метоксикарбонил)-N2-(фенилметокси)-карбонил] -L-лизил] -D-аланина Метиловый Эфир (47с)
Смесь 3.3 г D-аланин метилового эфира и 7.1 г 46с
нагревают
при 140oC в течение 10 мин, затем другие 1.6 г D-аланин метилового эфира добавляют. Hагревание дополнительно продолжают при 140oC еще 10 мин.
После охлаждения до температуры окружающей среды сырой продукт хроматографируют на силикагеле, используя переменный градиент гексан/этил ацетат. Выделяют очищенный продукт (6.7 г). Материал кристаллизуют из смеси гексан-диэтиловый эфир, получая 5.8 г желаемого продукта 47с в виде твердого вещества.
NMR δ 1.43 (s, d, 12H); 1.80-2.10 (m, 2H); 2.23-2.36 (m, 2H); 3.72 (s, 3H); 3.76 (s,
3H);
4.15-4.27 (m, 1H); 4.50-4.60 (m, 1H); 5.11 (b s, 2H); 5.76 (b s, 1H); 6.38 (b s, 1H); 6.47 (b t, 1H); 6.81 (b s, 1H); 7.34 (m, 5H)13C-NMR: 17.82 (-CHCH3; 24.33 (-CH2
-CH2); 28.02 (С(CH3)3); 30.99 (-CH2CH=C); 47.94 (-CHCH3); 52.17 (-OCH3); 52.29 (-OCH3); 54.28 (OCCHNH); 66.93
(-CH2Ar); 80.43 (-ОС(CH3)3); 126.57 (-HNC=C); 127.86 (phenyl ring carbon); 127.94 (phenyl ring carbon); 128.12 (phenyl ring carbon); 128.28 (phenyl ring carbon);
135.98
(phenyl ring carbon); 153.45 (OCONH); 156.21 (OCONH-); 165.13 (-CONH-); 171.04 (-CO2-); 172.99 (-CO2-). IR (KBr, cm-1) 3300 (s); 1720 (s); 1690 (s); 1650 (s);
1510
(s); MS (CI) m/z 522 (MH)+ 466 (MH-C4C8)+; 422 (MH-C4H8CO2)+ MS (FAB) m/z 544 (M + Na)+; 522
(MH)+; 466 (MH-C4H8)+; Anal Calcd: C, 57.57; H, 6.76; N, 8.06; Found: C, 56.98; H, 6.66; N, 7.88 [α]
Где:
phenyl ring carbon - углерод фенильного кольца
Found
- найдено
Пример 77
N-[N6-[(1,1-Диметилэтокси)карбонил]-(R)-6-(метоксикарбонил)- N2-(фенилметокси)карбонил]-L-лизил]-D-Аланина Метиловый Эфир (40с)
Раствор 8.5 г 47с в 25 мл уксусной кислоты и 250 мл ТГФ гидрируют при 48 psi (17.44 кг/см2) водорода над 0.5 г (бицикло (2.2.1.)гептан-2,5-диен[2S, 3S]бис(дифенилфосфино)бутан)родий (I)
перхлората в течение 18 ч.
Реакционную смесь отфильтровывают и упаривают до получения остатка. Остаток хроматографируют, используя переменный градиент гексан/этил ацетат для получения 7.9 г выделенного продукта в виде остатка. Множественные кристаллизации дают 2.6 г диастереомерно чистого 40с.
NMR δ (CDCl3) 1.40 (d, J = 6Hz, 3H); 1.43
(s, 9H);
1.60-1.97 (m, 6H); 3.73 (s, 3H); 3.74 (s, 3H); 4.12-4.37 (m, 2H); 4.52-4.61 (m, 1H); 5.12 (bs, 3H); 5.44-5.55 (b s, 1H); 6.73 (b s, 1H); 7.36 (b s, 5H);13C-NMR: "дельта" 18.02
(-CH -CH3); 21.12 (CH2-CH2-CH2); 28.23 (-ОС(CH3)3); 31.87 (-CH2-CH2-); 32.39 (-CH2CH2-);
47.99
(-CHCH3); 52.23 (-OCH3); 52.38 (-OCH3); 52.75 (OCCHN); 54.41 (OCCHN); 67.01 (-OCH2Ar); 79.97 (-ОС(CH3)3); 127.99 (phenyl ring
carbon);
128.09 (phenyl ring carbon); 128.44 (ArCH); 136.13 (ArCC); 155.48 (OCONH); 156.23 (OCONH); 171.10 (-CONH-); 173.03 (-CO2-2X);
IR (KBr(cm-1): 3340 (s); 1760 (s);
1740 (s);
1680 (s); 1660 (s); 1660 (s); 1520 (s); MS (FAB) m/z 546 (M + Na)+; 524 (MH)+; 424 (MH-C4H8CO2)+;
Anal. Calcd: C,
57,35; H,
7.12; N, 8.03; Found: C, 57.23; H, 7.27; N, 8.03; rotation [α]
Пример 78
N-[N6-[(1,1-Диметилэтокси)карбонил] -R-6-(метоксикарбонил) -L-лизил]-D-Аланина Метиловый Эфир (3c)
Раствор 40с (248 мг, 0.47
ммоля)
в метаноле (8 мл) гидрируют над Pd(OH)2, согласно Примеру 28. Спустя 3 ч, фильтрация и упаривание дают некрашенное стекло.
NMP (CDCl3) δ 3.50 (m, 1H), 3.80 (s, 6H), 4.30 (m, 1H), 4.55 (m, 1H), 5.15 (d, 1H), 7.85 (br s, 1H).
Пример 79
N-[N6-[(1,1-Диметилэтокси)карбонил] -6-(метоксикарбонил) -N2
-[[[3-оксо-2-[(1-оксогептил)амино] -3-(фенилметокси)пропил] амино]карбонил]-L-лизил]-D-аланин (1b-1)
Раствор 30 (94,5 мг, 0.24 ммоля) в высушенном ТГФ (3А сита, 0.8 мл) добавляют по каплям в
атмосфере аргона к смеси 1,1'-карбонилдиимидазола (39.34 мг, 0.24 ммоля, высушенного над P2O5) в 1.8 мл высушенного ТГФ. Смесь перемешивают в течение 2ч и добавляют 2-1 (83.3 мг,
0.24 ммоля) и TEA (34 ul, 0.24 мм).
Образующуюся смесь перемешивают 18 ч при температуре окружающей среды. Смесь разбавляют водой и экстрагируют этил ацетатом. Органический слой отделяют, промывают раствором соли, высушивают, отфильтровывают и упаривают до получения остатка. Остаток очищают хроматографически, элюируя 1-2% метанолом в хлороформе и получая 109.3 мг 1b-1 в виде белого продукта.
NMR δ 0.88 (t, 3H), 2.22 (t, 2H), 3.59 (m, 2H), 3.70 (s, 3H), 3.73 (s, 3H), 4.26 (m, 1H), 4.52 (t, 1H), 4.63 (m, 1H), 5.32 (d, 2H), 5.63 (d, 1H), 7.07 (d, 1H), 7.20 (d, 1H); MS (HR-FAB) m/z 722.3980 (M + H, calcd for С35H56N5O11 722.3976).
Пример 80
N-[6-метоксикарбонил)N2
-[[[3-оксо-2-[1-оксогептил)- амино]-3-(фенилметокси)пропил] амино] карбонил] -L-лизил-D- аланина метиловый эфир (1b-2)
К 16 мг 1b-1 под аргоном при 0oC добавляют 100 мкл TFA с
последующим перемешиванием в течение 1 ч. Летучие продукты упаривают, получая 11.1 мг 1b-2.
NMR (CD3OD) δ 0.80 (t, 3H), 1.30 (d, 3H), 2.15 (t, 2H), 3.32 (m, 1H), 3.56 (m, 1H), 3.60 (s, 3H), 3.73 (s, 3H), 3.95 (m, 1H), 4.15 (m, 1H), 4.30 (q, 1H), 4.38 (m, 1H), 5.07 (d, 2H), 7.28 (m, 5H); MS (HR-FAB) m/z 622.3435 (M + H, calcd for C30H48 N5O9 622.3452).
Пример 81
N-[N2-[[[2-карбокси-2-[(1-оксогептил)амино] этил] - амино] карбонил] -N2-[(1,1-диметилэтокси)карбонил]
-6- (метоксикарбонил)-L-лизил-D-аланина метиловый эфир (1b-3)
К 70 мг 1b-1 в 7 мл метилового спирта добавляют 31 мг Pd(OH)2 на углероде и реакционную смесь гидрируют в течение 4 ч
согласно Примеру 28. Реакционную смесь отфильтровывают через слой инфузорной земли. Фильтрат концентрируют для получения 53.8 мг 1b-3 в виде стекла.
NMR (CD3OD) δ 0.80 (t, 3H), 2.15 (t, 2H), 3.32 (m, 1H) 3.56 (m, 1H), 3.60 (s, 6H), 3.95 (m, 1H), 4.15 (m, 1H), 4.30 (q, 1H), 4.38 (m, 1H); MS (HR-FAB) m/z 632.3493 (M + H, calcd for C28H50 N5O11 632.3506).
Пример 82
N-[N2-[[[2-карбокси-2-[(1-оксогептил)амино] этил] -амино] карбонил]-6-(метоксикарбонил)-L-лизил-D-Аланина
метиловй
эфир (1b-3)
К 40.2 мг 1b-3 в атмосфере аргона при 0oC добавляют 300 мкл TFA в соответствии с методикой Примера 80. Летучие продукты упаривают, и концентрат высушивают в
течение
всей ночи, получая 47 мг 1b-4.
NMR (CD3OD) δ 0.80 (t, 3H), 1.30 (d, 3H), 2.15 (t, 2H), 3.28 (m, 1H), 3.56 (m, 1H), 3.62 (s, 3H), 3.75 (s, 3H), 3.95 (m, 1H), 4.13 (m, 1H), 4.31 (q, 1H), 4.43 (m, 1H); MS (HR-FAB) m/z 532.2972 (M + H, calcd for C23H42N5O9 532.2983).
Пример 83
N-[6-карбокси-N2-[[[-карбокси-2-[(1-оксогептил)амино] этил]-амино]карбонил]-N6-[(1,1-диметилэтокси)карбонил]-L-лизил -D-аланин (1b-5)
К раствору 135.9 мг 1b-1 в 2.7 мл
метилового спирта
добавляют 104 мг карбоната калия и 0.9 мл воды с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь упаривают до получения остатка, который
растворяют в 1 мл
воды и подкисляют 1 Н HCl до pH 2.
Реакционную смесь перемешивают в течение 5 минут и экстрагируют 2х этил ацетатом. Объединенные органические экстракты промывают раствором соли, высушивают и упаривают, получая 106 мг остатка. Остаток растирают с 3х5 мл диэтилового эфира, и эфир декантируют. Твердый остаток высушивают, получая 91.7 мг продукта 1b-5 в виде белого твердого продукта.
NMR (CD3OD) δ 0.80 (t, 3H), 2.15 (t, 2H), 3.32 (m, 1H), 3.56 (m, 1H), 3.95 (s, 3H), 4.15 (m, 1H), 4.30 (q, 1H), 4.38 (m, 1H); MS (HR-FAB) m/z 604.3200 (M + H, calcd for C26H46N5O11 604.3194).
Пример 84
N-[6-карбокси-N2
-[[[2-карбокси-2-[1-оксогептил)амино]- этил]амино]карбонил]-L-лизил]-D-аланин (1b-11)
85.9 мг 1b-5 в атмосфере аргона обрабатывают 500 мкл TFA, согласно Примеру 80. Летучие продукты
упаривают
до получения остатка, который обрабатывают диэтиловым эфиром 3х, и эфир декантируют. Остаток высушивают для получения 77.9 мг 1b-11 в виде белого твердого продукта.
NMR (CD3 OD) δ 0.80 (t, 3H), 2.16 (t, 2H), 3.22 (br s, 5H), 3.58 (m, 2H), 2.85 (m, 1H), 4.15 (m, 1H), 4.30 (d, 1H), 4.40 (m, 1H); MS (HR-FAB) m/z 526.2482 (M+H, calcd for C21 H38 N5O9 526.2489).
Пример 85
[S-(R*, S*)]-N-[N6-[(1,1- Диметилэтокси)карбонил-N2
-[[[3- метокси-[[[3-метокси-1-метил-3-оксо-2-[(1-оксогептил)амино] - пропил] амино] карбонил]-(R)-6-(метоксикарбонил)-L-лизил-D-Аланин (1b-6)
Амин 2h-2 соединяется с амином 3с, согласно
методике, описанной в Примере 79. Карбамид очищают хроматографически и идентифицируют как 1b-6.
Пример 86
[R-(R*, R*)] -N-[N6-[(1,
1- Диметилэтокси)карбонил-N2-[[[3- метокси-1-метил-3-оксо-2-[(1-оксогептил)амино]- пропил]аминокарбонил]-(R)-6-(метоксикарбонил)-L-лизил]-D-Аланина Метиловый Эфир (1b-7)
Амин 2h-3
превращают в карбамид 1b-7, согласно Примеру 85.
Пример 87
[S-(R*, S*)] -N-[(R)-6-карбокси-N2- [[[2-карбокси-1-метил-2-[(1-оксогептил)амино]
-этил]амино]карбонил]- N6-(1,1-диметилэтокси)карбонил]-L-лизил]-D-Аланин (1b-8)
Гидролиз 1b-6, согласно методике Примера, 83 дает 1b-8.
Пример 88
[R-(R*, R*)] -N-[(R)-6-карбокси-N2- [[[2-карбокси-1-метил-2-[(1-оксогептил)амино] -этил]амино]карбонил]- N6-(1,1-диметилэтокси)карбонил]-L-лизил]-D-Аланин
(1b-9)
Гидролиз 1b-7, согласно Примеру 87, дает 1b-9.
Пример 89
[S-(R*, S*)] -N-[(R)-6-карбокси-N2
-[[[2- карбокси-1-метил-2-[(1-оксогептил)амино]-этил]амино]карбонил]-L- лизил-D-Аланин (1b-12)
Деблокирование амино группы 1b-8, согласно методике Примера 84, дает 1b-12.
Пример 90
[R-(R*, R*)] -N-[(R)-6-карбокси-N2- [[[2-карбокси-1-метил-2-[(1-оксогептил)амино]-этил]амино]карбонил]- L-лизил]-D-Аланина (1b-13)
Соединения 1b-9 снимают защиту, согласно методике Примера 89, получая 1b-13.
Реферат
Описываются новые карбаматы и карбамиды, индуцирующие производство цитокинов, общей формулы I, где R1 выбирают из группы, состоящей из замещенной или незамещенной (C1-C20) алкильной группы, замещенной или незамещенной циклоалкильной группы, замещенной или незамещенной фенил(низший)алкильной группы, Ra и R3 независимо выбирают из (С1-С6)алкила, и R2, Rb и Rc независимо выбирают из карбокси или защищенного карбокси, Х представляет кислород или азот и R4 представляет Н или аминозащитную группу; где заместители в выше упомянутых замещенных алкильных, циклоалкильных, фенил(низший)алнильных группах выбирают из группы, состоящей из галогена, гидроксила, низшего алкила, низшего алкокси, амино, моно- или динизшего алкиламино, карбоксила, формила, низшего алкоксикарбонила, и его фармацевтически приемлемые соли. Новые карбаматы и карбамиды, представляют собой первые примеры непептидных аналогов бактериальных компонентов оболочки клетки и не содержат обычную для предшествующего уровня составляющую. Описываются также способ получения соединений I и фармацевтическая композиция, индуцирующая эндогенное продуцирование факторов роста IL-6 и C3F25 регулирующих продуцирование нейтрофилов в костном мозге млекопитающего. 4 с. и 2 з.п. ф-лы, 9 табл.
Формула

где R1 выбирают из группы, состоящей из замещенной или незамещенной (С1-С20)алкильной группы, замещенной или незамещенной циклоалкильной группы, замещенной или незамещенной фенил(низший)алкильной группы;
Rа и R3 независимо выбирают из (С1-С6)алкила;
R2, Rb и Rc независимо выбирают из карбокси или защищенного карбокси;
Х представляет кислород или азот;
R4 представляет Н или аминозащитную группу,
где заместители в выше упомянутых замещенных алкильных, циклоалкильных, фенил(низший)алкильных группах выбирают из группы, состоящей из галогена, гидроксила, низшего алкила, низшего алкокси, амино, моно- или динизшего алкиламино, карбоксила, формила, низшего алкоксикарбонила,
и их фармацевтически приемлемые соли.
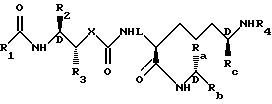
где R1 выбирают из группы, состоящей из н-гексильной группы, 4-н-пентилциклогексильной группы;
Rа и R3 независимо выбирают из водорода или метила;
R2, Rb и Rc представляют карбокси;
Х представляет кислород;
R4 представляет Н.
[S-(R*, R*)] -N-[(R)-6-карбокси-N2-[[2-карбокси-1-метил-2-[(1-оксогептил)амино]этокси]карбонил]-L-лизил]-D-аланин;
[R-(R*, S*)] -N-[(R)-6-карбокси-N2 -[[2-карбокси-1-метил-2-[(1-оксогептил)амино]этокси]карбонил]-L-лизил]-D-аланин;
(R)-N-[(R)-6-карбокси-N2-[[2-карбокси-2-[(1-оксогептил)-амино] этокси] карбонил]-L-лизил]-D-аланин;
[(R)-6-карбокси-N2-[[2-карбокси-1-метил-2-[[(4-пентилциклогексил)карбонил]амино]этокси]карбонил]-L-лизил]-D-аланин;
N-[N2-[[2-[[4-бутоксифенил)ацетил] амино] -2-карбокси-1-метилэтокси]карбонил] -(R)-6-карбокси-L-лизил] -D-аланин; [R-(R*, R*)]-N-[(R)-6-карбокси-N2-[[1-[карбокси[(1-оксогептил)амино] метил] пропокси]карбонил]-L-лизил]-D-аланин;
[S-(R*, S*)]-N-[(R)-6-карбокси-N2-[[1-[карбокси[(1-оксогептил)амино]метил]пропокси]карбонил]-L-лизин]-D-аланин;
N-[6-(метоксикарбонил)-N2-[[[3-оксо-2-[1-оксо-гептил)амино] -3-(фенилметокси)пропил]амино]карбонил]-L-лизил-D-аланин метиловый эфир;
N-[N2 -[[[2-карбокси-2-[(1-оксогептил)амино] этил] амино] карбонил-6-(метоксикарбонил)-L-лизил]-D-аланин метиловый эфир;
N-[6-карбокси-N2 -[[[карбокси-2-[(1-оксогептил)амино]этил]амино]карбонил] -N6-[(1,1-диметилэтокси)карбонил]-L-лизил-D-аланин;
N-[6-карбокси-N2-[[[2-карбокси-2-[(1-оксогептил)амино] этил]амино]карбонил]-L-лизил]-D-аланин;
[S-(R*, S*)]-N-[(R)-6-карбокси-N2-[[[2-карбокси-1-метил-2-[(1-оксогептил)амино]этил]амино]карбонил]-L-лизил]-D-аланин;
[R-(R*, R*)]-N-[(R)-6-карбокси-N2-[[[2-карбокси-1-метил-2-[(1-оксогептил)амино]этил]амино]карбонил]-L-лизил]-D-аланин.
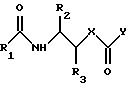
где R1, R2, R3 и Х являются такими, как определены в п.1;
Y представляет хлор, когда Х представляет О, и Y представляет имидазолил, когда Х представляет NH,
с соединением формулы

где Ra, Rb, Rc и R4 являются такими, как определено в п.1,
с получением соединения по п.1.

где R1, R2, R3 и Х являются такими, как определено в п.1,
с соединением формулы

где Ra, Rb, Rc и R4 являются такими, как определено в п.1;
Y представляет хлор, когда Х представляет О, и Y представляет имидазолил, когда Х представляет NH,
с получением соединения по п.1.
