Комплекс 1:2 германия и 2,6-пиридиндикарбоновой кислоты, способ его получения, фармацевтическая композиция - RU2171259C2
Код документа: RU2171259C2
Чертежи




Описание
Изобретение относится к антибактериальным иммуномодулирующим препаратам, которые могут найти применение в медицине и ветеринарии.
Поддержание гомеостаза и сопротивляемость влиянию факторам окружающей среды, таким как инфекционные агенты, обусловливается в большой степени функционированием систем (прежде всего, иммунной системы), обеспечивающих неспецифическую сопротивляемость организма. Система интерферона является одной из важнейших частей неспецифического иммунитета. Интерфероны являются цитокинами, посредством которых происходят внутриклеточные и гуморальные реакции, направленные на поддержание гомеостаза организма (Grеsser, Cell Immunol., 977, 43, N 2, pp. 406-413; Stewart, The Interferon System, Springer-Verlag, N.Y., 1979; Соловьев и др., Интерфероны в медицинской теории и практике, М., Медицина, 1981, стр. 400). Система интерферона представляет собой совокупность клеточных элементов, способных продуцировать различные виды интерферона, изменяющих свои функциональные возможности под действием интерферона и таким образом реализуя внутриклеточные и гуморальные реакции, обеспечивая поддержание гомеостаза организма. Дефекты в системе интерферона приводят к нарушениям функции иммунной системы и, как следствие, к возрастанию риска развития некоторых инфекций и онкологических заболеваний. Избирательная модуляция интерферонов, индукторов интерферонов или других иммуномодуляторов некоторых частей иммунной системы, непосредственно участвующих в защите против того или иного заболевания, может приводить к коррекции иммунодефицита и дефицита интерферона и значительно повышать устойчивость организма к инфекционным заболеваниям (The Biology of the Interferon System. 1988. Proceedings of the Fifth Annual meeting of the International Society for Interferon Research (ISIR 88), Kyoto, Japan, 14-18 November, 1988, Tokyo, 1989, p. 503).
Новая группа препаратов - индукторы интерферона - нашла широкое применение в качестве препаратов, подавляющих инфекцию, и в качестве иммуномодулирующих препаратов. Индукторы интерферона содержат гетерогенные группы высоко- и низкомолекулярных соединений природного или синтетического происхождения. Такие препараты обладают широким спектром биологической активности: антибактериальной, противоопухолевой, иммунномодулирующей, радиозащитной и т. д. (Ершов и др., Интерферон и его индукторы, М., Медицина, 1980, стр. 173).
Известны препараты альфа-,
бета- и гамма-интерферонов, которые, в
зависимости от способа получения,
делятся на природные (интерфероны первого
поколения) и
рекомбинантные (интерфероны второго поколения):
1.
Природные интерфероны: препараты α
-интерферона - человеческий лейкоцитарный
интерферон, эгиферон, виллиферон; препараты
β
-интерферона - человеческий фибробластный интерферон, ферон;
γ -интерферона - человеческий
иммунный интерферон.
2. Рекомбинантные интерфероны: препараты α 2а-интерферона реаферон, реалдирон, роферон; препараты α 2b-интерферона - интрон, инрек; препараты α 2с-интерферона - берофор; препараты β -интерферона - бета-ферон; препараты γ -интерферона - гамма-ферон (Чекнев и др. Система интерферона в нормальном и патологическом состоянии, М., Медицина, 1966, стр. 196-221).
Существенный недостаток естественных интерферонов заключается в способе их получения из крови человека, который включает риск переноса гетерогенной генетической информации и вирусных инфекций. Рекомбинантные интерфероны не обладают такими недостатками и являются достаточно ценными в определенных клинических ситуациях. Однако наличие только одного подтипа интерферона в каждом конкретном препарате ограничивает область их применения. Все препараты интерферона индуцируют экзогенное образование интерферона в организме, что является их общим недостатком.
Известны индукторы интерферонов, используемые в клинической практике: синтетические соединения, такие как, например, амиксин (низкомолекулярное соединение ароматического ряда, относящееся к классу флуоренонов), неовир (низкомолекулярное соединение, относящееся к биоосновным гетероароматическим соединениям, к классу акридинонов). Известны природные соединения, такие как, например, мегазин (продукт конденсации госсипола через альдегидную группу с натриевой солью β -аминоэтилсерной кислоты), ларифан (РНК фага λ 2 с двойной спиралью); ридостин (РНК с двойной спиралью, полученная из лизата киллерных дрожжей Saccharomyces cerevisiae) (Ершов и др. Антивирусные препараты. Санкт-Петербург, 1993, стр. 104). Преимущество этой группы заключается в ее способности индуцировать аутогенные интерфероны. Вышеуказанные индукторы интерферона, однако, индуцируют синтез только альфа- и бета-интерферонов. В настоящее время не известны достаточно эффективные индукторы гамма-интерферона, подходящие для применения в клинической практике.
Известно, что германий-органические соединения обладают различными видами биологической активности. Это препарат, известный как карбоксиэтилгерманий-сесквиоксид общей формулы [GeCH2 CH2COOH]2O3, который способен при пероральном введении индуцировать продукцию интерферона в крови мышей. Позднее было показано, что препарат способен индуцировать синтез γ -интерферона в суспензии мононуклеарных клеток in vitro (Munakata et al, Interferon Res., 1987, v. 7, pp. 69-76). Однако он обладает токсичностью и имеет низкую эффективность в качестве индуктора иммунного интерферона. Сырья (германий-хлороформ) для его получения имеется недостаточно.
Германиевый комплекс 2,6- пиридиндиил-бискарбонилокси (гидроксипропоксигерманий), обладающий свойствами индуктора иммунного интерферона, описан Игнатенко и др. в Российском авторском свидетельстве N 1622989 от 22.09.90. Это вещество, однако, имеет узкий спектр иммуномодулирующей активности.
Таким образом, целью настоящего изобретения является создание нового препарата, обладающего антибактериальной, интерферон-индуцирующей и иммуномодулирующей активностью, который мог бы быть использован в медицине и ветеринарии для профилактики и лечения инфекционных заболеваний, иммунодефицитных и интерферон-дефицитных состояний, и который не имел бы недостатков, присущих известным вышеуказанным аналогам.
Согласно изобретению, комплексы германия
представляют собой насыщенную или ненасыщенную,
карбоциклическую
или
гетероциклическую дикарбоновую кислоту, причем
две карбоксильные группы находятся, соответственно, в 1 и 3 положениях кольца.
Кольцо может иметь 0, 1 или 2 гетероатома,
например N, O или S.
Оно
может
быть 4-, 5-, 6- или 7-членным. Конкретным
воплощением данного изобретения является бис (пиридин-2,6-дикарбоксилат) германия
формулы I:
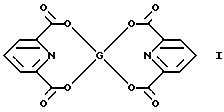
Новые соединения обладают антибактериальной, интерферон- индуцирующей и иммуномодулирующей активностями, что может найти применение в медицине и ветеринарии для профилактики и лечения инфекционных заболеваний, иммунодефицитных и интерферон- дефицитных состояний.
Новые комплексы, согласно изобретению, могут быть получены путем взаимодействия кислоты, например 2, 6-пиридиндикарбоновой кислоты, с тетраалкоксигерманием, предпочтительно тетраметоксигерманием или тетраэтоксигерманием. Тетраалкоксигерманий может быть получен непосредственно в реакционной смеси, например, из тетрагалогенида германия и алкоголята щелочного металла, например, тетрахлорида германия и метанолята (этанолята) натрия (получен путем растворения металлического натрия в метаноле (этаноле)).
Реакцию можно проводить в среде органического растворителя, такого как гексан, гептан, метанол или этанол; температура реакции находится обычно в области от 60 до 90oC. Реакцию предпочтительно проводят в атмосфере инертного газа, такого как аргон или азот, время реакции около 3-5 ч. Целевой продукт выделяют обычными методами, например, фильтрацией и сушкой в вакууме, например, при 133,322 Па (1 Торр) при 40oC.
Изобретение также относится к фармацевтической композиции, содержащей в качестве активного ингредиента эффективное количество комплекса германия вместе с фармацевтически приемлемым носителем, наполнителем или разбавителем. Фармацевтическая композиция может вводиться различными путями, такими как пероральный, парентеральный, интраназальный и т.д.
При пероральном применении композиция может использоваться в виде таблеток, водных суспензий, диспергируемых порошков или гранул, а также в виде сиропов или эликсиров. Композиции, предназначенные для перорального введения, могут быть получены любыми методами, известными в данной области, применяемыми для получения фармацевтических композиций. Такие композиции могут содержать один или несколько агентов, выбранных из подсластителей, ароматизаторов, красителей и консервантов, используемых в фармацевтических препаратах, обладающих хорошими эстетическими и вкусовыми качествами.
Таблетки могут содержать активный ингредиент в смеси с нетоксичными, фармацевтически приемлемыми наполнителями, которые обычно используются для приготовления таблеток. Указанные наполнители могут быть нейтральными разбавителями, такими как карбонат кальция, карбонат натрия, лактоза, фосфат кальция, гранулирующие и разрыхляющие агенты, например, кукурузный крахмал, производные целлюлозы или альгиновая кислота. Таблетки могут не иметь оболочку или могут быть покрыты известными способами, например, оболочкой, задерживающей процесс распада таблетки в желудочно-кишечном тракте, создавая пролонгирующий эффект. Водные суспензии могут содержать активный ингредиент в смеси с наполнителями, подходящими для приготовления водной суспензии.
Фармацевтическая композиция для парентерального введения, например подкожного или внутримышечного, может содержать стерильный раствор для инъекции в воде или физиологическом растворе. Для интраназального введения фармацевтическая композиция может содержать раствор комплекса германия в воде или физиологическом растворе.
Как будет понятно специалистам в данной области, применяемая доза комплекса будет зависеть от желаемого эффекта, например, иммуномодулирующего, интерферон-индуцирующего, антибактериального, а также от тяжести заболевания, возраста и состояния пациента. Обычно, однократная доза составляет от 0,05 мг/кг до 100 мг/кг. Число введений может колебаться от 1 до 4 в день.
Новый комплекс имеет низкую токсичность. В исследованиях острой токсичности на мышах ЛД50 равно 900 мг на килограмм массы тела.
Конкретные примеры получения германий-органического соединения формулы I, его физико-химические характеристики, примеры фармацевтических композиций на его основе, а также результаты биологических испытаний представлены ниже.
Структура полученного соединения была подтверждена данными спектрального анализа (ИК,1H и13C ЯМР, масс), чистота была подтверждена данными элементного анализа.
ИК спектр бис (пиридин-2, 6-дикарбоксилат) германия получен на приборе "Bruker IFS 113v".1H ЯМР и13C ЯМР были получены на спектрометре "Bruker AC-200". Масс-спектр (EU) был получен на приборе "Finnigan AT Incos 50" при 70 эВ.
Пример 1.
6,4 г (0, 038 моль) 2,6-Пиридиндикарбоновой кислоты, 4, 0 г (0,02 моль) тетраметоксигермания и 25 мл абсолютного метанола в атмосфере азота нагревали с обратным холодильником при энергичном помешивании при температуре кипения (64oC) в течение 3 ч. Осадок отфильтровывали на Shott фильтре, промывали метанолом (2х10 мл) и высушивали при температуре 40oC в вакууме (133,322 Па - 1 Торр) в течение 3 ч. Выход составлял 6,88 г (90%) соединения на основе 2,6-пиридиндикарбоновой кислоты.
Полученное соединение представляло собой бесцветные кристаллические иглы с температурой плавления 303-305oC (разложение). Оно средне растворимо в воде, диэтилформамиде и диметилсульфоксиде и нерастворимо в углеводородах, хлороформе, сложном эфире, этаноле.
ИК (v, см-1 таблетки в KBr): 667, 768, 922, 1095, 1148, 1304, 1368, 1493, 1600, 1732, 3097, 2800-3100.
1H ЯМР ( δ, м.д., 200, 13 МГц, D2O): 8,35 (м, 6Н, Н-ароматические).
13C ЯМР ( δ, м.д., 50,32 МГц, D2O): 129,7 ( β -C, 143,2 ( ν - C), 147,8 ( α -C), 167,4 (C=О).
Масс-спектр (m/z), (74Ge): 360 [M-CO2]+, 272, 228, 195, 171, 154, 139, 122, 112, 93, 84, 77.
Элементный анализ для
C14H6GeN2O8:
Найдено,%: C 41,47; H 1,68; Ge 17,86; N
6,60.
Вычислено,%: C 41,75; H 1,50; Ge 18,02; N 6,95.
Молекулярная масса 402, 76.
Пример 2
К 1,1 г (0,
048 моль) Na и 25 мл абсолютного
метанола при комнатной температуре в
атмосфере азота добавляли 2,6 г (0,012 моль)
тетрахлоргермания в течение 5
мин. Реакционную массу нагревали с обратным
холодильником в течение 1,5 ч, затем
охлаждали до 20oC. Осадок (NaCl)
отфильтровывали на Shott фильтре и
промывали метанолом (3х15 мл). К
полученному фильтрату, содержащему раствор
тетраэтоксигермания в этаноле, добавляли
3 г (0,18 моль) 2,6-пиридиндикарбоновой кислоты.
Далее обрабатывают, как описано
в Примере 1. Выход составлял 3,
45 г (95%) в расчете на 2,
6-пиридиндикарбоновую кислоту.
Спектральные характеристики соединения, полученного этим путем, по существу такие же, как описаны выше в примере 1.
Пример 3
Раствор для инъекции готовили путем
растворения бис(пиридин-2,6-дикарбоксилата) германия в воде при комнатной
температуре. Одна ампула
этого раствора содержит:
Бис(пиридин-2,
6-дикарбоксилат)
германия - 0,01 г
Вода
для инъекций - 2 мл
Пример 4
Таблетки готовили путем
растирания компонентов в
ступке и формования в прессовочной
машине. Одна
таблетка содержит:
Бис(пиридин-2,
6-дикарбоксилат) германия - 25 мг
Натрий метилцеллюлоза - 350 мг
Сахароза - 125 мг
Исследование индукции α,
β,
γ-интерферонов в
мышиной сыворотке in
vivo
Самцам мышей СВА массой 12-14 г прививали внутрибрюшинно соединение I в
виде водного раствора в
дозах 0,005-50 мг/кг. Уровень
синтеза
интерферона в сыворотке крови
определяли с
различными интервалами (5, 24, 48, 72 ч). Титрование интерферона проводили в L-929 клеточных
культурах. Тест-вирусом
являлся вирус мышиного
энцефаломиокардита. Результаты представлены в
таблице
1.
Как видно из таблицы 1, соединение I индуцировало продукцию сывороточного интерферона, причем в первые 5 ч после прививки были выявлены интерфероны α и β, а в последних интервалах - γ-интерферон. Оптимальная доза соединения составляла 0,5 мг/кг.
Исследование действия на клетки, чувствительные к интерферону.
(а) Клеточную культуру диплоидных фибробластов человека (М-19), высокочувствительную к интерферону, засевали в лунки 96-луночной плашки со средой Игла с 10%-ной телячьей эмбриональной сывороткой. На третий день роста культуре прививали соединение I в количестве 1 мкг/мл. После 24-часовой инкубации (37oC, 5% CO2), проводили титрование α- интерферона (реаферон с начальной активностью 2•106 ИЕ/мл против 100 TCD вируса везикулярного стоматита). Восприимчивость клеток к интерферону определялась путем цитопатического действия на вирус. Результаты представлены в таблице 2.
(б) Клетки непрерывной линии J-41 с пониженной чувствительностью к α - интерферону засевали в концентрации 105 клеток/мл в 96-луночную плашку со средой 199 с 10% телячьей эмбриональной сывороткой. На следующий день добавляли в культуру соединение I в количестве 1 мкг/мл. Титрование интерферона и определение чувствительности проводят, как описано выше в (а).
Как видно из таблицы 2, после 24-часовой обработки клеток М-19 соединением I, чувствительность клеток к α-интерферону (реаферон) возрастала в 8 раз. После 24-часовой обработки клеток J-41 соединением I их чувствительность к интерферону возрастала в 4 раза.
Вышеуказанные результаты показывают, что соединение может использоваться в клинической практике для коррекции интерферона и усиления чувствительности пациентов к препаратам интерферона.
Исследование действия на
гемопоэтические стволовые клетки
Соединение I разбавляли физиологическим раствором в концентрации 2,5 или 0,5 мкг/мл. Мышам
экспериментальной группы
прививали внутрибрюшинно 0,2 мл один
из
полученных растворов (0,5 и 1 мкг/мышь, соответственно). Контрольным животным вводили инъекции физиологического раствора. В 1, 2, 3,
4 и 7 дни после
введения
исследуемого соединения животным
вводили
гепарин (40 единиц/мышь) и затем брали образцы периферической крови, селезенки и костного мозга из бедренной кости. Кровь разводили
1:1
физиологическим
раствором. Суспензии костного мозга
и селезенки
готовили обычным методом. Содержание гемопоэтических стволовых клеток (ГСК) в крови, костном мозге и селезенке животных,
обработанных препаратом,
исследовали методом экзогенного
колонеообразования в
селезенке сингенных летально облученных реципиентов; более конкретно, разбавленную периферическую кровь (0,1 мл),
клетки
костного мозга (3-5
• 104 клеток)
или клетки селезенки
(5•105 клеток) прививали летально облученным сингенным реципиентам, которых забивали на 8-9 день;
их
селезенки извлекали,
фиксировали в растворе Боуина и
подсчитывали количество
видимых бляшек или развивающихся колоний ГСК.
Для определения действия препарата на пролиферацию ГСК, суспензию клеток костного мозга или клеток селезенки обрабатывали in vitro оксимочевиной в количестве 1 мг/мл в течение 2 ч при 37oC перед прививанием облученным реципиентам. Количество ГСК, перешедших в S-фазу, определялось формулой: A=(a-b) • 100/a, где a - количество ГСК колоний без обработки оксимочевиной и b - количество ГСК колоний, обработанных оксимочевиной. Результаты представлены в таблице 3.
Как видно из таблицы 3, соединение I увеличивает количество ГСК в крови. Было показано, что отсутствует способность стимулировать выход ГСК в S-фазу.
Исследование
стафилококковой
активности
Препарат
прививали подкожно мышам СВА в дозах от 0,1 до 10 мкг на мышь, после чего животному
прививали 1,25 • 105 микробных клеток
Staphylococcus
aureus Wood
46. Степень выживания определяли
как процент по отношению к контрольной группе мышей, которые не получали
соединения I. Результаты были,
соответственно, 39,8%, 60,0% и 80,
7% при дозах 0,1,
1,0 и
10,0 мкг. Таким образом, доза 1 мкг
повышает устойчивость мыши к стафилококку.
Исследование
противогриппозной активности
Модельная система была
экспериментальной
инфекцией
гриппа у мышей, вызванной лабораторным
штаммом WSN вируса гриппа A (H1N1). Вирус развивался в течение 9 дней
в куриных эмбрионах. Мышам
C57B1/6 под действием эфирного
наркоза прививали
интраназально каждой 50 мкл ЛД50 вируса,
разбавленного 1: 100. Препарат был привит в дозе 100 мкл (20
мкг/мышь) внутримышечно в день
инфицирования. Контрольная группа
животных получала
раствор плацебо. Каждая группа состояла из 10 самцов
мышей массой 14-16 г. Смерть животных регистрировали каждый
день в течение 14 дней, и в конце
эксперимента были определены
среднее время
выживаемости и летальность. Данные представлены в таблице
4.
Вышеуказанные данные показывают высокое противогриппозное действие.
Исследование
клинической
эффективности
на собаках, пораженных чумкой
Собакам с
установленным диагнозом чумки (продолжительность заболевания от
10 до 30 дней; у 3 животных
- кишечная форма болезни, у 2
- легочная
форма и у 3
животных нейропаралитическая стадия) прививали
внутримышечно 2-4 мл (зависит от массы животного) 0,5% раствор
исследуемого соединения I в
дистиллированной воде дважды в день
в течение
3-10 дней. После
этого курса лечения все животные
выздоровели.
Реферат
Описывается новый германиевый комплекс германия и ароматической или неароматической, циклической или гетероциклической 1,3-дикарбоновой кислоты, например, бис(пиридин-2,6-дикарбонат)германия, обладающий антибактериальной интерферониндуцируемой и иммуномоделирующей активностью. Описывается также способ его получения и фармацевтическая композиция. 3 с. и 1 з.п.ф-лы, 4 табл.

Комментарии