Вирусная частица, высвобождающаяся после инфицирования клеток млекопитающих цитомегаловирусом человека (hcmv), содержащая слитый белок, и ее применение - RU2623172C2
Код документа: RU2623172C2
Чертежи






Описание
Настоящее изобретение относится к вирусной частице, высвобождающейся после инфицирования клеток цитомегаловирусом человека (HCMV), причем
a) частица окружена липидной мембраной, в которую погружены вирусные гликопротеины,
b) частица не содержит ни вирусной ДНК, ни капсидов; и
c) частица содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид;
и к применению такой вирусной частицы или множества таких вирусных частиц.
Инфекция цитомегаловирусом человека (HCMV) является основной причиной заболевания у пациентов после трансплантации солидных органов или гемопоэтических стволовых клеток [1-9]. Более того, передача вируса в ходе беременности является одной из наиболее частых причин длительных осложнений у новорожденных в западном полушарии [10; 11]. Таким образом, разработка вакцины против HCMV определена как первоочередная цель [12].
Одной из целей такой вакцины является предупреждение инфицирования матери или по меньшей мере чресплацентарной передачи. Для достижения этого считается необходимой индукция нейтрализующих антител. Напротив, считается, что защита от реактивации и контроль инфекции у реципиентов трансплантатов обеспечивается клеточными ответами, в частности, опосредуемыми через CD8 T-клетки [13-15]. Терапевтическая вакцинация реципиентов трансплантатов, направленная на ответ лимфоцитов, возможно в комбинации с адоптивным T-клеточным переносом, является желательной для смягчения последствий вирусной реактивации HCMV в период после трансплантации [16].
Однако, несмотря на перспективные подходы к разработке вакцины против HCMV, все еще не существует доступного лицензированного состава [10; 17-19]. Из многочисленных исследований, направленных на иммунные эффекторы, которые обеспечивают защиту, очевидно, что идеальная вакцина против HCMV должна индуцировать как противовирусные нейтрализующие антитела, так и T-лимфоциты [10; 17; 18; 38]. Однако существует сомнение, что такая универсальная вакцина против HCMV может быть когда-либо получена. В недавнем клиническом исследовании было показано, что репликоны альфавируса, экспрессирующие белки HCMV, хорошо переносились и индуцировали длительные клеточные и гуморальные ответы [19]. В другом исследовании использовали очищенный gB в качестве вакцины и были получены обнадеживающие результаты, поскольку возможно было индуцировать значительные уровни нейтрализующих антител против HCMV [18]. Эти вакцины являются перспективными для применения для предупреждения врожденной инфекции HCMV.
В предшествующих исследованиях на мышах было показано, что так называемые плотные тельца, которые также обозначают в настоящем описании как DB, являются неожиданно иммуногенными [20]. Как, в основном, понимают в данной области и как также используют в настоящем описании, плотное тельце представляет собой вирусную частицу, высвободившуюся после инфицирования клеток цитомегаловирусом человека (HCMV), где
a) частица окружена липидной мембраной, в которую погружены вирусные гликопротеины,
b) частица не содержит ни вирусной ДНК, ни капсидов.
Предпочтительно такое плотное тельце также содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид. Плотные тельца и их получение также описаны в международной патентной заявке WO 00/53729.
Ввиду их неожиданной иммуногенности, были предприняты попытки разработать DB в качестве вакцины против HCMV. Недавние эксперименты обеспечили экспериментальные доказательства того, что DB можно модифицировать по их антигенному содержимому [21; 22]. Этого достигали путем экспрессии из рекомбинантного HCMV слитого белка, состоящего из основного компонента DB pp65 и гетерологичного пептида, презентируемого MHC класса I, из вирусного белка IE1. Это приводило к образованию рекомбинантных DB (recDB) в инфицированных фибробластах крайней плоти полового члена человека (HFF). Из инфицированных HFF высвобождались recDB, содержавшие слитый белок [21]. Применение этих частиц у мышей HHD, трансгенных по HLA-A2, индуцировало CD8+ T-лимфоцитарный ответ, который становился заметным после стимуляции пептидом in vitro выделенных T-клеток [22]. Однако специфичные к HCMV T-клетки нельзя было выявить непосредственно, когда фракции CD8+ T-клеток тестировали прямо ex vivo в анализе Elispot. Это указывает на то, что хотя эти частицы в принципе пригодны для терапевтического применения, стимуляция не была настолько выраженной, насколько это желательно. Кроме того, выход этих recDB из инфицированных культур HFF был низким.
Таким образом, задача, лежащая в основе настоящего изобретения, состояла в получении вирусных плотных телец, которые пригодны в качестве вакцины, где вирусное плотное тельце содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид и где предпочтительно вакцина способна индуцировать иммунный ответ по меньшей мере на один гетерологичный пептид.
Следующей задачей, лежащей в основе настоящего изобретения, было получение вирусного плотного тельца, где вирусное плотное тельце содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид, и где предпочтительно плотное тельце способно индуцировать образование нейтрализующих антител и/или CD8+ T-лимфоцитарный ответ.
Следующей задачей, лежащей в основе настоящего изобретения, было получение вирусного плотного тельца, где вирусное плотное тельце содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид, и где плотное тельце можно получать с высоким выходом.
Эти и другие задачи решаются с помощью объекта прилагаемых независимых пунктов формулы изобретения. Предпочтительные варианты осуществления могут быть установлены из также прилагаемых зависимых пунктов формулы изобретения.
Более конкретно, задача, лежащая в основе настоящего изобретения, решается в первом аспекте, который также представляет собой первый вариант осуществления первого аспекта, с помощью вирусной частицы, высвобождающейся после инфицирования клеток цитомегаловирусом человека (HCMV), причем
a) частица окружена липидной мембраной, в которую погружены вирусные гликопротеины,
b) частица не содержит ни вирусной ДНК, ни капсидов; и
c) частица содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид,
и где по меньшей мере один гетерологичный пептид встроен в положении аминокислоты W175 или A534 аминокислотной последовательности T-клеточного антигена pp65.
Во втором варианте осуществления первого аспекта, который также является вариантом осуществления первого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид встроен в положении аминокислоты W175 аминокислотной последовательности T-клеточного антигена pp65.
В третьем варианте осуществления первого аспекта, который также является вариантом осуществления первого и второго варианта осуществления первого аспекта, аминокислотная последовательность T-клеточного антигена pp65 содержит аминокислотную последовательность согласно SEQ ID NO: 1.
В четвертом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго и третьего варианта осуществления первого аспекта, частица является высоко антигенной.
В пятом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего и четвертого варианта осуществления первого аспекта, частица способна индуцировать образование нейтрализующих антител.
В шестом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого и пятого варианта осуществления первого аспекта, частица способна индуцировать CD8+ T-лимфоцитарный ответ.
В седьмом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого и шестого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид представляет собой антиген, презентируемый MHC класса I.
В восьмом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого и седьмого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или образован из одной или нескольких частей одного или нескольких белков, которые отличаются от pp65.
В девятом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или является одной или несколькими частями гликопротеина HCMV.
В десятом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого и девятого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или является одной или несколькими частями гликопротеина gB HCMV.
В одиннадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого и девятого вариант осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или является одной или несколькими частями гликопротеина gH HCMV.
В двенадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого и девятого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или состоит по меньшей мере из двух гликопротеинов HCMV, которые являются вариантами конкретного гликопротеина из различных штаммов HCMV.
В тринадцатом варианте осуществления первого аспекта, который также является вариантом осуществления двенадцатого варианта осуществления первого аспекта, один из по меньшей мере двух вариантов конкретного гликопротеина представляет собой вариант штамма HCMV Towne, и другой из по меньшей мере двух вариантов конкретного гликопротеина представляет собой вариант штамма HCMV Ad 169.
В четырнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления двенадцатого и тринадцатого варианта осуществления первого аспекта, гликопротеин представляет собой белок gB HCMV.
В пятнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или является одной или несколькими частями белка IΕ1 HCMV.
В шестнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого варианта осуществления первого аспекта, по меньшей мере один гетерологичный пептид содержит или является одной или несколькими частями гликопротеина HCMV и одной или несколькими частями белка IE1 HCMV.
В семнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого и восьмого вариант осуществления первого аспекта, по меньшей мере один гетерологичный пептид является одной или несколькими частями белка, который является частью патогена человека, отличного от HCMV.
В восемнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления семнадцатого варианта осуществления первого аспекта, белок, который является частью патогена человека, отличного от HCMV, представляет собой белок, против которого у человека образуются цитотоксические T-лимфоциты при естественном инфицировании человека патогеном человека, отличным от HCMV.
В девятнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления восемнадцатого варианта осуществления первого аспекта, патоген человека, отличный от HCMV, представляет собой патоген человека, выбранный из группы, включающей ВИЧ-1, HBV, HCV и вирус гриппа.
В девятнадцатом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого и девятнадцатого варианта осуществления первого аспекта, слитый белок представляет собой слитый белок, содержащий полноразмерный T-клеточный антиген pp65 и по меньшей мере один гетерологичный пептид.
В двадцать первом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого варианта осуществления первого аспекта, вирусная частица или множество таких частиц предназначены для получения лекарственного средства для лечения и/или профилактики заболевания.
В двадцать втором варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого варианта осуществления первого аспекта, вирусная частица или множество таких частиц предназначены для применения в способе лечения и/или профилактики заболевания.
В двадцать третьем варианте осуществления первого аспекта, который также является вариантом осуществления двадцать первого и двадцать второго варианта осуществления первого аспекта, заболевание представляет собой заболевание, которое можно лечить и/или предупреждать путем образования нейтрализующих антител против по меньшей мере одного гетерологичного пептида или его производного, или путем индукции CD8+ T-лимфоцитарного ответа против по меньшей мере одного гетерологичного пептида или его производного.
В двадцать четвертом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого варианта осуществления первого аспекта, вирусная частица или множество таких частиц предназначены для получения вакцины.
В двадцать пятом варианте осуществления первого аспекта, который также является вариантом осуществления двадцать четвертого варианта осуществления первого аспекта, вакцина предназначена для лечения и/или профилактики инфекции HCMV.
В двадцать шестом варианте осуществления первого аспекта, который также является вариантом осуществления двадцать четвертого варианта осуществления первого аспекта, вакцина предназначена для лечения и/или профилактики побочных эффектов трансплантации.
В двадцать седьмом варианте осуществления первого аспекта, который также является вариантом осуществления двадцать шестого варианта осуществления первого аспекта, трансплантация представляет собой трансплантацию солидного органа или гемопоэтических стволовых клеток.
В двадцать восьмом варианте осуществления первого аспекта, который также является вариантом осуществления двадцать шестого и двадцать седьмого варианта осуществления первого аспекта, побочный эффект вызывается инфекцией HCMV или сопровождает инфекцию HCMV.
Задача, лежащая в основе настоящего изобретения, решается во втором аспекте, который также является первым вариантом осуществления второго аспекта, с использованием вирусной частицы согласно любому из первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого варианта осуществления первого аспекта для изготовления лекарственного средства для лечения и/или профилактики заболеваний или побочных эффектов, причем заболевание представляет собой заболевание, а побочные эффекты представляют собой побочные эффекты, как определено для каждого и любого из предшествующих вариантов осуществления и каждого и любого аспекта.
Задача, лежащая в основе настоящего изобретения, решается в третьем аспекте, который также является первым вариантом осуществления третьего аспекта, с использованием вирусной частицы согласно любому из первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого, девятого, десятого, одиннадцатого, двенадцатого, тринадцатого, четырнадцатого, пятнадцатого, шестнадцатого, семнадцатого, восемнадцатого, девятнадцатого и двадцатого варианта осуществления первого аспекта для изготовления вакцины для лечения и/или профилактики заболевания или побочных эффектов, причем заболевание представляет собой заболевание и побочные эффекты представляют собой побочные эффекты, как определено для каждого и любого из предшествующих вариантов осуществления и каждого и любого аспекта.
Исходя из точки зрения, что участок встраивания последовательностей гетерологичного пептида в pp65 является критичным для эффективности последующего образования DB, авторы настоящего изобретения неожиданно открыли, что слитый белок, который содержится в вирусных частицах по изобретению и который содержит одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид, обеспечивает преимущественные характеристики DB, если гетерологичный пептид встроен в положении аминокислоты W175 или в положении аминокислоты A534 аминокислотной последовательности pp65. Преимущественные характеристики этих слитых белков включают индукцию нейтрализующих антител против гетерологичного пептида, индукцию CD8+ T-лимфоцитарного ответа на гетерологичный пептид и продуцирование таких DB с высоким выходом. Более того, эти два локуса в pp65 обеспечили эффективное образование и высвобождение DB, содержащих указанные слитые белки. CD8+ T-лимфоцитарный ответ, наблюдаемый для этих двух слитых белков, стимулировал CD8 T-клеточные ответы, которые легко выявляются в анализах Elispot фракций CD8 T-клеток ex vivo.
T-клеточный антиген pp65, который также обозначают в данной области как UL 83, описан Pande, H. et al. (Pande, H, Lee, T.D., Churchill, M.A. и Zaia, J.A, "Structural analysis of a 64-kDa major structural protein of human cytomegalovirus (Towne): identification of a phosphorylation site and comparison to pp65 of HCMV (AD 169); Virology 178 (1), 6-14 (1990)).
Мало известно о функции pp65 и о доменах, важных для функционирования и надлежащей укладки белка. Следовательно, отсутствует обоснование для выбора участка встраивания, который точно сохранит имеющие функциональное значение области в pp65. Выбор участка встраивания проводили так, чтобы избежать областей, консервативных у бета-герпесвирусов, а также предсказанных вторичных структур (α-спиралей и β-слоев). Это проводили, предполагая, что консервативные области α-спирали и β-слои могут быть структурно и функционально важными и не должны быть нарушены. Однако большинство из этих мутантов не образовывали эффективно recDB, что указывало на то, что эта стратегия не могла идентифицировать надлежащие участки встраивания. Ввиду этого, авторы настоящего изобретения неожиданно открыли, что участки встраивания в RV-SB3 и RV-SB6 оказались более подходящими для образования recDB.
Как показано в настоящей заявке, экзогенное встраивание химерного pp65 с помощью DB-SB3 и DB-SB6 в HFF приводило к эффективной презентации pp65NLV и IE1TMY. Введение этих частиц HLA-A2 трансгенным мышам HHD стимулировало CD8 T-клеточный ответ против обоих пептидов, который можно было выявить после размножения in vitro этих T-клеток с родственным пептидом. Сходные результаты также были получены в предшествующих экспериментах с использованием recDB со встраиванием пептида IE1 в положение 548 pp65 [21; 22]. Однако при использовании последнего recDB, CD8 T-клетки против любого из пептидов не поддавались детекции прямо ex vivo, указывая на то, что стимуляция была неэффективной. Введение DB-SB3, напротив, приводило к легко поддающейся детекции встречаемости pp65NLV-специфических и IE1TMY-специфических CD8 T-клеток. Это указывает на то, что эти recDB были высоко иммуногенными и индуцировали T-клетки как против эндогенного, так и против гетерологичного пептида.
В одном из вариантов осуществления изобретения гетерологичный пептид представляет собой антигенный пептид и более предпочтительно антигенный гетерологичный пептид.
В одном из вариантов осуществления настоящего изобретения гетерологичный пептид отличается от белка IE1 HCMV или его части.
В одном из вариантов осуществления настоящего изобретения длина пептида составляет приблизительно от 4 до 40 аминокислотных остатков, предпочтительно приблизительно от 6 до 25 аминокислотных остатков и более предпочтительно приблизительно от 8 до 15 аминокислотных остатков и наиболее предпочтительно приблизительно 8-12 аминокислотных остатков.
Как предпочтительно используют, любая формулировка, которая определяет пределы диапазона, например, такая как "от 1 до 5", означает любое целое число от 1 до 5, т.е. 1, 2, 3, 4 и 5. Иными словами, любой диапазон, который определяется двумя целыми числами, включает как два целых числа, определяющих указанные пределы определения, так и любое целое число, которое содержит указанный диапазон или находящееся в указанном диапазоне.
В одном из вариантов осуществления настоящего изобретения антигенность вирусной частицы по изобретению увеличена по сравнению с плотными тельцами уровня техники, более конкретно, с теми плотными тельцами, где плотное тельце содержит слитый белок, содержащий полноразмерный T-клеточный антиген pp65.
В одном из вариантов осуществления настоящего изобретения образование вирусной частицы по изобретению увеличено по сравнению с образованием плотных телец, как описано в [25].
Специалисту в данной области будет понятно, что предпочтительно белок IE1 HCMV также обозначают как ppUL123.
Также будет понятно, что в предпочтительном варианте осуществления слитый белок, содержащийся в частице, представляет собой химерный белок.
Настоящее изобретение далее проиллюстрировано с помощью следующих чертежей и примеров, из которых могут быть определены дополнительные преимущества, признаки и варианты осуществления, где
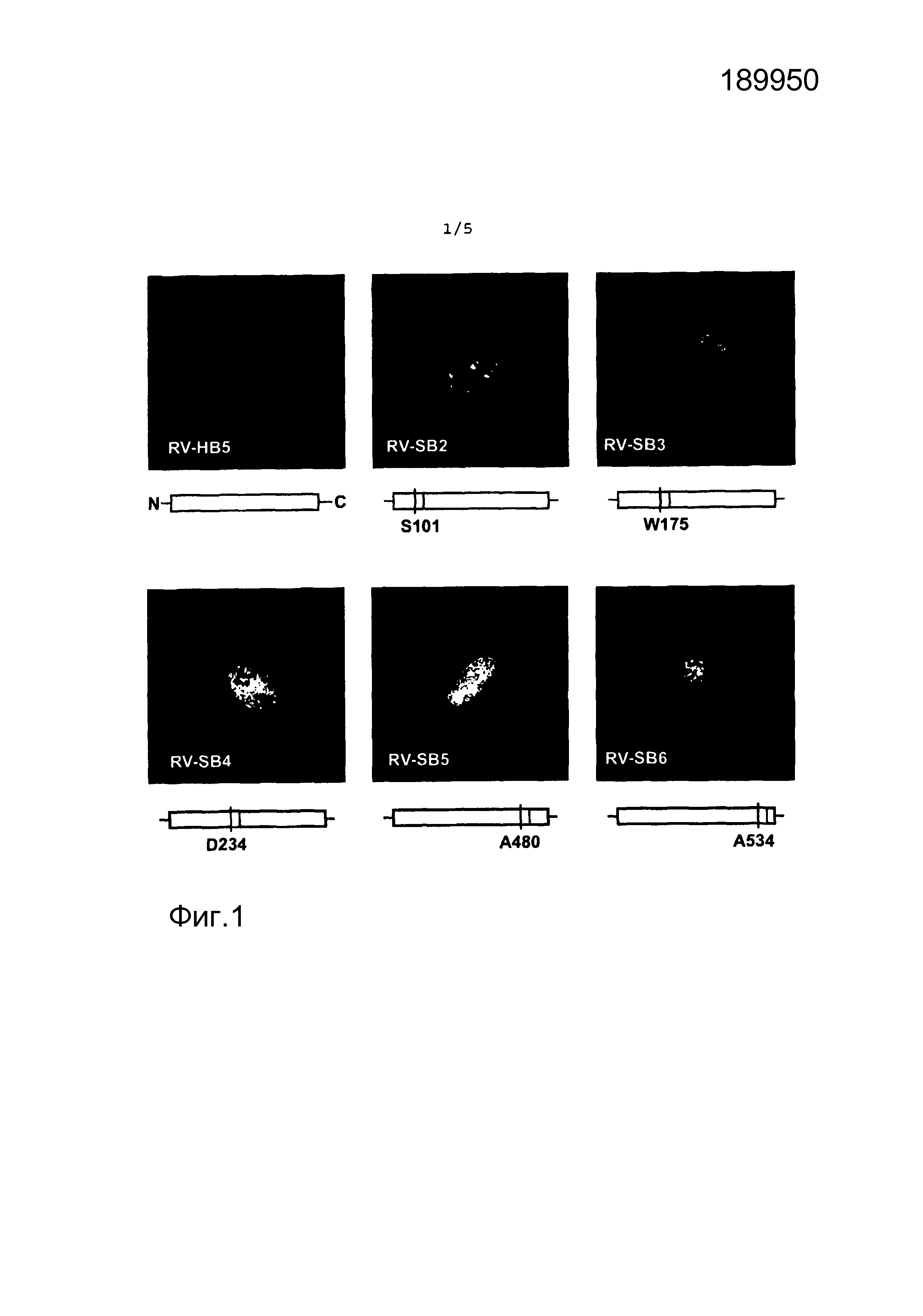
на фиг.1 представлен результат непрямого иммунофлуоресцентного анализа HFF, инфицированных рекомбинантами HCMV;
на фиг.2 представлен результат иммуноблот-анализа (A), результат анализа способом количественной ПЦР ДНК в качестве диаграммы, указывающей на число копий генома/мл в качестве функции времени (d.p.i) для различных слитых белках (B), и результат дополнительного иммуноблот-анализа (C);
на фиг. 3 представлен результат анализа IFN-γ-Elispot в качестве диаграммы, указывающей на процент отвечающих CD8+ клеток для различных слитых белков, с использованием либо pp65NLV-CTL (A), либо или IE1TMY-CTL (B) в качестве отвечающих клеток;
на фиг. 4 представлен результат анализа IFN-γ-Elispot в качестве диаграммы, указывающей на процент отвечающих CD8+ клеток для различных слитых белков с использованием клеток RMA-S в качестве стимулирующих клеток; и
на фиг. 5 представлена аминокислотная последовательность полноразмерного pp65 (SEQ ID NO: 1).
На фиг.1 представлен результат непрямого иммунофлуоресцентного анализа HFF, инфицированных рекомбинантами HCMV. Клетки инфицировали указанными вирусами в течение четырех суток, а затем обрабатывали для иммунофлуоресцентного анализа. Конфигурация рекомбинантного pp65, экспрессированного каждым вирусом, указана ниже на микрофотографиях. Обозначена N-концевая аминокислота pp65, фланкирующая участок встраивания.
На фиг. 2 представлена экспрессия слитых белков pp65, репликация рекомбинантных вирусов и эффективность упаковывания слитых белков в вирионы и DB. (A), Иммуноблот-анализ HFF, инфицированных в течение 2 и 4 суток. Клетки инфицировали при m.o.i. 2 и собирали в указанные моменты времени для анализа. Фильтры исследовали с помощью pp65-специфического моноклонального антитела 65-33. Количества белков в каждой дорожке нормализовали против β-актина. (B), Количественный анализ ПЦР ДНК вирусных геномов в супернатанте клеточной культуры инфицированных HFF. Клетки инфицировали при m.o.i. 10 геномов/клетка. Культуральные супернатанты собирали в указанные моменты времени и замораживали. Анализ ПЦР проводили параллельно в том же анализе. (C), Иммуноблот-анализ pp65, упакованного в recDB или вирионы. Клетки инфицировали рекомбинантными вирусами или wt RV-HB5 в течение 6-7 суток. Супернатанты подвергали центрифугированию в градиенте глицерин-тартрат для сбора фракций вирионов и DB. Эти фракции анализировали иммуноблоттингом с использованием моноклонального антитела 65-33 или, в качестве внутреннего стандарта, с использованием моноклонального антитела против вирусного gB.
На фиг. 3 представлен результат анализа IFN-γ-Elispot презентации MHC класса I положительными по HLA-A2 HFF, обработанными recDB. Клетки обрабатывали указанными DB, а затем использовали в качестве стимулирующих клеток в анализе IFN-γ-Elispot с использованием либо pp65NLV-CTL (A), либо IE1TMY-CTL (B) в качестве отвечающих клеток.
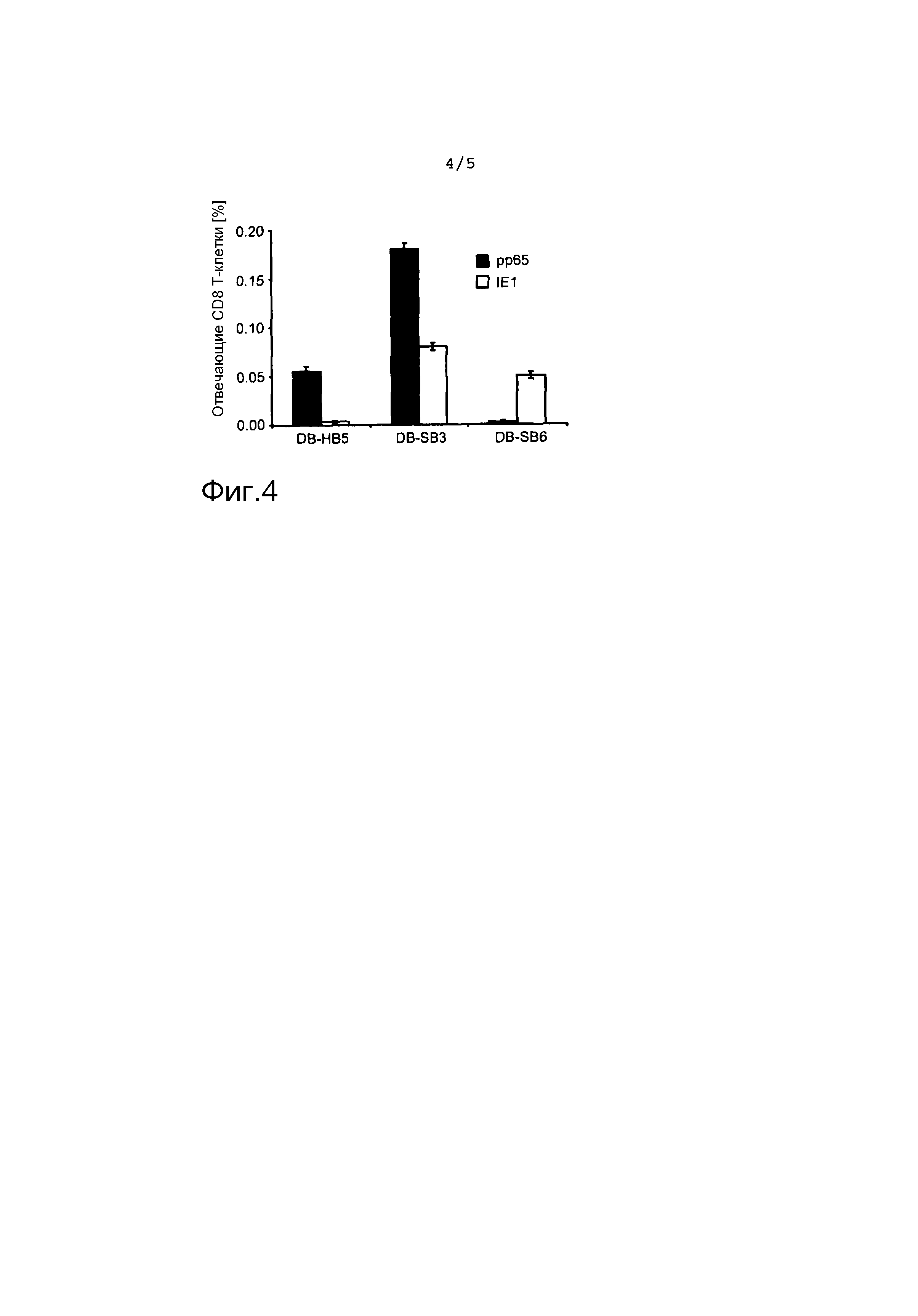
На фиг. 4 представлен результат анализа IFN-γ-Elispot ex vivo обогащенных CD8+ клеток селезенки из мышей HHD, иммунизированных recDB. Клетки RMA-S, нагруженные родственными пептидами, были выбраны в качестве стимулирующих клеток. Размер столбцов соответствует наиболее возможным частотам секретирующих IFN-γ CD8 T-клеток, при определении с помощью линейного регрессионного анализа, описанного Bohm et al [37]. Планки погрешностей указывают на 95% доверительные интервалы.
Пример 1: Материалы и способы
1. Клетки
Первичные фибробласты крайней плоти полового члена человека, линии CTL и клетки T2 культивировали, как описано ранее [23]. Клетки RMA-S [24] выращивали в среде RPMI 1640 (PAA Laboratories, Colbe, Германия), дополненной 10% FCS, 2 мМ L-глутамином, 50 мг гентамицином L-1 и 5 мкМ β-меркаптоэтанолом.
2. Плазмиды и вирусы
Для мутагенеза вирусной ДНК использовали бактериальную искусственную хромосому (BAC) HCMV pHB5 [25]. Мутагенез pHB5 проводили в соответствии с методикой положительной/отрицательной селекции с galK [26], как описано в литературе [21]. Последовательность ДНК, встроенная в открытую рамку считывания UL83, кодировала презентируемый HLA-A2 пептид IE1TMY [IE1297-305], фланкируемый дополнительными аминокислотами для обеспечения точного процессинга в протеасомах. Дополнительный полипептид, слитый с pp65, имеет последовательность TSDACMMTMYGGISLLSEFC, где презентируемый HLA-A2 нонапептид подчеркнут. Реконструирование вируса из клонов BAC проводили согласно Hobom et al. [27].
Исходный вирусный материал получали, титровали или количественно определяли либо путем подсчета положительных по IE1 клеток через 48 часов после инфицирования, либо с помощью анализа ПЦР ДНК TaqMan внеклеточных вирусных геномов, как описано [28]. HFF инфицировали в течение 7 суток. Инфицирование с moi 0,1 приводило к количеству внутриклеточных вирусных геномов, составляющему приблизительно 10.
3. Очистка плотных телец, непрямой иммунофлуоресцентный анализ и иммуноблоттинг
DB очищали из инфицированных HFF поздней стадии с помощью ультрацентрифугирования в градиенте глицерин-тартрат, как первоначально опубликовано Irmiere и Gibson [29] и как описано ранее [20]. Непрямой иммунофлуоресцентный анализ проводили, как описано [30]. pp65 метили с использованием моноклонального антитела 65-33 (любезно предоставленного W. Britt, University of Alabama, Birmingham, Alabama, USA) и конъюгированных с FITC вторичных антител (DAKO, Hamburg, Германия). Ядро подвергали контрастному окрашиванию с помощью DAPI. Данные иммунофлуоресцентного анализа получали с использованием микроскопа Axiophot-1 (Zeiss) при 1000-кратном увеличении. Для иммуноблоттинга образцы белка денатурировали в восстанавливающих условиях, разделяли путем SDS-PAGE и переносили на нитроцеллюлозные мембраны (Millipore, Schwalbach, Германия) путем электроблоттинга при 400 мА в течение 1 ч 45 мин. Мембраны инкубировали с антителами против pp65, β-актина (Rockland, Gilbertsville, PA, США) и гликопротеина B (gB) [31]). Вестерн-блоты исследовали с помощью вторичных антител против антител мыши или кролика, конъюгированных с ALEXA Fluor 680 (Invitrogen, Karlsruhe, Германия) или IRdye 800 (Rockland). Детекцию и количественное определение подвергнутых блоттингу белков проводили с использованием системы для инфракрасной визуализации Odyssey (LI-COR, Lincoln, Nebraska, США).
2.4 Анализ Elispot с интерфероном γ HFF, инкубированных с recDB
Точечный иммуноферментный анализ (Elispot) проводили, как описано ранее [23; 32]. В этих анализах использовали линии CTL, специфичные к ограниченным по HLA-A0201 (A2) происходящим пептидам HCMV pp65495-503 (pp65NLV-CTL) [33;34] и IE1297-305 (IE1 TMY-CTL) [35]. Линии CTL получали путем иммунизации двойных трансгенных (tg) по HLA-A2 huCD8 мышей [23].
2.5 Модель с трансгенными мышами HLA-A2
Трансгенных по HLA-A2 мышей в возрасте 8-12 недель (мыши HHD, [36]) иммунизировали внутрибрюшинно 6 мкг DB с RV-HB5 (DB-HB5), RV-SB3 (DB-SB3) или RV-SB6 (DB-SB6), соответственно, или PBS. На 7 сутки после иммунизации из селезенок получали лимфоциты. CD8 T-клетки обогащали путем сортировки MACS и частоту секретирующих IFN-γ клеток анализировали непосредственно с помощью Elispot ex vivo, с использованием нагруженных пептидом клеток RMA-S HHD или стимулирующих клеток T2. В этом случае использовали планшеты для Elispot от Millipore (Schwalbach/Ts., Германия). Анализ Elispot проводили согласно рекомендациям изготовителей. Частоты отвечающих клеток определяли с помощью линейного регрессионного анализа, как описано Bohm et al [37].
Пример 2: Выбор участка встраивания является важным для образования цитоплазматических DB
Как проиллюстрировано в этом примере, выбор участка встраивания гетерологичного пептида является важным для образования цитоплазматических DB.
Потенциал вакцины-кандидата для дальнейшей разработки в высокой степени зависит от выхода, который может быть достигнут, для дальнейшего увеличения масштаба. В предшествующей работе было показано, что DB можно модифицировать по их антигенному содержанию путем слияния последовательности гетерологичного пептида с белком оболочки pp65 [21]. Однако клетки, инфицированные соответствующим рекомбинантом HCMV, высвобождали только ограниченные количества recDB. Таким образом, тестировали гипотезу, что встраивание гетерологичной последовательности, такой как аминокислотная последовательность гетерологичного пептида, в другие участки в pp65 усиливает выход recDB.
Для встраивания было выбрано пять участков в различных частях молекулы (фиг. 1). Встроенный пептид состоял из 20 аминокислот, охватывающих презентируемый HLA-A2 нонапептид TMYGGISLL (IE1TMY) из белка IE1 HCMV [35]. Рекомбинантные вирусы получали путем модификации BAC-плазмиды pHB5 HCMV [25], с использованием методики селекции на основе galK [21; 22]. Рекомбинантные BAC-плазмиды анализировали в отношении правильности путем расщепления эндонуклеазой рестрикции и секвенированием нуклеотидов участка встраивания (данные не представлены). Затем проводили реконструирование рекомбинантных вирусов путем трансфекции BAC-плазмид в HFF. Полученные вирусы тестировали в отношении образования DB. Одним из признаков инфекции HCMV в HFF является цитоплазматическое накопление DB, которые можно визуализировать путем непрямого иммунофлуоресцентного анализа (IFA). Следовательно, HFF инфицировали вновь полученными мутантами и через 4 суток после инфицирования (d.p.i.) проводили IFA, с использованием pp65-специфического антитела (фиг. 1). Только клетки, инфицированные мутантами RV-SB3 и RV-SB6, продемонстрировали образование цитоплазматических DB, некоторым образом сравнимое с образованием DB в инфицированных исходным вирусом клетках. Напротив, в клетках, инфицированных RV-SB2, RV-SB4 и RV-SB5, не наблюдали образования DB или только небольшое образование DB. Следует отметить, что в этих клетках ядерно-цитоплазматическая транслокация pp65, которая, как правило, наблюдается в инфицированных HFF на поздней стадии, была нарушена. Эти результаты показали, что выбор участка для встраивания последовательностей гетерологичных пептидов в pp65 является критическим для образования recDB. Исходя из результатов IFA, вирусы RV-SB3 и RV-SB6 были выбраны для дальнейшего анализа.
Пример 3: Сравнение RV-SB3 и RV-SB6 с исходным штаммом
Как показано в этом примере, рекомбинантные вирусы RV-SB3 и RV-SB6 сравнимы с исходным штаммом в отношении экспрессии pp65, высвобождения вириона и упаковывания pp65 в частицы.
Уровни экспрессии pp65 в HFF, инфицированных RV-SB3 и RV-SB6, тестировали с помощью иммуноблот-анализа. Клетки инфицировали либо вирусом, либо исходным RVHB5 в течение двух или четырех суток, соответственно. Клеточные лизаты подвергали количественному иммуноблот-анализу с использованием системы для инфракрасной визуализации Odyssey. Количество клеточного актина принимали в качестве внутреннего стандарта (фиг. 2A). Уровни экспрессии слитых белков pp65 в клетках, инфицированных RV-SB3 и RV-SB6, были снижены через 2 суток после инфицирования по сравнению с уровнями pp65 в клетках, инфицированных исходным RV-HB5.
Однако через 4 суток после инфицирования уровни двух слитых белков оказались даже более высокими по сравнению с уровнями pp65 в клетках, инфицированных RV-HB5. Это показало, что в клетках, инфицированных RV-SB3 и RV-SB6, было синтезировано достаточно белка для направления на синтез recDB.
Для тестирования способности рекомбинантных штаммов реплицироваться в HFF, клетки инфицировали с m.o.i. 0,1, что приводило к 10 копиям генома/клетка и культуральный супернатант собирали с интервалом раз в сутки до 7 суток после инфицирования. Вирусную ДНК, высвободившуюся в супернатант, количественно определяли с использованием анализа способом количественной ПЦР (фиг. 2B). Как RV-SB3, так и RV-SB6, показали репликацию на сходных уровнях с исходным RV-HB5.
Упаковывание слитых белков в конце анализировали иммуноблот-анализом очищенных вирионов и DB, собранных из инфицированных супернатантов HFF центрифугированием в градиенте глицерина. В этом случае нормализацию проводили с использованием гликопротеина B (gB) вирусной оболочки в качестве внутреннего стандарта. Не было выявлено отличий в упаковывании pp65 в вирионы или DB, когда рекомбинантные штаммы сравнивали с их исходным штаммом (фиг. 2C). Взятые вместе, эти результаты показали, что как RV-SB3, так и RVSB6, были сравнимы с RV-HB5 с точки зрения экспрессии и упаковывания pp65 и репликации в инфицированных клетках.
Пример 4: Экспрессия как pp65NLV, так и IE1TMY, в HFF, обработанных DB-SB3 или DB-SB6
Настоящий пример демонстрирует, что как pp65NLV, так и IE1TMY, презентируются HFF, обработанными DB-SB3 или DB-SB6.
Одной целью использования recDB для разработки вакцины может быть поддержание восстановления цитотоксических T-клеток у пациентов после трансплантации. Было показано, что эти клетки обладают критической важностью для профилактики реактивации вируса и заболевания ([13; 15] в обзоре [16]). Таким образом, тестировали, способны ли recDB приводить как происходящий из pp65 pp65NLV, так и происходящий из IE1 IE1TMY, к пути презентации MHC класса I в HFF.
Таким образом, клетки обрабатывали recDB, а затем подвергали анализу интерферон-γ-Elispot (фиг. 3). В качестве отвечающих клеток использовали клоны CTL против обоих пептидов (pp65NLV-CTL; IE1TMY-CTL) [23]. Клетки, обработанные как DB-SB3, так и DB-SB6, презентировали IE1TMY и pp65NLV. Презентация pp65NLV было сравнимой между recDB и wt-DB, что указывало на то, что встраивание происходящей из IE1 последовательности не нарушало презентации pp65 в HFF. Обработка клеток DB-SB3 приводила к количествам отвечающих IE1TMY-CTL на уровнях, которые были сравнимым с pp65-специфическим ответом. Однако обработка клеток DB-SB6 привела к значительно сниженному количеству положительных пятен в IE1-специфическом анализе. Это показало, что способность HFF презентировать пептид IE1 после инкубации с DB была чувствительной к участку, где в pp65 был встроен пептид.
Пример 5: Иммунизация рекомбинантным DB (recDB) приводит к IE1TMY-специфическим и pp65NLV-специфическим CD8 T-клеткам
Этот пример демонстрирует, что иммунизация рекомбинантным DB (recDB) стимулирует значительную встречаемость IE1TMY-специфических и pp65NLV-специфических CD8 T-клеток.
Предшествующие эксперименты показали, что recDB может индуцировать IE1TMY-специфические CD8 T-клетки у мышей. Однако эти клетки выявлялись только после стимуляции in vitro CD8 T-клеточных фракций из иммунизированных мышей родственным пептидом. Не было выявлено отвечающих CD8 T-клеток непосредственно ex vivo, что указывает на то, что общее количество специфических клеток, и, таким образом, общий ответ на эти recDB были низкими [21]. Для оценки иммунологического потенциала вновь полученных recDB, трансгенных по HLA-A2 мышей HHD иммунизировали другим DB в отсутствие адъюванта. Как и ожидалось, после стимуляции in vitro выявлялись отвечающие CD8 T-клетки, специфичные к IE1TMY или pp65NLV (данные не представлены).
Клетки иммунизированных мышей также тестировали непосредственно ex vivo. Для этого CD8+ фракции клеток селезенки разделяли сортировкой MACS и тестировали в анализе Elispot с использованием нагруженных пептидов антигенпредставляющих клеток. CD8 T-клетки, специфичные к IE1TMY, можно было выявить после иммунизации посредством как DB-SB3, так и DB-SB6 (фиг. 4). IE1-специфический ответ, стимулированный DB-SB3, оказался сильнее, чем ответ, индуцированный DB-SB6, однако оба из них достигли четко выявляемых уровней.
После иммунизации DB-SB3, CD8 T-клетки, реактивные к pp65NLV, можно было выявить приблизительно на трехкратном уровне по сравнению с wt-DB.
Однако неожиданно этот ответ не поддавался детекции в экспериментальных условиях, выбранных после иммунизации DB-SB6, и pp65NLV-специфический ответ нельзя было выявить ex vivo. Этот результат был подтвержден во втором эксперименте и показал, что CD8 T-клеточный ответ, стимулированный против иммунодоминантного pp65NLV-пептида путем иммунизации DB-SB6, был недостаточным (фиг. 4). Сравнимые результаты были получены, когда для презентации антигена были выбраны клетки T2 (данные не представлены). Более того, это указывает на то, что эти клетки индуцировались только с низкой частотой ниже предела детекции анализа. В соответствии с этим, повторная стимуляция pp65NLV-специфических T-клеток in vitro была отсрочена по сравнению с IE1TMY-специфическими клетками (данные не представлены).
Взятые вместе, эти эксперименты, в частности, показали потенциал DB-SB3 к стимуляции CD8 T-клеточного ответа против гетерологичного антигенного пептида.
Список ссылок:
В настоящей заявке приводятся следующие различные ссылки:





Признаки настоящего изобретения, описанные в описании, формуле изобретения, списке последовательностей и/или на чертежах могут как по отдельности, так и в любой их комбинации быть материалом для осуществления изобретения в различных его формах.
Реферат
Изобретения относятся к вирусной частице, высвобождающейся после инфицирования клеток цитомегаловирусом человека (HCMV), ее применения для профилактики или лечения заболевания путем образования нейтрализующих антител к по меньшей мере одному антигенному гетерологичному пептиду или путем индукции CD8+ Т-лимфоцитарного ответа против такого гетерологичного пептида и вакцины, содержащей такую вирусную частицу. Охарактеризованная вирусная частица окружена липидной мембраной, в которую погружены вирусные гликопротеины и не содержит ни вирусной ДНК, ни капсидов. При этом частица содержит слитый белок, содержащий одну или несколько частей T-клеточного антигена pp65 и по меньшей мере один гетерологичный пептид, и где по меньшей мере один гетерологичный пептид встроен в положении аминокислоты W175 или A534 аминокислотной последовательности T-клеточного антигена pp65.4 н. и 19 з.п. ф-лы, 5 ил., 5 пр.

Комментарии