Триароматические соединения, содержащие их композиции и их применение - RU2149863C1
Код документа: RU2149863C1
Чертежи




Описание
Изобретение относится к триароматическим соединениям в качестве новых и полезных промышленных продуктов. Оно относится также к применению этих соединений в фармацевтических композициях, предназначенных для использования в медицине человека и животного, или в косметических композициях.
Соединения согласно изобретению обладают значительной активностью в областях дифференцировки и пролиферации клеток и могут найти особенное применение для топического и системного лечения дерматологических заболеваний, связанных с нарушением кератинизации, дерматологических (или других) заболеваний с воспалительным и/или иммуноаллергическим компонентом и доброкачественных или злокачественных кожных или эпидермических пролифераций. Эти соединения, кроме того, могут быть использованы для лечения дегенерации соединительной ткани, для борьбы против фотоиндуцируемого или возрастного старения кожи и для лечения нарушений заживления (рубцевания). К тому же они находят применение в области офтальмологии, в частности для лечения корнеопатий.
Соединения согласно изобретению можно также использовать в косметических композициях для гигиены тела и для ухода за волосами.
Соединения согласно изобретению могут быть
представлены следующей общей формулой (I):

где R1 означает (ii) -CH2OH, (iii) -O-R4, (iv) -CO-R5, где R4 и R5 имеют нижеуказанные значения;
Ar1 выбирается среди радикалов следующих формул (а)-(d):

где R6 имеет нижеуказанное значение;
X-Y означает связующее звено, выбираемое из следующих формул (e) - (m), которые могут быть присоединены к фенильному кольцу слева направо или наоборот:
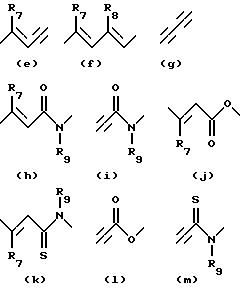
где R7, R8 и R9 имеют нижеуказанные значения;
Ar2 выбирается среди радикалов следующих формул (j)-(l):

причем Ar2 находится в орто- или мета-положении по отношению к связи X-Y и R10 и R11 имеют нижеуказанные значения;
R2 и R3 одинаковые или разные, означают атом водорода, линейный или разветвленный алкил с 1-20 атомами углерода, атом галогена; гидроксил, алкокси, остаток простого полиэфира;
R4 означает атом водорода, низший алкил;
R5 означает (а) атом водорода;
(в) радикал формулы:

где R' и R'' имеют нижеуказанные значения; и (г) радикал -OR13, где R13 имеет нижеуказанное значение;
R6 означает атом водорода, линейный алкил с 1-20 атомами углерода, гидроксил радикал; радикал -OR14 или радикал -OCOR14, где R14 имеет нижеуказанное значение; или остаток простого полиэфира,
R7 и R8, означают атом водорода, низший алкил;
R9 означает атом водорода;
R10 и R11, одинаковые или разные, означают атом водорода, линейный алкил с 1-20 атомами углерода, атом галогена; гидроксил, алкоксил, остаток простого полиэфира, CF3, алкенил или радикал -(CH2)n-R15, где n и R15 имеют нижеуказанные значения;
R' и R'', одинаковые или разные, означают атом водорода, низший алкил, незамещенный или замещенный гидроксигруппой фенил, или же оба радикала вместе образуют гетероцикл;
R13 означает атом водорода,
R14 означает низший алкильный радикал;
R15 означает гидроксил;
n = 1 или 2;
и оптические и геометрические изомеры вышеуказанных соединений формулы (I), так же как их соли.
Таким образом, изобретение относится также к солям соединений формулы (I), когда R1 означает карбоксил. Когда соединения согласно изобретению находятся в форме солей за счет присоединения кислоты, то речь идет о фармацевтически или косметически приемлемых солях, получаемых путем присоединения неорганической или органической кислоты, в частности соляной, серной, уксусной, лимонной, фумаровой, янтарной (с образованием неполной соли), малеиновой и миндальной кислоты. Когда соединения согласно изобретению находятся в форме солей за счет присоединения основания, то речь идет предпочтительно о солях щелочного или щелочноземельного металла или же солях цинка или органического амина.
Согласно настоящему изобретению из линейных или разветвленных алкильных радикалов с 1-20 атомами углерода предпочтительно можно назвать метил, этил, изопропил, бутил, трет-бутил, гексил, октил, нонил, 2-этилгексил и додецил. Эти радикалы предпочтительно содержат 1-12 атомов углерода. Когда алкильный радикал является низшим, то он обычно содержит 1-6 атомов углерода. В качестве низшего алкильного радикала можно назвать метил, этил, пропил, изопропил, трет-бутил, гексил.
Из линейных алкильных радикалов с 1-20 атомами углерода особенно можно назвать метил, этил, пропил, 2-этилгексил, октил, додецил, гексадецил и октадецил.
Из разветвленных алкильных радикалов с 1-20 атомами углерода особенно можно назвать 2-метилбутил, 2-метилпентил, 1-метилгексил, 3-метилгептил.
Под алкенильным радикалом понимают линейный или разветвленный радикал с 2-20 атомами углерода, включающий одну или несколько двойных связей.
Из алкенильных радикалов предпочтительным является радикал с 2-5 атомами углерода, включающий одну или несколько ненасыщенных двойных связей, такой, как более предпочтительно аллил.
Под моногидроксиалкильным или полигидроксиалкильным радикалом нужно понимать радикал с 1-6 атомами углерода, содержащий 1-5 гидроксильных групп.
Из моногидроксиалкильных радикалов предпочтительным является радикал предпочтительно с 1 или 3 атомами углерода, особенно гидроксиметил, 2-гидроксиэтил, 2- или 3-гидроксипропил.
Из полигидроксиалкильных радикалов предпочтительным является радикал с 3-6 атомами углерода с 2-5 гидроксильными группами, такие, как 2,3-дигидроксипропил, 2,3,4-тригидроксибутил, 2,3,4,5-тетрагидроксипентил или остаток пентаэритрита.
Под гетероциклом предпочтительно понимают пиперидиновый, морфолиновый, пирролидиновый или пиперазиновый радикал, незамещенный или замещенный в положении 4 алкильным радикалом с 1- 6 атомами углерода или полигидроксиалкильным радикалом, такими, как указанные выше.
Под радикалом простого полиэфира понимают радикал, содержащий предпочтительно 2-6 атомов углерода, особенно метоксиметоксигруппу, метоксиэтоксигруппу, метоксиэтокси-метоксигруппу, метоксиметоксиэтил, метоксиметоксипропил и метоксигексилоксигруппу.
Из алкоксильных радикалов предпочтительным является алкоксильный радикал с 1-12 атомами углерода, такие, как особенно метоксигруппа, этоксигруппа, пропилоксигруппа, изопропилоксигруппа, гексилоксигруппа, гептилоксигруппа, октилоксигруппа и нонилоксигруппа.
Когда радикалы R2, R3, R6, R10, R11 означают атом галогена, то он предпочтительно представляет собой атом фтора, брома или хлора.
Из соединений
вышеприведенной формулы (I), входящих в рамки настоящего изобретения, особенно можно назвать следующие:
4-[4-(бифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)акрилоиламино]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)-(E)-тиоакрилоиламино]бензойная
кислота;
4-[3-(4'-метилбифенил-2-ил)акрилоилокси]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бута-1(E),3(Z)-диенил]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бута-1(E),
3(E)-диенил]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)пропиноилокси]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)-(E)/(Z)-бут-1-ен-3-инил]бензойные кислоты;
4-[4-(4'-метилбифенил-2-ил)бута-1,3-диинил]бензойная кислота;
4-[4-(3-фтор-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4,
4'-диметилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(5,4'-диметилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(6,
4'-диметилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(5-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(6-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)пент-3-ен-(E)-1-инил]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)пропиноиламино]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)пропинтиоиламино]бензойная
кислота;
4-[4-(3'-метилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(2'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-хлорбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(3'-хлорбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-фторбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная
кислота;
4-[4-(4'-пропилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-винилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(3'-метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(2-тиофен-3-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(2-тиофен-2-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3'-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3'-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3'-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-4-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-4-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-метил-4-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-5-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-5-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-метил-5-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-6-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-6-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-трифторметилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-гидроксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-{4-[4'-(2-гидроксиэтил)бифенил-2-ил]бут-3-ен-(E)-1-инил}бензойная кислота;
4-[4-(3'-метилбифенил-3-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(2-пиридин-4-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(2-пиридин-3-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3-метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(3-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3-метокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-этоксиметоксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
метиловый эфир
4-[4-(4'-этоксиметоксиэтилбифенил-2-ил)бут-3-ен-(E)-1- инил]бензойной кислоты;
2-метил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
2-гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
6-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]пиридин-3-карбоновая кислота;
5-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]пиридин-2-карбоновая кислота;
5-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] тиофен-3-карбоновая кислота;
3-метоксиметокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
3-гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
3-метокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] - бензойная кислота;
{4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенил}метанол;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензальдегид;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенол;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамид;
N-этил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамид;
{ 4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] фенил}-морфолин- 4-илметанон;
N-(4-гидроксифенил)-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1 -инил] бензамид;
5-[4-(4'-метилбифенил-2-ил)бута-1,3-диинил]тиофен-3-карбоновая кислота.
Согласно настоящему изобретению наиболее предпочтительными соединениями формулы (I) являются такие, в которых соблюдаются по крайней мере одно и предпочтительно все нижеуказанные условия: R1 означает радикал -CO-R5; Ar1 означает радикалы формул (a) и (b); X-Y означает связи формул (e), (f), (h); Ar2 означает радикал формулы (j). Предпочтительно соединения отвечают формуле (I), в которой R1 означает радикал -CO-OR13, где R13 означает атом водорода или линейный или разветвленный алкильный радикал с 1-20 атомами углерода, такой, как указанный выше.
Предметом настоящего изобретения также являются способы получения соединений формулы (I), в частности согласно представленным на фиг. 1 и 2 реакционным схемам.
Таким образом, соединения формулы I (a) могут быть получены (фиг. 1) путем реакции сочетания ацетиленовых производных (10) с галогенированными (предпочтительно иодированными) производными (4) в растворителе, таком, как диметилформамид, в присутствии трифенилфосфина (PPh3), иодида одно валентной меди (CuJ) и карбоната калия (K2CO3) (согласно K. Okuro, Tetrahedron Letters, 33, N37, 5363-5364 (1992)). Галогенированные производные (4) могут быть получены из альдегидов (3) либо путем реакции типа реакции Виттига с бромметилентрифенилфосфонийбромидом (D. R. Williams, Tetrahedron Letters, 22, N38, 3745-3748 (1981)), либо путем реакции с йодоформом в присутствии CrCl2 (K. Takai, J. Am. Chem. Soc., 108, 7408-7410 (1986)). Альдегидные производные (3) получают путем реакции сочетания типа реакции Сузуки производных бора (1) с галогенированными производными (2) в присутствии катализатора, такого, как Pd(PPh3)4 .
Таким образом, соединения формулы I (b) могут быть получены (фиг. 1) путем реакции Хорнер-Эммонса между альдегидными производными (6) и фосфонатными производными (11). Производные (6) могут быть получены путем восстановления нитрильных производных (5) с помощью диизобутилалюминийгидрида. Производные (5) получают путем реакции Хорнер-Эммонса между альдегидными производными (3) и диэтилцианометилфосфонатом в присутствии основания, такого, как гидроксид калия.
Таким образом, соединения формулы I(c) могут быть получены (фиг. 1) путем введения во взаимодействие, в безводной среде, в органическом растворителе, предпочтительно в тетрагидрофуране, и в присутствии третичного амина (например, триэтиламина или пиридина), активированной формы производного коричной кислоты (7), например, хлорангидрида кислоты, с производным анилина формулы (12). Производные коричной кислоты (7) могут быть получены путем реакции типа реакции Кновенагеля из альдегидных производных (3) путем введения их во взаимодействие с малоновой кислотой или диэтилмалонатом.
Таким образом, соединения формулы I(d) могут быть получены (фиг. 2) путем реакции сочетания диацетиленовых производных (15) с галогенированными (предпочтительно иодированными) производными (8) в растворителе, таком, как диметилформамид, в присутствии PPh3, CuJ и K2 CO3. Производные (15) получают путем реакции Корей-Фухса из альдегидов (14), которые в свою очередь получают из ацетиленовых производных (12) путем введения во взаимодействие ацетиленовых производных (12) с бутиллитием, затем путем реакции с диметилформамидом.
Таким образом, соединения формулы I(f) могут быть получены (фиг. 2) путем введения во взаимодействие в безводной среде, в органическом растворителе, предпочтительно в тетрагидрофуране, и в присутствии третичного амина (например, триэтиламина или пиридина) активированной формы фенилпропиоловой кислоты (13), например, хлорангидрида кислоты (3), с производным анилина формулы (12). Производные (13) могут быть получены путем литиирования ацетиленовых производных (12) с помощью бутиллития, затем путем реакции с диоксидом углерода.
Когда R1 означает радикал -COOH, то соединения получают:
- либо защищая R1 защитной группой алкильного, аллильного,
бензильного или трет-бутильного типа;
причем переход к свободной форме можно осуществлять следующим образом:
- в случае алкильной защитной группы, с помощью гидроксида натрия или
гидроксида лития в спиртовом растворителе, таком, как метанол, или в тетрагидрофуране;
- в случае аллильной защитной группы, с помощью катализатора, такого, как некоторые комплексы переходных
металлов, в присутствии вторичного амина, такого, как морфолин;
- в случае бензильной защитной группы, путем дебензилирования в присутствии водорода с помощью катализатора, такого, как:
палладий-на-угле;
- в случае защитной группы трет-бутильного типа, с помощью триметилсиланиодида;
- либо из соответствующего фенола путем превращения его в трифлатное производное,
затем карбонилирования в присутствии катализатора на основе палладия.
Когда R1 означает спиртовую функцию, соединения могут быть получены:
- из соответствующих
альдегидных производных путем обработки гидридом щелочного металла, таким, как боргидрид натрия, в спиртовом растворителе (например, в метаноле);
- из производных кислот путем восстановления
с помощью литийалюминийгидрида.
Когда R1 означает альдегидную функцию, соединения могут быть получены из спиртовых производных путем окисления в присутствии оксида марганца, пиридинийбихромата или реактива Сверна.
Когда R1 означает амидную функцию, соединения могут быть получены из соответствующих карбоксильных производных путем реакции с алифатическими, ароматическими, гетероциклическими аминами, либо через посредство хлорангидрида кислоты или в присутствии дициклогексилкарбодиимида или карбонилдиимидазола.
Таким образом полученные продукты общей формулы (I) могут служить исходными продуктами для получения других соединений формулы (I) согласно изобретению. Эти соединения получают классическими способами синтеза, используемыми в химии, такими, как способы, описанные в "Advanced Organic Chemistry" J. March; John Willey and Sons, 1985.
Например, можно осуществлять функциональные
модификации группы R1 как указывается ниже:
карбоновая кислота ---> сложный эфир;
сложный эфир ---> карбоновая кислота;
кислота --->
хлорангидрид кислоты;
хлорангидрид кислоты ---> амид;
кислота ---> амид;
кислота ---> спирт;
спирт ---> альдегид;
амид
---> амин.
Соединения согласно изобретению проявляют активность в тесте дифференцировки клеток (F9) зародышевой тератокарциномы мыши (Cancer Research, 43, 5268 (1983)) и/или в тесте ингибирования орнитиндекарбоксилазы после индуцирования с помощью терефталевой кислоты в случае мыши (Cancer Research, 38, 793-801 (1978)). Эти тесты показывают активности этих соединений, соответственно, в областях дифференцировки и пролиферации клеток. В тесте дифференцировки клеток (F9) можно оценить агонистическую активность как антагонистическую активность к рецепторам ретиноевой кислоты. В самом деле, антагонист является неактивным, когда он один в этом тесте, однако, частично или полностью ингибирует воздействие, оказываемое агонистом-ретиноидом на морфологию и на выделение плазминогенного активатора. Эти соединения, следовательно, также проявляют активность в тесте, который состоит в идентификации молекул-антагонистов RARs и который описывается в заявке на патент Франции N 95-07302, поданной 19 июня 1995 г. заявителем. Этот тест включает следующие стадии: (i) на участок кожи млекопитающего локально наносят достаточное количество молекулы-агониста RARs, (ii) системным или топическим путем этому же млекопитающему или на тот же самый участок кожи млекопитающего, до, во время или после стадии (i), вводят молекулу, которая может обладать антагонистической активностью RARs, и (iii) оценивают ответную реакцию на таким образом обработанном участке кожи млекопитающего. Таким образом, ответная реакция на топическое введение в ухо млекопитающего молекулы-агониста RARs, которая выражается в утолщении этого уха, может быть подавлена путем введения топическим или системным путем молекулы-антагониста RARs.
Предметом настоящего изобретения являются также соединения вышеуказанной формулы (I) в качестве лекарственного средства.
Соединения согласно изобретению особенно пригодны в следующих областях лечения:
1) для лечения дерматологических заболеваний, связанных с нарушением кератинизации, вызванным дифференцировкой и пролиферацией, в частности для лечения обыкновенных, юношеских, полиморфных и
розовых угрей, узелковых и шаровидных угрей, старческих угрей, вторичных угрей, таких, как солнечные угри, медикаментозные или профессиональные угри;
2) для лечения других типов нарушений
кератинизации, особенно таких, как ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонно-подошвенные кератодермии, лейкоплазии и лейкоплазиеподобные состояния, кожный или мукозный (ротовой) лишай;
3) для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительным и/или иммуноаллергическим компонентом, и особенно всех форм псориаза, который может
быть кожным, мукозным или ногтевым, и также псориатического артрита, или же кожной атопии, такой, как экзема, или респираторной атопии или же десневой гипертонии; соединения также могут быть
использованы в случае некоторых воспалительных заболеваний без нарушения кератинизации;
4) для лечения любых доброкачественных или злокачественных кожных или эпидермических пролифераций
вирусного или невирусного происхождения, таких, как обыкновенные простые бородавки, плоские бородавки или напоминающая бородавку дисплазия эпидермы, оральные или цветущие папилломатозы, и пролифераций,
которые могут быть вызваны ультрафиолетовыми излучениями, особенно в случае базальноклеточных и спино-клеточных эпителием;
5) для лечения других дерматологических нарушений, таких, как
пузырчатые дерматозы и коллагенозы;
6) для лечения некоторых офтальмологических нарушений, особенно корнеопатий;
7) для восстановления или борьбы против фотоиндуцируемого или
возрастного старения кожи, или для уменьшения пигментаций и актинических кератозов, или любых патологий, связанных с хронологическим или актиническим старением;
8) для предотвращения или
излечивания характерных признаков эпидермической и/или кожной атрофии, вызванной топическим или системными кортикостероидами, или любой другой формы кожной атрофии;
9) для предотвращения или
лечения нарушений рубцевания или для предупреждения или для заживления полос на коже при ее растяжении;
10) для борьбы против нарушений сальной функции, таких, как угревая гиперсеборея или
простая себорея;
11) для лечения или предупреждения карциноматозных или предкарциноматозных состояний, более предпочтительно промиелоцитарных лейкемий;
12) для лечения воспалительных
заболеваний, таких, как артрит;
13) для лечения любого заболевания вирусного происхождения на уровне кожи, такого, как саркома Калоши, или общего заболевания;
14) для предупреждения
или лечения алопеции;
15) для лечения дерматологических или общих заболеваний с иммунологическим компонентом;
16) для лечения заболеваний сердечно-сосудистой системы, таких, как
артериосклероз, гипертония, инсулиннезависимый диабет, так же как ожирение;
17) для лечения кожных нарушений вследствие длительного пребывания под воздействием ультрафиолетовых излучений.
В вышеуказанных терапевтических областях соединения согласно изобретению предпочтительно могут быть использованы в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D или их производными, с кортикостероидами, со средствами против свободных радикалов, с α- гидрокси- или α- кетокислотами или их производными, или еще с блокаторами ионных каналов. Под витаминами D или их производными понимают, например, производные витамина D2 или D3 и, в частности, 1,25-дигидроксивитамин D3. Под средствами против свободных радикалов понимают, например, α- токоферол, дисмутатпероксид, убихинол или некоторые агенты образования хелатного металлоорганического соединения. Под α- гидрокси- или α- кетокислотами или их производными понимают, например, молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую или аскорбиновую кислоту или их соли, амиды или эфиры. Наконец, под блокаторами ионных каналов понимают, например, миноксидил-(2,4-диамино-6-пиперидинопиримидин-3-оксид) и его производные.
Объектом настоящего изобретения также являются фармацевтические композиции, содержащие по крайней мере одно соединение вышеуказанной формулы (I), один из его оптических или геометрических изомеров или одну из его солей.
Следовательно, объектом настоящего изобретения является новая фармацевтическая композиция, предназначенная, в частности, для лечения вышеуказанных заболеваний и отличающаяся тем, что она содержит, в фармацевтически приемлемом носителе, совместимом с путем введения, предусмотренным для этой композиции, по крайней мере одно соединение формулы (I), один из его оптических или геометрических изомеров или одну из его солей в эффективном количестве. Соединения согласно изобретению можно вводить кишечно, парентерально, локально или окулярно.
Для введения кишечно, лекарственные средства могут находиться в форме таблеток, желатиновых капсул с лекарством, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, микросфер или наносфер или липидных или полимерных везикул, позволяющих осуществлять контролируемое высвобождение. Для введения парентерально, композиции могут находиться в форме растворов или суспензий для перфузии или для инъекции.
Соединения согласно изобретению обычно вводят в суточной дозе примерно от 0,01 мг/кг до 100 мг/кг массы тела, и это за 1-3 приема.
При топическом введении, фармацевтические композиции на основе соединений согласно изобретению предназначены, в частности, для лечения кожи и слизистых оболочек и тогда они могут находиться в форме мазей, кремов, молочка, помад, пудр, впитывающих тампонов, растворов, гелей, спреев, лосьонов или суспензий. Они могут также находиться в виде микросфер или наносфер или липидных или полимерных везикул или полимерных пластырей и гидрогелей, позволяющих осуществлять контролируемое высвобождение. Эти композиции для локального применения, сверх того, могут находиться либо в безводной форме, либо в водной форме, в зависимости от клинического показания.
Для введения окулярно, композиции согласно изобретению представляют собой главным образом глазные капли.
Эти композиции для локального или окулярного использования содержат по крайней мере одно соединение вышеприведенной формулы (I) или один из его оптических или геометрических изомеров или еще одну из его солей, предпочтительно в концентрации 0, 001-5 мас.%, в расчете на всю массу композиции.
Соединения формулы (I) согласно изобретению также находят применение в области косметики, в особенности для гигиены тела и для ухода за волосами и особенно для обработки кож с тенденциями к угревой сыпи, для ускорения роста волос, для предотвращения выпадения волос, для борьбы против жирного вида кожи или волос, для защиты от пагубных воздействий солнца или для обработки физиологически сухих кож, для предупреждения и/или для борьбы с фотоиндуцируемым или возрастным старением кожи.
В области косметики, соединения согласно изобретению, помимо этого, предпочтительно могут быть использованы в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D или их производными, с кортикостероидами, со средствами против свободных радикалов, α- гидрокси- или, α- кетокислотами или их производными, или же с блокаторами ионных каналов, причем все эти различные продукты представляют собой продукты, указанные выше.
Следовательно, настоящее изобретение относится также к косметической композиции, отличающейся тем, что она содержит, в косметически приемлемом и пригодном для топического применения носителе, по крайней мере одно соединение вышеприведенной формулы (I) или один из его оптических или геометрических изомеров или одну из его солей в эффективном количестве, причем эта косметическая композиция может в частности находиться в форме крема, молочка, лосьона, геля, микросфер или наносфер или липидных или полимерных везикул, мыла или шампуня.
Концентрация соединения формулы (I) в косметических композициях согласно изобретению предпочтительно составляет 0,001-3 мас.%, в расчете на всю совокупность композиции.
Лекарственные и косметические композиции согласно изобретению, кроме того, могут содержать инертные или фармакодинамически или косметически активные добавки или сочетания этих добавок, и в частности, следующие: смачиватели; депигментирующие агенты, такие, как гидрохинон, азелаиновая кислота, кофейная кислота или койевая кислота; смягчители; увлажняющие компоненты, как глицерин, полиэтиленгликоль с молекулярной массой 400, тиаморфолинон и его производные, или еще мочевина; противосеборейные или противоугревые добавки, такие, как S-карбоксиметилцистеин, S-бензилцистеамин, их соли и их производные, или бензоилпероксид; антибиотики, как эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины; противогрибковые агенты, такие, как кетоконазол или 4,5-полиметилен-3-изотиазолидоны; благоприятствующие росту волос агенты, как миноксидил (2,4-диамино-6-пиперидинопиримидин-3-оксид) и его производные, диазоксид (7-хлор-3-метил-1,2,4-бензотиалиазин-1,1-диоксид) и фенитоин (5,4-ди-фенилимидазолидин-2,4-дион); противовоспалительные средства нестероидного типа; каротиноиды и особенно β- каротин; анти-псориатические агенты, такие, как антралин и его производные; и, наконец, эйкоза-5,8,11,14-тетранойевая кислота и эйкоза-5,8,11- тринойевая кислота, их эфиры и амиды.
Композиции согласно изобретению также могут содержать улучшающие вкус вещества, консерванты, такие, как эфиры п-гидроксибензойной кислоты, стабилизаторы, регуляторы влажности, регуляторы pH-значения, модификаторы осмотического давления, эмульгаторы, УФ-А- и УФ-Б-фильтры, антиоксиданты, такие, как α- токоферол, бутилгидроксианизол или бутилгидрокситолуол.
Ниже приводятся, в качестве иллюстрации и без ограничения ими объема охраны изобретения, несколько примеров получения активных соединений формулы (I) согласно изобретению, а также различных конкретных композиций на основе таких соединений.
А. Примеры соединений
Пример 1: 4-(4-бифенил-2-ил-бут-3-ен-(E)-1-инил)бензойная кислота
(а) Этиловый эфир 4-триметилсиланилэтинилбензойной
кислоты
В трехгорлую колбу в токе азота вводят 21,50 г (100,0 ммоль) метилового эфира 4-бромбензойной кислоты, 300 мл триэтиламина и смесь из 200 мг ацетата палладия с 400 мг трифенилфосфина.
Затем добавляют 20,00 г (204 ммоль) триметилсилилацетилена, нагревают постепенно до 90oC в течение одного часа и выдерживают при этой температуре в течение пяти часов. Реакционную среду
охлаждают, соль отфильтровывают и фильтрат выпаривают. Остаток обрабатывают с помощью 200 мл 5%-ной соляной кислоты и 400 мл диэтилового эфира. Эфирную фазу декантируют, промывают водой, сушат над
сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. После выпаривания растворителей получают 23,00 г (100%) целевого
соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.л.: 0,36 (с, 9H); 1,20 (т, 3H, J= 7,1 Гц); 4,19 (к, 2H, J=7,1 Гц); 7,60 (дд, 2H, J=6,8/1,5 Гц); 8,06 (дд, 2H, J=6,6/1,6 Гц).
(б) Метиловый эфир 4-этинилбензойной кислоты
В колбу вводят 45,90 г (197 ммоль) этилового эфира 4-триметилсилилэтинилбензойной кислоты, 300
мл метанола и добавляют 500 мг карбоната калия. Перемешивают при комнатной температуре в течение двенадцати часов и реакционную среду выпаривают досуха. Полученный остаток очищают путем хроматографии
на колонке с диоксидом кремния, элюируя дихлорметаном. После выпаривания растворителя получают 32,00 г (100%) целевого соединения в виде твердого вещества светло-желтого цвета с т. пл. 86-88oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,23 (с, 1H); 3,92 (с, 3H); 7,55 (д, 2H, J=8,3 Гц); 7,99 (д, 2H, J=8,2 Гц).
(в)
Бифенил-2-карбоксальдегид
В трехгорлую колбу в токе азота вводят 11,43 г (49 ммоль) 2-бромбифенила и 50 мл тетрагидрофурана. При температуре -78oC прикапывают 21,6 мл (54 ммоль) 2,
5М раствора н-бутиллития в гексане и перемешивают в течение часа при той же самой температуре. После этого прикапывают 4,17 мл (53,9 ммоль) диметилформамида и оставляют температуру повышаться до
комнатной. Реакционную среду подкисляют с помощью 1н. соляной кислоты, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают
путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 60% гексана и 40% дихлорметана. Получают 6,50 г (73%) целевого соединения в виде масла желтого цвета.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 7,36-7,67 (м, 7H); 7,62 (дд, 1H, J=7,5/1,4 Гц); 8,03 (дд, 1H, J=7,7/1,2 Гц).
(г) 2-((Z)/(E)-2-Иодвинил)бифенил
В трехгорлую
колбу, и в токе аргона, вводят 11,90 г (97 ммоль) хлорида хрома (II) и 195 мл безводного тетрагидрофурана. Охлаждают до температуры 0oC и поддерживая эту температуру прикапывают раствор из
3,54 г (19,4 ммоль) бифенил-2-карбоксальдегида, 15,30 г (38,8 ммоль) йодоформа в 97 мл безводного тетрагидрофурана. Перемешивают в течение трех часов при температуре 0oC, реакционную среду
выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния,
элюируя гептаном. Получают 4,70 г (79%) целевого соединения в виде слегка желтоватого масла в форме смеси из 70% (E)-изомера и 30% (Z)-изомера (определяют путем ЯМР).
1 H-ЯМР-спектр (дейтерохлороформ) [(E)-изомер], δ в м.д.: 6,74 (д, 1H, J= 14,8 Гц); 7,25-7,49 (м, 10H).
(д) Метиловый эфир 4-(4-бифенил-2-ил-бут-3-ен-(E)-1-инил)бензойной
кислоты
В колбу вводят последовательно 4,22 г (13,8 ммоль) 2-(2-иодвинил)бифенила, 2,21 г (13,8 ммоль) метилового эфира 4-этилбензойной кислоты, 131 мг CuJ, 362 мг (1,38 ммоль)
трифенилфосфина, 2,86 г (20,7 ммоль) карбоната калия и 30 мл диметилформамида. В течение 12 часов нагревают при температуре 120oC, охлаждают, реакционную среду выливают в воду, экстрагируют
этилацетатом, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 70% гептана и 30%
дихлорметана. После выпаривания растворителей получают 2,25 г (48%) целевого соединения в виде порошка белого цвета с т. пл. 97- 100oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,35 (д, 1H, J=16,2 Гц); 7,09 (д, 1H, J=16,2 Гц); 7,30- 7,49 (м, 10H); 7,63-7,68 (м, 1H); 7,97 (дд, 2H, J=6,7/1,7 Гц).
(е)
4-(4-Бифенил-2-ил-бут-3-ен-(E)-1-инил)бензойная кислота
В колбу вводят 1,99 г (5,9 ммоль) полученного в примере 1 (д) сложного эфира, 40 мл метанола и 40 мл тетрагидрофурана. Добавляют 11,8
мл (59 ммоль) 5н. раствора гидроксида натрия в метаноле и кипятят с обратным холодильником в течение одного часа. Выпаривают досуха, остаток обрабатывают смесью диэтилового эфира с 4н. соляной
кислотой, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток порошкуют в смеси из 20% диэтилового эфира и 80% гептана, отфильтровывают, высушивают. Получают 1,
70 г (90%) 4-(4-бифенил-2-ил-бут-3-ен-(E)- 1-инил)бензойной кислоты в виде порошка белого цвета с т. пл. 228- 229oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 6,36(д, 1H, J=16,2 Гц); 7,07(д, 1H, J=16,2 Гц); 7,29-7,48 (м, 10H); 7,65-7,68 (м, 1H); 7,98(д, 2H, J=8,4 Гц).
Пример 2: 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная
кислота
(а) 4-Метилфенилборная кислота
В трехгорлую колбу в токе азота вводят 17,1 г (0,1 моль) 4-бромтолуола и 70 мл тетрагидрофурана. При температуре -78oC прикапывают
48 мл (120 ммоль) 2,5М раствора н-бутиллития в гексане и перемешивают в течение часа при той же самой температуре. После этого прикапывают 34,6 мл (150 ммоль) триизопропилбората, оставляют температуру
повышаться до комнатной и перемешивают в течение 16 часов. Медленно добавляют 450 мл 1н., соляной кислоты и перемешивают в течение часа при комнатной температуре. Реакционную среду экстрагируют
дихлорметаном, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Получают 11,10 г (61%) целевого соединения в виде размельченного твердого вещества белого цвета с т. пл.
250-252oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 7,29(д, 2H, J= 7,6 Гц); 8,10(д, 2H, J-7,9 Гц).
(б)
2-Бром-4'-метилбифенил
В трехгорлую колбу вводят 5,34 г (39,3 ммоль) 4-метил-фенилборной кислоты, 10,0 г (35,3 ммоль) 1-бром-2-иод-бензола, 100 мл толуола и 42 мл 2М водного раствора
карбоната калия. Реакционную среду дегазируют путем барботирования аргона и добавляют 1,23 г (1,06 ммоль) тетракистрифенилфосфинпалладия-(O) и нагревают при температуре 90oC в течение 20
часов. Реакционную среду выливают в воду, экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с
диоксидом кремния, элюируя гексаном. После выпаривания растворителей получают 6,23 г (71%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,40 (с, 3H); 7,13-7,36(м, 7H); 7,64(д, 1H, J=7,9 Гц).
(в) 4'-Метилбифенил-2-карбоксальдегид
Аналогично методике примера 1(в), исходя из 5,90 г (23,9 ммоль)
4'-метил-2-бромбифенила, получают 3,92 г (84%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 7,28(с, 4H); 7, 42-7,50(м, 2H); 7,61(дд, 1H, J=7,5/1,4 Гц); 8,02(дд, 1H, J=7,6/1,2 Гц); 9,99(с, 1H).
(г) 2-((E)-2-Иодвинил)-4'-метилбифенил
Аналогично методике примера 1(г), исходя из 3,92 г
(20,0 ммоль) 4'-метилбифенил-2-карбоксальдегида, получают 4,98 г (78%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 6,73(д, 1H, J= 14,8 Гц); 7,22-7,74(м, 10H).
(д) Метиловый эфир 4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил]бензойной кислоты
Аналогично методике примера 1 (д), путем
взаимодействия 4,12 г (12,9 ммоль) 2-(2-иодвинил)-4'-метилбифенила с 2,06 г (12,9 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 1,67 г (37%) целевого соединения в виде твердого вещества
белого цвета с т. пл. 117-118oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,91(с, 3H); 6,34(д, 1H, J= 16,2 Гц); 7,11(д, 1H, J=16,2 Гц); 7, 26-7,37(м, 7H); 7,47(д, 2H, J=8,4 Гц); 7,63-7,66(м, 1H); 7,97 (д, 2H, J=8,4 Гц).
(e) 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике
примера 1(е), исходя из 1,46 г (4,14 ммоль) полученного в примере 2 (д) сложного метилового эфира, получают 1,31 г (93%) 4-[4-(4'-метилбифенил-2-ил)-бут-3-ен-(E)-1-инил] бензойной кислоты в виде
твердого вещества белого цвета с т. пл. 241-242oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,36(с, 3H); 6,29(д, 1H, J= 16,2 Гц); 7,02(д, 1H, J=16,2 Гц); 7,15-7,31 (м, 7H); 7,39 (д, 2H, J=8,4 Гц); 7,57-7,61 (м, 1H); 7,91(д, 2H, J=8,4 Гц).
Пример 3: 4-[3-(4'-Метилбифенил-2-ил)акрилоиламино]бензойная кислота
(а) Этиловый эфир
3-(4'-метилбифенил-2-ил)-(E)-акриловой кислоты
В трехгорлую колбу в токе азота вводят 20,75 г (92,0 ммоль) этилового эфира диэтилфосфоноуксусной кислоты и 40 мл тетрагидрофурана. Охлаждают до
температуры 0oC, добавляют маленькими порциями 3,45 г (115,0 ммоль) 80%-ного гидрида натрия и реакционную среду перемешивают в течение 15 минут при температуре 0oC. Прикапывают
раствор 15,00 г (76,4 ммоль) полученного в примере 2 (в) альдегида в 40 мл тетрагидрофурана. Реакционную среду перемешивают в течение 10 минут при комнатной температуре, подкисляют до pH 1 с помощью
2н. соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный
остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 50% этилацетата и 50% гептана. После выпаривания растворителей получают 19,40 г (95%) целевого соединения в виде
желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 1,29(т, 3H, J=7,1 Гц); 2,41(с, 3H); 4,21(к, 2H, J-7,2 Гц); 6,39(д, 1H, J=15,9 Гц); 7,18-7,26(м, 4H); 7, 32-7,45(м, 3H); 7,67- 7,71(м, 1H); 7,75(д, 1H, J=16,0 Гц).
(б) 3-(4'-Метилбифенил-2-ил)-(E)-акриловая кислота
В трехгорлую колбу в токе азота вводят 19,00 г (71,0 ммоль)
полученного в примере 3(а) сложного эфира, 70 мл 10н. водного раствора гидроксида натрия и 150 мл тетрагидрофурана. Реакционную среду нагревают в течение четырех часов при температуре 67oC,
охлаждают, подкисляют до pH 1 с помощью 2н. соляной кислоты и экстрагируют этилацетатом. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и
растворители выпаривают. Получают 16,92 г (99%) целевого соединения в виде "пушистого" кристаллического твердого вещества белого цвета с т. пл. 214-216oC.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41 (с, 3H); 6,38(д, 1H, J= 16,0 Гц); 7,18-7,26(м, 4H); 7,32- 7,45(м, 3H); 7,68-7,71(м, 1H); 7,70(д, 1H, J=15,9 Гц).
(в) Метиловый
эфир 4-[3-(4'-метилбифенил-2-ил)-(E)-акрилоиламино] бензойной кислоты
В трехгорлую колбу в токе азота вводят 17,50 г (73,4 ммоль) полученной в примере 3(б) кислоты и 350 мл дихлорметана.
Прикапывают 14,9 мл (74,9 ммоль) дициклогексиламина и полученный раствор перемешивают в течение часа при комнатной температуре. Реакционную среду выпаривают досуха, полученные кристаллы порошкуют в
диэтиловом эфире, отфильтровывают и высушивают в сушильном шкафу. Получают 29,67 г (96%) порошка белого цвета.
20,00 г (47,6 ммоль) Этой соли растворяют в 400 мл дихлорметана. Прикапывают 3,8 мл (52,0 ммоль) тионилхлорида и полученный раствор перемешивают в течение часа при комнатной температуре. Реакционную среду отфильтровывают и фильтрат выпаривают досуха. Полученный остаток растворяют в 200 мл тетрагидрофурана и таким образом полученный раствор прикапывают к раствору из 7,20 г (47,6 ммоль) метилового эфира 4-аминобензойной кислоты и 7,24 мл (52,0 ммоль) триэтиламина в 150 мл тетрагидрофурана. Реакционную среду перемешивают в течение часа и 15 минут при комнатной температуре, подкисляют до pH 1 с помощью 2н. соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 30% этилацетата и 70% гептана. После выпаривания растворителей получают 6,00 г (33%) целевого соединения в виде твердого вещества розового цвета с т. пл. 207oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,38 (с, 3H); 3,88 (с, 3H); 6,70(д, 1H, J=15,5 Гц); 7,18-7,25(м, 4H); 7,31-7,44 (м, 3H); 7,68(д, 1H, J= 8,0 Гц); 7,78(д, 2H, J=8,8 Гц); 7,80(д, 1H, J=15,7 Гц); 7,97(д, 2H, J=8,8 Гц); 9,48(с, 1H).
(г) 4-[3-(4'-Метилбифенил-2-ил)-(E)-акрилоиламино]бензойная кислота
В колбу объемом 250 мл и
в токе азота вводят 2,10 г (5,6 ммоль) полученного в примере 3(г) соединения и 100 мл тетрагидрофурана. Быстро приливают 5,6 мл (56,0 ммоль) 10н. водного раствора гидроксида натрия и реакционную среду
в течение 6 часов кипятят с обратным холодильником, затем в течение 16 часов выдерживают при комнатной температуре. Реакционную среду охлаждают, подкисляют до значения pH 1 с помощью 2н. соляной
кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Получают 1,82 г (90%)
4-[3-(4'-метилбифенил-2-ил)-(E)- акрилоиламино] бензойной кислоты в виде кристаллического порошка белого цвета с т. пл. 265oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,39(с, 3H); 6,78(д, 1H, J= 15,6 Гц); 7,18-7,25(м, 4H); 7,32-7,44(м, 3H); 7,70(д, 1H, J-15,7 Гц); 7,70-7,74(м, 1H); 7,77(д, 2H, J=8,7 Гц); 7,93(д, 2H, J=8,7 Гц); 10,14 (с, 1H).
Пример 4: 4-[3-(4'-Метилбифенил-2-ил)-(E)-тиоакрилоил-амино] бензойная кислота
(а) Метиловый эфир 4-[3-(4'-метилбифенил-2-ил)-(E)-тиоакрилоиламино] бензойной кислоты
В
колбу объемом 250 мл в токе азота вводят 2,50 г (6,7 ммоль) полученного в примере 3(г) соединения, 1,36 г (3,36 ммоль) реактива Лавессона и 60 мл толуола. Реакционную среду кипятят с обратным
холодильником в течение одного часа, охлаждают и выпаривают досуха. Полученный остаток порошкуют в смеси из 50% дихлорметана и 50% гептана, отфильтровывают и высушивают. Получают 1,92 г (73%) целевого
соединения в виде порошка ярко-оранжевого цвета с т. пл. 183oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 3,91(с, 3H); 7,17-7,26(м, 5H); 7, 37-7,49(м, 3H); 7,71(д, 1H, J=7,2 Гц); 7,95-8,04 (м, 6H); 11,28 (с, 1H).
(б) 4-[3-(4'-Метилбифенил-2-ил)-(E)-тиоакрилоиламино]бензоиная кислота
Аналогично методике примера
1(е), исходя из 1,50 г (3,9 ммоль) полученного в примере 4 (а) соединения, получают 1,25 г (86%) 4-[3-(4'-метилбифенил-2-ил)-тиоакрилоиламино] -(E)бензойной кислоты в виде порошка оранжевого цвета с
т. пл. 220oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,39(с, 3H); 7,23-7,33(м, 4H); 7,39-7,42(м, 2H); 7,48-7,51(м, 2H); 7,80-7,83 (м, 1H); 7,88(д, 1H, J= 15,1 Гц); 8,00(д, 2H, J=8,5 Гц); 8,12(м, 2H); 11,91(с, 1H); 12,99(с, 1H).
Пример 5: 4-[3-(4'-Метилбифенил-2-ил)акрилоилокси]-бензойная кислота
(а) Аллиловый
эфир 4-[3-(4'-метилбифенил-2-ил)-(E)-акрилоилокси] бензойной кислоты
В колбу объемом 1 литр в токе азота вводят 9,30 г (22,0 ммоль) полученной в первой части примера 3(в) соли
дициклогексиламина и 100 мл дихлорметана. Прикапывают 1,77 мл (24,0 ммоль) тионилхлорида и полученный раствор перемешивают в течение полутора часов при комнатной температуре. Реакционную среду
отфильтровывают и фильтрат выпаривают досуха. Остаток растворяют в 200 мл тетрагидрофурана и таким образом полученный раствор прикапывают к раствору из 7,20 г (47,6 ммоль) аллилового эфира
4-гидроксибензойной кислоты и 3,34 мл (24,0 ммоль) триэтиламина в 130 мл тетрагидрофурана. Реакционную среду перемешивают в течение 24-х часов при комнатной температуре, подкисляют до pH 1 с помощью
2н. соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный
остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 15% этилацетата и 85% гептана. После выпаривания растворителей получают 4,95 г (55%) целевого соединения в виде
порошка белого цвета с т. пл. 68oC.
1H-ЯМР-спектр(дейтерохлороформ), δ в м.д.: 2,41 (с, 3H); 4,81-4,84 (м, 2H); 5,29(дд, 1H, J-10,4/1,3 Гц); 5,41(дд, 1H, J=17,2/1,5 Гц); 5,96-6,12 (м, 1H); 6,59(д, 1H, J=15,9 Гц); 7,21- 7,28(м, 6H); 7,39-7,51(м, 3H); 7,77(д, 1H, J=7,2 Гц); 7,95(д, 1H, J=15,9 Гц); 8,10(д, 2H, J=8,7 Гц).
(б)
4-[3-(4'-Метилбифенил-2-ил)-(E)-акрилоилокси]бензойная кислота
В трехгорлую колбу, и в токе азота вводят 843 мг (5,25 ммоль) диэтилмалоната, 10 мл тетрагидрофурана и добавляют маленькими
порциями 170 мг (5,65 ммоль) 80%-ного гидрида натрия. Реакционную смесь перемешивают при комнатной температуре в течение 20 минут, затем переносят в капельную воронку. Этот раствор медленно добавляют
к смеси из 2,00 г (5,0 ммоль) полученного в примере 3(а) соединения, 290 мг тетракистрифенилфосфинопалладия-(O) и 75 мл тетрагидрофурана. Реакционную среду перемешивают в течение 20 минут при
комнатной температуре, подкисляют до pH 1 с помощью 2н. соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния,
отфильтровывают и растворители выпаривают. После порошкования в минимальном количестве этилацетата получают 1,50 г (83%) 4-[3-(4'-метилбифенил-2-ил)- (E)-акрилоилокси]-бензойной кислоты в виде чешуек
светло-бежевого цвета с т. пл. 234-236oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37(с, 3H); 6,90(д, 1H, J=15,9 Гц); 7,23-7,33(м, 6H); 7, 39- 7,59(м, 3H); 7,77(д, 1H, J= 15,9 Гц); 7,99-8,07(м, 3H); 13,09(с, 1H).
Пример 6: 4-[4-(4'-Метилбифенил-2-ил)бута-1(E), 3(Z)-диенил] бензойная кислота
(a)
(Z)/(E)-3-(4'-Метилбифенил-2-ил)акрилонитрил
В колбу объемом 250 мл в токе азота вводят 5,40 г (30,5 ммоль) диэтилцианометиолфосфоната и 20 мл тетрагидрофурана. Полученный раствор охлаждают
до температуры 0oC, затем добавляют маленькими порциями 1,15 г (38,0 ммоль) 80%-ного гидрида натрия. Реакционную среду перемешивают в течение 10 минут при температуре 0oC, затем
прикапывают раствор из 5,00 г (25,0 ммоль) полученного в примере 2 (в) альдегида в 20 мл тетрагидрофурана. Реакционную среду перемешивают в течение 15 минут при комнатной температуре, подкисляют до pH
1 с помощью 2н., соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают.
Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 2% этилацетата и 98% гептана. После выпаривания растворителей получают 1,40 г (25%) (Z)-изомера в виде
кристаллов слегка желтого цвета с т. пл. 80-82oC, а также 2,87 г (52%) (E)-изомера в виде кристаллов белого цвета с т. пл. 95-97oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д. [(E)-изомер]: 2,43 (с, 3H); 5,83(д, 1H, J= 16,7 Гц); 7,16(д, 2H, J=8,1 Гц); 7,27(д, 2H, J=7,1 Гц); 7,35-7,50(м, 4H); 7,59(д, 1H, J=7,6 Гц).
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д. [(Z)-изомер]: 2,41 (с, 3H); 5,41(д, 1H, J= 12,0 Гц); 7,12(д, 1H, J=12,1 Гц); 7,07-7,26(м, 4H); 7,37-7,52(м, 3H); 8,14(д, 1H, J-6,7 Гц).
(б) 3-(4'-Метилбифенил-2-ил)пропен-(E)/(Z)-аль
В трехгорлую колбу объемом 100 мл в токе азота вводят 1,35 г (6,1 ммоль) полученного в примере 6 (a) (Z)-изомера и 15 мл толуола.
Полученный раствор охлаждают до температуры -78oC и прикапывают 8,0 мл (8,0 ммоль) 1М раствора диизобутилалюминийгидрида в толуоле. Реакционную среду перемешивают в течение часа при
температуре -78oC, гидролизуют с помощью насыщенного раствора виннокислого натрий-калия и отфильтровывают. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом
магния, отфильтровывают и растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 5% этилацетата и 95% гептана. После выпаривания
растворителей получают 1,00 г (74%) целевого соединения, содержащего 16% (E)-изомера.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д. [(Z)-изомер]: 2,41(с, 3H); 6,15(дд, 1H, J= 11,5/8,2 Гц); 7,20-7,26(м, 4H); 7,36-7,60(м, 5H); 10,05(д, 1H, J=8,2 Гц).
(в) Этиловый эфир 4-[4-(4'-метилбифенил-2-ил)бута-1(E),3(Z)- диенил]бензоиной кислоты
В
трехгорлую колбу объемом 100 мл в токе азота вводят 2,01 г (6,7 ммоль) этилового эфира 4-(диэтилфосфонометил)бензойной кислоты и 10 мл тетрагидрофурана. Добавляют маленькими порциями 270 мг (9,0
ммоль) 80%-ного гидрида натрия и реакционную среду перемешивают в течение 10 минут при комнатной температуре. Прикапывают раствор из 1,00 г (4,5 ммоль) полученного в примере 6(б) альдегида в 15 мл
тетрагидрофурана. Реакционную среду перемешивают в течение 20 минут при комнатной температуре, добавляют, 4 мл N,N'-диметилпропилмочевины (DMPU) и продолжают перемешивание в течение дополнительных 15
минут. Реакционную среду подкисляют до pH 1 с помощью 2н., соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния,
отфильтровывают и растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 1% этилацетата и 99% гептана. После выпаривания
растворителей получают 440 мг (26%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,39(т, 3H, J=7,1 Гц); 2,39 (с, 3H); 4,37 (к, 2H, J=7,1 Гц); 6,34- 6,46(м, 2H); 6,70(д, 1H, J=15,6 Гц); 7,20(д, 2H, J=8,0 Гц); 7,29(д, 2H, J=8,1 Гц); 7,35- 7,51(м, 7H); 7,98(д, 2H, J=8,4 Гц).
(г)
4-[4-(4'-Метилбифенил-2-ил)бута-1(E),3(Z)-диeнил]бeнзойная кислота
Аналогично методике примера 1 (е), исходя из 440 мг (1,2 ммоль) полученного в примере 6 (в) соединения, получают 370 мг
(90%) 4-[4-(4'-метилбифенил-2-ил)бута-1(E),3(Z)-диенил]бензойной кислоты в виде порошка светло-желтого цвета с т. пл. 180-182oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,32 (с, 3H); 6,33-6,49 (м, 2H); 6,85(д, 1H, J=15,6 Гц); 7,20-7,27 (м, 4H); 7,32-7,49(м, 5H); 7,53(д, 2H, J=8,3 Гц); 7,89(д, 2H, J=8,3 Гц).
Пример 7: 4-[4-(4'-Метилбифенил-2-ил)бута-1(E), 3(E)- диенил]бензойная кислота
(а) (E)-3-(4'-Метилбифенил-2-ил)пропеналь
Аналогично методике примера 6(б), исходя из 800 мг
(3,65 ммоль) полученного в примере 6 (а) (E)-изомера, получают 420 мг целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,44 (с, 3H); 6,69(дд, 1H, J=15,9/7,8 Гц); 7,20-7,29(м, 4H); 7,37- 7,52(м, 3H); 7,56(д, 1H, J=15,9 Гц); 7,73(д, 1H, J=7,8 Гц); 9,55(д, 1H, J=7,8 Гц).
(б) Этиловый эфир
4-[4-(4'-метилбифенил-2-ил)бута-1(E),3(E)-диенил] бензойной кислоты
Аналогично методике примера 6(в), путем взаимодействия 700 мг (3,15 ммоль) полученного в примере 7 (а) (E)-изомера и 1,32 г
(4,4 ммоль) этилового эфира 4-(диэтилфосфонометил) бензойной кислоты, получают 860 мг (74%) целевого соединения в виде порошка желтого цвета с т. пл. 136oC.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,39(т, 3H, J=7,1 Гц); 2, 44 (с, 3H); 4, 37 (к, 2H, J=7,1 Гц); 6, 62-6, 79 (м, 2H); 6,87-6,97(м, 2H); 7,26-7,35(м, 7H); 7,43(д, 2H, J-8,3 Гц); 7,71(д, 1H, J=6,0 Гц); 7,97(д, 2H, J=8,3 Гц).
(в) 4-[4-(4'-Метилбифенил-2-ил)бута-1(E),3(E)-диенил]бензойная кислота
Аналогично методике примера 1(е), исходя из 860 мг (2,3 ммоль)
полученного в примере 7(б) соединения, получают 500 мг (64%) 4-[4- (4'-метилбифенил-2-ил)бута-1(E), 3(E)-диенил]бензойной кислоты в виде порошка желтого цвета с т. пл. 244-246oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37(с, 3H); 6,69-6,80(м, 2H); 7,04-7,41(м, 9H); 7,59(д, 2H, J=8,4 Гц); 7,80(д, 1H, J=6,9 Гц); 7,86(д, 2H, J=8,3 Гц).
Пример 8: 4-[3-(4'-Метилбифенил-2-ил)пропиноилокси]бензойная кислота
(a) 2-(2,2-Дибромвинил)-4'-метилбифенил
В трехгорлую колбу объемом 100 мл в токе азота
вводят 5,35 г (20,4 ммоль) трифенилфосфина, 3,38 г (10,2 ммоль) тетрабромида углерода и 30 мл дихлорметана. Раствор перемешивают в течение пяти минут при комнатной температуре, затем прикапывают
раствор из 1,00 г (5,1 ммоль) полученного в примере 2 (в) альдегида в 10 мл дихлорметана. Реакционную среду перемешивают в течение двух часов при комнатной температуре, добавляют разбавленный раствор
карбоната калия, чтобы довести pH-значение до 9-10, и экстрагируют дихлорметаном. Органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и
растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 3% этилацетата и 97% гептана. После выпаривания растворителей получают 1,60 г
(88%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41 (с, 3H); 7,21-7,23(м, 5H); 7,31-7,43(м, 3H); 7,65-7,69(м, 1H).
(б) 2-Этинил-4'-метилбифенил
В трехгорлую колбу объемом 500 мл в токе азота вводят 20,00 г (56,8 ммоль) полученного в примере 8 (а) соединения и 150 мл тетрагидрофурана.
Полученный раствор охлаждают до -78oC и прикапывают 48 мл (119,0 ммоль) 2,5н. раствора н-бутиллития в гексане, поддерживая температуру ниже -68oC. Реакционную среду перемешивают
в течение 15 минут при температуре -78oC, затем быстро добавляют 2н. соляную кислоту для доведения значения pH до 1. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают
водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя
гептаном. После выпаривания растворителя получают 9,05 г (81%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,39(с, 3H); 3,03(с, 1H); 7,20-7,29(м, 3H); 7,31-7,41(м, 2H); 7,48(д, 2H, J=8,1 Гц); 7,60(д, 1H, J=7,5 Гц).
(в) Метиловый эфир (4'-метилбифенил-2-ил)пропионовой кислоты
В трехгорлую колбу
объемом 250 мл и в токе азота вводят 5,00 г (25,5 ммоль) соединения, полученного в примере 8(б), и 60 мл тетрагидрофурана. Полученный раствор охлаждают до -78oC и прикапывают 11,2 мл (29,3
ммоль) 2,5н. раствора н-бутиллития в гексане, поддерживая температуру ниже -70oC. Реакционную среду перемешивают в течение 15 минут при температуре -78oC, затем прикапывают
раствор из 2,26 мл (29,3 ммоль) метилхлорформиата в 10 мл тетрагидрофурана. Перемешивают в течение полутора часов при температуре -78oC и быстро добавляют 2н. соляную кислоту для доведения
значения pH до 1. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают.
Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя гептаном. После выпаривания растворителя получают 5,97 г (93%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41 (с, 3H); 3,77(с, 3H); 7,25-7,36(м, 3H); 7,41-7,53(м, 4H); 7,68(дд, 1H, J=7,7/1,0 Гц).
(г)
(4'-Метилбифенил-2-ил)пропионовая кислота
В колбу объемом 250 мл вводят 5,83 г (23,3 ммоль) полученного в примере 8(в) соединения, 10 мл тетрагидрофурана, 5 мл метанола и 11,6 мл (116,5
ммоль) 10н. водного раствора гидроксида натрия. Реакционную среду перемешивают в течение полутора часов при комнатной температуре, затем быстро добавляют 2н. соляную кислоту для доведения значения pH
до 1. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток
порошкуют в гептане, отфильтровывают и высушивают. Получают 5,35 г (97%) целевого соединения в виде порошка бежевого цвета с т. пл. 114oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,37 (с, 3H); 7,29(д, 2H, J= 7,9 Гц); 7,42-7,50(м, 4H); 7,59(д, 1H, J=7,1 Гц); 7,72(д, 1H, J=7,4 Гц); 13,68 (с, 1H).
(д) Аллиловый эфир
4-[3-(4'-метилбифенил-2-ил)пропиноилокси] бензойной кислоты
В колбу объемом 250 мл в токе азота вводят 1,80 г (7,6 ммоль) полученного в примере 8 (г) соединения, 1,45 г (8,0 ммоль)
дициклогексиламина, 20 мл дихлорметана и прикапывают 0,58 мл (8,0 ммоль) тионилхлорида. Реакционную среду перемешивают в течение 5 минут при комнатной темпера туре, затем осадок отфильтровывают,
промывают дихлорметаном, фильтрат выпаривают досуха и остаток обрабатывают с помощью 15 мл тетрагидрофурана. Таким образом полученный раствор прикапывают к смеси из 1,35 г (7,6 ммоль) аллилового эфира
4-гидроксибензойной кислоты, 1,17 мл (8,4 ммоль) триэтиламина и 20 мл тетрагидрофурана. После перемешивания в течение четырех часов быстро добавляют 2н. соляную кислоту для доведения значения pH до 1.
Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток очищают
путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 99% гептана и 1% этилацетата. После выпаривания растворителей получают 1,50 г (50%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 4,81-4,84(м, 2H); 5,30(дд, 1H, J=10,4/1,3 Гц); 5,41(дд, 1H, J=17,2/1,4 Гц); 5,96-6,11(м, 1H); 7,21-7,40(м, 5H); 7,45-7,54(м, 4H); 7,73(дд, 1H, J=7,7/1,0 Гц); 8,10(д, 2H, J=11,2 Гц).
(е) 4-[3-(4'-Метилбифенил-2-ил)пропиноилокси]бензойная кислота
В трехгорлую колбу объемом 100 мл в токе
азота вводят 638 мг (3,97 ммоль) диэтилмалоната, 3 мл тетрагидрофурана и маленькими порциями 128 мл (4,27 ммоль) 80%-ного гидрида натрия. Реакционную смесь перемешивают в течение 15 минут при
комнатной температуре, затем полученный раствор прикапывают к смеси из 1,50 г (3,78 ммоль) полученного в примере 8(д) соединения, 218 мг (0,19 ммоль) тетракистрифенилфосфинопалладия-(O) и 10 мл
тетрагидрофурана. Реакционную среду перемешивают в течение 30 минут при комнатной температуре, подкисляют до pH 1 с помощью 2н., соляной кислоты и экстрагируют диэтиловым эфиром. Органическую фазу
промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток хроматографируют на колонке с диоксидом кремния, элюируя смесью
из 70% гептана и 30% этилацетата. После выпаривания растворителей получают 200 мг (15%) 4-[3-(4'- метилбифенил-2-ил)пропиноилокси]бензойной кислоты в виде порошка бежевого цвета с т. пл. 178oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37 (с, 3H); 7,31(д, 2H, J=8,0 Гц); 7,38(д, 2H, J=8,7 Гц); 7,47-7,56(м, 4H); 7,65-7,71(м, 1H); 7, 82(д, 1H, J=7,7 Гц); 8,01(д, 1H, J=8,7 Гц); 13,14(с, 1H).
Пример 9: 4-[4-(4'-Метилбифенил-2-ил)-(E)/(Z)-бут-1-ен-3-инил] бензойные кислоты
(a)
(4'-Метилбифенил-2-ил)пропиналь
В трехгорлую колбу объемом 250 мл в токе азота вводят 3,83 г (19,5 ммоль) полученного в примере 8(б) соединения и 40 мл тетрагидрофурана. Полученный раствор
охлаждают до -78oC и прикапывают 8,6 мл (21,5 ммоль) 2,5М раствора н-бутиллития в гексане, поддерживая температуру ниже -65oC. Реакционную среду перемешивают в течение 20 минут
при температуре -78oC, затем прикапывают 2,26 мл (29,3 ммоль) N,N-диметилформамида. Перемешивают в течение двух часов при температуре -78oC, оставляют стоять для повышения
темпера туры до -30oC и быстро добавляют 2н. соляную кислоту для до ведения значения pH до 1. Продукт экстрагируют диэтиловым эфиром, органическую фазу подщелачивают путем добавления 10н.
раствора гидроксида натрия и экстрагируют этилацетатом. Органические фазы объединяют, промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители
выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 95% гептана и 5% этилацетата. После выпаривания растворителей получают 3,65 г (83%)
целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 7,27(д, 1H, J= 8,2 Гц); 7,32-7,56(м, 6H); 7,70(дд, 1H, J=7,7/1,2 Гц); 9,28(с, 1H).
(б) Этиловый эфир 4-[4-(4'-метилбифенил-2-ил)бут-1-ен-(E)/ (Z)-3-инил] бензойной кислоты
Аналогично методике примера 6 (в), путем взаимодействия 1,60 г (7,1
ммоль) полученного в примере 9 (а) альдегида и 2,80 г (9,3 ммоль) этилового эфира 4-(диэтилфосфонометил) бензойной кислоты, получают 2,12 г (80%) целевого соединения в виде желтого масла, содержащего
78% (E)-изомера и 22% (Z)-изомера.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д. [(E)-изомер]: 1,41 (т, 3H, J= 7,0 Гц); 2,43 (с, 3H); 4,37 (к, 2H, J=7,0 Гц); 6,38(д, 1H, J=16,2 Гц); 6,86(д, 1H, J=16,2 Гц); 7,20- 7,62(м, 10H); 7,99(д, 2H, J=8,4 Гц).
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д. [(Z)-изомер]: 1,40 (т, 3H, J= 7,0 Гц); 2,38 (с, 3H); 4,36 (к, 2H, J=7,0 Гц); 5,96(д, 1H, J=12,0 Гц); 6,60(д, 1H, J= 12,0 Гц); 7,20- 7,62(м, 8H); 7,68(д, 2H, J=8,4 Гц); 7,83(д, 2H, J=8,4 Гц).
(в)
4-[4-(4'-Метилбифенил-2-ил)(E)/(Z)-бут-1-ен-3-инил]-бензойные кислоты
Аналогично методике примера 1(е), исходя из 2,00 г (5,4 ммоль) полученного в примере 9(б) продукта и после нагревания в
течение полутора часов, получают порошок желтого цвета, идентифицируемый как смесь (Z)- и (E)-изомеров. Эту смесь разделяют путем хроматографии на колонке с диоксидом кремния, элюируя градиентом
растворителя, переходя от чистого гептана к смеси из 50% гептана и 50% этилацетата. После выпаривания растворителей получают 1,03 г (55%) 4-[4-(4'-метилбифенил-2-ил)-(E)-бут-1-ен-3-инил]бензойной
кислоты с т. пл. 225oC и 0,30 г (16%) 4-[4-(4'-метилбифенил-2- ил)-(2)-бут-1-ен-3-инил] бензойной кислоты с т. пл. 177-179oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д. [(E)-изомер]: 2,38 (с, 3H); 6,70(д, 1H, J=16,3 Гц); 6,99(д, 1H, J=16,3 Гц); 7,31(д, 1H, J= 8,0 Гц); 7,36-7,63 (м, 7H); 7,66(д, 2H, J=8,4 Гц); 7,91(д, 2H, J=8,3 Гц); 13,03 (с, 1H).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д. [(Z)-изомер]: 2,34 (с, 3H); 6,11(д, 1H, J=12,0 Гц); 6,79(д, 1H, J=12,1 Гц); 7, 25(д, 2H, J= 7,9 Гц); 7,40-7,53 (м, 5H); 7,64-7,95(м, 5H).
Пример 10: 4-[4-(4'-Метилбифенил-2-ил)бута-1,3-диинил]-бензойная кислота
(а) 2-Бромэтинил-4'-метилбифенил
В колбу объемом 250 мл в токе азота вводят 1,45 г (7,39 ммоль) полученного в примере 8(б) соединения, 7,35 г (22,2 ммоль) тетрабромида углерода и 50 мл дихлорметана. Полученный раствор охлаждают до
температуры 0oC, затем добавляют 17,44 г (66,5 ммоль) трифенилфосфина и перемешивают в течение четырех часов при комнатной температуре. Добавляют диоксид кремния, выпаривают досуха и
продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя гептаном. После выпаривания растворителей получают 750 мг (37%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41 (с, 3H); 7,23-7,32 (м, 3H); 7,35-7,42 (м, 2H); 7,48(д, 2H, J=8,1 Гц); 7,56(д, 1H, J=7,5 Гц).
(б) Метиловый эфир
4-[4-(4'-метилбифенил-2-ил)бута-1,3-диинил] бензойной кислоты
В трехгорлую колбу объемом 50 мл и в токе азота вводят 128 мг (1,84 ммоль) гидроксиламингидрохлорида, 45 мг (0,46 ммоль) хлорида
одновалентной меди (CuCl), 1 мл (15 ммоль) этиламина, 20 мл метанола и 128 мкл воды. При постоянном перемешивании добавляют 370 мг (2,3 ммоль) полученного в примере 1(6) соединения и нагревают при
температуре 45oC в течение часа при интенсивном перемешивании. После этого прикапывают раствор 750 мг полученного в примере 10 (а) соединения в 10 мл метанола. Реакционную среду
перемешивают в течение 24-х часов при температуре 30oC, охлаждают и быстро добавляют 2н. соляную кислоту для доведения значения pH до 1. Продукт экстрагируют диэтиловым эфиром, органическую
фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток обрабатывают диэтиловым эфиром, добавляют диоксид кремния и
выпаривают досуха. Продукт очищают путем хроматографии на колонке с диоксидом кремния, элюируя гептаном. После выпаривания растворителя получают 380 мг (47%) целевого соединения в виде порошка
бежевого цвета с т. пл. 100-102oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 3,92(с, 3H); 7,26-7,34(м, 2H); 7,39-7,47(м, 2H); 7,50-7,58(м, 5H); 7,66(д, 1H, J=7,4 Гц); 7,99(д, 2H, J=8,5 Гц).
(в) 4-[4-(4'-Метилбифенил-2-ил)бута-1,3-диинил]бензойная кислота
Аналогично методике примера 1(е), исходя из 340 мг (0,97
ммоль) полученного в примере 10(б) продукта, получают 300 мг (93%) 4-[4-(4' -метилбифенил-2-ил)бута-1,3-диинил] -бензойной кислоты в виде порошка белого цвета с т. пл. 217-219oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 7,30-7,34(м, 2H); 7,39-7,44(м, 2H); 7,50-7,55(м, 5H); 7,66(д, 1H, J=7,4 Гц); 8,00(д, 2H, J=8,4 Гц).
Пример 11: 4-[4-(3-Фтор-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир 2-фтор-6-иодбензойной кислоты
В колбу объемом 100 мл и в токе азота
вводят 5,00 г (18,8 ммоль) 2-фтор-6-иодбензойной кислоты и 30 мл диметилформамида. Охлаждают до температуры 0oC и добавляют маленькими порциями 62 мг (20,7 ммоль) 80%-ного гидрида натрия.
Реакционную среду перемешивают в течение часа при комнатной температуре, затем прикапывают 1,76 мл (28,2 ммоль) метилиодида. Реакционную среду перемешивают в течение часа при комнатной температуре,
затем добавляют воду и диэтиловый эфир. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и
растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 50% гептана и 50% дихлорметана. После выпаривания растворителей получают 5,08
г (97%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,98 (с, 3H); 7,09-7,16(м, 2H); 7,61-7,68(м, 1H).
(б) Метиловый эфир 3-фтор-4'-метилбифенил-2-карбоновой кислоты
Аналогично методике примера 2(б), исходя из 3,21 г (23,6 ммоль) 4-метилфенилборной кислоты, 5,08 г (18,1 ммоль) метилового эфира
2-фтор-6-иодбензойной кислоты, полученной в примере 11(а), 629 мг (0,54 ммоль) тетракистрифенилфосфинпалладия-(O) и 23,6 мл водного 2М раствора карбоната калия, получают 4,14 г (93%) целевого
соединения в виде порошка белого цвета с т. пл. 62-65oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,38 (с, 3H); 3,70(с, 3H); 7,05-7,28(м, 6H); 7,38-7, 47(м, 1H).
(в) (3-Фтор-4'-метилбифенил-2-ил)метанол
Аналогично методике примера 6(б), исходя из 3,34 г (13,7 ммоль) полученного в примере 11(б) фторсодержащего сложного эфира,
получают 2,95 г (100%) целевого соединения в виде порошка белого цвета с т. пл. 76-78oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,82 (дт, 1H, J=6,3/1, 3 Гц); 2,41(с, 3H); 4,65 (дд, 2H, J=6,3/1,7 Гц); 7,04-7,12(м, 2H); 7,23- 7,37(м, 5H).
(г) 3-Фтор-4'-метилбифенил-2-карбоксальдегид
В колбе объемом 500 мл смешивают 2,16 г (10,
9 ммоль) полученного в примере 11(в) фторсодержащего спирта, 17,39 г оксида марганца и 150 мл дихлорметана. Реакционную среду перемешивают в течение 20 часов при комнатной температуре, затем
отфильтровывают оксид марганца и выпаривают дихлорметан. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 30% гептана и 70% дихлорметана. После
выпаривания растворителей получают 1,47 г (69%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 7,11-7,29(м, 5H); 7,52-7,61(м, 2H); 9,94(с, 1H).
(д) 2-((E)-2-Иодвинил)-3-фтор-4'-метилбифенил
Аналогично методике примера 1(г), исходя из 1,47 г (6,26 ммоль) полученного в примере 11(г)
3-фтор-4'-метил-бифенил-2-карбоксальдегида, получают 770 мг (36%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 6,95(д, 1H, J= 15,1 Гц); 7,01-7,17(м, 2H); 7,21-7,31(м, 7H).
(е) Метиловый эфир 4-[4-(3-фтор-4'-метилбифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойной кислоты
В колбу
последовательно вводят 770 мг (2,28 ммоль) 2-((E)-2-иодвинил)- 3-фтор-4'-метилбифенила и 50 мл пиперидина. Прикапывают раствор 548 мг (3,4 ммоль) метилового эфира 4-этинилбензойной кислоты в 50 мл
пиперидина. Добавляют 132 мг (0,11 ммоль) тетракистрифенилфосфинпалладия-(O) и реакционную среду перемешивают в течение 16 часов при комнатной температуре. Реакционную среду выливают в воду,
экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 90%
гептана и 10% этилацетата. После выпаривания растворителей получают 490 мг (58%) целевого соединения в виде кристаллического твердого вещества бежевого цвета с т. пл. 92oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,91 (с, 3H); 6,53(д, 1H, J= 16,6 Гц); 6,85(д, 1H, J=16,6 Гц); 7,05-7,13(м, 2H); 7,21-7,28(м, 5H); 7,47(д, 2H, J=8,4 Гц); 7, 97(д, 2H, J=8,4 Гц).
(ж) 4-[4-(3-Фтор-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 490 мг (1,3 ммоль) полученного в
примере 11(е) сложного метилового эфира, получают 450 мг (95%) 4-[4-(3-фтор-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде кристаллического твердого вещества бежевого цвета с т.
пл. 202oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,43 (с, 3H); 6,52(д, 1H, J=16,6 Гц); 6,83(д, 1H, J=16,6 Гц); 7,05-7,13(м, 2H); 7,21-7,31(м, 5H); 7,46(д, 2H, J=8,3 Гц); 7,98(д, 2H, J=8,3 Гц).
Пример 12: 4-[4-(4,4'-Диметилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота
(а)
Метиловый эфир 2-гидрокси-5-метилбензойной кислоты
В колбе объемом 1 литр растворяют 20,60 г (135,4 ммоль) 2-гидрокси-5-метилбензойной кислоты в 670 мл метанола. Прикапывают 6,7 мл серной
кислоты и реакционную среду кипятят с обратным холодильником в течение 48 часов. После охлаждения метанол выпаривают, затем добавляют лед и экстрагируют диэтиловым эфиром. Органическую фазу промывают
водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя
дихлорметаном. После выпаривания растворителя получают 20,87 г (93%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,28 (с, 3H); 3,93(с, 3H); 6,88(д, 1H, J=8,5 Гц); 7,26(дд, 1H, J=8,5/2,2 Гц); 7,62(д, 1H, J=1,8 Гц).
(б) Метиловый эфир 5-метил-2-трифторметансульфонилоксибензойной кислоты
В
колбу объемом 500 мл в токе азота вводят 13,48 г (81,13 ммоль) метилового эфира 2-гидрокси-5-метилбензойной кислоты, полученного в примере 12 (а), 22,42 г (162,3 ммоль) карбоната калия и 135 мл
диметилформамида. Охлаждают до температуры 0oC и прикапывают раствор 22,0 г 4-нитротрифторметансульфонилоксибензола в 80 мл диметилформамида. Реакционную среду перемешивают в течение 2,5
часов при комнатной температуре, затем добавляют воду и диэтиловый эфир. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом
магния и отфильтровывают. После выпаривания растворителя получают 23,89 г (99%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 3,96(с, 3H); 7,18(д, 1H, J=8,4 Гц); 7,41(дд, 1H, J=8,4/2,3 Гц); 7,89(д, 1H, J=2,1 Гц).
(в) Метиловый эфир 4,4'-диметилбифенил-2-карбоновой кислоты
В
трехгорлую колбу вводят 12,37 г (91,0 ммоль) 4-метилфенилборной кислоты, 22,61 г (75,8 ммоль) полученного в примере 12(б) трифлата, 6,43 г (151,6 ммоль) хлорида лития, 91 мл водного 2М раствора
карбоната калия и 680 мл толуола. Реакционную среду дегазируют путем барботирования аргона, добавляют 2,63 г (2,27 ммоль) тетракистрифенилфосфинпалладия-(O) и нагревают при температуре 90oC
в течение 5 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем
хроматографии на колонке с диоксидом кремния, элюируя смесью из 20% дихлорметана и 80% гептана. После выпаривания растворителей получают 18,26 г (96%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,39(с, 3H); 2,41(с, 3H); 3,65(с, 3H); 7,19-7,34(м, 6H); 7,61(с, 1H).
(г) (4,4'-Диметилбифенил-2-ил)
метанол
В трехгорлую колбу объемом 1 литр вводят 160 мл диэтилового эфира и 2,81 г (74,1 ммоль) литийалюминийгидрида. Реакционную среду охлаждают до температуры 0oC, затем
прикапывают раствор 17,81 г (74,1 ммоль) полученного в примере 12 (в) сложного эфира в 160 мл диэтилового эфира. Реакционную среду перемешивают в течение двух часов при температуре 0oC,
добавляют 1,40 г литийалюминийгидрида и перемешивают два часа при комнатной температуре. Среду охлаждают до температуры 0oC, затем прикапывают насыщенный раствор хлорида натрия, фильтруют
через целит® , добавляют воду и диэтиловый эфир. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния,
отфильтровывают и растворитель выпаривают. Получают 15,48 г (98%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,59(т, 1H, J=5,9 Гц); 2,39 (с, 3H); 2,40 (с, 3H); 4,59(д, 2H, J=5,8 Гц); 7,13-7,27(м, 6H); 7,35(с, 1H).
(д) 4,4'-Диметилбифенил-2-карбоксальдегид
Аналогично методике примера 11(г),
исходя из 14,80 г (69,7 ммоль) полученного в примере 12 (г) спирта, получают 14,27 г (97%) целевого соединения в виде порошка белого цвета с т. пл. 61-67oC.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 2,45(с, 3H); 7,18-7,26(м, 4H); 7,33(д, 1H, J=7,8 Гц); 7,44(дд, 1H, J=7,9/1,6 Гц); 7,82(c, 1H); 9,97(c, 1H).
(e)
2-((E)-2-Иодвинил)-4,4'-диметилбифенил
Аналогично методике примера 1(г), исходя из полученного в примере 12(д) 4,4'-диметилбифенил-2-карбоксальдегида, получают 4,47 г (93%) целевого
соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,40(с, 3H); 2,43(с, 3H); 6,72(д, 1H, J=14,7 Гц); 7,18-7,32(м, 8H).
(ж) Метиловый эфир 4-[4-(4,4'-диметилбифенил-2-ил)бут-3-ен- (E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 4,00 г (12,0 ммоль) полученного в примере 12
(e) 2-((E)-2-иодвинил)- 4,4'-диметилбифенила с 1,74 г (10,9 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 400 мг (10%) целевого соединения в виде желтых чешуек с т. пл. 95- 97o
C.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41(с, 3H); 2,42(с, 3H); 3,91(с, 3H); 6,34(д, 1H, J=16,2 Гц); 7,09(д, 1H, J=16,2 Гц); 7,13- 7,26(м, 6H); 7,45(с, 1H); 7,47(д, 2H, J=8,3 Гц); 7,97 (д, 2H, J=8,4 Гц).
(з) 4-[4-(4,4'-Диметилбифенил-2-ил)бут-3-ен-(E)-1-инил]- бензойная кислота
Аналогично методике примера 1(е), исходя из 360 г (1,
0 ммоль) полученного в примере 12 (ж) сложного метилового эфира, получают 240 мг (74%) 4-[4-(4,4'-диметилбифенил-2-ил)-бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка светло-желтого цвета с т.
пл. 217oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,25(с, 6H); 6,50(д, 1H, J=16,2 Гц); 6,83(д, 1H, J=16,3 Гц); 7,05-7,18 (м, 6H); 7,42(д, 2H, J=8,3 Гц); 7,55 (с, 1H); 7,79(д, 2H, J=8,32 Гц).
Пример 13: 4-[4-(5,4'-Диметилбифенил-2-ил)бут-3-ен-1-инил] бензойная кислота
(а) Метиловый эфир
2-гидрокси-4-метилбензойной кислоты
Аналогично методике примера 12 (а), исходя из 30,43 г (200,0 ммоль) 2-гидрокси-4-метилбензойной кислоты, получают, после кипячения с обратным холодильником
в течение 72-х часов, 29,49 г (89%) целевого соединения в виде бесцветной жидкости, которая медленно кристаллизуется. Т. пл. 20-25oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,34 (с, 3H); 3,92(с, 3H); 6,69(д, 1H, J=8,2 Гц); 6,79(с, 1H); 7,70(д, 1H, J=8,1 Гц).
(б) Метиловый эфир
4-метил-2-трифторметансульфонилоксибензойной кислоты
Аналогично методике примера 12(б), исходя из 9,97 г (60,0 ммоль) полученного в примере 13 (а) метилового эфира 2-гидрокси-4-метилбензойной
кислоты, получают 13,0 г (73%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,45(с, 3H); 3,95 (с, 3H); 7,09 (с, 1H); 7, 27(дд, 1H, J=7,9/2,9 Гц); 7,98(д, 1H, J=8,0 Гц).
(в) Метиловый эфир 5,4'-диметилбифенил-2-карбоновой кислоты
Аналогично методике примера 12 (в), исходя из 7,11 г (52,3 ммоль)
4-метилфенилборной кислоты и 13,0 г (43,6 ммоль) полученного в примере 13(б) трифлата, получают 10,15 г (97%) целевого соединения в виде кристаллов белого цвета с т. пл. 86-88oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,39 (с, 3H); 2,40(с, 3H); 3,65(с, 3H); 7,16-7,24(м, 6H); 7,74(д, 1H, J=7,7 Гц).
(г) (5,
4'-Диметилбифенил-2-ил)метанол
Аналогично методике примера 12 (г), исходя из 10,08 г (42,0 ммоль) полученного в примере 13(г) сложного эфира, получают 8,21 г (92%) целевого соединения в виде
кристаллов белого цвета с т. пл. 71-73oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,66(т, 1H, J=5,9 Гц); 2,37 (с, 3H); 2,39 (с, 3H); 4,56(д, 2H, J=5,9 Гц); 7,09(с, 1H); 7,15-7,27(м, 5H); 7,39(д, 1H, J=7,8 Гц).
(д) 5,4'-Диметилбифенил-2-карбоксальдегид
Аналогично методике примера 11(г), исходя из 8,17 г (38,5 ммоль)
полученного в примере 13(г) спирта, получают 7,62 г (94%) целевого соединения в виде светло-желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 2, 45 (с, 3H); 7,23-7,29 (м, 6H); 7,93 (д, 1H, J=7,9 Гц); 9,94 (д, 1H, J-0,7 Гц).
(e) 2-((E)-2-Иодвинил)-5,4'-диметилбифенил
Аналогично методике примера 1(г), исходя из 3,00 г
(14,3 ммоль) полученного в примере 13(д) 5,4'-диметил-бифенил-2-карбоксальдегида, получают 3,69 г (77%) целевого соединения в виде оранжевого масла, которое прямо используют в следующей стадии.
(ж) Метиловый эфир 4-[4-(5,4'-диметилбифенил-2-ил)бут-3-ен- (E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 3,69 г (11,0 ммоль) полученного в
примере 13(е) 2-((E)-2-иодвинил)-5,4'- диметилбифенила с 1,60 г (10,0 ммоль) метилового эфира 4- этинилбензойной кислоты, получают 1,00 г (27%) целевого соединения в виде порошка белого цвета с т. пл.
123-125oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,40(с, 3H); 2,44(с, 3H); 3,92(с, 3H); 6,30(д, 1H, J-16,2 Гц); 7,10(д, 1H, J=16,3 Гц); 7,13- 7,26(м, 6H); 7,47 (д, 2H, J=8,5 Гц); 7,61(м, 1H); 7,97 (д, 2H, J=8,4 Гц).
(з) 4-[4-(5,4'-Диметилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е),
исходя из 1,00 г (2,7 ммоль) полученного в примере 13 (ж) сложного метилового эфира, получают 920 мг (97%) 4-[4-(5,4'-диметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка желтого
цвета с т. пл. 269-271oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,14 (с, 3H); 2,17 (с, 3H); 6,37(д, 1H, J=16,2 Гц); 6,73(д, 1H, J=16,3 Гц); 6,90 (с, 1H); 6,98-7,01 (м, 1H); 6,99(д, 2H, J=8,0 Гц); 7,32(д, 2H, J=8,3 Гц); 7,54(д, 1H, J=8,1 Гц); 7,70(д, 2H, J=8,3 Гц); 12,94(уш.с, 1H).
Пример 14: 4-[4-(6,
4'-Диметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир 2-гидрокси-3-метилбензойной кислоты
Аналогично методике примера 12 (а), исходя из 30,43 г (200,0
ммоль) 2-гидрокси-3-метилбензойной кислоты, получают, после кипячения с обратным холодильником в течение 6 дней, 27,71 г (83%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,34 (с, 3H); 3,92(с, 3H); 6,69(дд, 1H, J= 8,2/1,1 Гц); 6,79(с, 1H); 7,70(д, 1H, J=8,1 Гц); 10,70(с, 1H).
(б) Метиловый эфир
3-метил-2-трифторметансульфонилоксибензойной кислоты
Аналогично методике примера 12(б), исходя из 13,29 г (80,0 ммоль) полученного в примере 14 (а) метилового эфира
2-гидрокси-3-метилбензойной кислоты, получают 11,69 г (49%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.л.: 2,43 (с, 3H); 3,94(с, 3H); 7,34(т, 1H, J= 7,7 Гц); 7,48(дд, 1H, J=7,7/1,2 Гц); 7,81(дд, 1H, J=7,7/1,8 Гц).
(в) Метиловый эфир 6,4'-диметилбифенил-2-карбоновой кислоты
Аналогично методике
примера 12 (в), исходя из 6,39 г (47,0 ммоль) 4-метилфенилборной кислоты и 11,69 г (39,2 ммоль) полученного в примере 14(б) трифлата, получают 8,60 г (91%) целевого соединения в виде бесцветного
масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,10(с, 3H); 2,40(с, 3H); 3,57 (с, 3H); 7,04(д, 2H, J=7,8 Гц); 7,20(д, 2H, J=7,8 Гц); 7,29 (т, 1H, J= 7,6 Гц); 7, 39(дд, 1H, J=7,5/0,7 Гц); 7,66(дд, 1H, J=7,6/0,9 Гц).
(г) (6,4'-Диметилбифенил-2-ил)метанол
Аналогично методике примера 12 (г), исходя из 8,60 г (35,8 ммоль) полученного в
примере 14(в) сложного эфира, получают 7,59 г (100%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,47(уш.с, 1H); 2,04 (с, 3H); 2,41 (с, 3H); 4,37(д, 2H, J=3,8 Гц); 7,06(д, 2H, J=7,9 Гц); 7, 19-7, 36 (м, 7H).
(д) 6,4'-Диметилбифенил-2-карбоксальдегид
Аналогично методике примера 11 (г), исходя из
7,59 г (35,75 ммоль) полученного в примере 14(г) спирта, получают 7,09 г (94%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2, 14 (с, 3H); 2,52 (с, 3H); 7,12 (д, 2H, J= 8,0 Гц); 7,26 (д, 2H, J=7,8 Гц); 7,37 (т, 1H, J=7,6 Гц); 7,48(дд, 1H, J-7,4/0,5 Гц); 7,84 (д, 1H, J=7,7 Гц); 9,71 (с, 1H).
(e)
2-((E)-2-Иодвинил)-6,4'-диметилбифенил
Аналогично методике примера 1(г), исходя из 3,00 г (14,3 ммоль) полученного в примере 14(д) 6,4'-диметилбифенил-2-карбоксальдегида, получают 3,06 г
(64%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,11 (с, 3H); 2,39 (с, 3H); 6,60(д, 1H, J= 14,8 Гц); 6,99-7,05 (м, 3H); 7, 24-7,35(м, 4H); 7,52-7,59(м, 1H).
(ж) Метиловый эфир 4-[4-(6,4'-диметилбифенил-2-ил)бут-3-ен-(E) -1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем
взаимодействия 3,06 г (9,2 ммоль) полученного в примере 14(е) 2-((E)-2-иодвинил)-6,4'-диметилбифенила с 2,20 г (13,7 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 2,40 г (71%) целевого
соединения в виде кристаллов желтого цвета с т. пл. 67oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,06 (с, 3H); 2,44 (с, 3H); 3,92(с, 3H); 6,25(д, 1H, J=16,2 Гц); 6,79(д, 1H, J=16,3 Гц); 7,05 (д, 2H, J= 8,0 Гц); 7,23-7,26 (м, 4H); 7, 44 (д, 2H, J=8,3 Гц); 7,51-7,57 (м, 1H); 7, 95 (д, 2H, J=8,4 Гц).
(з) 4-[4-(6,
4'-Диметилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера, 1(е), исходя из 700 мг (1,9 ммоль) полученного в примере 14 (ж) сложного метилового эфира, получают
580 мг (86%) 4-[4-(6,4'-диметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде кристаллов желтого цвета с т. пл. 238oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,06(с, 3H); 2,44(с, 3H); 6,25(д, 1H, J=16,2 Гц); 6,79(д, 1H, J= 16,3 Гц); 7,05(д, 2H, J=7,9 Гц); 7,24-7,28(м, 4H); 7,45(д, 2H, J-8,3 Гц); 7, 49-7,52(м, 1H); 7,99(д, 2H, J=8,3 Гц).
Пример 15: 4-[4-(4-Гидрокси-4'-метилбифенил-2-ил)бут-3-ен- (E)-1-инил] бензойная кислота
(а) 2-Гидрокси-5-метоксиметоксибензальдегид
В трехгорлую колбу вводят 15,00 г (108,6 ммоль) 2,5-дигидроксибензальдегида и 180 мл дихлорметана. Полученный раствор охлаждают до температуры 0oC, прикапывают 20,8 мл
диизопропилэтиламина и перемешивают при 0oC в течение 15 минут. Затем прикапывают 9,0 мл (119,0 ммоль) метилхлорметилового простого эфира и реакционную среду перемешивают в течение 16 часов
при комнатной температуре. Реакционную среду выливают в смесь 1н., соляной кислоты с диэтиловым эфиром, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и
выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 10% диэтилового эфира и 90% гептана. После выпаривания растворителей получают 4,42 г (22%)
целевого соединения в виде твердого вещества белого цвета с т. пл. 36-41oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,50(с, 3H); 5,15(с, 2H); 6,91-6, 95(м, 1H); 7,22-7,27(м, 2H); 9,85(д, 1H, J-0,35 Гц); 10,72 (с, 1H).
(б) 2-Формил-4-метоксиметоксифенилтрифторметансульфонат
Аналогично методике примера 12(б), исходя из 3,70
г (20,3 ммоль) полученного в примере 15 (а) 2-гидрокси-5- метоксиметоксибензальдегида, получают 2,65 г (41%) целевого соединения в виде бесцветной жидкости, которую прямо используют в следующей
стадии.
(в) 4-Метоксиметокси-4'-метилбифенил-2-карбоксальдегид
Аналогично методике примера 12 (в), исходя из 1,37 г (10,1 ммоль) 4-метилфенилборной кислоты и 2,65 г (8,4
ммоль) полученного в примере 15(б) трифлата, получают 1,92 г (89%) целевого соединения в виде порошка бежевого цвета с т. пл. 58-63oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 3,51(с, 3H); 5,26(с, 2H); 7,21-7,25(м, 4H); 7,30(дд, 1H, J=8,5/2,6 Гц); 7,38(д, 1H, J=8,4 Гц); 7,65(д, 1H, J=2,6 Гц); 9,94 (с, 1H).
(г) 2-((E)-2-Иодвинил)-4-метоксиметокси-4'-метилбифенил
Аналогично методике примера 1(г), исходя из 1,92 г (7,5 ммоль) полученного в примере 15(в)
4-метоксиметокси-4'-метилбифенил-2- карбоксальдегида, получают 2,00 г (70%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2, 41(с, 3H); 3,51(с, 3H); 5,22(с, 2H); 6,75(д, 1H, J=14,8 Гц); 6,98-7,29(м, 7H); 7,35(д, 1H, J-14,8 Гц).
(д) Метиловый эфир 4-[4-(4-Метоксиметокси-4'-метилбифенил-2-ил)
бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 2,00 г (5,3 ммоль) полученного в примере 15(г)
2-((E)-2-иодвинил)-4- метоксиметокси-4'-метилбифенила с 766 мг (4,8 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 880 мг (44%) целевого соединения в виде порошка светло-желтого цвета с
т. пл. 89-91oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 3,53(с, 3H); 3,91(с, 3H); 5,24(с, 2H); 6,34(д, 1H, J=16,2 Гц); 7,05-7,09(м, 1H); 7,07(д, 1H, J= 16,1 Гц); 7,19-7,27(м, 5H); 7,32(д, 1H, J=2,4 Гц); 7,47(д, 2H, J=8,4 Гц); 7,97(д, 2H, J=8,4 Гц).
(е)
4-[4-(4-Метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 170 мг (0,41 ммоль) полученного в примере 15(д) сложного
метилового эфира, получают 110 мг (69%) 4-[4-(4- метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты в виде порошка желтого цвета с т. пл. 216oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексалейтеродиметилсульфоксида), δ в м.д.: 2,42 (с, 3H); 3,43 (с, 3H); 5,15 (с, 2H); 6,27(д, 1H, J= 16,2 Гц); 6,95(д, 1H, J=16,2 Гц); 6, 97(дд, 1H, J=8,7/2,4 Гц); 7,10-7,19(м, 5H); 7,22(д, 1H, J=2,4 Гц); 7,37(д, 2H, J=8,3 Гц); 7,88(д, 2H, J=8,3 Гц).
Пример 16: 4-[4-(5-Гидрокси-4'-метилбифенил-2-ил)бут-3-ен- (E)-1-инил]
бензойная кислота
(а) 2-Гидрокси-4-метоксиметоксибензальдегид
Аналогично методике примера 15(а), исходя из 20,00 г (144,8 ммоль) 2,4-дигидроксибензальлегида, получают 21,05 г (80%)
целевого соединения в виде твердого вещества белого цвета с т. пл. 58-64oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,49(с, 3H); 5,23(с, 2H); 6,60-6, 68(м, 2H); 7,46(д, 1H, J=8,6 Гц); 9,74(с, 1H); 11,38(с, 1H).
(б) 2-Формил-5-метоксиметоксифенилтрифторметансульфонат
Аналогично примеру 12(б), исходя из 6,67 г (36,6 ммоль)
полученного в примере 16(а) 2-гидрокси-4-метокси-метоксибензальдегида, получают 8,03 г (70%) целевого соединения в виде бесцветной жидкости.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,51(с, 3H); 5,27(с, 2H); 7,05(д, 1H, J= 2,2 Гц); 7,18(дд, 1H, J=8,8/2,1 Гц); 7,94(д, 1H, J=8,7 Гц); 10,14 (с, 1H).
(в)
5-Метоксиметокси-4'-метилбифенил-2-карбоксальдегид
Аналогично примеру 12 (в), исходя из 4,17 г (30,7 ммоль) 4-метилфенилборной кислоты и 8,03 г (25,6 ммоль) полученного в примере 16(б)
трифлата, получают 6,19 г (95%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 3,50(с, 3H); 5,26(с, 2H); 7, 03(д, 1H, J=2,4 Гц); 7,11(дд, 1H, J=8,7/2,4 Гц); 7,26-7,28 (м, 4H); 8,01(д, 1H, J=8,7 Гц); 9,86(д, 1H, J=0,5 Гц).
(г) 2-((E)-2-Иодвинил)-5-метоксиметокси-4'-метилбифенил
Аналогично примеру 1(г), исходя из 6,20 г (24,2 ммоль) полученного в примере 16 (в) 5-метоксиметокси-4'-метилбифенил-2- карбоксальдегида, получают 5,60 г (60%) целевого соединения в виде красного
масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,34 (с, 3H); 3,41(с, 3H); 5,12(с, 2H); 6,51(д, 1H, J=14,8 Гц); 6,87-7,01(м, 2H); 7,12-7,18(м, 5H); 7,23(д, 1H, J=14,9 Гц).
(д) Метиловый эфир 4-[4-(5-метоксиметокси-4'-метилбифенил-2-ил) бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 5,60
г (14,7 ммоль) полученного в примере 16(г) 2-((E)-2-иодвинил)-5- метоксиметокси-4'-метилбифенила с 2,14 г (13,4 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 2,51 г (45%) целевого
соединения в виде порошка бежевого цвета с т. пл. 96-98oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,49(с, 3H); 3,91(с, 3H); 5,22(с, 2H); 6,24(д, 1H, J=16,2 Гц); 6,98-7,07 (м, 3H); 7,26(с, 4H); 7,46(д, 2H, J=8,4 Гц); 7,60 (д, 1H, J=8,6 Гц); 7,96 (д, 2H, J=8,5 Гц).
(е)
4-[4-(5-Метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 500 мг (1,2 ммоль) полученного в примере 16 (д) сложного
метилового эфира, получают 400 мг (83%) 4-[4-(5-Метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде желтого порошка с т. пл. 235oC.
1 H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,38(с, 3H); 3,40(с, 3H); 5,27(с, 2H); 6,52(д, 1H, J=16,2 Гц); 6,90(д, 1H, J=16,1 Гц); 6,92(д, 1H, J= 2,6 Гц); 7,07(дд, 1H, J=8,7/2,4 Гц); 7,23(д, 2H, J=8,0 Гц); 7,31(д, 2H, J=8,0 Гц); 7,53(д, 2H, J-8,3 Гц); 7,80(д, 1H, J=8,8 Гц); 7,91(д, 2H, J=8,3 Гц); 13,13(уш.с, 1H).
Пример 17:
4-[4-(6-Гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) 2 Формил-6-метоксифенилтрифторметансульфонат
Аналогично методике примера 12(б), исходя из 1,40 г (9,
2 ммоль) 2-гидрокси-3-метоксибензальдегида, получают 1,70 г (65%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,97 (с, 3H); 7,32(дд, 1H, J=7,8/1,7 Гц); 7,44-7,55(м, 2H); 10,25(с, 1H).
(б) 6-Метокси-4'-метилбифенил-2-карбоксальдегид
Аналогично методике примера 12 (в), исходя из 6,34 г (46,7
ммоль) 4-метилфенилборной кислоты и 11,00 г (38,7 ммоль) полученного в примере 17(а) трифлата, получают 7,75 г (88%) целевого соединения в виде кристаллов белого цвета с т. пл. 63-65oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 3,79(с, 3H); 7,16-7,23(м, 1H); 7,21(д, 2H, J=8,0 Гц); 7,27(д, 2H, J=8,1 Гц); 7,43 (т, 1H, J=7,9 Гц); 7,61(дд, 1H, J=7,9/1,1 Гц); 9,74(с, 1H).
(в) 6-Гидрокси-4-метилбифенил-2-карбоксальдегид
В колбу вводят 950 мг (4,2 ммоль) полученного в примере 17(б)
6-метокси-4'-метилбифенил-2-карбоксальдегида, 1,41 г (16,8 ммоль) этантиолята натрия и 20 мл диметилформамида. Реакционную среду нагревают при 150oC в течение двух часов, выливают в смесь
1н. соляной кислоты с диэтиловым эфиром и экстрагируют диэтиловым эфиром. Органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем порошкования в смеси
из 10% диэтилового эфира и 90% гептана. После высушивания в вакуумном сушильном шкафу получают 550 мг (61%) целевого соединения в виде порошка оранжевого цвета с т. пл. 170-171oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,45 (с, 3H); 5,14(уш.с, 1H); 7,22-7,27 (м, 3H); 7,35-7,43(м, 3H); 7,60(дд, 1H, J=7,7/1,2 Гц); 9,74(с, 1H).
(г)
6-Метоксиметокси-4'-метилбифенил-2-карбоксальдегид
Аналогично методике примера 15 (а), исходя из 4,35 г (20,5 ммоль) полученного в примере 17 (в)
6-гидрокси-4'-метилбифенил-2- карбоксальдегида, получают 4,31 г (82%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 3,35(с, 3H); 5,09(с, 2H); 7,22(д, 2H, J=8,3 Гц); 7,27(д, 2H, J=8,2 Гц); 7,38-7,45(м, 2H); 7,64-7,71(м, 1H); 9,74(с, 1H).
(д)
2-((E)-2-Иодвинил)-6-метоксиметокси-4'-метилбифенил
Аналогично методике примера 1(г), исходя из 4,30 г (16,8 ммоль) полученного в примере 17 (г)
6-метоксиметокси-4'- метилбифенил-2-карбоксальдегида, получают 3,74 г (58%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,
42 (с, 3H); 3,31(c, 3H); 5,03(c, 2H); 6,67(д, 1H, J=14,8 Гц); 7,09-7,41(м, 8H)
(е) Метиловый эфир 4-[4-(6-метоксиметокси-4'-метилбифенил-2-ил) бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 3,74 г (9,8 ммоль) полученного в примере 17 (д) 2-((E)-иодвинил)-6- метоксиметокси-4'-метилбифенила с 1,89 г (11,8 ммоль) метилового эфира
4-этинилбензойной кислоты, получают 900 мг (22%) целевого соединения в виде порошка светло-оранжевого цвета с т. пл. 98- 100oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(c, 3H); 3,32(с, 3H); 3,91(с, 3H); 5,04(с, 2H); 6,28(д, 1H, J=16,2 Гц); 6,83 (д, 1H, J=16,2 Гц); 7,15 (д, 2H, J= 8,0 Гц); 7,16 (д, 1H, J=8,3 Гц); 7,27 (д, 2H, J=8,3 Гц); 7,32-7,36 (м, 2H); 7,45(д, 2H, J=8,3 Гц); 7,96(д, 2H, J=8,2 Гц).
(ж) 4-[4-(6-Метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)- 1-инил] бензойная кислота
Аналогично методике примера
1(е), исходя из 200 мг (0,48 ммоль) полученного в примере 17 (е) сложного метилового эфира, получают 165 мг (87%) 4-[4-(6-метоксиметокси-4'-метилбифенил-2-ил)бут- 3-ен-(E)-1-инил] бензойной кислоты в
виде порошка белого цвета с т. пл. 185-187oC.
1H- ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,38(с, 3H); 3,20(с, 3H); 5,07(с, 2H); 6,58(д, 1H, J=16,3 Гц); 6,68 (д, 1H, J-16,3 Гц); 7,10 (д, 1H, J= 7,9 Гц); 7,18 (д, 1H, J=8,1 Гц); 7,28(д, 2H, J=7,9 Гц); 7,35(т, 1H, J-8,0 Гц); 7,52(д, 1H, J=8,0 Гц); 7,53(д, 2H, J=8,3 Гц); 7,90(д, 2H, J=8,3 Гц); 13,13(уш.с, 1H).
Пример 18: 4-[4-(4'-Метилбифенил-2-ил)пент-3-ен-(E)-1-инил] бензойная кислота
(а) 1-(4'-Метилбифенил-2-ил)этанон
Аналогично методике примера 2(б),
исходя из 15,00 г (75,0 ммоль) 2-бромацетофенона и 13,3 г (98,0 ммоль) полученной в примере 2 (а) 4-метилфенилборной кислоты, получают 15,10 г целевого соединения в виде желтого масла.
H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,02(с, 3H); 2,41(с, 3H); 7,24(с, 4H); 7,37-7,56(м, 4H).
(б) 3-(4'-Метилбифенил-2-ил)бут-2-ен-(E)-нитрил
Аналогично
методике примера 6 (а), исходя из 13,00 г (61,8 ммоль) полученного в примере 18(а) кетона, 16,40 г (93,0 ммоль) диэтилцианометилфосфоната, 3,15 г (105,0 ммоль) 80%-ного гидрида натрия и 160 мл
тетрагидрофурана, получают 14,40 г (100%) целевого соединения в неочищенном состоянии в виде масла коричневого цвета.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1, 97(д, 3H, J=1,0 Гц); 2,40 (с, 3H); 5,35(д, 1H, J=1,1 Гц); 7,16-7,46 (м, 8H).
(в) 3-(4'-Метилбифенил-2-ил)бут-2-ен-(E)-аль
Аналогично методике примера 6(б), исходя из 14,4 г
(61,7 ммоль) полученного в примере 18(б) нитрила, получают 16,00 г (75% чистого соединения) целевого продукта в неочищенном состоянии в виде желтого масла, содержащего около 25% исходного продукта.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 2,04(д, 3H, J=1,2 Гц); 2,39(с, 3H); 6,16(дд, 1H, J=8,1/1,3 Гц); 7,17-7,45(м, 8H); 10,01(д, 1H, J= 8,1 Гц).
(г) 2-(4,4-Дибром-1-метилбута-1-(E)-3-диенил)-4'-метилбифенил
Аналогично методике примера 8 (а), исходя из 11,00 г (46,5 ммоль) полученного в примере 18 (в) альдегида, 48,80 г (186,0 ммоль)
трифенилфосфина, 30,87 г (93,1 ммоль) тетрабромида углерода и 300 мл дихлорметана, получают 16,70 г (91%) целевого соединения в виде желтого масла, которое медленно кристаллизуется.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 1,62(д, 3H, J=1,3 Гц); 2,39(с, 3H); 6,18(дд, 1H, J=10,7/1,4 Гц); 6,75(д, 1H, J=13,7 Гц); 7,12-7,37(м, 8H).
(д)
4'-Метил-2-(1-метилбут-1-ен-(E)-3-инил)бифенил
Аналогично методике примера 8(б), исходя из 5,00 г (12,7 ммоль) полученного в примере 18 (г) дибромированного соединения и 10,7 мл 2,5н.
раствора н-бутиллития в гексане, получают 3,25 г (100%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,80(с, 3H); 2,39(с, 3H); 3,18 (д, 1H, J=2,3 Гц); 5,56-5,57 (м, 1H); 7,10-7,38(м, 8H).
(е) Метиловый эфир 4-[4-(4'-метилбифенил-2-ил)пент-3-ен- (E)-1-инил] бензойной кислоты
В колбу вводят
последовательно 3,00 г (13,0 ммоль) полученного в примере 18(д) соединения, 3,40 г (13,0 ммоль) метилового эфира 4-иодбензойной кислоты и 40 мл триэтиламина. Реакционную среду дегазируют путем
пропускания азота в течение 20 минут, затем добавляют 250 мг иодида одновалентной меди и 360 мг бис(трифенилфосфин) палладий-11-хлорида. Перемешивают при комнатной температуре в течение трех часов,
реакционную среду выливают в воду, подкисляют с помощью 1н. соляной кислоты, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток
очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 90% этилацетата и 10% гептана. После выпаривания растворителей получают 2,43 г (50%) целевого соединения в виде оранжевого
масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,88(д, 3H, J=1,0 Гц); 2,38 (с, 3H); 3,92 (с, 3H); 5,82(д, 1H, J=1,1 Гц); 7,14-7,40(м, 8H); 7,49(д, 2H, J=8,4 Гц); 7,99(д, 2H, J=8,4 Гц).
(ж) 4-[4-(4'-Метилбифенил-2-ил)пент-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 2,40 г (6,5 ммоль) полученного в
примере 18(е) соединения, получают 1,20 г (52%) 4-[4-(4'-метилбифенил-2-ил)пент-3-ен-(E)-1-инил] бензойной кислоты в виде порошка бежевого цвета с т.пл. 261-265oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 1,88(с, 3H); 2,34(с, 3H); 5,82(д, 1H, J=1,0 Гц); 7,25-7,43(м, 8H); 7,56(д, 2H, J=8,3 Гц); 7,93(д, 2H, J=8,3 Гц).
Пример 19: 4-[3-(4'-Метилбифенил-2-ил)пропиноиламино]бензойная кислота
(а) Аллиловый эфир 4-[3-(4'-метилбифенил-2-ил)пропиноиламино] бензойной кислоты
Аналогично методике примера 8
(д), исходя из 3,30 г (14,0 ммоль) полученного в примере 8 (г) соединения и 1,98 г (11,0 ммоль) аллилового эфира 4-аминобензойной кислоты, получают 900 мг (20%) целевого соединения в виде коричневого
масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41 (с, 3H); 4,79-4,81(м, 2H); 5,28(дд, 1H, J=10,4/1,2 Гц); 5,39(дд, 1H, J=17,2/1,5 Гц); 5,95-6,10(м, 1H); 7,25-7, 33(м, 3H); 7,39-7,62(м, 6H); 7,73(с, 1H); 8,00(д, 2H, J=8,6Гц).
(б) 4-[3-(4'-Метилбифенил-2-ил)пропиноиламино]бензойная кислота
Аналогично методике примера 3(г), исходя из
500 мг (1,3 ммоль) полученного в примере 19(а) соединения, получают 350 мг (77%) 4-[3-(4'-метилбифенил-2-ил)пропиноиламино] бензойной кислоты в виде порошка бежевого цвета с т. пл. 184-188o
C.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37(с, 3H); 7,30(д, 2H, J=7,9 Гц); 7,45-7,64(м, 5H); 7,71-7,79(м, 3H); 7,92(д, 2H, J=8,6 Гц); 11,06 (с, 1H); 12,83(уш. с, 1H).
Пример 20: 4-[3-(4'-Метилбифенил-2-ил)пропинтиоиламино]бензойная кислота
(а) Аллиловый эфир 4-[3-(4'-метилбифенил-2-ил)пропинтиоиламино] бензойной
кислоты
Аналогично методике примера 4 (а), исходя из 310 мг (0,8 ммоль) полученного в примере 19(а) соединения, получают 160 мг (50%) целевого соединения в виде красного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,40(с, 3H); 4,82(д, 2H, J= 5,6 Гц); 5,29(д, 1H, J=10,4 Гц); 5,42(дд, 1H, J=17,2/1,5 Гц); 5,99-6,10(м, 1H); 6,60(с, 1H); 7,12(д, 2H, J=8,5 Гц); 7,19-7,26(м, 4H); 7,42-7,44(м, 2H); 7,49- 7,57(м, 2H); 8,08(д, 2H, J=8,5 Гц).
(б) 4-[3-(4'- Метилбифенил-2-ил)пропинтиоиламино]бензойная кислота
Аналогично
методике примера 1(е), исходя из 100 мг (0,24 ммоль) полученного в примере 20(а) соединения, получают 90 мг (90%) 4-[3-(4' -метилбифенил-2-ил)пропинтиоиламино]бензойной кислоты в виде порошка
желто-оранжевого цвета с т. пл. 170oC (разложение).
1H- ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,36(с, 3H); 7,14(с, 1H); 7,28(уш.с, 6H); 7, 46-7,68(м, 4H); 8,00(д, 2H, J=8,2 Гц).
Пример 21: 4-[4-(3'-Метилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота
(а) 3'-Метилбифенил-2-карбоксальдегид
В трехгорлую
колбу вводят 3,85 г (28,0 ммоль) 3-метилбензолборной кислоты, 3.50 г (18,9 ммоль) 2-бромбензальдегида, 18,9 мл (37,8 ммоль) водного 2М раствора карбоната калия и 75 мл диметоксиэтана. Смесь дегазируют
при комнатной температуре путем барботирования аргона в течение часа, затем добавляют 1,09 г (0,95 ммоль) тетракистрифенилфосфинпалладия-(О) и кипятят с обратным холодильником в течение двух часов
сорока минут. Охлаждают, реакционную среду выливают в воду, экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем
хроматографии на колонке с диоксидом кремния, элюируя смесью из 5% этилацетата и 95% гептана. После выпаривания растворителей получают 3,70 г (100%) целевого соединения в виде масла бледно-желтого
цвета.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 7,17-7,20(м, 1H); 7,24-7,27(м, 1H); 7,35(д, 1H, J=7,7 Гц); 7,39-7,67 (м, 3H); 7,62(дд, 1H, J=7,4/1,5 Гц); 8,02(дд, 1H, J=7,6/1,4 Гц); 9,99 (с, 1H).
(б) 2-((E)-2-Иодвинил)-3'-метилбифенил
Аналогично методике примера 1(г), исходя из 1,45 г (7,38 ммоль) полученного в примере
21(а) 3'-метилбифенил-2-карбоксальдегида, получают 2,10 г (89%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,34 (с, 3H); 6, 65(д, 1H, J= 14,8 Гц); 6,91-7,38 (м, 9H).
(в) Метиловый эфир 4-[4-(3'-метилбифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем
взаимодействия 2,10 г (6,55 ммоль) 2-(2-иодвинил)-3'-метилбифенила, полученного в примере 21(б), с 1,05 г (6,55 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 520 мг (22%) целевого
соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,91(с, 3H); 6,35(д, 1H, J=16,2 Гц); 7,09(д, 1H, J=16,3 Гц); 7,17-7,38 (м, 7H); 7,47 (д, 2H, J=8,4 Гц); 7,64-7,68 (м, 1H); 7,97 (д, 2H, J=8,4 Гц).
(г) 4-[4-(3'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е),
исходя из 520 мг (1,47 ммоль) полученного в примере 21(в) сложного метилового эфира, получают 370 мг (74%) 4-[4-(3'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка бежевого
цвета с т. пл. 211oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д.: 2,43(с, 3H); 6,36(д, 1H, J=16,2 Гц); 7,07(д, 1H, J=16,3 Гц); 7,12-7,23(м, 3H); 7,29-7,48(м, 4H); 7,46(д, 2H, J=8,3 Гц); 7,65-7,69(м, 1H); 7,98(д, 2H, J=8,3 Гц).
Пример 22: 4-[4-(2'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная
кислота
(а) 2'-Метилбифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 3,86 г (28,4 ммоль) 2-метилбензолборной кислоты и 3,50 г (18,9 ммоль) 2-бромбензальдегида,
получают 2,50 г (67%) целевого соединения в виде слегка желтого масла.
1H-ЯМР-спектр (дейтерохлороформ),

(б)
2-((E)-2-Иодвинил)-2'-метилбифенил
Аналогично методике примера 1(г), исходя из 2,00 г (10,2 ммоль) полученного в примере 22(а) 2'-метилбифенил-2-карбоксальдегида, получают 3,26 г (100%)
целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,04 (с, 3H); 6,70(д, 1H, J= 14,8 Гц); 7,10(д, 1H, J=14,8 Гц); 7,09-7,49(м, 8H).
(в) Метиловый эфир 4-[4-(2'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 3,26 г (10,2 ммоль)
полученного в примере 22(б) 2-(2-иод-винил)-2'-метилбифенила с 1,63 г (10,2 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 360 мг (10%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,07 (с, 3H); 3,91 (с, 3H); 6,32(д, 1H, J= 16,3 Гц); 6,77(д, 1H, J=16,3 Гц); 7,13-7,57(м, 7H); 7,45(д, 2H, J=8,4 Гц); 7,66-7, 70(м, 1H); 7,95(д, 2H, J=8,5 Гц).
(г) 4-[4-(2'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 360 мг (1,02 ммоль)
полученного в примере 22 (в) сложного метилового эфира, получают 222 мг (64%) 4-[4-(2'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде желтого порошка с т. пл. 250oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,07 (с, 3H); 6,33(д, 1H, J=16,3 Гц); 6,75(д, 1H, J=16,3 Гц); 7,12-7,19(м, 2H); 7,27- 7, 46(м, 5H); 7,44(д, 2H, J=8,3 Гц); 7,67-7,71 (м, 1H); 7,96(д, 2H, J=8,3 Гц).
Пример 23: 4-[4-(4'-Хлорбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота
(а)
4'-Хлорбифенил-2-карбоксальдегид
Аналогично методике примера 21 (а), исходя из 5,00 г (31,9 ммоль) 4-хлорбензолборной кислоты и 3,94 г (21,3 ммоль) 2- бромбензальдегида, получают 4,40 г (95%)
целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 7,32(д, 2H, J=8,5 Гц); 7,42-7,55 (м, 2H); 7,45(д, 2H, J= 8,5 Гц); 7,64(дд, 1H, J=7,5/1,5 Гц); 8,03(дд, 1H, J=7,7/1,3 Гц); 9,97(с, 1H).
(б) 2-((E)-2-Иодвинил)-4'-хлорбифенил
Аналогично методике примера 1(г), исходя из 2,50 г (11,5 ммоль) полученного в
примере 23 (а) 4'-хлорбифенил-2-карбоксальдегида, получают 2,40 г (61%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 6, 76(д, 1H, J=14,8 Гц); 7,24-7,47 (м, 9H).
(в) Метиловый эфир 4-[4-(4'-хлорбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем
взаимодействия 2,40 г (7,0 ммоль) полученного в примере 23(б) 2-((E)-(2-иодвинил)-4'- хлорбифенила с 1,03 г (6,4 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 970 мг (41%) целевого
соединения в виде твердого вещества светло-желтого цвета с т. пл. 135oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,35 (д, 1H, J= 16,2 Гц); 7,01 (д, 1H, J=16,2 Гц); 7,26- 7,45(м, 7H); 7,49(д, 2H, J=8,4 Гц); 7,63-7,67(м,1H); 7, 97 (д, 2H, J=8,4 Гц).
(г) 4-[4-(4'-Хлорбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 0,97 г (26,01 ммоль) полученного в примере 23 (в) сложного метилового эфира, получают 880 мг (94%)
4-[4-(4'-хлорбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойной кислоты в виде твердого вещества светло-желтого цвета с т. пл. 273oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 6,15(д, 1H, J=16,2 Гц); 6,76(д, 1H, J=16,2 Гц); 7,05-7,18(м, 7H); 7,21(д, 2H, J=8,2 Гц); 7,43-7,46(м, 1H); 7,73(д, 2H, J=8,3 Гц).
Пример 24: 4-[4-(3'-Хлорбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) 3'-Хлорбифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 5,00 г (31,9
ммоль) 3-хлорбензолборной кислоты и 3,94 г (21,3 ммоль) 2-бромбензальдегида, получают 4,39 г (95%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 7,23- 7,27 (м, 1H); 7,37-7,45(м, 4H); 7,50-7,56(м, 1H); 7,64(дд, 1H, J=7,5/1,5 Гц); 8,04(дд, 1H, J= 7,7/1,4 Гц); 9,98(д, 1H, J=0,6 Гц).
(б)
2-((E)-2-Иодвинил)-3'-хлорбифенил
Аналогично методике примера 1(г), исходя из 2,50 г (11,5 ммоль) полученного в примере 24(а) 3'-хлорбифенил-2-карбоксальдегида, получают 1,85 г (47%) целевого
соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 6,77(д, 1H, J=14,9Гц); 7,19-7,47(м, 9H).
(в) Метиловый эфир
4-[4-(3'-хлорбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 1,85 г (5,4 ммоль) полученного в примере 24(б)
2-((E)-(2-иодвинил)-3'-хлорбифенила с 791 мг (4,9 ммоль) метилового эфира 4-этиленбензойной кислоты, получают 900 мг (49%) целевого соединения в виде порошка бежевого цвета с т.п. 120 - 125o
C.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,36 (д, 1H J= 16,2 Гц); 7,01 (д, 1H, J=16,2 Гц); 7,20-7,30 (м, 2H); 7,35-7,42 (м, 5H); 7,48 (д, 2H, J=8, 4 Гц); 7,64-7,68 (м, 1H); 7,97 (д, 2H, J=8,5 Гц).
(г) 4-[4-(3'-Хлорбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 900 мг (24,1
ммоль) полученного в примере 24(в) сложного метилового эфира, получают 800 мг (92%) 4-[4-(3'-хлорбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойной кислоты в виде твердого вещества светло-желтого цвета с
т.пл. 212oC.
1H-ЯМР-спектр (дейтерохлороформ + капли гексадейтеродиметилсульфоксида), δ в м. д. : 6,38 (д, 1H J=16,2 Гц); 6,99 (д, 1H, J=16,2 Гц); 7,22-7, 51 (м, 7H); 7,48 (д, 2H, J=8,3 Гц); 7,66-7,70 (м, 1H); 7,97 (д, 2H, J=8,3 Гц).
Пример 25: 4-[4-(4'-Фторбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
(а)
4'-Фторбифенил-2-карбоксальдегид
Аналогично методике примера 21(е), исходя из 4,36 г (31,1 ммоль) 4-фторбензолборной кислоты и 3,84 г (20,7 ммоль) 2-бромбензальдегида, получают 4,09 г (98%)
целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 7,15(д, 2H, J=8,7 Гц); 7,17-7,54 (м, 4H); 7,63(дд, 1H, J=7,5/1,5 Гц); 8,02(дд, 1H, J=7,7/1,3 Гц); 9,97(д, 1H, J=0,6 Гц).
(б) 2-((E)-2-Иодвинил)-4'-фторбифенил
Аналогично методике примера 1(г), исходя из 2,50 г (12,4 ммоль) полученного в примере 25 (а)
4'-фторбифенил-2-карбоксальдегида, получают 2,69 г (66%) целевого соединения в виде оранжевого масла, которое прямо используют в следующей стадии.
(в) Метиловый эфир
4-[4-(4'-фторбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 2,69 г (8,3 ммоль) полученного в примере 25(б)
2-((E)-(2-иодвинил)-4'- фторбифенила с 1,20 г (7,5 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 1,20 г (45%) целевого соединения в виде желтого порошка с т. пл. 113oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91(с, 3H); 6,35(д, 1H, J= 16,2 Гц); 7,02(д, 1H, J= 16,2 Гц); 7,11-7,19(м, 2H); 7,25-7,40(м, 5H); 7,48(д, 2H, J=8,4 Гц); 7,62-7, 68 (м, 1H); 7,97 (д, 2H, J=8,4 Гц).
(г) 4-[4-(4'-Фторбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 1,20 г (33,7 ммоль)
полученного в примере 25 (в) сложного метилового эфира, получают 1,12 г (97%) 4-[4-(4'-фторбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойной кислоты в виде твердого вещества светло-желтого цвета с т. пл.
220oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 6,36(д, 1H, J=16,2 Гц); 7,01(д, 1H, J=16,2 Гц); 7,12-7,19(м, 2H); 7,27-7,40(м, 5H); 7,47(д, 2H, J=8,4 Гц); 7,64-7,68(м, 1H); 7,99(д, 2H, J=8,4 Гц).
Пример 26: 4-[4-(4'-Пропилбифенил-2-ил)бут-3-ен-(E)-1- инил]бензойная кислота
(а)
4'-Пропилбифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 3,40 г (20,7 ммоль) 4-пропилбензолборной кислоты и 2,56 г (13,8 ммоль) 2-бромбензальдегида, получают 2,07 г
(67%) целевого соединения в виде слегка желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 0,99 (т, 3H, J=7,4 Гц); 1,70(м, 2H, J= 7,4 Гц); 2,66 (т, 2H, J-7,4 Гц); 7,29-7,32(м, 4H); 7,44-7,66(м, 2H); 7,61(дд, 1H, J=7,5/1,5 Гц); 8,01(дд, 1H, J=6,5/1,3 Гц); 9,99 (с, 1H).
(б) 2-((E)-2-Иодвинил)-4'-пропилбифенил
Аналогично методике
примера 1(г), исходя из 2,06 г (9,1 ммоль) полученного в примере 26 (а) 4'-пропилбифенил-2-карбоксальдегида, получают 2,14 г (67%) целевого соединения в виде желтого масла.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,00 (т, 3H, J=7,5 Гц); 1,69(м, 2H, J= 7,6 Гц); 2,65 (т, 2H, J=7,3 Гц); 6,73(д, 1H, J=14,8 Гц); 7,21-7,48(м, 9H).
(в) Метиловый эфир
4-[4-(4'-пропилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 2,14 г (6,1 ммоль) полученного в примере 26(б)
2-(2-иодвинил)-4'-пропилбифенила с 980 мг (6,1 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 760 мг (32%) целевого соединения в виде бесцветного масла.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,01 (т, 3H, J=7,2 Гц); 1,72(м, 2H, J=7,4 Гц); 2,66 (т, 2H, J=7,5 Гц); 3,91(с, 3H); 6,36(д, 1H, J= 16,2 Гц); 7,12(д, 1H, J= 16,2 Гц); 7,26-7,31(м, 4H); 7,33-7,38(м, 3H); 7,48(д, 2H, J=8,4 Гц); 7,64-7,67 (м, 1H); 7,97 (д, 2H, J=8,4 Гц).
(г) 4-[4-(4'-Пропилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично
методике примера 1(е), исходя из 760 мг (2,0 ммоль) полученного в примере 26(в) сложного метилового эфира, получают 670 мг (91%) 4-[4-(4'-пропилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойной кислоты в
виде зеленоватого порошка с т. пл. 198oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 1,00 (т, 3H, J=7,3 Гц); 1, 64-1,79(м, 2H); 2,66(т, 2H, J=7,4 Гц); 6,36(д, 1H, J= 16,2 Гц); 7,11(д, 1H, J=16,2 Гц); 7,27-7,38(м, 7H); 7,47(д, 2H, J=8,4 Гц); 7,64-7,68 (м, 1H); 7,98 (д, 2H, J=8,4 Гц).
Пример 27:
4-[4-(4'-Винилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(a) 4'-Винилбифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 5,00 г (33,8 ммоль)
4-винилбензолборной кислоты и 4,17 г (22,5 ммоль) 2-бромбензальдегида, получают 4,33 г (92%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 5,24(д, 1H, J=10,9 Гц); 5,75(дд, 1H, J=18,2/0,6 Гц); 6,69(дд, 1H, J=17,6/10,9 Гц); 7,26(д, 2H, J=8,2 Гц); 7,31-7,58(м, 2H); 7,42(д, 2H, J=8,2 Гц); 7,53(дд, 1H, J=7,5/1,4 Гц); 7,94(дд, 1H, J=7,7/1,3 Гц); 9,91(с, 1H).
(б) 2-((E)-2-Иодвинил)-4'-винилбифенил
Аналогично методике примера 1(г), исходя из 2,50 г (12,0 ммоль) полученного в примере 27 (а)
4'-винилбифенил-2-карбоксальдегида, получают 2,08 г (52%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 5,30(д, 1H, J=10,9 Гц); 5,82(д, 1H, J= 17,6 Гц); 6,69-6,83 (м, 1H); 6,75(д, 1H, J=14,7 Гц); 7,24-7,50(м, 9H).
(в) Метиловый эфир 4-[4-(4'-винилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 2,08 г (6,3 ммоль) полученного в примере 27(б) 2-((E)-(2-иодвинил)-4'- винилбифенила с 912 мг (5,9 ммоль) метилового эфира 4-этинилбензойной
кислоты, получают 960 мг (45%) целевого соединения в виде порошка светло-желтого цвета с т. пл. 136oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91(с, 3H); 5,31(д, 1H, J= 11,0 Гц); 5,83(д, 1H, J-17,2 Гц); 6,35(д, 1H, J=16,2 Гц); 6,79(дд, 1H, J= 17,6/10,9 Гц); 7,09(д, 1H, J=16,2 Гц); 7,31-7,39(м, 5H); 7,46-7,52(м, 4H); 7,64-7,68(м, 1H); 7,97(д, 2H, J=8,4 Гц).
(г)4-[4-(4'-Винилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 960 мг (26,3 ммоль)полученного в примере
27(в)сложного метилового эфира, получают 910 мг (98%)4-[4-(4'-винилбифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойной кислоты в виде твердого вещества желтого цвета с т. пл. 254-257oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 4,67(д, 1H, J=10,9 Гц); 5,20(д, 1H, J=17,6 Гц); 5,77(д, 1H, J= 16,2 Гц); 6,14(дд, 1H, J=17,6/10,9 Гц); 6,39(д, 1H, J=16,2 Гц); 6,66-6,76(м, 4H); 6,81-6,84 (м, 3H); 6,88(д, 2H, J=8,1 Гц); 7,04-7,08 (м, 1H); 7,29(д, 2H, J=8,2 Гц).
Пример 28:
4-[4-(4'-Метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) 4-Метоксиметоксибромбензол
В трехгорлую колбу вводят 48,84 г (282,3 ммоль) 4-бромфенола, 150 мл
тетрагидрофурана и 150 мл диметилформамида. Полученный раствор охлаждают до 0oC, добавляют маленькими порциями 11,74 г (366,9 ммоль) 75%-ного гидрида натрия и перемешивают при температуре
0oC в течение часа. Прикапывают 25,0 мл (310,5 ммоль) метилхлорметилового простого эфира и реакционную среду перемешивают в течение двух часов при комнатной температуре. Реакционную среду
выливают в смесь 1н. соляной кислоты с этилацетатом, экстрагируют этилацетатом, органическую фазу декантируют, сушат над сульфатом магния. После выпаривания растворителей получают 63,85 г (100%)
целевого соединения в виде бежевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,46 (с, 3H); 5,14 (с, 2H); 6,92(д, 2H, J=9,0 Гц); 7,57(д, 2H, J=9,0 Гц).
(б) 4-Метоксиметоксибензолборная кислота
Аналогично методике примера 2 (а), исходя из 63,81 г (293,0 ммоль) полученного в примере 28 (а) 4-метокси-метоксибромбензола, получают 35,
42 г (80%)целевого соединения в виде порошка белого цвета с т. пл. 122oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,52 (с, 3H); 5,27(с, 2H); 7,14(д, 2H, J=8,6 Гц); 8,16(д, 2H, J=8,6 Гц).
(в) 4'-Метоксиметоксибифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 14,00 г (9,3 ммоль) полученной в примере 28(б)
4-метоксиметоксибензолборной кислоты и 11,56 г (6,2 ммоль)2-бромбензальдегида, получают 13,10 г (87%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,51(с, 3H); 5,24 (с, 2H); 7,14(д, 2H, J=8,7 Гц); 7,30(д, 2H, J=8,7 Гц); 7,40-7,49(м, 2H); 7,60(дд, 1H, J=7,5/1,5 Гц); 8,00(дд, 1H, J=7,6/1,1 Гц); 10,00(д, 1H, J=0, 6 Гц).
(г) 2-((E)-2-Иодвинил)-4'-метоксиметоксибифенил
Аналогично методике примера 1(г), исходя из 13,10 г (54,0 ммоль) полученного в примере 28(в)
4'-метокси-метоксибифенил-2- карбоксальдегида, получают 5,51 г (28%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,54 (с, 3H); 5,24 (с, 2H); 6,73(д, 1H, J=14,8 Гц); 7,04-7,12 (м, 3H); 7,22-7,44 (м, 6H).
(д) Метиловый эфир 4-[4-(4'-метоксиметоксибифенил-2-ил)бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 5,51 г (15,1 ммоль)полученного в примере 28 (г) 2-(2-иодвинил)- 4'-метоксиметоксибифенила с 2,19 г (13,7 ммоль) метилового эфира
4-этинилбензойной кислоты, получают 3,42 г (63%) целевого соединения в виде желтого порошка с т. пл. 76-80oHC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,54 (с, 3H); 3,91 (с, 3H); 5,24 (с, 2H); 6,34 (д, 1H, J=16,2 Гц); 7,08- 7,14 (м, 2H); 7,26-7,37(м, 5H); 7,49(д, 2H, J=8,4 Гц); 7,97 (д, 2H, J=8,3 Гц).
(e)
4-[4-(4'-Метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1 (e), исходя из 850 мг (2,13 ммоль) полученного в примере 28 (д) сложного метилового
эфира, получают 490 мг (60%) 4-[4-(4'-метоксиметоксибифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойной кислоты в виде желтого порошка с т. пл. 209-213oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 3,30 (с, 3H); 5,01 (с, 2H); 6,13(д, 1H, J=16,2 Гц); 6,85(д, 1H, J= 16,0 Гц); 6,89(д, 2H, J=8,4 Гц); 7,04(д, 2H, J=8,6 Гц); 7,08-7,13(м, 3H); 7,25(д, 2H, J=8,2 Гц); 7,26-7,28(м, 1H); 7,41-7,43(м, 1H); 7,74(д, 2H, J=8,2 Гц).
Пример 2 9: 4-[4-(3'-Метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная
кислота
(а) 3-Метоксиметоксибромбензол
Аналогично методике примера 28(а), исходя из 48,84 г (282,3 ммоль) 3-бромфенола и 25,00 г (310,5 ммоль) метилхлорметилового простого эфира,
получают 65,00 г (100%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,48 (с, 3H); 5,15(с, 2H); 6,92-7,00(м, 2H); 7,10-7,18(м, 4H); 7,18- 7,22(м, 2H).
(б) 3-Метоксиметоксибензолборная кислота
Аналогично методике примера 2 (а), исходя из 65,00 г (299,4 ммоль) полученного в примере 29 (а)
3-метоксиметоксибромбензола, получают 30,20 г (67%) целевого соединения в виде порошка бежевого цвета с т. пл. 45oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,54 (с, 3H); 5,28(с, 2H); 7,26-7,54(м, 3H); 7,86-7,90(м, 1H).
(в) 3'-Метоксиметоксибифенил-2-карбоксальдегид
Аналогично методике примера 21 (а), исходя из 15,00 г (100,
0 ммоль) полученной в примере 29(б) 3-метоксиметокси-бензолборной кислоты и 12,33 г (66,6 ммоль) 2-бромбензальдегида, получают 7,60 г (31%) целевого соединения в виде бесцветного масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,51(с, 3H); 5,22(с, 2H); 7,01(д, 1H, J=7,5 Гц); 7,07-7,14 (м, 2H); 7,36(д, 1H, J=7,8 Гц); 7,41-7,53 (м, 2H); 7,62(дд, 1H, J=7, 5/1,5 Гц); 8,02(дд, 1H, J=7,7/1,2 Гц); 10,01(с, 1H).
(г) 2-((E)-2-Иодвинил)-3'-метоксиметоксибифенил
Аналогично методике примера 1(г), исходя из 7,60 г (31,4
ммоль)полученного в примере 29(в) 3'-метокси-метоксибифенил-2- карбоксальдегида, получают 4,25 г (37%) целевого соединения в виде коричневого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,51(с, 3H); 5,22(с, 2H); 6,73(д, 1H, J=14,8 Гц); 6,95-7,07(м, 3H); 7,30- 7,43(м, 5H).
(д) Метиловый эфир
4-[4-(3'-метоксиметоксибифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты
Аналогично методике примера 11 (е), путем взаимодействия 6,96 г (17,5 ммоль) полученного в примере 29 (г)
2-((E)-2-иодвинил)-3'- метоксиметоксибифенила с 5,59 г (34,9 ммоль)метилового эфира 4-этинилбензойной кислоты, получают 1,84 г (25%) целевого соединения в виде порошка светло-желтого цвета с т. пл.
102oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,50 (с, 3H); 3,91(с, 3H); 5,22(с, 2H); 6,98-7,09(м, 4H); 7,35-7,40(м, 4H); 7,47(д, 2H, J=8,4 Гц); 7, 64-7,67 (м, 1H); 7,97(д, 2H, J=8,4 Гц).
(е) 4-[4-(3'-Метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 450 мг (1,2
ммоль) полученного в примере 29(д) сложного метилового эфира, получают 420 мг (93%) 4-[4-(3'-метоксиметоксибифенил-2-ил)бут-3-ен- (E)-1-инил] бензойной кислоты в виде порошка бежевого цвета с т. пл.
213oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 3,50 (с, 3H); 5,23 (с, 2H); 6,36(д, 1H, J=16,2 Гц); 6,98-7,08(м, 3H); 7,09(д, 1H, J=16,3 Гц); 7,34-7,42(м, 4H); 7,46(д, 2H, J=8,3 Гц); 7,65-7,68 (м, 1H); 7,98(д, 2H, J=8,3 Гц).
Пример 30: 4-[4-(2-тиофен-3-илфенил)бут-3-ен-(E)-1-инил] -бензойная
кислота
(а) 2-Тиофен-3-илбензальдегид
Аналогично методике примера 21 (а), исходя из 5,15 г (40,2 ммоль) 3-тиофенборной кислоты и 4,96 г (26,8 ммоль) 2-бромбензальдегида, получают 4,
08 г (81%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 7,18-7,20 (м, 1H); 7,28-7,30(м, 1H); 7,44-7,50(м, 3H); 7,60(дд, 1H, J=7,0/1,5 Гц); 8,00(дд, 1H, J= 6,9/1,6 Гц); 10,11 (с, 1H).
(б) 2-((E)-2-Иодвинил)-2-тиофен-3-илбензол
Аналогично методике примера 1(г), исходя из 2,50 г (13,3 ммоль)
полученного в примере 30 (а) 2-тиофен-3-ил-бензальдегида, получают 2,74 г (66%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 6,74(д, 1H, J=14,8 Гц); 7,14-7,44 (м, 7H); 7,50(д, 1H, J=14,8 Гц).
(в) Метиловый эфир 4-[4-(2-тиофен-3-илфенил)бут-3-ен-(E)-1- инил]бензойной кислоты
Аналогично методике
примера 1 (д), путем взаимодействия 2,74 г (8,8 ммоль) полученного в примере 30(б) 2-(2-иод-винил)-2-тиофен-3-илбензола с 1,41 г (8,8 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 950 мг
(31%) целевого соединения в виде порошка бежевого цвета с т. пл. 89-91oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91(с, 3H); 6,33(д, 1H, J= 16,2 Гц); 7,17-7,36(м, 7H); 7,49(д, 2H, J=8,3 Гц); 7, 61-7, 63 (м, 1H); 7, 97 (д, 2H, J=8,3 Гц).
(г) 4-[4-(2-Тиофен-3-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике
примера 1(е), исходя из 950 мг (2,8 ммоль) полученного в примере 30 (в) сложного метилового эфира, получают 880 мг (96%) 4-[4-(2-тиофен-3-ил-фенил)бут-3-ен-(E)-1- инил]бензойной кислоты в виде желтого
порошка с т. пл. 218oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 6,38(д, 1H, J=16,2 Гц); 6,99(д, 1H, J=16,2 Гц); 7,22-7,51(м, 6H); 7,48(д, 2H, J=8,3 Гц); 7,66-7,70 (м, 1H); 7,97(д, 2H, J=8,3 Гц).
Пример 31: 4-[4-(2-Тиофен-2-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота
(а)
2-Тиофен-2-илбензальдегид
Аналогично методике примера 21(а), исходя из 4,19 г (32,7 ммоль) 2-тиофенборной кислоты и 4,04 г (21,8 ммоль) 2-бромбензальдегида, получают 3,85 г (89%) целевого
соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 7,07-7,09(м, 1H); 7,14-7,17 (м, 1H); 7,46-7,57 (м, 3H); 7,61(дд, 1H, J=7,0/1,3 Гц); 8, 01(дд, 1H, J= 7,7/1,4 Гц); 10,19(д, 1H, J=0,7 Гц).
(б) 2-((E)-2-Иодвинил)-2-тиофен-2-илбензол
Аналогично методике примера 1(г), исходя из 2,50 г (13,3 ммоль) полученного в
примере 31 (а) 2-тиофен-2-ил-бензальдегида, получают 3,17 г (76%) целевого соединения в виде масла каштанового цвета, которое прямо используют в следующей стадии.
(в) Метиловый эфир
4-[4-(2-Тиофен-2-илфенил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 3,17 г (10,2 ммоль) полученного в примере 31(б)
2-(2-иодвинил)-2-тиофен-2- илбензола с 1,63 г (10,2 ммоль)метилового эфира 4-этинилбензойной кислоты, получают 555 мг (16%) целевого соединения в виде твердого вещества желтого цвета с т. пл. 100oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,35(д, 1H, J-15,2 Гц); 7,07(д, 1H, J=1,2 Гц); 7,08- 7,14 (м, 1H); 7,30-7,46(м, 5H); 7,50(д, 2H, J=8,3 Гц); 7,61-7,63(м, 1H); 7,98(д, 2H, J=8,3 Гц).
(г) 4-[4-(2-Тиофен-2-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 550 мг (1,6
ммоль) полученного в примере 31 (в) сложного метилового эфира, получают 530 мг (100%) 4-[4-(2-Тиофен-2-илфенил)бут-3-ен-(E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл. 221o
C.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 6,37(д, 1H, J=16,2 Гц); 7,11(с, 1H, J=16,2 Гц); 7,08-7,17(м, 1H); 7,34-7, 47(м, 5H); 7,50(д, 2H, J=8,4 Гц); 7,62-7,66 (м, 1H); 8,00(д, 2H, J=8,4 Гц).
Пример 32: 4-[4-(4'-Гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир
4-[4-(4'-гидроксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты
В трехгорлую колбу объемом 100 мл в токе азота вводят 1,95 г (4,9 ммоль) полученного в примере 28(д) соединения, 20 мл
метанола и 20 мл тетрагидрофурана. Прикапывают 2,62 мл (48,9 ммоль) концентрированной серной кислоты в виде раствора в 20 мл метанола. Реакционную среду перемешивают в течение 15 часов при комнатной
температуре, затем добавляют воду, экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают.
Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя гептаном, затем смесью из 20% этилацетата и 80% гептана. После выпаривания растворителей получают 1,50 г (86%)
целевого соединения в виде порошка бежевого цвета с т. пл. 130oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,92(с, 3H); 4,96 (с, 1H); 6,34(д, 1H, J= 16, 2 Гц); 6,93(д, 2H, J=8,6 Гц); 7,09(д, 1H, J=16,3 Гц); 7,24(д, 2H, J= 8,6 Гц); 7,26-7,37(м, 3H); 7,48(д, 2H, J=8,4 Гц); 7,62-7,66 (м, 1H); 7,98(д, 2H, J=8,3 Гц).
(б)
4-[4-(4'-Гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 660 мг (1,9 ммоль) полученного в примере 32 (а) сложного метилового эфира,
получают 610 мг (96%) 4-[4-(4'-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка бежевого цвета с т. пл. 235oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 6,27(д, 1H, J=16,2 Гц); 6,83(д, 2H, J=8,5 Гц); 7,00(д, 1H, J= 16,3 Гц); 7,07(д, 2H, J=8,5 Гц); 7,18-7,26(м, 3H); 7,39(д, 2H, J=8,3 Гц); 7,54-7,58(м, 1H); 7,88(д, 2H, J=8,3 Гц); 9,10 (с, 1H).
Пример 33: 4-[4-(4'-Метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир
4-[4-(4'-метоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты
В трехгорлую колбу объемом 100 мл и в токе азота, вводят 420 мг (1,2 ммоль) полученного в примере 32 (а) соединения, 20 мл
диметилформамида и 20 мл тетрагидрофурана. Охлаждают и добавляют маленькими порциями 49 мг (1,5 ммоль) 75%-ного в масле гидрида натрия. Реакционную среду перемешивают в течение 40 минут при комнатной
температуре, затем прикапывают раствор из 81 мкл (1,3 ммоль) метилиодида в 5 мл диметилформамида. Реакционную среду перемешивают в течение трех часов при комнатной температуре, затем добавляют воду,
экстрагируют диэтиловым эфиром, органическую фазу промывают водой, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Получают 470 мг (100%) целевого соединения в виде желтого
порошка с т. пл. 190oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,88 (с, 3H); 3,91(с, 3H); 6,35(д, 1H, J= 16,2 Гц); 7,00(д, 2H, J=8,7 Гц); 7,08(д, 1H, J=16,3 Гц); 7,28(д, 2H, J=8,6 Гц); 7,32-7,38 (м, 2H); 7,43-7,50(м, 1H); 7,47(д, 2H, J= 8,4 Гц); 7,63-7,70(м, 1H); 7,97(д, 2H, J=8,7 Гц).
(б)
4-[4-(4'-Метоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1 (е), исходя из 430 мг (1,2 ммоль) полученного в примере 33 (а) сложного метилового эфира,
получают 390 мг (94%) 4-[4-(4'-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде желтого порошка с т. пл.253oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д.: 3,88 (с, 3H); 6,35(д, 1H, J=16,2 Гц); 7,00(д, 2H, J=8,7 Гц); 7,08(д, 1H, J= 16,2 Гц); 7,28(д, 2H, J=8,8 Гц); 7,32-7,40(м, 3H); 7,47(д, 2H, J=8,3 Гц); 7,63-7,67 (м, 1H); 7,98(д, 2H, J=8,3 Гц).
Пример 34: 4-[4-(4'-Пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир
4-[4-(4'-пропоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты
Аналогично методике примера 33 (а), исходя из 420 мг (1,2 ммоль) полученного в примере 32 (а)соединения и 127 мкл (1,3
ммоль) н-пропилиодида, получают 460 мг (98%) целевого соединения в виде порошка бежевого цвета с т. пл. 110-113oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,07 (т, 3H, J=7,5 Гц); 1,85 (к, 2H, J=7,2 Гц); 3,91 (с, 3H); 3,99 (т, 2H, J=6,5 Гц); 6,34(д, 1H, J=16,2 Гц); 6,92-7,00 (м, 3H); 7,11(д, 1H, J=16,2 Гц); 7,29-7,35(м, 4H); 7,48(д, 2H, J=8,3 Гц); 7,62-7,69 (м, 1H); 7,97(д, 2H, J=8,4 Гц).
(б) 4-[4-(4'-Пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 460 мг (1,2
ммоль) полученного в примере 34 (а) сложного метилового эфира, получают 400 мг (90%) 4-[4-(4'-пропоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты в виде желтого порошка с т. пл. 235oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 1,07 (т, 3H, J=7,4 Гц); 1,85(м, 2H, J=7,0 Гц); 3,99 (т, 2H, J=6,5 Гц); 6,35(д, 1H, J=16,2 Гц); 6,99(д, 2H, J=8,7 Гц); 7,09(д, 1H, J=16,2 Гц); 7,27(д, 2H, J=8,6 Гц); 7,32-7,38(м, 3H); 7,47(д, 2H, J=8,3 Гц); 7,63- 7,66(м, 1H); 7,98(д, 2H, J=8,3 Гц).
Пример
35: 4-[4-(3'-Гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир 4-[4-(3'-гидроксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты
Аналогично методике
примера 32 (а), исходя из 1,39 г (3,5 ммоль) полученного в примере 32 (а) сложного метилового эфира, получают 1,17 г (95%) целевого соединения в виде порошка бежевого цвета с т. пл. 120-125o
C.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 5,02(с, 1H); 6,35(д, 1H, J= 16,2 Гц); 6,82-6,93(м, 3H); 7,10(д, 1H, J=16,2 Гц); 7,30-7,39(м, 4H); 7,48(д, 2H, J=8,5 Гц); 7,64-7,67 (м, 1H); 7,97(д, 2H, J=8,5 Гц).
(б) 4-[4-(3'-Гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]-бензойная кислота
Аналогично методике примера 1(е), исходя из
450 мг (1,3 ммоль) полученного в примере 35 (а)сложного метилового эфира, получают 420 мг (97%) 4-[4-(3'-гидроксибифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты в виде белого порошка с т. пл.
219oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 6,34(д, 1H, J=16,2 Гц); 6,80-6,91(м, 3H); 7,13(д, 1H, J= 16,3 Гц); 7,24-7,37 (м, 4H); 7,47(д, 2H, J=8,3 Гц); 7,63-7,65 (м, 1H); 7,99(д, 2H, J=8,3 Гц).
Пример 36: 4-[4-(3'-Метоксибифенил-2-ил)бут-3-ен-(E)-1- инил]бензойная кислота
(а)
Метиловый эфир 4-[4-(3'-метоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты
Аналогично методике примера 33 (а), исходя из 360 мг (1,0 ммоль) полученного в примере 35(а) соединения и
70 мкл (1,1 ммоль) метилиодида, получают 370 мг (100%) целевого соединения в виде порошка белого цвета с т. пл. 105oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,85(с, 3H); 3,91 (с, 3H); 6,35(д, 1H, J= 16,2 Гц); 6,89-6,96 (м, 3H); 7,10(д, 1H, J=16,2 Гц); 7,34-7,39(м, 4H); 7,48(д, 2H, J=8,4 Гц); 7,62-7,64 (м, 1H); 7,97(д, 2H, J=8,4 Гц).
(б) 4-[4-(3'-Метоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1 (е), исходя из 370 мг (1,0 ммоль) полученного в примере 36(а)сложного
метилового эфира, получают 330 мг (92%)4-[4-(3'-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка бежевого цвета с т. пл. 214oC.
1 H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 3,85 (с, 3H); 6,35(д, 1H, J=16,2 Гц); 6,88-6,97 (м, 3H); 7,08(д, 1H, J=16,2 Гц); 7,30-7,40(м, 4H); 7,47(д, 2H, J=8,3 Гц); 7,65-7,68 (м, 1H); 7,98(д, 2H, J=8,2 Гц).
Пример 37: 4-[4-(3'-Пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир
4-[4-(3'-пропоксибифенил-2-ил)бут-3- ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 33 (а), исходя из 360 мг (1,0 ммоль) полученного в примере 35(а) соединения и 109 мкл (1,1
ммоль) н-пропилиодида, получают 400 мг (99%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,82 (к, 2H, J=7,1 Гц); 3,91 (с, 3H); 3,97 (т, 3H, J=6,6 Гц); 6,34(д, 1H, J=16,2 Гц); 6,87-6,95(м, 3H); 7,11(д, 1H, J=16,2 Гц); 7,31-7,39 (м, 4H); 7,48(д, 2H, J=8,4 Гц); 7,64-7,67 (м, 1H); 7,97(д, 2H, J=8,4 Гц).
(б)
4-[4-(3'-Пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 400 мг (1,0 ммоль) полученного в примере 37(а) сложного метилового эфира,
получают 330 мг (86%) 4-[4-(3'-пропоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты в виде светло-желтого порошка с т. пл. 177oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 1,03 (т, 3H, J=7,4 Гц); 1,83(м, 2H, J=7,1 Гц); 3,97 (т, 2H, J=6,6 Гц); 6,35(д, 1H, J=16,2 Гц); 6,89-6,95(м, 3H); 7,10(д, 1H, J=16,2 Гц); 7,30-7,38(м, 4H); 7,47(д, 2H, J=8,2 Гц); 7,64-7,67 (м, 1H); 7,99(д, 2H, J= 8,3 Гц).
Пример 38: 4-[4-(4'-Метил-4-гидроксибифенил-2-ил)бут-3- ен-(E)-1-инил] бензойная
кислота
(а) Метиловый эфир 4-[4-(4'-метил-4-гидроксибифенил-2-ил)-бут- 3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 32 (а), исходя из 700 мг (1,7 ммоль) полученного
в примере 15(д) сложного метилового эфира, получают 630 мг (100%) целевого соединения в виде желтого порошка с т. пл. 205oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41(с, 3H); 3,91 (с, 3H); 6,30(д, 1H, J= 16,1 Гц); 6,89(дд, 1H, J=8,4/2,4 Гц); 7,14-7,30 (м, 6H); 7,47(д, 2H, J=8,4 Гц); 7,97(д, 2H, J=8,4 Гц); 8, 59 (с, 1H).
(б)
4-[4-(4'-Метил-4-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1 (е), исходя из 270 мг (0,7 ммоль) полученного в примере 38 (а) сложного метилового
эфира, получают 210 мг (85%) 4-[4-(4'-метил-4-гидроксибифенил-2-ил)бут-3-ен-(E) -1-инил]бензойной кислоты в виде желтого порошка с т. пл. 285oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 2,32 (с, 3H); 6,24(д, 1H, J=16,2 Гц); 6,77(дд, 1H, J= 8,3/2,2 Гц); 6,91(д, 1H, J= 16,2 Гц); 7,01-7,05(м, 2H); 7,09(д, 2H, J=8,1 Гц); 7,16(д, 2H, J=8,0 Гц); 7,39(д, 2H, J=8,3 Гц); 7,86(д, 2H, J=8,3 Гц); 9,29(уш.с, 1H).
Пример 39: 4-[4-(4'-Метил-4-метоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная
кислота
(а) Метиловый эфир 4-[4-(4'-метил-4-метоксибифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 33 (а), исходя из 180 мг (0,49 ммоль) полученного
в примере 38(а) соединения и 79 мг (0,56 ммоль) метилиодида, получают 140 мг (75%) целевого соединения в виде желтого порошка с т. пл. 111oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 3,88 (с, 3H); 3,91 (с, 3H); 6,34(д, 1H, J=16,2 Гц); 6,94(дд, 1H, J=8,5/2,6 Гц); 7,08(д, 1H, J=16,2 Гц); 7,15(д, 1H, J=2,6 Гц); 7,19-7,26 (м, 5H); 7, 47(д, 2H, J=8,3 Гц); 7,97(д, 2H, J=8,3 Гц).
(б) 4-[4-(4'-Метил-4-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 140 мг
(0,37 ммоль) полученного в примере 39 (а) сложного метилового эфира, получают 110 мг (81%) 4-[4-(4'-метил-4-метокси-бифенил-2-ил)бут- 3-ен-(E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл.
225oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,37(c, 3H); 3,85(c, 3H); 6,72(д, 1H, J=16,2 Гц); 6,95(д, 1H, J= 16,3 Гц); 7,01(дд, 1H, J=8,5/2,3 Гц); 7,16-7,30 (м, 5H); 7,38(д, 1H, J=2,3 Гц); 7,55(д, 2H, J=8,2 Гц); 7,92(д, 2H, J=8,2 Гц); 13,14(уш.с, 1H).
Пример 40:
4-[4-(4'-Метил-4-пропоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир 4-[4-(4'-метил-4-пропоксибифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 33 (а), исходя из 180 мг (0,49 ммоль) полученного в примере 38 (а) соединения и 95 мг (0,56 ммоль) н- пропилиодида, получают 131 мг (65%) целевого соединения в виде желтого
порошка с т. пл. 87oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,07 (т, 3H, J=7,5 Гц); 1,85(м, 2H, J=7,2 Гц); 2,42 (с, 3H); 3,91 (с, 3H); 3,99 (т, 2H, J=6,6 Гц); 6,33(д, 1H, J=16,2 Гц); 6,93(дд, 1H, J=8,5/2,6 Гц); 7,08(д, 1H, J=16,2 Гц); 7,15(д, 1H, J=2,5 Гц); 7,19-7,25(м, 5H); 7,47(д, 2H, J=8,3 Гц); 7,97(д, 2H, J=8,3 Гц).
(б)
4-[4-(4'-Метил-4-пропоксибифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 131 мг (0,32 ммоль) полученного в примере 40 (а) сложного метилового
эфира, получают 126 мг (100%) 4-[4-(4'-метил-4-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде желтого порошка с т. пл. 181oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,07 (т, 3H, J=7,4 Гц); 1,85(м, 2H, J=7,0 Гц); 2,42 (с, 3H); 3,99 (т, 2H, J=6,5 Гц); 6,34(д, 1H, J= 16,1 Гц); 6,93(дд, 1H, J=8,4/2,5 Гц); 7,10(д, 1H, J=16,2 Гц); 7,16(д, 1H, J= 2,4 Гц); 7,20-7,27(м, 5H); 7,50(д, 2H, J=8,3 Гц); 8,04(д, 2H, J=8,3 Гц).
Пример 41: 4-[4-(4'-Метил-5-гидроксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир 4-[4-(4'-метил-5-гидроксибифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 32 (а), исходя из 2,00 г (4,8 ммоль) полученного в примере
16(д) сложного метилового эфира, получают 1,57 г (88%) целевого соединения в виде желтого порошка с т. пл. 166oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,42(с, 3H); 3,91(с, 3H); 6,18(д, 1H, J=16,2 Гц); 6,80(д, 1H, J=2,5 Гц); 6,86(д, 1H, J=8,6 Гц); 7,02(д, 1H, J=16,2 Гц); 7,24 (с, 4H); 7,45(д, 2H, J=8, 4 Гц); 7,53(д, 1H, J=8,6 Гц); 7,95(д, 2H, J=8,4 Гц); 8,99(с, 1H).
(б) 4-[4-(4'-Метил-5-гидроксибифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойная кислота
Аналогично методике примера
1(е), исходя из 700 мг (1,9 ммоль) полученного в примере 41(а) сложного метилового эфира, получают 500 мг (75%) 4-[4-(4'-метил-5-гидроксибифенил-2-ил)бут-3-ен- (E)-1-инил] бензойной кислоты в виде
желтого порошка с т. пл. 230-232oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д.: 2,38 (с, 3H); 6,42(д, 1H, J=16,2 Гц); 6,67(д, 1H, J=2,4 Гц); 6,83(дд, 1H, J=8,6/2,4 Гц); 6,87(д, 1H, J=2,4 Гц); 7,19(д, 2H, J=8,0 Гц); 7,30(д, 2H, J=7,9 Гц); 7,52(д, 2H, J=8,3 Гц); 7,71(д, 1H, J=8,7 Гц); 7,90(д, 2H, J=8,3 Гц); 9, 95(уш.с, 1H); 13,10(уш.с, 1H).
Пример 42: 4-[4-(4'-Метил-5-метоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир
4-[4-(4'-метил-5-метоксибифенил-2-ил)- бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 33 (а), исходя из 400 мг (1,1 ммоль) полученного в примере 41(а) соединения и 185 мг
(1,3 ммоль) метилиодида, получают 420 мг (100%) целевого соединения в виде желтого порошка с т. пл. 130oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2, 43(с, 3H); 3,84(с, 3H); 3,91(с, 3H); 6,22(д, 1H, J=16,2 Гц); 6,82(д, 1H, J=2,7 Гц); 6,91(дд, 1H, J= 8,7/2,7 Гц); 7,03(д, 1H, J=16,2 Гц); 7,26(с, 4H); 7,46(д, 2H, J=8,4 Гц); 7,60(д, 1H, J=8,7 Гц); 7, 96(д, 2H, J=8,4 Гц).
(б) 4-[4-(4'-Метил-5-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1 (е), исходя из 420 мг (1,1 ммоль)
полученного в примере 42(а) сложного метилового эфира, получают 300 мг (74%) 4-[4-(4'-метил-5-метоксибифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл. 258-260oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,38(с, 3H); 3,82(с, 3H); 6,50(д, 1H, J=16,2 Гц); 6,82(д, 1H, J=2,5 Гц); 6,90(д, 1H, J= 16,3 Гц); 6, 99(дд, 1H, J=8,8/2,4 Гц); 7,23(д, 2H, J=8,0 Гц); 7,31(д, 2H, J= 7,9 Гц); 7,53(д, 2H, J=8,2 Гц); 7,81(д, 1H, J=8,8 Гц); 7,91(д, 2H,J=8,2 Гц); 13,12(уш.с, 1H).
Пример 43:
4-[4-(4'-Метил-5-пропоксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир 4-[4-(4'-метил-5-пропоксибифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 33 (а), исходя из 350 мг (0,95 ммоль) полученного в примере 41(а) соединения и 194 мг (1,1 ммоль) н- пропилиодида, получают 410 мг (100%) целевого соединения в виде желтых
кристаллов с т. пл. 107oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,04 (т, 3H, J=7,5 Гц); 1,82(м, 2H, J= 7,2 Гц); 2,43 (с, 3H); 3,91 (с, 3H); 3,96(т, 2H, J=6,6 Гц); 6,21(д, 1H, J=16,2 Гц); 6,82(д, 1H, J=2,6 Гц); 6,90(дд, 1H, J=8,6/2,6 Гц); 7,03(д, 1H, J=16,2 Гц); 7,25 (с, 3H); 7,45(д, 2H, J=8,4 Гц); 7,59(д, 1H, J= 8,7 Гц); 7,96 (д, 2H, J=9,4 Гц); 8, 02-8,05 (м, 1H).
(б) 4-[4-(4'-Метил-5-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 400 мг (0,97 ммоль) полученного
в примере 43 (а) сложного метилового эфира, получают 270 мг (71%) 4-[4-(4'-метил-5-пропоксибифенил- 2-ил)бут-3-ен-(E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл. 255-257oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 0,98 (т, 3H, J= 7,4 Гц); 1,73(м, 2H, J=7,1 Гц); 2,38 (с, 3H); 3,99 (т, 2H, J=6,5 Гц); 6,49 (д, 1H, J= 16,2 Гц); 6,80 (д, 1H, J=2,5 Гц); 6,90 (д, 1H, J=16,3 Гц); 6,98(дд, 1H, J=8,7/2,3 Гц); 7,23 (д, 2H, J=8,0 Гц); 7,31 (д, 2H, J=8,0 Гц); 7,52 (д, 2H, J=8,2 Гц); 7,79(д, 1H, J=8,8 Гц); 7,91(д, 2H, J=8,3 Гц).
Пример 44: 4-[4-(4'-Метил-6-гидроксибифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир 4-[4-(4'-метил-6-гидроксибифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной
кислоты
Аналогично методике примера 32 (а), исходя из 700 мг (1,7 ммоль) полученного в примере 17(е) сложного метилового эфира, получают 620 мг (99%) целевого соединения в виде порошка
бежевого цвета с т. пл. 110oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,46(с, 3H); 3,91(с, 3H); 4,92(с, 1H); 6,29(д, 1H, J=16,2 Гц); 6,77(д, 1H, J=16, 2 Гц); 6,95-6,99 (м, 1H); 7,20 (д, 2H, J= 8,0 Гц); 7,25- 7,27(м, 2H); 7,36(д, 2H, J-7,8 Гц); 7,45(д, 2H, J=8,4 Гц); 7,96 (д, 2H, J=8,4 Гц).
(б)
4-[4-(4'-Метил-6-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 350 мг (0,95 ммоль) полученного в примере 44 (а) сложного метилового
эфира, получают 300 мг (90%) 4-[4-(4'-метил-6-гидроксибифенил-2-ил)бут- 3-ен-(E)-1-инил]бензойной кислоты в виде порошка бежевого цвета с т. пл. 234-236oC.
1 H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37(с, 3H); 6,51(д, 1H, J= 16,3 Гц); 6,71(д, 1H, J=16,3 Гц); 6,92(д, 2H, J=7,8 Гц); 7,08(д, 1H, J=7,8 Гц); 7,16-7,31(м, 4H); 7,52(д, 2H, J=8,2 Гц); 7,90(д, 2H, J=8,2 Гц); 9,41(уш.с, 1H).
Пример 45: 4-[4-(4'-Метил-6-метоксибифенил-2-ил)бут-3-ен-(E)- 1-инил] бензойная кислота
(а) Метиловый эфир
4-[4-(4'-метил-6-метоксибифенил-2-ил)-бут- 3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 33 (а), исходя из 270 мг (0,73 ммоль) полученного в примере 44 (а) соединения и 50 мкл
(0,80 ммоль) метилиодида, получают 270 мг (98%) целевого соединения в виде порошка бежевого цвета ст. пл. 116-118oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,74(с, 3H); 3,91(с, 3H); 6,29(д, 1H, J=16,2 Гц); 6,84(д, 1H, J=16,2 Гц); 6,93(дд, 1H, J= 7,1/1,9 Гц); 7,14(д, 2H, J=8,0 Гц); 7,25-7,36(м, 4H); 7,45(д, 2H, J=8,4 Гц); 7,96(д, 2H, J=8,4 Гц).
(б) 4-[4-(4'-Метил-6-метоксибифенил-2-ил)бут-3-ен-(E) -1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 270 мг (0,72 ммоль) полученного в
примере 45(а) сложного метилового эфира, получают 240 мг (92%) 4-[4-(4'-метил-6-метоксибифенил-2-ил) бут-3-ен-(E)-1-инил]бензойной кислоты в виде бежевых чешуек с т. пл. 235-236oC.
1H-ЯМР-спектр (гексалейтеродиметилсульфоксид), δ в м.д.: 2,37 (с, 3H); 3,66 (с, 3H); 6,57(д, 1H, J=16,3 Гц); 6,67(д, 1H, J=16,3 Гц); 7,04-7,09(м, 3H); 7,25(д, 2H, J= 7,7 Гц); 7,33 - 7,47(м, 2H); 7,52(д, 2H, J=8,3 Гц); 7,89(д, 2H, J=8,3 Гц); 13,12(уш.с, 1H).
Пример 46: 4-[4-(4'-Трифторметилбифенил-2-ил)бут-3-ен-(E)-1- инил]бензойная кислота
(а) 4'-Трифторметилбифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 1,43 г (7,5 ммоль) 4-трифторметилбензолборной кислоты и 928 мг (5,0 ммоль) 2-бромбензальдегида,
получают 1,13 г (60%) целевого соединения в виде слегка желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 7,43(д, 1H, J=7,5 Гц); 7,51(д, 2H, J= 7,8 Гц); 7, 57(д, 1H, J=7,6. Гц); 7,67(д, 1H, J=7,5 Гц); 7,74(д, 2H, J=8,3 Гц); 8,06(д, 1H, J=7,7 Гц); 9, 96 (с, 1H).
(б) 2-((E)-2-Иодвинил)-4'-трифторметилбифенил
Аналогично методике
примера 1(г), исходя из 1,13 г (4,5 ммоль) полученного в примере 46(а) 4'-трифторметилбифенил-2-карбоксальдегида, получают 520 мг (31%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ),

(в) Метиловый эфир 4-[4-(4'-трифторметилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты
Аналогично методике примера 11 (е), путем взаимодействия 520 мг
(1,4 ммоль) полученного в примере 46(б) 2-((E)-(2-иодвинил)-4'- трифторметилбифенила с 245 мг (1,5 ммоль)метилового эфира 4- этинилбензойной кислоты, получают 200 мг (35%) целевого соединения в виде
желтого порошка с т. пл. 119oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,38(д, 1H, J= 16,2 Гц); 6,98(д, 1H, J= 16,2 Гц); 7,28- 7,50(м, 7H); 7,66-7,70 (м, 1H); 7,72(д, 2H, J=8,4 Гц); 7,97(д, 2H, J=8,2 Гц).
(г) 4-[4-(4'-Трифторметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера
1(е), исходя из 200 мг (0,49 ммоль) полученного в примере 46(в) сложного метилового эфира, получают 150 мг (77%) 4-[4-(4'-трифторметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде желтого
порошка с т. пл. 270oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 6,31(д, 1H, J=16,2 Гц); 6,88(д, 1H, J=16,2 Гц); 7,20-7,24(м, 1H); 7,31- 7,46(м, 6H); 7,59-7,62 (м, 1H); 7,64(д, 2H, J=8,3 Гц); 7,88(д, 2H, J=8,2 Гц).
Пример 47: 4-[4-(4'-Гидроксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная
кислота
(а) 4-Этоксиметоксиметилбромбензол
В трехгорлую колбу вводят 8,00 г (42,8 ммоль) 4-бром-бензилового спирта, 1,02 г тетрабутиламмонийгидросульфата и 200 мл толуола. Полученный
раствор охлаждают до температуры 0oC и прикапывают 11,9 мл (128,3 ммоль) этилхлорметилового простого эфира, затем добавляют 200 мл водного 10н. раствора гидроксида натрия. Реакционную среду
перемешивают в течение двух часов при температуре 0oC, затем выливают в смесь 1н. соляной кислоты с диэтиловым эфиром и экстрагируют диэтиловым эфиром. Органическую фазу декантируют и сушат
над сульфатом магния. После выпаривания растворителей получают 10,48 г (100%) целевого соединения в виде масла бежевого цвета.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,23 (т, 3H, J=7,0 Гц); 3,64 (к, 2H, J= 7,1 Гц); 4,55 (с, 2H); 4,75 (с, 2H); 7,23(д, 2H, J=8,3 Гц); 7,47(д, 2H, J=8,3 Гц).
(б) 4-Этоксиметоксиметилфенилборная кислота
Аналогично методике примера 2 (а), исходя из 10,58 г (43,2 ммоль) полученного в примере 47(а) 4-этоксиметокси-метилбромбензола, получают 9,00 г (99%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,26(т, 3H, J=7,0 Гц); 3,69 (к, 2H, J= 7,1 Гц); 4,71 (с, 2H); 4,81 (с, 2H); 7,49(д, 2H, J=7,7 Гц); 8,22(д, 2H, J=7,7 Гц).
(в) 4'-Этоксиметоксиметилбифенил-2-карбоксальдегид
Аналогично методике примера 21 (а), исходя из 9,00 г (42,8 ммоль) 4-этоксиметоксиметилфенилборной кислоты, полученной в примере
47(б), и 5,33 г (28,8 ммоль) 2-бром-бензальдегида, получают 6,04 г (77%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,26(т, 3H, J=7,1 Гц); 3,69 (к, 2H, J= 7,1 Гц); 4,69 (с, 2H); 4,82 (с, 2H); 7,38(д, 2H, J-8,1 Гц); 7,42-7,56 (м, 2H); 7,48(д, 2H, J= 8,4 Гц); 7,63(дд, 1H, J=7,4/1,4 Гц); 8,03(дд, 1H, J-7,7/1,2 Гц); 9,99 (с, 1H).
(г) 2-((E)-2-Иодвинил)-4'-этоксиметоксиметилбифенил
Аналогично методике примера 1(г), исходя из 3,50 г (12,9 ммоль) 4'-этоксиметоксметилбифенил-2-карбоксальдегида,
полученного в примере 47(в), получают 1,97 г (39%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,29 (т, 3H, J=7,0 Гц); 3, 69 (к, 2H, J= 7,0 Гц); 4,67 (с, 2H); 4,83 (с, 2H); 6,75(д, 1H, J=14,8 Гц); 7,28-7,49(м, 9H).
(д) Метиловый эфир 4-[4-(4'-этоксиметоксиметилбифенил-2-ил)бут-3- ен-(E)-1-инил]бензойной
кислоты
Аналогично методике примера 11 (е), путем взаимодействия 1,97 г (5,0 ммоль) 2-((E)-(2-иодвинил)-4'-этокси-метоксиметилбифенила, полученного в примере 47 (г), с 1,20 г (7,5 ммоль)
метилового эфира 4-этинилбензойной кислоты, получают 537 мг (25%) целевого соединения в виде порошка светло-желтого цвета с т. пл. 60oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,27(т, 3H, J=7,1 Гц); 3,70 (к, 2H, J-7,1 Гц); 3,91 (с, 3H); 4,68 (с, 2H); 4,84(с, 2H); 6,35(д, 1H, J= 16,2 Гц); 7,08(д, 1H, J=16,2 Гц); 7,29-7,50 (м, 7H); 7,48(д, 2H, J=8,3 Гц); 7,64-7,68 (м, 1H); 7,97(д, 2H, J=8,4 Гц).
(е) Метиловый эфир 4-[4-(4'-гидроксиметилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты
Аналогично методике
примера 32 (а), исходя из 387 мг (0,91 ммоль) полученного в примере 47(д) сложного метилового эфира, получают 310 мг (93%) целевого соединения в виде порошка бежевого цвета с т. пл. 142o
C.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,79(уш.с, 1H); 3,91 (с, 3H); 4,79 (с, 2H); 6,36(д, 1H, J=16,2 Гц); 7,07(д, 1H, J=16,2 Гц); 7,32 (м, 5H); 7,45-7,49 (м, 2H); 7,47(д, 2H, J=8,4 Гц); 7,62-7,68 (м, 1H); 7,97(д, 2H, J=8,4 Гц).
(ж) 4-[4-(4'-Гидроксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера
1 (е), исходя из 310 мг (0,84 ммоль) полученного в примере 47(е) сложного метилового эфира, получают 250 мг (84%) 4-[4-(4'-гидроксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде
порошка бежевого цвета с т. пл. 227oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 4,69 (с, 2H); 6,33(д, 1H, J=16,
2 Гц); 7,03(д, 1H, J=16,3 Гц); 7,27-7,36(м, 5H); 7,42-
7,46(м, 2H); 7,44(д, 2H, J=8,3 Гц); 7,62-7,66(м, 1H); 7,94(д, 2H, J=8,3 Гц).
Пример 48:
4-{4-[4'-(2-Гидроксиэтил)бифенил-2-ил]бут-3-ен-(E)-1- инил} бензойная кислота
(а) 2-(4-Бромфенил)этанол
В трехгорлую колбу объемом 2 л в токе азота вводят 15,00 г (81,9 ммоль)
4-бромстирола и 300 мл тетрагидрофурана. Охлаждают до температуры 0oC, прикапывают 482 мл (245,8 ммоль) 9-борабицикло[3.3.1]нонана (0,5М раствор в тетрагидрофуране), поддерживая температуру
ниже 5oC. Реакционную среду перемешивают в течение четырех часов при комнатной температуре, затем охлаждают до 0oC, прикапывают 25 мл (254,0 ммоль) водного 10н. раствора
гидроксида натрия, потом 209 мл (2,05 моль) 30%-ного (9,8М) пероксида водорода, поддерживая температуру ниже 10oC. Реакционную среду перемешивают в течение четырех часов при комнатной
температуре, затем добавляют воду, 1н., соляную кислоту, экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и
растворители выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью из 30% этилацетата и 70% гептана. После выпаривания растворителей получают 12,92
г (78%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,54 (с, 1H); 2,81(т, 2H, J-6,5 Гц); 3,83(т, 2H, J=6,4 Гц); 7,10(д, 2H, J=8,32 Гц); 7,43(д, 2H, J=8,3 Гц).
(б) 4-Этоксиметоксиэтилбромбензол
Аналогично методике примера 47 (а), исходя из 12,92 г (64,3 ммоль) полученного в примере 48 (а)
2-(4-бромфенил)-этанола, получают 16,65 г (100%) целевого соединения в виде желтого масла.
91H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,17 (т, 3H, J=7,0 Гц); 2,84 (т, 2H, J=6,7 Гц); 3,50 (к, 2H, J=7,1 Гц); 3,74 (т, 2H, J=6,7 Гц); 4,64 (с, 2H); 7,10(д, 2H, J=8,2 Гц); 7,40(д, 2H, J=8,2 Гц).
(в) 4-Этоксиметоксиэтилфенилборная кислота
Аналогично методике примера 2 (а), исходя из 17,31 г (66,8 ммоль) полученного в примере 48(б) 4-этоксиметокси-этилбромбензола, получают 14,07 г (94%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,19 (т, 3H, J=7,0 Гц); 2,99 (т, 2H, J=6,7 Гц); 3,54 (к, 2H, J=7,1 Гц); 3,84 (т, 2H, J=6,9 Гц); 4,70 (с, 2H); 7,38(д, 2H, J=7,9 Гц); 8,16(д, 2H, J=7,8 Гц).
(г) 4'-Этоксиметоксиэтилбифенил-2-карбоксальдегид
Аналогично методике примера 21(а), исходя из 14,00 г (67,0 ммоль) 4-этоксиметоксиэтилфенилборной
кислоты, полученной в примере 48(в), и 8,30 г (44,8 ммоль) 2-бром-бензальдегида, получают 11,68 г (93%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,18 (т, 3H, J=7,1 Гц); 2,98 (т, 2H, J= 6,8 Гц); 3,54 (к, 2H, J=7,1 Гц); 3,84(т, 2H, J=6,9 Гц); 4,70(с, 2H); 7,29-7,37(м, 4H); 7,44(д, 1H, J= 7,5 Гц); 7,49(д, 1H, J=7,6 Гц); 7,61(дд, 1H, J=7,4/1,4 Гц); 8,02(дд, 1H, J=7,7/1,3 Гц); 9,98(с, 1H).
(д) 2-((E)-2-Иодвинил)-4'-этоксиметоксиэтилбифенил
Аналогично методике примера 1(г), исходя из
3,50 г (12,6 ммоль) 4'-этоксиметоксиэтилбифенил-2-карбоксальдегида, полученного в примере 48 (г), получают 2,07 г (40%) целевого соединения в виде светло-желтого масла.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,19 (т, 3H, J=7,1 Гц); 2,97 (т, 2H, J=6,8 Гц); 3,54 (к, 2H, J=7,1 Гц); 3,85 (т, 2H, J=6,8 Гц); 4,71 (с, 2H); 6,73 (д, 1H, J=14,8 Гц); 7,23-7,49(м, 9H).
(е) Метиловый эфир 4-[4-(4'-этоксиметоксиэтилбифенил-2-ил)-бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 11(е), путем взаимодействия 2,07 г (5,1
ммоль) 2-((E)-(2-иодвинил)-4'-этоксиметоксиэтилбифенила, полученного в примере 48 (д), с 1,22 г (7,6 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 1,02 г (46%) целевого соединения в виде
порошка светложелтого цвета с т. пл. 68oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,19 (т, 3H, J=7,1 Гц); 2,98 (т, 2H, J= 6,9 Гц); 3,54 (к, 2H, J=7,1 Гц); 3,86(т, 2H, J=6,9 Гц); 3,91(с, 3H); 4,71(с, 2H); 6,35(д, 1H, J=16,2 Гц); 7,09(д, 1H, J=16,2 Гц); 7,30-7,38 (м, 7H); 7,48(д, 2H, J=8,3 Гц); 7,64-7,67(м, 1H); 7,97(д, 2H, J=8,3 Гц).
(ж) Метиловый эфир 4-{4-[4'-(2-гидроксиэтил)бифенил-2-ил]-бут-3- ен-(E)-1-инил}бензойной кислоты
Аналогично методике примера 32 (а), исходя из 670 мг (1,5 ммоль) полученного в примере 48(е)
сложного метилового эфира, получают 540 мг (93%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,47 (т, 1H, J=5,9 Гц); 2,96(т, 2H, J=6,5 Гц); 3,91 (с, 3H); 3,95 (к, 2H, J=6,4 Гц); 6,36(д, 1H, J= 16,2 Гц); 7,10(д, 1H, J=16,2 Гц); 7,32- 7,39(м, 7H); 7,48(д, 2H, J=8,4 Гц); 7,64-7,68(м, 1H); 7,97(д, 2H, J=8,4 Гц).
(з) 4-{4-[4'-(2-Гидроксиэтил)бифенил-2-ил]бут-3-ен-(E)-1-инил} бензойная кислота
Аналогично методике примера 1(е), исходя из 540 мг (1,4 ммоль) полученного в примере 48 (ж)
сложного метилового эфира, получают 470 мг (90%) 4-{ 4-[4'-(2-гидроксиэтил)бифенил-2-ил] бут-3-ен-(E)-1-инил} бензойной кислоты в виде порошка бежевого цвета с т. пл. 205oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,84 (т, 2H, J=6,8 Гц); 3,78 (т, 2H, J=6,8 Гц); 6,29(д, 1H, J=16,2 Гц); 7,00(д, 1H, J=16,3 Гц); 7, 19(д, 2H, J=8,1 Гц); 7,26(д, 2H, J=8,2 Гц); 7,27-7,30(м, 3H); 7,38(д, 2H, J=8,2 Гц); 7,57-7,60(м, 1H); 7,88(д, 2H, J=8,2 Гц).
Пример 49:
4-[4-(3'-Метилбифенил-3-ил)бут-3-ен-(E)-1-инил]бензойная кислота
(а) 3-Метилфенилборная кислота
Аналогично методике примера 2 (а), исходя из 9,07 г (53,0 ммоль) 3-метилбромбензола,
получают 7,12 г (99%) целевого соединения в виде твердого вещества белого цвета с т. пл. ниже 30oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,46(с, 3H); 7,28-7,55(м, 2H); 7,90-8,06(м, 2H).
(б) 3'-Метилбифенил-2-карбоксальдегид
Аналогично методике примера 21 (а), исходя из 7,12 г (52,4 ммоль) 3-метилфенилборной кислоты и 6,46
г (34,9 ммоль) 3-бромбензальдегида, получают 6,56 г (90%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,44 (с, 3H); 7,23(т, 1H, J= 7,2 Гц); 7,33-7,44(м, 3H); 7,60(т, 1H, J=7,6 Гц); 7,83-7,87(м, 2H); 8,09-8,10(м, 1H); 10,09(c, 1H).
(в) 2-((E)-2-Иодвинил)-3'-метилбифенил
Аналогично методике примера
1(г), исходя из 3,34 г (17,0 ммоль) полученного в примере 49(б) 3'-метилбифенил-3-карбоксальдегида, получают 5,47 г (100%) целевого соединения в виде желтого масла.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 6,90(д, 1H, J= 14,9 Гц); 7,16-7,52(м, 8H); 7,51(д, 1H, J=14,9 Гц).
(г) Метиловый эфир
4-[4-(3'-метилбифенил-3-ил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 5,47 г (17,1 ммоль) 3-((E)-(2-иодвинил)-3'-метилбифенила, полученного
в примере 49(в), с 2,46 г (15,4 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 3,09 г (57%) целевого соединения в виде желтого порошка с т. пл. 98-100oC.
H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,92(с, 3H); 6,46(д, 1H, J= 16,2 Гц); 7,15(д, 1H, J=16,2 Гц); 7,18-7,21(м, 1H); 7,31-7,45(м, 5H); 7,51-7,55(м, 1H); 7,53 (д, 2H, J=8,5 Гц); 7,62 (с, 1H); 8,00 (д, 2H, J=8,4 Гц).
(д) 4-[4-(3'-Метилбифенил-3-ил)бут-3-ен-(E)-1-инил]бензойная кислота
Аналогично методике примера 1(е), исходя из 1,25 г (ммоль)
полученного в примере 49(г) сложного метилового эфира, получают 1,15 г (96%) 4-[4-(3'-метилбифенил-3-ил)-бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка светло-желтого цвета с т. пл. 224-228oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,26(с, 3H); 6,69(д, 1H, J=16,3 Гц); 7,05-7,38(м, 3H); 7,41- 7,49(м, 5H); 7,47(д, 2H, J= 8,4 Гц); 7, 74(с, 1H); 7,83 (д, 2H, J=8,3 Гц); 13,00(уш.с, 1H).
Пример 50: 4-[4-(2-Пиридин-4-илфенил)бут-3-ен-(E)-1-инил] бензойная кислота
(a) 2 Пиридин-4-ил-бензальдегид
Аналогично методике примера 21 (а), исходя из 2,50 г (16,7 ммоль) 2-формилбензолборной кислоты и 2,16 г (11,1 ммоль) 4-бромпиридингидрохлорида, получают 1,98 г (97%) целевого соединения в виде порошка
белого цвета с т. пл. 59oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д. : 7,33(д, 2H, J=6,0 Гц); 7,43(дд, 1H, J=8,4/0,9 Гц); 7,59 (т, 1H, J=7,4 Гц); 7, 70(дт, 1H, J=7,5/1,4 Гц); 8,07(дд, 1H, J=7,6/1,1 Гц); 8,73(д, 2H, J=6,0 Гц); 9,99 (с, 1H).
(б) 4-[2-((E)-2-Иодвинил)фенил]пиридин
Аналогично методике примера 1(г), исходя из
1,98 г (10,8 ммоль) полученного в примере 50 (а) 2-пиридин-4-ил-бензальдегида, получают 490 мг (15%) целевого соединения в виде масла зеленого цвета.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 6,84(д, 1H, J=14,8 Гц); 7,28-7,51(м, 7H); 8,69(д, 2H, J=5,5 Гц).
(в) Метиловый эфир 4-[4-(2-пиридин-4-илфенил)бут-3-ен-(E)-1- инил]бензойной
кислоты
Аналогично методике примера 11(е), путем взаимодействия 490 мг (1,6 ммоль) полученного в примере 50(б) 4-[2-((E)-2-иодвинил)фенил] пиридина с 380 мг (2,4 ммоль) метилового эфира
4-этинилбензойной кислоты, получают 200 мг (37%) целевого соединения в виде порошка оранжевого цвета с т. пл. 120oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,38(д, 1H, J= 16,1 Гц); 6,99(д, 1H, J= 16,1 Гц); 7,29- 7,32(м, 3H); 7,39-7,44 (м, 2H); 7,49(д, 2H, J= 8,3 Гц); 7,67- 7,70(м, 1H); 7,98 (л, 2H, J=8,3 Гц); 8,70(д, 2H, J=5,2 Гц).
(г) 4-[4-(2-Пиридин-4-илфенил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 200 мг (0,6 ммоль) полученного в примере 50 (в) сложного
метилового эфира, получают 190 мг (99%) 4-[4-(2-пиридин-4-илфенил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка белого цвета с т. пл. 169-177oC.
1 H-ЯМР-спектр (пентадейтеропиридин), δ в м.д.: 6,70(д, 1H, J=16,2 Гц); 7,28-7,45(м, 4H); 7,64(д, 2H, J=8,0 Гц); 7,80-7,93 (м, 2H); 7,97-8,10 (м, 1H); 8,38(д, 2H, J=7,7 Гц); 8,77(м, 2H).
Пример 51: 4-[4-(2-Пиридин-3-илфенил)бут-3-ен-(E)-1-инил]- бензойная кислота
(а) 2 Пиридин-3-ил-бензальдегид
Аналогично методике примера 21(а), исходя из 2,50 г (16,7
ммоль) 2-формилбензолборной кислоты и 1,76 г (11,1 ммоль) 3-бромпиридина, получают 1,48 г (73%) целевого соединения в виде желтого порошка с т. пл. 54oC.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 7,4 0-7,45 (м, 2H); 7,58 (т, 1H, J= 7,5 Гц); 7,69(дд, 1H, J=7,4/1,5 Гц); 7,72(дд, 1H, J=7,9/2,0 Гц); 8,07(дд, 1H, J=7,8/1,3 Гц); 8,67-8,72(м, 2H); 9, 99(с, 1H).
(б) 3-[2-((E)-2-Иодвинил)фенил]пиридин
Аналогично методике примера 1(г), исходя из 1,48 г (8,1 ммоль) полученного в примере 51 (а) 2-пиридин-3-ил-бензальдегида,
получают 600 мг (24%)целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 6,82(д, 1H, J=14,8 Гц); 7,26-7,30(м, 2H); 7,34-7,42(м, 3H); 7,50-7,53(м, 1H); 7,63-7,67(м, 1H); 8,61-8,65(м, 2H).
(в) Метиловый эфир 4-[4-(2-пиридин-3-илфенил)бут-3-ен-(E)-1-инил] бензойной кислоты
Аналогично методике примера 11(е),
путем взаимодействия 600 мг (2,0 ммоль) полученного в примере 51(б) 3-[2-((E)-2-иодвинил) фенил] пиридина с 469 мг (2,9 ммоль) метилового эфира 4- этинилбензойной кислоты, получают 550 мг (83%)
целевого соединения в виде желтого порошка с т. пл. 85oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,91 (с, 3H); 6,38(д, 1H, J= 16,1 Гц); 7,00(д, 1H, J= 16,2 Гц); 7,30- 7,50(м, 6H); 7,68-7,71(м, 2H); 7,98(д, 2H, J=8,3 Гц); 8,65(д, 2H, J=8,3 Гц).
(г) 4-[4-(2-Пиридин-3-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота
В колбу
вводят 550 мг (1,6 ммоль) полученного в примере 51 (в) сложного метилового эфира, 10 мл метанола и 10 мл тетрагидрофурана. Добавляют 1,6 мл (16,0 ммоль) 10н. раствора гидроксида натрия в метаноле и
кипятят с обратным холодильником в течение одного часа. Выпаривают досуха, добавляют этилацетат, подкисляют до pH 5 с помощью лимонной кислоты, осадок отфильтровывают, промывают водой, сушат в
вакуумном сушильном шкафу. Получают 290 мг 4-[4-(2-пиридин-3-илфенил)бут-3-ен- (E)-1-инил]бензойной кислоты в виде твердого вещества бежевого цвета с т. пл. 264oC.
1H-ЯМР-спектр (пентадейтеропиридин), δ в м.д.; 6,68(д, 1H, J=16,1 Гц); 7,23-7,34 (м, 4H); 7,38-7,44 (м, 2H); 7,58-7,70(м, 1H); 7,61(д, 2H, J=8,3 Гц); 7,82-7,85 (м, 1H); 8,36(д, 2H, J=8,2 Гц); 8,72- 8,74(м, 1H); 8,84(д, 1H, J=2,0 Гц).
Пример 52: 4-[4-(3-Метоксиметокси-4'метилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойная кислота
(а)
2-Формил-3-метоксифенилтрифторметансульфонат
Аналогично методике примера 12(б), исходя из 11,00 г (72,3 ммоль) 2-гидрокси-6-метоксибензальдегида, получают 15,00 г (73%) целевого соединения в
виде порошка бежевого цвета с т. пл. 65-67oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,98 (с, 3H); 6,90 (д, 1H, J=8,3 Гц); 7,07(д, 1H, J=8,6 Гц); 7,60 (т, 1H, J=8,5 Гц); 10,46(c, 1H).
(б) 3-Метокси-4'-метилбифенил-2-карбоксальдегид
Аналогично методике примера 12 (в), исходя из 8,30 г (61,3 ммоль) 4-метилфенилборной кислоты
и 14,50 г (51,0 ммоль) полученного в примере 52(а) трифлата, получают 10,80 г (94%) целевого соединения в виде кристаллов светло-желтого цвета с т. пл. 89-91oC.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,40 (с, 3H); 3,95(с, 3H); 6,98(т, 2H, J=7,3 Гц); 7,22(с, 4H); 7,51(т, 1H, J=7,7 Гц); 10,07 (с, 1H).
(в)
3-Гидрокси-4'-метилбифенил-2-карбоксальдегид
Аналогично методике примера 17 (в), исходя из 10,00 г (44,2 ммоль) 3-метокси-4'-метилбифенил-2-карбоксальдегида, полученного в примере 52(б),
получают 7,00 г (75%) целевого соединения в виде оранжевого порошка с т. пл. 52- 53oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 6,87(дд, 1H, J= 7,7/0,8 Гц); 6,97(д, 1H, J=8,5 Гц); 7,26(с, 4H); 7,51(т, 1H, J-7,6 Гц); 9,85(с, 1H).
(г) 3-Метоксиметокси-4'-метилбифенил-2-карбоксальдегид
Аналогично методике примера
28 (а), исходя из 7,00 г (33,0 ммоль), полученного в примере 52 (в) фенола и 3,18 г (40,0 ммоль)м етилхлорметилового простого эфира, получают 7,95 г (94%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,40(с, 3H); 3,54 (с, 3H); 5,31(с, 2H); 7,02(д, 1H, J=7,6 Гц); 7,18- 7,26(м, 5H); 7,49(т, 1H, J=7,8 Гц); 10,11(с, 1H).
(д) 2-((E)-2-Иодвинил)-3-метоксиметокси-4'-метилбифенил
Аналогично методике примера 1(г), исходя из 7,95 г (31,0 ммоль), полученного в примере 52 (г)
3-метоксиметокси-4'-метилбифенил-2- карбоксальдегида, получают 1,30 г (11%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2, 41 (с, 3H); 3,51(с, 3H); 5,25(с, 2H); 6,87(д, 1H, J= 14,8 Гц); 6,93(дд, 1H, J=7,5/1,2 Гц); 7,10-7,35(м, 5H); 9,84(с, 1H).
(е) Метиловый эфир
4-[4-(3-метоксиметокси-4'метилбифенил-2- ил)бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 1,30 г (3,4 ммоль)
2-((E)-2-иодвинил)-3-метоксиметокси-4'-метилбифенила, полученного в примере 52 (д), с 650 мг (4,1 ммоль) метилового эфира 4-этинилбензойной кислоты, получают 750 мг (53%) целевого соединения в виде
желтого порошка, соответствующего смеси Z/Е-изомеров.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 3,54(с, 3H); 3,91(с, 3H); 5,30(с, 2H); 6,57(д, 1H, J=16,5 Гц); 7,48 (д, 1H, J=16,2 Гц); 7,18-7,26(м, 7H); 7,46(д, 2H, J=8,3 Гц); 7,96 (д, 2H, J=8,4 Гц).
(ж) 4-[4-(3-Метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная
кислота
Аналогично методике примера 1 (е), исходя из 200 мг (0,48 ммоль) полученного в примере 52 (е) сложного метилового эфира, получают 152 мг (80%)
4-[4-(3-метоксиметокси-4'-метилбифенил-2-ил)бут- 3-ен-(E)-1-инил] бензойной кислоты в виде желтого порошка с т. пл. 160-162oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37(с, 3H); 3,44(с, 3H); 5,36(с, 2H); 6,57(д, 1H, J=16,5 Гц); 6,89 (д, 1H, J=16,3 Гц); 6,91 (д, 1H, J=7,8 Гц); 7,18-7,36(м, 6H); 7,53(д, 2H, J=8,2 Гц); 7,90(д, 2H, J=8,3 Гц); 13,08(уш.с, 1H).
Пример 53: 4-[4-(3-Гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир
4-[4-(3-гидрокси-4'метилбифенил-2-ил)-бут-3-ен- (E)-1-инил]бензойной кислоты
Аналогично методике примера 32 (а), исходя из 500 мг (1,2 ммоль) полученного в примере 52(е) сложного метилового
эфира, получают 350 мг (80%) целевого соединения в виде порошка бежевого цвета, образованного смесью (Z)- и (E)-изомеров.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д. [(E)-изомер]: 2,42(с, 3H); 3,91(с, 3H); 5,38(с, 1H); 6,53(д, 1H, J=16,6 Гц); 6,88-6,95(м, 3H); 7,20-7,26(м, 5H); 7,47(д, 2H, J=8,3 Гц); 7,97(д, 2H, J=8,4 Гц).
(б)
4-[4-(3-Гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 320 мг (0,87 ммоль) смеси сложных метиловых эфиров, полученных в
примере 53 (а), получают 250 мг (80%) 4-[4-(3-гидрокси-4'-метилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл. 221-223oC.
1 H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,37(с, 3H); 6,70(д, 1H, J= 8,3 Гц); 6,75(д, 1H, J=16,6 Гц); 6,87(д, 1H, J=16,4 Гц); 6,93(д, 1H, J=7,8 Гц); 7,16(д, 1H, J=7,6 Гц); 7,18(д, 2H, J=8,0 Гц); 7,28(д, 2H, J=8,0 Гц); 7,51(д, 2H, J=8,3 Гц); 7,89(д, 2H, J=8,3 Гц); 10,39(с, 1H).
Пример 54: 4-[4-(3-Метокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная
кислота
(а) 2-((E)-2-Иодвинил)-3-метокси-4'- метилбифенил
Аналогично методике примера 1(г), исходя из 4,43 г (19,6 ммоль) полученного в примере 52(б) соединения, получают 3,61 г
(53%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,41(с, 3H); 3,89(с, 3H); 6,86-6,97(м, 3H); 7,14-7,41(м, 6H).
(б) Метиловый эфир 4-[4-(3-метокси-4'метилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 3,61 г (10,3 ммоль)
полученного в примере 54 (а)соединения, с 1,80 г (11,3 ммоль)метилового эфира 4-этинилбензойной кислоты, получают 900 мг (23%) целевого соединения в виде желтого порошка с т. пл. 124-126o
C.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 3,91 (с, 3H); 3,93 (с, 3H); 6,90 (д, 1H, J=7,4 Гц); 6,93 (д, 1H, J=7,1 Гц); 7,00 (д, 1H, J= 16,5 Гц); 7, 24-7,30 (м, 5H); 7,45 (д, 2H, J=8,4 Гц); 7,95 (д, 2H, J=8,4 Гц).
(в) 4-[4-(3-Метокси-4'-метилбифенил-2-ил)бут-3-ен-(E) -1-инил]бензойная кислота
Аналогично методике примера
1(е), исходя из 900 мг (2,3 ммоль) полученного в примере 54(б) сложного метилового эфира, получают 700 мг (82%) 4-[4-(3-метокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде
порошка светло-желтого цвета с т. пл. 200-202oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеролиметилсульфоксида), δ в м.д.: 2,51 (с, 3H); 4,03 (с, 3H); 6,71(д, 1H, J=16,5 Гц); 7,07 (д, 1H, J=16,4 Гц); 6,98(д, 1H, J=7,6 Гц); 7,03(д, 1H, J=7,9 Гц); 7,32-7,40 (м, 5H); 7,53(д, 2H, J=8,3 Гц); 8,05(д, 2H, J=8,3 Гц).
Пример 55:
4-[4-(4'-Этоксиметоксиметилбифенил-2-ил)бут-3-ен-(E)- 1-инил] бензойная кислота
Аналогично примеру 1(е), исходя из 150 мг (0,35 ммоль) полученного в примере 47 (д) сложного метилового эфира,
получают 137 мг (94%) 4-[4-(4'-этоксиметоксиметилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты в виде порошка бежевого цвета с т. пл. 183oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 1,27 (т, 3H, J=7,1 Гц); 3,70 (к, 2H, J=7,1 Гц); 4,68 (с, 2H); 4,83 (с, 2H); 6,36 (д, 1H, J=16,2 Гц); 7,07 (д, 1H, J=16,2 Гц); 7,29-7,47 (м, 7H); 7,47 (д, 2H, J=8,3 Гц); 7,65-7,68 (м, 1H); 7,99 (д, 2H, J=8,3 Гц).
Пример 56: Метиловый эфир
4-[4-(4'-этоксиметоксиметил-бифенил-2- ил)бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1(е), исходя из 350 мг (0,79 ммоль) полученного в примере 48(е) сложного метилового
эфира, получают 320 мг (94%) 4-[4-(4'-этоксиметоксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка бежевого цвета с т. пл. 135oC.
1 H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 1,19 (т, 3H, J=7,1 Гц); 2,99(т, 2H, J=6,8 Гц); 3,55 (к, 2H, J= 7,1 Гц); 3,87 (т, 2H, J=6,8 Гц); 4,72(c, 2H); 6,36(д, 1H, J=16,2 Гц); 7,11(д, 1H, J= 16,2 Гц); 7,25-7,38(м, 7H); 7,50(д, 2H, J=8,2 Гц); 7,64-7,68(м, 1H); 8,04(д, 2H, J=8,2 Гц).
Пример 57:
2-Метил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
(а) Метиловый эфир 4-триметилсиланилэтинил-2-метилбензойной кислоты
Аналогично методике примера 1(а), исходя
из 4,00 г (18,4 ммоль) метилового эфира 4-бром-2-метилбензойной кислоты, получают 3,54 г (100%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,26(с, 9H); 2,56(с, 3H); 3,88(с, 3H); 7,31-7,35(м, 2H); 7,85 (д, 1H, J-8,0 Гц).
(б) Метиловый эфир 4-этинил-2-метилбензойной кислоты
В трехгорлой колбе
объемом 500 мл смешивают 3,29 г (17,6 ммоль) полученного в примере 57 (а) соединения с 50 мл тетрагидрофурана и прикапывают 19,3 мл (19,3 ммоль) 1,0М раствора тетрабутиламмонийфторида в
тетрагидрофуране. Перемешивают в течение одного часа при комнатной температуре, реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом
магния и выпаривают. Получают 1,20 г (59%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,58 (с, 3H); 3,18(с, 1H); 3,89(с, 3H); 7,34-7,42(м, 2H); 7,87 (д, 1H, J=7,9 Гц).
(в) Метиловый эфир 2-метил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)- 1-инил]бензойной кислоты
Аналогично методике примера 1 (д),
путем взаимодействия 1,20 г (10,4 ммоль) полученного в примере 57(б) соединения с 3,67 г (11,4 ммоль) полученного в примере 2 (г) соединения, получают 900 мг (23%) целевого соединения в виде порошка
белого цвета с т. пл. 105oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 2,57 (с, 3H); 3,88 (с, 3H); 6,34 (д, 1H, J=16,2 Гц); 7,09 (д, 1H, J=16,2 Гц); 7,26-7,38 (м, 9H); 7,63-7,67 (м, 1H); 7,86 (д, 1H, J=8,0 Гц).
(г) 2-Метил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике
примера 1 (е), исходя из 900 мг (2,4 ммоль) полученного в примере 57 (в) сложного метилового эфира, получают 800 мг (92%) 2-метил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в
виде порошка белого цвета с т. пл. 187oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,43(с, 3H); 2,59(с, 3H); 6, 34 (д, 1H, J=16,2 Гц); 7,08 (д, 1H, J= 16,2 Гц); 7,26-7,37 (м, 6H); 7,34 (д, 2H, J=7,9 Гц); 7,63-7,67 (м, 1H); 7,91 (д, 2H, J=7,8 Гц).
Пример 58:
2-Гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
(а) Метиловый эфир 4-триметилсиланилэтинил-2-гидроксибензойной кислоты
Аналогично методике примера 1(а),
исходя из 4,00 г (14,4 ммоль) метилового эфира 4-иод-2-гидроксибензойной кислоты, получают 3,07 г (86%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,06(с, 9H); 3,75(с, 3H); 6,76 (дд, 1H, J=8,2/1,5 Гц); 6,87 (д, 1H, J=1,4 Гц); 7,56 (д, 1H, J=8,2 Гц); 10,53 (с, 1H).
(б) Метиловый эфир
4-этинил-2-гидроксибензойной кислоты
Аналогично методике примера 57(б), исходя из 3,07 г (12,4 ммоль) полученного в примере 58 (а) соединения, получают 2,48 г (100%) целевого соединения в
виде порошка бежевого цвета с т. пл. 62oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,21(с, 1H); 3,96(с, 3H); 6,98 (дд, 1H, J=8,2/1,5 Гц); 7,10 (д, 1H, J=1,3 Гц); 7,78 (д, 1H, J=8,2 Гц); 10,76(с, 1H).
(в) Метиловый эфир 2-гидрокси-4-[4-(4'-метилбифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера
1 (д), путем взаимодействия 2,29 г (13,0 ммоль) полученного в примере 58(б) соединения с 4,59 г (14,3 ммоль) полученного в примере 2 (г) соединения, получают 1,24 г (26%) целевого соединения в виде
желтого порошка с т. пл. 96oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,94 (с, 3H); 6,33 (д, 1H, J= 16,2 Гц); 6,92 (дд, 1H, J=8,2/1,5 Гц); 7,03 (д, 1H, J=1,3 Гц); 7,11 (д, 1H, J=16,2 Гц); 7,22-7,29(м, 4H); 7,31-7,38(м, 3H); 7,63-7,66(м, 1H); 7,75 (д, 1H, J=8,2 Гц); 10,74 (с, 1H).
(г)
2-Гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 1,24 г (3,4 ммоль) полученного в примере 58(в) сложного метилового
эфира, получают 910 мг (76%) 2-Гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл. 211oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д.: 2,43 (с, 3H); 6,34 (д, 1H, J=16,2 Гц); 6,90 (дд, 1H, J= 8,2/1,5 Гц); 6,98 (д, 1H, J=1,3 Гц); 7,09 (д, 1H, J=16,3 Гц); 7, 22-7,38(м, 7H); 7,63-7,67(м, 1H); 7,79 (д, 1H, J=8,1 Гц); 11,29(уш.с, 1H).
Пример 59: 6-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]- пиридин-3-карбоновая кислота
(а)
Этиловый эфир 6-триметилсиланилэтинилпиридин-3-карбоновой кислоты
Аналогично методике примера 1(а), исходя из 4,00 г (14,4 ммоль) этилового эфира 6-иодпиридин-3-карбоновой кислоты, получают 3,
29 г (92%) целевого соединения в виде порошка бежевого цвета с т. пл. 55oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,10 (с, 9H); 1,22 (т, 2H, J= 7,1 Гц); 4,23 (к, 3H, J=7,1 Гц); 7,33 (д, 1H, J=8,2 Гц); 8,06 (дд, 1H, J= 8,1/2,1 Гц); 8,97 (д, 1H, J=2,1 Гц).
(б) Метиловый эфир 6-этинилпиридин-3-карбоновой кислоты
Аналогично
методике примера 57(б), исходя из 3,29 г (13,3 ммоль) полученного в примере 59(а) соединения, получают 1,00 г (43%) целевого соединения в виде чешуек бежевого цвета с т. пл. 35oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м. д.: 1,42 (т, 3H, J=7,1 Гц); 3,33(с, 1H); 4,42 (к, 2H, J=7,2 Гц); 7,56 (д, 1H, J=8,1 Гц); 8,28 (дд, 1H, J=8,1/2,1 Гц); 9,18 (д, 1H, J=2,0 Гц).
(в) Метиловый эфир 6-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил]пиридин-3-карбоновой кислоты
Аналогично методике примера 1 (д), путем взаимодействия 920 мг (5,3
ммоль) полученного в примере 59(б) соединения с 1,86 г (5,8 ммоль) полученного в примере 2 (г) соединения, получают 680 мг (35%) целевого соединения в виде порошка бежевого цвета с т. пл. 75-80oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,41 (т, 3H, J=7,1 Гц); 2,43 (с, 3H); 4,41 (к, 2H, J=7,1 Гц); 6,35 (д, 1H, J=16,2 Гц); 7,19-7,26(м, 5H); 7,34-7, 39(м, 3H); 7,47 (д, 1H, J=8,2 Гц); 7,64-7,68 (м, 1H); 8,23 (дд, 1H, J=8,2/2,1 Гц); 9,15 (д, 1H, J=1,6 Гц).
(г) 6-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]пиридин-3- карбоновая
кислота
Аналогично методике примера 1(е), исходя из 680 мг (1,9 ммоль) полученного в примере 60 (в) сложного метилового эфира, получают 530 мг
(84%)6-[4-(4'-метилбифенил-2-ил)-бут-3-ен-(E)- 1-инил] пиридин-3-карбоновой кислоты в виде желтого порошка с т. пл. 207oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д.: 2,25 (с, 3H); 6,18(д, 1H, J=16,2 Гц); 6,99-7,21(м, 7H); 7,48-7,51(м, 1H); 8,06 (дд, 1H, J=8,1/2,0 Гц); 8,96 (д, 1H, J=1,3 Гц).
Пример 60: 5-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]- пиридин-2-карбоновая кислота
(а) Метиловый эфир 6-триметилсиланилэтинилпиридин-2-карбоновой кислоты
Аналогично методике
примера 1(а), исходя из 7,00 г (26,6 ммоль)метилового эфира 6-иодпиридин-2-карбоновой кислоты, получают 4,25 г (68%) целевого соединения в виде оранжевого порошка с т. пл. 45oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,28 (с, 9H); 4,01(с, 3H); 7,87 (дд, 1H, J=8,1/2,0 Гц); 8,08 (д, 1H, J=8,1 Гц); 8,77 (д, 1H, J=1,3 Гц).
(б)
Метиловый эфир 6-этинилпиридин-2-карбоновой кислоты
Аналогично метидике примера 57(б), исходя из 2,25 г (9,6 ммоль) полученного в примере 60(а) соединения, получают 380 мг (24%) целевого
соединения в виде желтого порошка с т. пл. 40-45oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,40(с, 1H); 4,02(с, 3H); 7,93 (дд, 1H, J=8,1/2,0 Гц); 8, 12(д, 1H, J=8,1 Гц); 8,83 (д, 1H, J=1,9 Гц).
(в) Метиловый эфир 5-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)- 1-инил]пиридин-2-карбоновой кислоты
Аналогично методике примера 1(д),
путем взаимодействия полученного в примере 60(б) соединения с 568 мг (1,8 ммоль) полученного в примере 2(г) соединения, получают 130 мг (23%) целевого соединения в виде порошка бежевого цвета с т. пл.
140oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,44(с, 3H); 4,01(с, 3H); 6,35 (д, 1H, J=16,3 Гц); 7,17 (д, 1H, J=16,2 Гц); 7,26-7,38(м, 6H); 7,62-7, 75(м, 2H); 7,84 (дд, 1H, J=8,2/1,2 Гц); 8,08 (д, 1H, J=8,1 Гц); 8,75 (д, 1H, J=1,2 Гц).
(г) 5-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил] пиридин-2-карбоновая кислота
Аналогично методике примера 1(е), исходя из 130 мг (0,37 ммоль) полученного в примере 60 (в) сложного метилового эфира, получают 90 мг (72%)5-[4-(4'- метилбифенил-2-ил)бут-3-ен-(E)-1-инил]
пиридин-2-карбоновой кислоты в виде порошка бежевого цвета с т. пл. 190oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,44 (с, 3H); 6,36 (д, 1H, J=16,2 Гц); 7,19(д, 1H, J=16,3 Гц); 7,22-7,40(м, 7H); 7,65-7,68(м, 1H); 7,92 (дд, 1H, J=8,1/1,8 Гц); 8,16 (д, 1H, J=8,1 Гц); 8, 63 (с, 1H).
Пример 61:
5-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]- тиофен-3-карбоновая кислота
(а) Метиловый эфир тиофен-3-карбоновой кислоты
В трехгорлую колбу объемом 2 л и в токе азота вводят 19,85
г (154,9 ммоль) тиофен-2-карбоновой кислоты и 700 мл метанола, прикапывают 7 мл концентрированной серной кислоты и кипятят с обратным холодильником в течение 16 часов. Охлаждают, выпаривают метанол,
добавляют воду, экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Получают 20,26 г
(92%) целевого соединения в виде светло-желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,87 (с, 3H); 7,30 (дд, 1H, J=3,1/5,0 Гц); 7,53 (дд, 1H, J=1,1/5,1 Гц); 8,10 (дд, 1H, J=1,1/3,0 Гц).
(б) Метиловый эфир 5-бромтиофен-3-карбоновой кислоты
В трехгорлую колбу объемом 2 л в токе азота вводят 24,74 г (174,0 ммоль) полученного в
примере 61 (а) соединения и 410 мл дихлорметана. Охлаждают до температуры 10oC и добавляют маленькими порциями 51,04 г (382,8 ммоль) хлорида алюминия. Среду затем нагревают до температуры
35oC и прикапывают 30,60 г брома в виде раствора в 30 мл дихлорметана. Достигнутое кипение с обратным холодильником продолжается в течение часа, затем реакционную среду охлаждают и выливают
в смесь воды с диэтиловым эфиром. Продукт экстрагируют диэтиловым эфиром, органическую фазу промывают водой до нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители
выпаривают. Полученный остаток очищают путем колоночной хроматографии на диоксиде кремния, элюируя смесью из 20% дихлорметана и 80% гептана. После выпаривания растворителей получают 27,42 г (71%)
целевого соединения в виде кристаллов светло-желтого цвета с т. пл. ниже 40oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,86 (с, 3H); 7,47 (д, 1H, J=1,5 Гц); 7,99 (д, 1H, J=1,4 Гц).
(в) Метиловый эфир 5-триметилсиланилэтинилтиофен-3-карбоновой кислоты
Аналогично методике примера 1(а), исходя из 27,42 г (124,0 ммоль)
полученного в примере 61(б) соединения, получают 16,70 г (66%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,25(с, 9H); 3, 85(с, 3H); 7,60 (д, 1H, J=1,2 Гц); 7,96 (д, 1H, J=1,2 Гц).
(г) Метиловый эфир 5-этинилтиофен-3-карбоновой кислоты
Аналогично методике примера 57(б), исходя из 16,70 г (8,5
ммоль) полученного в примере 61 (в) соединения, получают 3,67 г (27%) целевого соединения в виде желтого порошка с т. пл. 42-45oC.
1H-ЯМР-спектр (дейтерохлороформ),

(д) Метиловый эфир 5-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил]тиофен-3-карбоновой кислоты
Аналогично методике примера 1 (д), путем взаимодействия 1,00 г (6,0 ммоль)
полученного в примере 61(г) соединения с 2,12 г (6,0 ммоль) полученного в примере 2 (г) соединения, получают 1,50 г (69%) целевого соединения в виде желтого масла.
1 H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,85(с, 3H); 6,32 (д, 1H, J=16,2 Гц); 7,07 (д, 1H, J=16,2 Гц); 7,24-7,29(м, 4H); 7,32-7,41(м, 3H); 7,55 (д, 1H, J=1,2 Гц); 7,62-7,65 (м, 1H); 7,97 (д, 1H, J=1,2 Гц).
(е) 5-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил] тиофен-3- карбоновая кислота
Аналогично методике примера 1(е), исходя из 1,50 г (4,2 ммоль)
полученного в примере 61 (д) сложного метилового эфира, получают 170 мг (12%) 5-[4-(4'-метилбифенил-2-ил)-бут-3-ен-(E)-1- инил]тиофен-3-карбоновой кислоты в виде порошка бежевого цвета с т. пл.
156oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,43 (с, 3H); 6,32 (д, 1H, J=16,2 Гц); 7,08(д, 1H, J=16,3 Гц); 7,25-7,36(м, 6H); 7,57(с, 1H); 7,61-7,66 (м, 1H); 8,09(с, 1H).
Пример 62: 3-Метоксиметокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен- (E)-1-инил]бензойная кислота
(а)
3-Гидрокси-4-иодбензойная кислота
В трехгорлую колбу объемом 1 л в токе азота вводят 25,00 г (180,00 ммоль) 3-гидроксибензойной кислоты, 7,20 г (180,0 ммоль) гидроксида натрия в виде таблеток,
27,13 г (180,0 ммоль) иодида натрия и 500 мл метанола. Охлаждают до 0oC и прикапывают в течение часа пятнадцати минут 374,30 г (180,0 ммоль) водного раствора гипохлорита натрия.
Реакционную среду перемешивают в течение двух часов при 0oC, затем добавляют раствор тиосульфата натрия, подкисляют до pH 5, экстрагируют диэтиловым эфиром, органическую фазу промывают до
нейтрального значения pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Получают 43,80 г (92%) целевого соединения в виде порошка бежевого цвета с т. пл. 198oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 7,13(дд, 1H, J= 8,1/1,9 Гц); 7,43(д, 1H, J=1,8 Гц); 7,80(д, 1H, J=8,1 Гц); 10,69(уш.с, 1H); 12,98(уш.с, 1H).
(б) Метиловый эфир 3-гидрокси-4-иодбензойной кислоты
Аналогично методике примера 61 (а), исходя из 43,80 г (166,0 ммоль) полученной в примере 62 (а) кислоты, получают 43,54 г
(94%) метилового эфира 3-гидрокси-4-иодбензойной кислоты в виде порошка бежевого цвета с т. пл. 153oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,89(с, 3H); 7,25(дд, 1H, J= 8,2/1,9 Гц); 7,58(д, 1H, J=1,9 Гц); 7,77(д, 1H, J=8,2 Гц); 8,79(уш.с, 1H).
(в) Метиловый эфир 3-метоксиметокси-4-иодбензойной кислоты
Аналогично методике
примера 28(а), исходя из 20,00 г (71,9 ммоль) метилового эфира 3-гидрокси-4-иодбензойной кислоты и 6,0 мл (79,1 ммоль) метилхлорметилового простого эфира, получают 12,38 г (53%) целевого соединения в
виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,52(с, 3H); 3,91(с, 3H); 5,30(с, 2H); 7,41(дд, 1H, J=8,2/1,8 Гц); 7,66(д, 1H, J=1,8 Гц); 7,86(д, 1H, J=8,2 Гц).
(г) Метиловый эфир 4-триметилсиланилэтинил-3-метокси-метоксибензойной кислоты
Аналогично методике примера 1(а), исходя из 12,38 г (38,4 ммоль) полученного в
примере 62 (в)соединения, получают 11,73 г (100%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,08(с, 9H); 3,35(с, 3H); 3, 71(с, 3H); 5,10(с, 2H); 7,30 (д, 1H, J=8,0 Гц); 7,44 (ДД, 1H, J=8,0/1,5 Гц); 7,53 (д, 1H, J=1,4 Гц).
(д) Метиловый эфир 4-этинил-3-метоксиметоксибензойной кислоты
Аналогично
метидике примера 57(б), исходя из 11,73 г (40,1 ммоль) полученного в примере 62 (г) соединения, получают 4,14 г (47%) целевого соединения в виде желтого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,43 (с, 1H); 3,53 (с, 3H); 3,92 (с, 3H); 5,32 (с, 2H); 7,52 (д, 1H, J=8,0 Гц); 7,66 (дд, 1H, J=8,0/1,3 Гц); 7,78 (д, 1H, J=1,3 Гц).
(e) Метиловый
эфир 3-метоксиметокси-4-[4-(4'-метилбифенил-2-ил) бут-3-ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 1 (д), путем взаимодействия 3,89 г (17,7 ммоль) полученного в примере 62
(д) соединения с 6,22 г (19,4 ммоль) полученного в примере 2 (г) соединения, получают 3,46 г (47%) целевого соединения в виде порошка с т. пл. 64oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42 (с, 3H); 3,50(с, 3H); 3,90(с, 3H); 5,28(с, 2H); 6,40(д, 1H, J=16,2 Гц); 7,11(д, 1H, J=16,2 Гц); 7,20-7,30 (м, 3H); 7,32-7,37 (м, 4H); 7,45(д, 1H, J=8,0 Гц); 7, 62-7,65(м, 2H); 7,74 (с, 1H).
(ж) 3-Метоксиметокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойная кислота
Аналогично методике примера 1(е), исходя из 1,00 г (2,4
ммоль) полученного в примере 62(е) сложного метилового эфира, получают 540 мг (56%) 3-метоксиметокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил] бензойной кислоты в виде порошка бежевого цвета с
т. пл. 185oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,43 (с, 3H); 3,49 (с, 3H); 5,27(с, 2H); 6,40(д, 1H, J=16,2 Гц); 7,09(д, 1H, J= 16,2 Гц); 7,25-7,37(м, 8H); 7,43(д, 1H, J=8,0 Гц); 7,63-7,66(м, 2H); 7,75 (с, 1H).
Пример 63: 3-Гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1- инил]
бензойная кислота
(а) Метиловый эфир 3-гидрокси-4-[4-(4'-метилбифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 32 (а), исходя из 2,46 г (6,0 ммоль)
полученного в примере 62(е) сложного эфира, получают 1,81 г (82%) целевого соединения в виде порошка бежевого цвета с т. пл. 111oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,90(с, 3H); 6,37(д, 1H, J= 16,2 Гц); 7,13(д, 1H, J=16,2 Гц); 7,25-7,29(м, 4H); 7,34-7,39(м, 4H); 7,55(дд, 1H, J=8,0/1,5 Гц); 7,59(д, 1H, J=1,5 Гц); 7, 63-7,67 (м, 1H).
(б) 3-Гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1 (е), исходя из 900 мг (2,4 ммоль) полученного
в примере 63 (а) сложного метилового эфира, получают 130 мг (15%) 3-гидрокси-4-[4-(4'-метил-бифенил-2-ил) бут-3-ен-(E)-1-инил]бензойной кислоты в виде желтого порошка с т. пл. 101oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,47 (с, 3H); 6,69 (с, 1H); 6,97(д, 1H, J=16,1 Гц); 7,26-7,49(м, 7H); 7,56(д, 1H, J=8,2 Гц); 7,60-7,74 (м, 2H); 7,97(д, 1H, J=9,4 Гц); 8,15 (с, 1H).
Пример 64: 3-Метокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен- (E)-1-инил] бензойная кислота
(а) Метиловый эфир
3-метокси-4-[4-(4'-метилбифенил-2-ил)-бут-3- ен-(E)-1-инил]бензойной кислоты
Аналогично методике примера 33 (а), исходя из 910 мг (2,5 ммоль) полученного в примере 63(е) соединения и 170 мкл
(2,7 ммоль) метилиодида, получают 870 мг (92%) целевого соединения в виде масла каштанового цвета.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43(с, 3H); 3,92(с, 3H); 6,40(д, 1H, J=16,2 Гц); 7,09(д, 1H, J=16,2 Гц); 7,32-7,37 (м, 5H); 7,44(д, 2H, J=8,0 Гц); 7,53 (с, 1H); 7,58(дд, 1H, J=8,2/1,2 Гц); 7,62-7,72(м, 1H).
(б)
3-Метокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота
Аналогично методике примера 1 (е), исходя из 870 мг (2,3 ммоль) полученного в примере 64 (а) сложного метилового
эфира, получают 500 мг (60%)3-метокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойной кислоты в виде порошка бежевого цвета с т. пл. 217oC.
1 H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 2,43 (с, 3H); 3,92 (с, 3H); 6,40(д, 1H, J=16,2 Гц); 7,10(д, 1H, J=16,2 Гц); 7,25-7,37(м, 9H); 7,43(д, 1H, J=7, 9 Гц); 7,56-7,65(м, 3H).
Пример 65: {4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенил} метанол
Аналогично методике примера 12(г), исходя из 1,00 г (2,8 ммоль) полученного
в примере 2 (д) сложного эфира, получают 900 мг (98%) {4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] фенил} метанола в виде кристаллов белого цвета с т. пл. 118-120oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 1,67 (т, 1H, J=5,9 Гц); 2,43 (3H); 4,68(д, 2H, J=5,7 Гц); 6,34(д, 1H, J=16,2 Гц); 7,06(д, 1H, J=16,2 Гц); 7,26-7,36 (м, 9H); 7,42(д, 2H, J=8,2 Гц); 7,62-7,66(м, 1H).
Пример 66: 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензальдегид
Аналогично методике примера 11 (г), исходя из 500 г (1,5 ммоль)
полученного в примере 65 спирта, получают 470
мг (95%) 4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензальдегида в виде желтого порошка с т. пл. 85oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,44(с, 3H); 6,36(т, 1H, J= 16,2 Гц); 7,13(д, 1H, J=16,2 Гц); 7,26-7,30(м, 4H); 7,34(д, 1H, J=4,1 Гц); 7,35(д, 1H, J=1,7 Гц); 7,38(д, 2H, J=4,1 Гц); 7,56(д, 2H, J=8,2 Гц); 7,64-7,68 (м, 1H); 7,82(д, 2H, J=8,2 Гц); 9,99 (с, 1H).
Пример 67: 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенол
(а)
4-Триметилсиланилэтинилфенол
Аналогично методике примера 1(а), исходя из 8,00 г (38,4 ммоль) 4-иодфенола, получают 7,50 г (100%) целевого соединения в виде коричневого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 0,23(с, 9H); 6,75 (д, 2H, J= 8,8 Гц); 7,36 (д, 2H, J=8,7 Гц).
(б) 4-Этинил фенил
В трехгорлую колбу и в токе
азота вводят 500 мг (2,6 ммоль) полученного в примере 67 (а) соединения, 500 мг (8,6 ммоль) фторида калия, 500 мг (3,3 ммоль) фторида цезия, 300 мл метанола и 30 мл тетрагидрофурана. Реакционную среду
перемешивают в течение 16 часов при комнатной температуре, затем растворители выпаривают и полученный остаток очищают путем пропускания через слой диоксида кремния, элюируя смесью из 80% гептана и 20%
дихлорметана. После выпаривания растворителей получают 280 мг (90%) целевого соединения в виде коричневого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 3,16 (с, 1H); 6,55 (д, 2H, J=8,6 Гц); 7,09 (д, 2H, J=8,6 Гц); 9,67 (с, 1H).
(в) 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенол
Аналогично методике примера 1 (д), путем
взаимодействия 200 мг (1,7 ммоль) полученного в примере 67(б)соединения с 420 мг (1,3 ммоль) полученного в примере 2(г) соединения, получают 60 мг (15%) 4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]
фенола в виде порошка каштанового цвета с т. пл. 80-82oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 5,03 (с, 1H); 6,32 (д, 1H, J= 16,2 Гц); 6,76 (д, 2H, J=8,7 Гц); 7,01(д, 1H, J=16,2 Гц); 7,25-7,36(м, 9H); 7,61-7,63(м, 1H).
Пример 68: 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамид
(а)
4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензоилхлорид
В трехгорлую колбу и в токе азота, вводят 450 мг (1,3 ммоль) полученной в примере 2(е) кислоты и 20 мл дихлорметана. Прикапывают
279 мкл (1,4 ммоль) дициклогексиламина и полученный раствор перемешивают в течение 10 минут при комнатной температуре. Прикапывают 101 мкл (1,4 ммоль) тионилхлорида и полученный раствор перемешивают в
течение 15 минут при комнатной температуре. Реакционную среду выпаривают досуха, обрабатывают остаток диэтиловым эфиром, отфильтровывают и фильтрат выпаривают досуха. Полученный остаток прямо
используют в следующей стадии.
(б) 4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамид
Полученный в предыдущей стадии хлорангидрид кислоты растворяют в 10 мл
тетрагидрофурана и таким образом полученный раствор прикапывают к раствору, приготовленному из 87 мкл (1,5 ммоль)водного 32%-ного раствора аммиака, 222 мкл (1,6 ммоль) триэтиламина и 20 мл
тетрагидрофурана. Реакционную среду перемешивают в течение часа при комнатной температуре, выливают в воду и экстрагируют диэтиловым эфиром. Органическую фазу промывают водой до нейтрального значения
pH, сушат над сульфатом магния, отфильтровывают и растворители выпаривают. Полученный остаток порошкуют в смеси из 90% гептана и 10% диэтилового эфира, отфильтровывают и высушивают. Получают 380 мг
(84%) 4-[4-(4'- метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамида в виде светло-желтого порошка с т. пл. 195-197oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д. : 2,43 (с, 3H); 5,98(уш.с, 1H); 6,35(д, 1H, J=16,2 Гц); 7,10(д, 1H, J=16,2 Гц); 7,26-7,29(м, 4H); 7,32(д, 1H, J=4,2 Гц); 7,34(д, 1H, J-1,1 Гц); 7,37(д, 1H, J=4,8 Гц); 7,48(д, 2H, J=8,4 Гц); 7,63-7,67 (м, 1H); 7,78(д, 2H, J=8,4 Гц).
Пример 69: N-Этил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензамид
Аналогично
методике примера 68 (б), исходя из 498 мг (1,4 ммоль) полученного в примере 68 (а) хлорангидрида кислоты и 3 мл (4,1 ммоль)водного 70%-ного раствора этиламина, получают 400 мг (80%)
N-этил-4-[4-(4'-метилбифенил-2- ил)бут-3-ен-(E)-1-инил]бензамида в виде порошка белого цвета с т. пл. 133-135oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м.д.: 1,12 (т, 3H, J=7,1 Гц); 2,38(с, 3H); 3,28(к, 2H, J=6,9 Гц); 6,64(д, 1H, J= 16,2 Гц); 6,96(д, 1H, J=16,3 Гц); 7,22(д, 2H, J=8,0 Гц); 7,31(д, 2H, J=7,8 Гц); 7,29-7,33(м, 1H); 7,40-7,43(м, 2H); 7,53(д, 2H, J=8,3 Гц); 7,82-7,85 (м, с, 1H); 7,84(д, 2H, J=8,3 Гц); 8,56(т, 1H, J=5,4 Гц).
Пример 70:
{4-[4-(4'-Метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенил} морфолин-4-илметанон
Аналогично методике примера 68(б), исходя из 498 мг (1,4 ммоль) полученного в примере 68 (а) хлорангидрида кислоты
и 3 мл (34,4 ммоль)морфолина, получают 510 мг (92%) {4-[4-(4'-метилбифенил-2-ил)бут- 3-ен-(E)-1-инил]-фенил}морфолин-4-илметанона в виде меренги оранжевого цвета с т. пл. 50oC.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,43 (с, 3H); 3,30-3,90(уш. м, 8H); 6,34(д, 1H, J=16,2 Гц); 7,09(д, 1H, J=16,2 Гц); 7,26-7,29(м, 4H); 7,33-7,36(м, 5H); 7,46(д, 2H, J=8,3 Гц); 7,63-7,67 (м, 1H).
Пример 71: N-(4-Гидроксифенил)-4-[4-(4'-метилбифенил-2-ил)-бут-3- ен-(E)-1-инил]бензамид
Аналогично методике примера 68 (б), исходя из 380
мг (1,1 ммоль) полученного в примере 68 (а) хлорангидрида кислоты и 138 мг (1,2 ммоль) 4-аминофенола, получают 340 мг (70%) N-(4-гидроксифенил)-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)- 1-инил]
бензамида в виде мелкого белого порошка с т. пл. 253-255oC.
1H-ЯМР-спектр (дейтерохлороформ + 2 капли гексадейтеродиметилсульфоксида), δ в м. д.: 2,35 (с, 3H); 6,28(д, 1H, J=16,2 Гц); 6,73(д, 2H, J=8,8 Гц); 7,00(д, 1H, J= 16,2 Гц); 7,14-7,30(м, 6H); 7,41(д, 2H, J=8,5 Гц); 7,44(д, 2H, J= 9,1 Гц); 7,56-7,60 (м, 1H); 7,83(д, 2H, J=8,3 Гц); 8,67 (с, 1H); 9, 31(c, 1H).
Пример 72: 5-[4-(4'-Метилбифенил-2-ил)бута-1,3-диинил]тиофен-3- карбоновая кислота
(а) Метиловый эфир 5-[4-(4'-метилбифенил-2-ил)бута-1,3-диинил]
тиофен-3-карбоновой кислоты
Аналогично методике примера 10 (б), путем взаимодействия 480 мг (2,9 ммоль) полученного в примере 61(г) продукта с 950 мг (3,5 ммоль) полученного в примере 10(а)
продукта, получают 650 мг (63%) целевого соединения в виде оранжевого масла.
1H-ЯМР-спектр (дейтерохлороформ), δ в м.д.: 2,42(с, 3H); 3,86(с, 3H); 7,27(д, 2H, J=8,1 Гц); 7,29-7,33(м, 1H); 7,38- 7,43 (м, 1H); 7,40(д, 1H, J= 1,4 Гц); 7,50(д, 2H, J=8,1 Гц); 7,62- 7,66 (м, 1H); 7,65(д, 1H, J=1,2 Гц); 8,00(д, 1H, J=1,2 Гц).
(б)
5-[4-(4'-Метилбифенил-2-ил)бута-1,3-диинил]тиофен-3-карбоновая кислота
Аналогично методике примера 1 (е), исходя из 650 мг (1,8 ммоль) полученного в примере 72(а) сложного метилового эфира,
получают 570 мг (93%)5-[4-(4'-метилбифенил-2-ил)-бута-1,3-диинил]тиофен-3-карбоновой кислоты в виде порошка бежевого цвета с т. пл. 160-165oC.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид), δ в м.д.: 2,38(с, 3H); 7,30(д, 2H, J=8,0 Гц); 7,40-7,59(м, 5H); 7,72-7,75(м, 1H); 7,75(д, 1H, J=1,2 Гц); 8,37(д, 1H, J=1,2 Гц); 13,09(уш.с, 1H).
Б. Примеры рецептур
1) Для применения перорально:
(а) Готовят следующую композицию в виде таблетки массой 0,8 г:
Соединение примера 1 - 0,005 г
Предварительно
желатинизированный крахмал - 0,265 г
Микрокристаллическая целлюлоза - 0,300 г
Лактоза - 0,200 г
Стеарат магния - 0,030 г
Для лечения акне взрослому человеку
назначают 1-3 таблетки в день в течение 3-6 месяцев в зависимости от тяжести излечиваемого случая.
(б) Готовят суспензию для питья, предназначенную для расфасовки в ампулы по 5 мл:
Соединение примера 2 - 0,050 г
Глицерин - 0,500 г
70%-ный Сорбит - 0,500 г
Сахаринат натрия - 0,010 г
Метилпарагидроксибензоат - 0,040 г
Ароматизатор
- Достаточное количество
Очищенная вода - До общего количества 5 мл
Для лечения акне взрослому человеку назначают 1 ампулу в день в течение трех месяцев в зависимости от тяжести
излечиваемого случая.
(в) Готовят следующую композицию, предназначенную для расфасовки в желатиновые капсулы:
Соединение примера 1 - 0,025 г
Кукурузный крахмал - 0,
060 г
Лактоза - До общего количества 0,300 г
Используемые желатиновые капсулы состоят из желатины, диоксида титана и консерванта.
Для лечения псориаза взрослому человеку назначают 1 желатиновую капсулу с лекарством в день в течение 30 дней.
2) Для применения локально:
(а) Готовят крем типа вода-в-масле неионного типа следующего
состава:
Соединение примера 1 - 0,100 г
Смесь образующих эмульсию спиртов ланолина, восков и рафинированных масел, выпускаемая в продажу фирмой BDF под названием "Eucerine anhydre"
- 39,900 г
Метилпарагидроксибензоат - 0,075 г
Пропилпарагидроксибензоат - 0,075 г
Стерильная деминерализованная вода - До общего количества
Этот крем наносят на
псориатическую кожу 1-2 раза в день в течение 30 дней.
(б) Готовят гель следующего состава:
Соединение примера 2 - 0,050 г
Эритромицин (основание) - 4,000 г
Бутилгидрокситолуол - 0,050 г
Гидроксипропилцеллюлоза, выпускаемая в продажу фирмой Геркулес под названием "KLUCEL HF" - 2,000 г
Этанол (95o) - До общего количества 100,
000 г
Этот гель наносят на пораженную дерматозом кожу или кожу с угревой сыпью 1-3 раза в день в течение 6-12 недель в зависимости от тяжести излечиваемого случая.
(в)
Готовят противосеборейный лосьон путем смешения следующих ингредиентов:
Соединение примера 5 - 0,030 г
Пропиленгликоль - 5,000 г
Бутилгидрокситолуол - 0,100 г
Этанол (95o) - До общего количества 100,000 г
Этот лосьон наносят два раза в день на пораженную себореей кожу волосистой части головы и констатируют значительное улучшение в
течение срока 2-6 недель.
(г) Готовят косметическую композицию против пагубных воздействий солнца путем смешения следующих ингредиентов:
Соединение примера 8 - 1,000 г
Бензилиденкамфора - 4,000 г
Триглицериды жирных кислот - 31,000 г
Глицеринмоностеарат - 6,000 г
Стеариновая кислота - 2,000 г
Цетиловый спирт - 1,200 г
Ланолин - 4,000 г
Консерванты - 0,300 г
Пропиленгликоль - 2,000 г
Триэтаноламин - 0,500 г
Отдушка - 0,400 г
Деминерализованная вода - До общего
количества 100,000 г
Эту композицию наносят ежедневно, она позволяет бороться против фотоиндуцируемого старения.
(д) Готовят крем типа масло-в-воде неионного типа следующего
состава:
Соединение 10 - 0,500 г
Витамин D3 - 0,020 г
Цетиловый спирт - 4,000 г
Глицеринмоностеарат - 2,500 г
Стеарат ПЭГ 50 - 2,500 г
Масло Каритэ - 9,200 г
Пропиленгликоль - 2,000 г
Метилпарагидроксибензоат - 0,075 г
Пропилпарагидроксибензоат - 0,075 г
Стерильная деминерализованная вода - До
общего количества 100,000 г
Этот крем наносят на псориатическую кожу 1-2 раза в день в течение 30 дней.
(е) Готовят гель для локального применения путем смешения следующих
ингредиентов:
Соединение примера 9 - 0,050 г
Этанол - 43,000 г
α- Токоферол - 0,050 г
Карбоксивиниловый полимер, выпускаемый в продажу фирмой "Goodrich" под
названием "Carbopol 941" - 0,500 г
Триэтаноламин в виде водного 20 мас.%-ного раствора - 3,800
Вода - 9,300 г
Пропиленгликоль - До общего количества 100,000 г
Этот
гель при лечении акне наносят 1-3 раза в день в течение 6-12 недель в зависимости от тяжести излечиваемого случая.
(ж) Готовят лосьон от выпадения волос и для ускорения роста волос
путем смешения следующих ингредиентов:
Соединение примера 12 - 0,05 г
Соединение, имеющееся в продаже под названием "Миноксидил" - 1,00 г
Пропиленгликоль - 20,00 г
Этанол - 34,92 г
Полиэтиленгликоль (молекулярная масса=400) - 40,00 г
Бутилгидроксианизол - 0,01 г
Бутилгидрокситолуол - 0,02 г
Вода - До общего количества 100,00
г
Этот лосьон наносят 2 раза в день в течение трех месяцев на кожу волосистой части головы, подверженную в значительной степени выпадению волос.
(з) Готовят противоугревой
крем путем смешения следующих ингредиентов:
Соединение примера 18 - 0,050 г
Ретиноевая кислота - 0,010 г
Смесь стеаратов глицерина и полиэтиленгликоля (75 моль), выпускаемая
в продажу фирмой "GATTEFOSSE" под названием "Gelot 64" - 15,000 г
Косточковое масло, полиоксиэтилинированное 6 молями этиленоксида, выпускаемое в продажу фирмой "GATTEFOSSE" под названием
"Labrafil M2130 CS" - 8,000 г
Пергидросквален - 10,000 г
Консерванты - Достаточное количество
Полиэтиленгликоль (молекулярная масса=400) - 8,000 г
Динатриевая соль
этилендиаминтетрауксусной кислоты - 0,050 г
Очищенная вода - До общего количества 100,000 г
Этот крем наносят на пораженную дерматозом кожу или покрытую угреватой сыпью кожу 1-3 раза
в день в течение 6-12 недель.
(и) Готовят крем типа масло-в-воде следующего состава:
Соединение примера 33 - 0,020 г
Бетаметазон-17-валерат - 0,050 г
S-Карбоксиметилцистеин - 3,000 г
Стеарат полиоксиэтилена (40 молей этиленоксида), выпускаемый в продажу фирмой "ATLAS" под названием "Myrj 52" - 4,000 г
Сорбитанмонолаурат,
полиоксиэтиленированный 20 молями этиленоксида, выпускаемый в продажу фирмой "ATLAS" под названием "Tween" - 1,800 г
Смесь моно- и дистеарата глицерина, выпускаемая в продажу фирмой
"GATTEFOSSE" под названием "Geleol" - 4,200 г
Пропиленгликоль - 10,000 г
Бутилгидроксианизол - 0,010 г
Бутилгидрокситолуол - 0,020 г
Кетостеариловый спирт - 6,200
г
Консерванты - Достаточное количество
Пергидросквален - 18,000 г
Смесь глицеридов каприловой и каприновой кислот, выпускаемая под названием "Miglyol 812" фирмой "DYNAMIT
NOBEL" - 4,000 г
Триэтаноламин (99 мас.%) - 2,500 г
Вода - До общего количества 100,000 г
Этот крем наносят 2 раза в день на пораженную дерматозом кожу в течение 30 дней.
(к) Готовят следующий крем типа масло-в-воде:
Молочная кислота - 5,000 г
Соединение примера 56 - 0,020 г
Стеарат полиоксиэтилена (40 молей этиленоксида),
выпускаемый в продажу фирмой "ATLAS" под названием "Myrj 52" - 4,000 г
Сорбитанмонолаурат, полиоксиэтиленированный 20 молями этиленоксида, выпускаемый в продажу фирмой "ATLAS" под названием
"Twee 20" - 1,800 г
Смесь моно- и дистеарата глицерина, выпускаемая в продажу фирмой "GATTEFOSSE" под названием "Geleol" - 4,200 г
Пропиленгликоль - 10,000 г
Бутилгидроксианизол - 0,010 г
Бутилгидрокситолуол - 0,020 г
Кетостеариловый спирт - 6,200 г
Консерванты - Достаточное количество
Пергидросквален - 18,000 г
Смесь триглицеридов каприловой и каприновой кислот, выпускаемая в продажу фирмой "DYNAMIT NOBEL" под названием "Migliol 812", - 4,000 г
Вода - До общего количества 100,000 г
Этот
крем наносят 1 раз в день, он помогает в борьбе против фотоиндуцируемого или хронологического старения кожи.
В. Примеры испытаний
Пример 1
Результаты теста для
идентификации молекул-антагонистов RARs, аналогичного тесту, описанному в заявке на патент Франции N 95-07302, поданной 19 июня 1995 г. заявителем.
Используемый тест является тестом на отек уха мыши, индуцируемый путем топического нанесения 2-(5,6,7,8-тетра-гидро-5,5,8,8-тетраметил-2- нафтил)-6-бензо[b] тиофенкарбоновой кислоты (CD270) в количестве 0,01 мас.% на объем.
Согласно этой модели топическое нанесение соединения CD270 на ухо провоцирует воспаление, которое характеризуется утолщением уха мыши. Ответная реакция может быть предотвращена путем топического введения дозы (выраженной в мас.% на объем) соединения X.
Результаты представлены в табл. 1.
Результаты этой таблицы показывают, что соединения примеров 1, 2, 11, 12, 14-18, 28, 42-45 и 52 являются соединениями- антагонистами RARs.
Пример 2
Результаты теста дифференциации клеток (F9) зародышевой тератокарциномы мыши для
идентификации молекул-антагонистов RARs, описанных в Cancer Research, 43, 5268 (1983).
В используемом тесте, соединение рассматривают как антагонист RAR, если оно уменьшает активность, агониста (4-[(5,5,8,8-тетраметил- 5,6,7,8-тетрагидронафталин-2-иламино)-метил] бензойная кислота, называемая как соединение CD2043) в отношении морфологии и выделения плазминогенного активатора клетками F9. В этом тесте соединения испытывают в концентрации 10-6 М и CD2043 испытывают в концентрации 10-8 М.
Результаты представлены в табл. 2.
Результаты этой таблицы показывают, что соединения примеров 1, 2, 11, 12, 14-18, 28, 42-45 и 52 являются соединениями- антагонистами RARs.
Реферат
Изобретение относится к новым триароматическим соединениям общей формулы I, охарактеризованной в п. 1 формулы изобретения. Соединение формулы I обладают антагонистической активностью к рецепторам ретиноевой кислоты и могут использоваться для приготовления фармацевтических композиций, предназначенных для применения в медицине человека или животного в частности при дерматологических, ревматических, респираторных, сердечно-сосудистых и офтальмологических заболеваний, и в косметических композициях, пригодных для гигиены тела или ухода за волосами. 3 с. и 9 з.п.ф-лы, 2 ил., 2 табл.

Формула

где R1 означает (ii) -CH2OH, (iii) -O-R4, (iv) -CO-R5, где R4 и R5 имеют нижеуказанные значения;
Ar1 выбирается среди радикалов следующих формул (a) - (d):

где R6 имеет нижеуказанное значение;
X-Y означает связующее звено, выбираемое из следующих остатков формул (e) - (m), которые могут быть присоединены к фенильному кольцу слева направо или наоборот:

где R7, R8 и R9 имеют нижеуказанные значения;
Ar2 выбирается среди радикалов следующих формул (j) - (l):

причем Ar2 находится в орто- или метаположении по отношению к связи X-Y, и R10 и R11 имеют нижеуказанные значения;
R2 и R3 одинаковые или разные, означают атом водорода, линейный или разветвленный алкильный радикал с 1 - 20 атомами углерода, атом галогена; гидроксил, алкоксил, остаток простого полиэфира;
R4 означает атом водорода, низший алкил;
R5 означает (a) атом водорода; (b) радикал формулы
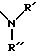
где R' и R'' имеют нижеуказанные значения; и (r) радикал -OR13, где R13 имеет нижеуказанное значение;
R6 означает атом водорода, линейный алкил с 1 - 20 атомами углерода, гидроксил; радикал -OR14 или радикал -OCOR14, где R14 имеет нижеуказанное значение; или остаток простого полиэфира,
R7 и R8 означают атом водорода, низший алкил;
R9 означает атом водорода;
R10 и R11, одинаковые или разные, означают атом водорода, линейный алкил с 1 - 20 атомами углерода, атом галогена; гидроксил, алкоксил, остаток простого полиэфира, CF3, алкенил или -(CH2)n-R15, где n и R15 имеют нижеуказанные значения;
R' и R'', одинаковые или разные, означают атом водорода, низший алкил, незамещенный или замещенный гидроксигруппой фенил, или же оба радикала вместе образуют гетероцикл;
R13 означает атом водорода;
R14 означает низший алкильный радикал;
R15 означает гидроксил;
n = 1 или 2;
и оптические и геометрические изомеры вышеуказанных соединений формулы I или их соли.
4-[4-(бифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)акрилоиламино]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)-(E)-тиоакрилоиламино]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)акрилоилокси]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бута-1(E), 3(Z)-диенил]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бута-1(E),3(E)-диенил]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)пропиноилокси]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)-(E)/(Z)-бут-1-ен-3-инил]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)бута-1,3-диинил]бензойная кислота;
4-[4-(3-фтор-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4,4'-диметилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(5, 4'-диметилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(6,4'-диметилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(5-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(6-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метилбифенил-2-ил)пент-3-ен-(E)-1-инил]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)пропиноиламино]бензойная кислота;
4-[3-(4'-метилбифенил-2-ил)пропинтиоиламино]бензойная кислота;
4-[4-(3'-метилбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(2'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-хлорбифенил-2-ил)бут-3-ен-1-инил]бензойная кислота;
4-[4-(3'-хлорбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-фторбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-пропилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-винилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(3'-метоксиметоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(2-тиофен-3-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(2-тиофен-2-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3'-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3'-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3'-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-4-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-4-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-метил-4-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-5-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-5-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-метил-5-пропоксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-6-гидроксибифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(4'-метил-6-метоксибифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-трифторметилбифенил-2-ил)бут-3-ен-(E)-1-инил] -бензойная кислота;
4-[4-(4'-гидроксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-(4-[4'-(2-гидроксиэтил)бифенил-2-ил]бут-3-ен-(E)-1-инил)бензойная кислота;
4-[4-(3'-метилбифенил-3-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(2-пиридин-4-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(2-пиридин-3-илфенил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3-метоксиметокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(3-гидрокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
4-[4-(3-метокси-4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
4-[4-(4'-этоксиметоксиметилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
метиловый эфир 4-[4-(4'-этоксиметоксиэтилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойной кислоты;
2-метил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
2-гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
6-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]пиридин-3-карбоновая кислота;
5-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]пиридин-2-карбоновая кислота;
5-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] тиофен-3-карбоновая кислота;
3-метоксиметокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
3-гидрокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензойная кислота;
3-метокси-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] бензойная кислота;
(4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенил)-метанол;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензальдегид;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]фенол;
4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамид;
N-этил-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил]бензамид;
(4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-1-инил] фенил)-морфолин-4-илметанон;
N-(4-гидроксифенил)-4-[4-(4'-метилбифенил-2-ил)бут-3-ен-(E)-2-инил] бензамид;
5-[4-(4'-метилбифенил-2-ил)бута-1,3-диинил]тиофен-3-карбоновая кислота.

Комментарии