Биологически активная композиция из томатов, имеющая уменьшенное содержание ликопина - RU2748400C2
Код документа: RU2748400C2
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области обработки пищевых продуктов. В частности, изобретение относится к биологически активной композиции из томатов, имеющей уменьшенное содержание ликопина.
УРОВЕНЬ ТЕХНИКИ
Томатные продукты широко используются как в пищевой промышленности, так и во все возрастающей степени при получении нутрицевтических и космецевтических композиций. В патенте США 5837311 описывается промышленный способ получения продуктов из томатов, включая в частности томатный олеорезин, содержащий высокие уровни каротиноида ликопина. Этот продукт олеорезин также содержит исключительно большой диапазон дополнительных фармакологически активных компонентов, включая другие каротиноиды, такие как фитоен, фитофлуен и бета-каротин, а также токоферолы и фитостеролы. Этот продукт олеорезин продается и используется в настоящее время широко и успешно в течение многих лет, и диапазон заболеваний, которые можно предупредить и/или вылечить с его использованием, включает, но не ограничивается ими, раковые заболевания (в частности, рак предстательной железы), повышенное артериальное давление, атеросклероз, кожные заболевания и повреждения клеток и ДНК.
Несмотря на то, что была подтверждена высокая эффективность такого препарата на основе томатного олеорезина в обеспечении здоровья и профилактике заболеваний, его яркий красный цвет может в некоторых случаях являться недостатком, например, если предполагается его применение на коже в качестве косметического или космецевтического средства.
Задачей настоящего изобретения является обеспечение решения этой проблемы предоставлением продукта из томатов, имеющего аналогичный (или расширенный) диапазон терапевтической активности вышеуказанного томатного олеорезина, который продается под названием Lyc-O-Mato®, но который имеет гораздо менее выраженный красный цвет за счет низкого содержания ликопина в нем.
Другие цели и задачи изобретения станут очевидными по мере последующего описания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение преимущественно относится к композиции из томатов с уменьшенным содержанием ликопина, содержащей ликопин и один или оба из фитоена и фитофлуена, при этом концентрация указанного ликопина находится в диапазоне от 0,3% до 2% (вес./вес.), и при этом весовое соотношение ликопина и одного или обоих из фитоена и фитофлуена находится в диапазоне от 1:1 до 1:2,5. Кроме того, указанная композиция дополнительно содержит фитостеролы.
В одном предпочтительном варианте осуществления раскрытой выше композиции концентрация фитостерола составляет, по меньшей мере, 2% (вес./вес.).
В одном предпочтительном варианте осуществления раскрытая выше композиция также содержит витамин Е в концентрации, по меньшей мере, 2% (вес./вес.).
В одном предпочтительном варианте осуществления изобретения концентрация одного или обоих из фитоена и фитофлуена в общей концентрации составляет от 0,25% до 3%.
В контексте настоящего раскрытия термины композиция с «уменьшенным содержанием ликопина» и «низким содержанием ликопина» и подобные этому используются взаимозаменяемо, и все указанные термины следует понимать как относящиеся к композиции, имеющей каротиноидный состав, определенный в предыдущем абзаце.
Следует отметить, что композиция по настоящему изобретению обладает выраженной биологической активностью (включая, но не ограничиваясь этим, противовоспалительную активность, несмотря на то, что содержание ликопина в указанной композиции уменьшают, по меньшей мере, в три раза по сравнению с обычно используемым продуктом на основе томатного олеорезина предыдущего уровня техники (Lyc-O-Mato®). Этот результат является совершенно неожиданным, поскольку многие терапевтические эффекты томатных олеорезинов объясняются содержанием в них ликопина.
В одном предпочтительном варианте осуществления композиция по настоящему изобретению имеет концентрацию растворителя менее 50 ppm.
В некоторых вариантах осуществления композиция по настоящему изобретению может также содержать один или более дополнительных фармакологически активных компонентов, включая, но не ограничиваясь ими, дополнительные каротиноиды, витамин Е и полифенолы, такие как карнозная кислота. Предпочтительные примеры дополнительных каротиноидов включают фитоен, фитофлуен, лютеин, зеаксантин, бета-каротин, астаксантин. Однако другие каротиноиды также могут присутствовать в композиции или в дополнение к или вместо вышеприведенных примеров.
В одном предпочтительном варианте осуществления изобретения композиция с уменьшенным содержанием ликопина также содержит карнозную кислоту.
В другом предпочтительном варианте осуществления композиция с уменьшенным содержанием ликопина также содержит растворимые сухие вещества томатов.
В еще одном предпочтительном варианте осуществления композиция по настоящему изобретению также содержит бета-каротин и витамин Е. Предпочтительно вышеуказанные дополнительные компоненты присутствуют в следующих диапазонах концентраций: 0,2-1,0% бета-каротина; 2,0-4% витамина Е.
В одном предпочтительном варианте осуществления раскрытую выше композицию получают из томатов.
В другом аспекте настоящее изобретение относится к способу получения раскрытой выше композиции из томатов с низким содержанием ликопина, где указанный способ включает стадии:
1. Предоставление томатного продукта, содержащего 5-20% ликопина (например, как описано в патенте США 5837311).
2. Добавление растворителя или смеси растворителей, которые растворяют липиды и не растворяют ликопин, включая (но не ограничиваясь ими) этанол, изопропиловый спирт (IPA) или ацетон, в соотношении более 1:1 (растворитель:томатный продукт), предпочтительно в соотношение 3:1.
3. Нагревание смеси растворитель/томатный экстракт при температуре около 25-60°C.
4. Отделение кристаллического материала от растворителя посредством фильтрации и/или разделения центрифугированием.
5. Необязательно включение кристаллов, содержащих приблизительно 70% ликопина, в окрашивающую композицию.
6. Выпаривание растворителя (который, в случае этанола, предпочтительно выходит из раствора, имеющего менее 50 ppm этанола), который затем может рециркулировать для использования на стадии 2.
7. Стандартизация полученного раствора до требуемой концентрации, например, добавлением питательной композиции.
В одном предпочтительном варианте осуществления раскрытого выше способа растворителем, используемым на стадии 2, является этанол.
В одном предпочтительном варианте осуществления раскрытого выше способа соотношение растворитель : томатный продукт составляет 4:1.
Несмотря на то, что можно использовать любой подходящий продукт из томатов, содержащий каротиноиды, в качестве исходного материала для данного способа, в одном особенно предпочтительном варианте осуществления томатный продукт, используемый в качестве исходного материала, представляет собой олеорезин. В другом предпочтительном варианте осуществления томатный продукт, используемый в качестве исходного материала, содержит кожуру томата.
Неожиданно было обнаружено, что раскрытая здесь композиция, несмотря на значительно уменьшенную в ней концентрацию ликопина (относительно томатных олеорезинов предшествующего уровня техники), вызывает увеличение продукции оксида азота (NO) в сосудистых тканях. Кроме того, было обнаружено, что настоящая композиция вызывает выраженную индукцию фермента эндотелиальной синтазы оксида азота в эндотелии сосудов.
Также неожиданно было обнаружено, что композиция по настоящему раскрытию вызывает выраженное увеличение активности системы антиоксидант-респонсивного элемента (ARE).
Кроме того, неожиданно было обнаружено, что композиция по настоящему раскрытию вызывает выраженное ингибирование провоспалительной системы транскрипции NFκB.
Раскрытую выше композицию можно использовать для получения лекарственного средства для лечения большого количества различных видов заболеваний. В одном предпочтительном варианте указанное лекарственное средство подходит для использования при лечении нарушений сердечно-сосудистой системы, включая, но, не ограничиваясь этим, повышенное артериальное давление.
В другом предпочтительном варианте осуществления лекарственное средство можно использовать для лечения или профилактики повреждения сосудов и/или невропатии у пациентов с диабетом.
В еще одном предпочтительном варианте осуществления заболевание, подлежащее лечению, характеризуется наличием воспалительного компонента. В одном особенно предпочтительном варианте осуществления лекарственное средство используют для лечения и/или профилактики воспаления сосудов.
В еще более предпочтительном варианте осуществления лекарственное средство по настоящему изобретению можно использовать для профилактики возникновения опухолевых заболеваний.
В некоторых вариантах осуществления указанная композиция также содержит один или более дополнительных активных компонентов, указанных выше, таких как дополнительные каротиноиды, полифенолы (такие как карнозная кислота), витамин Е, фитостеролы и растворимые сухие вещества томатов (например, в виде прозрачного томатного концентрата (CTC), полученного концентрированием сыворотки, полученной из томатов, после разделения на мякоть и сыворотку).
В дополнительном аспекте настоящее изобретение направлено на использование вышеуказанной композиции из томатов с уменьшенным содержанием ликопина при получении лекарственного средства для местного применения. В одном предпочтительном варианте осуществления данного аспекта лекарственное средство для местного применения представляет собой косметический или космецевтический препарат и может быть получено в виде крема, лосьона, мази, геля и так далее.
В одном предпочтительном варианте осуществления указанное косметическое или космецевтическое средство используют в качестве солнцезащитного крема, в котором космецевтическая композиция может также дополнительно содержать общепринятые солнцезащитные вещества, включая, но, не ограничиваясь ими, ПАБК, оксид цинка, оксид титана, циноксат, Падимат О и фенилбензимидазолсульфоновую кислоту.
В другом предпочтительном варианте осуществления полученную из томатов композицию по настоящему изобретению используют в качестве антивозрастного средства. В некоторых вариантах осуществления изобретения вышеуказанную композицию на основе томатов используют в качестве единственного активного вещества, в других случаях косметическое или космецевтическое средство содержит дополнительный активный компонент.
В другом предпочтительном варианте осуществления настоящее изобретение направлено на использование вышеуказанной полученной из томатов композиции с уменьшенным содержанием ликопина при получении лекарственного средства для системного применения, включая, но, не ограничиваясь ими, лекарственные средства для перорального применения и лекарственные средства, подходящие для парентерального применения. Кроме того, композицию по настоящему изобретению можно использовать при получении лекарственного средства, подходящего для местного применения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 схематично представлен способ получения композиции из томатов с низким содержанием ликопина.
На фиг.2 графически проиллюстрировано увеличение уровней NO в эндотелиальных клетках сосудов после обработки композицией с низким содержанием ликопина по настоящему изобретению.
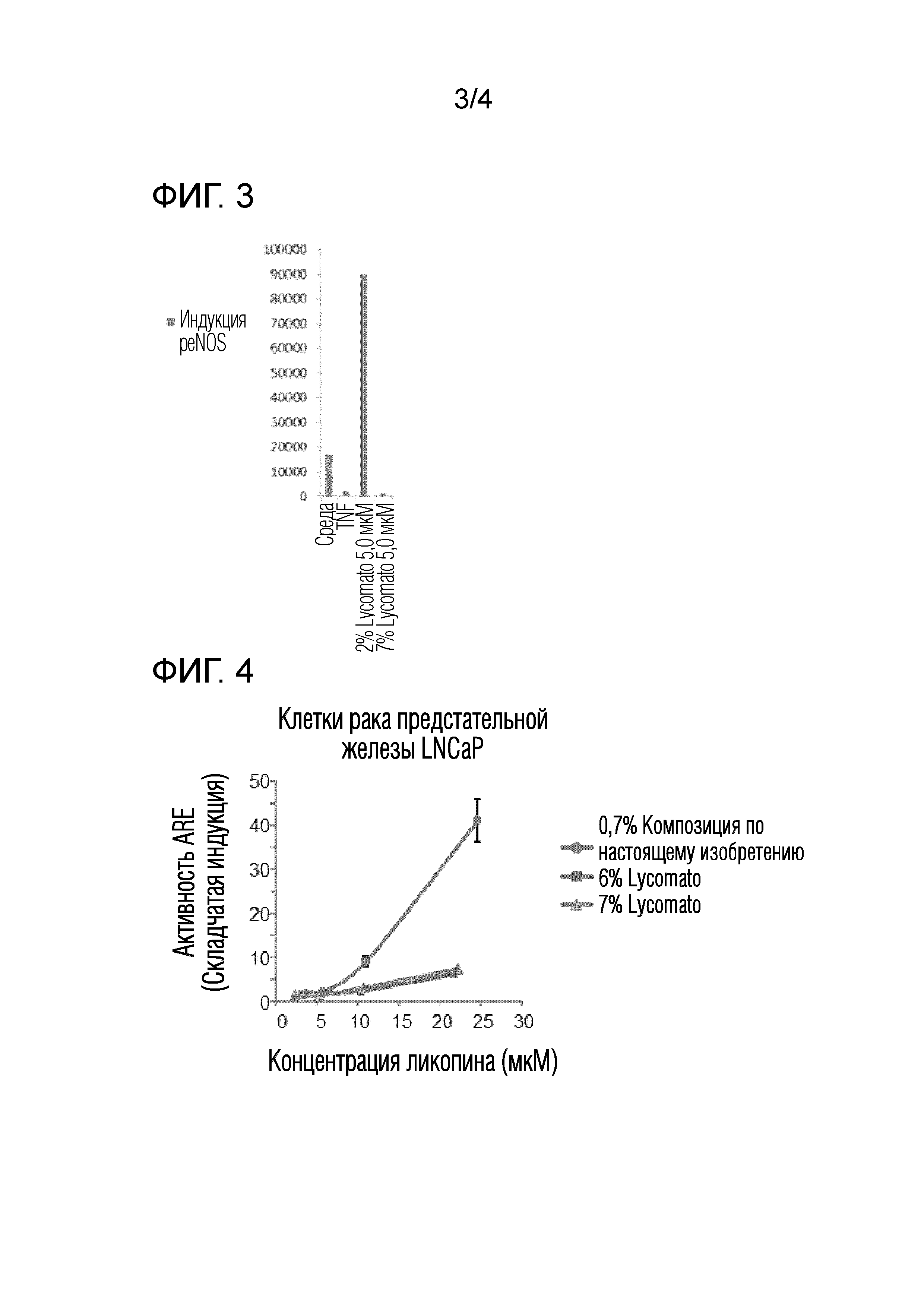
На фиг.3 графически проиллюстрировано увеличение индукции peNOS в эндотелиальных клетках сосудов после обработки композицией с низким содержанием ликопина по настоящему изобретению.
На фиг.4 графически проиллюстрировано увеличение активности ARE в клетках рака предстательной железы LNCaP, вызванное композицией с низким содержанием ликопина по настоящему изобретению.
На фиг.5 графически проиллюстрировано увеличение активности ARE в клетках рака молочной железы T47D, вызванное композицией с низким содержанием ликопина по настоящему изобретению.
На фиг.6 графически проиллюстрировано ингибирование системы транскрипции NFκB в клетках рака молочной железы T47D, которое вызвано композицией с низким содержанием ликопина по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Как раскрыто выше, настоящее изобретение относится к композиции, содержащей томатный продукт с уменьшенным содержанием ликопина, где общая схема способа получения указанной композиции представлена на фиг.1 и содержит стадии:
Стадия 1: предоставление томатного продукта, содержащего 5-20% ликопина (например, олеорезин, который описан в патенте США 5837311, или кожура томата).
Стадия 2: добавление растворителя или смеси растворителей, которые растворяют липиды и не растворяют ликопин, например, этанол или изопропанол, или ацетон в соотношении более 1:1 (растворитель:томатный продукт), предпочтительно в соотношение 3:1 или 4:1.
Стадия 3: нагревание смеси растворитель/томатный экстракт при температуре около 25-60°C.
Стадия 4: отделение кристаллического материала от растворителя посредством фильтрации или разделения центрифугированием.
Стадия 5: необязательно включение кристаллов, содержащих приблизительно 70% ликопина, в окрашивающую композицию.
Стадия 6: частично выпаривание растворителя (предпочтительно выходящего из раствора, имеющего менее 50 ppm растворителя), который затем может рециркулировать для использования на стадии 2.
Стадия 7: стандартизация полученного раствора до требуемой концентрации добавлением питательной композиции.
Фармацевтические композиции
Несмотря на то, что активные вещества, ликопин и фитоен/фитофлуен, необязательно в комбинации с другими каротиноидами и/или дополнительными веществами, можно вводить отдельно, предполагается, что эти соединения будут вводиться в фармацевтическую композицию, содержащую активные компоненты, вместе с фармацевтически приемлемым носителем или эксципиентом.
Фармацевтические композиции для использования в соответствии с настоящим изобретением можно получить общепринятым способом с использованием одного или более физиологически приемлемых носителей, содержащих эксципиенты и вспомогательные вещества, которые облегчают переработку активных соединений в препараты, которые можно использовать фармацевтически. Активные вещества получают в виде фармацевтических композиций и вводят субъекту-млекопитающему, такому как пациент-человек, в различных формах, таких как жидкая, твердая и полутвердая. Фармацевтические композиции можно вводить субъекту любым способом, известным специалисту в данной области, например, перорально, местно, парентерально, трансмукозально, трансдермально, внутримышечно, внутривенно, внутрикожно, подкожно, внутрибрюшинно, внутрижелудочно, внутричерепно или внутриматочно. Для перорального введения соединения можно получить смешиванием активных соединений с фармацевтически приемлемыми носителями, известными в данной области. Композиции можно получить в любой твердой или жидкой лекарственной форме, известной в данной области, включая, но, не ограничиваясь ими, таблетку, каплет, капсулу, микрокапсулу, пилюлю, брикет, порошок, сироп, гель, пасту, гранулу, суспензию, дисперсию, эмульсию, микстуру, раствор, драже, шарик и мелкую гранулу. Пероральные композиции можно получить в виде композиций с немедленным высвобождением или в виде композиций с контролируемым или пролонгированным высвобождением, обеспечивающих длительное высвобождение активного компонента(компонентов) в течение заданного периода времени.
Подходящие эксципиенты для твердых композиций включают, но, не ограничиваются ими, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; эксципиенты на основе крахмала, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал и тому подобное, желатин, трагакантовую камедь, эксципиенты на основе целлюлозы в виде микрокристаллической целлюлозы, карбоксиметилцеллюлозы, гидроксиметилцеллюлозы, гидроксиэтилцеллюлозы, метилгидроксипропилцеллюлозы, гидроксипропилцеллюлозы и тому подобного. Также можно использовать такие полимеры, как поливинилпирролидон (ПВП) и поперечно сшитый ПВП. Кроме того, композиции могут также содержать связующие вещества (например, аравийскую камедь, кукурузный крахмал, желатин, карбомер, этилцеллюлозу, гуаровую камедь, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, повидон), вещества для улучшения распадаемости таблеток (например, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, кроскармеллозу натрия, кросповидон, гуаровую камедь, натрия крахмал гликолят), поверхностно-активные вещества (например, лаурилсульфат натрия) и смазывающие вещества (например, стеариновую кислоту, стеарат магния, полиэтиленгликоль, лаурилсульфат натрия).
Для жидких композиций фармацевтически приемлемыми носителями могут быть водные или неводные растворы, суспензии, эмульсии или масла. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль и инъекционные органические сложные эфиры. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и буферную среду. Примеры масел включают, но не ограничиваются ими, масла нефтяного, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло, минеральное масло, оливковое масло, подсолнечное масло и рыбий жир.
Предпочтительные пероральные фармацевтические композиции включают капсулы, изготовленные из желатина, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. В мягких капсулах активные соединения можно растворить или суспендировать в подходящих жидкостях, таких как жирные масла, жидкое парафиновое масло или жидкие полиэтиленгликоли. Кроме того, можно добавить стабилизаторы. В некоторых предпочтительных вариантах осуществления капсулы не включают компоненты животного происхождения и подходят для вегетарианцев и веганов.
Мягкие желатиновые капсулы и способы их получения известны в данной области. Неограничивающие примеры можно найти в патентах США 6217902, 6258380, 5916591 и 4891229, все из которых включены в настоящее описание посредством ссылки.
В композиции по настоящему изобретению можно включить другие приемлемые эксципиенты и добавки, известные специалисту в данной области, например, стабилизаторы, растворители, повышающие тоничность агенты, буферные вещества, консерванты, загустители, комплексообразующие вещества и другие эксципиенты, а также дополнительные лекарственные средства.
Растворитель может представлять собой, например, тилоксапол, сложные эфиры полиэтиленгликоля и глицеридов жирных кислот, сложные эфиры полиэтиленгликоля и жирных кислот, полиэтиленгликоли, простые эфиры глицерина или смеси этих соединений. Конкретным примером растворителя является полиоксиэтилированное касторовое масло, например, имеющиеся на рынке продукты Cremophor® или Cremophor® RH40. Другим примером растворителя является тилоксапол. Используемая концентрация, в частности, зависит от концентрации активного компонента. Обычно добавляемое количество является достаточным для растворения активного компонента. Например, концентрация растворителя является 0,1-5000-кратной концентрации активного компонента.
Примерами буферных веществ являются ацетат, аскорбинат, борат, гидрокарбонат/карбонат, цитрат, глюконат, лактат, фосфат, пропионат и Трис (трометамин) буферы. Количество добавляемого буферного вещества является таким, например, которое необходимо для обеспечения и поддержания физиологически приемлемого диапазона рН. Диапазон рН обычно находится в диапазоне от 5 до 9, предпочтительно от 5,2 до 8,5.
Композиции по настоящему изобретению могут содержать дополнительные нетоксичные эксципиенты, такие как, например, эмульгаторы, смачивающие вещества или наполнители, такие как, например, полиэтиленгликоли (ПЭГ 200, 300, 400 и 600) или Carbowax® (Карбовакс 1000, 1500, 4000, 6000 и 10000). Другие эксципиенты, которые можно использовать при необходимости, перечислены ниже, но они не предназначены для ограничения каким-либо образом применимости возможных эксципиентов. Они могут представлять собой комплексообразующие вещества, такие как динатрий ЭДТА или ЭДТА; антиоксиданты, такие как аскорбиновая кислота, ацетилцистеин, цистеин, гидросульфит натрия, бутилгидроксианизол, бутилгидрокситолуол; стабилизаторы, такие тиомочевина, тиосорбит, диоктилсульфосукцинат натрия или монотиоглицерин; или другие эксципиенты, такие как, например, сложный эфир сорбита и лауриловой кислоты, метаноламина олеат или сложный эфир пальмитиновой кислоты.
Как известно, количество вводимой композиции зависит от многих факторов, включающих тяжесть заболевания, подлежащего лечению, способа введения и мнения лечащего врача. Однако используемая доза будет, как правило, зависеть от ряда факторов, включающих возраст и пол пациента и степень тяжести заболевания, подлежащего лечению.
Предпочтительно препараты находятся в единичной дозированной форме, предназначенной для перорального введения. В такой форме препарат разделен на единичные дозы, содержащие соответствующие количества активных компонентов. Единичная дозированная форма может представлять собой упакованный препарат, упаковку, содержащую дискретные количества препарата, например таблетки, капсулы и порошки во флаконах или ампулах. Также единичная дозированная форма может представлять собой капсулу, облатку или таблетку саму по себе, или она может представлять собой соответствующее количество любой из них в упакованной форме.
Режим дозирования композиций по настоящему изобретению может изменяться в зависимости от конкретного применения и эффективности активных компонентов. Определение правильной дозировки находится в пределах компетентности специалиста в данной области техники. Для удобства предпочтительна одна суточная доза. Альтернативно, общая суточная доза может быть разделена и вводиться порциями в течение суток, например два раза в сутки, три раза в сутки и тому подобное. Также предусмотрено введение два раза в неделю, один раз в неделю, два раза в месяц и один раз в месяц.
Настоящее изобретение будет также описано в следующих примерах, которые приведены только для иллюстративных целей и не ограничивают каким-либо образом объем изобретения.
ПРЕПАРАТИВНЫЙ ПРИМЕР 1. СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ИЗ ТОМАТОВ С НИЗКИМ СОДЕРЖАНИЕМ ЛИКОПИНА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Композицию с низким содержанием ликопина по настоящему изобретению получали в соответствии со следующими стадиями способа:
1. Получали согласно способу, описанному в патенте США 5837311, томатный олеорезин, имеющий следующий состав:
10,1% ликопина,
1,7% фитоена и фитофлуена,
2,5% фитостеролов,
2,5% витамина Е,
82,7% свободных жирных кислот,
0,5% воды.
(Следует отметить, что данный препарат можно приобрести под торговым наименованием Lyc-O-Mato®, производства LycoRed Ltd. of Beʹer Sheva, Израиль).
2. 100 мл томатного олеорезина, полученного согласно стадии 1, добавляли в смесительный сосуд, содержащий 300 мл 98% этанола, и перемешивали при 40°С в течение 0,5 часа.
3. Для отделения кристаллического материала от этанольного растворителя использовали фильтр-пресс. Такое разделение приводило к получению 10,94 г кристаллического материала, содержащего 85% ликопина и 15% жирных кислот.
4. Затем фильтрат со стадии 3 подвергали выпариванию для удаления большей части этанола, выходящего из 89 г жидкости (которая является продуктом с низким содержанием ликопина по настоящему изобретению), имеющей следующий состав:
2,0% ликопина,
2,2% фитоена и фитофлуена,
2,8% фитостеролов,
2,8% витамина Е.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Общие подходы
Культура клеток и обработки
Первичную культуру эндотелиальных клеток пупочной вены человека (HUVECs) выделяли из пупочных канатиков. Клетки получали обработкой 0,1% раствором коллагеназы (Worthington, Lakewood, NJ, США). HUVECs выращивали в предварительно покрытых 0,2% желатином колбах для культивирования тканей (Corning, Cole-Parmer, Vernon Hills, IL, USA) на среде M-199 с 20% BCS и другими добавками, как описано для EA.hy926. Клетки EA.hy926 использовались до пассажа 37, HUVECs на пассаже 3-8. Моноциты U937 культивировали на среде RPMI 1640 с 10% BCS, L-глутамином и антибиотиками, как указано ранее. Для большинства экспериментов эндотелиальные клетки при достижении конфлуентности 70-90% подвергали голоданию на среде 5% BCS DMEM/M199 в течение 24 часов, и предварительно инкубировали с носителем или раствором каротиноидов на среде 5% BCS DMEM/M199 в течение 18-24 часов, и активировали с использованием 10 нг/мл TNF-α (Peprotech, Rocky Hill, NJ, США) в течение определенного времени.
Раствор каротиноидов
Исходные растворы (400 мкМ) олеорезина (Lycored Natural Products Ltd., Beer-Sheva, Израиль), содержащие или 6% или 7% ликопина, 0,1% β-каротина, 1% витамина Е и полифенолы, и композицию с низким содержанием ликопина по настоящему изобретению (полученную согласно вышеприведенному препаративному примеру 1) готовили в свежеприготовленном тетрагидрофуране (ТГФ), содержащем 0,025% бутилированного гидрокситолуола (БГТ) (оба производства Sigma, St. Louis, MO, США) в качестве антиоксиданта, и добавляли в культуральную среду под действием потока N2 и уменьшали освещение.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 1. ВЛИЯНИЕ КОМПОЗИЦИИ ИЗ ТОМАТОВ С НИЗКИМ СОДЕРЖАНИЕМ ЛИКОПИНА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ НА ЭКСПРЕССИЮ ОКСИДА АЗОТА (NO)
NO является ключевой сигнальной молекулой во многих биологических процессах и тканях. В случае сосудистых тканей эндотелий использует оксид азота для сигнала на расслабление окружающей гладкой мышце, что приводит к вазодилатации и увеличению кровотока. Кроме того, NO играет роль в регуляции функции сосудов ингибированием роста гладких мышц сосудов, агрегации тромбоцитов и адгезии лейкоцитов к эндотелию. Во многих случаях заболеваний человека, характеризующихся наличием поражений сердечно-сосудистой системы (таких как атеросклероз, диабет или гипертония) часто обнаруживается нарушение функции обмена NO.
В настоящем исследовании для оценки влияния композиции с низким содержанием ликопина (2%) по настоящему изобретению на индукцию NO использовали модель культивируемых эндотелиальных клеток коронарных сосудов человека. Это осуществлялось как прямым измерением продукции NO культивируемыми клетками, так и анализом активности фермента NO синтазы эндотелиальных клеток, peNOS. Результаты, полученные с использованием композиции по настоящему изобретению, сравнивали с результатами, полученными с использованием композиции из томатов с высоким содержанием ликопина 7% Lyc-O-Mato (производимой и поставляемой LycoRed Ltd., Be'er Sheva, Израиль).
Методы и материалы
Композицию с низким содержанием ликопина (2%) по настоящему изобретению (полученную, как описано выше, и различные контрольные растворы (среда, TNF и 7% Lyc-O-Mato) добавляли в конфлюентные культивируемые эндотелиальные клетки коронарных сосудов человека (высевали на 2 мл базальной среды для эндотелиальных клеток в 60 мм чашку) на 24 часа, после чего собирали супернатантную культуральную жидкость.
Анализ нитратов и нитритов
Нитриты и нитраты (NOx), стабильные продукты окисления оксида азота, определяли в культуральной среде, собранной через 24 часа после воздействия каротиноидов, с использованием реактива Грисса, используя метод, описанный в Miranda KM, Espey MG и Wink DA, 2001 (Nitric Oxide 5: 62-71; «A rapid, simple spectrophotometric method for simultaneous detection of nitrate and nitrite»).
Как отмечалось, эксперименты проводили при комнатной температуре или при 37°С в теплой комнате.
Анализ peNOS
Экспрессию фермента эндотелиальной NO синтазы peNOS оценивали с использованием анализа Western Blot, который хорошо известен в данной области. Вкратце, содержание белка в лизате эндотелиальных клеток количественно определяли с использованием набора для анализа белка BCA (Pierce, Rockford, IL, США). Эквивалентные количества клеточных белков разделяли 7,5% SDS-PAGE и переносили на нитроцеллюлозную мембрану. После пропускания и инкубации с первичным антителом peNOS относительные изменения в содержании белка количественно определяли с использованием денситометрии в отраженном свете.
РЕЗУЛЬТАТЫ
Как показано на фиг.2, при использовании в концентрации 5,0 мкМ композиция с низким содержанием ликопина (2%) по настоящему изобретению вызывала выраженное увеличение уровня индукции NO по сравнению с обоими контролями средой и TNF. Неожиданно 7% Lyc-O-Mato, также вызывающий заметное увеличение экспрессии NO, был гораздо менее активным в этом отношении (примерно в четыре раза), чем композиция по настоящему изобретению.
На фиг.3 представлены результаты, полученные путем анализа Western Blot уровней peNOS в культивируемых эндотелиальных клетках. Таким образом, из данной фигуры видно, что композиция с низким содержанием ликопина (2%) по настоящему изобретению (используемая при концентрации 1,0 мкМ) вызывает сильно выраженную индукцию peNOS по сравнению с обоими контролями средой и TNF. Этот результат заметно отличается от результата, полученного с использованием 7% Lyc-O-Mato (1,0 мкМ), который не вызывал никакого увеличения экспрессии peNOS по сравнению с необработанными клетками.
Из этих результатов можно сделать вывод, что композиция с низким содержанием ликопина по настоящему изобретению способна достоверно увеличивать индукцию NO в эндотелиальных клетках сосудов, и что этот эффект, по меньшей мере, частично вызван повышенной экспрессией фермента NO синтазы в указанных клеток. С учетом этих результатов можно сделать вывод о том, что композиция данной системы имеет соответствующую активность, которую можно использовать при лечении и профилактике различных типов сердечно-сосудистых заболеваний.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 2. СТИМУЛЯЦИЯ СИСТЕМЫ ТРАНСКРИПЦИИ ARE КОМПОЗИЦИЕЙ ИЗ ТОМАТОВ С НИЗКИМ СОДЕРЖАНИЕМ ЛИКОПИНА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Антиоксидант-респонсивные элементы (AREs) идентифицируются в промоторах генов и опосредуют транскрипционную индукцию батареи генов, которые содержат систему химиопротекторного действия. Указанная система необходима для устойчивости к воздействию широкого спектра канцерогенов. Кроме того, активация цитопротекторных ARE-регулируемых генов может подавлять воспалительные реакции, в то время как снижение экспрессии этих генов приводит к аутоиммунному заболеванию и усилению воспалительных реакций при окислительных повреждениях. Поэтому данная модель ARE используется также для определения противовоспалительного эффекта испытуемых композиций.
Целью настоящего исследования было оценить активность модифицированной композиции олеорезина с уменьшенным содержанием ликопина (0,7% вес./вес.) по настоящему изобретению в системе ARE. Результаты, полученные с использованием этой композиции, сравнивали с результатами, полученными с использованием LycoMato (содержащий 6% или 7% ликопина), присутствующих в эквивалентных молярных концентрациях ликопина.
Методы и материалы
Модель культуры клеток с использованием клеток рака молочной железы (T47D) и предстательной железы (LnCAP) использовалась для оценки активности композиции с низким содержанием ликопина по настоящему изобретению, полученной, как описано выше, в системе ARE. Указанная композиция с низким содержанием ликопина содержала 0,7% ликопина, 1,7% фитоена/фитофлуена, 2,4% фитостеролов и 2,5% витамина Е. Две имеющиеся на рынке композиции с высоким содержанием ликопина (LycoMato 6% и LycoMato 7%, производства LycoRed Ltd., Beʹer Sheva, Израиль) также испытывали с целью сравнения.
Культура клеток
Клетки рака предстательной железы человека LNCaP приобретали в Американской коллекции типовых культур (Manassas, VA, США) и выращивали на среде RPMI 1640, содержащей пируват натрия (0,11 мг/мл) и DHT (10-9 М). В каждую среду добавляли пенициллин (100 единиц/мл), стрептомицин (0,1 мг/мл), нистатин (12,5 мкг/мл), Hepes (10 мМ) и 10% FCS.
Клеточная линия рака молочной железы человека T47D была любезно предоставлена доктором Iafa Keydar (Тель-Авивский университет, Израиль). Клетки T47D выращивали на DMEM, содержащей инсулин (0,6 мкг/мл или 6 мкг мл).
Транзиентная трансфекция и анализ репортерного гена ARE
Клетки T47D трансфецировали с использованием реагента jetPEI (Polyplus Transfection, Illkrich, Франция) в 24-луночных планшетах (100000 клеток на лунку). Клетки промывали один раз соответствующей культуральной средой без сыворотки с последующим добавлением 0,45 мл среды, содержащей 3% DCC-FCS и 50 мкл смеси, содержащей ДНК и реагент jetPEI при соотношении зарядов 1:5. Общее количество ДНК составляло 0,25 мкг, содержащих 0,2 мкг репортерного гена и 0,05 мкг люциферазы Рениллы. Затем клетки инкубировали в течение 4-6 ч при 37°С в 95% воздуха/5% СО2. Среду заменяли на одну добавку 3% DCC-FCS плюс испытуемые соединения, и клетки инкубировали еще 16 ч.
Клетки LNCaP трансфецировали с использованием реагента jetPEI. Клетки (70000) высевали на 1 мл среды без фенольного красного, содержащей 3% DCCFCS. На следующий день удаляли 500 мкл среды и добавляли 50 мкл смеси, содержащей ДНК и реагент jetPEI при соотношении зарядов 1:10. Общее количество ДНК составляло 0,2 мкг, содержащих 0,16 мкг репортерного гена и 0,04 мкг векторов люциферазы Рениллы. Клетки инкубировали в течение 4-6 ч, после добавления испытуемых соединений в течение 24 ч.
Анализ репортерного гена люциферазы для оценки активности ARE
Клеточные экстракты готовили для анализа репортерного гена люциферазы (система анализа репортерного гена двойной люциферазы (DLR™), Promega) в соответствии с инструкциями производителя. Система анализа репортерного гена двойной люциферазы представляет собой эффективное средство для проведения анализа с двумя репортерными генами. При проведении анализа DLR™ последовательно определяют активности люцифераз светлячков (Photinus pyralis) и Рениллы (Renilla reniformis, также известной как морские анютины глазки) от одного образца. Сначала определяют репортерный ген люциферазы светлячков, добавляя реагент для анализа люциферазы II (LAR II) с получением стабилизированного люминесцентного сигнала. После количественного определения люминесценции светлячков эта реакция гасится и одновременно инициируется реакция люциферазы Рениллы добавлением реагента Stop&Glo® в ту же самую трубку. Реагент Stop&Glo® также производит стабилизированный сигнал от люциферазы Рениллы, который медленно затухает в процессе определения.
РЕЗУЛЬТАТЫ
Как показано на фиг.4, композиция с низким содержанием ликопина по настоящему изобретению индуцирует достоверно более высокую активность ARE, чем Lyc-O-Mato в клетках рака предстательной железы LNCaP при сравнении эквивалентных молярных концентраций ликопина. Наблюдаемый эффект зависит от дозы. Над точкой перегиба кривой (около 10 мкМ) различия между настоящей заявленной композицией и Lyc-O-Mato в отношении индукции ARE являются более достоверными.
Как показано на фиг.5, аналогичные результаты также получают, если композицию по настоящему изобретению добавляют в клетки рака молочной железы T47D. Таким образом, как и в случае с результатами, полученными с использованием клеток рака предстательной железы, настоящая заявленная композиция вызывала достоверно более высокую активность в системе ARE, чем наблюдаемая с использованием контролей Lyc-O-Mato.
Из этих результатов можно сделать вывод, что композиция с низким содержанием ликопина по настоящему изобретению является высокоактивным индуктором активности ARE. Таким образом, указанная композиция имеет потенциал для влияния на важные клеточные механизмы, которые имеют огромное значение и для профилактики рака, и для уменьшения воспаления.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 3. ИНГИБИРОВАНИЕ СИСТЕМЫ ТРАНСКРИПЦИИ NFκB КОМПОЗИЦИЕЙ ИЗ ТОМАТОВ С НИЗКИМ СОДЕРЖАНИЕМ ЛИКОПИНА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Экспрессию воспалительных цитокинов, а также экспрессию ферментного белка можно регулировать активацией фактора транскрипции ядерного фактора-каппа В (NFκB), который играет важную роль в нескольких аспектах патогенеза хронических воспалительных заболеваний. NFκB активируется вследствие фосфорилирования, убиквитинирования и последующей протеолитической деградации белка IκB посредством активации киназы IκB (IKK). Освобожденный NFκB перемещается в ядро и связывается с мотивами в промоторах провоспалительных генов, таких как индуцибельная синтаза оксида азота (iNOS), и циклооксигеназы-2 (ЦОГ-2), TNF-α и IL-1β, что приводит к индукции экспрессии их мРНК. Было показано, что многие ранее разработанные противовоспалительные лекарственные средства подавляют экспрессию этих генов ингибированием пути активации NFκB. Таким образом, ингибитор NFκB можно использовать в качестве потенциального терапевтического лекарственного средства в клинических применениях для регулирования заболеваний человека, связанных с воспалительными процессами.
Цель данного исследования заключалась в том, чтобы изучить, может ли композиция с низким содержанием ликопина по настоящему изобретению ингибировать систему транскрипции NFκB в клетках рака молочной железы T47D.
Результаты данного исследования представлены на фиг.6. На данной фигуре видно, что композиция с низким содержанием ликопина по настоящему изобретению вызывает достоверно большее ингибирование системы транскрипции NFκB в клетках рака молочной железы T47D, чем контроль 6% Lyc-O-Mato. Эти результаты представляют дополнительные доказательства высокой противовоспалительной активности композиции с низким содержанием ликопина по настоящему изобретению.
Реферат
Группа изобретений относится к фармацевтической и косметической промышленности и касается композиции, обладающей противовоспалительной активностью. Композиция, обладающая противовоспалительной активностью, содержащая ликопин, один или оба из фитоена и фитофлуена и фитостеролы томатов, при этом концентрация ликопина находится в диапазоне от 0,3% до 2% по весу, и при этом весовое соотношение ликопина и одного или обоих из фитоена и фитофлуена находится в диапазоне от 1:1 до 1:2,5, где указанную композицию получают из томатов, и где концентрация фитостеролов составляет, по меньшей мере, 2% по весу. Способ получения композиции, содержащей ликопин, один или оба из фитоена и фитофлуена и фитостеролы. Применение вышеописанной композиции, обладающей противовоспалительной активностью, для получения лекарственного средства. Применение вышеописанной композиции, обладающей противовоспалительной активностью, для получения косметического или космецевтического средства. Вышеописанная композиция, с пониженным содержанием ликопина, обладает выраженной противовоспалительной активностью. 4 н. и 7 з.п. ф-лы, 3 пр., 6 ил.

Комментарии