Рекомбинантный ген, кодирующий белок hbd-epo, рекомбинантная плазмидная днк pl610, способ получения рекомбинантного белка hbd-epo, рекомбинантный белок hbd-epo, композиция для специфической индукции регенерации костной ткани, способ специфической индукции - RU2664192C1
Код документа: RU2664192C1
Чертежи








Описание
Изобретение относится к областям: биотехнологии, генной инженерии, биохимии, медицине, ветеринарии.
Изобретение включает получение рекомбинантной плазмиды pL610 на основе вектора pQE6, содержащей синтетическую нуклеотидную последовательность гена, кодирующего белковую последовательность гепарин-связывающего домена (HBD) из Danio rerio, и нуклеотидную последовательность гена, кодирующего эритропоэтин (Еро) человека, причем последовательность оптимизирована для гетерологичной экспрессии гибридного рекомбинантного белка HBD-Epo в непатогенных лабораторных штаммах Escherichia coli. Изобретение также включает способ очистки белка HBD-Epo катионообменной и аффинной хроматографией на гепарин-сефарозе. Изобретение относится к самому рекомбинантному гибридному белку HBD-Epo, экспрессионной плазмиде pL610, способу применения белка в составе деминерализованного костного матрикса (ДКМ), содержащего HBD-Epo, а также способу применения белка в составе ДКМ, содержащего помимо HBD-Epo рекомбинантный костный морфогенетический белок 2 (ВМР-2) для регенерации дефектов костной ткани. Изобретение позволяет получать устойчивый биологически активный очищенный белок HBD-Epo, а также его форму, иммобилизованную на ДКМ, в том числе, на ДКМ с рекомбинантным ВМР-2.
Эритропоэтин - белок-гормон, или цитокин, под действием которого дифференцируются предшественники эритроцитов в костном мозге. Еро - главный регулятор эритропоэза в организме человека, участвующий в формировании эритроцитов и гормональной регуляции. Связываясь со специфическими рецепторами, Еро стимулирует деление и дифференцировку компетентных предшественников эритроцитов в костном мозге [Krantz S.B. Erythropoietin. Blood. 1991. Vol. 77(3), P. 419-434.]. Помимо влияния на эритропоэз Еро участвует в процессе заживления ран, при восстановлении поврежденных нервов, а также выполняет другие биологические функции.
Еро - гликопротеин, молекулярная масса полипептида Еро без сахарных остатков составляет 18,236 Да. У природной интактной молекулы Еро приблизительно 40% мол. массы составляют углеводные остатки, гликозилирование Еро происходит по специфическим сайтам гликозилирования [Sasaki Н., Bothner В., Dell A., Fukuda М. Carbohydrate structure of erythropoietin expressed in Chinese hamster ovary cells by a human erythropoietin cDNA. J. Biol. Chem. 1987. Vol. 262(25), P. 12059-12076.].
Еро применяется в клинической практике в виде раствора для парентерального применения [Martindale, the extra pharmacopoeia. Martindale, William, 1840-1902. Royal Pharmaceutical Society of Great Britain. Department of Pharmaceutical Sciences Edition 31st ed. /Ed. James E.F. Reynolds. London: Royal Pharmaceutical Society, 1996. Martindale, 1996 WHO Drug Information, Vol. 10(3), P. 146 1-165-erythropoietin (human clone λHEPOFL13 protein moiety), glycoform ω.].
Для клинического применения Еро получают биосинтезом в эукариотических клетках с помощью технологии рекомбинантной ДНК [Egrie J.С., Strickland T.W., Lane J., Aoki K., Cohen A.M., Smalling R., Trail G., Lin F.K., Browne J.K., Hines D.K. Characterization and biological effects of recombinant human erythropoietin. Immunobiology. 1986. Vol. 172(3-5), P. 213-224.]. Такой Еро является продуктом экспрессии гена человеческого Еро, клонированного в культуре клеток яичников китайского хомячка [Патенты РФ №2125093, №2070931, №2070931].
Рекомбинантные Еро человека доступны в продаже в виде молекулярных форм Epoetin alfa и Epoetin beta. Они применяются для лечения анемии при хронической почечной недостаточности (ХПН). Эти формы Еро имеют одну и ту же последовательность в 165 а.о., но различаются картиной гликозилирования и фармакокинетическим профилем. Epoetin alfa медленно и не полностью сорбируется при подкожном введении, его биодоступность составляет ок. 10-50% от биодоступности при внутривенном введении. Epoetin beta тоже всасывается медленно, его биодоступность составляет ок. 40%.
Разработаны и другие формы Еро, например, Epoetin delta, gamma и omega, а также Darbepoetin alfa - гипергликозилированный аналог рекомбинантного человеческого Еро альфа - период полувыведения которого примерно втрое выше при внутривенном введении, чем у рекомбинантного человеческого Еро альфа и нативного гормона [Egrie J.С, Dwyer E., Browne J.K., Hitz A., Lykos M.A. Darbepoetin alfa has a longer circulating half-life and greater in vivo potency than recombinant human erythropoietin. Exp Hematol. 2003. Vol. 31(4), P. 290-299.].
Поскольку Еро человека необходим для формирования красных кровяных клеток, гормон успешно применяют для лечения заболеваний, приводящих к снижению образования эритроцитов, например, для лечения анемии при ХПН и у пациентов с иммунодефицитом [Eschbach J.W., Egrie J.С., Downing M.R., Browne J.K., Adamson J.W. NEJM. 1987. Vol. 316, P. 73-78; Eschbach J.W., Abdulhadi, M.H., Browne J.K., Delano B.G., Downing M.R., Egrie J.C., Evans R.W., Friedman E.A., Graber S.E., Haley N.R.,. Ann. Intern. Med. 1989. Vol. 111, P. 992; Egrie J.C., Eschbach J.W., McGuire Т., Adamson J.W. Kidney Intl. 1988. Vol. 33, P. 262; Lim V.S., Degowin R.L., Zavala D., Kirchner P.T., Abels R., Perry P., Fangman J. Ann. Intern. Med. 1989. Vol. 110, P. 108-114.; Danna R.P., Rudnick S.A., Abels R.I. In: Garnick M.B., ed. Erythropoietin in Clinical Applications - An International Perspective. New York, N.Y.: Marcel Dekker; 1990: P. 301-324.].
Для лечения этих заболеваний белок вводится парентерально (в том числе, внутривенно), и, попадая в кровь, в течение короткого времени разрушается системой протеаз, что приводит к снижению эффективности терапии.
Предпринимались попытки улучшения фармакокинетических свойств Еро, а именно, удлинение периода полувыведения для снижения частоты инъекций, что достигалось получением производных Еро.
На этом пути применялось несколько подходов: (1) конъюгирование с (поли)пептидами, т.е. получение гибридного белка Еро с сильно гликозилированными пептидами и других белковых конъюгатов Еро; (2) химические модификации Еро (например, присоединение остатка полиэтиленгликоля - ПЭГ, полисахаридов); (3) получение в высокой степени сиалированного белка в рекомбинантной эукариотической системе; (4) инкапсулирование Еро.
Первый подход реализован в патентах [20160176940; 20170114110], в которых получили рекомбинантные гибридные белки - конъюгаты Еро с сильно гликозилированным пептидом, либо частью полипептида иммуноглобулина, что повышало период полувыведения in vivo и биологическую активность по сравнению с природным или рекомбинантным Еро человека.
ПЭГ-илирование, присоединение полисахаридных и др. остатков к Еро, достигалось посредством получения мутеинов Еро (с применением техники бесклеточного синтеза) с последующей их химической дериватизацией (ковалентной модификацией) [ЕР 1219636]. В основном, ПЭГ присоединялся к свободным сульфгидрильным группам мутеинов Еро.
Примеры применения этого подхода - продукт, разработанный Roche и известный как CERA (Constant Erythropoiesis Receptor Activator), а также Hematide - ПЭГ-илированный синтетический пептид для лечения анемии при ХПН и раке. Он описан у Fan et al. [Fan Q., Leuther K.K., Holmes C.P., Fong K.L., Zhang J., Velkovska S., Chen M.J., Mortensen R.B., Leu K., Green J.M., Schatz P.J., Woodburn K.W. Preclinical evaluation of Hematide, a novel erythropoiesis stimulating agent, for the treatment of anemia. Exp. Hematol. 2006. Vol. 34 (10), P. 1303-1311.], аналогом его является препарат МИРЦЕРА (производимый согласно патенту [WO №2002/049673]). Способы получения Еро, конъюгированного с ПЭГ, описаны в патентах [RU 2433134 C1; U.S. Pat. No. 7,128,913; 20170008941; US 2004/0082765; 20160317674]. Ковалентное конъюгирование Еро с неантигенными гидрофильными полимерами (полиалкеноксидами, полиамидами, углеводами - анионным полисахаридом, полисиаловыми кислотами), ковалентно связывающимися с ним, также повышает период полувыведения полученного конъюгата [U.S. Pat. No. 7,074,755; U.S. Pat. No. 5,846,951; WO-A-0187922; 20170119893].
Известен способ получения рекомбинантной клеточной линии [20170129932], клетки которой синтезируют рекомбинантные гликопротеины, в частности, Еро, содержащий большое количество остатков сиаловой кислоты.
Примерами инкапсулированных форм Еро являются нанокапсулированная форма рекомбинантного Еро человека [Патент №: 2518329] (кроме удлинения периода полувыведения, нанокапсулы с Еро обладают высокой проникающей способностью), липосомальная форма Еро [РФ №2218914], липидная фаза которой содержит заряженное липидное соединение и холестерин, а также микрокапсулированная (в виде микросфер) форма Еро [CN 102233129], которая включает Еро. как активный компонент, и декстран в качестве защитного (стабилизирующего) агента для активного компонента.
Описанные выше способы производства рекомбинантного Еро в эукариотических клетках имеют общий недостаток - низкий выход белка и связанную с этим высокую стоимость целевого продукта. Поиск пути преодоления этой проблемы привел к разработке системы гетерологичной экспрессии гена, кодирующего рекомбинантный белок, в прокариотических клетках [Wang Y.J., Liu Y.D., Chen J., Hao S.J., Hu Т., Ma G.H., Su Z.G Efficient preparation and PEGylation of recombinant human non-glycosylated erythropoietin expressed as inclusion body in E. coli. Int. J. Pharm. 2010. Vol. 386 (1-2), P. 156-164.]. С точки зрения получения белка Еро прототипом и ближайшим аналогом настоящего изобретения является указанный способ. Этим способом достигается продукция негликозилированного рекомбинантного белка (мол. массой ~18,4 кДа) в составе телец включения, которые растворяют в денатурирующих восстанавливающих условиях, затем проводится очистка белка катионообменной хроматографией и гель-фильтрацией до гомогенного при электрофорезе состояния.
По сравнению с указанным прототипом [Wang Y.J., Liu Y.D., Chen J., Hao S.J., Hu Т., Ma G.H., Su Z.G. Efficient preparation and PEGylation of recombinant human non-glycosylated erythropoietin expressed as inclusion body in E. coli. Int J Pharm. 2010. Vol. 386(1-2), P. 156-164.], предлагаемый настоящим изобретением способ получения рекомбинантного Еро отличается тем, что последовательность рекомбинантного белка содержит в своем составе кроме Еро также последовательность гепарин-связывающего домена (HBD). Наличие гепарин-связывающего домена обеспечивает возможность иммобилизации Еро на гепарин-содержащем сорбенте. Благодаря наличию HBD также возможна аффинная очистка целевого белка HBD-Epo на гепарин-содержащем сорбенте (например, гепарин-сефарозе), и тем самым исключается этап очистки HBD-Epo гель-фильтрацией. Введение иммобилизованного на сорбенте, содержащем гепарин, например, деминерализованном костном матриксе (ДКМ), Еро в организм должно приводить к постепенному дозированному выходу фактора в окружающие ткани и, тем самым, обеспечивать пролонгированное действие и высокую локальную концентрацию Еро, что может быть полезным для некоторых вариантов использования фактора, в частности, при его применении для репарации дефектов костной ткани.
Гепарин-связывающие домены - природные аминокислотные последовательности, образующие комплекс с гепарином за счет ионных взаимодействий, присутствуют во многих белках [


Известны различные способы введения Еро в организм. В большинстве случаев Еро вводится в организм человека парентеральным путем (инъекционно) [Николаев А.Ю., Клепиков П.В., Лашутин С.В., Кухтевич А.В. Эффективность сочетания Еро-кальцитриол у больных с хронической почечной недостаточностью, находящихся на программном гемодиализе. Терапевтический архив. 1995. Т. 67, С. 27-31; Патент СССР №1801118].
Терапевтический эффект рекомбинантного человеческого Еро при парентеральном введении очевиден и описан во многих работах, но в тех же работах указывается и на его нежелательное побочное действие, приводящее к различным осложнениям. Введение парентеральных лекарственных форм, содержащих рекомбинантный человеческий Еро в больших дозах, может привести к нарушению гомеостаза и стать причиной возникновения дополнительных рисков для больного [Синюхин В.Н. Стецюк Е.А., Ловчинский Е.В. Фармакокинетика рекомбинантного человеческого эритропоэтина. Терапевтической архив. 1994. Т. 66, С. 60-62.].
Для решения этой проблемы была разработана лекарственная форма для приема внутрь «Репорон» [Заявка: 97108814/14, 22.05.1997 RU], которую получали смешиванием рекомбинантного Еро со стабилизирующими добавками в определенных пропорциях.
Известен также ингаляционный способ введения Еро в легкие человека [N 94/17784, 1994.].
Все описанные ранее способы введения в организм подразумевают системное поступление Еро через кровь.
Однако, учитывая многочисленные, проявляющиеся в различных органах - спинном и головном мозге, периферических нервах, сетчатке глаза, сердце и почках - эффекты Еро (в т.ч. антиапоптотический), реализующиеся через каскады белкового фосфорилирования и вовлекающие PI3K, Akt, NF-κВ и, таким образом, активирующие факторы транскрипции [Sharples E.J., Thiemermann С., Yaqoob М.М. Novel applications of recombinant erythropoietin. Curr Opin Pharmacol. 2006. Vol. 6(2), P. 184-189.], логично предположить, что при повреждении тканей и органов терапевтический эффект будет проявляться и при местном применении Еро (аппликации).
Открытие такого факта, как стимуляция образования кости Еро, послужило предпосылкой для исследования возможности местного применения Еро [Sun Н., Jung Y., Shiozawa Y., Taichman R.S., Krebsbach P.H. Erythropoietin modulates the structure of bone morphogenetic protein 2-engineered cranial bone. Tissue Eng Part A. 2012. Vol. 18(19-20), P.2095-2105;
Авторы работы
Авторы Sun et al., 2012 после создания краниальных дефектов критического размера в черепе мыши вводили Еро местно путем инъекции в область дефекта через день в течение 2 недель (доза 1000ед./мл Еро - Еро альфа, EPOGEN, Amgen, доза рассчитывалась на вес животных из расчета 1000 ед./кг). По данным микрокомпьютерной томографии, Еро достоверно усиливал индуцированное ВМР-2 формирование кости в зоне дефекта (т.е. наблюдалась синергия эффектов ВМР-2 и Еро).
Также был показан аддитивный эффект Еро при одновременном введении с ВМР2. В работе группы Patel et al., 2015 проводили оценку влияния на остеогенез при одновременном введении двух цитокинов, стимулирующих этот процесс - Еро (200 IU/mL) и BMP2 (65 μg/mL), введенных эктопически (подкожно) на носителе из полиэпсилонкапролактона. Имплантаты с Еро + ВМР2 и только с ВМР2 вводили подкожно. На 4 и 8 неделях анализировали прирост костной ткани в объеме имплантата с помощью томографии и гистологии. При этом при совместном введении цитокинов объем новообразованной костной ткани превышал на 31% этот показатель в варианте с введением только ВМР2.
В работе Li et al., 2015 исследован эффект однократного локального введения 10 и 20 ед. Еро в цилиндрический челюстной дефект диаметром ~1 мм у крыс. Наиболее выраженное отличие от контроля наблюдалось на 4 неделе после операции - вариант с внесением 20 ед Еро более чем в 3 раза отличался от контрольного.
Очень хорошие результаты по восстановлению костной ткани на модели перелома бедренной кости мышей получены Holstein et al., 2011 также и при системном введении Еро, при ежедневном интерперитонеальном введении цитокина из расчета 500 ед./кг веса животного. Расстояние между сегментами кости составляло 1,8 мм, и фиксировалось с помощью металлической скобы. Исследовано три варианта - контроль, перелом с удалением надкостницы и без удаления надкостницы. На двухнедельном сроке разница между экспериментальным и контрольным вариантом составляла 71,4%, а после 10 недель результат по приросту объема костной ткани при применении Еро превысил контрольный вариант более чем в 2 раза.
Из приведенных примеров прототипов (
Для увеличения периода удержания активного белка, в том числе Еро, в месте аппликации можно использовать активный белок, иммобилизованный на биологически совместимом материале, например, ДКМ. В настоящем изобретении этот подход решается путем получения гибридного белка Еро с полипептидным гепарин-связывающим доменом HBD (конструкции HBD-Epo). Отличие настоящего изобретения от прототипов [Sun Н., Jung Y., Shiozawa Y., Taichman R.S., Krebsbach P.H. Erythropoietin modulates the structure of bone morphogenetic protein 2-engineered cranial bone. Tissue Eng Part A. 2012. Vol. 18(19-20), P.2095-2105;
Отличие от прототипа [Wang Y.J., Liu Y.D., Chen J., Hao S.J., Hu Т., Ma G.H., Su Z.G Efficient preparation and PEGylation of recombinant human non-glycosylated erythropoietin expressed as inclusion body in E. coli. Int. J. Pharm. 2010. Vol. 386(1-2), P. 156-164.] и других перечисленных способов дериватизации Еро состоит в том, что вместо получения ПЭГ-илированных производных Еро, как предлагалось в прототипе, и других описанных выше способов дериватизации Еро, включение HBD в последовательность гибридного белка позволяет связывать (иммобилизовать) гибридный белок HBD-Epo на гепарин-содержащих носителях (например, деминерализованном костном матриксе, ДКМ), что удлиняет период полувыведения Еро из организма.
Техническое решение изобретения выражается в получении рекомбинантного белка HBD-Epo в клетках непатогенных прокариотических микроорганизмов (штаммов Escherichia coli), тем самым достигается удешевление получаемого продукта, и в повышении биодоступности Еро путем получения химерного варианта Еро с гепарин-связывающим доменом и его иммобилизации на ДКМ при местном применении в зоне поражения (внесении в дефект кости при переломе или другом повреждении костной ткани, нанесении на раневую поверхность или введении в окружающие мягкие ткани при раневом процессе).
Сущность изобретения состоит в том, что получают плазмиду, содержащую рекомбинантный ген HBD-Epo. Синтетическую ДНК с последовательностью, соответствующей гену, кодирующему белок HBD-Epo, спланированную таким образом, чтобы нуклеотидный состав кодонов был оптимизирован для гетерологичной экспрессии в непатогенном лабораторном штамме Е. coli, фланкируют на 5'-конце сайтом NcoI, а на 3'-конце - сайтом Kpn2I. Этот синтетический ген встраивают в плазмиду pQE6 по сайтам NcoI и Kpn2I и получают плазмиду pL610. После трансформации полученной плазмидой pL610 штамма Е. coli M15 [pREP4] получают штамм-продуцент Е. coli M15 [pREP4, pL610] с продукцией рекомбинантного белка HBD-Epo в тельцах включения. Расчетная молекулярная масса рекомбинантного белка HBD-Epo составляет ~20,5 кДа. Белок HBD-Epo восстанавливают в растворе, содержащем дитиотреитол или меркаптоэтанол, и очищают колоночной хроматографией на катионообменном сорбенте в качестве неподвижной фазы в денатурирующих условиях, после чего активную форму HBD-Epo концентрируют на катионообменном и/или аффинном сорбенте (гепарин-сефарозе).
Получают рекомбинантный биологически активный белок Еро, содержащий гепарин-связывающий домен (HBD-Epo), высокой степени чистоты, способный к сорбции на ДКМ, имеющем в своем составе гепарин.
Для этого получают синтетическую последовательность ДНК, кодирующую белок HBD-Epo. Настоящий способ отличается от прототипа [Wang Y.J., Liu Y.D., Chen J., Нао S.J., Hu Т., Ma G.H., Su Z.G. Efficient preparation and PEGylation of recombinant human non-glycosylated erythropoietin expressed as inclusion body in E. coli. Int J Pharm. 2010. Vol. 386(1-2), P. 156-164.] тем, что для обеспечения высокого уровня продукции рекомбинантного белка HBD-Epo в гетерологичной системе проводят оптимизацию кодонов. Спланированная кодирующая последовательность ДНК отличается от нативной последовательности ДНК Еро человека нуклеотидным составом. Этот прием позволяет получить высокоэффективную продукцию рекомбинантного белка HBD-Epo в нерастворимой фракции в количестве около 30% от суммарного белка клетки.
Заявляемая группа изобретений позволяет получить оптимальную для гетерологичной экспрессии синтетическую последовательность ДНК, кодирующую рекомбинантный белок HBD-Epo, обеспечивающую высокий уровень продукции белка HBD-Epo в непатогенных лабораторных экспрессионных штаммах Е. coli; проводить простую и эффективную очистку белка HBD-Epo в биологически активной форме, и в этой форме связываться с ДКМ и эффективно и специфически ускорять регенерацию костной ткани; создавать активные биологически-совместимые композиции на основе рекомбинантного белка с использованием ДКМ (в том числе, ДКМ, содержащем другие активные компоненты, например, рекомбинантный ВМР-2) в качестве матрикса-носителя биологически активного белка HBD-Epo.
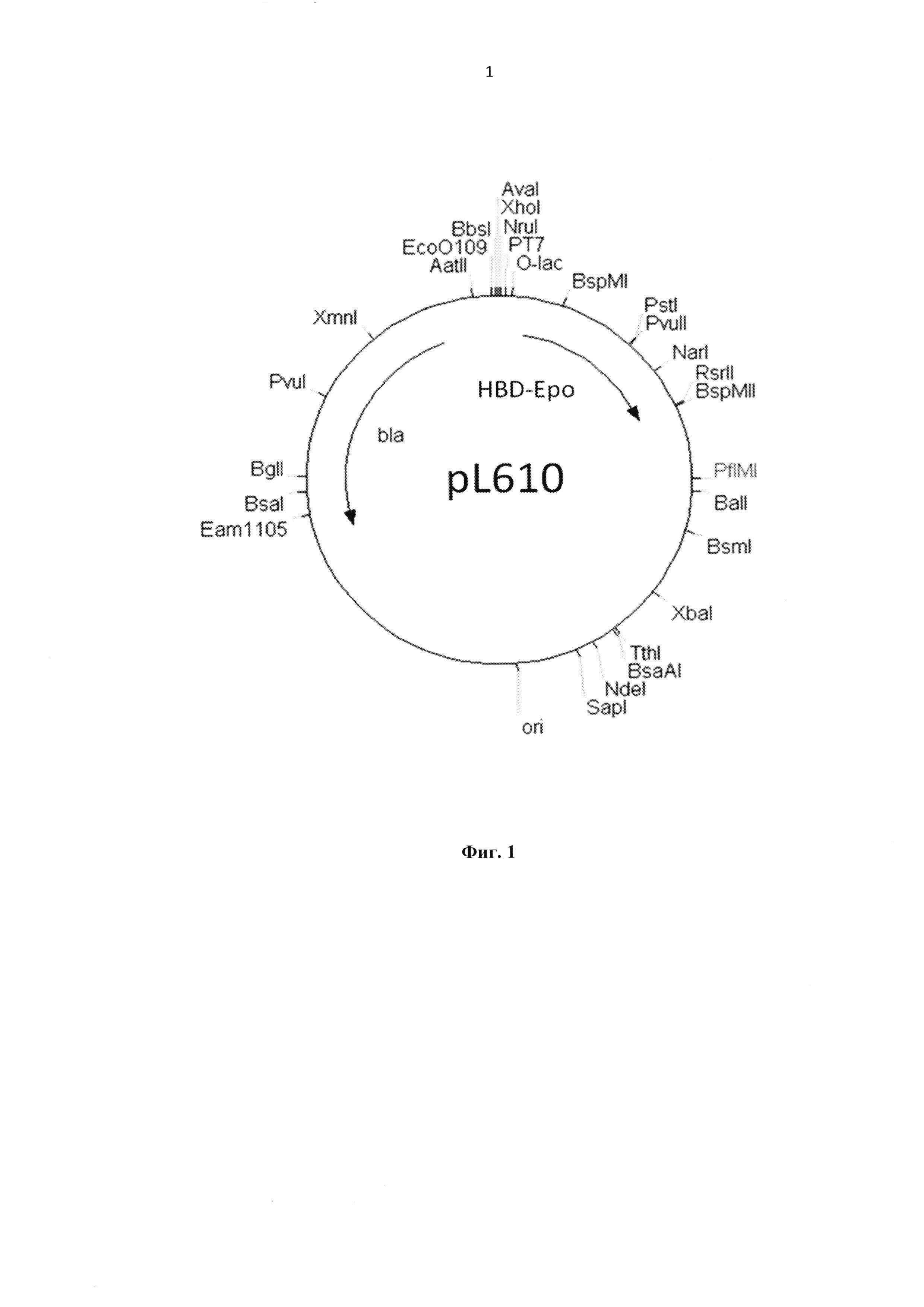
Указанный результат достигается за счет синтеза рекомбинантного белка HBD-Epo в клетках лабораторного штамма Е. coli, несущих рекомбинантную плазмиду pL610 (пример 1, фиг.1) с нуклеотидной последовательностью SEQ ID NO 1, а также за счет создания комплексного препарата HBD-Epo, иммобилизованного на ДКМ и на ДКМ, содержащем ВМР-2 (пример 4).
Рекомбинантный белок HBD-Epo имеет аминокислотную последовательность SEQ ID NO 2, включающую последовательность аминокислотных остатков гепаринсвязывающего домена из Danio rerio (SEQ ID NO 3), последовательность аминокислотных остатков спейсера (SEQ ID NO 4), последовательность аминокислотных остатков белка Еро из Homo sapiens (SEQ ID NO 5). Расчетное значение молекулярной массы белка 20520,51 Да; расчетное значение ИЭТ 9,62.
Техническим результатом, достигаемым при осуществлении изобретения, является получение высокого уровня продукции белка HBD-Epo (пример 2, фиг. 2), который после очистки формирует стабильную активную форму, способную связываться с гепарином ДКМ и индуцировать ускоренную регенерацию костной ткани.
Активность рекомбинантного белка HBD-Epo в растворе была исследована in vitro на линии клеток эритролейкемии человека TF-1 (АТСС CRL-2003). Результат проявился в виде специфической стимуляции пролиферации клеток и развития окраски при добавлении к клеткам специфического субстрата (пример 3, фиг. 3).
В части формулирования препарата рекомбинантного белка HBD-Epo, иммобилизованного на ДКМ, технический результат достигается за счет создания рекомбинантного белка HBD-Epo с последовательностью SEQ ID NO 2, а также за счет получения композиции, в которой рекомбинантный белок HBD-Epo содержится в виде комплекса с гепарином в составе ДКМ и в виде комплекса с гепарином в составе ДКМ, содержащего ВМР-2 (пример 4).
Кроме того, техническим результатом является то, что указанные биологически активные композиции специфически и эффективно индуцируют регенерацию костной ткани.
Специфичность и эффективность комплексных препаратов HBD-Epo - ДКМ и HBD-Epo - ВМР-2 - ДКМ были исследованы на мышиной модели краниальных дефектов критического размера (ДКР), (пример 5, фиг. 4).
Изобретение также включает способ специфической индукции регенерации костной ткани, включающий заполнение дефектов костной ткани фрагментами деминерализованного костного матрикса с иммобилизированным на них рекомбинантным белком HBD-Epo или фрагментами деминерализованного костного матрикса с иммобилизированными на них рекомбинантными белками HBD-Epo и ВМР-2.
Описание фигур
На фиг. 1 представлена Рекомбинантная плазмидная ДНК pL610, которая имеет размер 3583 н.п. и содержит искусственный бактериальный оперон рекомбинантного белка HBD-Epo, включающий: промоторную область раннего промотора бактериофага Т5 (7 - 87 н.п.), ген рекомбинантного белка HBD-Epo (117 - 674 н.п.), терминатор транскрипции (695 - 812 н.п.); бактериальный оперон бета-лактамазы (устойчивость к ампициллину) (3368 - 2518 н.п. комплементарной цепи); бактериальный участок инициации репликации типа ColE1, обеспечивающий репликацию плазмиды в штаммах Е. coli (1755 н.п.), кодирует синтез рекомбинантного белка HBD-Epo.
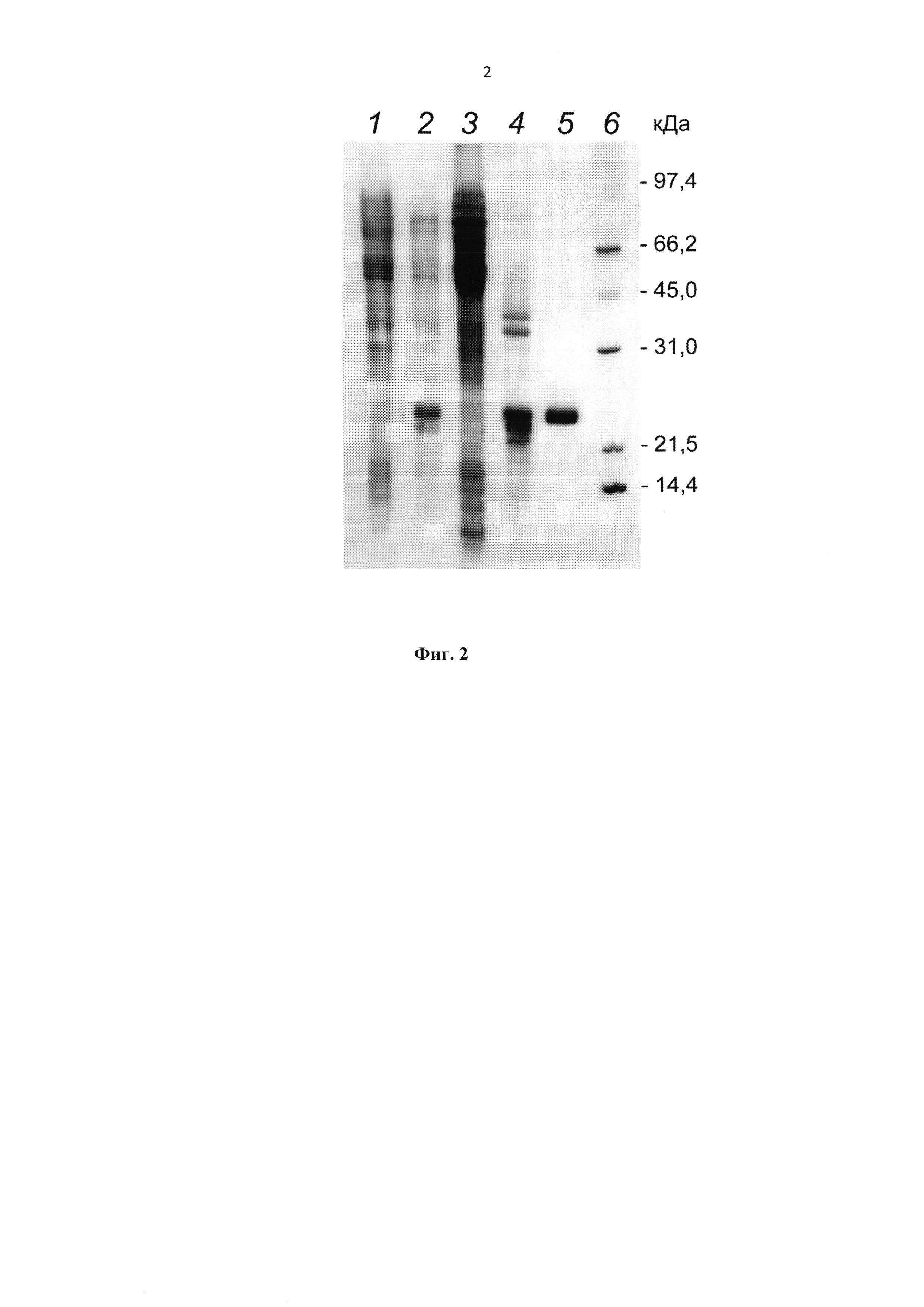
На фиг. 2 представлена Электрофореграмма образцов рекомбинантного белка HBD-Epo на различных стадиях очистки. Дорожки: 1 - экстракт клеток продуцента до индукции IPTG, 2 - экстракт клеток продуцента после индукции IPTG, 3 - супернатант (легко растворимые клеточные белки продуцента), 4 - отмытые тельца включения, 5 - элюат с колонки с катионообменным сорбентом, 6 - маркеры молекулярной массы.
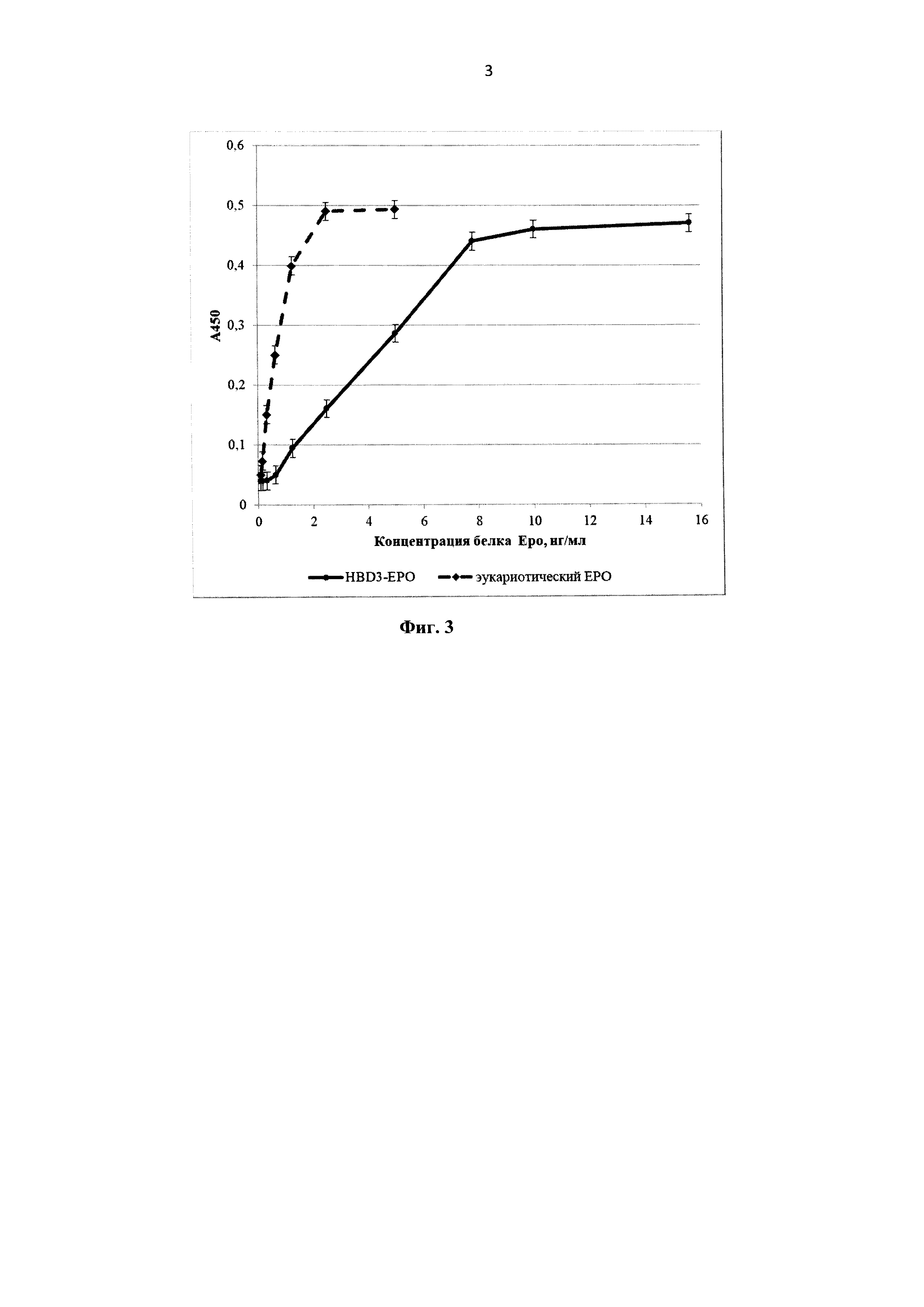
На фиг. 3 представлен График зависимости оптической плотности в лунке от концентрации образца при определении специфической активности HBD-Epo in vitro. Прерывистой линией с маркерами в виде ромбов изображен график, полученный с эукариотическим эритропоэтином, сплошной линией с закрашенными кружками - с HBD-Epo.
На фиг 4 представлены Томограммы дефектов через 9 недель после операции (контроль-1 - незаполненные ДКР; контроль-2 - ДКМ; опыт-1 - ДКМ + ВМР-2; опыт-2 - ДКМ + HBD-Epo; опыт-3 - ДКМ + ВМР-2 + HBD-Epo).
Изобретение проиллюстрировано следующими примерами, приведенными ниже.
Пример 1
Получение плазмиды pL610, несущей ген HBD-Epo
Генно-инженерные и микробиологические манипуляции, амплификацию и секвенирование ДНК проводили по стандартным методикам [Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование, М.: Мир. 1984. Клонирование ДНК. Методы. Под ред. Д. Гловера, Пер. с англ., М.: Мир. 1988; Saiki R.K., Gelfand D.H., Stoffel S., Scharf S.J., Higuchi R., Horn G.T., Mullis K.B., Erlich H.A. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science. 1988. Vol. 239, P. 487-491; Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors (DNA polymerase/nucleotide sequences/bacteriophage ФХ174). Proc. Nat. Acad. Sci. 1977. Vol. 74, P. 5463-5467.].
Синтетическая последовательность ДНК, соответствующая гену, кодирующему белок HDB-Epo, была спланирована таким образом, чтобы нуклеотидный состав кодонов был оптимизирован для гетерологичной экспрессии в непатогенном лабораторном штамме Е. coli. Этот синтетический ген HBD-Epo был фланкирован на 5'-конце сайтом NcoI, а на 3'-конце - сайтом Kpn2I. Синтетический ген встраивали в плазмиду pQE6 по сайтам NcoI и Kpn2I, для инициации и остановки трансляции были предусмотрены стартовый и терминирующий кодоны.
а) Химический синтез гена.
Ген HBD-Epo был синтезирован фирмой Евроген (Россия). По кодонному составу ген HBD-Epo был оптимизирован для экспрессии в Е. coli и был фланкирован на 5'-конце сайтом NcoI, а на 3'-конце - сайтом Kpn2I. Оптимизацию кодонного состава синтетического гена проводили с помощью программы JCat (http://www.jcat.de/), корректировку вторичной структуры транскрибируемой РНК - с помощью веб-сервера DINAMelt (http://mfold.rna.albany.edu/?q=DINAMelt/Two-state-folding).
б) Получение и клонирование рекомбинантного гена HBD-Epo в вектор pQE6.
Синтетический ген встраивали в плазмиду pQE6 по сайтам NcoI и Kpn2I. Полученной конструкцией pL610 (фиг. 1) с нуклеотидной последовательностью SEQ ID NO 1 трансформировали штамм Е. coli M15 [pREP4] и получали штамм-продуцент Е. coli M15 [pREP4, pL610] с уровнем продукции белка HBD-Epo равным 30% от тотального белка клетки.
Пример 2
Биомассу продуцента ресуспендировали в 5-10-кратном объеме буферного раствора: 10-100 мМ Трис-HCl, рН 7,0-8,0, 50 мМ NaCl, 1 мМ фенилметилсульфонилфторида (PMSF) и добавляли лизоцим из расчета 100 мкг/мл суспензии клеток. Инкубировали 1 ч при комнатной температуре, периодически перемешивая. Обрабатывали полученную суспензию ультразвуком для дезинтеграции клеток с помощью ультразвукового дезинтегратора. Центрифугировали 30 мин при 10000 g и температуре 5°C. Целевой белок находился в тельцах включения (ТВ), т.е. в осадочной фракции. Супернатант декантировали и отмывали осадок 10-кратным объемом буферного раствора: 10 мМ Трис-HCl, рН 8,0, 500 мМ NaCl, 1% Тритон Х-100. Отмытые ТВ растворяли в 5-кратном объеме раствора 8 М мочевины в буфере 10-100 мМ Трис-HCl, рН 8,0, с 50 - 100 мМ дитиотреитола (ДТТ). Содержание целевого белка в промытых ТВ составляло порядка 80% (оценено по денситограмме электрофореграммы, полученной после электрофореза в 15%-ном полиакриламидном геле и окраски Кумасси голубым R-250). Очистку белка HBD-Epo проводили методом колоночной катионообменной или аффинной (на гепарин-содержащем сорбенте - гепарин-сефарозе) хроматографии в денатурирующих условиях в 10-100 мМ Трис-HCl, рН 8,0, содержащем 6-8 М мочевины. Электрофореграмма образцов рекомбинантного белка HBD-Epo на различных стадиях до и в процессе очистки представлена на фиг. 2.
Полученные фракции очищенного белка диализовали против 10 мМ Na-фосфатного буфера, рН 4,5-5,5, и замораживали при -70°C.
Пример 3
Оценка биологической активности HBD-Epo in vitro. Биологическую активность препаратов HBD-Epo оценивали in vitro в пролиферативном тесте на линии клеток эритролейкемии человека TF-1 (АТСС CRL-2003). Клетки культивировали при 37°C, в атмосфере 5% CO2, в среде RPMI 1640 («Панэко», Россия) с добавлением 10% эмбриональной телячьей сыворотки («HyClone», США), гентамицина («Панэко», Россия) до концентрации 10 мкг/мл и гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) («Панэко», Россия) в конечной концентрации 2 нг/мл. Перед использованием в тесте по определению специфической активности клетки проходили инкубацию в течении 22-26 ч в среде с минимальным (0,5%-ным) содержанием сыворотки без добавления ГМ-КСФ и других факторов роста при 37°C, в атмосфере 5% CO2. После этого клетки отмывали от культуральной среды путем центрифугирования при 800 об/мин, отбора супернатанта и ресуспендирования осадка клеток в холодной среде RPMI 1640. Процедуру повторяли 3 раза. После третьей процедуры центрифугирования клеточный осадок суспендировали в таком объеме тестовой среды (RPMI 1640 с добавлением 5% эмбриональной телячьей сыворотки, 10 мкг/мл гентамицина, без ГМ-КСФ), чтобы получившаяся концентрация клеток была в пределах 600-800 тыс. клеток в 1 мл. Образцы HBD-Epo стерилизовали с помощью фильтрационной насадки 0,2 мкм («Corning», Германия) и разводили в тестовой среде. Готовили 96-луночные планшеты с различными концентрациями образцов, разведенных в тестовой среде (объем в лунке 50 мкл, двоичные разведения от 1000 нг/мл до 4 нг/мл и от 10 нг/мл до 0,04 нг/мл). В качестве отрицательного контроля использовали среду без HBD-Epo, в качестве препарата сравнения - рекомбинантный ЕРО из клеток млекопитающих - Эпостим (эпоэтин бета) («Фармапарк», Россия). Подготовленные клетки вносили по 50 мкл (30-40 тыс. клеток) в лунки планшета, содержавшие образцы. Планшет инкубировали в течение 68-72 ч при 37°C, в атмосфере 5% СО2. После окончания инкубации в каждую ячейку планшета добавляли по 10 мкл субстратной смеси WST-1 («Roche», Швейцария). Далее инкубировали планшет при 37°C, в атмосфере 5% СО2 в течение 5-6 ч при визуальном контроле развития окрашивания. Оптическую плотность в лунках планшета измеряли при длине волны 450 нм на планшетном спектрофотометре Tecan Infinite М 200 Pro («Tecan Group Ltd.», Швейцария). График зависимости оптической плотности в лунке от концентрации образца при определении специфической активности HBD-Epo in vitro представлен на фиг. 3. Удельная активность HBD-Epo, рассчитанная по регрессионной модели, составляла 12,4% от активности эукариотического эритропоэтина.
Пример 4
Получение дисков из ДКМ с иммобилизированным на них рекомбинантным белком HBD-EPO, а также HBD-EPO и ВМР-2.
Для получения мембран из ДКМ диафизы бедренных костей крупного рогатого скота с помощью ленточной пилы разрезали на слои толщиной 1 мм и в таком виде проводили обезжиривание, декальцинирование и депротеинизацию с целью удаления неколлагеновых белков, после чего вырезали диски диаметром 4 мм и лиофилизировали. Для иммобилизации HBD-Epo каждый диск помещали в 100 мкл раствора, содержащего 10 мкг HBD-Epo в буфере, содержащем 0,5 М NaCl и 25 мМ Трис-HCl, рН 7,5, инкубировали 3 часа, после чего проводили трехкратную отмывку тем же буфером и лиофилизацию. Содержание HBD-Epo составляло 10 мкг на один диск. После этого диски замораживали лиофильно высушивали и стерилизовали радиационным способом (значение поглощенной дозы 20±5 кГр). Полученные таким образом диски использовали для имплантации в краниальные дефекты мышей (пример изобретения 5).
Для иммобилизации HBD-Epo на дисках из ДКМ, содержащих также ВМР-2, проводили процедуру, аналогичную вышеописанной, но для инкубации использовали раствор, содержащий также 10 мкг рекомбинантного ВМР-2. Такие диски содержали 10 мкг HBD-Epo и 10 мкг ВМР-2 на один диск.
Пример 5
Оценка биологической активности HBD-Epo на модели регенерации костной ткани. Биологическую активность препаратов HBD-Epo оценивали in vivo на мышиной модели краниальных дефектов критического размера. Исследование выполняли на 30 аутбредных мышах ICR (CD-I), самцах возраста 38-47 дней.
Животных вводили в общий наркоз с помощью внутрибрюшинной инъекции препаратов «Золетил 100» (15 мг/кг массы тела) и «Рометар» (6 мг/кг массы тела). Операцию проводили в ламинарном боксе (Lamsystems, Россия) на термостатируемом хирургическом столике для лабораторных животных (Medax, Германия) при постоянной температуре 37°C. Подготовив хирургическое поле, в теменной области черепа скальпелем осуществляли кожно-мышечный разрез в саггитальной плоскости длиной 6-7 мм, после чего в теменных костях создавали ДКР диаметром 4 мм с помощью аппарата для хирургии и имплантологии Surgic АР (NSK Nakanishi Inc., Япония) при скорости вращения трепана 800 об/мин и моменте силы 0,10-0,15 Н⋅м. Место контакта трепана с костью постоянно охлаждали стерильным физраствором. По окончании операции рану послойно ушивали атравматической саморассасывающейся нитью Викрил 4/0 (Ethicon, Бельгия) и обрабатывали антибиотиком «Террамицин» (Pfizer Animal Health, США).
Животных делили на 5 групп по 6 мышей в каждой: незаполненные ДКР (контроль-1), с имплантацией дисков ДКМ (контроль-2), дисков ДКМ с костным морфогенетическим белком 2 (Bone Morphogenetic Protein 2, ВМР-2) (опыт-1), дисков с HBD-Epo (опыт-2) и дисков с ВМР-2 и HBD-Epo (опыт-3).
Микрокомпьютерную томографию выполняли на приборе SkyScan 1176 (Bruker, США) сразу после операции, а также через 3, 6 и 9 недель после операции. Анестезированных животных размещали в «кроватке» томографа в лежачем положении, фиксировали тело и голову с помощью бумажного скотча для полной иммобилизации. Сканирование осуществляли в одном поле зрения камеры с использованием алюминиевого фильтра толщиной 0,5 мм при напряжении 60 кВ, силе тока 575 мА, разрешении 35 мкм, экспозиции 240 мс, шаге 0,5°, угле поворота камеры 180°. Обработку данных проводили в программном обеспечении SkyScan. Полученный набор данных реконструировали при значениях сглаживания «2», коррекции кольцевых артефактов «2», коррекции жесткости излучения «5». В наборе реконструированных данных для анализа ДКР выбирали область интереса цилиндрической формы диаметром 4 мм и высотой 15 срезов, соответствующей 1,5 мм. В выбранной области интереса рассчитывали значения следующих морфологических параметров: объем всех тканей, объем костной ткани, площадь поверхности всех тканей, площадь поверхности костной ткани, доля костной ткани, плотность костной ткани.
Через 60 суток после имплантации материалов животных эвтаназировали в CO2-камере (ООО «НПК Открытая Наука», Россия) и проводили некропсию участка свода черепа с ДКР. Для проведения гистоморфометрического анализа образцы черепа с ДКР делили во фронтальной плоскости на 2 части, одну из них декальцинировали. Образцы заливали в парафин, деминерализованные срезы окрашивали гематоксилином и эозином, недеминерализованные - ализариновым красным и по фон Косса. В препаратах оценивали степень неоваскуляризации; площадь всех тканей и костной ткани измеряли в «ImageJ».
Статистическую обработку данных проводили с использованием непараметрического критерия Краскела-Уоллиса в Statistica 12.0 (StatSoft, США).
Через 9 недель после операции дефекты в 1 группе (контроль-1) заполнялись соединительной тканью с небольшими очагами костной ткани, во 2 группе (контроль-2) - фиброваскулярной соединительной тканью с остеоидом, в 3, 4 и 5 группах (опыт-1, 2, 3) - фиброваскулярной соединительной тканью, остеоидом и зрелой костной тканью. Во всех группах с имлантацией диски из ДКМ полностью резорбировались, окраска ализариновым красным и по фон Косса подтвердила частичную минерализацию остеоида, периостеоидные пространства содержали разнокалиберные кровеносные сосуды. Побочных явлений ни в одном случае зафиксировано не было. По результатам гистоморфометрии, объем и доля костной ткани во всех группах с имплантацией ДКМ достоверно выше, чем в группе с незаполненными ДКР (контроле-1), при этом достоверные отличия между группами с ДКМ зафиксированы с случае попарного сравнения групп опыт-1* - контроль-2; опыт-2* - контроль-2; опыт-3* - контроль-2; опыт-3* - опыт-1 (* достоверное увеличение с уровнем значимости р<0,05 при использовании критерия Краскела-Уоллиса).
По результатам томографии (фиг. 4), для объема, площади, доли и плотности костной ткани достоверные отличия групп с имплантацией от контроля-1 (р<0,01) наблюдаются на всех сроках наблюдения, причем максимальный прирост показателей происходит в течение 3 недель после операции. Все три опытных группы демонстрировали достоверные отличия по объему, площади, доле и плотности костной ткани также от контроля-2 (р<0,01) на сроке 3 недели после операции. При этом в случае применения дисков с иммобилизацией ВМР-2 и HBD-Epo (опыт-3) наблюдалось максимальное увеличение плотности новообразованной костной ткани при достоверном отличии от опытных групп 1 и 2 (р<0,05), что свидетельствует о стимуляции остеоиндуктивных процессов при иммобилизации HBD-Epo на ДКМ, особенно при совместном действии с ВМР-2.
Перечень последовательностей:
SEQ ID NO 1 Последовательность нуклеотидов рекомбинантной плазмидной ДНК pL610
SEQ ID NO 2 Последовательность аминокислотных остатков белка HBD-Epo
SEQ ID NO 3 Последовательность аминокислотных остатков гепаринсвязывающего домена из Danio rerio
SEQ ID NO 4 Последовательность аминокислотных остатков спейсера
SEQ ID NO 5 Последовательность аминокислотных остатков белка Еро из Homo sapiens
Реферат
Изобретение относится к биотехнологии, генной инженерии, биохимии, медицине, ветеринарии. Получают синтетическую последовательность ДНК, соответствующую гену, кодирующему белковую последовательность гепаринсвязывающего домена (HBD) из Danio rerio, слитую с последовательностью эритропоэтина (Еро) человека (белок HBD-Epo), спланированную таким образом, чтобы нуклеотидный состав кодонов был оптимизирован для гетерологичной экспрессии в непатогенном лабораторном штамме Е. coli. Этот синтетический ген HBD-Epo фланкируют на 5'-конце сайтом NcoI, а на 3'-конце - сайтом Kpn2I и встраивают в плазмиду pQE6 по сайтам NcoI и Kpn2I. На его основе получают рекомбинантную плазмиду pL610, содержащую искусственный бактериальный оперон рекомбинантного белка HBD-Epo, включающий промоторную область раннего промотора бактериофага Т5, ген рекомбинантного белка HBD-Epo, терминатор транскрипции; бактериальный оперон бета-лактамазы; бактериальный участок инициации репликации типа ColE1, кодирующую рекомбинантный белок HBD-Epo и обеспечивающую его синтез в штаммах Е. coli. Изобретение также включает способ очистки белка HBD-Epo методом ионообменной хроматографии. Изобретение относится к самому рекомбинантному белку HBD-Epo, экспрессионному вектору pL610 и композиции (деминерализованному костному матриксу (ДКМ), содержащему белок HBD-Epo, а также ДКМ, содержащему белок HBD-Epo и ВМР-2), направленной на стимулирование остеогенеза. Изобретение позволяет получать устойчивый очищенный активный белок HBD-Epo, а также HBD-Epo, иммобилизированный на ДКМ, в том числе на ДКМ с костным морфогенетическим белком ВМР-2. Изобретение, кроме того, включает способ специфической индукции регенерации костной ткани, заключающийся в заполнении дефектов костной ткани композицией, состоящей из HBD-Epo, иммобилизированного на ДКМ, в том числе на ДКМ с костным морфогенетическим белком ВМР-2. 6 н. и 1 з.п. ф-лы, 4 ил., 5 пр.

Комментарии